Хирургические болезни
Ответы к
экзаменационным вопросам
по кафедре
факультетской хирургии с курсом анестезиологии и реаниматологии КубГМУ к летней
экзаменационной сессии 2011-2012 уч. года для студентов 4 курса лечебного
факультета (по хирургическим болезням)
(все формы
обучения)
1.
Эндемический и спорадический зобы. Классификация. Клиника. Диагностика.
Дифференциальный диагноз. Лечение. Профилактика. Показания к операции.
Загрудинное расположение зоба
хирургическая болезнь лечение диагноз
Эндеми́ческий зоб - увеличение щитовидной
железы, связанное с дефицитом йода в среде обитания. Нормальный рост и развитие
человека зависит от правильного функционирования эндокринной системы, в
частности от деятельности щитовидной железы. Хронический дефицит йода приводит
к разрастанию ткани железы и изменению её функциональных возможностей. Основная
причина развития эндемического зоба - недостаточное поступление йода в
организм. Механизм, посредством которого щитовидная железа адаптируется к
йоддефициту, состоит в повышении захвата йода из крови и последующему синтезу и
секреции трийодтиронина (Т3). Эти процессы поддерживаются повышенной секрецией
тиреотропина (ТТГ), который обладает зобогенным эффектом, особенно среди детей.
Зобогенный эффект является сопутствующим нежелательным проявлением процесса
адаптации к йодной недостаточности в период роста. Эндемический зоб может быть
отнесён к мультифакторной патологии - помимо дефицита йода, выраженного в бо́льшей или меньшей степени,
определённая роль принадлежит генетическим факторам. Компенсаторная гиперплазия
щитовидной железы как ответная реакция на низкое поступление йода в организм и,
следовательно, низкую интратиреоидную концентрацию йода, недостаточную для
нормальной секреции тиреоидных гормонов. Нередко увеличение щитовидной железы в
объёме не обеспечивает оптимальный уровень тиреоидных гормонов и развивается
гипотиреоз. В ответ на снижение уровня тиреоидных гормонов в крови наблюдается
повышение секреции тиреотропина, что приводит вначале к диффузной гиперплазии
железы, а затем и к развитию узловых форм зоба. Увеличением массы ткани
щитовидная железа пытается увеличить синтез гормонов в условиях недостаточного
поступления йода в организм. Однако концентрация йода в щитовидной железе
снижена. При длительной йодной недостаточности развивается не только
гиперплазия и гипертрофия тиреоцитов, но также их очаговая дистрофия,
некробиоз, склероз. В крови больных появляются гормонально неактивные
соединения (тиреоальбумин и др.), что способствует снижению синтеза тироксина,
повышению уровня тиреотропина и дальнейшему росту щитовидной железы и
образованию в ней узлов.
Степень увеличения щитовидной железы.
Степень Описание
Зоба нетРазмеры долей больше дистальной фаланги
большого пальца.
Зоб пальпируется, но не виденЗоб пальпируется и виден
на глаз.
Согласно рекомендациям ВОЗ «щитовидная железа
считается увеличенной, если размеры каждой из долей при пальпации больше
дистальной фаланги большого пальца обследуемого пациента».
. Форма эндемического зоба (морфологическая).
.1.Диффузный.
.2.Узловой.
.3.Смешанный (диффузноузловой).
. Функциональное состояние щитовидной железы.
.1.Эутиреоидный зоб.
.2.Гипотиреоидный зоб.
. Локализация зоба:
.1.Обычно расположенный.
.2.Частично загрудинный.
.3.Кольцевой.
.4.Дистопироваший зоб из эмбриональных закладок (зоб
корня языка, добавочной доли щитовидной железы).
Диагностика
Лабораторные и инструментальные данные
. Клинический анализ крови и мочи без существенных
изменений.
. Поглощение 131I щитовидной железой
увеличено через 24 ч (более 50%), это является следствием дефицита йода в
щитовидной железе.
. Экскреция йода с мочой: показатели снижены, как
правило, менее 50 мкг/сут.
. Определение содержания в крови Т3, Т4,
тиреотропина. У клинически эутиреодных больных содержание в крови Т3
и Т4 в пределах нормы либо может отмечаться некоторое возрастание Т3
при тенденции к снижению уровня Т4 при нормальном уровне
тиреотропина.
. Определение содержания в крови тиреоглобулина.
. Ультразвуковое исследование (УЗИ) щитовидной железы.
При диффузной форме выявляется диффузное увеличение щитовидной железы различной
степени, возможно обнаружение участков фиброза.
. Радиоизотопное сканирование щитовидной железы
выявляет равномерное распределение изотопа и диффузное увеличение размеров
железы различных степеней (при диффузной форме) или наличие «холодных» или
«тёплых» узлов при узловой форме. При развитии гипотиреоза накопление изотопа
железой резко снижено.
.Тонкоигольная аспирационная пункционная биопсия
щитовидной железы под контролем УЗИ.
Лечение
Тактика лечения эндемического зоба во
многом зависит от степени увеличения щитовидной железы и состояния функции
железы. При небольшом увеличении размеров железы (зоб первой степени) обычно
ограничиваются назначением йодида калия, обязательно прерывистым курсом,
продуктов богатых йодом.
При наличии снижения функции
щитовидной железы назначаются синтетические аналоги тироидных гормонов
(Левотироксин, Эутирокс) или комбинированных препаратов (Тиреотом), под
контролем содержания гормонов щитовидной железы в крови. Если форма зоба
узловая, узлы большие или быстрорастущие, приводящие к сдавлению окружающих
органов, проводится хирургическое лечение зоба. Объем оперативного
вмешательства зависит от поставленного диагноза. Могут быть выполнены:
субтотальная резекция щитовидной
железы (остаются верхние полюса щитовидной железы);
гемитиреоидэктомия (удаление 1 из 2
долей щитовидной железы с перешейком);
струмэктомия (удаление всей
щитовидной железы).
После операции назначаются гормоны
щитовидной железы, для блокирования по механизму обратной связи тиреотропина и
предупреждения рецидива зоба.
Операции на щитовидной железе
проводятся под эндотрахеальным (общим) наркозом. Разрез для доступа к
щитовидной железе проводится в горизонтальном направлении по кожной складке в
нижней части шеи. Основным этапом операции является выделение щитовидной
железы. Трудности при выделении железы возникают при больших размерах зоба,
злокачественных опухолях с прорастанием в окружающие железу ткани, диффузном
токсическом зобе за счет воспалительноинфильтративных процессов. К тому же
щитовидная железа обильно кровоснабжается, поэтому необходима осторожность и
хорошие знания анатомии для избегания ранения крупных сосудов шеи. После
выделения щитовидной железы окончательно решается вопрос об объёме оперативного
вмешательства с последующим обязательным гистологическим исследованием
удаленной ткани. Заключительным этапом операции является ушивание раны
косметическим швом. Послеоперационное лечение проводится в зависимости от
диагноза и объема оперативного лечения.
Спорадический зоб - заболевание,
сопровождающееся увеличением щитовидной железы у лиц, проживающих вне районов
зобной эндемии. Спорадический зоб возникает вследствие некоторых
неблагоприятных эндогенных факторов, в основном генетического порядка.
Загрудинным называют зоб, часть
которого расположена ниже яремной вырезки грудинной ямки. Первичный
внутригрудной зоб развивается из эктопической ткани и встречается чрезвычайно
редко (не более 1% всех шейнозагрудинных зобов). Большинство загрудинных зобов
являются вторичными и развиваются из ткани ЩЖ, которая опустилась из области
шеи за грудину, поэтому более точным является термин «шейнозагрудинный зоб».
Кровоснабжение этих зобов осуществляется за счет верхних и нижних
артерий ЩЖ. Основными факторами, определяющими распространение зобноизмененной
ЩЖ в средостение, являются широкое верхнее отверстие грудной клетки у пациентов
с брахиоморфным типом телосложения, возрастающий вес ЩЖ при узловом и диффузном
зобе, присасывающее действие грудной полости, сила мышц передней поверхности
шеи, способствующая распространению увеличивающейся ЩЖ вниз и кзади.
В 1993 г. А. Ф. Романчишеным
предложена классификация шейнозагрудинного зоба, определяющая рациональную
тактику лечения этой группы пациентов. Выделены пять степеней шейнозагрудинного
зоба. К / степени отнесены новообразования ЩЖ, расположенные в основном
на шее, но имеющие тенденцию к распространению за грудину при наличии
перечисленных выше факторов. При II степени значительная часть ЩЖ уже сместилась ниже яремной вырезки грудины, но в момент
глотания она легко выводится пальцами врача на шею. Если при глотании ЩЖ
полностью не извлекается и не удается пропальпировать загрудинную ее часть, зоб
относится к III степени
шейнозагрудинной
локализации. При IV степени на шее определяются лишь верхние
полюсы долей ЩЖ, а основная часть органа располагается за грудиной. Под V степенью подразумевается внутригрудное
расположение ЩЖ (медиастинальная дистопия ЩЖ).
2.
Диффузный и узловой токсический зоб. Классификация. Клиника. Диагностика.
Дифференциальный диагноз. Показания к различным видам лечения. Предоперационная
подготовка больных. Показания и противопоказания к операции. Виды операций
Диффу́зный токси́ческий зоб (синонимы: болезнь
Грейвcа, Базедова болезнь, болезнь Перри, болезнь Флаяни) - аутоиммунное
заболевание, обусловленное избыточной секрецией тиреоидных гормонов диффузной
тканью щитовидной железы, которое приводит к отравлению этими гормонами -
тиреотоксикозу. В России до настоящего времени наиболее часто продолжает
использоваться классификация эндемического зоба по О.В. Николаеву, предложенная
в 1955 году.
Классификация зоба по О.В. Николаеву
|
Степень увеличения ЩЖ
|
Физикальная
характеристика
|
|
0 степень
|
ЩЖ не видна и не
пальпируется
|
|
I степень
|
ЩЖ не видна, но
пальпируется и виден при глотании перешеек
|
|
II степень
|
ЩЖ видна при глотании и
пальпируется, форма шеи не изменена
|
|
III степень
|
ЩЖ видна, изменяет контур
шеи (“толстая шея”)
|
|
IV степень
|
большой зоб, нарушающий
конфигурацию шеи
|
|
V степень
|
зоб огромных размеров,
сдавление трахеи и пищевода.
|
Этиология и патогенез
В основе патогенеза ДТЗ лежит выработка стимулирующих
аутоантител к рецепторам ТТГ, вероятно, в результате врожденного дефекта
иммунной системы. О генетической предрасположенности свидетельствует выявление
циркулирующих аутоантител у 50% родственников ДТЗ, частое обнаружение у больных
гаплотипа HLA DR3 (аллели DRB1*03 04 - DQB1*02 - DQA1*05 01), нередкое
сочетание с другими аутоиммунными. Сочетание ДТЗ с аутоиммунной хронической
надпочечниковой недостаточностью, сахарным диабетом 1го типа, а также другими
аутоиммунными эндокринопатиями обозначается как аутоиммунный полигландурный
синдром 2 типа. Женщины болеют в 510 раз чаще мужчин. Как правило, ДТЗ
манифестирует в молодом и среднем возрасте.
Клиническая картина весьма вариабельна - варьирует от
предельно ярко очерченных форм с очевидным с первого взгляда диагнозом (главным
образом, благодаря сочетанию экзофтальма с резким похуданием и тремором) до
стертых, моносимптомных вариантов. Последние особенно часто встречаются при
манифестации заболевания в пожилом возрасте.
1. Щитовидная железа как правило увеличена за счет обеих
долей и перешейка, безболезненна, подвижна, эластической консистенции. У
пожилых людей и у мужчин ДТЗ нередко протекает при нормальном или только
незначительно увеличенном объеме ЩЖ. Таким образом, отсутствие увеличения ЩЖ
само по себе диагноз ДТЗ не исключает.
2. Сердечно сосудистая система: постоянная, реже пароксизмальная
синусовая тахикардия, экстрасистолия, пароксизмальная, реже постоянная
мерцательная аритмия, преимущественно систолическая артериальная гипертензия,
миокардиодистрофия, сердечная недостаточность ("тиреотоксическое
сердце").
3. Катаболический синдром: похудание, субфебрилитет, горячая
кожа, потливость, повышенный аппетит, мышечная слабость.
4. Нервная система: повышенная возбудимость,
плаксивость, суетливость, симптом Мари (тремор пальцев вытянутых рук),
тремор всего тела ("симптом телеграфного столба")..
5. Глазные симптомы развиваются в результате нарушение
вегетативной иннервации глаза. Их описано более 50.
Глазные симптомы тиреотоксикоза
|
Симптом Грефе
|
отставание верхнего века от
радужки при взгляде вверх
|
|
Симптом Кохера
|
отставание верхнего века от
радужки при взгляде вниз
|
|
Симптом Мебиуса
|
потеря способности
фиксировать взгляд на близком расстоянии
|
6.
Эктодермальные нарушения: ломкость ногтей, выпадение волос.
7. Система пищеварения: боли в животе, неустойчивый стул со
склонностью к поносам, тиреотоксический гепатоз.
8. Эндокринные железы: дисфункция яичников вплоть до
аменореи, фибрознокистозная мастопатия, гинекомастия, нарушение толерантности к
углеводам, тирогенная относительная, то есть при нормальном или повышенном
уровне секреции кортизола, надпочечниковая недостаточность (умеренной
выраженности меланодермия, гипотония).
Консервативное фармакологическое лечение
Основным средством консервативного лечения являются
препараты мерказолил и метилтиоурацил (либо пропилтиоурацил). Суточная доза
мерказолила составляет 3040 мг, иногда при очень больших размерах зоба и
тяжелом течении тиреотоксикоза она может достигать 6080 мг. Поддерживающая
суточная доза мерказолила обычно составляет 1015 мг. Препарат принимают
непрерывно в течение 1/22 лет. Снижение дозы мерказолила строго индивидуально,
его проводят, ориентируясь на признаки устранения тиреотоксикоза: стабилизацию
пульса (7080 ударов в минуту), увеличение массы тела, исчезновение тремора и
потливости, нормализацию пульсового давления.
Радиойодтерапия (РЙТ) - это один из современных
методов лечения диффузного токсического зоба и других заболеваний щитовидной
железы. В ходе лечения радиоактивный йод (изотоп I131) вводится в организм в
виде желатиновых капсул перорально (в редких случаях используется жидкий
раствор I131). Радиоактивный йод, накапливающийся в клетках щитовидной железы,
подвергает бета и гамма излучению всю железу. При этом уничтожаются клетки
железы и опухолевые клетки, распространившиеся за её пределы. Проведение
радиойодтерапии подразумевает обязательную госпитализацию в специализированное
отделение.
Абсолютными показаниями для оперативного лечения
служат аллергические реакции или стойкое снижение лейкоцитов, отмечаемые при
консервативном лечении, большие размеры зоба (увеличение щитовидной железы выше
III степени), нарушения ритма сердечных сокращений по типу мерцательной аритмии
с симптомами сердечнососудистой недостаточности, выраженный зобогенный эффект
мерказолила.
Операция проводится только при достижении состояния
медикаментозной компенсации, так как в противном случае в раннем
послеоперационном периоде может развиться тиреотоксический криз.
Узловой токсический зоб - гипертиреоз вследствие
автономно функционирующей аденомы щитовидной железы (ЩЖ) в виде одного или
нескольких узелков. Функция остальных участков железы подавлена низким уровнем
ТТГ вследствие высоких уровней тиреоидных гормонов. Эти участки выявляют по
способности накапливать радиоактивный йодпосле инъекции ТТГ. Узлы и кисты в ЩЖ
- часто случайные находки, выявляемые при УЗИ. У больных с единичным узловым
образованием в ткани ЩЖ, выявленным клинически или с помощью УЗИ, следует
учитывать возможность рака.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ. Оперативному лечению подлежат
все злокачественные и некоторые доброкачественные образования ЩЖ
Показания для хирургического лечения
· Наличие в анамнезе облучения области шеи (подозрение
на злокачественный процесс)
· Большие размеры узла (более 4 см) или
обусловленные им компрессионные симптомы
· Прогрессирующий рост узла
· Плотная консистенция узла
· Молодой возраст больного.
Объём операции при солидном доброкачественном узловом
образовании - удаление доли с/без перешейка железы; при
высокодифференцированном раке (папиллярном или фолликулярном) - предельно
субтотальная тиреоидэктомия.
Показания к хирургическому вмешательству: диффузный
токсический зоб средней и тяжелой формы, узловой токсический зоб
(тиреотоксическая аденома), большой зоб,
сдавливающий органы шеи независимо от тяжести
тиреотоксикоза. До операции обязательно надо привести функции щитовидной железы
к эутиреоидному состоянию.
Противопоказания к хирургическому вмешательству:
легкие формы тиреотоксикоза, у старых истощенных больных в связи с большим
операционным риском, у больных с необратимыми изменениями печени, почек,
сердечнососудистыми и психическими заболеваниями.
3. Зоб и тиреотоксикоз. Осложнения во
время и после операции. Клиника осложнений, их лечение и профилактика
Интраоперационные осложнения: кровотечения, воздушная
эмболия, повреждение возвратного нерва, удаление или повреждение паращитовидных
желез с последующим развитием гипопаратиреоза. При повреждении обоих возвратных
нервов у больного наступает острая асфиксия и только немедленная интубация
трахеи или трахеостомия могут спасти больного. У больных тиреотоксикозом в
послеоперационном периоде наиболее опасное осложнение развитие
тиреотоксического криза. Первый признак тиреотоксического криза быстрое
повышение температуры тела до 40°С, сопровождающееся нарастающей тахикардией.
Артериальное давление сначала повышается, а затем снижается, наблюдаются
нервнопсихические расстройства.
В развитии криза главную роль играет недостаточность
функции коры надпочечников, обусловленная операционным стрессом. Лечение криза
должно быть направлено на борьбу с надпочечниковой недостаточностью,
сердечнососудистыми нарушениями, гипертермией и кислородной недостаточностью.
Трахеомаляция. При длительно существующем зобе,
особенно при ретростернальном, позадитрахеальном и позадипищеводном, вследствие
постоянного давления его на трахею происходят дегенеративные изменения в
трахеальных кольцах и их истончение Трахеомаляция. После удаления зоба сразу
вслед за экстубацией трахеи или в ближайшем послеоперационном периоде может
произойти ее перегиб в участке размягчения или сближение стенок и сужение
просвета. Наступает острая асфиксия, которая может привести к гибели больного,
если не выполнить срочную трахеостомию (см. "Воспалительные заболевания
трахеи").
Послеоперационный гипотиреоз недостаточность функции
щитовидной железы, обусловленная полным или почти полным ее удалением во время
операции, развивается у 910% оперированных больных. Гипотиреоз характеризуется
общей слабостью, постоянным чувством усталости, апатичностью, сонливостью,
общей заторможенностью больных. Кожа становится сухой, морщинистой, отечной.
Начинают выпадать волосы, появляются боли в конечностях, половая функция
слабеет.
Лечение: назначают тиреоидин и другие препараты
щитовидной железы. С развитием микрохирургической техники и успехами
иммунологии стали выполнять аллотрансплантацию щитовидной железы, используя
трансплантат на сосудистой ножке. Применяют и свободную подсадку кусочков ткани
железы под кожу, в мышцу, однако эти операции обычно дают временный эффект,
поэтому на практике применяют в основном заместительную терапию.
4. Тиреоидиты и струмиты. Определение.
Понятия. Клиника. Диагностика. Дифференциальный диагноз. Консервативное и
хирургическое лечение. Тиреоидит Хашимото и Фиделя
Воспалительный процесс, развивающийся в неизмененной
до этого щитовидной железе, называют тиреоидитом, а развивающийся на фоне зоба
струмитом. Причиной развития тиреодита и струмита является острая или
хроническая инфекция.
Острый тиреоидит или струмит начинается с повышения
температуры тела, головной боли и сильной боли в щитовидной железе. Боль
иррадиирует в затылочную область и ухо. На передней поверхности шеи появляется
припухлость, смещаемая при глотании. Тяжелым осложнением тиреоидита является
развитие гнойного медиастинита. Иногда развивается сепсис. Вот почему всем
больным показана госпитализация с целью активного лечения.
Лечение:назначают антибиотики; при образовании
абсцесса показано его вскрытие во избежание распространения гнойного процесса
на шею и средостение.
Хронический лимфоматозный тиреоидит Хашимото.
Заболевание относят к аутоиммунным органоспецифическим патологическим
процессам, при которых антитела, образующиеся в организме, специфичны по
отношению к компонентам одного органа. При тиреоидите Хашимото под влиянием
неизвестных причин щитовидная железа начинает продуцировать измененные
гормональнонеактивные йодпротеины, отличающиеся от тиреоглобулина. Проникая в
кровь, они становятся антигенами и образуют антитела против ацинарных клеток
щитовидной железы и тиреоглобулина. Последние инактивируют тиреоглобулин. Это
приводит к нарушению синтеза нормальных тиреоидных гормонов, что обусловливает
повышение секреции ТТГ гипофиза и гиперплазию щитовидной железы. В поздних
стадиях заболевания тиреоидная функция железы понижена, накопление в ней йода
понижается.
Клиника и диагностика: тиреоидит Хашимото чаще
возникает у женщин в возрасте старше 50 лет. Заболевание развивается медленно
(14 года). Единственным симптомом на протяжении длительного времени является
увеличение щитовидной железы. На ощупь она плотная, но не спаяна с окружающими
тканями и подвижна при пальпации В дальнейшем появляются дискомфорт, признаки
гипотиреоза Регионарные лимфатические узлы не увеличены.
Большое значение в диагностике имеет обнаружение в
сыворотке больного антитиреоидных аутоантител Окончательный ответ получают при
пункционной биопсии.
Лечение:консервативное, включает назначение тиреоидных
и глюкокортикоидных гормонов Дозу тиреоидных гормонов избирают индивидуально,
средняя суточная доза тиреоидина 0,10,3 г Суточная доза преднизолона 2040 мг в
течение 1 1/2 2 мес с постепенным уменьшением дозы.
При подозрении на злокачественное перерождение, при
сдавлении органов шеи большим зобом показана операция. Производят субтотальную
резекцию щитовидной железы. После операции необходимо лечение тиреоидином
вследствие неизбежно развивающегося гипотиреоза.
Хронический фиброзный тиреоидит Риделя. Заболевание
характеризуется разрастанием в щитовидной железе соединительной ткани,
замещающей ее паренхиму, вовлечением в процесс окружающих тканей. Этиология
заболевания не установлена.
Клиника и диагностика. Щитовидная железа диффузно
увеличена, каменистой плотности, спаяна с окружающими тканями. Отмечаются
умеренные признаки гипотиреоза. Давление на пищевод, трахею, сосуды и нервы
обусловливают соответствующую симптоматику.
Лечение: до операции практически невозможно исключить
злокачественную опухоль щитовидной железы, поэтому при тиреоидите Риделя
показано хирургическое вмешательство. Производят максимально возможное
иссечение фиброзирующей тиреоидной ткани с последующей заместительной терапией.
5.
Рак щитовидной железы. Классификация. Клиника. Диагностика. Дифференциальный диагноз.
Типы операций. Комбинированное лечение
Клиникоморфологическая классификация опухолей
щитовидной железы
. Доброкачественные опухоли
а) эпителиальные эмбриональные, коллоидные,
папиллярные,
б) неэпителиальные фиброма, ангиома, лимфома,
невринома, хемодектома
. Злокачественные опухоли
а) эпителиальные папиллярная аденокарцинома
фолликулярная аденокарии нома, опухоль Лангханса, солидный рак, плоскоклеточный
и недифференцированный рак,
б) неэпителиальные опухоли саркома, нейросаркома,
лимфоретикулосаркома
Рак щитовидной железы составляет 0,41% всех
злокачественных новообразований. Развивается в узловом зобе с нормальной или
пониженной функцией и очень редко в диффузном токсическом зобе У 1520% больных
при гистологическом исследовании узлового зоба обнаруживают рак В 34 раза чаще
рак наблюдается у женщин, чем у мужчин К факторам, способствующим развитию рака
щитовидной железы, относят травму, хронические воспалительные процессы,
рентгеновское облучение области щитовидной железы, длительное лечение I133 или
тиреостатическими препаратами. Доброкачественные опухоли щитовидной железы
наблюдаются редко.
Существует Международная классификация рака щитовидной
железы по системе TNM, однако в практике чаще используют классификацию по
стадиям.
Клинические стадии рака щитовидной железыстадия
одиночная опухоль в щитовидной железе без ее деформации, прорастания в капсулу
и ограничения смещаемостиA стадия одиночная или множественные опухоли
щитовидной железы, вызывающие ее деформацию, но без прорастания в капсулу железы
и ограничения ее смещаемости
Регионарные и отдаленные метастазы отсутствуютБ
стадия одиночная или множественные опухоли щитовидной железы без прорастания в
капсулу и без ограничения смещаемости, но при наличии смещаемых метастазов в
лимфатических узлах на пораженной стороне шеистадия опухоль, распространяющаяся
за пределы капсулы щитовидной железы и связанная с окружающими тканями или
сдавливающая соседние органы. Смещаемость опухоли ограничена, имеются метастазы
в смещаемые лимфатические узлыстадия опухоль прорастает в окружающие структуры
и органы при полной несмещаемости щитовидной железы, несмещаемые лимфатические
узлы Метастазы в лимфатические узлы шеи и средостения, отдаленные метастазы
Регионарное лимфогенное метастазирование происходит в глубокие шейные,
предгортанные, пре и паратрахеальные лимфатические узлы. Гематогенное
метастазирование наблюдается в отдаленные органы, чаще поражаются легкие и
кости.
Клиника и диагностика: ранние клинические симптомы
быстрое увеличение размеров зоба или нормальной щитовидной железы, увеличение
ее плотности, изменение контуров. Железа становится бугристой, малоподвижной,
пальпируются шейные регионарные лимфатические узлы. Неподвижность и уплотнение
опухоли создают механическое препятствие для дыхания и глотания. При сдавлении
возвратного нерва происходит изменение голоса, развивается охриплость,
связанная с парезом голосовых связок. В более поздние сроки отмечаются
симптомы, обусловленные метастазированием опухоли. Часто больные жалуются на
боли в области уха и затылка
Для дифференциального диагноза новообразований
щитовидной железы основное значение имеют данные цитологического и
гистологического исследования пунктата опухоли, которые дают возможность не
только установить диагноз заболевания, но и определить морфологический тип
опухоли. Ложнонегативные результаты при пункции злокачественной опухоли
щитовидной железы получают примерно у 30% больных
Лечение: основной метод лечения рака щитовидной железы
хирургический. При папиллярных и фолликулярных формах рака щитовидной железы
(III стадии) показаны экстракапсулярная субтотальная тиреоидэктомия с ревизией
лимфатических узлов и удаление их при выявлении метастазов. При III стадии
заболевания проводят комбинированную терапию: предоперационную гамматерапию,
затем субтотальную или тотальную тиреоидэктомию с фасциальнофутлярным
иссечением клетчатки с обеих сторон. При раке IIIIV стадий, если не проводилась
предоперационная лучевая терапия, целесообразно провести послеоперационное
облучение. Для воздействия на отдаленные метастазы при дифференцированных
формах рака назначают I133. Прогноз благоприятный при фолликулярной и
папиллярной формах рака щитовидной железы. При солидных и недифференцированных
формах рака прогноз плохой даже при относительно раннем хирургическом вмешательстве.
6. Острый мастит. Классификация. Клиника
различных форм. Диагностика. Консервативное лечение. Показания к операции,
методы операции. Профилактика мастита у беременных и родильниц
Мастит (mastitis; греч. mastos грудь
+ itis; синоним грудница) - воспаление паренхимы и межуточной ткани молочной
железы.
Различают острый и хронический мастит. В зависимости
от функционального состояния молочной железы (наличие или отсутствие лактации)
выделяют лактационный (послеродовой) и нелактационный М. На долю лактационного
приходится 95% случаев М. При этом наиболее часто (до 85%) лактационный М.
возникает у первородящих женщин. У 95% больных возбудителем М. является
патогенный стафилококк, часто (до 80%) не чувствительный к широко применяемым
антибиотикам.
Острый мастит. Воспалительный процесс в молочной
железе может ограничиваться воспалением млечных протоков (галактофорит),
которое сопровождается выделением молока с примесью гноя, или воспалением желез
околососкового кружка (ареолит, телит). При прогрессировании заболевания
серозное пропитывание сменяется диффузной гнойной инфильтрацией паренхимы
молочной железы с мелкими очагами гнойного расплавления, которые в последующем
сливаются, образуя абсцессы. В зависимости от локализации гнойного очага
выделяют
· субареолярный,
· подкожный,
· интрамаммарный
· ретромаммарный
С учетом течения воспалительного процесса острый
мастит подразделяют на
· серозный (начальный),
· инфильтративный,
· инфильтративногнойный (апостематозный
- по типу «пчелиных сот»),
· абсцедирующий,
· флегмонозный,
· гангренозный.
Признаками серозного М. являются нагрубание, отек
молочной железы, сопровождающиеся повышением температуры тела. Отмечаются также
потливость, слабость, разбитость, резкие боли в молочной железе. Железа
увеличена в размерах, отечна, болезненна при пальпации, с помощью которой
определяется инфильтрат без четких контуров. Сцеживание молока болезненно и не
приносит облегчения. Количество лейкоцитов в крови повышается до 10-12109/л,
СОЭ увеличена до 20-30 мм в 1 ч. При неэффективном лечении через 2-3 дня
серозный М. может перейти в инфильтративный, который характеризуется большей
выраженностью клинических признаков воспаления и ухудшением общего состояния
больной. Появляется гиперемия кожи железы, при пальпации более четко определяется
воспалительный инфильтрат. Переход в инфильтративногнойный и абсцедирующий М.
сопровождается усилением общих и местных симптомов воспаления, более
выраженными признаками интоксикации. Температура тела постоянно высокая или
принимает гектический характер. Гиперемия кожи пораженной железы усиливается,
инфильтрат увеличивается в размерах, в одном из его участков появляется
флюктуация.
Флегмонозный М. характеризуется обширным гнойным
поражением молочной железы без четких границ со здоровой тканью. Отмечаются
повышение температуры тела до 40°, озноб. Молочная железа резко увеличена,
покрыта отечной, блестящей, гиперемированной, с синюшным оттенком кожей. Рано
возникает регионарный лимфаденит. В редких случаях вследствие вовлечения в
воспалительный процесс сосудов и их тромбоза развивается гангренозный М. Важную
роль играет также аутосенсибилизация организма к органоспецифическим антигенам:
молоку, ткани молочной железы. Процесс характеризуется быстрым гнойным
расплавлением ткани, распространяется на клетчаточные пространства грудной
клетки, сопровождается некрозом кожи и выраженной интоксикацией. Состояние
больных крайне тяжелое: температура тела повышена до 40-41°, пульс учащен до
120-130 в 1 мин. Наблюдаются лейкоцитоз до 30109/л со
сдвигом лейкоцитарной формулы влево, в моче определяется белок.
Мастит может осложняться лимфангиитом, лимфаденитом и
редко сепсисом. После вскрытия (особенно самопроизвольного) гнойника образуются
молочные свищи, которые могут закрыться самостоятельно, но в течение длительного
времени.
Диагноз основывается на данных анамнеза и результатах
клинического обследования. Проводят бактериологическое исследование гноя,
молока (из пораженной и здоровой железы), а при высокой температуре тела и
ознобе - бактериологическое исследование крови. Электротермометрия кожи и
тепловизионное исследование молочных желез позволяют выявить более высокую
температуру над очагом поражения (на 1-2°), чем в неизмененных участках. Важную
роль играет также ультразвуковое исследование. Лечение следует начинать при
появлении первых признаков заболевания, что позволяет в значительном числе
случаев предотвратить развитие гнойного процесса. Консервативную терапию
начинают с тщательного сцеживания молока. Перед сцеживанием выполняют
ретромаммарную новокаиновую блокаду 0,25% раствором новокаина (70-80 мл), в
который добавляют антибиотики (оксациллин или метициллин) в половинной суточной
дозе, вводят внутримышечно 2 мл ношпы (за 20 мин до сцеживания) и 0,5-1 мл
окситоцина (за 1-2 мин), проводят десенсибилизирующую терапию. При лактостазе
после сцеживания боли в молочной железе купируются, пальпируются небольшого
размера безболезненные дольки с четкими контурами, нормализуется температура
тела. При серозном и инфильтративном М. эти мероприятия проводят неоднократно,
но не более 3 раз в сутки. Назначают антибиотики (полусинтетические
пенициллины, в более тяжелых случаях - линкомицин, гентамицин). При отсутствии
положительной динамики в течение 2 сут. (нормализации температуры тела,
уменьшения размеров инфильтрата и болезненности его при пальпации) показано
оперативное вмешательство, в сомнительных случаях - пункция инфильтрата толстой
иглой. Для повышения эффективности комплексного лечения подавляют или временно
тормозят лактацию препаратами, ингибирующими секрецию пролактина передней долей
гипофиза (парлодел).
Оперативное вмешательство заключается в широком
вскрытии гнойника и его карманов, обследовании его полости, разделении
перемычек, тщательном удалении некротизированных тканей, дренировании гнойной
полости. При инфильтративногнойном М. иссекают всю зону инфильтратов в пределах
здоровой ткани. Если имеется несколько абсцессов, каждый из них вскрывают
отдельным разрезом. Интрамаммарные гнойники вскрывают радиарными разрезами,
ретромаммарный - нижним полуовальным разрезом, что позволяет избежать
пересечения внутридольковых млечных протоков, обеспечивает хорошие условия для
оттока гноя и отхождения некротизированных тканей. Лечение ран после вскрытия
гнойника проводят с учетом фазы раневого процесс. В послеоперационном периоде
продолжают сцеживание молока с целью предотвращения лактостаза. При
локализованных формах острого М. иссекают гнойный очаг в пределах здоровых
тканей, дренируют полость раны через контрапертуры одним двухпросветным или
несколькими однопросветными силиконовыми дренажами и накладывают первичный шов.
В послеоперационном периоде проводят проточнопромывное дренирование раны
растворами антисептиков, что позволяет добиться заживления ран в более ранние
сроки и с лучшим косметическим и функциональным результатом. Показаны
адекватная антибиотикотерапия, дезинтоксикационная и общеукрепляющая терапия,
назначение витаминов и препаратов, повышающих иммунологическую реактивность
организма больной, местное УФоблучение, ультразвуковая и УВЧтерапия. Прогноз
при своевременно начатом лечении благоприятный. Профилактика М. начинается с
периода беременности. В женской консультации наряду с рекомендациями,
касающимися рационального питания беременных, физических упражнений, ухода за
молочными железами, обучения женщин правилам и технике грудного вскармливания,
существенное внимание уделяют выявлению беременных группы высокого риска
развития послеродового мастита. В акушерском отделении одним из решающих
факторов предупреждения М. является соблюдение санитарногигиенических н
противоэпидемических мероприятий, предупреждение и своевременное лечение трещин
сосков и лактостаза (нагрубания) молочных желез.
7. Дисгормональные заболевания молочной
железы. Классификация. Клиника. Диагностика. Дифференциальный диагноз. Лечение
консервативное и хирургическое
Под дисгормональными мастопатиями в
настоящее время понимают группу доброкачественных заболеваний молочной железы,
характеризующихся появлением узловых уплотнений, болями в молочных железах, а
иногда патологической секрецией. Эта группа включает около 30 самостоятельных
заболеваний, связанных с различными нарушениями функции яичников,
надпочечников, гипофиза и сопровождающихся относительной гиперэстрогенемией,
дисбалансом содержания прогестерона и андрогенов, нарушением цикличности
продукции гормонов гипофиза и повышением концентрации плазменного пролактина. В
качестве синонимов мастопатии используют также термины фиброаденоз,
фиброаденоматоз. фибрознокистозная мастопатия и ряд других.
Мастопатия обнаруживается обычно у пациенток в
возрасте от 25 до 50 лет. Различные формы заболевания встречаются при
плановых обследованиях у 2060% пациенток данной возрастной группы, а по данным
аутопсий - более чем у 50% женщин. После наступления менопаузы все признаки
заболевания, как правило, исчезают, что, безусловно, свидетельствуют о роли
нарушений гормонального фона в происхождении мастопатии.
Доброкачественные изменения молочных
желез по рентгенологическим признакам делятся на диффузную доброкачественную
дисплазию (аденоз, фиброаденоз, диффузная фибрознокистозная мастопатия) и
локальные формы (кисты, фиброаденомы, дуктэктазии, узловые пролифераты).
Согласно гистологической
классификации ВОЗ (1984), мастопатия определяется, как фибрознокистозная
болезнь и характеризуется широким спектром пролиферативных и регрессивных
процессов в ткани молочных желез с ненормальным соотношением эпителиального и
соединительнотканного компонентов. Для клинической практики используется
классификация, при которой мастопатию разделяет на диффузную и узловую.
Формы диффузной кистознофиброзная
мастопатии:
· аденоз с преобладанием железистого
компонента;
· фиброзная мастопатия с преобладанием
фиброзного компонента;
· кистозная мастопатия с преобладанием
кистозного компонента;
· смешанная форма диффузной
кистознофиброзной мастопатии;
· cклерозирующий аденоз.
Формы узловой (локализованной)
фибрознокистозной мастопатии:
· узловая мастопатия;
· киста молочной железы;
· внутрипротоковая папиллома;
· фиброаденома.
Диффузная фибрознокистозная
мастопатия чаще всего возникает у женщин 2540 лет, поражает обе молочные
железы, чаще локализуется в наружноверхних квадрантах. Боли в молочных железах,
как правило, появляются за несколько дней до менструации и постепенно нарастают
в течение второй фазы цикла. В некоторых случаях боли отдают в плечо,
подмышечную впадину, в лопатку. При длительном течении заболевания
интенсивность болей может ослабевать. Из сосков при некоторых форма диффузной
мастопатии появляются выделения (молозиво, прозрачного или зеленоватого цвета).
При мастопатии с преобладанием
железистого компонента, в ткани молочной железы на ощупь определяются плотные
образования, переходящие в окружающую ткань. На рентгенограммах выявляются
множественные тени неправильной формы с нечеткими контурами. При мастопатии с
преобладанием фиброзного компонента железы мягкоэластической консистенции с
участками диффузного уплотнения с грубой фиброзной тяжистостью. Выделения из
сосков отсутствуют. При мастопатии с преобладание кистозного компонента
отмечается наличие множественных кистозных образований, хорошо ограниченных от
окружающей ткани железы. Характерным клиническим признаком является
болезненность, усиливающаяся перед менструацией. Смешанная форма мастопатии
характеризуется увеличением железистых долек, склерозированием внутридольковой
соединительной ткани. На ощупь определяется либо диффузная мелкая зернистость,
либо дисковидная тестоватость.
Для узловой фибрознокистозной
мастопатии характерны несколько иные клинические проявления. Так, узловая форма
встречается у пациенток 3050 лет, представляет собой плоский участок уплотнения
с зернистой поверхностью. Уплотнение не исчезает между менструациями и может
увеличиваться перед менструацией. Эти образования бывают одиночные и
множественные и выявляются в одной или обеих железах и определяются на фоне
диффузной мастопатии. Киста молочной железы представляет собой подвижное, чаще
одиночное образование округлой формы, эластической консистенции с гладкой
поверхностью. Образование не связано с клетчаткой, кожей и подлежащей фасцией.
Кисты бывают одиночными и множественными. Внутрипротоковая папиллома
располагается непосредственно под соском или ареолой. Может определяться в виде
округлого мягковатоэластичного образования или продолговатого тяжа. При наличии
внутрипротоковой папилломы отмечаются кровянистые выделения из соска.
Фиброаденоама является доброкачественной опухолью молочной железы. Она
представляет собой безболезненное округлое образование эластической
консистенции с гладкой поверхностью. Встречается сравнительно редко.
Озлокачествление фиброаденомы происходит в 11,5% случаев. Лечение оперативное
в объеме секторальной резекции молочной железы с проведением срочного
гистологического исследования. Вообще для мастопатии наиболее характерными
клиническими проявлениями является: болезненность молочных желез, ощущение
увеличения их объема, нагрубание (мастодиния) и отек желез. Боли могут отдавать
в подмышечные области, плечо и лопатку.
При диагностике заболеваний молочных
желез оценивается наследственная предрасположенность к данной патологии. Уточняются
жалобы пациентки на болезненность, нагрубание, отек молочных желез, время их
появления, связь с менструальным циклом или его нарушениями. Определяется
наличие выделений из сосков, уточняется время и причина их появления,
консистенция, цвет, количество. При объективном обследовании отмечается
симметрия молочных желез, наличие опухолевидных образований, ассиметричного
втяжения сосков, присутствие рубцовых изменений, кожных втяжений, папиллом,
родимых пятен на коже молочной железы, оценивается степень развития молочных
желез.
Пальпация молочных желез также имеет
важное диагностическое значение. При этом определяется консистенция молочных
желез, ее симметричность, наличие уплотнений и их характер. Особое внимание
следует уделять наличию узловых образований. Оценивают их размер, плотность,
однородность, количество, подвижность, связь с подлежащими тканями, кожей. В
качестве инструментальных методов используют УЗИ и маммографию. При этом УЗИ
более целесообразно выполнять молодым женщинам, с 1 раз в 6 месяцев.
Маммографию рекомендуется проводить женщинам до 40 лет при подозрении на
очаговую патологию молочных желез по данным УЗИ, а женщинам после 40 лет с
профилактической целью1 раз в год.
Лечение. Больные с диффузными формами
мастопатии подлежат консервативному лечению, которое носит в основном
симптоматический характер. Предложено множество схем лечения и препаратов,
однако лечебная тактика должна вырабатываться конкретно для каждой пациентки. В
лечении таких больных обязательно участие эндокринолога и гинеколога. Все
пациентки с узловыми формами заболевания должны быть направлены в хирургический
стационар для оперативного лечения. Таким больным после обследования
выполняется секторальная резекция пораженного отдела молочной железы со срочным
интраоперационным гистологическим исследованием препарата, по результатам
которого определяется окончательный объем оперативного вмешательства. Любой
выявленный в молочной железе узел необходимо расценивать как предрак. В таких
случаях ни выжидательная тактика, ни консервативное лечение не допустимы.
8. Доброкачественные опухоли молочной
железы. Клиника. Диагностика. Дифференциальный диагноз. Лечение
В молочной железе представлены
различные ткани тела человека, каждая из которых может дать начало опухолевому
росту. Чаще всего выделяют эпителиальные и неэпителиальные опухоли. Среди
эпителиальных доброкачественных опухолей чаще всего встречаются фиброаденомы,
аденомы. Наиболее частыми неэпителиальными доброкачественными опухолями,
встречающимися в молочной железе, являются фибромы, липомы, лимфангиомы. Они
имеют морфологическое строение и характерные клинические признаки независимо от
органа, в котором развиваются.
Наиболее признанной является
гистологическая классификация доброкачественных опухолей молочной железы,
предложенная экспертами ВОЗ в 19781981 гг.
Гистологическая классификация
доброкачественных опухолей молочной железы.
I. Эпителиальные опухоли:
) интрадуктальная папиллома;
) аденома соска;
) аденома: а) тубулярная, б)
лактирующая,
) прочие.
II. Смешанные соединительнотканные и
эпителиальные опухоли:
) фиброаденома: а) периканаликулярная
(околопротоковая), б) интраканаликулярная (внутрипротоковая): простой тип,
клеточная внутрипротоковая;
) филлоидная опухоль (кистозная
карцинома филлоидная).
III. Смешанные опухоли:
) опухоли мягких тканей;
) опухоли кожи.
IV. Неклассифицируемые опухоли.
V. Дисплазии молочной железы
(фибрознокистозное заболевание).
VI. Опухолеподобные процессы:
) воспалительные псевдоопухоли;
) гамартома;
) гинекомастия;
4) прочие
Наиболее часто встречающейся доброкачественной
эпителиальной опухолью молочной железы является фиброаденома. Эта
опухоль обнаруживается чаще в возрасте 1535 лет, обычно в виде одиночных узлов,
хотя могут быть и множественные. Опухоли могут располагаться в одной молочной
железе или поражать обе, часто сочетаясь с мастопатией.
Фиброаденома состоит из
пролиферирующих эпителиальных компонентов и соединительной ткани.
Гистологически выделяют несколько форм фиброаденомы. В интракаяаликулярных
опухолях преобладают разрастания соединительной ткани, среди которых
располагаются сдавленные протоки в виде эпителиальных ветвистых тяжей.
Периканаликулярные фиброаденомы гистологически представлены параллельным
разрастанием соединительной ткани и эпителия, который образует железистые трубочки.
При этом выявляются расширенные протоки и кисты, как при мастопатии. Филлоидные
(или листовидные) фиброаденомы на разрезе имеют слоистое строение, напоминая
листы сложенной книги. При их гистологическом исследовании выявляются
разрастания соединительной ткани, богатой клеточными элементами, железистые
ходы и кисты, выстланные пролиферирующим эпителием, участки интраканаликулярных
и периканаликулярных фиброаденом.
В тех случаях, когда фиброаденомы
бедны стромой, в их структуре преобладают разрастания железистого эпителия.
Такие опухоли называют аденомами. Для них характерны менее четкие контуры,
консистенция их мягче, чем фиброаденом.
Клиника и диагностика. Клинически
фиброаденомы определяются как плотноэластические округлые образования с четкими
контурами, одиночные или множественные, располагающиеся в одной или поражающие
обе молочных железы. Размеры их могут быть различными - от микроскопических
узелков до опухолей больших размеров, меняющих форму железы, при этом они
хорошо видны в виде опухолевого узла. В некоторых случаях, что более характерно
для филлоидных фиброаденом, опухоль может занимать практически всю молочную
железу. Пальпация фиброаденом безболезненная. Опухоль свободно перемещается в
ткани железы, не исчезает при пальпации больной в положении лежа (положительный
симптом Кенига). Кожа над опухолью не изменена. Реже фиброаденомы имеют
крупнобугристую поверхность. Темп роста опухоли медленный, но иногда
(филлоидные фиброаденомы) они могут быстро увеличиваться в размерах.
Диагноз фиброаденомы устанавливают,
как правило, в результате клинического обследования больной. Однако для
подтверждения диагноза обязательным является проведение рентгенологического
бесконтрастного исследования - маммографии. На маммограмме опухоль выявляется в
виде округлой плотной тени с четкими контурами. Обязательно также
морфологическое подтверждения диагноза - гистологическое или цитологическое
исследование материала, получаемого при пункционной биопсии новообразования. В
некоторых случаях для исключения диагноза кисты молочной железы показано
проведение ультразвукового исследования.
Дифференциальный диагноз фиброаденом проводится,
прежде всего, со злокачественными опухолями молочных желез, а также с другими
доброкачественными опухолями, узловой формой мастопатии, хроническими
неспецифическими воспалительными процессами, со специфическими поражениями
молочных желез (туберкулез, сифилис). Еще реже приходится дифференцировать
фиброаденомы от грибковых (актиномикоз) или паразитарных (эхинококкоз)
поражений.
Лечение. Все пациентки с фиброаденомами, как,
впрочем, и со всеми другими узловыми образованиями молочных желез, должны
направляться в специализированные хирургические стационары для дообследования и
оперативного лечения. Хирургическое лечение должно заключаться в проведении
секторальной резекции пораженного участка молочной железы в пределах
неизмененных тканей со срочным гистологическим интраоперационным исследованием
препарата. Не следует выполнять вылущивание (энуклеацию) опухоли, так как это
может привести к усилению процессов пролиферации в тканях, прилежащих к
опухоли. При больших размерах опухоли (филлоидной фиброаденомы), превышающих
810 см в диаметре, может потребоваться проведение простой мастэктомии.
Результаты лечения больных с фиброаденомами после проведения адекватного
хирургического вмешательства хорошие. Обычно фиброаденомы редко малигнизируются
- всего в 11,5% случаев. Чаще возможно перерождение филлоидных опухолей.
Для них характерно также местное рецидивирование опухоли, в связи с чем
пациентки, перенесшие оперативные вмешательства, должны находиться в
последующем под динамическим наблюдением специалиста..
9.
Рак молочной железы. Классификация. Клиника. Диагностика. Дифференциальный
диагноз. Виды операций
Рак молочной железы (РМЖ) - злокачественная эпителиальная
опухоль, развивающаяся в паренхиме или выводных протоках молочной железы. Среди
всех онкологических заболеваний у женщин РМЖ прочно занимает ведущее место, и
число заболеваний неуклонно увеличивается из года в год. Наиболее часто опухоль
выявляется у женщин в возрасте 4560 лет, однако в настоящее время заболевание
поражает и женщин как более старшего, так и молодого (3040 лет) возраста.
В настоящее время практически
общепринятой является международная классификация TNM (шестое издание, 2002), учитывающая характер самой
опухоли (критерий Т), состояние регионарных лимфоузлов (критерий N) и наличие или отсутствие отдаленных
метастазов (критерий М).
Для характеристики самой первичной
опухоли (Т) используются следующие градации:
Тх - недостаточно данных для оценки
первичной опухоли; То - первичная опухоль не определяется;
Tis - преинвазивная карцинома (Carcinoma in situ), сюда же относится внутрипротоковая опухоль in situ, дольковая опухоль in situ и рак Педжета без наличия опухолевого узла (если при
раке Педжета определяется опухолевый узел, опухоль классифицируется по его
размерам);
Т1 - опухоль до 2 см в наибольшем
измерении (Tlmic - микроинвазия, до 0,1 см в
наибольшем измерении):
Т1а - до 0,5 см в наибольшем
измерении,
T1b - до 1 см в наибольшем измерении,
T1c - до 2 см в наибольшем измерении;
Т2 - опухоль до 5 см в наибольшем
измерении;
ТЗ - опухоль более 5 см в наибольшем
измерении;
Т4 - опухоль любого размера с прямым
распространением на грудную стенку или кожу:
Т4а - распространение на грудную стенку,
т. е. прорастание в ребра, межреберные мышцы, переднюю зубчатую мышцу, но не
считая грудных мышц,
Т4b - отек, включая лимонную корочку, или изъязвление кожи
молочной железы, или сателлиты в коже молочной железы,
Т4с - признаки, перечисленные в 4а и
4b, T4 - воспалительная форма рака.
Критерий N характеризует регионарные
лимфоузлы. Для молочной железы регионарными лимфатическими узлами являются
следующие.
. Подмышечные (на стороне поражения)
- интерпекторальные (узлы Роттера) а лимфатические узлы по ходу
аксиллярной вены и ее притоков, подразделяющиеся на следующие уровни:
) уровень I - нижние подмышечные - расположены латерально по отношению к
боковой границе малой грудной мышцы;
) уровень II - средние подмышечные - расположены между медиальным и латеральным
краем малой грудной мышцы, а также интерпекторальные лимфатические узлы (узлы
Роттера);
) уровень III - апикальные подмышечные - расположены медиально по
отношению к медиальному краю малой грудной мышцы, исключая подключичные.
. Подключичные на стороне поражения.
. Внутренние лимфатические узлы
молочной железы (располагаются в эндоторакальной фасции на стороне поражения и
межреберных пространствах вдоль края грудины).
. Надключичные на стороне поражения.
Любые другие лимфатические узлы,
пораженные метастазами, включая шейные или контралатеральные внутренние
лимфатические узлы молочной железы, обозначаются как отдаленные метастазы Nl.
Состояние упомянутых лимфатических
узлов при раке молочной железы определяются следующим образом.
Nx - недостаточно данных для оценки
состояния регионарных лимфатических узлов;
No - нет признаков поражения
регионарных лимфатических узлов;- метастазы в смещаемых лимфатических(ом)
узлах(е) на стороне поражения;- метастазы в подмышечных лимфатических узлах,
фиксированных друг с другом, или клинически определяемые (при физикальном
осмотре или с помощью методов визуализации) метастазы во внутренних
лимфатических узлах молочной железы на стороне поражения при отсутствии
клинически определяемых метастазов в подмышечных лимфатических узлах:
N2a - метастазы в подмышечных лимфатических узлах, фиксированных
друг к другу или к другим структурам;
N2b - метастазы определяемые только клинически во внутренних
лимфатических узлах молочной железы при отсутствии клинически определяемых метастазов
в подмышечных лимфатических узлах.- метастазы в подключичных лимфатических
узлах с/или без метастазов в подмышечных лимфатических узлах или клинически
определяемые метастазы во внутренних лимфатических узлах молочной железы на
стороне поражения при наличии метастазов в подмышечных лимфатических узлах; или
метастазы в подключичных лимфоузлах на стороне поражения с/или без метастазов в
подмышечных или внутренних лимфатических узлах молочной железы:
N3a - метастазы в подключичных лимфатических узлах;
N3b - метастазы во внутренних лимфатических узлах молочной
железы на стороне поражения;
N3c - метастазы в подключичных лимфоузлах.
Отдаленные метастазы характеризуются критерием М:
Мх - недостаточно данных для
определения отдаленных метастазов;
Мо - нет признаков отдаленных
метастазов;
Ml - имеются отдаленные метастазы.
Критерий Ml может быть дополнен в зависимости от локализации отдаленных метастазов
(легкие, печень, головной мозг, костный мозг, плевра, брюшина, надпочечник,
почка, лимфатические узлы и др.). Обязательным также является указание
патогистологической характеристики (рТ) и степени гистопатологической
дифференцировки (критерий G),
что осуществляется уже в послеоперационном периоде по всему препарату.
Клиника и диагностика. Основной
жалобой больных с раком молочной железы является наличие безболезненной,
плотной опухоли в молочной железе с неровными контурами. Это клинические
признаки наиболее часто встречающейся формы РМЖ - узловой. Для опухоли
характерно отсутствие четких границ уплотнения, постепенный переход в
окружающую паренхиму железы, хрящевая плотность при отсутствии болезненности.
Для небольших опухолей в железистом теле характерен симптом «морщинистой кожи»,
обусловленный укорочением связок Купера, вовлеченных в бластоматозный процесс. При
центральной локализации опухолевого узла возможно сужение ареолы, втяжение
соска, отклонение его в сторону опухолевого узла. Симптом Кенига отчетливо
положителен: опухоль не исчезает при надавливании в горизонтальном положении
больной. При более выраженной опухолевой инфильтрации при обследовании больной
выявляются признаки нарушения лимфообращения в подареолярном сплетении: симптом
умбиликации, площадки, может отмечаться отек ареолы. При опухолевом поражении
лимфатических сосудов с отеком кожи может отмечаться симптом «апельсиновой
корки», что свидетельствует о далеко зашедшем процессе. При скиррозной форме
опухоли отмечается уменьшение («сморщивание») железы в размерах по мере роста
опухоли.
Диффузные формы рака протекают более
злокачественно. По клиническим проявлениям выделяют отечноинфильтративную,
маститоподобную, рожеподобную, панцирную формы. Отечноинфильтративная и
маститоподобная формы встречаются чаще у более молодых пациенток, особенно
часто в период беременности и лактации, и быстро прогрессируют. При этих формах
отмечается раннее метастазирование в регионарные лимфоузлы. Панцирная форма РМЖ
встречается чаще у пожилых пациенток, растет довольно медленно, но прогноз при
ней неблагоприятен.
Своеобразно протекает рак Педжета -
опухоль с преимущественным поражением соска молочной железы, встречается чаще у
женщин 4570 лет. Для этой формы РМЖ характерно образование чешуек и бляшек, а
также появление изъязвлений на соске, мокнущих экзематозных изменений,
сочетающихся с зудом, неприятными ощущениями и неопределенными болями в области
соска. По мере прогрессирования опухоли сосок постепенно утолщается,
деформируется, втягивается и может совершенно исчезнуть. К этому времени обычно
в железистом теле появляется плотный опухолевый узел. Иногда такой узел является
единственным проявлением заболевания (узловая форма рака Педжета). По мере
роста опухоли отмечается метастатическое поражение регионарных лимфатических
узлов: к моменту обращения к врачу у 2050% больных женщин выявляются метастазы
в регионарных лимфоузлах. Поражение опухолью лимфоузлов приводит к сдавлению
сосудов и нервов в подмышечной области с развитием слоновости верхней
конечности, развитием стойкого болевого синдрома. Блокада лимфоузлов
метастазами приводит к извращению лимфооттока от железы, что в свою очередь
обусловливает распространение метастазов в лимфоузлы и кожу противоположной
молочной железы.
Отдаленные метастазы при обычном течении заболевания
появляются через 23 года после установления диагноза. Наиболее часто
метастазами поражаются кости, легкие, плевра, печень, головной мозг, что
проявляется соответствующими клиническими симптомами. Однако в некоторых
случаях признаки генерализации опухолевого процесса могут появляться как в
более ранние сроки, так и через 1520 лет после удаления первичной опухоли.
Диагноз основывается на данных объективного
обследования - выявление опухолевого узла в железе или обнаружение других
характерных изменений покрывающей железу кожи или соска. Большое значение имеет
тщательный сбор анамнеза с выяснением факторов риска развития опухоли.
Обязательным является проведение безконтрастного рентгенологического
исследования молочных желез - маммографии. Рентгенологически опухоль имеет вид
округлой тени овальной или неправильной лучистой формы с неровными бугристыми контурами.
Весьма характерно наличие в самой опухоли или окружающих ее тканях мелких
множественных кальцинатов, которые в некоторых случаях могут быть единственными
признаками рака. В комплекс диагностических исследований обязательно включается
компьютерная томография или магнитнорезонансное исследование с целью выявления
возможных метастатических очагов в органахмишенях, УЗИ органов брюшной полости,
сканирование костей скелета с радиоактивными изотопами (технеций). Обязательным
в настоящее время является определение рецепторов стероидных гормонов
(эстрогена и прогестерона) в опухоли для планирования комплексного лечения
больных.
Дифференциальный диагноз рака молочной железы изза
многоликости заболевания необходимо проводить практически со всеми
заболеваниями молочной железы, используя все необходимые методы исследований.
Наиболее часто РМЖ приходится диффенцировать с доброкачественными опухолями
молочной железы, узловыми формами мастопатии, воспалительными заболеваниями,
специфическими процессами (туберкулез, сифилис), грибковыми поражениями
(актиномикоз) и паразитарными заболеваниями (эхинококкоз).
Наиболее часто выполняемой операцией
в настоящее время является мастэктомия по ПейтиДайсену, при которой для
сохранения функции верхней конечности большая грудная мышца не удаляется. При
прорастании опухоли в большую грудную мышцу должна выполняться мастэктомия по
ХолстедуМайеру, при которой данная мышца включается в блок удаляемых тканей.
Менее травматичной является
мастэктомия по Маддену, при которой удаляются вместе с молочной железой
клетчатка подмышечной, подлопаточной и доступных отделов подключичной области,
при сохранении грудных мышц. Обязательным условием ее выполнения является
отсутствие признаков поражения регионарных лимфатических узлов.
В последние годы все большее число сторонников
приобретают органосохраняющие оперативные вмешательства - радикальная резекция
молочной железы, квадрантэктомия или гемимастэктомия с лимфаденэктомией. Такие
операции могут быть выполнены у пациенток, у которых опухоль не превышает 3 см
в наибольшем измерении (по данным маммографии), при узловом типе опухоли, при
отсутствии прорастания в кожу и в подлежащие ткани, при отсутствии признаков
мультицентрического роста и при отсутствии регионарных и отдаленных метастазов.
10. Рак молочной железы. Классификации.
Клинические формы. Пути метастазирования. Лечение
Опухоль инфильтрирует паренхиму
молочной железы, распространяется по междольковым щелям, млечным протокам,
лимфатическим и капиллярным кровеносным сосудам, а затем выходит за пределы
молочной железы. Проникая в лимфатические узлы, опухолевые клетки блокируют их.
При этом извращается отток лимфы от органа, что обусловливает необычные пути
лимфогенного метастазировання. При дальнейшем распространении опухоли возникают
отдаленные лимфогенные и гематогенные метастазы РМЖ. В связи с этим необходимо
знать основные пути метастазирования опухоли.
. Пекторальный путь - к парамаммарным
узлам и далее к лимфатическим узлам подмышечных впадин.
. Подключичный путь - к подключичным
лимфатическим узлам.
. Парастернальный путь - к парастернальным
лимфатическим узлам.
. Медиастинальный путь - к
медиастинальным лимфатическим узлам, минуя парастернал ьные.
. По лимфатическим узлам Герота - к
эпигастральным лимфоузлам и узлам брюшной полости.
Реже встречается метастазирование по
другим путям лимфооттока: а) транспекторальный путь - к центральным (верхним)
подмышечным лимфоузлам; б) перекрестный путь - в подмышечные лимфатические узлы
и в молочную железу противоположной стороны; в) внутрикожный - по
брюшной стенке к паховым лимфоузлам.
Лечение больных с РМЖ проводится с
обязательным учетом гистологической формы и распространенности опухоли,
возраста и физиологического статуса пациентов, конституциональных особенностей,
наличия сопутствующих заболеваний. В настоящее время при лечении таких
пациентов используют комплексный подход, включающий местнорегионарное
(хирургическое удаление опухоли и регионарных ее метастазов, лучевая терапия) и
системные воздействия (химиотерапия, гормонотерапия, иммунотерапия).
Несмотря на несомненные успехи
химиогормонотерапии и лучевого лечения, ведущим и наиболее эффективным в
настоящее время является хирургический метод лечения больных с РМЖ.
Обязательным компонентом комбинированного лечения больных с РМЖ является
лучевое лечение. При обнаружении регионарных метастазов оно проводится перед
операцией и в послеоперационном периоде. При выявлении признаков опухолевого
роста в удаленных лимфатических узлах в послеоперационном периоде обязательно
проводится лучевая терапия. Послеоперационное облучение грудной стенки
осуществляется после полного заживления операционной раны и стихания
воспалительных явлений, что происходит через 23 недели после операции.
Рак молочной железы может оказаться
системным заболеванием в любой его стадии, что сопровождается скрытой
диссеминацией опухолевых клеток. Отдаленные метастазы в последующем выявляются
у 1015% больных даже при первой стадии заболевания. В связи с этим системное
лечение является неизменным компонентом в комплексном лечении таких больных.
Подавление функции яичников у женщин с сохраненным менструальным циклом или в
течение первого года постменопаузы может быть достигнуто назначением
гормональных препаратов (тамоксифен). Прежде с этой целью проводилось еще одно
оперативное вмешательство - овариэктомия.
Для проведения химиотерапии при РМЖ
предложено значительное количество химиопрепаратов. Активный поиск новых
лекарственных веществ и их компонентов продолжается и сегодня во многих
развитых странах мира. Наиболее эффективные и часто применяемые при РМЖ
препараты могут быть разделены на четыре группы: алкилирующие вещества
(циклофосфан, тиофосфамид), антиметаболиты (5фторурацил, фторафур,
метотрексат), вещества растительного происхождения - алкалоиды (винбластин,
винкристин), противоопухолевые антибиотики (адриабластин, адриамицин,
карминомицин). Для химиотерапии распространенного рака молочной железы у мужчин
применяют те же препараты, что и у женщин. Предложено значительное количество
схем полихимиотерапии РМЖ: схема Купера, CMF, CAF, CAMF и другие. Наиболее часто
используемой в настоящее время является апробированная схема CMF - сочетание циклофосфана,
метотрексата и 5фторурацила. Циклофосфан по 400 мг вводят внутривенно или
внутримышечно через день с 1го по 15й день (суммарная доза 2800 мг),
метотрексат - по 30 мл внутривенно в 1й и 8й день (суммарная доза 60 мг),
5фторурацил - 750 мг внутривенно в 1й, 8й и 15й дни (суммарная доза 2250 мг).
Лечение начинают через 2 недели после мастэктомии и проводят 2недельными
курсами с интервалом 23 месяца в течение одного года, всего 5 курсов
полихимиотерапии. Выбор конкретной схемы полихимиотерапии осуществляется сугубо
индивидуально у каждой конкретной пациентки.
11.
Пневмоторакс. Классификация. Причины. Клиника. Диагностика. Первая помощь.
Лечение. Спонтанный пневмоторакс. Причины. Лечение
В зависимости от характера сообщения
плевральной полости с внешней средой различают закрытый, открытый и клапанный
пневмоторакс. Все они встречаются при открытых повреждениях, когда нарушается
целость кожи и париетальной плевры.
Закрытый пневмоторакс образуется, когда раневое отверстие в
мягких тканях груди и легком быстро закрывается в результате смещения тканей и
их травматического отека; в дальнейшем воздух через него в плевральную полость
не поступает. Объем воздуха, попавшего в плевральную полость, может быть
значительным или очень небольшим, практически не определяющимся обычными
методами исследования.
Расстройства дыхания и кровообращения
при закрытом пневмотораксе выражены относительно мало и быстро компенсируются
после кратковременного периода острых нарушений, носящих в значительной мере
рефлекторный характер.
Открытый пневмоторакс. Если рана грудной стенки зияет, то
всегда возникает цепь неблагоприятных анатомических и функциональных изменений.
При вдохе порция воздуха, входя в полость плевры, сдавливает легкое, податливые
отделы сердца и полые вены, резко оттесняет средостение в здоровую сторону, а
диафрагму книзу. При выдохе воздух выталкивается из плевральной полости наружу;
легкое, лишенное эластической тяги грудной клетки, частично расправляется.
Появляется парадоксальное дыхание, при котором на вдохе в здоровое легкое
попадает часть воздуха, насыщенного углекислым газом, из пораженного легкого, а
на выдохе он устремляется в обратном направлении. В итоге из газообмена
выключается не только легкое на стороне повреждения, но заметно уменьшается
эффективность дыхательной функции здорового легкого, значительно нарушаются
общая и легочная гемодинамика, развивается гипоксемия, что в сочетании с
раздражением нервных образований средостения при его флотации приводит к
нарастанию функциональных расстройств.
Клапанный пневмоторакс. Выраженные расстройства дыхания и
кровообращения возникают также и при клапанном пневмотораксе. С каждым вдохом
воздух на стороне повреждения нагнетается в плевральную полость через рану
грудной стенки или бронха, все больше сдавливая легкое и оттесняя средостение,
поскольку в результате клапанного механизма выйти наружу не может. Таким
образом, возникает внутриплевральная компрессия легкого, быстро ведущая к
тяжелой дыхательной и сердечнососудистой недостаточности.
Закрытый пневмоторакс является частым
проявлением закрытых травм и проникающих ранений груди. Величина его зависит от
характера повреждения легкого. При травме поверхностной части дыхательной
паренхимы пневмоторакс чаще небольшой, а легкое коллабировано на 1/31/4 его
объема. К моменту поступления пострадавшего в стационар дыхательные нарушения,
возникшие после травмы, становятся незначительными, одышка заметна лишь при физической
нагрузке. Па рентгенограммах соответственно пораженной стороне определяются
участки просветления в виде большей или меньшей зоны, лишенной легочного
рисунка. Легкое колллбировано, средостение смещено в противоположную сторону.
Открытый пневмоторакс, выявленный в
годы Великой Отечественной войны примерно у трети раненых (33,2%), отличается
значительной тяжестью даже при сравнительно небольшом повреждении легкого.
Частота шока у таких раненых достигала 5055%.
Пострадавшие возбуждены, напуганы,
страдают от резких болей в ране и мучительного кашля. Не имеющие окклюзионной
повязки на ране стремятся закрыть зияющее повреждение грудной стенки рукой или
подручными средствами.
В общей клинической картине отчетливо
преобладают дыхательные расстройства. Цианоз кожи, холодный пот, выраженная
одышка, снижение артериального давления, малый и частый пульс свидетельствуют о
тяжести состояния раненого. Осмотр зияющей раны груди, сообщающейся с
плевральной полостью, сквозь которую с шумом проходит воздух в обоих направлениях,
дает основание для установления окончательного диагноза.
Физикально определяется пневмоторакс
с почти полным коллапсом легкого и смещение средостения в противоположную
сторону. В большинстве наблюдений можно выявить и гемоторакс, выраженный в
большей или меньшей степени.
На рентгенограммах выявляют коллапс легкого, смещение
органов средостения в противоположную сторону и горизонтальный уровень
жидкости. Устанавливают характер повреждений костей, локализацию инородных тел.
Ранения и закрытые травмы грудп с клапанным
пневмотораксом наблюдаются у небольшой группы (12%) от общего числа
пострадавших, но отличаются значительной тяжестью функциональных сдвигов. В
этих случаях при обследовании наблюдается большая часть симптомов,
встречающихся при других видах проникающих ранений груди. Во время осмотра
пострадавших наряду с признаками гипоксии и гемодинамических расстройств
бросается в глаза резко выраженная нарастающая подкожная эмфизема грудной
стенки, часто распространяющаяся на шею, голову, конечности, живот.
Физикально обнаруживается
пневмоторакс с резким смещением средостения в противоположную сторону.
Рентгенологически выявляется коллапс легкого, опущение
купола диафрагмы и резкое смещение средостения в неповрежденную сторону. Всем
раненым с клапанным пневмотораксом необходима неотложная хирургическая помощь,
без которой они быстро погибают в связи с прогрессированием дыхательных и
сердечнососудистых расстройств.
При закрытом пневмотораксе в случае незначительного
скопления воздуха в плевральной полости срочных лечебных мероприятий не
требуется; при скоплении большого количества воздуха в плевральной полости,
вызвавшем полное спадение легкого, показана эвакуация воздуха из плевральной
полости с помощью плевральной пункции.
При открытом пневмотораксе первая помощь заключается в
немедленном наложении на рану грудной клетки герметической (окклюзионной)
повязки с помощью лейкопластыря или клеенчатой прокладки из индивидуального
пакета, которую фиксируют к краям раны клеем и марлевой (бинтовой) повязкой.
Раненому необходимо обеспечить ингаляцию кислорода, ввести обезболивающие
средства (морфин и др.), антибиотики. В стационаре производят хирургическую
обработку раны с герметизацией дефекта грудной стенки путем послойного ушивания
или пластики окружающими тканями.
При клапанном пневмотораксе, открытом кнаружи, на рану
грудной стенки накладывают герметическую повязку из лейкопластыря и
транспортируют больного в стационар. В случае, если клапанный пневмоторакс
открыт кнутри (дефекта грудной стенки нет), показаны срочная плевральная
пункция во втором межреберье по среднеключичной линии и оставление толстой иглы
в плевральной полости во время транспортировки в стационар.
Первичный спонтанный пневмоторакс возникает с частотой
от 1 до 18 случаев на 100 000 населения в год (в зависимости от пола). Обычно
он появляется у высоких, худых молодых людей в возрасте от 10 до 30 лет и редко
бывает у людей старше 40 лет. Курение сигарет увеличивает риск возникновения
пневмоторакса примерно в 20 раз (в зависимости от числа выкуренных сигарет).
Хотя у пациентов с первичным спонтанным пневмотораксом не бывает клинически
явной легочной патологии, у 76100% таких больных во время видеоторакоскопии
обнаруживаются субплевральные буллы, а при открытой торакотомии они выявляются
у 100% больных. В контралатеральном легком буллы обнаруживаются у 7996%
больных. Компьютерная рентгеновская томография грудной клетки обнаруживает
буллы у 89% больных первичным спонтанным пневмотораксом, по сравнению с 20%
частотой булл у таких же здоровых людей тех же возрастных групп, с таким же
количеством потребляемых сигарет. Даже среди некурящих с пневмотораксом в
анамнезе буллы обнаруживаются у 81%. Механизм формирования булл остается
неясным. Возможно, они возникают вследствие деградации эластических волокон легких,
которая обусловлено активацией нейтрофилов и макрофагов, вызванной курением.
Это приводит к нарушению баланса между протеазами и антипротеазами и системой
окисления и антиоксидантов. После формирования буллы возникает воспалительная
обструкция мелких дыхательных путей, в результате чего увеличивается
внутриальвеолярное давление и воздух начинает проникать в легочный интерстиций.
Потом воздух продвигается по направлению к корню легкого, вызывая эмфизему
средостения, с ростом давления в средостения происходит разрыв медиастинальной
париетальной плевры и возникает пневмоторакс. Большинство случаев первичного
спонтанного пневмоторакса возникает в покое. Практически все больные жалуются
на боль в грудной клетке со стороны пневмоторакса и остро возникшую одышку.
Интенсивность боли может варьировать от минимальной до очень сильной, чаще
всего ее описывают, как острую, а позднее, как ноющую или тупую. Обычно
симптомы исчезают в течение 24 часов, даже если пневмоторакс остается нелеченым
или не разрешается. У больных с небольшим пневмотораксом (занимающим менее 15%
от объема гемиторакса) физикальная симптоматика обычно отсутствует. Чаще всего
у них наблюдается тахикардия. Если объем пневмоторакса больше, может
наблюдаться уменьшение экскурсии грудной клетки на больной стороне, перкуторный
звук с коробочным оттенком, ослабление голосового дрожания и резкое ослабление
или вовсе отсутствие проведения дыхательных шумов на больной стороне.
Тахикардия более 135 ударов в минуту, гипотония, или цианоз заставляют подумать
о напряженном пневмотораксе. Результаты измерения газов артериальной крови
обычно указывают на увеличение альвеолярноартериального градиента и острый
дыхательный алкалоз. Диагноз первичного спонтанного пневмоторакса
устанавливается на основании анамнеза и выявления свободного края легкого (то
есть становится видимой тонкая линия висцеральной плевры) на обычной
рентгенограмме органов грудной клетки, выполненной сидя или стоя. В выявлении
пневмоторакса небольшого объема, особенно верхушечного, может помочь рентгеноскопия
или рентгенография на выдохе, однако их выполнение в отделение интенсивной
терапии не всегда возможно. Лечение пневмоторакса заключается в эвакуации
воздуха из плевральной полости и предотвращении рецидива. При пневмотораксе
небольшого объема можно ограничиться наблюдением, можно аспирировать воздух
через катетер, и сразу же удалить его. Оптимальным методом лечения
пневмоторакса является дренирование плевральной полости. Для предупреждения
рецидивов проводят хирургическое вмешательство на легком либо через
торакоскопический доступ, либо путем торакотомии. Выбор доступа зависит от
объема пневмоторакса, тяжести клинических проявлений, наличия постоянной утечки
воздуха в плевральную полость и того, является ли пневмоторакс первичным или
вторичным.
12. Острый абсцесс легкого.
Классификация. Клиника. Диагностика. Дифференциальный диагноз. Консервативные
методы лечения. Показания к операции в остром периоде. Виды операций.
Осложнения
Острый абсцесс легкого - гнойнонекротическое поражение
легкого, при котором происходит бактериальный и/или аутолитический протеолиз
некротических масс и формирование полости, отграниченной от жизнеспособной
легочной ткани.
Выделяют следующие
клиникоморфологические формы абсцесса легкого: • простой (гнойный); •
гангренозный (с секвестрами). • грамотрицательные палочки: - представители
семейства Enterobacteriaceae; - Pseudomonas aeruginosa; • неклостридиальные
анаэробные микроорганизмы; • Haemophilus influenzae; • Mycoplasma pneumoniae; •
грибы.
По распространенности процесса
различают: • односторонние поражения: • абсцесс легкого: - одиночный абсцесс
легкого; - множественные абсцессы легкого; • гангрена легкого: - долевая; -
субтотальная; - тотальная; • двусторонние поражения: - множественные абсцессы
легкого; - гангрены легких; - абсцесс одного легкого, гангрена другого; -
абсцессы и гангрена одного легкого, пневмония с противоположной стороны.
Наиболее характерным симптомом абсцесса легкого и
гангрены легкого является кашель с отхождением мокроты. Кашель может беспокоить
преимущественно по утрам (по мере накопления мокроты) или быть сухим,
приступообразным, мучительным. Мокрота может быть: • гнойной, чаще - с запахом,
реже - без запаха; белого, грязнозеленого или сероватобелого цвета; двух или
трехслойной; • гнилостной, с резким труднопереносимым запахом; грязносерого или
шоколадного цвета; трехслойной (характерно для гангрены легкого); • с примесью
крови. Нередко возникает боль на стороне поражения, связанная с дыханием,
кашлем. Часто у пациентов отмечается одышка. Вначале она обусловлена
затруднением дыхания, затем артериовенозным шунтированием крови, уменьшением
объема вентилируемой легочной ткани. Характерны выраженные симптомы
интоксикации: • повышение температуры тела, нередко гектического характера,
сопровождающееся ознобами; • энцефалопатия; • нарушение функций паренхиматозных
органов; • повышенная утомляемость; • снижение аппетита до анорексии; •
снижение массы тела. Наряду с вышеназванными симптомами клиническая картина
может включать проявления, характерные для развития осложнений абсцесса легкого
и гангрены легкого: • со стороны плевральной полости: - серозный плеврит; -
эмпиема плевры; - пневмоторакс; - пиопневмоторакс; • со стороны грудной стенки:
- прободающая эмпиема; - флегмона грудной стенки; - наружные торакальные свищи;
- перикардит: - серозный; - гнойный; • кровотечение, кровохарканье; •
ДВСсиндром; • респираторный дистресссиндром взрослых; • сепсис; • полиорганная
недостаточность.
В зависимости от выраженности клинических проявлений
выделяют следующие степени тяжести течения абсцесса легкого: • легкое (симптомы
поражения нижних дыхательных путей без признаков дыхательной недостаточности);
• средней тяжести: - симптомы поражения нижних дыхательных путей + дыхательной
недостаточности; - симптомы поражения нижних дыхательных путей + дыхательной
недостаточности + выраженная интоксикация; - выраженный протеолиз легочной
ткани с быстрым образованием полостей на фоне невыраженных симптомов поражения
нижних дыхательных путей; • тяжелое: - симптомы поражения нижних дыхательных
путей + дыхательной недостаточности + сепсис; • крайне тяжелое: - септический
шок, сохраняющийся несмотря на адекватную инфузионную терапию; - полиорганная
недостаточность.
Чрезвычайно важно выявление вредных
привычек и факторов риска, предрасполагающих к развитию абсцесса легкого и
гангрены легкого и более тяжелому их течению. При осмотре обращает на себя
внимание серый оттенок кожных покровов.
Наиболее типичными признаками
являются:
• отставание пораженной стороны
грудной клетки при дыхании;
• участок притупления перкуторного
звука, над которым дыхание вначале резко ослаблено, а при прорыве абсцесса
становится жестким, с множеством разнокалиберных хрипов. При расположении
полости близко к поверхности легкого может определяться тимпанит, амфорическое
дыхание. Характерные изменения в анализе крови:
• нейтрофильный лейкоцитоз со сдвигом
лейкоцитарной формулы влево (при тяжелой интоксикации количество лейкоцитов
может быть нормальным);
• гипохромная анемия;
• гипопротеинемия;
• гипоксемия, гиперкапния, снижение
насыщения кислородом артериальной крови.
Анемия и гипопротеинемия
характеризуют тяжесть гнойного процесса.
Посев венозной крови выполняется
дважды пациентам со среднетяжелым и тяжелым течением абсцесса легкого и
гангрены легкого до начала антибактериальной терапии (кровь берется из разных
мест с интервалом в 10 мин и более).
При тяжелом течении абсцесса легкого
и гангрены легкого в анализах мочи могут выявляться следующие изменения:
• протеинурия;
• цилиндрурия.
При микроскопическом исследовании мокроты
выявляются нейтрофильные лейкоциты, бактерии, некротизированные элементы
легочной ткани. Бактериоскопия позволяет максимально быстро определить наличие
грамположительных кокков, грамотрицательных палочек, грибов, что помогает в
выборе противомикробного лекарственного средства. Последующее
бактериологическое исследование мокроты/бронхоальвеолярной лаважной жидкости
позволяет в ряде случаев выявить возбудителя, определить его чувствительность к
противомикробным лекарственным средствам и при необходимости внести изменения в
проводимую терапию.
Лучевые методы исследования являются
основными методами диагностики абсцесса легкого и гангрены легкого.
Рентгенография легких в 2 проекциях
позволяет выявить очаг гнойной деструкции и определить его распространенность.
В начальной стадии определяется массивное затемнение легочной ткани.
абсцесс легкого после прорыва
выглядит как округлое полостное образование с толстой стенкой и горизонтальным
уровнем жидкости, окруженное зоной перифокальной инфильтрации, более выраженной
в нижних отделах. В ранних стадиях полость может принимать овальную форму во
время дыхания (максимальный диаметр - вертикальный на вдохе, горизонтальный на
выдохе).
При гангрене легкого воспалительная
инфильтрация и затемнение легочной ткани не имеют четких границ и захватывают
больше одной доли, нередко все легкое. Иногда появляются разнокалиберные
просветления на месте очагов распада, в наиболее крупных из них могут быть
хорошо видны участки омертвевшей ткани - легочные секвестры. Характерно быстрое
присоединение рентгенологических признаков плеврального выпота, а затем и
пиопневмоторакса. Дополнительную информацию о количестве и локализации
абсцессов, наличии секвестров, а также о появлении сопутствующего плеврального
выпота, плохо заметного на обычных рентгенограммах, можно получить при
компьютерной томографии легких.
Бронхоскопия. Позволяет определить
дренирующий бронх, выраженность "дренажного" бронхита, наличие
инородного тела в бронхе, а также исключить заболевание бронхов, которые могли
привести к нагноительному процессу.
В острой фазе исследование функции
внешнего дыхания нередко затруднительно. При стихании острых явлений
исследование функции внешнего дыхания помогает осуществить динамический
контроль эффективности лечения.
Дифференциальная диагностика острого
абсцесса легкого должна проводиться со следующими заболеваниями:
• рак легкого;
• туберкулез;
• эхинококковые кисты легких.
Прежде всего абсцесс легкого приходиться
дифференцировать с полостной формой рака легкого и центральным раком легкого с
абсцедированием в ателектазе.
Цели лечения: • предотвратить неблагоприятный
исход заболевания; • остановить деструкцию легкого, сохранить орган полностью
или частично; • максимально возможно восстановить функцию дыхания. Пациентам с
острыми гнойнодеструктивными заболеваниями легких проводится комплексная
терапия, основными элементами которой являются: • оптимальное дренирование
полостей распада; • антибактериальная терапия; • лечение полиорганной
недостаточности; • коррекция волемических, реологических, электролитных
нарушений и нарушений кислотнощелочного равновесия; • дезинтоксикационная
терапия (включая плазмаферез); • специфическая иммунотерапия
(антистафилококковый гаммаглобулин, антистафилококковая плазма); •
общеукрепляющее лечение.
Санационная бронхоскопия, как
правило, позволяет восстановить проходимость дренирующих абсцесс бронхов,
выполнить его катетеризацию, промыть и ввести в полость антисептики,
протеолитические ферменты, антибиотики. При необходимости лечебные бронхоскопии
проводят многократно, что позволяет в большинстве случаев добиться
положительного эффекта.
Для улучшения отхождения мокроты
используют муколитики, лечебную физкультуру, дыхательную гимнастику,
физиотерапевтическое лечение.
Амброксол внутрь по 30 мг 3 р/сут в
течение 2 сут, далее по 30 мг
р/сут (длительность определяется
индивидуально) или
Ацетилцистеин внутрь по 200 мг 3-4
р/сут (длительность определяется индивидуально) или
Бромгексин внутрь по 8-16 мг
р/сут (длительность определяется
индивидуально) или
Карбоцистеин внутрь по 750 мг 3 р/сут
(длительность определяется индивидуально)
Пункцию абсцесса производят при полной непроходимости
дренирующего бронха и в случае неэффективности бронхоскопической санации.
Существуют методики как трансторакальной, так и транстрахеальной пункции.
Дренирование применяют в тех случаях, когда иными методами невозможно добиться
полного опорожнения абсцесса. При больших абсцессах легких используется
трансторакальное дренирование с последующей санацией гнойной полости
антисептическими растворами и постоянной активной аспирацией содержимого.
При выборе противомикробных лекарственных средств у
пациентов с острыми деструктивными заболеваниями необходимо помнить о том, что:
• большинство из них до этого длительно получали массивную антибактериальную
терапию; • высока вероятность микробных ассоциаций. До выделения возбудителя и
определения его чувствительности проводят эмпирическую антибактериальную
терапию с учетом предполагаемого возбудителя. В дальнейшем подбор антибиотиков
зависит от чувствительности к ним идентифицированных возбудителей. Общая
длительность антибактериальной терапии составляет 4-6 недель.
Показания к хирургическому лечению: • осложнения: -
кровотечение; - напряженный пиопневмоторакс; - флегмона грудной стенки; -
угроза асфиксии при большом количестве мокроты; • отсутствие эффекта от лечения
в течение 6-8 недель; • переход процесса в хронический. Наиболее часто при
абсцессе легкого выполняют лобэктомию. Операцией выбора при гангренозном
абсцессе является пневмотомия с последующими этапными некрсеквестрэктомиями и
санацией полости распада.
13. Хронический абсцесс легкого. Причины
перехода острого абсцесса в хронический. Клиника. Диагностика. Медикаментозное
и хирургическое лечение
Если абсцесс легкого не завершается в
течение 2 месяцев, он переходит в хроническую стадию.
Этилогия хронического абсцесса
лёгкого
Причины перехода острого абсцесса в
хронический можно разделить на две группы:
Обусловленные особенностями течения
патологического процесса:
· очень большие, диаметром более 6 см,
полости в легком
· наличие секвестров в полости
· плохие условия для дренирования
(узкий извитой дренирующий бронх; ход из полости, начинающийся в верхней ее
части), локализация абсцесса в нижней доле
· вялая реакция организма на
воспалительный процесс
Обусловленные ошибками в лечении
больного:
· поздно начатая антибактериальная
терапия
· малые дозы антибиотиков, применение
антибиотиков без учета чувствительности флоры
· недостаточное использование
мероприятий, направленных на улучшение условий для дренирования абсцесса
· недостаточное использование
общеукрепляющих лечебных средств
На фоне общих признаков острого и
хронического абсцессов, таких как: тахикардия, асимметричные дыхательные
движения грудной клетки, ослабления дыхательных шумов, разнокалиберных влажных
хрипов, амфорического дыхания при хорошем дренировании полости абсцесса,
трёхслойной мокроты: желтой слизи, водянистого слоя и гноя (на дне), для
Хронического абсцесса лёгкого характерны:
Периодическое обострение гнойного
процесса. В период ремиссии: пароксизмы лающего кашля, увеличение количества
гнойной мокроты при перемене положения тела, возможно кровохарканье, сильная
утомляемость, похудание, повышенная потливость.
Болезнь течёт циклично, с
периодическими обострениями острой лихорадкой, увеличением количества типичной
трёхслойной мокроты. Длительность стадий зависит от того, насколько сохранились
функции дренирующего бронха и опорожняемости полости абсцесса.
При длительном течении возможны
осложнения: кахексия, бронхоэктаз (расширение бронхов с связи с воспалением),
пневмосклероз (разрастание рубцовой соединительной ткани), эмфизема легких
(повышенная воздушность легочной ткани), легочные кровотечения, дыхательная
недостаточность, амилоидоз (отложение белка амилоида) внутренних органов,
абсцесс мозга и др.
Клиника и диагностика: выделяют два
основных типа течения хронических абсцессов.
Первый тип. Острая стадия завершается
клиническим выздоровлением больного или значительным улучшением. Больного
выписывают из стационара с нормальной температурой тела. После выписки
состояние остается удовлетворительным, и больной нередко приступает к работе.
Однако через некоторый' период снова повышается температура тела, усиливается
кашель. Через 7-12 дней происходит опорожнение гнойника, температура тела снижается.
Впоследствии обострения становятся более длительными и частыми. Развиваются
явления гнойного бронхита, нарастают интоксикация и связанные с ней
дистрофические изменения в органах.
Второй тип. Острый период без
выраженной ремиссии переходит в хроническую стадию. Заболевание протекает с
гектической температурой. Больные выделяют большое количество гнойной мокроты,
делящейся при стоянии на три слоя. Быстро развивается и нарастает тяжелая форма
интоксикации, приводящая к общему истощению и дистрофии паренхиматозных
органов. Чаще такой тип течения заболевания имеет место при множественных
абсцессах легкого. У больных характерный вид: они бледны, кожа землистого
оттенка, слизистые оболочки цианотичны, отмечается одутловатость лица,
появляются отеки на стопах и пояснице, связанные с белковым голоданием и
нарушением функции почек. Быстро нарастает легочносердечная недостаточность, от
которой больные умирают.
При хроническом абсцессе возможно
развитие тех же осложнений, которые присущи острому периоду заболевания.
В комплекс лечебных мероприятий
обязательно входит назначение больших доз антибиотиков и сульфаниламидов,
антнгнетаминиых средств, внутривенное введение кристаллоидных (1% раствор
хлорида кальция, 5% раствор глюкозы) и дезинтоксикационных растворов (гемодез,
лолндез). Выделение гноя всегда сопровождается большими потерями белка, для
возмещения которого используют белковые гидролизаты и аминокислотные среды, а
также вливание плазмы и крови.
Возможна также катетеризация
бронхиальных артерий из просвета аорты (по методу Сельдингера). Однако оба эти
метода сложны, небезопасны и могут применяться только в специализированных
учреждениях. В ряде случаев, особенно при периферическом расположении
абсцесса, восстановить проходимость бронха не удается. Это диктует необходимость
прямой пункции гнойника через грудную клетку. Данное вмешательство следует
проводить под рентгенологическим контролем, с соблюдением всех мер профилактики
воздушной эмболии. Если же и пункция легкого не достигает желательного
результата, возникают показания к дренированию абсцесса хирургическим путем.
Введение дренажной трубки в полость абсцесса можно осуществить двумя
путями. Первый из них - торакоцентез, который применяют при расположении
гнойника непосредственно возле грудной стенки. Второй способ заключается в
проколе грудной стенки и капсулы абсцесса троакаром, через который вводят
дренажную трубку. В обоих случаях предварительно осуществляют пункцию абсцесса
тонкой иглой, которая служит ориентиром для дальнейших манипуляций.
Установленный в полость абсцесса резиновый или полиэтиленовый дренаж подшивают
к коже и подключают к постоянному вакуумному аппарату. Периодически производят
промывание абсцесса и вливают в его полость растворы антибиотиков. Прекращение
гнойной секреции служит основанием к удалению дренажа. При сформированном
хроническом абсцессе пневмотомию производят лишь при стойкой блокаде
дренирующего бронха во время тяжелого рецидива воспаления. В этом случае
операция относится к разряду паллиативных.
Пневмотомию выполняют как под местной
анестезией, так и под наркозом. Если абсцесс расположен далеко от грудной
стенки, весьма велика опасность кровотечения нз паренхимы легкого с последующей
асфиксией. В таких случаях целесообразно использовать наркоз с эндобронхиальной
интубацией. Перед пневмотомией необходимо тщательно локализовать полость
абсцесса. Разрез кожи производят в проекции максимально близкого прилегания
гнойника к грудной клетке. Резецируют 1-2 ребра на протяжении 5-10 см. Как
правило, плевральная полость в зоне расположения абсцесса облитерирована, что
облегчает вскрытие его капсулы. При отсутствии сращений края капсулы абсцесса
подшивают к грудной стенке, однако такой прием ие исключает полностью опасности
возникновения эмпиемы плевры. Редкими осложнениями пневмотомии являются
флегмона грудной стенки, аррознонное кровотечение, образование
бронхоторакальных свищей. Частые рецидивы нагноения инвалидизируют больных и
могут привести к тяжелым осложнениям - появлению новых очагов абсцедирования,
эмпиемы плевры, легочного кровотечения, амилоидоза внутренних органов и др.
Добиться излечения в таких случаях удается только путем радикальной резекции
пораженной части или всего легкого. Современная оперативная техника позволяет
выполнить резекцию сегмента, доли, двух долей легкого. Однако при хронических
абсцессах экономные операции (клиновидная резекция, сегментэктомия) применяют
очень редко изза опасности вспышки воспаления в прилежащих к области резекции
участках легкого.
14. Гангрена легкого. Причины. Клиника.
Диагностика. Дифференциальный диагноз. Принципы лечения. Стафилококковая
деструкция легких. Понятие. Клиника. Диагностика. Лечение.
Гангрена лёгкого - гнойногнилостный распад лёгочной
ткани, не имеющий четких границ со здоровой тканью лёгкого. Объём поражения -
доля, две доли, всё лёгкое. Так же как и абсцесс, гангрена развивается «на
базе» того или иного воспалительного процесса (затянувшаяся пневмония,
бронхоэктатическая болезнь и т. д.). Развитие гангрены легкого связано, как
правило, с двумя моментами: наличием гнилостной микрофлоры и значительным
ослаблением организма (тяжелые истощающие заболевания, алкоголизм, понижение
сопротивляемости организма в старческом возрасте).
Симптомы гангрены легкого. Абсцесс и гангрена легкого имеют
ряд общих черт в своем начале: тяжелое состояние, высокая температура тела,
проливной пот и т. д. Однако при гангрене легкого заболевание вскоре
приобретает специфические черты. Прежде всего прогрессивно ухудшается состояние
больного, он выделяет зловонную мокроту (резкий отвратительный запах гнилого
зуба). Мокрота собранная в стеклянный сосуд, четко делится на 3 слоя: верхний -
пенистый, средний - коричневого цвета с примесью гноя и крови, нижний -
крошковатая масса (частицы разрушенной легочной ткани).
При микроскопии мокроты
обнаруживаются лейкоциты, эритроциты, пробки Диттриха, характерные для гангрены
легкого; эластических волокон нет, они растворяются ферментами микроорганизмов,
вызывающих гангрену (в отличие от мокроты при абсцессе легкого, когда при
микроскопии обнаруживаются эластические волокна).
Изменения в крови говорят о
выраженной патологии, характерной для воспалительного процесса.
Госпитализация в отделение
интенсивной терапии • Диета высококалорийная: 3000-3500 ккал/сут •
Консервативное лечение •• Антибактериальная терапия (антибиотики в максимальных
дозировках с учётом воздействия на анаэробную флору) •• Иммуностимулирующая
терапия (ронколейкин и др.) •• Коррекция нарушений микроциркуляции
(реополиглюкин, пентоксифиллин) •• Витаминотерапия •• Санационные бронхоскопии
•• Ингаляционная терапия • Хирургическое лечение. Показания: отсутствие
клинической и лабораторной положительной динамики в течение 10-12 дней.
Выполняют лобэктомию, билобэктомию или пневмонэктомию.
Стафилококковая деструкция легких . Под этим термином
принято понимать абсцедирующие (деструктивные) формы стафилококковых пневмоний.
Клинические особенности их, независимо от возраста, отличаются бурностью
течения, высоким токсикозом, подъемом температуры до 38-39°, значительным
сдвигом нейтрофильного ряда крови влево, кашлем, наличием хрипов в легких и
очаговой инфильтратавностью ткани легких на рентгенограмме. В сравнительно
ранние сроки (3-6й день от начала заболевания) возможно развитие
абсцедирования. В подавляющем числе случаев эти абсцессы прорываются в
плевральную полость или реже - в бронх. Это явление сопровождается внезапным
резким ухудшением состояния, развитием выраженной одышки, цианоза, участия
вспомогательных мышц в дыхании как прямое следствие наступившего
пиопневмоторакса. На рентгенограмме определяется резкое смещение средостения в
здоровую сторону, колябирование легкого, наличие уровня жидкости и газа в
плевральной полости. Первая помощь и лечение заключаются в безотлагательной
пункции плевральной полости с отсасыватгием гноя и воздуха. Если дефект бронха
окажется значительным, что скажется на неэффективности пункции, необходимо
произвести торакоцентез, лучше в 4-5м межреберье на боковой поверхности грудной
клетки с больной стороны и завести в плевральную полость резиновый дренаж с
подводным клапаном (по Бюляу). Эти мероприятия позволят и ликвидировать
напряженный пневмоторакс, и вывести больного из угрожающего состояния. В
дальнейшем больному необходимы мероприятия по полному расправлению ткани
легкого, проведению направленной антибактериальной, детоксицирующей,
десенсибилизирующей терапии, пассивной иммунизации (свежей кровью, плазмой,
гаммаглобулином) и других мероприятий, что лучше проводить в специализированных
(детских хирургических) стационарах. Перечисленную группу заболеваний,
проявляющихся острой дыхательной недостаточностью (одышкой, цианозом),
необходимо дифференцировать с группой врожденных пороков сердца, особенно
синего типа.
15. Острая эмпиема плевры. Определение
понятия. Классификация. Клиника. Диагностика. Принципы лечения. Показания к
дренированию плевральной полости. Виды дренирования.
Острая эмпиема плевры это ограниченное или диффузное
воспаление висцеральной и париетальной плевры, протекающее с накоплением гноя в
плевральной полости и сопровождающееся признаками гнойной интоксикации и
нередко дыхательной недостаточности Острая эмпиема плевры является
полиэтиологичным заболеванием. В зависимости от этиологии различают
специфическую, неспецифическую и смешанную эмпиему плевры. Специфическая
эмпиема плевры вызывается микобактериями туберкулеза, некоторые авторы сюда
относят также и грибковые ЭП (актиномикотические, кандидомикотические,
аспергилезные). К специфическим эмпиемам плевры относят также и сифилитический
плеврит.
Неспецифическая эмпиема плевры вызывается различными
гноеродными или гнилостными микроорганизмами. До применения антибиотиков в гное
из плевральной полости чаще всего находили пневмококки, стрептококки и
диплококки. За последнее десятилетие соотношение микробных возбудителей заметно
изменилось. Чаще других обнаруживаются стафилококки до 77%. Это объясняется
выраженной его вирулентностью и устойчивостью к большинству антибактериальных
средств. В 3045% случаев при посевах гноя из плевральной полости получают рост
гр () микроорганизмы это различные штаммы кишечной, синегнойной палочки,
протея. До 80% случаев высевается анаэробная неклостридиальная флора
(бактероиды, фузобактерии, пептококки, пептострептококки и др.).
Патогенетически различают первичную и вторичную
эмпиему плевры. При первичной эмпиеме плевры очаг воспаления с самого начала
локализуется в плевральной полости, при вторичной он является осложнением
какоголибо другого гнойновоспалительного заболевания. Первичная эмпиема плевры
возникает на фоне неизмененных, здоровых плевральных листков в результате
нарушения их барьерной функции с занесением микрофлоры Это бывает при травме
груди, после операции на легком, а также при наложении искусственного
пневмоторакса.
По данным Г.И.Лукомского, в 88% случаев вторичная
эмпиема плевры явилась осложнением пневмонии, острых и хронических гнойных
заболеваний легких. Пневмония может с самого начала протекать с развитием
гнойного плеврита (парапневмоническая эмпиема плевры, или же эмпиема плевры
развивается на исходе пневмонии и приобретает характер самостоятельного
заболевания (метапневмоническая). При абсцессах легких эмпиема плевры
развивается у 811% больных, а при гангрене легкого у 5590%. В единичных
случаях эмпиема может развиваться, как осложнение нагноившейся или паразитарной
кисты легкого, распадающегося рака, спонтанного пневмоторакса. Вторичная эмпиема
плевры может развиваться и контактным путем, при нагноении ран груди,
остеомиелите ребер, позвоночника, грудины, хондрите, лимфадените, медиастините,
перикардите. Источником инфицирования плевры в редких случаях могут быть острые
воспалительные заболевания брюшной полости (поддиафрагмальный абсцесс,
холецистит. панкреатит и др.). Проникновение микробов из брюшной полости на
плевру происходит по лимфатическим сосудам и щелям в диафрагме, так называемым
«люкам» (расширенным лимфатическим сосудам), или гематогенным путем..Этиология:
.Неспецифические: 2.Специфические: 3.Смешанные
гнойные туберкулезные
гнилостные грибковые
анаэробные сифилитические.Патогенез:
.Первичные 2.Вторичные
травматичекие пара и метапневмонические
послеоперационные контактные
метастатические.Клиническое течение:
. Острые (до 3 месяцев) 2. Хронические (свыше 3
месяцев)..Деструкция легкого:
. Эмпиема плевры без деструкции легкого (простая)
. Эмпиема плевры с деструкцией легкого.
. Пиопневмоторакс..Сообщение с внешней средой: VI.Распространенность:
. Закрытые 1.Отграниченные
. Открытые: 1) верхушечные
с бронхоплевральным свищом; 2) парамедиастинальные
с плеврокожным свищом; 3) наддиафрагмальные
с бронхоплеврокожным свищом; 4) междолевые
решетчатым легким; 5) пристеночные
с другими полыми органами. 2.Распространенные
) тотальные
) субтотальные
Прорыв aбсцесca легкого в полость плевры
сопровождается тяжелыми клиническими симптомами, которые выражаются различно в
зависимости от предшествующего состояния больного и формы абсцесса легкого.
Острое начало гнойного плеврита характеризуется повышением температуры до
38-39°, появлением болей в груди и одышкой. Больной принимает вынужденное
положение сидя или лежа на здоровом боку. Болевой синдром возникает, как
правило на стороне поражения, постоянного или ноющего характера, усиливающийся
при глубоком дыхании, кашле, при перемене положения тела. Иногда возникают боли
в животе вследствие раздражения диафрагмы с иррадиацией по чревному нерву.
Кашель нередко с выделением большого количества мокроты, что зависит от
степени поражения легкого, наличия бронхоплеврального свища.
Кашель встречается практически у всех этих больных как
характерная ocoбeнность первичного патологического процесса (абсцесс легкого,
гангрена легкого, бронхоэктазы и т. д.). Явления дыхательной недостаточности,
обусловлены накоплением жидкости в плевральной полости и сдавлением легкого, а
также гнойнодеструктивным процессом в паренхиме легкого, шунтированием крови из
коллабированных отделов легкого, нарушением гемодинамики, бронхоспастическим
компонентом.
Интоксикация она зависит преимущественно от
распространенности гнойного процесса, вирулентности микрофлоры и индивидуальной
реактивности больного. В течение нескольких дней температурная реакция, как
один из важнейших признаков гнойнорезорбтивного процесса становится
ремиттирующей, появляются ознобы. При гнилостной эмпиеме плевры лихорадка часто
имеет гектический характер с суточными колебаниями около 3 градусов,
сопровождается резкими ознобами, потливостью, тяжелым общим состоянием, иногда
рвотой. У некоторых больных с острой эмпиемой плевры гнойная интоксикация
проявляется нервнопсихическими расстройствами: от головной боли,
раздражительности, бессонницы, быстрой утомляемости до психомоторного
возбуждения, делирия, комы. Гнойная интоксикация приводит к дистрофии миокарда
и энергодинамической недостаточности сердца. Одновременно может развиться
сосудистая недостаточность изза нарушения функции надпочечников. В последующем
при сохранении гнойной интоксикации развивается легочносердечная
недостаточность с нарастающей декомпенсацией кровообращения и гипертензией в
малом круге, о чем свидетельствует акцент 2 тона на легочной артерии, сдвиг
электрической оси сердца вправо. Как следствие гнойной интоксикации появляются
признаки нарушений функции органов.
При объективном обследовании определяется ограничение
дыхательных движений одной половины грудной клетки, сглаженность межреберных
промежутков, местный отек кожи и подкожной клетчатки над областью скопления
гноя в плевральной полости. В дальнейшем ткани грудной стенки в этой зоне
становятся плотными, усиливается болезненность, появляется гиперемия кожи. При
перкуссии над зоной скопления жидкости определяется притупление. При отсутствии
воздуха и сращений в плевральной полости верхняя граница тупости соответствует
линии ЭллисаДамуазо. При аускультации отмечается ослабление везикулярного
дыхания вплоть до полного его отсутствия над большим скоплением жидкости. Над
зоной поджатого легкого бронхиальное дыхание, иногда выслушиваются разнокалиберные
влажные хрипы, иногда шум трения плевры изза фибринозного плеврита вокруг
полости эмпиемы. Если имеется бронхоплевральный свищ и полость хорошо
дренируется через бронх, то может выслушиваться амфорическое дыхание. Очень
характерно усиление бронхофонии над областью скопления жидкости. Местные
симптомы при остром гнойном плеврите выражаются в притуплении перкуторного
звука, не всегда выраженного вследствие небольшого количества экссудата,
расположенного тонким слоем по поверхности легкого; в ослаблении или отсутствии
дыхательного шума; в отсутствии «голосового дрожания»; заметном отставании
больной стороны при вдохе. Болезненны межреберные промежутки; болезненность
имеется и в верхней части живота; характерно выражение лица больного с румянцем
на щеке с больной стороны.
Рентгенологическое исследование при острой эмпиеме плевры и
пиопневмотораксе имеет наибольшее значение, позволяет точно верифицировать
диагноз и определить ближайшую тактику лечения больного. Наиболее информативной
является полипозиционная рентгеноскопия, позволяющая локализовать
поражение, точно определить степень коллапса легкого и смещения средостения,
количество жидкости, выявить патологические изменения в легочной паренхиме,
наметить точку для адекватного дренирования плевральной полости, особенно при
ограниченной эмпиеме. При редко встречающихся междолевых эмпиемах возможна
пункция гнойника под контролем рентгеноскопии. Дополнительные
рентгенологические методы исследования применяются после стабилизации состояния
больных. В их задачу входит определение характера деструктивного процесса, его
протяженности и окализации. Томография позволяет ответить на эти
вопросы, однако, это исследование малоинформативно на фоне коллапса легкого или
наличия значительного количества жидкости в плевральной полости. Поэтому ее
целесообразно выполнять после дренирования плевральной полости и освобождения
ее от гноя.
При лабораторных исследованиях периферической
крови выявляются анемия, значительное повышение количества лейкоцитов (до 20109
в 1 мкл), резкий сдвиг влево лейкоцитарной формулы с появлением юных форм
нейтрофилов, высокий лейкоцитарный индекс интоксикации. Биохимическое
исследование крови выявляет гипопротеинемию, нарушения функций печени и почек
(повышение уровня трансаминаз и фосфатаз, креатинина, мочевины). Анализ мочи
подтверждает наличие токсической нефропатии (протеинурия, цилиндрурия)
Плевральная пункция должна быть произведена во всех
случаях, когда возникло подозрение на наличие экссудата в плевральной полости.
Современный уровень диагностики и лечения острых эмпием плевры предусматривает
полноценное микробиологическое (в т. ч. вирусологическое) исследование
мокроты, содержимого легочных гнойников и плевральной полости (исследование
экссудата)
Своевременное и эффективное дренирование плевральной
полости при острой эмпиеме плевры является решающим фактором успешного лечения.
Однако важнейшее значение принадлежит и общему лечению таких больных. Оно
проводится, как упоминалось выше, по нескольким основным направлениям. Наиболее
важным является коррекция волемических расстройств на фоне выраженной
интоксикации и обезвоживания. Как правило, всем больным выполняется
катетеризация подключичной вены для массивных инфузий и контроля центрального
венозного давления. Для коррекции водноэлектролитных нарушений используются
растворы, содержащие глюкозу (10-20% растворы), калий (аспаркам), инсулин. Для
устранения гипо и диспротеинемии показаны инфузии альбумина, нативной плазмы. У
истощенных больных нередко приходится строить программу инфузионной терапии по
принципам полного или частичного парентерального питания (глюкоза и
аминокислотные смеси). При анемии, особенно в случаях распространенных
деструктивных поражениях, необходимы гемотрансфузии значительного объема. У
многих больных (около 20%) возникновение и прогрессирование
гнойнодеструктивного процесса в легком связано с наличием сахарного диабета
различной степени тяжести. Коррекция углеводного обмена у таких больных должна
проводиться с обязательным участием эндокринолога на всех этапах лечения.
Основное внимание уделяется полноценному дренированию
и санации плевральной полости. Пункционное лечение острой эмпиемы плевры и
пиопневмоторакса, о котором упоминается даже в публикациях последних лет, как
правило, малоэффективно и должно быть оставлено или применяться по строго
ограниченным показаниям (ограниченная, небольшого объема эмпиема плевры без
деструкции легочной ткани в труднодоступных для дренирования зонах).
Дренирование плевральной полости при острой эмпиеме плевры и пиопневмотораксе
должно в обязательном порядке проводиться после предварительной рентгеноскопии,
при которой следует определить оптимальное место для торакоцентеза: оно должно
находиться в максимально низкой точке полости, желательно по заднеподмышечной
линии. Показанием к дренированию плевральной полости является скопление между
листками плевры воздуха, крови или экссудата при различных заболеваниях и
патологических состояниях (пневмотораксе, эмпиеме плевры, гемотораксе и др.)
или после трансплевральных операций.
16. Хроническая эмпиема плевры. Понятие.
Причины перехода острой эмпиемы в хроническую. Клиника. Диагностика. Лечение.
Открытые и закрытые методы лечения
Общепринятый в настоящее время клинический термин
"хроническая эмпиема плевры" обозначает гнойнодеструктивный процесс
в остаточной плевральной полости с грубыми и стойкими морфологическими
изменениями, характеризующийся длительным течением с периодическими
обострениями. Если при остром гнойном плеврите легкое полностью не
расправилось, то между плевральными покровами остается полость, стенки которой
покрыты грануляционной тканью. Со временем эта ткань созревает и превращается в
волокнистую соединительную ткань, т. е. делается более плотной. Легкое в
начальной стадии заболевания остается подвижным и при освобождении полости плевры
от экссудата расширяется, а при накоплении экссудата снова спадается. При
длительном течении экссудативного воспаления легкое покрывается соединительной
тканью, как панцирем, и теряет возможность расправляться. Эти фиброзные
наложения на плевре носят название шварт. При длительном течении болезни они
достигают значительной толщины (23 см и более) и плотности. Следовательно,
длительное воспаление является одной из причин хронической эмпиемы плевры.
Второй причиной хронической эмпиемы плевры является
фиброз легкого с потерей им эластичности. Подобные изменения могут оставаться в
легком как после пневмоний, так и после абсцессов. Особое значение для
возникновения хронической эмпиемы имеют повреждения грудной клетки. Помимо
того, что открытые эмпиемы плевры имеют тяжелое клиническое в большом числе
наблюдений (до 25%) они осложняются бронхиальными свищами, которые приводят к
хронической эмпиеме, так как условия для расправления легкого при этом весьма
неблагоприятны. Хронические эмпиемы плевры наблюдаются после радикальных
легочных операций пневмонэктомий, лобэктомий и сегментарных резекций. Основными
условиями развития хронической эмпиемы плевры являются недостаточное
расправление легкого с формированием стойкой остаточной плевральной полости и
поддержание инфекции в стенках этой полости. Главными и поддерживающими
факторами служат бронхиальные свищи, хондриты, склеротические изменения
коллабированных отделов легкого, а при послеоперационных эмпиемах
несоответствие размеров оставшегося после резекции легкого объему плевральной
полости. Клиническая картина хронической эмпиемы определяется прежде всего
величиной гнойной полости, наличием или отсутствием бронхоплеврального и
плеврокожного свищей, морфологическими изменениями плевры и подлежащих тканей,
т. е. стадией эмпиемы. Переход острой эмпиемы в хроническую происходит
постепенно. Основными признаками такого перехода являются снижение температуры
тела до нормальной или субфебрильной, улучшение самочувствия, уменьшение
гнойного отделяемого и стабилизация объема остаточной плевральной полости. В 1
стадии хронической эмпиемы состояние больного удовлетворительное, боли в груди
уменьшаются или исчезают, почти нет признаков гнойной интоксикации и
дыхательной недостаточности. Только наличие стойкой остаточной полости с
небольшим количеством гноя или скудные гнойные выделения из плеврокожного свища
свидетельствуют о хроническом воспалительном процессе. Лабораторные признаки
гнойного процесса также мало выражены: сохраняются лишь умеренное повышение
СОЭ,незначительная анемия, диспротеинемия. Однако благополучие это кажущееся,
так как нагноительный процесс продолжается и медленно прогрессирует,
устойчивость организма к инфекции понижается, и при малейших неблагоприятных
обстоятельствах (охлаждение, переутомление, сопутствующие заболевания)
развивается обострение. Во время обострения повышается температура тела,
появляются ознобы, усиливаются боли в груди, нарастают признаки гнойной
интоксикации (особенно при наличии большой эмпиемной полости), увеличивается
количество гнойных выделений из плеврокожного свища или количество гнойной
мокроты (при эмпиеме с бронхоплевральным свищом). Нарастают анемия и
диспротеинемия, повышаются число лейкоцитов в крови и нейтрофильный сдвиг
влево. В плевральной жидкости резко увеличивается число лейкоцитов (до 15 '
10^/л), причем нейтрофилез экссудата достигает 95-99%; значительно увеличено
количество разрушенных клеток.стадия хронической эмпиемы плевры характеризуется
более тяжелой клинической картиной, так как длительное течение нагноительного процесса
отражается на общем состоянии больного, усиливаются общее недомогание,
разбитость, ухудшается аппетит, нарастают одышка и сердцебиение. При
сопутствующем процессе в легком значительно усиливается кашель, увеличивается
количество гнойной мокроты. Боли в груди непостоянны, часто колющего характера,
возникают или усиливаются при физической нагрузке. При переходе воспаления на
ткани грудной стенки и вовлечении в процесс нервных стволов боли могут
иррадиировать в руку, лопатку, живот. При осмотре таких больных обращает на
себя внимание их бледность, иногда цианоз. Грудная клетка неравномерно
участвует в акте дыхания. Пальпаторно нередко определяются отечность и
инфильтрация мягких тканей над полостью эмпиемы, особенно при наличии
плеврокожного свища. Данные перкуссии и аускультации различные в зависимости от
положения и величины гнойной полости, количества жидкости в ней, толщины шварт.
Чаще всего определяется значительное притупление перкуторного звука в нижних
отделах полости, переходящее в тимпанит над воздушной подушкой. Дыхание над
проекцией жидкости резко ослаблено или не выслушивается. Вне полости нередко
выслушиваются разнокалиберные хрипы. Тахикардия более стойкая, чем в 1 стадии,
что объясняется не только гнойной интоксикацией, но и смещением средостения.
Границы сердца могут быть смещены. При электрокардиографии и интегральной
реографии тела определяются гемодинамические нарушения с признаками легочной
гипертензии.
В III стадии хронической эмпиемы (с продолжительностью
заболевания более года) отмечается значительная деформация грудной клетки,
ребра на стороне поражения малоподвижны, межреберные промежутки резко сужены,
надплечье опущено. Почти всегда имеется плеврокожный свищ, нередко остеомиелит
ребра или хондрит. Закрытые хронические эмпиемы могут протекать бессимптомно
изза плотного осумкования гноя. В таких случаях только внимательное клиническое
и рентгенологическое обследование ослабленного больного позволяет заподозрить
наличие гнойного очага, а пункция остаточной плевральной полости подтверждает
наличие эмпиемы. В клинической картине этой стадии преобладают явления
длительной дыхательной недостаточности и хронической гнойной интоксикации. При
обострении гнойного процесса и нарушении оттока из полости состояние больных
значительно ухудшается, нарастает интоксикация. Длительное течение гнойного
процесса сопровождается развитием истощения больного, анемией, иногда
амилоидным перерождением почек и других внутренних органов.
Диагностика хронической эмпиемы, как правило,
несложна. Решающее значение имеют рентгенологические методы исследования.
Обычно исследование начинается выполнением стандартных рентгенограмм грудной
клетки в двух проекциях, в рядеслучаев необходима латерография. Характер
содержимого остаточной плевральной полости устанавливается при пункции ее.
Для уточнения локализации и размеров гнойной полости,
конфигурации ее стенок показаны плеврография, фистулография. Большое значение
для оценки состояния легкого и выбора лечебной тактики имеют томография,
бронхография и ангиопневмография. При длительном уществовании хронической
эмпиемы в коллабированном легком наступают необратимые морфологические
изменения,значительно нарушающие функциональные возможности легкого.
Бронхография дает возможность выявить состояние бронхиального дерева, определить
локализацию и характер бронхоплевральных свищей, установить причину
хронического течения процесса (бронхоэктазии, хронический абсцесс и т. п.).
Ангиопульмонография (общая или селективная)показана
лишь в тех случаях, когда неинвазивные методы исследования не дают четкого
представления о состоянии легкого над швартой. При получении серийных
ангиопневмограмм всех трех фаз контрастирования сосудов(артериальной,
капиллярной и венозной) надо считать, что в легком отсутствуют необратимые
склеротические изменения, функция его после декортикации и плеврэктомии может
восстановиться. Если же капиллярная фаза отсутствует, а ветви легочных сосудов
не только сближены, но и деформированы, сужены, причем контрастное вещество
задерживается в сосудах легкого более 10 с, то это свидетельствует о
развившемся плеврогенном склерозе легкого. В таких случаях плеврэктомия может
быть выполнена лишь в сочетании с частичной резекцией легкого. Наиболее полное
представление об изменениях в легочной паренхиме дает сопоставление данных бронхографии
и ангиопневмографии.
Лечение хронической эмпиемы плевры состоит из
мероприятий общего характера, направленных на организм больного в целом, и
мероприятий по санации и ликвидации гнойного очага.При обострении гнойного
процесса задачи общего лечения те же, что и при острой эмпиеме плевры. В стадии
ремиссии, когда заболевание проявляется в основном наличием плеврокожного свища
без признаков интоксикации и выраженных нарушений гомеостаза, проводится лишь
общеукрепляющее лечение и лечение сопутствующих заболеваний, если таковые
имеются. Длительность и объем предоперационной подготовки определяются
индивидуально для каждого больного.При этом должны быть использованы все
средства, способствующие устранению задержки гноя в полости, очищению стенок эмпиемы
и уменьшению размеров остаточной плевральной полости.При отсутствии
бронхиального свища эмпиемную полость можно санировать пункциями с максимальной
аспирацией гноя и промыванием антисептическими растворами, а также активным
вакуумным дренированием полости. Местная фибринолитическая терапия
внутриплевральным введением протеаз с последующими систематическими
промываниями позволяет ликвидировать рыхлые гнойнофибринозные напластования на
стенках полости. Однако расправить коллабированное легкое удается редко изза
плотных организованных шварт на висцеральной плевре, не поддающихся лизису.
Поэтому чаще устанавливаются показания к более сложным оперативным
вмешательствам. Задачи хирургического лечения хронической эмпиемы плевры
сводятся к устранению очага инфекционного процесса и ликвидации стойкой
остаточной плевральной полости.
Декортикация легкого при хронической эмпиеме значительно
затруднена в связи с плотными сращениями фиброзных шварт с висцеральной
плеврой.
Техника операции состоит в следующем. Под эндотрахеальным
наркозом осуществляется переднебоковая, боковая или заднебоковая торакотомия в
зависимости от локализации полости эмпиемы. Декортикация - это удаление
висцеральной плевры. Рассекаются шварты, отделяются от висцеральной и
париетальной плевры. Отслойку производят тупфером или пальцем, надавливая на
фибринозную ткань, а не на легкое. Важнейшее правило декортикации - это
проникновение в слой между фибринозной швартой и плеврой. Это значительно
облегчается при использовании гидравлической препаровки. Расширяя зону
декортикации, постепенно удается высвободить легкое. Однако нельзя стремиться
выполнить декортикацию всех отделов легкого, если имеются очень плотные
сращения, так как это, как правило, сопровождается повреждением легочной
паренхимы, что потребует ее ушивания, герметизации и может свести на нет все,
достигнутое декортикацией. Плотные участки сращений лучше оставлять на легком.
В некоторых случаях плотные шварты на висцеральной плевре рассекают
параллельными и перпендикулярными разрезами на расстоянии 1,5-2 см друг от
друга, не повреждая легкое [Маслов В. И., 1971]. Образующиеся участки шварты
иссекают параллельно легочной поверхности, наиболее плотно фиксированные
участки шварты остаются на легком. Декортикация будет эффективнее, и легкое лучше
расправится после операции, если разделить междолевые щели и произвести
мобилизацию всего легкого (пневмолиз). Для этого необходимо рассечь и иссечь
переходные складки эмпиемного мешка с участком париетальной плевры, рассечь
легочную связку,освободить диафрагмальную поверхность легкого, удалить
костодиафрагмальные шварты.
После декортикации, пневмолиза и диафрагмолиза
обязательно выполняется плеврэктомия, т. е. удаление париетальной плевры
и фиброзных напластований на ней. Удаляются не только фиброзные напластования с
поверхности плевры, но и фиброзноизмененная, имбибированная гноем плевра.
Отслаивание шварты при полной плеврэктомии
производится широко во всех направлениях, плотные сращения рассекаются
ножницами или скальпелем. Во многих случаях отделение плевры и фиброзных шварт
облегчается гидравлической препаровкой. Особенно осторожно необходимо
манипулировать на месте перехода париетальной плевры в висцеральную, чтобы
избежать повреждения легкого, а также при выделении шварт у купола плевральной
полости, где велика опасность повреждения подключичных сосудов. Удаление
эмпиемного мешка без вскрытия его, т. е. идеальная плеврэктомия и декортикация
легкого, удается редко. Чаще производится планируемое вскрытие полости эмпиемы
с аспирацией всего содержимого, очищением и промыванием
стенок полости, обработкой их 3-5 % спиртовым
раствором йода или первомуром,а после этого выполняются поэтапная декортикация
легкого, плеврэктомия и диафрагмолиз. Удаление париетальной шварты через
полость эмпиемы безопаснее, так как доступ к опасным зонам у средостения и
купола плевры шире, чем при удалении эмпиемного мешка целиком.
Декортикация и плеврэктомия завершаются тщательным
гемостазом и восстановлением герметичности легкого. Небольшие повреждения
легочной паренхимы можно герметизировать с помощью медицинского клея МК6 или
МК7. Перед ушиванием торакотомной раны полость обильно промывают
антисептическим раствором, нередко с использованием ультразвуковой обработки
стенок, устанавливают два дренажа с последующей активной аспирацией и
расправлением легкого. Декортикация легкого и плеврэктомия в чистом виде могут
быть выполнены очень ограниченному контингенту больных при отсутствии
значительной деструкции легкого и бронхоплевральных свищей. Чаще всего эту
операцию необходимо сочетать с дополнительными вмешательствами: резекцией
пораженных отделов легкого, ушиванием небольших бронхиальных свищей,
реампутацией культи бронха, корригирующей торакопластикой и др. При наличии
гнойнодеструктивных очагов в легком (абсцесс, бронхоэктазии,множественные
бронхиальные свищи), поддерживающих хронический гнойный процесс в плевре,
плеврэктомия сочетается с частичной резекцией легкого. Чаще всего производится
лобэктомия с декортикацией остающихся отделов легкого. При периферически
расположенных небольших участках деструкции легкого может быть выполнена
атипичная клиновидная резекция с помощью аппарата УКЛ.
17. Центральный рак легкого.
Классификация. Клиническая и рентгенологическая картина. Пути мегастазирования.
Дифференциальный диагноз. Лечение. Показания и противопоказания к
хирургическому лечению
Согласно клиникоанатомической классификации рака
легких существуют следующие формы, которые имеют свои клинические особенности:
· Центральный: а) эндобронхиальный; б)
перибронхиальный узловой; в) разветвленный.
· Периферический: а) круглая тень; б)
пневмониеподобный; в) верхушки легкого (Панкоста).
· Атипичные формы: а) медиастинальная;
б) милиарный карциноматоз.
Согласно TNМклассификации,
опухоли определяют:
T - первичная опухоль:
§ Тх - недостаточно данных
для оценки первичной опухоли либо опухолевые клетки обнаружены только в мокроте
или промывных водах бронхов, но не выявлена бронхоскопией и/или другими
методами
§ Т0 - первичная опухоль не
определяется
§ Тis - неинвазивный рак (carcinoma in situ)
§ Tl - опухоль до 3 см в
наибольшем измерении, окружённая лёгочной тканью или висцеральной плеврой без
прорастания проксимальнее долевого бронха при бронхоскопии (главный бронх не
поражён)
§ Т2 - опухоль более 3 см в
наибольшем измерении или опухоль любого размера, прорастающая висцеральную
плевру, или сопровождающаяся ателектазом, или обструктивной пневмонией,
распространяющаяся на корень лёгкого, но не захватывающая всё лёгкое; По данным
бронхоскопии, проксимальный край опухоли располагается не менее 2 см от карины.
§ ТЗ - опухоль любого
размера, переходящая на грудную стенку (в том числе опухоль верхней борозды),
диафрагму, медиастинальную плевру, перикард; опухоль, не доходящая до карины
менее чем на 2 см, но без вовлечения карины, или опухоль с сопутствующим
ателектазом или обструктивной пневмонией всего легкого.
§ Т4 - опухоль любого
размера непосредственно переходящая на средостение, сердце, крупные сосуды,
трахею, пищевод, тела позвонков, карину (отдельные опухолевые узлы в той же
доле или опухоль со злокачественным плевральным выпотом)
N - регионарные лимфатические узлы
§ Nx - недостаточно данных
для оценки состояния регионарных лимфатических узлов
§ N0 - нет признаков
метастатического поражения регионарных лимфатических узлов
§ N1 - имеется поражение
перибронхиальных и/или лимфатических узлов корня легкого на стороне поражения,
включая непосредственное распространение опухоли на лимфатические узлы.
§ N2 - имеется поражение
лимфатических узлов средостения на стороне поражения или бифуркационных
лимфатических узлов.
§ N3 - поражение
лимфатических узлов средостения или корня легкого на противоположной стороне:
прескаленных или надключичных узлов на стороне поражения или на противоположной
стороне
М - отдаленные метастазы
§ Мх - недостаточно данных
для определения отдаленных метастазов
§ М0 - нет признаков
отдаленных метастазов
§ M1 - имеются признаки
отдаленных метастазов, включая отдельные опухолевые узлы в другой доле
G - гистопатологическая градация
§ Gx - степень
дифференцировки клеток не может быть оценена
§ G1 - высокая степень
дифференцировки
§ G2 - умеренная степень
дифференцировки
§ G3 -
низкодифференцированная опухоль
§ G4 - недифференцированная
опухоль
Симптомы центрального рака легкого:
Первичные (местные), обусловленные развитием в
просвете бронха первичной опухоли, как правило, возникают рано.
· Кровохарканье, возникающее у 50%
больных, проявляется в виде прожилок крови алого цвета в мокроте. Мокрота в
виде «малинового» желе характерна для поздних стадий болезни.
· Боли в грудной клетке различной интенсивности
на стороне поражения беспокоят 60% больных, хотя у 10% пациентов боли могут
возникать с противоположной стороны. Данный симптом болезни появляется тогда,
когда в процесс вовлечена плевра или нервные стволы, т.к. легочная ткань не
имеет болевых окончаний.
· Кашель, который возникает рефлекторно
на ранних этапах болезни, появляется у 8090% больных. Вначале кашель сухой. При
прогрессировании болезни кашель начинает сопровождаться выделением слизистой
или слизистогнойной мокроты.
· Одышка, беспокоящая 30-40% больных,
напрямую связана с размером просвета поражённого бронха. Она нередко
обусловлена сдавлением крупных вен и артерий лёгкого, сосудов средостения,
плевральным выпотом (жидкостью между грудной стенкой и легкими).
· Признаки обтурационного (связанного с
закрытием просвета бронха) пневмонита (воспаление легочной ткани), который
протекает быстротечно, рецидивирует, а также развивается на фоне сегментарного
или долевого ателектаза (спадения легкого) со специфической рентгенологической
симптоматикой.
Вторичные признаки, которые развиваются в результате
сопутствующих раку воспалительных осложнений либо обусловлены
метастазированием, а также вовлечением соседних органов, обычно бывают более
поздними и появляются при относительно распространённом опухолевом процессе.
Общие признаки (слабость, повышенная утомляемость, похудание, снижение
трудоспособности и другие симптомы) являются следствием влияния на организм
опухоли и сопутствующих воспалительных осложнений.
Семиотические признаки центрального
рака легкого при рентгенографии включают:
· наличие опухолевых масс в области
корня легкого;
· гиповентиляция одного или нескольких
сегментов легкого;
· признаки клапанной эмфиземы одного
или нескольких сегментов легкого;
· ателектаз одного или нескольких сегментов
легкого.
Вторым обязательным этапом
обследования больных с подозрением на рак легкого должна быть рентгеновская
компьютерная томография (РКТ). Компьютерная томография позволяет достаточно
точно идентифицировать корень легкого и прикорневое объемное образование.
Обычно центральный рак характеризуется полиморфным строением, гомогенной
структурой и плотностью от 40 до 70 HU. Очаги распада, как правило, появляются
при значительных размерах опухоли. Всегда при РКТ органов грудной клетки
оцениваются лимфатические узлы средостения и корней легких.
Рак лёгкого метастазирует тремя путями: лимфогенным,
гематогенным и имплантационным.
Наиболее характерен первый путь - в расположенные
рядом пульмональные, бронхопульмональные, бифуркационные, трахеобронхиальные,
паратрахеальные, околопищеводные (параэзофагеальные) лимфатические узлы. На
первом этапе лимфогенного метастазирования поражаются лёгочные лимфатические
узлы у места деления долевого бронха на сегментарные. Далее процесс
распространяется на бронхопульмональные лимфоузлы вдоль долевых бронхов. На
третьем этапе метастазы возникают в корневых лимфоузлах вдоль главного бронха и
сосудов корня лёгкого, верхних и нижних трахеобронхиальных лимфоузлах и
лимфоузлах у нижней стенки непарной вены. На четвёртом этапе в процесс
вовлекаются паратрахеальные, ретрокавальные, предаортокаротидные,
перикардиальные и параэзофагеальные лимфоузлы.
Отдалённое метастазирование возможно в печень,
лимфатические узлы средостения и надключичной области.
Гематогенное метастазирование присоединяется при
прорастании опухолью кровеносных сосудов - в печень, лёгкие, почки, кость и
надпочечники.
При прорастании плевры возможен перенос опухолевых
клеток по плевре.
При немелкоклеточном раке лёгкого
химиотерапия проводится при наличии противопоказаний к хирургическому и
лучевому лечению. При этом назначаются следующие препараты: доксорубицин,
цисплатин, винкристин, этопозид, циклофосфамид, метотрексат, блеомицин,
нитрозилмочевина, винорелбин, паклитаксел, доцетаксел, гемцетабин и др.,
применяемые курсами с интервалами в 34 недели (до 6 курсов).
Частичное уменьшение размеров
первичной опухоли и метастазов наблюдается не у всех больных, полное
исчезновение злокачественного новообразования происходит редко. Химиотерапия
неэффективна при отдалённых метастазах в печени, костях, головном мозге.
Лучевое лечение рака лёгкого
проводится при его неоперабельных формах, в случае отказа больного от
оперативного лечения, а также наличии серьёзных противопоказаний к оперативному
вмешательству. Наибольший эффект наблюдается при лучевом воздействии на
плоскоклеточные и недифференцированные формы рака лёгкого.
Лучевое вмешательство применяется как
для радикального, так и паллиативного лечения. При радикальном лучевом лечении
облучению подвергают как саму опухоль, так и зоны регионального
метастазирования, то есть средостение, общей дозой 6070 Гр.
Хирургическое вмешательство
подразделяется на:
§ радикальное
§ условнорадикальное
§ паллиативное
При радикальной операции удалению
подвергается весь опухолевый комплекс: первичный очаг, регионарные
лимфатические узлы, клетчатка с путями метастазирования. К условнорадикальной
операции добавляют лучевую и лекарственную терапию. Следует учитывать также и
то, что часть первичной опухолевой ткани и метастазы иногда не могут быть хирургически
удалены ввиду угрозы кровотечения или процессов распада в ателектазе.
Противопоказаниями к радикальной
операции являются:
§ неоперабельность - распространение
опухоли на соседние ткани и органы
§ нецелесообразность ввиду отдалённых
метастазов в печень, кости и головной мозг
§ недостаточность функций
сердечнососудистой и дыхательной систем
§ тяжёлые заболевания внутренних
органов
Хирургическому удалению опухоли часто
сопутствует широкое удаление корневых, трахеобронхиальных лимфоузлов, клетчатки
и лимфоузлов средостения, резекция грудной стенки, перикарда, диафрагмы,
бифуркации трахеи, предсердия, магистральных сосудов (аорты, верхней полой
вены), мышечной стенки пищевода и других тканей, проросших
опухолью.Паллиативное лечение рака лёгкого применяется в том случае, когда
возможности противоопухолевого лечения ограничены или исчерпаны. Такое лечение
направлено на улучшение качества жизни неизлечимых больных и включает в себя:
· обезболивание
· психологическую помощь
· детоксикацию
· паллиативное хирургическое
вмешательство (трахеостомия, гастростомия, энтеростомия, нефростомия и т. д.)
Паллиативная помощь при раке лёгкого
применяется для борьбы с одышкой, кашлем, кровохарканьем, болевыми ощущениями.
Проводится лечение присоединяющеся к опухолевому процессу пневмонии и
пневмонита, возникающего при лучевой и химиотерапии.
Методы паллиативного лечения во
многом индивидуальны и зависят от состояния больного.
18.
Периферический рак легкого. Классификация. Клиническая и рентгенологическая
картина. Пути метастазирования. Дифференциальный диагноз. Лечение. Показания и
противопоказания к хирургическому лечению
Периферическая форма рака лёгких долгое время прогрессирует без
клинических симптомов, т.к. легочная ткань не имеет болевых окончаний, и, как
правило, болезнь диагностируют довольно поздно. Первые признаки обнаруживают
при появлении давления опухоли на рядом расположенные структуры и органы или
прорастании их. Наиболее характерными симптомами периферического рака лёгкого
считают одышку и боли в грудной клетке. Выраженность одышки зависит от размера
опухоли, степени сдавления анатомических структур средостения, особенно крупных
вен, бронхов и трахеи. Одышку наблюдают приблизительно у 50% больных, причём
только у 10% из них заболевание бывает ещё в ранних стадиях. Боли в грудной
клетке, беспокоящие 20-50% больных, имеют постоянный или перемежающийся
(периодический) характер, не связаны с актом дыхания, бывают обычно
локализованы на стороне поражения. Чаще они возникают при прорастании плевры и
грудной стенки. Прорастание опухолью бронха сопровождается кашлем и
кровохарканьем, хотя эти симптомы в отличие от центрального рака не считают
ранними. Часто беспокоят признаки общего воздействия опухоли на организм:
слабость, повышение температуры тела, быстрая утомляемость, снижение
трудоспособности и др. В поздних стадиях заболевания, при распространении
патологического процесса на крупный бронх и сужении его просвета, клиническая
картина периферического рака становится похожей на таковую центральной формы
болезни.
Для всех периферических раков наиболее характерна
узловая форма роста опухоли. Независимо от гистологического строения
периферического рака легкого располагаются опухоли наиболее часто во втором
сегменте верхней доли и локализуются в различных отделах: прикорневом, ядерном
и плащевом.
Рентгеновская диагностика периферического рака легкого
нередко сложна вследствие схожести его семиотических признаков с другими
заболеваниями. Проблема заключается не в выявлении образования, а в
интерпретации полученных данных. Типичным является одиночное поражение верхней
доли легкого. Структура чаще гомогенна, но на самом деле некроз возникает
довольно часто. Однако длительное время дренирование бронхом остается
нераспознанным. Время удвоения опухоли зависит от гистологической структуры
опухоли. Так, при плоскоклеточном раке оно составляет в среднем 140 дней.
Верхушечный рак сопровождается синдромом Панкоста. Для него характерно наличие
округлого образования области верхушки легкого, плевральных изменений,
деструкции верхних ребер и соответствующих позвонков. Говорить о раке Панкоста
можно лишь в случае, когда он имеет истинное бронхогенное происхождение.
Нередким осложнением периферического рака легких является распад опухолевого
узла. При псевдокавернозной форме рака наряду с уже перечисленными
семиотическими признаками выявляются дополнительные особенности, помогающие
отличить его от абсцесса. Полость распада может занимать значительную часть
опухолевых масс. При этом полость имеет неровный, фестончатый характер.
Клинически отсутствуют признаки абсцесса легкого.
19. Легочное кровотечение. Причины.
Клиника. Диагностика. Дифференциальный диагноз. Принципы лечения
Под легочным кровотечением понимают излияние
значительного количества крови в просвет бронхов. В клинической практике условно
различают легочное кровотечение и кровохарканье. Отличие легочного кровотечения
от кровохарканья в основном количественное. Кровохарканье - это наличие
прожилок крови в мокроте или слюне, выделение отдельных плевков жидкой или
частично свернувшейся крови. При легочном кровотечении кровь
откашливается в значительном количестве одномоментно, непрерывно или с
перерывами. В зависимости от количества выделенной крови различают кровотечения
малые (до 100 мл), средние (до 500 мл) и большие, или профузные (свыше 500 мл).
Наиболее частой причиной легочных кровотечений
являются острые и хронические гнойные заболевания легких, туберкулез легких,
реже - злокачественные опухали легких, эхинококк, актиномикоз. В течение
длительного времени считалось, что источником легочных кровотечений являются
аррозированные ветви легочной артерии в зоне деструкции легкого. Однако в
последнее время установлено, что кровотечение чаще всего происходит из
расширенных и истонченных участков ветвей бронхиальных артерий.
Клиническая картина легочного
кровотечения состоит из симптомокомплекса общей кровопотери, признаков
наружного кровотечения и проявлений легочносердечной недостаточности,
обусловленной как основным заболеванием, явившимся причиной кровотечения, так и
обструкцией трахеобронхиального дерева излившейся кровью. Часто возникновению
легочного кровотечения предшествуют тяжелая физическая нагрузка, сильный,
упорный кашель, вначале сухой, а после с гнойной или слизистой мокротой, а
затем пенистой алой кровью или обильным откашливанием крови со сгустками.
Больных беспокоит слабость, головокружение, чувство страха, одышка. Некоторые
больные отмечают своеобразное чувство жжения на стороне поражения и могут
указывать из какого легкого отделяется кровь. Почти всегда из анамнеза этих больных
удается выяснить наличие существовавшего легочного заболевания (острые или
хронические гнойные заболевания, туберкулез легких, бронхоэктатическая
болезнь). Однако возможны случаи, когда легочное кровотечение является первым
проявлением основного заболевания.При объективном исследовании обращают на себя
внимание общие проявления кровопотери - бледность кожи, холодный липкий пот,
тахикардия, снижение артериального давления, акроцианоз, выраженность которых
зависит от степени потери крови.
При I степени легочного кровотечения
(кровопотеря до 300 мл крови) гемодинамические нарушения отсутствуют или слабо
выражены.
При II степени (кровопотеря до 700
мл) отмечается общая слабость, бледность кожи, одышка до 2025 дыханий в минуту.
Пульс учащается до 100120 уд/мин, систолическое артериальное давление снижается
до 9080 мм рт. ст., уровень гемоглобина снижается до 6080 г/л, а гемотокрита -
до 0,25 л/л.
При III степени (кровопотеря более
700 мл) - выражены бледность кожных покровов, одышка, частота дыханий до 3040 в
минуту, частота сердечных сокращений - 140 уд/мин и более, систолическое
артериальное давление 4050 мм рт. ст. и ниже, гемоглобин снижается до 50 г/л и
ниже, гемотокрит - ниже 0,25 л/л.
При аускультации легких на стороне
поражения выслушиваются разнокалиберные влажные хрипы. В ближайшие сутки у
больных присоединяются явления нижнедолевой аспирационной пневмонии, нередко
двухсторонней. Диагностика. Наиболее информативными методами диагностики
являются рентгенологические методы исследования - ренгеноскопия,
рентгенография, при необходимости - линейная или компьютерная томография. Для
уточнения источника кровотечения в отдельных случаях используют бронхоскопию,
бронхографию, ангиопульмонографию или селективную ангиографию бронхиальных
артерий . Оказание помощи больным должно осуществляться только в условиях
специализированных отделений торакальной хирургии, где имеется значительно
большие возможности использования современных методов диагностики,
консервативного и хирургического лечения этого крайне тяжелого осложнения.
В комплекс лечения больных должны
быть включены, прежде всего, мероприятия по остановке кровотечения, обеспечению
проходимости дыхательных путей, подавлению кашля, снижению давления в малом
круге кровообращения, лечению анемии, антибактериальной профилактики
аспирационной пневмонии. Может оказаться вполне достаточным создание
физического и психического покоя больному - строгий постельный режим.
Назначается заместительная терапия кровопотери. При продолжающемся легочном
кровотечении применяют длительную (23 суток), управляемую гипотензию
инфузионнокапельным введением Пентамина при снижении артериального давления до
безопасного уровня, обеспечивающего перфузию жизненно важных органов. Для
подавления кашля назначаются наркотические анальгетики, а кровь из трахеи и
бронхов аспирируют с помощью электроотсоса. Большое значение в санации
бронхиального дерева имеет фибробронхоскопия, иногда при этом используют
средства местного воздействия на источник кровотечения. В ряде случаев
возникает необходимость выполнения временной эндобронхиальной окклюзии бронха
пораженного отдела легкого. При кровотечениях из бронхиальных артерий в
последние годы успешно применяют эндоваскулярную эмболизацию бронхиальных
артерий. Показанием к выполнению радикального оперативного вмешательства при
продолжающемся легочном кровотечении является неэффективность комплексной
консервативной терапии. Операцией выбора в этих случаях является резекция
пораженной части легкого с удалением источника кровотечения. Противопоказанием
к хирургическому вмешательству является декомпенсация функции жизненно важных
органов и систем организма. Реже выполняются плановые оперативные вмешательства
при легочных кровотечениях 1 степени.
Основной операцией при легочном
кровотечении является резекция легкого с удалением его пораженной части и
источника кровотечения. Значительно реже, главным образом в случаях
кровотечения у больных легочным туберкулезом, могут быть использованы
коллапсохирургические вмешательства (торакопластика, экстраплевральная пломбировка),
а также хирургическая окклюзия бронха, перевязка бронхиальных артерий. После
профузного кровотечения иногда может возникнуть необходимость в частичном
замещении потерянной крови. С этой целью используют эритроцитную массу и
свежезамороженную плазму. Во время и после операции по поводу легочного
кровотечения необходима бронхоскопия для санации бронхов, так как оставшаяся в
них жидкая и свернувшаяся кровь способствует развитию аспирационной пневмонии.
После остановки легочного кровотечения для профилактики аспирационной пневмонии
и обострения туберкулеза необходимо назначать антибиотики широкого спектра
действия, а больным туберкулезом - и противотуберкулезные препараты.
20. Аневризмы брюшной аорты.
Классификация. Клиника. Диагностика. Дифференциальный диагноз. Расслаивающая
аневризма и ее клиника. Лечение.
Аневризма брюшной аорты - это
хроническое дегенеративное заболевание с угрожающими жизни осложнениями. Под
аневризмой брюшной аорты понимают увеличение диаметра аорты более чем в два
раза в сравнении с нормой или локальное выбухание её стенки.
Классификация аневризм брюшной аорты
строится с учетом этиологии, морфологии, локализации и клинического течения
заболевания. Аневризмы подразделяются по этиологии следующим образом.
Приобретенные:
· невоспалительные
(атеросклеротические, травматические);
· воспалительные (сифилитические, при
аортоартериите)
Врожденные.
По морфологии аневризмы делятся на
истинные, ложные и расслаивающие, а по форме - на мешковидные и диффузные.
Кроме того, А. В. Покровский предлагает
различать:тип - аневризму проксимального сегмента брюшной аорты с вовлечением
висцеральных ветвей; тип - аневризму инфраренального сегмента без вовлечения
бифуркации; тип - аневризму инфраренального сегмента с вовлечением бифуркации
аорты и подвздошных артерий; тип - тотальное поражение брюшной аорты.
У больных с этой формой аневризмы основным симптомом
являются тупые, ноющие боли в животе. Боли могут быть постоянными или
периодическими, они локализуются преимущественно в области пупка или в левой
половине живота. У ряда больных отмечается иррадиация болей в поясничную, реже
в паховую область. Боли в животе обычно связаны с увеличением размера аневризмы
и ее давлением на нервные корешки спинного мозга и сплетения в забрюшинном
пространстве. Некоторые больные ощущают усиленную пульсацию в животе, иногда
тяжесть или распирание, у других вследствие сдавления аневризмой
двенадцатиперстной кишки могут наблюдаться тошнота, рвота, отрыжка, вздутие
живота. При осмотре худых больных в положении лежа можно увидеть усиленную
пульсацию аневризмы через брюшную стенку, но основные симптомы заболевания
выявляются при пальпации и аускультации живота. При пальпации в верхней
половине живота, чаще слева, определяется пульсирующее опухолевидное
образование. Аневризма обычно плотноэластической консистенции, плохо смещается
в сторону, мало или совсем безболезненна и отчетливо пульсирует под пальцами.
Пульсация передается во все стороны. Если при пальпации верхний полюс аневризмы
удается отграничить от реберной дуги, то аневризма скорее всего расположена
ниже почечных артерий. Только небольшие аневризмы не удается пальпировать,
особенно у тучных больных.
Диагностические исследования
включают:
· Ультразвуковое
исследование(допплерография)
· Ангиография (рентгенография с применением
контрастного вещества)
· Магнитнорезонансная томография (МРТ)
· Компьютерная томография (КТ)
Расслаивающая аневризма только брюшной аорты
наблюдается крайне редко. Чаще расслоение брюшной аорты служит продолжением
расслоения грудной аорты. Возникновению расслаивающей аневризмы способствует
артериальная гипертензия. На первом этапе отмечаются внезапные сильнейшие боли
в животе и пояснице, сопровождающиеся тошнотой и рвотой, и развивается коллапс.
Живот вначале мягкий, без признаков раздражения брюшины, в дальнейшем
появляются вздутие живота и его болезненность. Этот период длится от нескольких
минут до нескольких часов. Основным симптомом расслаивающей аневризмы брюшной
аорты является пульсирующее образование в брюшной полости, над которым можно
прослушать систолический шум. Однако расслаивающая аневризма может быть
небольшой и тогда ее не удается пальпировать. Обычными методами исследования
трудно установить диагноз расслаивающей аневризмы брюшной аорты. Диагностика
возможна при использовании ультразвукового сканирования и аортографии. При
расслаивающей аневризме грудной аорты установить диагноз проще, так как это
заболевание можно заподозрить при обычном рентгенологическом исследовании
грудной клетки. Второй этап наступает в момент разрыва наружной стенки
аневризмы с массивным кровотечением и обычно ведет к быстрой смерти больного.
Расслоение бывает острым или хроническим в зависимости от времени, которое
проходит между первым и вторым этапом. Хроническое течение, по данным ряда
авторов, наблюдается у 10 - 20% больных. На этом этапе больные отмечают
усиление болей в животе, поясничной и паховой областях, быстро развиваются
симптомы внутреннего кровотечения с коллапсом. Иногда больные отмечают
нарастающую слабость, одышку, удушье. У большинства из них имеется напряжение
передней брюшной стенки и резкая болезненность при пальпации. В брюшной полости
определяется болезненное пульсирующее образование, которое или появилось, или
увеличилось. При хроническом течении расслаивающей аневризмы имеются
признаки обычной аневризмы: анамнез, ультразвуковое и аортографическое
исследование помогают уточнить характер аневризмы.
Показания к хирургическому лечению вытекают из
неблагоприятного прогноза аневризмы брюшной аорты. Следовательно, при выявлении
аневризмы брюшной аорты необходимо направить больного в специализированное
сосудистое отделение для хирургического лечения.
Существует несколько методик лечения
аневризм аорты. Очень важно знать преимущества и недостатки каждой из этих
методик. Существуют следующие подходы к лечению аневризм брюшного отдела аорты:
Наблюдение за пациентом в динамике
При размере аневризмы менее 4.5 см в
диаметре риск хирургического вмешательства превышает риск разрыва. Таким
пациентам должны проводится повторные ультразвуковые исследования и/или
компьютерная томография не реже 1 раза в 6 месяцев. При диаметре аневризмы
более 5 см хирургическое вмешательство становится предпочтительным, так как с
увеличением размеров аневризмы повышается риск разрыва аневризмы.
Открытое хирургическое вмешательство
Хирургическое лечение направлено на
профилактику жизнеугрожающих осложнений. Риск хирургического вмешательства
связан с возможными осложнениями, которые включают инфаркт, инсульт, потерю
конечности, острую ишемию кишечника, сексуальную дисфункцию у мужчин,
эмболизацию, инфекцию протеза, почечную недостаточность. Средний показатель
смертности при открытых вмешательствах составляет от 35 %, однако может быть
выше при вовлечении в аневризму почечных и/или подвздошных артерий, а также в
силу имеющейся у пациента сопутствующей патологии. Наблюдение в
послеоперационном периоде осуществляется один раз в год. Отдаленные результаты
лечения хорошие.
Эндопротезирование аорты является
современной альтернативой открытому вмешательству. Операция выполняется через
небольшие разрезы/проколы в паховых областях. Эта методика позволяет снизить
частоту ранних осложнений, сократить сроки пребывания пациентов в стационаре и
уменьшить показатель смертности до 12%. Наблюдение в послеоперационном периоде
осуществляется каждые 46 месяцев с использованием ультразвуковых методик,
КТангиографии, рентгенконтратной ангиографии. Эндоваскулярный метод лечения,
безусловно, менее травматичный. Ежегодно только в США проводится около 40 000
подобных операций.
Таким образом, выбор методики лечения аневризмы
брюшного аорты основывается на индивидуальных особенностях пациента.
21. Артериальные тромбозы и эмболии.
Понятие, отличие. Этиология. Клиника. Степени ишемии конечностей. Диагностика.
Консервативные и оперативные методы лечения
Тромбоз - это сложный и многогранный процесс
формирования сгустка крови в какомлибо участке сосудистого русла или полости
сердца. С современной точки зрения тромбообразование представляет собой
взаимодействие комплекса факторов. Среди них основное место принадлежит изменению
физикохимических свойств, скорости движения и функционального состояния
форменных элементов крови (прежде всего тромбоцитов), а также нарушению
целостности и электростатической разности потенциалов сосудистой стенки и
составных элементов крови.
Артериальная эмболия - патологическое состояние, при
котором просвет сосуда закупорен какимлибо телом (эмболом), что приводит к
нарушению (прекращению) кровотока. Причиной эмболии наиболее часто является
сгусток крови, оторвавшийся от первоначального тромба н мигрирующий по
сосудистому руслу. Термин „эмболия" был введен Биржевом (1854),
провозгласившим так называемую триаду спонтанного тромбообразования: нарушение
свертываемости крови, замедление кровотока, повреждение стенки сосуда.
Таким образом, причиной острой артериальной
непроходимости артерий могут явиться тромбоз или эмболия. Закупорка артерии
приводит к внезапному прекращению кровотока в определенном сосудистом бассейне,
развитию острого ишемического синдрома с различной клинической картиной в
зависимости от локализации окклюзии, степени закупорки (полная, неполная), ее
протяженности, а также состояния коллатерального кровообращения. Основное
отличие эмболии и острого тромбоза артериального русла заключается в том. что
последний формируется, как правило, в зоне с патологически измененной
вследствие какихлибо причин сосудистой стенкой. В связи с этим клиническая
картина тромбоза артерии, пораженной, например, атеросклерозом, не всегда
характеризуется острой артериальной недостаточностью и декомпенсацией кровообращения,
так как к моменту полной окклюзии сосуда у больного успевает развиться
коллатеральное кровообращение. Эмболия же, напротив, возникает внезапно,
поражая нормальный, неизмененный сосуд. Вследствие этого клиническая картина
при эмболии ярко выражена и обусловлена более тяжелыми расстройствами
кровообращения.
Острый артериальный тромбоз представляет собой локальное
проявление общего заболевания сосудистого русла. Важное значение имеет
рассмотрение тех основных заболеваний, которые могут осложняться периферическим
тромбообразованнем. К числу их относятся: 1) атеросклероз; артерииты, в том
числе облитерирующий эндартериит: 2) острые послеоперационные тромбозы после
сосудистых операций (перевязка артерии, боковой и циркулярный сосудистый швы,
пластика артерий) и после диагностических или лечебных манипуляций на артериях
(пункция, катетеризация, виутриартериальные трансфузии крови); 3)
травматические повреждения (разрывы и надрывы артерий, кровоизлияния в стенку
сосуда, пульсирующая гематома, ложная аневризма); 4) компрессия артерий извне
гематомой, опухолью, фрагментом кости и др.;
) гематологические заболевания -
полицитемия, тромбоцитопеническая пурпура и др.;
) инфекционные заболевания - сыпной
тиф. брюшной тиф и др.
В патогенезе внутрисосудистого тромбообразования
ведущая роль принадлежит трем основным факторам: сужению просвета сосуда с
нарушением ее гладкой и несмачиваемой внутренней поверхности вследствие
артериита или атеросклероза, повышению тромбопластической активности пораженной
артериальной стенки и нарушению функционального состояния системы
гемокоагуляции. Не меньшую роль играет функциональный фактор - спазм сосуда.
Немаловажное значение в процессе внутрисосудистого
тромбообразования наряду с морфологическими изменениями имеют нарушения биохимических
свойств сосудистой стенки. В настоящее время последняя рассматривается не
только как механический фактор, обеспечивающий постоянство движения крови, но и
как орган, в котором происходят сложные биохимические процессы, связанные, в
частности, с тромбообразованнем.
Этиология артериальной эмболии зависит от характера патологических
процессов, лежащих в основе внутрисердечного и внутрисосудистого свертывания
крови. Тромбообразование с последующей эмболизацией периферических артерий
может наблюдаться при различных заболеваниях: ревматизме, атеросклерозе,
инфаркте миокарда, эндокардите и др. Непосредственным источником эмболии
бифуркации аорты, ее ветвей и артерий конечностей служит пристеночный тромбоз
левых камер сердца, аорты и крупных артерий. Наиболее часто причиной
артериальной эмболии служат заболевания сердца, среди которых, бесспорно,
первое место занимают ревматические пороки, преимущественно митральный стеноз,
осложненный виутрипредсердным тромбозом. Артериальные эмболии возникают
практически у каждого шестого - седьмого больного с митральным стенозом. Видное
место среди других эмбологениых заболеваний сердца занимают инфаркт миокарда и
постинфарктная аневризма левого желудочка. Первый осложняется эмболией примерно
в 15-20% случаев. Частота же артериальных эмболии при аневризме сердца
достигает угрожающей величины (30-50% н более).
Нередкой причиной артериальных
эмболии является атеросклероз в форме атеросклеротического кардиосклероза и
язвенного атероматоза аорты. Наиболее часто подобные изменения локализуются в
грудном и брюшном отделах аорты. Примерно в 4% случаев эмболии вызываются
аневризмами аорты и крупных магистральных артерий.
Источником эмболии легочной артерии чаще всего являются различные
флеботромбозы и в первую очередь тромбозы вен таза и нижних конечностей.
С тем, чтобы правильнее решать вопросы тактики
лечения, о сроке и объеме была разработана классификация ишемии тканей
конечности (В.С.Савельев).
В классификации выделяется три степени ишемии (каждая
из которых в свою очередь делится на подгруппы), а также "ишемия
напряжения". Признаки ишемии отсутствуют в покое и появляются при
нагрузке.
При ишемии I степени отсутствуют нарушения
чувствительности и движений в пораженной конечности. И1А степени
характеризуется наличием чувства онемения, похолодания, парестезиями. При И1Б
степени появляются боли в дистальных отделах конечности.
Для ишемии II степени характерны расстройства
чувствительности, а также активных движений в суставах от пареза (II А степень)
до паралича (II Б степень).
Ишемия III степени характеризуется начинающимися
некробиотическими явлениями, что выражается клинически в появлении
субфасциального отека (III Б степень) или тотальной (III В степень). Гангрена
представляет собой конечный результат ишемии.
Диагностика: тщательно собранный
анамнез часто дает возможность поставить правильный предварительный диагноз.
Наибольшую информацию о характере и протяженности патологического процесса,
состоянии коллатералей при тромбозах и эмболиях дает ангиография. При полной
обтурации артерии эмболом на ангиограммах определяется четкий обрыв тени сосуда
и хорошо видна верхняя граница эмбола. При неполной, закупорке артерии эмбол
прослеживается в виде овального или округлого образования, обтекаемого
контрастным веществом. Если стенка артерии не изменена, контуры ее ровные,
гладкие; у больных с атеросклеротическим поражением артерий они изъеденные,
неровные.
Лечение: эмболии брюшной аорты и
магистральных артерий верхних и нижних конечностей являются абсолютным
показанием к хирургическому лечению. Это обусловлено тем, что консервативная
терапия не способна привести к полному лизису эмбола, который часто
представляет собой тромб с явлениями организации. Консервативное лечение может
быть назначено лишь больным, находящимся в крайне тяжелом состоянии при
достаточной компенсации кровообращения в пораженной конечности. Острые тромбозы
крупных магистральных артерий с декомпенсацией кровообращения в пораженной
конечности подлежат хирургическому лечению и последующей консервативной
терапии. Чем раньше от начала заболевания выполнена операция, тем лучше ее
результаты. Медикаментозная терапия нередко дает положительные результаты у
больных с артериальными тромбозами (исключая травматические) при компенсации
кровообращения в конечности. Она достаточно эффективна и у больных с острой
непроходимостью артерий предплечья и голени. Консервативное лечение должно быть
направлено на устранение факторов, способствующих прогрессированию ишемии. В
комплекс лечебных мероприятий следует включать препараты, обладающие тромболитическим,
антикоагулянтным, дезагрегационным и спазмолитическим действием. Одновременно
должны быть назначены лекарственные средства, улучшающие микроциркуляцию и
центральную гемодинамику, а также устраняющие метаболические нарушения. Среди
тромболитических препаратов наиболее широкое распространение получил
фибринолизин, представляющий собой профибринолизин плазмы крови ,активированный
трипсином. Препарат растворяют в изотоническом растворе хлорида натрия и вводят
внутривенно капельно. Суточная доза его составляет 40 000 60 000 ЕД. Наибольший
эффект достигается при введении фибринолизина 2 раза в сутки с 12часовым
интервалом. Одновременно назначают и гепарин, который добавляют к раствору из
расчета 10000 ЕД на каждые 20000 ЕД фибринолизина. Гепарин вводят в перерывах
между инфузиями фибринолизина. Лечение проводят под контролем показателей
коагулограммы, а при невозможности ее выполнения ориентируются на значение
времени свертывания крови, которое должно быть длиннее исходного уровня в 221/2
раза. Через 35 сут в случае достижения клинического эффекта сочетанное
применение фибринолизина и гепарина заканчивают, продолжая использование
гепарина, а затем антикоагулянтов непрямого действия. Эффективность
фибринолизина недостаточно высока, так как он быстро нейтрализуется
антиплазмином, содержащимся в плазме крови. Гораздо эффективнее применение
препаратов, непосредственно активирующих профибринолизин (плазминоген),
стрептокиназы и урокиназы. Стрептокиназа продукт жизнедеятельности
бетагемолитического стрептококкаявляется непрямым активатором плазминогена. Ее
вводят внутривенно капельно в дозе от 800 000 до 1 750 000 ЕД/сут, иногда на
протяжении нескольких дней до получения клинического эффекта. Урокиназа прямой
активатор плазминогена, выделенный из мочи, обладает высокой тромболитической
активностью. Вводят внутривенно капельно, разовая доза от 400 000 до 800 000
ЕД. Эффективность препарата увеличивается при одновременном применении
небольших доз гепарина. Выраженное тромболитическое и антикоагулянтное действие
оказывает тромболитин, являющийся соединением трипсина с гепарином. Назначают
его по 100 мг через каждые 8 ч внутривенно или внутримышечно в течение
нескольких дней до получения клинического эффекта. Одним из наиболее
эффективных антикоагулянтов прямого действия, используемых для лечения больных
с острой артериальной непроходимостью, является гепарин. Он препятствует
образованию тромбина, блокируя тем самым процесс свертывания крови.
Антикоагулянтный эффект гепарина наступает сразу же после внутривенного и через
1015 мин после внутримышечного введения и продолжается в течение 45 ч. Суточная
доза гепарина составляет 30 00050 000 ЕД. Гепаринотерапия считается
эффективной, если время свертывания крови превышает исходный уровень в 22'/з
раза. При передозировке гепарина может возникнуть геморрагический синдром,
который устраняют путем введения 1% раствора протамина сульфата, 1 мг которого
нейтрализует эффект 100 ЕД гепарина. Лечение гепарином продолжают в течение 7
10 дней и за 2 сут до отмены назначают антикоагулянты непрямого действия. При
этом суточную дозу гепарина постепенно снижают в Г/22 раза за счет уменьшения
его разовой дозы. Антикоагулянты непрямого действия (неодикумарин, пелентан,
синкумар, фенилин и др.) подавляют биологический синтез протромбина в
ретикулоэндотелиальной системе печени. Действие их начинается через 1848 ч от
начала применения и сохраняется в течение 23 дней после отмены препарата.
Критерием эффективности проводимой терапии служит величина протромбинового
индекса. Оптимальной дозой препарата Следует считать такую, когорая снижает
протромбиновый индекс до 4550%. Повышение у больных с острой артериальной
непроходимостью адгезивноагрегационной функции тромбоцитов делает необходимым
назначение препаратов, обладающих дезагрегационным действием, в частности
трентала и курантила. Указанные средства наибольший эффект оказывают при
внутривенном введении. Целесообразно также использование низкомолекулярного
декстрана реополиглюкина, улучшающего микроциркуляцию, обладающего
дезагрегационными свойствами и усиливающего фибринолиз. Спазмолитические
средства (ношпа, папаверин, галидор) предпочтительнее вводить внутривенно.
Метаболический ацидоз, который нередко развивается у больных, требует контроля
за показателями кислотнощелочного состояния и их своевременной коррекции с
введением 4% раствора бикарбоната натрия. Для улучшения метаболических
процессов в тканях целесообразно назначение витаминов, компламина, солкосерила.
При соответствующих показаниях должны быть назначены сердечные гликозиды и антиаритмические
препараты.
Хирургическое лечение больных с
острой артериальной непроходимостью заключается в удалении тромба или эмбола из
просвета артерии с помощью катетера Фогарти. Последний представляет собой
гибкий эластический проводник диаметром 22,5 мм с нанесенными делениями. На
одном конце его имеется павильон для присоединения шприца, на другом резиновый
баллончик с тонким направителем. При поражении артерий нижних конечностей
обнажают бифуркацию бедренной артерии, а при обтурации артерий верхних конечностей
бифуркацию плечевой артерии. Выполняют поперечную артериотомию и катетер
продвигают к месту закупорки сосуда, проводя его через тромботические массы.
Затем с помощью шприца вводят жидкость, раздувают баллончик, и катетер удаляют.
Раздутый баллончик увлекает за собой тромботические массы и при восстановлении
проходимости артерии из артериотомического отверстия появляется струя крови. На
разрез в артерии накладывают сосудистый шов. С помощью баллонного катетера
тромботические массы могут быть удалены не только из периферических артерий, но
и из бифуркации аорты. При тяжелой ишемии, сопровождающейся отеком мышц. (ІІІ a
степень) или мышечной контрактурой (ІІІ б степень), с целью декомпрессии и
улучшения тканевого кровотока показана дополнительная фасциотомия. Если тромбоз
или эмболия возникли на фоне органического поражения артериального русла,
выполняют различные виды реконструктивных операций.
При гангрене нижней конечности
показана первичная высокая ампутация, чаще в средней трети бедра. При начинающейся
гангрене верхней конечности не следует спешить с ампутацией, так как
интоксикация у таких больных, как правило, не выражена, уровень развития
коллатералей лучше и в ряде случаев удается ограничиться некрэктомией.
22. Облитерирующий атеросклероз периферических
артерий. Клиническая картина по стадиям. Диагностика. Дифференциальный диагноз.
Течение. Консервативное лечение. Показание к оперативному лечению. Виды
операций. Показания к ампутациям. Синдром Лериша
Облитерирующий атеросклероз артерий
нижних конечностей
(или ишемическая болезнь нижних конечностей) представляет собой важную
клиническую форму атеросклероза (третью по частоте после ИБС и ишемической
болезни мозга) и является ведущей причиной окклюзии артерий нижних конечностей
у лиц старше 40 лет. Облитерирующий атеросклероз артерий нижних конечностей
развивается главным образом у мужчин. В патогенезе атеросклероза сосудов нижних
конечностей особое значение придают гипертриглицеридемии, хотя у таких больных
нередко наблюдается сочетание ее с гиперхолестеринемией. Неизвестно, почему при
атеросклерозе наблюдаются тяжелые сосудистые поражения нижних конечностей, в то
время как верхние конечности страдают в значительно меньшей степени.
Практически все пациенты с перемежающейся хромотой на фоне атеросклероза
являются курильщиками.
Основным симптомом этого заболевания
являются боли в мышцах нижних конечностей (мышцы бедер и икроножные
мышцы) при ходьбе. Это связано с повышенной потребностью мышц нижних
конечностей при физической нагрузке в артериальной крови, которая доставляет к
тканям кислород. При ходьбе обычным шагом или беге суженные артерии не могут
удовлетворить потребность тканей в артериальной крови. Это приводит к
кислородному «голоданию» и вызывает интенсивные боли в мышцах. На начальных
стадиях заболевания при прекращении физической нагрузки боли быстро проходят.
Таким образом, получается, что пациент проходит определенную дистанцию обычным
шагом. При этом постепенно появляются и нарастают боли в ногах. После
остановки, в течение нескольких минут, боли проходят. В медицине этот феномен
называется болями по типу перемежающейся хромоты - это основной
клинический симптом облитерирующего атеросклероза артерий нижних конечностей.
Если боли возникают в мышцах бедер - боли по типу высокой перемежающейся
хромоты, если в икроножных мышцах - боли по типу низкой перемежающейся
хромоты.
Следует отличать эти боли от болей
при очень распространенных в пожилом возрасте заболеванияхсуставов нижних
конечностей (артрозах). Для артрозов нижних конечностей также характерны
боли при физической нагрузке. Однако боли при артрозах локализуются, в
основном, не в мышцах, а в суставах и при этом носят «стартовый» характер. То
есть наибольшая интенсивность болей в начале движения. Затем больной
«расхаживается» и боли немного ослабевают.
Нельзя не сказать и о таком
заболевании как облитерирующий атеросклероз артерий верхних конечностей,
который встречается значительно реже облитерирующего атеросклероза артерий
нижних конечностей. Механизм развития этого заболевания также заключается в
формировании атеросклеротических бляшек, но только в артериях верхних
конечностей, а основным симптомом являются боли при физических нагрузках на
руки, которые также быстро купируются при прекращении физического воздействия.
Стадии облитерирующего атеросклероза
Исходя из дистанции безболевой
ходьбы, выделяют 4 стадии облитерирующего атеросклероза артерий нижних
конечностей.
1 стадия. Боли появляются при тяжелой
физической нагрузке. Дистанция безболевой ходьбы более 1000 м.
2а стадия. Дистанция безболевой ходьбы 2501000
м.
2б стадия. Дистанция безболевой ходьбы 50250 м.
3 стадия (критическая ишемия). Дистанция
безболевой ходьбы менее 50 м. На этой стадии появляются боли в мышцах нижних
конечностей в покое, преимущественно по ночам. Больные, как правило, опускают
ногу с кровати для улучшения кровонаполнения тканей. Часто это действительно
приводит к ослаблению болей.
4 стадия. На этой стадии появляются трофические
расстройства. Как правило, участки почернения кожи (некрозы) появляются на
пальцах или пяточных областях. В дальнейшем это может привести к гангрене.
Диагностика заболевания вызывает
затруднения только в начальных стадиях, когда не удается распознать характерных
болей по типу перемежающейся хромоты. При подозрении на данное заболевание врач
обязан определить интенсивность пульсации на артериях нижних конечностей. Для
облитерирующего атеросклероза артерий нижних конечностей характерно ослабление
или отсутствие пульсации артерий ниже места расположения атеросклеротической
бляшки, вызывающей стеноз, который изменяет гемодинамику. При выявлении
дефицита пульсации на артериях нижних конечностей врач должен обследовать и
другие артерии, в частности аорту, артерии верхних конечностей, сонные артерии,
так как атеросклероз является системным заболеванием, и при продолжении
обследования высока вероятность выявления дефицита пульсации или систолических
шумов при аускультации других отделов сердечнососудистой системы.
Следует отметить, что заболевание часто носит
несимметричный характер, то есть на одной конечности изменения более выражены,
чем на другой. Однако также на начальных стадиях заболевания возможно
сохранение четкой пульсации артерий нижних конечностей на всех уровнях. Тогда
расставить все точки над «и» поможет только ультразвуковая допплерография (УЗДГ)
или дуплексное сканирование (ДС) артерий нижних конечностей.
Синдром Лериша - совокупность клинических проявлений,
обусловленных хронической окклюзией в области бифуркации брюшной части аорты и
подвздошных артерий. Наиболее часто встречается у мужчин в возрасте 40-60 лет.
При синдроме Лериша, обусловленном
атеросклерозом, максимальные изменения наблюдаются в области бифуркации аорты и
в месте отхождения внутренней подвздошной артерии. Часто имеется выраженный
кальциноз стенки аорты и артерии, во многих случаях - пристеночный тромбоз
Первым симптомом синдрома Лериша
обычно являются боли, которые возникают в икроножных мышцах при ходьбе. При
средних и высоких окклюзиях аорты боли локализуются в ягодичных мышцах, в
пояснице и по заднелатеральной поверхности бедер (высокая перемежающаяся
хромота). Кроме того, больные отмечают похолодание, онемение нижних
конечностей, выпадение на них волос и медленный рост ногтей. Иногда наблюдается
и атрофия нижних конечностей. У 20-50% больных мужчин наступает импотенция.
Течение прогрессирующее. У больных до 50 лет синдром Лериша развивается более
быстрыми темпами, чем у больных старше 60 лет.
Диагноз синдрома Лериша в большинстве
случаев устанавливают на основании осмотра, пальпации и аускультации, а также
результатов инструментальных методов исследования. Отмечаются изменение окраски
кожи нижних конечностей, гипотрофия мышц, снижение кожной температуры. При IV
степени ишемии появляются язвы и очаги некроза в области пальцев и стоп. При
пальпации отсутствует пульсация бедренной артерии. В случаях окклюзии брюшной
части аорты не определяется ее пульсация на уровне пупка. При аускультации
выслушивается систолический шум над бедренной артерией в паховом сгибе, по ходу
подвздошной артерии с одной или с обеих сторон и над брюшной частью аорты.
Отсутствие пульсации артерий конечности и систолический шум над сосудами
являются основными признаками синдрома Лериша на нижних конечностях АД
аускультативно не определяется
Ультразвуковая допплерография
позволяет оценить характер кровотока по бедренным и подколенным артериям.
Важным показателем является лодыжечный индекс (отношение АД на стопе к АД на
лучевой артерии), который в норме равен 1,1-1,2. При индексе менее 0,8
появляются признаки перемежающейся хромоты, а менее 0,3 - язвеннонекротические
изменения.
Топическую картину поражения можно установить с
помощью ангиографии радионуклидной, дигитальной субтракционной и
рентгеноконтрастной ангиографии. Из методов рентгеноконтрастного исследования
предпочтение отдают транслюмбальной пункционной аортографии, при которой можно
получить изображение не только аорты, но и дистального сосудистого русла
конечностей. С помощью аортографии выявляют локализацию и протяженность
поражения.
Лечение больных с облитерирующим
атеросклерозом артерий нижних конечностей заключатеся в следующем:
Коррекция артериальной гипертензии,
дислипидемии, гипергликемии у больных сахарным диабетом и пр. Следует
подчеркнуть безусловную необходимость прекращения курения.
У больных с ишемией нижних
конечностей нежелательно применять бетаадреноблокаторы, так как они ухудшают
периферическое кровоснабжение.
При наличии у больных с
перемежающейся хромотой АГ артериальное давление надо снижать постепенно (чтобы
не вызвать ухудшения перфузии нижних конечностей) и стараться поддерживать его
на уровне, который не вызывает нарастания ишемии, т. е. появления болей и
понижения толерантности к физической нагрузке.
Первостепенное значение придается
физической активности. Больные с перемежающейся хромотой должны ежедневно
ходить в продолжение 30-45 мин - это способствует развитию коллатералей,
приводит к нарастанию мышечной силы и увеличению пройденного без боли
расстояния. При появлении боли и сжатия в мышцах ноги пациент долхсен
остановиться, а после исчезновения этих ощущений - продолжить ходьбу. Нередко
езда на велосипеде или плавание переносятся значительно лучше, чем ходьба
(однако не заменяют ее).
Улучшение микроциркуляции и
гемореологии. С этой целью назначают пентоксифиллин по 300 мг 3 раза в день и
аспирин по 0,1 г/сут на длительное время.
Реваскуляризация нижних конечностей
может осуществляться с помощью эндоваскулярных методов (баллонная ангиопластика
со стентированием сосудов, эндартерэктомия, лазерная ангиопластика) и
хирургическим путем - аортобедренное, бедренноподколенное и другие виды
шунтирования. Вопрос о реваскуляризации встает, когда перемежающаяся хромота
нарастает и препятствует повседневной физической активности и/или выполнению
работы. Выбор того или иного метода реваскуляризации проводится специалистом по
эндоваскулярным методам лечения совместно с сосудистым хирургом.
Эндоваскулярные методы получили достаточно большое распространение и весьма
эффективны. Однако поражение сосуда на большом протяжении обычно требует
шунтирования. При наличии болей в покое, трофических язв, сахарном диабете,
когда велик риск потери ноги, также проводится хирургическое лечение.
Поясничная симпатэктомия
Она выполняется как дополнение к
операции шунтирования или для ускорения заживления язв, когда другие виды
вмешательств невозможны.
Прогноз при облитерирующем атеросклерозе артерий
нижних конечностей определяется не только степенью окклюзии сосудов
конечностей, но и наличием других клинических проявлений атеросклероза - ИБС
и/или церебрального атеросклероза. У больных с сахарным диабетом прогноз
значительно хуже.
23.
Облитерирующий эндартериит периферических артерий. Клиническая картина по
стадиям. Диагностика. Дифференциальный диагноз. Лечение. Консервативное
лечение. Показания к оперативному лечению Виды операций. Показания к
ампутациям. Болезнь Бюргера (облитерирующий тромбангиит)
Облитерирующий эндартериит - это
заболевание, поражающее сосуды преимущественно нижних конечностей, приводящее к
прогрессирующему нарушению кровообращения, заканчивающееся нередко гангреной.
Заболевание это поражает в большей степени мужчин среднего и молодого возраста.
Основным специфическим симптомом, позволяющим заподозрить и выявить
облитерирующий эндартериит, является перемежающаяся хромота: сильная боль в
икроножных мышцах, вынуждающая больного замедлять шаг и останавливаться через
определённые промежутки пути. После небольшого отдыха боль исчезает и больной
двигается дальше. Появление этого симптома связано с недостаточным поступлением
кислорода и питательных веществ к мышцам ног, вследствие поражения сосудов.
Выделяют 5 фаз заболевания,
последовательно сменяющие одна другую:
· Пациент способен пройти 1 и более км
до появления боли в ногах;
· Боль возникает при движении на
расстояние около 200м;
· Боль возникает при ходьбе на
расстояние 25 м, появляются боли в покое.
· Наряду с болью появляются
язвеннонекротические изменения на кожных покровах конечности.
· Гангрена.
Помимо перемежающейся хромоты больные
жалуются на тяжесть в ногах, быструю утомляемость, ощущение ползания мурашек,
потливость. Внешне заболевание проявляется бледностью и похолоданием
поражённого участка конечности, на начальных этапах, и появлением незаживающих
трофических язв в запущенных случаях. Ослабляется или вовсе пропадает пульсация
на магистральных артериях нижней конечности.
Болезнь иногда прогрессирует
медленно, обострения сменяются ремиссиями, что позволяет больному длительное
время не обращаться к врачу. Но нередко болезнь стремительно развивается,
быстро приводя к необратимым изменениям в сосудах и тканях конечности. Поэтому,
при первых признаках нарушения кровообращения в ногах следует немедленно
обратиться за медицинской помощью.
Реовазография - регистрация пульсовых
колебаний стенок сосудов, позволяет оценить состояние кровотока на поражённом
участке.
Капиллярография - микрофотографирование
капилляров, которое даёт возможность определить состояние микроциркуляторного
русла.
Ультразвуковая допплерография -
исследование скорости кровотока с помощью ультразвуковых импульсов.
Артериальная ангиография - исследование кровеносных
сосудов с использованием рентгенконтрастных веществ.
На ранних стадиях заболевания лечение преимущественно
консервативное. Приём лекарственных препаратов, физиотерапевтические процедуры
призваны снять спазм сосудистой стенки, предотвратить тромбообразование в просвете
сосуда, улучшить микроциркуляцию. Для этой цели применяются несколько групп
препаратов:
· Спазмолитики
· Антиагреганты
· Витамины (В, Е, С, РР)
· Антигистаминные препараты
Из физиотерапевтических процедур хороший
терапевтический эффект на ранних стадиях оказывают диадинамические токи,
диатермия, баротерапия. При позднем выявлении заболевания, а также при
неэффективности медикаментозного лечения прибегают к хирургической операции.
Если поражён небольшой участок артерии (до 15 см), то
его удаляют. Если же патологический процесс затронул участок больше 15 см, то
прибегают к шунтированию или протезированию артерии. Наиболее частой операцией
при облитерирующем эндартериите является аортобедренное шунтирование: от
брюшной части аорты к бедренной артерии в обход поражённого участка вшивается
искусственный сосуд.
Хороший эффект даёт операция симпатэктомии:
пересечение симпатических нервных стволов, приводящее к купированию сосудистого
спазма. При развитии гангрены прибегают к ампутации поражённого сегмента или всей
конечности.
Облитерирующий тромбангиит (болезнь Бюргера) -
системное иммунопатологическое воспалительное заболевание артерий и вен,
преимущественно мелкого и среднего диаметра, с вторичными элементами
аутоиммунной агрессии.
В зависимости от того в каком участке
артериального русла происходит затруднение кровотока, выделяют 3 типа:
§ Дистальный тип (6065% от общего
числа), характеризуется облитерацией артерий малого диаметра (стопа, голень,
кисти, предплечье).
§ Проксимальный тип (1520%), поражение
артерий среднего и крупного диаметра (бедренная, подвздошная, аорта).
§ Смешанный тип (1520%), сочетание двух
первых типов поражения.
Заболевание развивается в основном у
молодых мужчин (редко у женщин) в возрасте до сорока лет, хотя может
встречаться и в более позднем возрасте, а также у подростков. Всегда
наблюдается поражение двух нижних и/или двух верхних конечностей - начиная с
дистальных отделов с распространением проксимально. Весьма характерна триада:
перемежающаяся хромота, синдром Рейно и мигрирующий поверхностный тромбофлебит
в дистальных частях конечностей. Перемежающаяся хромота проявляется болями при
ходьбе в подъеме стопы и нижней части икроножных мышц; в случае поражения
верхних конечностей при работе руками возникают боли в мышцах кисти и предплечья
(«перемежающаяся хромота» верхних конечностей).
Наблюдается повышенная
чувствительность кистей и стоп к холоду, резкое побледнение пальцев стоп и
кистей при охлаждении; пальцы могут быть цианотичными, появляются болезненные
узелки и кровоизлияния на подушечках пальцев. Не все пальцы поражаются в
одинаковой степени, что связано с неравномерностью поражения артериального
русла. Могут быть бледными и холодными не только пальцы, но и стопы и кисти.
При тяжелой ишемии появляются боли в дистальных отделах конечностей в покое,
трофические поражения ногтей, болезненные изъязвления и даже гангрена кончиков
пальцев; возможна самопроизвольная ампутация некротизированных участков.
Тяжелые поражения пальцев могут провоцироваться травмой.
Часто определяется отсутствие пульса
(или значительное снижение пульсации) на артериях ног - a. dorsalis pedis,a.
tibialis posterior и на артериях рук - a. radialis, a. ulnaris, при
этом пульс на плечевых и подколенных артериях нормальный.
У больных нередко наблюдаются
вторичные инфекции кожи и подкожной клетчатки в дистальных отделах конечностей.
Болезнь довольно быстро прогрессирует и характеризуется частыми обострениями,
которые нередко провоцируются воздействием холода или интенсивным курением.
Боли в покое, язвы и гангрена могут появляться в срок от нескольких месяцев до
нескольких лет - считая от первых проявлений заболевания.
Лечение облитерирующего тромбангиита
в первую очередь состоит в отказе от курения. Так же, как и при атеросклерозе
артерий нижних конечностей, рекомендуют дозированную ходьбу с целью развития
коллатералей, прием трентала по 300 мг 3 раза в день, аспирина по 0,1 г/сут.
Имеются сообщения о благоприятном эффекте антагонистов кальция.
Симпатэктомия в ряде случаев
позволяет уменьшить боли и другие проявления вазоспазма. Реваскуляризация
неприменима, так как имеется множественное поражение мелких сосудов. Сообщается
также о положительном действии плазмафереза и гипербарической оксигенации, но
эти методы не являются общепринятыми.
При появлении некрозов проводится ампутация
пораженных пальцев рук (при правильном ведении больных это, к счастью,
требуется не часто); при гангрене пальцев стопы или самой стопы проводится
экономная (низкая) ампутация - обычно по границе некротизированных тканей. У
больных с проявлением вторичной инфекции назначаются антибиотики. Прогноз у
пациентов, прекративших курение и не имеющих частых обострений, достаточно
благоприятный. У больных, продолжающих курить, с частыми обострениями
заболевания - прогноз в отношении сохранения стопы значительно хуже.
24. Ампутация и экзартикуляция. Принципы
ампутации и протезирования верхних и нижних конечностей
Ампутация (лат. amputatio) - усечение
дистально расположенной части органа в результате травмы или хирургической
операции. Наиболее часто термин употребляется в значении «ампутация конечности»
- усечение её на протяжении кости (или нескольких костей) в отличие от
экзартикуляции (вычленения на уровне сустава).
Классификация ампутаций
. По времени выполнения (по П. А.
Куприянову - Н. Н. Бурденко)
· Первичные (в порядке первичной
хирургической обработки)
Ранние
Поздние
· Вторичные (по поводу осложнений)
· Повторные (реампутации)
2. По способу усечения мягких тканей
· Круговые - применяются на тех отделах
конечностей, где кость равномерно окружена мягкими тканями. Различают следующие
виды круговых ампутаций:
- Гильотинные: все мягкие ткани и кость
отсекаются в одной плоскости без оттягивания кожи. Обычно применяются при
анаэробной инфекции, особенно при газовой гангрене, так как при таком способе
культя хорошо аэрируется. Однако при таком способе удаления пораженных тканей
образуется порочная культя, требующая реампутации.
- Одномоментные: кожа и подкожная
жировая клетчатка оттягивается проксимально, затем весь слой мягких тканей
пересекается ампутационным ножом, а кость перепиливается. Единственное
преимущество заключается в быстроте исполнения - такая операция проводится в
том случае, если ослабленный больной не может перенести более сложный способ
ампутации.
- Двухмоментные: сначала рассекается
оттянутая проксимально кожа, подкожная жировая клетчатка и поверхностная фасция
(1й момент), затем по краю кожи рассекаются мышцы (2й момент) и перепиливается
кость.
- Трехмоментная конусокруговая
ампутация бедра по Н. И. Пирогову: вначале рассекается оттянутая проксимально
кожа, подкожная жировая клетчатка и поверхностная фасция (1й момент), затем по
краю кожи рассекаются поверхностные мышцы (2й момент), далее по краю
сократившихся поверхностных мышц рассекаются глубокие мышцы (3й момент), после
чего мягкие ткани сдвигают проксимально ретрактором и перепиливают кость. Два
последних способа ампутации позволяют укрыть опил кости мягкими тканями,
образующими «конус».
· Эллипсовидные
· Лоскутные - обычно производятся на
голени и предплечье.
· Однолоскутные
· Двухлоскутные (с переднезадними и
кособоковыми лоскутами)
3. По отношению к надкостнице
· Субпериостальные - пластический
способ, при котором опил кости покрывается лоскутами надкостницы с удаляемой
части;
· Апериостальные - способ ампутации у
взрослых, при котором на протяжении 4 см остается оголенная кость. При этом
способе надкостницу пересекают скальпелем и сдвигают распатором Фарабефа
дистально на расстояние не менее 0.5 см, а распиливание кости ведут на
расстоянии 23 мм дистальнее от ровного проксимального края надкостницы;
· Периостальные - надкостницу рассекают
дистальнее уровня распила кости и оттягивают проксимально, чтобы далее укрыть
ею опил кости. Метод применим только в детской хирургии вследствие хорошей
эластичности надкостницы у детей; подобная операция у взрослых приводит к
повреждению надкостницы, ведущему к её окостенению с образованием остеофитов,
которые становятся причиной формирования порочной культи.
4. По способу закрытия костного опила
· Костнопластическая ампутация по
методу Пирогова (1867)
(применяются обычно при ампутации
нижних конечностей - например, ампутация голени по Пирогову, по Биру, ампутация
бедра по ГриттиШимановскомуАльбрехту). При этом способе опил укрывают костным
лоскутом (например, при удалении голени по Пирогову - лоскутом пяточной кости),
что позволяет сформировать полноценную опорную культю благодаря отсутствию
травматизации мягких тканей опилом кости.
· Периостопластические
· Тенопластические (напр., ампутация
бедра по Каллендеру)
· Миопластические (над опилом кости
мышцы сшиваются практически всегда, кроме тяжелых огнестрельных ранений,
анаэробной инфекции, сосудистой патологии)
· С пластикой кожноподкожнофасциальными
лоскутами
· Без закрытия культи
Показания:
· Осложнения заболеваний сосудов при
невозможности реконструктивного лечения (сухая гангрена конечности, хроническая
критическая ишемия конечности - стадии III-IV по классификации
FontainПокровского - при невозможности её купирования, острая необратимая
ишемия конечности, синяя флегмазия - тотальный тромбоз всех венозных стволов,
белая флегмазия - тотальный тромбоз артерий и вен конечности). Решение об
ампутации принимается только совместно с сосудистым хирургом. Реконструктивная
сосудистая операция менее травматична для больного, чем ампутация. Однако в
случае необратимой ишемии конечности выполнение ампутации является единственно
возможным методом спасения пациента, так как восстановление кровотока в
конечности может привести к гибели на фоне тяжелейшего реперфузионного
синдрома.
· Тяжелая гнойная патология, угрожающая
жизни (анаэробная инфекция, в том числе газовая гангрена, влажная гангрена).
Чаще, чем при других формах хирургической инфекции конечностей, к ампутациям
прибегают у больных с синдромом диабетической стопы, так как у них имеются
нарушения местной сосудистой воспалительной реакции (отграничение) и
иммунитета. Однако более, чем у половины больных с диабетической стопой
ампутации можно избежать при полноценном лечении. В современных условиях
показания к ампутации при хирургической инфекции должны быть значительно
сокращены за счёт применения активной хирургической тактики, современных
антибиотиков и средств местного лечения.
· Тяжелая травма (синдром длительного
сдавления, конечность, висящая на лоскуте мягких тканей и т. п.) В настоящее
время показания к первичной ампутации при травме резко ограничены, так как
имеются возможности реплантации конечности, имеются современные способы лечения
ран и раневой инфекции.
· Злокачественные новообразования:
· Ортопедические заболевания,
нарушающие функцию конечности и не подлежащие ортопедической коррекции. К таковым относят различные
варианты порочной культи, требующие реампутации.
Приступая к ампутации необходимо
помнить о последующем протезировании, т.к. образующаяся культя не просто
остаток конечности, а орган с новыми анатомофизиологическими особенностями,
предназначенный служить человеку всю его жизнь и, притом, в сочетании с
протезом. Учитывая опорную функцию нижней конечности, культя должна отвечать
определенным требованиям.
Общие принципы ампутаций и
экзаркуляций.. Целью всякой ампутации является:
· предотвратить распространение
инфекции и поступление продуктов метаболизма из очага поражения в организм
пострадавшего и, тем самым, спасти жизнь больного.
· Создать работоспособную культю
пригодную для протезирования
II. Обезболивание. Положение больного
на спине, хирург стоит справа от больного.. Обезболивание конечности.
Определение уровня ампутации.. Этапы ампутации
Общим принципом ампутаций и
экзаркуляций является то, что все они без исключения проводятся в три этапа:этап
- рассечение мягких тканейэтап - обработка надкостницы и перепиливание
костиэтап - туалет культи
Критерии годности культи к
протезированию
· длина культи от вышерасположенного
сустава должна быть достаточной (не короче диаметра), чтобы больной мог владеть
протезом;
· форма культи должна быть
цилиндрической, слегка суживающейся книзу (жесткая тотальноконтактная приемная
полость протеза);
· кожный рубец должен быть линейным,
подвижным и неспаянным с костью;
· культя должна быть безболезненной;
· оставшиеся суставы должны быть подвижными.
Экзартикуляция это ампутация на уровне сустава.
25. Болезнь Рейно. Клиника. Диагностика.
Лечение
Болезнь Рейно - относится к вазоспастическим
заболеваниям, представляет собой ангиотрофоневроз с преимущественным поражением
мелких концевых артерий и артериол. Заболевание поражает верхние конечности,
как правило, симметрично и двусторонне.
Выделяют 3 основные стадии заболевания:
· ангиоспастическую (кратковременные
спазмы сосудов концевых фаланг 23 пальцев кисти или 13 пальцев стопы; спазм
быстро сменяется расширением сосудов с покраснением кожи, потеплением пальцев);
· ангиопаралитическую (кисть и пальцы
приобретают цианотичную окраску, отечность и пастозность пальцев);
· трофопаралитическую (склонность к
развитию панарициев и язв, очаги поверхностного некроза мягких тканей концевых
фаланг, после отторжения - длительно незаживающие язвы).
Дифференциальный диагноз проводится с облитерирующим
эндартериитом и нарушениями кровообращения в конечности, обусловленными
сдавлением подключичной артерии; в качестве заболеваний для дифференциальной
диагностики также рассматриваются другие вазоспастические патологии.
Для больных данным синдромом
характерно специфическое нарушение микроциркуляции, проявляющееся в виде
зябкости пальцев и реакции на холод в виде болей и побледнения. Иногда, по
определенным рисункам капилляров кровеносных сосудов, которые прилегают к
ногтевым пластинам, можно определить феномен Рейно. Однако следует отметить,
что не существует какоголибо однозначного клинического синдрома,
свидетельствующего о наличии данного синдрома. Врач может также провести
определенные исследования конечностей пациента, чтобы исключить сжатие
кровеносных сосудов, имитирующее феномен Рейно, как, например, синдром
лестничной мышцы.
Обычно у людей с феноменом Рейно, который
рассматривается как одно из проявлений ревматических заболеваний, повышена
скорость оседания эритроцитов, отмечается повышенный уровень антинуклеарных
антител
Методы лечения болезни Рейно можно
разделить на две группы - консервативные и хирургические.
Консервативные методы включают
применение сосудорасширяющих лекарственных средств (например, фентоламин).
Лекарственная терапия при болезни Рейно продолжается в течение жизни больного.
Следует отметить, что при длительном приеме данных препаратов неизбежно
происходит развитие осложнений.
Хирургическим методом лечения является симпатэктомия.
Суть лечения заключается в «выключении» нервных волокон, по которым идут
патологические импульсы, заставляющие кровеносные сосуды спазмироваться.
Существуют несколько видов симпатэктомии. Наименее травматичной является
эндоскопическая симпатэктомия.
26. Варикозное расширение вен нижних
конечностей (Варикоз). Первичный и вторичный варикоз. Клиника. Функциональные
пробы. Диагностика. Дифференциальный диагноз. Показания и противопоказания к
традиционным и эндохирургическим операциям. Виды операций. Склерозируюитя
терапия
Варикозное расширение вен нижних
конечностей (варикозная болезнь) - расширение поверхностных вен нижних
конечностей, сопровождающееся несостоятельностью клапанов и нарушением
кровотока. Варикозное изменение вен может быть первичным или вторичным.
Разделить заболевания по этому признаку чрезвычайно важно. Первичное варикозное
расширение вен развивается при отсутствии поражения глубоких вен и в целом
протекает доброкачественно. Варикозное изменение вен вследствие обструкции или
недостаточности клапанов глубокой венозной системы представляет собой
значительно более серьезное заболевание. Клинические признаки варикозного
расширения вен. Ведущим признаком варикозной болезни является расширение
подкожных вен, изза которого болезнь и получила своё название. Варикозное
расширение вен, как правило, появляется в молодом возрасте, у женщин - во время
или после беременности. В начальных стадиях заболевания появляются
немногочисленные и весьма неспецифичные симптомы. Больных беспокоят чувство
тяжести и повышенной утомляемости, распирание и ночные судороги в икроножных
мышцах. Одним из частых симптомов, появляющихся уже в самом начале заболевания,
бывают преходящие отеки и боль по ходу вен (зачастую ещё не расширенных). Весь
этот симптомокомплекс настолько отличается от пациента к пациенту, что
практически единственным удачным его названием следует признать «синдром
беспокойных ног». Не обязательно наличие данного синдрома предрасполагает к
последующей варикозной трансформации вен. Однако большинство больных с
варикозным расширением вен нижних конечностей в начале заболевания отмечали
какиелибо из перечисленных симптомов. Заболевание развивается медленно -
годами, а порой и десятилетиями. В дальнейшем к перечисленным субъективным
симптомам присоединяются регулярно возникающие к вечеру и исчезающие к утру
отеки. При появлении таких отеков следует говорить о развившейся хронической
венозной недостаточности. Если пациенты на этой стадии не получают необходимого
лечения, у определенной их части возникает гиперпигментация кожи голеней и
липодерматосклероз. В более запущенных случаях возникают трофические язвы.
Диагностика первичного варикозного расширения вен основана на осмотре нижних
конечностей больного, находящегося в вертикальном положении. При варикозном
расширении вен диаметр сосудов увеличивается, они становятся извитыми; в
патологический процесс чаще всего вовлекаются сосуды систем большой и малой
подкожных вен. Если изолированный клубок вен находится в нетипичном месте, то
можно думать об имеющейся недостаточности перфорирующих вен или артериовенозных
свищей. Для подтверждения диагноза недостаточности клапанов глубоких и
перфорирующих вен можно использовать допплеровское измерение скорости
кровотока. Клапанная недостаточность проявляется развитием рефлюкса (обратного
кровотока) в венах при выполнении пробы Вальсальвы. Функциональные пробы
состояния клапанов вен нижних конечностей.
О состоянии клапанного аппарата
поверхностных вен позволяют судить проба Троянова -Тренделенбурга и проба
Гаккенбруха.
Проба Троянова -Тренделенбурга.Больной,находясь в горизонтальном
положении,поднимает ногу вверх под углом 45 °.Врач,поглаживая конечность от
стопы к паху,опорожняет варикознорасширенные поверхностные вены.После этого на
верхнюю треть бедра накладывают мягкий резиновый жгут или сдавливают пальцами
большую подкожную вену в овальной ямке у места ее впадения в бедренную.Больного
просят встать.В норме наполнение вен голени не происходит в течение 15
с.Быстрое наполнение вен голени снизу вверх свидетельствует о поступлении крови
из коммуникантных вен вследствие недостаточности их клапанов.Затем быстро
снимают жгут (или прекращают сдавление вены).Быстрое наполнение вен бедра и
голени сверху вниз свидетельствует о недостаточности остиального клапана и
клапанов ствола большой подкожной вены,характерного для первичного варикозного
расширения вен.
Проба Гаккенбруха.Врач нащупывает на бедре овальную
ямку - место впадения большой подкожной вены в бедренную и просит больного
покашлять.При недостаточности остиального клапана пальцы воспринимают толчок
крови (положительный симптом кашлевого толчка).
Для оценки состоятельности клапанов
коммуникантных вен используют пробу Пратта2,трехжгутовую пробу Шейниса или
пробу Тальмана.
Проба Пратта2.В положении больного лежа после
опорожнения подкожных вен на ногу,начиная со стопы,накладывают резиновый
бинт,сдавливающий поверхностные вены.На бедре под паховой складкой накладывают
жгут.После того как больной встанет на ноги,под самым жгутом начинают
накладывать второй резиновый бинт.Затем первый (нижний)бинт снимают виток за
витком,а верхним обвивают конечность книзу так,чтобы между бинтами оставался
промежуток 5 -6 см.Быстрое наполнение варикозных узлов на свободном от бинтов
участке указывает на наличие здесь коммуникантных вен с несостоятельными
клапанами.
Трехжгутовая проба Шейниса по существу является модификацией
предыдущей пробы.Больного укладывают на спину и просят приподнять ногу,как при
пробе Троянова -Тренделенбурга.После того как подкожные вены
спадутся,накладывают три жгута в верхней трети бедра (вблизи паховой
складки),на середине бедра и тотчас ниже колена.Больному предлагают встать на
ноги.Быстрое наполнение вен на какомлибо участке конечности, ограниченном
жгутами,указывает на наличие в этом сегменте коммуникантных вен с
несостоятельными клапанами.Быстрое наполнение варикозных узлов на голени
свидетельствует о наличии таких вен ниже жгута.Перемещая жгут вниз по голени (при
повторении пробы),можно более точно локализовать их расположение.
Проба Тальмана - модификация пробы Шейниса.Вместо
трех жгутов используют один длинный (2 -3 м)жгут из мягкой резиновой
трубки,который накладывают на ногу по спирали снизу вверх;расстояние между
витками жгута - 5 -6 см.Наполнение вен на какомлибо участке между витками
свидетельствует об имеющейся в этом пространстве коммуникантной вены с
несостоятельными клапанами.
Представление о проходимости глубоких
вен дают маршевая проба Дельбе -Пертеса и проба Пратта1.
Маршевая проба Дельбе -Пертеса.Больному в положении стоя,когда
максимально наполняются подкожные вены,ниже коленного сустава накладывают
жгут,сдавливающий только поверхностные вены.Затем просят больного походить или
промаршировать на месте в течение 5 -10 мин.Если при этом подкожные вены и
варикозные узлы на голени спадаются,значит, глубокие вены проходимы.Если вены
после ходьбы не запустевают,напряжение их на ощупь не уменьшается,то результат
пробы надо оценивать осторожно,так как он не всегда указывает на непроходимость
глубоких вен,а может зависеть от неправильного проведения пробы (сдавление
глубоких вен чрезмерно туго наложенным жгутом),от наличия резкого склероза
поверхностных вен,препятствующего спадению их стенок.Пробу следует повторить.
Проба Пратта1.После измерения окружности голени
(уровень следует отметить,чтобы повторное измерение провести на этом же
уровне)больного укладывают на спину и поглаживанием по ходу вен опорожняют их
от крови.На ногу (начиная снизу)туго накладывают эластичный бинт,чтобы надежно
сдавить подкожные вены.Затем больному предлагают походить в течение 10
мин.Появление боли в икроножных мышцах указывает на непроходимость глубоких
вен.Увеличение окружности голени после ходьбы при повторном измерении
подтверждает это предположение.
Локализацию перфорантных вен с
несостоятельными клапанами можно определить иногда путем пальпации дефектов в
апоневрозе,через которые они перфорируют фасцию.Инструментальная оценка
несостоятельности клапанов точнее перечисленных выше проб.
Варикозное расширение вен нижних
конечностей - заболевание хирургическое, поэтому радикальное его лечение
возможно только хирургическими методами. Людям, имеющим факторы риска и
наследственную предрасположенность к варикозной болезни необходимо один раз в 2
года консультироваться у флеболога с обязательным ультразвуковым исследованием
вен.
Флебэктомия. Хирургическое лечение
варикозных вен предполагает их удаление. Данный вид оперативного вмешательства
длится 1-2 часа. Удаления вен, находящихся под кожей, не оказывает нагрузку на
более глубокие слои вен. По ним, как правило, проходит не более 10% крови.
Процедура атравматична, рубцы достигают 4-5 мм.
Показания
· обширный варикоз
· расширенные подкожные вены
· нарушение оттока крови
· трофические язвы, сопровождающие
варикоз
· тромбофлебит
Противопоказания
· поздняя стадия варикозного расширения
вен
· ишемическая болезнь сердца
· тяжелые инфекционные заболевания
· вторая половина беременности
· пожилой возраст
Эндовазальная (эндовенозная) лазерная
коагуляция (облитерация) варикозных вен (ЭВЛК, ЭВЛО) - современный метод,
призванный устранить рефлюкс крови в поверхностных и перфорантных венах с
помощью тепловой энергии лазерного излучения. ЭВЛО позволяет отказаться от
выполнения разрезов и не требует госпитализации пациента в стационар.
Методика проведения ЭВЛО складывается
из пяти последовательно выполняемых шагов:
· Шаг 1. Пункция магистральной
подкожной вены и проведение световода.
· Шаг 2. Позиционирование рабочей части
световода.
· Шаг 3. Создание тумесцентной
анестезии.
· Шаг 4. Проведение эндовазальной
лазерной облитерации.
· Шаг 5. Наложение компрессионного
бандажа.
Радиочастотная коагуляция варикозных
вен
Радиочастотная коагуляция (абляция)
варикозных вен (РЧК, РЧА) метод эндовенозного лечения варикозного расширения
подкожных вен нижних конечностей, целью которого является устранение рефлюкса
по большой и/или малой подкожной вене. Процедура радиочастотной коагуляции
варикозных вен выполняется под ультразвуковым контролем, под местной
анестезией, без разрезов и без госпитализации.
Под непосредственным визуальным
контролем или под контролем специального оборудования производится пункция
вены. Выполняется аспирационная проба для подтверждения нахождения кончика иглы
в просвете вены. После этого вводится склерозирующий препарат. Дозировка
препарата, а также форма введения определяется специалистом флебологом.
Осуществляется экспозиция препарата и накладывается эластичная компрессия.
Микросклеротерапия не требует эластичной компрессии. Введение препарата в просвет
вены безболезненно. После сеанса склеротерапии необходима 40 60 минутная
прогулка. В настоящее время эффективна склеротерапия магистральных вен (большой
и (или) малой подкожных) под ультразвуковым контролем. Использование
разнообразного инструментального контроля за введением препарата, а также
специального оборудования для введения позволяет выполнять прецизионную
(точную) склеротерапию, что обеспечивает отличные результаты лечения.
Консервативное лечение варикозной
болезни не следует противопоставлять лечению хирургическому. Оно используется в
комплексе с ним, дополняя его. Как основное лечение оно используется при
невозможности выполнить хирургическое вмешательство. Консервативное лечение не
приводит к излечению от варикозной болезни, однако способствуют улучшению
самочувствия и может замедлить скорость прогрессирования заболевания.
Ведущим компонентом в программе
консервативного лечения является компрессионное лечение. Его эффективность
подтверждена многочисленными исследованиями. Действие компрессионного лечения
многокомпонентное и заключается в следующем:
· уменьшение диаметра поверхностных вен
· уменьшение или исчезновение рефлюкса
в них
· возрастание скорости движения крови
по глубоким венам
· повышение эффективности работы
мышечной венозной помпы
· уменьшение капиллярной фильтрации и
увеличение резорбции
· увеличение лимфатического дренажа
В зависимости от характера патологии
и преследуемых целей, компрессионное лечение может применяться ограниченный или
длительный срок. В клинической практике для компрессионного лечения чаще всего
используют эластичные бинты и компрессионный трикотаж. Несмотря на широкое
распространения последнего, эластичные бинты не потеряли своего значения.
· Лекарственные препараты для лечения
варикозной болезни должны удовлетворять следующим критериям:
· Повышать тонус вен
· Уменьшать проницаемость капилляров и
улучшать лимфодренаж
· Улучшать микроциркуляцию и устранять
реологические расстройства
· Ингибировать адгезию лейкоцитов к
венозной стенке и купировать воспаление
Хорошо переноситься больными
27.
Варикозное расширение вен нижних конечностей. Течение заболевания. Осложнения,
их клиника и лечение. Правила, Эластического бинтования нижних конечностей.
Причины рецидива варикозной болезни
|
Осложнения варикозной
болезни. К осложнениям варикозной
болезни относят тромбофлебит, кровотечение и образование трофических язв. Кровотечение
из варикозных вен бывает спонтанным и травматическим, наружным и
подкожным. Наибольший риск представляет наружное кровотечение, обусловленное
травматическим разрывом или изъязвлением истонченной кожи над варикозной
веной. Кровотечение, обычно, развивается из варикозных вен, расположенных в
нижней трети голени и области лодыжек. Неотложные мероприятия включают в себя
немедленный перевод пациента в горизонтальное положение, подъем пораженной
конечности под максимальным углом и тугое эластическое бинтование (ни в коем
случае не наложение жгута!!!). В последующем - пациента необходимо госпитализировать
в хирургический стационар, где производится окончательная остановка
кровотечения путем прошивания сосуда или его склерооблитерация. Трофическая
язва представляет собой дефект кожи, возникающий, как правило, в
нижней трети медиальной поверхности голени - в зоне максимально выраженных
трофических расстройств. Лечение варикозных трофических язв строится на
принципе этапности: первоочередной задачей является закрытие язвы, в
последующем - выполняется хирургическое вмешательство, направленное на профилактику
рецидива. Помимо этого лечение трофической язвы определяется фазой течения
язвенного процесса. Фаза экссудации характеризуется обильным раневым
отделяемым, выраженной перифокальной воспалительной реакцией мягких тканей и
частой бактериальной обсемененностью язвы. В связи с этим главной задачей
лечения в этих условиях является санация трофической язвы от патогенной
микрофлоры и некротических тканей, а также подавление системного и местного
воспаления. Для этого всем пациентам на 1014 дней рекомендуют полупостельный
режим. Основными компонентами терапии являются антибиотики широкого спектра
действия (полусинтетические пенициллины или цефалоспорины), которые назначают
парентерально или перорально. При длительно существующих трофических язвах у
пациентов с признаками микотического поражения ногтевых пластинок,
межпальцевых промежутков и стопы в антибактериальную терапию целесообразно
включать противогрибковые препараты и производные нитроимидазола (Флагил,
Мератин и др.). При выраженном воспалении мягких тканей, сопровождающимся
сильным болевым синдромом, применяют нестероидные противовоспалительные
средства (Диклофенак, Кетопрофен и др.) в виде внутримышечных инъекций или
свечей. Дополнительно назначают инфузии гемореологическиактивных препаратов
(Рефортан, Реополиглюкин, Трентал, Аспизол и др.) Важное место занимает
местное лечение трофической язвы. Оно включает в себя ежедневный
двухтрехкратный туалет язвенной поверхности с помощью мягкой губки и
антисептического раствора (Димексид, Эплан, Диоксидин, Хлоргексидин, Цитеал,
раствор перманганата калия, отвары ромашки или череды). После этого
накладывают повязку с водорастворимой мазью, обладающей осмотической
активностью (Левосин, Левомеколь, Диоксиколь и др.), специальные сорбирующие
повязки (карбонет) и эластический бандаж. Для предотвращения мацерации мягких
тканей по периферии трофической язвы целесообразно нанести цинкооксидную мазь
или обработать кожу слабым раствором нитрата серебра. Переход язвы в фазу
репарации характеризуется очищением раневой поверхности, появлением
грануляций, стиханием перифокального воспаления и уменьшением экссудации.
Основной задачей лечения становится стимуляция роста и созревания
соединительной ткани. Для этого назначают поливалентные флеботонические
препараты (Венорутон, Гинкорфорт, Гливенол, Детралекс и др.), антиоксиданты
(Аевит, Токоферол и др.), депротеинизированные дериваты крови телят
(Актовегин, Солкосерил). Для улучшения реологических свойств крови
целесообразно включать в комплекс лечения ультрафиолетовое или лазерное
облучение аутокрови. Для ускорения роста соединительной ткани целесообразно
применять Куриозин (гиалуронат цинка). Гиалуроновая кислота является основным
структурным компонентом соединительной ткани, ионизированный цинк - активное
антисептическое средство. Очень хорошо себя зарекомендовали биодеградирующие
раневые покрытия (Аллевин, Альгипор, Альгимаф, Гешиспон, Свидерм и др.).
Обязательным компонентом остается адекватная эластическая компрессия. В фазу
эпителизаиии, характеризующуюся началом эпителизации трофической язвы и
созреванием соединительнотканного рубца, необходимо надежно защитить
последний от возможного внешнего механического повреждения. Это достигается
постоянным ношением эластического бандажа или компрессионного трикотажа.
Необходимо продолжить прием поливалентных флеботоников. После закрытия
трофической язвы целесообразно выполнение комбинированной хирургической
операции. При наличии серьезных противопоказаний к хирургическому
вмешательству пациентам рекомендуют пожизненную эластическую компрессию и
прием веноактивных препаратов. Копрессионная терапия подразумевает
использование медицинских эластических компрессионных изделий (МЭКИ).
Сведения о них хорошо представлены А. В. Покровским и С. В. Сапелкиным.
Основная задача использования МЭКИ ослабление проявления признаков
хронической венозной недостаточности при варикозной болезни и варикозеПри
назначении компрессионной терапии необходимо обучить пациентов пользоваться
эластическими бинтами или чулками. Обычно утром бинтование начинают со стопы.
При этом наибольшее натяжение на стопе. По мере наложения витков давление
следует уменьшать. Последний виток на бедре фиксируется специальными
застежками. Такой же принцип приемлем и для чулок, у которых такое ослабление
предусмотрено производителем. Вечером перед сном эластические изделия
снимаются. Показания к использованию компрессионной терапии относительны при
всех группах варикозной болезни и варикоза.
|
В 1986 году Г.И. Лукомский с соавт.
разделили причины рецидива варикозного расширения вен нижних конечностей на две
группы:
· Диагностические ошибки в
результате неправильной диагностики локализации перфорантных вен с клапанной
недостаточностью, невыявленного варикоза в системе малой подкожной вены;
· Тактические ошибки в
результате низкой перевязки большой подкожной вены с оставлением латеральной
ветви, нерадикального удаления малой подкожной вены, неполной перевязки
коммуникантныхвен
Считаем наиболее приемлемым в настоящее
время среди причин рецидива варикозной болезни выделять следующие:
· Рецидивы, возникшие в
результате ошибки при выполнении флебэктомии (оставление длинной культи большой
или малой подкожных вен, плохая обработка приустьевых притоков основных
стволов, неудаление магистрального ствола подкожной вены, неустраненный стопный
варикоз, реканализация вен после склеротерапии);
· Рецидивы, возникшие изза
дальнейшего развития заболевания, развитие варикозной болезни в ранее
неизмененных отделах венозной системы.
На основании всего вышеизложенного, на
современном этапе развития диагностической техники и лечебных возможностей во
флебологии причинами развития истинного рецидива варикозного расширения вен
можно считать следующие: '
· Неадекватное
использование возможностей цветного ангиосканирования, невыявленные особенности
ангиоархитектоники венозной системы, неполный диагноз - неполная хирургическая
коррекция;
· Неполноценное
хирургическое устранение патологических вертикальных и горизонтальных
веновенозных сбросов крови (оставление длинной культи большой или малой
подкожных вен в приустьевом отделе с сохраненными боковыми притоками);
· Гиподиагностика и
неадекватная интраоперационная обработка несостоятельных перфорантных вен;
· Неустраненный стопный
варикоз как фактор, поддерживающий венозную гипертензию в поверхностной
венозной системе после флебэктомии;
· Недиагностированная в
предоперационном периоде клапанная недостаточность глубоких вен, приводящая в
послеоперационном периоде к нарастанию венозной гипертензии в дистальных
отделах нижних конечностей и способствующая развитию рецидива.
28. Флеботромбозы и тромбофлебиты
глубоких вен нижних конечностей. Клиника в зависимости от локализации и
протяженности тромбоза. Диагностика. Консервативное и оперативное лечение. Виды
операций
Флеботромбоз образование в просвете вены тромба,
фиксированного к стенке вены, полностью или частично («флотирующий тромб»)
обтурирующего сосуд с присоединением воспалительных изменений в венозной
стенке. Тромбофлебитом называют воспалительные изменения венозной стенки с
последующим образованием тромба в просвете вены. С точки зрения современной
флебологии нет принципиальных отличий патогенеза тромбофлебита и флеботромбоза.
При тромбозе вены всегда есть воспалительные изменения венозной стенки, а
воспаление стенки вены (флебит) сопровождается ее тромбозом. Однако флебологи,
понимая условность подобного деления, пользуются термином тромбофлебит при
поражении подкожных, а флеботромбоз глубоких вен. Исключение составляют лишь
крайне редкие в наши дни случаи гнойного расплавления тромботических масс,
которое может возникнуть как в поверхностной, так и в глубокой венозной
системах.
По течению различают:
· Острый тромбофлебит
(продолжительность патологического процесса до 1 месяца);
· Подострый тромбофлебит
(продолжительность клинических проявлений от 1 до 2 месяцев);
· Хронический тромбофлебит, или
посттромбофлебитический синдром (длительный патологический процесс в венозной
системе вследствие перенесенного тромбофлебита, который развиваются в сроки
более 23 месяцев).
По характеру воспаления тромбофлебит различают на:
· Гнойный;
· Не гнойный.
По локализации патологического процесса различают:
· Тромбофлебит поверхностных вен;
· Тромбофлебит глубоких вен.
Тромбофлебит глубоких вен является
самостоятельным или осложнением поверхностного тромбофлебита. Чаще всего
поражаются глубокие вены голени, затем подколенная и вышележащие вены бедра.
Тромбоз глубоких вен всегда тяжелая по своим последствиям и потенциально
опасная болезнь. Симптомы: внезапное начало, боли и уплотнения по ходу глубоких
вен (икроножные мышцы). Боли усиливаются при давлении. Развивается отечность,
ощущение налитости, распирания, жара и судорог в икроножных мышцах. Боли,
тяжесть и только что названные ощущения резко усиливаются при опускании ноги.
Увеличивается объем соответствующей части конечности. Невозможно встать на
ногу. Кожа на стопе, пальцах, голени делается слегка блестящей изза отека и
бледной. Рисунок кожных и подкожных вен резко усиливается, иногда они заметно
расширяются.
При тромбофлебите глубоких (и в
меньшей степени поверхностных) вен развивается рефлекторный спазм артерий и вен
пораженной конечности. Вследствие этого изменяется пульсация на задней и
передней артериях стопы, подколенной, а при тромбозе бедренных вен и бедренной
артерии. Ухудшается общее состояние. Повышается температура тела, изменяются реакции
крови. Тромбоз глубоких вен склонен к обострениям (часто сезонным) и вовлечению
других вышерасположенных вен.
Поражение подколенной и особенно
бедренной вены протекает значительно тяжелее, чем тромбофлебит голени. Быстро
нарастает отек ноги. Кожа делается горячей, синюшной. Развивается спазм
сосудов, что определяется по состоянию пульса и изменениям температуры кожи.
Появляются сильные боли по ходу пораженных вен голени и бедра. Отекает и
ограничиваются движения в коленном суставе. Ткани напряжены по ходу
тромбированной вены, кожа горяча на ощупь, отечна. Отмечается резкая
болезненность по ходу сосудистонервного пучка. Подкожные вены расширены и четко
вырисовываются на фоне синюшной и слегка покрасневшей кожи. При тазовобедренной
форме тромбофлебита, т. е. при вовлечении в процесс подвздошных вен, нижней
полой вены особенно сильные боли локализуются в голени, бедре и ягодице, нижней
половине брюшной стенки. Нарушаются функции кишечника, мочевого пузыря.
Развивается тяжелая общая реакция организма с высокой температурой тела,
лейкоцитозом, повышением РОЭ, ознобом и т. п. Наступает отек ноги, а иногда и
половых органов, промежности, нижней части передней брюшной стенки.
Заболевание глубоких вен нижних конечностей после
окончания острого периода переходит в подострую и хроническую стадии развития.
Прогрессируют характерные симптомы нарушения венозного артериолокапиллярного и
артериального кровообращения, лимфообращения, обмена, трофизма тканей.
Развиваются боли в связи с воспалением нервов, сосудов, подкожной жировой
клетчатки.
Диагностика тромбофлебита в
большинстве случаев не вызывает существенных затруднений. Применяются
инструментальные методы исследования реовазография или ультразвуковая
допплерография. Наиболее точную диагностическую информацию предоставляет
ультразвуковое дуплексное ангиосканирование с цветовым кодированием кровотока.
Это исследование позволяет оценить состояние стенок и просвета вен, наличие в
них тромботических масс, характер тромба и даже ориентировочно судить о его
«возрасте», т.е. степени организации. Ультразвуковое сканирование подкожных вен
дает возможность с абсолютной точностью выявить истинную протяженность
тромбоза.
Роль лабораторной диагностики
невелика. Общий анализ крови выявляет умеренно выраженные признаки воспаления.
Большинство пациентов с
тромбофлебитом могут лечиться консервативно в амбулаторных условиях. Неотложная
госпитализация в хирургические стационары (желательно в специализированные
сосудистые или флебологические отделения) необходима при восходящих формах тромбофлебита
стволов большой и малой подкожных вен, когда возникает угроза перехода тромбоза
на глубокие вены. Такие больные должны быть оперированы в экстренном порядке
после ультразвукового сканирования.
Хирургическое лечение включает в себя
перевязку подкожных вен или удаление всех варикозно расширенных (тромбированных
и нетромбированных) вен.
Консервативное лечение тромбофлебита
должно быть направлено на устранение воспалительного и локального
тромботического процессов. Режим, который предписывается больным, должен быть
активным. Ошибкой следует признать назначение постельного режима, поскольку
деятельность мышечновенозной помпы голени обеспечивает интенсивный кровоток в
глубоких венах, препятствуя развитию в них тромбоза. В первые дни заболевания,
когда максимально выражены воспалительные явления и требуется активное местное
лечение, целесообразно формировать бандаж с помощью эластических бинтов средней
степени растяжимости. По мере стихания воспалительных явлений для
компрессионного лечения может быть с успехом использован медицинский трикотаж
гольфы, чулки или колготы 23 компрессионного класса.
Простой, но действенной мерой
является местное охлаждение, дающее хороший обезболивающий эффект.
При тромбофлебите оправдано
использование различных форм нескольких классов фармацевтических препаратов:
· нестероидных противовоспалительных
средств (НПВС);
· производных рутина;
· дезагрегантов;
· полиэнзимных смесей;
· флеботоников растительного
происхождения
· антикоагулянтов.
Из группы НПВС наиболее эффективными при данном
заболевании являются диклофенак и кетопрофен. Эти препараты оказывают не только
мощное противовоспалительное, но и хорошее обезболивающее действие. Гель
кетопрофена наносят 23 раза в день в количестве 35 г (1 см мази, выдавленной из
тюбика) непосредственно на пораженный участок конечности и легкими круговыми
движениями пальцев рук втирают в кожу. Быстрый эффект дают внутримышечные
инъекции НПВС, а также использование их в ректальных свечах. Эти способы
применения указанных средств уменьшают частоту и выраженность осложнений.
Эффективным средством лечения
тромбофлебита являются производные рутина (рутозид, троксевазин, троксерутин),
представляющие собой универсальные протекторы венозной стенки и оказывающие
выраженное противовоспалительное действие. Суточная доза различных
троксерутинов обычно составляет 1200 мг.
В комплекс консервативных мероприятий
целесообразно включать дезагрегантные средства: внутривенное введение
реополиглюкина (400 мл) и трентала (10 мл). Вливания проводят капельно 1 раз в
сутки в течение 35 дней. В таблетках трентал назначают в суточной дозе 8001200
мг. В профилактических целях могут быть использованы малые дозы аспирина.
Эффект системной энзимотерапии
обусловлен способностью ферментов угнетать процесс воспаления, оказывать
противоотечное и иммуномодулирующее действие, удалять фиксированные в тканях
иммунные комплексы и активизировать фибринолиз. Вобэнзим (смесь панкреатина,
папаина, бромелаина, трипсина, химотрипсина, амилазы, липазы и рутина)
принимают по 510 таблеток 3 раза в день; флогэнзим (смесь бромелаина, трипсина
и рутозида) по 2 таблетки 3 раза в день, запивая большим количеством воды.
Сдерживающим фактором для широкого применения системной энзимотерапии является
необходимость приема большого числа таблеток в строго определенное время и ее
достаточно высокая стоимость.
Гепарин оказывает мощное
противотромботическое и противовоспалительное действие. Дозировка и частота
применения гепаринсодержащих гелей аналогичны таковым при использовании НПВС. В
то же время хорошо зарекомендовало себя чередование этих препаратов, т.е.
гелевые аппликации проводят 4 раза в день по схеме: гепарин НПВС гепарин
НПВС.
При проведении консервативных
мероприятий необходимо помнить о возможности прогрессирования тромбофлебита,
несмотря на проводимое лечение. Поэтому в процессе терапии должен проводиться
динамический контроль (клинический и ультрасонографический) за течением
заболевания.
29. Тромбоэмболия легочной артерии
(ТЭЛА). Причины. Клиника. Диагностика. Дифференциальный диагноз. Консервативное
и оперативное лечение. Профилактика
Тромбоэмболи́я лёгочной арте́рии (ТЭЛА) - закупорка лёгочной
артерии или её ветвей тромбами, которые образуются чаще в крупных венах нижних
конечностей или таза (эмболия).
В основе заболевания лежит тромбообразование, которому
способствуют три фактора (триада Вирхова): нарушение кровотока, повреждение
эндотелия сосудистой стенки, гиперкоагуляция и угнетение фибринолиза.
Нарушение кровотока обусловлено варикозным расширением
вен, сдавлением сосудов извне (опухолью, кистой, костными отломками,
увеличенной маткой), разрушением клапанов вен после перенесённого
флеботромбоза, а также иммобилизация, которая нарушает функцию мышечновенозной
помпы нижних конечностей. Полицитемия, эритроцитоз, дегидратация, диспротеинемия,
повышенное содержание фибриногена повышают вязкость крови, что замедляет
кровоток.
При повреждении эндотелия обнажается субэндотелиальная
зона, что запускает каскад реакций свёртывания крови. Причины этого - прямое
повреждение стенки сосуда при установке внутрисосудистых катетеров, фильтров,
стентов, протезировании вен, травме, операции. Также к повреждению эндотелия
приводят гипоксия, вирусы, эндотоксины. При системной воспалительной реакции
активируются лейкоциты, которые прикрепляясь к эндотелию повреждают его.
Источником тромбов при ТЭЛА чаще служат вены нижних
конечностей (тромбоз вен нижних конечностей), намного реже - вены верхних
конечностей и правые отделы сердца. У больных тромбофилией увеличивается
вероятность венозного тромбоза.
Диагноз острой массивной ТЭЛА обычно бывает очевиден
(при отсутствии других заболеваний и наличии факторов риска).
Малые или повторяющиеся ТЭЛА.
Проявляющиеся только одышкой, часто не замечают, и
правильный диагноз устанавливают поздно. У пожилых больных с тяжёлой сердечнолёгочной
патологией может быстро развиться декомпенсация даже при тромбоэмболии мелких
ветвей лёгочной артерии. Признаки ТЭЛА часто принимают за обострение основного
заболевания, и правильный диагноз ставят поздно.
Наиболее типичные клинические признаки (в порядке
убывания по частоте встречаемости: от 70% до10%) одышка, тахипноэ, боли,
напоминающие плеврит, страх смерти, тахикардия, кашель, кровохарканье и явные
признаки ,тромбоза глубоких вен нижних конечностей.
К сожалению, признаки с высокой специфичностью имеют
низкую чувствительность, и наоборот.
Клинические проявления, даже в сочетании, имеют
ограниченное значение для постановки правильного диагноза. Однако ТЭЛА
маловероятна при отсутствии трёх следующих симптомов: одышки, тахипноэ (свыше
20 в минуту) и болей, напоминающих плеврит. Если дополнительные признаки
(изменения на рентгенограммах органов грудной клетки и РО2 крови) не
выявляются, диагноз ТЭЛА фактически можно исключить.
Одышка наиболее важный признак. Она может возникать в
покое либо только при физических нагрузках. Одышка часто связана с тахипноэ и
тахикардией. При одышке у больных, из группы риска необходимо всегда исключать
ТЭЛА.
Боль в груди может быть спровоцирована инфарктом
миокарда, перикардитом, пневмотораксом или пневмонией. Однако при ТЭЛА боль
может быть малоинтенсивной и даже отсутствовать.
Кашель и субфебрильная температура тела провоцируются
инфекциями лёгких.
Кровохарканье отмечают очень редко.
Клинические признаки тромбоза глубоких вен нижних
конечностей нередко отсутствуют, особенно у больных, прикованных к постели.
У 30% больных с ТЭЛА при флебографии не выявляют
какойлибо патологии
При аускультации лёгких патологии обычно не выявляют,
Возможно тахипноэ. набухание яремных вен бывает связано с массивной ТЭЛА.
Характерна артериальная гипотензия; в положении сидя У больного может случиться
обморок.
Утяжеление течения основного сердечнолёгочного
заболевания может быть единственным проявлением ТЭЛА. В этом случае правилый
диагноз становить трудно.
Диагностика трудна, так как симптомы ТЭЛА не
специфичны, а диагностические тесты несовершенны. Стандартные методы
обследования (обычные лабораторные тесты, электрокардиография (ЭКГ),
рентгенография органов грудной клетки) полезны только для исключения другой
патологии (например, пневмонии, пневмоторакса, переломов рёбер, инфаркта
миокарда, отёка лёгких). К чувствительным и специфичным методам диагностики
ТЭЛА относят определение dдимера, эхокардиография, компьютерная томография
(КТ), вентиляционноперфузионная сцинтиграфия, ангиография сосудов лёгких, а
также методы диагностики тромбоза глубоких вен нижних конечностей
(ультрасонография, КТвенография)
Лечение больных с ТЭЛА должно осуществляться в
отделениях реанимации и интенсивной терапии.
Коррекция гемодинамики и гипоксии
При остановке сердца выполняют сердечнолёгочную
реанимацию. В случае возникновения гипоксии у пациента с ТЭЛА проводят
оксигенотерапию (маски, носовые катетеры); реже требуется искусственная
вентиляция лёгких. Для устранения гипотензии внутривенно вводят солевые растворы
или вазопрессоры (адреналин, добутамин, допамин).
Антикоагулянтная терапия
Своевременная антикоагулянтная терапия снижает риск
смерти и рецидивов тромбоэмболий, поэтому её рекомендуют начинать не только при
подтверждённом диагнозе, но ещё в процессе диагностики при высокой вероятности
ТЭЛА. Для этого применяют нефракционированный гепарин (внутривенно),
низкомолекулярный гепарин (подкожно) или фондапаринукс (подкожно).
Дозировку нефракционированного гепарина подбирают,
учитывая массу пациента и активированное частичное тромбопластиновое время. Для
этого готовят раствор гепарина натрия - 20 000 МЕ/кг на 500 мл физиологичесого
раствора. Вначале вводят внутривенно струйно 80 МЕ/кг, а затем проводят инфузию
со скоростью 18 МЕ/кг/ч. Через 6 часов после струйного введения проверяют АЧТВ
и корректирую скорость введения гепарина как указано в таблице. АЧТВ определяют
через 3 часа после каждого изменения скорости; при достижении желаемого уровня
(46-70 с, в 1,5-2,5 раза выше контроля) этот показатель контролируют ежедневно.
В большинстве случаев применяют низкомолекулярные гепарины, так как они
эффективнее, безопаснее и удобнее в применении, чем нефракционированный. Однако
с осторожностью их следует назначать при дисфункции почек (уменьшение клиренса
креатинина <30 мл/мин) и при высоком риске геморрагических осложнений
(длительность действия нефракционированного гепарина более короткая и поэтому
его можно быстрее отменить в случае развития кровотечения). Из
низкомолекулярных гепаринов рекомендованы: эноксапарин. (1 мг/кг каждые 12 ч
или 1,5 мг/кг 1 раз в сутки), тинзапарин (англ.)русск. (175 МЕ/кг 1 раз в
сутки). У больных с онкологическими заболеваниями можно использовать
дальтепарин . (200 МЕ/кг 1 раз в сутки).
Также желательно уже в первый день введения антикоагулянтов
прямого действия (гепарины или фондапаринукс) назначить варфарин. При
достижении уровня международного нормализованного отношения (МНО) 2-3 и
удержании его на таком уровне не менее 2 суток прямые антикоагулянты отменяют
(но не ранее, чем через 5 суток от начала их применения). Начальная доза
варфарина - 5 или 7,5 мг 1 раз в сутки. Пациентам моложе 60 лет и без серьёзной
сопутствующей патологии допустима начальная доза 10 мг. Приём варфарина
продолжают не менее 3 месяцев.
Цель реперфузионной терапии - удаление тромба и
восстановление нормального лёгочного кровотока. Чаще всего для этого применяют
тромболитическую терапию. Её рекомендуют проводить больным высокого риска.
Некоторые авторы допускают применение тромболизиса при умеренном риске, однако
польза такой терапии в этой группе больных в настоящее время не ясна. Применяют
следующие препараты:
Стрептокиназа - нагрузочная доза 250 000 МЕ в течение
30 минут, затем 100 000 МЕ в час в течение 1224 ч или ускоренная схема 1,5 млн
МЕ в течение 2 ч
Урокиназа - нагрузочная доза 4400 МЕ/кг массы тела в
течение 10 мин, затем 4400 МЕ/кг массы тела в час в течение 12-24 ч или
ускоренная схема 3 млн МЕ в течение 2 ч
Альтеплаза - 100 мг на протяжении 2 ч или ускоренная
схема 0,6 мг/кг массы тела на протяжении 15 мин (максимальная доза 50 мг)
Кровотечение - основная проблема тромболитической
терапии. Массивное кровотечение развивается в 13% случаев, в 1,8% -
внутримозговое кровоизлияние.
Хирургические методы
Хирургическое удаление тромба (тромбэктомия)
рассматривают как альтернативный метод лечения ТЭЛА высокого риска, когда
тромболитическая терапия противопоказана. Больным с высоким риском рецидива и
при абсолютных противопоказаниях к антикоагулянтной терапии возможна установка
кавафильтров[22]. Они представляют собой сетчатые фильтры, которые улавливают
отрывающиеся от стенки тромбы и предотвращают их попадание в лёгочную артерию.
Кавафильтр вводят чрескожно, чаще через внутреннюю яремную или бедренную вену,
и устанавливают ниже почечных вен (выше - при наличии тромбов в почечных венах)
30.
Синдром Педжета Шреттера. Определение понятия. Причины острого тромбоза
подключичной вены. Клиника. Диагностика. Лечение
Синдромом ПеджетаШреттера называют
острый тромбоз проксимальных отделов подключичной вены с распространением его
на подмышечную вену и вены плеча и нарушением венозного оттока в верхней
конечности. Развитию заболевания способствуют топографоанатомические
особенности подключичной вены, расположенной в окружности костных и
сухожильномышечных образований. При сильных напряжениях мускулатуры плечевого
пояса, сочетающихся с движениями в плечевом суставе, уменьшаются размеры
подключичного пространства и вена оказывается сдавленной между ключицей и I
ребром. Особенно благоприятные условия для нарушения оттока по подключичной
вене, а следовательно, и тромбообразования возникают при высоком стоянии I
ребра, гипертрофиях подключичной мышцы и мышечносухожильной части малой грудной
мышцы. Клиника и диагностика: синдром Педжета ШреттераКристелли наблюдается
преимущественно у людей в возрасте 2040 лет с хорошо развитой мускулатурой,
занимающихся спортом или тяжелым физическим трудом. Основными клиническими
признаками острого тромбоза подключичной вены являются выраженный отек, цианоз,
напряжение и расширение подкожных вен верхней конечности и плечевого пояса
соответствующей стороны (чаще справа), боли. Появлению этих симптомов обычно
предшествует значительная физическая нагрузка.
Отек характеризуется плотностью и
отсутствием ямок при надавливании. Нередко он захватывает не только руку и
плечевой пояс, но и переходит на верхнюю половину грудной клетки. Расширение и
напряжение подкожных вен в ранние сроки заболевания заметно лишь в области
локтевой ямки. Впоследствии локализация расширенных вен соответствует границам
распространения отека. Цианоз кожных покровов наиболее выражен в области кисти
и предплечья.
При распространении тромбоза на
подкрыльцовую и плечевую вены течение заболевания становится тяжелым.
Нарастающий отек тканей в ряде случаев ведет к сдавливанию артериальных стволов,
вследствие чего ослабевает пульс на лучевой артерии и снижается температура
конечности. Нарушения артериального кровообращения иногда настолько
значительны, что возникает опасность развития гангрены.
После стихания острых явлений
наступает обратное развитие клинической картины.
Однако у некоторых больных полного
регресса симптомов заболевания не происходит, что позволяет выделить
хроническую стадию синдрома.
Диагностика острого тромбоза подключичной вены в
большинстве случаев не представляет трудностей. Она основывается на указанных
выше симптомах и на частой связи заболевания с физической нагрузкой. Ценным
методом исследования, позволяющим судить о локализации и распространенности
тромбоза, о степени развития коллатеральных сосудов, является флебография, при
которой контрастное вещество вводят в кубитальную вену или в одну из
поверхностных вен тыльной поверхности кисти.
В острой стадии заболевания проводится преимущественно
консервативное лечение с применением фибринолитических и антикоагулянтных препаратов,
ангиопротекторов, спазмолитиков, аналгетиков, компрессионной терапии. Показания
к хирургическому лечению определяются в зависимости от тяжести клинических
проявлений и обычно возникают при угрозе развития венозной гангрены, выраженных
регионарных гемодинамических нарушениях. При острых тромбозах подмышечной и
подключичной вен, не поддающихся консервативной терапии, выполняется
тромбэктомия, оптимальными сроками для которой являются первые дни от момента
развития клинической картины заболевания. Вопрос о реконструктивных
вмешательствах решается в первые два месяца от начала заболевания, так как
венозная гипертензия является важным фактором для обеспечения функции шунта,
поэтому более оправдано раннее применение реконструктивных операций, когда пути
коллатерального оттока крови еще недостаточно развиты.
31. Грыжи живота. Определение. Элементы
грыжи живота. Классификация грыж живота по происхождению и локализации. Общая
симптоматика грыж. Редкие формы грыж живота
ГРЫЖИ ЖИВОТА - выпячивание из брюшной
полости внутренностей вместе с покрывающим их пристеночным листком брюшины
через "слабые» места брюшной стенки под кожу (наружные грыжи) или в
различные карманы и сумки брюшины (внутренние грыжи). Различают наружные и
внутренние грыжи.
Наружные грыжи. Грыжами называется
выхождение брюшных органов, покрытых пристеночной брюшиной, через дефекты в
брюшной стенке под кожу (в отличие от ложных грыж, не имеющих брюшинного
покрытия, например, так называемые грыжи пупочного канатика, или выпадения
внутренностей наружу - эвентерации).
Внутренние грыжи - выхождение брюшных внутренностей в
различные карманы брюшины или брыжейки, или через отверстия диафрагмы - в
грудную полость (при этом органы покрыты брюшиной).
I/ по происхождению - врожденные и
приобретенные (травматические и после операционные);
/ по локализации - паховые,
бедренные, пупочные, белой линии (чаще), поясничные, промежностные, спигелиевой
линии (реже).
3/ по течению - полные и неполные, неосложненные и
осложненные.
В грыже различают - грыжевые ворота,
грыжевой мешок, грыжевое содержимое и грыжевые оболочки.
Грыжевые ворота - дефект (отверстие)
в брюшной стенке, через которое выходит грыжа. Чаще всего это врожденные
"слабые места": место выхода семенного канатика, пупочного канатика,
сосудов, нервов; при приобретенных - образованные в результате травм и
операций. Форма их различна - округлая, овальная, щелевидная, треугольная. По
размерам различают малые (до 2 см в диаметре), средние (24 см) и большие (свыше
4 см в диаметре). Они могут быть в виде каналов или кольца.
Грыжевой мешок - выпячивание
париетальной брюшины (в виде дивертикулов) через грыжевые ворота. По форме
бывают грушевидные, цилиндрические, шаровидные, в виде "песочных
часов", многокамерные. Различают устье, шейку, тело и дно. Грыжевой мешок
в недавно образованных грыжах - тонкий, полупрозрачный, гладкий - неизмененная
брюшина; в застарелых - плотный, со сращениями, рубцово изменен, снаружи часто
покрыт предбрюшинным жиром.
Грыжевое содержимое - любой орган
брюшной полости, чаще всего тонкий кишечник и сальник, реже отделы толстого
кишечника, снабженного брыжейкой (слепая, поперечноободочная, сигма),
червеобразный отросток, жировые подвески, трубы матки и яичник. Грыжевым
содержимым при разной локализации грыж могут быть практические любые органы
брюшной полости. Если в грыжевой мешок опускается орган, частично покрытый
брюшиной (слепая кишка, мочевой пузырь), он может составлять одну из стеной
грыжевого мешка это, так называемая, скользящая грыжа .
Оболочки грыжевого мешка - неодинаковы в разных
грыжах: это могут быть предбрюшинная клетчатка, фасции (поверхностная,
поперечная), волокна мышц (m. cremaster), элементы семенного канатика
Заболевание развивается постепенно,
редко сразу после физического перенапряжении, кашля.
Субъективные ощущения: а/ боли разной
интенсивности и иррадиации, усиливаются в вертикальном положении, при
физическом напряжении. Боли более выражены в начальном периоде, иногда могут
отсутствовать, б) диспепсические явления - тошнота, рвота, отрыжки, запоры; в/
дизурия (при скользящих грыжах) - наблюдаются не всегда.
Объективные данные: I/ Наличие
грыжевого выпячивания - припухлости шаровидной или овальной формы, с
неизмененной кожей, в характерном месте, появляющаяся в вертикальном положении
или при натуживании; 2/ вправимость ее (в лежачем положении), самопроизвольно
или рукой - классический признак грыжи; 3/ наличие грыжевых ворот 4/ феномен
кашлевого толчка; 5/ данные перкуссии (тимпанит при наличии в грыжевом мешке
кишки, тупость при наличии сальника); 6/ данные аускультации - урчание,
особенно в момент вправления кишки; 7/ "Шприцфеномен" - при
вправлении сальника.
Наиболее трудна диагностика грыж в начальном периоде,
когда они не контурируются или с трудом выходят. Необходимо тщательное
исследование в поисках грыжевых ворот и канала в положении лежа при
расслабленной брюшной стенке, определение "феномена кашлевого
толчка".
Запирательные грыжи выходят из брюшной полости через
запирательное отверстие таза. Canalis obturatorius имеет внутреннее и наружное
отверстия. Его ширина 1 см, длина 2,5-3 см. Грыжевой мешок формируется со
стороны таза в области запирательной ямки, затем внедряется в расширенное
внутреннее отверстие запирательного канала, проходит его и выходит через
внутреннее отверстие на медиальную поверхность бедра под приводящими мышцами.
Поясничные грыжи (herniae lumbales) Выходят из брюшной полости через
заднюю её стенку, чаще в области пространства ГрюнфельдаЛесгафта и треугольника
Пети. Они встречаются исключительно редко.
Промежностные грыжи (herniae
perineales) Выходят
из брюшной полости на промежность через дефекты диафрагмы таза. Встречаются
исключительно редко. Различают врождённые и приобретенные промежностные грыжи.
Врождённые грыжи являются следствием аномалий в развитии мускулатуры тазового
дна, приобретенные - возникают под влиянием причин, среди которых выделяют: а)
слабость тазового дна; б) нарушение целостности тазового дна после оперативных
вмешательств или травм; в) наличие внутритазовой, субперитонеальной опухоли .
По анатомическому расположению бывают передние и задние промежностные грыжи.
Граница их деления - межседалищная линия или глубокая поперечная мышца
промежности. Грыжи, выходящие впереди этой мышцы, называют передними, а
выходящие сзади - задними. Передняя промежностная грыжа у женщин развивается из
пузырноматочного углубления брюшины и проходит в щель между m. constrictor ani
и m. ischiocavernosus. Далее она расслаивает ткани, проходит в большую половую
губу, выпячивая центральную её часть. У мужчин передние промежностные грыжи
практически не наблюдаются. Этому препятствует плотная мочеполовая перегородка
с отверстием только для мочеиспускательного канала. Задняя промежностная грыжа
у мужчин начинается из пузырнопрямокишечного углубления брюшины, у женщин - из
маточнопрямокишечного. Далее грыжа проходит кзади от межседалищной линии и
через межкишечные щели выходит в клеточное пространство седалищнопрямокишечной
впадины. Наиболее частым местом прохождения грыжи через диафрагму таза являются
щели между подвздошнокопчиковой мышцей и мышцей, поднимающей задний проход,
между подвздошнокопчиковой и копчиковой мышцами, а также щели в мышце,
поднимающей задний проход.
Седалищные грыжи (hernia
ischiadicae). Грыжевое
выпячивание выходит из брюшной полости через большое или малое седалищные
отверстия. В связи с этим, выделяют три формы: а) седалищная грыжа, выходящая
над грушевидной мышцей (hernia suprapiriformis); б) седалищная грыжа, выходящая
под грушевидной мышцей (hernia infrapiriformis); в) седалищная грыжа, выходящая
через малое седалищное отверстие (hernia spinotuberosa
32.
Показания и противопоказания к грыжесечению. Основные этапы операции
грыжесечепия. Принципы надежной пластики грыжевых ворот
В основном все грыжи должны быть устранены, если
местный или системный статус больного предвещает надежный исход. Возможным
исключением из этого правила является грыжа, имеющая широкую шейку и мелкий
мешок, т. е. признаки, указывающие на возможность медленного увеличения грыжи.
Грыжевые бандажи и хирургические ремни успешно используют при лечении небольших
грыж в ситуации, когда операция противопоказана, но применение грыжевых
бандажей не рекомендуется больным, обладающим бедренными грыжами.
Противопоказания к операции: абсолютные - острая
инфекция, тяжелые заболевания - туберкулез, злокачественные опухоли, выраженная
дыхательная и сердечная недостаточность и пр. Относительные - ранний возраст
(до полугода), состояние одряхления, последние 23 месяца беременности,
стриктуры уретры, аденома предстательной железы (грыжесечение производится
после их устранения).
Операция во всех случаях складывается
из двух этапов: I/ собственно грыжесечение - выделение грыжевого мешка,
вскрытие его, вправление внутренностей, прошивание и перевязка мешка в области
шейки и отсечение его - производится одинаково при всех формах грыж; 2/
пластика (ушивание) грыжевых ворот - производится различно даже при одной и той
же форме грыж, в зависимости от этого различают разные методы грыжесечения.
Обезболивание - традиционно местное
(новокаин или лидокаин) - при небольших грыжах у взрослых, наркоз применяется
при всех других грыжах у взрослых, в том числе осложненных больших
послеоперационных грыжах и у невропатов, а также у детей.
Предоперационная подготовка гигиеническая ванна и
бритьё операционного поля, очистительная клизма накануне операции. В
послеоперационном периоде - профилактика легочных осложнений, борьба с
метеоризмом. Сроки вставания варьируют в зависимости от особенностей больного и
операции.
Последний наиболее важный этап операции пластику
грыжевых ворот производят различными способами: 1) путем сшивания местных
однородных тканей (аутопластические методы); 2) с использованием дополнительных
биологических или синтетических материалов (аллопластические методы).
33. Косая паховая грыжа. Клиническая
картина. Диагностика. Дифференциальный диагноз. Методы операций. Врожденная
паховая грыжа
Косые паховые грыжи образуются в
результате выпячивания грыжевого мешка через внутреннее паховое кольцо,
соответствующее латеральной паховой ямке. Грыжевой мешок при этом покрыт общей
влагалищной оболочкой семенного канатика и повторяет его ход.
В зависимости от стадии развития
принято различать следующие формы косых паховых грыж (по А.П. Крымову): 1)
начальная грыжа, при которой мешок определяется только в паховом канале; 2)
канальная форма дно мешка доходит до наружного отверстия пахового канала; 3)
канатиковая форма грыжа выходит через наружное от верстие пахового канала и
располагается на различной высоте семенного канатика; 4) паховомошоночная
грыжа грыжевой мешок с содержимым опускается в мошонку (у женщин в клетчатку
большой половой губы).
Врожденные паховые грыжи всегда являются косыми. Они
развиваются в случае незаращения влагалищного отростка брюшины. Последний,
сообщаясь с полостью брюшины, образует грыжевой мешок. На дне грыжевого мешка
лежит яичко, поскольку собственная его оболочка является одновременно
внутренней стенкой грыжевого мешка. Врожденные паховые грыжи нередко сочетаются
с водянкой яичка или семенного канатика.
Диагноз паховой грыжи обычно не
представляет затруднений. Характерным объективным признаком является
выпячивание передней брюшной стенки в паховой области, увеличивающееся при нату
живании и кашле. При косой паховой грыже оно имеет продолговатую форму,
располагается по ходу пахового канала, часто опускается в мошонку.
Пальцевое исследование грыжевого канала позволяет
определить его направление и дифференцировать вид грыжи. При косой паховой
грыже палец не опре деляет наличия кости при продвижении его по паховому
каналу, так как этому мешают мышечноапоневротические элементы пахового
треугольника. Не извлекая пальца из грыжевого канала, больного просят
потужиться или покашлять определяют симптом кашлевого толчка. Дифференциальная
диагностика. Паховую грыжу следует дифференцировать от бедренной грыжи, водянки
оболочек яичка, кисты семенного канатика и нукова канала, крипторхизма,
варикоцеле, пахового лимфаденита, опухолей в зоне пахового канала. При
дифференцировании грыжи, водянки, опухоли яичка целесообразно применять метод
трансиллюминации. Источник света (фонарик) устанавливают с одной стороны
мошонки, а с другой стороны с помощью какойлибо трубочки определяют свечение.
При грыже и опухоли яичка свечения нет, а при водянке оно определяется. Для
крипторхизма характерны высокое расположение «опухоли» у корня мошонки, несмещаемость
ее и невозможность вправления в брюшную полость.
Наличие паховой грыжи является
показанием к оперативному лечению. Способов восстановления и реконструкции
брюшной стенки при паховых грыжах предложено более 200. Условно их можно
разделить на три группы:
• Методы укрепления передней стенки
пахового канала без рассечения апоневроза наружной косой мышцы живота. В эту
группу входят способы Ру, РуОппеля, Краснобаева. Применяются они при
неосложненных паховых грыжах в детском возрасте.
• Методы, направленные на укрепление
передней стенки пахового канала после рассечения апоневроза наружной косой
мышцы живота (способы операции Мартынова, Жирара, Спасокукоцкого, Кимбаровского
и др.).
3. Методы герниопластики, связанные с укреплением
задней стенки пахового канала и перемещением семенного канатика. В эту группу
входят способы Бассини, Кукуджанова, МакВея, Шулдайса, Постемпского и др.
При выборе метода герниопластики необходимо помнить,
что в генезе формирования паховых грыж ведущую роль играют не слабость апоневроза
наружной косой мышцы живота и расширение наружного пахового кольца, а
ослабление задней стенки пахового канала и увеличение диаметра его глубокого
отверстия. Исходя из этой предпосылки, при всех прямых, большинстве косых грыж
и рецидивных грыжах следует пользоваться методами пластики задней стенки
пахового канала. Укрепление передней его стенки может быть при менено у детей и
молодых мужчин при небольших косых паховых грыжах. Целесообразность такой
хирургической тактики подтверждена статистикой отдаленных результатов
грыжесечения.
Особенность операции при врожденной паховой грыже
заключается в методике обработки грыжевого мешка. Последний выделяют у шейки,
перевязывают и пересекают. Дистальную часть мешка не удаляют, а рассекают ее по
всей длине вдоль, затем выворачивают и сшивают позади семенного канатика и
яичка (аналогично операции Винкельмана при водянке яичка). Пластику пахового
канала производят по одному из перечисленных выше методов.
Последовательность операции по поводу
паховой грыжи однотипна при различных методах и состоит из следующих этапов:
Первый этап формирование доступа к
паховому каналу. Обнажение пахового канала достигается разрезом кожи,
производимой параллельно паховой связке и выше ее на 2 см длиной около 1012 см.
Соответственно ране рассекается апоневроз наружной косой мышцы живота и
обнажается пупартова связка.
Второй этап выделение из окружающих
тканей и удаление грыжевого мешка. Прошивание шейки мешка перед его отсечением
производят или снаружи, или изнутри кисетным швом, но обязательно под контролем
глаза.
Третий этап ушивание глубокого
пахового отверстия до нор мальных размеров (0,60,8 см) при его расширении или
разрушении.
Четвертый этап операции пластика
пахового канала.
Большое количество операций, предложенных для лечения
паховых грыж, отличается друг от друга лишь завершающим этапом способом
пластики пахового канала.
34. Прямая и косая паховые грыжи
(анатомические и клинические различия).. Причины рецидива грыж. Методы операций
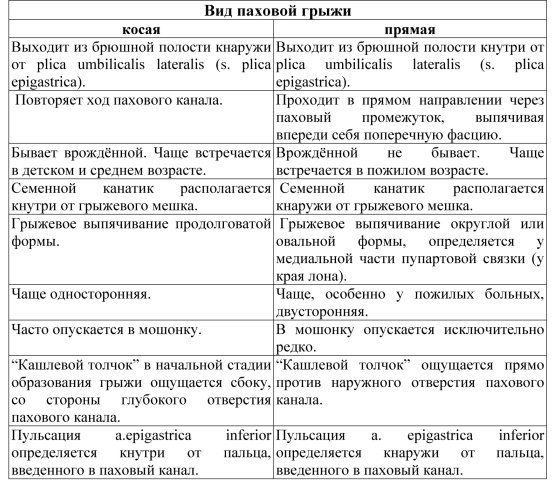
Причины рецидивирования паховых грыж многообразны. Их можно
систематизировать следующим образом: 1) причины, существующие до операции; 2)
причины, зависящие от вида произведенной операции и её технического исполнения;
3) причины, возникшие в послеоперационном периоде.
К первой группе причин рецидивов относятся:
1) поздняя операция при наличии значительных изменений тканей паховой области
(давно замечено [А.И. Барышников, 1965], что чем дольше существует грыжа, тем
более глубокие морфологические изменения она вызывает в паховом канале, тем
чаще возникают рецидивы в послеоперационном периоде); 2) пожилой возраст
больного (у этого контингента больных рецидивные грыжи наблюдаются наиболее
часто, что связано, прежде всего, с прогрессирующими дегенеративными изменениями
в тканях паховой области: особенно демонстративны в этом отношении результаты
исследований Ю.Н. Нестеренко и Ю.Б. Салова (1980), которые представлены в табл.
13); 3) наличие сопутствующих хронических заболеваний, вызывающих резкие
колебания внутрибрюшного давления (гипертрофия предстательной железы, стриктура
уретры, хронические запоры, хронический бронхит, эмфизема лёгких и т.д.); 4)
недостаточное обследование и санация больного перед операцией с оставлением в
организме очагов инфекции, которые могут привести к осложнениям
послеоперационного периода (хронический тонзиллит, гнойничковые и инфекционные
заболевания).
Ко второй группе причин рецидивов относятся: 1)
неправильный выбор метода операции, без учёта патогенетических условий
образования грыжи и тех изменений в паховом канале, которые возникают у больных
с паховыми грыжами (например, укрепление при прямых и рецидивных грыжах только
передней стенки пахового канала, оставление расширенного глубокого отверстия
пахового канала и высокого пахового промежутка); 2) грубые дефекты оперативной
техники (недостаточный гемостаз, недостаточно высокое выделение грыжевого
мешка, просмотр второго грыжевого мешка, соскальзывание лигатуры с культи
грыжевого мешка, оставление неушитой поперечной фасции или разрушение её во
время операции, сшивание тканей с большим натяжением, подшивание к паховой
связке поверхностной фасции вместо апоневроза наружной косой мышцы, подшивание
к паховой связке не всей толщи мышц, а лишь поверхностного слоя, недостаточное
отделение сшиваемых тканей от жировой клетчатки, повреждение сосудов и нервов).
При аллопластических способах операций наиболее частой причиной осложнений
является применение пластических материалов, вызывающих высокую тканевую
реакцию.
К третьей группе причин рецидивов
относятся: 1) воспалительные осложнения со стороны операционной раны
(нагноение, инфильтраты, лигатурные свищи); 2) ранняя нагрузка на ещё не
сформировавшийся рубец; 3) тяжёлая физическая работа в позднем
послеоперационном периоде.
Способ Жирара. Пластика пахового канала производится
путем подшивания внутренней косой и поперечной мышц живота к пупартовой связке
поверх семенного канатика. Затем к пупартовой же связке подшивают внутренний
листок рассеченного апоневроза наружной косой мышцы живота. Поверх него
пришивают наружный листок апоневроза, создавая таким образом апоневротическую
дупликатуру. Формируют наружное отверстие пахового канала так, что бы оно
пропускало кончик пальца (семенной канатик). Накладывают швы на кожу.
Способ Спасокукоцкого. Отличается от способа Жирара
тем, что к паховой связке подшиваются одновременно (одним швом) внутренняя
косая и поперечная мышцы вместе с внутренним листком апоневроза наружной косой
мышцы живота. Затем так же создается дугошкатура из листков апоневроза.
Способ Кимбаровского (швы Кимбаровского) является наи
более часто применяемой в клинической практике модификацией операции
ЖирараСпасокукоцкого . Суть модификации в использовании при пластике
оригинальных швов, обеспечивающих сопоставление однородных тканей. Для этого
первый вкол иглы делают, отступя 1 см от края верхнего листка апоневроза. Игла
проходит через всю толщу подлежащих мышц и возвращается на переднюю поверхность
апоневроза у самого его края. Затем этой же иглой захватывают паховую связку.
Остальные швы накладывают таким же образом. При затягивании нитей верхний
листок апоневроза подворачивается и прикрывает мышцы. В результате спереди от
семенного канатика к паховой связке подшиваются края мышц, окутанных
апоневрозом.
Способ Мартынова. Этапы операции такие же, как при
способе Жирара. Пластику производят путем подшивания внутреннего листка
апоневроза косой мышцы живота к пупартовой связке с последующим формированием
дупликатуры из апоневроза.
35. Прямая паховая грыжа. Клиническая
картина. Диагностика. Дифференциальный диагноз. Методы операций. Скользящая
грыжа: особенности строения и хирургической техники
Важной анатомофизиологической
предпосылкой для образования прямых паховых грыж являются возрастные
атрофические процессы в мышцах, апоневрозах, связочном аппарате и нервных
волокнах. Паховый промежуток при этом увеличивается, и клапанная функция мышц
отсутствует, что объясняет факт довольно частого образования двусторонних
паховых грыж у стариков.
Грыжевой мешок при прямой паховой
грыже округлой формы покрыт слоем предбрюшинной клетчатки и резко растянутой
поперечной фасцией. По отношению к семенному канатику он располагается кнутри,
легко отделяется от него во время операции. Паховый промежуток всегда высокий.
Передняя стенка канала растягивается грыжевым выпячиванием. Постепенно
расширяется и наружное паховое отверстие. Прямая паховая грыжа редко достигает
больших размеров, этому препятствуют поперечная фасция и апоневроз наружной
косой мышцы живота.
Таким образом, при прямой паховой
грыже наблюдается, прежде всего, недостаточность задней стенки пахового канала,
которая может касаться или всей стенки, или её части.
Прямая паховая грыжа начинается с выпячивания в
апоневрозе поперечной мышцы живота в задней стенке пахового канала в треугольнике
Гессельбаха. После начала выпячивания постепенно начинает изгибаться
апоневротическая дуга. Грыжевые ворота начинают увеличиваться прежде всего
вверх, так как снизу и медиально они ограничены плотными апоневротическими
структурами.
Способ Бассини. Это классический способ
укрепления задней стенки пахового канала, имеющий множество модификаций.
Восстановление ослабленной задней стенки при этом способе достигается путем
подшивания под семенным канатиком внутренней косой и поперечной мышц вместе с
поперечной фасцией живота к паховой связке. Семенной канатик укладывается на
образованную мышечную стенку. Края апоневроза наружной косой мышцы живота
сшиваются над семенным канатиком край в край). Метод Бассини в клас сическом
варианте редко применяется в клинической практике. Слабым местом этой операции
считается сопоставление швами разнородных тканей: захваченные в шов мышцы со
временем могут атрофиро ваться и рубцово перерождаться.
Способ Кукуджанова . При этом способе
операции укрепление задней стенки пахового канала производится: а) в медиальном
отделе пахового промежутка путем подшивания наружного края влагалища прямой
мышцы живота к верхней лобковой (Куперовой) связке 34 швами; б) в латеральном
отделе к паховой связке подшивают соединенное сухожилие внутренней косой и поперечной
мышц живота вместе с краями рассеченной поперечной фасции. Апоневроз наружной
косой мышцы живота сшивают дупликатурой над семенным канатиком. Достоинством
этой операции является не только механическое укрепление задней стенки пахового
канала, но и уменьшение пахового промежутка с восстановлением клапанной функции
пахового канала.
Способ Постемпского. Этот способ герниопластики
заключается в полной ликвидации пахового канала, пахового промежутка и в
создании пахового канала с совершенно новым направлением. К лобковоподвздошному
тяжу и пупартовой связке подшивают четыре анатомических слоя: апоневроз
наружной косой мышцы живота, внутреннюю и поперечную мышцы, поперечную фасцию,
захватывая их в один шов. В первые медиальные швы захватывают край влагалища
прямой мышцы живота, подшивая его к верхней лоб ковой связке. Под семенным
канатиком формируется и дупликатура из листков апоневроза наружной косой мышцы
живота. Вновь созданный «паховый канал» с семенным канатиком должен проходить
через мышечноапоневротический слой в косом направлении так, чтобы его наружное
отверстие находилось несколько латеральное по отношению к внутреннему
отверстию. Семенной канатик укладывают на апоневроз и над ним сшивают подкожную
клетчатку и кожу.
Скользящие грыжи. Скользящими грыжами называются
грыжи, в которых одной из стенок грыжевого мешка является орган, частично
покрытый брюшиной. Скользящие грыжи составляют около 1,5% всех паховых грыж. По
механизму возникновения они могут быть врожденными и приобретенными. Больные
при скользящих грыжах могут жаловаться на запоры, боли в животе во время
дефекации, дизурические расстройства. Наличие этих симптомов требует
дополнительного обследования с проведением ирриго скопии, цистографии,
бимануального гинекологического исследования у женщин
Диагностика скользящих паховых грыж
до операции очень важна, так как определяет действия хирурга во время операции,
исключая случайное ранение органов. Наличие скользящей грыжи следует
предполагать в следующих случаях: 1) при длительно существующих грыжах больших
размеров с широкими грыжевыми воротами; 2) при многократно рецидивирующих
грыжах, когда нередко происходит разрушение задней стенки пахового канала; 3)
при наличии жалоб больного, характерных для соскальзывания того или иного
органа; 4) при частичной или полной невправимости грыжи; 5) когда при пальпации
грыжевого мешка (после вправления содержимого) определяется тестоватость
консистенции; иногда грыжевое выпячивание состоит как бы из двух частей, одна
из которых более утолщена; 6) когда наблюдается мочеиспускание в два приёма
(при скользящих грыжах мочевого пузыря вначале больной опорожняет мочевой
пузырь, а затем, после вправления грыжи, у него появляется новый позыв к
мочеиспусканию).
При подозрении на наличие скользящей
грыжи целесообразно применить дополнительные методы исследования: ирригоскопию,
цистографию, цистоскопию, бимануальное гинекологическое исследование. Если
возникла мысль о вовлечении в процесс мочеточника или почки, то необходимо
произвести инфузионную урографию.
Важные дополнительные сведения о
грыже даёт УЗИ. И.В. Бобковой и В.В. Божко (1999) разработана методика УЗИ,
позволяющая визуализировать основные анатомические структуры паховой области:
отличить косую грыжу от прямой, высоту пахового промежутка, размеры
поверхностного и глубокого отверстий, характер содержимого грыжевого мешка при
невправимой грыже.
В.В. Кисляковым (2002) разработана методика УЗИ
диагностики скользящих грыж, а также определения характера предыдущей операции
при рецидивных и многократно рецидивировавших грыжах.
36. Паховые грыжи, Грыжесечение по
Кукуджанову. Отношение связки Купера к пупартовой . Грыжесечение по Мартынову
Последовательность операции по поводу паховой грыжи
однотипна при различных методах и состоит из следующих этапов:
Первый этап формирование доступа к паховому каналу.
Обнажение пахового канала достигается разрезом кожи, производимой параллельно
паховой связке и выше ее на 2 см длиной около 1012 см. Соответственно ране
рассекается апоневроз наружной косой мышцы живота и обнажается пупартова
связка.
Второй этап выделение из окружающих тканей и удаление
грыжевого мешка. Прошивание шейки мешка перед его отсечением производят или
снаружи, или изнутри кисетным швом, но обязательно под контролем глаза.
Третий этап ушивание глубокого пахового отверстия до
нор мальных размеров (0,60,8 см) при его расширении или разрушении.
Четвертый этап операции пластика пахового канала.
Способ Кукуджанова . При этом способе операции
укрепление задней стенки пахового канала производится: а) в медиальном отделе
пахового промежутка путем подшивания наружного края влагалища прямой мышцы
живота к верхней лобковой (Куперовой) связке 34 швами; б) в латеральном отделе
к паховой связке подшивают соединенное сухожилие внутренней косой и поперечной
мышц живота вместе с краями рассеченной поперечной фасции. Апоневроз наружной
косой мышцы живота сшивают дупликатурой над семенным канатиком. Достоинством
этой операции является не только механическое укрепление задней стенки пахового
канала, но и уменьшение пахового промежутка с восстановлением клапанной функции
пахового канала.
Способ Мартынова. Этапы операции такие же, как при
способе Жирара. Пластику производят путем подшивания внутреннего листка
апоневроза косой мышцы живота к пупартовой связке с последующим формированием
дупликатуры из апоневроза.
37. Бедренные грыжи. Анатомия бедренного
канала. Клиника. Диагностика. Дифференциальный диагноз. Методы операций
Бедренными называют грыжи, которые
выходят через бедренный канал. По частоте образования они составля ют 58% от
всех грыж живота. Бедренные грыжи чаще наблюдаются у женщин (5:1), что
обусловлено анатомическими особенностями строения таза у них. Врожденных
бедренных грыж не бывает, так как бедренного канала как анатомического
образования, в отличие от пахового канала, не существует.
По расположению бедренной грыжи различают следующие ее
разновидности: мышечнолакунарную, предсосудистую, сосудисто лакунарную,
гребешковую. Наиболее частой, типичной, является сосудистолакунарная ее
разновидность, при которой грыжа выходит из брюшной полости между жимбернатовой
связкой и бедренными сосудами. Грыжевой мешок, выйдя изпод пупартовой связки,
располагается в овальной ямке кнутри от бедренной вены и кпереди от
горизонтальной ветви лобковой кости.
Клиника и диагностика. Бедренные
грыжи чаще, чем паховые, представляют трудности для диагностики, чаще
ущемляются и имеют более коварное течение.
Грыжи этой локализации
характеризуются небольшой (размерами с орех) припухлостью, расположенной ниже
пупартовой связки в зоне овальной ямки бедра. Больные обычно жалуются на боли в
паху с иррадиацией в ногу, диспептические расстройства. При скользящих грыжах
мочевого пузыря могут отмечаться дизурические расстройства. Нередко первым
клиническим проявлением бедренной грыжи является ее ущемление.
Дифференциальная диагностика. Бедренную грыжу
дифференцируют с паховой грыжей, липомой, располагающейся под пупартовой
связкой, лимфаденитом, метастазами опухоли в лимфатические узлы, натечным
абсцессом при туберкулезе позвоночника, варикозным узлом большой подкожной вены
в овальной ямке, аневризмой бедренных сосудов.
Лечение. Склонность бедренной грыжи к
ущемлению диктует необходимость ее оперативного лечения возможно раньше.
Предложено более 100 способов операций для устранения бедренных грыж, которые в
зависимости от доступа к грыжевым воротам делят на две группы: бедренные и
паховые.
Бедренные способы. Эти способы
характеризуются подходом к бедренному каналу со стороны его наружного
отверстия. Преимуществом этого доступа является наименьшая травматичность и
быстрота выполнения операции, недостатком наибольшее число рецидивов.
Способ Локвуда. Разрез делают над
грыжевым выпя чиванием параллельно и ниже паховой связки. После удаления грыжевого
мешка грыжевые ворота закрывают путем подшивания 34 швами пупартовой связки в
области внутреннего бедренного кольца к надкостнице лонной кости.
Способ Бассини. Пластику
осуществляют, как и при предыдущем способе, сшивая пупартову связку с
надкостницей лонной кости. Первый шов накладывают рядом с лонным бугорком, последний
на 1 см кнутри от бедренной вены. Затем накладывают дополнительный ряд швов
между серповидным краем широкой фасции бедра и гребешковой фасцией, с тем чтобы
укрепить наружное отверстие бедренного канала.
Паховые способы. Преимуществами
паховых способов являются возможность максимально высокой перевязки и отсечения
грыжевого мешка, а также удобное и надежное ушивание внутреннего отверстия
бедренного канала. Операции паховым доступом дают меньше рецидивов. К
недостаткам их можно отнести большую длительность и техническую сложность
выполнения.
Способ Руджи. Разрез делают, как при
паховой грыже. Вскрывают паховый канал, поперечную фасцию и в забрюшинной
клетчатке, у внутреннего отверстия бедренного канала, тупо выделяют шейку
грыжевого мешка. Последний выводят из бедренного канала в рану, вскрывают,
прошивают у шейки и удаляют. Грыжевые ворота закрывают путем подшивания паховой
связки к куперовской связке. Операция заканчивается восстановлением пахового
канала.
Способ Парлавеччио. Этапы операции, как и при способе
Руджи. Пластика грыжевых ворот производится путем наложения швов между лонной и
паховой связками. Вторым рядом швов подшивают внутреннюю косую и поперечную
мышцы к паховой связке.
38. Пупочные грыжи. Клиника. Диагностика.
Дифференциальный диагноз. Методы операций. Особенности лечения пупочных грыж в
детском возрасте
Пупочные и околопупочные грыжи. Пупочными и
околопупочными называют такие грыжи, при которых грыжевыми воротами являются
дефекты брюшной стенки в области пупка. По происхождению, анатомическим и
клиническим признакам, принято различать: 1) эмбриональные пупочные грыжи; 2)
пупочные грыжи у детей; 3) пупочные грыжи у взрослых.
Эмбриональные пупочные грыжи относятся к врожденным
порокам развития, являясь следствием задержки формирования передней брюшной
стенки плода. Грыжевой мешок при этом представляет собой амниотическую оболочку
пуповины с покрывающей ее изнутри недоразвитой внутренней оболочкой
(предшественницей брюшины).
Пупочные грыжи у детей являются дефектом развития
передней брюшной стенки. Возникают они в первые месяцы жизни, чаще у девочек.
Расширению пупочного кольца и образованию грыжи способствуют все факторы,
вызывающие резкое повышение внутрибрюшного давления. Грыжи у детей обычно
небольших размеров.
Пупочные грыжи у взрослых. Пупочные грыжи у взрос лых
составляют 35% от всех наружных грыж живота. Они возникают преимущественно у
женщин старше 40 лет, особенно у многорожав ших и страдающих ожирением. У
тучных пациенток образование и постепенное увеличение околопупочных грыж часто
сочетается возникновением отвислого живота.
Величина грыжи может быть самой различной от
нескольких сантиметров в диаметре до гигантских. Следует помнить об одной
особенности грыж этой локализации: даже при очень больших грыжах грыжевые
ворота обычно небольшие и редко достигают более 10 см в диаметре. Это облегчает
пластику грыжевых ворот, но вместе с тем предрасполагает к возникновению таких
осложнений, как каловые завалы, хроническая непроходимость кишечника, ущемление
грыжи.
Диагностика. Небольшие пупочные грыжи могут протекать
бессимптомно. При больших грыжах возникают болевые ощущения в области пупка,
которые усиливаются после еды и физической нагрузки, появляется запор.
Диагностика пупочных грыж несложна и обычно не представляет затруднений. И только
при невправимых грыжах небольших размеров существуют определенные трудности в
постановке диагноза.
Лечение. Лечение пупочных грыж оперативное. У детей
возможно самоизлечение в период 36 лет. Если в течение этого срока заращения
пупочного кольца не произошло им также показано хирургическое лечение.
При операциях по поводу околопупочных грыж больших
размеров необходимо помнить, что быстрое перемещение содержимого грыжевого
мешка в брюшную полость может вызвать расстройства дыхания и сердечнососудистой
деятельности вследствие значительного повышения внутрибрюшного давления. Таким
больным необходима специальная подготовка к операции в виде постепенных
нагрузок, связанных с увеличением внутрибрюшного давления (бинтование живота и
т.д.).
Основными операциями, которые применяют для лечения
пупочных и околопупочных грыж, являются аутопластические методы Лексера,
Сапежко и Мейо.
Способ Лексера. Применяется этот способ в основном у
детей при небольших грыжах. После удаления грыжевого мешка дефект в апоневрозе
ушивается кисетным швом.
Способ Сапежко. Разрез над грыжевым выпячиванием
продольный. Грыжевые ворота рассекают вверх и вниз до мест, где белая линия
живота суживается и выглядит неизмененной. Брюшину отслаивают ножницами на 24
см от задней поверхности влагалища одной из прямых мышц. Затем края
рассеченного апоневроза накладывают один на другой и сшивают, создавая
дупликатуру из мышечноапоневротических лоскутов шириной 24 см.
Способ Мейо. Двумя поперечными разрезами иссекают кожу
вместе с пупком (об удалении пупка больного следует поставить в известность
заранее). После иссечения грыжевого мешка грыжевые ворота расширяют в
поперечном направлении до внутренних краев прямых мышц живота. Нижний лоскут
апоневроза несколькими Побразными швами подшивают под верхний. Край верхнего
лоскута затем фиксируется узловыми швами к нижнему в виде дупликатуры
39. Диастаз прямых мышц живота.
Определение понятия. Клиника. Диагностика. Дифференциальный диагноз. Лечение
Расхождение прямых мышц живота
развивается преимущественно в верхнем отделе белой линии, которая от
мечевидного отростка до пупка имеет наибольшую ширину по сравнению с участком
ее ниже пупка. Благоприятствуют расхождению прямых мышц живота врожденная
слабость брюшной стенки, растяжение и истончение белой линии в связи с
перенапряжением ее. Особо выделяются диастазы, развивающиеся одновременно с
грыжами белой линии и большими пупочными, а также после операций, проведенных с
рассечением белой линии в продольном направлении как выше пупка, так и ниже.
Размеры выпячивания при диастазе и края его хорошо определяются при осмотре
больного в положении лежа. Приподнятие головы и туловища сопровождается
характерным для диастаза выпячиванием, которое обычно не сопровождается
болевыми ощущениями. При ощупывании хорошо определяются края влагалищ прямых
мышц. При значительном расхождении прямых мышц живота одновременно наблюдаются
и функциональные изменения всей брюшной стенки с ослаблением брюшного пресса,
атрофическими процессами в мышцах, истончением апоневрозов.
Нарушение внутрибрюшного равновесия
сопровождается опущением органов брюшной полости, в связи с чем при
значительном расхождении прямых мышц выявляется клиника спланхоптоза. Ширина
расхождения прямых мышц больше выражена на середине расстояния между мечевидным
отростком и пупком.
В основном больные жалуются на боли в
животе, диспепсические явления, ощущение тяжести в животе, метеоризм, запоры,
затрудненную ходьбу.
По данным Б. А. Баркова (1958),
обследовавшего 81 больную с так называемыми чистыми диастазами без сопутствующих
грыж белой линии, 54 больные предъявляли жалобы на отрыжку, изжогу, тошноту,
рвоту, ощущения тяжести в животе, метеоризм, запоры. При рентгенологическом
обследовании 150 больных с диастазами прямых мышц живота было обнаружено, что у
84,7 % желудок располагался на уровне гребешковой линии и ниже. Понижение
кислотности желудочного сока наблюдалось у 56,2 % больных.
В связи с отсутствием типичных
грыжевых ворот при расхождении прямых мышц ущемления органов брюшной полости не
наблюдается.
Показания к операции по поводу
расхождения прямых мышц должны ставиться весьма ограниченно после всестороннего
обследования больного и перспективной оценки ближайших и отдаленных результатов
операции. Из операций, проводящихся без вскрытия влагалища прямых мышц,
анатомически обоснована методика А. В. Мартынова. Эллипсовидным разрезом
иссекают избыток кожи. Апоневроз наружной косой мышцы обнажают в обе стороны.
На всем протяжении диастаза рассекают апоневроз на 1 см от края влагалища левой
прямой мышцы живота и вскрывают брюшную полость. Образуются два неодинаковых
брюшинноапоневротических лоскута; края их захватывают несколькими зажимами,
оттягивают в стороны. Края влагалищ прямых мышц выступают; начиная сверху, на
края влагалищ накладывают ряд швов. Таким образом, прямые мышцы сближают до
соприкосновения без вскрытия их влагалищ. Свободный край апоневроза у влагалища
правой прямой мышцы накладывают спереди и пришивают на всем протяжении разреза
к апоневрозу влагалища левой прямой мышцы
При диастазе прямых мышц применима
операция Н. И. Напалкова без вскрытия брюшины со сшиванием в два этажа
рассеченных краев влагалища прямых мышц живота . Целесообразно в некоторых
случаях при диастазе применить метод наложения швов по Кунцу (1962), при
котором тесно сближаются края растянутой белой линии и натяжение после операции
распределяется равномерно .
40. Грыжи белой линии живота: клиника,
диагностика, дифференциальный диагноз, методы операций
В белой линии живота имеются
щелевидные промежутки, через которые проходят сосуды и нервы, связующие
предбрюшинную клетчатку с подкожной. Эти щели и являются местами выхода грыж.
Типичным местом локализации грыж является верхняя часть белой линии, поэтому
эти грыжи называют еще эпигастральными. Реже встречаются грыжи околопупочные и
подчревные. Грыжи белой линии составляют 34% от всех наружных грыж живота.
Формирование грыжи белой линии живота
начинается с проникновения предбрюшинной клетчатки в щели апоневроза с
образованием так называемой «предбрюшинной липомы». Сдавление этого образования
может обусловливать возникновение выраженного болевого синдрома, напоминающего
клиническую картину некоторых заболеваний органов брюшной полости язвенной
болезни, холецистита, панкреатита и др. С течением времени вслед за жировой
клетчаткой в апоневротическую щель выпячивается брюшина и формируется истинная
грыжа. Содержимым грыж белой линии чаще всего бывает сальник, реже петли
тонкой и стенка поперечноободочной кишок.
Клиника и диагностика. Грыжи белой
линии живота могут протекать бессимптомно. Чаще больные отмечают боли в
эпигастральной области, усиливающиеся при пальпации, натуживании или после еды.
Нередки диспептические расстройства (тошнота, изжога, запоры), что вызывает
необходимость комплексного обследования иольных.
Наличие вправимого или невправимого выпячивания
по белой линии, увеличивающегося при натуживании, позволяет обычно правильно
поставить диагноз. У лиц с выраженной подкожножировой клетчаткой возникают
определенные трудности в обнаружении грыжевого выпячивания.
Эпигастральным грыжам часто сопутствует
расхождение (дчастаз) прямых мышц живота. Определение величины этого
расхождения производят на середине расстояния между мечевидным отростком и
пупком. Различают три стадии диастаза прямых мышц живота: I ст. до 57 см, II
ст. более 7 см, III ст. большой диастаз в сочетании с отвислым животом.
Дифференциальный диагноз грыж белой
линии живота следует проводить с язвенной болезнью желудка и двенадцатиперстной
кишки, гастритом, холециститом, панкреатитом, аппендицитом. Для исключения
упомянутых заболеваний необходимо детальное лабораторное и рентгенологическое
исследование желудочно кишечного тракта. Лечение оперативное. Для устранения
грыж белой линии живота применяются те же методы операций, что и для лечения пупочных
и околопупочных грыж (способы Сапежко и Мейо). При сопутствующем грыже
расхождении прямых мышц живота производят дупликатурную перестройку белой линии
от мечевидного отростка до пупка (способы апоневротической пластики Напалкова
или Мартынова).
Способ Напалкова. После удаления
грыжевого мешка края апоневроза сшиваются край в край. Затем рассекают
влагалища прямых мышц живота вдоль по внутреннему краю и сшивают сначала
внутренние, а затем наружные края разрезов апоневротиче ского влагалища.
41.
Послеоперационные грыжи живота (вентральные). Причины, клиника, диагностика.
Осложнения. Методы операций. Ущемление в грыжевом мешке
Грыжа послеоперационная (hernia postoperative) является грыжей живота, выходящей через дефект
послеоперационного рубца.
В группу послеоперационных грыж
объединены выпячивания брюшной стенки после произведенных рассечений ее в связи
с заболеваниями или повреждениями органов брюшной полости, травмы или ранения
брюшной стенки. Послеоперационной грыже присущи все элементы грыжи: грыжевые
ворота, грыжевой мешок, грыжевое содержимое (выпадающие внутренности) и
покрывающие мешок наружные ткани. Основной особенностью является образование ее
в области послеоперационного рубца. С этой точки зрения термин «вентральная
грыжа» менее точно определяет существо патологии.
Послеоперационные грыжи наблюдаются в
тех анатомических областях, где обычно проводятся разрезы для доступа к органам
брюшной полости. При огнестрельных ранениях и других проникающих повреждениях
живота они могут локализоваться на любом участке брюшной стенки.
Частота образования послеоперационных грыж разными
авторами указывается неодинаковая и приводимые ими цифры существенно
отличаются. Важно иметь в виду, что наиболее часто грыжа появляется после косых
и поперечных разрезов брюшной стенки, когда значительно нарушается целостность
мышечноапоневротических структур.
Формирование послеоперационной грыжи
обусловлено многими факторами. Основными из них являются неадекватный выбор
хирургического доступа, нагноение послеоперационной раны, эвентрация и наличие
предрасполагающих причин.
Неадекватность выбора операционного
доступа состоит в том, что лапаротомия производится без учета
анатомофизиологических условий. Разрез передней брюшной сТенки в
этих случаях вызывает существенные нарушения кровообращения и иннервации тканей
с последующими стойкими изменениями в них. Причинами, предрасполагающими к
развитию послеоперационных грыж, служат истощение, авитаминоз, гипопротеинемия,
сопутствующие заболевания (сахарный диабет, ожирение и др.), повышение
внутрибрюшного давления в результате пареза кишечника, кашля, ранних физических
нагрузок и т. д.
Классификация. В практической
деятельности наиболее приемлемым является деление послеоперационных грыж по
локализации, величине дефекта брюшной стенки и выпячивания. В особую группу
выделяются послеоперационные рецидивные грыжи.
В зависимости от локализации
различают срединные (верхние и нижние) и боковые (верхние, нижние, лево и
правосторонние). По величине выделяют малые, большие и громадные. К рецидивным
относят повторные (многократные) рецидивы.
Основным симптомом заболевания
является наличие выпячивания (деформации) в области послеоперационного рубца.
Наиболее часто оно возникает в первые 6 месяцев после операции. Болевые
ощущения не являются характерными признаками, хотя они могут сопровождать
формирование грыжи. Боль, как правило, не бывает сильной. Чаще больные
испытывают неприятное чувство в виде «выпирания» внутренностей или тяжести,
особенно при физической нагрузке. В зависимости от органа, входящего в грыжевой
мешок, они могут отмечать диспептические явления (отрыжка, тошнота, запор). При
послеоперационной грыже, располагающейся над лобком, больные иногда жалуются на
расстройство мочеиспускания.
Грыжевое выпячивание на ранних
стадиях развития является вправимым и практически не ограничивает трудовую
активность больного. С развитием заболевания выпячивание не только
увеличивается, но и может стать частично или полностью невправимым. В грыжевом
мешке могут находиться почти все органы брюшной полости. Эти изменения
способствуют увеличивающемуся ослаблению всей брюшной стенки. Происходит
растяжение прямых мыщц живота. Растянутый рубец истончается, развиваются
воспалительные изменения вплоть до образования эрозии и язв, через брюшную
стенку можно увидеть перистальтику петель кишечника. Резко снижается активность
больных, развиваются явления спланхоптоза. Постепенно заболевание отягощается
не только значительными нарушениями функции желудочнокишечного тракта, но и
развитием существенных изменении в сердечнососудистой системы. Выпячивание особенно
хорошо заметное при натуживании, кашле и в положении стоя. Небольшие
выпячивания лучше определяются в лежачем положении больного при активном
поднимании им головы и верхней части туловища без опоры на локти
Лечение послеоперационных грыж может
быть только оперативным При определении показании к операции и сроках ее
проведения следует учесть те обстоятельства, что грыжи имеют тенденцию к
постоянному увеличению. Хирургическое лечение послеоперационных грыж брюшной
стенки производят различными способами.
При небольших грыжах в ранние сроки
благоприятные результаты обеспечивает простое восстановление анатомических
соотношений. При этом необходимо иметь в виду, что, независимо от размера
грыжи, следует тщательно выделить края грыжевого отверстия, а брюшину ушить
после удаления грыжевого мешка. Для закрытия дефекта брюшной стенки лучшим
пластическим материалом являются собственные ткани, а оптимальным способом их
использования - метод создания дупликатуры за счет фасциальноапоневротических
образований в области грыжевых ворот.
Небольшие послеоперационные грыжи
можно оперировать под местным обезболиванием по А. В. Вишневскому.
Операция при больших длительно
существующих грыжах представляет особые трудности, вопервых, изза возможной
необходимости проведения дополнительных вмешательств по ликвидации сращений
содержимого грыжи с грыжевым мешком и, вовторых, изза необходимости особых
восстановительных манипуляций по устранению больших дефектов брюшной стенки.
Техника операции при этих грыжах
сложна и требует специального опыта их проведения. Даже иссечение кожного рубца
при истонченных грыжевых оболочках требует самых осторожных действий хирурга,
чтобы случайно не повредить внутренние органы. Не меньшие трудности в этом
отношении возникают и при высвобождении сальника, петель кишечника из грыжевого
мешка. Выраженный спаечный процесс, фиксирующий органы между собой и брюшной
стенкой, может значительно изменить топографоанатомические взаимоотношения. Эти
трудности существенно возрастают при наличии многокамерного грыжевого мешка.
Для закрытия больших грыжевых
дефектов применяют методы аутопластики, аллопластики и методы комбинированной
(сочетанной) пластики. Такие операции по восстановлению целостности брюшной
стенки особый раздел в хирургии послеоперационных грыж, который, несмотря на
достижение заметных успехов, все еще находится на стадии поисков.
В восстановительной хирургии основным
методом остается аутопластическии использование тканей самого больного.
Наиболее широкое Распространение получила Фасциальноапоневротическая пластика.
В трудных ситуациях, прежде всего при атрофически измененных тканях, когда даже
формирование дупликатуры не ведет к скольконибудь существенному укреплению
стенки живота или ее (дупликатуру) невозможно создать, для закрытия дефекта
брюшной стенки используется лоскут широкой фасции бедра.
В последние годы достаточно широкое
распространение нашел метод аллопластического закрытия больших грыжевых
дефектов. Для этой цели используют различные материалы (лавсан, тефлон, капрон,
тантал и др.). Применение сеток из синтетической ткани или танталовых нитей
упрощает оперативное вмешательство, делает его менее травматичным и
продолжительным и, тем самым, более безопасным.
Основное достоинство аллопластики в
том, что этот метод почти незаменим в случаях, когда имеется обширный дефект в
мышечноапоневротических структурах, а ткани почти не дифференцируются, и
закрыть дефект ими не удается. Аллопластика является также методом выбора при
повторных рецидивах послеоперационных грыж.
По мнению многих хирургов, наиболее
целесообразным представляется метод комбинированной (сочетанной) пластики с
максимальным использованием тканей больного, вплоть до рубцовоизмененных.
Имплантированный между слоями рубцовоизмененных тканей аллопластический
материал может быть применен как каркас. При этом уменьшается натяжение
сшиваемых тканей и, следовательно, улучшаются условия для их срастания. Этому в
немалой степени способствует общее обезболивание и релаксация мышц передней
брюшной стенки.
42. Осложнения грыж живота: воспаление,
невправимость, копростаз, ущемление, травма. Определение понятия. Клиника,
диагностика, дифференциальный диагноз, лечение
Ущемление это опасное осложнение
грыжи. Развитие его может быть внезапным или постепенным. Под ущемлением грыжи
понимают сдавление содержимого грыжи в ее воротах.
Возникает при повышении давления в
брюшной полости вследствие необычных физических нагру. зок во время работы,
спортивных упражнений и даже при кашле, чихании и т. д. Однако оно может
развиться вследствие перекрута, перегиба петли тонкой кишки или другого органа
в грыжевом мешке, при переполнении участка кишки, находящегося в грыжевом
мешке, каловыми массами.
Невправимая грыжа. Невправимой
называют грыжу, содержимое которой невозможно вправить в брюшную полость.
Невправимой грыжа становится в результате образования сращений внутренних
органов между собой и с грыжевым мешком. Невправимость может быть полной или
частичной. Довольно часто невправимые грыжи бывают многокамерными. В отличие от
ущемления грыжевое выпячивание при невправимости обычно остается неизмененным
по величине и форме, но при натуживании может увеличиваться в объеме. При
пальпации невправимая грыжа безболезненна или слабо болезненна, при перкуссии
дает тупой звук. Общее состояние больного удовлетворительное.
Копростаз. Копростаз (каловый застой)
в грыжевом мешке наблюдается обычно у пожилых и старых больных, склонных к
запорам. Способствующими факторами являются ожирение, малоподвижный образ
жизни, обильная еда. Явления копростаза развиваются медленно и сопровождаются
упорными запорами, болями, тошнотой, общим недомоганием. Грыжевое выпячивание
медленно увеличивается, оно почти безболезненно (в отличие от ущемленной
грыжи), тестообразной консистенции. Симптом кашлевого толчка определяется, что
также свидетельствует об отсутствии ущемления грыжи.
Лечение при копростазе
консервативное. Оно заключается в освобождении толстой кишки от содержимого.
Это достигается с помощью легкого массажа грыжевого выпячивания, повторных
клизм с вазелиновым маслом или с глицерином, опорожнения желудка с помощью
зонда. Применение слабительных средств противопоказано, так как возникающее при
этом переполнение приводящей петли способствует переходу копростаза в каловую
форму ущемления.
Воспаление грыжи. Это осложнение
возникает вследствие инфицирования грыжевого мешка. Воспалительный процесс, как
правило, начинается со стороны грыжевого содержимого. Однако проникновение
инфекции в грыжевой мешок возможно и с кожных покровов, и из брюшной полости.
Воспаление грыжи протекает обычно в острой форме и может быть серозным,
серознофибринозным, гнойным и гнилостным. Реже наблюдается хроническое
воспаление (туберкулез грыжи).
Клиническая картина воспаления грыжи
характеризуется тем, что процесс возникает остро, сопровождается резкими
болями, рвотой, повышением температуры, напряжением и болезненностью в области
грыжевого выпячивания, чем напоминает клинику ущемления грыжи. При
дифференциальной диагностике этих осложнений грыжи, необходимо иметь в виду,
что ущемлению обычно предшествует внезапное повышение внутрибрюшного давления с
последующим быстрым нарастанием клинических проявлений острой кишечной
непроходимости. При воспалении же грыжи имеются более выраженные воспалительные
изменения со стороны крови и в области грыжевого выпячивания.
Лечение воспаления грыжи, если оно
вызвано инфицированием со стороны грыжевого содержимого, заключается в срочной
операции с удалением источника инфицирования. Если причиной инфицирования грыжи
являются воспалительные процессы на кожных покровах, то проводится консервативное
лечение.
43. Ущемленная грыжа. Определение
понятия. Виды ущемления. Патологоанатомические и патофизиологические изменения
в различных участках (отделах) ущемленного органа. Клиника ущемления.
Дифференциальный диагноз
Под ущемлением грыжи понимают внезапно возникающее
сдавление грыжевого содержимого в грыжевых воротах с последующим ишемическим
некрозом находящихся в грыжевом мешке органов и тканей. Ущемление наиболее
частое и опасное осложнение грыжи. Оно возникает у 1015% больных с грыжами. В структуре
острых хирургических заболеваний органов брюшной полости ущемленные грыжи
занимают 34 место и составляют около 4,5%. Среди больных с ущемленными грыжами
преобладают лица пожилого и старческого возраста.
С точки зрения механизма
возникновения ущемленной грыжи различают два принципиально различных типа
ущемления: эластическое и каловое . Возможно также сочетание того и другого
Эластическое ущемление возникает при
резком повышении внутрибрюшного давления и внезапном выхождении большего, чем
обычно, количества внутренних органов через грыжевые ворота. Вследствие узости
грыжевых ворот и возникающего спазма окружающих мышц вышедшие органы не могут
вправиться в брюшную полость. Происходит их сдавление (странгуляция),
приводящее к ишемии ущемленных органов и нарушению венозного оттока.
Возникающий отек грыжевого содержимого способствует еще большему усилению
странгуляции.
Каловое ущемление развивается в результате
переполнения каловыми массами кишечной петли, находящейся в грыжевом мешке. Ее
приводящий отдел растягивается и, увеличиваясь в размерах, начинает сдавливать
в грыжевых воротах отводящий отдел этой кишки вместе с прилежащей брыжейкой. В
конечном итоге развивается картина странгуляции, подобная той, которая
наблюдается при эластическом ущемлении. Для возникновения калового ущемления
основное значение имеет не физическое усилие, а нарушение кишечной моторики,
замедление перистальтики, что чаще бывает в пожилом и старческом возрасте.
Кроме того каловому ущемлению способствуют широкие грыжевые ворота, перегибы и
сращения кишки со стенкой грыжевого мешка. В ряде случаев переполнение
приводящего отдела кишечной петли, находящейся в грыжевом мешке, сочетается с
эластическим давлением со стороны грыжевых ворот, в результате чего развивается
смешанное (комбинированное) ущемление.
При ущемлении в грыжевых воротах
кишечной петли в ней следует различать 3 отдела: приводящее колено; центральный
отдел, находящийся в грыжевом мешке; отводящее колено. Наибольшие
патологоанатомические изменения возникают в центральном отделе ущемленной
кишечной петли и странгуляционной борозде, образующейся на месте сжатия кишки
ущемляющим кольцом.
Вследствие нарушений крово и
лимфообращения в ущемленном органе, длительного венозного стаза происходит
пропотевание плазмы в стенку и просвет кишки. Последующая транссудация жидкости
из ущемленной кишки в замкнутую полость грыжевого мешка ведет к появлению так
называемой «грыжевой воды», которая вначале бывает прозрачной, а затем
вследствие пропотевания эритроцитов и инфицирования становится мутногеморрагической.
Постепенно в грыжевом мешке развивается гнойногнилостное воспаление, выходящее
(при отсутствии своевременного лечения) за пределы грыжевого мешка. Подобное
гнойное воспаление грыжевого мешка и окружающих его тканей, развивающееся в поздних
стадиях ущемления, получило название флегмоны грыжевого мешка.
При быстром и одновременном сдавлении
ущемляющим кольцом и вен, и артерий брыжейки кишки «грыжевая вода» не
образуется. Развивается так называемая «сухая гангрена» ущемленной кишки.
При ущемлении страдает не только часть кишки,
находящаяся в грыжевом мешке, но и приводящий ее отдел, находящийся в брюшной
полости. В нем происходят все те изменения, которые характерны для острой
кишечной непроходимости: переполнение содержимым и перерастяжение стенки кишки,
развитие гнилостных процессов в ее просвете, транссудация жидкости,
пропотевание токсинов и микроорганизмов в свободную брюшную полость, развитие
перитонита.
При ущемлении любой грыжи наиболее
характерны 4 следующих клинических признака: 1) резкая боль в области грыжевых
ворот; 2) невправимость грыжи; 3) напряжение и болезненность грыжевого
выпячивания; 4) отсутствие передачи кашлевого толчка.
Боль является главным симптомом
ущемления. Она настолько сильна, что больные не могут удержаться от стонов и
крика. Нередко наблюдаются явления настоящего болевого шока. Боль возникает в
момент физического напряжения и не стихает в течение нескольких часов: до того
момента, когда происходит некроз ущемленного органа с гибелью интрамуральных
нервных элементов.
Второй признак невправимость грыжи
имеет большое диагностическое значение при ущемлении свободной грыжи. В этом
случае больные отмечают, что ранее вправляемое грыжевое выпячивание перестало
вправляться в брюшную полость с момента появления болей.
Напряжение грыжевого выпячивания и
некоторое увеличение его размеров сопутствуют ущемлению как вправимой, так и
невправимой грыжи. Поэтому данный признак имеет гораздо большее значение для
распознавания ущемления, чем сама по себе невправимость грыжи. Диагностическое
значение имеет не только напряжение грыжевого выпячивания, но и резкая его
болезненность при ощупывании.
Отрицательный симптом кашлевого
толчка обусловлен тем, что в момент ущемления грыжевой мешок разобщается со
свободной брюшной полостью и становится изолированным образованием. В связи с
этим повышение внутрибрюшного давления в момент кашля не передается в полость
грыжевого мешка.
Кроме указанных четырех признаков при ущемлении грыжи
могут наблюдаться симптомы, обусловленные развитием непроходимости кишечника:
рвота, вздутие живота, неотхождение газов и др. При ущемлении мочевого пузыря
возникают боли над лобком, дизурические расстройства, микрогематурия.
Дифференциальный диагноз. Дифференцировать ущемление
грыжи необходимо: 1) с патологическими состояниями самого грыжевого выпячивания
(невправимость, копростаз, воспаление грыжи, «ложное ущемление»); 2) с
заболеваниями, не имеющими непосредственного отношения к грыже (паховый
лимфаденит, натечный абсцесс, опухоли яичка и семенного канатика, заворот
кишок).
44.
Особенности оперативной техники при ущемленной грыже живота. Критерии для
определения жизнеспособности ущемленной петли кишки. Лечебная тактика при:
сомнительном диагнозе ущемленной грыжи живота; при самопроизвольном вправлении
ущемлённой грыжи; при ложном ущемлении
Хирургическая тактика при ущемленных грыжах.
Единственным методом лечения ущемленных грыж является хирургический. Экстренная
операция должна выполняться вне зависимости от сроков ущемления, разновидности
и локализации грыжи.
Попытки насильственного вправления ущемленной грыжи
недопустимы, так как могут привести к тяжелым осложнениям повреждению
грыжевого мешка и его содержимого, кровотечению, перитониту.
Попытка устранить ущемление грыжи без операции
допустима лишь в исключительных случаях, когда больные находятся в крайне
тяжелом состоянии изза наличия декомпенсированных сопутствующих заболеваний и с
момента ущемления прошло не более 2 часов. Больному делают инъекции атропина,
промедола, опорожняют желудок и мочевой пузырь, выполняют очистительную клизму,
теплую ванну. Если указанные меры оказываются безуспешными, то больного,
несмотря на тяжесть состояния, необходимо оперировать.
В случаях самостоятельного вправления ущемленной грыжи
(на дому, во время транспортировки, в приемном отделении) больной должен быть
обязательно госпитализирован в хирургический стационар для динамического
наблюдения, так как вправившаяся после ущемления кишка может стать источником
перитонита или кишечного кровотечения!
Если спонтанное вправление грыжи произошло в поздние
сроки после ущемления или у больного при поступлении в стационар выявляются
симптомы перитонита или кишечной непроходимости, то показано экстренное
оперативное вмешательство. Больному же, у которого при динамическом наблюдении
не выявляются признаки какихлибо осложнений, показано грыжесечение в
отсроченном (плановом) порядке.
Больной с установленным диагнозом ущемленной грыжи
подлежит немедленному оперативному лечению. Организационные и подготовительные
мероприятия должны быть предельно короткими и занимать, как правило, не более
11,5 часов.
Больные с нерезко выраженными нарушениями гомеостаза и
стабильными гемодинамическими показателями не нуждаются в специальной
предоперационной подготовке. В запущенных случаях ущемления, осложненных
перитонитом, выраженной интоксикацией, показана кратковременная (1,52 часа)
инфузионная корригирующая терапия (в объеме 2025 мл на 1 кг массы тела).
Основная ее цель устра нение грубых нарушений в системе кровообращения.
Основные этапы операции при ущемленной грыже такие же,
как и при плановом грыжесечении. Однако имеется и ряд принципиальных отличий.
Первоочередная задача хирурга при ущемленной грыже как можно более быстрое
обнажение и фиксация ущемленного органа с помощью влажных марлевых салфеток.
Только после этого рассекается ущемляющее кольцо и оценивается жизнеспособность
ущемленного органа.
Перед вскрытием грыжевого мешка рану необходимо
обложить салфетками, так как вскрытие мешка сопровождается изливанием
инфицированной грыжевой воды. Само рассечение грыжевого кольца необходимо
производить с большой осторожностью, с учетом анатомических взаимоотношений,
чтобы не повредить сосудистые или связочные образования вне ущемляющего кольца.
При паховой грыже это рассечение апоневроза наружной косой мышцы живота или
внутреннего пахового кольца. При бедренной грыже производится рассечение
лакунарной (жимбернатовой) связки кнутри от грыжевого мешка. Другие направления
рассечения грыжевого кольца при бедренной грыже недопустимы, так как кзади от
мешка лежит лонная кость, кнаружи бедренная вена, а кпереди в зоне паховой
связки могут находиться аномально расположенные сосуды. При пупочной грыже
ущемляющее кольцо рассекают в поперечном или продольном направлении в обе
стороны.
После рассечения грыжевого кольца ущемленный орган
(чаще всего кишка) осторожно подтягивается в рану с целью обследования и
выяснения его жизнеспособности. Это один из наиболее ответственных этапов
операции.
Определение жизнеспособности ущемленной петли кишки не
всегда просто. Предложенные для этого объективные методы (измерение температуры
и электропроводимости кишечной стенки, трансиллюминация, интрамуральная
ангиотензометрия и пульсомоторография) не нашли широкого распространения. В
повседневной клинической практике для определения жизнеспособности кишки,
освобожденной от сдавления, руководствуются ее внешним видом. При этом
оцениваются: 1) цвет кишки; 2) пульсация сосудов ее брыжейки; 3) наличие
перистальтики на измененном отрезке кишки.
Жизнеспособная кишка быстро принимает нормальный вид,
становится розовой, серозная оболочка блестящей, перистальтика отчетливой,
брыжейка неотечна, сосуды пульсируют. Перед вправлением кишки в брюшную полость
в ее брыжейку следует ввести 100150 мл 0,25% раствора новокаина.
Бесспорными признаками нежизнеспособности кишки и
абсолютным показанием к ее резекции являются: темная окраска кишки, тусклая
серозная ее оболочка, дряблая стенка, отсутствие перистальтики кишки и
пульсации сосудов брыжейки, наличие грубых изменений в области странгуляционной
борозды.
Резекция кишки независимо от протяженности измененного
ее участка должна производиться в пределах безусловно здоровых тканей. Такие
меры, как инвагинация швами сомнительных участков кишки или странгуляционной
борозды являются порочными и долж ны быть исключены из арсенала хирурга. Кроме
измененного участка кишки подлежат резекции не менее 40 см неизмененного
приводящего и не менее 1520 см отводящего отрезков кишки. Если после
пересечения кишки обнаруживаются изменения со стороны ее слизистой оболочки, объем
резекции расширяют в пределах здоровых тканей. Анастомоз между приводящим и
отводящим отделами кишки предпочтительнее накладывать «конец в конец».
Анастомоз «бок в бок» функционально менее выгоден, но в условиях кишечной
непроходимости более безопасен. Пластика грыжевых ворот производится в
соответствии с видом грыжи.
Термином «ложное ущемление» обозначают такие ситуации,
когда у больного с грыжей при какомлибо остром заболевании органов брюшной
полости (аппендицит, холецистит, панкреатит, перфорация полого органа)
развивается симптомокомплекс, напоминающий общую картину ущемления. Это
обусловлено скоплением воспалительного экссудата брюшной полости в грыжевом
мешке, в результате чего грыжевое выпячивание становится болезненным и
трудновправимым. Если в этом случае операция будет ограничена грыжесечением, а
причина перитонита и «ложного ущемления» не будет распознана и устранена, то
больной погибнет в результате диагностической ошибки.
45. Мнимое вправление ущемленной грыжи
живота. Показания и принципы резекции кишечника. Тактика при сомнительной
жизнеспособности практически всей ущемленной тонкой кишки. Хирургическая
тактика при флегмоне грыжевого мешка
Результатом попыток насильственного вправления
ущемленной грыжи является и так называемое мнимое или ложное вправление. Под
мнимым вправлением понимается вправление грыжевого содержимого в брюшную
полость или в предбрюшинную клетчатку вместе с ущемляющим кольцом. В таких
случаях типичный для ущемления признак в виде напряженного грыжевого
выпячивания исчезает. Однако наличие резкой болезненности при исследовании в
зоне грыжи, а также анамнестические сведения об имевших место попытках
насильственного вправления позволяют установить факт «мнимого» вправления.
Такой больной должен быть подвергнут срочному оперативному вмешательству.
При вправлении грыжи во время обезболивания или
операции необходимо принять все меры для осмотра ущемленного органа через
герниолапаротомную рану. Если орган не обнаружен и имеются сомнения в его
жизнеспособности, то показана срединная лапаротомия или интраоперационная
лапароскопия через грыжевой мешок.
При осложнении флегмоной ущемленной
паховой или бедренной грыжи операцию выполняют в два этапа.
Операция начинается с нижней
срединной лапаротомии. Во время ревизии устанавливается, какой орган ущемлен.
Если это сальник, то производится резекция его. Если это ущемленная кишечная
петля, то выполняют ее резекцию в пределах здоровых тканей, а затем накладывают
межкишечный анастомоз. Пересеченные концы кишки, идущие к грыжевому кольцу, ушивают
наглухо. После санации брюшной полости лапаротомная рана ушивается (первый этап
операции). Только после этого делается рассечение тканей над грыжевым
выпячиванием и вскрытие флегмоны. Омертвевшую петлю кишки убирают со стороны
раны. Брюшина ушивается, а рана дренируется. Пластика грыжевых ворот
производится в плановом порядке, после эпителизации гнойной раны.
При ущемленной пупочной или околопупочной грыжи,
осложненной флегмоной, выполняют операцию по способу Грекова. Суть этого
способа состоит в следующем: окаймляющим поперечным разрезом вокруг грыжевого
выпячивания производят рассечение всех слоев брюшной стенки, включая брюшину, и
таким образом высекают единым блоком ущемленную грыжу в пределах здоровых
тканей. Войдя в брюшную полость, пересекают ущемленный орган прокси мальнее
странгуляции и удаляют грыжу целиком, не вскрывая ее. Если была ущемлена кишка,
то между ее приводящим и отводящим отделами накладывают анатомоз. Производят
пластику грыжевых ворот.
46. Грыжи пищеводного отверстия
диафрагмы. Классификация. Клиника, диагностика, дифференциальный диагноз.
Осложнения. Принципы консервативного ечения. Показания к оперативному лечению.
Методы операций.
Грыжа пищеводного отверстия диафрагмы или
диафрагмальная грыжа возникает, если через пищеводное отверстие диафрагмы
(отверстие, через которое пищевод из грудной полости проникает в брюшную)
брюшная часть пищевода, часть желудка или брюшная часть пищевода вместе с
частью желудка смещается в грудную полость. Иногда через пищеводное отверстие
диафрагмы в грудную полость могут смещаться и другие органы, расположенные в
полости живота.
Единой общепринятой классификацией грыж пищеводного
отверстия диафрагмы нет. Распространено деление грыж по Akerlund (1926) на три
типа: I тип - грыжи пищеводного отверстия с врожденным укорочением пищевода; II
тип - параэзофагеальные грыжи и III тип - грыжи с внутригрудным положением
кардии и пищеводом нормальной длины.
Если исключить из классификации, предложенный
Akerlund, I тип, как не являющийся в подлинном смысле слова грыжей, то все
остальные формы грыж пищеводного отверстия диафрагмы можно разделить на
параэзофагеальные и аксиальные (осевые), соответствующие III типу
Классификация Б. В. Петровского и Н. П. Каншина (1966)
исходит из основных принципов классификации Akerlund, но основывается на
названии отделов пищеварительного канала, принимающих участие в
грыжеобразовании. В соответствии с этой классификацией различают следующие
формы скользящих (аксиальных) грыж: 1) кардиальную, 2) кардиофундальную, 3)
субтотальную желудочную, 4) тотальную желудочную без укорочения пищевода и 5) с
укорочением пищевода.
Аксиальные грыжи составляют 80-90% всех грыж
пищеводного отверстия. Параэзофагеальные грыжи встречаются значительно реже, но
в отличие от аксиальных обладают большей наклонностью к ущемлению, поэтому
имеют особое клиническое значение.
Клиническая симптоматика грыж пищеводного отверстия
диафрагмы довольно неопределенна и многообразна, что часто ведет к ошибочной
диагностике. У значительной части больных грыжа протекает бессимптомно и
обнаруживается лишь во время рентгенологического исследования по другому
поводу.
Жалобы в основном бывают обусловлены недостаточностью
кардии и вторично развивающимся рефлюксэзофагитом. Больные отмечают изжогу,
жжение и боли за грудиной, срыгивания, дисфагию. Симптомы усиливаются в
горизонтальном положении, особенно вскоре после еды или усилий, повышающих
брюшное давление (наклоны вниз, подъем тяжести, кашель). Боли в области сердца
могут симулировать стенокардию, инфаркт миокарда.
Основным признаком аксиальной грыжи является наличие в
области пищеводного отверстия диафрагмы типичных складок слизистой оболочки
желудка, которые продолжаются непосредственно в складки поддиафрагмальной части
желудка. Другим обязательным признаком аксиальной грыжи служит смещение
кардиального отдела желудка выше диафрагмы.
Грыжевая часть желудка образует округлое или
неправильной формы выпячивание с ровными или зазубренными контурами, что
связано с поперечным ходом складок слизистой оболочки желудка. Это выпячивание
широко сообщается с желудком. Иногда на контуре пролабировавшей части желудка
видны симметричные втяжения - «кардиальные зарубки», которые отделяют
преддверие от кардиального отдела желудка.
Пищевод при аксиальной грыже способен частично
инвагинировать в желудок, что проявляется симптомом «венчика», или «воротника».
Сходную картину образует также соскальзывание слизистой оболочки пищевода в
желудок. При большой аксиальной грыже грудной отдел пищевода искривляется,
главным образом в его дистальной трети. Если грыжа не фиксирована, то при
переводе больного из горизонтального в вертикальное положение можно видеть
обратное проскальзывание свода и кардиального отдела желудка через пищеводное
отверстие в брюшную полость.
Степень подвижности грыжи устанавливают как в процессе
проб с повышением брюшного давления, так и путем сравнения снимков, сделанных в
горизонтальном положении больного (с натуживанием) со снимками
пищеводножелудочного перехода в вертикальной позиции пациента.
Нефиксированную аксиальную грыжу при рентгенологическом
исследовании в вертикальном положении больного, как правило, обнаружить не
удается.
Наиболее затруднительно распознавание небольших
аксиальных грыж. О наличии такой грыжи можно с уверенностью говорить лишь в
случае обнаружения трех кольцевидных перетяжек в области пищеводножелудочного
перехода, которые лучше всего заметны при исследовании больного в
горизонтальном положении в момент глубокого вдоха.
Верхняя перетяжка соответствует входу в
желудочнопищеводное преддверие, вторая представляет собой кардиальный сфинктер,
а третья перетяжка на смещенной в грудную полость части желудка отделяет ее от
внутрибрюшной и соответствует уровню расположения грыжевых ворот.
Существует также ряд косвенных признаков грыжи
пищеводного отверстия: отсутствие или необычно малый размер газового пузыря
желудка и искривление наддиафрагмального отдела пищевода. Обнаружение каждого
из этих признаков требует целенаправленного поиска прямых симптомов грыжи
пищеводного отверстия.
Диагностика параэзофагеальных грыж обычно не сложна,
так как они чаще фиксированы и заметны даже при вертикальном положении
больного. В горизонтальном положении они увеличиваются еще больше. Выступающий
в грудную полость свод желудка перекрывает кардиальную часть пищевода, которая
лучше всего видна при исследовании в косых проекциях. Для параэзофагеальных
грыж характерно фиксированное расположение кардии на уровне пищеводного
отверстия диафрагмы или под диафрагмой.
Наиболее типичным осложнением грыж пищеводного
отверстия является рефлюксэзофагит, поэтому выявлению желудочнопищеводной
регургитации в процессе рентгенологического исследования следует придавать
особое значение.
Язвы и эрозии слизистой оболочки пищевода,
развивающиеся в результате рефлюксэзофагита, ведут к появлению на контуре
пищевода ниши или стойкого депо бария на рельефе слизистой оболочки.
Длительной текущий эзофагит у больных грыжей может
вызывать образование рубцовой стриктуры и укорочения пищевода, что не следует
смешивать с первичным врожденным коротким пищеводом.
В участке пищеварительного канала, образующего грыжу,
могут развиваться раковые опухоли, диагностика которых основывается на
свойственной им симптоматике. Первично развивающийся в кардиальном отделе рак
может способствовать укорочению пищевода и вторичному образованию грыжи.
Аксиальные грыжи в первую очередь следует
дифференцировать с наличием ампулы пищевода, имеющей сходную картину, но
исчезающей на выдохе. Облегчают правильную диагностику обнаружение трех
отмеченных ранее кольцевидных зарубок на контурах пищевода и желудка,
характерная для ампулы активная сокращаемость, регистрируемая во время
просвечивания и документируемая рентгенокинематограммой или видеозаписью
рентгенотелевизионного изображения.
Выраженные параэзофагеальные грыжи обычно не вызывают
диагностических трудностей, небольшие же могут иметь сходство с эпифренальными
дивертикулами. Заполнение мешкообразного выпячивания во время проглатывания
контрастной массы свидетельствует в пользу дивертикула, тогда как заполнение
его за счет ретроградного заброса из желудка, возникающее при переводе больного
в горизонтальное положение, наклоне, натуживании, более свойственно грыже.
Осложнением грыжи пищеводного отверстия диафрагмы чаще
всего бывает рефлюксэзофагит, но может развиться пептическая язва пищевода, при
длительном течении которой в свою очередь может произойти рубцовый стеноз
(сужение) пищевода. Встречаются острое и хроническое кровотечение из пищевода,
перфорация пищевода или ущемление грыжи в пищеводном отверстии диафрагмы
Консервативное лечение направлено на предотвращение
осложнений и улучшение самочувствия пациентов. Для лечения и профилактики
рефлюксэзофагита назначают препараты, снижающие кислотность желудочного сока
(омез, париет, ранитидин и т.д.), обволакивающие препараты (маолокс и др.),
которые защищают слизистую пищевода от действия желудочного сока. Проводят
лечение сопутствующих заболеваний.
При отсутствии эффекта от медикаментозной терапии
ГПОД, показано оперативное лечение, суть которого заключается в восстановлении
нормальных анатомических отношений в области пищевода и желудка.
Показания к хирургическому лечению грыжи пищеводного
отверстия диафрагмы:
· неэффективность консервативного лечения;
· наличие осложнений грыжи ПОД
(эзофагит, эрозии и язвы пищевода, анемия, кровотечения);
· большие размеры грыжи, ее фиксация в
грыжевых воротах;
· параэзофагеальная (около пищеводная)
скользящая грыжа (высокий риск ущемления грыжи);
· дисплазия слизистой пищевода
(слизистая пищевода приобретает строение слизистой тонкого кишечника).
Виды хирургического лечения при грыже пищеводного
отверстия диафрагмы: все существующие на сегодняшний день хирургические
методики лечения ГПОД направлены на хирургическое создание арефлюксного
механизма, препятствующего забросу желудочного содержимого в пищевод. В
большинстве отечественных клиник используются операции фундопликации по
Ниссену, которая состоит в хирургическом обороте дна желудка вокруг пищевода на
360’, что позволяет создать манжетку, препятствующую забросу желудочного
содержимого в пищевод и, следовательно, развитию эзофагита.
47. Диафрагмальные грыжи. Классификация.
Клиника, диагностика, дифференциальный диагноз. Показания к оперативному
лечению. Методы операций. Грыжи Ларрея и Бохдалека
Под грыжами естественных отверстий
диафрагмы следует понимать пролабирование органов полости брюшины в грудную
полость через расширенные естественные отверстия диафрагмы. Образование грыжи в
противоположном направлении, т. е. смещение внутригрудных органов в брюшную
полость, относится к редкой патологии. Естественными отверстиями диафрагмы
являются, прежде всего, пищеводное отверстие, отверстие аорты, нижней полой
вены, а также щель симпатического нерва, отверстия чревного и межреберных
нервов. Все перечисленные отверстия грудобрюшной преграды при определенных
условиях могут стать грыжевыми воротами.
В настоящее время единой общепринятой классификации
грыж естественных отверстий диафрагмы не существует. С учетом механизмов
возникновения данной патологии выделяют грыжи врожденные и приобретенные. По
частоте возникновения можно выделить грыжи пищеводного отверстия диафрагмы - на
их долю приходится более 75% всех диафрагмальных грыж и грыжи других
естественных отверстий диафрагмы, встречающиеся гораздо реже
Все диафрагмальные грыжи они делят на
две группы:
ТРАВМАТИЧЕСКИЕ
Ложные
Истинные
НЕТРАВМАТИЧЕСКИЕ
Ложные
Истинные
Естественных отверстий
пищеводного отверстия - 70%
редкие грыжи других отверстий
Клиника и диагностика грыж диафрагмы: появление и
степень выраженности симптомов диафрагмальных грыж зависят от характера
перемещенных брюшных органов в плевральную полость, их объема, степени
наполнения перемещенных полых органов, сдавления и перегиба их в области
грыжевых ворот, степени коллапса легкого и смещения средостения, размеров и
формы грыжевых ворот.
Симптомы диафрагмальной грыжи: желудочнокишечные,
легочносердечные и общие. Факторы, приводящие к повышению внутрибрюшного
давления, усиливают выраженность симптомов заболевания в связи с увеличением
содержимого грыжевого мешка.
Больные жалуются на чувство тяжести и боли в подложечной
области, грудной клетке, подреберьях, одышку и сердцебиение, возникающие после
обильного приема пищи. Часто отмечают бульканье и урчание в грудной клетке на
стороне грыжи, усиление одышки в горизонтальном положении. После еды бывает
рвота принятой пищей, что приносит облегчение. При завороте желудка,
сопровождающемся перегибом пищевода, развивается парадоксальная дисфагия
(твердая пища проходит лучше жидкой).
Большое диагностическое значение имеет прямая
зависимость выраженности клинических симптомов от степени наполнения
желудочнокишечного тракта.
Ущемление диафрагмальной грыжи характеризуют резкие
боли в соответствующей половине грудной клетки или в эпигастральной области,
иррадиирующие в спину, лопатку. Ущемление полого органа может привести к некрозу
и перфорации его стенки с развитием пиопневмоторакса.
Заподозрить диафрагмальную грыжу можно при наличии в
анамнезе травмы, перечисленных выше жалоб, уменьшении подвижности грудной
клетки и сглаживании межреберных промежутков на стороне поражения, западении
живота при больших длительно существующих грыжах, определении притупления или
тимпанита над соответствующей половиной грудной клетки, меняющих интенсивность
в зависимости от степени наполнения желудка и кишечника, выслушивании
перистальтики кишечника или шума плеска в этой зоне при одновременном
ослаблении или полном отсутствии дыхательных шумов, смещении тупости
средостения в непораженную сторону.
Окончательный диагноз устанавливают при
рентгенологическом исследовании. Рентгенологическая картина зависит от
характера и объема переместившихся в грудную клетку брюшных органов, от степени
наполнения желудочнокишечного тракта. При выпадении желудка виден большой
горизонтальный уровень в левой половине грудной клетки, поднимающийся при
приеме жидкости и пищи. При выпадении петель тонкой кишки на фоне легочного
поля определяют отдельные участки просветления и затемнения. Перемещение
селезенки или печени дает затемнение в соответствующем отделе легочного поля. У
некоторых больных хорошо видны купол диафрагмы и брюшные органы, расположенные
выше него.
При контрастном исследовании желудочнокишечного тракта
определяют характер выпавших органов (полый или паренхиматозный), уточняют
локализацию и размеры грыжевых ворот на основании картины сдавления выпавших
органов на уровне отверстия в диафрагме (симптом грыжевых ворот). У некоторых
больных для уточнения диагноза накладывают диагностический пневмоперитонеум.
При ложной грыже воздух может пройти в плевральную полость (рентгенологически
определяют картину пневмоторакса).
Лечение диафрагмальных грыж: в связи с возможностью ущемления
при диафрагмальной грыже показана операция. При правосторонней локализации
грыжи операцию производят через трансторакальный доступ в четвертом межреберье,
при парастернальных грыжах лучший доступ - верхняя срединная лапаротомия, при
левосторонних грыжах показан трансторакальный доступ в седьмом - восьмом
межреберье.
После разделения сращений,
освобождения краев дефекта в диафрагме низводят перемещенные органы в брюшную
полость и 1 ушивают дефект отдельными узловыми швами с образованием
дубликатуры. При больших размерах дефекта прибегают к аллопластическому
замещению диафрагмы протезами из капрона, нейлона, тефлона, лавсана и др.
При парастернальных грыжах (грыжа
Ларрея, ретростернальная грыжа) низводят перемещенные органы, выворачивают и
отсекают у шейки грыжевой мешок, накладывают и последовательно завязывают
Побразные швы на края дефекта диафрагмы и задний листок влагалища брюшных мышц,
надкостницу грудины и ребер.
При грыжах поясничнореберного
пространства (грыжа Бохдалека) дефект диафрагмы ушивают трансабдоминально
отдельными швами с образованием дубликатуры.
При ущемленных диафрагмальных грыжах
доступ трансторакальный. После рассечения ущемляющего кольца исследуют
содержимое грыжевого мешка. При сохранении жизнеспособности выпавший орган
вправляют в брюшную полость, при необратимых изменениях - резецируют. Дефект в
диафрагме ушивают.
Местом проникновения грудиннореберных
грыж (стернокостальных) является лишенная мышц область соединения с грудиной и
реберной частью. Это место носит название стернокостального треугольника
Ларрея, а такие грыжи носят название грыж треугольника Ларрея
48.
Медиастинит. Классификация. Клиника переднего и заднего медиастинита.
Диагностика. Виды операций. Доступы
Медиастинит (mediastinitis; от
позднелатинского mediastinum - средостение) - воспаление клетчатки
средостения.Различают острый и хронический медиастинит. Острые медиастиниты
относятся к числу наиболее тяжелых форм хирургической инфекции. Острое воспаление
жировой клетчатки средостения, содержащей большое количество кровеносных и
лимфатических сосудов, лимфатических узлов и нервных проводников, является
грозным осложнением различных гнойных заболеваний, прежде всего органов груди и
шеи, огнестрельных ран и закрытых повреждений груди. Тяжесть течения, сложность
ранней диагностики и связанная с этим высокая летальность придают проблеме
особую актуальность.
По происхождению различают первичные
(травматические) и вторичные медиастиниты. Первичные медиастиниты возникают при
ранениях средостения и его органов, а также после оперативных вмешательств на
них.
Вторичные медиастиниты встречаются в
23 раза чаще, чем первичные, и могут возникать при проникновении в средостение
инфекции контактным, гематогенным и лимфогенным путями. Они могут стать
осложнениями гнойных и гнилостных воспалений клетчатки шеи, дивертикулов и
других нагноений стенок пищевода, распадающегося рака пищевода, остеомиелитов
костного каркаса грудной клетки, воспалительных процессов в дермоидных кистах и
лимфатических узлах средостения, нагноений легких и плевры.
В зависимости от характера экссудата
и вида возбудителя выделяют серозные (негнойные), гнойные, гнилостные,
анаэробные и гангренозные формы заболевания.
Различают ограниченные (абсцессы) и
распространенные (флегмоны) формы. Среди них выделяют медиастиниты передние
(верхние с расположением очага выше уровня третьего межреберья; нижние книзу
от третьего межреберья и всего переднего средостения), задние (верхние с
расположением очага выше уровня V грудного позвонка; нижние книзу от V
грудного позвонка и всего заднего средостения) и тотальные. Острые медиастиниты
могут иметь молниеносную, острую и подострую формы течения.
Клинические проявления острого
травматического медиастинита довольно характерны. Состояние пострадавших с
травмой груди после некоторого улучшения на фоне хирургического лечения вновь
ухудшается. Заболевание начинается остро, обычно на 23 сутки после ранения
средостения, и характеризуется прежде всего общими симптомами тяжелейшей
интоксикации. В отдельных случаях, при повреждении пищевода с поступлением в
клетчатку средостения большого количества инфицированного материала,
медиастинит развивается к концу первых - началу вторых суток.
Больные предъявляют жалобы на боль в
груди, нарастающую общую слабость, недомогание, нехватку воздуха. Обращают на
себя внимание их беспокойство, иногда с двигательным возбуждением, повышение
температуры тела до 3940°С и потрясающие ознобы, профузное потоотделение,
гиперемия кожи, одышка. Через сутки картина возбуждения сменяется выраженным
общим угнетением, иногда со спутанностью сознания.
Пострадавшие, как правило, стараются
принять вынужденное положение полусидя с наклоненной к груди головой, уменьшая
таким образом боль и облегчая дыхание. У части пациентов появляется отек
верхней половины туловища, шеи и лица с переполнением кровью и напряжением
поверхностных вен, цианозом кожи.
Значительная интоксикация,
обусловленная резорбцией токсинов и продуктов распада тканей, сдавление крупных
сосудов и нервов приводят к заметным расстройствам деятельности сердечнососудистой
системы. Всегда выражена тахикардия с частотой пульса до 110120 в минуту. По
мере прогрессирования гнойного процесса появляется аритмия. Артериальное
давление снижается, венозное - несколько возрастает. При аускультации сердца
отмечается ослабление I тона на верхушке и П тона на аорте.
Из местных симптомов наиболее ранним
и постоянным является интенсивная боль в груди, усиливающаяся при глотании или
запрокидывании головы (симптом Герке). У больных с передним медиастинитом боль
обычно локализуется за грудиной, а при заднем расположении в межлопаточном
пространстве или же проецируется в надчревную область. Надавливание на грудину
или остистые отростки позвонков при соответствующем расположении гнойников
резко усиливает болевые ощущения.
Прогрессировала воспалительного
процесса в средостении с отеком клетчатки часто приводит к (давлению блуждающих
и диафрагмальных нервов, крупных кровеносных сосудов, а при наличии больших
ограниченных гнойников пищевода и трахеи. В результате этого возникают дисфагия.
удушье, упорный кашель, осиплость голоса. В периферической крови обнаруживают
анемию и высокий лейкоцитоз с резким сдвигом формулы влево. При биохимических
исследованиях крови выявляют гипопротеннемню с уменьшением в сыворотке
альбуминов, повышение содержания глобулинов и уменьшение альбуминоглобулинового
коэффициента.
Помимо общих и местных клинических
признаков, большое значение в распознавании воспалительного процесса имеет
лучевое исследование
Рентгенологическая картина острых
гнойных медиастинитов определяется их распространенностью, локализацией и
происхождением.
Ограниченный медиастинит отображается
в виде округлой, достаточно очерченной тени в том или другом отделе
средостения, выступающей в правое или левое легочное поле. В ней могут быть
включения газа, дающие либо просветления в виде отдельных пузырьков, либо
образующие горизонтальный уровень. Все эти изменения достоверно выявляются при
КТ. Использование контрастирования позволяет дифференцировать грануляционную
ткань, развивающуюся вокруг такого медиастинального абсцесса.
Особой формой ограниченного
медиастинита является натечный абсцесс, формирующийся при туберкулезном
спондилите шейного или грудного отдела позвоночника. Он локализуется в
паравертебральной зоне, имеет овальную или грушевидную форму, обычно с ровными
и четкими контурами. Эта картина весьма схожа с нейрогенной опухолью
средостения. Уточнению диагноза способствует выявление при рентгенографии
специфических изменений позвоночника.
Диффузный медиастинит при
рентгенологическом исследовании в прямой проекции характеризуется расширением
срединной тени, полицикличностью и нечеткостью контуров, недифференцируемостью
сердечнососудистых дуг. При разрыве пищевода, трахеи, главных бронхов в
средостении определяются скопления газа, горизонтальные уровни жидкости.
На рентгенограммах в боковой проекции
передний медиастинит характеризуется затенением ретростернального пространства,
а задний медиастинит - затенением паравертебральной зоны. Инфильтрация верхнего
средостения нередко распространяется на клетчатку шеи, что также хорошо
выявляется на рентгенограммах в боковой проекции.
При КТ воспалительная инфильтрация
клетчатки средостения проявляется повышением ее плотности и потерей
дифференцируемости анатомических структур средостения. Достоверно определяются
даже мельчайшие скопления газа.
Хирургическая тактика. При остром
медиастините травматического происхождения необходимо более раннее оперативное
вмешательство для вскрытия воспалительного очага (медиастинотомия) и его
надежного дренирования. Резорбция токсинов и продуктов некробиоза приводит к
быстрому ухудшению состояния больных, и без своевременного оказания
хирургической помощи процесс почти всегда заканчивается смертью. Оперативное
пособие следует проводить даже при общем тяжелом состоянии пострадавших, так
как лишь операция в сочетании с другими методами лечения может спасти их жизнь.
Успех лечения таких больных в
определенной степени зависит не только от хорошо проведенной анестезии и
радикальности самой операции, но во многом определяется оценкой общего
состояния пациентов и обязательной кратковременной (6080 мин) предоперационной
интенсивной терапией, направленной на коррекцию нарушенного гомеостаза и
устранение расстройств жизненно важных функций. Она включает в себя назначение
достаточных по объему количеств плазмозамещающих растворов и крови,
дополнительное введение больших доз антибиотиков широкого спектра действия,
кардиотропных средств, витаминов, антигистаминных препаратов и т. д.
Операцию проводят под общим
обезболиванием с ИВЛ. Выбор оперативного доступа, в конечном счете,
определяется уровнем и характером распространенности гнойного очага.
Операции при передних медиастинитах.
При передних ограниченных медиастинитах, развившихся вследствие ранения грудины
и клетчатки средостения, иногда может быть применим трансстернальный доступ к
гнойнику в средостении с поперечной стернотомией. При этом, помимо полноценного
дренирования абсцесса, обязательно резецируют измененные участки кости.
Определенное практическое значение
имеет предложенный О. Маделунгом внеплевральный парастернальный доступ с
резекцией 23 реберных хрящей. Уровень предстоящего дренирования определяют по
обзорной рентгенограмме грудины и при диагностической межребернозагрудинной
пункции переднего средостения.
В случаях верхнего медиастинита (до
уровня дуги аорты или IV грудного позвонка) применяют шейную медиастинотомию.
Больной лежит на спине с валиком под
лопатками. Производят поперечный разрез длиной не менее 1012 см чуть выше
рукоятки грудины. Рассекают поверхностные слои и 2ю фасцию шеи, тупым путем
расслаивают надгрудинный клетчаточный слой, не повреждая яремные вены,
разъединяют 3ю фасцию и пальцем проникают за грудину в переднее средостение.
После вскрытия и опорожнения гнойника его полость многократно промывают антисептическим
раствором и дренируют силиконовыми или мягкими резиновыми трубками. В
послеоперационном периоде показано непрерывное промывание раны в сочетании с
активной аспирацией.
При нижнем переднем медиастините
проводят срединный разрез длиной 57 см, начиная от мечевидного отростка книзу.
При необходимости резецируют верхушку мечевидного отростка и тупым путем
оттесняют книзу диафрагму. Пальцем входят в клетчаточный слой и продвигаются
кверху позади грудины. Вскрывают и опорожняют гнойник, промывают рану и дренируют
ее силиконовыми трубками.
Разлитую флегмону переднего
средостения дренируют, комбинируя надгрудинный и подгрудинный доступы.
Операции при задних медиастинитах.
При высоком заднем медиастините используют доступ, предложенный В. И.
Разумовским (1899).
Больного укладывают на спину с
подложенным под плечи валиком, голова повернута вправо. Проводят разрез длиной
1012 см по переднему краю левой грудиноключичнососцевидной мышцы, начиная от
рукоятки грудины. Послойно рассекают кожу, клетчатку, поверхностную и 2ю фасции
шеи. Вместе с мышцей отводят кнаружи сосудистонервный пучок. Пальцем осторожно
создают канал, проникая вглубь и книзу позади пищевода, по направлению к
заднему средостению. Вскрывают гнойник, промывают и дренируют рану.
При задних медиастинитах в нижнем
отделе средостения можно использовать чрездиафрагмальную медиастинотомию по
СавиныхРозанову Брюшную полость вскрывают верхним срединным разрезом. Рассекают
треугольную связку печени и отводят левую ее долю книзу и вправо, обнажая
пищеводное отверстие диафрагмы. Брюшную полость ограничивают марлевыми
салфетками. Производят сагиттальный разрез диафрагмы кпереди от пищеводного
отверстия. Пальцем расслаивают клетчатку и проникают вверх вдоль пищевода,
достигая полости гнойника. После удаления гноя и введения дренажа тщательно
ушивают разрез диафрагмы вокруг него для создания полной герметичности и
условий, обеспечивающих последующее активное удаление патологического экссудата
из средостения. Поддиафрагмальное пространство также дренируют.
49. Дивертикулы пищевода. Классификация.
Клиника. Диагностика. Лечение
Дивертикул пищевода - ограниченное расширение просвета
органа в виде мешковидного выпячивания его стенки
Все известные классификации дивертикулов пищевода
основаны на их локализации и механизме возникновения. В 1840 г, Rokitansky, а
затем Zenker (1877) предложили различать пульсионные, тракционные и смешанные
дивертикулы. Эта простая схема деления сохранила свое значение до настоящего
времени.
Пульсионные дивертикулы пищевода формируются обычно в
результате длительного постоянного влияния повышенного внутрипросветного
давления на потенциально слабый участок стенки пищевода вследствие нарушения
нервномышечной координации или органического сужения просвета органа. Само
выпячивание чаще всего представлено слизистой оболочкой, вышедшей через
истонченную расслоившуюся мышечную стенку пищевода.
Тракционные дивертикулы чаще всего возникают при
вовлечении стенки пищевода в воспалительные и спаечные процессы, развивающиеся
в клетчатке средостения. В дальнейшем к первичной тракцип стенки органа нередко
присоединяется пульсионныи механизм, обусловленный задерживающейся в слепом
мешке дивертикула пищи. Таким образом, дивертикул приобретает смешанный
тракционнопульсионный характер
Следует выделять еще один вид дивертикулов -
функциональные (релаксацион ные). Они являются следствием расстройства
иннервации участка пищевода и проявляются появлением ограниченных выбуханий его
стенки во время фазы сокращения органа. Функциональные дивертикулы нередко
бывают множественными, имеют непостоянные размеры и исчезают при расслаблении
пищевода.
По локализации дивертикулы разделяют на
глоточнопищеводные (ценкеровские) бифуркационные и эпифренальные.
ГЛОТОЧНОПИЩЕВОДНЫЕ (ЦЕНКЕРОВСКИЕ) ДИВЕРТИКУЛЫ
Эти дивертикулы обычно имеют пульсионный характер и
встречаются в практической деятельности достаточно часто. Выходят они из
просвета органа на уровне перехода глотки в пищевод по его задней стенке. Для
формирования глоточнопищеводного дивертикула имеются определенные
анатомофункциональные предпосылки. Установлено, что между нижним сжимателем
глотки и перстневидноглоточной мышцей имеется участок слабо развитых мышц
глотки и пищевода (треугольник ЛанньеГеккермана). Второй аналогичный участок
расположен между перстневидноглоточной мышцей и мускулатурой пищевода
(треугольник ЛемераКиллиана).
В эти зоны при определенных условиях и выдвигаются
дивертикулы, которые чаще всего смещаются в левую, реже правую сторону. Размеры
дивертикулов колеблются в больших пределах: от сравнительно небольших (12 см)
до выпячивания слизистой в виде мешка значительных размеров, спускающегося в
заднее средостение.
Различают три стадии образования ценкеровского
дивертикула: 1) небольшое выпячивание слизистой оболочки пищевода; 2)
сформированный дивертикулярный мешок, располагающийся между пищеводом и
позвоночником; 3) дивертикул больших размеров, распространяющийся в
средостение.
Во второй стадии развития дивертикула устье его имеет
форму косо расположенного овала. По мере прогрессирования патологического
процесса отверстие дивертикула принимает горизонтальное положение,
способствующее быстрому наполнению его пищей. Наполненный дивертикулярный мешок
нередко сдавливает своей тяжестью просвет пищевода.
Стенка дивертикула чаще всего состоит из слизистой
оболочки, выстланной многослойным плоским эпителием, снаружи - из фиброзной
ткани и истонченных циркулярных мышечных волокон глотки у шейки дивертикула. В
стенке дивертикула обычно имеются воспалительные изменения, связанные, главным
образом, с застоем пищевых масс. В воспалительный процесс могут вовлекаться
окружающие ткани, вызывая картину перидивертикулита с образованием плотных
сращений на шее и в средостении.
Клиника и диагностика. Симптоматика глоточнопищеводных
дивертикулов широко варьирует в зависимости от их размеров и способности
опорожняться. Сравнительно небольшие выпячивания слизистой оболочки обычно
клинически не проявляются. По мере увеличения дивертикула больной начинает
ощущать некоторое неудобство в горле, легкие царапающие боли, чувство жжения,
першения в горле. Появляются кашель, незначительная саливация.
Характерная клиническая картина появляется при
полностью сформировавшемся дивертикуле (III стадия). Во время глотания при наполнении мешка пищей
и воздухом возникают булькающие звуки, слышимые на расстоянии. Постепенно
проявляются нарушения глотания. Это заставляет больных есть медленно, придавая
определенное положение голове и шее. Наиболее яркая симптоматика отмечается в
третьей стадии заболевания. Отчетливо проявляется дисфагия, регургитация,
признаки сдавления окружающих органов, легочные осложнения. Переполненный
пищевыми массами дивертикул оттесняет пищевод, вызывая иногда полную его
непроходимость. Для облегчения глотания больные расстегивают воротник, давят на
шею, нагибают голову в разные стороны, делают рвотные движения, срыгивают
задерживающиеся в дивертикуле пищевые массы. В ряде случаев больные выдавливают
содержимое дивертикула в рот или промывают его. Наступает заметное облегчение.
Часть застрявшей в мешке пищи застаивается и
разлагается. Появляется зловонный запах изо рта, диспепсические явления.
При большом глоточнопищеводном дивертикуле на боковой
поверхности шеи слева иногда отмечается выпячивание мягкой консистенции, над
которым перкуторно определяется тимпанический звук.
Сдавление трахеи вызывает затруднение дыхания, а
крупных венозных стволов - нарушение венозного оттока от головы и шеи.
В ряде наблюдений возможна регургитация и аспирация
содержимого дивертикула с развитием легочных осложнений (рецидивирующий
бронхит, пневмонии, абсцесс легкого). Длительный застой пищи способствует
развитию дивертикул ита, перидивертикулита с соответствующей симптоматикой. При
длительном течении воспалительного процесса возможны перфорация дивертикула или
развитие в нем злокачественной опухоли.
Окончательный диагноз пищеводноглоточного дивертикула
основывается на клинической картине заболевания и, главным образом, данных
рентгенологического исследования.
Лечение. Радикальным методом лечения является
оперативное удаление дивертикула. Консервативная терапия, включающая строгий
пищевой режим, мягкую диету, тщательное пережевывание пищи, промывание
дивертикула и тому подобное обычно назначается для подготовки больного к
операции. В редких случаях ею ограничиваются при наличии серьезных
противопоказаний к вмешательству.
Хирургическому лечению подлежат дивертикулы II и III
стадии, в первую очередь осложненные. Операцией выбора является одномоментная
дивертикулэктомия. Техника ее заключается в следующем. Производят разрез кожи
по переднему краю грудиноключичнососцевидной мышцы слева. Послойно рассекают
ткани, доходят до левой доли щитовидной железы. Последнюю мобилизуют,
отодвигают кверху и вправо. Сосудистонервный пучок шеи отводят крючком Фарабефа
кнаружи, раздвигают клетчатку и обнажают заднюю поверхность пищевода и глотки.
Глоточнопищеводнын дивертикул обычно располагается на уровне перстневидного
хряща. Его захватывают окончатым зажимом и тщательно выделяют из сращений до
самой шейки. На последнюю накладывают мягкие зажимы, между которыми шейку мешка
пересекают и дивертикул удаляют.
БИФУРКАЦИОННЫЕ ДИВЕРТИКУЛЫ
Дивертикулы средней трети пищевода располагаются
обычно на его переднебоковой стенке в области пересечения органа с бифуркацией
трахеи. Поэтому их называют эпибронхиальными, бифуркационными или
парабронхиальными. Встречаются они чаще глоточнопищеводных дивертикулов.
Клиника и диагностика. Клиническая картина
бифуркационных дивертикулов весьма неоднородна и, как правило, не имеет
характерной симптоматики. В ряде случаев они являются случайной находкой во
время лучевого исследования средостения и пищевода.
В клинически выраженных наблюдениях появляется чувство
тяжести в груди, эпизодические или постоянные загрудинные боли, усиливающиеся
при прохождении пищи по пищеводу. Боли нередко иррадиируют в спину, лопатку. Иногда
возникает упорный кашель, болезненность в груди при глубоком вдохе. Очень часто
одновременно с бифуркационными дивертикулами отмечаются другие заболевания
органов желудочнокишечного тракта (язвенная болезнь, гастрит, спастический
колит). Именно эти патологические состояния заставляют больных в первую очередь
обращаться за врачебной помощью,
Дисфагия у пациентов с бифуркационными дивертикулами в
большинстве случаев выражена незначительно, так как они самостоятельно хорошо
дренируются в пищевод. Лишь иногда появляется срыгивание съеденной пищей или
старыми пищевыми массами. На этом фоне возникает отрыжка с неприятным запахом.
Наиболее характерными осложнениями бифуркационных
дивертикулов являются дивертикулит, пищеводнотрахеальный свищ, аррозионное кровотечение,
развитие рака пищевода в области дивертикула.
Точное установление диагноза с детальной всесторонней
характеристикой бифуркационных дивертикулов обеспечивает рентгеноконтрастное
исследование пищевода.
Лечение. Выбор метода лечения бифуркационных дивертикулов
зависит от особенностей течения заболевания. У значительной части этих больных
оперативное вмешательство не показано. Хирургическому лечению подлежат
дивертикулы больших размеров с выраженной клинической картиной и признаками
длительной задержки контрастной взвеси в них. Операция показана также при
выраженной клинике дивертикулита, пищеводнотрахеальных свищах, развитии
кровотечения при аррозии сосудов.
Операцией выбора является дивертикулэктомия, реже
инвагинация по Жирару.
Техника дивертикулэктомии сводится к следующему.
Выполняют правостороннюю боковую торакотомию в пятомшестом межреберье. Легкое
отводят кнутри и кпереди. Рассекают медиастинальную плевру и перевязывают и
пересекают непарную вену. Выделяют из медиастинальной клетчатки пищевод и проводят
под него турникет. Обнаруживают дивертикул, который выделяют вплоть до шейки из
сращений. В затруднительных случаях для обнаружения дивертикула можно через
зонд ввести в пищевод воздух. При этом дивертикул раздувается и становится
хорошо заметным.
После выделения дивертикула со всех сторон основание
его прошивают сшивающими аппаратами или накладывают непрерывный Побразный
кетгуговый шов. После отсечения дивертикула той же нитью дополнительно
прошивают слизистую пищевода через край.
ЭПИФРЕНАЛЬНЫе (НАДДИАФРАГМАЛЬНЫЕ) ДИВЕРТИКУЛЫ
Эти дивертикулы по своей сути являются пульсионными, а
впоследствии могут приобретать черты смешанных,
В образовании эпифренальных дивертикулов ведущую роль
играет врожденная или приобретенная слабость мышечной оболочки пищевода, а
также факторы, способствующие повышению внутрипищеводного давления. Последнее
нередко возникает вследствие некоординированной перистальтики пищевода и его
нижнего сфинктера. Наддиафрагмальные дивертикулы обычно располагаются на
заднеправой стенке пищевода на 210 см выше диафрагмы. Форма их правильная
шаровидная с достаточно выраженной шейкой. Стенка дивертикулярных мешков
представлена слизистой оболочкой пищевода, отдельными истонченными мышечными
пучками в области шейки и наружной соединительнотканной оболочкой. Клиника и
диагностика. Клинические проявления эпифренальных дивертикулов обусловлены,
главным образом, дисфагией, в основе которой лежит сдавление пищевода
наполненным дивертикулярным мешком. Дисфагия более выражена в тех случаях,
когда шейка дивертикула располагается выше, чем дно, и условия для его
опорожнения плохие. Сопутствующий спазм пищевода в еще большей степени
способствует затруднению прохождения пищи. Воспалительный отек стенки пищевода,
нередко встречающийся в таких наблюдениях, ведет к развитию эзофагита и
дивертикулита, - что само по себе усугубляет дисфагию. Со временем длительный
воспалительный процесс в стенке пищевода ниже дивертикула может привести к
образованию стойкого органического стеноза этой зоны.
Дисфагия приобретает постоянный характер. Жалобы
больного и объективные клинические данные лишь позволяют предположить наличие
наддиафрагмального дивертикула. Установить же точный диагноз обычно удается с
помощью рентгеноконтрастного исследования пищевода. Трудности могут возникнуть
только с дифференциацией эпифренального дивертикула с параэзофагеальной грыжей.
Лечение. Во всех случаях при эпифренальных
дивертикулах показано оперативное лечение. Операцией выбора является
дивертикулэктомия. Предпочтителен правосторонний боковой доступ в
седьмомвосьмом межреберье. После рассечения медиастинальной плевры над
пищеводом выделяют со всех сторон дивертикул. Шейку дивертикула прошивают
механическим швом или синтетическим швом с атравматичной иглой. На мышечную
оболочку пищевода накладывают второй ряд узловых тонких синтетических швов.
Линию швов укрывают лоскутом париетальной плевры или диафрагмы
50. Химические ожоги пищевода. Патогенез
и патофизиология заболевания. Первая помощь при ожогах. Клиника. Диагностика.
Дифференциальный диагноз. Осложнения. Консервативное лечение в остром и
метаожоговом периоде. Место лечения в остром периоде. Раннее и позднее
бужирование
Ожоги пищевода возникают при
попадании в него едких химических веществ при случайном приеме внутрь или
вследствие суицидальных попыток.
Чаще ожоги возникают при приеме
едкого натра (каустическая сода, натрия гидроокись), концентрированных
растворов серной, хлористоводородной, уксусной (уксусная эссенция) кислот, реже
наблюдаются ожоги фенолом, лизолом, спиртовым раствором йода (йодная настойка),
сулемой.
Помимо пищевода, при приеме внутрь
едких веществ страдает также желудок; изменения обнаруживают на слизистой
оболочке полости рта и глотки. Принято считать, что при приеме сильной кислоты
наиболее выраженные изменения развиваются в пищеводе, а при приеме едкой щелочи
- в желудке (так как слизистая оболочка желудка в какойто степени устойчива к
действию кислоты). Степень поражения зависит от концентрации, характера и
количества выпитого вещества. Слизистая оболочка желудка поражается меньше,
если желудок заполнен жидкостью и пищей.
Ожоги щёлочами характеризуются более
глубоким и распространённым поражением стенки пищевода. Наиболее выраженные
изменения возникают в местах физиологических сужений
Стадии ожога
• I - гиперемия и отёк слизистой оболочки
•II - некроз и изъязвление слизистой оболочки
•III - образование грануляционной ткани
•IV - рубцевание
К концу первой недели
некротизированные участки отторгаются образуя изъязвления. Поверхностные язвы
эпителизируются в течение 1-2 мес, глубокие - в течение 2-6 мес с образованием
соединительной ткани.
Выделяют 3 степени ожога пищевода.
При ожоге 1 степени поражаются только поверхностные слои слизистой оболочки
пищевода; при ожоге II степени
поражение распространяется до мышечной его оболочки, при ожоге III степени наблюдается поражение всех
слоев пищеводной стенки, а также параэзофагеальной клетчатки и окружающих
органов. При ожоге III степени помимо
местных выражены и общие явления, обусловленные интоксикацией и шоком. При
ожогах II и особенно III степени (если больного удается спасти) развиваются
рубцовые изменения в пищеводе, стриктуры, рубцовое укорочение пищевода, в ряде
случаев - хроническое изъязвление стенки пищевода.
При ожоге пищевода в типичных случаях
течение подразделяют на 3 периода: 1й - острый (до 1-1 1/2 нед), проявляющийся
гиперемией, отеком, некрозом и изъязвлениями слизистой оболочки, в этот период
изза сильной боли глотание невозможно; 2й - подострый (1 1/2 -3 нед), период
грануляции и постепенного восстановления возможности принимать жидкость и пищу;
3й - хронический, период рубцевания, нарастающего сужения пищевода и
возобновления дисфагии.
Предварительный диагноз устанавливают
на основании анамнеза и оценки тяжести общего состояния больного. Характер
едкой жидкости, принятой больным, можно установить либо с его слов, либо по
остаткам жидкости, находящейся в емкости (чашка, пузырек, бутылка), из которой
больной ее пил. Следует, однако, иметь в виду, что надпись на флаконе или
бутылке не всегда соответствует характеру ее содержимого (едкое вещество может
по небрежности храниться в случайной, неприспособленной посуде).
Первый и наиболее яркие симптомы -
сильное жжение и боль в полости рта, глотки, за грудиной и в эпигастральной
области, возникающие сразу вслед за проглатыванием едкого вещества. Нередко
появляется рвота. Губы отекают.
В тяжелых случаях развиваются шок,
потеря сознания. Если в течение 1-2 дней смерть больного не наступила,
появляются выраженная одышка вследствие отека гортани, рвота слизью и кровью, в
рвотных массах можно определить кусочки слизистой оболочки. Повышается
температура тела. Глотание невозможно. Вследствие глубокого поражения стенки
пищевода возможны пищеводные кровотечения, симптомы, обусловленные развитием
медиастинита или других осложнений, нарушения функции почек (вследствие их
токсического поражения).
В случаях средней тяжести через
несколько дней уменьшается боль, однако глотание затруднено, отмечаются
повышенная саливация, срыгивание кровянистым отделяемым. При осмотре полости
рта видны следы ожога слизистой оболочки. Через 10-20 дней постепенно
восстанавливается способность проглатывать жидкость и жидкую пищу, однако
глотание долго остается болезненным. В период рубцевания, через несколько
недель дисфагия возобновляется; при резком стенозировании пищевода больной не
может принимать жидкость и пищу, развивается истощение.
При тяжелых отравлениях едкими
веществами больные умирают вследствие интоксикации, шока, развития гнойных
осложнений (медиастинит, абсцесс и гангрена легкого, плеврит). Из осложнений
могут наблюдаться тяжелые пищеводные кровотечения, перфорации пищевода,
развиваться пищеводнотрахеальные и пищеводнобронхиальные свищи. Наиболее частым
поздним осложнением химических ожогов пищевода является развитие Рубцовых
сужений (стенозов) пищевода, его рубцовых деформаций и укорочения.
Окончательный диагноз устанавливают
тогда, когда можно точно определить степень поражения и возникшие осложнения.
Рентгенологическое исследование
пищевода в первые дни проводить не следует, необходимо добиться стабилизации
состояния больного. Через несколько дней после ожога (при средней тяжести
поражения) при концентрированном рентгенологическом исследовании можно отметить
отечность слизистой оболочки пищевода и локальные спазмы. В более поздние
периоды информативность рентгенологического исследования значительно выше:
можно определить места, протяженность и выраженность рубцовых сужений и
деформаций пищевода.
Эзофагоскопия в первые дни
противопоказана, в дальнейшем возможна только в периоде рубцевания и эпителизации
слизистой оболочки, при этом проводить ее следует крайне осторожно.
Эзофагоскопия позволяет определить протяженность поражения, проследить за
динамикой процесса, своевременно выявить формирующиеся стриктуры (они чаще
образуются в дистальном отрезке пищевода, над кардиальным сфинктером; несколько
реже в области глоточнопищеводного соединения и на уровне бифуркации трахеи).
Неотложная терапия; необходимы
срочная госпитализация, парентеральное введение обезболивающих средств (для
борьбы с шоком), введение желудочного зонда, обильно смазанного маслом, для
выведения желудочного содержимого и промывания желудка с целью нейтрализации
едкого вещества. При отравлениях щелочами желудок промывают разведенным
раствором уксусной кислоты (3-6%) или растительным маслом, при отравлениях
кислотами - слабым (2%) раствором натрия гидрокарбоната. В сомнительных случаях
желудок промывают молоком. До введения зонда назначают обильное питье слабых
растворов уксусной кислоты или гидрокарбоната натрия (в зависимости от характера
яда)
Промывание с помощью зонда проводят
после предварительного введения под кожу наркотических анальгетиков (промедол 1
мл 2% раствора) и атропина сульфата (1 мл 0,1% раствора), а также местной
анестезии полости рта и глотки 2% раствором дикаина. Промывание желудка
эффективно только в первые 6 ч после отравления. Необходима дезинтоксикационная
терапия. Парентерально вводят гемодез, реополиглюкин, солевые растворы. Для
профилактики и лечения инфекционных осложнений назначают парентерально антибиотики
широкого спектра действия (ампициллина натриевая соль, ампиокс, гентамицина
сульфат, цефамезин и др.). Чтобы уменьшить развитие рубцовых изменений в
пищеводе, назначают препараты гормонов коры надпочечников парентерально. В
зависимости от характера принятого яда и особенностей клинической картины
применяют средства, нормализующие деятельность сердечнососудистой системы,
функцию почек, при значительной кровопотере проводят гемостатическую и
кровезамещающую терапию и т. д.
Введение жидкости внутрь в первые 1
-3 сут исключается, а в более тяжелых случаях этот запрет продолжается до 5-7
дней, затем дробными порциями в небольших количествах разрешают прием сливок,
молока, сырых яиц, теплого бульона. Постепенно диету расширяют. При тяжелых
ожогах пищевода для обеспечения питания больного через 7-10 дней накладывают
гастростому.
После стихания острых воспалительных явлений при
ожогах 2-3й степени с целью ранней профилактики развития стенозов начинают
бужирование пищевода, которое продолжают несколько недель. Бужирование полыми
рентгеноконтрастными бужами по металлическому проводнику под контролем
эзофагоскопа по принципу бужирование без конца (бужирование с последовательным
увеличением диаметра бужей в течение одной процедуры с использованием
гастростомы - бужи проводят через ротовую полость, пищевод и гастростому) Если
развитие стеноза не удается предотвратить, прибегают к оперативному лечению -
созданию искусственного пищевода. При своевременно начатом лечении
благоприятные результаты наблюдаются в 90% случаев. Позднее бужирование
пищевода проводят после тщательного общеклинического обследования больного,
рентгенологического и эзофагоскопического исследований. Бужирование начинают с
бужей № 8-10, постепенно переходя к бужам большего диаметра. Процедуру проводят
ежедневно или через день, а по достижении достаточного эффекта - 1-2 раза в
неделю на протяжении 3-4 мес, а иногда до полугода и более. Даже при хорошем и
относительно стойком результате, достигнутом при бужировании, стриктура
обладает тенденцией к сужению, поэтому больные, перенесшие химические ожоги
пищевода и лечение бужированием, должны находится под контролем и при
необходимости проходить повторные курсы лечения.
Осложнения
• Рубцовое сужение пищевода
• Внутрисосудистый гемолиз при ожогах уксусной эссенцией
• Аспирационная пневмония
• Психоз
• Сепсис.
51.
Рубцовые сужения пищевода после химического ожога. Клиника. Диагностика.
Дифференциальный диагноз. Локализация и формы сужения. Методы бужирования.
Показания к хирургическому вмешательству. Оперативное лечение: подготовка,
доступы, анестезия, виды операций. Органы для эзофагопластики. Пути проведения
трансплантата по отношению к грудной клетке и плевральной полости.
Рубцовые сужения пищевода разделяются:
.По числу пораженных органов:
изолированные;
сочетанные сужения пищевода и желудка или
двенадцатиперстной кишки.
.По протяженности:
мембранозные (мембранозные) до 1см;
короткие (стриктуры) до 5 см;
протяженные (стенозы) более 5 см.
.По числу сужений в пищеводе:
единичные;
множественные.
.По степени рубцовых изменений стенки пищевода:
несформированные;
сформированные, (с супрастенотическим расширением).
. По наличию деструктивных изменений:
ульцерированные (изъязвленные);
простые (не ульцерированные).
. По срокам формирования:
ранние до 6 месяцев;
поздние от 6 месяцев и более.
. По степени облитерации просвета пищевода:
полные;
частичные.
. По виду расположения устья сужения:
с прямым расположением входа;
с эксцентрично расположенным входом.
Глубина, тяжесть и протяженность ожога пищевода зависит
от концентрации, природы химического вещества, его количества, времени контакта
со слизистой, резорбтивного действия и реактивности организма пострадавшего. В
зависимости от указанных выше причин принято различать три степени ожога
пищевода:
I степень ЛЕГКАЯ десквамативный эзофагит (повреждение
поверхностных слоев эпителия) гиперемия, отек, повышенная ранимость слизистой
оболочки. Воспалительные явления сохраняются не более 24 дней.
II степень СРЕДНЯЯ фибринозный, эрозивный эзофагит
(повреждения слизистой, часто подслизистого слоя) выраженный отек, фибринозные
наложения, покрывающие изъязвления, просвет может не дифференцироваться.
Поверхностные язвы эпителизируются к концу 23 недели.
III степень ТЯЖЕЛАЯ язеннонекротический эзофагит
(некроз захватывает стенку органа на всю глубину вплоть до околопищеводной
клетчатки). Продолжительность течения процесса отторжения и рубцевания, в
случае благополучного исхода интенсивной первичной терапии, до 2 и более лет.
Развитие патоморфологического процесса в пищеводе и
желудке разделяют (Э.Н.Ванцян, Р.А.Тощаков, 1971) на 5 стадий:
стадия повреждение тканей;
стадия острое воспаление (от первых часов до 310
суток), характеризуется отеком, фибринозным налетом на гиперемированной
слизистой;
стадия отторжение некротических масс и образование
изъязвлений (от8 до 18 дней), период опасен развитием кровотечений;
стадия развитие грануляций (начиная с 2 4 недель и
продолжается несколько месяцев); ее клинические проявления определяются
скоростью развития грануляционных тканей;
стадия рубцевание (длительность от 1месяца до 3лет и
более).
При IIIII
степени ожогового поражения пищевода, начиная со второй недели, острые
воспалительные изменения сменяются стадией изъязвления. Симптомов нарушения
проходимости пищевода, как правило, не отмечается. Этот период многими авторами
обозначается как мнимое благополучие, иногда его клинически расценивают как
полное выздоровление. Рубцовые изменения в эти сроки еще не наступают. При
ожогах III степени период мнимого благополучия
оказывается истинным эрозии эпителизируются к концу 34 недели. При ожогах III степени, с конца 23 недели наступает
стадия развития грануляционной ткани, периодически возникают симптомы дисфагии.
Если не придать этому значения, то к концу 45 недели усиливаются проявления
"перемежающейся" дисфагии, связанные с рубцовыми изменениями. Исходом
ожога пищевода III стадии
является формирование органического сужения или полная рубцовая непроходимость.
Сложность проблемы заключается в том, что из всей группы больных, поступивших с
клиникой химического ожога органов верхнего отдела ЖКТ, необходимо выделить
нуждающихся в проведении раннего профилактического бужирования. Несмотря на то,
что первые клинические проявления формирования РСП появляются через 23 недели
после ожоговой травмы, нередко начало бужирования задерживается на значительное
время, часто до возникновения тяжелых обменных нарушений в результате рубцовых
изменений стенки пищевода.
Больным с грубыми циркулярными поражениями и
ригидностью стенок пищевода необходимо проводить ПРОФИЛАКТИЧЕСКОЕ бужирование,
начиная с 1 2 недели после ожоговой травмы.
После выполнения полного объема обследования
(неотъемлемой частью которого является рентгенологическая диагностика и
эндоскопическое исследование, а нередко их сочетание), проводится бужирование,
начиная с бужей наименьшего диаметра.
ПОКАЗАНИЯ ДЛЯ БУЖИРОВАНИЯ РСП С ИСПОЛЬЗОВАНИЕМ ГИБКОГО
ПРОВОДНИКА
Протяженные РСП, осложненные:
сложным ходом канала;
множественностью сужений;
максимальной степенью сужения (менее 2 мм);
эксцентричным расположением просвета и наличием
псевдодивертикулов
При наличии РСП диаметром не менее 5 6 мм, можно
попытаться провести эндоскоп уменьшенного диаметра через суженный участок
пищевода в желудок. По инстументальному каналу эндоскопа, в антральный отдел
желудка устанавливается струнанаправитель. Плавно извлекая эндоскоп из желудка,
пищевода и одновременно продвигая струну направитель вниз по инструментальному
каналу, под контролем зрения металическая струна установливается в антральный
отдел желудка и затем, после извлечения аппарата, фиксируется у зазубника
ассистентом. По установленной струненаправителю выполняется бужирование по
общепринятой методике.
Применение методики бужирования с использованием
эластичного проводника дает возможность:
сократить количество сочетанных рентгенэндоскопический
вмешательств;
уменьшить лучевую нагрузку на пациента и медперсонал;
выполнять бужирование преимущественно амбулаторно изза
минимальной опасности возникновения осложнений.
После курса стационарного лечения и проведения бужей
№№ 36 40 больные переводятся на амбулаторное поддерживающее бужирование,
которое выполняется с возрастающим интервалом между сеансами от 1 раза в 8 10
дней до 1 раза в 2 3 месяца на протяжении 1,5 3лет. За это время, как
правило, формируется рубец в области химического ожога дилатированный "на
буже" до диаметра, достаточного для адекватного питания. Однако, признаки
хронического эзофагита с периодическими обостениями в зоне бывшего глубокого
ожога пищевода обнаруживаются в течение всей жизни. Восспалительный процесс то
усиливаясь, то стихая исключительно редко ликвидируется совсем.
Одномоментно с бужированием пациенты проходят
амбулаторно курсы физиотерапевтического и общеукрепляющего лечения с интервалом
1 раз в 6 9 месяцев.
Показания к операции:
. Полная рубцовая непроходимость пищевода не
подающаяся бужированию. 2. Ограничения возможности проведения бужа выше N 2426
(по шкале Шарьера) и частые рецидивы сужения на протяжении 23 лет. 3. Развитие
вторичного укорочения пищевода и тяжелого рефлюксэзофагита, приводящего к
рецидиву РСП. 4. Развитие выраженного супрастенотического расширения над
сужением с проявлениями тяжелого хронического эзофагита на фоне стойкой атонии
и истончения стенок 5. Свищи пищевода, при которых бужирование противопоказано.
6. Рак пищевода, развившийся на фоне РСП.
Операция Ру- Герцена состоит из трех этапов: 1.
Лапаротомия, мобилизация верхнего отрезка тощей кишки и пересечение ее на
расстоянии 15-20 см от двенадцатиперстнотощей связки; восстановление проходимости
путем вшивания приводящего конца в бок отводящего; зашивание конца кишки,
мобилизованной для образования искусственного пищевода, и проведение последней
впередигрудинно, в образованном в подкожной клетчатке туннеле.
. Повторная лапаротомия, пересечение тощей
кишки выше анастомоза, образованного при первой лапаротомии, ушивание
приводящего конца кишки (искусственного пищевода) в желудок и зашивание
отводящего конца кишки.
. Выделение шейной части пищевода
продольным разрезом на левой половине шеи, пересечение его, ушивание отводящего
конца и соединение приводящего с подведенной кишкой. Для успешного завершения
всех трех этапов операции требуется предварительное образование желудочного
свища для питания больного.
С. С. Юдин внес изменения в операцию Ру - Герцена,
Он исключил второй этап операции, т. е. не соединял искусственный пищевод с
желудком, чем исключалось прохождение пищи через желудок, а этим самым желудок
выключался из акта пищеварения. Таким образом, это изменение шло в разрез с
физиологией пищеварения, и в настоящее время все хирурги от него отказались.
Второе изменение заключалось в том,
что С. С. Юдин отказался от пересечения шейной части пищевода и
соединение его с подведенной кишкой стал производить бок в бок. В случаях, где
сужение пищевода начинается более низко, соединение его с подведенной кишкой
бок в бок имеет отрицательную сторону: ниже анастомоза остается слепой мешок, в
котором скапливается и задерживается пища. Иногда это причиняет пострадавшему
боль.
Существующие методы пластики пищевода можно разбить на
4 группы:
) тотальная предгрудинная пластика из кожи;
) тотальная предгрудинная пластика из кишки (тонкой,
толстой) и желудка;
) комбинированные способы предгрудинной пластики
(кишечнокожная, желудочнокожная);
) загрудинная (трансмёдиастинальная) пластика
пищевода;
) внутригрудная пластика.
Тотальная пластика из кожи. После предварительного
создания желудочного свища (гастростомия - первый этап) на передней поверхности
грудной стенки производятся два параллельных разреза, внутренние края которых
после частичной отсепаровки сшиваются поверх резиновой трубки в виде цилиндра.
Наружные края этого же разреза сшиваются поверх вновь образованного цилиндра.
Во второй этап производится соединение орального конца кожной трубки с шейным
отделом пищевода и дистального с желудком.
Недостатками этой операции являются трудности
герметического смыкания кожной трубки с пищеводом и, особенно, желудком,
развитие на этой почве свищей, а также развитие упорных дерматитов внутри
кожной трубки.
Тотальная предгрудинная пластика из кишки. Наибольшее
распространение в СССР и ряде стран мира благодаря работам С. С. Юдина и его
учеников получила операция предгрудинной пластики из тонкой кишки (операция
Ру-Герцена-Юдина). Операция производится больным с оформленным заранее
желудочным свищом.
Производится срединная верхняя лапаротомия (при
условии расположения желудочного свища по левой параректальной линии). Отступя
на 8-10 см от flexura duodenojefunalis, мобилизуется петля тонкой кишки с
обязательным сохранением артериальных аркад ее брыжейки, обеспечивающих ей
надежное питание. После мобилизации петли кишки, длина которой достаточна для
выведения ее из эпигастральной области на шею, верхний конец пересекается,
кишечный конец закрывается наглухо кисетным швом, а короткий дуоденальный
отрезок анастомозируется конец в бок с отводящим коленом мобилизованной кишки
(Уобразное соустье). С помощью специальных подкожных расширителей создается
подкожный предгрудинный туннель, в который проводится мобилизованная петля
кишки и фиксируется к коже шеи. Нормальный цвет кишки, сохранение перистальтики
являются непременным условием для успеха пластики. Через 5- 7-10 дней
производится под местной анестезией соединение шейного отдела пищевода с
выведенной кишкой.
С успехом может быть использована в целях пластики
правая половина толстой кишки или поперечноободочная кишка, имеющая мощные
сосудистые аркады.
В тех случаях, где по анатомическим особенностям не
удается мобилизовать участок кишки достаточной длины, последнюю выводят на
соответствующий уровень грудной клетки, надставляя недостающий отрезок кишки
кожной трубкой (комбинированная пластика - III тип).
Загрудинная (трансмедиастинальная) пластика. При этой
операции мобилизованная петля кишки проводится сзади грудины через переднее
средостение на шею, где соединяется с пищеводом выше уровня препятствия.
Физиологические и косметические преимущества этой операции очевидны.
Недостатками являются значительные трудности в ее выполнении и опасность
некроза мобилизованной кишки внутри средостения с последующим развитием
медиастинита.
52. Кардиоспазм (ахалазия кардии).
Классификация. Клиника. Диагностика. Дифференциальный диагноз. Принципы
лечения. Кардиодилатация. Показания к операции и виды вмешательств
Ахалазия кардии - одно из наиболее
распространенных нервномышечных заболеваний пищевода. Основными клиническими
проявлениями его являются дисфагия и регургитация, возникающие вследствие
стойкого нарушения рефлекторного открытия кардии при глотании, изменения
перистальтики и ослабления тонуса стенки пищевода. установлено, что ведущими
этиологическими факторами заболевания являются конституциональные неврастении с
предрасположенностью к возникновению под влиянием всевозможных внешних
раздражителей неврогенной дпекоординации моторики пищевода, в том числе и его
терминального отдела; рефлекторные дисфункции пищевода с формированием ахалазии
кардиального сфинктера; врожденные аномалии развития нервного аппарата и
пищевода, предрасполагающие к развитию болезни при определенных условиях;
инфекционнотоксические или вирусные поражения нервных сплетений пищевода и кардии.
В начале заболевания нарушение
проходимости кардии имеет чисто функциональный характер, что доказывается и
фармакологическими пробами (с нитроглицерином и ацетилхолином). В дальнейшем
нарастают рубцововоспалительные изменения в стенке пищевода и кардии, стенка
кардиального сегмента пищевода становится ригидной, малоэластичной, плохо
растягивается, не поддается лекарственной терапии. Непропульсивные сегментарные
сокращения пищеводной стенки не в состоянии протолкнуть пищевой комок сквозь
функциональный барьер в виде нерасслабившегося нижнего пищеводного сфинктера.
Вследствие этого проглатываемая пища надолго задерживается в пищеводе и
поступает в желудок только при заполнении пищевода до определенного уровня,
когда под влиянием гидростатического давления столба жидкости в пищеводе
происходит механическое насильственное раскрытие кардии, не связанное с
глотанием.
Длительный застой пищевых масс, слюны
и слизи в пищеводе вызывает ряд дополнительных его изменений в виде расширения
просвета органа, эзофагита, периэзофагита. Это в свою очередь еще больше
усугубляет нарушение перистальтики пищевода.
Известен ряд классификаций ахалазии
кардии. В основу большинства из них положены клиникорентгенологические и
морфологические признаки, длительность заболевания, присоединяющиеся инфекции.
Т. А. Суворова (1959) предложила выделять два типа ахалазии кардии: при первом
типе нижний отрезок пищевода сужен, отмечается одновременная дистрофия и
гипертрофия его циркулярных мышечных волокон. Вышележащий отдел пищевода
умеренно расширен, весь орган имеет цилиндрическую или веретенообразную форму.
При втором типе нижний отрезок пищевода резко сужен, мышечная оболочка его
атрофична, имеются прослойки грубоволокнистой соединительной ткани. Вышележащие
отделы пищевода резко расширены, диаметр его может Достигать 1618 см. Стенка
органа чаще всего умеренно утолщена за счет гипертрофии мышечного слоя, а в
некоторых случаях атрофична. Часто пищевод имеет Sобразную форму.
В дополнение А. Л. Гребнев (1969)
выделяет три стадии развития заболевания:
/ стадия - субкомпенсации
(периоды дисфагии редки и не нарушают самочувствия и общего состояния
больного);
// стадия - декомпенсации
(значительная задержка пищевых масс в пищеводе, нарушается питание, уменьшается
масса тела больного, нередко наблюдается частая и обильная регургитация; угроза
возникновения легочных осложнений);
III стадия - резкой декомпенсации (резко
нарушено питание, кахексия, дистрофические изменения органов, дегидратация,
авитаминоз).
Основу клинической картины ахалазии
кардии составляют дисфагии, регургитации и боли.
Наиболее ранним и характерным
симптомом является дисфагия. В большинстве случаев она развивается постепенно.
Дисфагические проявления, вначале неотчетливые и редкие, с течением времени
возникают все чаще и становятся яснее, пока не принимают постоянного характера.
Различные неблагоприятные факторы (спешка, заглатывание плохо пережеванных
кусков пищи, питье холодной воды и др.) ведут к еще большему усилению
расстройств глотания. Дисфагия также усиливается вследствие отрицательных
эмоций, волнений, переживаний, излишнего внимания окружающих.
На фоне прогрессирования заболевания
больными вырабатываются различные приемы, облегчающие прохождение пищи в
желудок, - заглатывание воздуха во время еды, глубокие вдохи с натуживанием,
запрокидывание головы назад, энергичная ходьба, подпрыгивание на месте.
У большинства больных с ахалазией
кардии наблюдается регургитация. В поздних стадиях заболевания, когда пищевод
расширен и вмещает до 2 л жидкости, она бывает более редкой, но обильной.
Иногда она возникает через 24 ч после еды,
особенно при сильном наклоне туловища
или в положении лежа. У больных со вторым типом ахалазии кардии регургитация
наблюдается во время сна, нередко с поперхиванием и приступами судорожного
мучительного кашля, возникающими изза аспирации пищевых масс в дыхательные
пути.
Чувство давления и боли за грудиной
также являются частыми симптомами ахалазии кардии.^Они обусловлены, главным
образом, растяжением пищевода, его нервных сплетений, сдавлением нервных
структур средостения. По мере расширения пищевода интенсивность болей
уменьшается, появляются тупые, распирающие болевые ощущения за грудиной. При
присоединении эзофагита появляется жжение по ходу пищевода, повышенное
слюноотделение, неприятный запах изо рта.
Почти у всех больных с течением
времени отмечается более или менее значительное похудание.
Развитию эзофагита, в различной
степени выраженного, способствуют длительный застой в пищеводе пищевых масс,
слизи, возникновение в них гнилостных процессов с последующим инфицированием
стенки органа и кровотечением. Длительный эзофагит с задержкой пищевых масс
благоприятствует возникновению рака пищевода.
Периодическое длительное затекание в
дыхательные пути содержимого пищевода при регургитации способствует
формированию хронического бронхита, аспирационной пневмонии, абсцесса легкого,
бронхоэктазов.
Диагностика ахалазии кардии помимо
клинических проявлений основывается на данных лучевого исследования, эзофагоскопии
и эзофагоманометрии, фармакологических проб.
Наиболее информативным является
рентгенологический метод, позволяющий точно установить диагноз у подавляющего
большинства больных с ахалазией кардии. Основными скиалогическими симптомами
данного заболевания, которые обнаруживаются при рентгеноконтрастном
исследовании пищевода, являются сужение пищеводножелудочного перехода,
затруднение прохождения контрастного вещества в этой области и диффузное
расширение проксимальных отделов пищевода.
Дифференцировать ахалазию кардии
следует с раком пищеводножелудочного перехода и Рубцовым стенозом этой области.
В пользу ахалазии свидетельствуют наличие складок слизистой оболочки в зоне
сужения, резкое диффузное расширение всего пищевода выше сужения, отсутствие газового
пузыря желудка, многолетний анамнез заболевания.
Эзофагоскопия в сомнительных случаях
позволяет уточнить диагноз или провести дифференциальную диагностику с другими
клинически схожими заболеваниями.
Лечение. Консервативное лечение
ахалазии кардии, имеющее обычно временный эффект, применяют в начальных стадиях
заболевания. Оно включает диету (кашицеобразная, химически щадящая пища с
достаточным количеством белков и витаминов), местные анестетики, спазмолитики,
мхолинолитики, витамины, седативные препараты, физиотерапию.
В случаях развивающегося заболевания
с четкой клинической картиной применяют кардиодилатанию или оперативное
лечение.
Кардиодилатацию чаще применяют в I, II стадиях заболевания. Противопоказанием к кардиодилатацин
являются тяжелая сердечная недостаточность, хроническая ишемическая болезнь
сердца с частыми приступами стенокардии, варикозное расширение вен пищевода,
выраженный эзофагит, стеноз привратника, поздние сроки беременности,
заболевания, сопровождающиеся пониженной свертываемостью крови и повышенной
кровоточивостью.
Перед выполнением кардиодилатации
тщательно промывают пищевод дезинфицирующим раствором и отсасывают его
содержимое через зонд. Подкожно вводят 1 мл 1% раствора промедола и 1 мл 0,1%
раствора атропина. Смазывают глотку и корень языка 1% раствором дикаина в дозе
1 мл на 10 кг массы больного. Под рентгенологическим контролем вводят в пищевод
и правильно устанавливают кардиодилататор. Расширение кардии продолжается 1025
мин.
При использовании дилататора Штарка
раскрывают бранши, а при применении пневмо или гидрокардиодилатации под
определенным давлением в баллон нагнетают воздух или воду. Через 24 дня
проводят повторные сеансы. Общее число их составляет от 2 до 7.
Наиболее тяжелыми осложнениями
кардиодилатации являются перфорация и разрыв пищевода, кровотечение из органа.
Хирургическое лечение ахалазии кардии
в значительной степени является симптоматическим, устраняющим главное страдание
- непроходимость пищеводножелудочного перехода.
Наибольшее распространение получили
различные варианты внеслизистой эзофагокардиомиотомии - операция Геллера.
Техника видоизмененной
эзофагокардиомиотомии по Геллеру сводится к следующему. Выполняют верхнюю
серединную лапаротомию. Рассекают левую треугольную связку печени и отводят ее
левую долю. Диафрагму рассекают кверху на 45 см, предварительно прошив и
перевязав нижнюю диафрагмальную вену. Выделяют пищевод до расширенной его части
и берут на держалку. Переднюю стенку пищевода рассекают до слизистой от
расширенной его части до перехода в желудок. Длина расширения мышц пищевода и
желудка должна быть не менее 810 см. Разрез на пищеводе не зашивают. Диафрагму
ушивают.
53. Недостаточность кардии.
Рефлюксэзофагит. Клиника. Диагностика. Осложнения. Дифференциальный диагноз.
Показания к оперативному лечению. Виды операций
Недостаточность кардии - синдром,
возникающий вследствие нарушения физиологического механизма запирания кардии.
Чаще наблюдается при аксиальных
грыжах пищеводного отверстия диафрагмы вследствие смещения нормального
сфинктера из пищеводного отверстия в грудную полость, отсутствия подкрепляющего
действия диафрагмальных ножек и сглаживания пищеводножелудочного угла.
Встречается также после операций, сопровождающихся резекцией или повреждением
кардиального сфинктера, при системном прогрессирующем склерозе (склеродермии)
вследствие атрофии гладких мышц зоны кардии.
При язвенной болезни, холелитиазе и в
некоторых других случаях может иметь место относительная, т. е. функциональная,
недостаточность кардии изза спастического сокращения привратника и гипертонуса
желудка, повышения внутрижелудочного давления. Наблюдается также при
беременности, больших опухолях брюшной полости, асците вследствие значительного
повышения внутрибрюшного давления.
Клиника. Основными симптомами
являются отрыжка воздухом и срыгивание желудочным содержимым (при наклоне
туловища, в положении лежа). При сохраненной секреции желудочного сока
возникает рефлюксэзофагит, имеющий свою характерную симптоматику.
Диагноз. Рентгенологическое
исследование позволяет определить желудочнопищеводный рефлюкс как проявление
недостаточности кардии. Однако исследование нужно проводить и в положении
пациента лежа с применением специальных диагностических приемов, повышающих
внутрибрюшное давление (натуживание, покашливание, давление тубусом на эпигастрий
и т. д.). Эзофагоскопия позволяет выявить недостаточность кардии и
рефлюксэзофагит. Тонус кардиального сфинктера можно точно оценить методом
графической регистрации внутрипищеводного давления - эзофаготонокимографией.
Желудочнопищеводный рефлюкс можно выявить при рНметрии пищевода и пробой с
метиленовым синим, раствор которого вводят в желудок, а затем с помощью зонда
откачивают содержимое пищевода; появление окрашенной жидкости подтверждает
рефлюкс.
Осложнения: развитие
рефлюксэзофагита, пептической язвы и стриктуры пищевода, пищеводных
кровотечений из воспаленной слизистой.
Лечение прежде всего направлено на
предупреждение желудочнопищеводного рефлюкса. Рекомендуется ограничение
физических нагрузок, связанных с напряжением брюшного пресса и наклонами
туловища. Спать рекомендуется с высоко приподнятым изголовьем. Лечение также
включает терапию рефлюксэзофагита. При отсутствии эффекта и возникновении
осложнений прибегают к хирургическому лечению: выполняют фундопликацию
(подшивание желудка к диафрагме вокруг пищеводного отверстия с фиксацией его
малой кривизны к брюшной стенке для восстановления острого угла между дном
желудка и брюшной часть пищевода), пилоропластику (хирургическая операция:
рассечение стенки привратника или иссечение ее участка с последующим ушиванием
образовавшегося дефекта;), селективную ваготомию.
Рефлюксэзофагит - это развитие
воспалительного поражения пищевода вследствие повторяющегося заброса в пищевод
желудочного содержимого.
Проявления рефлюксэзофагита выявляют почти у половины
взрослого населения, эндоскопические признаки - более чем у 10% лиц,
подвергшихся эндоскопическому исследованию. Пищевод Берретта развивается у 20%
больных рефлюксэзофагитом (0,4% населения).
Классификация рефлюксэзофагита
· Степень А - одно (или более)
поражение слизистой оболочки менее 5 мм, ограниченное пределами складки
слизистой оболочки
· Степень В - одно (или более)
поражение слизистой оболочки более 5 мм, ограниченное пределами складки
слизистой оболочки
· Степень С - одно (или более)
поражение слизистой оболочки, распространяющееся на 2 и более складки слизистой
оболочки, но занимает менее 75% окружности пищевода
· Степень D - одно (или более)
поражение слизистой оболочки, распространяется на 75% и более окружности
пищевода.
Проявления рефлюксэзофагита
Изжога - наиболее характерный признак
(испытывают 83% больных), появляется в результате длительного контакта кислого
желудочного содержимого со слизистой оболочкой пищевода. Изжога усиливается при
погрешностях в диете, приёме алкоголя, газированных напитков, физическом
напряжении, наклонах и в горизонтальном положении. Отрыжка, усиливается после
еды, приёма газированных напитков. Срыгивание пищи, усиливается при физическом
напряжении .Нарушение глотания. Боли в подложечной области или за грудиной - появляются
вскоре после еды, усиливаются при наклонах туловища, в горизонтальном
положении. Реже возникают ощущение кома в горле при глотании, боль в ухе и
нижней челюсти, боли в грудной клетке, которые могут провоцироваться физической
нагрузкой. Внепищеводные проявления - хронический кашель, пневмония, осиплость
голоса, кариес зубов и т.д.
Диагностика рефлюксэзофагита
· Рентгенологическое исследование лёжа
на спине или в вертикальном положении при сильном наклоне пациента кпереди:
заброс сульфата бария в пищевод
· Эндоскопическое исследование с
биопсией
· Эзофаготонокимография (манометрия)
· Суточная рНметрия - основной метод
контроля эффективности лечения.
· Билиметрию проводят для выявления
щелочных (жёлчных) рефлюксов
· Сцинтиграфия показана для выявления
моторноэвакуаторных нарушений пищевода
· Омепразоловый тест
· Тест Бернстайна
· Лечение рефлюксэзофагита
· Прекращение курения
· Нормализация массы тела
· Подъём головного конца кровати
· Избегать нагрузки на мышцы брюшного
пресса, работы с наклоном туловища, ношения тугих поясов, ремней
Нежелателен приём лекарственных
средств, снижающих тонус пищеводного сфинктера (нитраты, антагонисты кальция,
теофиллин, прогестерон, антидепрессанты)
Диета: ограничение продуктов,
усиливающих газообразование, острой, очень горячей или холодной пищи; избегать
приёма алкоголя, продуктов, снижающих тонус нижнего пищеводного сфинктера (лук,
чеснок, перец, кофе, шоколад и др.); избегать переедания, последний приём пищи
- не позднее чем за 3-4 часа до сна.
Лекарственную терапию проводят не
менее 8-12 недель с последующей поддерживающей терапией в течение 6-12 месяцев.
Применяют ингибиторы протонного насоса (омепразол, лансопразол, рабепразол) в
обычной или двойной дозировке, антациды (альмагель, фосфалюгель, маалокс,
гелусиллак и др.) назначают обычно через 1,5-2 часа после еды и на ночь.
Прокинетики - домперидон, метоклопрамид.
Хирургическое лечение. Показания к оперативному
лечению: осложнения рефлюксэзофагита (стриктуры пищевода, повторные
кровотечения, пищевод Берретта), неэффективность медикаментозной терапии (в
течении 6 месяцев) у молодых пациентов, сочетание рефлюкса с бронхиальной
астмой
54. Доброкачественные опухоли и кисты
пищевода. Классификация. Клиника. Диагностика. Дифференциальный диагноз.
Лечение.
Доброкачественные опухоли пищевода
встречаются довольно редко. Они составляют всего 0,5-5 % от всех опухолевых
поражений пищевода. Наиболее часто различные доброкачественные опухоли пищевода
встречаются у людей в возрасте 25-60 лет, болеют преимущественно мужчины. В настоящее
время этиология этих заболеваний неизвестна, за исключением некоторых видов
кист пищевода, являющихся врожденными пороками развития.
Патологическая анатомия. По своему
происхождению выделяют эпителиальные и неэпителиальные доброкачественные
опухоли и кисты.
По форме роста выделяют
внутрипросветные опухоли - аденомы, папилломы, фибромы, липомы и
внутристеночные - прочие виды опухолей.
Клиника. Клинические проявления
болезни обусловлены формой роста опухоли, ее размерами и локализацией. В
значительно меньшей степени клиника заболевания связана с гистологической
структурой. Следует отметить, что нет строгого параллелизма между величиной
опухоли и выраженностью клинической картины. Иногда даже крупные опухоли
длительное время протекают бессимптомно и являются случайной находкой при
рентгенологическом, эндоскопическом исследовании пищевода или на вскрытии. Реже
при небольших опухолях больные жалуются на довольно сильные спастические боли
за грудиной или в эпигастральной области, дисфагию, что связано с функциональными
расстройствами моторики пищевода и эзофагоспазмом.
Более значительное влияние на
клиническую картину заболевания оказывает форма роста опухоли. При
внутрипросветных опухолях пищевода ведущим симптомом болезни является дис
фагия, как правило, незначительная или умеренно выраженная. Нарастание степени
дисфагии происходит медленно, по мере роста самой опухоли.
Вторым по частоте симптомом является
тупая боль умеренной интенсивности, локализующаяся за грудиной. Боль
усиливается при приеме пищи. Среди других клинических проявлений
внутрипросветных опухолей следует отметить тошноту, слюнотечение, срыгивание,
ощущение инородного тела за грудиной. При больших размерах внутрипросветных
опухолей дисфагия может быть достаточно выраженной, нередко возникает рвота,
больные теряют в массе тела. Однако выраженных нарушений общего состояния
пациентов обычно не наступает. Полной непроходимости пищевода вследствие
доброкачественных внутрипросветных опухолей, как правило, не бывает.
Внутрипросветные опухоли локализуются
чаще всего в верхней трети пищевода. Нередко аденомы, папилломы и липомы
располагаются на довольно длинной ножке и при рвоте могут мигрировать из
пищевода в просвет гортани, вызывая асфиксию, иногда даже со смертельным
исходом.
Внутристеночные опухоли обычно
локализуются в нижней половине пищевода, длительное время протекают
бессимптомно. Лишь по достижении опухолью значительных размеров возникает
дисфагия, являющаяся наиболее частым симптомом заболевания. Полной
непроходимости пищевода, как правило, не бывает, за исключением случаев, когда
опухоль циркулярно охватывает пищевод.
Среди прочих клинических проявлений
внутристеночных опухолей наиболее часто наблюдается тупая боль за грудиной или
в области мечевидного отростка, тошнота, снижение аппетита. Общее состояние
больных обычно не нарушается. При преимущественно экстраэзофагеальном росте
опухоли, при ее больших размерах могут наблюдаться симптомы, связанные с
компрессией органов средостения - постоянные тупые боли за грудиной, сухой
кашель, одышка, нарушение сердечного ритма, осиплость голоса.
Кисты пищевода. Занимают второе место
по частоте среди всех доброкачественных опухолей пищевода. Наиболее частая их
локализация - нижняя часть пищевода. Большинство кист пищевода являются
врожденными. Они представляют собой тонкостенные образования, содержащие
прозрачную желтоватую или опалесцирующую жидкость. Наружная стенка кисты
представлена фиброзной и гладкомышечной тканью, внутренняя - плоскоклеточным
или цилиндрическим, мерцательным (при бронхогенных кистах) эпителием.
Содержимое кисты определяется морфологической структурой ее внутренней
оболочки. Оно может быть серозным, слизистым, серозногнойным, желеобразным. Во
всех случаях в содержимом кисты определяются слущенные эпителиальные клетки.
Если внутренний слой кисты представлен желудочной слизистой оболочкой, довольно
часто содержимое ее приобретает геморрагический или бурый оттенок. В этих
случаях за счет активной секреции желудочного сока киста может быстро
увеличиваться в размерах, вызывая сдавление жизненно важных органов средостения
с характерной клинической симптоматикой (компрессионный синдром). Нередко
наблюдаются изъязвление и кровотечение в просвет кисты. При инфицировании
микробной флорой кисты могут нагнаиваться. Описаны случаи и их злокачественной
трансформации, что наблюдается и при других доброкачественных новообразованиях
пищевода у 10 % больных.
Диагностика. Объективное
исследование, как правило, не выявляет специфических симптомов
доброкачественных опухолей пищевода. При больших размерах их могут выявляться
притупление перкуторного звука в задних отделах легких, а также типичные
проявления компрессионного синдрома. Основными способами инструментальной
диагностики являются рентгенография пищевода, эзофагоскопия и компьютерная
томография.
При рентгенологическом исследовании
внутрипросветные опухоли представляются в виде локального утолщения одной из
складок (на ранней стадии развития) или округлого дефекта наполнения на широком
основании или на ножке. Очертания его резкие, иногда мелковолнистые. Структура
тени папилломы может быть сетчатой ввиду соеочкового характера ее поверхности.
Складки слизистой оболочки утолщены и огибают полип. Перистальтика не нарушена,
задержка контрастной массы бывает лишь при больших размерах новообразования или
при локализации его в брюшной части пищевода над кардиальной частью желудка.
При глотании образование смещается вместе со стенкой пищевода в проксимальном
направлении.
При внутристеночных опухолях складки
слизистой оболочки сохранены, могут лишь огибать опухоль и обычно сужены или
уплощены. Сама опухоль дает краевой дефект наполнения с ровными контурами.
Перистальтика и эластичность пищевода в зоне проекции новообразования
сохранены. Если опухоль растет из мышечной оболочки и привела к атрофии ее,
наблюдается перерыв перистальтики. Опухоль обычно хорошо смещается при
глотании. При преимущественно экстраэзофагеальном росте и связи ее с органами
средостения смещаемость ограничена. Наиболее частый симптом - краевой дефект
наполнения с четкими ровными контурами. В отличие от дефекта наполнения
вследствие сдавления пищевода извне, со стороны окружающих органов
доброкачественные опухоли не вызывают смещения пищевода. Отличительной
особенностью их является наличие четкого угла между стенкой неизмененного
пищевода и краем опухоли (симптом козырька), выявляемого в боковой проекции. На
хороших рентгеновских снимках и томограммах (в особенности компьютерных)
удается получить изображение той части опухоли, которая вдается в окружающую
медиастинальную клетчатку. При крупных опухолях наблюдается веретенообразное
расширение вышележащих отделов пищевода.
При преимущественно
экстраэзофагеальном росте опухоли ее взаимосвязь с окружающими органами
средостения может быть изучена с помощью пневмомедиастинографии. В этих случаях
рентгенологическое исследование выполняют после введения газа (кислород) в
средостение. Более полную информацию дает компьютерная томография. Этот способ
исследования дает возможность дифференцировать кисты пищевода (которые слабее
поглощают рентгеновское излучение) от солидных опухолей.
Всем больным с подозрением на опухоль
пищевода показана эзофагоскопия. При внутрипросветных опухолях выявляют
округлые образования, покрытые малоизмененной слизистой оболочкой. Во время их
инструментальной пальпации возможна умеренная кровоточивость слизистой
оболочки. Прицельная биопсия с последующим морфологическим исследованием
материала позволяет установить окончательный диагноз, верифицировать
гистологическую структуру опухоли.
Для внутристеночных опухолей
характерно наличие образования, выступающего в просвет пищевода. Слизистая
оболочка над ним, как правило, не изменена, рельеф ее сохранен или несколько
сглажен. При изъязвлении опухоли можно обнаружить дефект слизистой оболочки.
Следует подчеркнуть, что при наличии интактной слизистой оболочки над
новообразованием биопсию при выполнении эзофагоскопии производить не надо. Это
связано с тем, что при оперативном лечении внутристеночных опухолей обычно
удается вылущить опухоль без повреждения покрывающей ее слизистой оболочки.
Если же ранее больному была произведена эзофагобиопсия, при выделении опухоли
легко травмируется слизистая оболочка, вскрывается просвет пищевода, что
значительно увеличивает риск возникновения послеоперационных осложнений.
Поэтому клиническое применение биопсии показано лишь при внутрипросветных
опухолях и при изъязвленных внутристеночных образованиях, когда слизистая
оболочка над опухолью уже разрушена.
Дифференциальная диагностика. Ее
необходимо проводить прежде всего со злокачественными опухолями пищевода. Учитывая,
что клинические проявления этих групп заболеваний довольно схожи и чаще всего
проявляются в виде дисфагии, большое внимание должно быть уделено анамнезу
болезни. Более молодой возраст больного, длительное течение заболевания без
признаков интоксикации и кахексии свидетельствуют в пользу доброкачественного
поражения пищевода. Тем не менее наибольшее значение в дифференциальной
диагностике доброкачественных и злокачественных опухолей пищевода имеют
инструментальные методы исследования, прежде всего эндоскопическое
исследование. В редких случаях окончательный диагноз устанавливают на основании
данных интраоперационных находок или морфологического исследования удаленного
препарата (экстренного или планового).
Лечение. Лечение доброкачественных
опухолей пищевода только оперативное. Показанием к операции является реальная
возможность злокачественного перерождения, развития компрессионного синдрома,
кровотечения и других осложнений.
Внутрипросветные опухоли, располагающиеся на ножке,
могут быть удалены с помощью эндоскопа электроэксцизией. При внутристеночных
опухолях обычно выполняют торакотомию и энуклеацию опухоли с последующим
восстановлением целости мышечной оболочки пищевода. Во время выделения опухоли
из окружающих тканей необходимо стремиться не повредить слизистую оболочку во
избежание развития гнойных осложнений в послеоперационном периоде в результате
недостаточности наложенных швов. При опухолях больших размеров со значительным
разрушением мышечной оболочки пищевода в редких случаях приходится выполнять
резекцию пораженного участка органа с последующей пластикой его тонкой или
толстой кишки или наложением эзофагогастроанастомоза (при локализации опухоли в
нижней трети пищевода) .
55. Рак пищевода. Классификация. Клиника.
Диагностика. Дифференциальный диагноз. Показания и противопоказания к
хирургическому лечению. Подготовка, доступы, анестезия, виды операций. Органы
для эзофагопластики. Пути проведения трансплантата по отношению к грудной
клетке и плевральной полости
Среди всех злокачественных новообразований
рак пищевода составляет около 4-6 %. В нашей стране он занимает 6-7е место
среди злокачественных опухолей и 3е место в структуре причий смертности от
онкологических заболеваний, уступая лишь раку желудка и раку легкого.
Заболевание встречается чаще всего у лиц в возрасте старше 60 лет, женщины
болеют в 2-5 раз реже мужчин. У 65 % больных опухоль локализуется в средней
трети пищевода, у 25 % - в нижней его трети и у 10 % пациентов - в верхней
трети. Особенно часто опухоль располагается в местах физиологических сужений
пищевода.
Классификация. Различают следующие
стадии рака пищевода:
стадия - так называемая преинвазивная
карцинома;стадия - четко ограниченная опухоль, прорастающая только слизистый и
подслизистый слои; проходимость пищевода не нарушена; метастазы отсутствуют;а
стадия - опухоль прорастает мышечный слой и адвентицию; метастазы в регионарных
лимфатических узлах отсутствуют;б стадия - опухоль прорастает мышечный слой и
адвентицию; имеются метастазы в регионарных лимфатических узлах;стадия -
опухоль занимает большую полуокружность пищевода или циркулярно охватывает его,
прорастает всю стенку пищевода, спаяна с соседними органами. Проходимость
пищевода нарушена полностью; множественные метастазы в регионарных
лимфатических узлах;стадия опухоль прорастает все слои стенки пищевода,
выходит за его пределы, пенетрируя в близлежащие органы; имеются множественные
метастазы в регионарные лимфатические узлы и отдаленные органы.
Международная классификация рака
пищевода предусматривает характеристи опухоли по системе TNM, учитывая при этом
следующие факторы: первичную о КУ холь, глубину инвазии, состояние регионарных
лимфатических узлов, отдаленнь метастазы. Эта классификация для рака пищевода
является более удобной и точной
Т - первичная опухоль:
ТХ - недостаточно данных для оценки
первичной опухоли;
ТО - первичная опухоль не
определяется;
Tis - преинвазивная карцинома (carcinoma in situ);- опухоль инфильтрирует стенку пищевода до
подслизистого слоя;
Т2 - опухоль инфильтрирует стенку
пищевода до мышечного слоя;
ТЗ - опухоль инфильтрирует стенку
пищевода до адвентиции;
Т4 - опухоль распространяется на
соседние структуры.- регионарные лимфатические узлы:- недостаточно данных для
оценки регионарных лимфатических узлов;- нет признаков метастатического поражения;-
имеется поражение регионарных лимфатических узлов метастазами.
М - отдаленные метастазы:-
недостаточно данных для определения отдаленных метастазов;
МО - нет признаков отдаленных
метастазов;- имеются отдаленные метастазы.
Для опухолей нижнегрудного отдела
пищевода:a - метастазы в чревных лимфатических узлах;b - другие отдаленные
метастазы.
Для опухолей верхнегрудного отдела
пищевода:
М1а - метастазы в шейных
лимфатических узлах;b - другие отдаленные метастазы.
Для опухолей среднегрудного отдела
пищевода:
М1а - метастазы не определены;
М1b - нерегионарные лимфатические
узлы и другие отдаленные метастазы.
Клиника и диагностика. Достоверный
диагноз заболевания обычно устанавливается лишь при сопоставлении результатов
комплексного исследования пищевода различными методами и данными клиники.
Важное значение имеют данные анамнеза, общее состояние больного. Внешний вид
больного и данные объективного обследования на ранних стадиях заболевания, как
правило, не обнаруживают какихлибо патологических изменений. Поэтому основным
методом диагностики рака пищевода является рентгенологическое исследование, при
котором выявляются следующие характерные признаки: нарушение структуры рельефа
слизистой, обнаружение дефекта наполнения, наличие тени опухолевого узла, отсутствие
перистальтики стенки пищевода. Достоверные представления о состоянии и
особенностях стенок пищевода на различных уровнях могут быть получены при
рентгенологическом исследовании в различных положениях, а также с помощью
двойного контрастирования и париетографии. Для определения распространения
опухоли на соседние органы применяют рентгенологическое исследование в условиях
пневмомедиастинума, рентгенографию в прямой, боковой и косой проекциях.
При этом могут быть выявлены признаки
местного распространения рака, включающие извилистость опухоли, перегиб,
расширение, изгиб, свищи; при подозрении на наличие свища применяется
водорастворимый контраст. Для определения распространенности опухолевого
процесса в средостении весьма информативным методом является компьютерная
рентгенотомография. Применение этого исследования позволяет более четко
определить размеры и границы опухолевого поражения в средостении, оценить
степень инфильтрации окружающих тканей и связать новообразования с жизненно
важными органами средостения, распространенность поражения регионарных
лимфатических узлов. В некоторых случаях компьютерная рентгенотомография может
быть дополнена париетографией.
Фиброэзофагоскопия показана всем
больным с подозрением на рак пищевода. Эндоскопическое исследование позволяет
улучшить визуальное представление о пищеводе, непосредственно увидеть и оценить
опухоль, установить уровень поражения пищевода, форму опухоли, степень сужения
пищевода, наличие распада или кровотечения из опухоли. Обязательное взятие
материала для цитологического и гистологического исследований позволяет в 96%
случаев установить морфологическую структуру опухоли
В клиническом проявлении рака
пищевода выделяют три основные группы симптомов: местные, зависящие от
поражения стенок пищевода; вторичные, возникающие в результате распространения
процесса на соседние органы; общие симптомы. На ранних стадиях данное
заболевание практически никак себя не проявляет и не имеет специфических
симптомов.
Нарушение проходимости пищи
(дисфагия) является первым и, по существу, поздним симптомом заболевания. Она
связана с сужением его просвета опухолью, возникающим лишь при поражении
опухолевым процессом не менее 2/3 периметра пищевода. Возникновению дисфагии
могут предшествовать ощущение инородного тела, появляющееся при проглатывании
твердой пищи, чувство царапанья за грудиной, прилипания пищи к поверхности
слизистой пищевода. В начальном периоде заболевания дисфагия возникает при
проглатывании плотной пищи. Больные ощущают временную задержку пищевого комка
на определенном уровне. Глоток воды обычно устраняет эти явления. В дальнейшем
перестает проходить даже хорошо прожеванная пища, дисфагия становится
постоянной и возникает даже при приеме жидкости.
Классификация дисфагии, предложенная
А. И. Савицким:стадия - затруднение при глотании твердой пищи;стадия -
затруднение при глотании кашицеобразной пищи;стадия - затруднение при глотании
жидкости;стадия - полная непроходимость или болезненность при глотании, -
частый симптом рака пищевода, встречается в 33% случаев. Боли возникают во
время приема пищи, локализуются за грудиной и носят постоянный и мучительный
характер, могут иррадиировать в спину, шею. Возникновение болей обусловлено
механическим травмированием пищей изъязвленной карциномы. Постоянные боли, не
зависящие от приема пищи или усиливающиеся после еды, обусловлены прорастанием
опухоли в окружающие пищевод ткани и органы, развитием периэзофагита и
медиастинита. Срыгивание пищей, или «пищеводная рвота», встречается у 23%
больных. Появляется при значительном стенозировании просвета пищевода и
скоплении пищи над местом сужения. Некоторые больные искусственно вызывают
рвоту для снятия ощущения распираний за грудиной и болей, появляющихся во время
еды.
Усиленное слюнотечение
(гиперсаливация) возникает в 67% случаев и является результатом рефлекторного
возбуждения блуждающих нервов. Общие проявления заболевания - слабость,
прогрессирующее похудание - являются следствием голодания и интоксикации.
Симптомы осложнения рака пищевода,
возникающие вследствие распространения процесса на соседние органы, относятся к
поздним проявлениям болезни и обычно свидетельствуют о неоперабельности
опухоли. К ним относятся нарастающая дисфагия, мучительные боли, выраженная
интоксикация. При прорастании возвратных нервов у больных развивается осиплость
голоса, при поражении узлов симпатического нерва - синдром Горнера. Сдавление
блуждающего нерва может вызвать брадикардию, приступы кашля, рвоту. Переход
опухоли на гортань сопровождается изменением звучности голоса, появлением
одышки и стридорозного дыхания. Анорексия, быстрое насыщение, тошнота и рвота
манифестируют о распространении опухоли на желудок. Перфорация опухоли в
средостение вызывает гнойный медиастинит, а при вовлечении в процесс
магистральных сосудов практически во всех случаях приводит к смерти больного.
Дифференциальную диагностику следует
проводить с теми заболеваниями, для которых ведущим симптомом является
дисфагия. К таким заболеваниям относятся ахалазия кардии (кардиоспазм),
рубцовое сужение пищевода и пептический стенозирующий эзофагит, язвы и
доброкачественные опухоли пищевода, склерозирующий медиастинит. Для
послеожоговых стриктур и травм пищевода характерны длительный и стойкий анамнез
и рентгенологическая картина стриктуры пищевода. У больных с пептическим
эзофагитом и язвами пищевода в анамнезе имеется указание на наличие язвенной
болезни, сопровождающейся симптомами рефлюксэзофагита.
Лечение. Основным методом лечения
рака пищевода является оперативное удаление опухоли. Выбор метода лечения
зависит от локализации опухоли, стадии процесса, наличия сопутствующих
заболеваний. Операции при раке пищевода относятся к одним из наиболее сложных
вмешательств на органах желудочнокишечного тракта. По топографоанатомическим
отношениям наиболее выгодным является правосторонний чресплевральный доступ,
предложенный еще В. О. Добромысловым. Значительно более вариабельным является
вопрос о пластике резецированного пищевода. Наиболее часто для эзофагопластики
используются различные отделы толстой кишки и желудок, целый и в виде
стебельчатых трансплантатов. Наиболее предпочтительными для замещения пищевода
при раке являются различные варианты эзофагогастропластики. Широкое
распространение получил способ замещения пищевода в изоперистальтическом
положении целым желудком либо изоперистальтическим стеблем из большой кривизны
желудка. Тонкокишечная эзофагопластика в настоящее время используется редко
изза большого числа осложнений, частой незавершенности, неудовлетворительных
функциональных результатов. Значительно чаще применяется замещение пищевода
толстой кишкой, что объясняется устойчивым кровоснабжением, возможностью
тотального замещения пищевода.
Немаловажным аспектом эзофагопластики
является выбор пути проведения трансплантата: антероторакальный,
ретростернальный, внутриплевральный и заднемедиастинальный
Антероторакальное проведение
трансплантат исторически связано с именами Ру (RouxenY), П. А. Герцена, С. С.
Юдина, использовавших подкожный путь при тонкокишечной эзофагопластике.
Чресплевральный путь проведения трансплантата считается наиболее целесообразным
у больных раком пищевода, так как позволяет наименее травматично объединить два
этапа операции - удаление пищевода и его пластику. Хорошие результаты
хирургического лечения оказываются в I стадии заболевания и значительно худшие
- при операциях во IIIII стадиях. К
сожалению, рак пищевода редко диагностируется рано, и больные, как правило,
обращаются за помощью в поздней стадии заболевания. Таким образом, радикальное
оперативное лечение удается выполнить лишь у сравнительно небольшого числа
больных. При раке шейного и верхнегрудного отделов пищевода опухоль быстро
прорастает в окружающие ткани. При этой локализации опухоли методом выбора при
лечении считается лучевая терапия. При раке среднегрудного отдела пищевода
методом выбора является одномоментная резекция пищевода с наложением соустья
между оставшейся частью проксимального отдела пищевода и перемещенным в
плевральную полость или заднее средостение желудком (операция типа Льюиса). Во
всех случаях выполняется широкая лимфаденэктомия средостения с удалением всех
групп лимфатических узлов. При наличии противопоказаний к одномоментным
операциям выполняется многоэтапная операция ДобромысловаТорека. В этих случаях
из чресплеврального доступа удаляют грудной отдел пищевода и накладывают гастростому.
Спустя 36 месяцев создают искусственный пищевод из толстой или тонкой кишки.
Необходимо подчеркнуть, что, несмотря на хорошие непосредственные результаты
многоэтапных операций, неудовлетворительным остается показатель завершенности
лечения, так как вследствие прогрессирования основного заболевания восстановить
непрерывность пищеварительного тракта удается только одному из трех больных.
Применение комбинированного (лучевого
и хирургического) лечения существенно не улучшило отдаленные результаты, а в
некоторых случаях результаты оказались хуже. Тем не менее оно применяется,
особенно во ПШ стадиях заболевания. Существуют различные методики
предоперационного облучения, при котором суммарная очаговая доза (СОД)
составляет от 25 до 40 Гр.
При неоперабельных опухолях при наличии
противопоказаний к радикальному лечению выполняются различные паллиативные
операции с целью восстановления проходимости пищевода. К ним относятся
паллиативная резекция пищевода, реканализация опухоли, наложение гастростомы.
При наличии метастазов опухоли в отдаленных лимфатических узлах лучевое лечение
нецелесообразно. При невозможности выполнения хирургического и лучевого лечения
может быть применена химиотерапия.
56. Язвенная болезнь желудка. Клиника.
Диагностика. Дифференциальный диагноз. Классификация Джонсона. Осложнения.
Показания и противопоказания к хирургическому лечению. Методы операций
Язвенная болезнь - хроническое рецидивирующее
заболевание, характеризующееся образованием язвы в желудке или
двенадцатиперстной кишке вследствие расстройства общих и местных
механизмов нервной и гормональной регуляции основных функций гастродуоденальной
системы, нарушения трофики слизистой оболочки
В соответствии с классификацией
английского хирурга Н. Johnson
(1956) различают три типа язвы желудка (I, И, Щ), которая в последующем была дополнена понятиями IV и V типов заболевания (А. М. Flynn, 1998).
Тип I. Язвы локализуются в теле желудка на малой кривизне,
возникают, как правило, на фоне пониженной секреции соляной кислоты и
составляют от 50 до 60% всех хронических язв желудка.
Тип II. Язвы локализуются на малой кривизне тела желудка и
сочетаются с язвой двенадцатиперстной кишки. Возникают на фоне
повышенной секреции соляной кислоты, составляют 510% всех хронических язв
желудка и редко озлокачествляются.
Тип III. Препилорические язвы желудка возникают на фоне
повышенной секреции соляной кислоты, составляют приблизительно 20% всех
хронических язв желудка.
Тип IV. Язвы локализуются в верхних отделах малой кривизны
желудка около пищеводножелудочного перехода. Встречаются менее чем в 10%
случаев.
Тип V. Эти язвы описаны недавно. Развиваются вторично на фоне
длительного приема нестероидных противовоспалительных средств. Имеют высокий
риск осложнения кровотечением и перфорацией, до развития которых, как правило,
протекают бессимптомно. Эффективная профилактика этих язв обеспечивается
применением синтетических простагландинов (мизопростол и др.).
Ведущим симптомом в клинической
картине хронической язвенной болезни является боль в подложечной области. При язвах
тела желудка боли чаще всего ощущаются ближе к левому подреберью, появляются
через 2030 мин после еды и не отличаются четкой сезонностью обострений. При
язвах кардиальной и субкардиальной локализации боли, как правило, отмечаются в
области мечевидного отростка и за грудиной, которые могут ошибочно приниматься
за стенокардию. Частым симптомом язвенной болезни является рвота. При язвах,
осложненных Рубцовым стенозом желудка или двенадцатиперстной кишки, рвота
бывает обильной, но всегда приносит облегчение, вследствие чего больные охотно
вызывают ее искусственно, особенно при высокой кислотности желудочного сока. Из
других диспептических симптомов у больных язвенной болезнью наблюдаются изжога,
отрыжка, обычно кислая, и срыгивание, которые чаще всего бывают обусловлены
недостаточностью кардиального жома, так как язвенная болезнь очень часто
сочетается со скользящей грыжей пищеводного отверстия диафрагмы. Аппетит у
больных язвенной болезнью не только сохранен, но иногда даже повышен. Однако у
больных язвой желудка изза ранних болей, связанных с едой, появляется страх
перед приемом пищи, они ограничивают себя в еде и худеют
Клинический анализ крови. Клинический
анализ крови при не осложненном течении язвенной болезни чаще всего остается
без существенных изменений. Иногда отмечается незначительное повышение
содержания гемоглобина и эритроцитов, но может обнаруживаться и анемия,
свидетельствующая о явных или скрытых кровотечениях. Лейкоцитоз и ускорение СОЭ
встречаются при осложненных формах язвенной болезни.
Анализ кала на скрытую кровь.
Исследование кислотообразующей
функции желудка, которое проводится с помощью рНметрии (в последние годы - с
помощью суточного мониторирования внутрижелудочного рН). При язвах тела желудка
и субкардиального отдела обычно отмечаются нормальные или сниженные показатели
кислотной продукции.
Рентгенологический метод
исследования. При рентгенологическом исследовании с двойным тугим
контрастированием барием, обнаруживается прямой признак язвенной болезни -
«ниша» на контуре или на рельефе слизистой оболочки и косвенные признаки
заболевания.
Эндоскопический метод исследования.
Наиболее информативным в диагностике язвенной болезни желудка и 12перстной
кишки является эндоскопическое исследование, которое визуально подтверждает
наличие язвенного дефекта, позволяет уточнить его локализацию, глубину, форму,
размеры, позволяет оценить состояние дна и краев язвы, выявить сопутствующие
изменения слизистой оболочки. При проведении эндоскопического исследования
имеется возможность произвести прицельную биопсию - «отщипывание» кусочка ткани
из краев или дна язвенного дефекта посредством специального инструментария.
Полученный таким образом биоптат (кусочек ткани) направляется на
гистологическое исследование, которое позволяет выявить возможную раковую
природу обнаруженного язвенного дефекта (язвенная форма рака желудка).
· Биопсия с последующим гистологическим
исследованием полученного материала.
· Данное исследование дает возможность
исключить злокачественный характер язвенного поражения.
· Исследования наличия в слизистой
оболочке желудка Helicobacter pylori.
· Электрогастроэнтерография и антродуоденальная
манометрия - позволяют выявить нарушения гастродуоденальной моторики.
Дифференциальную диагностику проводят
с симптоматическими язвами желудка, изъязвленной опухолью (в том числе
первичноязвенным раком), туберкулезной, сифилитической язвой; изъязвлениями при
коллагенозах, амилоидозе. Особенностью язвенной болезни является характер болей
(голодные, после еды через определенный срок, ночные), длительный анамнез
заболевания с периодическими обострениями в весеннеосенние периоды, наличие
хлористоводородной кислоты в желудочном соке при исследовании.
Осложнения: кровотечение, перфорация, пенетрация,
деформации и стенозы, перерождение язвы в рак, вегетативнососудистая дистония,
спастическая дискинезия желчного пузыря, хронический холецистит, жировой
гепатоз, реактивный панкреатит.
Лечение язвенной болезни до сих пор остается
делом сложным. Консервативные и хирургические методы лечения нельзя
противопоставлять, наоборот, они должны дополнять друг друга. Большинство
больных язвенной болезнью лечатся терапевтами и только при безуспешности такого
лечения, при развитии осложнений, приходится больных оперировать. При этом для
достижения успеха хирургическое лечение должно сочетаться с терапевтическим
пособием. Традиционные, выработанные десятилетиями, основные принципы
консервативного лечения язвенной болезни сохраняются до настоящего времени. Эти
принципы включают постельный режим при обострении заболевания, лечебное
питание, богатое витаминами, лекарственные препараты, подавляющие желудочную
секрецию н повышающие сопротивляемость слизистой оболочки желудка и
двенадцатиперстной кишки, щелочи, санаторнокурортное лечение. В последнее
десятилетие указанное лечение стали сочетать с эндоскопическими методами
прямого воздействия на язву различными лекарственными препаратами, ускоряющими
заживление язвы, в том числе некоторых ее осложненных форм.
При язвенной болезни желудка и
двенадцатиперстной кишки, протекающей на Фоне инфицирования желудка Н. pylori, проводится так называемая эрадикационная
антихеликобактерная терапия, включающая ингибиторы протонной помпы (омепразол и
др.), препараты висмута и антибиотики (кларитромицин, тетрациклин, метронидазол
и др.). Считается, что уничтожение (эрадикация) Н. pylori способствует быстрому заживлению язвы и удлиняет
период ремиссии заболевания.
Все хирургические вмешательства по
поводу язвы желудка и двенадцатиперстной кишки делятся на радикальные и
паллиативные. К радикальным операциям (с некоторой долей условности) относятся
резекция желудка и различные виды ваготомии в сочетании с дренирующими желудок
операциями, антрумрезекцией и без них (СПБ). К паллиативным операциям
относятся: ушивание перфоративной язвы, прошивание и иссечение кровоточащей
язвы, перевязка магистральных сосудов желудка, изолированная пилоропластика и
гастроеюностомия.
Единственным условием, при котором
можно рассчитывать на заживление язвы после хирургического вмешательства,
является снижение желудочной секреции до ахлоргидрии или близкого к ней
состояния. Наиболее признанной в этом отношении операцией считается резекция
желудка. Установлено, что при язве желудка для достижения ахлоргидрии бывает
достаточно резецировать 1\4 его часть (рис. 163). При этом удалением антрального
отдела и значительной части секреторной зоны желудка удается устранить
гуморальную фазу секреции, как наиболее ответственное звено в патогенезе язвы
желудка. При язве двенадцатиперстной кишки резекция желудка в таком объеме
недостаточна, так как остается очень большое секреторное поле и сохраняется
мозговая фаза желудочной секреции, регулируемая через ядра блуждающего нерва, в
результате чего нередко (45%) развиваются пептические язвы желудочнокишечного
соустья. По этой причине при дуоденальной язве резекция желудка должна
выполняться в пределах не менее 2/3 органа, а у больных в возрасте до 30 лет и
гиперсекреторов - в объеме 3/4 желудка (С. С. Юдин, 1955). При язве желудка
предпочтительнее выполнять резекцию Бильрот I, сохраняя пассаж пищи по двенадцатиперстной
кишке. Что касается второй радикальной операции - ваготомии, то физиологической
основой ее применения в качестве метода лечения язвенной болезни является
парасимпатическая денервация всего желудка (стволовая ваготомия) или его
кислотообразующей зоны (селективные варианты) с целью устранения мозговой фазы
желудочной секреции/
Показания к хирургическому лечению.
Абсолютными показаниями являются такие, когда отказ от
операции угрожает жизни больного.
К ним относятся:
· перфорация язвы;
· профузное продолжающееся
кровотечение;
· декомпенсированный стеноз привратника
или двенадцатиперстной кишки;
· малигнизация язвы.
Относительные показания к операции определяются в тех
случаях, когда надежды на успех консервативной терапии минимальны, но в данный
момент непосредственной угрозы для жизни больного нет.
К ним относятся:
· пенетрация язвы;
· неоднократно повторяющиеся
кровотечения;
· каллезная язва;
· суб и компенсированный стеноз
привратника;
· рецидивы язвы после ушивания
перфорации;
· безуспешность консервативной терапии
язвы желудка в течение 3 мес и язвы двенадцатиперстной кишки в течение 2 лет с
частыми обострениями заболевания;
· язвенная болезнь с непрерывным типом
кислотной продукции и декомпенсированной рН антрального отдела.
Выполнение операций по относительным показаниям, когда
имеется возможность хорошего обследования больного и полноценной
предоперационной подготовки, уменьшает число тяжелых осложнений и улучшает
непосредственные и отдаленные результаты лечения. Выбор способа хирургического
лечения должен быть индивидуальным, с учетом возраста больного, тяжести
язвенных осложнений и сопутствующих заболеваний.
57. Язвенная болезнь 12перстной кишки.
Классификация. Клиника. Диагностика. Дифференциальный диагноз. Осложнения.
Показания и противопоказания к хирургическому лечению. Виды операций (виды
резекций и ваготомий)
Язва двенадцатиперстной кишки (лат. ulcus duodeni)-
язва, возникающая в результате действия кислоты и пепсина на слизистую оболочку
двенадцатиперстной кишки у людей с повышенной чувствительностью мечевидного
отростка и за грудиной, которые могут ошибочно приниматься за стенокардию.
Для язвы двенадцатиперстной кишки
характерны голодные, поздние (через 1,52 ч после еды) и ночные боли.
Происхождение их связано с возникновением в это время алиментарной
гипогликемии, которая является мощным раздражителем ядер блуждающего нерва и
стимулятором кислой желудочной секреции. В этих случаях еда, особенно прием
сладкого чая, повышает содержание сахара в крови, и боль исчезает. При язве двенадцатиперстной
кишки обострение заболевания носит строго сезонный характер (весной и осенью),
боли локализуются выше и правее пупка («северозападнее пупка»)
При пенетрации язвы двенадцатиперстной кишки в
поджелудочную железу или в печеночнодуоденальную связку боли часто приобретают
опоясывающий характер или иррадиируют по ходу правого диафрагмального нерва. В
тех случаях, когда язва двенадцатиперстной кишки сочетается с язвой желудка,
клиническая картина приобретает признаки обоих заболеваний при язве двенадцатиперстной
кишки больные стараются чаще есть, чтобы утолить голодные и ночные боли,
вследствие чего многие из них не только не худеют, но нередко даже полнеют.
Существует несколько основных схем
операций ваготомии:
· стволовая ваготомия, при которой пересекаются
стволы блуждающего нерва над диафрагмой до их разветвления, что приводит к
денервации всех органов брюшной полости; основной недостаток стволовой
ваготомии - пересечение печеночной и чревной ветвей блуждающих нервов лишает
печень, поджелудочную железу и кишечник парасимпатической иннервации,
следствием чего наступает «постваготомический синдром»
· селективная ваготомия, при которой
пересекаются все желудочные ветви блуждающего нерва, идущие к желудку, при этом
сохраняются ветви, идущие к печени и солнечному сплетению; селективная
ваготомия выполняется ниже пищеводного отверстия диафрагмы
· селективная проксимальная ваготомия,
при которой пересекаются только ветви блуждающего нерва, идущие к верхним
отделам желудка; этот вариант ваготомии считается в настоящее время наиболее
предпочтительным, так как он дает возможность сохранить максимально форму и
функции желудка.
Ваготомия может выполняться как с
помощью механического рассечения нерва хирургическим инструментом, так и
медикаментознотермическим способом, при котором разрушение ветвей блуждающих
нервов происходит за счет комбинации медикаментозного (например,
спиртоновокаиновой гиперионной смеси) и электротермического (электрокоагуляция)
воздействия (Е.А. Баранов).
Ваготомия может сопутствовать другим
операциям, например, при лечении язвенной болезни желудка и двенадцатиперстной
кишки ваготомия выполняют с дренированием желудка, при хирургическом лечении
рефлюксэзофагита селективная проксимальная ваготомия применяется совместно с
операции фундопликации (О.С. Васнёв, К.В. Пучков и др.).
В настоящее время ваготомия
выполняется не только традиционным, открытым способом, но и лапароскопическим.
«Золотым» стандартом в неотложной хирургии является стволовая ваготомия,
которую доступно выполнить лапароскопическим способом, а дренирующую желудок
операцию с ликвидацией осложнения заболевания из местного минилапаротомного
доступа (А.И. Михалев).
Недостатки ваготомии, как метода
лечения язвенной болезни
У некоторых больных, несмотря на ваготомию, секреция кислоты
и пепсина через некоторое время восстанавливаются, как следствие, язвенная
болезнь рецидивирует. Примерно у 4 % оперированных наблюдаются серьезные
моторноэвакуаторные нарушения функции желудка и развивающаяся в тяжелой форме
диарея, что иногда даже требует дополнительного операционного вмешательства.
У некоторых пациентов после стволовой ваготомии через
23 года обнаруживаются камни в желчном пузыре.
При втором варианте резекции желудка
(Бильрот II) культи двенадцатиперстной кишки и желудка зашивают наглухо, а
затем создают желудочнотощекишечный анастомоз по типу бок в бок. Петлю тощей
кишки подводят к культе желудка позади поперечной ободочной кишки через
отверстие в mesocolon transversum.
Модификация этого способа по Гофмейстеру - Финстереру
состоит в том, что гастроэнтероанастомоз накладывают по типу конец в бок (конец
культи желудка сшивается с боковым отверстием в тонкой кишке) в
изоперистальтическом направлении. Ширина просвета составляет 56 см. Приводящий
конец кишки 23 швами подшивают к желудку ближе к малой кривизне. Края разреза
mesocolon узловыми швами подшивают к желудку вокруг созданного анастомоза.
58.
Каллезная и пенетрирующая язвы. Клиника. Диагностика. Лечение
Каллезная язва отличается большой
величиной (до 23 см) и глубиной. Края такой язвы уплотнены вследствие развития
в них грубой соединительной ткани, вокруг язвы образуется плотный
воспалительный инфильтрат, напоминающий злокачественное образование (ulcus tumor).
Слизистая оболочка в области язвы утолщена и
вследствие гиперплазии желез имеет шагреневый вид, хорошо заметно радиальное
расположение около язвы складок слизистой оболочки. Дно омозолелой язвы часто
сращено с прилежащим органом (печень, поджелудочная железа и др.), или соседний
орган сам служит дном, или язва углубляется в ткань органа. В последнем случае
язвы называются пенетрирующими. Иногда на дне каллезной язвы может находиться
кровеносный сосуд, являющийся источником кровотечения. Застарелые долго не
заживающие язвы желудка в 20% озлокачествляются.
59.
Прободная язва желудка и 12перстной кишки. Классификация. Клиника. Диагностика.
Дифференциальный диагноз. Лечебная тактика. Метод Тейлора. Виды операций
Перфорация (perforatio -
пробуравливание) стенки желудка и двенадцатиперстной кишки на месте язвенного
дефекта - осложнение язвенной болезни и острых гастродуоденальных язв.
У лиц молодого возраста язва
двенадцатиперстной кишки перфорирует значительно чаще, чем язва желудка, у
пожилых людей преобладает прободение язв желудка. Это осложнение наступает при
различной локализации язв, но наиболее часто при их расположении на передней
стенке.
Различают три вида перфорации язв:
· в свободную брюшную полость;
· прикрытую;
· атипичную.
Такое разделение имеет важное значение, так как
позволяет выделить особенности клинической симптоматики этого осложнения.
Перфорация в свободную брюшную
полость встречается чаще всего и сопровождается истечением в полость брюшины
желудочнокишечного содержимого, которое является сильным раздражителем
рецепторов брюшины. Его нередко сравнивают с кислотным ожогом брюшины. При
внезапном излиянии желудочного сока в организме Характеризуя динамику развития
заболевания, Н. Н. Самарин (1952) выделил три стадии. Первую стадию он назвал
стадией шока. С наступлением «паралича» чувствительных окончаний нервов
париетальной брюшины начинается вторая стадия - эйфории, или мнимого
благополучия, а в дальнейшем и третья стадия - разлитого перитонита.
Прикрытая перфорация встречается
значительно реже и составляет менее 7% (В. Н. Репин с соавт,, 1999). Прободное
отверстие может прикрыться соседними органами (сальником, долей печени и др.),
иногда кусочком пищи. Такая ситуация при благоприятных условиях может
разрешиться ограничением патологического процесса с исходом на выздоровление.
В редких случаях атипичной перфорации
прободение происходит в той части СТенки полого органа, где отсутствует
брюшинный покров (между листками малого сальника, забрюшинная часть
двенадцатиперстной кишки). В этих случаях как правило, образуется
воспалительный инфильтрат с исходом в абсцесс или флегмону забрюшинной
клетчатки. При проникновении значительного количества воздуха может развиться
эмфизема тканей.
Клиника и диагностика. У многих
больных прободению язвы предшествует так называемый предперфоративный период,
характеризующийся обострением язвенной болезни. За 34 дня, иногда и больше (23
недели), усиливаются боли в эпигастрии и диспептические явления (тошнота, рвота,
изжога). Перфорация в этих случаях происходит на фоне клинически
манифестированного обострения язвенной болезни. Иногда перфорация происходит
при отсутствии ярких симптомов и даже при бессимптомном течении заболевания.
При прободении язвы в свободную брюшную
полость клиническая картина весьма характерна.
Болевой синдром в этих случаях
отличается резкой интенсивностью, доводящей иногда больного до шока, который
сопровождается появлением характерных признаков: резкой «кинжальной» боли в
эпигастрии, «доскообразного» напряжения мышц живота. В это время больной
занимает неподвижное вынужденное положение с подтянутыми к животу коленями.
Лицо принимает страдальческое выражение, может отмечаться акроцианоз,
поверхностное дыхание, живот в дыхании не участвует, язык сухой. Пульс
замедлен, артериальное давление снижено.
В дальнейшем, по мере распространения
излившегося в брюшную полость желудочнокишечного содержимого, характер боли и
ее локализация меняются. В течение 56 ч с момента перфорации интенсивность боли
уменьшается, напряжение мышц передней брюшной стенки снижается. Самочувствие
больного улучшается, иногда он становится несколько эйфоричен и воспринимает
это улучшение как благоприятный перелом в течении болезни. Наступает период
мнимого благополучия.
Наиболее часто излившееся содержимое
перемещается по правому флангу брюшной полости, боль смещается в правое
подреберье, правую подвздошную область, но может ощущаться и по всему животу.
От раздражения излившимся содержимым окончаний даафрагмального нерва нередко появляется
иррадиация болей в правое надодечье под правую лопатку. Достоверным
свидетельством перфорации язвы желудка или двенадцатиперстной кишки является
наличие в брюшной полости свободного газа. Наиболее надежно он может быть
обнаружен при рентгенологическом исследовании. Начинаться оно должно с
производства обзорной рентгенограммы живота в том положении больного, в котором
он доставлен в рентгеновский кабинет. Свободный газ в брюшной полости
располагается в наиболее высоких отделах живота. При исследовании в
вертикальном положении больного газ определяется под диафрагмой в виде светлого
серпа. Если исследование производится в горизонтальном положении пациента, то
следует применять методику латерографии: в положении на спине газ будет
выявляться под передней брюшной стенкой, в положении на боку - на
противоположной стороне. Оптимальной является латерография на левом боку, что
позволяет получать более четкое изображение даже небольшого количества
свободного газа, скапливающегося между печенью и боковой стенкой живота. В
противоположность этому при латерографии на правом боку могут возникнуть
трудности в дифференциации свободного газа в брюшной полости с газом в просвете
нисходящей кишки. Рентгенограммы после изменения положения тела больного
следует выполнять с интервалом не менее 10 мин, чтобы газ в полном объеме успел
переместиться в другой отдел брюшной полости. Наличие спаек в ней может
обусловить скопление газа в нетипичных местах. Когда помимо воздуха в брюшной
полости имеется еще и жидкость, то могут определяться горизонтальные уровни.
Если на рентгенограммах удается обнаружить газ внутрибрюшинной локализации, то
рентгенологическое исследование на этом может быть закончено.
Прикрытая перфорация привносит свою
особенность в клиническую картину заболевания. Она заключается в том, что
возникший острый болевой синдром обрывается. Резчайшие боли прекращаются,
напряжение мышц передней брюшной стенки и симптомы раздражения брюшины
становятся менее выраженными или имеют локальный характер. Они могут быть
установлены в эпигастральной области или ближе к правому подреберью. В это
время в остальных отделах живот остается мягким, безболезненным. Изза малого
количества поступившего в брюшную полость газа или отсутствия его печеночная
тупость может быть сохранена. Прикрытая перфорация в этих случаях часто не
распознается и рассматривается как обострение язвенной болезни.
Атипичная перфорация клинически тоже
проявляется внезапно возникшими и уменьшающимися по интенсивности в последующем
болями. Локализация боли в эпигастральной области, типичная иррадиация - в
спину. Свободный газ в брюшной полости отсутствует, но бывает распространенная
крепитация, выявляемая при пальпации передней стенки живота или груди.
Заболевание развивается относительно медленно при наличии стойкого болевого
синдрома. Клиниколабораторные данные характерны для формирующегося абсцесса
брюшной полости или забрюшинной флегмоны. Диагностика этого вида перфорации
очень трудна.
Дифференциальный диагноз
перфоративной язвы наиболее часто проводят с уже упоминавшимся острым
аппендицитом и острым холециститом, а также с острым панкреатитом, инфарктом
миокарда (эпигастральная форма) и нижнедолевой плевропневмонией.Хирургическое
лечение. В лечении перфоративной язвы желудка и двенадцатиперстной кишки
основным методом является оперативный. Операция, как правило, Должна
осуществляться в экстренном порядке. Чем раньше установлен диагноз и поизведена
операция, тем лучше прогноз на выздоровление больного. Поэтому на
Догоспитальном этапе наиболее важной задачей является организация немедленной
госпитализации больного в хирургический стационар. Перед транспортировкой
больного вводят в желудок зонд и без промывания удаляют содержимое. Несмотря на
выраженный бол«3 синдром, противопоказано введение наркотических препаратов,которые
могут исказить клиническую картину заболевания и дезориентировать хирурга.
Объем лечебных мероприятий должен быть ограничен коррекцией нарушения жизненно
важных функций, которая проводится одновременно с транспортировкой больного в
стационар.
Диагноз перфоративной язвы в
свободную брюшную полость следует считать абсолютным показанием к неотложной
операции.
При прикрытом прободении хирурги
поступают поразному. Одни в силу существующих трудностей диагностики и
прогнозирования течения такой формы перфорации при установлении и даже по
подозрению на нее считают необходимым срочно оперировать.
Консервативный способ лечения (метод
Тейлора) применим в крайне редких случаях - категорического отказа больного от
операции или при невозможности выполнения вмешательства в силу технических
условий. Лечение основано на постоянной аспирации желудочного содержимого через
зонд, введении в желудок антибиотиков, адекватной антибактериальной и
дезинтоксикационной терапии. Осуществляется парентеральное питание, назначаются
препараты, снижающие секрецию желудочного сока, проводится местная гипотермия
(холод на живот). Такое лечение длится 710 дней. Перед удалением зонда из
желудка рекомендуется провести рентгенологическое исследование с использованием
водорастворимого контрастирующего вещества для исключения затекания его за
контуры желудка или двенадцатиперстной кишки. Этот метод в исключительных
ситуациях дает надежду на выздоровление.
Основная цель хирургического лечения
- спасение жизни больного. Поэтому оперативное вмешательство может быть
минимальным и заключается в ушивании перфоративного отверстия. Однако выбор
вида и объема вмешательства зависит от общего состояния больного, его возраста,
наличия сопутствующих заболеваний, времени, прошедшего с момента перфорации,
выраженности перитонита и опыта хирурга. Эти основные условия определяют
возможность выполнения патогенетически обоснованных радикальных операций. В
настоящее время в качестве радикальных операций применяются резекция желудка и
ваготомия в сочетании с дренирующими желудок вмешательствами.
Предоперационная подготовка включает
лечебные мероприятия, направленные на коррекцию нарушений жизненно важных
функций организма.
Обезболивание общее.
Хирургическая тактика. Ушивание
перфорационного отверстия производится без иссечения и с иссечением язвы. В
настоящее время накапливается опыт выполнения таких операций с помощью
эндовидеохирургии (лапароскопически).Показаниями к ушиванию является
терминальная фаза разлитого перитонита, острая язва молодых людей без
предшествующего язвенного анамнеза, тяжелые сопутствующие заболевания,
препятствующие расширению объема оперативного вмешательства, отсутствие
необходимого опыта хирурга.
Необходимость применения
патогенетически обоснованных операций диктуется высоким риском рецидива заболевания
после простого ушивания язвы. Считается, что не менее 70% оперированных больных
продолжают страдать язвенной болезнью. Резекция желудка показана больным с
хронической, особенно каллезной, язвой желудка или вызывающей подозрение на ее
малингнизацию, при отсутствии перитонита в первые 6 ч с момента перфорации.
Некоторые хирурги считают резекцию желудка оправданной при осложненных
одновременно перфорацией и кровотечением,
Ваготомия с иссечением или ушиванием
перфоративной язвы и пилоропластикой или гастродуоденостомией выполняется у
больных с локализацией язвы в двенадцатиперстной кишке также при условии
отсутствия фибринозногнойного перитонита в первые 6 ч с момента перфорации.
Предпочтение отдается стволовой поддиафрагмальной ваготомии как более простому
и надежному оперативному вмешательству.
Техника ушивания прободной язвы сводится к наложению
одиночных узловых швов из нерассасывающегося шовного материала в поперечном
направлении по отношению к продольной оси желудка или двенадцатиперстной кишки.
Обычно бывает достаточно 34 швов. Второй ряд швов удается наложить на желудке и
редко на Двенадцатиперстной кишке. Для укрепления линии швов иногда подшивается
прядь сальника. В тех случаях, когда края язвы при завязывании нитей
прорезаются или перфорационное отверстие имеет большие размеры, следует
воспользоваться методом ОппеляПоликарпова. Он состоит в «тампонировании»
перфорационного отверстия язвы прядью большого сальника на ножке, которая
проводится в просвет органа через прободное отверстие, плотно фиксируется, а по
окружности язвы подшивается дополнительными нитями. При атипичных перфорациях
необходимо проводить дополнительно к основной операции дренирование
забрюшинного пространства.
60. Кровоточащая язва желудка и 12
перегной кишки. Клиника. Диагностика. Классификация по степени тяжести
кровопотери. Дифференциальная диагностика. Принципы лечения. Хирургическая
тактика
Острые желудочнокишечные кровотечения являются
осложнениями различных заболеваний.
Различают скрытый и явный период острого желудочнокишечного
кровотечения.
В скрытом периоде отмечаются неспецифические признаки,
входящие в общую симптоматику острой кровопотери. Проявления слабости и
головокружения, «шум и звон» в голове, «мелькание мушек» перед глазами,
тошнота, холодный пот и даже обморочное состояние могут быть кратковременными
или сохраняться несколько часов и даже суток. При этом учащается пульс и
снижается артериальное давление. Тяжелая геморрагия иногда может начинаться с
потери сознания, нередко обморок развивается в момент или после акта дефекации,
при этом характерен внезапный позыв к нему. Продолжительность и степень
выраженности вышеназванных симптомов в основном определяется темпом и объемом
кровопотери. Диагностика кровотечения в это время наиболее трудна, но
обнаружение указанных признаков должно заставить врача подумать о нем.
Явный период начинается с появления кровавой рвоты,
крови в каловых массах или дегтеобразного кала (мелены) в виде липкой массы
черного цвета.
Кровавая рвота может быть неизмененной кровью или
«кофейной гущей» (изменение цвета обусловлено воздействием соляной кислоты на
кровь). Наличие в рвотных массах большого количества алой крови или сгустков ее
- признак тяжелой кровопотери. Рвота бывает однократной или многократной и
возникает при кровотечении из верхних отделов пищеварительного тракта.
Дегтеобразный кал характерен для тяжелой кровопотери,
оформленный кал черного цвета (при отсутствии у больного запоров) обычно
сопутствует легкой и средней степени тяжести кровотечения, источник которого
также находится в верхних отделах желудочнокишечного тракта.
Кровопотеря бывает разной. Выделяется массивное
кровотечение и, если оно происходит быстро, его называют профузным.
В период развития явных признаков установление самого
факта кровотечения не вызывает затруднения, но точное определение величины
кровопотери не всегда возможно. О ней наиболее часто судят по косвенным
признакам. Определение уровня систолического артериального давления и частоты
пульса уже дает возможность получить такое представление
Безусловно, хирург не ограничивается только оценкой
лабораторных данных и всегда соотносит их с результатами клинического
исследования. Привлекает внимание характеристика степеней кровопотери,
рекомендуемая для использования в военных лечебных учреждениях.степень - легкая
кровопотеря: общее состояние больного удовлетворительное, умеренная тахикардия
(до 100 ударов в минуту), артериальное давление в норме,
ЦВД - 515 см вод. ст., диурез не снижен, содержание
гемоглобина не ниже 100 г/л, дефицит ОЦК до 20% к должному.степень - средняя
кровопотеря: общее состояние больного средней тяжести, частота пульса до 110
ударов в минуту, систолическое артериальное давление не ниже 90 мм рт. ст., ЦВД
меньше 5 см вод. ст., умеренная олигурия, содержание гемоглобина не ниже 80
г/л, дефицит ОЦК от 20 до 29%.степень - тяжелая кровопотеря: состояние больного
тяжелое, частота пульса более ПО ударов в минуту, систолическое артериальное
давление ниже 90 мм рт. ст.,
ЦВД - 0, олигурия, метаболический ацидоз, содержание
гемоглобина ниже 80 г/л, дефицит ОЦК 30% и больше. Коллаптоидное состояние на
высоте кровотечения все гда свидетельствует о тяжелой кровопотере.
Кровотечения из верхнего отдела пищеварительного
тракта. Язвенные кровотечения. При язвенной болезни желудка и
двенадцатиперстной кишки манифестированные кровотечения, как правило, возникают
из крупного кровеносного сосуда. Хронические язвы желудка и двенадцатиперстной
кишки осложняются кровотечением в 1520% случаев. Такое осложнение развивается в
34 раза чаще при язве двенадцатиперстной кишки. Важно отметить, что больной с
кровоточащей язвой обычно имеет характерный для язвенной болезни желудка или
двенадцатиперстной кишки анамнез. При этом следует иметь в виду, что
кровотечение не является редкостью при бессимптомном течении болезни и может
быть первичным признаком существования у больного язвы. По данным В. Н.
Сацукевича и Д. В. Сацукевича (1999), почти у 14% больных с кровотечениями из
язв желудка или двенадцатиперстной кишки не было «желудочного » анамнеза. В то
же время при тщательном изучении анамнестических данных нередко удается
обнаружить признаки «желудочного дискомфорта» (нечастые боли в эпигастральной
области, отрыжка, изжога, потребление соды, спазмолитиков и т. д.). Появлению
правильного предположения о наличии язвы помогают такие дополнительные
признаки, как исчезновение боли при возникновении кровотечения, наличие
локальной болезненности при пальпации и перкуссии пилородуоденальной зоны.
Существенно усложняется диагностика по клиническим
данным в случаях сочетания двух осложнений язвенной болезни кровотечения и
перфорации. Обычно перфорирует та же язва, реже - разные. Кровотечение и
прободение могут происходить одновременно или в разной последовательности.
Указанное сочетание встречается в 2,710% случаев по отношению ко всем перфоративным
язвам (Р. Ш. Вахтангишвили, 1985; В. Н. Репин с соавт., 1999).
Наиболее трудным является распознавание перфорации у
больного с развившимся кровотечением. В клинической картине болезни отсутствует
болевой синдром, известный как «кинжальная боль», и нет «доскообразного»
живота. Отсутствие или малая интенсивность этих признаков объясняется тем, что
при перфорации в брюшную полость изливается содержимое желудка, в котором
соляная кислота нейтрализована поступившей кровью. Для исключения диагностической
ошибки любое усиление боли в животе у больного с кровоточащей язвой должно
привлечь внимание врача, чтобы с особой настойчивостью осуществить необходимые
инструментальные и рентгенологические исследования для исключения или
подтверждения предположения о развитии еще одного осложнения - перфорации.
Лечение острых желудочнокишечных кровотечений до
настоящего времени остается сложной проблемой. В идеале оно предусматривает не
только достижение гемостаза, но и устранение заболевания, приведшего к
кровотечению. Однако реализация этого принципа в полном объеме не всегда
представляется возможной, и в этих случаях главной целью является остановка
кровотечения, с тем чтобы сохранить жизнь больного.
Лечение должно начинаться на догоспитальном этапе.
Первая враче!fom посостоит в назначении строгого постельного режима, в
запрещении приема , в пении "я" льдом или холодной водой „а живот, во
внутримышечном введении 5 мл 1% раствора викасола, внутривенном медленном
введении 10 мл 10% раствора хлорида кальция ИЛИ глюконата кальция.
При коллапсе больному придается положение
Тренделенбурга и осуществляется внутривенное вливание плазмозамещающих
растворов, вначале струйно, а при подъеме артериального давления выше 80 мм рт.
ст. - калельно. Инфузионная терапия проводится и в пути следования в
хирургический стационар.
Лечение в стационаре должно быть комплексным, с
использованием как традиционных консервативных методов, так и современных
технологий (с применением эндовидеотехники), а также оперативных вмешательств.
Обязательного жесткого алгоритма их применения не существует, но необходимость
дифференцированной лечебной тактики неоспорима.
Важное значение придается инфузионнотрансфузионной
терапии. Без нее тяжелые нарушения в тканях и органах, вызванные кровопотерей,
не могут быть ликвидированы. Предложены различные схемы ее проведения, созданы
специальные поэтапные программы лечения больных. Основной целью существующих
предложений, независимо от их содержания и этапности использования, является
стремление к нормализации гемодинамики и адекватности перфузии тканей.
Достижению такого эффекта наилучшим образом способствует тактика управляемой
умеренной гемодилюции - поддержание гематокрита в пределах 30% и гемоглобина
около 100 г/л
При язвенном гастродуоденальном кровотечении для подавления
желудочной секреции целесообразно применение антацидов, ганглиоблокаторов
(атропин), современных антисекреторных препаратов блокаторов Н2рецепторов
(циметидин и др.). Для предотвращения растворения кровяного сгустка пепсином
считается полезным капельное введение в желудок молока. . Основную роль в
окончательной остановке кровотечения играют эндоскопические методы и
оперативные вмешательства.
Эндоскопические методы остановки желудочнокишечного
кровотечения. Диагностика и лечение внутреннего кровотечения при применении
эндоскопической техники должны быть совмещены по времени. При выявлении
одиночного источника кровотечения на него можно воздействовать как холодом, так
и теплом. Через манипуляционный канал эндоскопа в желудок, двенадцатиперстную
кишку проводится полихлорвиниловая трубка и патологический очаг орошается
хлорэтилом. Через манипуляционный канал можно провести и другие инструменты и
осуществить диатермокоагуляцию или лазерную коагуляцию.
Для остановки кровотечения применяется также обкалывание
источника кровотечения лекарственными препаратами. Под контролем фиброскопа в
ткани патологического очага вводятся сосудосуживающие лекарства (норвдреналин)
или усиливающие репаративные процессы (витамины, оксиферрискорбон), а также
препараты (майодил, йодолипол и др.), создающие плотный инфильтрат,
сдавливающий кровоточащий сосуд.
Как показывает опыт, накопленный в специализированных
центрах по лечению острых желудочнокишечных кровотечений, эндоскопическая
диатермокоагуляция высокоэффективна у больных с кровотечениями на почве острых
язв желудка и двенадцатиперстной кишки, синдрома МаллориВейсс. Она менее
эффективна при кровоточащих хронических язвах желудка и двенадцатиперстной
кишки с локализацией на задней стенке луковицы и залуковичного отдела, при нарастании
тяжести кровопотери вследствие аррозии крупных сосудов. Обкалывание источника
кровотечения лекарственными препаратами менее надежно при хронических каллезных
язвах больших размеров.
Неотложной операции должны подвергаться больные с
продолжающимся кровотечением, представляющим непосредственную угрозу для жизни.
Из приемного отделения такие пациенты сразу направляются в операционную. Забор
крови для лабораторных исследований, аппаратные и другие виды диагностических
мероприятий проводятся одновременно с предоперационной подготовкой (в
частности, с восполнением крови) и анестезиологическим пособием. При этом
эндоскопическая диагностика и попытка остановки кровотечения остаются
обязательными мероприятиями. Успех в такой попытке не может служить основанием
для отмены операции при большой (40% ОЦК и более) кровопотере. Он позволяет
избежать продолжения кровопотери до ее окончательной остановки во время
оперативного вмешательства.Обнаружение подслизистых кровоизлияний в области
пищеводножелудочного перехода позволяет заподозрить синдром МаллориВейсс.
Хронические язвы желудка и двенадцатиперстной кишки выявляются по характерному
виду серозного покрова в проекции язвы, а также по наличию спаечного процесса,
пальпируемого язвенного инфильтрата.
В тех случаях, когда во время операции не находят
источника кровотечения, целесообразно прибегнуть к интраоперационной эндоскопии
или гастротомии. Хорошим доступом к дистальной части желудка и
двенадцатиперстной кишки является продольный разрез (длиной около б см) через привратник,
а к проксимальной - продольный или поперечный разрез в верхней трети желудка.
Пилородуоденальный разрез ушивают по типу пилоропластики по ГейнекеМикуличу,
остальные разрезы - обычным путем с применением двух рядов швов.
Оперативные вмешательства при острых язвеняых
кровотечениях. Наиболее целесообразным является дифференцированный подход к
выбору оперативного вмешательства.
Резекция желудка патогенетически оправданная операция
как при хронической язве желудка, так и при язве двенадцатиперстной кишки.
Кровоточащая язва Должна «уйти, в препарат вместе с гастршшродуцирующеи зоной
приязве желудка или в пределах двух третей этого органа при язве
двенадцатиперстной кишки. При подозрении на злокачественный характер желудочной
язвы резекция желудка осуществляется по онкологическим принципам.
У больных с высокой степенью риска, находящихся в
крайне тяжелом состоянии, допустимы паллиативные операции в виде иссечения или
прошивания язвы.
Иссечение язвы следует производить дугообразным
разрезом в продольном направлении, чтобы избежать функционально невыгодной
деформации желудка при зашивании дефекта.
В тех случаях, когда иссечение язвы технически
оказывается трудным (при локализации большой каллезной язвы на задней стенке
желудка или высоко в проксимальном его отделе) рекомендуется прошивание
кровоточащего сосуда с дополнением тампонадой пористой гемостатической губкой
(колартеком).
При прошивании язвы целесообразно накладывать
8образный или Zобразный швы (см. рис. 174). С его помощью можно надежно
остановить кровотечение при наличии плотного язвенного инфильтрата.
Следует отметить, что паллиативные операции при
язвенных желудочнокишечных кровотечениях дают плохие отдаленные результаты.
Почти у половины из них возникает необходимость в повторных оперативных вмешательствах
(В. В. Гопеенко, 1999). Следовательно, такие операции не должны иметь широкого
применения.
Остановка кровотечения из язвы двенадцатиперстной
кишки может быть достигнута другой патогенетически обоснованной, но менее
травматичной операцией - поддиафрагмальной стволовой ваготомией с иссечением
или прошиванием язвы и дренирующей желудок операцией. Этот вид вмешательства
предпочтителен перед селективной и проксимальной селективной ваготомией. Он
обладает не меньшим лечебным эффектом, но более прост и менее травматичен.
Такое преимущество позволяет использовать стволовую ваготомию у больных с
высоким операционным риском. Эта операция в сочетании с пилоропластикои по
Финнею особенно выгодна при локализации язвы в залуковичном отделе
двенадцатиперстной кишки, так как выбранный вид дренирующей операции
обеспечивает хороший доступ к кровоточащей язве.
У больных молодого возраста с легкой или умеренной
степенью кровопотери ваготомия может быть дополнена антрумэктомией (резекцией
дистальной «1/3 желудка), которая обеспечивает более эффективное снижение
желудочной секреции. При этом хирург должен быть готов к решению сложных
технических задач, связанных с закрытием культи двенадцатиперстной кишки, если
низко расположенная в ней большая язва пенетрирует в головку поджелудочной
железы.
Лечение сочетанных язв (язвы двенадцатиперстной кишки
и желудка) осуществляется, как правило, так же, как и лечение дуоденальной
язвы. Предпочтение отдается стволовой ваготомии с дренирующей желудок
операцией. Кровоточащая желудочная язва при этом иссекается или ушивается. Она
является вторичной по отношению к язве двенадцатиперстной кишки и очень редко
малигнизируется. Если язва не иссекалась, то такой больной в последующем
подлежит динамическому наблюдению с эндоскопическим (при необходимости с
биопсией) контролем.
Остановка кровотечения из пептической язвы
желудочнокишечного соустья, развившейся после резекции желудка, осуществляется
прошиванием кровоточащего сосуда. Стволовая ваготомия в этих случаях также
является эффективной операцией. Отличительной особенностью такого вмешательства
является отсутствие необходимости в дренирующей операции. Ваготомия позволяет
избежать более травматичной резекции желудка при недостаточной по объему
первичной резекции желудка
61.
Кровоточащая язва желудка и 12 перегной кишки. Классификация Форреста (Forrest). Консервативное и оперативное
лечение. Методы операций. Эндоскопические методы остановки кровотечения
В 1974 г. Forrest и соавт. описали
эндоскопические признаки кровотечения из пептической язвы и систематизировали
их. В настоящее время эта классификация получила признание во всем мире. Ее
преимущество в том, что она является базисной при определении тактики ведения
больных с кровотечениями.
Тип F I - активное кровотечение :a -
пульсирующей струей;b - потоком.
Тип F II - признаки недавнего
кровотечения :а - видимый (некровоточащий) сосуд;b - фиксированный
тромбсгусток;с - плоское черное пятно (черное дно язвы).
Тип F III - язва с чистым (белым) дном .
62. Стеноз привратника язвенной
этиологии. Клиника. Стадии стеноза. Диагностика. Дифференциальный диагноз.
Предоперационная подготовка больных с декомпеисированным пилородуоденальным
стенозом. Показания (абсолютные и относительные) к операциям. Виды операций
Рубцовый стеноз двенадцатиперстной кишки и выходного
отдела желудка развивается у 1015% больных язвенной болезнью. Ранее
указывалось, что стеноз всегда образуется на уровне язвы. Однако сужение
выходного отдела желудка и двенадцатиперстной кишки не всегда бывает
обусловлено Рубцовым процессом. Отек и воспаление тканей в области язвы в
период обострения заболевания иногда могут сопровождаться нарушением эвакуации
желудочного содержимого, которое устраняется при эффективном противоязвенном
лечении. В зависимости от степени нарушения эвакуации содержимого желудка
принято различать три степени стеноза выходного отдела желудка или
двенадцатиперстной кишки: компенсированный, субкомпенсированный и
декомпенсированный.
При компенсированной стадии стеноза
больные находятся в удовлетворительном состоянии, у них не бывает рвот
застойным содержимым желудка, при рентгенологическом исследовании желудок не
расширен, тонус его повышен, перистальтика протекает глубокими волнами
(«стенозирующая», «сегментирующая»), просвет двенадцатиперстной кишки или
выходного отдела желудка сужен до 10,8 см, а эвакуация контрастирующей массы из
желудка бывает задержана до 610 ч.
При субкомпенсированной стадии
стеноза у больных периодически бывают рвоты, иногда в рвотных массах
обнаруживается примесь пищи, употребленной накануне. Такая рвота приносит
больному облегчение, так как желудок освобождается от кислого содержимого и
застойных пищевых масс. Пальпация живота в таких случаях нередко провоцирует
заметную на глаз перистальтику желудка, а при сотрясении брюшной стенки в
подложечной области бывает слышен «шум плеска». При рентгенологическом
исследовании желудка обнаруживается значительное его расширение, сужение
просвета двенадцатиперстной кишки или выходного отдела желудка достигает 0,5
см. Контрастирующая масса задерживается в желудке до 1224 ч. Однако тонус
желудка еще достаточно сохранен, а в положении больного на правом боку
эвакуация ускоряется.
Наконец, при декомпенслрованной
стадии стеноза рвоты становятся систематическими, обильными (до 11,5 л),
больные обезвоживаются, у них резко нарушается белковый и минеральный обмен,
иногда до появления судорог, больные истощаются, уменьшается диурез,
развивается гемоконцентрация, натощак в желудке постоянно отмечается симптом
«шума плеска». В связи с резким опущением желудка, контуры которого хорошо
видны при осмотре живота, часто в подложечной области пальпаторно определяется
пульсация брюшной аорты, которая у здоровых людей обычно прикрыта желудком. При
рентгенологическом исследовании обнаруживается резко расширенный желудок (рис.
161), тонус его почти утрачен, он опущен в полость малого таза, эвакуация
контрастирующей массы отсутствует, в том числе в положении на правом боку.
Просвет двенадцатиперстной кишки или выходного отдела желудка бывает сужен до
0,20,4 см и не пропускает даже конец фиброскопа. При повторном
рентгенологическом исследовании желудка у таких больных контрастирующая масса
задерживается в нем до 3672 ч. Очень часто у этих больных стул может
отсутствовать в течение 7 сут а в терминальной стадии иногда развивается
энтероколит с тяжелой, холероподобнои диареей и энцефалопатией. Прогноз в таких
случаях крайне сомнительный, больные нуждаются в интенсивном реанимационном
пособии Длительный анамнез заболевания, классические признаки язвенной болезни
и данные инструментальных исследований позволяют в таких случаях исключить
злокачественную опухоль.
Лечение начальных стадий стеноза
привратника сводится к уменьшению воспалительного процесса в области язвы, т.е.
лечению самой язвенной болезни, так как стихание воспалительного процесса может
привести к полному восстановлению проходимости. Также применяют медикаментозные
средства улучшающие моторику желудка и кишечника - прокинетики.
Если стадия болезни далеко зашедшая,
то прибегают к хирургическим методам лечения.
В ряде случаев возможно проведение
эндоскопического вмешательства, при котором специальным баллоном раздувают
место сужения, конечно, после этого пилорический клапан функционировать не
будет, но проходимость восстановиться.
Если такая процедура противопоказана
или заведомо шансов на успех мало, прибегают к открытой, полостной операции.
При рубцовом стенозе привратника
язвенной этиологии показано оперативное лечение - резекция желудка. Истощенные
и обезвоженные больные с резко атрофичной желудочной стенкой плохо переносят
радикальную операцию, поэтому успех последней во многом зависит от рациональной
предоперационной подготовки. Для уменьшения атонии желудка производят
ежедневные промывания его, инъекции азотнокислого стрихнина. Больной получает
парентеральное питание, частые переливания белковых кровезаменителей и
гемотрансфузии, вливания глюкозы с витаминами, электролитных жидкостей
(физиологический раствор хлористого натрия, 0,3% раствор хлористого калия в 5%
растворе глюкозы).
При гастрогенной тетании немедленно внутривенно
вливают 50 мл 10% раствора хлористого натрия, 20 мл 40% раствора глюкозы с
витаминами Вх и С и налаживают капельное вливание 1000 мл 0,3% раствора
хлористого калия в 5% растворе глюкозы. В дальнейшем необходимо энергично
готовить больного к операции по указанной выше схеме.
63. Симптоматические острые язвы:
стрессовые, гормональные, лекарственные. Клиника. Диагностика. Дифференциальный
диагноз. Осложнения. Хирургическая тактика. Показания и особенности
хирургического лечения. Синдром ЗоллингераЭллисона
Заболевание возникает при стрессовых
ситуациях, связанных с серьезной патологией внутренних органов, тяжелыми
оперативными вмешательствами, ожогами, политравмой, приемом некоторых
лекарственных веществ и др.
В зависимости от причины
возникновения различают следующие виды острых язв:
1) стрессовые язвы - у больных с
множественной травмой (политравма), шоком, сепсисом, тяжелыми большими
операциями на органах грудной полости, живота, на крупных сосудах и операциях
на мозге;
2) язва Кушинга - после операции на
головном мозге, при черепномозговой травме и опухолях мозга вследствие
центральной стимуляции желудочной секреции и повышения его агрессивных свойств
по отношению к слизистой оболочке желудка;
3) лекарственные язвы , возникающие при
приеме ацетилсалициловой кислоты, индометацина, волтарена, стероидных гормонов,
цитостатических препаратов.
Типичными признаками всех острых язв
является внезапное массивное угрожающее жизни кровотечение или перфорация язвы.
Оптимальным способом диагностики острых язв является эндоскопическое
исследование. Следует учитывать, что до появления кровотечения острые язвы
протекают обычно бессимптомно.
Острый эрозивный гастрит. Для этого заболевания характерны
поверхностные плоские округлые или удлиненной формы дефекты слизистой оболочки
желудка (эрозии). В отличие от язв они не разрушают мышечную пластинку
слизистой оболочки (lamina muscularis mucosae). Причинами их возникновения являются тяжелый стресс,
множественные травмы, обширные ожоги (язва Курлинга), обширные травматичные операции,
прием некоторых лекарственных средств; основные клинические симптомы -
кровотечение (гематемезис, мелена), шок. Диагноз устанавливают при
эндоскопическом исследовании.
Лекарственные средства (стероидные
гормоны, ацетилсалициловая кислота, бутадион, индометацин, атофан) уменьшают
образование слизи, разрушают защитный барьер слизистой оболочки, вызывают
геморрагии. При отмене препаратов язва и эрозии быстро заживают.
Ишемия слизистой оболочки играет
ключевую роль в развитии геморрагического гастрита, так как способствует
ослаблению ее защитного барьера.
Лечение. При острых язвах и эрозивном гастрите
вначале проводят консервативное лечение
Хирургическое лечение применяют
редко. Предпочтение отдают селективной проксимальной ваготомии, обкалыванию и
перевязке кровоточащих сосудов, реже производят резекцию желудка или даже
гастрэктомию (в исключительных случаях).
Простая язва Дьелафуа поддается
только оперативному лечению: обкалывают и перевязывают кровоточащую артерию
через гастротомическое отверстие или иссекают изъязвленный участок и
накладывают шов на края раны в стенке желудка. Кровотечение часто рецидивирует.
Синдро́м Зо́ллингераЭ́ллисона (аденома поджелудочной железы
ульцерогенная, гастринома) - опухоль островкового аппарата поджелудочной
железы, характеризующаяся возникновением пептических язв двенадцатиперстной
кишки и желудка, не поддающихся лечению и сопровождающаяся упорными поносами.
Клиническими проявлениями заболевания являются боли в верхней части живота,
которые имеют те же закономерности по отношению к приёму пищи, что и при
обычной язве двенадцатиперстной кишки и желудка, но в отличие от них очень
упорны, отличаются большой интенсивностью и не поддаются противоязвенной
терапии.
Характерны упорная изжога и отрыжка
кислым. Важным признаком являются поносы, обусловленные попаданием в тонкий
кишечник большого количества соляной кислоты и усилением вследствие этого
моторики тонкой кишки и замедлением всасывания. Стул обильный, водянистый, с
большим количеством жира. Возможно значительное снижение массы тела, что
характерно для злокачественной гастринемии.
Язвы желудка и двенадцатиперстной кишки при синдроме
Золлингера-Эллисона не поддаются заживлению даже при продолжительной
соответствующей терапии. У многих пациентов наблюдаются явления эзофагита, иногда
даже с образованием сужения пищевода. Пальпаторно определяется выраженная
болезненность в верхней части живота, и области проекции нижней части желудка,
может быть положительный симптом Менделя (локальная болезненность в проекции
язвы). В случае злокачественного течения болезни возможны опухолевые
образования в печени и значительное её увеличение.
Основным методом лечения (в 80%)
считается гастрэктомия. Для того чтобы решиться на полное удаление желудка,
надо быть уверенным в наличии синдрома ЦоллингераЭллисона. Если такой
уверенности нет, то некоторые авторы (В. М. Ситенко, В. И. Самохвалов, 1972)
рекомендуют прибегать к диагностической ваготомии или резекции неоперированного
желудка и, если через месяц после них желудочная секреция остается чрезвычайно
высокой, производить экстирпацию желудка в плановом порядке, не дожидаясь
развития осложнений язвы. Показанием к гастрэктомии считают наличие
множественных гастрином, одиночной гастриномы с метастазами, а также рецидив
язвы после удаления опухоли.
Как уже указывалось, гастриномы часто
бывают множественными, располагаются в разных отделах поджелудочной железы и в
различных органах, что крайне затрудняет их поиск во время операции. Поэтому
попытки лечить больных синдромом ЦоллингераЭллисона одним только удалением
опухоли, как правило, нереальны. Правда, описаны случаи успешного лечения таких
больных подобным вмешательством под контролем операционной рНметрии слизистой
желудка (А. А. Курыгин, 1987). В этих отдельных наблюдениях после удаления
одиночных гастрином уже на операционном столе наступала ахлогидрия. Однако
такие наблюдения крайне редки и не всегда надежны.
Удаление аденомы поджелудочной железы оправдано и
надежно при синдроме ВернераМоррисона, при котором больному не угрожает
развитие язв в желудке и двенадцатиперстной кишке.
64.
Синдром МеллориВейса. Определение. Причины. Клиника. Диагностика.
Дифференциальный диагноз. Консервативное лечение. Показания к операции
Синдром МэлориВейса это продольный
разрыв слизистой оболочки пищевода, происходящий при сильных позывах к рвоте
или во время самой рвоты.
Клинически синдром МэлориВейса будет
проявляться наличием крови в рвотных массах. При чем кровь может отсутствовать
во время первых приступов рвоты, когда только происходит разрыв слизистой.
Кроме рвоты с примесью крови у
больных с данным синдромом возможно наличие болей в животе, стула черного цвета
(мелены).
Диагностика синдрома МэлориВейса.
Из инструментальных методов
диагностики синдрома МэлориВейса наибольшую ценность представляет
эндоскопическое исследование (фиброэзофагогастродуоденоскопия). Данное
исследование позволяет увидеть продольный разрыв слизистой оболочки пищевода.
Кроме того, если обнаруживается кровотечение, то его можно попытаться
остановить эндоскопически (см. Лечение синдрома МэлориВейса).
В анамнезе больных синдромом
МэлориВейса часто можно встретить упоминание об употреблении алкогольных
напитков в большом количестве, вследствие чего возникала рвота.
При осмотре больного с синдромом
МэлориВейса можно обнаружить общие признаки всех кровотечений: бледность кожных
покровов, холодный липкий пот, вялость, тахикардия, гипотония, возможно, даже
развитие шока.
В клиническом анализе крови будет
снижение количества эритроцитов, уровня гемоглабина, повышение количества
тромбоцитов, что свидетельствует о наличии кровотечения.
а. Консервативная терапия при
синдроме МэлориВейса используются с целью восстановления объема циркулирующей
крови. Для этого применяют различные кристалоидные (NaCl 0,9%, глюкоза 5%,
раствор Рингера и др.), коллоидные растворы (альбумин, аминоплазмаль и др.), в
случае тяжелой кровопотери возможно применение гемотрансфузии (эритроцитарная
масса, свежезамороженная плазма)
При рвоте (или позывах на рвоту)
применяют метоклопрамид (церукал).
С целью остановки кровотечения используют
зонд Блэкмора. Этот зонд имеет 2 балона. С помощью нижнего балона зонд
фиксируется в желудке в правильном положении, после чего раздувается второй
балон, находящийся в просвете пищевода. Гемостатический эффект достигается за
счет механического сдавления кровоточащих сосудов
пищевода. С целью остановки
кровотечения возможно приминение этамзилата натрия, хлористого кальция,
аминокапроновой кислоты, октреатида.
б. При выполнении
фиброэзофагогастродуоденоскопии и обнаружении продольного разрыва слизистой
оболочки пищевода с кровотечением, можно попытаться остановить это кровотечение
эндоскопически. При этом используется:
. Обкалывание места кровотечения
адреналином
Раствор адреналина гидрохлорида
вводят в область кровотечения, а также вокруг источника кровотечения.
Гемостатический эффект достигается за счет сосудосуживающего действия
адреналина.
. Аргоноплазменная коагуляция
Данный метод является одним из
наиболее эффективных и одновременно одним изи наиболее технически трудным.
Применение метода аргонноплазменной коагуляции позволяет добиться стойкого
гемостаза.
. Электрокоагуляция
Также достаточно эффективный метод.
Часто применение электрокоагуляции сочетают с введением адреналина.
. Введение склеразантов
Данный метод заключается в том, что
гемостатический эффект достигается за счет введение слеразирующих препаратов
(полидоканол).
. Лигирование сосудов
При синдроме МэлориВейса часто
используется эндоскопическое лигирование кровоточащих сосудов. Применение
эндоскопического лигирования сосудов особенно оправдано при сочетании синдрома
МэлориВейса и портальной гипертензии с варикозным расширением вен пищевода.
. Клипирование сосудов
По своей сути этот метод схож с
предыдущим. Разница лишь в том, что на кровоточащий сосуд накладывается не
лигатура, а металлическая клипса. Наложение клипс возможно с помощью
аппликатора. К сожалению, эндосопическое клипирование сосудов не всегда
возможно изза технических трудностей наложения клипс на сосуды.
в. При синдроме МэлориВейса к
хирургическому лечению прибегают в случае неэффективности консервативной
терапии и эндоскопических методов лечения. При синдроме МэлориВейса выполнят
операцию Бейе:
Доступ: срединная лапоротомия.
Операция: гастротомия, прошивание кровоточащих
сосудов.
65. Рак желудка. TNM классификация. Пути метасгазирования,
признаки иноперабельности. Стадии заболевания. Виды расширенной
лимфаденэкгомии. Химиотерапия и лучевая терапия при раке желудка
Рост и распространение рака желудка
идут как внутристеночно, так и путем перехода на соседние органы. Вначале процесс
распространяется по слизистой и подслизистой оболочкам, в дальнейшем проникает
в глубокие слои желудочной стенки.
Инфильтрация стенки желудка более
выражена при язвенных и инфильтративно растущих (эндофитных) раках, чем при
экзофитных (ограниченно очерченных) формах. Наибольшее распространение
опухолевого процесса наблюдается в сторону кардии по основному току лимфы от
желудка вплоть перехода его на пищевод. На двенадцатиперстную кишку рак желудка
переходит редко, при этом он инфильтрирует стенку кишки, не захватывая
слизистой оболочки.
Рак желудка в 6070% случаев возникает
в антральном отделе, в 1015% - на малой кривизне, в 10% - в кардиальном отделе
и значительно реже - в других частях желудка. Поражение раковой опухолью всего
желудка наблюдается у 35% этих больных.
Исходя из характера роста и внешнего
вида опухоли С. А. Холдин (1952) предлагает следующую морфологическую
классификацию рака желудка.
I. Ограниченно растущий рак
(экзофитная форма):
1)полипообразная, грибовидная, капустообразная формы; 4
2)блюдцеобразная форма; *
3)плоский, бляшкообразный рак с поверхностным изъязвлением или без него. П.
Инфильтративно растущий рак (эндофитная, диффузная форма):
4) язвенноинфильтративная форма;
5) диффузный рак: а) фиброзного
характера (скиррозная - linitis plastica), б)
коллоидного характера.
III. Переходные формы (смешанные,
неясные формы).
Рак желудка может давать метастазы.
Различают три пути метастазирования: по лимфатическим, кровеносным путям и
имплантационное метастазирование по брюшине. Этот последний путь
метастазирования часто приводит к генерализованному карциноматозу (обычно с
асцитом) брюшины с образованием крупных метастазов в полости малого таза
(метастаз Шницлера), этот же путь метастазирования некоторые авторы признают
основным при метастазах в оба яичника (метастаз Крукенберга), хотя не
исключается связь лимфатических путей яичников с лимфатическим коллектором
желудка через забрюшинные сосуды.
Гематогенные метастазы часто
возникают в печени, реже в других органах.
Главный путь метастазирования -
лимфогенный. В соответствии с путями оттока лимфы из различных отделов желудка
можно проследить четыре направления: в ретропилорическое пространство, по
направлению к воротам печени, соответственно ходу левых желудочных сосудов по
малому сальнику и в сторону ворот селезенки по большому сальнику (А. В.
Мельников, 1960).
Согласно Japanese Research Society for Gastric Cancer (JRSGC)
(1998), регионарными лимфатическими узлами являются перигастральные узлы,
расположенные вдоль малой и большой кривизны, а также вдоль левой желудочной,
общей печеночной, печеночнодвенадцатиперстной, селезеночной и чревной артерий.
Эти лимфатические узлы могут быть удалены при хирургическом вмешательстве на
желудке.
Поражение ретропанкреатодуоденальных,
брыжеечных и парааортальных лимфатических узлов классифицируется как отдаленные
метастазы.
Кроме того, к отдаленным метастазам
относятся метастазы в печень, поджелудочную железу, почки, надпочечники и др.,
а также некоторые типичные метастазы: Вирхова - в область левого надключичного
пространства, Крукенберга в яичники, Шницлера в дугласово,
пузырнопрямокишечное пространства и в пупок.
Клиническая классификация по системе
TNM (шестое издание, 2003) выглядит следующим образом:
Т - первичная опухоль:
Тх недостаточно данных для оценки
первичной опухоли;
ТО - первичная опухоль не
определяется; неинвазивная карцинома: интраэпителиальная опухоль без инвазии
ственной пластинки слизистой оболочки (carcinoma in situ), опухоль
инфильтрирует стенку желудка до подслизистого слоя,
Т2 - опухоль инфильтрирует стенку
желудка до субсерозной оболочки;
ТЗ - опухоль прорастает висцеральную
брюшину без инвазии в соседние органы
Т4 - опухоль распространяется на
соседние структуры.- регионарные лимфатические узлы:- недостаточно данных для
оценки регионарных лимфатических узлов; - нет признаков поражения регпонарных
лимфатических узлов;- имеются метастазы в 16 регионарных лимфатических узлах; -
имеются метастазы в 715 регионарных лимфатических узлах; - имеются метастазы
более чем в 15 регионарных лимфатических узлах.
М - отдаленные метастазы,
Мх - недостаточно данных для
определения отдаленных метастазов;
МО - нет признаков отдаленных
метастазов;
M1 - имеются отдаленные метастазы.
Симптомы рака желудка разнообразны и
не всегда одинаково выражены. Так, наблюдаются больные раком желудка, считающие
себя здоровыми, и больные, диагноз заболевания которых ясен при первом
ознакомлении с ними. Особенно сложно бывает согласиться с диагнозом рака
желудка, когда он развивается у больных, постоянно наблюдаемых врачами в
течение ряда лет по поводу хронической язвы желудка, хронического гастрита с
пониженной желудочной секрецией, хроническим колитом и больных с астеническим
складом нервной системы, «надоевших» своим врачам тысячами жалоб. В этих
случаях так называемый синдром малых признаков рака желудка, приписываемый А.
И. Савицкому, но известный еще с 1914 г. (В. С. Левит, 1914), не имеет никакого
значения в распознавании рака желудка. Эти малые признаки в виде слабости,
бессонницы, понижения аппетита, потери удовлетворения едой, похудания,
депрессии и др., появившиеся на фоне предшествующего полного здоровья, должны
привлечь внимание добросовестного и вдумчивого врача. При стечении таких
обстоятельств при современных методах диагностики распознавание рака желудка
состоится практически во всех случаях, в том числе при озлокачествленных
полипах, хронической язве желудка и антральном гастрите типа болезни Менетнер
(Menetner), если будет сделана эндоскопическая биопсия.
Локализация раковой опухоли в
желудке, характер ее роста сильно влияют на клиническую картину заболевания.
Появление дисфагии непременно заставит подумать о раке кардиального отдела
желудка или пищевода. Однако при кардиальной локализации рака дисфагия иногда
отсутствует. Заболевание может проявляться в виде стенокардии, и такие больные
иногда долго лечатся у терапевтов.
Появление рвоты съеденной накануне
пищей, «шум плеска» при сотрясении брюшной стенки, быстрое похудание больных
непременно наведут на мысль о стенозе выходного отдела желудка, а дальше - дело
диагностической техники.
Наибольшие трудности диагностики
возникают при поражении раковой опухолью малой кривизны желудка, его свода,
задней стенки и большой кривизны. Эти раки отличаются длительным «немым»
течением, но почти всегда наблюдаются симптомы малых признаков. При этих
локализациях опухоли часто развивается анемия, больных тревожит потеря массы
тела, утомляемость и периодическое повышение температуры тела. На этом фоне
неожиданно ет развиться желудочное кровотечение, перфорация желудка на месте
опухоли, а также симптомы заболевания других органов при переходе на них
ракового процесса. Часто бывает так, что до обнаружения основного очага в
желудке на первый план выступают асцит, увеличенная метастазами печень и
опухолевые узлы в левой надключичной ямке, в полости малого таза и пупке, что
свидетельствует о неизлечимости больного.
Диагностика рака желудка в настоящее
время сильно упростилась. Добротно собранный анамнез, последовательная
пальпация живота, обследование всех мест возможной локализации типичных
отдаленных метастазов, выполнение УЗИ живота, использование компьютерной
томографии живота, общепринятые исследования крови дают много сведений о
патологическом процессе. Однако определение главного очага заболевания - рака
желудка - позволяют сделать рентгенологическое исследование желудка и
фиброгастроскопия. Первое исследование решает вопрос диагностики почти в 90%
случаев, а ФГДС с прицельной биопсией доводит его до 99%, в том числе и в плане
дифференциального диагноза. Большую помощь в определении распространенности
процесса оказывает лапароскопия и, в случае сомнений, радиоизотопная
диагностика. Однако во многих случаях диагностика в расширенном плане
продолжается во время оперативного вмешательства, если оно предпринимается.
Лечение. Основным методом лечения
рака желудка в настоящее время является хирургический. Химиотерапия, лучевая
терапия и иммунотерапия, как самостоятельные методы, так и в сочетании с
хирургическим лечением, применяются в специализированных учреждениях, однако скольконибудь
значительного успеха при этом пока не достигается.
Показания к операции имеются во всех
случаях рака желудка, если отсутствуют несомненные признаки отдаленных
метастазов и асцита, а также при наличии непроходимости кардиопнщеводного
участка и выходного отдела желудка и если общее состояние больного позволяет
выполнить оперативное вмешательство.
Основными, так называемыми
радикальными, операциями при раке желудка считаются субтотальная резекция
желудка (дисталыгая - при раке выходного отдела и проксимальная - при раке
проксимального отдела желудка) и гастрэктомия.
Субтотальная дистальная резекция
желудка должна выполняться только при экзофитной опухоли, расположенной в
дистальных отделах желудка и не распространяющейся далее'его угла.
Проксимальная субтотальная резекция желудка должна выполняться при экзофлтной
опухоли кардиального отдела желудка.
При расположении экзофитных опухолей
в теле желудка, тотальном поражении желудка, а также при инфильтративных
опухолях любой локализации показана гастрэктомия. Особенности дистальной
субтотальной резекции желудка при раке заключаются в широкой мобилизации
желудка вместе с обоими сальниками, перевязке левой желудочной артерии у места
отхождения ее от чревной, полном удалении всей малой кривизны и отсечении двенадцатиперстной
кишки, отступив от привратника вниз на 23 см. Линия пересечения по малой
кривизне проходит в 12 см от пищевода, а по большой на уровне нижнего полюса
селезенки. При прорастании опухоли в соседние органы нередко выполняют
комбинированные (расширенные) операции, удаляя вместе с желудком участки
пораженной печени, поджелудочной железы, селезенки, поперечной ободочной и
тонкой кишок. Радикальным операциям из поступающих в лечебные учреждения
подвергаются 4060% больных раком желудка.
Кроме радикальных операций при раке
желудка часто приходится выполнять паллиативные и симптоматические
вмешательства.
Сущность паллиативной резекции желудка состоит в том,
что удаляется часть желудка с опухолью (например, при кровотечении и
перфорации), но остаются отдаленные метастазы. Симптоматические вмешательства в
виде обходных анастомозов, гастростомы и еюностомы производятся при
неосуществимости радикальной операции по поводу непроходимости кардиалъного
отдела пищевода и выходного отдела желудка. Паллиативная экстирпация желудка
недопустима. Паллиативные и симптоматические операции существенно не продлевают
жизнь, но часто избавляют больных от физических и душевных страданий.
66. Рак желудка. Осложнения:
кровотечения, прободение, стеноз. Клиника, диагностика, дифференциальный
диагноз
К частым осложнениям рака желудка
следует отнести:
истощение (кахексия), которое
обусловлено нарушением питания и интоксикацией;
хроническое малокровие, связанное с
голоданием (нарушено усвоение пищи), мелкими частыми кровопотерями, нарушением
выработки антианемического фактора (фактор Кастля), опухолевой интоксикацией,
метастазами в костный мозг (нарушение гемопоэза);
общее острое малокровие, которое
может возникнуть в результате разъедания крупных сосудов и служить причиной
смерти;
перфорация опухолевой язвы желудка и
развитие перитонита;
флегмону желудка в результате
инфицирования;
развитие желудочной и кишечной
непроходимости, возникающей при прорастаниии и сдавлении просвета привратника и
кишки (чаще ободочной);
развитие механической желтухи, портальной
гипертензии, асцита в результате прорастания опухолью головки поджелудочной
железы, желчных протоков, воротной вены или сдавления их метастазами в
лимфоузлы ворот печени.
Одним из тяжелых осложнений рака
желудка является кровотечение.
Кровотечения чаще возникают при
раковой опухоли: расположенной на малой кривизне желудка. Они могут возникнуть
в любой стадии процесса, но чаще наблюдаются в IIIIV стадии. Кровотечение
возникает в результате распада или изъязвления опухоли или разрыва кровеносного
сосуда, пораженного опухолью. В других случаях деструкция опухоли и развитие
гнойного и воспалительного процессов ведут к тромбированию и аррозии питающих
ее сосудов, что в свою очередь является причиной гангрены значительных
участков опухоли и ее распада, сопровождающегося кровотечением. Более часто
осложняются кровотечением язвенные формы рака. Чаще кровоточат опухоли желудка,
расположенные в теле и антральном отделе, значительно реже кровотечение
возникает при опухолях кардии. Это необходимо учитывать при определении
локализации источника кровотечения, особенно при его профузном характере. Наиболее
интенсивные кровотечения характерны для рака малой кривизны желудка, где
проходят ветви левой желудочной артерии.
Кровотечение может быть скрытым и
диагностироваться лишь при исследовании кала на скрытую кровь (реакция
Грегерсена). В других случаях клиническая картина довольно типична. Главным и
нередко единственным симптомом кровотечения является кровавая рвота (рвота
"кофейной гущей"), часто повторная, несколько реже дегтеобразный
стул, или, наконец, и то. и другое вместе.
В связи с кровопотерей у больных
развивается выраженная в той или иной степени картина острого малокровия. При
незначительных кровотечениях симптомы острой анемии выражены в большинстве
случаев нечетко или могут отсутствовать. При выраженных кровотечениях,
сопровождающихся рвотой, дегтеобразным стулом, падением гемоглобина до 6
ммоль/л, больные жалуются на общую слабость, головокружение, наблюдаются
бледность кожных покровов и видимых слизистых оболочек, тахикардия и снижение
уровня артериального давления. При тяжелых профузных кровотечениях,.
сопровождающихся быстрым падением гемоглобина до 54 ммоль/л и ниже. развивается
тяжелый сердечнососудистый коллапс с падением уровня артериального давления до
6040 мм рт.ст. и ниже. Пульс учащается до I20I40 уд в мин. Некоторые больные
теряют сознание, кожные покровы их принимают восковидный оттенок и покрывается
холодным потом, лицо делается мертвенно бледным, отмечается цианоз губ,
расширение зрачков. Количество эритроцитов снижается до 2 млн в I мм3 (2 Т/л )
и менее. В терминальной стадии пульс становится нитевидным, часто не
сосчитывается, у больных появляется непроизвольное мочеиспускание и дефекация.
Скрытое кровотечение из раковой
опухоли нередко не распознается на фоне раковой анемии и кахексии.
Выбор оптимальной лечебной тактики
при кровотечении, обусловленном распадающейся опухолью желудка, зависит прежде
всего от объема потерянной крови, и от того, остановилось кровотечение или нет.
Большую помощь при этом может оказать срочная эндоскопия. Она позволяет не
только определить локализацию источника кровотечения, но также установить факт
его прекращения или продолжения.
Лечение больных с желудочным
кровотечением ракового происхождения в большинстве случаев должно начинаться с
консервативных мероприятий: холод на живот, голод, хлористый кальции, викасол,
аминокапроновая кислота, гемотрансфузии, переливание кровезаменителей. Однако
при проведении указанных мероприятий не всегда удается добиться успеха.
Консервативная терапия при кровотечении у больных раком желудка позволяет в
большинстве случаев лишь временно остановить кровотечение и подготовить
больного к операции.
Большие возможности для местной
остановки желудочного кровотечения дает использование эндоскопа. У
тяжелобольных эндоскопию можно проводить только в тех случаях, когда
обеспечены срочное оказание анестезиологического пособия и реанимационная
помощь. При гастроскопии можно добиться гемостаза путем охлаждения места
кровотечения хлорэтилом или углекислым газом, прицельного орошения источника
кровотечения гемостатическими средствами. В отдельных случаях кровотечение
останавливается путем электрокоагуляции
Показаниями к экстренному
оперативному вмешательству являются: 1) не останавливающееся под влиянием
консервативной терапии кровотечение, 2) прекратившееся кровотечение при угрозе
его возобновления, 3) рецидив кровотечения после его остановки в условиях
стационара, 4) сочетание кровотечения с перфорацией.
Следует иметь в виду, что
одномоментная потеря 500 мл крови при продолжающемся кровотечении из раковой
опухоли желудка является показанием к немедленной операции на высоте кровотечения.
Таких больных следует сразу же направлять в операционную, где одновременно с
анестезиологическим пособием им проводят интенсивную инфузионнотрансфузионную
терапию.
Нередко весьма трудно выбрать метод хирургического
лечения при кровотечении из раковой опухоли желудка непосредственно во время
операции. Следует учитывать состояние больного, локализацию и стадию развития
раковой опухоли и часто чрезвычайно сложные топографоанатомические
взаимоотношения, возникшие в результате распространения опухоли за пределы
желудка. Методом выбора является выполнение радикальной или паллиативной
резекции желудка.
Прободение опухоли желудка
сравнительно частое осложнение, требующее неотложного хирургического
вмешательства.
Наиболее часто происходит прободение
в свободную брюшную полость с развитием гнойного и нередко гнилостного
перитонита.
Перфоративное отверстие обычно
неправильной формы, с неровными истонченными краями грязносерого цвета.
Встречаются и отверстия с плотными, утолщенными краями белесоватого цвета,
имеющие вид извилистого свищевого хода, щели, канала или небольшого дефекта
ткани опухоли. Нередко наблюдается большие прободные отверстия (до 1 см в
диаметре). В запуганных стадиях рака возможна микроперфорация, которая может
протекать как с выраженной картиной перфорации полого органа, так и в форме
скрытого течения. Обычно перфорация бывает одиночной, но может быть двойной и
множественной. Перфорация возможна при любой локализации злокачественного
процесса, но чаще встречается при опухолях малой кривизны и пилорического
отдела желудка.
Перфорация рака желудка может
сопровождаться кровотечением, что затрудняет диагностику и несомненно ухудшает
прогноз возникшего осложнения. Иногда кровотечение и развившаяся вследствие
этого анемия становятся ведущими в клинической картине течения опухолевого
процесса и затуиевывают симптомы прободения.
Перфорация раковой опухоли желудка
отличается разнообразием клинических проявлений, изменчивостью и
непостоянством симптомов. Она может характеризоваться типичной клинической
картиной перфорации полого органа, но может протекать атипично, скрыто, без
обычных признаков прободения. Прободной рак желудка имеет много сходных черт с
прободением язвы и в большинстве случаев так и расценивается.
Симптоматика прободения зависит от
локализации и величины перфорационного отверстия, изменений местного характера,
стадии развития опухолевого процесса, времени, прошедшего с момента перфорации,
сочетания перфорации с другими осложнениями. Для острой формы прободения
характерно внезапное появление резких болей, а в дальнейшем развитие
клинической картины прободения полого органа и симптомов перитонита. В этих
случаях обычно отчетливо выражены признаки прободения: резкое напряжение передней
брюшной стенки. положительный симптом ЩеткинаБлюмберга, разлитая болезненность
по всему животу, симптом исчезновения печеночной тупости. При острой форме, как
правило, легко диагностируют перфорацию, но не распознают раковый характер
процесса. Нередко перед прободением возникают продромальные симптомы. Весьма
характерными клиническими предвестниками перфорации являются усиление боли в
эпигастральной области с иррадиацией в подреберье иди надплечье, икота,
тошнота, рвота, повышение температуры тела, озноб. Появление предвестников
прободения связано с развитием воспалительнодеструктивных изменений в стенке
желудка и прилегающих к нему органов. В этот момент могут определяться
умеренное напряжение мышц передней брюшной стенки и даже симптомы раздражения
брюшины при сохранении печеночной тупости и отсутствии признаков свободного
газа в брюшной полости.
В запущенных случаях злокачественного
процесса типичная картина перфорации полого органа может отсутствовать, или
быть слабо выраженной, или напоминать таковую прикрытой перфорацией.Характерным
симптомом прободного рака желудка, как и прободной язвы, служит наличие
свободного газа в брюшной полости, которое выражается в исчезновении печеночной
тупости. В положении больного на спине на два пальца выше края реберной дуги по
сосковой и парастернальной линиям справа на месте определяемого обычно
перкуторно тупого звука выявляется отчетливый тимпанит.
Выбор метода оперативного
вмешательства при прободном раке желудка является трудной задачей, особенно в
ШIV стадии злокачественного процесса. Зачастую хирургу приходится решать ее
непосредственно во время экстренного оперативного вмешательства, предпринятого
по поводу предполагаемой прободной язвы желудка или двенадцатиперстной кишки.
Нередко злокачественный характер
перфорации не распознается даже во время операции, поэтому производится
типичное ушивание перфорационного отверстия, как при обычной язве. Особенно
трудно установить истинный характер прободения в ранних стадиях ракового
процесса, когда оно макроскопически не отличается от перфорации при язве
желудка. Это связано с тем, что в III стадии рака желудка инфильтрация и
уплотнение краев перфоративного отверстия имеет такой же вид, как при обычной
язве. Только при гистологическом исследовании язвенных краев или лимфатических
узлов в случае резекции желудка удается установить точный диагноз.
Выбор объема оперативного
вмеиательства при прободном раке желудка зависит от стадии злокачественного
процесса, локализации опухоли, наличия или отсутствия перитонита, состояния
больного, квалификации хирурга, владения им техникой резекции желудка, а
также от наличия условий для проведения такой операции и прежде всего
обязательного участия анестезиолога и ассистента. Операцией выбора при
прободном раке желудка следует считать субтстальную резекцию желудка. Крайне
редко в этих случаях осуществляют проксимальную резекцию или экстирпацию
желудка, которые сопровождаются весьма высокой летальностью, особенно при
выполнении по неотложным показаниям. Эти операции могут оказаться паллиативными
в смысле соблюдения онкологических принципов и в то же время радикальными в
отношении ликвидации патологического очага, являющегося непосредственной
угрозой жизни. В неоперабельной стадии рака желудка, но при наличии подвижной
опухоли показана паллиативная резекция или даже экстирпация. При малоподвижной
опухоли в некоторых случаях удается мобилизовать и выделить желудок вместе с
опухолью и произвести резекцию. Однако выполнение паллиативной резекции не
всегда возможно изза распространения злокачественного процесса на прилегающие
органы и ткани. При общем тяжелом состоянии больного: разлитом перитоните и
неподвижной опухоли, показано ушивание прободного отверстия с дренированием
брюшной полости.
Быстрота возникновения стеноза
зависит от формы роста опухоли и ее локализации. При экзофитных paкax, растущих
в просвет желудка, стеноз наступает быстрее, чем при эндофитных. При
локализации опухоли в канале привратника стенозирование наступает раньше, чем
при раке антрального отдела желудка.
Различают три стадии стеноза
выходного отдела желудка. В начальной стадии (компенсированный стеноз) наряду с
умеренным сужением выхода из желудка имеет место гипертрофия мускулатуры
желудка с небольшим увеличением его объема. В следующей стадии
(субкомпенсированный стеноз) сужение выхода из желудка прогрессирует, желудок
растягивается, стенка его начинает атрофироваться, отмечаются явления застоя
пищи в желудке. Наконец, заключительная стадия (декомпенсированный стеноз)
проявляется почти полной непроходимостью привратника, резким растяжением
желудка и атрофией его стенки.
Рак пилорического отдела желудка в
ранних стадиях клинически проявляется чувством переполнения в подложечной
области после приема пищи, урчанием в животе, отрыжкой воздухом или пищей. С
ростом опухоли симптомы стенозирования усиливаются, приобретая характер стойкой
задержки эвакуации содержимого желудка. Чувство переполнения в подложечной
области после еды усиливается, отрыжка приобретает кислый, затем тухлый запах.
К концу дня у больного появляется рвота пищей, съеденной не только в течение
дня, но и накануне. Рвота носит постоянный характер, повторяясь ежедневно.
Нередко больные сами вызывают рвоту. Иногда в рвотных массах определяется
примесь свежей или измененной крови. После рвоты больной испытывает
значительное облегчение.
Сужение привратника может достичь
крайней степени, при которой полностью прекращается поступление пищи из желудка
в двенадцатиперстную кишку. Наступает резкое похудание, переходящее в кахексии.
С рвотными массами больной теряет большое количество электролитов.
Стеноз выходного отдела желудка
является жизненным показанием к операции. Однако операция может быть выполнена
только после полноценной предоперационной подготовки больного.
Для борьбы с обезвоживанием
назначаются внутривенные инфузии раствора Рингера, изотонического раствора
поваренной соли. 5% раствора глюкозы. Необходимое количество жидкости рассчитывается
из суточной потребности организма в соответствии с весом больного и степенью
обезвоженности, которая определяется на основании показателей гематокрита
(норма 0.851,05) и пробы МакКлюраОлдрича. На I кг веса больного вводится 3050
мл жидкости в сутки. При этом необходимо контролировать суточный диурез и
центральное венозное давление, объем циркулирующей крови.
Наряду с обезвоживанием при частой
рвоте наблюдается гипохлоремия (в норме хлоридов 95110 ммоль/л) и гипокалиемия
(калий сыворотки 4,16,1 ммоль/л). В связи с этим назначается вливание 10%
раствора поваренной соли (50100 мл) и 3% раствора хлористого калия (200 мл).
У больных со стенозом привратника
должна быть проведена тщательная подготовка желудка к операции. В связи с
застоем в желудке развиваются процессы брожения и гниения, в связи с чем
наблюдаются воспалительный процесс в стенке желудка, лейкоцитарная
инфильтрация. Стенка желудка в таких случаях легко прорезается при накладывании
швов. Для уменьшения воспалительных явлений необходимо ежедневное промывание
желудка на ночь большим количеством воды с добавлением соляной кислоты. Такая
подготовка должна проводиться в течение 35 дней.
Оперативное лечение при раке
выходного отдела желудка может быть выполнено в виде радикальной операции, паллиативной
резекции желудка, симптоматической операции и эксплоративной (пробной)
лапаротомии.
Из радикальных операций при
дистальном раке желудка выполняется дистальная субтотальная резекция, а при
инфильтративных формах и большой распространенности процесса гастрэктомия.
При субтотальной резекции малую
кривизну пересекают отступя на 1.53 см от пищевода, большую на уровне нижнего
полиса селезенки. В дистальном направлении линия пересечения проходит через
двенадцатиперстную кишку на расстоянии 1,01.5 см за привратником.
При субтотальной резекции и других
радикальных операциях вместе с резецируемой частью желудка должны быть удалены
регионарные лимфатические узлы. С этой целью одним блоком с желудком удаляют
большой и малый сальники с заключенными в них лимфатическими узлами, а левую
желудочную артерию пересекают в желудочноподжелудочной связке непосредственно у
места отхождения от чревной артерии.
При наличии отдаленных метастазов и
технически удалимой опухоли выполняют паллиативную резекцию желудка; Во время
операции удаляют сальники с лимфатическими узлами. Операция ликвидирует
тягостные симптомы, продлевает жизнь больного на несколько месяцев,
предотвращает осложнения опухоли желудка. Последующая адъювантная химиотерапия
иногда позволяет увеличить продолжительность жизни оперированных.
При неоперабельном раке желудка, осложненном стенозом
привратника, возможно выполнение обходного гастроэнтероанастомоза. Операция
восстанавливает эвакуацию содержимого из желудка, ликвидирует мучительнув рвоту
и улучшает состояние больных. Гастроэнтероанастомоз может быть выполнен с
задней стенкой желудка (по ГаккеруПетерсену) или с передней (по Бельфлеру).
Изза возможного сдавления анастомоза метастазами в забрюшинные лимфатические
узлы обычно накладывают передний впередиободочный анастомоз на длинной петле с
дополнительным брауновским соустьем
67. Рак кардиального отдела желудка.
Клиника. Диагностика, Дифференциальный диагноз. Показания и противопоказания к
радикальным и паллиативным операциям Основные этапы проксимальной резекции
желудка и гастрэктомии
Рак кардиального отдела желудка. Первым симптомом
является боль в эпигастральной области под мечевидным отростком, нередко
иррадиирующая в область сердца. По мере роста опухоли нарастает дисфагия,
вначале при глотании грубой пищи, а затем и при приеме жидкости. Чувство
давления за грудиной, слюнотечение, срыгивание пищей признак расширения
пищевода над опухолью и застоя пищи в пищеводе. Больные быстро истощаются.
Рентгенологически определяется дефект наполнения в кардиальном отделе желудка.
Этапы операции:
1. Мобилизация желудка по большой и
малой кривизне.
2. Резекция 2/3 мобилизованного желудка.
. Обработка культи
двенадцатиперстной кишки.
. Обработка культи желудка.
. Мобилизация петли тонкой
кишки.
. Наложение позадиоободочного
гастроэнтероанастомоза на короткой петле.
68.
Рак тела желудка. Клиника. Диагностика, дифференциальный диагноз. Принципы
хирургическою лечения Комбинированные операции.
Рак тела желудка долгое время протекает бессимптомно.
Среди первых проявлений рака этой локализации преобладают общие симптомы:
нарастание слабости, быстрая утомляемость, похудание, анемия. Могут быть
снижение и потеря аппетита, отрыжка, рвота. При распаде опухоли наблюдается
повышение температуры тела.
На рентгенограммах выявляют большой
дефект наполнения. При локализации рака в области дна желудка первыми
проявлениями может быть боль типа стенокардии.
Вздутие живота, урчание, задержка
стула бывают обусловлены прорастанием опухоли большой кривизны желудка в
поперечную ободочную кишку с сужением ее просвета.
Радикальность операции включает:
) иссечение желудка,
двенадцатиперстной кишки и пищевода в пределах здоровых тканей;
) удаление в едином блоке с желудком
тех групп лимфоузлов, которые могут быть поражены метастазами при данной
локализации рака;
) абластическое оперирование, т. е.
использование комплекса приемов, направленных на уменьшение возможности так
называемой манипуляционной диссиминации.
Противопоказания к операции:
) наличие отдаленных метастазов в
печень, легкие, надключичные лимфоузлы, наличие большого асцита, в случае
поражения метастазами лимфатических узло 3го и 4го порядка;
) тяжелые сопутствующие заболевания.
Уровень пересечения органов
определяется локализацией опухоли, характером ее роста и распространенностью.
Линия резекции от краев опухоли должна отстоять при инфильтративноязвенных
формах не менее чем на 810 см в обе стороны от пальпируемой границы опухоли,
при экзофитно растущих формах не менее чем на 68 см от пальпируемой границы
опухоли.
Пересечение пищевода надо производить
не менее чем на 3 см выше пальпируемой верхней границы опухоли при экзофитной
форме и на 56 см при инфильтративной форме рака.
При раке пилорического отдела
желудка, особенно при эндофитных формах, возможно распространение опухолевых клеток
по лимфатическим сосудам подслизистого и мышечного слоев на начальную часть
двенадцатиперстной кишки. В связи с этим необходимо удалять 23 см
двенадцатиперстной кишки.
Основные типы радикальных операций
для лечения рака желудка:
) дистальная субтотальная резекция
желудка, выполняемая чрезбрюшинно;
) гастрэктомия, выполняемая
чрезбрюшинным и чрезплевральным доступом;
) проксимальная субтотальная резекция
желудка.
69. Рак пилорического отдела желудка.
Клиника. Диагностика. Дифференциальный диагноз. Подготовка к операции.
Показания и противопоказания к радикальным и паллиативным операциям. Отличие
дистальной резекции желудка при раке и язвенной болезни
Рак пилорического отдела желудка вызывает стенозирование и появление
симптомов нарушения эвакуации. Вначале возникают непостоянное чувство тяжести,
полноты, распирания в эпигастральной области после еды, отрыжка пищей. По мере
роста опухоли симптомы непроходимости усугубляются и становятся постоянными.
Стойкая задержка эвакуации пищи
вызывает распирающую боль в эпигастральной области, а компенсаторное усиление
перистальтики придает ей схваткообразный характер. Часто возникает рвота
съеденной пищей, приносящая временное облегчение. Накапливающаяся в желудке
пища подвергается брожению, появляется дурно пахнущая отрыжка. Рвота
непереваренной пищей, съеденной задолго до рвоты и даже накануне, возникает
несколько раз в день. Больные прогрессивно худеют, наступает обезвоживание.
Рентгенологически выявляется сужение выходного отдела желудка.
Дистальная резекция:
Этапы операции:
1. доступ, ревизия;
2. мобилизация желудка и
двенадцатиперстной кишки;
. пересечение
двенадцатиперстной кишки и ушивание ее культи;
. резекция желудка и
восстановление непрерывности пищеварительного тракта;
. ушивание операционной раны.
Вместе с желудком единым блоком
удаляют малый и большой сальник с лимфатическими узлами, расположенными вдоль
сосудов по обеим кривизнам желудка, околопилорические лимфатические узлы и
лимфатические узлы по ходу левой желудочной артерии, которую пересекают у места
отхождения ее от чревной.
При раке производят расширенную лимфодиссекцию.
70. Кишечная непроходимость.
Классификация. Патогенетические и патофизиологические изменения в кишечнике и
организме при разных видах непроходимости кишечника. Коррекция гомеостаза в
послеоперационном периоде
Непроходимость кишечника (ileus)
относится к числу наиболее грозных и тяжелых заболеваний. Синдром,
характеризующийся частичным или полным нарушением продвижения содержимого по
пищеварительному каналу и обусловленный механическим препятствием или
нарушением двигательной функции кишечника.
Классификация. Предложения по
классификации кишечной непроходимости мн гообразны, но в основе большинства из
них лежит принцип Е. Wahl (1889). Он разде лил все виды непроходимости на странгуляционную
и обтурационную. С позиций практической хирургии привлекает внимание
предложение придерживаться следующей классификации.. По происхождению:
) врожденная;
) приобретенная.. По течению:
) острая;
) хроническая.
Ш. По механизму развития:
) механическая: а) странгуляционная,
б) обтурационная (закупорка изнутри
и сдавление извне): опухолевая,
неопухолевая, в) смешанная;
) функциональная: а) спастическая, б)
паралитическая.. По локализации механического препятствия:
) тонкокишечная: а) высокая, б)
низкая;
) толстокишечная.
Кроме того, по развитию
патологического процесса выделяют следующие стадии: стадия острых нарушений
пассажа по кишечнику;- стадия острых расстройств внутристеночной кишечной
гемоциркуляции;- стадия перитонита.
Наиболее важными моментами в этой
классификации следует считать выделение механической и динамической, а также
странгуляционной и обтурационной непроходимости.
Существенное отличие первых двух
видов состоит в том, что при динамической непроходимости просвет кишки
свободен. Это в большинстве случаев обратимое заболевание, развивающееся в
результате нарушения мышечного тонуса кишечника на почве функциональных или
органических поражений его иннервационного аппарата. Механическое препятствие
отсутствует, но перистальтика прекращается.
Спастическая непроходимость
характеризуется тем, что спазм развивается на отдельных участках кишечника или
является общим. Предположительно механизм ее возникновения сводится к
рефлекторным влияниям из различных источников, в том числе от раздражения
слизистой оболочки самой кишки инородными телами, ядовитыми веществами и т. д.
Известно, что иннервация большинства органов брюшной полости осуществляется из
одного и того же нервного сплетения. Любое раздражение этих органов может
привести к рефлекторному спазму. Особенно подвергнуты такому влиянию лица с
вегетоневрозами. Спазм, как правило, сменяется параличом кишки.
Паралитическая непроходимость
встречается значительно чаще, чем спастическая. При ней отмечается расширение
кишки. Наиболее часто парез и паралич кишки наступают вследствие воздействия
токсинов или перехода воспалительного процесса с серозного покрова на
нервномышечный аппарат кишки (при перитоните). Раздражение брюшинного покрова
(травма, излияние в забрюшинную клетчатку или в полость брюшины крови,
высыхание, охлаждение и т. д.) также ведут к развитию паралитической
непроходимости. Кроме того, в силу указанных выше особенностей иннервации,
такая непроходимость может появиться и при острых воспалительных процессах в
других органах брюшной полости.
Динамическая кишечная непроходимость
составляет в структуре острой кишечной непроходимости не больше 35%, хотя
хирурги встречаются с ней практически ежедневно в раннем послеоперационном
периоде у больных, оперированных на органах брюшной полости и забрюшинного
пространства. К ее развитию могут привести метаболические нарушения
(диабетическая и уремическая комы), острые нарушения кровообращения (тромбоз
брыжеечных сосудов, инфаркт селезенки и др.).
Наиболее часто как при диагностике,
так и при лечении трудности возникают при механической кишечной непроходимости.
Выделение странгуляционного и обтурационного вида ее имеет принципиальное
значение. Если обтурационная непроходимость характеризуется закрытием просвета
кишечной трубки извне или изнутри (опухолью, каловым или желчным камнем,
клубком гельминтов и т. д.), то при странгуляционной непроходимости нарушается
еще и кровоснабжение кишки. Такое состояние возникает в результате заворота
кишечной петли вокруг своей оси , образования узла между несколькими петлями
кишки , ущемления кишечной петли вместе с брыжейкой в грыжевых воротах .
К смешанной кишечной непроходимости
относится инвагинация, при которой происходит внедрение одной кишки в другую .
При этом внедрившаяся кишка может закупоривать (обтурировать) просвет другой
кишки и приводить к сдавлению сосудов своей брыжейки.
Ущемление кишки и спаечная
непроходимость также могут быть отнесены к смешанной кишечной непроходимости.
Хроническая непроходимость прежде
всего связана с развитием мощных сращений в брюшной полости. Большинство таких
больных были многократно оперированы вследствие рецидивов острой кишечной
непроходимости. Иногда к хронической форме кишечной непроходимости относят
случаи неполного, частичного перекрытия просвета кишки. Такие ситуации могут
возникнуть, например, при новообразованиях кишки, при наличии многокамерных
послеоперационных вентральных грыж.
В современных концепциях патогенеза
синдрома ОКН прослеживаются два пути развития патологического процесса:
ишемический и обтурационный.
Механизм ишемических нарушений при
ОКН достаточно универсален и связан как с общими повреждениями микроциркуляции,
так и с влиянием на кровообращение кишечной гипертензии и других звеньев
патогенеза. Волемические и гемодинамические изменения возникают в связи с
сокращением артериального притока и венозного оттока за счет компрессии сосудов
брыжейки (при странгуляционных видах непроходимости), либо внутристеночных
сосудов за счет повышения критического давления в просвете кишки при
функциональной или обтурационной ОКН.
В последующем под влиянием
биологически активных веществ происходит ишемический паралич прекалиллярных
сфинктеров, развивается стаз и агрегация форменных элементов крови. Свободные
тканевые кинины и гистамин нарушают проницаемость сосудистой стенки, что
способствует появлению интерстициального отека, это в совокупности с ишемией и
действием эндотоксинов приводит к деструкции кишечной стенки с некробиозом всех
ее слоев даже при обтурационных формах ОКН, а следовательно, и к развитию
перитонита. Острая кишечная непроходимость, по сути, - это осложнение, а
основное заболевание, являющееся этиологическим фактором, оказывается на втором
плане.. Универсальность механизмов развития ОКН независимо от причин
заболевания позволяет рассматривать ее как синдромную патологию. Считается, что
повреждения основных функций кишечника, характерные для кишечной
непроходимости, объединяются в синдром кишечной недостаточности или энтераргию.
Катастрофический рост обменных расстройств при синдроме кишечной
недостаточности является следствием нарушения гомеостаза, в норме
поддерживаемого межуточным обменом между энтеральной и внутренней средой.
Доказано, что «синдром кишечной недостаточности* в определенной мере
универсален и присущ многим заболеваниям. Он является составной частью
описанного в конце 1970х гг. синдрома полиорганной недостаточностb
Патологические изменения в кишке при
ОКН развиваются прежде всего в участках, противоположных месту вхождения
брыжеечных сосудов. Вначале возникает деструкция слизистой оболочки, а затем и
других слоев кишечной стенки. Тяжесть и темп некробиотических изменений
нарастает значительно быстрее при странгуляционной непроходимости, а также в
приводящей петле кишки, чем в отводящей. В приводящей кишке они располагаются
намного дальше в проксимальном направлении, чем в отводящей кишке в дистальном
направлении.
Клиника и диагностика. Клиническая
картина непроходимости разнообразна и изменчива. С течением времени одни
симптомы могут исчезать, другие появляются. Однако окончательная оценка состояния
больного не может быть отложена до появления какогонибудь несомненного
признака. Все усилия врача на любом этапе болезни должны быть направлены на
самые тщательные поиски тревожных симптомов этого грозного патологического
состояния и, несомненно, учтены даже косвенные признаки.
Клиническая картина механической
кишечной непроходимости зависит не только от ее формы, но также от уровня
закупорки, сроков заболевания, индивидуальных особенностей больного и других
факторов.
Известно, что чем выше расположено
препятствие, вызвавшее непроходимость, тем тяжелее клинически протекает это
заболевание. Чем больше времени проходит от начала заболевания, тем больше
вероятность появления симптомов перитонита. Наиболее тяжело непроходимость
протекает в раннем детском возрасте и у пожилых людей. При всем многообразии
клинической картины все же можно выявить ряд доминирующих симптомов,
позволяющих распознать ее. К этим симптомам относятся боль, рвота, задержка
стула и газов.
Боль относится к наиболее ранним и
постоянным симптомам заболевания. Самой характерной особенностью при
обтурационной непроходимости являются схваткообразные боли. Появление боли
совпадает с моментом прохождения перистальтической волны перед препятствием.
Схватка может быть очень мучительной, и взрослые люди даже просят врача на этот
момент прервать осмотр. С прекращением схватки оль утихает, но на короткое
время (на 23 мин), а затем вновь возникает прогрессированием болезни сила
мышечных сокращений кишки ослабевает, наступает парез, болезненные проявления
успокаиваются.
71. Динамическая кишечная непроходимость.
Классификация. Этиология. Патогенез. Клиника. Диагностика. Дифференциальный
диагноз. Принципы лечения
Динамическая непроходимость кишечника характеризуется стойким
парезом или параличом кишечника или стойким спазмом. Функциональные
расстройства, ведущие к паралитической динамической непроходимости, бывают
обусловлены острыми воспалительными процессами в брюшной полости (холецистит,
панкреатит, аппендицит, перитонит) или забрюшинной клетчатке (паранефрит и
др.), травмами и травматичными операциями, интоксикацией, острыми нарушениями
кровообращения в органах брюшной полости (тромбоз брыжеечных сосудов, инфаркт
селезенки), забрюшинными гематомами и др. Метаболические нарушения
(диабетическая, уремическая кома), интоксикация, гипокалиемия также могут
привести к развитию паралитической непроходимости кишечника. Спастическая
динамическая непроходимость чаще вызывается аскаридами, отравлением свинцом,
плоскостными спайками в брюшной полости, печеночной порфирией.
Этиология: чтобы вызвать стаз
кишечного содержимого и клинические проявления динамической кишечной
непроходимости, достаточно того, чтобы был парализован не весь кишечник, а лишь
какойлибо его отдел Отсутствие пропульсивной перистальтической волны
обусловливает застой в приводящем отрезке кишки. Паралитическая непроходимость
кишечника развивается как осложнение различных заболеваний и травм органов
брюшной полости. Все перитониты ведут к появлению симптомов паралитической
непроходимости. Нередко паралитическая непроходимость кишечника осложняет
нехирургические заболевания органов грудной и брюшной полости, забрюшинного
пространства (инфаркт миокарда, острая плевропневмония, плеврит, мочекаменная
болезнь и др.).
Отдельную и тяжелую группу
динамической паралитической непроходимости составляют те виды, которые
возникают на почве острых нарушений кровообращения в мезентериальных сосудах
(тромбозы и эмболии верхнебрыжеечной артерии Клиника и диагностика: основными
симптомами динамической паралитической непроходимости являются боли, рвота,
стойкая задержка отхождения стула и газов, вздутие живота. Боли носят тупой,
распирающий характер, не имеют четкойлокализации и иррадиации. Они, как
правило, постоянные, схваткообразный компонент как бы уходит на второй план.
Рвота, второй по частоте симптом
паралитической непроходимости, обычно многократная, сочетается со срыгиванием
застойного зловонного желудочного содержимого. Рвотные массы обильные, с
большой примесью дуоденального и кишечного содержимого. Нередко рвота носит
геморрагический характер вследствие диапедезного кровотечения из стенки
желудка, а также из острых язв и эрозий. Живот вздут равномерно. Асимметрии
вздутия, свойственной механической непроходимости, не наблюдается. При
пальпации определяют ригидность брюшной стенки. У худощавых больных удается
пальпировать растянутые в виде цилиндров петли тонкой кишки. Перистальтика либо
резко ослаблена, либо отсутствует и при аускультации живота вместо кишечных
шумов слышны дыхательные и сердечные шумы (симптом "гробовой тишины"
Лотейссена).
Если паралитическая непроходимость не
сочетается с развитием перитонита, в первые часы общее состояние больных от нее
страда ет мало, но затем, спустя 3-4 ч, быстро начинают нарастать ги поволемия,
тяжелые расстройства обмена веществ, нарушения сердечной деятельности.
Диагноз паралитической непроходимости
ставят на основании характерных признаков динамической непроходимости и наличия
симптомов основного заболевания, приведшего к ее развитию.
При обзорной рентгеноскопии живота для
паралитической непроходимости характерны: равномерное вздутие всех отделов
кишечника, преобладание в раздутых кишках газообразного содержимого над жидким,
наличие горизонтальных уровней жидкости как в тонкой, так и в толстой кишке
одновременно. Лечение: комплексное и в первую очередь направлено на устранение
патологического процесса, приведшего к развитию пара литической кишечной
непроходимости. С целью восстановления моторной функции кишечника и борьбы с
парезом проводят мероприятия по восстановлению активной перистальтики.
При консервативном лечении
паралитической непроходимости применяют аминазин. снижающий угнетающее действие
на перис тальтику симпатической эфферентации и антихолинэстеразные препараты
(прозерин, убретид), активирующие перистальтику путем усиления функции
парасимпатической нервной системы. Необходима определенная последовательность в
использовании этих препаратов. Вначале вводят аминазин или аналогичные ему
препараты, через 45-50 мин прозерин. Хороший эффект дает также и электростимуляция
кишечника. Больным необходима постоянная декомпрессия желудка и ки шечника
путем назогастральной катетеризации двенадцатиперстной и тонкой кишки, зондом
Миллера - Эббота.
Нарушения гомеостаза корригируют по
общим принципам лс чения острой кишечной непроходимости Хирургическое лечение
при паралитической кишечной непроходимости показано редко в случаях
возникновения кишечной непроходимости на фоне перито нита, тромбоза или эмболии
брыжеечных сосудов, а также при смешанном варианте кишечной непроходимости (сочетание
механичес кого и паралитического компонентов) Спастическая кишечная
непроходимость сравнительно редкий вид динамической кишечной непроходимости.
Прекращение продвижения кишечного содержимого обусловлено возникновением
стойкого спазма мышечного слоя стенки кишки. Этиология.
Стойкий спазм кишечника возникает,
при отравлении тяжелыми металлами (свинцом), никотином; при порфириновой
болезни, при уремии.
Длительность спазма может быть
различная: от нескольким минут до нескольких часов.
Клиника и диагностика: спастическая
кишечная не проходимость может быть в любом возрасте. Заболевание
характеризуется внезапным началом. Ведущий симптом - сильные схваткообразные
боли. Боли не имеют определенной локализации и обычно распространяются по всему
животу. В период схваток больной мечется по кровати, кричит.
Диспепсические расстройства не
характерны. Задержка стула и газов наблюдается не у всех больных, они никогда
не бывают стойкими. Общее состояние больного нарушается незначительно. Живот
при осмотре имеет обычную конфигурацию. Иногда брюшная стенка вытянута, и живот
принимает ладьевидную форму. При обзорном рентгеновском исследовании живота
выявляют спастическиатоническое состояние кишечника. Иногда по ходу тонкой
кишки видны мелкие чаши Клойбера, расположенные цепочкой слева сверху вниз и
вправо. При контрастном исследовании желудочнокишечного тракта с барием
определяют замедленный пассаж бариевой взвеси по тонкой кишке.
Лечение: консервативное. Больным
назначают спазмолитики, физиотерапевтические процедуры, тепло на живот,
проводят лечение основного заболевания.
72. Механическая кишечная непроходимость.
Классификация. Клиника. Диагностика. Дифференциальный диагноз. Осложнения.
Предоперационная подготовка
Обтурационная непроходимость кишечника
Артериомезентериальная непроходимость обусловлена
сдавлением нижней горизонтальной ветви двенадцатиперстной кишки верхней
брыжеечной артерией, отходящей у таких больных от аорты под острым углом.
Иногда этот вариант кишечной непроходимости возникает остро, после обильного
приема пищи (желудочное содержимое, поступающее в кишечник, оттягивает его
книзу, передавливая натягивающейся при этом верхней брыжеечной артерией
двенадцатиперстную кишку). В клинической картине преобладают резкие боли в
верхней половине живота и обильная рвота с примесью желчи. Состояние больного
довольно быстро улучшается при принятии горизонтального или коленнолоктевого
положения. Рентгенологически в остром периоде отмечается значительное
расширение желудка и двенадцатиперстной кишки, при контрастном исследовании
отмечается задержка эвакуации контраста из двенадцатиперстной кишки в
вертикальном положении и улучшение эвакуации в коленнолоктевом. Возможно
хроническое течение заболевания. Лечение: консервативное - частое дробное
питание, после еды отдых в горизонтальном положении, лучше на правом боку. При
неэффективности консервативных мероприятий показано хирургическое вмешательство
- наложение дуоденоеюноанастомоза.
Прогноз: благоприятный.
Обтурация желчными камнями составляет 0,5-2% от всех
случаев кишечной непроходимости.
Этиология: при хронических холециститах вследствие
деструктивных изменений в желчном пузыре происходит спаяние его стенки с
органами желудочнокишечного тракта и затем образуется пузырнодуоденальный свищ,
по которому камень, находящийся в желчном пузыре, отходит в просвет кишечника
Обтурацию вызывают камни диаметром 3-4 см. Застреванию камня в просвете кишки и
развитию острой кишечной непроходимости способствует вторичный спазм кишечной
стенки. Наиболее часто обтурация желчными камнями происходит на уровне
терминального отрезка подвздошной кишки, что объясняют сравнительной узостью
просвета этого отдела кишечника.
Клиника и диагностика: явления обтурационной
непроходимости при закупорке желчными камнями возникают, как правило, остро и
протекают со схваткообразными болями, многократной рвотой. Явления
непроходимости иногда носят перемежающийся характер.
При обзорной рентгеноскопии живота обнаруживают
раздутые газом петли тонкой кишки с характерным "спиралевидным"
рисунком складок слизистой оболочки. Нередко имеется газ в проекции
желчевыводящих протоков и в отдельных случаях на фоне газа в кишечнике видна
тень камня, обтурирующего просвет кишки. Лечение: только хирургическое.
Производят энтеротомию дистальнее камня, удаление его и декомпрессию кишечника.
В дальнейшем выполняют по показаниям холецистэктомию.
Закупорки, каловыми камнями бывает преимущественно в
толстой кишке. Этот вид непроходимости наблюдается у пожилых людей, страдающих
хроническим энтероколитом, упорными запорами. Предрасполагающими факторами
часто бывают аномалии развития (мегаколон, мегасигма, врожденные мембраны
слизистой оболочки и др.).
Клиника и диагностика: судьба копролитов различна.
Нередко они, находясь в просвете кишки годами, не вызывают болезненных
симптомов. Копролиты могут самостоятельно отходить со стулом. В ряде случаев
копролиты приводят к развитию пролежней стенки кишки и каловому перитониту. Они
могут вызывать острую непроходимость толстой кишки, симптомы и клиническое
,течение которой имеет все характерные особенности низкой непроходимости
кишечника: схваткообразные боли, полная задержка стула и газов, усиленная,
длительно сохраняющаяся перистальтика, резкое вздутие сигмовидной и ободочной
кишки, принимающих форму раздутой автомобильной шины, пустая, баллонообразно
раздутая ампула прямой кишки.
Лечение: при обтурации каловыми камнями операция
показана в редких случаях, если консервативные методы лечения (сифонные и
масляные клизмы, попытка пальцевого удаления камней через прямую кишку даже под
наркозом) не дают эффекта.
Хирургическое лечение заключается в колотомии,
удалении камней и наложении колостомы или противоестественного заднего прохода.
Обтурация кишечника опухолью составляет 9-10% от всех
форм острой кишечной непроходимости. Обтурацию чаще вызывают злокачественные
опухоли, локализующиеся в тонкой или толстой кишке (чаще в сигмовидной кишке).
Клиника и диагностика симптомы кишечной непроходимости при обтурации опухолями
развиваются постепенно, подостро. Обычно они сочетаются с симптомами
злокачественной опухоли, которая вызывает истощение, кровотечение и
интоксикацию больного. Нередко непроходимость является первым симптомом опухоли
ободочной кишки.
Непроходимость на почве опухоли в зависимости от
локализации может протекать по типу как высокой, так и низкой непроходимости.
Резкое вздутие ободочной кишки при опухоли, обтурирующей сигмовидную кишку,
приводит к резким нарушениям микроциркуляции в стенке кишечника и перфорациям,
которые чаще локализуются в слепой кишке, чем в непосредственной близости от опухоли.
Лечение: только хирургическое. При тонкокишечной обтурации производят резекцию
с первичным межкишечным анастомозом. При раке слепой и восходящей
кишки-гемиколэктомию (см.выше). В случае наличия неоперабельной опухоли
накладывают обходной анастомоз. При непроходимости на уровне левых отделов
ободочной кишки производят двух и трехэтапные операции. При неоперабельной
опухоли толстой кишки накладывают постоянную колостому или противоестественный
задний проход. Послеоперационная летальность составляет 20-30%.
Странгуляционная кишечная непроходимость
Частота странгуляционных видов непроходимости
составляет 40-50% от всех наблюдений острой непроходимости.
Завороты (volvulus) представляют собой закручивание
кишки с ее брыжейкой вокруг продольной оси и составляют 4-5% всех видов
кишечной непроходимости. Различают завороты тонкой; сигмовидной и слепой кишки.
Этиология: среди причин заворотов кишки выделяют предрасполагающие и
производящие.
К предрасполагающим причинам относят: а) врожденную
или приобретенную чрезмерно длинную брыжейку кишки, мальротацию, б) рубцовые
тяжи, сращения, спайки между петлями кишечника как врожденного, так и
приобретенного характера, в) резкое похудание с исчезновением жировых прослоек
между листками брыжейки. К производящим причинам относят: а) внезапное
повышение внутрибрюшного давления, приводящее к резкому перемещению кишечных
петель, б) алиментарные факторы: нерегулярное питание, длительное голодание с
последующей перегрузкой кишки большим количеством грубой пищи.
В нормальных условиях петли кишечника совершают
значительные по объему движения и нередко делают повороты до 180°С, не вызывая
какихлибо патологических нарушений. При перекручивании кишки более чем на 180°
происходит перекрытие ее просвета и сдавление сосудов брыжейки. Возникают
кровоизлияния и некроз стенки кишки. Впоследствии развивается перитонит.
Заворот слепой кишки возможен в тех случаях, когда
кишка имеет собственную брыжейку или общую с брыжейкой тонкой кишки. Наиболее
часто бывает заворот сигмовидной кишки. Помимо значительной длины брыжейки
завороту способствует рубцовое сморщивание корня брыжейки сигмовидной кишки при
мезосигмоидите. Следствием этого является сближение петель кишки, которые
располагаются почти параллельно (по типу "двустволки"). При усилении
перистальтических сокращений или переполнения плотным и газообразным содержимым
кишка легко закручивается вокруг своей оси, что приводит к непроходимости.
Клиника и диагностика: завороты тонкой кишки
начинаются остро. Заболевание протекает с тяжелыми общими и местными
клиническими симптомами, характерными для острой высокой странгуляционной
непроходимости кишечника. Ведущим симптомом являются резкие боли. Характерна
постоянная острая боль в глубине живота и в превертебральной области. В первые
часы заболевания на фоне постоянной боли периодически возникают схваткообразные
боли, интенсивность которых нарастает синхронно с перистальтикой, достигая
характера нестерпимых. Часто больные кричат от болей, становятся беспокойными,
принимают вынужденное положение с приведенными к животу ногами. . Рвота с
самого начала многократная и не приносит облегчения. |Сначала она рефлекторная,
неизмененным желудочным содержимым "и желчью, а затем принимает
фекалоидный характер. Задержка стула и газов бывает не всегда. Часто в начале заболевания
бывает однократный стул за счет опорожнения нижних отделов кишечника, не
приносящий облегчения. Общее состояние крайне тяжелое. Быстро появляются и
нарасгают нарушения водносолевого, белкового и углеводного обмена,
микроциркуляторные и гемодинамические расстройства, интоксикация, сокращается
диурез. Живот умеренно вздут. Иногда вздутие фоявляется лишь сглаженностью
подреберных областей. В первые часы заболевания нередко обнаруживают
положигельный симптом Валя. В более поздние сроки над растянутой
странгулированной петлей тонкой кишки определяют "шум плеска"
(положительный симптом Склярова). При обзорной рентгеноскопии живота
обнаруживают чаши Клойбера, которые появляются через 1-2 ч от начала
заболевания.
Прогноз: при заворотах тонкой кишки плохой.
Летальность постигает 30%. При завороте слепой кишки симптомы выражены так же
остро, как и при завороте тонкой кишки.
Боли (как постоянные, так и схваткообразные)
локализуются в правой половине живота и в околопупочной области Рвота
появляется в начале заболевания, но редко бывает фекалоидной Задержка стула и
газов имеется у большинства больных. При осмотре выявляют асимметрию живота за
счет вздутия в околопупочной области Одновременно нередко происходит западение
правой подвздошной области (положительный симптом Шимана-Данса). При пальпации
живота часто обнаруживается ригидность мышц брюшной стенки.
При выслушивании живота отмечают характерные звонкие с
металлическим оттенком перистальтические шумы. В дальнейшем, по мере развития
перитонита, перистальтические шумы ослабевают.
На обзорной рентгенограмме живота видна шаровидно
раздутая слепая кишка, которая локализуется в правой половине живота или
смещена кнутри и кверху. В зоне проекции кишки виден большой (длиной до 20 см)
горизонтальный уровень жидкости. Заворот сигмовидной кишки возникает чаще у
пожилых людей, длительно страдающих запорами.
Боли носят такой же характер, как и при других формах
стран гуляционной непроходимости. Они возникают внезапно, интенсивные,
локализуются обычно в нижних отделах живота и в области крестца. Рвота одно и
двукратная. Фекалоидной рвоты, как правило, не бывает. Она появляется лишь с
развитием перитонита. Ведущим симптомом является задержка стула и газов. Живот
резко вздут. Асимметрия проявляется выбуханием верхних отделов правой его
половины. При этом живот приобретает характерный "перекошенный" вид.
Вследствие сильного вздутия ободочной кишки все
внутренние органы и диафрагма оттесняются кверху. В связи с этим у больных
затрудненное дыхание и нарушается сердечная деятельность.
При рентгеноскопии видна резко раздутая газами
сигмовидная кишка, которая занимает почти всю брюшную полость и дает
характерный симптом "светлого живота", на фоне которого видны 1-2
чаши Клойбера с длинными уровнями жидкости. Лечение при заворотах кишечника
необходима экстренная операция, так как консервативные методы лечения не
эффективны.
Хирургическое лечение состоит в расправлении
завернувшихся петель кишки (деторсия) и опорожнении кишки от содержимого
(декомпрессия). При омертвении кишки показана ее резекция. Резекцию производят
по общим правилам, принятым при хирургическом лечении острой непроходимости
кишечника (см выше). С целью профилактики рецидива заболевания при заворотах
слепой и сигмовидной кишки необходима их фиксация к брюшной стенке Узлообразование
кишок (nodulus intestini). Протекает с тяжелыми нарушениями кровообращения в
сосудах брыжейки и ранним некрозом больших отрезков тонкой и толстой кишки.
Наблюдается у 3 4% всех больных острой кишечной непроходимостью. Этиология в
узлообразовании принимают участие не менее двух кишечных петель. Одна из
кишечных петель, сложенная в виде двустволки вместе со своей брыжейкой,
образует ось, вокруг которой вторая петля кишки также вместе с ее брыжейкой
закручивается на один или несколько оборотов, сдавливает первую петлю и сама
подвергается странгуляции. В результате образования узла просвет кишечника
оказывается перекрытым не менее чем на двух уровнях.
В узлообразовании обычно принимают участие тонкая
кишка и подвижные, имеющие собственную брыжейку отделы толстой кишки. Наиболее
частыми видами межкишечных узлов являются узлы между тонкой кишкой и
сигмовидной или тонкой кишкой и слепой, которая в этих случаях имеет
собственную брыжейку. Узлообразование между петлями тонкой кишки (тощей и
подвздошной) наблюдается редко. Кровоснабжение в сосудах брыжеек
странгулируемой и странгулирующей кишки в начальных стадиях заболевания
нарушается в различной степени. В начале заболевания обычно в большей степени
страдает кровоснабжение в странгулируемой петле. Затем быстро нарушается
кровоснабжение обеих петель, и они оказываются в состоянии некроза.
Клиника и диагностика: предполагать узлообразование
кишок надо в тех случаях, когда клинические и рентгенологические признаки
странгуляции тонкой кишки сочетаются с признаками непроходимости толстой кишки,
невозможно введение высокой клизмы, имеются "баллонообразная" ампула
прямой кишки и горизонтальные уровни жидкости в левых отделах толстой кишки
(наряду с уровнями жидкости в тонкой кишке) Лечение: хирургическое.
В ранней стадии заболевания производят развязывание
узла. При невозможности расправить узел, что часто наблюдается в поздние сроки,
прибегают к резекции больших отделов толстой и тонкой кишки.
Принципы оперативного лечения острой механической
кишечной непроходимости: 1) Ликвидация механического препятствия или создание
обходного пути для кишечного содержимого. При тонкокишечной непроходимости
следует стремиться к полной ликвидации причины, вызвавшей ее, вплоть до
резекции кишки с наложением межкишечного анастомоза (рассечение спаек, резекция
кишки при опухоли, рассечение кишки с удалением желчного камня и др.). Это
правило не относится к толстокишечной непроходимости, при лечении которой
одномоментное наложение межкишечного анастомоза приводит к недостаточности швов
и развитию перитонита. Только при правосторонней локализации опухоли,
обтурирующей ободочную кишку, у молодых больных при незапущенной кишечной
непроходимости допустима правосторонняя гемиколэктомия с наложением
илеотрансверзоанастомоза. В остальных случаях более целесообразны: а)
двухэтапные и б) трехэтапные операции.
Двухэтапная операция - резекция кишки, несущей
опухоль, с наложением противоестественного заднего прохода на приводящую петлю,
вторым этапом - наложение анастомоза между приводящей и отводящей петлей.
Трехэтапная операция - разгрузочная цекостома или противоестественный задний
проход проксимальнее места обтурации; резекция участка ободочной кишки с
опухолью с наложением межкишечного анастомоза; закрытие цекостомы или
противоестественного заднего прохода. 2. Удаление некротизированных или
подозрительных на некроз участков кишечника. Необходимость в резекции может
возникнуть как при странгуляционной, так и при обтурационной непроходимости
(некроз приводящей петли кишки). Признаки нежизнеспособности петли кишки см.
"Ущемленные грыжи". 3. Разгрузка дилатированного участка кишечника
способствует восстановлению микроциркуляции в стенке кишки, тонуса стенки кишки
и перистальтики. Добиться разгрузки дилатированного сегмента можно трансназальным
введением в тонкую кишку во время операции перфорированных зондов или введением
аналогичных зондов через гастро или цекостому.
Лечение больных оперативной ликвидацией непроходимости
не заканчивается. В послеоперационном периоде патогенетическое лечение проводят
по тем же принципам, что и в дооперационном периоде.
Основной задачей послеоперационного введения является
ликвидация тяжелых патофизиологических нарушений, восстановление нормального
водносолевого, белкового и углеводного обменов. Особое значение приобретают
мероприятия, направленные на раннюю активизацию кишечной перистальтики,
дезинтоксикацию, профилактику тромбоэмболических и воспалительных осложнений. С
целью восстановления моторной функции желудка и кишечника в послеоперационном
периоде проводят постоянную (на протяжении 3-4 сут) аспирацию
желудочно.кишечного содержимого через назогастральный зонд, назначают
антихолинэстеразные препараты, сеансы электростимуляции кишечника.
Дезинтоксикация достигается восстановлением нормального диуреза, для чего необходимо
тщательное возмещение водных потерь. Хороший дезинтоксикационный эффект
достигают стимуляцией форсированного диуреза введением лазикса (30-40 мг) при
умеренной гемодилюции. Синтетические плазмозаменители (реополиглюкин, гемодез)
являются хорошими адсорбентами токсинов, способствуют их выведению почками.
Профилактику тромбоэмболических осложнении
осуществляют комплексом мероприятии: эластической компрессией вен нижних
конечностей, активным режимом, назначением дезагрегантов, антикоагулянтов
прямого и непрямого действия. Для борьбы с инфекцией и профилактики ее
назначают антибиотики широкого спектра действия: внутривенно, внутримышечно и
местно в брюшную полость через введенные в нее во время операции
микроирригаторы.
Прогноз: летальность после операций по поводу острой
кишечной непроходимости остается высокой и составляет в среднем 13-18%. Для
снижения послеоперационной летальности большое значение имеет организация
оказания скорой медицинской помощи. Ранняя госпитализация и раннее
хирургическое вмешательство имеют основное значение для благоприятного исхода
лечения. По данным крупных статистик, летальность среди больных с острой
кишечной непроходимостью, оперированных в первые 6 ч, составляет 3,5%, а среди
оперированных после 24 ч - 24,7% и более.
73. Обтурационная кишечная
непроходимость. Определение. Клиника. Диагностика. Дифференциальный диагноз.
Виды операций. Борьба с интоксикацией, парезом кишечника
Обтурационная непроходимость
Обтурация кишечника опухолью составляет 9-10% всех форм острой
непроходимости кишечника, причинами ее бывают в основном злокачественные
опухоли, локализующиеся в толстой кишке (чаще в сигмовидной), реже - опухоли
тонкой кишки.
Клиническая картина и диагностика. Симптомы непроходимости кишечника
развиваются постепенно, подостро, обычно сочетаясь с симптомами злокачественной
опухоли (истощение, анемия, интоксикация и др.). Нередко непроходимость
является первым проявлением опухоли ободочной кишки.
Заболевание может протекать по типу
как высокой, так и низкой непроходимости. Резкое вздутие ободочной кишки при
опухоли, обтурирующей сигмовидную ободочную кишку, приводит к резким нарушениям
микроциркуляции в стенке кишечника, изъязвлению и перфорации.
Лечение. Применяют хирургическое и
консервативное лечение в зависимости от причины обтурации. При опухоли тонкой
кишки производят резекцию кишки с первичным межкишечным анастомозом. При
обтурации слепой и восходящей ободочной кишки опухолью производят
гемиколэктомию. В случае неоперабельной опухоли накладывают обходной
илеотрансверзоанастомоз. При локализации опухоли в левых отделах ободочной
кишки производят двух и трехэтапные операции. В случае неоперабельной опухоли
этих отделов кишки накладывают противоестественный задний проход.
Послеоперационная летальность при этом составляет 2030%.
Артериомезентериальная непроходимость
кишечника
обусловлена сдавлением нижней горизонтальной ветви двенадцатиперстной кишки
верхней брыжеечной артерией, отходящей в некоторых случаях от аорты под острым
углом. Иногда этот вариант непроходимости кишечника возникает остро после
обильного приема пищи. Желудочное содержимое, поступающее в тощую кишку,
оттягивает ее вместе с верхней брыжеечной артерией книзу. Это приводит к
сдавлению двенадцатиперстной кишки между позвоночником сзади и натянутой как
струна верхней брыжеечной артерией и брыжейкой тонкой кишки спереди.
Клиническая картина и диагностика. В клинической картине преобладают
резкие боли в верхней половине живота и обильная рвота с примесью желчи.
Состояние больного довольно быстро улучшается в коленнолоктевом положении, при
котором степень сдавления двенадцатиперстной кишки значительно уменьшается.
Рентгенологически выявляют значительное расширение желудка и двенадцатиперстной
кишки. При контрастном исследовании отмечают задержку эвакуации контрастного
вещества из двенадцатиперстной кишки при вертикальном положении больного и
улучшение эвакуации - в коленнолоктевом. Возможны варианты хронического течения
заболевания.
Лечение. Вначале применяют консервативное
лечение: частое дробное питание, отдых после еды в горизонтальном положении,
лучше на правом боку. При неэффективности консервативных мероприятий показано
хирургическое вмешательство - наложение дуоденоеюноанастомоза.
Прогноз благоприятный.
Обтурация желчными конкрементами составляет 0,5-2% всех случаев
кишечной непроходимости.
Этиология и патогенез. При хроническом калькулезном
холецистите вследствие деструктивных изменений в желчном пузыре (пролежень
нижней стенки пузыря) происходит спаяние его стенки с двенадцатиперстной или
толстой кишкой. При увеличении пролежня образуется пузырнодуоденальный или
пузырнотолстокишечный свищ, по которому конкремент из желчного пузыря
проваливается в просвет кишечника. Обтурация возникает при конкрементах
диаметром 3-4 см и более. Развитию острой непроходимости при этом способствует
вторичный спазм кишки. Наиболее часто обтурация желчными конкрементами
происходит на уровне терминального отрезка подвздошной кишки, что объясняют
сравнительной узостью просвета этого отдела кишечника.
Клиническая картина и диагностика. Явления непроходимости возникают, как
правило, остро и протекают со схваткообразными болями, многократной рвотой. При
обзорной рентгеноскопии живота обнаруживают раздутые газом петли тонкой кишки с
характерным "спиралевидным" рисунком складок слизистой оболочки.
Нередко выявляют газ в желчевыводящих протоках.
Закупорка каловыми
"конкрементами" происходит преимущественно в толстой кишке. Этот вид непроходимости
наблюдается у пожилых людей, страдающих хроническим колитом, длительным
запором. Предрасполагающими факторами часто бывают аномалии развития
(мегаколон, мегасигма, врожденные мембраны слизистой оболочки и др.).
Клиническая картина и диагностика. Каловые конкременты могут
самостоятельно отходить со стулом. В ряде случаев они приводят к развитию
пролежней стенки кишки и каловому перитониту. Конкременты могут вызывать острую
непроходимость толстой кишки, симптомы и клиническое течение которой характерны
для низкой непроходимости кишечника: схваткообразные боли, задержка стула и
газов, усиленная, длительно сохраняющаяся перистальтика, резкое вздутие
ободочной кишки, принимающей форму раздутой автомобильной шины, пустая,
раздутая баллонообразно ампула прямой кишки.
Лечение. При обтурации каловыми конкрементами
операция показана в тех редких случаях, когда консервативные методы лечения
(сифонные и масляные клизмы, попытка пальцевого или эндоскопического
размельчения и удаления конкрементов через прямую кишку) не дают эффекта.
Хирургическое лечение заключается в
колотомии, удалении конкрементов и наложении временной колостомы.
74. Странгуляшюниая кишечная
непроходимость. Понятие. Классификация. Клиника различных видов сфангуляционной
непроходимости. Диагностика. Дифференциальный диагноз. Виды операций. Показания
к резекции кишечника
Частота странгуляционных видов непроходимости
кишечника составляет 40-50% всех наблюдений острой непроходимости.
Завороты (volvulus) представляют собой закручивание
кишки с ее брыжейкой вокруг продольной оси. Они составляют 4-5% всех видов
непроходимости кишечника. Различают завороты тонкой, сигмовидной ободочной и
слепой кишки.
Среди причин заворотов кишки выделяют предрасполагающие
и производящие факторы.
К предрасполагающим причинам относят: а) чрезмерно
длинную брыжейку кишки, незавершенный поворот кишечника; б) рубцовые тяжи,
сращения, спайки между петлями кишечника как врожденного, так и приобретенного
характера; в) резкое похудание.
К производящим причинам относят: а) внезапное
повышение внутрибрюшного давления, приводящее к резкому перемещению кишечных
петель; б) алиментарные факторы: нерегулярное питание, длительное голодание с
последующей перегрузкой кишки большим количеством грубой пищи.
Заворот тонкой кишки. В нормальных условиях петли
кишечника совершают значительные по объему движения и нередко делают повороты
до 90°, не вызывая какихлибо патологических нарушений. При повороте кишки более
чем на 180° происходит перекрытие ее просвета и сдавление сосудов брыжейки.
Завороту способствуют переполнение кишечника, усиленная перистальтика, спайки.
В заворот могут вовлекаться несколько петель, а иногда весь кишечник
Клиническая картина и диагностика. Завороты тонкой кишки
начинаются остро. Заболевание протекает с тяжелыми общими и местными
клиническими симптомами, характерными для острой высокой странгуляционной
непроходимости.
В первые часы заболевания на фоне постоянной боли
периодически возникают схваткообразные боли, интенсивность которых нарастает
синхронно с перистальтикой, достигая характера нестерпимых. Часто больные
становятся беспокойными, кричат от боли, принимают вынужденное положение с
приведенными к животу ногами. С самого начала заболевания возникает многократная
рвота, не приносящая облегчения, вначале - неизмененным желудочным содержимым и
желчью, а затем она становится фекалоидной. Задержка стула и газов является
непостоянным симптомом заболевания: часто вначале бывает однократный стул за
счет опорожнения нижних отделов кишечника, не приносящий облегчения.
Общее состояние больного тяжелое. Быстро появляются и
нарастают нарушения водносолевого, белкового и углеводного обменов,
микроциркуляторные и гемодинамические расстройства, интоксикация, снижение диуреза.
Живот умеренно вздут, иногда вздутие проявляется лишь сглаженностью подреберных
областей.
Нередко обнаруживают положительный симптом Валя -
баллонообразно растянутую и фиксированную в животе петлю тощей кишки, над
которой определяют высокий тимпанит и шум плеска.
При обзорной рентгеноскопии живота обнаруживают чаши
Клойбера, которые появляются через 1-2 ч от начала заболевания и локализуются в
левой половине эпигастральной области и в мезогастральной области.
Лечение хирургическое. Оно заключается в деторсии или
"развязывании" узлообразования, удалении содержимого кишечника через
длинный назоинтестинальный зонд. При не вызывающей сомнения жизнеспособности
кишки ограничиваются деторсией. При некрозе кишки производят резекцию
нежизнеспособной петли с анастомозом конец в конец. Линия пересечения кишки
должна быть на 40-60 см выше препятствия и на 10-15 ниже него.
Заворот слепой кишки возможен в тех случаях, когда она
имеет собственную брыжейку или общую с тонкой кишкой брыжейку. При завороте
слепой кишки симптомы выражены так же остро, как и при заворотах тонкой кишки.
Боли (как постоянные, так и схваткообразные) локализуются в правой половине
живота и в околопупочной области. Обычно наблюдается рвота. У большинства
больных имеется задержка стула и газов.
При осмотре выявляют асимметрию живота за счет вздутия
в околопупочной области. Одновременно происходит западение правой подвздошной
области. При пальпации живота часто обнаруживают положительный симптом
Шиманса-Данса (ощущение "пустоты" при пальпации в правой подвздошной
области) и ригидность мышц брюшной стенки.
При аускультации живота отмечают характерные звонкие,
с металлическим оттенком перистальтические шумы. В дальнейшем, по мере развития
перитонита, перистальтические шумы ослабевают.
На обзорной рентгенограмме живота выявляют шаровидно
раздутую слепую кишку, которая локализуется в правой половине живота или
смещена кнутри и кверху. В зоне проекции кишки виден большой (длиной до 20 см)
горизонтальный уровень жидкости.
Заворот сигмовидной ободочной кишки возникает чаще у
пожилых людей, длительно страдающих запорами. Помимо значительной длины
брыжейки, завороту способствует рубцовое сморщивание брыжейки сигмовидной обо
дочной кишки при мезосигмоидите. Следствием этого является сближение
приводящего и отводящего участков кишки, которые располагаются почти
параллельно (по типу "двустволки"). При усилении перистальтических
сокращений или переполнения плотным и газообразным содержимым кишка легко
закручивается вокруг своей оси, что приводит к непроходимости.
Клиническая картина. Боли возникают внезапно, бывают
интенсивными, локализуются обычно в нижних отделах живота и в области крестца,
сопровождаются одно и двукратной рвотой. Фекалоидная рвота, как правило,
возникает только при развитии перитонита и паралитической непроходимости.
Ведущий симптом заворота сигмовидной ободочной кишки - задержка стула и газов.
Живот резко вздут. Отмечается его асимметрия - выбухание верхних отделов правой
половины вследствие перемещения сигмовидной кишки вверх и вправо. При этом живот
приобретает характерный "перекошенный" вид.
Вследствие сильного вздутия ободочной кишки все
внутренние органы и диафрагма оттесняются кверху. Это ведет к затруднению
дыхания и нарушению сердечной деятельности.
При рентгеноскопии выявляют резко раздутую газами
ободочную кишку (восходящую, поперечную, нисходящую), которая занимает почти
всю брюшную полость (характерный симптом "светлого" живота), на фоне
которой видны 1-2 чаши Клойбера с длинными уровнями жидкости.
Лечение. При заворотах сигмовидной кишки применяют
хирургический и консервативный методы лечения.
Хирургическое лечение состоит в расправлении
завернувшихся петель кишки (деторсия) и опорожнении кишки от содержимого
(декомпрессия). При омертвении кишки показана ее резекция по общим правилам, принятым
при хирургическом лечении острой непроходимости кишечника. С целью профилактики
рецидива заболевания при заворотах сигмовидной кишки производят
мезосигмопликацию по ГагенТорну. На передний и задний листки удлиненной
брыжейки от корня ее до кишки накладывают 3-4 параллельных сборивающих шва. При
их затягивании брыжейка укорачивается. Это уменьшает опасность повторного
заворота. Некоторые хирурги предпочитают фиксировать сигмовидную кишку
несколькими швами к передней или задней брюшной стенке.
Узлообразование кишки (nodulus intestini) протекает с
тяжелыми нарушениями кровообращения в сосудах брыжейки и ранним некрозом
значительных участков тонкой и толстой кишки. Наблюдается у 3 - 4% всех больных
острой непроходимостью кишечника (рис. 25.3).
Этиология и патогенез. В узлообразовании принимают
участие не менее двух кишечных петель. Одна из них, сложенная в виде
"двустволки" вместе со своей брыжейкой, образует ось, вокруг которой
вторая петля кишки также вместе с ее брыжейкой закручивается на один или несколько
оборотов, сдавливает первую петлю и сама подвергается странгуляции. В
результате образования узла просвет кишечника оказывается перекрытым не менее
чем на двух уровнях.
В узлообразовании обычно принимают участие тонкая
кишка и подвижные, имеющие собственную брыжейку отделы толстой кишки. Наиболее
частыми видами межкишечных узлов являются узлы между тонкой кишкой и
сигмовидной ободочной или тонкой кишкой и подвижной слепой, имеющей собственную
брыжейку. Узлообразование между петлями тонкой кишки (тощей и подвздошной)
наблюдается редко.
Кровоснабжение в сосудах брыжеек ущемляемой и
ущемляющей кишки в начальных стадиях заболевания нарушается в различной степени
(обычно в большей степени страдает кровоснабжение в ущемляемой петле). Затем
быстро нарушается кровоснабжение обеих петель, в которых развивается некроз.
Клиническая картина и диагностика. Предполагать
узлообразование кишки надо в тех случаях, когда клинические и
рентгенологические признаки странгуляции тонкой кишки сочетаются с признаками
непроходимости толстой кишки ("баллонообразная" ампула прямой кишки
при ректальном исследовании, горизонтальные уровни жидкости в левых отделах
толстой кишки наряду с уровнями жидкости в тонкой кишке).
Лечение. Применяют только хирургическое лечение. В
ранней стадии заболевания производят "развязывание" узла. При
невозможности расправить узел, что часто наблюдается в поздние сроки, прибегают
к резекции толстой и тонкой кишки.
Прогноз часто неблагоприятный. Летальность составляет
около 25%.
Инвагинация кишки возникает вследствие внедрения
одного из отделов кишечника в другой. В результате образуется цилиндр
(инвагинат), состоящий из трех кишечных трубок, переходящих одна в другую.
Наружная трубка цилиндра называется воспринимающей или влагалищем. Средняя и
внутренняя трубки цилиндра называются образующими. Участок, где средний цилиндр
переходит во внутренний, называют головкой инвагината, место перехода наружного
цилиндра в средний - шейкой. В редких случаях инвагинат состоит из 5 - 7 слоев.
Внедрение одной кишки в другую происходит на различную глубину. Закрытие
просвета кишки инвагинатом ведет к обтурационной непроходимости. Вместе с
кишкой внедряется и ее брыжейка, что приводит к сдавлению сосудов
(странгуляция), расстройству кровообращения и некрозу внутреннего и среднего
цилиндра кишки. Наружный цилиндр инвагината, как правило, не подвергается
некрозу.
Инвагинацию кишечника наблюдают преимущественно у
детей (до 75% всего числа больных). У взрослых острая инвагинация кишечника
бывает редко и составляет 2-3% больных с непроходимостью кишечника. Наиболее
часто бывает инвагинация подвздошной кишки в слепую (илеоцекальная инвагинация)
или (у 80% больных) подвздошной и слепой кишки в восходящую ободочную.
Этиология. Основной причиной инвагинации являются
опухоли на "ножке", гематома, воспалительный инфильтрат и др.,
которые в результате перистальтических сокращений продвигаются в дистальном
направлении, увлекая за собой стенку кишки. Причиной инвагинации может стать
стойкий спазм стенки кишки, в результате которого спазмированный участок кишки
перистальтическими сокращениями внедряется в другой отрезок кишки, находящийся
в состоянии пареза.
Клиническая картина и диагностика. У детей чаще бывают
острые формы заболевания; у взрослых преобладают подострые и хронические формы.
При острой форме заболевание начинается внезапно,
иногда на фоне энтерита или после приема слабительного средства. Ведущим
симптомом являются резкие, схваткообразные боли, которые нарастают по своей
интенсивности до нестерпимых при перистальтических сокращениях кишечника и
затем постепенно стихают. Со временем интервалы между схватками укорачиваются,
боли становятся постоянными, сопровождаются неоднократной рвотой. Вместе с тем
отхождение кишечного содержимого из нижележащих отделов сохраняется. В
испражнениях обнаруживают примесь крови и слизи. У ряда больных наблюдают
кровавый стул и тенезмы. Кровянистые выделения нередко имеют вид
"малинового желе".
При осмотре живота выявляют видимую на глаз
перистальтику. Живот при пальпации мягкий. При глубокой пальпации обычно
удается определить болезненное, малоподвижное, цилиндрической формы
образование, располагающееся при илеоцекальной инвагинации в правой подвздошной
области, правом подреберье или поперечно над пупком (при глубокой инвагинации).
При ректальном исследовании находят расширенную пустую ампулу прямой кишки, а
при глубокой инвагинации у детей иногда и головку спустившегося в прямую кишку
инвагината. Как правило, в просвете прямой кишки обнаруживают кровянистые
выделения.
Диагноз основывается на характерной триаде симптомов -
схваткообразные боли в животе, пальпируемое цилиндрической формы образование в
правой половине брюшной полости, кровянистые выделения из прямой кишки. Важна
дифференциальная диагностика инвагинации и аппендикулярного инфильтрата. Правильному
распознаванию способствуют большая интенсивность болей при инвагинации, их
схваткообразный характер, отсутствие присущих аппендициту симптомов. В
сомнительных случаях диагноз уточняет обзорная рентгеноскопия живота, при
которой выявляют горизонтальные уровни жидкости в тонкой кишке, и ирригоскопия,
при которой обнаруживается дефект наполнения в слепой или восходящей ободочной
кишке с четкими контурами, имеющий форму полулуния или двузубца.
Лечение. Необходима экстренная операция.
Консервативные мероприятия (сифонные клизмы, введение газа в ободочную кишку,
назначение спазмолитиков) редко бывают эффективными даже в первые часы
заболевания. Во время операции, произведенной в ранние сроки, путем осторожного
и нежного выдавливания удается произвести дезинвагинацию. После этого для
уменьшения излишней подвижности кишки и предупреждения рецидива заболевания
производят цекопексию (фиксируют отдельными узловыми швами терминальный отрезок
подвздошной кишки и слепую кишку к задней париетальной брюшине). Если расправить
инвагинат не удается или дезинвагинированная кишка оказывается
нежизнеспособной, производят резекцию кишечных петель с соблюдением всех правил
резекции кишечника в условиях острой непроходимости.
Прогноз у больных с острой странгуляционной кишечной
непроходимостью зависит прежде всего от своевременной постановки диагноза и
сроков выполнения оперативного пособия, а также от характера сопутствующих
заболеваний у лиц пожилого и старческого возраста. К сожалению, средние
показатели послеоперационной летальности у больных странгуляционной
непроходимостью кишечника достигают 20% и более, что связано с поздней
обращаемостью больных к врачу, запоздалой диагностикой и, как следствие этого,
потерей времени для выполнения операции в более благоприятных условиях.
75. Спаечная непроходимость кишечника.
Причины. Клиника. Диагностика. Дифференциальный диагноз. Консервативное и
хирургическое лечение
Спаечная кишечная непроходимость встречается у 2/3
больных острой кишечной непроходимостью. Наиболее часто бывает послеоперационная
спаечная кишечная непроходимость, возникающая после различных лапаротомий. Чаще
всего она развивается после аппендэктомий, операций по поводу острой кишечной
непроходимости и гинекологических операций.
Спаечная непроходимость в 40-50% случаев может быть
странгуляционной, в 15-20% - обтурационной и 30-40% - смешанной. Наиболее
частой формой странгуляционной кишечной непроходимости является ущемление петли
тонкой или толстой кишки рубцовой, шнуровидной или плоскостной спайкой между
петлями кишечника, сальником, маткой и ее придатками, червеобразным отростком,
желчным пузырем и брюшной стенкой, в области послеоперационного рубца и т. д.
Обтурация просвета кишечника возникает в результате перегиба кишечной петли, ее
деформации и сдавления спайками. Спаечная непроходимость может сочетаться с
заворотом и узлообразованием кишечника.
Клиническая картина
Клиника зависит от формы непроходимости. При
странгуляционной кишечной непроходимости состояние больного тяжелое, отмечаются
повторные рвоты, боли и вздутие живота, задержка стула и газов при ущемлении
сигмовидной кишки. Пульс частый (до 120 ударов в минуту), язык сухой, обложен
белым налетом, живот вздут, при аускультации выслушивается усиленная
перистальтика. При развитии гангрены кишки отмечаются симптомы перитонита.
Обтурационная спаечная непроходимость отличается более благоприятным течением с
постепенным нарастанием симптомов, нередко носит характер частичной
непроходимости.
Лечение спаечной непроходимости
При спаечной кишечной непроходимости производят
рассечение спаек, при некрозе - резекцию кишечника. При множественных
сращениях, рубцовых стенозах кишки может быть выполнена операция обходного
межкишечного анастомоза. Для профилактики повторного образования спаек в
брюшную полость через капиллярную полихлорвиниловую трубку вводят 100 мл 4%ного
поливинилпирролидона совместно с 10-20 тыс. ЕД фибринолизина, 5-10 тыс. ЕД
гепарина и 60-100 мг гидрокортизона, 200 мл 0,25%чного новокаина с
антибиотиками (200 тыс. ЕД пенициллина, 250 тыс. ЕД стрептомицина и др.). После
операции рекомендуется кратковременное введение гидрокортизона или кортизона в
течение 4-5 дней. Кортикостероиды вводят внутримышечно в снижающих дозировках.
76. Инвагинация кишечника. Определение.
Виды инвагинации. Клиника. Диагностика. Дифференциальный диагноз. Виды
операций. Техника и показания кдезинвагинации и резекции кишки
Инвагина́ция кише́чника - выделяемый в отдельную
нозоформу вид непроходимости кишечника, причиной которого является внедрение
одной части кишечника в просвет другой. Этот вариант кишечной непроходимости
встречается преимущественно у детей грудного возраста (8590 %), особенно часто
в период с 4 до 9 мес. У детей старше 1 года инвагинация наблюдается редко и в
большинстве случаев бывает связана с органической природой (дивертикул
подвздошной кишки, гиперплазия лимфоидной ткани, полип, злокачественное
новообразование и др.)
Инвагинация встречается чаще у грудных детей (между 4
и 10 м месяцем жизни), которые хорошо упитаны. Заболевание начинается внезапно.
Ребенок становится беспокойным, плачет, корчится, поджимает ножки. Приступ
заканчивается так же неожиданно, как и начинается. Ребенок успокаивается, даже
играет, но через некоторое время приступы болей повторяются снова. Приступы
болей соответствуют волнам кишечной перистальтики, которые продвигают
инвагинированную часть кишки вперед. Приступы болей встречаются в 90 % случаев
заболевания. Вскоре после первых приступов боли возникает одно или двукратная
рвота, которая также возникает периодически. В начале заболевания рвота носит
рефлекторный характер, а потом причиной становится обтурация просвета
инвагинированной кишки. Температура тела как правило остается нормальной.
Вначале у ребенка нормальный стул 12 раза, но позднее, через 610ч в
испражнениях появляются примеси крови и они приобретают характерный вид
«малинового желе». Позднее выделение испражнений и газов прекращается.
Вследствие сдавления внедрившегося участка кишки и соответствующего ему участка
брыжейки в них наступают выраженные расстройства кровообращения. Воспалительные
явления приводят к слипанию цилиндров, что препятствует расправлению
инвагинации. При внимательной пальпации в интервалах между приступами, живот
мягкий, не вздут. Во время приступа ребенок рефлекторно напрягает брюшную
мускулатуру и живот невозможно тщательно обследовать. Часто удается
пропальпировать инвагинированный участок кишки, опухолевидное образование
мягкоэластической консистенции, колбасовидной формы, болезненное при пальпации.
Опухоль изменяет свою форму и локализацию в зависимости от сроков заболевания и
подвижности кишечника. В литературе описаны случаи, когда инвагинат пройдя по
толстой кишке, выпадает из заднего прохода, и его принимают за выпавшую прямую
кишку. О тяжести состояния ребенка с инвагинацией кишечника можно судить по выраженным
явлениям интоксикации. В случаях поздней диагностики развивается клиника
перитонита, живот становится вздутым, напряженным, резко болезненным при
пальпации во всех отделах. Осмотр ребенка заканчивают исследованием через
прямую кишку. При этом в ряде случаев бимануально удается ощупать опухоль.
После извлечения пальца из заднего прохода выделяется слизь с кровью, без
примеси каловых масс.
В зависимости от причины инвагинации (которая, как
правило, существенно различается для разных возрастных групп) её лечение может
быть консервативным или оперативным. У детей грудного возраста инвагинация в
большинстве случаев разрешается при помощи консервативных мероприятий. В данный
момент применяется консервативный метод лечения кишечной инвагинации нагнетание
воздуха в толстый кишечник через газоотвод посредством манометрической груши.
Данный метод эффективен при тонкотолстокишечных инвагинации на сроках до 18
часов. Тонкотонкокишечную инвагинацию как правило таким способом расправить не
удается. Включение лапароскопии в комплекс лечебнодиагностических мероприятий
при кишечной инвагинации может существенно повысить процент больных, вылеченных
консервативно. Цель лапароскопиивизуальный контроль за расправлением инвагината
и оценка жизнедеятельности кишечника. Показаниями к этому методу являются:
· неэффективность консервативного лечения при ранних
сроках заболевания
· попытка консервативного расправления
инвагината при позднем поступлении(исключая осложненные формы заболевания)
· выяснение причин инвагинации у детей
старше 1 года
Оперативное лечение состоит в лапаротомии и ручной
дезинвагинации, которую производят не вытягиванием внедренной кишки, а методом
осторожного «выдавливания» инвагината, захваченного всей рукой или двумя
пальцами. Если не удалось осуществить дезинвагинацию или обнаружен некроз
участка кишки, производят резекцию в пределах здоровых тканей с наложением
анастомоза.
77. Свищи тонкой кишки. Классификация.
Клиника. Диагностика. Дифференциальный диагноз. Показания к операции и ее
сроки. Виды операций. Доступы
Кишечный свищ - сообщение просвета
кишки с поверхностью тела или с просветом другого полого органа.
Классификация кишечных свищей
I.
По времени
возникновения: врожденные, приобретенные.
II.
По этиологии:
травматические, наложенные с лечебной целью, возникшие при заболеваниях тонкой
кишки.
III.
По функции:
полные, неполные.
IV.
По характеру
свища: губовидные, трубчатые.
V.
По уровню
расположения на кишке: высокие, низкие, смешанные.
VI.
По наличию
осложнений: неосложненные, осложненные.
VII. По количеству: одиночные и
множественные.
Свищи тонкой кишки могут быть
врожденными (например, при незаращении желточного протока) и приобретенными.
Приобретенные свищи возникают в результате травмы, болезней (дивертикулез
толстой кишки, болезнь Крона), операций, при которых свищ накладывают с
лечебной целью (еюностомия при неоперабельном тотальном раке желудка,
колостомия при острой обтурационной кишечной непроходимости на фоне рака
сигмовидной кишки).
Свищи могут развиться в результате
длительного стояния тампонов и дренажей в брюшной полости, несостоятельности
швов тонкой или толстой кишки.
Свищ, соединяющий просвет кишки с
поверхностью тела, называют наружным, один орган с другим - внутренним. При
полном свище все кишечное содержимое изливается наружу, при неполном - часть
его проходит в отводящую петлю кишки. Если свищ открывается непосредственно на
поверхности тела и слизистая оболочка кишки сращена с кожей, это состояние
называют губовидным свищом. Когда между кишкой и поверхностью тела имеется ход,
это - трубчатый свищ.
Свищи, расположенные на
двенадцатиперстной и тощей кишке, относят к высоким, на подвздошной и толстой -
к низким.
Возникающие в организме изменения
связаны с потерей через свищ белков, жиров, углеводов, витаминов, воды,
электролитов и ферментов. Чем оральнее расположен свищ, тем больше эти потери и
тем более выражены нарушения обмена веществ и водноэлектролитного баланса. На
коже вокруг свища может возникать мацерация (дерматит). К местным осложнениям
относят абсцессы, флегмону брюшной стенки, гнойные или каловые затеки. Кроме
того, могут возникать выпадения кишки, парастомальные грыжи, кровотечения из
свища, энтерит (колит). К общим осложнениям относят кахексию, почечную и
печеночную недостаточность.
Клиническая картина и диагностика. Наружные тонкокишечные свищи
проявляются выделением жидкого тонкокишечного содержимого. Из свищей толстой
кишки выделяются кал и газы. Локализацию свища, его функцию и уровень
расположения уточняют во время рентгенологического исследования. При
тонкокишечных свищах контрастное вещество вводят через рот и следят за его
пассажем, при толстокишечных - через прямую кишку (ирригоскопия). Важным
способом диагностики является фистулография, при которой водорастворимое
контрастное вещество вводят в наружное отверстие свища.
При трубчатых свищах
двенадцатиперстной, тощей и подвздошной кишки обычно проводят консервативное
лечение: калорийное парентеральное и энтеральное (зондовое) питание, коррекцию
нарушений обмена веществ и водноэлектролитных расстройств, окклюзию свища с
помощью различных устройств (пелоты, обтураторы), уход за кожей вокруг свища. У
ряда больных положительного результата достигают при проведении полного
парентерального питания. В целом курс консервативной терапии дает эффект у
30-40% больных при его продолжительности 1 - 1 , 5 мес.
Неэффективность консервативного
лечения свища двенадцатиперстной кишки после резекции желудка может быть
обусловлена дуоденостазом, синдромом приводящей петли, что требует проведения
реконструктивной операции. При свищах нисходящей ветви двенадцатиперстной кишки
изза несостоятельности билиодигестивного анастомоза или травмы,
сопровождающихся значительными потерями желчи и содержимого кишки, показана
операция на отключение двенадцатиперстной кишки, однако прогноз у этой категории
больных, особенно при инфрапапиллярных свищах, сомнительный.
При губовидных и длительно
незаживающих свищах тонкой кишки показано хирургическое лечение. При неполных
трубчатых и губовидных свищах целесообразно использовать внебрюшинные методы их
закрытия, при остальных видах свищей методом выбора является лапаротомия с
внутрибрюшинной резекцией участка кишки, несущей свищ, и наложением анастомоза
между приводящей и отводящей петлями по типу конец в конец.
При губовидных свищах толстой кишки
прибегают к операциям, вариант которых зависит от типа свища (полный или
неполный). При небольших неполных губовидных свищах используют внебрюшинные
способы их закрытия. Для этого выделяют стенку кишки в зоне свища и ушивают
дефект двухрядным швом. При больших неполных и при полных губовидных свищах
показано применение внутрибрюшных способов закрытия. С этой целью выделяют
кишку по всему периметру свища, выводят ее в рану и ушивают свищевое отверстие
(при неполных свищах) или накладывают анастомоз (при полных свищах). При
множественных свищах, расположенных на одной кишечной петле, целесообразно
резецировать ее и наложить анастомоз.
78.
Острый аппендицит. Классификация. Клиника. Диагностика. Дифференциальный
диагноз. Хирургическая тактика. Методы операций. Доступы.
Острый аппендицит - воспаление
червеобразного отростка слепой кишки, обусловленное внедрением в его стенку
патогенной микробной флоры. Основным путем инфицирования стенки отростка
является энтерогенный. Гематогенный и лимфогенный варианты инфицирования встречаются
чрезвычайно редко и не играют решающей роли в патогенезе заболевания.
Непосредственной причиной воспаления
являются разнообразные микроорганизмы (бактерии, вирусы, простейшие),
находящиеся в отростке. Среди бактерий чаще всего (90%) обнаруживают анаэробную
неспорообразуюшую флору (бактероиды и анаэробные кокки). Аэробная флора
встречается реже (6-8%) и представлена прежде всего кишечной палочкой,
клебсиеллой, энтерококками и др. (цифры отражают соотношение содержания
анаэробов и аэробов в химусе толстой кишки).
В основе патогенеза острого
аппендицита чаще всего (у 60% больных) лежит окклюзия просвета отростка,
причиной которой, как правило, являются гиперплазия лимфоидных фолликулов (у
молодых пациентов), феколиты (у 20-35%), фиброзные тяжи, стриктуры (у лиц
старше 40-50 лет), реже - инородные тела, паразиты, опухоли. У
ВИЧинфицированных блокаду просвета отростка могут вызвать саркома Капоши и
лимфомы (ходжкинская и неходжкинская).
Продолжающаяся в этих условиях
секреция слизи приводит к тому, что в ограниченном объеме полости отростка
(0,1-0,2 мл) развивается и резко возрастает внутриполостное давление.
Увеличение давления в полости аппендикса вследствие растяжения ее секретом,
экссудатом и газом приводит к нарушению сначала венозного, а затем и артериального
кровотока.
При нарастающей ишемии стенки
отростка создаются условия для бурного размножения микроорганизмов. Выработка
ими экзо и эндотоксинов приводит к повреждению барьерной функции эпителия и
сопровождается локальным изъязвлением слизистой оболочки (первичный аффект
Ашоффа). В ответ на бактериальную агрессию макрофаги, лейкоциты, лимфоциты и
другие иммунокомпетентные клетки начинают выделять одновременно
противовоспалительные и антивоспалительные интерлейкины, фактор активации
тромбоцитов, адгезивные молекулы и другие медиаторы воспаления, которые при
взаимодействии друг с другом и с клетками эпителия в состоянии ограничить
развитие воспаления, не допустить генерализацию процесса, появление системной
реакции организма на воспаление.
Избыточное образование и выделение
противовоспалительных интерлейкинов (IL1, IL6, TNF - фактор некроза опухоли, PAF - фактор активации тромбоцитов и др.) способствуют
дальнейшему распространению деструктивных изменений в стенке органа. При
некрозе мышечного слоя, особенно при наличии феколитов в аппендиксе, у 50%
больных происходит перфорация отростка, развиваются перитонит или
периаппендикулярный абсцесс.
Неокклюзионные формы острого
аппендицита можно объяснить первичной ишемией отростка в результате развития
несоответствия между потребностью органа в артериальном кровотоке и
возможностью его обеспечения при стенозе питающих сосудов, их тромбозе в
бассейне артерии червеобразного отростка - артерии функционально конечного
типа. Тромбоз сосудов брыжейки отростка приводит к развитию первичной гангрены.
Большинством хирургов принята
следующая классификация аппендицита.
1. Острый неосложненный аппендицит:
а) катаральный (простой,
поверхностный),
б) деструктивный (флегмонозный,
гангренозный).
2.Острый осложненный аппендицит: перфорация отростка, аппендикулярный
инфильтрат, абсцессы (тазовый, поддиафрагмальный, межкишечный), перитонит,
забрюшинная флегмона, сепсис, пилефлебит.
3.Хронический аппендицит (первичнохронический, резидуальный,
рецидивирующий).
Клиническая картина и диагностика. Диагностика и лечение больных с
острой болью в животе остается одним из трудных бастионов классического
искусства врачевания. Клиническая картина острого аппендицита вариабельна и
зависит от степени воспалительных изменений в стенке отростка, особенностей
локализации аппендикса в брюшной полости, возраста, физического состояния
больных, их реактивности, наличия или отсутствия осложнений сопутствующих
заболеваний.
Жалобы. При остром неосложненном аппендиците
в начале болезни внезапно появляется абдоминальный дискомфорт: ощущение
вздутия, распирания живота, колик или неопределенной боли в эпигастрии или в
околопупочной области. Отхождение стула или газов на короткий период облегчает
состояние пациента. С течением времени (1-3 ч) интенсивность боли нарастает,
меняется ее характер. Вместо приступообразной, ноющей, колющей появляется
постоянная, жгучая, распирающая, давящая боль. Как правило, это соответствует
фазе миграции боли из эпигастрия в правый нижний квадрант живота (симптом
Кохера-Волковича). В этот период резкие движения, глубокое дыхание, кашель,
тряская езда, ходьба усиливают локальную боль, которая может заставить больного
принять вынужденное положение (на правом боку с приведенными к животу ногами).
Локализация боли в животе часто
указывает на место расположения воспалительного очага в брюшной полости. Так,
боль, сосредоточенная в лонной области, внизу живота справа может
свидетельствовать о тазовой локализации отростка. При медиальном расположении
аппендикса боль проецируется на пупочную область, ближе к середине живота.
Наличие боли в поясничной области, возможная иррадиация в правую ногу,
промежность, наружные половые органы при отсутствии патологических изменений в
почке и мочеточнике могут указывать на расположение воспаленного отростка позади
слепой кишки. Боль в правом подреберье характерна для подпеченочной локализации
отростка. Боль в левом нижнем квадранте живота отмечается очень редко и может
возникать при левостороннем расположении слепой кишки и отростка.
Хотя локальная боль в правом нижнем
квадранте живота наблюдается более чем у 90% больных, эпигастральная фаза
начала болезни встречается только у 70%, а симптом перемещения боли сверху вниз
и вправо - лишь у 50% пациентов.
Боль в животе при остром аппендиците,
как правило, умеренная, терпимая. При растяжении червеобразного отростка гноем
(эмпиема) она достигает большой интенсивности, становится невыносимой,
пульсирующей, дергающей. Гангрена отростка сопровождается гибелью его нервных
окончаний, что объясняет короткий период мнимого улучшения состояния за счет
исчезновения самостоятельной боли в животе. Перфорация отростка характеризуется
резким внезапным усилением боли с постепенным ее распространением на другие
отделы живота.
В типичных случаях боль при остром
аппендиците не иррадиирует, за исключением тех наблюдений, когда отросток тесно
предлежит к другим внутренним органам (желчный пузырь, прямая кишка,
мочеточник, мочевой пузырь). Вовлечение в воспалительный процесс стенок этих
органов при атипической локализации воспаленного отростка обусловливает
характерную для этих органов отраженную боль.
Через несколько часов после начала
"абдоминального дискомфорта" у большинства больных (80%) появляется
тошнота, сопровождающаяся одно или двукратной рвотой (наблюдается у 60%
больных, чаще у детей). Тошнота и рвота у больных аппендицитом возникают уже на
фоне боли в животе. Появление рвоты до развития болевого синдрома делает
диагноз острого аппендицита маловероятным.
Как правило, у большинства больных
(90%) наблюдается анорексия. В случае, если аппетит сохраняется, диагноз
воспаления червеобразного отростка проблематичен.
Важным и постоянным признаком острого
аппендицита является задержка стула (30-40%), обусловленная парезом кишечника
вследствие распространения воспалительного процесса по брюшине. В редких
случаях (12-15%) больные отмечают жидкий одно либо двукратный стул или тенезмы.
Эти расстройства чаще проявляются при медиальном (воспаленный аппендикс
раздражает брыжейку тонкой кишки и вызывает усиленную перистальтику) и тазовом
(ирритация сигмовидной или прямой кишки) положениях червеобразного отростка.
У 50% больных в течение первых суток
заболевания отмечают повышение температуры тела до субфебрильных значений
(37,2-37,6°С). Важно отдавать себе отчет в том, что в начальной стадии заболевания
лихорадка у больных не развивается. Высокая температура (более 38°С), особенно
в первые сутки, указывает или на развитие осложнений аппендицита, или на
другое, чаще инфекционное заболевание.
Считают, что для острого аппендицита
свойственна определенная последовательность в появлении симптомов:
1) боль в эпигастрии или околопупочной
области;
2) анорексия, тошнота, рвота;
3) локальная болезненность и защитное
напряжение мышц при пальпации живота в правой подвздошной области;
4) повышение температуры тела;
5) лейкоцитоз.
У больных пожилого и старческого
возраста эту последовательность симптомов наблюдают лишь в 25% случаев, а у
детей старше 6 лет - в 60%.
Объективное исследование. Клиническая картина острого
аппендицита весьма изменчива. Он может симулировать многие заболевания органов
брюшной полости, и наоборот, поражения других органов и систем могут протекать
с клиническими признаками, напоминающими острый аппендицит.
Для аппендицита характерно
постепенное, прогрессивное нарастание клинических признаков болезни в
противоположность другим заболеваниям, при которых симптомы могут то исчезать,
то появляться вновь. Поэтому в высшей степени важно в сомнительных случаях
некоторое время наблюдать за больным, неоднократно обследовать его, чтобы
убедиться в нарастании некоторых характерных симптомов.
Обследование необходимо начинать в
положении пациента лежа на спине. Не следует сразу начинать с осмотра живота.
Обратите внимание на лицо больного, частоту дыхания, пульса, величину
артериального давления.
После оценки состояния систем органов
дыхания и кровообращения обнажите живот: вверх - до сосков и вниз - до верхней
трети бедер. Не следует начинать пальпацию брюшной стенки до тщательного
визуального наблюдения за животом, так как зрительные впечатления о наличии или
отсутствии изменений часто бывают более точны, чем пальпаторные.
Аппендицит часто протекает как
болезнь "здорового человека", поэтому в течение первых часов с начала
заболевания вы можете не обнаружить его внешних проявлений. Если приступ
постоянной боли в животе, вопреки ожиданиям больного, затягивается, не
купируется самостоятельно, возникает повторная рвота, на его лице может
появиться испуг и страдальческое выражение. При осложненном течении аппендицита
оно становится бледным, осунувшимся.
Резкая боль, усиливающаяся при
движениях и ходьбе, вынуждает пациентов лечь в постель и занять положение на
спине. При этом они стараются лежать неподвижно, поскольку поворот тела,
попытка лечь или встать без помощи рук усиливает боль в животе.
Особенно характерно появление или
усиление боли в правом нижнем квадранте живота при повороте на левый бок
(симптом Ситковского). В положении на правом боку боль уменьшается, поэтому
некоторые больные принимают это положение с приведенными к животу ногами.
Почти у 30-40% больных частота пульса
соответствует норме. Тахикардию до 1 0 0 ударов в 1 мин обнаруживают в более
поздней стадии у 50% больных. Пульс свыше 100, как правило, свидетельствует о
наличии осложнений. Частота пульса обычно соответствует уровню температуры тела.
Так, у 50% больных она меньше 37°С. Обнаружение несоответствия между пульсом,
температурой и количеством лейкоцитов у больных острым аппендицитом при
динамическом контроле за величиной этих показателей каждые 3 ч считают плохим
прогностическим признаком, указывающим на развитие синдрома системной реакции
на воспаление, свидетельствующим о тяжести процесса и возможном развитии
диффузного перитонита.
При неосложненных формах аппендицита
язык влажный, покрыт белым налетом. Сухие слизистые оболочки внутренней
поверхности щеки и языка указывают на выраженную дегидратацию, наблюдаемую по
мере развития перитонита. Описано большое число признаков острого аппендицита.
Не все они имеют одинаковую диагностическую значимость, основные из них
приведены далее.
При осмотре живота находят, что
конфигурация его, как правило, не изменена, но иногда отмечают некоторое
вздутие в нижних отделах, вызванное умеренным парезом слепой и подвздошной
кишки. Реже наблюдают асимметрию живота, обусловленную защитным напряжением
мышц в правом нижнем квадранте.
При деструктивном аппендиците часто
обнаруживают некоторое отставание в акте дыхания правой половины живота,
особенно в нижних отделах. При перфоративном аппендиците почти вся брюшная
стенка напряжена, не участвует в акте дыхания в связи с возникшим перитонитом.
При перкуссии живота у многих больных
удается определить умеренный тимпанит над правой подвздошной областью, часто
распространяющийся на весь гипогастрий. У 60% больных сотрясение воспаленной
брюшины при перкуссии в правом нижнем квадранте живота вызывает резкую
болезненность (симптом Раздольского), в большинстве случаев соответствующую
локализации источника воспаления.
Пальпация живота позволяет обнаружить
два наиболее важных симптома острого аппендицита - локальную болезненность и
напряжение мышц брюшной стенки в правой подвздошной области. Поверхностную
пальпацию следует начинать в левой подвздошной области, последовательно проводя
по всем отделам (против часовой стрелки), и заканчивать в правой подвздошной.
"Ключом" к диагнозу острого
аппендицита, "симптомом, спасшим жизни миллионам больных", является
защитное напряжение мышц брюшной стенки. Необходимо различать степень
напряжения мышц брюшной стенки: от небольшой резистентности до ярко выраженного
напряжения и, наконец, "доскообразный живот".
Симптом защитного напряжения мышц
живота возникает рефлекторно (висцеромоторный рефлекс) в результате раздражения
париетальной брюшины воспалительным процессом. Его местоположение соответствует
локализации воспаленного отростка. В случае типичного расположения аппендикса
симптом локальной мышечной защиты выявляют только в правой подвздошной области.
Более обширная зона мышечного напряжения свидетельствует о распространении
воспаления по брюшине, т. е. о диффузном перитоните. Напряжение мышц брюшной
стенки может отсутствовать у лиц с выраженной жировой клетчаткой, многорожавших
женщин, престарелых людей, пациентов, находящихся в состоянии алкогольного
опьянения.
Скольжение рукой по брюшной стенке
через рубашку в направлении от эпигастрия к лонной области позволяет обнаружить
(в 60-70%) зону кожной гипертензии (болезненности) в правой подвздошной области
(симптом Воскресенского).
Для определения болевых симптомов
проводят глубокую пальпацию живота. Ее начинают, так же как и поверхностную, с левой
стороны вдали от места проецируемой боли. Одним из наиболее информативных
признаков является симптом Щеткина-Блюмберга (медленное глубокое надавливание
на брюшную стенку всеми сложенными вместе пальцами кисти не влияет на
самочувствие пациента, тогда как в момент быстрого отнятия руки больной
отмечает появление или резкое усиление боли). При остром аппендиците симптом
Щеткина-Блюмберга положителен в той части брюшной стенки, которая ближе всего
располагается к червеобразному отростку. Симптом обусловлен сотрясением
воспаленной брюшины и не является специфическим. Нередко (40%) обнаруживают
появление или усиление боли в правой подвздошной области при резком, отрывистом
кашле (симптом Кушниренко).
Сотрясение внутренних органов
происходит и при симптоме Ровсинга: надавливание левой рукой на брюшную стенку
в левой подвздошной области соответственно расположению нисходящей части
ободочной кишки, а правой - на ее вышележащую часть (толчкообразно) вызывает
появление или усиление боли в правой подвздошной области.
При повороте больного на левый бок
червеобразный отросток становится более доступным для пальпации вследствие
смещения влево большого сальника и петель тонкой кишки. При пальпации в этом
положении в правой подвздошной области отмечают появление или усиление
болезненности (положительный симптом Бартомье).
Если в положении больного на левом
боку кистью правой руки медленно сместить петли кишечника снизу вверх и слева
направо, а затем во время выдоха резко убрать руку, внутренние органы под
влиянием силы тяжести смещаются в исходное положение. Это приводит не только к
сотрясению внутренних органов и воспаленной брюшины, но и к натяжению брыжейки
отростка, что провоцирует при остром аппендиците резкую боль в правой
подвздошной области.
Если воспаленный отросток предлежит к
правой подвздошнопоясничной мышце (m. ilcopsoas), TO
пальпация правой подвздошной области в момент подъема больным выпрямленной в
коленном суставе правой ноги будет вызывать резкую болезненность (симптом
Образцова).
Сопоставляя данные перкуссии брюшной
стенки, поверхностной и глубокой пальпации живота, можно выявить область
максимальной выраженности симптомов раздражения брюшины, т. е. область наиболее
выраженного развития воспалительного процесса. При неосложненном остром
аппендиците она чаще всего проецируется в площадь треугольника, углы которого
соответствуют пупку, правой передневерхней ости подвздошной кости и правому
лонному бугорку. При осторожном обследовании больного в типичном случае можно
определить наиболее болезненную точку. Обычно она располагается на границе
между средней и наружной третями линии, соединяющей пупок и правую
передневерхнюю ость (точка МакБернея) или на границе между средней и правой
третью линии, соединяющей 2 передневерхние ости подвздошных костей (точка Ланца).
Физикальное обследование следует
завершить ректальным исследованием. При расположении воспаленного отростка на
дне пузырнопрямокишечного (маточнопрямокишечного) углубления можно установить
резкую болезненность правой и передней стенок кишки, что часто позволяет
поставить окончательный диагноз.
При клиническом обследовании больных
с подозрением на наличие острого аппендицита следует считать обязательным
проведение лабораторных и инструментальных исследований.
Изменения в крови не являются
специфическими, однако они позволяют верифицировать острый воспалительный
процесс и в сочетании с другими признаками подтвердить диагноз. Чаще всего (90%)
обнаруживают лейкоцитоз более 10 109/л, у 75% больных лейкоцитоз
достигает значения 12 • 109/л и более. Кроме того, у 90% больных
лейкоцитоз сопровождается сдвигом лейкоцитарной формулы влево, при этом у 2/з
больных обнаруживают более 75% нейтрофилов. Однако у 10% больных
количество лейкоцитов остается нормальным, а у ВИЧинфицированных может
выявляться лейкопения.
В анализе мочи у 25% больных
обнаруживают незначительное количество эритроцитов и лейкоцитов, что
обусловлено распространением воспаления на стенку мочеточника (при
ретроцекальном ретроперитонеальном расположении отростка) или мочевого пузыря
(при тазовом аппендиците).
В ряде случаев целесообразно
прибегать к лучевым методам диагностики (обзорная рентгеноскопия органов
грудной клетки и брюшной полости, УЗИ, компьютерная томография).
При обзорной рентгеноскопии органов
брюшной полости у 80% больных можно выявить один или несколько косвенных
признаков острого аппендицита: уровень жидкости в слепой кишке и терминальном
отделе подвздошной кишки (симптом "сторожащей петли"), пневматоз
подвздошной и правой половины ободочной кишки, деформация медиального контура
слепой кишки, нечеткость контура m. ileopsoas. Значительно реже выявляют рентгенопозитивную тень калового
камня в проекции червеобразного отростка. При перфорации аппендикса иногда
обнаруживают газ в свободной брюшной полости.
При наличии стертой клинической картины
заболевания, невозможности с уверенностью установить или опровергнуть диагноз
острого аппендицита, прежде всего у женщин детородного возраста, у пожилых
людей и стариков, у детей, показаны УЗИ и/или лапароскопия.
При остром аппендиците воспаленный
отросток идентифицируют по данным УЗИ более чем у 90% больных. Его прямыми
отличительными признаками являются увеличение диаметра червеобразного отростка
до 8- 10 мм и более (в норме 4-6 мм), утолщение стенок до 4-6 мм и более (в
норме 2 мм), что в поперечном сечении дает характерный симптом
"мишени" ("кокарды"). Косвенными признаками острого
аппендицита считают ригидность отростка, изменение его формы (крючковидная,
Sобразная), наличие конкрементов в его полости, нарушение слоистости его стенки,
инфильтрация брыжейки, обнаружение скопления жидкости в брюшной полости.
Точность метода в руках опытного специалиста достигает 95%.
Лапароскопические признаки острого
аппендицита можно также разделить на прямые и косвенные. К прямым признакам
относят видимые изменения отростка, ригидность стенок, гиперемию висцеральной
брюшины, мелкоточечные кровоизлияния на серозном покрове отростка, наложения
фибрина, инфильтрация брыжейки. Непрямые признаки - наличие мутного выпота в
брюшной полости (чаще всего в правой подвздошной ямке и малом тазу), гиперемия
париетальной брюшины в правой подвздошной области, гиперемия и инфильтрация
стенки слепой кишки.
Специфических признаков катарального
аппендицита, позволяющих отличить его при лапароскопии от вторичных изменений
отростка (на фоне пельвиоперитонита, аднексита, мезаденита, тифлита), не
существует.
При флегмонозном аппендиците отросток
утолщен, напряжен, серозная оболочка гиперемирована, имеет геморрагии, налеты
фибрина. Брыжейка инфильтрирована, гиперемирована. В правой подвздошной области
может быть виден мутный выпот.
При гангренозном аппендиците отросток
резко утолщен, зеленоваточерного цвета, неравномерно окрашен, на его серозной
оболочке видны множественные очаговые или сливные кровоизлияния, наложения
фибрина, брыжейка резко инфильтрирована. В правой подвздошной области часто
виден мутный серознофибринозный выпот. Считают, что диагностическая точность
лапароскопии при остром аппендиците составляет 95-98%.
К компьютерной томографии прибегают
при осложненном аппендиците с целью дифференциальной диагностики
аппендикулярного инфильтрата и опухоли слепой кишки, а также для поиска
отграниченных скоплений гноя (абсцессов).
79.
Острый аппендицит. Особенности клиники в зависимости от варианта положения
червеобразного отростка. Диагностика. Дифференциальный диагноз. Показания и
противопоказания к аппендэктомии. Доступы. Анестезия.
Атипичные формы острого аппендицита
Подобные проявления заболевания
встречаются у 20-30% больных. Атипизм клинической картины объясняют
многообразием вариантов расположения червеобразного отростка в животе, а также
возрастными и физиологическими вариантами индивидуальной реактивности
организма, наличием или отсутствием признаков системной реакции организма на
воспаление (табл. 22.1).
Самым частым вариантом атипических
форм является ретроцекальный аппендицит (50-60%). В этом случае отросток может
тесно предлежать к правой почке, мочеточнику, поясничным мышцам. Заболевание
начинается обычно с боли в эпигастрии или в правой половине живота. Если
происходит ее миграция, то она локализуется в правой боковой или поясничной
области. Боль постоянная малоинтенсивная, как правило, усиливается при ходьбе и
движении в правом тазобедренном суставе. Развивающаяся контрактура правой
подвздошнопоясничной мышцы может приводить к хромоте на правую ногу. Тошнота и
рвота бывают реже, чем при типичном расположении отростка, но раздражение
купола слепой кишки обусловливает возникновение 2-3кратного жидкого и
кашицеобразного стула. Ирритация почки или стенки мочеточника приводит к возникновению
дизурии. При объективном исследовании отмечают отсутствие ключевого симптома -
повышения тонуса мышц передней брюшной стенки, но выявляют ригидность
поясничных мышц справа. Зона максимальной болезненности локализуется около
гребня подвздошной кости или в правой боковой области живота. Симптом
Щеткина-Блюмберга на передней брюшной стенке сомнителен, его можно вызвать лишь
в области правого поясничного треугольника (Пти). Характерными для
ретроцекального аппендицита являются симптом Образцова и болезненность при
перкуссии и пальпации поясничной области справа. При исследовании лабораторных
данных следует обратить внимание на анализ мочи, где обнаруживают лейкоциты,
свежие и выщелоченные эритроциты.
Близость забрюшинной клетчатки,
плохое опорожнение отростка вследствие изгибов и деформаций, обусловленных
короткой брыжейкой, а значит, и худшие условия кровоснабжения вместе со скудной
атипической клинической картиной предопределяют склонность к развитию
осложненных форм аппендицита.
Низкое или тазовое расположение
отростка встречается в 15-20% атипических форм, причем у женщин в 2 раза чаще,
чем у мужчин. Отросток может располагаться или над входом в малый таз, или на
дне прямокишечнопузырного (маточного) углубления, непосредственно в полости
малого таза. В этих условиях боль часто начинается по всему животу, а затем
локализуется в первом случае - в лонной области, реже - в левой паховой; во
втором - над лоном либо в правой подвздошной области, непосредственно над
паховой складкой.
Близость воспаленного отростка к
прямой кишке и мочевому пузырю нередко вызывает императивный, частый, жидкий
стул со слизью (тенезмы), а также учащенное болезненное мочеиспускание
(дизурию). Живот при осмотре правильной формы, участвует в акте дыхания.
Сложность диагностики в том, что напряжение мышц живота и симптом
Щеткина-Блюмберга могут отсутствовать. Диагноз уточняется при ректальном
исследовании, поскольку уже в первые часы обнаруживают резкую болезненность
передней и правой стенок прямой кишки (симптом Куленкампффа). У детей может
одновременно появляться отек и инфильтрация ее стенок.
В связи с частым ранним отграничением
воспалительнго процесса температурная и лейкоцитарная реакции при тазовом
аппендиците выражены слабее, чем при типичной локализации отростка.
Медиальное расположение отростка
встречается у 8-10% больных с атипичными формами аппендицита. При этом отросток
смещен к средней линии и располагается близко к корню брыжейки тонкой кишки.
Именно поэтому аппендицит при срединном расположении органа характеризуется бурным
развитием клинических симптомов.
Боль в животе вначале носит разлитой
характер, но затем локализуется в области пупка или правом нижнем квадранте
живота, сопровождаясь многократной рвотой и высокой лихорадкой. Локальная
болезненность, напряжение мышц живота и симптом Щеткина-Блюмберга наиболее ярко
выражены около пупка и справа от него. Вследствие рефлекторного раздражения
корня брыжейки рано возникает и быстро нарастает вздутие живота изза пареза
кишечника. На фоне увеличивающейся дегидратации появляется лихорадка.
При подпеченочном варианте острого
аппендицита (2-5% атипичных форм) боль, первоначально появившаяся в подложечной
области, перемещается затем в правое подреберье, обычно локализуясь латеральнее
проекции желчного пузыря - по переднеподмышечной линии. Пальпация этой области
позволяет установить напряжение широких мышц живота, симптомы раздражения
брюшины, иррадиацию боли в подложечную область. Симптомы Ситковского,
Раздольского, Ровсинга бывают положительными. Верифицировать высокое расположение
купола слепой кишки можно при обзорной рентгеноскопии органов брюшной полости.
Полезную информацию может дать УЗ И.
Левосторонний острый аппендицит
наблюдают крайне редко. Эта форма обусловлена обратным расположением внутренних
органов или избыточной подвижностью правой половины ободочной кишки.
Клинические проявления заболевания отличаются только локализацией всех местных
признаков аппендицита в левой подвздошной области. Диагностика заболевания
облегчается, если врач обнаруживает декстракардию и расположение печени в левом
подреберье.
На догоспитальном этапе запрещается:
применять местное тепло /грелки/ на область живота, вводить наркотики и другие
болеутоляющие средства, давать больным слабительное и применять клизмы.
Постановка диагноза острого аппендицита
является показанием к проведению экстренного оперативного лечения. При
отсутствии явлений разлитого перитонита используется доступ Макбурнея
(McBurney), иногда называемый в отечественной литературе доступом
ВолковичаДьяконова. Основной этап операции при остром аппендиците -
аппендэктомия (удаление червеобразного отростка). Аппендэктомия технически
может быть проведена одним из двух способов:
типичная аппендэктомия (используется
всегда, когда червеобразный отросток можно полностью вывести в операционную
рану) - после перевязки брыжейки червеобразного отростка отросток отсекается,
его культя погружается в купол слепой кишки кисетным и Zобразным швами;
ретроградная аппендэктомия
(используется в случае невозможности выведения червеобразного отростка в рану по
причине наличия спаечного процесса между отростком и другими органами брюшной
полости или при некоторых видах атипичного расположения отростка) -
червеобразный отросток отсекается от купола слепой кишки, его культя
погружается в купол, а затем производится поэтапное выделение отростка и
перевязка его брыжейки.
В настоящее время все большее
распространение получает лапароскопическая аппендэктомия - удаление аппендикса
через небольшие проколы брюшной стенки с помощью специальных инструментов. В
большинстве таких операций число проколов достигает трех. Первый прокол
осуществляется в одном сантиметре над пупком, второй в четырех сантиметрах под
пупком, расположение третьего прокола непосредственно зависит от расположения
аппендикса.
В последние годы все больше и больше
начинает вживляться в современную медицину малоинвазивные операционные
вмешательства, к которым можно отнести и транслюминальную хирургию
(эндохирургические вмешательства, где гибкие инструменты вводятся в просвет
полого органа сквозь естественные отверстия человеческого тела и через разрез в
стенке внутреннего органа подводятся непосредственно к оперируемому объекту)
При транслюминальной апендэктомии
может быть выбрано два доступа:
трансгастральная аппендэктомия
(инструменты вводят через крошечное отверстие в стенке желудка);
трансвагинальная аппендэктомия
(инструменты вводят через небольшой разрез во влагалище).
Преимущество таких операций:
полное отсутствие косметических
дефектов;
относительно быстрое выздоровление, сокращение сроков
послеоперационной реабилитации.
80. Острый аппендицит у беременных, детей
и стариков. Перитонит как осложнение острого аппендицита. Особенности
оперативного вмешательства в зависимости от распространенности перитонита.
Подготовка к операции и ведение послеоперационного периода
Острый аппендицит у детей имеет
клинические особенности в младшей возрастной группе (до 3 лет). Незаконченное
созревание иммунной системы и недоразвитие большого сальника (он не достигает
аппендикса) способствуют быстрому развитию деструктивных изменений в
червеобразном отростке, снижают возможность отграничения воспалительного
процесса и создают условия для более частого развития осложнений заболевания.
Отличительным признаком развития
болезни является преобладание общих симптомов над местными. Клиническим
эквивалентом боли у детей младшего возраста считают изменение их поведения и
отказ от приема пищи. Первым объективным симптомом часто бывает лихорадка
(39-39,5°С) и многократная рвота (у 45-50%). У 30% детей отмечают частый
жидкий стул, который вместе со рвотой приводит к развитию ранней дегидратации.
При осмотре обращают внимание на
сухость слизистых оболочек полости рта и тахикардию свыше 100 ударов в 1 мин.
Осмотр живота целесообразно проводить в состоянии медикаментозного сна. С этой
целью ректально вводят 2% раствор хлоргидрата из расчета 10 мл/год жизни
больного. Осмотр во сне позволяет выявить провоцируемую боль, проявляющуюся
сгибанием правой ноги в тазобедренном суставе и попыткой оттолкнуть руку
хирурга (симптом "правой ручки и правой ножки"). Кроме того,
обнаруживают мышечное напряжение, которое во время сна удается дифференцировать
от активной мышечной защиты. Ту же реакцию, что и пальпация живота, вызывает и
перкуссия передней брюшной стенки, проводимая слева направо. В крови у детей до
3 лет обнаруживают выраженный лейкоцитоз (15-18 • 109/л) с
нейтрофильным сдвигом.
У больных пожилого и старческого
возраста (около 10% всех пациентов с острым аппендицитом) пониженная
реактивность организма, склероз всех слоев стенки отростка, а также кровеносных
сосудов, питающих аппендикс, предопределяют, с одной стороны, стертость
клинических проявлений острого аппендицита, с другой - преобладание
деструктивных форм.
Физиологическое повышение порога
болевой чувствительности приводит к тому, что многие пациенты упускают из виду
возникновение эпигастральной фазы болей и связывают начало болезни с болью в
правой подвздошной области, интенсивность которой варьирует от сильной до
незначительной. Тошнота и рвота возникают реже, чем у людей зрелого возраста.
Задержку стула, характерную для аппендицита, больные часто объясняют привычным
запором.
При обследовании следует обратить
внимание на выраженное общее недомогание, сухость слизистых оболочек полости
рта на фоне вздутия живота, обусловленного парезом кишечника. Хотя вследствие
возрастной релаксации брюшной стенки мышечное напряжение над очагом поражения
выражено незначительно, кардинальный симптом - локальную болезненность при
пальпации и перкуссии над местом расположения червеобразного отростка - обычно
выявляют. Часто симптомы Щеткина-Блюмберга, Воскресенского, Ситковского,
Ровсинга выражены нечетко, имеют стертую форму. Температура тела даже при
деструктивном аппендиците остается нормальной или повышается до субфебрильных
значений. Количество лейкоцитов также нормально или повышено до 8-12* 109/л,
нейтрофильный сдвиг не выражен. У стариков чаще, чем у лиц среднего возраста,
возникает аппендикулярный инфильтрат, характеризующийся медленным вялотекущим
течением. Отсутствие указаний на острый приступ боли в животе, первое обращение
к врачу в фазу плотного инфильтрата в правой подвздошной области заставляют
врача проводить дифференциальный диагноз между аппендикулярным инфильтратом и
раком слепой кишки.
Проявления симптомов острого живота у
беременных редуцированы вследствие гормональных, метаболических и
физиологических изменений, связанных с беременностью, которые меняют облик
болезни и сохраняются в течение всего периода вынашивания плода. Основное
значение в развитии изменений клиники острого аппендицита имеют прогрессирующая
рела сация мышц передней брюшной стенки и смещение внутренних органов:
аппендикс и слепая кишка смещаются краниально, брюшная стенка поднимается и
отодвигается от отростка, большой сальник после перемещения вверх не может
окутать отросток (рис. 22.2). Кроме того, для беременных характерны
физиологический лейкоцитоз, анемия, увеличение концентрации в крови щелочной
фосфатазы и амилазы (плацентарных), снижение воспалительного ответа, частые
гастроинтестинальные жалобы (изза высокого уровня половых стероидов). Наиболее
яркие отличия от типичного течения острого аппендицита возникают во второй
половине беременности. Заболевание начинается внезапной резкой болью в животе,
которая приобретает постоянный ноющий характер и перемещается в место локализации
отростка (правый боковой отдел живота, правое подреберье). Нередко появляющиеся
тошнота и рвота не имеют диагностического значения, так как присущи беременным.
У 35- 40% больных выявляют тахикардию свыше 100 ударов в 1 мин, у 20% -
температура тела достигает 38°С и выше. Только у половины беременных при
аппендиците определяют незначительное напряжение мышц передней брюшной стенки,
другие симптомы раздражения брюшины могут также отсутствовать. При обследовании
обращают внимание на усиление боли в животе при повороте тела с левого бока на
правый (симптом Тараненко), сохранение местоположения участка максимально
выраженной боли и болезненности при повороте справа налево (симптом Alder). Необходимо отметить, что у 60%
больных лейкоцитоз свыше 15 • 109/л. Для визуализации отростка
следует чаще применять УЗИ. В среднем диагностический период у беременных от
начала боли в животе до установления диагноза длится до 60 ч. Указанные
объективные (анатомофизиологические) и субъективные факторы создают условия для
запоздалой диагностики и развития осложненных форм аппендицита, что может
привести к прерыванию беременности и гибели плода. Поскольку перитонит, а не
аппендэктомия определяет риск летального исхода у матери и фетальной
смертности, то именно ранняя операция у беременной женщины спасает две жизни
при обоснованном подозрении на аппендицит.
81. Осложнения острого аппендицита.
Классификация. Аппендикулярный инфильтрат. Причины возникновения. Клиника.
Диагностика. Дифференциальный диагноз. Исходы. Консервативное лечение
К осложнениям острого аппендицита
относят аппендикулярный инфильтрат, локальные скопления гноя (абсцессы) в
брюшной полости (тазовый, межкишечный, поддиафрагмальный), распространенный
перитонит и пилефлебит - септический тромбофлебит воротной вены и ее ветвей.
Аппендикулярный инфильтрат - это
конгломерат спаянных между собой органов, располагающихся вокруг воспаленного
червеобразного отростка, отграничивающих его от свободной брюшной полости.
Инфильтрат осложняет течение аппендицита в 3 - 5% случаев и развивается спустя
3-5 дней от начала заболевания. Интенсивность боли в животе при этом снижается,
в покое она почти полностью исчезает или меняет характер, становясь тупой,
нечетко локализованной, несколько усиливаясь лишь при ходьбе. Температура тела
нормализуется или снижается до субфебрильной.
На фоне убывающей клинической
симптоматики в брюшной полости начинает прощупываться различных размеров
воспалительный инфильтрат. Сначала пальпируемое образование имеет нечеткие
контуры, болезненно. Затем боль исчезает, а контуры "опухоли"
приобретают четкую форму, сам инфильтрат становится плотным. Если инфильтрат
предлежит к париетальной брюшине (правая подвздошная область, малый таз), то он
практически не смещается при пальпации. Над инфильтратом тонус мышц брюшной
стенки незначительно повышен; в стороне от него - живот мягкий, безболезненный.
Симптомы раздражения отсутствуют, лейкоцитоз, как правило, умеренный с
незначительным нейтрофильным сдвигом.
Исходом аппендикулярного инфильтрата
может быть либо его полное рассасывание, либо абсцедирование. В типичных
случаях воспалительная "опухоль" рассасывается за 1,5-2,5 нед. По
мере рассасывания инфильтрата исчезают боль в животе и болезненность при
пальпации. Температура тела и картина крови становятся нормальными.
Вследствие нагноения инфильтрата
возобновляются боль в животе и болезненность при пальпации. Повышается
температура тела, принимающая гектический характер, бывают озноб и тахикардия.
Объективно - границы инфильтрата расширяются, становятся нечеткими, пальпация
образования резко болезненна. Если инфильтрат предлежит к брюшной стенке, то
иногда удается выявить его размягчение и флюктуацию. Как правило, в этой фазе
процесса над инфильтратом определяют симптомы раздражения брюшины.
Абсцессы могут образовываться не
только вокруг червеобразного отростка, но и в других местах брюшной полости
вследствие осумковывания инфицированного выпота, внутрибрюшных гематом или
несостоятельности швов культи аппендикса. В связи с этим возникают тазовый,
межкишечный и поддиафрагмальный абсцессы. Для поиска гнойников целесообразно
использовать УЗИ и компьютерную томографию. Тазовый абсцесс можно выявить при
ректальном (вагинальном) исследовании.
Распространенный гнойный перитонит осложняет течение
острого аппендицита у 1% больных, однако при перфоративном аппендиците
его наблюдают у 8-10% пациентов. Перитонит является основной причиной смерти
больных при остром аппендиците
Самым редким и наиболее тяжелым
осложнением острого аппендицита является пилефлебит - септический тромбофлебит
воротной вены и ее ветвей. Пилефлебит развивается, как правило, после
аппендэктомии. В этом случае с первого дня после операции нарастает тяжесть
состояния, появляются гектическая лихорадка, резкое вздутие живота, равномерная
болезненность в его правой половине без выраженных симптомов раздражения
брюшины. При переходе воспалительного процесса на печеночные вены возникают
желтуха, гепатомегалия, прогрессирует печеночнопочечная недостаточность,
которая приводит к смерти больного. При относительно медленном развитии
тромбофлебита необходимо резецировать всю брыжейку гангренозноизмененного
отростка с тромбированными венами.
82. Аппендикулярный абсцесс.
Классификация. Клиника. Диагностика. Дифференциальный диагноз. Методы
оперативных вмешательств в зависимости от локализации абсцесса
Аппендикулярный абсцесс - осложнение острого
аппендицита, отграниченный перитонит (гнойник, содержащий червеобразный
отросток. Стенками его могут быть большой сальник, петли кишечника и другие
органы), располагается в полости брюшины или забрюшинной клетчатке (правая
подвздошная область, малый таз, поддиафрагмальное пространство, ретроцекальное
пространство).
Частота - 14-19% случаев аппендикулярного инфильтрата.
Преобладающий пол - женский, т.к. женщины болевой синдром часто связывают с
заболеваниями внутренних половых органов и своевременно не обращаются к
хирургу.
Этиология и патогенез Абсцедирование аппендикулярного
инфильтрата (ошибки в диагностике, неполноценное лечение, позднее обращение к
врачу) В случае прогрессирования может происходить прорыв гнойника в брюшную
полость с развитием перитонита, в забрюшинное пространство (с образованием
забрюшинной флегмоны) или в полые органы (чаще в просвет кишки).
Клиническая картина
Начало заболевания - типичный приступ острого аппендицита.
При наличии признаков острого аппендицита в течение
2-3 сут следует предполагать образование аппендикулярного инфильтрата, в
течение 5-6 сут - его абсцедирование и развитие аппендикулярного абсцесса.
Пальпация - болезненное неподвижное опухолевидное
образование в правой подвздошной области, нижний его полюс может определяться
при вагинальном или ректальном исследовании.
Клинические признаки распространённого перитонита
отсутствуют.
Проводимое лечение аппендикулярного инфильтрата
неэффективно Повышение температуры тела до 39-40 °С с ознобами Увеличение
инфильтрата в размерах (приближается к передней брюшной стенке), усиление
болезненности при пальпации Нарастание интенсивности пульсирующей боли
Появление признаков раздражения брюшины Увеличение разницы между температурой
тела, измеренной в подмышечной впадине и прямой кишке Гиперемия кожи и
флюктуация - поздние признаки.
В некоторых случаях - явления непроходимости
кишечника, разлитого перитонита.
Лабораторные исследования Постепенно нарастающий
лейкоцитоз с ядерным сдвигом влево Значительное (до 30-40 мм/ч) увеличение СОЭ.
Специальные методы исследования Ректальное или
вагинальное исследование - выраженная болезненность, иногда можно
пропальпировать нижний полюс образования Обзорная рентгенография органов
брюшной полости - уровень жидкости в правой половине брюшной полости УЗИ
позволяет установить размер абсцесса и его точную локализацию.
Лечение - оперативное: вскрытие и дренирование полости
абсцесса Обезболивание - общее, при пункционном дренирование под УЗИ - местное
Доступ определяется локализацией абсцесса Типичен доступ по Пирогову -
правосторонний боковой внебрюшинный При тазовой локализации - доступ через
прямую кишку или задний свод влагалища Чрескожное дренирование под контролем
УЗИ или компьютерной томографии (КТ) Удаление червеобразного отростка не
является целью операции, но при возможности - предпочтительно Полость абсцесса
промывают антисептиками В качестве дренажей используют двухпросветные трубки
для промывания и активной аспирации содержимого в послеоперационном периоде В
послеоперационном периоде - дезинтоксикационная и антибактериальная терапия
83. Карциноид червеобразного отростка.
Кариинондный синдром. Пилефлебит. Определение. Клиника. Диагностика. Лечение
Опухоли, как правило, обнаруживают
при аппендэктомии по поводу острого аппендицита, когда они провоцируют окклюзию
отростка. Опухоли встречаются у 40 больных на 5000 операций (0,8% наблюдений).
Чаще всего (90%) обнаруживают карциноидную опухоль. Это медленно растущее новообразование
из энтерохромаффинных клеток, продуцирующих серотонин, гистамин,
вазоинтестинальный пептид, брадикинин и другие вазоактивные пептиды. Считают,
что рост карциноидных опухолей провоцирует гипергастринемия, обусловленная
стойким повышением рН в слизистой оболочке антрального отдела желудка на фоне
атрофического гастрита.
У большинства больных (60-70%) карциноидная
опухоль имеет размеры менее 2 см и не прорастает серозную оболочку (стадия А и Duce). Прорастание всех слоев стенки
отростка наблюдают у 25% больных (стадия В). При этом увеличивается вероятность
метастазов в регионарные лимфатические узлы (стадия С) - 5-10% наблюдений. У
3-5% обнаруживают метастазы опухоли в печень (стадия D). В этом случае заболевание проявляется карциноидным
синдромом. Он не проявляется приливами крови с окрашиванием лица и шеи в
краснофиолетовый цвет. В ряде случаев наблюдают слезотечение, периорбитальный
отек, тахикардию, гипотонию, вздутие живота, понос, бронхоспазм. При
карциноидном синдроме развивается фиброз эндокарда с медленным
прогрессированием клинической картины трикуспидальной недостаточности и/или
стеноза устья легочной артерии.
Предположить диагноз карциноида до
операции можно на основании характерной клинической картины приливов,
увеличения суточной экскреции 5оксииндолилуксусной кислоты (5ОИУК) с мочой до
200-300 мг/сут (в норме 5-9 мг/сут), повышения в крови уровня серотонина.
Топическая верификация диагноза сложна, поскольку карциноид может развиваться
во всех органах, образовавшихся из эмбриональных зачатков головной кишки
(бронхи, желудок, поджелудочная железа, тонкая кишка), а также в тератомах
яичника и яичка. Однако чаще всего (55%) карциноид обнаруживают именно в
аппендиксе. Эти больные нуждаются в тщательном обследовании (УЗИ, КТ,
радиологическое исследование с "октреотидом" - синтетическим аналогом
соматостатина, меченным радиоактивным изотопом Тс).
Лечение. На стадии А (нет инвазии в слепую
кишку и брыжейку) может быть выполнена аппендэктомия, на стадиях В и С показана
правосторонняя гемиколэктомия. Результаты лечения (5летняя переживаемость):
стадия А 100%, стадия В 65%, стадия С 25%, стадия D - 5%.
Значительно реже, чем карциноид,
обнаруживают аденокарциному червеобразного отростка. Рост опухоли происходит
преимущественно эндофитно. Раковая опухоль быстро инфильтрирует серозную
оболочку, часто дает лимфогенные и имплантационные метастазы в органы малого
таза. Метод лечения - правосторонняя гемиколэктомия. Пятилетняя
выживаемость составляет 60%.
84. Болезнь Крона. Определение понятия.
Клиника, диагностика, дифференциальный диагноз. Лечение. Осложнения, их
диагностика и лечение.
Болезнь Крона характеризуется ограниченным воспалением
с гранулематозными изменениями какоголибо участка пищеварительного тракта,
сопровождающегося изъязвлением слизистой оболочки, стенозом кишки и
образованием свищей.
Макроскопически при болезни Крона выявляется
значительная воспалительная инфильтрация пораженного сегмента кишки. Стенка ее
имеет синеватобагровую окраску, заметно утолщена и ригидна. В подслизистом слое
нередко обнаруживаются характерные гранулемы. Отмечается выраженный отек
брыжейки. В ее толще определяются заметно увеличенные лимфатические узлы. На
поверхности слизистой оболочки образуются множественные язвы щелевидной формы,
глубиной до субсерозного слоя. Между язвами в кишечный просвет выступают
участки здоровой слизистой, что придает последней вид «булыжной мостовой».
Часто развиваются стриктуры и псевдополипы.
Классификация. Общепринятая классификация отсутствует.
Некоторые исследователи пытаются выделить стадии заболевания. С учетом
особенностей клинического течения заболевания. Крон предложил различать
следующие стадии.
. Острый энтерит с локализацией патологического
процесса в терминальном отделе подвздошной кишки, клиническая картина которого
напоминает острый аппендицит.
. Хронический энтерит с приступами кишкообразных болей
и появлением в стуле крови и слизи. Клиническая картина сходна с проявлениями
неспецифического язвенного колита.
. Стенозирующий илеит, вызывающий частичную или полную
непроходимость кишечника.
. Свищевой илепт, протекающий с образованием наружных
и внутренних свищей.
Основной недостаток этой классификации состоит в том,
что, отражая некоторые особенности клинической картины заболевания, она не
учитывает многообразия локализации патологического процесса, прежде всего,
поражения толстой кишки.
Клиническая картина зависит от уровня
ипоражения и распростарненности процесса. Для нее характерны интенсивные боли
преимущественно в правой подвздошной области. Характерна часто отмечается диарея
с появлением неоформленного стула (иногда жидкого), имею щего примесь слизи, с
частотой до 5 раз в сутки. Следующим важным симптомом болезни Крона является
потеря массы тела.
Клиническая картина болезни Крона с
поражением терминального отдела вздошной кишки или илеоцекальной области может
напоминать клинику острого аппендицита с повышением температуры тела и
лейкоцитозом. Поэтому диагноз болезни Крона попрежнему нередко устанавливается
во время проведения аппендэктомии. Поражение червеобразного отростка при
болезни Крона является в большинст случаев результатом распространения
воспаления с терминального отдела подвздошной кишки и слепой кишки.
При одновременном поражении
терминального отдела подвздошной кишки, слепой и восходящей кишок в правой
подвздошной области может пальпироваться опухолевидный конгломерат,
обусловленный продуктивным воспалением кишок и лимфоузлов брыжейки.
Диффузный еюноилеит встречается
преимущественно у более молодых пациентов. Точные данные о частоте этого
варианта заболевания пока не известны. Больные жалуются на рецидивирующие
схваткообразные боли в животе, потерю массы тела и диарею. Возникновение этих
клинических симптомов является результатом множественных воспалительных или
Рубцовых обструктивных изменений тонкой кишки.
Болезнь Крона на начальном этапе
может неправильно интерпретироваться как синдром раздраженного кишечника. Это
бывает в тех случаях, когда диарея и схваткообразные боли в животе возникают
периодически. Внекишечные проявления (в первую очередь поражение суставов,
анемия, нарушения роста и др.) могут также выступать в начальном периоде
заболевания на передний план в клинической картине и, при отсутствии кишечных
проявлений, задерживать своевременную постановку диагноза.
При хронической форме заболевание
начинается постепенно, и в большинстве случаев проходит более 1 года, прежде
чем устанавливается диагноз. Периоды обострений могут сменяться периодами
продолжительных ремиссий.
В настоящее время нет специфических
лабораторных тестов, которые были бы патогномоничными для болезни Крона.
Следующие лабораторные показатели дают ориентировочную информацию о степени
тяжести воспалительного процесса в кишечнике: СОЭ, Среактивный белок,
лейкоциты, тромбоциты, альбумин сыворотки, железо, показатели свертывающей
системы крови.
В распознавании заболевания важное
значение принадлежит колоноскопии, при поражении дистальных отделов толстой
кишки - ректороманоскопии с проведением биопсии слизистой оболочки. В начальном
периоде определяется тусклая слизистая оболочка, на ней видны эрозии,
окруженные белесоватыми грануляциями. По мере увеличения длительности болезни в
фазу обострения слизистая оболочка неравномерно утолщается, появляются глубокие
язвы - трещины, просвет кишки сужается. С уменьшением активности процесса на
месте язв образуются рубцы и формируются участки стеноза.
В рамках первичной диагностики важное
значение сохраняет применение рентгенографии с использованием энтероклизмы по
Селлинку с целью исследования всей тонкой кишки. При этом выявляется
гирляндообразное чередование суженных и расширенных сегментов кишки.
Чувствительность ультрасонографии в
диагностике болезни Крона составляет около 90%. Классическим ультразвуковым
признаком воспалительных изменений стенки кишки, выявляемым при поперечном
сечении, служит обнаружение конфигурации в виде кольца - так называемый симптом
мишени. Этот ультразвуковой феномен коррелирует с выраженностью изменений
стенки кишечника. В продольном сечении наблюдается протяженное анэхогенное
утолщение стенки кишки. Однако перечисленные ультрасонографические признаки
являются неспецифичными.
Компьютерная томография дает
возможность не только оценить толщину стенки пораженного участка, но и
обнаружить внекишечные изменения, а также распознать осложнения. В отличие от
компьютерной томографии, магнитнорезонансная томография позволяет провести
срезы в дополнительных плоскостях, что повышает ее диагностические возможности.
Осложнения. Наиболее частыми
осложнениями воспалительного процесса в тонкой кишке при болезни Крона являются
перфорация стенки кишки, образование свищей, абсцессов, стриктур и стенозов.
Перфорация стенки кишки может
возникнуть в любом ее отделе. Описаны случаи, когда перфорация оказывалась
первым клиническим проявлением болезни Крона. Поскольку при обострении
хронического воспалительного заболевания кишечника уже исходно имеются боли в
животе и нарушения общего состояния, внезапное ухудшение состояния служит
важным диагностическим признаком перфорации. Диагноз подтверждается при
обнаружении воздуха в брюшной полости при рентгенологическом исследовании,
проводимом в положении больного стоя и лежа на левом боку.
Свищи являются также нередким
осложнением болезни Крона, особенно при тонкокишечной локализации
воспалительного процесса, и представляют собой каналы, образующиеся в
результате трансмурального воспаления. Свищевые ходы могут достигать кожи
(наружные свищи) (рис. 277, 278), соседних органов (внутренние свищи) (см. рис.
279) или же заканчиваться слепо в окружающих тканях, становясь исходной зоной
для последующего образования абсцесса (см. рис. 280).
Частота возникновения свищей у лиц с
длительно существующей болезнью Крона достигает 40%. Свищи могут выглядеть как
одиночные свищевые ходы или представлять собой сложную систему в виде «лисьей
норы». Принципиально важно, что свищи могут возникать между воспалительно
измененными отделами кишечника и любыми органами, расположенными как
внутрибрюшинно, так и в забрюшинном пространстве, прилегающими к патологически
измененным участкам кишки.
Вначале они протекают бессимптомно,
особенно если из нормального пассажа выключается сравнительно короткий участок
кишки. Факультативными клиническими признаками служат рецидивы лихорадки, а
также появление резистентности мышц передней брюшной стенки при пальпации
живота. Кишечнокишечные свищи пред. ставляют собой наиболее частый вариант
свищей, встречающихся при болезни Крона. Среди них преобладают свищи между
различными участками тонкой кишки, свищи между терминальным отделом подвздощной
кишки и толстой или сигмовидной кишкой. Свищевые ходы приводят к развитию
спаечного процесса между пораженными участками кишечника с формированием
опухолевидных конгломератов. Если выключенные участки оказываются обширными, с
течением времени развиваются синдром мальабсорбции, кахексия, гипоальбуминемия
и электролитные расстройства.
Ведущими клиническими симптомами
кишечнопузырных свищей являются пневматурия (выделение с мочой воздуха),
дизурия, рецидивирующее инфицирование мочевых путей. Кишечнокожные свищи
встречаются сравнительно редко и проявляются выделением тонкокишечного
содержимого наружу. В большинстве случаев они берут начало из воспалительно
измененных участков подвздошной кишки.
Для диагностики внутренних свищей
целесообразно применять ультразвуковое исследование, компьютерную томографию, а
также рентгенологическое исследование тонкой кишки. При лабораторном
исследовании можно обнаружить лейкоцитоз, гипоальбуминемию, анемию.
Внутренние свищи, а также перфорация
стенки кишки могут стать причинами возникновения абсцессов. Эти абсцессы часто
не распознаются, поскольку ожидаемые клинические признаки (боли, лихорадка)
отмечаются далеко не всегда, а применяемые лекарственные препараты могут
маскировать клинические симптомы. В диагностике абсцессов важная роль
принадлежит, прежде всего, компьютерной томографии. Кроме того, применяются
ультразвуковое исследование, эндосонография, а также сцинтиграфия с мечеными
лейкоцитами.
Стриктуры кишечника обнаруживаются у
3050% пациентов с болезнью Крона (рис. 281). Кишечная обструкция наблюдается в
35% случаев поражения тонкой кишки, что вдвое чаще, чем при локализации
воспаления в толстой кишке (17%).
Чаще всего кишечная обструкция
развивается при остром воспалении слизистой оболочки, которое сопровождается
отеком
Все больные рано или поздно
подвергаются хирургическому лечению Через 5 лет после начала заболевания
вероятность операции составляет через 10 лет около 70%, через 20 лет почти
90%. Частота оперативных вмешательств зависит не только от продолжительности
заболевания, но и от локализации поражения. Вероятность операции наиболее
высока при комбинированном поражении тонкой и толстой кишок. При болезни Крона
применяют два вида оперативных вмешательств резекцию пораженного участка кишки
в пределах здоровых тканей и выключение пораженного участка с помощью
формирования межкишечного анастомоза. Методом выбора следует считать резекцию
пораженного участка тонкой кишки, отступив 3050 см от места поражения, с
обязательным удалением лимфатических узлов, так как они могут быть причиной
рецидива заболевания.
Согласно современной концепции лечения
болезни Крона, хирургические методы должны применяться только для лечения
осложнений. Выделяют абсолютные и относительные показания к операции. К
абсолютным относятся перфорация, кишечная непроходимость, тяжелое кровотечение,
вовлечение в процесс мочевых путей. По относительным показаниям оперируются
больные с хронической обструкцией кишки, наличием свища или абсцесса. При
развитии этих осложнений лечение начинают с противовоспалительной терапии. При
этом нередко удается купировать острые проявления воспаления, а следовательно,
улучшить пассаж кишечного содержимого при хронической обструкции, достигнуть
закрытия трубчатого свища, а при поверхностных абсцессах, используя чрескожное
дренирование, - избежать операции. Неэффективность консервативного лечения
будет служить показанием к ее осуществлению.
85. Дивертикулы ободочной кишки. Клиника.
Диагностика. Дифференциальный диагноз. Осложнения. Лечение
Дивертикулы ободочной кишки могут быть истинными и
ложными. Истинный дивертикул представляет собой грыжеподобное выпячивание всех
слоев стенки кишки размером от нескольких миллиметров до нескольких
сантиметров. Истинные дивертикулы встречаются редко; они являются врожденными.
При ложных дивертикулах через дефект в мышечной оболочке кишки выпячивается
только слизистый и подслизистый слои, покрытые снаружи серозной оболочкой.
Дивертикулы бывают одиночными (дивертикул) и множественными (дивертикулез).
Обычно дивертикулезом называют множественные ложные
дивертикулы. Дивертикулез встречается более чем у 50% лиц старше 40 лет. С
возрастом заболеваемость возрастает. У женщин дивертикулез встречается с такой
же частотой, как у мужчин. Заболеваемость дивертикулезом в XX столетии
значительно возросла. По данным аутопсии, в 1910 г. дивертикулез был обнаружен
у 5%, а в 1970 - уже у 40%. Это объясняется, с одной стороны, лучшим
распознаванием дивертикулеза, с другой - изменением условий жизни и питания. У
жителей Европы и США дивертикулез локализуется в левой половине толстой кишки,
а у жителей Азии - в правой. Следовательно, возникновение дивертикулеза связано
не только с характером питания, но и с другими факторами.
Этиология и патогенез. Врожденные дивертикулы
развиваются вследствие нарушений, возникающих в период эмбрионального развития.
Ложные дивертикулы (дивертикулез) являются приобретенными. Причиной их
появления могут быть многие факторы: бедная клетчаткой и шлаками пища,
вызывающая запоры и повышение давления в толстой кишке, особенно в сигме и
нисходящем отделе; наличие отверстий в местах, где сосуды проникают в стенки
кишки; воспалительные процессы в кишке, ослабляющие ее стенку; возраст,
гиподинамия, механический фактор. Недостаток растительной, богатой клетчаткой
пищи является наиболее важным фактором, оказывающим влияние на
перистальтическую активность толстой кишки, находящуюся под контролем
миогенных, нервных и гормональных воздействий. Моторная функция толстой кишки -
сложный процесс, предназначенный для продвижения фекалий в дистальном
направлении, всасывания воды, электролитов и ряда других компонентов пищи.
У пациентов с дивертикулезом наблюдается избыточная
сократительная способность мышечной оболочки на пищевые и гормональные
воздействия, способствующая повышению давления в просвете кишки, особенно в
нисходящем отделе и сигме. Усиленные сокращения приводят к гипертрофии мышечной
оболочки кишки. Продвижение фекалий осуществляется координированными
сегментарными сокращениями, которые разделяют просвет толстой кишки на камеры.
Сокращение камеры вызывает повышение давления в ней, способствующее
проталкиванию содержимого в следующую открытую, свободную камеру. После
опорожнения давление в камере снижается. Аналогичный процесс происходит в
следующей камере данного сегмента кишки. Таким образом, один конец камеры
остается открытым, поэтому фекалии продвигаются в дистальном направлении. Если
дистальный конец камеры оказывается временно закрытым в связи с нарушением
моторики кишки, то давление в камере понижается за счет перемещения содержимого
в проксимальном направлении. Если некоторые камеры в данном сегменте оказываются
закрытыми с обоих концов, то сокращения сегмента кишки становятся смешивающими,
а не пропульсивными, давление в камере резко возрастает, достигает 90 мм рт.ст.
и более. Высокое давление в просвете предрасполагает к выпячиванию слизистой
оболочки и подслизистого слоя через слабые участки стенки кишки, подобно
выпячиванию грыжи. Такими участками обычно являются места, через которые сосуды
проникают в стенку кишки. В результате продолжительного функционирования этого
механизма возникает дивертикулез
Патологоанатомическая картина. Дивертикул представляет
собой выпячивание стенки кишки, имеющее шейку длиной 3 - 5 мм и тело
диаметром0,5-1,5 см. Наиболее часто дивертикулы располагаются в сигмовидной
ободочной кишке и левой половине ободочной кишки (70-85%). По мере увеличения
дивертикула его стенки истончаются, слизистая оболочка атрофируется, создаются
условия для перфорации и других осложнений. В дивертикуле изза застоя кала
образуются эрозии, язвы, развивается воспалительный процесс (дивертикулит).
Клиническая картина и диагностика. Принято выделять 3
основные клинические формы дивертикулеза: 1) дивертикулез без клинических
проявлений, случайно выявляемый при исследовании кишечника при диспансерном
осмотре; 2) дивертикулез с клиническими проявлениями; 3) дивертикулез,
сопровождающийся осложнениями (дивертикулит, параколические абсцессы,
внутренние и наружные свищи, перфорация, кровотечение) .
С развитием дивертикулита (у 10-20% больных)
появляются боли в левом нижнем квадранте живота, усиливающиеся при пальпации.
Обычно прощупывается спастически сокращенная болезненная кишка. При более
выраженном дивертикулите наблюдается неустойчивый стул (смена запоров
поносами), снижается аппетит, появляется тошнота, изредка рвота. При этом
воспаление сопровождается довольно интенсивными болями в животе, повышением
температуры тела, лейкоцитозом. Пальпация живота в зоне поражения вызывает
резкую боль, умеренное напряжение мышц.
Клиническая картина дивертикулита поперечной ободочной
кишки может напоминать язвенную болезнь желудка и двенадцатиперстной кишки, а
дивертикулита восходящей ободочной кишки - острый аппендицит. При перфорации
дивертикула в свободную брюшную полость развивается перитонит, при перфорации в
забрюшинную клетчатку - флегмона, при перфорации в клетчатку, расположенную
между листками брыжейки толстой кишки, - параколический абсцесс. Гнойные
осложнения проявляются свойственными им симптомами.
Другим осложнением дивертикулита являются
формирующиеся в замкнутой полости дивертикула абсцессы. Прорыв абсцесса в кишку
ведет к выздоровлению. При прорыве абсцесса в брюшную полость развивается
перитонит, при прорыве в подпаявшийся полый орган - внутренний свищ. Чаще всего
свищи возникают между петлями кишки, мочевым пузырем и влагалищем. Возможно
возникновение наружных свищей. Пузырнокишечные свищи, проявляющиеся пиурией,
выделением газа или частиц кала при мочеиспускании, обычно образуются у мужчин.
Кровотечение наблюдается у 3-5% больных дивертикулезом
толстой кишки, возникает внезапно, нередко бывает профузным и проявляется как
общими симптомами кровопотери (слабость, головокружение, бледность, тахикардия
и др.), так и примесью малоизмененной крови в кале (в зависимости от
локализации дивертикула). Механизм этого осложнения заключается в аррозии
артериального сосуда, расположенного у шейки дивертикула. Длительно
существующий дивертикулит ведет к спаечному процессу, следствием которого
нередко является непроходимость кишечника.
Диагностика дивертикулеза основывается на данных
анамнеза, результатах рентгенологического и колоноскопического исследований. На
рентгенограммах, полученных во время ирригоскопии, бывают отчетливо видны
выпячивания небольших размеров, выходящие за пределы наружного контура кишки.
Они хорошо заметны после опорожнения кишки и раздувания ее воздухом. При
колоноскопии ощущается некоторое препятствие при продвижении инструмента через
пораженный дивертикулезом сегмент кишки, обусловленное спазмом и гипертрофией
стенки. Можно увидеть устья дивертикулов, воспалительные изменения слизистой
оболочки в зоне их расположения. Следует помнить, что грубое колоноскопическое
и рентгенологическое исследования опасны в связи с возможностью перфорации
дивертикула.
Лечение. Консервативное лечение включает диету,
богатую растительной клетчаткой, спазмолитики, прокинетики (цизаприд,
метеоспазмил и др.). Следует воздерживаться от назначения слабительных средств,
так как можно вызвать повышение давления в кишке. Больные с острым
дивертикулитом, сопровождающимся высокой температурой тела и другими признаками
синдрома системной реакции на воспаление, подлежат госпитализации. В этих
случаях назначают антибиотики (сочетание цефалоспорина последнего поколения,
метронидазола и гентамицина или другого препарата из группы аминогликозидов),
инфузионную терапию для коррекции водноэлектролитных нарушений и
дезинтоксикации. В качестве послабляющего при запорах рекомендуется
использовать лактулозу (нормазе) по 30 мл ежедневно.
Хирургическое лечение проводят при перфорации
дивертикула, непроходимости кишечника, внутренних свищах, массивном кровотечении,
тяжелом дивертикулезе с частыми эпизодами дивертикулита при безуспешности
консервативного лечения. При дивертикулите толстой кишки удаляют пораженный
участок кишки (гемиколэктомия, резекция сигмовидной ободочной кишки). Для
снижения внутрикишечного давления целесообразно сочетать эти операции с
миотомией ободочной кишки.
Хирургическому лечению подлежат до 30% больных с
кровотечением (промывается кровоточащий сосуд, инвагинируется дивертикул в
просвет кишки, если это удается технически). Смертность при экстренных
операциях достигает 20%.
86. Полипы и полипоз ободочной кишки.
Клиника. Диагностика. Дифференциальный диагноз. Лечение. Осложнения
Полипы относят к доброкачественным
новообразованиям, исходящим из эпителия, они склонны к малигнизации. Полипы
обнаруживают у 10-12% проктологических больных, а среди лиц, которым при
профилактическом осмотре выполняют колоноскопию, - у 2-4%. Мужчины заболевают в
2-3 раза чаще, чем женщины.
Полипы могут быть одиночным и
множественными. Обычно их диаметр равен 0,5-2 см, но изредка они достигают 3-5
см и более. Полипы имеют ножку и свисают в просвет кишки, реже расположены на
широком основании. Выделяют ювенильные, гиперпластические, аденоматозные
(железистые), ворсинчатые полипы, ворсинчатые опухоли, а также множественный
полипоз толстой кишки (истинный и вторичный).
Ювенильные полипы наблюдаются
преимущественно у детей. Чаще поражается слизистая оболочка прямой кишки.
Макроскопически полипы имеют вид виноградной грозди, обладающей ножкой,
поверхность их гладкая, окраска более интенсивная по сравнению с окружающей
неизмененной слизистой оболочкой. Они являются характерными железистокистозными
образованиями, в которых строма преобладает над железистыми элементами. Как
правило, ювенильные полипы не малигнизируются.
Гиперпластические (метапластические)
полипы - мелкие (2-4 мм) образования, чаще имеют форму конуса. В них
сохраняется нормальное строение слизистой оболочки кишки с правильными
строением и ориентацией желез при значительном увеличении их числа, за счет
чего и создается впечатление об утолщении слизистой оболочки в виде полипа.
Малигнизируются очень редко.
Аденоматозные (железистые) полипы
наблюдаются наиболее часто (90%). Аденоматозный полип имеет вид опухоли с
гладкой поверхностью, округлой формы, располагается на ножке на широком
основании, представляет собой участок гиперплазии слизистой оболочки, построен
из разнообразных по форме желез, нередко кистознорасширенных, выстланных
цилиндрическим эпителием. Эти полипы часто малигнизируются при размерах более 2
см - в 50% случаев (чем больше размеры полипа, тем чаще выявляют малигнизацию).
Ворсинчатый полип (аденопапиллома)
имеет дольчатое строение, бархатистую поверхность, покрыт тонкими нежными
ворсинками.
Ворсинчатая опухоль выступает в
просвет кишки, расположена на широком основании (узловая форма). Одной из
разновидностей ворсинчатых опухолей является стелющаяся, ковровая форма, при
которой опухолевого узла нет. В таком случае процесс распространяется по
поверхности слизистой оболочки, занимая иногда довольно большую площадь по всей
окружности кишки, и проявляется ворсинчатыми или мелкодольчатыми разрастаниями.
Размеры ворсинчатых опухолей - 1,5-5 см. Склонность к малигнизации ворсинчатых
опухолей очень большая (до 90%). Среди всех новообразований толстой кишки они
составляют около 5%. Наиболее часто ворсинчатые опухоли локализуются в прямой и
сигмовидной ободочной кишке.
Клинически ворсинчатые опухоли
толстой кишки проявляются выделением слизи при дефекации, причем количество
слизи может быть значительным и достигать 1-1,5 л в сутки, что приводит к
водноэлектролитным расстройствам. Вследствие легкой ранимости ворсин опухоли
почти у всех больных возникает кровотечение. К другим симптомам заболевания
относят боли в животе, запор, понос, кишечный дискомфорт.
При одиночных полипах симптоматика
иногда отсутствует или они являются причиной жалоб больных на выделение крови и
слизи из прямой кишки, боли в животе, запор, понос, кишечный дискомфорт. Эти
симптомы не являются патогномоничными для полипов, поэтому для выявления их
необходимы пальцевое исследование прямой кишки, ректороманоскопия,
колоноскопия, ирригография. Биопсия необходима для определения гистологической
структуры образования, выявления атипичных клеток и малигнизации.
Множественный полипоз толстой кишки
бывает врожденным, семейным и вторичным (как результат других поражений толстой
кишки, например колита). Частота малигнизации при полипозе достигает 70-100%,
т. е. он является облигатным предраком. Врожденный семейный полипоз передается
по наследству, поражая нескольких членов семьи. Заболевание обычно выявляют у
детей и людей молодого возраста. Полипы могут локализоваться на всем протяжении
желудочнокишечного тракта. Частота малигнизации приближается к 100%.
Сочетание множественного полипоза
толстой кишки с доброкачественными опухолями мягких тканей и костей называют
синдромом Гарднера [Gardner
E. J., 1951]. Сочетание полипоза пищеварительного тракта с
пигментными пятнами на слизистой оболочке щек, вокруг рта и на коже ладоней
называют синдромом Пейтца-Егерса-Турена [Peutz L. А., 1921; Touraine A., 1941; Eghers H., 1949]. В детском возрасте он протекает бессимптомно.
Для множественного полипоза толстой
кишки характерны боли в животе без четкой локализации, понос, выделение крови и
слизи с калом, похудание, анемия. Диагностику заболевания проводят на основании
клинических симптомов и анамнестических данных. Наиболее информативно
инструментальное исследование: колоноскопия с биопсией, ирригография.
Лечение. Выбор метода лечения полипов и
множественного полипоза толстой кишки должен быть индивидуализирован. Одиночные
полипы удаляют электрокоагуляцией через ректо или колоноскоп. Электрокоагуляция
допустима и для удаления ворсинчатых опухолей с хорошо выраженной ножкой при
отсутствии малигнизации.
При малигнизации ворсинчатой опухоли
выполняют радикальную операцию, объем которой определяется локализацией опухоли
(право или левосторонняя гемиколэктомия, резекция сигмовидной ободочной кишки).
При клеточной атипии верхушки полипа без инвазии мышечной пластинки слизистой
оболочки радикальной операцией является клиновидное иссечение стенки кишки в
зоне полипа.
При врожденном семейном полипозе
толстой кишки выполняют субтотальную колэктомию с наложением илеоректального
или илеосигмовидного анастомоза. При локализации множественных полипов на
ограниченном участке производят резекцию пораженного отдела кишки.
87. Рак ободочной кишки. Классификаиия.
Клиника. Диагностика. Дифференциальный диагноз. Осложнения. Виды операций при
неосложненном и осложненном раке ободочной кишки
Рак ободочной кишки занимает одно из первых мест в
структуре онкологических заболеваний. Заболевание поражает одинаково часто
мужчин и женщин, обычно в возрасте 50-75 лет. Частота заболевания наиболее
высока в развитых странах Северной Америки, Австралии, Новой Зеландии, занимает
промежуточное место в странах Европы и низка - в регионах Азии, Южной Америки и
тропической Африки. В России заболевание встречается с частотой 17 наблюдений
на 100 000 населения. Ежегодно выявляют около 25 000 новых случаев заболевания
(в США - более 130 000).
К факторам повышенного риска развития рака толстой
кишки относят диету с высоким содержанием жира и низким содержанием
растительных волокон (целлюлозы), возраст старше 40 лет, аденомы и рак толстой
кишки в анамнезе, наличие прямых родственников с колоректальным раком, полипы и
полипозные синдромы (Гарднера, Пейтца-Егерса-Турена, семейный ювенильный
полипоз), болезнь Крона, неспецифический язвенный колит и др.
Патологоанатомическая картина. Наиболее часто рак
развивается в сигмовидной ободочной (50%) и слепой (15%) кишке, реже - в
остальных отделах (восходящая ободочная кишка - 12%, правый изгиб - 8%,
поперечная ободочная кишка - 5%, левый изгиб - 5%, нисходящая ободочная кишка -
5%).
Рак ободочной кишки возникает в слизистой оболочке,
затем прорастает все слои кишечной стенки и выходит за ее пределы,
инфильтрирует окружающие органы и ткани. Опухоль распространяется вдоль
кишечной стенки незначительно. За пределами видимых граней, даже при эндофитном
раке, она выявляется на расстоянии не более чем 4-5 см, чаще 1-2 см.
Экзофитные формы рака встречаются чаще в правой
половине ободочной кишки, бывают узловыми, полипообразными и
ворсинчатопапиллярными; опухоль растет в просвет кишки. Эндофитные опухоли
встречаются чаще в левой половине ободочной кишки. Они бывают блюдцеобразными и
диффузноинфильтративными, в последнем случае нередко циркулярно охватывают
кишку и суживают ее просвет.
Большинство злокачественных опухолей ободочной кишки
имеет строение аденокарциномы (примерно у 90% больных), реже - слизистой
аденокарциномы (слизистого рака), перстневидноклеточного рака (мукоцеллюлярного
рака), плоскоклеточного (ороговевающего и неороговеваюшего) и
недифференцированного рака.
Специфической особенностью рака ободочной кишки
является довольно длительное местное распространение опухоли (включая
прорастание в окружающие органы и ткани) при отсутствии метастазирования в
регионарные лимфатические узлы, которое может появиться довольно поздно.
Метастазирование происходит лимфогенным (30%), гематогенным
(50%) и имплантационным (20%) путем. Метастазы чаще всего возникают в печени,
реже - в легких, костях, поджелудочной железе.
Международная классификация рака ободочной кишки
Т - первичная опухоль
ТХ - недостаточно данных для оценки первичной опухоли
ТО - нет данных за наличие первичной опухоли- рак in
situ: интраэпителиальная опухоль или опухоль с инвазией собственной пластинки
Т1 - опухоль прорастает подслизистую основу
Т2 - опухоль прорастает в мышечный слой
ТЗ - опухоль прорастает мышечный слой и подсерозную
основу или окружающие ткани неперитонизированных участков кишки
Т4 - опухоль прорастает висцеральную брюшину и/или
распространяется на соседние органы и анатомические структуры- регионарные
лимфатические узлы- недостаточно данных для оценки регионарных лимфатических
узлов- нет метастазов в регионарные лимфатические узлы- метастазы в 1-3
регионарных лимфатических узлах- метастазы в 4 и более регионарных
лимфатических узлах
К регионарным относят параколические и параректальные
лимфатические узлы, а также лимфатические узлы, расположенные вдоль a.
ileocolica, a. colica dextra, a. colica media, a. colica sinistra, a.
mesenterica inferior, a. rectalis superior, a. iliaca interna.- отдаленные
метастазы- недостаточно данных для определения отдаленных метастазов
МО - нет отдаленных метастазов- имеются отдаленные
метастазы
Учитывается также гистопатологическое строение
опухоли. Различают хорошо дифференцированные, умеренно или
малодифференцированные, недифференцированные и опухоли, степень дифференцировки
которых не может быть определена.
Клиническая группировка по стадиям
Стадия 0 - интраэпителиальная опухоль, поражена только
слизистая оболочка без признаков инфильтративного роста (Tis carcinoma in
situ), без метастазов.
Стадия I - небольшая опухоль (Tl, T2),
локализирующаяся в толще слизистой и подслизистой оболочек без регионарных и
отдаленных метастазов (N0, МО).
Стадия II - опухоль, занимающая не более
полуокружности кишечной стенки (ТЗ, Т4), не выходящая за ее пределы и не
переходящая на соседние органы (N0, М О ) (возможны единичные метастазы в
лимфатические узлы).
Стадия III - опухоль занимает более полуокружности
стенки кишки, прорастает всю толщу стенки, распространяется на брюшину соседних
органов (любое Т (без метастазов) N0) или любое Т с множественными метастазами
в лимфатические узлы (N1, N2), без отдаленных метастазов (МО).
Стадия IV - большая опухоль (любое Т), прорастающая в
соседние органы с множественными регионарными метастазами (любое N), с
отдаленными метастазами (Ml).
Клиническая картина и диагностика. Клинические
проявления зависят от локализации опухоли, ее типа, роста, размеров, стадии
развития, наличия осложнений. Ранние формы рака протекают бессимптомно и
выявляются при колоноскопии по поводу других заболеваний или при диспансерном
исследовании. Большинство больных обращаются к врачу по поводу появления следов
крови в кале, выделения слизи, внезапно появившихся запоров, уменьшения калибра
каловых масс, желудочнокишечного дискомфорта, болевых ощущений, ухудшения
общего состояния.
При опухолях правой половины толстой кишки рано
возникают общие симптомы - недомогание, слабость, умеренно выраженная анемия,
тупые боли в правой половине живота. Нередко в сравнительно ранней стадии
пальпируется опухоль.
Для опухолей левой половины характерны частые запоры,
испражнения в виде овечьего кала со следами крови на его поверхности, признаки
частичной кишечной непроходимости (метеоризм, вздутие живота, урчание,
схваткообразные боли на фоне постоянных тупых болей).
Боли в животе отмечают у 80-90% больных, особенно
часто - при локализации опухоли в правой половине ободочной кишки. Они связаны
с воспалительным процессом в зоне распадающейся опухоли и переходом его на
брюшину, они могут быть незначительными (тупыми, тянущими), но при развитии
непроходимости кишечника становятся очень интенсивными, схваткообразными.
Кишечная диспепсия проявляется потерей аппетита,
отрыжкой, тошнотой, чувством тяжести в эпигастральной области. Кишечные
расстройства бывают вызваны воспалительными изменениями в стенке кишки,
нарушениями ее моторики и сужением просвета. Они проявляются запорами,
поносами, их чередованием, урчанием в животе и его вздутием. При резком сужении
просвета кишки развивается обтурационная непроходимость кишечника (частичная
или полная).
Патологические выделения (примесь крови, гноя, слизи в
кале) отмечаются у 40-50% больных. Кровь в кале появляется в результате распада
опухоли и развития сопутствующего колита.
Нарушение общего состояния (похудание, лихорадка,
повышенная утомляемость, слабость, анемия) связано с интоксикацией и особенно
выражено при раке правой половины ободочной кишки.
У некоторых больных единственным симптомом заболевания
является пальпируемая опухоль (чаще при опухолях правой половины ободочной
кишки).
Выделяют шесть форм клинического течения рака
ободочной кишки: токсикоанемическую, энтероколитическую, диспепсическую,
обтурационную, псевдовоспалительную, опухолевую (атипическую).
Токсикоанемическая форма проявляется слабостью,
повышенной утомляемостью, субфебрильной температурой тела, бледностью кожных
покровов вследствие анемии. Прогрессирующая анемия - основное проявление
развивающегося патологического процесса. Больных иногда длительное время
обследуют для выявления ее причины, и лишь возникающие кишечные расстройства
наводят врача на мысль о раковой опухоли ободочной кишки.
Энтероколитическая форма заболевания характеризуется
выраженными кишечными расстройствами: вздутием живота, урчанием, чувством
распирания, запором, поносом. Возникают тупые ноющие боли в животе. В кале
обычно имеется примесь крови и слизи. Клиническая картина энтероколитической
формы рака ободочной кишки нередко сходна с таковой при колите, энтерите,
дизентерии, что является причиной диагностических ошибок.
Диспепсическая форма рака проявляется потерей
аппетита, тошнотой, отрыжкой, рвотой, чувством тяжести и вздутием в
эпигастральной области, болями в верхней половине живота. Все эти симптомы
могут наблюдаться при многих заболеваниях органов брюшной полости и не являются
строго специфичными для этой формы рака.
Ведущим симптомом обтурационной формы рака является
кишечная непроходимость. Возникают приступообразные боли, урчание в животе,
вздутие, чувство распирания, неотхождение кала и газов. Вначале эти симптомы
самостоятельно проходят, эпизодически повторяясь (частичная непроходимость
кишечника). По мере нарастания обтурации просвета кишки развивается острая
непроходимость кишечника, при которой необходимо экстренное хирургическое
вмешательство.
Псевдовоспалительная форма заболевания характеризуется
болями в животе и повышением температура тела. Кишечные расстройства выражены
слабо. В анализе крови выявляют лейкоцитоз, повышение СОЭ.
При опухолевидной форме рака опухоль в животе
обнаруживает сам больной или врач при обследовании больного. При этом других
проявлений заболевания нет или они выражены очень слабо.
Нередко клинические проявления заболевания
соответствуют нескольким формам рака ободочной кишки. Однако для рака правой ее
половины более характерны токсикоанемическая, энтероколитическая,
псевдовоспалительная и опухолевая формы, а для рака левой половины -
обтурационная.
Диагностика основывается на тщательной оценке
анамнестических данных, жалоб больного, результатах физикального и специальных
методов исследования.
Следует придавать большое значение диспепсическим
явлениям, жалобам на тупые боли в животе, кишечным расстройствам и всегда
выяснять их причины. При осмотре больного нередко обращают на себя внимание
бледность кожных покровов, похудание. Пальпацию живота нужно проводить
целенаправленно в различных положениях тела больного (стоя, лежа на спине, на
правом и левом боку). Пальпация живота у 20% больных позволяет выявить опухоль,
определить ее размеры, подвижность.
При перкуссии живота устанавливают наличие или
отсутствие свободной жидкости в брюшной полости (асцита), увеличение печени. В
известной мере этим и определяют операбельность больного.
Пальцевое исследование прямой кишки позволяет выявить
метастазы в клетчатке малого таза, исключить наличие второй опухоли в прямой
кишке (синхронный рак).
Рентгенологическое исследование должно включать
ирригографию толстой кишки с двойным контрастированием, при котором в кишку
вводят воздух после опорожнения ее от бариевой взвеси. Исследование позволяет
выявить степень сужения просвета кишки, локализацию опухоли, ее размеры,
наличие изъязвления.
Ценным методом диагностики является колоноскопия, при
которой можно не только выявить опухоль, расположенную на любом участке толстой
кишки, но и взять биопсию для морфологической верификации диагноза.
Рентгенологическое и колоноскопическое исследования
дополняют друг друга и позволяют получить наиболее полную информацию о
заболевании. Дополнительными методами исследования, направленными на выявление
метастазов, являются УЗИ (при необходимости сочетается с тонкоигольной аспирационной
биопсией печени), лапароскопия, компьютерная томография.
В группе больных повышенного риска развития
колоректального рака необходимо проведение скрининговых исследований.
Используют тест на скрытую в кале кровь, определение карциноэмбрионального антигена,
проводят генетическое тестирование, выполняют колоноскопию.
Осложнения. Наиболее частыми осложнениями являются
непроходимость кишечника, воспаление в окружающих опухоль тканях и перфорация
опухоли, кишечные кровотечения, свищи между ободочной кишкой и соседними
органами.
Непроходимость кишечника чаще является следствием
обтурации просвета кишки опухолью. Она возникает у 10-15% больных. Изредка
непроходимость кишечника может быть вызвана инвагинацией кишки при экзофитно
растущей опухоли, заворотом петли кишки, пораженной опухолью.
При локализации опухоли в левой половине ободочной
кишки или в сигмовидной кишке непроходимость возникает в 2-3 раза чаще, чем при
ее локализации в правой половине ободочной кишки. Предвестниками развития
острой кишечной непроходимости являются запор, сменяющийся иногда поносом,
урчание в животе, эпизодически возникающее вздутие живота.
Воспаление в окружающих опухоль тканях развивается у
8-10% больных, причем у 3-4% из них возникают параколические флегмоны и
абсцессы. Воспаление является следствием проникновения патогенных
микроорганизмов из просвета кишки через ее стенки в окружающие ткани по
лимфатическим путям и в результате разрушения стенки кишки опухолью. Более
часто воспалительные инфильтраты, флегмоны и абсцессы в клетчатке возникают при
опухолях слепой, восходящей, реже сигмовидной ободочной кишки.
Перфорация стенки ободочной кишки при поражении ее
опухолью развивается у 1 -2% больных и является частой причиной смерти больных
раком этого отдела кишечника. К перфорации приводят изъязвление опухоли, ее
распад, причем способствует перфорации появление непроходимости кишечника,
приводящее к повышению давления в просвете кишки и растяжению ее стенки.
Перфорация в свободную брюшную полость ведет к развитию распространенного перитонита,
а в клетчатку позади кишки (на участках, не покрытых брюшиной) - к развитию
флегмоны или абсцесса забрюшинной клетчатки.
К редким осложнениям рака ободочной кишки относят
прорастание опухоли в полые органы с образованием свищей. Указанные осложнения
ухудшают прогноз заболевания.
Лечение. Основным методом лечения является
хирургический.
Перед хирургическим вмешательством на ободочной кишке
больные нуждаются в предоперационной подготовке, направленной на очищение
кишечника. В последние годы при подготовке кишечника используют перорально
фортране, растворенный в 3 л воды. Применяют также ортоградное промывание
кишечника путем введения 6 - 8 л изотонического раствора через зонд,
установленный в двенадцатиперстной кишке. Реже используют бесшлаковую диету и
очистительные клизмы.
Выбор метода хирургического вмешательства зависит от
локализации опухоли, наличия или отсутствия осложнений и метастазов, общего
состояния больного. При отсутствии осложнений (перфорация, непроходимость) и
метастазов выполняют радикальные операции - удаление пораженных отделов кишки
вместе с брыжейкой и регионарными лимфатическими узлами.
При раке правой половины ободочной кишки производят
правостороннюю гемиколэктомию (удаляют терминальный отдел подвздошной кишки
протяженностью 15-20 см, слепую кишку, восходящую и правую половину поперечной
ободочной кишки), завершая операцию наложением илеотрансверзоанастомоза по типу
конец в бок или бок в бок (рис. 23.3). При раке средней трети поперечной
ободочной кишки производят резекцию поперечной ободочной кишки, завершая ее
колоколоанастомозом по типу конец в конец (рис. 23.4). При раке левой половины
ободочной кишки производят левостороннюю гемиколэктомию (удаляют часть
поперечной ободочной кишки, нисходящую ободочную кишку и часть сигмовидной
ободочной кишки) с наложением трансверзосигмоанастомоза (рис. 23.5).
При наличии неудалимой опухоли или отдаленных
метастазов производят паллиативные операции, направленные на предупреждение
непроходимости кишечника: паллиативные резекции, наложение обходного
илеотрансверзоанастомоза, трансверзосигмоанастомоза и др. (рис. 23.6), или
накладывают колостому. Химиотерапия в послеоперационном периоде не увеличивает
продолжительность жизни. Оптимальная схема лекарственной терапии, так же как
ценность пред и послеоперационной рентгенотерапии, не установлена.
Летальность при радикальных операциях, выполненных по
поводу рака ободочной кишки, равна 6 - 8%. Пятилетняя выживаемость зависит от
стадии заболевания и степени дифференцировки клеток опухоли; среди радикально
оперированных она составляет в среднем 50%. Если опухоль не выходит за пределы
подслизистой основы, то пятилетняя выживаемость приближается к 100%. При
экзофитном росте опухоли прогноз несколько лучше, чем при эндофитном. Прогноз
для жизни во многом зависит от наличия или отсутствия метастазов в регионарные
лимфатические узлы. При наличии таких метастазов пятилетняя выживаемость
составляет 40%, а при их отсутствии - 80%. Прогноз ухудшается с уменьшением
степени дифференцировки опухоли.
Наиболее часто метастазы рака ободочной кишки выявляют
в печени, при этом 70-80% метастазов появляются в течение первых 2 лет после
операции. Лечение - комбинированное: их удаляют оперативным путем (возможно в
4-11% наблюдений), проводят селективное введение химиопрепаратов в артериальную
систему печени, эмболизацию ветвей печеночной артерии в сочетании с
внутрипеченочной химиотерапией и д
88. Рак правой и левой половины ободочной
кишки. Особенности клиники. Диагностика. Особенности хирургического лечения при
непроходимости одной из половин толстой кишки. Паллиативные и радикальные
операции. Виды расширенной лимфаденэктомии
Начальные проявления рака правой половины толстой
кишки характеризуются в основном болями без выраженных нарушений пассажа
содержимого. Значительно чаще и сравнительно раньше, чем при раках левой
половины толстой кишки, развиваются симптомы кишечного дискомфорта, потеря
аппетита, ощущение тяжести и распираний в правой половине живота, резкое и
громкое урчание в кишках через 3-4 часа после еды. В дальнейшем присоединяются
метеоризм, пустая отрыжка, тошнота, очень редко рвота. Сравнительно рано
выявляются нарушения общего состояния больных в виде недомогания, быстрой
утомляемости, бледности и малокровия без видимой потери крови с испражнениями,
повышения температуры.
При локализации рака в правой половине толстой кишки
развитие признаков кишечной непроходимости наступает сравнительно поздно. Рак
слепой кишки отличается выраженной наклонностью к изъязвлению, а богатое
бактериями и их токсинами, продуктами распада опухоли жидкокашицеобразное
содержимое, постоянно омывая изъязвленную поверхность опухоли, легко
всасывается.
Этим обстоятельством при данной локализации рака
толстой кишки объясняется преобладание в клинической картине явлений общей
интоксикации над нарушениями пассажа кишечного содержимого. Различают три типа
рака правой половины толстой кишки:
) диспепсический тип, при котором преобладают
диспепсические жалобы, запор и боли в животе;
) анемический тип (без видимой потери крови с
испражнениями) и
) тип, при котором опухоль обнаруживается случайно при
хорошем самочувствии больного.
Хотя для рака правой половины толстой кишки типичных
признаков нет, все же приблизительно у 75% больных удается при более детальном
расспросе констатировать, что еще до обращения к врачу наблюдались неприятные
ощущения - вздутие, полнота и распирание в правой половине живота, объединяемые
понятием «кишечного дискомфорта». К этим жалобам у 50% больных присоединялись:
периодическое ухудшение аппетита, отрыжка, урчание, реже тошнота, срыгивание,
рвота, тенденция к запору, часто тупые боли в животе, особенно вокруг пупка и в
правом нижнем квадранте. При раке правой половины толстой кишки боли беспокоят
больных в 3 раза чаще, нежели при его локализации в левой половине; коликообразные
боли в виде периодических болевых схваток могут обусловливаться постепенным
развитием кишечной непроходимости. 25% больных предъявляли жалобы на общую
прогрессирующую слабость, 50% отмечали потерю веса задолго до выявления у них
рака толстой кишки. Выраженная тенденция к запору отмечалась у 25% больных,
значительно реже, чем у больных с левосторонней локализацией рака. Часто
отмечался понос, нередко чередовавшийся с запором; кишечные кровотечения в виде
стула темнобурой окраски, реже дегтеобразного, встречаются лишь у 20% больных,
особенно при поражении поперечноободочной кишки, при этом кровь оказывается
смешанной с жидкими пли кашицеобразными испражнениями.
При раке слепой и поперечноободочной кишки на первый
план могут выступать симптомы, связанные с анемией, выраженная бледность кожных
покровов при относительно хорошем состоянии питания больного и пр. Наконец, в
5-14% раковая опухоль обнаруживается случайно самим больным или врачом при
отсутствии выраженных предшествующих симптомов заболевания кишечника.
Для рака левой половины толстой кишки в отличие от
правостороннего поражения характерны более длительный бессимптомный период
болезни, менее выраженный и реже встречающийся болевой синдром.
Чем позже выявляется раковая опухоль, тем чаще
наблюдается частичная и полная кишечная непроходимость, развивающаяся при
левосторонней локализации опухоли в 84%.
Запор наблюдается лишь у 50%60% больных, он медленно
прогрессирует, резко обостряется при недостаточном опорожнении кишечника и
уменьшается или временно прекращается после клизмы или приема слабительных. От
10 до 20% больных отмечают чередование поноса и запора, иногда понос
развивается вследствие длительных приемов слабительных или в виде ложного, или
«запорного», поноса.
Приблизительно у 25% больных раком левой половины
толстой кишки наблюдается примесь крови к испражнениям, чаще на поверхности
оформленных каловых масс; при дефекации кровь выделяется до появления кала в
отличие от геморроидальных кровотечений, при которых выделение крови следует
после дефекации. Обильное выделение крови с испражнениями более характерно для
рака, локализующегося в нисходящей или сигмовидной кишке.
Около 1/3 больных раком левой половины толстой кишки
отмечали потерю в весе, которую следует относить к сравнительно поздним признакам.
Правосторонняя гемиколэктомия предполагает удаление
слепой кишки с червеобразным отростком и восходящей ободочной кишки,
печеночного изгиба ободочной кишки и проксимальной трети поперечной ободочной
кишки, 1020 см терминального отдела подвздошной кишки, а также регионарных
лимфатических узлов. При локализации опухоли в слепой и восходящей кишке
перевязывают и пересекают подвздошноободочные, правые ободочные и правую ветвь
средней ободочной артерии. Ствол средней ободочной артерии необходимо пересекать
при локализации опухоли в печеночном изгибе и поперечной ободочной кишке.
В качестве хирургического доступа используют срединную
или параректальную лапаротомию. После вскрытия брюшной полости петли тонкой
кишки перемещают в ее левую половину и отгораживают пеленкой. Мобилизацию
правой половины ободочной кишки начинают с илеоцекального угла, захватывая 10
20 см подвздошной кишкипой, восходящей и части поперечноободочной кишки и
дистального отдела подвздошной кишки. Затем отделяют слепую и восходящую кишку
с параколической клетчаткой от околопочечной клетчатки. Крючком отводят правую
реберную дугу и печень кверху и кнаружи. По частям перевязывают и пересекают
пече ночноободочную связку. Далее пересекают большой сальник и
желудочноободочную связку, начиная от намеченного места резекции ободочной
кишки и продолжая в проксимальном направлении. После этого терминальный отдел
подвздошной кишки и правая половина ободочной становятся подвижными и выводятся
в рану. Следующим этапом операции является рассечение внутреннего листка
брюшины от намеченного места пересечения подвздошной кишки по направлению к ее
корню и далее к месту пересечения поперечной ободочной кишки. Мобилизованную
кишку резецируют, пересекая вначале подвздошную кишку. Удаляют правую половину
ободочной кишки с частью подвздошной.
Следующий этап операции - формирование соустья между
тонкой и поперечной ободочной кишками - проводят с применением многочисленных
методик наложения илеотрансверзоанастомоза, который может быть по типу «конец в
конец», «бок в бок» или «конец тонкой в бок толстой», наложенный анти или
изоперистальтически. В зависимости от способа формирования межкишечного
анастомоза обрабатывают концы подвздошной и поперечной ободочной кишки,
освобождая их от брыжейки на протяжении 1-2-3 см.
89. Геморрой. Определение понятия.
Классификация. Клиника Диагностика. Дифференциальный диагноз. Показания к
хирургическому лечению. Методы консервативного лечения
Геморрой (varices haemorrhoidales) - варикозное
расширение вен в области заднего прохода, обусловленное гиперплазией
кавернозных телец прямой кишки. Геморроем страдает более 10% всего взрослого
населения в возрасте 30-50 лет. Эти больные составляют 15-28% от общего числа
проктологических больных. Мужчины болеют в 3 - 4 раза чаще, чем женщины.
Клиническая картина и диагностика. Вначале больные отмечают неприятные
ощущения в области заднего прохода (ощущение инородного тела).
Кровотечение является главным
симптомом геморроя. Оно возникает в момент дефекации или тотчас после нее
(выделяется кровь алого цвета, иногда при натуживании - струйкой); кал не
перемешан с кровью, она покрывает его сверху. Геморроидальные кровотечения
могут быть интенсивными и приводить к анемизации больных вследствие своей
продолжительности.
Боль не является характерным
симптомом хронического геморроя. Она наблюдается при присоединении воспаления,
тромбоза узлов или их ущемлении, при появлении анальной трещины, возникает в
момент дефекации и продолжается некоторое время после нее.
Зуд в области заднего прохода
ощущается в связи с мацерацией кожи при слизистых выделениях из кишки, что
может вести к развитию экземы.
Различают 4 стадии развития
заболевания (выпадение внутренних геморроидальных узлов). При I стадии узлы выступают в просвет
кишки (но не выпадают), во время дефекации выделяется кровь из анального
канала. На II стадии узлы выпадают при дефекации и вправляются самостоятельно.
При III стадии узлы выпадают даже при незначительной физической нагрузке,
самостоятельно не вправляются, необходимо вправлять их рукой. В IV стадии
выпавшие за пределы анального канала узлы не вправляются.
Для геморроя характерна смена
периодов ремиссий и обострений. В период ремиссий больные жалоб не предъявляют.
При погрешности в диете (прием алкоголя, острой пищи), физическом
перенапряжении могут возникать кровотечения.
Характерные жалобы больного и
выявление геморроидальных узлов при осмотре позволяют поставить правильный
диагноз. Осматривают больного в коленнолоктевом положении и в положении на
корточках при натуживании. Осмотр дополняют пальцевым исследованием прямой
кишки, аноскопией и ректоскопией.
Дифференцируют геморрой от полипа и
рака прямой кишки, трещины заднего прохода, выпадения слизистой оболочки прямой
кишки. Для дифференциальной диагностики с раком толстой кишки применяют
ирригоскопию, колоноскопию.
Лечение. Основу консервативной терапии
составляют диетотерапия, устранение запоров, соблюдение гигиенического режима,
флеботропные препараты, влияющие на повышение тонуса вен, улучшающие
микроциркуляцию в кавернозных тельцах и нормализацию в них кровотока
(венорутон, детралекс, диосмин, ПроктоГливенол, проктоседил и др.).
При выборе местного лечения (состава
мазей, свечей) исходят из преобладания одного из симптомов осложненного
геморроя (тромбоз, кровотечение, воспалительные изменения, боль).
В последние годы все большее
распространение находят малоинвазивные методы лечения - склерозирующая терапия,
инфракрасная фотокоагуляция, лигирование латексными кольцами, электрокоагуляция
и др. В большинстве стран Западной Европы и Америки эти методы лечения
применяют у 75-80% больных, к хирургическому лечению прибегают при безуспешном
консервативном лечении. В России наиболее распространенным методом лечения
является геморроидэктомия, выполняемая у 75% пациентов.
Пациентам с I стадией заболевания показано консервативное лечение препаратами,
влияющими на тонус венозных сосудов, при его неэффективности применяют
склерозирующую терапию (иглу вводят в верхний край узла, чтобы блокировать
артерию, снабжающую узел кровью). При II стадии используют вышеперечисленные
методы, а также лигирование геморроидальных узлов латексными кольцами; при III
стадии - либо лигирование, либо геморроидэктомию. В IV стадии заболевания
методом выбора является геморроидэктомия.
90. Геморрой. Осложнения. Клиника.
Диагностика. Дифференциальный диагноз. Виды консервативного и оперативного
лечения
К осложнениям геморроя относят тромбоз
и ущемление геморроидальных узлов.
Тромбоз наружного геморроидального
узла возникает чаще при физической нагрузке, напряжении при дефекации, родах и
др. Является основой для развития острого геморроя. Воспалительный процесс в
узле и окружающих тканях является его следствием. Появляются резкие боли в
области заднего прохода, усиливающиеся при любой физической нагрузке, кашле;
ощущение инородного тела. В области анального отверстия виден синюшного цвета
узел, очень болезненный при пальпации. Ректальное исследование производить
нецелесообразно, оно не дает какойлибо полезной информации.
Лечение. Чаще применяют
консервативное лечение (см. выше) - диету с исключением острых блюд, алкоголя;
послабляющие средства, нестероидные противовоспалительные препараты. Назначают
сидячие теплые ванночки со слабым раствором перманганата калия. Более
целесообразно хирургическое лечение (иссечение тромбированного узла),
позволяющее сократить сроки нетрудоспособности больного, ликвидировать болевой
синдром.
Ущемление внутренних геморроидальных
узлов происходит в результате их внезапного выпадения и тонического спазма
сфинктера. Вторично возникает тромбоз ущемленных узлов и их некроз. Заболевание
следует дифференцировать от тромбоза наружного геморроидального узла. У больных
появляются резкие распирающие боли в области заднего прохода и ощущение
инородного тела. При осмотре по всему периметру анального канала видны выпавшие
геморроидальные узлы темносинюшного или черного цвета. При некрозе слизистой
оболочки возможно кровотечение, впоследствии парапроктит. Ректальное
исследование в остром периоде проводить не рекомендуется.
Лечение. Консервативное лечение
заключается в назначении послабляющей диеты, применении ненаркотических
анальгетиков и противовоспалительных средств. Местно используют обезболивающие,
противовоспалительные и антибактериальные препараты (ауробин, ПроктоГливенол,
ультрапрокт, левосин, левомеколь, мафинид и др.). При безуспешности
консервативного лечения показано иссечение тромбированных геморроидальных узлов
- геморроидэктомия.
У ряда больных выпавшие и ущемленные
узлы могут на фоне лечения самостоятельно вправиться. После ликвидации острых
явлений спустя 5- 7 дней показано хирургическое лечение - геморроидэктомия.
Хирургическое лечение (методика
Миллигана-Моргана) состоит в иссечении трех групп кавернозных телец с
внутренними узлами и перевязкой их сосудистых ножек.
Предоперационная подготовка
заключается в назначении бесшлаковой диеты на 1-2 дня, клизмы утром и вечером
перед операцией. Хорошей подготовки толстой кишки можно достичь без клизм -
назначением фортранса, растворенного в 3 - 4 л воды. Жидкость принимают по 1
стакану через каждые 15 мин. Это вызывает многократный жидкий стул и
полноценное очищение кишечника. Ортоградное промывание сочетают с назначением невсасывающихся
в кишечнике антибиотиков (неомицин, канамицин, метронидазол). Операцию
целесообразно производить под общим обезболиванием. Во время операции иссекают
геморроидальные узлы: после растяжения сфинктера заднего прохода захватывают
окончатым зажимом один из узлов, рассекают слизистую оболочку по обе стороны от
него, выделяют ножку узла, на которую накладывают кровоостанавливающий зажим.
Узел отсекают, ножку прошивают и перевязывают, края раны слизистой оболочки
сшивают кетгутом. Наружные геморроидальные узлы, местонахождение которых не
всегда соответствует по локализации внутренним, иссекают отдельно. Рецидивы при
данном способе операции возникают в 1-3% случаев. После операции ежедневно
производят перевязки, назначают бесшлаковую диету. На 5-6й день возникает
самостоятельный стул. Первый акт дефекации может быть болезненным и
сопровождаться небольшим кровотечением.
Хирургическое лечение геморроя противопоказано при
выраженной портальной гипертензии и гипертонической болезни III стадии.
91. Расширение геморроидальных вен как
симптом ряда заболеваний. Дифференциальный диагноз. Методы лечения
Все заболевания внутренних органов,
приводящие к застою крови в тазовых венах и венах прямой кишки, могут стать
причиной геморроя. Например, неправильное положение матки или воспалительные
заболевания половых органов у женщин, а также опухоли органов таза в отдельных
случаях приводят к увеличению геморроидальных узлов вследствие сдавливания вен.
Нередко причиной геморроя бывает длительное натуживание при мочеиспускании у
мужчин с сужением мочеиспускательного канала или аденомой предстательной
железы.
Источником появления симптомов
геморроя является также цирроз печени. Так как при этом прохождение венозной
крови от пищеварительного тракта к печени нарушается, она устремляется по
«обходным» путям, так называемым коллатералям, которые располагаются и возле
прямой кишки. Вены прямой кишки не справляются с повышенной нагрузкой и
постепенно расширяются, обусловливая формирование крупных геморроидальных
узлов.
Геморрой, развивающийся на фоне
других болезней, врачи часто называют симптоматическим, поскольку после
излечения основного заболевания его симптомы очень быстро исчезают. Внимание
врачей и пациентов в таких случаях должно быть направлено на борьбу не с
геморроем, а с вызвавшей его причиной.
92. Острый парапроктит. Классификация.
Пути инфицирования. Клиника. Диагностика. Дифференциальный диагноз. Виды
операций. Доступы. Анестезия
Парапроктит (параректальный абсцесс) - острое или
хроническое воспаление параректальной клетчатки. На его долю приходится около
30% всех заболеваний, процесс поражает примерно 0,5% населения. Мужчины
страдают в 2 раза чаще женщин, заболевают в возрасте 30-50 лет.
Этиология и патогенез. Парапроктит возникает в результате
попадания в параректальную клетчатку микрофлоры (стафилококк, грамотрицательные
и грамположительные палочки). При обычном парапроктите чаще всего выявляют
полимикробную флору. Воспаление с участием анаэробов сопровождается особо
тяжелыми проявлениями заболевания - газовой флегмоной клетчатки таза,
гнилостным парапроктитом, анаэробным сепсисом. Специфические возбудители
туберкулеза, сифилиса, актиномикоза очень редко являются причиной парапроктита.
Пути инфицирования очень
разнообразны. Микробы попадают в параректальную клетчатку из анальных желез,
открывающихся в анальные пазухи. При воспалительном процессе в анальной железе
ее проток перекрывается, в межсфинктерном пространстве образуется абсцесс,
который прорывается в перианальное или параректальное пространство. Переход процесса
с воспаленной железы на параректальную клетчатку возможен также лимфогенным
путем.
В развитии парапроктита определенную
роль могут играть травмы слизистой оболочки прямой кишки инородными телами,
содержащимися в кале, геморрой, анальные трещины, неспецифический язвенный
колит, болезнь Крона, иммунодефицитные состояния.
Парапроктит может быть вторичным -
при распространении воспалительного процесса на параректальную клетчатку с
предстательной железы, уретры, женских половых органов. Травмы прямой кишки
являются редкой причиной развития парапроктита (травматического).
Распространение гноя по
параректальным клетчаточным пространствам может идти в разных направлениях, что
приводит к формированию различных форм парапроктита (рис. 24.2). При этом гной
нередко прорывается наружу через кожу с образованием свища.
Классификация парапроктитов
I. Острый парапроктит.
1.
По
этиологическому принципу: обычный, анаэробный, специфический, травматический.
2.
По локализации
гнойников (инфильтратов, затеков): подкожный, ишиоректальный, подслизистый,
пельвиоректальный, ретроректальный.
II. Хронический парапроктит (свищи
прямой кишки).
1. По анатомическому признаку: полные,
неполные, наружные, внутренние.
2. По расположению внутреннего отверстия
свища: передний, задний, боковой.
3. По отношению свищевого хода к
волокнам сфинктера: интрасфинктерный, транссфинктерный, экстрасфинктерный.
4. По степени сложности: простые,
сложные.
Острый парапроктит характеризуется быстрым развитием
процесса.
Клиническая картина и диагностика. Клинически парапроктит проявляется
довольно интенсивными болями в области прямой кишки или промежности, повышением
температуры тела, сопровождающимся ознобом, чувством недомогания, слабости,
головными болями, бессонницей, исчезновением аппетита. Обширная флегмона
параректальной клетчатки ведет к выраженной интоксикации, развитию синдрома
дисфункции жизненно важных органов, угрожающей переходом в полиорганную
недостаточность и сепсис. Больные испытывают недомогание, слабость, головные
боли, бессонницу, исчезновение аппетита. Нередко появляются задержка стула,
тенезмы, дизурические явления. По мере скопления гноя боли усиливаются,
становятся дергающими, пульсирующими. Если своевременно не производят вскрытие
гнойника, то он прорывается в смежные клетчаточные пространства, прямую кишку,
наружу через кожу промежности.
Прорыв гнойника в прямую кишку
является следствием расплавления ее стенки гноем при пельвиоректальном
парапроктите. Образуется сообщение полости гнойника с просветом прямой кишки
(неполный внутренний свищ).
При прорыве гноя наружу (на кожу
промежности) формируется наружный свищ. Боли стихают, снижается температура
тела, улучшается общее состояние больного.
Прорыв гнойника в просвет прямой
кишки или наружу очень редко приводит к полному выздоровлению больного. Чаще
образуется свищ прямой кишки (хронический парапроктит).
Рецидивирующий парапроктит
проявляется наличием ремиссий, когда наступает, казалось бы, полное
выздоровление больного (исчезают боли, нормализуется температура тела, рана
заживает). Затем возникает обострение с клинической картиной острого
параректального абсцесса.
Подкожный парапроктит - наиболее
часто встречающаяся форма заболевания (до 50% всех больных парапроктитом).
Характерны острые, дергающие боли, усиливающиеся при движении, натуживании,
дефекации; наблюдается дизурия. Температура тела достигает 39"С, часто
возникают ознобы. При осмотре выявляют гиперемию, отечность и выбухание кожи на
ограниченном участке вблизи ануса, деформацию анального канала. При пальпации
этой зоны отмечается резкая болезненность, иногда определяют флюктуацию.
Пальцевое исследование прямой кишки вызывает усиление болей. Однако под
обезболиванием его целесообразно провести, так как это дает возможность
определить размеры инфильтрата на одной из стенок прямой кишки вблизи анального
канала и принять решение о способе лечения.
Ишиоректальный парапроктит
встречается у 35-40% больных. Вначале появляются общие признаки гнойного
процесса, характерные для синдрома системной реакции на воспаление с резким
повышением температуры тела, ознобом, тахикардией и тахипноэ, высоким
содержанием лейкоцитов в крови. Наряду с этим отмечаются слабость, нарушение
сна, признаки интоксикации. Тупые боли в глубине промежности становятся
острыми, пульсирующими. Они усиливаются при кашле, физической нагрузке,
дефекации. При локализации гнойника спереди от прямой кишки возникает дизурия.
Лишь через 5 - 7 дней от начала болезни отмечают умеренную гиперемию и
отечность кожи промежности в зоне расположения гнойника. Обращают на себя
внимание асимметрия ягодичных областей, сглаженность полулунной складки на
стороне поражения. Болезненность при пальпации кнутри от седалищного бугра
умеренная. Весьма ценным в диагностике ишиоректальных гнойников является
пальцевое исследование прямой кишки. Уже в начале заболевания можно определить
болезненность и уплотнение стенки кишки выше прямокишечнозаднепроходной линии,
сглаженность складок слизистой оболочки прямой кишки на стороне поражения.
Подслизистый парапроктит наблюдается
у 2-6% больных с острым парапроктитом. Боли при этой форме заболевания весьма
умеренные, несколько усиливаются при дефекации. Температура тела субфебрильная.
Пальпаторно определяют выбухание в просвете кишки, в зоне гнойника, резко
болезненное. После самопроизвольного прорыва гнойника в просвет кишки наступает
выздоровление.
Пельвиоректальный парапроктит -
наиболее тяжелая форма заболевания, встречается у 2-7% больных с острым
парапроктитом. Вначале отмечаются общая слабость, недомогание, повышение
температуры тела до субфебрильной, озноб, головная боль, потеря аппетита,
ноющие боли в суставах, тупые боли внизу живота. При абсцедировании инфильтрата
пельвиоректальной клетчатки (через 7-20 дней от начала заболевания) температура
тела становится гектической, выражены симптомы гнойной интоксикации. Боли
становятся более интенсивными, локализованными, отмечаются тенезмы, запор,
дизурия. Болезненности при пальпации промежности нет. Диагноз может быть
подтвержден УЗИ, компьютерной или магнитнорезонансной томографией. Без
инструментальных исследований диагноз поставить трудно до тех пор, пока гнойное
расплавление мышц тазового дна не приведет к распространению воспалительного
процесса на седалищнопрямокишечную и подкожную жировую клетчатку с появлением
отека и гиперемии кожи промежности, болезненности при надавливании в этой
области. Во время пальцевого исследования прямой кишки можно обнаружить
инфильтрацию стенки кишки, инфильтрат в окружающих кишку тканях и выбухание его
в просвет кишки. Верхний край выбухания пальцем не достигается.
Ретроректальный парапроктит
наблюдается у 1,5-2,5% всех больных парапроктитом. Характерны интенсивные боли
в прямой кишке и крестце, усиливающиеся при дефекации, в положении сидя, при
надавливании на копчик. Боли иррадиируют в область бедер, промежность. При
пальцевом исследовании прямой кишки определяют резко болезненное выбухание ее
задней стенки. Из специальных методов исследования применяют ректороманоскопию,
которая информативна при пельвиоректальном парапроктите. Обращают внимание на
гиперемию и легкую кровоточивость слизистой оболочки в области ампулы,
сглаживание складок и инфильтрацию стенки, внутреннее отверстие свищевого хода
при прорыве гнойника в просвет кишки. При других формах эндоскопия не нужна.
Лечение. При остром парапроктите проводят
хирургическое лечение. Операция заключается во вскрытии и дренировании
гнойника, ликвидации входных ворот инфекции. Операцию выполняют под общим
обезболиванием. После обезболивания (наркоз) устанавливают локализацию
пораженной пазухи (осмотр стенки кишки с помощью ректального зеркала после
введения в полость гнойника раствора метиленового синего и раствора перекиси
водорода). Если прорыв абсцесса произошел наружу через кожу, то хорошего его
дренирования, как правило, не наступает. При подкожном парапроктите его
вскрывают полулунным разрезом, гнойную полость хорошо ревизуют пальцем,
разделяют перемычки и ликвидируют гнойные затеки. Пуговчатым зондом проходят
через полость в пораженную пазуху и иссекают участок кожи и слизистой оболочки,
образующие стенку полости вместе с пазухой (операция Габриэля).
При подкожноподслизистом парапроктите
разрез можно произвести в радиальном направлении - от гребешковой линии через
пораженную анальную крипту (входные ворота инфекции) на перианальную кожу.
Затем иссекают края разреза, пораженную крипту вместе с внутренним отверстием
свища. На рану накладывают повязку с мазью, вводят газоотводную , трубку в
просвет прямой кишки.
При ишиоректальном и
пельвиоректальном парапроктитах подобное хирургическое вмешательство
невозможно, поскольку при этом будет пересечена большая часть наружного
сфинктера. В подобных случаях производят вскрытие гнойника полулунным разрезом,
тщательно обследуют полость его и вскрывают все гнойные затеки, рану промывают
раствором перекиси водорода и рыхло тампонируют марлевым тампоном с
диоксидиновой мазью.
Для ликвидации криптита, который
привел к развитию парапроктита, в таких случаях необходимо обеспечить парез
сфинктера. Для этого производят дозированную заднюю сфинктеротомию (при этом
рассекают и пораженную пазуху). В ряде случаев, когда при ревизии гнойной
полости четко определяется дефект в стенке прямой кишки (входные ворота
инфекции), можно использовать лигатурный метод. Полулунный разрез кожи после
вскрытия гнойника продлевают до средней линии кпереди или кзади от прямой кишки
(в зависимости от локализации пораженной пазухи). Далее со стороны прямой кишки
эллипсовидным разрезом иссекают пораженную пазуху. Нижний угол раны в кишке
соединяют с медиальным углом промежностной раны, слизистую оболочку в указанных
пределах иссекают. Через вскрытую полость и иссеченную пазуху в прямую кишку и
далее наружу проводят толстую лигатуру, укладывают строго по средней линии
спереди или сзади анального канала и затягивают. Через 2-3 дня часть волокон
сфинктера прорезается лигатурой, и ее снова затягивают. Повторяя эту процедуру
несколько раз, постепенно пересекают лигатурой мышечные волокна сфинктера, в
результате чего у большинства больных удается ликвидировать свищ без нарушения
замыкательной функции сфинктера. Целесообразно при лечении этим методом
использовать эластичные, специально изготовленные лигатуры, которые после
затягивания, в силу эластических свойств, будут более длительно, чем простая
лигатура, постепенно разрушать волокна сфинктера.
При ретроректальном (пресакральном) остром
парапроктите производят разрез кожи длиной 5-6 см посередине между проекцией
верхушки копчика задним краем анального отверстия. На расстоянии 1 см от
копчика пересекают заднепроходнокопчиковую связку. Эвакуируют гной, полость
абсцесса обследуют пальцем, разъединяя перемычки. Экспонируют с помощью крючков
заднюю стенку анального канала, окруженную мышцами сфинктера, где отыскивают
участок свищевого хода, ведущий в просвет кишки. Второй этап операции -
проведение лигатуры - производят аналогично описанному выше.
93. Трещина заднего прохода:
классификация, клиника, диагностика, лечение
Трещина заднего прохода представляет
собой хроническую линейную язву нижней части анального канала (90%). Анальная
трещина по частоте третья среди болезней прямой кишки - после колитов и
геморроя, ее обычная длина около 2 см, ширина 2-3 мм. Дном линейного дефекта
слизистой оболочки являются волокна анального сфинктера. При нескольких
трещинах наиболее типичная локализация их - передняя и задняя комиссуры
("зеркальные" трещины), направление - продольное. Несколько чаще они
наблюдаются у мужчин в возрасте 30-50 лет.
Этиология и патогенез. Наиболее частую локализацию анальной
трещины в области задней комиссуры объясняют травматизацией этой зоны при
дефекации и худшим кровоснабжением. Предрасполагающими факторами являются
колиты, проктиты, энтероколиты, криптит, геморрой. Изредка они возникают в
результате грубых манипуляций при аноскопии, ректороманоскопии.
Вначале трещина представляет собой
надрыв кожи в области переходной складки и слизистой оболочки прямой кишки в
зоне анального канала (острая трещина). Мягкие края постепенно становятся
твердыми, каллезными, она расширяется и приобретает вид трофической язвы, дно
которой покрыто грануляциями. Присоединение спазма сфинктера прямой кишки
уменьшает возможность заживления трещины изза ишемии тканей. В области
внутреннего края трещины развивается зона избыточной ткани - пограничный
анальный бугорок. Такая трещина называется хронической.
Клиническая картина и диагностика. В момент дефекации возникает боль,
кровотечение. Боли режущие, жгучие, колющие, длятся от нескольких минут до
нескольких часов после дефекации, их интенсивность может быть очень
значительной. Боли могут иррадиировать в промежность, прямую кишку, крестец.
Характерен длительный спазм сфинктера.
Кровотечение при трещине заднего
прохода обычно незначительное. Кровь при этом не смешана с калом, а находится
на его поверхности в виде полос или появляется в конце дефекации в виде капель.
Диагностика трещины заднего прохода основана
на данных анамнеза, оценке жалоб больного и осмотра области заднего прохода,
при котором трещина хорошо видна. Длительно существующая трещина приводит к
замещению мышечных элементов сфинктера прямой кишки соединительной тканью,
вследствие чего он становится ригидным, образовавшееся фиброзное кольцо
суживает задний проход.
Дифференциальный диагноз. При больших трещинах, расположенных в
нетипичных местах, множественном их характере, необходим дифференциальный
диагноз с раком прямой кишки, туберкулезом, сифилисом, ВИЧ, болезнью Крона.
Лечение. Вначале применяют консервативное
лечение - слабительные, болеутоляющие препараты, спазмолитики, используют
свечи, содержащие анестезирующие вещества, специальные мази, микроклизмы перед
актом дефекации, теплые сидячие ванны со слабым раствором перманганата калия,
физиотерапевтические процедуры. Производят спиртоновокаиновую блокаду (под
основание трещины) либо вводят 25-30 мг гидрокортизона в 3-4 мл раствора
новокаина, а также насильственное расширение сфинктера с целью вызвать
временный парез сфинктера и устранить патологический спазм. При правильном и
своевременном лечении острые анальные трещины заживают в течение 3 - 6 нед.
Хирургическое лечение применяют при
хронических трещинах и безуспешности консервативных методов лечения -
производят иссечение трещины, подслизистую боковую сфинктеротомию с последующим
гистологическим исследованием удаленных тканей для исключения рака.
94. Рак прямой кишки. Классификации.
Клиника. Диагностика. Дифференциальный диагноз. Виды операций. Лучевая и
химиотерапия
В структуре всех онкологических
заболеваний рак прямой кишки в нашей стране находится на 8м месте, составляя
2,5-3,5% от всех злокачественных опухолей, а в некоторых странах (США, Англия,
Франция) он встречается чаще (2-3е место). Рак прямой кишки в России в среднем
диагностируется с частотой 13,8 на 100 000 населения. Преимущественно
заболевают люди в возрасте 50-60 лет, мужчины и женщины одинаково часто. В
последние десятилетия отмечено достоверное увеличение заболеваемости раком
прямой кишки, причем эта тенденция сохраняется и в настоящее время.
Возникновение рака прямой кишки
связывают прежде всего с предшествующими предраковыми заболеваниями, к которым
относят аденоматозные полипы, семейный аденоматозный полипоз, неспецифический
язвенный колит, болезнь Крона, хронический парапроктит. Некоторое значение
имеет характер принимаемой пищи (легкоусвояемая пища, содержащая мало шлаков,
большое количество консервантов).
Классификация рака прямой кишки
I. По локализации: в анальном отделе
кишки (10%), нижнеампулярном, среднеампулярном и верхнеампулярном отделах
(60%), ректосигмоидном отделе (30%).
II. По типу роста: эндофитный (30%),
экзофитный (20%), смешанный (50%).
III.По гистологическому строению: аденокарцинома, слизистый, солидный,
плоскоклеточный, недифференцированный, фиброзный рак.
IV.По стадии процесса: по системе TNM (I-IV стадии).
Патологоанатомтеская картина. Экзофитные опухоли имеют четкие
контуры, растут в просвет прямой кишки. К ним относят полиповидный рак (опухоль
на широком или узком основании, выступает в просвет кишки), бляшковидный
(опухоль на широком основании, с плоской поверхностью, незначительно выступает
в просвет кишки), ворсинчатопапиллярный рак (бугристая опухоль дольчатого
строения).
Эндофитные опухоли характеризуются
внутристеночным ростом; опухоль поражает стенку прямой кишки на большем или
меньшем протяжении, в разной степени проникая в ее толщу
(диффузноинфильтративный рак) и сужая просвет кишки. Границы опухоли четко не
определяются. На отдельных участках могут возникать изъязвления
(эндофитноязвенный рак). Стенка кишки становится ригидной.
Смешанный тип опухоли прямой кишки
характеризуется тем, что наряду с ростом ее в просвет кишки происходит
инфильтрация стенки на относительно большом протяжении. Смешанным ростом
обладает блюдцеобразный рак, представляющий собой овальной или круглой формы
изъязвление с плотными, бугристыми, валикообразно приподнятыми краями.
Гистологическая структура рака прямой
кишки различна, однако у подавляющего большинства больных опухоль является
аденокарциномой, реже - слизистым (обычно растет эндофитно), солидным,
плоскоклеточным, недифференцированным (обладает инфильтрирующим ростом) или
фиброзным раком (скирр). Особенно высокой степенью злокачественности обладают
слизистый, солидный, недифференцированный рак.
Международная классификация по
системе TNM (1997)
Т - первичная опухоль
ТХ - недостаточно данных для оценки
первичной опухоли ТО - нет данных за наличие первичной опухоли
Tis - рак in situ: интраэпителиальная опухоль или опухоль с инвазией
собственной пластинки
Т1 - опухоль прорастает подслизистую
основу Т2 - опухоль прорастает в мышечный слой
ТЗ - опухоль прорастает мышечный слой
и подсерозную основу или окружающие ткани неперитонизированных участков кишки
Т4 - опухоль прорастает висцеральную брюшину и/или распространяется на соседние
органы и анатомические структуры
N - регионарные лимфатические узлы
NX - недостаточно данных для оценки
регионарных лимфатических узлов
N0 - нет метастазов в регионарные
лимфатические узлы N1 - метастазы в
1-3 регионарных лимфатических узлах N2 - метастазы в 4 и более регионарных лимфатических узлах
М - отдаленные метастазы
MX - недостаточно данных для
определения отдаленных метастазов
МО - нет отдаленных метастазов
Ml - имеются отдаленные метастазы
Гистопатологическая классификация (G):
G - степень дифференцировки не может
быть определена
G1 - хорошо дифференцированная опухоль
G2 - умеренно дифференцированная
опухоль
G3 - малодифференцированная опухоль
G4 - недифференцированная опухоль
Рак прямой кишки, разрастаясь,
распространяется в просвет кишки и в толщу кишечной стенки (поражая
подслизистую основу и мышечный слой), выходя затем за ее пределы и врастая в
окружающие органы (влагалище, матка, мочевой пузырь, семенные пузырьки, мочеточники)
и ткани. Одновременно с ростом опухоли в толщу кишечной стенки идет ее
распространение по окружности прямой кишки. Инфильтрация раковыми клетками
стенки кишки не превышает обычно 4-5 см от видимой на глаз границы опухоли.
Метастазирование рака прямой кишки может идти лимфогенным (в регионарные и
отдаленные лимфатические узлы), гематогенным (чаще всего в печень) и
имплантационным путями (карциноматоз брюшины, распространение раковых клеток по
поверхности слизистой оболочки).
Клиническая картина и диагностика. Рак прямой кишки развивается
постепенно, клинические проявления возникают лишь при достижении опухолью
значительных размеров и сводятся к болевым ощущениям, патологическим выделениям
(кровь, слизь, гной) из прямой кишки и нарушению функции кишечника.
Выраженность симптомов зависит от стадии заболевания, типа роста опухоли и ее
локализации.
Болевые ощущения обычно не являются
ранним симптомом рака прямой кишки. Они возникают в начале заболевания лишь при
раке, локализующемся в анальном канале, так как обусловлены прорастанием
опухолью зоны, богатой нервными окончаниями, растяжением пораженного анального
канала при дефекации. При других локализациях опухоли появление болей
свидетельствует о распространении ее за пределы кишечной стенки и поражении окружающих
органов и тканей. Причиной возникновения схваткообразных болей может быть
растяжение стенки кишки вследствие непроходимости, вызванной обтураций просвета
опухолью. Боли при раке прямой кишки постоянны. Они локализуются внизу живота,
в крестцовокопчиковой области, в области заднего прохода, могут быть в области
поясницы.
Патологические выделения часто
являются симптомом, заставляющим больного обратиться к врачу. Это постоянный
симптом заболевания. Кровотечение из прямой кишки при раке вызвано изъязвлением
опухоли и травмой ее каловыми массами. Оно проявляется в виде примеси темного,
реже алого цвета крови в кале. Нередко при дефекации вначале выходит небольшое
количество крови, а затем кал с примесью крови. Анемия наступает постепенно,
так как сильных кровотечений обычно не бывает. При резком сужении просвета
кишки кал принимает лентовидную форму.
В результате распада опухоли и
присоединения инфекции начинается воспаление, проявляющееся выделением из
прямой кишки зловонного гноя и слизи в начале дефекации. Гной и слизь могут
быть смешаны с каловыми массами или находиться на их поверхности. Наличие гноя
и слизи является признаком далеко зашедшего процесса. Выделение крови, гноя и
слизи при экзофитных опухолях начинается раньше, чем при эндофитных.
Нарушения функции кишечника
проявляются поносом, запором, тенезмами. Понос и его смена запором возникают в
результате проктосигмоидита, сопутствующего раку прямой кишки, и могут быть
ранними симптомами заболевания. По мере инфильтрации стенки кишки опухолью или
обтураций просвета кишки преобладающим симптомом становятся запоры. У некоторых
больных возникают частые позывы на дефекацию, которые, однако, не
сопровождаются отхождением кала (тенезмы). При этом из прямой кишки отделяется
небольшое количество гноя, слизи, крови. Иногда первым симптомом заболевания
является изменение формы кала (лентовидный). У некоторых больных имеется
чувство неполного опорожнения прямой кишки после дефекации и ощущение
инородного тела в ней.
В связи с сужением просвета кишки
развивающейся опухолью появляются симптомы кишечной непроходимости: вздутие
живота, неотхождение кала и газов, урчание и схваткообразные боли в животе,
рвота. В зависимости от локализации рака преобладают те или иные перечисленные
выше симптомы.
При раке анального канала ведущим и
довольно ранним симптомом болезни является тупая постоянная боль в области
заднего прохода, которая усиливается при дефекации. В связи с эндофитным ростом
опухоли этой локализации часто наступает изъязвление новообразования, что
проявляется в виде патологических примесей к калу: вначале крови, затем слизи и
гноя. При этом за счет присоединения воспалительного процесса боли усиливаются.
При распространении воспаления на параректальную клетчатку возникают свищи,
через которые выделяются кал, кровь, слизь, гной. При прорастании опухоли в
анальный сфинктер на большом протяжении наблюдается недержание газов, кала.
Вместе с тем опухоль за счет сужения наиболее узкого отдела прямой кишки быстро
приводит к развитию кишечной непроходимости. При раке анального канала
метастазы распространяются в паховые лимфатические узлы, о чем нужно помнить
при объективном исследовании больного.
При раке ампулярного отдела прямой
кишки симптоматика более скудная. Первым симптомом болезни являются
патологические примеси к калу. В это же время или несколько позже возникают
симптомы нарушения функции кишечника. Боли появляются лишь при прорастании
опухоли через все слои стенки кишки. При прорастании опухоли в мочевой пузырь
возникают частые позывы на мочеиспускание, лейкоцитурия, микрогематурия,
позднее могут сформироваться пузырнопрямокишечные свищи, характеризующиеся
выделением кала и газов при мочеиспускании. При формировании
влагалищнопрямокишечных свищей наблюдается выделение кала из влагалища. В связи
с тем что ампула является наиболее широкой частью прямой кишки, кишечная
непроходимость при данной локализации опухоли развивается редко.
Рак ректосигмоидного отдела прямой
кишки проявляется прогрессирующими запорами с последующей полной кишечной
непроходимостью.
Общими симптомами рака прямой кишки
являются анемия, общая слабость, похудание, гипертермия; они появляются в
поздние сроки заболевания.
Диагностика рака прямой кишки
основывается на данных анамнеза, анализе жалоб больного и проведении
специальных методов обследования: осмотра промежности, пальцевого исследования
прямой кишки (можно определить около 50% опухолей прямой кишки), ирригографии,
ректороманоскопии с биопсией.
Учитывая скудность клинических
проявлений рака прямой кишки в ранних стадиях заболевания, следует придавать
важное значение жалобам больных на нарушения функции кишечника и при их наличии
прибегать к специальным методам обследования. При диспансерном обследовании
больных всегда необходимо производить пальцевое исследование прямой кишки,
периодически производить колоноскопию.
Пальцевое исследование прямой кишки -
наиболее простой и доступный метод, нередко позволяющий установить факт наличия
заболевания и в известной мере определить его распространенность. Оно может
быть выполнено в коленнолоктевом положении больного, в положении на спине, на
корточках, на боку. Наиболее целесообразно сочетать пальцевое исследование
прямой кишки в коленнолоктевом положении с исследованием в положении больного
на корточках. Последнее положение делает возможным достижение опухолей,
расположенных на расстоянии 10-12 см от заднего прохода. У женщин, кроме
пальцевого исследования прямой кишки, обязательно выполняют исследование через
влагалище.
Пальцевое исследование прямой кишки
при раке проводят с целью выявления опухоли, ее локализации (расстояние от
сфинктера), размеров, протяженности, подвижности, наличия изъязвлений, степени
сужения просвета кишки, характера отделяемого из прямой кишки.
Рак прямой кишки при пальцевом
исследовании определяют в просвете кишки в виде опухолевого узла или язвы с
плотными краями, или в виде ригидности и уплотнения стенки кишки. Установив
наличие опухоли, необходимо провести пальпацию паховых областей для выявления
состояния лимфатических узлов.
Следующим методом исследования прямой
кишки является ректороманоскопия, позволяющая уточнить данные, полученные при
пальцевом исследовании, выполнить биопсию, т. е. верифицировать диагноз путем
получения сведений о гистологической структуре опухоли. Кроме того,
ректороманоскопия делает возможной диагностику опухолей, недостижимых при
пальцевом исследовании прямой кишки, расположенных на расстоянии более 35 см от
заднего прохода.
Ирригоскопия и колоноскопия позволяют
выявить первичномножественное поражение ободочной и прямой кишки, уточнить
протяженность поражения, степень сужения просвета кишки в области опухоли.
Для обнаружения отдаленных метастазов
применяют УЗИ, КТ и МРТ, реже - лапароскопию и целиакографию. Для выявления
ранних форм рака, определения протяженности раковой инфильтрации в стенке кишки
используют УЗИ с помощью специального ректального датчика. Метод также
позволяет получить полезную информацию об инвазии опухолью окружающих
анатомических структур.
Осложнения. Наиболее частыми
осложнениями рака прямой кишки являются острая непроходимость кишечника,
перфорация кишки, свищи (пузырнопрямокишечный, влагалищнопрямокишечный,
параректальный).
Перфорация кишки возникает при
непроходимости вследствие чрезмерного растяжения ее стенки выше опухоли.
Возможна также перфорация кишки в зоне самой опухоли (особенно часто при ее
распаде). Перфорация в брюшную полость ведет к каловому перитониту, перфорация
в параректальную клетчатку - к развитию абсцесса или флегмоны.
Дифференциальная диагностика. Рак
прямой кишки дифференцируют от геморроя, полипов, сифилиса, туберкулеза. Как
для рака прямой кишки, так и для геморроя характерным симптомом является
выделение крови, однако при раке кровь темного цвета, измененная, иногда со
сгустками, появляется перед выделением кала или смешивается с ним, а при
геморрое кровь алого цвета, выделяется в конце акта дефекации.
Гистологическое исследование
позволяет дифференцировать рак прямой кишки от полипов, туберкулеза и сифилиса.
При сифилисе серологические реакции, а при туберкулезе бактериологические
методы исследования способствуют разрешению диагностических трудностей.Лечение.
Основным методом является хирургическое лечение. Его могут дополнять
химиотерапия и лучевой метод.
В последние годы при подготовке
кишечника к предстоящей операции используют перорально фортране, растворенный в
3 л воды. Применяют также ортоградное промывание кишечника путем введения 6-8 л
изотонического раствора через зонд, установленный в двенадцатиперстной кишке.
Реже используют бесшлаковую диету и подготовку кишечника очистительными
клизмами.
Радикальные операции при раке прямой
кишки направлены на удаление опухоли и регионарных лимфатических узлов.
Наиболее часто используют брюшнопромежностную экстирпацию прямой кишки,
переднюю резекцию прямой кишки; брюшноанальную резекцию прямой кишки с низведением
сигмовидной ободочной (или поперечной ободочной) кишки, операцию Хартманна
(обструктивная резекция).
Выбор метода радикальной операции при
раке прямой кишки определяется главным образом отдаленностью опухоли от
заднепроходного отверстия. При локализации опухоли на расстоянии менее 6-7 см
от заднего прохода прибегают к брюшнопромежностной экстирпации прямой кишки.
Расположение опухоли на расстоянии более 6-7 см от заднего прохода делает
возможным выполнение сфинктеросохраняющих операций (брюшноанальная резекция с
низведением сигмовидной ободочной кишки). При расположении опухоли выше 10-12
см от заднего прохода целесообразна передняя резекция прямой кишки.
Трансабдоминальную резекцию прямой и сигмовидной ободочной кишки с наложением
одноствольной колостомы (операция Хартманна, обструктивная резекция) производят
при расположении опухоли выше 10-12 см от заднего прохода и невозможности
выполнения по тем или иным причинам передней резекции прямой кишки (например,
при экстренной операции, выполняемой в связи с непроходимостью кишечника, когда
вмешательство производят на неподготовленной кишке).
Выбирая метод радикальной операции
при раке прямой кишки, следует учитывать также конституциональные особенности
больного, наличие и тяжесть сопутствующих заболеваний.
Брюшно промежностная экстирпация
прямой кишки (операция Кеню-Майлса) заключается в удалении всей прямой кишки и
части сигмовидной ободочной кишки с наложением одноствольной колостомы в левой
половине подвздошной области (рис. 24.4). Операция состоит из двух этапов -
брюшного и промежностного. Брюшной этап операции выполняют из нижней срединной
лапаротомии. Перевязывают и пересекают нижнюю брыжеечную артерию (и вену) ниже
отхождения от нее левой толстокишечной артерии, рассекают брыжейку сигмовидной
ободочной кишки, а саму кишку перевязывают. Мобилизуют сигмовидную и прямую
кишку. Сигмовидную ободочную кишку перевязывают и выводят в левой подвздошной
области на брюшную стенку, формируя одноствольную колостому. Рану брюшной
стенки зашивают. Переходят к промежностному этапу. Вокруг заднего прохода
накладывают и затягивают кисетный шов. На расстоянии 2-3 см от заднего прохода
окаймляющим разрезом рассекают кожу, подкожную жировую клетчатку, пересекают
заднепроходнокопчиковую связку и мышцы, поднимающие задний проход. Завершив
мобилизацию прямой кишки, ее удаляют. Промежностную рану зашивают, оставляя
дренаж в пресакральном пространстве.
Целесообразно синхронное выполнение
брюшного и промежностного этапов операции двумя бригадами хирургов, что более
полно отвечает требованиям абластики.
Переднюю резекцию прямой кишки
выполняют из нижней срединной лапаротомии. После мобилизации прямой кишки ее
пересекают на 4-5 см ниже опухоли. Пересекают сигмовидную ободочную кишку
(удаляя тем самым подлежащий резекции участок кишки) и накладывают анастомоз
между сигмовидной ободочной кишкой и культей прямой кишки В пресакральное
пространство вводят дренаж, а в кишку через задний проход - зонд, проводя его
выше линии анастомоза - для декомпрессии кишки.
При брюшноанальной резекции прямой
кишки с низведением сигмовидной, нисходящей или поперечной ободочной кишки
производят нижнюю срединную лапаротомию. Мобилизуют прямую, сигмовидную и
нисходящую ободочную кишку. Рану брюшной стенки зашивают. После растяжения
заднего прохода стенку кишки рассекают по прямокишечнозаднепроходной линии и
отсепаровывают слизистую оболочку до верхнего края анального канала,
перфорируют мышечную оболочку прямой кишки над анальным каналом и отсекают
прямую кишку. Низводят прямую и сигмовидную ободочную кишку через задний проход
и отсекают сигмовидную ободочную кишку на уровне, определенном при брюшном
этапе операции. Края низведенной кишки фиксируют по окружности анального
канала.
В последние годы многие отечественные
и зарубежные хирурги отказались7 от методики иссечения слизистой оболочки
анального канала. Операцию стали выполнять с низведением через анальный канал с
сохраненной слизистой оболочкой и оставлением избытка низведенной кишки (ее
фиксируют 4-6 швами к коже вокруг ануса) длиной 4-5 см, который отсекают на
12-14е сутки после операции. Возможно также наложение анастомоза по типу
"конец в конец" между низведенной кишкой и оставшимся участком прямой
кишки.
Операцию Хартманна выполняют из
нижней срединной лапаротомии. Мобилизуют сигмовидную ободочную и прямую кишку.
Пересекают прямую кишку ниже опухоли, культю кишки ушивают. Отсекают пораженный
отдел кишки и накладывают одноствольную колостому в левой подвздошной области .
Паллиативные операции преследуют
целью лишь продление жизни больного и уменьшение его страданий. Их выполняют
при развитии выраженных симптомов кишечной непроходимости и невозможности
выполнения радикальной операции. Они заключаются в наложении двуствольной
колостомы либо сигмостомы на передней брюшной стенке в левой подвздошной
области.
Комбинированное лечение. Применение
предоперационной лучевой терапии в настоящее время считают целесообразным при
местно распространенном раке прямой кишки. В этом случае оно позволяет
увеличить операбельность и улучшить результаты хирургического лечения, повышая
частоту пятилетней переживаемости больных.
Выход опухоли за пределы стенки
кишки, инвазия параректальной клетчатки, метастазы в регионарные лимфатические
узлы являются показаниями для проведения послеоперационной лучевой терапии (с
общей дозой 60-70 Гр) и химиотерапии. Стандартным лечением рака прямой кишки,
выходящего за пределы ее стенки, или метастазов в ближайшие регионарные
лимфатические узлы считают радикальную резекцию с последующей адъювантной
терапией облучением и химиотерапией. При раке прямой кишки, ограниченном
слизистой оболочкой, в последние годы стали применять трансанальное
эндоскопическое удаление опухоли с последующей лучевой и химиотерапией.
Применяют также внутриполостную лучевую терапию.
95. Рак прямой кишки. Клиника в
зависимости от анатомической формы и локализации рака. Радикальные и
паллиативные операции. Виды расширенной лимфаденэктомии.
(см предыдущий вопрос)
96.
Дивертикулы двенадцатиперстной и тонкой кишки. Классификация. Дивертикул
Меккеля. Значение в практике. Осложнения и их клиника. Диагностика.
Дифференциальный диагноз. Лечение.
Выпячивание кишечной стенки в виде
слепого мешка называют дивертикулом, распространенность дивертикулеза - 1%,
поданным аутопсий, и 2%, по данным энтерографии. Дивертикулы, как правило,
располагаются в тощей кишке, реже - в подвздошной, они бывают единичными и
множественными (дивертикулез). Дивертикулез обнаруживают у 75% больных. Размеры
дивертикулов варьируют от 3 - 5 мм до 4-5 см, они встречаются чаще у мужчин.
Врожденные (истинные) дивертикулы
имеют все слои кишечной стенки и расположены обычно на противобрыжеечной
стороне, приобретенные (ложные) - не имеют мышечной оболочки и чаще всего
расположены на брыжеечной стороне кишки, где проходят сосуды (как и в толстой
кишке). Натяжение стенки кишки спайками на ограниченном участке ведет к
формированию тракционных дивертикулов.
Осложнения. Дивертикулы тонкой кишки
протекают бессимптомно, пока в результате бактериальной контаминации не
развиваются воспаление (дивертикулит) и последующие осложнения, наблюдающиеся у
6-10% больных. Наиболее частым из них является кровотечение. Они бывают
массивными и повторными. У больных с дивертикулами тонкой кишки и меленой надо
убедиться, что кровотечение происходит именно из этих образований. Среди
диагностических методов, которые помогут установить источник кровотечения,
более эффективны зондовая энтерография, радионуклидное исследование и
селективная ангиография (при дебите кровопотери свыше 0,5-2 мл/мин).
Реже встречаются перфорация кишки на
фоне острого дивертикулита, непроходимость, обусловленная спаечным процессом,
связанным с дивертикулитом, а также кистозный пневматоз.
Операцией выбора при дивертикулезе
является резекция пораженного участка кишки с анастомозом конец в конец. При
одиночных дивертикулах возможна операция дивертикулэктомии. Для выявления
дивертикулов тонкую кишку раздувают во время операции, вводя воздух через
назоэнтеральный зонд.
Специфическим видом истинного
дивертикула является меккелев дивертикул, встречающийся у 2-5% людей
(соотношение мужчин и женщин 3:2). Дивертикул располагается на подвздошной
кишке на расстоянии от 10 до 150 см от илеоцекального угла (в среднем 40 см у
детей и 50 см - у взрослых), имеет диаметр 0,5-2 см и длину от 1 до 26 см
(обычно 3-5 см).
Стенка дивертикула имеет то же
строение, что и подвздошная кишка, но у 20-30% больных обнаруживают
гетеротопические островки слизистой оболочки желудка, двенадцатиперстной кишки,
ткани поджелудочной железы или стенки толстой кишки (изолированные или в
сочетании).
Осложнения. Дивертикул у большинства
больных не проявляется клинически. Однако при наличии островков гетеротопии
слизистой оболочки других органов в дивертикуле могут возникать осложнения (у
15- 20% больных): 1) пептические (гетеротопическая ткань слизистой оболочки
желудка выделяет соляную кислоту и пепсин, что приводит к образованию язв на
границе со слизистой оболочкой тонкой кишки); 2) воспалительные (флегмонозный,
гангренозный, перфоративный дивертикулит); 3) кишечная непроходимость,
возникающая в результате заворота, инвагинации, спаечного перивисцерита; 4)
опухолевые.
Наиболее часто встречаются
кровотечения из пептических язв - 25- 30%, острый дивертикулит - 25%,
непроходимость - 20-25%, грыжа Литтре (меккелев дивертикул входит в состав
грыжевого содержимого) - 810%, опухоли 2%.
Кровотечения из меккелева дивертикула
проявляются, как правило, у молодых в виде гипохромной анемии или повторной
мелены в течение 1 - 3 дней. Характерными являются рецидивы кровотечений с
промежутками от 2-3 дней до 6 мес.
При остром дивертикулите больные
жалуются на острую боль в животе, тошноту, повышение температуры тела. При
объективном исследовании находят напряжение мышц брюшной стенки и симптомы
раздражения брюшины, как и при остром аппендиците.
Перфорация дивертикула возникает вследствие изъязвления
дивертикула, а также пролежня стенки каловым камнем или инородным телом. При
перфорации развивается диффузный перитонит с характерной для него клинической
картиной.
При хроническом дивертикулите спаечный
процесс в брюшной полости способствует развитию кишечной непроходимости,
которая может возникнуть и на фоне инвагинации дивертикула, заворота кишки
вокруг фиброзного тяжа (облитерированного остатка желчного протока). Ущемление
меккелева дивертикула (грыжа Литтре) чаще всего протекает по типу пристеночного
(без развития полной кишечной непроходимости) и наблюдается при паховых (50%),
пупочных (20%), бедренных (20%) и послеоперационных грыжах (10%).
В стенке дивертикула обнаруживают
иногда доброкачественные (лейомиома, фиброма, неврома, липома, гемангиоэпителиома)
и злокачественные опухоли (лейомиосаркома, карциноид, аденокарцинома).
Основным методом диагностики
дивертикула является зондовая энтерография. При этом обнаруживают
дополнительную тень в виде трубки или мешка, расположенную рядом с подвздошной
кишкой и связанную с ней. Избирательное накопление изотопа в клетках слизистой
оболочки желудка позволяет использовать радионуклидный метод для визуализации
эктопированных участков слизистой оболочки в стенке дивертикула. На
сканограммах брюшной полости в этом случае видны две зоны накопления: в
эпигастрии (желудок) и в гипогастрии (дивертикул). Точность метода - около 90%.
Хирургическое лечение показано при осложнениях дивертикула.
Основным типом операции является клиновидная резекция подвздошной кишки с
дивертикулом и ушиванием образовавшегося дефекта двухрядным швом.
Дивертикулэктомию необходимо проводить и при случайном обнаружении этого
заболевания во время внутрибрюшных операций.
97. Желчнокаменная болезнь
(камненосительство). Клиника, диагностика, дифференциальный диагноз. Показания
к хирургическому лечению. Методы лечения. Осложнения
Желчнокаменная болезнь является распространенным
заболеванием, развивающимся у людей в возрасте старше 40 лет. Особенно часто
это заболевание наблюдают среди городского населения индустриально развитых
стран Европы и Северной Америки. По данным большинства исследователей, около
10% мужчин и до 25% женщин стран Европы страдают желчнокаменной болезнью. У лиц
старше 70 лет этот показатель возрастает до 30-40%. Значительно чаще болеют
женщины.
Этиология и патогенез. Морфологическим субстратом
желчнокаменной болезни являются конкременты в желчном пузыре и в желчевыводящих
протоках, состоящие из обычных компонентов желчи - билирубина, холестерина,
солей кальция. Чаще всего встречаются смешанные камни, содержащие в большей или
меньшей пропорции указанные компоненты. При значительном преобладании одного из
компонентов говорят о холестериновых (около 90%), пигментных или известковых
конкрементах. Их размеры варьируют от 1 - 2 мм до 3 - 5 см; форма может быть
округлой, овальной, в виде многогранника и т. д.
Основным местом образования желчных конкрементов
является желчный пузырь, в очень редких случаях - желчные пути. Выделяют три
основные причины их образования: застой желчи в пузыре, нарушение обмена
веществ, воспалительные изменения в стенке желчного пузыря. При нарушении
обмена веществ имеет значение не столько уровень концентрации холестерина в
желчи, сколько изменение соотношения концентрации холестерина, фосфолипидов (лецитина)
и желчных кислот. Желчь становится литогенной при увеличении в ней концентрации
холестерина и уменьшении концентрации фосфолипидов и желчных кислот. В
пресыщенной холестерином желчи он легко выпадает в виде кристаллов из
нарушенного коллоида желчи. Известно, что желчнокаменная болезнь часто
развивается у больных с такими заболеваниями обмена веществ, как диабет,
ожирение, гемолитическая анемия.
В связи с длительным, хотя и нерезко выраженным,
застоем желчи в пузыре она инфицируется. Инфекция приводит к повреждению стенки
желчного пузыря, слущиванию ее эпителия. Возникают так называемые первичные
ядра преципитации (бактерии, комочки слизи, клетки эпителия), служащие основой
для аккумуляции выпадающих кристаллов основных составных частей желчи, находившихся
до этого в коллоидном состоянии. Далее повреждение стенки желчного пузыря
нарушает процесс всасывания некоторых компонентов желчи, изменяет их
физикохимическое соотношение, что также способствует камнеобразованию. Кроме
того, при холестазе в желчи, находящейся в желчном пузыре, может повышаться
концентрация холестерина, билирубина, кальция, что увеличивает литогенность
желчи. Этому способствуют прием богатой холестерином пищи, ожирение, прием
оральных контрацептивов.
Клиническая картина и диагностика. Желчнокаменная
болезнь может протекать бессимптомно. Конкременты в желчном пузыре обнаруживают
как случайную находку при обследовании пациентов по поводу другого заболевания,
при операциях на органах брюшной полости или во время вскрытия. Наиболее часто
желчнокаменная болезнь проявляется печеночной (желчной) коликой. Причинами
возникновения болевого приступа являются ущемление конкремента в шейке желчного
пузыря или пузырном протоке, повышение давления в желчном пузыре или протоках
вследствие нарушения оттока желчи. Боли возникают чаще всего после погрешности
в диете (жирная, острая пища), при физической нагрузке, психоэмоциональном
напряжении, тряской езде, имеют интенсивный режущий, колющий, раздирающий, реже
приступообразный характер, локализуются в правом подреберье и эпигастральной
области. Боли часто иррадиируют в поясничную область, правую лопатку, правое
предплечье (раздражение ветвей правого диафрагмального нерва), реже - в область
сердца, симулируя приступ стенокардии (симптом Боткина, холецистокоронарный
симптом).
Часто приступ печеночной колики сопровождается
тошнотой и многократной рвотой с примесью желчи, не приносящей больному
облегчения. Колика может длиться от нескольких минут до нескольких часов.
Больные при этом беспокойны, часто меняют позу, стараясь найти удобное
положение, при котором уменьшается интенсивность боли. Температура тела во
время приступа остается нормальной. При осмотре отмечается умеренная тахикардия
- до 100 ударов в 1 мин. Язык влажный, обложен беловатым налетом. Обращает на
себя внимание некоторое вздутие живота, правая половина брюшной стенки иногда
отстает при акте дыхания. При перкуссии и пальпации живота возникает резкая
болезненность в правом подреберье, особенно в месте проекции желчного пузыря.
Защитное напряжение мышц отсутствует или выражено незначительно. Определяются
положительные симптомы Ортнера, Георгиевского-Мюсси (болезненность при
надавливании между ножками грудиноключичнососцевидной мышцы). Симптомов
раздражения брюшины нет. Количество лейкоцитов в крови нормальное. Приступ
болей проходит самостоятельно или после введения спазмолитических средств,
способствующих восстановлению оттока желчи.
98.
Острый холецистит. Этиология, патогенез. Классификация. Клиника. Диагностика.
Дифференциальный диагноз
Острое воспаление желчного пузыря
является одним из наиболее частых осложнений желчнокаменной болезни. Острый
холецистит при желчнокаменной болезни называют "каменным" в
противоположность "бескаменному", возникающему при отсутствии камней
в желчном пузыре.
Этиология и патогенез. Каменный холецистит возникает
примерно у 25% больных хроническим калькулезным холециститом. Бескаменный
холецистит встречается редко, наблюдается только у 5-10% больных острым
холециститом. Основные причины развития острого холецистита: нарушение оттока
желчи (чаще всего при блокаде шейки или пузырного протока конкрементом),
растяжение стенок пузыря и связанная с этим ишемия стенки, микрофлора в
просвете пузыря. В желчный пузырь микрофлора попадает восходящим путем из
двенадцатиперстной кишки, нисходящим путем - с током желчи из печени, куда
инфекция попадает с током крови, реже - лимфогенным и гематогенным путями.
У подавляющего большинства больных
хроническим калькулезным холециститом желчь содержит микрофлору. Однако острый
воспалительный процесс возникает лишь при нарушении оттока желчи.
Второстепенное значение имеют ишемия стенки пузыря и повреждающее действие
панкреатического сока на слизистую оболочку пузыря при панкреатобилиарном
рефлюксе.
Клиническая картина и диагностика. Различают следующие
клиникоморфологические формы острого холецистита: катаральный, флегмонозный и
гангренозный (с перфорацией желчного пузыря или без нее).
Катаральный холецистит характеризуют
интенсивные постоянные боли в правом подреберье, эпигастральной области с иррадиацией
в правую лопатку, плечо, правую половину шеи. В начале заболевания боли могут
носить приступообразный характер за счет усиленного сокращения стенки желчного
пузыря', направленного на ликвидацию окклюзии шейки пузыря или пузырного
протока. Часто возникает рвота желудочным, а затем дуоденальным содержимым, не
приносящая пациенту облегчения. Температура тела повышается до субфебрильных
цифр. Развивается умеренная тахикардия до 80-90 ударов в 1 мин, иногда
наблюдается некоторое повышение артериального давления. Язык влажный, может
быть обложен беловатым налетом. Живот участвует в акте дыхания, отмечается лишь
некоторое отставание верхних отделов правой половины брюшной стенки в акте
дыхания. При пальпации и перкуссии живота возникает резкая болезненность в
правом подреберье, особенно в области проекции желчного пузыря. Напряжение мышц
брюшной стенки отсутствует или выражено незначительно. Симптомы Ортнера, Мерфи,
Георгиевского-Мюсси положительные. У 20% больных можно прощупать увеличенный,
умеренно болезненный желчный пузырь. В анализе крови отмечают умеренный
лейкоцитоз (10-12 • 109/л).
Катаральный холецистит, как и
печеночную колику, у большинства больных провоцируют погрешности в диете. В
отличие от колики приступ острого катарального холецистита бывает более
продолжительным (до нескольких суток) и сопровождается неспецифическими
симптомами воспалительного процесса (гипертермия, лейкоцитоз, увеличение СОЭ).
Флегмонозный холецистит имеет более
выраженную клиническую симптоматику: боли значительно интенсивнее, чем при
катаральной форме воспаления, усиливаются при дыхании, кашле, перемене
положения тела. Чаще возникают тошнота и многократная рвота, ухудшается общее
состояние больного, температура тела достигает фебрильных цифр, тахикардия
возрастает до 100 ударов в 1 мин и более. Живот несколько вздут за счет пареза
кишечника, при дыхании больной щадит правую половину брюшной стенки, кишечные
шумы ослаблены. При пальпации и перкуссии живота возникает резкая болезненность
в правом подреберье, здесь же отмечается выраженная мышечная защита; нередко
можно определить воспалительный инфильтрат или увеличенный болезненный желчный
пузырь. При исследовании определяются положительный симптом Щеткина-Блюмберга в
правом верхнем квадранте живота, симптомы Ортнера, Мерфи, Георгиевского-Мюсси,
лейкоцитоз до 12-18 • 109/л со сдвигом формулы влево, увеличение
СОЭ.
Отличительным признаком флегмонозного
процесса является переход воспаления на париетальную брюшину. Отмечается
увеличение желчного пузыря: стенка его утолщена, багровосинюшного цвета. На
покрывающей его брюшине имеется фибринозный налет, в просвете - гнойный
экссудат. Если при катаральной форме острого холецистита при микроскопическом
исследовании отмечают лишь начальные признаки воспаления (отек стенки пузыря, гиперемия),
то при флегмонозном холецистите выявляют выраженную инфильтрацию стенки пузыря
лейкоцитами, пропитывание тканей гнойным экссудатом, иногда с образованием
мелких гнойников в стенке пузыря.
Гангренозный холецистит обычно
является продолжением флегмонозной стадии воспаления, когда естественные
защитные механизмы организма не в состоянии ограничить распространение
вирулентной микрофлоры. На первый план выступают симптомы выраженной
интоксикации с явлениями местного или общего гнойного перитонита, что особенно
выражено при перфорации стенки желчного пузыря. Гангренозную форму воспаления
наблюдают чаще у людей пожилого и старческого возраста со сниженными
регенеративными способностями тканей, снижением реактивности организма и
нарушением кровоснабжения стенки желчного пузыря за счет атеросклеротического
поражения абдоминальной части аорты и ее ветвей.
При переходе воспалительного процесса
в гангренозную форму может наступить некоторое уменьшение болевых ощущений и
кажущееся улучшение общего состояния больного. Это связано с гибелью
чувствительных нервных окончаний в желчном пузыре. Однако довольно быстро этот
период мнимого благополучия сменяют нарастающая интоксикация и симптомы
распространенного перитонита. Состояние больных становится тяжелым, они вялы,
заторможены. Температура тела фебрильная, развивается выраженная тахикардия (до
120 ударов в 1 мин и более), дыхание учащенное и поверхностное. Язык сухой,
живот вздут за счет пареза кишечника, правые его отделы не участвуют в акте
дыхания, перистальтика резко угнетена, а при распространенном перитоните
отсутствует. Защитное напряжение мышц передней брюшной стенки становится более
выраженным, выявляются симптомы раздражения брюшины. Перкуторно иногда
определяют притупление звука над правым латеральным каналом живота. В анализах
крови и мочи высокий лейкоцитоз с резким сдвигом лейкоцитарной формулы влево,
увеличение СОЭ, нарушение электролитного состава крови и кислотноосновного
состояния, в моче - протеинурия, цилиндрурия (признаки деструктивного воспаления
и тяжелой интоксикации).
Острый холецистит у лиц пожилого и
особенно старческого возраста со снижением обшей реактивности организма и
наличием сопутствующих заболеваний имеет стертое течение: нередко отсутствуют
интенсивные болевые ощущения, защитное напряжение мышц передней брюшной стенки
не выражено, нет высокого лейкоцитоза. В связи с этим возникают довольно
серьезные затруднения в диагностике острого холецистита, оценке состояния и
выборе метода лечения.
В типичных случаях диагностика
острого холецистита не представляет серьезных проблем. Вместе с тем сходная
клиническая картина может возникать при остром аппендиците, остром панкреатите,
перфоративной язве желудка и двенадцатиперстной кишки, почечной колике и
некоторых других острых заболеваниях органов брюшной полости.
Среди инструментальных способов
диагностики острого холецистита ведущая роль принадлежит ультразвуковому
исследованию, при котором можно выявить утолщение стенки желчного пузыря,
конкременты в его просвете, экссудат в подпеченочном пространстве. Из
инвазивных методов исследования большое распространение получила лапароскопия,
позволяющая визуально оценить характер морфологических изменений в желчном
пузыре. Оба этих способа могут быть использованы и в качестве лечебных процедур
в сочетании с пункцией желчного пузыря и его наружным дренированием.
99. Острый холецистит. Хирургическая
тактика. Показания к хирургическому вмешательству. Виды операций по срочности
выполнения. Доступы. Анестезия
Лечение. Все больные острым холециститом
должны находиться в стационаре под постоянным наблюдением хирурга. При наличии
симптомов местного или распространенного перитонита показана экстренная
операция. В остальных случаях проводят консервативное лечение. Ограничивают
прием пищи, разрешая лишь щелочное питье (кислое желудочное содержимое, белки и
жиры стимулируют выделение кишечных гормонов, усиливающих моторную деятельность
желчного пузыря и секреторную активность поджелудочной железы). Для уменьшения
болей применяют ненаркотические анальгетики.
Наркотические анальгетики применять
нецелесообразно, так как выраженное аналгезирующее действие препаратов может,
значительно уменьшив болевые ощущения, затушевать объективные признаки
воспаления (перитонеальные симптомы), затруднить диагностику. Кроме того, наркотические
анальгетики, вызывая спазм сфинктера Одди, способствуют развитию желчной
гипертензии и нарушению оттока панкреатического сока, что крайне нежелательно
при остром холецистите.
Болевые ощущения могут быть уменьшены
благодаря применению холинолитических спазмолитических (атропин, платифиллин,
баралгин, ношпа и т. п.) средств. На область правого подреберья кладут пузырь
со льдом для уменьшения кровенаполнения воспаленного органа. Применение теплой
грелки абсолютно недопустимо, так как при этом значительно увеличивается
кровенаполнение желчного пузыря, что ведет к дальнейшему прогрессированию
воспалительного процесса и развитию деструктивных изменений. Для подавления
активности микрофлоры назначают антибиотики широкого спектра действия, за
исключением препаратов тетрациклинового ряда, обладающих гепатотоксическими
свойствами. Для дезинтоксикации и парентерального питания назначают инфузионную
терапию в общем объеме не менее 2-2,5 л растворов в сутки.
На фоне лечения проводят постоянное
наблюдение за больным: фиксируют изменения субъективных ощущений и объективных
симптомов болезни. Целесообразно вести индивидуальную карту наблюдения, в
которой отмечают через каждые 3-4 ч частоту пульса, величину артериального
давления, температуру тела, количество лейкоцитов в крови. Таким образом,
оценивают эффективность проводимого лечения, судят о течении воспалительного
процесса.
При остром холецистопанкреатите
комплекс лекарственной терапии должен включать также препараты, применяемые для
лечения острого панкреатита.
У большинства пациентов возможно
купирование приступа острого холецистита. В процессе наблюдения и лечения
необходимо обследовать больного; для выявления конкрементов в желчном пузыре -
произвести УЗИ. При их обнаружении и отсутствии противопоказаний (тяжелые
заболевания жизненно важных органов) больного целесообразно оперировать в
плановом порядке через 24-72 ч или через 2-3 нед после стихания острого
приступа.
Если на фоне проводимого лечения
острого холецистита в течение 48- 72 ч состояние больного не улучшается,
продолжаются или усиливаются боли в животе и защитное напряжение брюшной
стенки, учащается пульс, сохраняется на высоком уровне или поднимается
температура, увеличивается лейкоцитоз, то показано срочное хирургическое
вмешательство для предупреждения перитонита и других тяжелых осложнений.
В последние годы для лечения острого
холецистита у больных с повышенным операционным риском успешно применяют
пункции и наружное дренирование желчного пузыря. Под контролем лапароскопа или
УЗИ пунктируют желчный пузырь, через ткань печени эвакуируют его инфицированное
содержимое (желчь, гной), после чего в просвете пузыря устанавливают гибкий
пластмассовый катетер для аспирации содержимого и местного введения
антибиотиков. Это позволяет остановить развитие воспалительного процесса,
деструктивных изменений в стенке желчного пузыря, быстро добиться
положительного клинического эффекта, избежать вынужденных, рискованных для
больного оперативных вмешательств на высоте процесса и не производить
оперативное вмешательство без надлежащей предоперационной подготовки.
Ситуация значительно усложняется при
развитии обтурационной желтухи на фоне острого холецистита. Болезнь может
осложниться холангитом, повреждением гепатоцитов, дальнейшим усугублением
интоксикации, развитием печеночнопочечной недостаточности. Обтурационная
желтуха развивается нередко у лиц пожилого и старческого возраста,
компенсаторные возможности организма которых весьма ограничены, и оперативное
вмешательство на фоне острого холецистита представляет большой риск. В этой
ситуации перспективной является срочная эндоскопическая папиллотомия.
Через биопсийный канал дуоденоскопа в
большой сосочек двенадцатиперстной кишки вводят тонкую канюлю, после чего с
помощью специального папиллотома рассекают его верхнюю стенку. При этом
конкременты из протоков либо отходят самостоятельно, либо их удаляют
специальными щипчиками с помощью петли (корзинки) Дормиа или зонда Фогарти.
Такая манипуляция позволяет ликвидировать желчную и панкреатическую
гипертензию, уменьшить желтуху и интоксикацию. В последующем выполняют операцию
на желчном пузыре в плановом порядке.
Холецистэктомия - основное
оперативное вмешательство, выполняемое при остром холецистите. Удаление
желчного пузыря может представлять значительные трудности в связи с выраженными
воспалительными изменениями в окружающих его тканях. Поэтому рекомендуют
удалять пузырь "от дна". Холецистэктомия при наличии показаний должна
быть дополнена интраоперационным исследованием внепеченочных желчных протоков
(холангиографией). При обнаружении холедохолитиаза или стеноза терминального
отдела общего желчного протока производят те же манипуляции, которые принято
делать в аналогичных случаях при плановых операциях у больных хроническим
калькулезным холециститом (холедохотомия, Тобразный дренаж и др.). В брюшной
полости оставляют дренаж для контроля за крово и желчеистечением.
Летальность после холецистэктомии,
выполненной по поводу острого холецистита, составляет 6 - 8%, достигая улиц
пожилого и старческого возраста 1520%.
Холецистостомия с удалением
конкрементов и инфицированного содержимого желчного пузыря показана в редких
случаях, в качестве вынужденной меры при общем тяжелом состоянии пациента и
массивном воспалительном инфильтрате вокруг желчного пузыря, особенно у лиц
пожилого и старческого возраста. Эта операция позволяет лишь ликвидировать
острые воспалительные изменения в стенке желчного пузыря. В отдаленные сроки
после операции, как правило, в желчном пузыре вновь образуются конкременты и
больных приходится оперировать повторно.
100.
Желчнокаменная болезнь, осложненная обтурационной желтухой. Причины
доброкачественной механической желтухи. Клиника. Диагностика. Дифференциальный
диагноз. Хирургическая тактика. Предоперационная подготовка
Холедохолитиаз - наличие конкрементов
в общем желчном протоке - одно из наиболее частых осложнений желчнокаменной
болезни. Улиц пожилого и старческого возраста холедохолитиаз наблюдают в 2-3
раза чаще. Конкременты в общий желчный проток попадают в подавляющем
большинстве случаев из желчного пузыря. Миграция их возможна при коротком
широком пузырном протоке, пролежне в области шейки желчного пузыря или кармана
Гартмана с образованием широкого свища между желчным пузырем и общим желчным
протоком. У некоторых больных (1-4%) возможно первичное образование конкрементов
в желчевыводящих путях.
Холедохолитиаз может длительное время
протекать бессимптомно. Даже при множественных конкрементах в общем печеночном
и общем желчном протоках нарушения пассажа желчи возникают далеко не всегда.
Желчь как бы обтекает конкременты, находящиеся в общем желчном протоке,
свободно поступая в двенадцатиперстную кишку. При миграции конкрементов в
наиболее узкие отделы общего печеночного и общего желчного протоков - его
терминальный отдел и в ампулу большого сосочка двенадцатиперстной кишки - может
возникнуть препятствие оттоку желчи в кишечник, что клинически проявляется
обтурационной желтухой. Камень может изменить свое положение при возникшей
желчной гипертензии. Это приведет к восстановлению оттока желчи до следующего
обострения. Такие камни называют вентильными. При ущемлении конкремента в
ампуле большого сосочка двенадцатиперстной кишки наряду с нарушением оттока
желчи и обтурационной желтухой происходит нарушение оттока панкреатического
сока, часто развивается острый или хронический билиарный панкреатит.
Желтуха является основным клиническим
признаком холедохолитиаза. Иногда она носит ремиттирующий характер - при
наличии так называемого вентильного камня терминального отдела общего желчного
протока. При стойкой окклюзии камнем терминального отдела общего желчного
протока возникает гипертензия в желчных путях. Клинически это проявляется
тупыми болями в правом подреберье и желтухой. При дальнейшем повышении давления
во внепеченочных желчных протоках просвет последних расширяется и конкремент
как бы всплывает и перемещается в проксимальные отделы общего печеночного и
общего желчного протоков, желтуха уменьшается и может вовсе исчезнуть на
некоторое время.
При традиционном методе лечения общий желчный проток
вскрывают при выполнении открытой холецистэктомии и после удаления камней
дренируют его Тобразной трубкой сроком на 37 дней. Это увеличивает
продолжительность операции и период восстановления, а также частоту осложнений
и летальность. Лапароскопическая холедохотомия также возможна, но требует
высокого технического мастерства и поэтому выполняется лишь в отдельных
центрах. Поэтому наиболее предпочтительным является эндоскопический метод
лечения, который применяется в большинстве клиник.
Эндоскопическое удаление камней из общего желчного
протока выполняют в амбулаторных условиях под местной анестезией. После ЭРХПГ
через фатеров сосок вводят баллонный катетер или корзину Дормиа. Обычно перед
этим рассекают сфинктер Одди, что облегчает извлечение камней, но в тех
случаях, когда камни мелкие, сфинктеротомия необязательна или вместо нее можно
выполнить сфинктеропластику (баллонную дилатацию сфинктера), которая позволяет
сохранить функцию сфинктера. Эндоскопическая сфинктеротомия в 510% случаев
осложняется развитием панкреатита, кровотечения, перфораций, а в отдаленном
периоде - стенозом. Традиционная ЭРХПГ позволяет удалить камни из общего
желчного протока в 85% случаев. Крупные камни (более 18 мм в диаметре) следует
сначала раздробить. Это обычно делают с помощью механического литотриптора,
вводимого через эндоскоп. Применение более сложных методов, в частности
контактной литотрипсии импульсным лазером или ударноволновой либо
экстракорпоральной ударноволновой литотрипсии, позволяет повысить число
успешных результатов до 90%. В тех случаях, когда удалить камни бывает
технически трудно, и при тяжелом общем состоянии больного можно прибегнуть к
временному или длительному стентированию. Больным с восходящим холангитом
экстренное дренирование желчных протоков часто позволяет спасти жизнь.
101. Желчнокаменная болезнь, осложненная
механической желтухой. Очередность диагностической программы Диаметр холедоха
по данным УЗИ, рентгенологического и визуального исследования. Виды
холедохотомий, холедохостомий, билиодигестивных анастомозов. Эндоскопические
методы лечения, их плюсы и минусы. Минилапаротомный доступ
Хронический склерозирующий холангит
-хроническое воспаление желчных путей, сопровождающееся утолщением и склерозам
их стенок, которое приводит к обструкции внутрипеченочных желчных протоков. В большинстве
случаев это генерализованный процесс, захватывающий все желчные пути. Различают
первичный и вторичный склерозирующий холангит, возникающий на фоне
желчнокаменной болезни, после хирургических манипуляций и цирроза печени.
Этиология склерозирующего холангита неизвестна.
Клинически заболевание проявляется
безболевой обтурационной желтухой. Кожные покровы больных приобретают
бронзовожелтую окраску. Диагноз нередко становится ясным после исключения рака
желчных путей. При консервативном лечении применяют стероидные гормоны,
иммунодепрессанты, антибиотики. При оперативном лечении, когда позволяют
анатомические условия, накладывают билиодигестивные анастомозы, в отдельных
случаях производят трансплантацию печени. Результаты как оперативного, так и
консервативного лечения неудовлетворительные.
Рубцовые стриктуры большого сосочка
двенадцатиперстной кишки и терминального отдела общего желчного протока
возникают при повреждении слизистой оболочки сосочка конкрементами,
воспалительным процессом. Стриктуры могут быть ограниченными по протяженности -
от нескольких миллиметров до 1-1,5 см и тубулярными, при которых имеется
концентрическое сужение терминального отдела общего желчного протока на
протяжении 2-2,5 см и более. Такое условное подразделение стриктур удобно для
выбора оптимального способа коррекции этого осложнения во время операции.
Рубцовые стриктуры, как правило, не
имеют патогномоничных клинических симптомов. При выраженном стенозе
терминального отдела общего желчного протока появляются симптомы холецистопанкреатита,
острого или хронического билиарного панкреатита, обтурационной желтухи,
холангита. Нередко стриктуры сочетаются с холедохолитиазом.
Рубцовые стриктуры подлежат
реконструктивному оперативному лечению либо миниинвазивному вмешательству в виде
расширения стенотического участка баллоном и последующей установкой
металлического стента в этом месте.
Холедох диаметр ≤6 мм по данным узи. При
мануальном обследовании не более 10 мм
Холедохотомия операция, применяемая
для обследования, дренирования, удаления камешков из протока. Проток дренируют
при холангитах для отведения инфицированого содержимого протоков наружу.
Различают три вида холедохотомий: супрадуоденальную, ретродуоденальную и
трансдуоденальную.После удаления камня проток тщательно ушивают тонкими
кетгутовыми швами и закрывают вторым рядом швов, накладываемых на брюшину. К
месту вскрытия протока подводят тампон, так как при самом тщательном ушивании
желчь может просачиваться меж швами и вызвать желчный перитонит.
Холедоходуоденостомия образование
соустья меж желчным протоком и двенадцатиперстной кишкой. Эта операция делается
при сужениях либо непроходимых стриктурах желчного протока. Как недостаток
холедоходуоденостомии надо отметить возможность попадания дуоденального
содержимого в проток. Однако опыт указывает, что при обычном оттоке желчи это
не сопровождается опасными последствиями. Кратковременные вспышки инфекции
желчных путей купируют антибиотиками
Лапароскопическая холецистэктомия.
Для проведения видеолапароскопической холецистэктомии необходимы специальная
аппаратура и инструменты. Операция проводится под общим обезболиванием.
Пациенту вводят в брюшную полость через проколы брюшной стенки 4-5 троакаров.
Через один из них вводят некоторое количество воздуха, чтобы создать
необходимое пространство для манипуляций. Давление воздуха в брюшной полости
поддерживается на одном уровне. Через второй канал вводится осветительная
аппаратура с видеокамерой, передающей изображение операционного поля на
специальный монитор. Оставшиеся троакары используют для введения специальных
инструментов, рассекающих ткани, для остановки кровотечения, наложения клипс на
пузырную артерию и пузырный проток, что позволяет затем пересекать эти
анатомические структуры. Имеется специальный инструмент для сшивания тканей и
завязывания узлов с помощью введенных лигатур.
Техника лапароскопического удаления
желчного пузыря принципиально не отличается от общепринятой методики. Этапы
операции те же, что и при открытой холецистэктомии. Хирург следит за своими
манипуляциями, глядя на монитор, а не в рану, как при обычной открытой
операции.
Летальность при лапароскопической
холецистэктомии составляет доли процента, но несколько возрастает ятрогенное
повреждение желчных протоков (до 0,3% и выше). В настоящее время
лапароскопическая холецистэктомия считается "золотым стандартом" в
хирургическом лечении желчнокаменной болезни и ее осложнений. Она отличается от
традиционной открытой холецистэктомии малой травматичностью и значительным
сокращением послеоперационного и реабилитационного периодов.
Конкуренцию лапароскопической
холецистэктомии может составить открытая холецистэктомия из минилапаротомного
доступа длиной 3 - 5 см. При этой операции используются специальные инструменты
и осветители, которые значительно дешевле видеолапароскопической аппаратуры.
Холецистэктомия из минилапаротомного доступа по всем параметрам не уступает
лапароскопической.
Показанием к хирургическому лечению
калькулезного холецистита являются частые тяжелые приступы печеночной колики,
наличие в пузыре крупных камней, способных вызвать пролежень стенки пузыря с
последующим образованием пузырнокишечного свища, опасность развития рака
желчного пузыря, который возникает у 5% больных, длительно страдающих
желчнокаменной болезнью. Не меньшую опасность представляют мелкие камни пузыря,
которые могут закупоривать пузырный проток, проникать в общий желчный проток и
вызывать механическую желтуху, холангит, билиарный острый или хронический
панкреатит. Оперативному лечению подлежат больные, которые не испытывают
полного исчезновения симптомов болезни между приступами.
102.
Желчнокаменная болезнь. Клиника в зависимости от локализации камня. Осложнения:
водянка, эмпиема, сморщенный желчный пузырь. Синдром Мириззи. Холангит.
Клиника. Диагностика. Дифференциальный диагноз. Лечение
Клиническая картина и диагностика. После прекращения приступа печеночной
колики пациенты могут чувствовать себя здоровыми (бессимптомная стадия
хронического холецистита). Однако нередко у них сохраняются симптомы болезни,
характерные для хронического холецистита - тяжесть и тупые боли в правом
подреберье, усиливающиеся после еды, особенно при погрешности в диете,
метеоризм, понос после жирной пищи, чувство горечи во рту и изжога, связанные с
дуоденогастральным и гастроэзофагеальным рефлюксами. Первичнохронический
калькулезный холецистит может протекать с указанными симптомами без приступов
печеночной колики
Холангит - острое или хроническое
бактериальное воспаление внутри и внепеченочных желчных путей. Возникает чаще
всего при холедохолитиазе, а также при других заболеваниях, сопровождающихся
механической желтухой. Холестаз способствует развитию имеющейся в желчи
инфекции, стенки желчных протоков воспаляются. По характеру морфологических
изменений в стенках желчных протоков выделяют катаральный и гнойный холангит,
по клиническому течению - острый и хронический.
Клинически острый холангит
характеризуется внезапным повышением температуры тела до фебрильных цифр,
потрясающим ознобом, тяжестью и тупыми болями в правом подреберье, тошнотой и
рвотой. При остром гнойном холангите боли имеют интенсивный характер, рано
появляется желтуха, которая связана не только с затруднением оттока желчи, но и
с поражением печеночной паренхимы. Потрясающие ознобы, высокая температура
тела, учащение дыхания, тахикардия, повышение числа лейкоцитов характерны для
синдрома системной реакции на воспаление - грозного предвестника возможной
декомпенсации функции жизненно важных органов, развития полиорганной
недостаточности, септического состояния, септического шока. При указанных симптомах
системной реакции на воспаление необходимы неотложные меры для того, чтобы не
допустить дальнейшего развития осложнений.
При физикальном исследовании больных
отмечают болезненность в правом подреберье, умеренно выраженную мышечную защиту
(при гнойном холангите). Симптомы раздражения брюшины отсутствуют. У
большинства больных можно прощупать нижний край увеличенной болезненной печени.
При прогрессирующем бурном течении гнойного холангита образуются мелкие
гнойники в стенках желчных протоков, в толще паренхимы печени и на ее
поверхности, что приводит к образованию множественных холангиогенных абсцессов
печени, абсцессов в поддиафрагмальном или подпеченочном пространстве. Это
свидетельствует о генерализации инфекции, т.е. сепсиса, и
неблагоприятном прогнозе.
Водянка желчного пузыря закупорка
пузырного протока камнем или рубцовое его сужение до полной облитерации
просвета. Закупорке способствует узость просвета протока (3 мм) при длине 3-7
см. Развитию водянки предшествует воспалительный процесс в пузыре и ослабленная
инфекция.
При прекращении доступа желчи в
пузырь остатки желчи в пузыре всасываются его стенками. При хроническом
воспалении стенки пузыря в его просвет выделяется воспалительный экссудат и
слизь. При отсутствии опорожнения пузыря прозрачный серознослизистый экссудат
растягивает его иногда до огромных размеров и стенки его истончаются, складки
слизистой сглаживаются, она атрофируется. Жидкость может быть стерильной, так
как бактерии погибают.
Симптомы. Водянка пузыря начинается с
печеночной колики (интенсивные боли в правом подреберье с отдачей в правое
плечо или лопатку, часто после приема жирной и острой пищи или тряской езды,
успокаивающиеся после введения морфина, пантопона).
По окончании колик температура
повышается до 37-38°С, остаются тупые боли, местная болезненность и мышечное
напряжение под реберной дугой у края прямой мышцы. Затем картина острого
холецистита несколько стихает, температура падает, боли уменьшаются, но в
брюшной полости определяется овальной формы эластическое тело (соответственно
области пузыря), слегка болезненное и имеющее маятникообразную подвижность
(фиксация у шейки).
Эмпиема желчного пузыря острое
гнойное воспаление желчного пузыря, сопровождающееся скоплением значительного
количества гноя в полости желчного пузыря.
Эмпиема желчного пузыря, как правило,
возникает как осложнение острого холецистита при стойкой обструкции пузырного
протока, способствующей инфицированию застойной желчи гноеродными бактериями.
Клиническая картина напоминает острый
холецистит и проявляется высокой лихорадкой, сильной болью в правом подреберье,
выраженным лейкоцитозом и часто резкой слабостью.
Эмпиема желчного пузыря сопряжена с
высоким риском перфорации желчного пузыря и сепсиса, вызванного
грамотрицательными бактериями. При подозрении на нее показаны неотложное
хирургическое вмешательство и назначение антибиотиков.
Прогрессирование воспалительного
процесса приводит к переходу острой эмпиемы в гангрену желчного пузыря.
Тотальный гангренозный холецистит
встречается сравнительно редко. Некрозы стенок чаще всего наблюдаются на более
или менее ограниченном участке, преимущественно на дне, возможны и в других
местах, особенно над вдавленным в стенку камнем. Встречается полный некроз
слизистой пузыря, при котором она отделяется почти целиком. Тотальный некроз
пузыря может развиться при тромбозе пузырной артерии.
Большое значение в развитии
гангренозной формы холецистита имеет тяжесть инфекции, развивающейся на фоне
аллергической сенсибилизации больного.
Реальную распространённость эмпиемы
желчного пузыря оценить достаточно трудно, но по данным ограниченного
количества исследований развитие данного осложнения при остром холецистите
наблюдается приблизительно в 515% случаев.
В результате перенесенных тяжелых
воспалительных, некротических и деструктивных процессов в дальнейшем нередко
наступает резкое рубцовое сморщивание пузыря. Он тогда не имеет вида желчного
пузыря, резко уменьшается в размерах вплоть до того, что превращается в комок
рубцовой ткани. Чаще всего он представляет собой узкий, деформированный мешок
длиной в 7-8 см, толщиной в палец, мало выступающий над поверхностью печени,
охватывающий лежащие в нем несколько камешков или один камень и содержащий еще
немного окрашенной желчью слизи и гноя. Стенки его представляют собой более или
менее однородную рубцовую ткань, местами гиалинизированную. Слои пузырной
стенки уже неразличимы. Изредка она омелотворяется.Различают 2 формы
омелотворенных желчных пузырей: гипертрофическую и атрофическую. Первая может
достигать больших размеров - головы ребенка. Атрофические пузыри очень малы,
часто погружены в печень. Стенка их иногда значительной толщины, так что ее
приходится распиливать. Редко в содержимом имеется желчь. Если не говорить о
случаях с камнями, этиологию заболевания объясняли сифилисом или туберкулезом,
хотя прямых доказательств этому не было. Такие пузыри чаще всего случайно
обнаруживались на вскрытии или при рентгеновском исследовании.
Синдром Мириззи (mirizzi) это клинический синдром,
включающий холецистит и желтуху, который развивается при заклинивании камня в
пузырном протоке. В результате возникшего воспаления происходит сдавление и
нарушение проходимости общего печеночного или общего желчного протоков.
Нарушение проходимости желчных протоков приводит в дальнейшем к развитию
холангита. Стеноз желчного протока может имитировать клинические проявления
стриктуры, обусловленной злокачественной опухолью. Острый холецистит часто
сочетается с незначительными изменениями функциональных печеночных проб, но
уровень билирубина в сыворотке крови > 50 мг/л однозначно свидетельствует о
закупорке общего желчного протока. При отсутствии лечения не исключено
образование пролежня стенки пузырного протока с последующим формированием
билиобилиарного свища и попаданием камня в общий желчный проток. Лечение синдрома
Мириззи заключается в дренировании желчных путей, назначении антибиотиков,
внутривенном введении жидкостей и холецистэктомии.
103. Постходецистэктомический сидром
(ПХЭС). Определение понятия. Причины. Клиника. Диагностики. Дифференциальный
диагноз.
Постхолецистэктомический синдром
У большинства больных желчнокаменной
болезнью оперативное лечение приводит к выздоровлению и полному восстановлению
трудоспособности. Иногда у пациентов сохраняются некоторые симптомы болезни,
бывшие у них до операции, или появляются новые. Причины этого весьма
разнообразны, тем не менее данное состояние больных, перенесших
холецистэктомию, объединяют собирательным понятием
"постхолецистэктомический синдром". Термин неудачен, так как далеко
не всегда удаление желчного пузыря служит причиной развития болезненного
состояния пациента. Основными причинами развития так называемого
постхолецистэктомического синдрома служат: 1) болезни органов пищеварительного
тракта - хронический гастрит, язвенная болезнь желудка и двенадцатиперстной
кишки, грыжи пищеводного отверстия диафрагмы, хронический колит,
рефлюксэзофагит. Эта группа болезней является наиболее частой причиной
постхолецистэктомического синдрома; 2) органические изменения в желчных путях;
оставленные при холецистэктомии конкременты в желчных протоках (так называемые
забытые камни), стриктура большого сосочка двенадцатиперстной кишки или
терминального отдела общего желчного протока, длинная культя пузырного протока
или даже оставленная при операции часть желчного пузыря, где вновь могут
образовываться конкременты, ятрогенные повреждения общего печеночного и общего
желчного протоков с последующим развитием рубцовой стриктуры (эта группа причин
связана как с дефектами оперативной техники, так и с недостаточным
интраоперационным исследованием проходимости желчных протоков); 3) заболевания
органов гепатопанкреатодуоденальной зоны - хронический гепатит, панкреатит,
дискинезия желчных протоков, перихоледохиальный лимфаденит.
Лишь болезни второй группы прямо или
косвенно связаны с выполненной ранее холецистэктомией; другие причины
возникновения синдрома обусловлены дефектами дооперационного обследования
больных и своевременно не диагностированными заболеваниями системы органов
пищеварения.
В выявлении причин, приведших к
развитию постхолецистэктомического синдрома, помогают тщательно собранный
анамнез заболевания, данные инструментальных методов исследования органов
пищеварительной системы.
При органических поражениях желчных
протоков больным показана повторная операция. Характер ее зависит от конкретной
причины, вызвавшей постхолецистэктомический синдром. Как правило, повторные
операции на желчных путях сложны и травматичны, требуют высокой квалификации
хирурга. При длинной культе пузырного протока или оставлении части желчного
пузыря их удаляют, в случае холедохолитиаза и стеноза большого сосочка
двенадцатиперстной кишки выполняют те же операции, что и при осложненном
холецистите. Протяженные посттравматические стриктуры внепеченочных желчных
путей требуют наложения билиодигестивных анастомозов с выключенной по Ру петлей
тощей кишки или с двенадцатиперстной кишкой.
В профилактике
постхолецистэктомического синдрома ведущая роль принадлежит тщательному
обследованию больных до операции, выявлению сопутствующих заболеваний органов
пищеварительной системы и их лечению в до и послеоперационном периодах. Особое
значение имеет тщательное соблюдение техники оперативного вмешательства с
исследованием состояния внепеченочных желчных путей.
104. Эхинококкоз и альвеококкоз печени.
Эпидемиология. Клиника. Диагностика. Дифференциальный диагноз. Виды операций
Эхинококкоз (гидатидный, однокамерный эхинококкоз) -
гельминтоз, характеризующийся развитием эхинококковых кист в различных
органах.Клиническая картина и диагностика. Длительное время, иногда в течение
многих лет, какиелибо клинические признаки заболевания отсутствуют. Лишь при
достижении паразитарной кистой довольно больших размеров появляются симптомы
болезни: тупые, ноющие, постоянные боли в правом подреберье, эпигастральной
области, нижних отделах правой половины грудной клетки.
При осмотре груди и живота при больших кистах можно
обнаружить выбухание передней брюшной стенки в области правого подреберья.
Перкуторно выявляют расширение верхней и нижней границ печени (гепатомегалия).
При пальпации печени определяют округлое опухолевидное образование эластической
консистенции (при локализации больших эхинококковых кист в передненижних
отделах печени).
Ухудшение состояния связано с аллергической реакцией
организма на присутствие живого паразита, что проявляется в виде крапивницы,
диареи и т. п. При сдавлении крупными кистами двенадцатиперстной или толстой
кишки возникают симптомы высокой или низкой непроходимости кишечника. При
сдавлении воротной вены или ее магистральных ветвей у ряда больных развивается
синдром портальной гипертензии.
Диагностике эхинококкоза помогают сведения о
проживании больного в местности, являющейся эндемичной по данному заболеванию;
обнаружение в клиническом анализе крови эозинофилии (до 20% и выше);
положительные серологические реакции на эхинококкоз; реакция агглютинации с
латексом, непрямой гемагглютинации, иммуноферментный анализ. Последние две
пробы чувствительны в 90-95% случаев.
При обзорной рентгенографии отмечают высокое стояние
купола диафрагмы или его выпячивание, иногда петрификацию оболочек кисты. О
локализации и размерах эхинококковой кисты можно судить по данным
радиоизотопного исследования (в месте проекции кисты виден дефект накопления
изотопа). Наиболее достоверные данные могут быть получены при ультразвуковой
эхолокации и компьютерной томографии (рис. 12.2).
Осложнения. Наиболее частыми осложнениями эхинококкоза
являются механическая желтуха, разрыв, нагноение кисты с прорывом жидкого
содержимого и оболочек в соседние и анатомические образования.
Желтуха (обтурационная) связана со сдавлением кистой
магистральных желчевыводящих путей или с прорывом мелких кист в просвет желчных
протоков и последующей их обтурацией при частичном разрыве хитиновой оболочки и
фиброзной капсулы.
Разрыв гидатидной кисты может происходить с излиянием
ее содержимого в свободную брюшную полость, в просвет пищеварительного тракта,
в желчные протоки, в плевральную полость или бронх.
Наиболее серьезным осложнением является перфорация
кисты в свободную брюшную полость. При этом возникают симптомы шока и
распространенного перитонита, весьма часты различные проявления аллергии.
Перфорация кисты в брюшную полость приводит к диссеминации паразита с развитием
в ней множественных кист. Нагноение эхинококковой кисты связано с образованием
трещины в капсуле гидатиды, особенно при наличии сообщения с желчными путями.
Находящиеся в желчи бактерии служат источником инфицирования. При нагноении
эхинококковой кисты возникают сильные боли в области печени, гипертермия и
другие симптомы тяжелой гнойной интоксикации.
Лечение. Очень редко происходит самоизлечение,
связанное с гибелью паразита и последующим обызвествлением его стенок. Высокая
частота развития серьезных осложнений диктует необходимость хирургического
лечения независимо от размеров кисты. Обязательным методом интраоперационной
ревизии является ультразвуковое исследование, позволяющее выявить мелкие
эхинококковые кисты, не обнаруженные при дооперационном обследовании.
Оптимальным способом лечения является
эхинококкэктомия. Идеальную эхинококкэктомию, при которой удаляют кисту без
вскрытия ее просвета, применяют редко - при небольших размерах кисты, краевом
расположении. Чаще удаляют кисту вместе с герминативной и хитиновой оболочками
после предварительной пункции полости кисты, аспирации ее содержимого и последующей
обработки полости противопаразитарными средствами. Этот прием позволяет
избежать разрыва кисты при выделении и тем самым предотвратить диссеминацию
зародышей паразита.
После удаления кисты фиброзную оболочку изнутри
повторно обрабатывают концентрированным раствором глицерина (85%) или 20%
раствором хлорида натрия. Затем полость кисты ушивают отдельными швами изнутри
и вворачивают наружные края фиброзной капсулы внутрь полости (капитонаж). При
невозможности ушить полость прибегают к тампонаде ее сальником. В стенках
плотной и толстой фиброзной капсулы иногда остаются дочерние мелкие пузыри.
Поэтому при благоприятных анатомических условиях рекомендуют производить
перицистэктомию, т. е. иссечение фиброзной капсулы, что делает операцию более
радикальной, но более трудной и опасной для выполнения.
При нагноении содержимого кисты после завершения
основного этапа операции оставшуюся полость дренируют. При больших размерах
кисты, а также в случае обызвествления ее стенок в качестве вынужденной меры
прибегают к марсупиализации (вшиванию стенки кисты в переднюю брюшную стенку),
которая в последние годы применяется исключительно редко. При прорыве
паразитарной кисты в желчные пути с развитием механической желтухи необходимо
вначале ликвидировать препятствие для нормального оттока желчи в
двенадцатиперстную кишку с помощью эндоскопической папиллосфинктеротомии или
выполнить наружное желчеотведение (холангиостомию под контролем ультразвукового
исследования или компьютерной томографии) и лишь в последующем прибегнуть к
операции на самой кисте.
Послеоперационная летальность при неосложненном
эхинококкозе печени обычно не превышает 1-2% и повышается в 10-15 раз при
развитии различных осложнений. Если оперативное пособие выполнено адекватно (т.
е. удалены все паразитарные кисты), то наступает выздоровление. Иммунитета к
эхинококковой болезни не существует, поэтому всем больным после операции
необходимо разъяснять способы предупреждения возврата болезни (соблюдение
элементарных правил личной гигиены).
В настоящее время имеются сообщения об использовании
"закрытых" методов лечения эхинококкоза печени с использованием
малоинвазивных технологий. Суть метода заключается в следующем. При живом
паразите и отсутствии обызвествления его оболочек под контролем ультразвукового
метода или компьютерной томографии выполняют прицельную пункцию полости кисты
тонкой иглой с последующим введением в ее просвет различных антипаразитарных
средств. После экспозиции 7-10 мин производят наружное дренирование полости
кисты, что позволяет добиться ее спадения уже через несколько дней после
операции. В последующем наружный дренаж заменяют на более толстый (диаметром
8-10 мм), через просвет которого с помощью фиброволоконного холедохоскопа
удаляют хитиновую оболочку паразита. Возможно также удаление хитиновой оболочки
паразита лапароскопическим путем. Данная методика малотравматична, легко
переносится больными и существенно сокращает сроки послеоперационной
реабилитации. Этот способ нецелесообразен при множественных (более 5)
паразитарных кистах и при существовании дочерних и внучатых кист в просвете
материнской кисты - многочисленные дренажи существенно уменьшают преимущества
малоинвазивной технологии. Абсолютным противопоказанием к использованию
пункционного дренирования под контролем ультразвукового исследования является
погибшая эхинококковая киста, особенно при обызвествлении ее стенок, так как в
этих случаях полностью удалить густое, вязкое содержимое бывает невозможно.
Послеоперационная летальность при использовании
малоинвазивных методов лечения эхинококкоза печени практически отсутствует, что
объясняется, с одной стороны, тщательным отбором больных, с другой - высокой
квалификацией хирургов, занимающихся данной проблемой. Частота рецидивов
болезни при соблюдении всех необходимых правил выполнения данной процедуры
менее 1%. Методика несомненно займет достойное место в лечении больных
эхинококкозом.
В настоящее время имеются сообщения о возможности
химиотерапевтического лечения небольших (диаметром менее 3 см) эхинококковых
кист печени с помощью препаратов мебендазолового ряда (альбендазол, тинидазол и
др.). Этот способ позволяет добиться полного излечения от эхинококкоза при
небольших размерах паразитарных кист без какоголибо вмешательства,
предотвратить диссеминацию сколексов, как это бывает при интраоперационом
разрыве паразитарной кисты.
Симптоматика альвеококкоза очень похожа на
симптоматику злокачественной опухоли печени: тупые ноющие боли в правом
подреберье, эпигастральной области, слабость, гепатомегалия, желтуха. При
больших размерах паразита в центре узла образуется полость распада. В
дальнейшем может произойти прорыв содержимого в брюшную или плевральную
полость, в полые органы. Наиболее частым осложнением альвеококкоза является
обтурационная желтуха, обусловленная сдавлением магистральных желчевыводящих
путей.
Диагностика трудна. При расспросе больного важно
выявить, не проживает ли он в местности, где встречается альвеококкоз.
Применяют те же лабораторные и инструментальные методы исследования, что и при
диагностике опухолей, эхинококкоза. Дифференцируют альвеококкоз от первичного
рака печени или метастазов опухоли в печень. Помогают уточнить диагноз
серологические пробы на альвеококкоз и прицельная пункция новообразования.
Лечение. Радикальным методом лечения является резекция
печени (атипичная или анатомическая с учетом долевого или сегментарного
строения органа). При невозможности проведения радикальной операции применяют
следующие оперативные вмешательства: удаление основной массы узла с оставлением
его фрагментов в области ворот печени, наружное или внутреннее дренирование
желчных путей при обтурационной желтухе, дренирование полости распада, введение
в толщу ткани узла противопаразитарных препаратов, криодеструкция остатков
неудаленного паразита жидким азотом. Паллиативные операции продлевают жизнь
больного, улучшают качество жизни.
В последние годы рекомендуют химиотерапию мебендазолом
и его производными (альбендазол), с помощью которого удается добиться
существенного продления жизни больных, даже при невозможности удаления
пораженного участка печени хирургическим путем.
Прогноз. При альвеококкозе прогноз заболевания гораздо
менее благоприятный, чем при гидатидном эхинококкозе. Высок процент рецидивов,
послеоперационная летальность составляет около 5%.
105.
Рак желчного пузыря и желчевыводящих протоков. Клиника. Диагностика.
Дифференциальный диагноз. Методы хирургического лечения. Виды операций.
Рак желчного пузыря занимает 5-6е место в структуре всех
злокачественных опухолей органов пищеварительного тракта. Заболеваемость раком
желчного пузыря среди населения развитых стран увеличивается так же, как и
заболеваемость желчнокаменной болезнью, чаще болеют женщины старше 50 лет. Рак
желчного пузыря в 80-100% случаев сочетается с желчнокаменной болезнью.
Повидимому, частая травматизация и хроническое воспаление слизистой оболочки
желчного пузыря являются пусковыми моментами в дисплазии эпителия пузыря с
последующим развитием рака. Рак желчного пузыря начинается обычно в области его
дна и быстро распространяется на прилежащие органы (печень, поперечная
ободочная кишка). Опухоль растет в виде полипов в просвет желчного пузыря
(экзофитный рост) или интрамурально (эндофитный рост). В этом случае
макроскопически опухоль трудно отличить от хронического фибропластического
воспаления. По гистологической структуре наиболее часто встречаются
аденокарцинома и скиррозный рак, реже - слизистый, солидный и
низкодифференцированный рак.
Клиническая картина и диагностика. На ранних стадиях развития рак
желчного пузыря протекает бессимптомно либо с признаками калькулезного
холецистита, что связано с частым сочетанием рака желчного пузыря и
желчнокаменной болезни. В более поздних стадиях также не удается выявить
патогномоничных симптомов заболевания, и лишь в фазе генерализации ракового
процесса наблюдают как общие его признаки (слабость, утомляемость, отсутствие
аппетита, похудание, анемия и др.), так и местные симптомы (увеличенная
бугристая печень, асцит и желтуха).
Холецистография малоинформативна, так
как дефект наполнения и "отключенный" желчный пузырь могут быть
выявлены как при раке желчного пузыря, так и при калькулезном холецистите.
Ценная информация может быть получена при использовании ультразвукового
исследования, компьютерной томографии. Лапароскопия также позволяет определить
размеры опухоли, границы ее распространения, наличие отдаленных метастазов,
произвести прицельную биопсию новообразования.
Лечение. Радикальные операции
(холецистэктомия) удается выполнить только при раннем раке у незначительного
числа больных. К ним относят также холецистэктомию с резекцией прилежащего
участка печени (реже объем удаляемой зоны печени расширяют до сегментэктомии
или гемигепатэктомии). Во время радикальной операции необходимо удалить
лимфатические узлы по ходу печеночнодвенадцатиперстной связки. Отдаленные результаты
радикальных операций плохие, большинство оперированных умирают в течение 6 мес.
Пятилетняя выживаемость составляет лишь несколько процентов.
Паллиативные операции выполняют при
неоперабельном раке желчного пузыря. Используют наружное дренирование желчных
протоков или внутренние билиодигестивные анастомозы, однако технически эти
операции выполнимы в редких случаях.
106. Острый панкреатит. Клиника.
Диагностика. Дифференциальный диагноз. Консервативное лечение
Острый панкреатит - заболевание
поджелудочной железы, возникающее в результате аутолиза тканей поджелудочной
железы липолитическими и активированными протеолитическими ферментами,
проявляющееся широким спектром изменений - от отека до очагового или обширного
геморрагического некроза. В большинстве случаев (около 90%) наблюдается
незначительный аутолиз тканей, сопровождающийся только отеком поджелудочной
железы и умеренными болями. В тяжелых случаях возникает жировой или
геморрагический некроз ткани с тяжелыми метаболическими нарушениями, гипотензиеи,
секвестрацией жидкости, полиорганной недостаточностью и летальным исходом.
После перенесенного острого панкреатита функции поджелудочной железы, как
правило, приходят к норме. При хроническом панкреатите сохраняются остаточные
явления с нарушением функций поджелудочной железы и периодическим обострением.
Среди неотложных хирургических
заболеваний органов брюшной полости острый панкреатит по частоте занимает 3е
место, уступая лишь острому аппендициту и острому холециститу. Более часто
заболевают лица зрелого возраста (30-60 лет), женщины - в 2 раза чаше, чем
мужчины.
Этиология и патогенез. Патогенез острого панкреатита
недостаточно изучен. Основной этиологический фактор - аутолиз паренхимы
поджелудочной железы, возникающий обычно на фоне гиперстимуляции экзокринной
функции, частичной обтурации ампулы большого дуоденального сосочка, повышения
давления в вирсунговом протоке, рефлюкса желчи в вирсунгов проток. Остро
развивающаяся внутрипротоковая гипертензия вызывает повреждение и повышение
проницаемости стенок терминальных протоков. Создаются условия для активизации
энзимов, выхода их за пределы протоков, инфильтрации паренхимы и аутолиза ткани
поджелудочной железы.
Клиническая картина и диагностика. Клинические
симптомы острого панкреатита зависят от морфологической формы, периода развития
и тяжести синдрома системной реакции на воспаление. В начальном периоде заболевания
(1-3й сутки) как при отечной (абортивной) форме панкреатита, так и при
прогрессирующем панкреатите больные жалуются на резкие, постоянные боли в
эпигастральной области, иррадиирующие в спину (опоясывающие боли), тошноту,
многократную рвоту.
Боли могут локализоваться в правом или левом квадранте
живота. Четкой связи болей с локализацией процесса в поджелудочной железе нет.
Иногда боли распространяются по всему животу. При алкогольном панкреатите боли
возникают через 12-48 ч после опьянения. При билиарном панкретите
(холецистопанкреатит) боли возникают после обильной еды. В редких случаях
острый панкреатит протекает без болей, но с резко выраженным синдромом
системной реакции, проявляющимся гипотензией, гипоксией, тахикардией,
дыхательной недостаточностью, нарушением сознания. При таком течении болезни
диагностировать острый панкреатит можно с помощью УЗИ, компьютерной томографии,
лабораторных тестов.
В ранние сроки от начала заболевания объективные
данные очень скудные, особенно при отечной форме: бледность кожных покровов,
легкая желтушность склер (при билиарном панкреатите), легкий цианоз. Пульс
может быть нормальным или ускоренным, температура тела нормальная. После
инфицирования очагов некроза она повышается, как при всяком гнойном процессе.
Живот обычно мягкий, все отделы участвуют в акте
дыхания, иногда отмечают некоторое вздутие живота. Симптом Щеткина-Блюмберга
отрицательный. Примерно у 1-2% тяжелобольных на левой боковой стенке живота
появляются синюшные, иногда с желтоватым оттенком пятна (симптом Грея Тернера)
и следы рассасывания кровоизлияний в области поджелудочной железы и
забрюшинной клетчатки, свидетельствующие о геморрагическом панкреатите. Такие
же пятна могут наблюдаться в области пупка (симптом Куллена). Перкуторно
определяется высокий тимпанит над всей поверхностью живота - парез кишечника
возникает вследствие раздражения или флегмоны забрюшинной клетчатки или
сопутствующего перитонита. При скоплении значительного количества экссудата в
брюшной полости отмечается притупление перкуторного звука в отлогих частях
живота, легче выявляющееся в положении больного на боку.
При пальпации живота отмечают болезненность в
эпигастральной области. Напряжения мышц живота в начальном периоде развития
панкреатита нет. Лишь иногда отмечают резистентность и болезненность в
эпигастрии в зоне расположения поджелудочной железы (симптом Керте). Пальпация
в левом ребернопозвоночном углу (проекция хвоста поджелудочной железы) часто
бывает болезненной (симптом МейоРобсона). При жировом некрозе поджелудочной
железы рано образуется воспалительный инфильтрат. Его можно определить при
пальпации эпигастральной области. В связи с парезом и вздутием поперечной
ободочной кишки или наличием инфильтрата не удается четко определить пульсацию
брюшной аорты (симптом Воскресенского). Перистальтические шумы уже в самом
начале развития панкреатита ослаблены, исчезают по мере прогрессирования
патологического процесса и появления перитонита. При перкуссии и аускультации
грудной клетки у ряда больных выявляется сочувственный выпот в левой
плевральной полости.
При очень тяжело протекающем панкреатите развивается
синдром системного ответа на воспаление, нарушаются функции жизненно важных органов,
возникает дыхательная недостаточность, проявляющаяся увеличением частоты
дыхания, респираторным дистресссиндромом взрослых (интерстициальный отек
легких, накопление транссудата в плевральных полостях), сердечнососудистая
недостаточность (гипотензия, частый нитевидный пульс, цианоз кожных покровов и
слизистых оболочек, уменьшение ОЦК, ЦВД, минутного и ударного объема сердца,
признаки ишемии миокарда на ЭКГ), печеночная, почечная и гастроинтестинальная
недостаточность (динамическая кишечная непроходимость, геморрагический
гастрит). У большинства больных наблюдают расстройство психики: возбуждение,
спутанное сознание, степень нарушения которого целесообразно определять по
баллам шкалы Глазго.
Функциональные нарушения печени обычно проявляются
желтушной окраской кожных покровов. При стойкой обтурации общего желчного протока
возникает механическая желтуха с повышением уровня билирубина, трансаминаз,
увеличением печени. Для острого панкреатита характерно повышение амилазы и
липазы в сыворотке крови. Значительно увеличивается концентрация амилазы
(диастазы) в моче, в экссудате брюшной и плевральной полостей. При тотальном
панкреонекрозе уровень амилазы снижается. Более специфичным исследованием для
ранней диагностики панкреатита является определение трипсина в сыворотке крови,
ахимотрипсина, эластазы, карбоксипептидазы и особенно фосфолипазы А, играющей
ключевую роль в развитии панкреонекроза. Однако сложность их определения
сдерживает широкое распространение указанных методов.
Кислотноосновное состояние претерпевает сдвиг к
ацидозу, на фоне которого увеличивается поступление внутриклеточного калия в
кровь при одновременном уменьшении выделения его почками. Развивается опасная
для организма гиперкалиемия. Снижение содержания кальция в крови
свидетельствует о прогрессировании жирового некроза, о связывании кальция
жирными кислотами, высвобождающимися в результате воздействия липазы на
жировую клетчатку в очагах некроза. Мелкие очаги стеатонекроза возникают на
сальнике, париетальной и висцеральной брюшине ("стеариновые пятна").
Содержание кальция ниже 2 ммоль/л (норма 2,10-2,65 ммоль/л, или 8,4-10,6 мг/дл)
является прогностически неблагоприятным показателем.
Диагностика острого панкреатита основывается на данных
анамнеза (появление резких болей в животе после обильной еды, приема алкоголя
или обострения хронического калькулезного холецистита), данных физикального,
инструментальных и лабораторных исследований.
Ультразвуковое исследование. Значительную помощь в
диагностике оказывает УЗИ, позволяющее установить этиологические факторы
(холецисто и холедохолитиаз), выявить отек и увеличение размеров поджелудочной
железы, скопление газа и жидкости в раздутых петлях кишечника. Признаками отека
поджелудочной железы являются увеличение ее объема, снижение эхогенности ткани
железы и
уменьшение степени отражения сигнала. При некрозе
поджелудочной железы выявляют нерезко ограниченные участки пониженной
эхогенности или полного отсутствия эхосигнала. Распространение некроза за
пределы поджелудочной железы ("дорожки некроза"), а также абсцессы и
ложные
кисты могут быть с большой точностью визуализированы
при ультразвуковом исследовании (рис. 14.3; 14.4; 14.5). К сожалению,
возможности УЗИ нередко ограничены в связи с расположением перед поджелудочной железой
раздутого газом и жидкостью, кишечника, закрывающего железу.
Компьютерная томография является более точным методом
диагностики острого панкреатита по сравнению с УЗИ. Для проведения ее нет помех.
Достоверность диагностики увеличивается при интравенозном или пероральном
усилении контрастным материалом. Компьютерная томография с усилением позволяет
более четко выявить диффузное или локальное увеличение размеров железы, отек,
очаги некроза, скопление жидкости, изменения в парапанкреатической клетчатке,
"дорожки некроза" за пределами поджелудочной железы, а также
осложнения в виде абсцессов и кист.
Магнитнорезонансная томография - более совершенный
метод диагностики. Она дает информацию, аналогичную получаемой при компьютерной
томографии.
Рентгенологическое исследование позволяет выявить
патологические изменения в брюшной полости у большинства больных: изолированную
дилатацию поперечной ободочной кишки, сегментов тощей и двенадцатиперстной
кишки, прилежащих к поджелудочной железе, иногда рентгеноконтрастные
конкременты в желчных путях, в протоке поджелудочной железы или отложения
кальция в ее паренхиме (преимущественно при алкогольном панкреатите). При
объемных процессах в поджелудочной железе (ложные кисты, воспалительные
инфильтраты, абсцессы) наблюдается изменение расположения (оттеснение в
стороны) желудка и двенадцатиперстной кишки. При рентгенологическом
исследовании выявляются признаки паралитической непроходимости кишечника,
выпот в плевральной полости, дисковидные ателектазы базальных отделов легких,
часто сопутствующие острому панкреатиту. Исследование желудка и кишечника с
контрастным веществом в остром периоде заболевания противопоказано.
Эзофагогастродуоденоскопию выполняют при желудочнокишечном
кровотечении из острых эрозий и язв, являющихся осложнениями острого (чаще
всего деструктивного) панкреатита. Ретроградная панкреатохолангиография при
остром панкреатите противопоказана, так как при этой процедуре дополнительно
повышается давление в главном протоке поджелудочной железы.
Лапароскопия показана при неясном диагнозе, при
необходимости лапароскопической установки дренажей для лечения острого
панкреатита. Лапароскопия позволяет увидеть очаги стеатонекроза (стеариновые
пятна), вспалительные изменения брюшины, желчного пузыря, проникнуть в полость
малого сальника и осмотреть поджелудочную железу, установить дренажи для оттока
экссудата и промывания полости малого сальника. При невозможности
воспользоваться лапароскопией для взятия перитонеального экссудата и проведения
диагностического лаважа можно ввести в брюшную полость так называемый
"шарящий" катетер через прокол в брюшной стенке (лапароцентез).
Электрокардиография необходима во всех случаях как для
дифференциальной диагностики с острым инфарктом миокарда, так и для оценки состояния
сердечной деятельности в процессе развития заболевания.
Дифференциальную диагностику
необходимо проводить прежде всего с тромбозом мезентериальных сосудов, так как
при этом заболевании внезапные резкие боли, шоковое состояние при мягком животе
и нормальной температуре тела могут напоминать острый панкреатит.
Паралитическая непроходимость кишечника и перитонит встречаются при обоих
заболеваниях. При неясном диагнозе целесообразно проведение верхней
мезентерикографии.
Инфаркт миокарда по клиническим
данным трудно дифференцировать от острого панкреатита, так как в острой фазе
панкреатита иногда возникают изменения ЭКГ, характерные для инфаркта миокарда.
Как в случае мезентериального инфаркта кишечника, так и при инфаркте миокарда
ультразвуковое исследование помогает дифференцировать эти заболевания. Острый
холецистит и его осложнения можно сравнительно легко отличить по типичной
клинической картине и ультразвуковой симптоматике. Острый панкреатит необходимо
дифференцировать от прободной язвы желудка и двенадцатиперстной кишки,
странгуляционной тонкокишечной непроходимости, расслаивающей аневризмы аорты,
почечной колики.
Первоочередной задачей является снятие боли и спазма
сфинктера Одди. С этой целью назначают ненаркотические анальгетики,
спазмолитики, холинолитики. При твердой уверенности в диагнозе допустимо
введение и наркотических анальгетиков. Применение препаратов морфинного ряда,
вызывающих спазм сфинктера Одди, недопустимо. Для обезболивания вводят также
внутривенно капельно глюкозоновокаиновую смесь (10 мл 1% раствора новокаина и
400 мл 5% раствора глюкозы). Наилучшее обезболивающее действие оказывает
перидуральная анестезия.
Одной из основных задач в комплексном лечении острого
панкреатита является угнетение внешнесекреторной функции поджелудочной железы. Для
предотвращения гормональной стимуляции экзокринной функции железы необходимо
полностью исключить прием пищи через рот. Показана также постоянная аспирация
содержимого желудка через назогастральный зонд. Важную роль в лечении
панкреатита отводят угнетению секреторной функции желудка с помощью блокаторов
Н2гистаминовых рецепторов, антацидов, антихолинергических препаратов
(гастроцепин, атропин).
Более эффективными средствами подавления экзокринной
функции поджелудочной железы являются цитостатики (5фторурацил, циклофосфан),
синтетические нейропептиды (даларгин), синтетические аналоги соматостатина
(сандостатин, стиламин, октэтрид). Последняя группа препаратов в настоящее
время используется редко, так как они не имеют существенных преимуществ перед
указанными выше средствами и весьма дорогостоящи.
Для борьбы с ферментной токсемией в первой фазе
острого панкреатита используют ингибиторы протеаз (трасилол, контрикал, гордокс
и др.). Эти препараты ингибируют протеолитические ферменты и калликреин и тем
самым уменьшают интоксикацию. В последние годы эффективность и целесообразность
применения их ставятся под сомнение. В поздней фазе развития острого
панкреатита применение их нецелесообразно. Влияние этих препаратов на
внешнесекреторную деятельность поджелудочной железы минимальное. Довольно
эффективным способом уменьшения ферментной токсемии является переливание
свежезамороженной плазмы, содержащей естественные антиферментные вещества, в
частности, ингибиторы трипсина, химотрипсина.
Для коррекции ОЦК внутривенно вводят растворы
коллоидных и кристаллоидных растворов под контролем уровня центрального
венозного давления и почасового диуреза. Соотношение коллоидных и
кристаллоидных растворов должно быть примерно 1:1. Крупномолекулярные растворы
(полиглюкин, желатиноль, реомакродекс, альбумин и т. п.) увеличивают
онкотическое давление крови, способствуя удержанию жидкости в сосудистом русле,
что очень важно для устранения обезвоживания организма и повышения ОЦК. Кроме
того, они связывают циркулирующие в крови токсичные продукты, оказывая тем
самым и дезинтоксикационное действие. Кристаллоидные растворы (изотонический
раствор натрия хлорида, 5% раствор глюкозы, ацесоль, трисамин и т. п.),
содержащие важнейшие электролиты - калий, натрий, хлор, кальций, вводят
внутривенно капельно под контролем ионограммы крови и показателей
кислотноосновного состояния.
Парентеральное питание является обязательным
компонентом лечения, так как питание через рот прекращают на 3 - 5 дней.
Энергетические потребности организма больного (30 калорий в день на 1 кг массы
тела с последующим повышением до 60 калорий на 1 кг массы тела в день) обеспечивают,
вводя концентрированные растворы глюкозы с инсулином, белковые гидролизаты,
растворы аминокислот. Наибольшей энергетической ценностью обладают жировые
эмульсии (интралипид, липофундин). Эти препараты применяют не только для
восстановления энергетических расходов организма, но и для стабилизации мембран
клеток поджелудочной железы, что уменьшает повреждение их ферментами и
активными кислородными радикалами.
Для дезинтоксикации часто применяют форсированный
диурез. После нормализации объема циркулирующей крови с помощью инфузионной
терапии вводят мочегонные препараты (лазикс, фуросемид). При этом с мочой
элиминируются токсины, продукты распада белков, ферменты. При тяжелой
интоксикации прибегают к плазмо и лимфосорбции, плазмаферезу. Применение этих
процедур сдерживается высокой стоимостью, иногда тяжелыми сопутствующими
реакциями и большими затратами времени. Существенного влияния на частоту летальных
исходов экстракорпоральные методы детоксикации в сравнимых группах больных не
оказывают.
Перитонеальный лаваж применяют не только для
диагностики, но и для лечения панкреонекроза (чаще всего, геморрагического).
При этом из брюшной полости удаляют экссудат, богатый протеолитическими и
липолитическими ферментами, цитокинами, кининами и другими токсичными
субстанциями, продуктами расплавленных некротизированных тканей. Перитонеальный
лаваж предупреждает всасывание токсичных продуктов и уменьшает действие токсинов
на паренхиматозные органы.
Для проведения перитонеального лаважа под контролем
лапароскопа устанавливают дренажи в верхнем этаже брюшной полости, в полости малого
таза и правом боковом канале. По верхним дренажам раствор вводят в брюшную
полость, через нижние - жидкость выделяется наружу. При этом необходимо следить
за балансом вводимой и выводимой жидкости, контролировать ЦВД, предусмотреть
возможные легочные осложнения.
Для улучшения микроциркуляции, в том числе в
поджелудочной железе, вводят реополиглюкин, небольшие дозы гепарина, применяют
управляемую гемодилюцию. Антибактериальную терапию при панкреонекрозе проводят
как для профилактики инфицирования очагов некроза, так и для лечения уже
развивающейся инфекции. Предпочтение отдают антибиотикам широкого спектра
действия (цефалоспорины 3-4го поколения, карбопенемы, аминогликозиды),
подавляющим развитие грамположительной и грамотрицательной микрофлоры.
Обязательным компонентом антибактериальной терапии является введение
метронидазола (флагил), который избирательно воздействует на неклостридиальную
микробную флору. С этой же целью применяют лаваж тонкой кишки с помощью
назоинтестинального зонда, вводимого в просвет кишечника с помощью эндоскопа.
Кишку промывают охлажденным изотоническим раствором. Данная методика позволяет
аспирировать содержимое кишечника, уменьшить число микробных тел в содержимом,
снизить давление в кишечнике, уменьшить вероятность транслокации бактерий и
эндотоксинов в брюшную полость, активизировать перистальтику.
107. Острый панкреатит. Классификации.
Показания к хирургическому лечению. Виды операций
По характеру изменений в
поджелудочной железе выделяют: 1) отечный или интерстициальный панкреатит; 2)
жировой панкреонекроз и 3) геморрагический панкреонекроз.
Отечная или абортивная форма
панкреатита развивается на фоне незначительного, микроскопического повреждения
клеток поджелудочной железы. Фаза отека может в течение 1-2 дней превратиться в
фазу некроза. При прогрессирующем панкреатите развивается жировой
панкреонекроз, который по мере развития кровоизлияний превращается в
геморрагический с образованием обширного отека в забрюшинной клетчатке и
появлением геморрагического выпота в брюшной полости (панкреатогенный
асептический перитонит). В ряде случаев наблюдаются смешанные формы панкретита:
геморрагический панкреатит с очагами жирового некроза и жировой панкреонекроз с
кровоизлияниями .
В зависимости от распространенности
процесса различают очаговый, субототальный и тотальный панкреонекроз.
По клиническому течению выделяют абортивное
и прогрессирующее течение болезни. По фазам течения тяжелых форм острого
панкреатита выделяют период гемодинамических нарушений - панкреатогенного шока,
функциональной недостаточности (дисфункции) внутренних органов и период гнойных
осложнений, наступающий через10-15 дней.
Показаниями к оперативному лечению
являются: 1) неуверенность в диагнозе; 2) лечение вторичной инфекции (сочетание
острого панкреатита с деструктивным холециститом, инфицирование некротической
ткани железы, гнойники в забрюшинной клетчатке, распространенный гнойный
перитонит, абсцессы в брюшной полости, если невозможно лечение чрескожным
дренированием под контролем УЗИ); 3) прогрессирующее ухудшение состояния
больного, несмотря на адекватное интенсивное лечение (в том числе при безуспешности
лапароскопического лаважа брюшной полости), массивные аррозивные кровотечения.
Целью хирургического лечения является
удаление инфицированных некротизированных участков ткани до развития нагноения,
оптимальное дренирование брюшной полости для лечения перитонита или удаления
жидкости, содержащей большое количество ферментов поджелудочной железы. В
последнем случае в сальниковую сумку, по ходу поджелудочной железы и в
забрюшинную клетчатку (при ее поражении) вводят перфорированные дренажные
трубки, удаляя не только экссудат и содержащиеся в нем ферменты, но и
образовавшийся в результате расплавления тканей детрит. Трубки выводят наружу
через боковые отделы живота. Одну или две трубки устанавливают в полости малого
таза. В течение суток через них вводят до 10 л раствора, содержащего 5,6 г
натрия хлорида, 5,09 г лактата натрия, 0,52 г кальция хлорида, 0,15 г магния
хлорида, 15 г глюкозы, до 1000 мл дистиллированной воды (осмолярность раствора
360 мосм/л). К раствору можно добавлять антибиотики по показаниям.
При выраженном множественном очаговом
панкреонекрозе в сочетании с перитонитом прибегают к поэтапной некрэктомии, т.
е. программированной ревизии и промывании брюшной полости. Рану при этом
способе не закрывают наглухо, чтобы создать условия для оттока перитонеального
экссудата в повязку. В зависимости от состояния больного и данных
инструментальных методов исследования (УЗИ или КТ) через 1-2 дня рану
раскрывают, проводят ревизию с удалением очагов некроза и повторным промыванием
брюшной полости.
При очаговом панкреонекрозе в области
хвоста поджелудочной железы и безуспешности комплексного интенсивного лечения
возможно проведение дистальной резекции железы. В редких случаях, при тотальном
панкреонекрозе, раньше производили тотальную или субтотальную панкреатэктомию.
Однако эта операция является весьма травматичной, сопровождается высокой
послеоперационной летальностью, поэтому от этого вида вмешательства отказались.
В последние годы в клиническую
практику внедрены малоинвазивные методы "закрытого" лечения
панкреонекроза и его осложнений. Различные оперативные пособия, выполнявшиеся
ранее с помощью широкой лапаротомии (холецистостомия, дренирование сальниковой
сумки, брюшной полости, забрюшинной клетчатки, дренирование абсцессов и ложных
кист), можно производить чрескожно под контролем ультразвукового исследования
или компьютерной томографии. Через установленные таким способом дренажи можно
аспирировать содержимое гнойных полостей и кист, промывать полости и вводить
антибактериальные препараты. Данная методика менее травматична, легче
переносится больными, сопровождается меньшим числом осложнений и более низкой
послеоперационной летальностью.
Наиболее благоприятной в
прогностическом плане является отечная форма острого панкреатита, при которой
проводят комплексное медикаментозное лечение по указанным выше принципам.
Средние показатели летальности составляют доли процента. При панкреонекрозе,
особенно при его гнойных осложнениях, летальность достигает 20-40% и более. При
использовании малоинвазивных технологий удается снизить показатели летальности
до 10% и ниже.
108. Осложнения острого панкреатита.
Хирургическая тактика. Виды операций
Острый панкреатит может
сопровождаться многочисленными осложнениями. Наиболее тяжелыми из них являются:
1. гиповолемический шок;
2. полиорганная, в том числе
острая почечная, недостаточность, появляющаяся вследствие прогрессирования
синдрома системной реакции на воспаление и развитие шока;
. плевролегочные осложнения,
проявляющиеся дыхательной недостаточностью в связи с развитием шокового
легкого, экссудативного плеврита, ателектаза базальных отделов легких, высокого
стояния диафрагмы;
. печеночная недостаточность
(от легкой желтухи до тяжелого острого токсического гепатита, развивающегося
вследствие перенесенного шока и влияния токсичных ферментов и белковых
субстанций); этому способствуют заболевание желчных путей и сопутствующий им
холангит;
. абсцессы поджелудочной
железы и экстрапанкреатические абсцессы в забрюшинной клетчатке, появление
которых обусловлено инфекцией, легко развивающейся в очагах некроза;
. наружные панкреатические
свищи чаще образуются на месте стояния дренажей или послеоперационной раны;
внутренние свищи обычно открываются в желудок, двенадцатиперстную, тонкую и
толстую кишку;
. распространенный гнойный перитонит
возникает при прорыве парапанкреатического гнойника в свободную брюшную полость
или транслокации бактерий из кишечника в свободную брюшную полость,
асептический панкреатогенный перитонит становится гнойным;
. кровотечения, возникающие
вследствие аррозии сосудов (кровь из брюшной полости выделяется наружу через
рану или по каналу дренажа).
Внутренние кровотечения чаще всего
являются следствием эрозивного гастрита, стрессовой язвы, синдрома
Мэллори-Вейса, а также в связи с нарушениями в системе гемостаза (коагулопатия
потребления).
К поздним осложнениям панкреонекроза
относятся псевдокисты. Некротизированная ткань поджелудочной железы при
обширном некрозе не рассасывается полностью. Она инкапсулируется и превращается
в постнекротическую псевдокисту благодаря формированию соединительнотканной
капсулы вокруг очага некроза. Содержимое кисты может быть стерильным или
гнойным. Иногда происходит спонтанное рассасывание кист (чаще всего при ее
сообщении с выводными протоками поджелудочной железы).
109. Рак поджелудочной железы.
Классификация. Клиника. Диагностика. Дифференциальный диагноз. Виды радикальных
и паллиативных операций
Патологоанатомическая картина. Рак поджелудочной железы у
подавляющего большинства больных (около 80%) локализуется в головке органа,
гораздо реже - в теле и хвосте железы. Еще реже наблюдают мультицентрическую
локализацию опухоли, а также диффузный рак, поражающий всю поджелудочную
железу. Опухоль в 80-90% развивается из эпителия выводных протоков
поджелудочной железы и имеет строение аденокарциномы различной степени
дифференциации. При морфологическом исследовании обнаруживают также опухоль,
исходящую из ацинарных клеток (ацинарная аденокарцинома) и плоскоклеточный рак.
Метастазирует рак поджелудочной железы наиболее часто
в забрюшинные лимфатические узлы и в лимфатические узлы, расположенные в
печеночнодвенадцатиперстной связке. Гематогенное метастазирование происходит в
печень, легкие, почки, надпочечники, кости.
Клиническая картина и диагностика. Клинические проявления заболевания зависят
от размеров новообразования и его локализации. Рак головки поджелудочной железы
в ранней стадии протекает бессимптомно или проявляется общими расстройствами -
слабостью, повышенной утомляемостью, диспепсическими явлениями, тяжестью в
животе. Иногда возникает понос, свидетельствующий о нарушениях
внешнесекреторной функции поджелудочной железы. Позднее появляются боли в
животе, постоянные, тупые, локализующиеся в эпигастральной области или правом
подреберье. Нередко они иррадиируют в спину, поясницу, имеют опоясывающий
характер (особенно часто при прорастании опухоли в чревное нервное сплетение).
Перечисленные симптомы являются неспецифичными, обычно расцениваются как
проявление хронического панкреатита или остеохондроза позвоночника. У многих
больных первым и зачастую единственным симптомом рака головки поджелудочной
железы является механическая желтуха, развивающаяся без предшествующего
приступа острых болей в животе. Желтуха постепенно прогрессирует и
сопровождается интенсивным кожным зудом. Менее чем у трети больных раком
головки поджелудочной железы отмечаются боли в животе, а первым симптомом
болезни является механическая желтуха. У больных с распространенным раком
наблюдаются симптомы дуоденальной непроходимости, обусловленные компрессией
вертикального, реже - нижнегоризонтального участка двенадцатиперстной кишки.
Опухоли в теле или в хвосте изза
отсутствия клинических проявлений болезни обнаруживаются в поздней стадии,
когда возникают интенсивные боли в эпигастральной области или в спине. Они
усиливаются в положении больного лежа на спине и ослабевают в положении сидя
или в согнутом вперед положении. При сдавлении опухолью селезеночной вены
иногда наблюдают ее тромб'оз, что клинически проявляется спленомегалией, реже -
варикозным расширением вен пищевода (кровотечение при их разрыве) в связи с
развитием регионарной портальной гипертензии.
У 15-20% больных с распространенными
формами рака отмечаются клинические и лабораторные признаки впервые выявленного
сахарного диабета. Иногда первым клиническим признаком рака поджелудочной
железы, особенно у пожилых больных, является приступ острого панкреатита без
какихлибо очевидных провоцирующих факторов.
При объективном исследовании больных
раком головки поджелудочной железы довольно часто (примерно у 30-40% пациентов)
выявляют гепатомегалию и удается пропальпировать дно желчного пузыря. При
механической желтухе наблюдается симптом Курвуазье. Асцит свидетельствует о
запущенности опухолевого процесса и невозможности выполнения радикальной
операции.
У больных раком дистальных отделов
поджелудочной железы данные объективного исследования малоинформативные, и лишь
при запущенных новообразованиях можно пропальпировать опухоль или опухолевый
инфильтрат и нередко обнаруживать асцит и спленомегалию.
В рутинных анализах крови у больных с
ранними формами рака поджелудочной железы обычно не выявляют какихлибо
отклонений от нормы. В поздних стадиях можно обнаружить ускорение СОЭ,
умеренную анемию. В биохимическом анализе крови обычно определяется
гипопротеинемия, гипоальбуминемия, а у больных с механической желтухой -
гипербилирубинемия, повышение уровня щелочной фосфатазы и трансаминаз, причем
щелочная фосфатаза повышается в большей степени, чем трансаминазы.
Значительно более информативным
является определение уровня опухолевых маркеров в крови. Из всех известных
маркеров наиболее чувствительным и специфичным (около 90%) при раке
поджелудочной железы является карбоангидратный гликопротеин (СА199)
эмбрионального происхождения. У здоровых лиц его содержание в крови не превышает
37 ЕД, в то время как при раке поджелудочной железы этот показатель возрастает
в десятки, а иногда и в сотни и тысячи раз. К сожалению, уровень СА199 при
раннем раке железы обычно не повышен, что существенно ограничивает применение
данного метода в скрининговом исследовании на предмет выявления ранних форм
рака поджелудочной железы, даже у больных, входящих в группу риска.
В последнее время появились сообщения
о высокой степени информативности метода определения антигена СА 494 в крови
при ранней диагностике рака поджелудочной железы и особенно при
дифференциальной диагностике с хроническим панкреатитом.
Основное место в диагностике
принадлежит инструментальным методам исследования.
Рентгенологическое исследование с
контрастированием желудка и двенадцатиперстной кишки позволяет выявить только
ряд косвенных симптомов рака поджелудочной железы, обусловленных давлением
опухоли на соседние органы: деформацию и смещение желудка кпереди, смещение и
развертывание "подковы" двенадцатиперстной кишки, сдавление ее нисходящей
ветви с дефектом наполнения по внутреннему контуру. При значительных размерах
рака тела поджелудочной железы рентгенологически можно выявить смещение малой
кривизны желудка с утолщением и инфильтрацией складок слизистой оболочки в этой
области, смещение и сдавление тощей кишки в области связки Трейтца. Однако эти
рентгенологические данные являются поздними признаками рака поджелудочной
железы. Рентгенологическое исследование позволяет обнаружить стеноз
двенадцатиперстной кишки. Наиболее информативными из инструментальных методов
исследования являются ультразвуковое исследование, компьютерная и
магнитнорезонансная томография. Чувствительность последних двух методов
несколько выше ультразвукового. Для верификации диагноза производят
тонкоигольную пункционную биопсию новообразования под контролем ультразвукового
исследования или компьютерной томографии.
При этом у 90-95% больных удается
получить морфологическое подтверждение диагноза.
В последние годы опухоли
поджелудочной железы диагностируют, применяя эндоскопическое ультразвуковое
исследование. При этом миниатюрный ультразвуковой датчик располагается на
дистальном конце эндоскопа. Помещая его в просвете желудка или
двенадцатиперстной кишки над различными отделами поджелудочной железы за счет
минимального расстояния между датчиком и новообразованием удается выявить
опухоли размером менее 1 см, что обычно невозможно при рутинном УЗИ и КТ.
Чувствительность эндоскопического ультразвукового исследования в диагностике
рака поджелудочной железы достигает 90% и более.
Весьма ценным способом диагностики
рака поджелудочной железы является ретроградная панкреатохолангиография, при
которой удается обнаружить стеноз или "ампутацию" главного
панкреатического протока. Однако на основании данного способа исследования бывает
довольно трудно отдифференцировать злокачественную опухоль от хронического
панкреатита.
У больных с протоковым раком весьма
эффективным является цитологическое исследование аспирата из вирсунгова
протока. Если же при компьютерной или магнитнорезонансной томографии удается
выявить новообразование, а тем более верифицировать диагноз с помощью
чрескожной пункции, необходимость выполнения данного исследования отпадает.
Применявшаяся ранее селективная ангиография (целиакография и верхняя
мезентерикография), при которой обнаруживают изменения архитектоники сосудов
поджелудочной железы, появление зон гиперваскуляризации за счет вновь
образованных сосудов, в настоящее время применяется редко. Это связано с
гораздо более высокой информативностью неинвазивных инструментальных способов
исследования (рис. 14.6).
Дифференциальная диагностика. Дифференциальный диагноз следует
проводить с заболеваниями желчевыводящих путей (холедохолитиаз, стриктура
большого дуоденального сосочка, опухоли внепеченочных желчных протоков),
доброкачественными опухолями поджелудочной железы, хроническим панкреатитом.
Ведущая роль при этом отводится инструментальным методам исследования, их
сочетанию с чрескожной биопсией патологического очага в ткани железы. Следует
отметить, что клиническая картина, а зачастую и данные инструментальных методов
исследования при раке головки поджелудочной железы, двенадцатиперстной кишки,
большого дуоденального сосочка и терминального отдела общего желчного протока
весьма схожи. Даже во время интраоперационной ревизии иногда не удается
установить первичную локализацию опухоли. В связи с этим данная группа
новообразований, особенно при ранней стадии заболевания, обычно объединяется
под термином "периампулярные опухоли". Это вполне объяснимо, так как
хирургическая тактика единообразна и заключается в выполнении
панкреатодуоденальной резекции.
Лечение. На ранних стадиях заболевания
применяют радикальные операции, на поздних - паллиативные. Выбор метода
операции зависит от локализации опухоли и ее размеров.
При раке головки поджелудочной железы
выполняют панкреатодуоденальную резекцию: удаляют головку и часть тела
поджелудочной железы, двенадцатиперстную кишку и 10-12 см начального отдела
тощей кишки, антральныи отдел желудка, желчный пузырь и резецируют общий желчный
проток, примерно на уровне впадения в него пузырного протока. Необходимо также
удалить забрюшинные лимфатические узлы, а также лимфатические узлы,
расположенные по ходу печеночнодвенадцатиперстной связки. У больных с
небольшими опухолями стремятся сохранить антральный отдел желудка и привратник.
Реконструктивный этап операции предусматривает формирование
панкреатоеюнального, холедохоеюнального и гастроеюнального анастомозов. К
сожалению, резектабельность при раке головки поджелудочной железы составляет не
более 20% в связи с местным распространением опухоли и наличием отдаленных
метастазов. Послеоперационная летальность составляет в среднем 10-15%. В
специализированных хирургических центрах этот показатель не превышает 5-8%. Отдаленные
результаты панкреатодуоденальной резекции также малоутешительны. Пятилетняя
переживаемость обычно не превышает 3 - 8%.
При раке головки и тела поджелудочной
железы, а также диффузном раке железы показана тотальная
панкреатодуоденэктомия. Операция заключается в удалении всей поджелудочной
железы, двенадцатиперстной кишки, антрального отдела желудка, дистальной части
общего желчного протока, селезенки и регионарных лимфатических узлов. Операцию
завершают наложением двух анастомозов - холедохоеюноанастомоза и
гастроеюноанастомоза. Операция неизбежно приводит к развитию тяжелого сахарного
диабета, плохо поддающегося инсулинотерапии, а отдаленные результаты операции
панкреатэктомии значительно хуже, чем при панкреатодуоденальной резекции. В
связи с этим данный тип вмешательства применяется редко.
При раке тела и хвоста поджелудочной
железы выполняют левостороннюю (дистальную) резекцию органа в сочетании со
спленэктомией. Культю проксимальной части поджелудочной железы ушивают наглухо.
К сожалению, опухоли этой локализации обычно выявляют в запущенной стадии,
когда радикальное хирургическое лечение невыполнимо. Отдаленные результаты
дистальной резекции поджелудочной железы также малоутешительны. Средняя
продолжительность жизни оперированных больных - около 10 мес, 5летняя
переживаемость - 5 - 8%.
Рентгенотерапия в комбинации с
химиотерапией несущественно продливает жизнь как оперированных пациентов, так и
при их изолированном применении у неоперабельных больных.
Паллиативные операции при
неоперабельных формах рака поджелудочной железы применяют для устранения
обтурационной желтухи и непроходимости двенадцатиперстной кишки. Наиболее
распространенными паллиативными билиодигестивными операциями являются операции
холецисто и холедохоеюностомии на выключенной по Ру петле тощей кишки.
При резком сужении опухолью просвета
двенадцатиперстной кишки может возникнуть необходимость в гастроэнтеростомии
для обеспечения эвакуации желудочного содержимого в тонкую кишку.
Не менее эффективным, но менее
травматичным способом декомпрессии желчных путей является наружная
холангиостомия, выполняемая под контролем УЗИ или КТ, а также
эндопротезирование терминального отдела общего желчного протока с помощью
пластиковых или металлических протезов, вводимых чреспеченочно в просвет общего
желчного протока и далее через его суженный участок в двенадцатиперстную кишку.
Средняя продолжительность жизни больных после различных типов паллиативных
вмешательств составляет около 7 мес.
Современные методы полихимиотерапии и
лучевое лечение лишь незначительно увеличивают продолжительность жизни
пациентов.
110. Травмы поджелудочной железы. Острые
травматические панкреатиты. Острые послеоперационные панкреатиты. Клиника.
Диагностика. Особенности хирургического лечения
Различают открытые и закрытые
повреждения поджелудочной железы. Открытые повреждения возникают при
огнестрельных и ножевых ранениях, закрытые - при тупой травме живота.
Повреждения могут быть изолированными или сочетаться с повреждениями соседних
органов (двенадцатиперстная кишка, желудок, тонкая кишка). Последние виды
травмы изза особенностей расположения поджелудочной железы наблюдаются чаще.
При закрытых травмах чаще повреждается тело поджелудочной железы, которое в
момент ушиба и повышения внутрибрюшного давления оказывается более плотно
прижатым к позвонкам, чем другие ее отделы.
Различают четыре степени тяжести
травм поджелудочной железы: 1) ушиб и кровоизлияние в ткань железы; 2)
поверхностный разрыв капсулы и паренхимы поджелудочной железы; 3) глубокий
разрыв паренхимы без повреждения протока поджелудочной железы; 4) разрыв
поджелудочной железы с повреждением протока.
Клиническая картина и диагностика. При массивной травме возникают
кровотечение в брюшную полость, симптомы травматического шока. В более поздние
сроки появляются признаки травматического панкреатита, а в случае повреждения
полых органов возникает перитонит. Больные предъявляют жалобы на резкие боли в
верхнем отделе живота, иррадиирующие в спину, нередко носящие характер
опоясывающих, тошноту, рвоту.
Диагностика повреждений поджелудочной
железы изза отсутствия патогномоничных симптомов затруднена. Для ранней
диагностики целесообразно использовать УЗИ, с помощью которого обнаруживают
скопление крови или экссудата, определить состояние поджелудочной железы и
других органов брюшной полости и забрюшинного пространства. Скопление крови в
брюшной полости можно обнаружить с помощью "шарящего" катетера,
который вводят в брюшную полость через небольшой разрез. В полученной при этой
процедуре жидкости необходимо определить содержание амилазы, что позволит
подтвердить повреждение поджелудочной железы. В условиях хорошо оснащенной
больницы можно воспользоваться лапароскопией, которая позволяет более четко
выявить характер повреждения и даже произвести некоторые манипуляции или
оперативные вмешательства, такие как остановка кровотечения из поврежденных
сосудов, подведение дренажей к поврежденной железе и т. п. Наличие
значительного скопления крови в брюшной полости является показанием к срочной
лапаротомии.
Лечение только хирургическое. Операция должна
проводиться до развития воспалительных процессов в самой поджелудочной железе,
в брюшной полости и в забрюшинной клетчатке.
При небольших разрывах поджелудочной
железы удаляют образовавшуюся гематому, ушивают разрывы паренхимы отдельными
швами и дренируют сальниковую сумку через контрапертуру в поясничной области.
При повреждении левой половины
поджелудочной железы с нарушением целости протоков производят резекцию ее тела
и хвоста.
При размозжении головки поджелудочной
железы с разрывом главного панкреатического протока выполняют панкреатэктомию
или панкреатодуоденальную резекцию, хотя эти операции довольно сложны и
травматичны, а послеоперационная летальность достигает 60-80%.
Послеоперационные панкреатиты по механизму развития
делятся на травматические (27,7%) и нетравматические (72,3% А.Н. Киселев,
1980). Подобное деление весьма условно, поскольку при так называемых
нетравматических (функциональных) панкреатитах очень часто пусковым механизмом
является незамеченная, негрубая, обычная операционная травма (пальпация,
давление металлическим зеркалом, отграничение марлевыми тампонами и т.д.),
оказывающая выраженное рефлекторное воздействие.
При грубом повреждении ткани железы и ее сосудистой
системы патологическая энзимопатия возникает в результате прямого разрушения
паренхимы поджелудочной железы или критического расстройства кровообращения,
приводящего к некробиозу (В.И. Филин, 1982). Наиболее часто травматические
повреждения поджелудочной железы и нарушения ее кровообращения наблюдаются при
операциях на самой железе, резекциях желудка по поводу пенетрирующих язв,
вмешательствах на 12ПК, билиарной системе, спленэктомиях, левосторонней
гемиколэктомии.
Резекция желудка, особенно при низколуковичных язвах,
операции на 12ПК практически всегда приводят к механическому повреждению
паренхимы поджелудочной железы, а также расстройству кровообращения вследствие
перевязки поджелудочнодуоденальной артерии.
Левосторонняя гемиколэктомия и спленэктомия могут
сопровождаться травмой хвоста поджелудочной железы и частичным нарушением
кровотока после перевязки селезеночной артерии или ее ветвей.
Оперативные вмешательства на билиарной системе иногда
сопровождаются механическими повреждениями поджелудочной железы или d.
Wirsungi, однако в подавляющем большинстве случаев эти операции обусловливают
развитие функционального панкреатита. Поскольку именно эти операции чаще всего
осложняются послеоперационным панкреатитом, рассмотрим подробнее патогенез
данного явления.
111. Псевдокисты и свищи поджелудочной
железы. Клиника. Диагностика. Дифференциальный диагноз. Виды операций
Кисты поджелудочной железы представляют собой ограниченные
капсулой скопления жидкости в виде полостей, расположенных как в самой железе,
так и в окружающих ее тканях. Заболевание встречается в различных возрастных
группах одинаково часто у мужчин и у женщин. Понятие "кисты поджелудочной
железы" является собирательным. Различают следующие виды кист.
I. Врожденные (дизонтогенетические)
кисты, образующиеся в результате пороков развития ткани поджелудочной железы и
ее протоковой системы (дермоидные, тератоидные кисты, фибознокистозная
дегенерация).. Приобретенные кисты:
1. ретенционные кисты,
развивающиеся при стриктуре выводных протоков железы, стойкой закупорке их
просвета конкрементами, рубцами;
2. дегенеративные, возникающие
вследствие некроза ткани железы при деструктивном панкреатите, травме
поджелудочной железы;
. пролиферационные - полостные
формы опухолей, к которым относятся доброкачественные цистаденомы и
злокачественные цистаденокарциномы.
В зависимости от причины и механизмов
образования кист, особенностей строения их стенок различают истинные и ложные
кисты.
К истинным кистам относят врожденные
кисты поджелудочной железы, приобретенные ретенционные кисты, цистаденомы и
цистаденокарциномы. Отличительной особенностью истинной кисты является наличие
эпителиальной выстилки ее внутренней поверхности. Истинные кисты составляют
менее 10% всех кист поджелудочной железы. В отличие от ложных кист истинные
обычно бывают небольших размеров и нередко являются случайными находками при
проведении ультразвукового исследования или во время операции, предпринятой по
поводу другого заболевания.
Клиническая картина и диагностика. Кисты небольших размеров клинически
обычно не проявляются. Симптомы заболевания появляются в тех случаях, когда
киста инфицируется, достигает больших размеров или вызывает сдавление или
смещение соседних органов.
Наиболее частыми симптомами больших
ложных кист являются тупые ноющие боли в верхней половине живота, диспепсия,
нарушения общего состояния (слабость, похудание), периодическое повышение
температуры тела, наличие опухолевидного образования в животе.
Боли могут быть постоянными или
приступообразными (при компрессии различных отделов кишечника). Иногда отмечают
опоясывающие и распирающие боли, изза которых больные принимают вынужденное
положение. Особенно сильными боли бывают в случаях, когда киста оказывает
давление на чревное нервное сплетение. Однако даже при гигантских кистах боли
нередко бывают выражены незначительно и больные жалуются лишь на чувство
давления в эпигастральной области. Наиболее частыми диспепсическими явлениями
бывают тошнота, рвота, неустойчивый стул. При расположении крупной кисты в
головке поджелудочной железы нередко наблюдается механическая желтуха.
При объективном исследовании довольно
часто выявляют обычно безболезненное опухолевидное образование в верхней
половине живота (подложечная, околопупочная область, правое или левое
подреберье) с четкими наружными границами, округлой или овальной формы, гладкой
поверхностью.
Наблюдается постепенное, медленно
прогрессирующее течение заболевания, реже как острое, когда киста за короткий
срок достигает больших размеров, вызывая тяжелые функциональные нарушения со
стороны других органов, и сопровождается осложнениями, наиболее частыми из
которых при ложных кистах (панкреатических) являются кровоизлияния в полость
кисты, нагноение, разрывы кисты с развитием перитонита, внутренние
цистодуоденальные или цистогастральные свищи, а также компрессия соседних
органов.
Диагноз кисты поджелудочной железы
основывается на клинических данных и результатах специальных методов
исследования. Кисты больших размеров можно обнаружить при пальпации. Кроме
незначительного повышения концентрации ферментов поджелудочной железы в крови и
моче, иногда отмечают уменьшение их в содержимом двенадцатиперстной кишки. При
рентгенологическом исследовании выявляют оттеснение желудка, поперечной
ободочной кишки кпереди и кверху или книзу. Компьютерная томография и
ультразвуковое исследование являются наиболее информативными. У больных с
истинными врожденными и ложными кистами при УЗ И обнаруживают гипоэхогенное
образование с ровными четкими контурами, округлой или овальной формы,
расположенное в проекции поджелудочной железы. Для цистаденомы и
цистаденокарциномы характерна неровность внутреннего контура вследствие роста
опухолевой ткани в полость кисты и более высокая эхогенность ее содержимого.
Довольно часто наблюдаются внутрикистозные перегородки. Для дифференциальной
диагностики доброкачественного кистозного образования поджелудочной железы от
злокачественного применяют цистографию, тонкоигольную биопсию стенки кисты и
биохимическое исследование ее содержимого. При цистаденоме и цистаденокарциноме
содержимое кисты дает положительную реакцию на муцин.
Дифференциальная диагностика. При дифференциальной диагностике
прежде всего необходимо отличить доброкачественную цистаденому от
цистаденокарциномы и ложной кисты. Обычно для этой цели, помимо ультразвукового
и компьютернотомографического исследований, используют прицельную пункцию
стенки кисты с последующим морфологическим исследованием биоптата.
Для дифференциальной диагностики кист
поджелудочной железы с аневризмой аорты, опухолями забрюшинных лимфатических
узлов, опухолями и кистами печени, гидронефрозом, опухолями почек, кистами
брыжейки тонкой или ободочной кишки решающее значение имеют ультразвуковое
исследование, компьютерная и магнитнорезонансная томография, а также
ангиография висцеральных ветвей брюшной аорты.
Лечение. Традиционным способом лечения кист
является хирургический. При небольших истинных кистах с тонкими стенками
(обычно менее 1 мм) и отсутствии выраженной клинической симптоматики
оперативное лечение не показано. При крупных истинных кистах, сопровождающихся
симптомами хронического панкреатита или с осложнениями производят энуклеацию
кисты или дистальную резекцию поджелудочной железы (при множественных кистах
тела и хвоста железы). При ложных кистах обычно выполняют различные варианты
цистодигестивных анастомозов (цистоеюностомию, цистогастростомию или
цистодуоденостомию), в зависимости от локализации кисты и степени ее спаяния с
окружающими органами. Целью оперативного вмешательства является опорожнение
содержимого кисты в просвет тощей кишки или желудка. В последующем происходят
облитерация полости кисты и практически полное выздоровление при отсутствии
морфологических и клинических признаков хронического панкреатита.
С развитием малоинвазивных технологий
в хирургической практике появилась возможность "закрытого" способа
лечения больных с ложными кистами поджелудочной железы. Для этой цели
используют пункцию и наружное дренирование кист под контролем ультразвукового
исследования или компьютерной томографии. В полученной при пункции жидкости
определяют концентрацию амилазы. Высокая концентрация этого фермента указывает
на связь полости кисты с выводными протоками поджелудочной железы. При
отсутствии такой связи выполняют поэтапное склерозирование стенок кисты
раствором абсолютного спирта. Это позволяет добиться асептического некроза
эпителия стенки кисты и последующей облитерации ее просвета. При сообщении
просвета кисты с выводными протоками, а тем более главным панкреатическим
потоком подобная тактика неприменима, так как весьма высок риск попадания
склерозанта в протоковую систему железы. В этих случаях накладывают чрескожный
цистогастроанастомоз с помощью специального синтетического эндопротеза с
внутренним диаметром около 1 , 5 мм под контролем ультразвукового исследования
и гастроскопии. При локализации кисты в головке железы с помощью аналогичной методики
возможно формирование цистодуоденоанастомоза. Небольшой диаметр эндопротеза
препятствует забросу желудочного содержимого в просвет кисты и в то же время не
препятствует оттоку содержимого кисты в просвет желудка или двенадцатиперстной
кишки. Особенно целесообразно использование "закрытого" метода у
больных с "несформированными" тонкостенными кистами, развивающимися в
ранние сроки (2-4 нед) деструктивного панкреатита, когда технически невозможно
выполнить тот или иной тип "открытого" цистодигестивного соустья.
При нагноившейся кисте обычно
производят наружное дренирование под контролем УЗИ или КТ. При локализации
цистаденомы в теле и хвосте железы показана энуклеация или дистальная резекция
железы. В хирургическом лечении цистаденокарцином используют те же операции,
что и при раке поджелудочной железы. Отдаленные результаты оперативного лечения
данного вида опухолей значительно лучше, чем при раке поджелудочной железы.
Свищи поджелудочной железы - патологическое сообщение протоков с
внешней средой или внутренними полыми органами. Различают наружные свищи, когда
устье свища открывается на коже, и внутренние, при которых свищ сообщается с
полым органом (желудок, тонкая или толстая кишка). Они могут быть полными и
неполными. При обтурации проксимальной части протока (полный свищ) весь
панкреатический сок выделяется наружу. При неполных свищах основная часть
панкреатического сока оттекает естественным путем в двенадцатиперстную кишку и
только часть его отделяется по свищу.
Этиология. Наружные свищи наиболее часто
возникают после открытой травмы живота, после операций на поджелудочной железе.
Внутренние свищи обычно являются следствием деструктивных изменений в железе,
переходящих на стенку соседнего органа (острый панкреатит, пенетрация и
прободение кисты поджелудочной железы).
Патологоанатомическая картина. Панкреатический свищ представляет
собой неравномерно суженный канал, сообщающийся с протоком поджелудочной
железы, стенки которого образованы фиброзной тканью. В ткани поджелудочной
железы в месте формирования свища обнаруживают различного рода морфологические
изменения, которые привели к его образованию (некроз, воспаление, киста).
Клиническая картина и диагностика. Для наружных свищей поджелудочной
железы характерно выделение панкреатического сока через их наружное отверстие.
Количество отделяемого зависит от вида свища. При полном свище за сутки
выделяется до 1-1,5 л панкреатического сока, при неполном - нередко всего
несколько миллилитров. В зависимости от выраженности деструктивных и
воспалительных изменений в поджелудочной железе и в стенках из свища выделяется
либо чистый панкреатический сок, либо сок с примесью крови или гноя.
Выделяющийся в большом количестве панкреатический сок с кожей очень быстро
вызывает мацерацию кожи вокруг наружного отверстия свища. Значительная потеря
сока приводит к резкому ухудшению состояния больного, выраженным нарушениям
белкового, жирового и углеводного обмена, существенным потерям воды,
электролитов и расстройствам кислотноосновного состояния.
При внутренних свищах выделение
панкреатического сока происходит в просвет желудка или кишечника. В связи с
этим тяжелые метаболические расстройства, свойственные наружным свищам, не
развиваются.
Диагностика наружных свищей больших
трудностей не представляет. Окончательный диагноз подтверждается обнаружением в
отделяемом свища высокой концентрации панкреатических ферментов. Для уточнения
диагноза применяют фистулографию. Если при ней контраст заполняет протоки
поджелудочной железы, то диагноз не вызывает сомнений.
Лечение. Неполные свищи обычно закрываются под
влиянием консервативного лечения. Оно включает мероприятия, направленные на
ликвидацию истощения и обезвоживания организма. Для снижения секреторной
активности поджелудочной железы назначают цитостатики и антиметаболиты (5фторурацил,
циклофосфан и др.) или синтетические аналоги соматостатина, а также специальную
диету, богатую белками и бедную углеводами, ограничивающую выделение
панкреатического сока. При неэффективности подобного способа больных переводят
на парентеральное питание с массивной медикаментозной терапией, направленной на
угнетение экзокринной функции поджелудочной железы и кислотопродуцирующей
функции желудка. Местное лечение состоит в тщательном уходе за кожей вокруг
свища, предупреждении ее мацерации и введении в просвет свища дренажа, через
который аспирируют его содержимое и промывают свищ растворами антисептиков.
При полных свищах показано
хирургическое лечение. Основным методом лечения свищей тела и хвоста
поджелудочной железы является дистальная резекция органа. При локализации
внутреннего отверстия свища в области головки поджелудочной железы оперативное
лечение представляет значительные трудности. В этой ситуации обычно стенки
свища вшивают в петлю тонкой кишки, выделенной по Ру.
112. Перитониты. Классификация.
Клиническая картина при различных стадиях. Принципы комплексного лечения
Перитонит - острое диффузное
воспаление висцеральной и париетальной брюшины, не имеющее тенденции к
отграничению. Отграниченное воспаление брюшины называют абсцессом или воспалительным
инфильтратом, образовавшимся в результате склеивания фибрином органов (сальник,
петли кишечника, париетальная брюшина), расположенных рядом с воспаленным
органом. Наиболее часто встречаются аппендикулярные, поддиафрагмальные,
подпеченочные, тазовые абсцессы.
Этиология и патогенез. Перитонит возникает вследствие
инфицирования брюшной полости. По характеру проникновения микрофлоры в брюшную
полость выделяют первичный и вторичный перитониты. При первичных перитонитах
видимого очага инфекции в брюшной полости нет. Микрофлора проникает в брюшную
полость гематогенным, лимфогенным путями или через фаллопиевы трубы. Первичные
перитониты встречаются редко, приблизительно в 1% всех наблюдений.
Вторичные перитониты возникают из
очагов инфекции, находящихся в брюшной полости. Микрофлора проникает в брюшную
полость вследствие деструктивного воспаления органов брюшной полости,
перфорации, ранения полых органов, несостоятельности швов анастомозов,
наложенных во время операций.
Самой частой причиной перитонита
является деструктивный аппендицит (свыше 60%). Далее по частоте следуют
деструктивные формы острого холецистита (10%), перфорация язв желудка и
двенадцатиперстной кишки (7%), острый панкреатит (3%), перфорация
дивертикулов и рака ободочной кишки (2%), тромбоз сосудов брыжейки тонкой и
толстой кишки, проникающие ранения живота, несостоятельность швов анастомозов
после операций на органах брюшной полости.
Перитонит, как правило, вызывается
полимикробной грамположительной и грамотрицательной, анаэробной и аэробной флорой
пищеварительного тракта. В норме в 1 мл содержимого желудка, двенадцатиперстной
и тощей кишки содержится около 103-105 микробных тел.
Соотношение аэробов к анаэробам 1:100. В подвздошной и особенно в толстой кишке
в 1 мл содержимого число микробных тел возрастает в 2-3 раза (от 106
до 10'2, т. е. значительно выше критического уровня). Соотношение
аэробов к анаэробам достигает 1:1000. В кишечнике находится более 400
разновидностей микроорганизмов. Многие из них погибают при попадании в брюшную
полость, остальные быстро размножаются как в экссудате, так и в просвете
кишечника в связи с нарушением перистальтики, ишемией стенок. Концентрация
микробных тел в 1 мл экссудата в 2-3 раза выше по сравнению с нормальной
микрофлорой кишечника, при посеве удается выделить 3-5 и более разновидностей
анаэробных и аэробных микроорганизмов.
Аэробная флора чаще представлена
кишечной палочкой, стафилококками, стрептококками, энтерококками и др. Из
анаэробов наиболее часто обнаруживают бактероиды, относящиеся к неклостридиальным
(не образующим споры) анаэробам, анаэробые стафилококки и стрептококки,
пептострептококки, фузобактерии и др. Клостридиальные (спорообразующие)
бактерии встречаются значительно реже.
Первичный перитонит вызывает
микрофлора, не имеющая отношения к пищеварительному тракту. Она представлена
обычно в виде монокультуры (гонококки, микобактерии туберкулеза, пневмококки).
Кроме микробных перитонитов, выделяют
асептические (абактериальные) перитониты, вызванные попаданием в брюшную
полость различных неинфекционных агентов, обладающих агрессивным действием на
брюшину (моча, желчь, желудочный и панкреатический соки, кровь). Уже через 1-2
дня абактериальный перитонит становится бактериальным вследствие поступления
(транслокации) микроорганизмов из кишечника в связи с нарушением защитной
функции его слизистой оболочки.
Выделяют также особые формы
перитонита: карциноматозный (карциноматоз брюшины), ревматический,
фибропластический, возникающий при попадании на брюшину талька или крахмала с
перчаток хирурга. Перитонит может возникнуть вследствие инфицирования
асцитической жидкости. Опасность инфицирования брюшной полости возникает при
проведении перитонеального диализа у больных с хронической почечной
недостаточностью.
По характеру выпота выделяют
серозный, фибринозный, фибринозногнойный, гнойный, геморрагический и гнилостный
перитониты.
Диффузный перитонит, локализованный
только в непосредственной близости от источника инфекции одной анатомической
области живота, называют местным. Диффузный перитонит, занимающий несколько
анатомических областей живота, называют распространенным. Поражение всей
брюшины именуют общим перитонитом. Не рекомендуется употреблять термин
"разлитой перитонит", так как под этим подразумеваются два разных
процесса - диффузный характер воспаления брюшины и распространенность
воспаления в брюшной полости. Воспаление не может "разливаться", оно
может лишь распространяться по брюшине, в мягких тканях, в легких.
По клиническому течению различают
острый, подострый и хронический перитониты. Наиболее частой формой является
острый перитонит. Для темпа развития и тяжести процесса имеют значение такие
факторы, как скорость поступления в свободную брюшную полость инфицирующего
материала, его количество. При перфорации полого органа имеет значение уровень
перфорации: чем ниже он расположен по ходу желудочнокишечного тракта, тем выше
содержание микробных тел, тем больше анаэробной флоры в каждом миллилитре
содержимого.
При формулировке диагноза на первое
место ставят основное заболевание (деструктивный аппендицит, холецистит,
перфоративная язва желудка и т. п.), затем его осложнение перитонит
(серозногнойный, гнойный, гнилостный и т. п.) с указанием распространенности, а
затем сопутствующие и фоновые заболевания с указанием степени компенсации.
Выделяют три стадии развития
перитонита: 1) стадия компенсации функций внутренних органов, характеризующаяся
преимущественно местной реакцией на воспаление; 2) стадия субкомпенсации,
проявляющаяся синдромом системной реакции на воспаление с нарушением функции
1-2 органов; 3) стадия декомпенсации, полиорганной недостаточности, характерная
для перитонеального сепсиса.
Степень тяжести процесса определяется
нарушением функций внутренних органов. Первая стадия - перитонит
(компенсированный) без нарушения функций других органов; вторая стадия -
перитонит среднетяжелый (субкомпенсированный) с нарушением функции одного из
органов (легкие, почки, печень); третья стадия - тяжелый и крайне тяжелый
перитонит (декомпенсированный) с недостаточностью функций 2-3 органов и более.
Третья стадия фактически является перитонеальным сепсисом. Это поздняя стадия
синдрома системного ответа на воспаление.
Признание непрерывности и
прогрессивного развития реакции организма на воспаление - от местной, через
стадию системной, до стадии неконтролируемой, свойственной для полиорганной
недостаточности и сепсиса, очень важно. Это позволяет в ранние сроки распознать
появление признаков дисфункции того или другого органа и предпринять более
энергичное лечение, чтобы не допустить развития полиорганной недостаточности и
сепсиса.
Стадии развития перитонита отражают
закономерность, характерную для любого воспалительного процесса, где бы он ни
локализовался. Реакция на воспаление бывает также местной (компенсированной),
системной (субкомпенсированной) с последующим переходом в декомпенсированную,
аутодеструктивную реакцию, проявляющуюся полиорганной недостаточностью,
сепсисом и септическим шоком.
Каждую стадию связывают со временем,
прошедшим от начала болезни. Предполагается, что рефлекторная стадия
продолжается до 24 ч от начала заболевания. Однако никто не указывает, какой же
агент вызывает этот рефлекс, какой орган задействован в реализации рефлекса.
Токсическая стадия длится 24-48 ч, но разве можно предположить, что
эндотоксикации не было в рефлекторной или она прекратилась в терминальной
стадии, наступающей через 72 ч и более. Связь стадии перитонита со временем от
начала болезни более чем условна. Во многих случаях в течение 24 ч (отведенных
для рефлекторной стадии) перитонит прогрессирует столь быстро, что развивается
не рефлекторная, а терминальная стадия, проявляющаяся септическим шоком.
Название стадий не совсем корректно. Если термины "рефлекторная" и
"токсическая" стадии претендуют на связь с патофизиологическими
механизмами развития перитонита, то наиболее тяжелая стадия,
"терминальная", является лишь отражением безнадежности лечения, что
не соответствует действительности. Такая классификация тяжести перитонита
слишком условна и едва ли может принести пользу практическому хирургу.
В основу классификации должен быть
положен один принцип - степень компенсации функций жизненно важных органов в
процессе развития воспаления.
Комплексное лечение острого распространенного
перитонита должно включать: коррекцию гемодинамики; коррекцию
вводноэлектролитоного баланса и метаболических нарушений; обеспечение
энергетических и пластических потребностей организма; обеспечение нормального
газообмена и устранение нарушений микроциркуляции; антибактериальную терапию;
детоксикационную терапию, в т.ч. методы активной детоксикации: плазмаферез,
лимфо и гемосорбции, УФОК; повышение естественной резистентности организма;
устранение функциональной недостаточности кишечника; парентеральное и
энтеральное питание; симптоматическую терапию
113. Острый гнойный перитонит. Клиника.
Диагностика, Дифференциальный диагноз. Особенности оперативного вмешательства.
Показания к дренированию брюшной полости, программируемым санациям
(реоперациям)
Распространенный гнойный перитонит
возникает наиболее часто как осложнение острых заболеваний органов брюшной
полости, операций, травмы. Поэтому ранние симптомы перитонита маскируются
симптомами этих заболеваний. При расспросе больных можно выявить жалобы,
характерные для заболевания того или иного органа брюшной полости, послужившего
причиной развития перитонита.
В первой, компенсированной стадии
перитонита больные жалуются на интенсивную боль в животе постоянного характера,
усиливающуюся при перемене положения тела. Локализация боли зависит от
локализации первичного очага воспаления. Боль связана с массивным раздражением
многочисленных нервных окончаний брюшины. Любое изменение положения тела
сопровождается растяжением того или иного участка воспаленной брюшины, вызывает
раздражение огромного рецепторного поля, что усиливает боль. Для того чтобы уменьшить
ее, больные стараются лежать неподвижно, избегая лишних движений.
Характерным признаком перитонита
является рвота небольшим количеством желудочного содержимого, которая не
приносит облегчения. Она связана с переполнением желудка вследствие угнетения
моторной активности пищеварительного тракта. По мере прогрессирования
перитонита в стадии субкомпенсации развивается паралитическая непроходимость
кишечника. Рвота становится частой, обильной, имеет неприятный запах. В стадии
декомпенсации рвотные массы приобретают фекалоидный запах, обусловленный
застоем содержимого в кишечнике, резким увеличением числа бактерий, выделением
продуктов жизнедеятельности микроорганизмов, гниением остатков пищи. При
эрозивном гастрите наблюдается кровавая рвота.
При физикальном исследовании больных
в I стадии перитонита определяется
умеренное учащение пульса и дыхания, температура тела - не выше 38"С.
При осмотре отмечают сухость языка и
слизистых оболочек ротовой полости. Заметно ограничение подвижности брюшной
стенки при дыхании, более выраженное в проекции воспаленного органа. При
перкуссии в этой области определяется наибольшая болезненность, высокий
тимпанит за счет пареза кишечника, внизу и в боковых отделах живота -
притупление перкуторного звука (при скоплении значительного количества
экссудата - 7501000 мл).
Поверхностная пальпация живота
выявляет защитное напряжение мышц передней брюшной стенки соответственно зоне
воспаленной париетальной брюшины. Мышечная защита наиболее резко выражена при
перфорации полого органа ("доскообразный живот" при перфорации язвы
желудка или двенадцатиперстной кишки). Защитное напряжение мышц передней
брюшной стенки может отсутствовать при локализации воспалительного процесса в
малом тазу, при поражении задней париетальной брюшины, у недавно родивших
женщин, стариков, лиц, находящихся в алкогольном опьянении. Ценным оказывается
пальцевое исследование прямой кишки, при котором в случае скопления экссудата в
малом тазу определяется нависание и болезненность при давлении на переднюю
стенку. У женщин при исследовании через влагалище можно обнаружить нависание
заднего свода, болезненность при смещении шейки матки в стороны и вверх.
При глубокой пальпации передней
брюшной стенки можно определить воспалительный инфильтрат, опухоль, увеличенный
орган (деструктивно измененный желчный пузырь), инвагинат и т. д. Характерным
симптомом перитонита является симптом Щеткина-Блюмберга.
При аускультации живота в I стадии перитонита выслушиваются
слабые перистальтические шумы. В стадии субкомпенсации и декомпенсации в связи
с паралитическим илеусом кишечные шумы не выслушиваются (симптом "гробовой
тишины").
В анализе крови в I стадии перитонита имеется умеренный
лейкоцитоз (до 1000012000), нейтрофилез, сдвиг лейкоцитарной формулы влево,
увеличение СОЭ.
Рентгенологическое исследование
является обязательным. При обзорной рентгенографии живота можно обнаружить
скопление газа под правым или левым куполом диафрагмы (перфорация полого
органа), ограничение ее подвижности (локализация патологического процесса в
верхнем этаже брюшной полости), высокое стояние купола диафрагмы на стороне
поражения, "сочувственный" плеврит в виде большего или меньшего
количества жидкости в ребернодиафрагмальном синусе, дисковидные ателектазы в
легком. Можно определить паретичную, раздутую газом кишку, прилежащую к очагу
воспаления, а в поздних стадиях перитонита - уровни жидкости с газом в петлях
тонкой и толстой кишки (чаши Клойбера), характерные для паралитической
непроходимости кишечника.
Лапароскопия показана при
неуверенности в диагнозе, когда неинвазивные способы исследования оказываются
недостаточно информативными. При лапароскопии можно осмотреть почти все органы
брюшной полости, выявить источник перитонита, наличие и характер экссудата,
оценить состояние париетальной и висцеральной брюшины. С помощью
видеолапароскопической аппаратуры и инструментов можно аспирировать экссудат,
удалить воспаленный орган, наложить швы на перфорационное отверстие, промыть
участок брюшной полости, поставить дренажи для оттока экссудата.
При отсутствии лапароскопической
техники можно воспользоваться лапароцентезом с использованием так называемого
шарящего катетера: через прокол в брюшной стенке в брюшную полость вводят
катетер, через который вливают небольшое количество физиологического раствора,
затем аспирируют его вместе с экссудатом или другой жидкостью, скопившейся в
брюшной полости. По характеру полученной жидкости (кровь, гной и т. п.) можно
сделать заключение о природе изменений в брюшной полости.
Ультразвуковое исследование позволяет
определить скопление экссудата в том или ином отделе брюшной полости,
воспалительные изменения в желчном пузыре, аппендиксе, в органах малого таза,
поджелудочной железе и других органах.
В стадии субкомпенсации развивается
синдром системной реакции на воспаление, который включает характерные для
воспаления признаки:
) повышение или снижение температуры
тела (выше 38°С или ниже 36°С в случаях анергии); тахикардию (более 90 в 1
мин);
2. тахипноэ (увеличение частоты
дыхания свыше 20 в 1 мин, или РаС02 менее 32 мм рт. ст.);
3. лейкоцитоз (свыше 12 000 в 1
мм3) или снижение количества лейкоцитов (ниже 4000 в 1 мм3),
палочкоядерный сдвиг более чем на 10%.
Тяжесть синдрома определяется числом
признаков нарушения функций органов у данного пациента: при наличии 2 из 4
признаков - перитонит средней тяжести; при 3 и 4 признаках - перитонит тяжелый
с риском прогрессирования болезни, иногда протекающий с нарушением сознания,
тяжесть которого целесообразно оценивать по шкале Глазго. Появляется опасность
развития полиорганной недостаточности, сепсиса и летального исхода. Совершенно
очевидно, что приведенные критерии более объективны, чем субъективное суждение
о состоянии пациента с оценкой удовлетворительное, средней тяжести, тяжелое,
так как каждый врач вкладывает в эти понятия свои субъективные представления о
больном.
Для более объективной оценки тяжести
состояния пациентов целесообразно пользоваться подсчетом числа баллов по шкале
АРАСНЕ11, учитывающей не только острые нарушения физиологических функций, но и
возраст пациента, отягощающие хронические заболевания (см. приложение). Такая
оценка может быть использована не только для определения состояния больного,
эффективности лечения, но и для прогнозирования возможных осложнений и исхода
болезни. Определение тяжести перитонита по указанным выше критериям доступно
любому врачу.
Интенсивность болей в животе во II
стадии (стадии субкомпенсации) несколько уменьшается, наступает короткий период
мнимого благополучия, когда пациент испытывает облегчение и некоторое
"улучшение". Однако вскоре состояние ухудшается, срыгивание и рвота
жидкостью бурого цвета становятся чаще, возникают задержка стула и отхождения
газов. На этой стадии развития перитонита выражены общие симптомы, характерные
для резкой интоксикации организма и выраженной дегидратации. Больные испытывают
сильную жажду, язык и поверхность слизистой оболочки щек сухие, тургор кожи
понижен.
Живот резко вздут вследствие пареза
кишечника, защитное напряжение мышц несколько ослабевает в связи с истощением
висцеромоторных рефлексов, кишечные шумы не выслушиваются. Симптом
Щеткина-Блюмберга несколько менее выражен.
При специальном исследовании можно
определить снижение объема циркулирующей крови, нарушение водноэлектролитного
баланса и кислотноосновного состояния (гипокалиемия и алкалоз, а при снижении
диуреза гиперкалиемия и ацидоз). В этой стадии развития перитонита снижается
содержание общего белка, альбумина, несколько возрастает концентрация
билирубина, трансаминаз, креатинина, мочевины. Необходимо регулярно брать кровь
для посева (в течение дня исследования - 3 пробы с интервалом в 1-2 ч).
Выделение бактериальной флоры из крови означает, что перитонит осложнился
сепсисом. Необходимо определять выделенную из крови и экссудата бактериальную
флору на чувствительность к антибиотикам, чтобы назначить адекватную
антибактериальную терапию.
В III стадии, стадии декомпенсации
жизненно важных органов, дисфункция сменяется полиорганной недостаточностью.
Клинические проявления у конкретного пациента зависят от предшествующих
заболеваний, возраста, от числа и неблагоприятного сочетания органов с
нарушенной функцией (например, одновременная недостаточность печени и легких).
Синдром полиорганной недостаточности обычно развивается в определенной
последовательности: сначала легочная, затем печеночная, желудочнокишечная и
почечная. Последовательность поражения органов зависит от предшествующих
заболеваний.
О недостаточности функций легких
свидетельствует респираторный дистресссиндром взрослых, проявляющийся
выраженной одышкой в покое, отеком легких ("шоковое легкое" -
диффузная инфильтрация легких на рентгеновских снимках), гипоксией. Отмечается
тахикардия (свыше 120 в 1 мин), выраженная гипотензия, для устранения которой
необходимо применять специальное интенсивное лечение. Губы, кончик носа,
конечности становятся синюшными.
У ряда больных отмечается олигурия
или анурия, значительное повышение концентрации мочевины и креатинина,
характерные для почечной недостаточности. Они возникают вследствие гипоперфузии
ткани почки, снижения клубочковой фильтрации, прямого повреждения нефротелия
активированными макрофагами, лейкоцитами и другими медиаторами воспаления.
О печеночной недостаточности
свидетельствует нарушение многих метаболических процессов. Снижается синтез
белков, развивается диспротеинемия, гипоальбуминемия, повышается содержание
билирубина и трансаминаз.
Симптомы поражения ЦНС становятся
более тяжелыми. Развивается мозговая недостаточность: спутанность сознания,
бред, адинамия, иногда сменяющаяся психомоторным возбуждением, эйфорией.
Желудочнокишечная недостаточность
может проявляться эрозивным геморрагическим гастритом, язвами слизистой
оболочки, желудочным кровотечением. Снижается всасывательная способность кишки,
возникает рвота большим количеством желудочнокишечного содержимого с каловым
запахом. При осмотре живота отмечается резкое вздутие его. Перистальтика
кишечника отсутствует. При пальпации отмечается распространенная болезненность
по всему животу.
В анализе крови отмечается высокий
лейкоцитоз с резким сдвигом лейкоцитарной формулы влево, лимфопения, анемия,
снижение гемоглобина и гематокрита. У некоторых больных лейкоцитоз снижается и
может сменяться лейкопенией при истощении защитных механизмов организма. При
посеве крови более чем у половины больных удается выделить бактериальную флору,
что в сочетании с клинической картиной болезни однозначно свидетельствует о
наличии перитонеального сепсиса. Отрицательный результат посева крови при
клинических признаках, свойственных III стадии, не дает оснований для
исключения перитонеального сепсиса.
Нарушения водноэлектролитного
баланса, кислотноосновного состояния достигают максимума по сравнению со II
стадией субкомпенсации. На ЭКГ выявляют признаки, характерные для токсического
повреждения миокарда и гиперкалиемии. Отмечаются признаки гиперкоагуляции и
диссеминированного внутрисосудистого свертывания, которые значительно усиливают
нарушение микроциркуляции, создают условия для ишемии, гипоксии и
дистрофических изменений в паренхиматозных органах, которые существенно
утяжеляют течение заболевания. Появляется акроцианоз, цианоз губ, кончика носа.
Заостряются черты лица, западают глазные яблоки (facies Hippocratica). Facies Hippocratica - это уже не признак перитонита, а
признак приближающейся смерти.
Лечение. Распространенный гнойный перитонит
является абсолютным показанием к экстренному оперативному вмешательству.
Основные принципы лечения перитонита предусматривают:
) раннее удаление пораженного органа,
послужившего причиной развития перитонита, или дренирование гнойников;
2) подавление резидуальной инфекции в
брюшной полости разными способами: а) аспирацией экссудата и тщательным
промыванием брюшной полости растворами (санация полости) во время операции; б)
программированным промыванием (повторной санацией) и ревизией брюшной полости
после опрации; в) длительным промыванием брюшной полости через дренажи; г)
дренированием 1-2 дренажами; д) созданием лапаростомы;
3. применение адекватной
антибактериальной терапии до и после операции;
4. ликвидацию паралитической
непроходимости кишечника (аспирация желудочного и кишечного содержимого через
гастроинтестинальный зонд, промывание и стимуляция перистальтики кишечника);
. интенсивную терапию,
направленную на восполнение дефицита ОЦК, коррекцию нарушений
водноэлектролитного баланса, кислотноосновного состояния, белкового обмена с
помощью массивной инфузионной терапии, парентерального питания,
экстракорпоральной детоксикации;
. поддержание на оптимальном
уровне функционального состояния сердечнососудистой системы, легких
(своевременное проведение искусственной вентиляции), печени, почек (проведение
гемодиализа).
В качестве операционного доступа
используют срединную лапаротомию. Аспирируют экссудат, в тонкую кишку вводят
длинный двухпросветный зонд для аспирации кишечного содержимого. Это создает
благоприятные условия для ревизии всех отделов брюшной полости, включая ранее
наложенные анастомозы. Если источником перитонита является орган, который может
быть удален (аппендикс, желчный пузырь, некротический участок кишки), а условия
позволяют это сделать, то его удаляют (аппендэктомия, холецистэктомия, резекция
кишки и т. п.). В случае перфорации полого органа (язва желудка,
двенадцатиперстная кишка) ушивают перфоративное отверстие или производят более
радикальную органосохраняющую операцию на желудке. Некротизированные участки
кишки при механической кишечной непроходимости или тромбозе мезентериальных
сосудов резецируют. Если позволяют условия, то концы резецированной тонкой
кишки соединяют анастомозом. После резекции толстой кишки концы ее выводят на
переднюю брюшную стенку. Аборальный конец кишки иногда закрывают наглухо, т. е.
накладывают одноствольную колостому. Через несколько недель после выздоровления
восстанавливают непрерывность к и ш к и . Если орган, послуживший причиной
перитонита, удалить или вывести на брюшную стенку нельзя, то приходится
ограничиваться удалением гноя, подведением дренажей для аспирации гнойного или
кишечного содержимого. Тампоны для отграничения очага инфекции от остальных
отделов брюшной полости применяют редко, по специальным показаниям.
Брюшную полость в конце операции
тщательно промывают 10-15 л изотонического раствора натрия хлорида до чистой
воды. К 1 л раствора натрия хлорида необходимо добавлять 100 мл 3% раствора
перекиси водорода. Выделяющийся при контакте с воспаленными тканями активный
кислород пагубно действует на анаэробные возбудители. К последней порции
жидкости для промывания добавляют раствор антисептического вещества (диоксидин,
хлоргексидин, гипохлорид натрия, фурацилин). В процессе санации брюшной полости
удаляют рыхлые налеты фибрина, содержащие, как правило, большое количество
микроорганизмов.
Для декомпрессии кишечника в тонкую
кишку через рот или носовой ход проводят длинный двухпросветный зонд с
множественными отверстиями. Через зонд из просвета кишечника аспирируют
жидкость и газы, периодически промывают кишечник, вводят энтеросорбенты и
антибактериальные вещества. Зонд на некоторое время рекомендуется ввести в
прямую кишку для удаления содержимого толстой кишки, в котором имеется
наибольшая концентрация микроорганизмов.
При невозможности проведения зонда в
кишечник в некоторых хирургических учреждениях накладывают илеостому.
Выполнение илеостомии или энтеротомии для опорожнения кишечника при перитоните
нежелательно, так как эта процедура часто дает опасные осложнения.
В корень брыжейки тонкой кишки в
начале или в конце операции вводят 100-120 мл 0,25% раствора новокаина для
предотвращения пареза кишки.
Для дренирования брюшной полости при
распространенном гнойном или гнилостном перитоните дренажи вводят в полость
малого таза (справа и слева), под диафрагму (с обеих сторон) и под печень. Все
дренажи выводят через отдельные проколы брюшной стенки по передней аксиллярной
линии. На операционном столе в брюшную полость вводят 1-2 л раствора, для того
чтобы убедиться в полноценности оттока жидкости и экссудата по дренажам. Рану
передней брюшной стенки зашивают наглухо или только до подкожной клетчатки,
чтобы избежать раннего нагноения. Через 3 - 4 дня рану закрывают наглухо.
Экссудат, накапливающийся после операции, будет оттекать пассивно по установленным
дренажам.
Если во время операции выявлен
распространенный гнойный перитонит, а источник инфекции удален, то для
подавления резидуальной инфекции через установленные дренажные трубки
осуществляют постоянное промывание (перитонеальный диализ/лаваж) брюшной
полости. Предполагают, что этим достигается дальнейшее механическое очищение
брюшной полости от резидуальной инфекции. В первые же сутки в верхние дренажи
капельно вводят изотонический раствор хлорида натрия с добавлением к нему
калия, натрия, хлора, кальция, учитывая их содержание в крови (рис. 26.1).
Отток раствора происходит через
нижние дренажи. Необходимо следить за тем, чтобы жидкость не накапливалась в
брюшной полости, а количество введенной и выделенной жидкости было одинаковым.
Такой способ промывания (диализа) называют проточным. Если количество
оттекающей жидкости значительно меньше количества вводимой, то для
предотвращения задержки жидкости в животе переходят на фракционное промывание.
В этом случае вводят раствор в тот или иной дренаж и на несколько часов
перекрывают его, а затем аспирируют жидкость и экссудат. Фракционное промывание
уступает по эффективности проточному. При проточном промывании в течение суток
капельно в брюшную полость вводят 8-10 л раствора, при фракционном - 2-3 л.
Проточное промывание проводят в течение 2-3 дней. За это время, как правило,
удается более или менее хорошо отмыть брюшную полость, удалить накапливающийся
экссудат и пленки фибрина. Несмотря на промывание в брюшной полости образуются
рыхлые спайки, отграничивающие дренажи от свободной брюшной полости,
препятствующие ирригации всех отделов ее. Дальнейшее проведение промывания
становится нецелесообразным.
Недостатками проточного и
фракционного промывания является большая частота (до 20%) формирования межкишечных,
поддиафрагмальных и тазовых абсцессов вследствие слипания петель кишечника и
отграничения экссудата в образовавшемся пространстве. Примерно так же часто
возникают абсцессы при дренировании без промывания.
В настоящее время для лечения
распространенного гнойного перитонита с успехом применяют программированное, т.
е. заранее запланированное, промывание (повторную ревизию и санацию) брюшной
полости. В этом случае после операции края раны брюшной стенки лишь сближают
швами на специальных прокладках. Иногда к краям апоневроза прямых мышц живота
подшивают застежку "молния" или нейлоновую сетку, для того чтобы
быстро, без дополнительной травмы тканей можно открывать и закрывать рану
передней брюшной стенки при повторных ревизиях и санации. Через не полностью
закрытую рану (лапаростому) происходит отток экссудата из брюшной полости. В
зависимости от общего состояния пациента через 24- 48 ч проводят повторную
ревизию брюшной полости, промывая ее, как во время операции. У больных с
запущенными формами гнойного перитонита в среднем требуется 35 сеансов этапного
промывания. Повторные ревизии прекращают, когда брюшная полость становится
чистой, а экссудат прозрачным. Данная методика позволяет более радикально
справляться с резидуальной инфекцией, предотвращать формирование абсцессов,
существенно улучшить результаты лечения.
Не следует рассматривать
программированное промывание как лапаростому. При лапаростомии повторные
ревизии и санации брюшной полости не производятся. При перевязках лишь меняют
тампоны, закрывающие рану, а иногда тупым путем в пределах видимости разделяют
рыхлые спайки между петлями кишечника и с краями брюшины. Если же источник
перитонита во время первой операции не был ликвидирован (например, при
несостоятельности пищеводно или желудочнокишечного анастомозов), то применение
данного способа лечения нецелесообразно.
При местном серозном перитоните после
удаления органа, послужившего причиной перитонита, достаточно провести
локальное промывание, ввести дренаж и закрыть рану. При серозногнойном перитоните,
распространившемся на нижнюю или верхнюю часть брюшной полости, необходима
тщательная санация и дренирование 1-2 двухпросветными трубками. При местном
диффузном перитоните с серозным выпотом вблизи воспаленного органа после
удаления последнего рану промывают, вводят дренаж и зашивают.
Антибактериальная терапия включает
введение антибиотиков внутривенно или внутримышечно. Эндолимфатическое и
внутриартериальное введение не имеет существенных преимуществ. Основная цель -
создание оптимальной концентрации препарата в крови в течение всего периода
лечения - может быть достигнута внутривенным и внутримышечным введением
препаратов. Перед операцией, за 1 ч до ревизии брюшной полости, необходимо
ввести антибиотики широкого спектра действия (цефалоспорины последнего
поколения, аминогликозиды, метронидазол или карбопенемы). Предпочтение отдается
комбинации из 2-3 препаратов разных групп, для того чтобы воздействовать на
анаэробную и аэробную флору. С целью предотвращения диссеминации и попадания
микроорганизмов в кровь желательно, чтобы травматичный этап операции совпал с
пиком концентрации антибиотиков в крови. Трехкомпонентную антибиотикотерапию
(по одному препарату из перечисленных выше групп антибиотиков) целесообразно
продолжать до получения ответа из бактериологической лаборатории. После
получения результатов бактериологического исследования экссудата и крови
назначают антибиотики с учетом чувствительности микрофлоры. Дозировку
антибактериальных препаратов устанавливают, оценивая функциональное состояние
печени и почек больного.
Лечение паралитической непроходимости
кишечника начинают уже на операционном столе. В корень брыжейки тонкой кишки
вводят 0,25% раствор новокаина, в просвет - назоинтестинальный двухпросветный
зонд для аспирации содержимого и декомпрессии кишечника. Декомпрессия позволяет
улучшить микроциркуляцию стенок кишечника, удалить эндотоксины и
микроорганизмы, уменьшить интоксикацию. Зонд целесообразно провести возможно
дальше от трейтцевой связки. В послеоперационном периоде производят постоянную
аспирацию содержимого кишечника и желудка. Через зонд можно вводить
энтеросорбенты, не всасывающиеся в кишечнике антибактериальные препараты.
Периодически зонд и кишечник необходимо промывать. Указанные мероприятия
позволяют уменьшить интоксикацию и транслокацию эндотоксинов и бактерий. Для
стимуляции кишечника используют антихолинэстеразные препараты, накожную
электростимуляцию кишечника, клизмы.
Перед операцией и после нее
необходимо проводить адекватную интенсивную терапию для коррекции нарушений
гомеостаза. Это является важнейшим компонентом лечения перитонита! При
проведении инфузионной терапии количество внутривенно вводимой жидкости
определяют, исходя из рассчета 40-45 мл жидкости на 1 кг массы тела пациента (в
среднем 3-4 л/сут). При этом необходимо учитывать и восполнять ощутимые потери
воды и электролитов (потери жидкости с мочой, рвотой, выделениями по дренажам и
кишечному зонду), а также неощутимые потери (выделение жидкости с потом и
выдыхаемым воздухом) - приблизительно 1 - 1 , 5 л/сут.
Для проведения инфузионной терапии и
контроля за ее полноценностью сразу после поступления тяжело больного в
стационар ему необходимо ввести зонд в желудок для предотвращения аспирации
содержимого желудка в дыхательные пути при индукции наркоза, подключичный катетер
для быстрого восполнения ОЦК и измерения центрального венозного давления с
целью контроля за адекватностью введения растворов. В мочевой пузырь вводится
катетер для измерения почасового диуреза. Инфузионная терапия считается
адекватной, если центральное венозное давление удается довести и поддерживать
на нормальных цифрах и восстановить диурез до 40-50 мл/ч.
С учетом содержания электролитов в
крови и кислотноосновного состояния, сначала внутривенно вводят кристаллоидные
растворы для быстрого восполнения дефицита ОЦК (0,9% раствор натрия хлорида,
трисамин, 5% и 10% растворы глюкозы, раствор Дарроу и др.), затем коллоидные
растворы для поддержания онкотического давления плазмы и удержания жидкости в
сосудистом русле (полиглюкин, реополиглюкин, гемодез, плазму крови, альбумин и
другие инфузионные препараты). По строгим показаниям производят переливание
эритроцитной массы.
Для парентерального питания
используют 10-20% растворы глюкозы, легкоусвояемые растворы аминокислот,
жировые эмульсии и другие специально приготовленные растворы. Потребности
пациента в питании (в калориях) следует мониторировать так же, как частоту
пульса и артериального давления. Многоцентровые исследования метаболизма
показали, что более 30% пациентов в отделениях интенсивной терапии голодают.
Дефицит в калориях за время пребывания в отделении интенсивной терапии у 30%
больных достигает 10000 калорий. Это эквивалентно голоданию здорового человека
в течение 5 дней. Позднее, когда восстановится перистальтика кишечника,
приступают к энтеральному зондовому, а затем и пероральному питанию.
Для устранения синдрома
диссеминированного внутрисосудистого свертывания применяют препараты,
улучшающие реологические свойства крови (реополиглюкин, дезагреганты, гепарин).
Для дезинтоксикации организма используют
методику гемодилюции с форсированным диурезом (введение фуросемида), в более
тяжелых случаях - экстракорпоральные методы очищения организма от продуктов
метаболизма и токсичных веществ (плазмаферез - более эффективный метод, а также
плазмо и гемосорбцию). Заслуживает осуждения подключение селезенки свиньи. Это
равнозначно ксенотрансплантации. В течение 40-60 мин в селезенке развивается
сверхострая реакция отторжения, сосуды ее тромбируются, кровь реципиента
перестает поступать в подключенную селезенку. В ответ на поступление в кровь
реципиента чужеродных белков стимулируется тот же механизм защиты против
антигенной агрессии, который организм использует от агрессии эндотоксинов
микроорганизмов. Гиперстимуляция макрофагов и других цитокин продуцирующих
клеток, как упоминалось выше, может быть опасной. Эффективность метода в
рандомизированном сравнительном исследовании не доказана. Вместе с тем жизнь
пациента подвергается дополнительному риску заражения вирусами животных,
избыточной стимуляции иммунной системы антигенами и белками животных.
Для устранения дыхательной
недостаточности широко применяют искусственную вентиляцию легких.
При острой почечной недостаточности
осуществляют гемодиализ - для выведения азотистых шлаков и гемофильтрацию - для
удаления избытка воды. Изменяя содержание электролитов в диализирующей
жидкости, можно во время диализа удалить избыток калия из плазмы. Эти способы
помогают эффективно лечить полиорганную недостаточность.
114.
Перитониты. Борьба с нарушениями гемодинамики и микроциркуляции, гидроионными
нарушениями, парезом кишечника, интоксикацией. Принципы инфузионной терапии и
парентерального питания.
См. выше
115. Отграниченные перитониты
(поддиафрагмальный, подпеченочный, межкишечный, прямокишечно маточный и
прямокишечнопузырный). Причины возникновения. Клиника, диагностика, лечение.
Роль чрескожного дренирования под контролем УЗИ
Абсцессы при перитоните возникают в типичных местах,
где имеются благоприятные условия для задержки экссудата и отграничения его
рыхлыми спайками. Наиболее часто они локализуются в субдиафрагмальном,
подпеченочном пространствах, между петлями кишечника, в боковых каналах, в
подвздошной ямке, в дугласовом пространстве малого таза. Абсцесс может
сформироваться вблизи воспаленного органа (червеобразный отросток, желчный
пузырь и др.). Раннее отграничение воспаления предупреждает развитие диффузного
перитонита.
Клиническая картина и диагностика. Клинические
проявления абсцессоввесьма разнообразны: от легкого, почти бессимптомного
течения до тяжелого, характерного для синдрома системной реакции на воспаление,
сепсиса и полиорганной недостаточности. Одним из тяжелых осложнений является
прорыв гноя в свободную брюшную полость. Симптомы зависят от локализации
гнойников.
Поддиафрагмальные и подпеченочные абсцессы могут
образоваться в процессе лечения распространенного перитонита вследствие
осумкования экссудата под диафрагмой, в малом тазу, т. е. в местах, где
происходит наиболее интенсивное всасывание экссудата. Нередко они являются
осложнением различных операций на органах брюшной полости или острых
хирургических заболеваний органов живота. Клиническая картина и диагностика.
Больных беспокоят боли в правом или левом подреберье, усиливающиеся при
глубоком вдохе. В ряде случаев они иррадиируют в спину, лопатку, плечо
(раздражение окончаний диафрагмального нерва). Температура тела повышена до
фебрильных цифр, имеет интермиттирующий характер. Пульс учащен. Лейкоцитоз со
сдвигом формулы влево и повышение СОЭ. Иногда абсцесс проявляется лишь
повышением температуры тела. В тяжелых случаях наблюдается симптоматика,
характерная для синдрома системной реакции на воспаление, сепсиса,
полиорганной недостаточности. При бессимптомном течении осмотр больного не дает
существенной информации. Заподозрить абсцесс при отсутствии других заболеваний
можно при наличии субфебрильной температуры, ускоренной СОЭ, лейкоцитоза,
небольшой болезненности при надавливании в межреберьях, поколачивании по
правой реберной дуге. При тяжелом течении болезни имеются жалобы на постоянные
боли в правом подреберье, боли при пальпации в правом или левом подреберье, в
межреберных промежутках (соответственно локализации абсцесса). Иногда в этих
областях можно определить некоторую пастозность кожи. Симптомы раздражения
брюшины определяются нечасто. В общем анализе крови выявляют лейкоцитоз,
нейтрофилез, сдвиг лейкоцитарной формулы крови влево, увеличение СОЭ, т. е.
признаки, характерные для гнойной интоксикации.
Рентгенологическое исследование позволяет выявить
высокое стояние купола диафрагмы на стороне поражения, ограничение ее
подвижности, "сочувственный" выпот в плевральной полости. Прямым
рентгенологическим симптомом поддиафрагмального абсцесса является наличие
уровня жидкости с газовым пузырем над ним. Наиболее ценную для диагноза информацию
дают ультразвуковое исследование и компьютерная томография.
Лечение. Показано дренирование абсцесса, для чего в
настоящее время чаще используют малоинвазивные технологии. Под контролем
ультразвукового исследования производят чрескожную пункцию абсцесса, аспирируют
гной. В полость гнойника помещают специальный дренаж, через который можно
многократно промывать гнойную полость и вводить антибактериальные препараты.
Процедура малотравматична и гораздо легче переносится больными, чем открытое
оперативное вмешательство. Если эту технологию применить невозможно, то полость
абсцесса вскрывают и дренируют хирургическим способом. Применяют как
чрезбрюшинный, так и внебрюшинный доступ по Мельникову. Последний метод
предпочтительнее, так как позволяет избежать массивного бактериального
обсеменения брюшной полости.
Клиническая картина и диагностика. Больные предъявляют
жалобы на постоянные боли, тяжесть в нижней части живота, тенезмы, жидкий стул
со слизью, частые позывы на мочеиспускание. Температура тела может быть повышенной.
В тяжелых случаях, как при всяком тяжелом гнойном заболевании, развивается
синдром системной реакции на воспаление. Температура тела повышается до
38-39°С с суточным колебанием в 2 - 3° С. Возникает тахикардия, тахипноэ,
лейкоцитоз свыше 12 000. При пальпации живота, как правило, не удается выявить
защитного напряжения мышц передней брюшной стенки и перитонеальных симптомов.
Лишь при распространении воспаления по брюшине в проксимальном направлении за
пределы малого таза появляется мышечная защита. При пальцевом исследовании
прямой кишки определяют нависание ее передней стенки, плотное образование
(инфильтрат, нижний полюс абсцесса), болезненное при ощупывании. У женщин это
плотное образование пальпируется при исследовании через влагалище. Отмечается
резкая болезненность при надавливании на шейку матки и смещении ее в стороны.
Наиболее точную информацию о наличии абсцесса дает УЗИ и компьютерная
томография. Достоверные данные можно получить при пункции заднего свода
влагалища или передней стенки прямой кишки у мужчин в месте наибольшего
размягчения инфильтрата.
Лечение. Основной метод лечения - дренирование
абсцесса и адекватная антибиотикотерапия. Дренирование может быть произведено
малоинвазивным способом под контролем УЗИ или хирургическим методом. Операцию
выполняют под наркозом. Для доступа к абсцессу осуществляют насильственное
расширение ануса. Через переднюю стенку прямой кишки, в месте наибольшего
размягчения, абсцесс пунктируют и вскрывают по игле. Образовавшееся отверстие
расширяют корнцангом, в полость абсцесса вводят дренажную трубку.
Для антибиотикотерапии используют препараты широкого
спектра действия, чтобы подавить развитие анаэробной и аэробной микрофлоры.
Межкишечные абсцессы развиваются при распространенном
перитоните, при острых хирургических и гинекологических заболеваниях органов
брюшной полости.
Клиническая картина и диагностика. Больных беспокоят
тупые боли в животе умеренной интенсивности, без четкой локализации,
периодическое вздутие живота. По вечерам температура тела повышается до 38°С и
выше. Живот остается мягким, признаков раздражения брюшины нет, и лишь при
близкой локализации гнойника к передней брюшной стенке и при его больших
размерах определяется защитное напряжение мышц передней брюшной стенки. В
анализах крови выявляют умеренный лейкоцитоз, ускорение СОЭ. При больших
размерах абсцесса на рентгеновских снимках выявляется очаг затемнения, иногда с
уровнем жидкости и газа. Компьютерная томография и ультразвуковое исследование
являются основными способами диагностики.
Лечение. Полость абсцесса пунктируют и дренируют под
контролем ультразвукового исследования, компьютерной томографии или
лапароскопии. При невозможности использования этого способа абсцесс вскрывают
хирургическим путем через лапаротомный разрез.
116.
Гинекологические перитониты. Клиника, диагностика, лечение.
Выделяют неспецифические и
специфические перитониты. Неспецифический генитальный перитонит возникает при
прорыве в брюшную полость гноя из воспалившихся маточных труб и яичников,
гнойников параметрия, нагноившейся кисты яичника, при перекруте ее ножки.
Генитальные перитониты развиваются также в послеродовом периоде и после
внебольничных септических абортов за счет распространения инфекции из матки
(метроэндометрит) лимфогенным или гематогенным путем. Еще одна возможная
причина возникновения перитонита - попадание микрофлоры в брюшную полость при
проникающих повреждениях матки (перфорация во время аборта).
Воспалительный процесс может
захватывать только полость таза, вызывая пельвиоперитонит, но может
распространяться и на большую часть поверхности брюшины - возникает
распространенный перитонит.
Пельвиоперитонит протекает относительно
доброкачественно. Наблюдаемые в начале болезни тупые боли внизу живота, высокая
температура тела под влиянием массивной антибактериальной терапии через
некоторое время уменьшаются, экссудат рассасывается, наступает выздоровление.
При прогрессировании пельвиоперитонита развивается распространенный перитонит,
проявляющийся синдромом системной реакции на воспаление. При отграничении
воспаления формируется абсцесс в малом тазу.
Клиника и диагностика. Имеются типичные боли в нижней части
живота с обеих сторон. Температура тела обычно более высокая, чем при остром
аппендиците. Отмечаются выделения из влагалища. При вагинальном исследовании
заметны гнойные выделения из цервикального канала, резкая болезненность при
смещении шейки матки вверх и в стороны, увеличенные и болезненные придатки
матки. В отличие от острого аппендицита при пельвиоперитоните и абсцессе
определяются боли при смещении шейки матки в обе стороны. Выделения из
цервикального канала необходимо взять для бактериологического исследования. УЗИ
и компьютерная томография дают наиболее ценную информацию для дифференциальной
диагностики.
Лечение проводится в соответствии со стадией
развития воспалительного процесса. Диффузный пельвиоперитонит лечат так же, как
распространенный перитонит. При отграничении воспаления в малом тазу показано
вскрытие абсцесса и его дренирование. Используют доступ через задний свод
влагалища (задняя кольпотомия). В полость абсцесса вводят дренаж для аспирации
содержимого и промывания. Абсцесс можно дренировать под контролем УЗИ.
Параллельно с хирургическим лечением проводят массивную антибиотикотерапию
препаратами широкого спектра действия, способными подавить развитие анаэробной
и аэробной инфекции.
Специфический пельвиоперитонит чаще обусловлен гонококками или
хламидиями. Первые симптомы появляются через неделю после инокуляции инфекции.
Они проявляются уретритом, бартолинитом, выделениями из цервикального канала и
влагалища. Воспаление труб наступает позднее, преимущественно во время
очередной менструации. В этот период инфекция быстро распространяется из
цервикального канала на эндометрий и эндосальпинкс. Наиболее ярко инфекция
проявляется в фаллопиевых трубах, откуда она распространяется на брюшину малого
таза. Примерно у 15% больных гонореей развивается пельвиоперитонит,
проявляющийся интенсивными болями внизу живота, тенезмами, жидким стулом,
повышением температуры тела. Живот вздут, при пальпации отмечается
болезненность в его нижнем отделе. Напряжение мышц передней брюшной стенки и
симптом Щеткина-Блюмберга обычно отсутствуют. При пальцевом исследовании прямой
кишки и исследовании через влагалище выявляются признаки воспаления тазовой брюшины,
серозногнойные выделения из влагалища.
Лечение. Гонорейный пельвиоперитонит лечат
большими дозами антибиотиков. В остром периоде назначают холод на живот,
дезинтоксикационную и антибактериальную терапию. Прогноз благоприятный. Тазовые
абсцессы дренируют под контролем УЗИ или вскрывают через свод влагалища.
117. Туберкулезный перитонит.
Классификация. Клиника, диагностика, лечение
В настоящее время эта форма
перитонита встречается чаще, чем в 70- 80е годы, в связи с ростом
заболеваемости туберкулезом. Туберкулезные возбудители проникают в брюшную
полость тремя путями: 1) трансмурально из пораженной туберкулезом кишки или из
мезентериальных лимфатических узлов; 2) из фаллопиевых труб; 3) гематогенным
путем из отдаленного туберкулезного очага. Большинство пациентов при
рентгенологическом исследовании не имеют признаков туберкулеза легких или
желудочнокишечного тракта, однако на аутопсии у подавляющего большинства
обнаруживаются очаги туберкулеза в разных органах.
Клиническая картина и диагностика. Выделяют экссудативную,
казеозноязвенную и фиброзную формы туберкулезного перитонита. При экссудативной
форме наблюдаются нарастающий асцит, повышенная температура, боли в животе,
слабость. Фиброзная и казеозноязвенная формы проявляются теми же симптомами, но
без асцита; и в том, и в другом случае на поверхности брюшины имеются
туберкулезные бугорки. Скопившаяся в животе асцитическая жидкость представляет
собой транссудат.
Наиболее часто наблюдается
хронический туберкулезный перитонит, при фиброзной и казеозной форме которого
может возникать частичная или полная непроходимость кишечника вследствие
образования спаек, казеозного конгломерата, состоящего из сальника и петель
кишки. Иногда формируются свищи. Картина распространенного перитонита
наблюдается редко. В диагностике помогают данные анамнеза о перенесенном
туберкулезе, выявление пораженного туберкулезом органа, положительная проба
Манту. Наиболее точные сведения о туберкулезном характере поражения дает
лапароскопия с прицельной биопсией и посевом полученного материала.
Положительный результат посева бывает менее чем в 50% случаев. При исследовании
жидкости из брюшной полости выявляется значительное число лимфоцитов и редко -
туберкулезные бактерии.
Лечение. Обычно проводят консервативную
терапию с учетом современных принципов лечения туберкулеза. При появлении
симптомов острой непроходимости кишечника или распространенного перитонита
показано хирургическое вмешательство.
118. Проникающие и непроникающие
повреждения грудной клетки. Классификация. Клиника. Диагностика. Принципы
лечения
Повреждения грудной клетки и органов,
находящихся в ней, разделяют на закрытые и открытые (открытые подробно
рассматриваются в курсе военнополевой хирургии).
К закрытым относятся повреждения
костного каркаса грудной клетки и расположенных в нем органов без повреждения
кожи. В мирное время они встречаются значительно чаще открытых. Основная
причина этого вида травмы - дорожнотранспортные происшествия, а также природные
и производственные катастрофы.
Закрытую травму можно подразделить на
две группы, определяющие тяжесть травмы: а) без повреждения внутренних органов;
б) с повреждением внутренних органов (легкие, бронхи, крупные сосуды, сердце).
Другим критерием тяжести является разделение на травму с повреждением и без
повреждения костей грудной клетки. И в том и в другом случае травма может быть
изолированной, а также может сопровождаться повреждением внутренних органов.
Чаще всего при закрытой травме груди
травмируются легкие (60,0%), ребра (45,4%), сердце (7,7%), позвоночник (4,8%),
значительно реже - диафрагма, крупные сосуды и крупные бронхи.
Плевра, межреберные сосуды, легкие,
бронхи и сосуды легких повреждаются преимущественно острыми концами сломанных
ребер, а также резким сдавлением грудной клетки, вызывающим повышение давления
в легких, бронхах, сосудах. В результате местами возникает разрыв легочной
ткани, бронхов, сосудов, сердца, кровотечение в плевральную полость
(гемоторакс), скопление воздуха в плевральной полости (пневмоторакс, клапанный
пневмоторакс, пневмогемоторакс). Воздух из поврежденной легочной ткани и
бронхов часто накапливается в клетчатке средостения (эмфизема средостения),
распространяется на шею и подкожную клетчатку груди (подкожная эмфизема). Ее
легко распознать по изменению контуров шеи, лица, передней грудной стенки и по
характерной крепитации при надавливании пальцами или стетоскопом на кожу
соответствующей области.
Скопление слизи и крови в бронхах
вследствие подавления кашлевого рефлекса изза болей приводит к частичной или
полной обтурации их, развитию ателектаза долей легкого. Ателектаз, сдавление
легочной ткани вследствие гемоторакса, пневмоторакса (особенно клапанного),
способствует увеличению степени гипоксии и дыхательной недостаточности. В
сочетании с кровопотерей эти изменения вызывают шок, на фоне которого
развивается картина шокового легкого. Состояние больного становится
критическим, требующим немедленных мероприятий для восстановления функций
нарушенных органов.
Сдавление грудной клетки тяжелыми предметами приводит к
резкому уменьшению объема ее, сдавлению легких и спазму голосовой щели. Это
вызывает резкое повышение давления в легких и в сосудах верхней полой вены. В
результате внезапного запредельного повышения давления в легких происходят
многочисленные разрывы альвеол и мелкие кровоизлияния. Острое повышение
давления в ветвях верхней полой вены, не имеющей клапанов, передается на
периферические мелкие вены, что и приводит к разрыву мелких кожных венозных
капилляров в верхней части туловища с образованием множественных петехиальных
кровоизлияний. Кожа, склеры, язык, слизистые оболочки ротовой полости
приобретают в результате этого фиолетовую окраску, за исключением участков
кожи, к которым плотно прилегала одежда и оказывала в известной мере
препятствие для кровоизлияний. На этих участках кожа сохраняет нормальную
окраску. Закрытые повреждения груди этого типа называют травматической
асфиксией.
Ушиб мягких тканей часто сочетается с переломом ребер.
На месте ушиба груди возникает гематома. При обширной травме груди ребера
ломаются в двух местах - в передней и задней части, возникают так называемые
окончатые переломы. Часть грудной клетки в зоне расположения "окончатого
перелома" западает на вдохе и выбухает при выдохе (парадоксальное
дыхание).
Клиника и диагностика. Как при любой тяжелой механической травме,
больные прежде всего жалуются на сильные боли на поврежденной стороне груди,
усиливающиеся при движениях, кашле, глубоком дыхании. При повреждении легочной
ткани наблюдаются одышка, частый кашель и кровохарканье. При массивной
кровопотере в плевральную полость наблюдаются характерные симптомы: учащение
пульса, снижение артериального давления, бледность кожных покровов, сосудистая
и дыхательная недостаточность, шок.
В области повреждения мягких тканей
груди и перелома ребер часто видна гематома. При пальпации этой области
отмечается резкая болезненность, особенно выраженная при переломе ребер. Иногда
ощущается крепитация костных отломков. При повреждении легочной ткани можно
определить подкожную эмфизему по характерной крепитации воздуха, скопившегося в
мягких ткнях грудной клетки.
При тяжелых множественных
повреждениях каркаса грудной клетки, легких и сосудов отчетливо определяются
признаки кровопотери, дыхательной и сосудистой недостаточности, пневмо и
гемоторакса. Клиническая симптоматика их будет приведена ниже.
Травматическую асфиксию легко распознать по характерной
синюшной окраске верхней части туловища, петехиальным кровоизлияниям на коже,
одышке. Иногда наблюдается временная потеря зрения и слуха в связи с
кровоизлияниями в эти органы.
При небольших надрывах бронхов или
трахеи состояние больных некоторое время может оставаться удовлетворительным, а
первые симптомы появляются довольно поздно вследствие образования рубца,
вызывающего стеноз поврежденного бронха. Диагноз ставят на основании данных бронхоскопии,
при которой обнаруживают разрыв стенки трахеи.
Лечение. При любом повреждении грудной клетки
первейшая задача врача - устранить боль. Вслед за этим предпринимают
мероприятия в зависимости от характера повреждения.
При переломе ребер без повреждения
внутренних органов и ушибе мягких тканей достаточно ограничиться обезболиванием
и предоставлением покоя.
При повреждении внутренних органов,
сопровождающихся гемотораксом и пневмотораксом, наблюдается резко выраженная
одышка, дыхательная и сердечнососудистая недостаточность (шок). В этих случаях
необходимо применить все средства реанимации и интенсивной терапии для борьбы с
шоком, кровопотерей, сердечнолегочной недостаточностью. Важнейшее значение при
этом имеет своевременная постоянная аспирация крови и воздуха из плевральной
полости, предпринимаемые для того, чтобы расправить коллабированное легкое,
восстановить трахеобронхиальную проходимость, предупредить инфицирование
плевральной полости, для чего рекомендуется дренировать ее дренажной трубкой диаметром
не менее 15 мм, а при небольшом скоплении крови или воздуха - ограничиться
пункциями.
Одновременно с этим необходимо
восполнить кровопотерю, восстановить кислотноосновное сосотояние и
водноэлектролитный баланс, провести необходимые противошоковые мероприятия.
Оперативное вмешательство
(торакотомия) показано в тех случаях, когда через дренажную трубку выделяется
более 250 мл крови в час. При наличии видеоторакоскопическй техники можно
провести видеоторакоскопию. Это позволит не только определить характер
повреждения легких, интенсивность кровотечения, но и провести торакоскопическое
оперативное вмешательство, т. е. остановить кровотечение, произвести краевую
резекцию и другие необходимые вмешательства на разрушенной части легкого,
удалить скопление крови и воздуха, установить дренажные трубки для постоянной
аспирации содержимого плевральной полости.
Показания к торакотомии при закрытых
и открытых повреждениях органов грудной полости определяют как неотложные,
срочные и отсроченные. Неотложные торакотомии производят при остановке сердца,
профузном внутриплевральном кровотечении, возникшем в связи с повреждением
сердца и крупных сосудов, а также при быстро нарастающем клапанном
пневмотораксе. Срочные торакотомии показаны при продолжающемся кровотечении, когда
из плевральной полости через дренаж выделяется более 250-300 мл крови в час,
при подозрении на ранение сердца и крупных сосудов, при некупирующемся
нарастающем клапанном пневмотораксе. Срочные операции производят через 3-5 дней
преимущественно по поводу осложнений, таких как свернувшийся гемоторакс,
безуспешная попытка остановить нарастание пневмоторакса. Указанные операции
могут быть произведены менее травматичным торакоскопическим способом. Наиболее
частыми осложнениями повреждений органов грудной полости являются пневмония,
свернувшийся гемоторакс, эмпиема плевры, пиопневмоторакс и др.
119.
Проникающие и непроникающие повреждения живота. Классификация. Клиника.
Диагностика. Принципы лечения
Различают проникающие ранения живота
и тупую травму живота. Любое проникающее ранение может сопровождаться
повреждением органов, что в свою очередь ведет либо к развитию перитонита, либо
к внутрибрюшному кровотечению. Поэтому при всяком проникающем ранении живота,
каким бы незначительным оно ни казалось, больному показана срочная
лапароскопия, если диагноз не совсем ясен. При наличии видеолапароскопической
аппаратуры и специалистов, владеющих ею, одновременно с уточнением диагноза
может быть произведено оперативное вмешательство, например удаление
воспаленного червеобразного отростка, холецистэктомия, остановка кровотечения
из поврежденных сосудов, оперативные вмешательства на желудке и органах малого
таза у женщин.
Тупая травма живота может вызвать разрыв селезенки,
печени, брыжейки кишечника с кровотечением в брюшную полость. В ряде случаев
наблюдается повреждение паренхиматозных органов без нарушения целости капсулы.
Развивается подкапсульная гематома. Позднее могут произойти разрыв капсулы и
кровотечение в брюшную полость.
Возможно повреждение забрюшинно
расположенных органов (поджелудочная железа, двенадцатиперстная кишка, почки).
Спустя несколько дней после травмы на фоне повреждения этих органов может
развиться перитонит вследствие инфицирования излившейся крови, поступления
инфицированного содержимого из поврежденных органов или вследствие транслокации
микрофлоры кишечника через неповрежденную стенку. Предпосылками для этого
служат парез кишечника, нередко сопровождающий тупую травму живота, и
ослабление защитного барьера слизистой оболочки кишечника.
При травме нижнего отдела живота
возможен разрыв мочевого пузыря (при наполненном мочевом пузыре). При
внутрибрюшном разрыве мочевого пузыря истечение мочи в свободную брюшную
полость быстро вызывает перитонит. Внутрибрюшинный разрыв мочевого пузыря часто
сочетается с тяжелыми переломами костей таза со смещением отломков. Почти
всегда такие травмы сопровождаются гематурией и расстройствами мочеиспускания
вплоть до острой задержки мочи. При повреждении внебрюшной части мочевого
пузыря на первое место выступают задержка мочеиспускания и инфекционные
осложнения (мочевые затеки, флегмоны). УЗИ позволяет подтвердить клинические
данные о скоплении жидкости (мочи) в нижней части брюшной полости.
Дополнительными методами диагностики являются цистография и цистоскопия.
Обследование больного с тупой травмой
живота начинают с
осмотра, при котором уже внешние признаки травмы (подкожные и внутрикожные
кровоизлияния) могут служить первым указанием для постановки диагноза. Так,
подкожные кровоизлияния в левом подреберье, резкие боли в этой области с
иррадиацией в левое надплечье позволяют предположить повреждение селезенки.
Боль в правом подреберье с иррадиацией в правое надплечье заставляет
заподозрить повреждение печени.
Симптомами внутрибрюшного
кровотечения являются бледность кожных покровов, учащение пульса, снижение
артериального давления и гематокрита, гиповолемический шок. При исследовании
живота может наблюдаться значительная болезненность, тупая постоянная боль. УЗИ
может достоверно определить жидкость (кровь, моча, экссудат) в брюшной полости.
Это наиболее точный и высокоспецифичный метод определения внутрибрюшных
повреждений и воспалительных заболеваний. По специфичности УЗИ уступает
лапароскопическому исследованию. При лапароскопии можно не только
диагностировать характер повреждения, но и остановить кровотечение, произвести
необходимое вмешательство на поврежденном органе.
При повреждении полого органа явления
перитонита развиваются не сразу после травмы, поэтому больной с подозрением на
возможное повреждение должен находиться под наблюдением хирурга. Необходимы
также повторные исследования с помощью ультразвуковой, эндоскопической
аппаратуры и повторные анализы крови.
При подозрении на перитонит или
кровотечение после травмы живота пальцевое исследование через прямую кишку и
исследование через влагалище помогают уточнить диагноз. Болезненность при
надавливании на переднюю стенку прямой кишки или влагалища у женщин, боли при
смещении шейки матки, нависание стенок являются признаками воспаления брюшины
малого таза. Следует помнить, что к моменту установления диагноза
"перитонит" хирург уже упустил время для раннего оперативного
лечения.
Характерным признаком повреждения
аорты или подвздошных сосудов является ослабление или отсутствие пульсации на
бедренных артериях, гиповолемический шок. В качестве дополнительного метода
диагностики применяют УЗИ, лапароскопию, при необходимости производят
ангиографическое исследование.
120. Диабетическая ангиопатия нижних
конечностей. Клиника, диагностика, лечение. Диабетическая стопа
Диабетическая ангиопатия. Диабетическая ангиопатия развивается
у лиц, страдающих сахарным диабетом. Наблюдается одинаково часто у лиц обоего
пола старше 50 лет. Характеризуется симметричностью поражения с преимущественной
локализацией изменений в артериях среднего и малого калибра, а также в сосудах
микроциркуляторного русла - артериолах и капиллярах (микроангиопатия). При
микроангиопатии перемежающаяся хромота отсутствует, пульсация магистральных и
дистальных артерий может быть сохранена. При макроангиопатии в стенках
магистральных артерий обнаруживаются изменения, характерные для атеросклероза.
При диабете высока частота множественных поражений артериального русла. Следует
помнить о возможности частого сочетания диабетической ангиопатии и
облитерирующего атеросклероза.
Диабетическая ангиопатия развивается у лиц, страдающих
сахарным диабетом, и характеризуется поражением как мелких (микроангиопатия),
так и крупных сосудов (макроангиопатия).
При микроангиопатиинаиболее часто поражаются сосуды
микроциркуляторного русла - артериолы, капилляры и венулы. При этом наблюдается
пролиферация эндотелия, утолщение базальных мембран, отложение
мукополисахаридов в стенках, что в конечном итоге приводит к сужению и
облитерации просвета. В результате этих изменений ухудшается микроциркуляция и
наступает гипоксия тканей. Проявлениями микроангиопатии обычно являются
диабетическая ретинопатия и нефропатия.
При макроангиопатиив стенках магистральных артерий
обнаруживаются изменения, характерные для атеросклероза. Отличительной особенностью
данного вида поражения является то, что на фоне сахарного диабета создаются
благоприятные условия для развития атеросклероза, который поражает молодой
контингент больных и быстро прогрессирует. Типичным для диабета является
артериосклероз Менкеберга - кальциноз средней оболочки артерии.
При диабете высока частота мультисегментарных
поражений артериального русла. Причем поражаются артерии среднего и малого
калибра (подколенная, берцовая, артерии стопы).
ДИАБЕТИЧЕСКАЯ АНГИОПАТИЯ НИЖНИХ КОНЕЧНОСТЕЙ.
В течении ангиопатии нижних конечностей имеются
некоторые специфические особенности:
раннее присоединение симптомов нейропатии с потерей
поверхностной и глубокой чувствительности и полиневрита различной степени
выраженности - от чувства жжения и онемения отдельных участков или всей стопы
до выраженного болевого синдрома;
появление трофических язв и даже гангрены пальцев стоп
при сохраненной пульсации периферических артерий. Инфицирование стоп может
возникнуть после незначительной травмы, трещин, некроза кожи и проявиться
целлюлитом дорсальной поверхности стопы, глубоким абсцессом плантарного
пространства, остеомиелитом костей дистального отдела стопы или гангреной всей
стопы; сочетание ангиопатии нижних конечностей с ретино и нефропатией.
«Диабетическая стопа» - симптомокомплекс, включающий в
себя явления нейропатии и ангиопатии стопы, проявляющийся гнойновоспалительными
изменениями и язвеннонекротическими поражениями.
Этиология и патогенез. Диабетическая нейропатия.
В основе метаболической теории развития диабетической
нейропатии лежит активизация так называемого полиолового шунта, следствием
которого является повышение синтеза сорбитола из глюкозы под действием фермента
альдозоредуктазы в леммоцитах. Из сорбитола, в свою очередь, под влиянием
сорбитолдегидрогеназы образуется фруктоза. Как известно, активность
альдозоредуктазы не зависит от инсулина и не насыщается при гипергликемии. В
норме до 12% внутриклеточной глюкозы превращается в сорбитол, в то время как в
условиях гипергликемии конвертация возрастает в 710 раз.
Вместе с этим ряд исследований показали, что
активизация полиолового шунта какимто образом влияет на состояние
интраневрального кровотока, приводя к его снижению, а значит развитию состояния
хронической гипоксии, что в свою очередь может приводить к функциональным и
структурным изменениям нерва.
Гипергликемия, конкурентно ингибируя транспорт
миоинозитола в клетку, приводит к снижению его внутриклеточной концентрации,
что наряду с нарушением синтеза миелина приводит к снижению NaKАТФазной
активности и, как следствие, демиелинизации нервных волокон, утрате способности
сальтаторной передачи нервного импульса по волокну и замедлению скорости
проведения нервного возбуждения. Этим механизмом определяются первые
функциональные расстройства периферической нервной системы в ответ на
гипергликемию.
Диабетическая аигиопатия. При синдроме диабетической
стопы развиваются диабетическая макро и микроангиопатии. Морфологически
атеросклеротические изменения сосудистой системы у лиц без диабета и
макроангиопатические изменения сосудистой системы у больных диабетом одинаковы.
Возникновению диабетической макроангиопатии способствуют следующие факторы:
пожилой и старческий возраст, длительность диабета, курение, гипертония,
гипергликемия, гипергриглицеридемия, гиперхолестеринемия.
Характерные признаки и симптомы макроангиопатии:
перемежающаяся хромота, холодная на ощупь стопа, ночные боли, боли в покое,
отсутствие пульсации, побледнение конечности в приподнятом положении,
замедленное заполнение вен при предварительном приподнятом положении
конечности, рубиоз кожи и мелкоточечные петехии, атрофия подкожножировой ткани,
наличие акральных некрозов, гангрена.
Диабетическая микроангиопатия - расстройства
циркуляторного русла, обратимые в ранние сроки от момента развития заболевания
и необратимые при длительном его течении. Микроциркуляторным нарушениям,
имеющим место при сахарном диабете, отводится ведущая роль в развитии его
поздних осложнений.
Ключевую роль играет увеличение образования конечных
продуктов гликирования, которое является следствием длительно протекающей
гипергликемии с нарушением структуры сосудистой стенки и, в частности,
базальной мембраны капилляров. В то же время происходит индуцирование
образования липопротеидов низкой плотности и их накопление в сосудистой стенке,
пролиферация гладкомышечных клеток. Определенная роль отводится также влиянию,
оказываемому перекисным окислением липидов, при котором значительно возрастает
образование свободных радикалов, обладающих деструктивным действием в отношении
эндотелия, а также подавлением синтеза простациклина, обладающего
сосудорасширяющими свойствами и являющегося физиологическим ингибитором
агрегации тромбоцитов.
Периферическая и автономная нервная система в свою
очередь определяют состояние микроциркуляции и осуществляют ее регуляцию. Это в
первую очередь касается микроциркуляции кожи и подкожной жировой клетчатки. У
больных сахарным диабетом отмечается нарушение микроциркуляторной функции изза
структурных и функциональных изменений, в основе которых лежат метаболические
нарушения, а также поражения нейрорегуляторного влияния периферической и
автономной нервной системы. Здесь следует отметить, что именно нейропатия
приводит к начальным функциональным расстройствам в системе микроциркуляции,
которые предваряют структурные изменения.
Существуют два основных механизма нарушения кровотока
в микрососудистом русле.
. Градиент гидростатического давления капиллярной сети
определяется балансом между пре и посткапиллярами, прекапилляры находятся под
нейрогенным контролем, потеря которого ведет к сужению прекапилляров и
нарушению гидростатического давления. Это в свою очередь ведет к нарушению
фильтрации жидкости и нутриентов.
. Автономная нейропатия ведет к паралитическому
расширению шунтов между артериолами и венулами и значительному повышению
кровотока в них. Артериоловенозные шунты особенно развиты на нижних
конечностях. Они проходят параллельно микроциркуляторной сети, но никоим
образом не участвуют в тканевом питании. Таким образом, при повышении кровотока
в них происходит сброс артериализированной крови, богатой кислородом, в
венозную систему, минуя капиллярную сеть. Отмечается своеобразное обкрадывание
кровотока в микроциркуляторном русле.
Классификация. Различают нейропатическую, ишемическую
и смешанную формы синдрома диабетической стопы (СДС).
Нейропатическая инфицированная стопа,для которой
характерно наличие длительного диабетического анамнеза, других поздних
осложнений диабета, отсутствие болевого синдрома, обычная окраска и температура
кожных покровов, сохраненная пульсация на артериях стоп, снижение всех видов
периферической чувствительности.
Ишемическая гангренозная стопа,для которой характерны
выраженный болевой синдром, бледность кожных покровов и снижение их
температуры, резкое снижение пульсации на артериях стоп и сохраненная
чувствительность. Этому состоянию, как правило, сопутствуют гипертензия и
дислипидемия.
Смешанная форма (нейроишемическая).
Одной из наиболее распространенных классификаций СДС
является классификация предложенная Wagner (1979):
степень - без визуальных изменений кожных покровов;
степень - поверхностные изъязвления, не
распространяющиеся на всю дерму, без признаков воспаления;
степень - более глубокие изъязвления, захватывающие
прилегающие сухожилия или костную ткань;
степень - язвеннонекротический процесс, сопровождается
присоединением инфекции с развитием отека, гиперемии, возникновением абсцессов,
флегмоны, контактного остеомиелита;
степень - гангрена одного пальца и более или гангрена
дистального отдела стопы;
степень - гангрена большей части стопы или всей стопы.
Данная классификация в силу своей простоты
используется наиболее широко. Однако она во многом условна и не отражает всего
многообразия поражений, часто затрудняет описание язвенного дефекта. Для
характеристики диабетической макроангиопатии большинство хирургов
придерживаются классификации ФонтенаПокровского.
Клинические проявления поражений стоп у больных
сахарным диабетом весьма разнообразны. На ранних этапах развития заболевания
пациенты предъявляют жалобы на повышенную утомляемость ног при ходьбе
(перемежающаяся хромота), зябкость стоп, парестезии. В дальнейшем
присоединяются судороги, атрофия кожи и мышц, сухость кожи, выпадение волос,
снижение чувствительности, отсутствие периферической пульсации на нижних
конечностях, трофические изменения, вплоть до образования язв (рис. 1.28) и
возникновения гангрены. Постоянство и выраженность этих жалоб зависит от стадии
заболевания.
Для ряда пациентов первой и ведущей жалобой является
нарушение конфигурации стопы, что приводит к дискомфорту при ходьбе и большим
сложностям при подборе обуви.
Осмотр и пальпация стоп и голеней являются наиболее
простыми и эффективными методами выявления патологических изменений нижних
конечностей у больных сахарным диабетом. При этом необходимо обращать внимание
на следующие признаки.
Цвет кожных покровов. Изменение цвета кожи стоп и
голеней зачастую является наиболее ранним признаком поражения нижних
конечностей. Яркорозовый и красный цвет характерен для нейропатии, бледный,
цианотичный - для проявлений ишемии, темнокоричневый с синюшным оттенком для
явлений венозной недостаточности. Появление мелких очагов гиперпигментации на
голенях и тыльной поверхности стоп (чаще симметричное) наблюдается у больных с
длительно протекающим сахарным диабетом, осложненным нейропатией. Этот
симптомокомплекс получил название пятнистой голени.
Конфигурация стоп и голеностопных суставов. Изменение
конфигурации не является обязательным признаком поражения нижних конечностей.
Необходимо помнить, что hallux valgus и деформация межфаланговых суставов
пальцев стоп часто встречается у лиц старшего возраста и у не страдающих
диабетом. При длительно протекающем сахарном диабете наиболее распространенной
формой деформации является стопа Шарко (увеличение поперечного размера стопы,
поперечное и продольное плоскостопие, увеличение объема и деформация
голеностопного сустава), клювовидная и молоткообразная деформация пальцев,
выступающие головки метатарзальных костей стопы. Изменение конфигурации стоп
может быть как односторонним, так и симметричным двусторонним.
Сухая, истонченная кожа больного сахарным диабетом
теряет свои барьерные свойства в отношении патогенных микроорганизмов,
обитающих на ее поверхности. В сочетании с длительным повышением уровня
гликемии может привести к развитию инфекционного воспаления.
Изменения ногтей - очень часто встречающийся признак
поражения стоп при диабете. Диабетическая нейропатия приводит к атрофии и
деформации ногтевой пластинки. Нередко ногти больного бывают утолщенными,
рыхлыми, что является предрасполагающим фактором для микозного поражения
ногтевых пластинок.
Диагностика. Основные задачи диагностических
мероприятий:
Тщательный сбор анамнеза.Имеет значение длительность
заболевания, тип сахарного диабета, проводимое ранее лечение, наличие симптомов
нейропатии (колющие или жгущие боли в ногах, судороги в икроножных мышцах,
чувство онемения, парестезии). Перемежающаяся хромота - основной признак
макроангиопатии. Учитываются наличие ночных болей, пройденное больным
расстояние до появления первых болей в ногах.
Осмотр ног. Пальпаторно определяется пульсация на
артериях стоп, состояние кожного и волосяного покрова.
Оценка неврологического статуса.Неврологическое
обследование включает исследование вибрационной чувствительности с помощью
градуированного камертона, определение болевой, тактильной и температурной
чувствительности по стандартным методикам, определение сухожильных рефлексов.
Оценка состояния артериального кровотокаосуществляется
с помощью ультразвуковой допплерографии, в ряде случаев - ангиографии.
ЛПИ = РАГ : РПА, где ЛПИ - лодыжечноплечевой индекс,
РАГ - систолическое давление в артериях, РПА - систолическое давление в
плечевой артерии.
Рентгенография стоп и коленных суставов.Этот метод
исследования позволяет выявить признаки диабетической остеоартропатии , диагностировать
спонтанные переломы мелких костей стопы, заподозрить наличие остеомиелита,
исключить или подтвердить развитие газовой гангрены.
Бактериологическое исследование отделяемого раневого
дефекта имеет первостепенное значение для подбора адекватной антибиотикотерапии.
Современным методом оценки состояния капиллярного
кровотока конечностей является лазерная допплерография, позволяющая определить
интенсивность движения крови по системе капилляров вне зависимости от их
тонуса.
Лечение. В основе консервативной терапии диабетической
стопы лежат следующие принципы:
. Оптимизация метаболического контроля.Проводится
интенсификация режима инсулинотерапии. Ориентиром оптимального количества дозы
инсулина являются показатели гликемии.
. Разгрузка пораженного участка.Различают
кратковременную и длительную разгрузку. Кратковременная разгрузка достигается
использованием постельного режима, креслакаталки или костылей. Длительная
разгрузка достигается применением специальной обуви.
. Антибиотикотерапия.Основные группы применяемых
антибиотиков - беталактамные (пенициллины широкого спектра действия,
цефалоспорины) и фторхинолоны.
. Местная обработка ран.Местная обработка ран включает
удаление некротических тканей, дренирование гнойных затеков, иссечение участков
гиперкератоза.
. Лечение нейропатических отеков.Наиболее эффективным
средством лечения является назначение симпатомиметиков.
. Снижение веса.
. Дозированная физическая нагрузка.
. Отказ от курения.
. Использование простагландинов (вазопростан).
. Медикаментозная терапия.Используются препараты,
улучшающие микроциркуляцию и трофику тканей (Трентал, Реополиглюкин, Агапурин,
Вобензим, Компламин, Ксантинола никотинат, Солкосерил, Циннаризин, Стугерон и
др.).
Показания к оперативному лечению:
неэффективность консервативной терапии,
прогрессирование ишемии;
возможность выполнения реконструктивной сосудистой
операции.
При наличии у больного стенотического поражения в
подвздошных артериях, предпочтение отдают транслюминальной ангиопластике.
Ампутации конечности. На современном этапе
предпочтение отдается операциям, позволяющим сохранить пораженную конечность,
крупные суставы (голеностопный и коленный) или, в крайнем случае, коленный
сустав. Для этого в предоперационном периоде необходимо использование
простагландинов (Вазопростан), что позволяет в большинстве случаев при гангрене
конечности произвести ампутацию по уровню демаркации. Вместе с тем в ряде
случаев при распространенной гангрене, особенно при сочетании синдрома
диабетической стопы с атеросклерозом все же приходится прибегать к ампутации
конечности на уровне верхней трети бедра.
Послеоперационное лечениенаправлено на сохранение
стабильного течения сахарного диабета, на профилактику ранних тромбозов,
инфекционных осложнений, осложнений со стороны сопутствующих заболеваний.
После выписки из стационара больной должен наблюдаться
у эндокринолога и сосудистого хирурга с обязательным УЗконтролем 1 раз в
полгода. К обязательным рекомендациям относятся: постоянный контроль за уровнем
сахара крови, прием дезагрегантов, госпитализация в стационар 1 раз в год для
проведения плановой консервативной терапии.
121. Хирургический сепсис. Классификация.
Этиология. Патогенез. Клиника. Диагностика. Дифференциальный диагноз. Лечение
Синдром системной воспалительной
реакции (ССВР) (Systemic Inflammation Response Syndrome). Это патологическое
состояние, обусловленное одной из форм хирургической инфекции или альтерацией
тканей неинфекционной природы (травмой, панкреатитом, ожогом, ишемией или
аутоиммунным повреждением тканей и др.) и характеризующееся наличием как
минимум двух из четырех клинических признаков:
· температура выше 38°С или ниже 36°С;
· частота сердечных сокращений свыше 90
ударов в минуту;
· частота дыхания свыше 20 дыханий в
минуту (при ИВЛ раСО2 меньше 32 мм рт. ст);
· количество лейкоцитов свыше 12109/л
или ниже 4109/л или количество незрелых форм превышает 10%.
Под сепсисом в широком смысле слова
предлагается понимать наличие четко установленного инфекционного начала,
послужившего причиной возникновения и прогрессирования ССВР.
Инфекция - микробиологический
феномен, характеризующийся воспалительным ответом на присутствие
микроорганизмов или на их инвазию в поврежденные ткани организмахозяина.
Бактериемия - присутствие живых
бактерий в крови; присутствие вирусов, грибов или паразитов должно обозначаться
иначе: вирусемия, фунгемия, паразитемия. Септицемия определялась в прошлом как
присутствие микробов или их токсинов в кровеносном русле, при наличии
клинической картины сепсиса. Однако этот термин в силу своей неопределенности
вносит большие трудности в интерпретацию данных. В связи с этим его применение
рекомендуется исключить из врачебной практики.
Признаками инфекционной природы
прогрессирования ССВР (что дает основание для диагностики сепсиса) предлагается
считать:
· устойчивую бактериемию (с наличием
идентичной флоры);
· наличие обширного очага
воспалительной альтерации.
Тяжелый сепсис характеризуется
развитием одной из форм органносистемной недостаточности (респираторный
дистресссиндром взрослых, кардиогенная недостаточность кровообращения, острая
почечная недостаточность ОПН, коагулолатия и др.) при наличии установленного
инфекционного очага и двух или более признаков ССВР.
Септический шок обусловленное
сепсисом снижение давления (гипотония АД < 90 мм рт ст.) в условиях
адекватно восполненного объема циркулирующей крови и невозможность подъема
артериального давления выше 90 мм рт. ст. путем использования симпатомиметиков.
Иначе говоря, септический шок можно рассматривать как одну из форм
сепсиссиндрома, при которой отмечается несостоятельность сосудистой регуляции.
Рекомендациями конференции в клиническую практику было введено новое
клиническое понятие: синдром системной воспалительной реакции. Диагностика
синдрома системной воспалительной реакции строится на перечисленных выше
четырех признаках. В случае наличия трех признаков указывается ССВР3 (SIRS3), а
четырех - ССВР4 (SIRS4)
Диагностика «тяжелого сепсиса»
производится на основании четко разработанных критериев:
· наличие синдрома СВР;
· верифицированный очаг инфекционного
процесса;
· признаки органной несостоятельности
(недостаточности, дисфункции).
Признаки органной несостоятельности
определяются во многих исследованиях, однако характеризуются значительной
вариабельностью. В связи с этим встает вопрос об использовании унифицированных
шкал для более корректного и адекватного описания больных В настоящее время
наиболее распространена балльная оценка тяжести нарушения тех или иных органов
и систем при сепсисе. Среди наиболее простых и распространенных шкала SOFA (Sepsis Oriented Failure Assessment) и шкала MODS (Multiple Organs Disfunction Score). Шкала SOFA разработана Европейским обществом по
интенсивной терапии под руководством J.L. Vinsent (см. табл. 6). Шкала MODS
предложена J. С. Marshall в 1995 г. в США. В настоящее время в европейских
публикациях предпочтение отдается шкале SOFA, в то время как в американских
источниках используются обе шкалы. Шкалы очень просты в использовании и
доступны практически для любого стационара, имеющего рутинную биохимическую лабораторию.
Эти шкалы используются для оценки
тяжести органных нарушений, что позволяет объективно выделить группу больных с
тяжелым сепсисом и описать развивающиеся нарушения. Для оценки тяжести
состояния в конкретный момент времени наиболее популярными являются шкалы SAPS,
SAPS П, APACHE II, APACHE III. В то же время прогностическая ценность этих
шкал, имеется в виду при сепсисе, весьма противоречива, тогда как эффективность
MODS и SOFA достаточно высока.
Таким образом, для диагностики
тяжелого сепсиса необходима верификация инфекционного процесса (в качестве
такового может выступать доказанная бактериемия), наличие трех или более
признаков ССВР и хотя бы один балл по предлагаемым шкалам - SOFA или MODS.
В септическом шоке выделяют две фазы:
· ранний септический шок - артериальное
давление менее 90 мм рт. ст. (или на 40 мм рт. ст. меньше обычного уровня),
сохраняющееся на протяжении, по крайней мере, 1 ч, несмотря на проводимую
соответствующую терапию;
· рефрактерный септический шок -
артериальное давление менее 90 мм рт. ст. (или на 40 мм рт. ст. меньше обычного
уровня), сохраняющееся более 1 ч, несмотря на проводимую соответствующую
терапию.
Предложенные определения вносились с
целью унификации терминологии, возможности получения сравнимых результатов в
ходе проведения исследований. Прошедшие почти десять лет после принятия этой
классификации показали, что, несмотря на всю свою упрощенность и необычность,
понятия синдром системной воспалительной реакции, тяжелый сепсис, сепсиссиндром
прочно завоевали свое место в умах многих практических врачей. В большинстве
периодических изданий, специализирующихся на исследованиях в области
генерализованных воспалительных реакций, описание материала в соответствии с
принятой на Согласительной конференции терминологией, является обязательным
требованием.
Всю свою упрощенность и необычность,
понятия синдром системной воспалительной реакции, тяжелый сепсис, сепсиссиндром
прочно завоевали свое место в умах многих практических врачей. В большинстве
периодических изданий, специализирующихся на исследованиях в области
генерализованных воспалительных реакций, описание материала в соответствии с
принятой на Согласительной конференции терминологией, является обязательным
требованием.. Посттравматический:
) раневой;
) ожоговый.
II. Легочный.. Ангиогенный..
Кардиогенный.. Абдоминальный:
) билиарный;
) панкреатогенный;
) интестиногенный;
) перитонеальный;
) аппендикулярный.. Воспалительных
заболеваний мягких тканей. . Урологический.
Для диагностики перечисленных выше
форм сепсиса должны использоваться перечисленные выше критерии. Это важный
принципиальный момент. Таким образом, наличие инфекционного процесса в той или
иной области, сопровождающегося двумя, тремя или четырьмя клиническими
признаками синдрома системной воспалительной реакции, должно отражаться в
истории болезни как «сепсис». Это важный объединяющий все перечисленные формы
сепсиса признак. Однако в их течении отмечаются существенные клинические
различия. Они обусловлены, прежде всего, различными функциями заинтересованных
органов и систем, а также последствиями их нарушений, вегетирующей в них
микрофлорой, что привносит специфическую клиническую окраску всему процессу.
Прежде всего, главным пусковым
моментом сепсиса считаются процессы, протекающие в зоне первичного очага. Именно
они определяют последующую картину развивающейся (или нет) генерализации
воспалительной реакции.
Воспаление может быть определено как
локализованный защитный ответ на повреждение тканей, который имеет своей
главной задачей удаление повреждающего агента (микроорганизмов) и поврежденных
тканей. Этот процесс характеризуется каскадной активацией систем комплемента,
свертывающей и противосвертывающей, калликреинкининовой, клеточных элементов
(эндотелиоцитов, лейкоцитов, моноцитов, макрофагов, тучных клеток) и высвобождением
медиаторов (гистамина, эйкозаноидов, факторов свертывания, цитокинов).
Первым звеном любой воспалительной
реакции является внутриклеточная экспрессия генов, обеспечивающих экскрецию
цитокинов и медиаторпродуцирующих энзимов в клетках, обеспечивающих иммунный
ответ. Необходимым условием для развития этой активации является появление
избытка кислородных радикалов (Reactive oxygen species) на митохондриях этих
клеток. Важно отметить, что независимо от причины, вызвавшей активацию, процесс
захватывает клетки эндотелия, полиморфноядерные лейкоциты и моноциты/макрофаги.
Основными задачами локального
воспаления являются:
· ограничение развития инфекции зоной
первичного поражения;
· эрадикация возбудителя.
В ряде случаев количество патогена
может превосходить возможности фагоцитирования (фагоцитарная емкость), тогда
возможно развитие абсцессов. Тем не менее, даже в этих ситуациях функция
ограничения играет важнейшую роль, не позволяя микроорганизмам попадать в
системный кровоток. Таким образом, реализация ограничительной функции
локального воспаления является важнейшей составной частью системы,
предотвращающей развитие генерализованных воспалительных реакций.
Системная воспалительная реакция
(СВР), исходя из этой концепции, представляет собой патологическое явление, при
котором механизмы отграничения локального воспалительного процесса становятся
несостоятельными. Это может быть обусловлено следующими ситуациями.
. Микроорганизмы, либо вследствие
несостоятельности факторов сдерживания, либо вследствие своей высокой
вирулентности и патогенности преодолевают все линии защиты и попадают в
системный кровоток.
. Продукты жизнедеятельности или
распада микроорганизмов (экзотоксины, эндотоксины, клеточные структуры)
периодически проникают в системный кровоток, несмотря на то, что сами
возбудители находятся в местном очаге воспаления и не могут преодолеть факторы
защиты.
. Местный воспалительный процесс
сохраняет свою ограничительную функцию, однако интенсивность повреждения
настолько высока, что в кровоток попадают продукты развившейся в очаге
поражения «медиаторной бури*.
В тех ситуациях, когда реализуется
последний механизм развития ССВР, этот процесс может развиваться вообще без
присутствия микроорганизмов. В качестве типичных клинических ситуаций можно
привести тяжелую сочетанную травму, ожоговую травму, первый период
(асептический) развития тяжелого панкреатита (панкреонекроза).
В ряде случаев развитие ССВР может
происходить при отсутствии локального внутритканевого воспалительного процесса.
Это происходит при поступлении продуктов жизнедеятельности или распада
микроорганизмов (экзотоксинов, эндотоксинов, участков клеточных структур) из
какихлибо резервуаров микробиоты в системный кровоток. Одним из наиболее
вероятных и потенциально опасных источников такого поступления является просвет
желудочнокишечного тракта.
Диагноз сепсис (в трактовке
Согласительной конференции 1991 г.), свидетельствующий о появлении системных
признаков инфекционного процесса, позволяет считать достаточным назначение
различных препаратов «первого» ряда, как в случае эмпирической терапии, так и
при верифицированном возбудителе. Выявление признаков органной недостаточности
(2 и более баллов по шкале SOFA), что свидетельствует о тяжелом сепсисе, должно
заставить врача вспомнить об антибиотиках так называемого резерва, современных
принципах деэскалационной терапии.
Антибактериальная терапия сепсиса в
подавляющем большинстве случаев носит эмпирический характер, особенно в начале
лечения. Надо сразу подчеркнуть, что забор материала для микробиологического
исследования (окраска мазков по Граму, различные биологические жидкости и
отделяемое из дренажей и т. д.) должен производиться до начала
антибактериальной терапии. К сожалению, это далеко не всегда возможно,
особенно, когда больные переводятся из одного стационара в другой, однако,
независимо от предшествующей терапии и состояния больного, новый этап лечения
должен начинаться с оценки микробиологического статуса.
Выбор препарата для эмпирической терапии основывается
на органном подходе (в каком органе или системе локализован инфекционный
процесс), наиболее вероятном возбудителе, по данным клинического обследования,
а также - обычной резидентной флоре, присутствующей в пораженном органе.