Определение параметров реакций горения и взрывчатого разложения
1. Определить объём
воздуха, необходимого для полного сгорания 1 кг горючей жидкости стирола C8H8, с молекулярной массой 104,151, при давлении 101325 Па и
температуре +25 
Дано:
М (C3H8O3) = 104,151;
Р = 101325 Па;
Т = +25 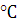 = 298 К.
= 298 К.
Найти: 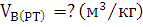
Решение:
) Записываем уравнение реакции
горения стирола:
По формуле:
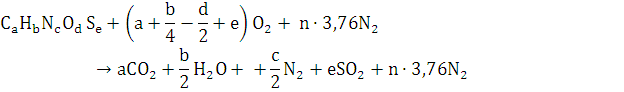
Тогда уравнение реакции примет вид:

) Определяем теоретический объём
воздуха для нормальных условий.

где 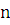 - стехиометрический коэффициент при O2, N2;
- стехиометрический коэффициент при O2, N2;
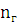 -
стехиометрический коэффициент при горючем;
-
стехиометрический коэффициент при горючем;
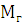 -
молекулярная масса глицерина
-
молекулярная масса глицерина
 -
объем воздуха при н.у.
-
объем воздуха при н.у.
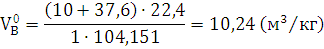
) Определяем практический объём
воздуха.
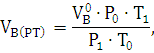
где  - давление и температура при н.у, Па, К.;
- давление и температура при н.у, Па, К.;
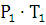 -
давление и температура при заданных условиях, Па, К
-
давление и температура при заданных условиях, Па, К
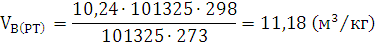
Ответ: Для сгорания 1 кг стирола при заданных условиях требуется 11,18 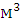 воздуха.
воздуха.
2. Определить объём
воздуха, необходимого для полного сгорания 1 кг хлопка, в состав которого
входит С = 42,4%, Н = 5,92%, О=46,6%, N=0,58% W = 4,0%, А = 0,5%, при
давлении 101325 Па и температуре +25
Дано:
С = 42,4%; Н = 5,92%; О=46,6%; N=0,58%; W = 4,0%; А = 0,5%; Р = 101325 Па;
Т = +25 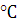 = 298 К.
= 298 К.
Найти: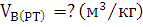
Решение:
) Определяем теоретический объем
воздуха, необходимый для сгорания 1 кг древесного угля при н.у. по формуле:
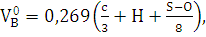
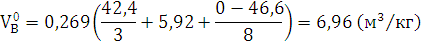
) Определяем практический объём
воздуха.
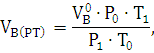

Ответ: Для сгорания 1 кг хлопка при заданных условиях требуется 7,6 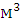 воздуха.
воздуха.
3. Определить объём
воздуха, необходимого для полного сгорания 1 кг технического продукта
дизельного топлива Л C14,605H29,965, при
давлении 101325 Па и температуре +25
Дано:
C14,605H29,965
Р = 101325 Па;
Т = +25 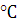 = 298 К.
= 298 К.
Найти: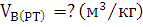
Решение:
) Записываем уравнение реакции
горения дизельного топлива Л:
C14,605H29,965+ O2 + 22,096*3,76N2
O2 + 22,096*3,76N2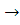 14,605CO2 + 14,983H2O +83,08N2
14,605CO2 + 14,983H2O +83,08N2
2) Определяем теоретический объём
воздуха для нормальных условий.

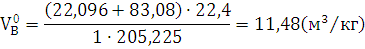
) Определяем практический объём
воздуха.
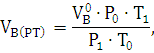
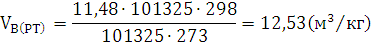
Ответ: Для сгорания 1 кг дизельного топлива Л при заданных условиях
требуется 12,53 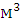 воздуха.
воздуха.
4. Определить объём
воздуха, необходимого для полного сгорания 1 кг полукоксового газа, состоящего
из следующих газов: диоксид углерода, водород, этилен, пропилен, дициан,
кислород, оксид углерода, азот, при давлении 101325 Па и температуре +25 .
.
Дано:
CO2=0,4%; Н2 =
9,3%; C2H4=21,8%; C3H6=9,0%; HCN=1,6%; C2H3N=8,5%; C2N2=19,6%; O2=0,8%; СО = 18,5%; N2 = 20,6%; Р = 101325 Па; Т = +25 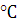 = 298 К.
= 298 К.
Найти: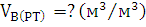
Решение:
) Записываем уравнения
реакций горения:
Н2 +  H2O2H4+3O2
H2O2H4+3O2 2CO2+2H2O3H6+4,5O2
2CO2+2H2O3H6+4,5O2 3CO2+3H2O+1,25O2
3CO2+3H2O+1,25O2 CO2+0,5H2O+0,5N2
CO2+0,5H2O+0,5N2
C2H3N+2,75O2 2CO2+1,5H2O+0,5N2
2CO2+1,5H2O+0,5N2
C2N2+2O2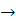 2CO2+N2
2CO2+N2
CО +0,5О2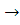 СO2
СO2
2) Определяем теоретический
объём воздуха для нормальных условий.

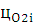 -
процентное содержание O2
-
процентное содержание O2
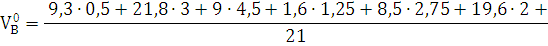

3) Определяем практический
объём воздуха.
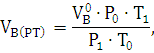

Ответ: Для сгорания 1м3 полукоксового газа при заданных
условиях необходимо 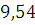 м3
воздуха.
м3
воздуха.
5. Определить состав и
объём продуктов сгорания единицы массы (объёма) горючего вещества хлопок с
составом: C=42,4%; H=5,92%; O=46,6%; N=0,58; W=4,0; A=0,5.
1) Рассчитаем объемы отдельных
продуктов горения:
Vco2=1,86* м3/кг.
м3/кг.
VH2O=11,2*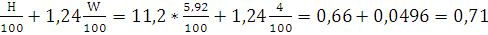 м3/кг.
м3/кг.
VN2=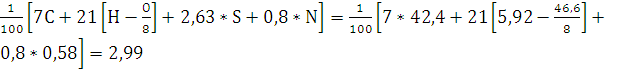 м3/кг.
м3/кг.
Просуммируем полученные объемы:
Vпг.=0,79+0,71+2,99=4,49 м3/кг.
Ответ: При сгорании 1 килограмма хлопка выделяется 4,49 м3
продуктов горения.
6. Определить
состав и объём продуктов сгорания единицы массы (объёма) горючего вещества газ
полукоксовый состава
CO2=0,4%; H2=9,3%;
C2H2=21,8%; C3H6=9%; HCN=1,6%; C2H3N=8,5%;
C2N2=19,6%;2=0,8%; CO=18,5%; N2=20,6%.
) Составим уравнения реакций
горения:
H2+0,5O2→H2O
C2H2+3O2→2CO2+2H2O
C3H6+4,5O2→3CO2+3H2O
HCN+1,25O2→CO2+0,5H2O+0,5N2+2,75
C2H3N+2,75O2→2CO2+1,5H2O+0,5N2
C2N2+2O2→2CO2+N2
CO+0,5O2→CO2
2) Определим объемы отдельных
продуктов горения:
V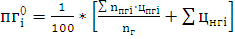
VСО2= м3/м3.
м3/м3.
VH2O= м3/м3.
м3/м3.
VN2=0,79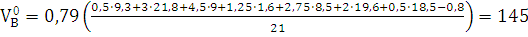 м3/м3.
м3/м3.
) Просуммируем полученные
объемы:
Vпг.=1,47+0,93+145=147,4 м3/м3.
Ответ: При сгорании 1 м3 полукоксового газа образуется 147,4
м3 продуктов горения.
7. Определить
состав и объём продуктов сгорания единицы массы (объёма) горючего вещества
амилсульфид C10H22S с молярной массой М=174,35 г./моль при Т=0°С и Р=101325 Па
1) Составим уравнение горения:
C10H22S+16,5О2+16,5·3,76N2→10CO2+11H2O+SO2+16,5·3,76N2
2) Определим объем продуктов
горения:

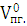 =
=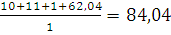 м3/кг.
м3/кг.
Так как заданные условия не
отличаются от нормальных (Т=0°С; Р=101325 Па), то 
Ответ: При сгорании 1 м3 амилсульфида образуется 84,04 м3
продуктов горения.
8. Определить
состав и объём продуктов сгорания единицы массы (объёма) горючего вещества
масло генераторное тяжелое С20,98Н23,11S0,04 с молярной массой М=300 при T=-20°C и Р=101000 Па
1) Составим уравнение горения
вещества:
С20,98Н23,11S0,04+26,8О2+26,8·3,76N2→20,98СО2+11,56Н2О+0,04S2+26,8·3,76N2
) Определим объем продуктов
горения:

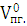 =
=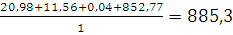 м3/кг.
м3/кг.
) Определим объем продуктов
горения при заданных условиях:

Vпг.= м3/кг.
м3/кг.
Ответ: При сгорании 1 кг. тяжелого генераторного масла образуется 823,08
м3 продуктов горения.
9. Определить
концентрационные пределы распространения пламени газо-, паро-, и пылевоздушных
смеси вещества н-Бутиловый спирт С4Н10О при температуре Т=50°С
(экспериментальные пределы: 1,80…10,90)
Составим уравнение
горения вещества:
С4Н10О+6О2→4СО2+5Н2О
Определим
концентрационные пределы:
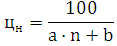
где для нижнего предела: a=8684; b=4,679;
для нижнего: а=1,55; в=0,560
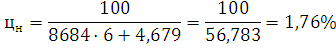

Определим
погрешность расчета:

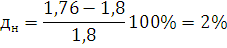
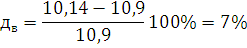
Определим
концентрационные пределы при заданной температуре:
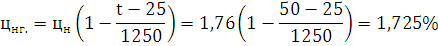

Ответ: Концентрационные пределы распространения для н-Бутилового спирта
 ;
; 
) Составим уравнение горения
вещества:
С4Н6+5,5О2→4СО2+3Н2О
) Определим концентрационные
пределы:


) Определим погрешность для
нижнего предела:
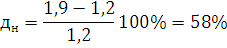
) Определим концентрационные
пределы для заданной температуры:
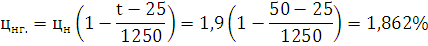
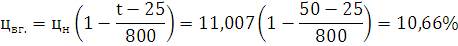
Ответ: Концентрационные пределы распространения для 1-Бутина 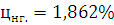 ;
; 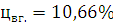
11. Определить
концентрационные пределы распространения пламени газо-, паро-, и пылевоздушных
смеси вещества 2-аминобензойная кислота С7Н7О2N c молярной массой
М=137,15 г./моль;  кДж/моль;
экспериментальный НКПВ=30 г./моль при температуре t=0°C
кДж/моль;
экспериментальный НКПВ=30 г./моль при температуре t=0°C
1) Для определения НКПВ данного
вещества воспользуемся следующими формулами:
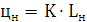
 K=
K=
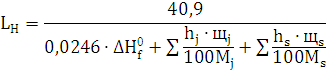
) Определим стандартную
теплоту образования взрывчатого вещества:
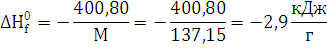
) Определим массовые доли С,
О, Н и N в веществе:
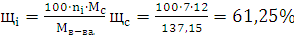

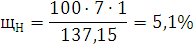
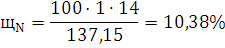
) Рассчитаем Lн, учитывая, что hc=9,134; hH=2,612; hO=-0,522; hN=-0,494:

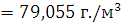
) Определим НКПВ:
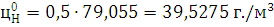
) Определим НКПВ при заданной
температуре:
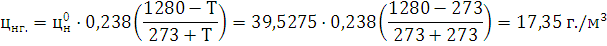
) Определим погрешность:

Ответ: НКПВ 2-Аминобензойной кислоты равен 17,35 г./м3.
12. Определить состав
и объём продуктов взрывчатого разложения динитробензола С6Н4N2O4; кислородный баланс равен -95,3%; молярная масса М=168 г./моль; Q=8,6 ккал / моль
1) Составим уравнение реакции
взрыва:
С6Н4N2O4→2H2O+2CO2+4C+N2
2) Определим объем продуктов
взрыва:
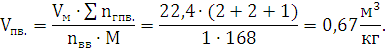
Ответ: при взрыве 1 кг. динитробензола образуется 0,67 м3
продуктов взрыва.
13. Определить состав и
объём продуктов взрывчатого разложения алюмотола, состоящего на 95% из тротила
С7H5N3O6 молярной массы
М=227 г./моль и на 5% из алюминия молярной массы М=27 г./моль
1) Составим приведенную формулу
взрывчатого вещества:
 →4,18
С7H5N3O6+1,85Al
→4,18
С7H5N3O6+1,85Al
29,26H20,9N12,54O25,08Al1,85→10,45Н2О+0,925Al2O3+11,855CO+17,405C+6,27N2
2) Определим объем продуктов
взрыва:

 при
взрыве 1 кг. алюмотола образуется 0,64 м3 продуктов взрыва.
при
взрыве 1 кг. алюмотола образуется 0,64 м3 продуктов взрыва.
14. Определить
теплоту и температуру продуктов взрывчатого разложения динитробензола С6Н4N2O4; кислородный баланс равен -95,3%; молярная масса М=168 г./моль; Q=8,6 ккал / моль
Теплота взрыва определяется из
уравнения:
Q=Qпв.-Qвв.
) Определение теплоты взрыва
основным методом:
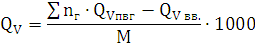
Составим уравнение процесса взрыва:
С6Н4N2O4→2H2O+2CO2+4C+N2
Парциальная теплота отдельных
продуктов взрыва:
Qp(H2o)=57,78 ккал / моль
Qp(СО)=26,88 ккал / моль
Qpпв=2·57,78+2·26,88=169,32
ккал / моль
QV=Qp+0,58·n=169,32+0,58·(2+2)=171,64 ккал / моль
Qvвв=8,6+0,58·(1)=9,18 ккал/
моль

Ответ: теплота, выделяемая при взрыве 1 кг динитробензола при расчете по
основному методу составляет 4051,8 кДж/кг.
) Определение теплоты взрыва по методу
Авакяна:
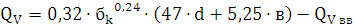



Ответ: теплота, выделяемая при взрыве 1 кг динитробензола при расчете по
методу Авакяна составляет 1862,5 кДж/кг.
) Определим температуру
взрывчатого разложения данного вещества:
где:
CV=a+b·tпв. - суммарная молярная
теплоемкость
tпв - температура продукта
взрыва
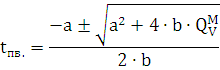 МV =QVпв. - QVвв.
МV =QVпв. - QVвв.
Vпв.=171640 кал/мольVвв.=9180 кал/моль
QМV=171640-9180=162460 кал/моль
Молярная теплоемкость для различных
веществ составляет:
для двухатомных газов (СО, N2):
СV=4,8+0,00045·tпв.
для Н2О:
СV=4,0+0,00215·tпв
- для СО2:
СV=9+0,00058·tпв.
для твердых продуктов взрыва:
СV=const=6,4
Определим теплоемкость для продуктов
взрыва динитробензола:
СVн2о=2·(4,0+0,00215· tпв.)=8+0,0043 tпв.
СVсо2=2·(9+0,00058· tпв.)=18+0,00116· tпв.
СV=4·6,4=25,6
СVN2=4,8+0,00045· tпв.
Суммарная молярная теплоемкость
составляет:
CV=8+18+25,6+4,8+(0,0043+0,00116+0,00045) · tпв.=56,4+0,00591· tпв.
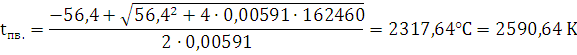
Ответ: при взрыве 1 кг динитробензола температура составит 2590,64 К.
15. Определить теплоту и
температуру продуктов взрывчатого разложения алюмотола, состоящего на 95% из
тротила С7H5N3O6 молярной массы
М=227 г./моль и на 5% из алюминия молярной массы М=27 г./моль. Парциальные
теплоты веществ: Qp трот.=17,5
ккал / моль=1010 ккал/кг; Qp Al=0
1) Определим теплоту методом
ориентировочного определения:

QV=0,95·1010=959,5 ккал/кг=4020,3 кДж/кг.
Ответ: теплота, выделяемая при взрыве 1 кг алюмотола при расчете по
ориентировочному методу составляет 4020,3 кДж/кг.
) Определим теплоту уточненным
методом:
Составим приведенную формулу
взрывчатого вещества:
 →4,18
С7H5N3O6+1,85Al29,26H20,9N12,54O25,08Al1,85→10,45Н2О+0,925Al2O3+11,855CO+17,405C+6,27N2
→4,18
С7H5N3O6+1,85Al29,26H20,9N12,54O25,08Al1,85→10,45Н2О+0,925Al2O3+11,855CO+17,405C+6,27N2
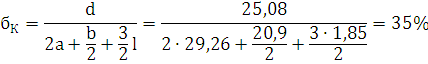
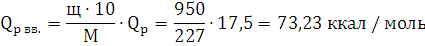
QV вв.=73,23+0,58·(4,18+0)=75,66
ккал / моль
Qv=0,32·350,24·(47·25,08+5,25·20,9) - 75,66=892,2 ккал /
моль

Ответ: теплота, выделяемая при
взрыве 1 кг алюмотола при расчете по уточненному методу составляет 3742,8
кДж/кг.
) Определим теплоту основным
методом:
Данные возьмем из предыдущего
расчета:
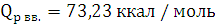
QV вв. =75,66 ккал / моль
Qp пв.=10,45·57,78+11,86·26,88=922,6
ккал / моль
QV пв. =922,6+0,58·(10,45+11,86)=935,54
ккал / моль
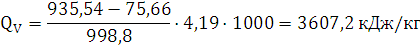
Ответ: теплота, выделяемая при взрыве 1 кг алюмотола при расчете по
основному методу составляет 3607,2 кДж/кг.
) Определим температуру
взрывчатого разложения данного вещества:
QVпв.=935540 кал/моль
QVвв.=75660 кал/моль
QМV=935540-75660=859880 кал/моль
Определим теплоемкость для продуктов
взрыва алюмотола:
СVн2о=10,45·(4,0+0,00215· tпв.)=41,8+0,0225 tпв.
СVal2o3=0,925·6,4=5,92
СVсо=11,855·(4,8+0,00045· tпв.)=56,904+0,0054· tпв.
СVс=17,405·6,4=111,392
СVN2=6,27·(4,8+0,00045· tпв.)=30,096+0,0028· tпв.
Суммарная молярная теплоемкость
составляет:
CV=10,45+5,92+56,904+111,392+30,096+(0,0225+0,0054+0,0028) · tпв.=
=246,112+0,0307· tпв.
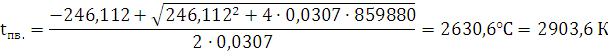
Ответ: при взрыве 1 кг алюмотола температура составит 2903,6 К.
16. Определить давление
продуктов взрыва 1 кг. динитробензола С6Н4N2O4; кислородный баланс равен -95,3%; молярная масса М=168 г./моль; Q=8,6 ккал / моль;
плотность свв=1050 кг/м3; объем продуктов взрыва V0=0,67 м3/кг; температура взрыва T=2590,64 К
1) Составим уравнение процесса
взрыва вещества:
С6Н4N2O4→2H2O+2CO2+4C+N2
2) Давление продуктов взрыва
определяется из уравнения:
P·(V-б-бk)=n·R·T

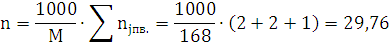
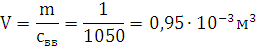

R=8,314 - универсальная газовая постоянная.
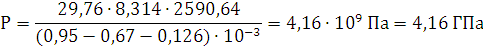
Ответ: давление при взрыве 1 кг. динитробензола составит 4,16 ГПа.
17. Определить давление
продуктов взрыва 1 кг. алюмотола, состоящего на 95% из тротила С7H5N3O6 молярной массы М=227 г./моль и на 5% из алюминия молярной массы
М=27 г./моль; молярная масса взрывчатого мещества М=998,8 г/моль; плотность свв=1000
кг/м3; объем продуктов горения V0=0,64 м3; температура взрыва Т=2903,6 К
1) Составим уравнение процесс
взрыва вещества
C29,26H20,9N12,54O25,08Al1,85→10,45Н2О+0,925Al2O3+11,855CO+17,405C+6,27N2

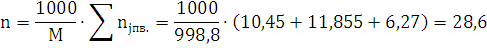
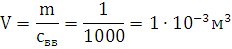


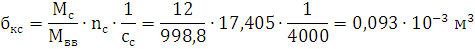
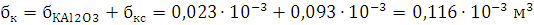
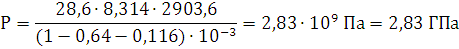
Ответ: давление при взрыве 1 кг. алюмотола составляет 2,83 ГПа.
Заключение
В ходе данной курсовой работы мною
были рассчитаны различные величины, характеризующие процессы горения и взрыва
для индивидуальных и смесевых горючих и взрывчатых веществ. Полученные
результаты близки по значениям к экспериментальным, что позволяет сделать вывод
что расчеты верны и использованные методы допустимо применять в ходе дальнейшей
профессиональной деятельности.
Библиографический список
1 СТО ЮУрГУ 04-2008
Стандарт организации. Курсовое и дипломное проектирование. Общие требования к
содержанию и оформлению / Т.И. Парубочая, Н.В. Сырейщикова, В.И. Гузеев, Л.В.
Винокурова. - Челябинск: Изд-во ЮУрГУ, 2008. - 56 с.