Хімічні джерела струму
Вступ
-1746 рр. німецький фізик Евальд
Юрген фон Клейст і голландський фізик Пітер ван Мушенбрук створили прилад, що
дозволяє зберігати електричний заряд, отриманий від електростатичної машини. Це
був один з перших конденсаторів, який назвали «лейденською банкою». Створенню
постійних джерел струму сприяло відкриття італійського професора анатомії
Луїджі Гальвані в кінці XVIII ст. Розкрити природу відкритого явища Гальвані
вдалося італійському фізикові Алессандро Вольта. Він зробив висновок, що за
умови контакту різних металів виникає електрика. Дослідним шляхом Вольта
розташував метали в ряд таким чином, що чим далі один від одного стоять вони в
цьому ряду, тим більший ефект спостерігаємо. У такому ж порядку змінюється і
хімічна активність металів: Li...Mg...Zn...Fe...Sn...H... Cu...Ag...Au. Щоб
підсилити ефект, Вольта сполучав пари металів послідовно, так, що отримав
ланцюжок, названий ім’ям винахідника «Стовпом Вольта».
Введення в електричне коло розчинів
виявилося вирішальним у винаході Вольта. На згадку про Гальвані Вольта назвав
свої елементи гальванічними.
р. російський фізик В. В. Петров
створив батарею, яку складено з 4200 мідних і цинкових пластин. Між металевими
пластинами діаметром близько 4 см прокладалися картонні кружечки, просочені
розчином хлориду амонія. «Стовп Петрова», на відміну від «вольтова стовпа»,
розташовувався горизонтально в сухих вузьких дерев’яних скриньках. Всю батарею
було складено з чотирьох рядів, кожен завдовжки близько 3 м. Теоретично така
батарея може давати напругу 2500 вольт.
В XIX ст. працею фізиків і хіміків
було засновано теорію роботи гальванічних елементів; основна заслуга в цьому
належить німецькому фізико-хіміку Вальтеру Нернсту.
р. Джон Фредерік Данієль звернув
увагу, що на мідному електроді утворюються бульбашки водню, які заважають
роботі елемента. Він занурив цинковий електрод в розчин цинкового купоросу, а
мідний - в розчин мідного купоросу. В результаті на мідному електроді водень не
виділявся, а відбувалося відновлення іонів міді. Такий пристрій вперше забезпечив
тривалу і стабільну дію гальванічного елемента, та ЕРС близьку до теоретичної,
що дорівнює 1,09 В. Незалежно аналогічний елемент був розроблений російським
ученим Б.С. Якобі.
р. французький інженер Жорж Лекланше
почав використовувати електроліт, загущений клейстером. Це революційним чином
змінило справу: «сухі» елементи Лекланше можна було застосовувати в будь-якому
положенні.
В сучасній техніці та технічних
засобах широко застосовують енерго-накопичувальні пристрої. Нагадаємо, що всі
джерела електроживлення поділяють на первинні та вторинні: первинні джерела
електроживлення - перетворюють різні види енергії в електричну (атомні,
теплові, гідроелектростанції; хімічні джерела струму тощо); вторинні джерела
електроживлення - перетворюють параметри електроенергії, отриманої від
первинних джерел.
Хімічним джерелом струму (ХДС)
називають засіб, в якому енергія хімічної реакції перетворюється безпосередньо
в електричну енергію. Хімічні джерела струму також поділяють на первинні
(гальванічні елементи) або primаry cells та вторинні акумулятори - secondary
cells.
Широке застосування ХДС обумовлене
їхньою ефективністю та універсальністю. Діапазон електричної потужності ХДС є
досить широким та складає від 10-5 Вт (для мініатюрних годинникових елементів
живлення) до 107 Вт (для акумуляторних батарей на підводних човнах). Маса
різних джерел змінюється в межах від долів грама до сотень тон. Жодне інше
джерело електричної енергії не має таких різноманітних можливостей для
застосування та універсальності характеристик.
Первинні хімічні джерела струму
складено з однієї чи декількох елементарних комірок - гальванічних елементів.
Робоча напруга окремого елемента є невеликою (від 0.4 В до 4 В), тому за
необхідності отримання більш високих значень напруг, необхідну кількість елементів
з’єднують послідовно, і об’єднують в гальванічну батарею. Первинними хімічними
джерелами струму є вугільно-цинові, лугові, ртутні, літієві та ін. Вторинними
хімічними джерелами струму є нікель-кадмієві, нікель-металгідридні,
літій-іонні, літій-полімерні, свинцево-кислотні, срібно-цинкові акумулятори.
Свинцево-кислотні акумулятори застосовують у джерелах безперервного живлення,
літій-іонні та літій-полімерні застосовують для живлення мобільних телефонів та
ін.
Акумуляторами називають вторинні
ХДС, які дозволяють повторне заряджання батареї під час пропускання струму від
зовнішнього кола в зворотному напрямі, що відновлює активні речовини
(реагенти). Такі ХДС також називають реверсивні або зворотні. Накопичення
енергії в акумуляторі відбувається під час проходження хімічної
окислювально-відновлювальної реакції, що може протікати як в прямому напрямі,
так і у зворотньому - такі реакції називають електродними.
Для деяких акумуляторів властивий,
так званий, «ефект пам’яті» («memory effect») - він полягає в зменшенні ємності
акумулятора за умов його неповного заряджання.
Заряджання акумулятора є процесом
перетворення електричної енергії в енергію, що поглинають реагенти ХДС,
внаслідок чого протікає відновлювальна хімічна реакція, а розряджання
акумулятора - це процес емісії електричної енергії в результаті окислювальної
хімічної реакції. Процес розряджання є зворотним до процесу заряджання, коли
акумулятор віддає заряд у зовнішнє електричне коло споживачеві електроенергії.
З появою електростанцій знадобились потужні
стаціонарні акумулятори. На станціях постійного струму вони є додатковим
джерелом енергії в моменти пікових навантажень. На станціях змінного струму
стаціонарні акумулятори застосовують для допоміжних цілей або як резервні.
Наведемо приклади: міські мережі постійного струму в 1927 р. мали батареї
акумуляторів, які розвивали потужність 80000 кВт (Берлін) та 95000 кВт
(Нью-Йорк).
В телефонних станціях акумулятори є
джерелом постійної напруги. Їх також застосовують у засобах зв'язку, системах
автоматики на залізниці, пристроях охоронної й пожежної сигналізації, для
аварійного освітлення та ін. З великої розмаїтості стаціонарних акумуляторів,
які забезпечують електроживлення навантажувального кола на час відключення
електропостачання, у більшості випадків застосовують свинцево-кислотні та
нікель-кадмієві акумулятори.
До ХДС відносять також іоністор -
енергонакопичувальний конденсатор, заряд у якому накопичується на межі
розподілу двох середовищ - електроду й електроліту.
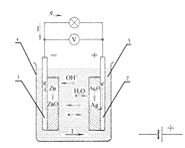
На рисунку 1 зображено ілюстрацію до
хімічного процесу, який має місце в ХДС (а) на прикладі срібно-цинкового
акумулятора та умовне позначення (б). До складу ХДС входять два електроди
(електрод з окислювачем (1) та з відновником(2)), електроліт (3) та корпус (4).
а б
Рисунок 1 - Хімічне джерело струму;
а - ілюстрація хімічного процесу в ХДС, б - умовне позначення на схемах
електричних принципових
Електрод (1), на якому має місце
окислювальний процес (з виділенням електронів) та через який струм протікає в
електроліт (3) - називають катодом (Zn). Електрод (2), на якому має місце
відновлювальний процес та до якого струм надходить з електроліту (3) -
називають анодом (Ag2O). Під час розряджання вторинного джерела струму анодом є
електрод з додатнім зарядом (на рис.2.1 - срібний електрод є анодом, цинковий -
катодом), під час заряджання елемента - анодом є електрод з від’ємним зарядом
(оскільки струм протікає в зворотному напрямі).
Хімічні реакції у ХДС наведені на
рис. 2.1, спостерігають на поверхнях електродів, занурених в електроліт.
На від’ємному електроді цинк
окислюють з виділенням електронів е, отримуючи при цьому окис цинку та воду
+ 2OH- → ZnO + H2O + 2e.
(2.1)
На додатньому електроді окис срібла
відновлюють з поглинанням електронів е, отримуючи при цьому срібло та окисник
O + H2O +2e → 2Ag + 2OH-.
(2.2)
В хімічних джерелах струму, залежно
від реагентів, хімічна реакція може протікати з виділенням газу.
Класифікація
хімічних джерел струму
За особливостями застосування ХДС
розділяють на п’ять різновидів (рис. 1):
) первинні (призначені для одного
розряду);
вторинні або акумулятори
(розраховані на певну кількість зарядів та розрядів до повного відпрацювання
реагентів);
паливні елементи (під час розряду
реагенти безперервно надходять до гальванічного елемента);
комбіновані (початковий запас одного
з реагентів залишається незмінним, другий необхідний реагент постійно надходить
до гальванічного елемента);
відновлювані (реагенти періодично
підлягають заміні, що дозволяє значно подовжити термін експлуатації батареї).
За конструктивними особливостями ХДС
класифікують за чотирма основними ознаками:
тип реагентів;
спосіб герметизації;
тип електролітичного розчину;
тип сепаратора.
Така класифікація є узагальненою,
оскільки ХДС можна розділити на підгрупи й за більш детальними ознаками.
За типом реагентів:
з рідкими реагентами (переважно
паливні елементи, оскільки реагенти розчиняються в електроліті під час розряду
батареї);
з твердими реагентами (реагенти на
твердих електродах, також можливе застосування твердих електролітів пористої
структури).
За видом герметизації:
з частковою герметизацією
(встановлюють односторонній клапан, що спрацьовує коли тиск газу перевищує
допустиме значення);
з повною герметизацією (газ
накопичується в спеціальних комірках - такий тип герметизації є характерним для
первинних ХДС).
Оскільки в результаті хімічних
реакцій гальванічний елемент може виділяти газ (водень або вуглекислий газ),
постало питання щодо відведення цього газу з гальванічних елементів. Повністю
розгерметизованими батареї не виготовляють, оскільки в багатьох з них
застосовують рідкі електроліти.
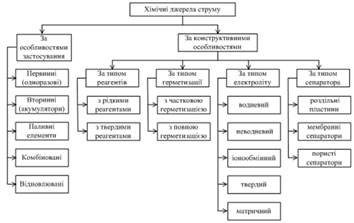
Рисунок 2 - Класифікація хімічних
джерел струму
Для того, щоб під час розряду
напруга батареї була в заданих межах (стабільною), необхідно забезпечити
однаковий рівень протікання хімічної реакції протягом роботи ХДС, для цього
застосовують сепаратори.
За типом електроліту:
водневі електроліти (розчини на
основі води);
неводневі (рідкий аміак);
іонообмінні (різновид твердих електролітів,
в яких один з видів іонів утворює макромолекулярна основа органічної речовини -
нерухомі іони);
тверді електроліти (іонні кристали,
в яких лише один з видів іонів є рухомим);
матричні електроліти.
За типом сепаратора:
з розділювальними пластинами;
з мембранними сепараторами;
з пористими сепараторами.
Гальванічні елементи
Загальні технічні характеристики
Гальванічним елементом (первинним
джерелом струму) називають пристрій, який складено з двох електродів та
іонопровідного електроліту.
Конструктивно гальванічний елемент
складено з уніфікованого контейнера, електродів (анодів та катодів) та
електроліту, абсорбованого активним матеріалом сепаратора, тому їх називають
сухими елементами. Цей термін застосовують до всіх елементів, що не містять
рідкого електроліту. Сухі елементи застосовують в режимах малих струмів та
переривчастих режимах для живлення телефонних апаратів, систем сигналізації,
систем керування та ін. Основні електричні характеристики гальванічних
елементів визначають умови їх експлуатації, тривалість дії та ефективність
використання.
Ємність гальванічного
елемента 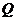 -
максимальна кількість електричної енергії, що споживає навантажувальне коло до
повного розряджання джерела.
-
максимальна кількість електричної енергії, що споживає навантажувальне коло до
повного розряджання джерела.
Ємність первинного заряджання
визначають за формулою:
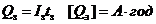 , (2.3)
, (2.3)
де  - ємність
заряджання, А·год;
- ємність
заряджання, А·год;
 - струм заряджання, А;
- струм заряджання, А;
 - час заряджання, год.
- час заряджання, год.
Ємність розряджання (для
вторинних елементів) 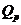 розраховують
за аналогічною формулою.
розраховують
за аналогічною формулою.
Напруга на клемах за умови
відсутності навантаження (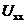 , або ЕРС) -
це значення різниці потенціалів (або окислювально-відновлювальних потенціалів)
між електродами, зануреними в електролітичний розчин, без підключення
навантажувального кола до гальванічного елемента.
, або ЕРС) -
це значення різниці потенціалів (або окислювально-відновлювальних потенціалів)
між електродами, зануреними в електролітичний розчин, без підключення
навантажувального кола до гальванічного елемента.
Напруга розряджання
(навантажувальна характеристика) ХДС 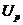 - це номінальне значення напруги,
що встановлюється між виводами джерела за під’єднанням навантажувального кола.
Залежність напруги розряджання від струму розряджання ХДС наведено на рис. 3.
- це номінальне значення напруги,
що встановлюється між виводами джерела за під’єднанням навантажувального кола.
Залежність напруги розряджання від струму розряджання ХДС наведено на рис. 3.

Рисунок 3 - Графіки залежності
напруги від струму розряджання U(Ip)
Струм розряджання Iр зазвичай
не визначають як окрему характеристику ХДС, оскільки залежить від опору
навантажувального кола, тому застосовують параметр пов’язаний з ним -
максимально допустимий струм розряджання Iдоп, (цей параметр відповідає
зниженню напруги розряджання до деякого критичного значення 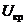 , нижче
якого застосування ХДС не є доцільним)
, нижче
якого застосування ХДС не є доцільним)
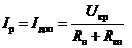 ,(2.4)
,(2.4)
де Rн - опір
навантажувального кола;вн - внутрішній опір ХДС.
Енергію ХДС W розраховують за
формулою:
 , (2.5)
, (2.5)
де 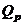 - заряд, що
вивільнився під час розряджання батареї;
- заряд, що
вивільнився під час розряджання батареї;
 - середнє значення наруги
розряджання.
- середнє значення наруги
розряджання.
Типи гальванічних елементів
Вугільно-цинкові
(марганець-цинкові) елементи є найбільш поширеними сухими гальванічними
елементами. Електроліт перебуває в пастоподібному стані або нанесений на
пористу діафрагму. Такий електроліт є малорухомим і не розтікається, тому такі
елементи називають сухими. Конструкцію циліндричного марганець-цинкового
гальванічного елемента наведено на рис. 4.
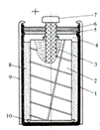
Рисунок 4 - Конструкція
циліндричного марганець-цинкового елементу
До складу циліндричних гальванічних
елементів зазвичай входять: цинковий стакан (1), пресований додатній електрод
(2), струмовідвідний стрижень (3), газовий проміжок (4), картонна шайба (5),
композитний матеріал, що герметизує (6), контакт позитивного електрода (7),
рідкий електроліт (8), картонний футляр (9), прокладка, що ізолює (10).
Номінальне значення напруги
розряджання для вугільно-цинкових елементів складає 1,5 В (для нормальних
елементів допускають середнє відхилення номіналу в межах 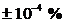 ; нормальні
- елементи, які застосовують як джерело опорної напруги).
; нормальні
- елементи, які застосовують як джерело опорної напруги).
Сухі елементи можуть мати
також дискову та прямокутну форму. Конструкція прямокутних елементів аналогічна
дисковим.
Конструкцію дискового
гальванічного елемента зображено на рис. 5. До складу дискових елементів
входять: позитивний пресований електрод (6), негативний секційний електрод (2),
сепаратор (3), зовнішній циліндричний струмовідвідний корпус (4), газовідвідні
камери (5), донна прокладка (1) та термокришка (7).
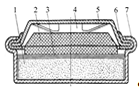
Рисунок 5 - Конструкція
дискового гальванічного елементу
Дискові елементи послідовно
з’єднують між собою (позитивно заряджений електрод одного елемента з’єднується
спеціальною перемичкою з негативно зарядженим електродом іншого гальванічного
елемента), отриманий елемент ізолюють та вкладають у футляр.
Вугільно-цинковим елементам
притаманний ефект відновлення протягом перерви в роботі. Це явище обумовлено
поступовим вирівнюванням локальних неоднорідностей в композиції електроліту, що
виникають в процесі розряджання.
Перевагою вугільно-цинкових
елементів є їх відносно низька вартість. До недоліків слід віднести доволі
значне зниження напруги під час розряджання, невисоку питому енергоємність
(5...10 Вт·год/кг) та малий термін зберігання.
В лугових елементах (на них
зазначають «alkaline»), як і у вугільно-цинкових, застосовують анод із MnO2 та
цинковий катод з розділеним електролітом. Відмінність лугових елементів від
вугільно-цинкових полягає у застосуванні лугового електроліту, внаслідок чого
процес виділення газу при розряджанні фактично відсутній, і їх можна виконувати
герметичними, що є дуже важливим для цілого ряду їх застосувань.
Номінальне значення робочої
напруги для лугових елементів приблизно на  менше (табл. 1), ніж у
вугільно-цинкових за однакових умов. Змінення напруги елементів з луговим
електролітом є більш повільним, ніж у елементів з сольовим електролітом. Вони
також мають більш високу питому енергію (65...90 Вт·год/кг), потужність
(100...150 кВт·год/м3) та вдвічі більший термін зберігання.
менше (табл. 1), ніж у
вугільно-цинкових за однакових умов. Змінення напруги елементів з луговим
електролітом є більш повільним, ніж у елементів з сольовим електролітом. Вони
також мають більш високу питому енергію (65...90 Вт·год/кг), потужність
(100...150 кВт·год/м3) та вдвічі більший термін зберігання.
Ртутні елементи дуже схожі за
параметрами на вугільно-цинкові елементи. До складу аноду входять суміші з
порошку цинку та ртуті. Напруга ртутного елементу приблизно на 0,15 В нижча ніж
у лугового (табл. 2.1). Ртутні елементи характеризуються високою питомою
енергією (90...120 Вт·год/кг, 300...400 кВт∙год/м3), стабільністю напруги
та високою механічною стійкістю. Ртутні елементи працездатні в інтервалі
температур від 0 до +50°С, окрім того їх виготовляють холодостійкими та
теплостійкими елементами, які здатні працювати при температурі до +70°С.
Оскільки ртуть є токсичною речовиною, ртутні елементи підлягають вторинній
переробці.
В літієвих елементах
застосовують аноди з літію, органічний електроліт та катоди з різноманітних
матеріалів (оксиди, сульфіди, фторовуглець). Їх характеризують дуже великими
термінами зберігання, високою густиною енергії та працездатні на широкому
інтервалі температур (-30…+70), оскільки вони не містять води.
Літій характеризують найвищим
від’ємним потенціалом серед інших металів, тому літієві елементи мають
найбільшу номінальну напругу за мінімальних габаритів.
Іонна провідність
забезпечується методом введення в розчинники солей, котрі мають аніони великих
розмірів.
Питома електрична провідність
неводних розчинів електролітів на 1...2 порядки нижча провідності водних. Крім
того, катодні процеси в них зазвичай протікають повільно, тому в елементах з
неводними електролітами густина струму невелика.
До недоліків літієвих
елементів слід віднести їх відносно високу вартість, обумовлену високою ціною
літію, особливими вимогами до їх виробництва: необхідність інертної атмосфери
та очистки неводних розчинників. Вибухонебезпечні елементи зазвичай розраховані
на напругу 1,5 В та 3 В. Вони успішно забезпечують електроживленням пристрої зі
споживанням близько 30 мкА в безперервному або 100 мкА в переривчастому
режимах. Літієві елементи широко застосовують в резервних джерелах
електроживлення, вимірювальних приладах та інших високотехнологічних системах.
Узагальнену інформацію
стосовно основних гальванічних елементів наведено в табл. 1.
Таблиця 1 - Порівняльні
характеристики основних типів гальванічних елементів
|
Параметр
|
Тип гальванічного елементу
|
|
Вугільно-цинкові елементи
|
Лугові елементи
|
Ртутні елементи
|
Літієві елементи
|
|
Номінальна напруга на елементі, В
|
1,5
|
1,4
|
1,25
|
1,5-3
|
|
Опір зовнішнього кола, Ом
|
20-200
|
20-200
|
25-300
|
30000
|
|
Середнє значення ємності, А·год
|
1,5-3
|
1,5-3
|
2,3
|
2,4
|
|
Діапазон робочих температур, ○С
|
0...+40
|
-30...+55
|
0...+50
|
-30…+70
|
|
Мінімально допустиме значення напруги, В
|
0,75
|
0,75
|
-
|
0,1
|
|
Термін гарантійного зберігання, міс
|
6-18
|
36
|
36
|
18
|
Акумулятори
Загальні характеристики
Акумулятори належать до категорії
хімічних джерел енергії багаторазової дії. Накопичення енергії в них
здійснюється під час протікання окисно-відновних хімічних реакцій на
електродах. Під час процесу розряджання акумулятора відбуваються зворотні
процеси.
Напруга акумулятора - це різниця
потенціалів між полюсами акумулятора під час фіксованого навантаження. Для
отримання достатньо великих значень напруги чи ємкості окремі акумулятори
поєднують між собою паралельно чи послідовно у батареї.
Ємність акумулятора Q - це
максимальний заряд в кулонах (ампер-годинах) (1Агод = 3600Кл), який акумулятор
здатен віддати під час проходження процесу розряджання до визначеного кінцевого
значення напруги.
В умовних позначеннях типу
акумулятора вказують номінальну ємність, тобто ємність за нормальних умов
розряджання (розряджання номінальним струмом за температури 20°С).
Акумулятори слід обирати за такими
параметрами:
коефіцієнт віддачі kвід - це
відношення заряду, що віддає акумулятор під час повного розряджання, до заряду,
отриманого під час заряджання;
коефіцієнт корисної дії акумулятора η
- це відношення заряду, який він спроможний
віддати навантажувальному колу під час процесу розряджання до кількості
отриманого ним заряду під час заряджання.
Значення коефіцієнта корисної дії
завжди менше значення коефіцієнта віддачі.
Паралельним з’єднанням акумуляторів можна
скласти батарею великої ємності з номінальною напругою одного акумулятора і
сумарною ємністю всіх акумуляторів.
Акумулятори широко застосовують для
електроживлення різних електронних пристроїв - мобільних телефонів, портативних
комп’ютерів, диктофонів та ін. Визначальним фактором під час виробництва
акумуляторів є портативність. Під цим терміном розуміють малий об’єм, вагу,
високу надійність, тривалий час автономної роботи. Окрім цього існує ряд інших
параметрів, важливих для всіх акумуляторів, наприклад: кількість циклів
«заряджання-розряджання», внутрішній опір, термін зберігання, стабільність
напруги під дією навантаження і т.п.
Типи акумуляторних батарей
Широке застосування в мобільних
пристроях та пристроях радіозв’язку знайшли такі типи акумуляторів:
нікель-кадмієві (Ni-Cd) -
електроживлення фотоапаратів, відеокамер та портативної побутової техніки;
нікель-металгідридні (Ni-MH) -
електроживлення побутової техніки;
літій-іонні (Li-Ion) -
електроживлення мобільних телефонів;
літій-полімерні (Li-polymer) -
електроживлення мобільних телефонів;
герметичні свинцево-кислотні
-джерела безперервного електроживлення.
Акумулятори виготовляють як один
елемент, так і як декілька послідовно з’єднаних і оформлених в одному корпусі
елементів - батарей. Деякі моделі сучасних акумуляторів включають в себе
електронні елементи керування, що забезпечують контроль режиму зарядження та
захист акумулятора від неправильної експлуатації.
Таблиця 2 - Порівняльні
характеристики основних типів акумуляторних батарей
|
Параметр
|
Тип акумуляторної батареї
|
|
Нікель-кадмієва
|
Нікель-метал-гідридна
|
Літій-іонна
|
Літій-полімерна
|
Свинцево-кислотна
|
|
Умовне позначення
|
Ni-Cd
|
Ni-MH
|
Li-Ion
|
Li-Polimer
|
Pb
|
|
Густина енергії, Вт∙год/кг
|
40 ÷ 60
|
60 ÷ 80
|
100 ÷ 150
|
150 ÷ 200
|
30
|
|
Напруга на елементі, В
|
1,25
|
1,25
|
3,6
|
3,6
|
2,0
|
|
Сила струму навантажувального кола, А,
відносно ємності С
|
>2∙С
|
(0,5÷1,0) ∙С
|
<1∙С
|
0,2∙С
|
0,2∙С
|
|
Кількість робочих циклів
заряджання/розряджання (зменшення ємності до 80%)
|
1500
|
500
|
500÷1000
|
100÷150
|
200÷500
|
|
Діапазон робочих температур, ○С
|
-40...+60
|
-20...+60
|
-20...+60
|
0...+60
|
-20...+60
|
|
Мінімальний час заряджання, год
|
1 ÷ 2
|
2 ÷ 4
|
3 ÷ 4
|
8 ÷ 15
|
8 ÷ 16
|
|
Безпека експлуатації
|
висока
|
висока
|
низька
|
низька
|
середня
|
|
Саморозряджання за місяць, %
|
20
|
30
|
10
|
10
|
5-15
|
|
Періодичність обслуговування, днів
|
30
|
60 ÷ 90
|
не регл.
|
не регл.
|
90 ÷ 180
|
|
Ефект пам’яті
|
так
|
так
|
ні
|
ні
|
так
|
|
Вартість
|
низька
|
середня
|
висока
|
висока
|
низька
|
Нікель-кадмієві (Ni-Cd) акумулятори
були створені ще в 1899 р. Вальдмаром Юнгнером (Швеція), їх виробляють в різних
країнах світу орієнтовно з 1950 р. На сьогоднішній день близько 50% всіх
акумуляторів для портативного обладнання є нікель-кадмієвими.
Конструкцію нікель-кадмієвого
акумулятора наведено на рисунку 2.6,а. У нікель-кадмієвого елемента негативно
та позитивно заряджені пластини з’єднані разом та вміщені в металевий циліндр.
Позитивна пластина є гідроокисом нікелю, а негативна - гідроокисом кадмію. Дві
пластини ізольовані сепаратором в електроліті.
Переваги таких акумуляторів:
висока стійкість до перепадів
температур;
висока стійкість до великої сили
струму заряджання і розряджання, оскільки малий внутрішній опір дозволяє
віддавати струми великої сили (для інших типів акумуляторів це не характерно);
велика кількість циклів
заряд-розряд;
саморозрядження в 1-й місяць
зберігання 25-30% від ємності акумулятора, надалі 5-10%;
низька вартість.
Серед усіх акумуляторів
нікель-кадмієві - єдині, які найкраще віддають максимальну ємність,
забезпечують велику кількість циклів заряджання-розряджання, якщо періодично
здійснюються глибокі розряди.
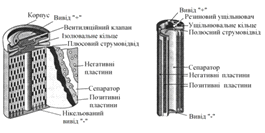
а б
Рисунок 6 - Конструкція
акумуляторів; а - нікель-кадмієвого; б - нікель-металгідридного
Недоліки нікель-кадмієвих
акумуляторів:
відносно низька питома ємність;
наявність так званого «ефекту
пам’яті» (у тих випадках, коли акумулятор не завершує повного циклу
заряду/розряду, це призводить до того, що батарея начебто «запам’ятовує»
ємність з розрахунку невикористаних секторів, і таким чином номінальна ємність
акумуляторної батареї стає меншою);
екологічна небезпечність, оскільки
кадмій є високотоксичною речовиною; виникають проблеми з його утилізіцією.
Нікель-металгідридні (Ni-MH)
акумулятори з’явились на ринку в кінці 80-х років XX століття. Стимулом для
виробництва цих акумуляторів є їх більш висока густина енергії у порівнянні з
Ni-Cd. Нікель-металгідридний акумулятор конструктивно схожий на
нікелево-кадмієвий акумулятор, але має інший хімічний склад електроліту та
електродів (рис. 2.6, б). В порівнянні з нікель-кадмієвими акумуляторами
нікель-металгідридні акумулятори мають більший коефіцієнт саморозрядження.
Переваги Ni-MH (у порівнянні з Ni-Cd
акумуляторів):
більша питома ємність (за однакових
габаритних розмірах значення ємності на 30% більше), менша маса;
у порівнянні з Ni-Cd акумуляторами
менший прояв «ефекту пам’яті»;
простота зберігання і
транспортування - не потребує регулярного контролю
містять меншу кількість токсичних
металів.
Недоліки (у порівнянні з Ni-Cd):
менший діапазон температури, ніж у
Ni-Cd;
не витримують великого зарядного
струму, оскільки в процесі розрядки виділяється велика кількість тепла;
мають суттєво меншу кількість циклів
заряджання-розряджання;
саморозряджання майже у 1,5 рази
вище ніж у Ni-Cd акумулятора;
найнижча навантажувальна здатність -
не можуть віддавати великі струми;
глибокі розряди є небажаними,
оскільки довговічність роботи батареї безпосередньо пов'язана з глибиною
розряду;
ціна Ni-MH акумулятора вища, ніж
Ni-Cd;
Сучасні Ni-MH батареї обладнані
внутрішнім сенсором температури для виявлення повного заряду. Надмірне заряджання
акумулятора в найпростішому зарядному пристрої (що не має автоматичного
відключення) може призвести до перенагрівання та повного руйнування
акумулятора.
Виробництво літій-іонних (Li-Ion)
акумуляторних батарей почалося на початку 90-х років XX століття.
На рис. 7 наведено конструкцію
літій-іонного акумулятора, В якому електроди та сепаратор поміщені в електроліт
із літієвої солі.

Рисунок 7 - Конструкція
літій-іонного акумулятора
Переваги літій-іонних акумуляторів:
кількість циклів
заряджання-розряджання більша ніж у Ni-MH акумулятора;
відносно низький саморозряд;
висока питома ємність;
літій має найбільший електрохімічний
потенціал, що забезпечує більшу ємкість;
відсутній «ефект пам’яті», тому час
від часу можна заряджати і не повністю розряджений акумулятор;
літій-іонні акумулятори значно
безпечніші та більш екологічно чистіші від акумуляторів на основі свинцю або
кадмію.
Недоліки літій-іонних акумуляторів:
малий діапазон робочих температур;
висока ціна;
вибухонебезпечні.
В конструкції сучасних Li-Ion
акумуляторів присутні так звані smart-мікросхеми. Це дозволяє керувати зарядним
пристроєм таким чином, щоб процес заряджання був найбільш ефективним залежно
від відпрацьованої кількості циклів заряджання-розряджання. Літій-полімерні
(Li-Polymer) акумулятори відрізняються від літій-іонних акумуляторів видом
електроліту, що застосовують. Це найновіший тип акумуляторів. Виробництво
літій-полімерних акумуляторів почалось в 1999 році. Основна концепція батареї
літій-полімеру полягає у застосуванні твердого електроліту на полімерній
основі. Переваги літій-полімерних акумуляторів:
велика густина енергії акумулятора;
низьке саморозрядження;
малі розміри (застосування твердого
електроліту дозволяє зменшити товщину акумулятора до 1 мм);
гнучка форма (застосування
різноманітних плівок замість рідкого електроліту);
низька вага;
висока безпека при використанні.
Недоліки літій-полімерних
акумуляторів:
не працюють в режимах великих
струмів;
не працює за низьких температур
висока ціна.
Виробництво свинцево-кислотних
акумуляторів почалось в 1900 році. Основною перевагою герметичних
свинцево-кислотних акумуляторів (1970) (рис. 8) є стабільність напруги за умови
змінення струму навантаження й температури.
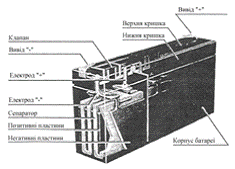
Рисунок 8 - Конструкція
свинцево-кислотної акумуляторної батареї
Свинцево-кислотний акумулятор
складено, як правило, з двох пластин (електродів), поміщених в електроліт:
водний розчин сіркової кислоти.
Переваги свинцево-кислотних
акумуляторів:
стабільність напруги за умов
змінення струму навантаження й температури;
в сучасних свинцево-кислотних
акумуляторах, залежно від середньої глибини розряджання, кількість циклів може
досягати 800-1000;
низьке саморозрядження;
відсутність «ефекту пам'яті»;
невисока вартість.
Недоліки свинцево-кислотних
акумуляторів:
найнижча питома ємність, хоча у
багатьох випадках це може бути і не критичним;
вимагають додаткових витрат на
обслуговування;
можуть негативно впливати на людей і
апаратуру.
На відміну від інших типів акумуляторних
батарей свинцево-кислотну батарею зазвичай застосовують, коли потрібна велика
ємність, вимоги до маси не критичні і ціна батареї повинна бути низькою.
Іоністори
Іоністор (за міжнародною
термінологією - суперконденсатор, supercapacіtor) - це конденсатор, заряд у
якому накопичується на межі розподілу двох середовищ - електроду й електроліту.
Іоністор зберігає енергію у вигляді статичного заряду. Накопичення
відбувається, якщо до його обкладинок прикладена постійна напруга. Іоністори
можуть замінювати хімічні джерела струму як резервне (мікросхеми пам’яті) або
основне (годинники, калькулятори) джерело електроживлення.
Якщо простий конденсатор має
обкладинки з фольги, розділені сухим сепаратором, то іоністор - це сполучення
конденсатора з електрохімічною батареєю. У ньому застосовують спеціальні
обкладинки й електроліт (рис. 9). Найчастіше іоністори застосовують для
електроживлення мікросхем пам’яті. Крім того, їх застосовують у колах
фільтрації й згладжувальних фільтрах.
струм акумуляторний батарея
іоністор

Рисунок 9 - Конструкція іоністора
Максимально допустиме значення
напруги іоністора залежить від виду застосованого електроліту. Для отримання
вищої робочої напруги, іоністори з’єднують послідовно; параметри іоністорів в
такому з’єднанні мають бути дуже близькими.
Внутрішній опір Rвн іоністора
розраховують за формулою:
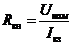 ,(2.6)
,(2.6)
де Rвн - внутрішній опір; ном
- номінальна напруга іоністора;кз - струм короткого замикання.
Основні характеристики деяких
іоністорів наведено в табл. 3.
Таблиця 3 - Основні
характеристики іоністорів
|
Тип іоністора
|
Ємність, Ф
|
Номінальна напруга, В
|
Внутрішній опір, Ом
|
Маса, г
|
|
58-3
|
2,00
|
2,5
|
30
|
2,0
|
|
58-9а
|
0,47
|
2,5
|
80
|
0,5
|
|
2,00
|
2,5
|
30
|
2,0
|
|
58-96
|
0,62
|
5,0
|
60
|
11.0
|
5,0
|
60
|
11,0
|
|
0,62
|
6,3
|
90
|
11,0
|
|
58-98
|
1,00
|
5,0
|
60
|
8,0
|
|
0,62
|
6,3
|
90
|
10,0
|
Довговічність іоністора залежить від
умов експлуатації. Так, за умови роботи з номінальною напругою Uном та
температурою навколишнього середовища +70°С гарантована довговічність складає
500 годин. За умови роботи з напругою 0,8Uном вона може бути збільшена до 5000
годин. Якщо ж напруга на іоністорі не перевищує 0,6 Uном, а температура
навколишнього середовища +40°С, то іоністор справно працюватиме не менше 40000
годин.
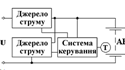
Схему під’єднання іоністора як
резервного джерела живлення наведено на рис. 2.10. Діод VD1 запобігає
розряджанню іоністора С1, якщо Uживл=0. Резистор R1 обмежує зарядний струм
іоністора, й захищає джерело живлення від перевантаження під час вмикання. Він
не потрібен, якщо джерело електроживлення витримує короткочасне навантаження
струмом 100...250 мА.
У багатьох випадках іоністор замінює
вбудовані в прилад резервні джерела електроживлення. Також іоністор є
перспективним як накопичувач енергії під час роботи спільно з сонячними
батареями. В цьому стані особливо важлива його некритичність до режиму
заряджання, практично необмежене число циклів заряджання-розряджання.

Рисунок 10 - Схема включення
іоністора як резервного джерела живлення
На рис. 11 наведено типові
характеристики саморозряджання іоністорів для опорів від 27 кОм до 1 МОм, та в
режимі холостого ходу (режим зберігання).
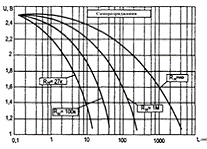
Рисунок 11 - Типові характеристики
саморозрядження іоністорів
Іоністори можуть працювати як буфер
з батареями з метою захисту їх від різких перепадів навантажувального струму:
при низькому струмі навантаження батарея заряджає суперконденсатор. Якщо струм
різко зросте, іоністор віддасть накопичену енергію, й зменшить навантаження на
батарею. За таких умов застосування його розташовано безпосередньо біля
акумуляторної батареї або всередині її корпусу.
Переваги іонисторів:
широкий діапазон робочих температур:
-25...+70°С;
низький внутрішній опір;
швидкий заряд (декілька секунд);
робота за напруги, що не перевищує
номінальну;
відсутність необхідності контролю за
режимом заряджання;
застосування простих методів
заряджання;
великий термін служби;
низька вартість.
Недоліки іоністорів:
низька енергетична густина;
низька напруга для окремих типів
іоністорів;
для одержання необхідної напруги
необхідно послідовне включення не менше трьох іоністорів;
високе саморозрядження.
За умови застосування іоністорів у
схемах електронних пристроїв, принципіальна схема їх заряду є досить простою,
оскільки іоністори допускають значне змінення струму заряджання.
Режими заряджання та розряджання
акумуляторних батарей
Порівняння режимів заряджання
У таблиці 4 наведено еквівалентні
схеми, параметри контролю, основні переваги й особливості методів заряджання.
Обґрунтування вибору методу заряджання виконаємо порівнянням основних
характеристик.
Режим квазі-усталеного струму
характеризується тим, що на початку заряду напруга батареї u має мінімальне
значення, струм заряджання i максимальний; в процесі заряджання батареї напруга
зростає, а струм заряджання зменшується. Величина обмежувального опору R
визначає максимальний струм заряджання батареї на початку періоду на рівні 0,1С
(де С - ємність акумулятора в А∙год, а 0,1 - коефіцієнт у год-1).
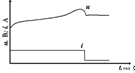
Двоінтервальні режими заряджання
характеризуються розбивкою часу заряджання на два інтервали. Відмінність
режимів полягає в організації контролю закінчення першого інтервалу, у той час
як на другому інтервалі у всіх режимах здійснюється компенсація саморозряджання
батареї струмом 0,05С…0,033С.
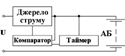
У режимі заряджання за часом на
першому жорстко заданому інтервалі відбувається основне заряджання батареї
струмом 0,2С; тривалість інтервалів контролюється таймером, що входить до
складу системи. У режимі заряджання з контролем спаду напруги на першому
інтервалі заряджання здійснюється постійним струмом 0,5С…1С й ознакою його
закінчення є спад напруги батареї, що становить 15…20 мВ на один елемент і
визначається за допомогою компаратора.
У режимі контролю градієнта
температури батареї на першому інтервалі відбувається основне заряджання
струмом 0,5С…1С, ознакою закінчення якого є зростання градієнта температури
батареї внаслідок електролізу води, що супроводжується виділенням тепла й
контроль над яким здійснюється датчиком температури Т, що входить до складу
системи.
Режим з безперервним підзарядженням
батареї, або режим заряджання батареї в буферному режимі характеризують
безперервним заряджанням невеликим струмом, що не здатний спричинити ефект
перезарядження й підтримує батарею в максимально зарядженому стані. Значення
струму заряджання вибирають з урахуванням періодичності застосування батареї -
при частому застосуванні контролер, що веде статистику роботи батареї,
установлює струм заряджання 0,033С…0,05С, а за умови нечастого використання -
0,02С…0,033С. Якщо зникне зовнішнє живлення, заряджена батарея підключається до
навантажувального кола через реле, яке вмикає система керування. Даний режим
також відносять до двоінтервальних, але, на відміну від попередніх, у ньому жорстко
обмежується час розряджання.
У режимі імпульсного заряджання
батарею заряджають імпульсами струму з постійною амплітудою, рівної 2С. Між
імпульсами струму є короткі паузи (rest-періоди), протягом яких батарея
перебуває в стані спокою, і які дозволяють хімічним реакціям у батареї
рівномірно розподілятися по всій поверхні електродів. Така форма струму
частково запобігає ефекту пам’яті, проявом якого є в зменшенні реальної ємності
акумулятора в процесі експлуатації.
Таблиця 4 - Характеристики методів
заряджання акумуляторів
|
№ п. п.
|
Метод
|
Криві заряджання
|
Еквівалентна схема
|
Переваги
|
Недоліки
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
|
1
|
Квазі- усталеного струму
|

|

|
проста конструкція системи заряджання
|
тривалий час заряджання; більші втрати на
обмежувальному резисторі R
|
|
|
2
|
Двоінтервальні методи
|
Заряджання за часом
|
|

|
проста конструкція системи заряджання
|
не враховано ступінь початкового рівня розряду
батареї
|
|
|
3
|
|
Контроль спаду напруги
|

|
|
висока швидкість заряджання
|
можливі помилки під час визначення часу
завершення заряджання, внаслідок чого можливе перезаряджання акумулятора
(виділення активної маси з елемента, що призводить до виходу його з ладу)
|
|
|
4
|
|
Контроль градієнта температури
|
|

|
висока швидкість заряджаня; надійність
визначення закінчення заряджання
|
необхідність у вбудованому в батарею датчика
температури
|
|
|
5
|
|
З безперервним підзарядкжаням батареї
|

|

|
простота конструкції; низька вартість системи
заряджання
|
відсутність контролю за процесом заряджання
|
|
|
6
|
Імпульсне заряджання батареї
|
|

|
зниження ефекту пам’яті батареї
|
складна конструкція системи заряджання
|
|
7
|
Заряджання асиметричним струмом (імпульсне
заряджання зі зворотним імпульсом)
|

|
|
зниження ефекту пам’яті батареї; зниження
пікових значень температури й внутрішнього тиску батареї за умови заряджання.
|
складна конструкція системи заряджання.
|
|
|
|
|
|
|
|
|
|
|
|
Режим заряджання імпульсним
асиметричним струмом, або метод імпульсного заряджання зі зворотним викидом
характеризують заряджанням батареї імпульсами струму з постійною амплітудою,
рівної 2С, між якими є короткі паузи, а також імпульси розрядного струму з
амплітудою 10С. Завдяки таким імпульсам розряджання кисень, що виділяється в
процесі заряджання батареї, видаляють з реагуючої пластини, що запобігає її
окислюванню й подовжує термін служби батареї. Для визначення закінчення
заряджання батареї в останніх двох режимах може використатися ознака спаду
напруги та (або) ознака градієнта температури.
Для кожного джерела струму існують
оптимальні рекомендовані режими розряджання, за яких він спроможний віддати
максимальну енергію. Для визначення типу акумулятора та розрахунку їх кількості
використовують криві розряджання. Значення Ip та Uр задають умови роботи
споживача; особливості експлуатації роботи апаратури визначають тривалості tp
кожного з можливих режимів роботи апаратури. Сума добутків Iрtр відповідає
необхідній ємності розряду Ср. Зі значень Uр та Ір за кривими розряджання
знаходять ємність розряджання Ср, яку забезпечують хімічні джерела струму.
У ХДС має місце процес
саморозряджання (втрата енергії, що обумовлена протіканням в джерелі внутрішніх
неперервних процесів), незалежно від того, віддають вони енергію споживачу або
ні. Низький рівень саморозряджання є одним із показників ефективності батареї.
Можливі випадки, коли джерело малої ємності з меншим саморозряджанням за добу
може бути кращим ніж джерело з більшою ємністю, але з більшим саморозряджанням.
Для акумуляторів саморозряджання
визначають відсотком від номінальної ємності, втраченої за нормований час, коли
акумулятор перебуває у неробочому стані. Для первинних елементів мірою
саморозряджання є його зберігання.
На рис. 12 наведено дані, щодо
змінення номінальної ємності від кількості циклів заряджання-розряджання для
різних режимів заряджання.
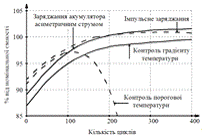
Рисунок 12 - Залежність ємності
акумулятора від кількості циклів заряджання/розряджання
Термін служби акумуляторних батарей
Термін служби (термін експлуатації)
акумулятора прийнято оцінювати за кількістю циклів заряджання/розряджання, які
він допускає в процесі експлуатації без значного погіршення своїх основних
параметрів: ємності, саморозрядження і внутрішнього опору. Термін служби
залежить від багатьох чинників: методів заряджання, глибини розряджання,
процедури обслуговування або його відсутності, температури і хімічної природи
акумулятора. Крім того, термін служби визначають часом з дати виготовлення
акумулятора, особливо для LI-Ion акумуляторів. Вважають, що акумулятор вийшов з
ладу, якщо його ємність зменшилась до 60-80% від номінального значення.
Втрати ємності визначають за
формулою:
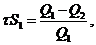 (2.8)
(2.8)
де 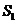 - втрати
ємності за добу;
- втрати
ємності за добу;
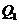 - ємність ХДС до зберігання;
- ємність ХДС до зберігання;
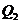 - ємність ХДС після зберігання;
- ємність ХДС після зберігання;
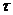 - термін зберігання, діб.
- термін зберігання, діб.
Які ж числові значення
терміну служби для різних акумуляторів? За критерій вибрано зменшення реальної
ємності акумулятора в процесі проведення циклів заряджання/розряджання до 80%
від номінального значення. Нижче наведено терміни служби для деяких
акумуляторів (дивись Табл 2.2):Сd (нікель-кадмієві) - 1500 циклів
заряджання/розряджання (за умови правильного і регулярного обслуговування число
робочих циклів заряд може досягати 4000);MH (нікель-металгідридні) - 500 циклів
заряджання/розряджання;Ion (літій-іонні) - 500...1000 циклів заряджання/розряджання;Pol
(літій-полімерні) - 100...150 циклів заряджання/розряджання.
Таким чином, найбільшу
кількість циклів заряджання/розряджання забезпечують нікель-кадмієві
акумулятори, але вони ж найбільш вимогливі в обслуговувані. Слід зазначити, що
відлагоджена технологія і надійна робота забезпечили цьому типу акумуляторів
широке розповсюдження для живлення портативної техніки і устаткування. Крім
того вони мають найменшу вартість в перерахунку на один цикл
заряджання/розряджання.
Найменша кількість максимально
допустимих циклів у літій-полімерних акумуляторів.
Літій-іонні акумулятори мають
найбільш сприйнятливий термін служби: від 500 до 1000 циклів, або два роки з
моменту виготовлення.
Технічні характеристики та термін
роботи акумуляторів мобільних телефонів
У таблиці 5 додатково вказані
приблизні дані терміну роботи та інші характеристики мобільних телефонів під
час реалізації різних функцій порівняно з режимом очікування:
1 хвилина роботи
підсвічування 1 годині у
режимі очікування;
1 годині у
режимі очікування;
секунд роботи з меню 15 хвилинам
в режимі очікування;
15 хвилинам
в режимі очікування;
хвилина приймання інформації
з мережі 30 хвилинам
очікування;
30 хвилинам
очікування;
реєстрація на наступній БС 1 годині
очікування;
1 годині
очікування;
включення телефону з
подальшим пошуком і реєстрації в мережі 2годинам очікування.
2годинам очікування.
Сучасні телефони, як правило,
застосовують адаптивне налаштування рівня потужності в режимі розмови (Active
mode), тобто залежно від відстані до базової станції потужність буде
автоматично регулюватися для підтримання на незмінному рівні відношення сигналу
до шуму (С/Ш). Також сила струму залежить від того, яка інформація передається
через канал зв’язку, оскільки під час передачі даних (режим GPRS) потрібний
рівень С/Ш повинен бути на 2 дБ більший ніж під час передачі голоса.
У режимі розмови сила струму
телефону в середньому прийнято від 200 до 450 мА . Якщо в середньому струм у
режимі очікування 3…5 мА, то дані роботи щодо різних функцій телефону порівняно
з режимом очікування, відповідно, можна визначити так:
хвилина роботи підсвічування 20 мА;
20 мА;
секунд роботи з меню 5 мА;
5 мА;
хвилина приймання інформації
з мережі 10 мА;
10 мА;
реєстрація на наступній БС 20 мА;
20 мА;
включення телефону з
подальшим пошуком і реєстрації в мережі 40 мА.
40 мА.
Але в режимі очікування (Idle
mode) струм може доходити і до 20 мА. Все залежить від яскравості підсвічування
та відстані до БС.
Акумуляторні батареї, які
зараз застосовують у портативних пристроях (мобільні телефони, КПК, плеєри та
інші) мають ємність від 500 мА/год. до 1550 мА/год.
Таблиця 5 - Технічні
характеристики акумуляторів деяких мобільних телефонів
|
Модель телефона
|
Тип акумулятора
|
Модель акумулятора
|
Ємність, мАгод
|
Напруга, В
|
Час роботи (очікування/розмова), год
|
|
Nokia N95
|
Li-Ion
|
BL-5F
|
950
|
3,7
|
240/6
|
|
Nokia N73
|
Li-Pol
|
BP-6M
|
1100
|
3,7
|
350/4
|
|
Nokia 7373
|
Li-Ion
|
BL-4B
|
700
|
3,7
|
250/2
|
|
Sony-Ericsson K850i
|
Li-Pol
|
BST-38
|
930
|
3,6
|
400/9
|
|
Sony-Eicsson K750i
|
Li-Pol
|
BST-37
|
900
|
3,6
|
360/7
|
|
Motorola RAZR2 V8
|
Li-Ion
|
BX40
|
950
|
3,6
|
260/3
|
Висновки
. Хімічним джерелом струму називають
пристрій, в якому енергія хімічної реакції перетворюється безпосередньо в
електричну енергію.
. Гальванічним елементом називають
пристрій, який складено з двох електродів та іонопровідного електроліту.
. Акумуляторами називають ХДС, які
дозволяють повторне заряджання під час пропускання струму від зовнішнього кола
в зворотному напрямі, що відновлює активні речовини (реагенти). Такі ХДС також
називають вторинними (реверсивними або зворотними).
. Заряджання акумулятора - це процес
перетворення електричної енергії в енергію, що поглинають реагенти ХДС,
внаслідок чого протікає відновлювальна хімічна реакція, а розряд акумулятора -
це процес емісії електричної енергії в результаті окислювальної хімічної
реакції. Процес розряджання є зворотним до процесу заряджання, коли акумулятор
віддає заряд у зовнішнє електричне коло споживачеві електроенергії.
. За особливостями застосування ХДС
розділяють на первинні; вторинні, або акумуляторні; паливні елементи;
комбіновані; відновлювані.
. За конструктивними особливостями
ХДС класифікують за такими ознаками: тип реагентів; спосіб герметизації; тип
електролітичного розчину; тип сепаратора.
. Електрод, на якому протікає
окислювальний процес (з виділенням електронів) та через який струм протікає в
електроліт - називають анодом. Електрод, на якому протікає відновлювальний
процес, та до якого струм надходить з електроліту - називають катодом.
. Напруга розряджання ХДС - це
номінальне значення напруги, що встановлюється між виводами джерела за
під’єднанням навантажувального кола.
. Основні типи гальванічних
елементів поділяють на вугільно-цинкові елементи, лугові елементи, ртутні
елементи, літієві елементи.
. Ємність акумулятора - це фізична
величина, що дорівнює максимальному заряду в кулонах (ампер годинах) (1Агод =
3600Кл ), який акумулятор здатен віддати під час проходження процесу
розряджання до визначеного кінцевого значення напруги.
. Акумулятори слід обирати за такими
параметрами: коефіцієнт віддачі - це відношення кількості електрики в кулонах,
що віддає акумулятор під час повного розряджання, до кількості електрики,
отриманої під час заряджання; коефіцієнт корисної дії акумулятора - це
відношення заряду, який він спроможний віддати навантажувальному колу під час
процесу розряджання, до кількості отриманого ним заряду під час заряджання.
. У пристроях радіозв’язку знайшли
застосування такі типи акумуляторів: нікель-кадмієві (Ni-Cd),
нікель-металгідридні (Ni-MH), літій-іонні (Li-Ion), літій-полімерні
(Li-polymer), герметичні свинцево-кислотні (SLA).
. Важливою характеристикою
акумуляторів є, так званий, «ефект пам’яті», який полягає у зменшенні
номінальної ємності акумуляторної батареї, коли акумулятор не завершує повного
циклу заряджання/розряджання.
. Альтернативою акумуляторним
батареям є іоністори або конденсатори, заряд у якому накопичується на межі
розподілу двох середовищ - електроду й електроліту. Вони мають малий час
заряджання, необмежену кількість циклів заряджання та розряджання, та широкий
діапазон робочих температур.
. В ХДС має місце ефект
саморозряджання (зниження електричної ємності батареї з часом), що спричинено
наявністю активних речовин, які за певних зовнішніх умов тимчасово стають
нестійкими (проходять бічні хімічні реакції); корозією електродів за тривалий
проміжок часу (особливо проявляється для елементів з частковою герметизацією та
з електролітами на основі водних розчинів).
. Термін служби (термін
експлуатації) акумулятора прийнято оцінювати за кількістю циклів
заряджання/розряджання, які він витримує в процесі експлуатації без значного
погіршення своїх основних параметрів: ємності, саморозряджання і внутрішнього
опору. Термін служби залежить від багатьох чинників: методу заряджання, глибини
розряджання, процедури обслуговування або її відсутності, температури та
хімічної природи акумулятора.
Список використаної літератури
1.
Справочник по электрическим конденсаторам / М.Н. Дьяконов, В.И. Карабанов, В.И.
Присняков и др.; Под общ. ред. И.И. Четверткова и В.Ф. Смирнова. М.: Радио и
связь, 2003. - 576 с.
.
Вересов Г.П. Электропитание бытовой радиоэлектронной аппаратуры. - М.: Радио и
связь, 1983. - 128 с.
.
Иванов-Цыганов А.И., Хандогин В.И. Источники вторичного электропитания приборов
СВЧ. - М.: Радио и связь, 1989. - 144 с.
.
Исаев Э.А. Полупроводниковые преобразователи напряжения. - М.: Воениздат, 1962,
112 с.
.
Источники электропитания радиоэлектронной аппаратуры: Справочник / Г.С.
Найвельт, К.Б. Мазель, Ч.И. Хусаинов и др.; под ред. Г.С. Найвельта. - М.:
Радио и связь, 2006. - 576 с.
.
Китаев В.Е., Бокуняев А. . Проектирование источников питания устройств связи.
Учебное пособие. М., Связь, 1972, 200 с.
.
Митрофанов А.В., Щеголев А.И. Импульсные источники вторичного электропитания в
бытовой радиоаппаратуре. - М.: Радио и связь, 1985. - 72 с.
.
Жучков В. “Расчёт трансформатора импульсного блока питания”, “Радио”, №11,
2007, с. 43.
.
Косенко С. “Расчёт импульсного трансформатора двухтактного преобразователя”,
“Радио”, №4, 2005, с. 35 - 37, 44.
.
Функциональные устройства систем электропитания наземной РЭА / В.В. Авдеев,
В.Г. Костиков, А.М. Новожилов, В. И. Чистяков; под редакцией В.Г. Костикова. -
М.: Радио и связь, 1990. - 192 с.
.
Эраносян С.А. Сетевые блоки питания с высокочастотными преобразователями. - Л.:
Энергоатомиздат. Ленинградское отделение, 1991. - 176 с.
.
Создание Web-страниц и Web-сайтов. Самоучитель: под ред. В.Н. Печникова, 2006
г.
.
Петухов В.М. Транзисторы и их зарубежные аналоги. Справочник. В 4т. 2003 г.
.
Высокочастотные транзисторные преобразователи. Э.М. Ромаш и др. 1988 г.
.
Апаров А. Б. и др. Транзисторные преобразователи для низковольтных источников
энергии. / Апаров А.Б., Еременко В.Г., Негневицкий И.Б. - М.: Энергия, 1978. -
96 с.
.
Ж. А. Мкртчян. Основы построения устройств электропитания ЭВМ. 2000 г.
.
В.Г. Бастанов. 300 практических советов. 2002 г.
.
С. Алексеев. Справочник по микросхемам ТТЛ и КМОП-2.