Определение отношения теплоемкостей газов (Сp/Сv) способом Дезорма и Клемана
Лабораторная
работа
Определение
отношения теплоемкостей газов (Сp/Сv)
способом Дезорма и Клемана.
Томск,
2007
Введение
Теплоемкостью называется количество теплоты,
которое необходимо сообщить телу для изменения его температуры на 10.
Теплоемкость отнесенная к массе вещества , называется удельной теплоемкостью, а
отношение к молю- молярной или мольной теплоемкостью.
 (1)
(1)
Газ, получая (отдавая) тепло, изменяет свой
объем и совершает работу, а так же изменяет свою внутреннюю энергию. По первому
началу термодинамики
 (2)
(2)
где 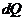 - теплота, переданная газу;
- теплота, переданная газу;  - изменение
внутренней энергии газа;
- изменение
внутренней энергии газа;  - работа,
совершенная газом.
- работа,
совершенная газом.
Элементарная работа, совершенная
газом при изменении его объема, определяется
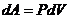 (3)
(3)
где  - давление газа;
- давление газа;  - изменение
объема.
- изменение
объема.
Теплоемкость газа найдем, используя
уравнения (1) и (2).
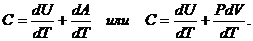 (4) и (4а) соответственно
(4) и (4а) соответственно
Так как Р зависит от V по- разному
в зависимости от процесса, то теплоемкость для различных процессов будет не
одинакова.
При изохорном процессе V=const. dV=0 (dA=0), а
поэтому теплоемкость газа, сохраняющего неизменным объем
 (5)
(5)
теплоемкость газ объем
давление
При изобарно процессе Р=const. Величину  найдем,
используя уравнение Менделеева- Клапейрона.
найдем,
используя уравнение Менделеева- Клапейрона.
 (6)
(6)
При рассмотрении многих вопросов
входит отношение теплоемкости при постоянном давлении (Ср) к
теплоемкости при постоянном объеме (Сv).
 (7)
(7)
Величина этого отношения одинакова
как для молярных , так и для удельных теплоемкостей, так как  , где
, где  - молярные
теплоемкости;
- молярные
теплоемкости;  - удельные
теплоемкости;
- удельные
теплоемкости;  = масса моля
газа.
= масса моля
газа.
Ход работы
Накачал воздух в баллоне до тех пор,
пока разность уровней жидкостей в манометре не будет равна примерно 30 см.
Закрыл кран, когда давление в кране перестало изменяться, отсчитал показание
манометра. Затем нашел разность L2 - L2 = h1τ. Закрыл
кран на 2 секунды, когда давление в баллоне успокоиться, измерил l1 и l2, нашел разность
l1-l2=h2τ. Открыл
кран для того, чтобы уровень жидкостей в коленах манометра стал равным. Закрыл
кран. Повторил измерения, описанные выше, три раза. Далее, последовательно на
4с; 6с; 8с; 10с, открыл кран, повторяя опыт по три раза для каждого опыта.
Все результаты занес в таблицу №1.
Таблица №1Таблица зависимости
времени τ
от
ln(h2τ/h1τ)ср.
|
№
|
τ, с
|
L1,см
|
L2,см
|
h1,см
|
l1,см
|
l2,см
|
h2,см
|
h2τ/h1τ
|
(h2/h1)ср
|
ln(h2τ/h1τ)
|
|
1
|
2
|
44
|
18
|
26
|
25
|
37
|
12
|
0,46
|
0,59
|
-0,53
|
|
2
|
|
43
|
19
|
24
|
24
|
39
|
15
|
0,62
|
|
|
|
3
|
|
44
|
18
|
26
|
22
|
40
|
18
|
0,63
|
|
|
|
1
|
4
|
44
|
19
|
25
|
27
|
9
|
0,36
|
0,36
|
-1,02
|
|
2
|
|
43
|
18
|
25
|
36
|
27
|
9
|
0,36
|
|
|
|
3
|
|
44
|
19
|
25
|
36
|
27
|
9
|
0,26
|
|
|
|
1
|
6
|
43
|
19
|
23
|
34
|
29
|
5
|
0,21
|
0,22
|
-1,51
|
|
2
|
|
47
|
15
|
32
|
35
|
27
|
8
|
0,25
|
|
|
|
3
|
|
46
|
16
|
30
|
34
|
28
|
6
|
0,20
|
|
|
|
1
|
8
|
44
|
19
|
25
|
34
|
29
|
5
|
0,20
|
0,20
|
-1,60
|
|
2
|
|
45
|
16
|
23
|
34
|
28
|
6
|
0,21
|
|
|
|
3
|
|
44
|
19
|
34
|
29
|
5
|
0,20
|
|
|
|
1
|
10
|
45
|
17
|
28
|
32
|
30
|
2
|
0,07
|
0,13
|
-2
|
|
2
|
|
43
|
19
|
24
|
33
|
29
|
4
|
0,17
|
|
|
|
3
|
|
44
|
20
|
24
|
33
|
29
|
4
|
0,17
|
|
|
Построил график зависимости τ
от ln(h2τ/h1τ)ср.
Через полученные точки провел прямую до пересечения с осью ординат.
График зависимости времени τ от  .
.

ln(h2τ/h1τ)cр = 0,5.
h2τ/h1τ = 1,6.
γ  = 1,5.
= 1,5.
γ1=(i+1)/i=1,2 ; i=5; γ>
γ1;
γ1/ γ=0,8
Метод наименьших квадратов:



Вывод
Мы определили отношение теплоемкости
газа способом Дезорма и Клемана. Опытным путем мы получили измерения, благодаря
которым мы построили график зависимости. Через полученные точки мы провели
прямую до пересечения с осью ординат. Точка пересечения ln(h2τ/h1τ),
соответствующую процессу, происходящему бесконечно быстро, - адиабатическому.
Потенциальную мы определили отношением h2τ/h1τ; мы подставили
это значение в расчетную формулу и получили показание адиабаты. А так же мы
сделали вывод, что газ либо двухатомный, либо одноатомный.