Оценка качества мясных продуктов по содержанию в них креатина
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное
учреждение
высшего профессионального образования
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО «КубГУ»)
Кафедра аналитической химии
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ (ДИПЛОМНАЯ) РАБОТА
Оценка
качества мясных продуктов по содержанию в них креатина
Работу
выполнила О.А. Ильясова
Факультет
химии и высоких технологий, ОФО
Специальность
«Стандартизация и сертификация» - 200503
Научный
руководитель Л. И. Пиль
канд.
хим. наук, ст. преподаватель
Нормоконтролер
О.Б. Воронова
доц.,
канд. хим. наук
Краснодар
2013г.
РЕФЕРАТ
Цель настоящей работы - разработать методику
определения креатина в мясных продуктах.
В результате исследования подобраны условия определения
креатина фотометрическим методом.
ВВЕДЕНИЕ
Креатин был выделен из скелетных
мышц
<#"668004.files/image001.gif">
Рисунок 1 - Структурная формула креатина
Креатин в организме образуется в процессе
азотистого обмена из аргинина, глицина и метионина.
Синтез креатина протекает в два этапа. В начале
в результате переноса амидной группы с аргинина на глицин образуется
гуанидинуксусная кислота (в почках и поджелудочной железе эта реакция
катализируется ферментом L-аргинин: глицин-амидинотрансферазой), а затем
происходит метилирование гуанидинуксусной кислоты в печени и поджелудочной
железе при участии S-аденозилметионина, катализируемое
гуанидинацетатметилтрансферазой. Из печени и поджелудочной железы креатин с
током крови поступает в другие органы. Около 2% всего креатина неферментативным
путем (в результате неферментативной дегидратации) превращается в креатинин и
выделяется с мочой. Креатин синтезируется в человеческом организме во время сна
в количестве примерно 2-3 г в сутки. По кровотоку креатин доставляется к
мышечным клеткам, где при помощи фермента креатинкиназы конвертируется в
креатинфосфат. Примерно около 95% креатина запасается в скелетных мышцах,
остальные - в сердце, мозге. Креатин пребывает в человеческом теле в двух
модификациях: в свободном и химически связанном в виде креатинфосфата.
Химически связанного креатина в организме
человека содержится около 65-70%, остальная треть - свободный креатин
В скелетных мышцах и ткани головного мозга в
результате обратимой реакции Ломана переноса фосфорильной группы АТФ на креатин
образуется креатинфосфат - высокоэргическое соединение, выполняющее роль донора
энергии, необходимой для осуществления мышечного сокращения, активного
транспорта ионов в нервной ткани и др (рисунок 2).
креатинфосфат + АДФ креатин + АТФ
Рисунок 2 - Реакция Ломана
Эта реакция катализируется
ферментом креатинкиназой (креатинфосфокиназой), множественные формы которой
присутствуют в различных тканях. Активность креатинкиназы в сыворотке крови
является ценным информативным диагностическим тестом при инфаркте миокарда,
миопатиях типа дистрофии Дюшенна и т.д. Отношение количества креатинина,
выделяемого человеком и сутки (в миллиграммах) к массе тела (в килограммах),
называют креатининовым коэффициентом. У мужчин он равен 20-30, у женщин 10-25.
Ценным функциональным тестом
является измерение скорости почечного клиренса креатинина из почек, поскольку
она примерно соответствует скорости клубочковой фильтрации и не требует
введения для ее определения соединения-ксенобиотика. Т.о., данные о содержании
креатинина в плазме крови и скорости его выведения с мочой используют как
показатели состояния функции почек [1].
1.2 Определение
креатина и креатинина
.2.1 Определение
креатинина в биологических жидкостях
В клинико-диагностических лабораториях для
определения креатинина в крови и моче используют различные количественные
методы. Ряд наиболее употребляемых методов основаны на цветной реакции Яффе,
которая заключается в восстановлении пикриновой кислотой креатинина в сильно
щелочной среде с образованием красно-оранжевого пикрата креатинина;
интенсивность окраски определяют колориметрически. Используемые
колориметрические методы определения креатинина различаются по способу
осаждения белков из плазмы или сыворотки крови (например, осаждения
фосфорно-вольфрамовой кислотой, пикриновой кислотой и др.). Наиболее специфичным
считают определение креатинина в крови и моче унифицированным в нашей стране
методом Поппера с применением цветной реакции Яффе, предусматривающем обработку
материала пикриновой кислотой.
По методу Поаппера: определения креатина, в
щелочной среде пикриновая кислота взаимодействует с креатинином с образованием
оранжево-красной окраски (реакция Яффе - образование таутомера пикрата
креатинина), которую измеряют фотометрически. Определение в сыворотке крови
проводят после депротеинизирования, в моче - после разведения водой.
Определение не совсем специфично, интерферируют вещества с активной метиленовой
группой и некоторые восстанавливающие вещества, например глюкоза, ацетон,
ацетоуксусная и пировиноградная кислоты.
Определение креатинина в сыворотке крови по
методу Поппера: 2 см3 сыворотки смешивают с 6 см3 насыщенного раствора
пикриновой кислоты. Через 5 минут пробирку помещают на 15-20 секунд в кипящую
водяную баню, затем центрифугируют. К 4 см3 центрифугата добавляют 0,2 см3 2,5
моль/дм3 раствора едкого натра и тщательно смешивают. Иногда после
подщелачивания раствор мутнеет вследствие выпадения фосфатов. В этом случае
раствор еще раз центрифугируют. Затем раствор доводят до объема 10 см3 водой.
Через 10 минут (не позже 20 минут) измеряют в кювете с толщиной слоя в 2
сантиметра при длине волны 500-560 нм (зеленый светофильтр) против холостой
пробы.
Холостая проба: 3 см3
насыщенного раствора пикриновой кислоты и 0,2 см3 2,5 моль/ дм3 раствора едкого
натра доводят до объема 10 см3 водой.
Расчет производят по калибровочному графику.
Содержание креатина определяют описанными выше
колориметрическими методами после его перевода в креатинин при нагревании в
присутствии соляной кислоты [2].
Реакция с пикратом - не единственная для
определения креатинина. Предложены также метод превращения креатинина в
метилгуанидин с последующим определением его в реакции Сакагучи, в которой
метилгуанидин реагирует с α-нафтолом
и хлоридом натрия в присутствии диацетила с образованием хромогена красного
цвета.
Определение свободного креатина проводят в
безбелковом растворе, используя цветную реакцию с диацетилом в присутствии α-нафтола.
Креатин - стандартный раствор, содержащий 0,5
мкмоль/мл.
Мышечную ткань осторожно срезают по сухожилиям,
избегая перерезки мышечных волокон, так как это приводит к сокращению мышечных
клеток и увеличению свободного креатина. Раствор охлаждают, выпавший в осадок
КС1О4 удаляют фильтрованием и в фильтрате определяют креатин.
Одновременно с опытными ставят пробы, содержащие
0,1-0,5 мкмоль стандартного раствора креатина. Строят калибровочный график,
определяют содержание креатина в опытных пробах и в исследуемой ткани, учитывая
произведенные разведения.
К 1 мл безбелкового раствора (полученного, как
при определении креатина) приливают 1,5 мл магнезиальной смеси, добавляют 1
каплю фенолфталеина и проводят осаждение неорганического фосфата (с.
реакции трансфосфорилирования и
образуют аналог комплекса переходного состояния (Е-Mg-АДФ-МОз~-креатин)
[<#"668004.files/image002.gif">
Рисунок 3 - Реакции, используемые для
определения креатинина с участием креатининиминогидролазы
В частично ферментативных, ранних вариантах
автоматизированных и неавтоматизированных методов, использовали эти ферменты, или
в сочетании, или раздельно. Их использовали для разрушения креатинина и
определения разницы между общим количеством Яффе-реагирующих хромогенов (до
добавления фермента) и остающихся в среде «некреатининовых» Яффе-реагирующих
хромогенов (после добавления фермента). Данные методы позволяют оценить
истинное содержание креатинина в материале.
Для определения креатинина использовали
иммобилизированный фермент креатининазу в сочетании с ион-селективным
электродом, чувствительным к ионам аммония. Поскольку методы, основанные на
данной реакции, чувствительны как к эндогенному аммиаку и креатинину, так и к
аммиаку в окружающей среде и реактивах, потребовалось введение дополнительных
реакций, позволяющих вывести из реакции ионы аммония и поддерживать стабильный
уровень кофермента НАДФН2.
Был предложен полностью ферментативный метод, в
котором креатинин гидролизуют до креатина, который определяют в креатинкиназной
реакции (рисунок 4).
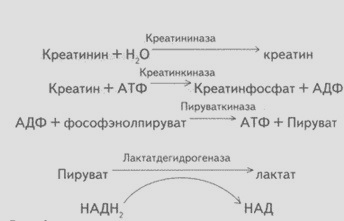
Рисунок 4 - Реакции, используемые для определения
креатинина с помощью креатинкиназы и пируваткиназы
Скорость индикаторной реакции в данной
сопряженной системе ферментов контролируется спектрофотометрически при длине
волны 340 нм или в равновесном, или кинетическом варианте. Метод используют как
для неавтоматизированного определения, так и для определения с помощью
автоанализаторов [4].
Для устранения влияния аммиака при определении
креатинина используют методы с использованием креатининамидогидролазы для
превращения креатинина в креатин. Креатин превращают в саркозин, который
окисляется саркозиноксидазой до глицина, формальдегида и перекиси водорода
(рисунок 5). Содержание перекиси водорода определяют количественно в
пероксидазной реакции, интенсивность окраски среды зависит от концентрации
креатинина в образце [5-7].

Рисунок 5 - Реакции, используемые для
определения креатинина с помощью реакции Триндера
Референтный метод для определения креатинина в
сыворотке включает массспектрометрию с изотопным разведением. В данном методе
применяют ионообенную ВЭЖХ с фотометрией при 234 нм [8].
Количественное определение креатинина может быть
проведено с помощью высокоэффективной жидкостной хроматографии [9].
Другие методы определения креатинина включают
реакцию креатинина с 3,5-динитробензойной кислотой (ДНБК) или ее производными
[10], 1,4-нафтохинон-2-сульфонатом или o-нитробензальдегидом [11].
Реакция креатинина с ДНБК была использована в
технологии «сухой» химии. В этом методе креатинин реагирует с ДНБК с
образованием окрашенного комплекса. Реакция оценивается с помощью отражательной
фотометрии при 560 нм [12] .
При использовании более специфичных
(ферментативных) методов определения креатинина в плазме результаты обычно на
10-25 ммоль/л (0,1-0,3 мг/100мл) ниже по сравнению с обычно используемыми
методами.
1.2.2 Определение
креатина и креатинина в мясе
Методом жидкостной хроматографии определяли
содержание креатина и креатинина в свином окороке. Исследовали влияние
приготовления окорока на содержание креатина и креатинина [13]
Определение креатина методом Flow-injection
в мясе животных [14].
1.3 Мясо, состав и
пищевая ценность
Мясом называют тушу и часть
туши, полученной от убоя скота и представляющую собой совокупность мышечной,
жировой, соединительной и костной (или без нее) тканей. Ткани, из которых
состоит мясо, подразделяют на мышечную, соединительную, жировую и костную.
Химический состав мышечной ткани весьма сложен и достаточно стабилен. В ней
70-75% воды, 18-22 - белков, 2-3% жиров, содержатся экстрактивные и минеральные
вещества, ферменты и витамины. Белки мышечной ткани в основном обладают высокой
биологической ценностью, за исключением белков сарколеммы (коллаген, эластин,
муцины и мукоиды), которые имеют низкую биологическую ценность. Саркоплазма
содержит более сложный комплекс белков. В ней обнаружены миоген, миоглобин,
глобулин и миоальбумин. Все белки саркоплазмы биологически ценные. Миоген
составляет 20-30% всех белков мышечной ткани; он легко экстрагируется водой и
на поверхности бульона после свертывания образует пену. Миоглобин и его
соединения обусловливают окраску мышечной ткани. Интенсивно работавшие мышцы
содержат больше миоглобина и имеют более темную окраску по сравнению с мало
работавшими мышцами. В мышцах молодых животных значительно меньше миоглобина,
чем у взрослых, и в связи с этим они имеют бледно-розовую окраску. Малым
содержанием миоглобина объясняется и бледная окраска свинины.
При скоплении миоглобина
мышечная ткань приобретает буро-коричневую окраску. В состав миофибриллярных
белков входят миозин, актин, актоми-озин, тропомиозинтитин, десмолин, тропонины
и ряд других белков. Миозин - наиболее важный белок. В общем количестве белков
мышечной ткани он составляет 35%. При определенных условиях он соединяется с
белком актином.
Актомиозиновый комплекс
содержит все незаменимые аминокислоты. Химический состав экстрактивных веществ
мышечной ткани непостоянен и зависит от глубины послеубойных изменений в мясе.
Отдельные экстрактивные вещества или продукты их превращений существенно влияют
на многие свойства мяса. Они оказывают влияние на его консистенцию,
влагоудерживающую способность белков и отчасти определяют вкус и аромат мяса. К
азотсодержащим экстрактивным веществам относят креатин, креатинин, креатин
фосфат, карнозин, аденозинтрифосфорную кислоту и продукты ее распада, свободные
аминокислоты, глюта.тион, пуриновые и пиримидиновые основания. Многие из
перечисленных низкомолекулярных соединений участвуют в образовании вкуса и
аромата мясных продуктов. По содержанию креатина судят о крепости бульона.
Глютатион активизирует мышечные ферменты, улучшающие консистенцию мяса. К
экстрактивным веществам, не содержащим азота, относят гликоген, декстрины,
мальтозу, глюкозу, молочную и пировиноградную кислоты. Количество и соотношение
этих веществ зависят от состояния животного и продолжительности хранения мяса.
Гликоген, называемый животным крахмалом, играет роль энергетического вещества.
В мышечной ткани гликоген содержится в свободном и в связанном с белками
состоянии. Содержание гликогена в мышцах достигает 0,8%, но значительно больше
его в печени. В мышцах откормленных и упитанных животных гликогена несколько
больше, чем у истощенных, утомленных и больных.
После убоя животного гликоген
распадается с образованием в основном молочной кислоты, от содержания которой
зависят многие процессы, косвенно оказывающие влияние на консистенцию и вкус
мяса.
Кроме того, кислая среда,
обусловленная накоплением молочной и фосфорной кислот, препятствует развитию
гнилостной микрофлоры. Соединительная ткань. Эта ткань составляет в среднем 16%
массы туши и выполняет в организме в основном механическую функцию, связывая
отдельные ткани между собой и со скелетом. Разновидности ткани: ретикулярная,
рыхлая и плотная, эластическая и хрящевая. Из соединительной ткани построены
сухожилия, суставные связки, надкостница, оболочки мышц, хрящи дыхательных
путей, ушные раковины, межпозвоночные связки и кровеносные сосуды. В отличие от
мышечной в соединительной ткани сильно развито межклеточное вещество, которое
создает многообразие видов этой ткани. Основным структурным образованием
соединительной ткани являются коллагеновые и эластиновые волокна, в зависимости
от соотношения которых меняются и ее свойства. Коллагеновые волокна обладают
значительной прочностью; отдельные волокна собраны в пучки, покрытые тонкой
оболочкой, и связаны аморфным веществом. Эластиновые волокна содержатся в
соединительной ткани в меньшем количестве, чем коллагеновые. Исключение
составляет эластическая соединительная ткань, входящая в состав
затылочно-шейной связки и крупных кровеносных сосудов. Эластические волокна
этой ткани имеют однородную структуру и меньшую прочность, чем коллагеновые.
Коллагеновые и упругие эластические волокна значительно превосходят по
прочности волокна мышечной ткани и обусловливают жесткость мяса. С возрастом
животного заметно уменьшается растворимость фракций коллагена в связи с
образованием дополнительных межмолекулярных поперечных связей. Эти возрастные
изменения приводят к увеличению жесткости мяса. В соединительной ткани меньше
воды, чем в мышечной, но преобладают белки. Основными белками этой ткани
являются коллаген, эластин, ретикулин, муцины, мукоиды. Коллаген входит в
состав всех видов соединительной ткани, но особенно много его в сухожилиях (до
35%). Он не растворяется в холодной воде, но набухает. При нагревании коллагена
с водой образуется глютин в виде вязкого раствора, который при охлаждении
переходит в студень-гель. Эластин исключительно устойчив к действию горячей
воды и не образует при нагреваний глютина. Жировая ткань. В теле животного эта
ткань откладывается преимущественно в подкожной клетчатке, брюшной полости,
около кишечника, почек и умеренно -в соединительной ткани между мышцами. У
отдельных пород овец жир накапливается в хвосте или по обе стороны хвоста в
виде подушек. В теле упитанного животного мясных пород жир откладывается между
мышцами и мышечными пучками, образуя прослойки, а у беспородных и старых
животных - в брюшной части и подкожной клетчатке и отсутствует между мышцами.
Кроме того, жир содержится в саркоплазме мышечных волокон, в ретикулярной ткани
костного мозга. В зависимости от расположения в теле животного жировая ткань
имеет соответствующие названия. Подкожную жировую ткань называют подкожным
жиром (у свиней - шпиком); жировую ткань желудка - сальником; кишечника -
кишечным жиром; жир хвоста - курдючным; жир костной ткани - костным. В живой
ткани имеются от 73 до 97% жира, вода, белки и в небольших количествах
жироподобные вещества, витамины и ферменты, пигменты и минеральные вещества.
Состав жира у разных видов убойных животных неодинаков и даже у одного
животного жир в разных частях тела различается. На химический состав жира
влияют вид, порода, пол, упитанность и возраст животного, характер его откорма.
В зависимости от вида животного температура плавления жира различна. Так,
температура плавления бараньего жира 44-56 °С , говяжьего - 42-49, свиного
-29-35 °С. Усвояемость жиров тесно связана с их температурой плавления. Жиры с
температурой плавления ниже 37 °С плавятся в организме человека, легче эмульгируются
и хорошо усваиваются. К красящим веществам говяжьего жира относятся каротины и
ксантофилы. Жиры различных животных и разного происхождения отличаются по
органолептическим показателям и коэффициенту преломления: Костная ткань.
Эта ткань построена из костных
клеток и межклеточного вещества. Клетки костной ткани имеют овальную форму и
массу отростков. Полости, в которых расположены клетки, соединяются костными
канальцами, сливающимися в более крупные каналы. Волокнистая часть костной
ткани состоит в основном из коллагеновых волокон. Снаружи кости покрыты
соединительнотканным образованием - надкостницей. По форме кости подразделяют
на трубчатые, дугообразные, короткие и плоские. Внутри трубчатых костей
расположен костный мозг, обильно пронизанный кровеносными сосудами. Жировые
клетки придают костному мозгу желтоватый оттенок. Содержание костей в мясе
зависит от вида животных, упитанности, пола и колеблется в значительных
пределах. В составе костей в отличие от других тканей мяса преобладают
неорганические вещества. По мере старения животного в костях увеличивается
содержание неорганических веществ и жира. В костной ткани содержатся жиры (в
тазовых костях - до 24%, в трубчатых и позвонках - 12-22, в ребрах - до 11%),
коллаген, муцины, мукоиды, экстрактивные вещества. Из минеральных веществ в
состав костей входят в основном кальциевые соли фосфорной и угольной кислот.
Кости убойных животных используют для приготовления бульона, производства
костного жира, желатина, костной муки и клея. Кровь. Ее относят к питательной
соединительной ткани. Содержание крови в теле убойных животных от 5 до 8% живой
массы. При убое животных извлекается около 50% содержащейся в и теле крови.
Кровь состоит из плазмы и взвешенных в ней эритроцитов, лейкоцитов и
тромбоцитов. В состав крови входят белки (до 18,5%), вода (до 85%), небелковые
органические вещества, минеральные соединения, ферменты, гормоны, витамины. Из
небелковых веществ содержатся полипептиды, аминокислоты, креатин, жирные
кислоты, глюкоза и полисахариды. Основные белки крови - альбумин, глобулин,
фибриноген (биологически ценные) и гемоглобин. Кровь убойных животных широко
используют как ценное сырье для производства пищевой, лечебной и технической
продукции.
Из стабилизированной крови
сепарированием получают жидкую массу соломенного цвета, называемую плазмой.
Кровяная плазма содержит ценные белки и физиологически активные вещества. Из
плазмы вырабатывают светлый пищевой альбумин, используемый в качестве добавок в
отдельные мясные продукты. Холестерин - жироподобное вещество в мясе, довольно
устойчив при тепловой обработке. В мясе содержится от 0,06 до 0,1 %
холестерина. Углеводы <#"668004.files/image005.gif">
Рисунок 6 - реакция Яффе
В основе лежит взаимодействие креатинина,
производного креатина, с пикрат-ионом, образуется пикрат креатинина, окрашенный
в оранжево-красный цвет.
2.3.1 Определение длины
волны
Для определения поглощения электромагнитного
излучения пикриновой кислотой измеряют значения оптических плотностей в
интервале длин волн [505; 515] нм относительно воды [18]. Результаты
представлены в таблице 1.
Таблица 1 - Фрагмент спектра пикриновой кислоты
|
λ, нм
|
А
|
|
505
|
0,038
|
|
508
|
0,010
|
|
508,5
|
0,008
|
|
509
|
0,005
|
|
509,5
|
0,001
|
|
510
|
0,000
|
|
512
|
0,001
|
|
515
|
0,001
|
В интервале длин волн [509,5; 515] нм пикриновая
кислота не поглощает электромагнитное излучение.
Абсорбционность растворов пикриновой кислоты и
пикрат-иона при одинаковой молярной концентрации идентична вследствие наличия
одинаковых хромофорных групп в структуре. Поэтому в качестве раствора сравнения
для определения оптической плотности креатинин-пикратного комплекса можно
использовать дистиллированную воду.
Для определения длины волны, при которой
происходит максимальное поглощение креатинин-пикратным комлексом, измеряют
оптические плотности комплекса с концентрацией креатинина 0,014ммоль/дм3 в
интервале [509,5; 514] нм относительно воды (таблица 2).
Таблица 2 - Зависимость абсорбционности
креатинин-пикратного комплекса от длины волны
|
λ, нм
|
А
|
|
509,5
|
0,469
|
|
510
|
0,468
|
|
511
|
0,450
|
|
512
|
0,434
|
|
513
|
0,418
|
|
514
|
0,402
|
Максимальная оптическая плотность
креатинин-пикратного комплекса наблюдается при длинах волн 509,5; 510 нм. При
меньших значениях длин волн поглощает и пикриновая кислота. Происходит
аддитивное сложение оптических плотностей двух компонентов.
.3.2 Зависимость
абсорбционности креатинин-пикратного комплекса от времени
.3.2.1 Определение
времени образования креатинин-пикратного комплекса в концентрированном растворе
Для определения времени максимального развития
окраски креатинин-пикратного комплекса получали зависимость оптической
плотности от времени.
В мерные колбы вместимостью 25,00 см3 помещают
0,50 см3 и
,20 см3 рабочего раствора креатинина с
концентрацией 7,072×10-4 моль/дм3.
Приливают 1,50 см3 раствора пикриновой кислоты с концентрацией 0,05 моль/дм3,
0,12 см3 гидроксида натрия с концентрацией 2,455 моль/дм3. Выдерживают от 0,5
до 25 минут при комнатной температуре. Доводят до метки дистиллированной водой.
Измеряют оптическую плотность продукта
взаимодействия креатинина с пикриновой кислотой на фотоэлектроколориметре КФК-3
при длине волны λ=510 нм (таблица
). В качестве раствора сравнения используют дистиллированную воду.
Таблица 3 - Зависимость оптической плотности от
времени образования креатинин-пикратного комплекса
|
Ʈ, мин
|
А
|
|
С(креатинина)=0,0056
ммоль/дм3
|
С(креатинина)=0,0141
ммоль/дм3
|
|
0,5
|
0,032
|
0,120
|
|
1
|
0,077
|
0,133
|
|
2
|
0,111
|
0,220
|
|
4
|
0,159
|
0,333
|
|
6
|
0,179
|
0,396
|
|
8
|
0,194
|
0,432
|
|
9
|
0,199
|
0,453
|
|
9,5
|
0,200
|
0,464
|
|
10
|
0,199
|
0,468
|
|
10,5
|
0,198
|
0,474
|
|
11
|
0,199
|
0,480
|
|
11,5
|
0,200
|
0,476
|
|
12
|
0,197
|
0,475
|
|
12,5
|
0,195
|
0,480
|
|
13
|
0,195
|
0,481
|
|
14
|
0,194
|
0,482
|
|
16
|
0,195
|
0,470
|
|
18
|
0,195
|
0,483
|
|
20
|
0,194
|
0,484
|
|
22
|
0,194
|
0,475
|
|
25
|
0,194
|
0,473
|
Получают кривые зависимости оптической плотности
от времени образования креатинин-пикратного комплекса (рисунок 7).
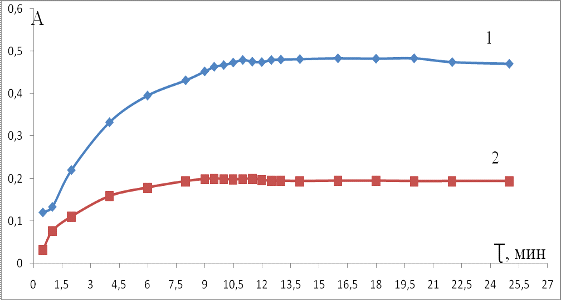
Рисунок 7 - Зависимость оптической плотности от
времени образования креатинин-пикратного комплекса в концентрированном
растворе; 1 - концентрация креатинина 0,0141 ммоль/дм3; 2 - концентрация
креатина 0,0056 ммоль/дм3
Минимальное время развития окраски 11 минут. В
течение следующих 10 минут аналитический сигнал не изменяется.
2.3.2.2 Зависимость
аналитического сигнала раствора креатинин-пикратного комплекса после
разбавления
Для определения зависимости аналитического сигнала
раствора креатинин-пикратного комплекса после разбавления получают
креатинин-пикратный комплекс в концентрированном растворе, доводят объем в
мерной колбе 25,00 см3 до метки дистиллированной водой, выдерживают
определенное время, измеряют аналитический сигнал. Концентрация креатинина
0,014 ммоль/дм3 (таблица 3).
Таблица 3 - Зависимость абсорбционности
креатинин-пикратного комплекса в разбавленном растворе от времени
|
Ʈ, мин
|
А
|
|
1
|
0,484
|
|
2
|
0,484
|
|
3
|
0,484
|
|
4
|
0,484
|
|
5
|
0,483
|
|
6
|
0,481
|
|
7
|
0,479
|
|
8
|
0,477
|
|
9
|
0,476
|
Измерять аналитический сигнал в разбавленном
растворе необходимо в течение 5 минут с момента разбавления, так как комплекс
разрушается, аналитический сигнал уменьшается (рисунок 8).
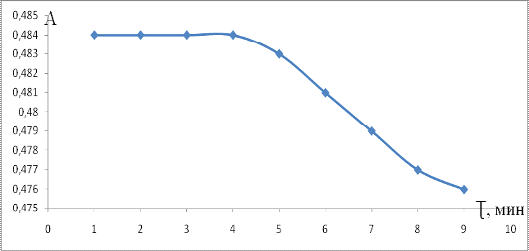
Рисунок 8 - Зависимость абсорбционности
разбавленного раствора креатинин-пикратного комплекса от времени
.3.3 Определение
концентрации щелочи
Для определения оптимальной концентрации
гидроксида натрия
для образования креатинин-пикратного комплекса
исследуют зависимость оптической плотности от концентрации щелочи. Концентрация
креатинина 0,014ммоль/дм3, объем гидроксида натрия с концентрацией 2,455
моль/дм3 прибавляют в интервале [0,05; 0,20] см3 (таблица 4).
Таблица 4 - Зависимость абсорбционнности
креатинин-пикратного комплекса от концентрации щелочи
|
C(NaOH), моль/л
|
А
|
|
0,060
|
0,460
|
|
0,071
|
0,466
|
|
0,083
|
0,473
|
|
0,094
|
0,477
|
|
0,106
|
0,481
|
|
0,117
|
0,485
|
|
0,130
|
0,489
|
|
0,140
|
0,493
|
|
0,150
|
0,493
|
|
0,161
|
0,494
|
|
0,171
|
0,493
|
|
0,182
|
0,492
|
|
0,192
|
0,493
|
|
0,203
|
0,492
|
|
0,213
|
0,492
|
|
0,224
|
0,491
|
Получают кривую зависимости оптической плотности
креатинин-пикратного комплекса от концентрации щелочи (рисунок 9).

Рисунок 9 - Зависимость оптической плотности
креатинин-пикратного комплекса от концентрации гидроксида натрия
Оптимальный объем щелочи находится в интервале
[0,12; 0,20] см3, это соответствует значениям рН [12,0; 12,5].
2.3.4 Определение
концентрации пикриновой кислоты
Для определения оптимальной концентрации
пикриновой кислоты исследуют зависимость оптической плотности
креатинин-пикратного комплекса от концентрации пикриновой кислоты. Концентрация
креатинина 0,014ммоль/дм3(таблица 5).
Таблица 5 - Зависимость абсорбционности
креатинин-пикратного комплекса от концентрации пикриновой кислоты
|
С(пикриновой
к-ты)×102 моль/л
|
А
|
|
0,235
|
0,210
|
|
0,707
|
0,363
|
|
1,179
|
0,412
|
|
1,650
|
0,434
|
|
2,120
|
0,454
|
|
2,360
|
0,466
|
|
2,600
|
0,478
|
|
2,830
|
0,480
|
|
3,066
|
0,484
|
|
3,301
|
0,487
|
|
3,530
|
0,490
|
Получают кривую зависимости оптической плотности
от концентрации пикриновой кислоты (рисунок 10).
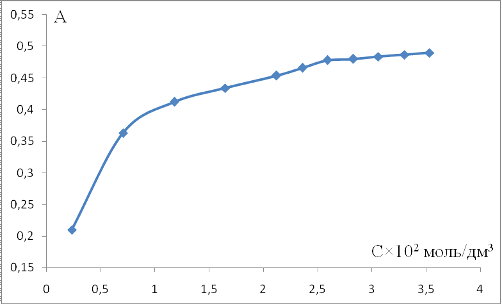
Рисунок 10 - Зависимость абсорбционности
креатинин пикратного комплекса от концентрации пикриновой кислоты
Оптимальная концентрация пикриновой кислоты
принадлежит интервалу [2,59; 3,53]×10-2
моль/дм3.
Результаты определения оптимальных условий
реакции представлены в таблице 6.
Таблица 6 - Оптимальные условия проведения
реакции образования креатинин-пикратного компекса
|
λ, нм
|
510
|
|
Ʈ, мин
|
11
|
|
Концентрация
пикриновой кислоты, моль/дм3
|
3,30×10-2
|
|
Концентрация
гидроксида натрия, моль/дм3
|
0,15
|
2.4 Построение
градуировочной зависимости креатинина
В мерные колбы вместимостью 25,00 см3 помещают
0,10; 0,20; 0,30; 0,40; 0,50 см3 рабочего раствора креатинина с концентрацией 7,072×10-5
моль/дм3 и 0,10; 0,15; 0,20; 0,25; 0,30; 0,35; 0,40; 0,45; 0,50 см3 рабочего
раствора креатинина с концентрацией 7,072×10-4
моль/дм3.
Приливают по 1,50 см3 раствора пикриновой
кислоты с концентрацией 0,05 моль/дм3, 0,12 см3 гидроксида натрия с
концентрацией 2,455 моль/дм3. Выдерживают 11 минут при комнатной температуре.
Доводят до метки дистиллированной водой.
Измеряют оптическую плотность продуктов
взаимодействия креатинина с пикриновой кислотой на фотоэлектроколориметре КФК-3
при длине волны λ=510 нм. В
качестве растворов сравнения используют дистиллированную воду. Получают
зависимость А=f (С), где С -
концентрация креатинина (таблица 7).
Таблица 7 - Зависимость оптической плотности от
концентрации креатинина
|
С(креатинина)×10-5 моль/дм3
|
А
|
|
0,02829
|
0,017
|
|
0,05657
|
0,026
|
|
0,08486
|
0,036
|
|
0,14144
|
0,047
|
|
0,2829
|
0,096
|
|
0,4243
|
0,145
|
|
0,5657
|
0,203
|
|
0,7072
|
0,242
|
|
0,8486
|
0,295
|
|
0,9900
|
0,346
|
|
1,1315
|
0,402
|
|
1,2729
|
0,446
|
|
1,4144
|
0,490
|
По полученным данным строят градуировочный
график зависимости
А=f
(C)
где С - концентрация креатинина (рисунок 11).
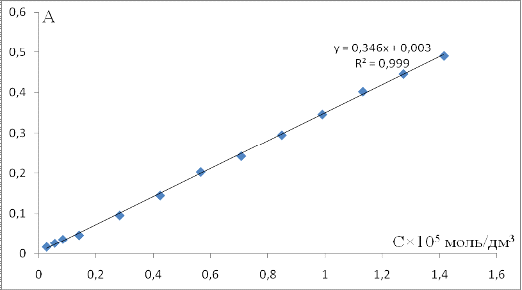
Рисунок 11 - Градуировочная зависимость
оптической плотности от концентрации креатинина
2.5 Определение
зависимости выхода продукта реакции креатинина от времени нагревания креатина
Превращение креатина проводят при нагревании в
кислой среде. В результате нагревания креатина отщепляется молекула воды,
происходит замыкание цикла, образуется креатинин [19]. На рисунке 12 реакция
образования креатинина.

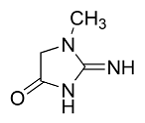
Рисунок 12 - Реакция нагревания креатина
Содержание креатина определяют по креатинину
косвенным методом.
В мерные колбы вместимостью 25,0 см3 переносят
0,50 см3 рабочего раствора креатина с концентрацией 7,072×10-4
моль/дм3. Приливают 1,50 см3 раствора пикриновой кислоты с концентрацией
0,05моль/дм3. Помещают на водяную баню, температура воды (96±2)º
С на определенное время Ʈ [20].
Далее пробы охлаждают в ледяной воде, приливают
0,12 см3 раствора гидроксида натрия с концентрацией 2,455 моль/дм3, выдерживают
11 минут при комнатной температуре. Доводят до метки дистиллированной водой.
Измеряют оптическую плотность при λ=
510 нм. В качестве раствора сравнения используют дистиллированную воду.
Выход продукта реакции рассчитывают по формуле
[21]:
ƞ = 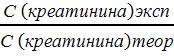
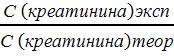
где С(креатинана)эксп - концентрация
креатинина в растворе после нагревания на водяной бане;
С(креатинана )теор - концентрация
креатинина по уравнению реакции при 100 % выходе продукта, равна начальной
концентрация креатина в растворе (таблица 8).
Таблица 8 - Зависимость оптической
плотности креатинин-пикратного комплекса от времени нагревания стандартного
раствора креатина
А
|
ƞ, %
|
|
30
|
0,186
|
37,17
|
|
60
|
0,306
|
62,22
|
|
90
|
0,365
|
73,53
|
|
120
|
0,396
|
80,40
|
|
130
|
0,398
|
82,64
|
|
140
|
0,410
|
83,95
|
|
150
|
0,411
|
85,03
|
|
210
|
0,420
|
88,84
|
|
240
|
0,446
|
89,69
|
|
300
|
0,444
|
89,69
|
На рисунке 13 представлена зависимость выхода
продукта (ƞ) реакции креатинина от времени
(Ʈ)
нагревания стандартного раствора креатина
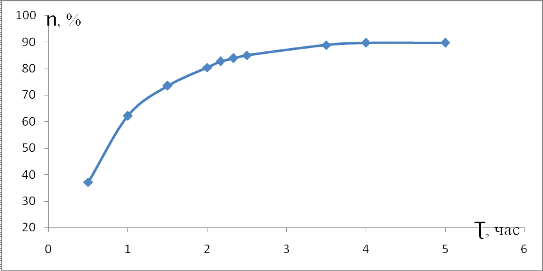
Рисунок 13 - Зависимость выхода продукта реакции
креатинина ƞ от времени нагревания
стандартного раствора креатина
При нагревании креатина на кипящей водяной бане
в течение 5 часов выход продукта реакции креатинина - 89,7%.Оптимальным
временем нагревания креатина для получения креатинина выбрано 2,5 часа. Выход
при этом составляет около 83% для концентрации креатина 0,014ммоль/дм3.
2.6 Зависимость выхода
продукта реакции креатинина от концентрации креатина
В мерные колбы вместимостью 25,00 см3 помещают
0,10; 0,20; 0,30; 0,40; 0,50; 0,60; 0,70; 0,80; 0,90; 1,00; 1,50 см3 рабочего
раствора креатина с концентрацией 7, 072×10-4моль/дм3.
Приливают 1,50 см3 раствора пикриновой кислоты с концентрацией 0,05моль/дм3.
Помещают на водяную баню, температура воды (96±2)º
С на 2,5 часа.
Затем пробы охлаждают в ледяной воде, приливают
0,12 см3 раствора гидроксида натрия с концентрацией 2,455 моль/дм3, выдерживают
11 минут при комнатной температуре. Доводят до метки в мерной колбе 25,0 см3
дистиллированной водой. Измеряют оптическую плотность при λ=
510 нм. В качестве раствора сравнения используют дистиллированную воду.
Результаты рассчитывают по формуле (1) и заносят в таблицу 9 .
На рисунке 14 представлена зависимость выхода
продукта реакции креатинина от концетрации креатина в растворе.
Таблица 9 - Зависимость выхода продукта реакции
креатинина от концентрации креатина в растворе
|
С(креатина)×105, моль/дм3
|
А
|
ƞ, %
|
|
0,2829
|
0,089
|
93,7
|
|
0,4243
|
0,136
|
92,4
|
|
0,5657
|
0,180
|
90,7
|
|
0,7072
|
0,215
|
89,2
|
|
0,8486
|
0,247
|
87,4
|
|
0,99
|
0,280
|
86,2
|
|
1,1315
|
0,325
|
85,4
|
|
1,2729
|
0,372
|
84,3
|
|
1,4144
|
0,406
|
83,6
|
|
1,69
|
0,531
|
82,2
|
|
1,98
|
0,565
|
81,2
|
|
2,26
|
0,628
|
80,2
|
|
2,54
|
0,734
|
79,4
|
|
2,828
|
0,780
|
78,3
|
|
4,243
|
1,131
|
72,8
|
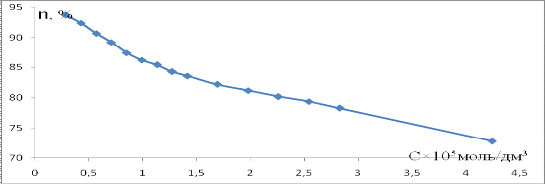
Рисунок 14 - Зависимость выхода продукта реакции
креатинина от концентрации креатина в растворе
С увеличением концентрации креатина выход
продукта реакции уменьшается.
2.7 Определение
градуировочной зависимости креатина
В мерные колбы вместимостью 25,0 см3 помещают
0,10; 0,20; 0,30; 0,40; 0,50; 0,60; 0,70; 0,80; 0,90; 1,00; 1,50 см3 рабочего
раствора креатина с концентрацией 7, 072×10-4моль/дм3.
Приливают 1,50 см3 раствора пикриновой кислоты с
концентрацией 0,05моль/дм3. Помещают на водяную баню на 2,5 часа, температура
воды (96±2)º
С.
Далее пробы охлаждают в ледяной воде, приливают
0,12 см3 раствора гидроксида натрия с концентрацией 2,455 моль/дм3, выдерживают
11 минут при комнатной температуре.
Раствор доводят до метки дистиллированной водой.
Измеряют оптическую плотность при λ=
510 нм.
В качестве раствора сравнения используют
дистиллированную воду (таблица 10).
Таблица 10 - Зависимость абсорбционности от
концентрации креатина
|
С(креатина)×105, моль/дм3
|
А
|
|
0,2829
|
0,089
|
|
0,4243
|
0,136
|
|
0,5657
|
0,180
|
|
0,7072
|
0,215
|
|
0,8486
|
0,247
|
|
0,9900
|
0,280
|
|
1,1315
|
0,325
|
|
1,2729
|
0,372
|
|
1,4144
|
0,406
|
|
1,6900
|
0,531
|
|
1,9800
|
0,565
|
|
2,2600
|
0,628
|
|
2,5400
|
0,734
|
|
2,8280
|
0,780
|
|
4,2430
|
1,131
|
По полученным данным строят градуировочный
график зависимости
А=f
(C)
где С - концентрация креатина (рисунок 15).

Рисунок 15 - Градуировочная зависимость
оптической плотности от концентрации креатина
2.8 Выбор
депротеинизирующего агента
При выборе депротеинизирующего агента
использовуют такие экстрагенты, как насыщенный раствор пикриновой кислоты,
раствор хлороводородной кислоты с концентрацией 0,1моль/дм3 и дистиллированная
вода. При использовании насыщенного раствора пикриновой кислоты происходит
сильная коогуляция белков и более полное извлечение креатина.
Насыщенный раствор пикриновой кислоты выбран для
осаждения белков в пробах мяса [22].
2.9 Увеличение
селективности реакции образования креатинин-пикратного комплекса
Для улучшения селективности реакцию образования
креатинин-пикратного комплекса проводят сначала в щелочной среде, где
образуется пикрат креатинина, окрашенный в оранжевый цвет, затем создают кислую
среду, происходит разрушение креатинин-пикратного комплекса, при этом комплексы
пикриновой кислоты с другими веществами окраску сохраняют. Содержание
креатинина определяют по разности аналитических сигналов раствора пробы в
кислой и щелочной среде [23].
При добавлении 0,65 см3 хлороводородной кислоты
с концентрацией 0,40моль/дм3 к концентрированному раствору креатинин-пикратного
комплекса, концентрация креатинина в котором 0,014 моль/дм3, комплекс
разрушается в течение 15 минут, оптическая плотность понижается до нуля.
2.10 Проверка
правильности разрабатываемой методики
Проверку правильности разрабатываемой методики
проводят методом «введено-найдено».
2.10.1 Подготовка пробы
к анализу
Образец сырого мяса (говядина, тазобедренная
часть), не содержащего жира и соединительных тканей, взвешивают на
аналитических весах (2,00000 ± 2,5×10-5
) г. Стандартную добавку креатина вводят в образец мяса путем вкалывания
хроматографическим шприцем. Добавку вводят в разные части пробы для
равномерного распределения стандартного раствора. Образец оставляют в
холодильной камере на 5 часов.
Пробу мяса с добавкой гомогенизируют блендером в
чашке до получения пастообразной массы и переносят количественно в коническую
колбу вместимостью 100,0 см3. Чашку блендера промывают от остатков пробы 20,00
см3 насыщенного раствора пикриновой кислоты, кислоту с остатками мяса переносят
в коническую колбу, и объединяют с пробой мяса. Колбу с пробой мяса помещают на
шейкер для встряхивания в течение 1 часа. Далее содержимое колбы фильтруют
через обеззоленный фильтр «Синяя лента» в мерную колбу вместимостью 100, 0 см3.
Фильтр промывают насыщенным раствором пикриновой кислоты и доводят до метки
пикриновой кислотой. Полученный фильтрат объемом 100,0 см3 тщательно
перемешивают.
2.10.2 Определение
содержания креатинина в пробе
Аликвоту фильтрата 1,50 см3
переносят в мерную колбу вместимостью 25,0 см3, приливают 1,50 см3 насыщенного
раствора пикриновой кислоты и 0,12 см3 раствора гидроксида натрия с
концентрацией 2,455 моль/дм3 . Через 11 минут раствор доводят до метки
дистиллированной водой, перемешивают и измеряют аналитический сигнал на КФК-3
при 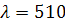
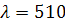 нм. В качестве раствора сравнения
используют дистиллированную воду. Полученный аналитический сигнал А 1 -
аддитивное сложение сигнала поглощения креатинин -пикратным комплексом и
сигнала поглощения комплексов пикриновой кислоты с другими веществами.
нм. В качестве раствора сравнения
используют дистиллированную воду. Полученный аналитический сигнал А 1 -
аддитивное сложение сигнала поглощения креатинин -пикратным комплексом и
сигнала поглощения комплексов пикриновой кислоты с другими веществами.
Для улучшения селективности реакции
в концентрированный раствор креатинин-пикратного комплекса приливают 0,65 см3
хлороводородной кислоты с концентрацией 0,40 моль/дм3. Через 15 минут раствор
доводят до метки дистиллированной водой, перемешивают и измеряют аналитический
сигнал. Раствором сравнения служит холостая проба: в колбу вместимостью 25,00
см3 приливают 1,50 см3 насыщенного раствора пикриновой кислоты, 0,12 см3
раствора гидроксида натрия с концентрацией 2,455 моль/дм3 и
,65 см3 хлороводородной кислоты с
концентрацией 0,40 моль/дм3, доводят до метки дистиллированной водой.
Полученный аналитический сигнал А2 -
поглощение комплексов пикриновой кислоты с другими веществами. Аналитический
сигнал креатинин-пикратного комплекса находят по разности аналитических
сигналов раствора пробы в щелочной и в кислой среде по формуле (2).
А = А1 - А2
Где А - оптическая плотность
креатинин-пикратного коплекса;
А1 - оптическая плотность,
измеренная в щелочной среде;
А2 - оптическая плотность,
измеренная в кислой среде
Для определения концентрации (С1)
креатинина в фотометрируемом растворе используют градуировочный график (п.
2.4).
Содержание креатинина в мясе
вычисляют по формуле.
С=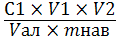
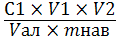
Где С1 - концентрация креатинина в
фотометрируемом растворе, г/дм3;
V1 - объем
фотометрируемой колбы, 0,025 дм3;
V2 - объем
колбы с фильтратом, 0,100 дм3;
Vал - объем
аликвоты для определения содержания креатинина;
mнав - масса пробы
мяса, 2×10-3
кг.
По результатам анализа получают содержание
креатинина в говядине (0,085±0,004) г/кг.
2.10.3 Определение
содержания креатина в говядине
Аликвоту фильтрата 0,40 см3
переносят в мерную колбу вместимостью 25,0 см3, приливают 1,50 см3 насыщенного
раствора пикриновой кислоты. Раствор помещают на водяную баню на 2,5 часа.
После этого колбу с раствором охлаждают в ледяной воде. В колбу с раствором
приливают 0,12 см3 раствора гидроксида натрия с концентрацией 2,455 моль/дм3. Через
11 минут раствор доводят до метки дистиллированной водой, перемешивают и
измеряют аналитический сигнал на КФК-3 при 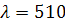
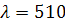 нм. В качестве раствора сравнения
дистиллированная вода. Полученный аналитический сигнал А1 - аддитивное сложение
сигнала поглощения креатинин -пикратным комплексом и сигнала поглощения
комплексов пикриновой кислоты с другими веществами.
нм. В качестве раствора сравнения
дистиллированная вода. Полученный аналитический сигнал А1 - аддитивное сложение
сигнала поглощения креатинин -пикратным комплексом и сигнала поглощения
комплексов пикриновой кислоты с другими веществами.
Для улучшения селективности реакции
в концентрированный раствор креатинин-пикратного комплекса приливают 0,65 см3
хлороводородной кислоты с концентрацией 0,40моль/дм3. Через 15 минут раствор
доводят до метки дистиллированной водой, перемешивают и измеряют аналитический
сигнал. Раствором сравнения служит холостая проба: в колбу вместимостью 25,0
см3 приливают 1,50 см3 насыщенного раствора пикриновой кислоты и 0,12 см3
раствора гидроксида натрия с концентрацией 2,455 моль/дм3 и
,65 см3 хлороводородной кислоты с
концентрацией 0,40 моль/дм3, доводят до метки дистиллированной водой.
Полученный аналитический сигнал А2 -
поглощение комплексов пикриновой кислоты с другими веществами. Оптическую
плотность креатинин-пикратного комплекса определяют по разности аналитических
сигналов раствора пробы в щелочной и в кислой среде по формуле (2).
Содержание креатинина в растворе
после нагревания на водяной бане включает в себя количество креатинина, которое
было в пробе изначально и количество креатинина, которое перешло из креатина в
процессе нагревания. Таким образом, для определения содержания креатина в пробе
из общего содержания креатинина вычитают содержание креатинина, которое было в
пробе первоначально.
Определение содержания креатина С1
проводят по градуировочному графику (п. 2.7).
Содержание креатина в мясе вычисляют
по формуле.
С=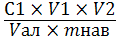
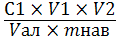
Где С1 - концентрация креатина,
г/дм3;
V1 - объем
фотометрируемой колбы, 0,025 дм3;
V2 - объем
колбы с фильтратом, 0,100 дм3;
Vал - объем
аликвоты для определения содержания креатина;
mнав - масса пробы
мяса, 2×10-3
кг.
Аналогично определяют содержание креатина и
креатинина в пробе мяса без введения добавки. Все пробы мяса одной и той же
массы и из одного куска. Результаты анализа представлены в таблице 10.
Таблица 11
Результаты проверки правильности разрабатываемой
методики
|
Проба
|
Концентрация
креатина г/кг
|
Погрешность,
%
|
|
|
введено
|
найдено
|
4,0
|
|
Говядина
|
_
|
4,96±0,06
|
|
|
4,60
|
9,38±0,15
|
|
|
|
|
|
|
|
Относительная погрешность составила 4,0 %.
2.11 Определение
содержания креатина и креатинина в образцах сырого мяса
На аналитических весах взвешивают 2,00000 г
сырого измельченного мяса: говядины (тазобедренная часть), свинины
(тазобедренная часть), баранины (тазобедренная часть), козлятины (голень),
крольчатины (тазобедренная часть), курятины (окорок), курятины (филе грудной
части), индейки (голень). Определяют креатин и креатинин (п. 2.11). В таблице
представлены результаты определения креатина и креатинина.
Таблица 12 - Результаты определения креатина и
креатинина в пробах сырого мяса
|
Проба
(сырое мясо)
|
Концентрация
креатинина, г/кг
|
Концентрация
креатина, г/кг
|
|
Говядина
(тазобедреннаячасть)
|
0,085±0,004
|
4,96±0,06
|
|
Свинина
(тазобедренная часть)
|
0,099±0,002
|
4,49±0,08
|
|
Баранина
тазобедренная часть)
|
0,060±0,002
|
3,40±0,16
|
|
Козлятина
(голень)
|
0,067±0,002
|
3,24±0,12
|
|
Крольчатина
(тазобедренная часть)
|
0,079±0,002
|
6,00
±0,05
|
|
Курятина
(окорок)
|
0,035±0,002
|
3,66±0,03
|
|
Курятина
(филе грудной части)
|
0,067±0,003
|
2,40
±0,03
|
|
Индейка
(окорок)
|
0,057±0,004
|
4,33±0,02
|
Наиболее богаты креатином говядина и
крольчатина.
2.12 Удаление влаги из
проб мяса
Для удаления влаги из проб сырого мяса
используют метод длительного вымораживания при температуре (-18±2) ºС.
Образцы сырого мяса говядины (тазобедренная
часть), свинины (тазобедренная часть), курятины (филе грудной части)
гомогенизируют блендером до получения пастообразной массы. Тонкий слой
гомогенизированной пробы помещают на пластиковую чашку Петри, толщина слоя
составляет не более 1мм. Чашку Петри закрывают бумажным фильтром с отверстиями
и помещают в морозильную камеру. Вымораживание длится в течение 3 - 4 месяцев,
при этом слой образца на чашке периодически переворачивают для ускорения
процесса.
Анализ лиофилизованного мяса на содержание
креатина и креатинина проводят описанным методом (п. 2.11). В таблице 13
представлены результаты содержания креатина в пробах сырого и лиофилизованного
мяса. Оценено содержание влаги в образцах мяса.
Таблица 13 - Содержание креатина в сыром и
лиофилизованном мясе
|
Содержание
креатина в сыром мясе, г/кг
|
Содержание
креатина в лиофил. мясе, г/кг
|
Влага,
%
|
|
Говядина
( таз. часть)
|
4,96±0,06
|
6,73±0,16
|
70,3
|
|
Свинина(
таз. часть)
|
4,49±0,08
|
14,46±0,12
|
68,2
|
|
Курятина
(филе грудки)
|
2,40±0,03
|
10,36±0,10
|
76,8
|
Концентрация креатина в пробах лиофилизованного
мяса увеличилась в 3 - 4 раза в зависимости от вида мяса.
2.13 Определение
массовой доли влаги в мясе
Содержание массовой доли влаги в мясе определяют
по ГОСТ Р 51479-99 методом высушивания до постоянной массы [24].
Взвешивают 15,00000 г очищенного высушенного
песка и добавляют 5,00000 г измельченного, гомогенизированного мяса, не
содержащего соединительных тканей, тщательно перемешивают стеклянной палочкой.
Предварительно песок кварцевый очищают промыванием хлороводородной кислотой
(1:1), затем дистиллированной водой до рН = 7. Высушивают до постоянной массы
при температуре (103±2) ºС.
Высушивают полученную смесь вместе со стеклянной
палочкой при температуре (103±2) ºС
в сушильном шкафу. Пробу охлаждают в эксикаторе и взвешивают на аналитических
весах. Высушивание проводят до постоянной массы. Расхождение между массами не
должно быть более 1%.
Массовую долю влаги определяют в образцах
свинины и курятины (окорок).
Массовую долю влаги в пробах мяса рассчитывают
по формуле:
X = (m1 - m2)×

Где m0 - масса
чашки с палочкой и песком, г;
m1 - масса
чашки с навеской пробы, палочкой и песком перед высушиванием, г;
m2 - масса
чашки с навеской пробы, палочкой и песком после высушивания, г.
По результатам анализа в свинине
(тазобедренная часть) содержится 72,4 % влаги, в курятине (окорок) - 75,3 %.
2.14
Определение влияния ингредиентов мясной продукции на аналитический сигнал
Мясная продукция по рецептуре включает и другие
ингредиенты [25]. Исследуют возможность влияния этих ингредиентов на
аналитический сигнал пробы.
Анализируют пробы: хлеба, панировочных сухарей,
муки пшеничной, сои, крахмала, картофеля, соли, перца черного молотого, нитрита
натрия, лука, чеснока, сыворотки молочной, яйца куриного аналогично образцам
мяса (п. 2.11). Большинство ингредиентов образуют окрашенный комплекс в
щелочной среде, который в отличие от креатинин-пикратного комплекса в кислой
среде не разрушается. Поэтому аналитический сигнал измеряют в кислой и щелочной
среде. Абсорбционность анализируемых проб в кислой и щелочной среде была
одинакова в пределах погрешности.
2.15 Определение
креатина в образцах мясной продукции
Используя рецепты из «Сборника рецептур блюд и
кулинарных изделий для предприятий общественного питания», готовили для анализа
образцы мясной продукции [25] . Для уменьшения массы изделия массы ингредиентов
уменьшают пропорционально по рецепту (таблица 14).
В рецепте «Биточки мясные» часть мяса заменяют
продуктом не животного происхождения, входящим в рецептуру, например хлебом.
Сравнивают аналитический сигнал пробы,
приготовленной по рецепту и пробы с заменой части мяса хлебом.
Готовят пробу «Фарша говяжьего» и пробу «Фарша
говяжьего», в котором часть мяса заменяют соей, пробу «Фарша свиного» и пробу
«Фарша свиного», в котором часть мяса заменяют
крахмалом. Сравнивают аналитический сигнал проб, состоящих только из мяса и
проб, в которых часть мяса заменяют соей и крахмалом. Содержание кареатина
определяют описанным методом (см. 2.11). Результаты заносят в таблицу 14 .
Таблица 14 - Результаты содержания креатина в
мясных продуктах
|
Проба
|
Содержание
креатина, г/кг
|
|
«Биточки
мясные» говядина…………..1,20000 г хлеб пшеничный… 0,29180 г вода………………..0,38910
г сухари………..........0,16210 г
|
2,90±0,03
|
|
«Биточки
мясные» говядина…………..0,60000 г хлеб пшеничный… 0,87540 г вода………………..0,38910
г сухари………..........0,16210 г
|
1,43±0,02
|
|
«Фарш
говяжий» 1,00000 г говядины + 0,80000 г сои
|
4,96±0,06
|
|
«Фарш
говяжий» 0,20000 г говядины + 0,80000 г сои
|
1,03±0,02
|
|
«Фарш
свиной» 1,00000 г свинины
|
4,49±0,08
|
|
«Фарш
свиной» 0,40000 г свинины + 0,60000 г крахмала
|
1,68±0,08
|
Таким образом содержание креатина может служить
показателем содержания мяса в мясных рубленных полуфабрикатах.
2.16 Анализ пельменей,
приобретенных в торговой сети, на содержание креатина и креатинина
Анализируют начинку пельменей, приобретенных в
торговой сети, на содержание креатина и креатинина. Пельмени «Цезарь» ООО
«Морозко» с говядиной категории «В» и пельмени «Табрис» ООО «ТВК-Р» с индейкой
категории «Б». В таблице 15 представлен состав.
Таблица 15 - Состав пельменей «Цезарь» ООО
«Морозко» и «Табрис» ООО «ТВК-Р», указанный на упаковке
|
«Цезарь»
ООО «Морозко» с говядиной
|
«Табрис»
ООО «ТВК-Р» с индейкой
|
|
-
говядина; - вода питьевая; - яйца куриные; - лук репчатый; - соль поваренная;
- сыворотка молочная; - перец черный молотый
|
-
индейка; - вода питьевая; - лук репчатый; - яйца куриные; - соль поваренная;
- перец черный молотый
|
Определение содержания креатина и креатинина
проводят по пункту 2.11. Результаты содержания креатина в начинке заносят в таблицу
16 .
Таблица 16 - Результаты содержания креатина в
начинке пельменей, приобретенных в торговой сети
|
Проба
|
Массовая
доля мышечной ткани, %
|
Концентрация
креатина, г/кг
|
Погрешность,
%
|
|
|
Введено
|
Найдено
|
|
|
«Цезарь»
ООО «Морозко» с говядиной
|
40
- 60 (Категория В)
|
-
|
2,30±0,04
|
3,2
|
|
|
2,48
|
4,86±0,10
|
|
|
«Табрис»
ООО «ТВК-Р» с индейкой
|
60
- 80 (Категория Б)
|
-
|
3,84±0,06
|
3,7
|
|
|
3,20
|
6,92±0,09
|
|
Таким образом содержание креатина может служить
показателем содержания мяса.
ЗАКЛЮЧЕНИЕ
Исследована зависимость абсорбционности пикрата
креатинина от условий проведения реакции: длины волны, времени, концентрации NaOH
и пикриновой кислоты.
Установлено, что при длине волны 510 нм
пикрат-ион не поглощает электромагнитное излучение, а поглощение комплекса
максимальное.
Определено время образования пикрата креатинина.
Оптимальное время равно 11 минут(ам).
Установлены концентрации реагентов: С(NaOH)=
0,15 моль/дм3, С(C6H2(NO2)3OH)=
3,30моль/дм3.
Получена линейная зависимость оптической
плотности от концентрации креатинина.
Установлена зависимость выхода продукта реакции
креатинина от времени нагревания. Выбрано время проведения реакции 2,5 часа.
Исследована зависимость выхода продукта реакции
креатинина от концентрации креатина. С увеличением концентрации креатина выход
продукта реакции уменьшается.
Получена линейная зависимость оптической
плотности от концентрации креатина, коэффициент линейной корреляции R²
= 0,9957.
Правильность разработанной методики проверена
методом «введено-найдено», погрешность 4%.
Определена концентрация креатина в образцах
сырого мяса: свинины, говядины, баранины, курятины, индейки, крольчатины и
козлятины.
Проведено удаление влаги из образцов мяса
методом длительного вымораживания при температуре - 18±2º
С. Оценено содержание влаги в образцах.
Исследована возможность влияния не мясных
ингредиентов пробы на аналитический сигнал. Проанализированы пробы хлеба,
панировочных сухарей, муки пшеничной, сои, крахмала, картофеля, соли, перца
черного молотого, нитрита натрия, лука, чеснока, сыворотки молочной, яйца.
Большинство ингредиентов образует окрашенный комплекс в щелочной среде, который
в отличии от креатинин-пикратного комплекса в кислой среде не разрушается.
Оптическую плотность определяли по разности аналитических сигналов в щелочной и
кислой средах.
Проанализированы образцы мясных продуктов.
Установлено, что содержание креатина пропорционально содержанию мяса в мясной
продукции, может служить показателем качества и подлинности мясных продуктов.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1 Комаров, Ф.И. Биохимические
исследования в клинике / Ф. И Комаров, Б.Ф Коровкин, В.В Меньшиков //
Руководство по клинической лабораторной диагностике . - М., 1981. - Т. 2. - С.
68.
2 Nagel, R. A new
enzymatic assay for creatinine in blood, serum, and urine for the Reflotron system
// Clin. Chem. - 1992. - Vol. 37. - P. 962.
3 Rosano, T. G.
Candidate reference method for determination creatinine in serum: Method
development and interlaboratory validation / T. G. Rosano, R.T. Ambrose. //
Clin. Chem. - 1990. - Vol. 36. - P. 1951-1955
4 Brown, N.D. Determination of
“true” serum creatinine by high-performance liquid chromatography combined with
continious flow microanalysers / N.D. Brown, H.C. Sing, W.E. Neely, E.S.
Koetitz. // Clin. Chem. - 1977. - Vol. 23. - 1281-1283.
5 Sims C. Determination
of serum creatinine by reaction with methyl-3,5-dinitrobenzoate in methyl
sulfoxide / C. Sims, A.C. Parekh. // Ann. Clin. Biochem. 1977. - Vol. 14. - P.
227-232.
6 Sullivan, M. A
highly specific test for creatinine / M. Sullivan, F. Irreverre . // J. Biol.
Chem. - 1958. - Vol. 223. - P. 530-533.
7 Slickers, K.
Performance of Kodak Ektachem clinical chemistry slides for creatinine and
ammonia / K. Slickers, N. Fame, D. Powers, R. Rand // Clin. Chem. 1982. - Vol.
28, - P. 1570.
8 Frazer, C.G.
Biological variability of 26 clinical chemistry analytes in elderly people /
C.G. Frazer, S.T. Cummings, S.P. Wilkinson // Clin. Chem. -1989. - Vol. 35. -
P. 783-786.
9 Mora, L. Effect of
cooking conditions on creatinine formation in cooked ham L. Mora, M.A.
Sentandreu, F. Toldra // Agric. Food Chem. - 2008. - Vol. 56. - P. 11279-11284.
10 Dvorak, Z. Flow-injection
determination of creatine in animal tissues // Anal. Chimica Acta. - 1988. -
Vol. 208. - P. 307-312.
11 Электронный
ресурс. URL: http://www.znaytovar.ru/s/Ximicheskij-sostav-i-pishhevaya-ce2.html
12 ГОСТ ГОСТ Р 52675 - 2006
Полуфабрикаты мясные и мясосодержащие. Общие технические условия. - Введ.
2006.12.27. - М.: Госстандарт России: Изд-во Стандартинформ, 2008.
13 Электронный
ресурс. URL: <http://labx.narod.ru/documents/creatinine.html>
14 Козлов,
А.В. Методы определения креатинина / А.В. Козлов, Е.С. Ларичева // Лабораторная
диагностика. - 2005. - № 3. - С. 28-31.
Электронный
ресурс. URL: http://parma-d.ru/assets/files/instr/instr_react/creatinine.pdf
Электронный
ресурс. URL: <https://sites.google.com/himulacom/-opredelenie-vyhoda-pro-dukta-reakcii.pdf>
Электронный
ресурс. URL: <http://mediklink.ru/medmir/laboratornye-issledovaniya.html>
.Пат.
2093831 Российская Федерация, МПК G01N33/52. Способ определения креатинина в
сыворотке крови и моче колориметрическим методом / Яковлева Г.Е.; Пупкова В.И.
; заявитель и патентообладатель Акционерное общество "Вектор-Бест". -
№ 94038070/13 ; заявл. 10.10.1994 ; опубл. 20.10.1997.
ГОСТ
Р 51479 - 99 Мясо и мясные продукты. Методы определения массовой доли влаги. -
Введ. 1999.12.22. - М.: Госстандарт России: Изд-во Стандартинформ, 2006.
Голунова,
Л.Е. Сборник рецептур блюд и кулинарных изделий для предприятий общественного
питания - М., т. 2. - С. 255