Содержание тяжелых металлов в высших водных растениях водоемов города Гомеля
Содержание
тяжелых металлов в высших водных растениях водоемов города Гомеля
тяжелый металл
растение водоем
Реферат
Ключевые слова: медь, марганец, свинец,
макрофиты, водные растения, накопление, поверхностные воды, донные отложения.
Объектами исследований являлись высшие водные
растения водоемов города Гомеля и его окрестностей.
Целью работы было определение уровней накопления
меди, марганца и свинца в высших водных растениях в водоемах г. Гомеля и
прилегающих территорий донных отложениях и тканях моллюсков в водоемах,
расположенных на территории г. Гомеля.
Метод исследования - эмиссионный спектральный
анализ микроколичеств меди, марганца, свинца.
Установлено, что из восьми обследованных видов
макрофитов концентраторами меди являются частуха подорожниковая, роголистник,
ряска малая, стрелолист обыкновенный. Отмечены также высокие уровни марганца у
роголистника и ряски малой. Максимальная степень аккумуляции свинца характерна
для элодеи канадской и частухи подорожниковой. Обнаружены различия параметров
накопления тяжелых металлов растениями в зависимости от экологических условий
произрастания. Установлено, что содержание Pb,
Cu и Mn
достигает максимума у плавающих неприкрепленных и подводных макрофитов.
Введение
Оценка современного состояния изучаемой
проблемы. Особенностью поведения тяжелых металлов в водных экосистемах является
то, что они не подвержены радиоактивному распаду, не разлагаются и не
деградируют. Тяжелые металлы не исчезают из водных систем, а постоянно
распределяются по отдельным компонентам биотопов, накапливаясь в гидробионтах
различных трофических уровней. Изменение концентрации тяжелых металлов в
различных экосистемах может происходить, прежде всего, естественным путем в
процессе перераспределения между поверхностью суши, воды и атмосферы.
Установившиеся соотношения в экосистеме нарушаются за счет поступления тяжелых
металлов в результате производственной деятельности человека. При этом резкое
увеличение содержания одного или нескольких элементов в живых организмах
переводит их в разряд токсикантов. Они подавляют те функции в организме,
которые ранее, находясь в малых количествах, регулировали или активировали. В
связи с этим проблема индикации загрязнения водных экосистем тяжелыми металлами
является очень важной и требует дальнейшего глубокого ее изучения.
Актуальность работы. В связи с усиливающимся
антропогенным влиянием на водные экосистемы важное значение приобретает
мониторинг этого влияния. Использование для этой высшей водной растительности
имеет ряд преимуществ по сравнению с другими подходами. Высшие растительные
организмы удовлетворяют многим требованиям к биоиндикаторам, среди которых
повсеместная встречаемость, высокая численность, удобство сбора и обработки,
относительно крупные размеры. Занимая прибрежную часть водоема, водные растения
служат своеобразным барьером, предотвращающим проникновение в водоемы и
водотоки недостаточно очищенных сточных вод. В зоне произрастания макрофитов
происходят важные процессы задержания и переработки многих биогенных элементов
и загрязняющих веществ. Однако, информация о накоплении тяжелых металлов в
органах растений разноречива. Это обусловлено тем, что содержание одного и того
же элемента в растительных тканях может одновременно отражать как
физиологическую потребность растения в минеральном питании, так и влияние
окружающей среды.
Целью работы Целью работы было определение
уровней накопления меди, марганца и свинца различными видами высших водных
растений, произрастающих в водоемах г. Гомеля и прилегающих территорий.
1. Обзор литературы
.1 Физиологическая роль металлов в
жизнедеятельности растительных организмов
К тяжелым металлам относят металлы с удельным
весом более 4.5 г/см3. Тяжелые металлы играют особую роль в
биосфере. Находясь преимущественно в рассеянном состоянии, они могут
образовывать локальные аккумуляции, где их концентрация в сотни и тысячи раз
превышает среднепланетарные уровни. Большинство металлов, присутствуя в живых
организмах в ничтожно малых количествах, выполняют весьма важные функции, входя
в состав биологически активных веществ. Соотношение их концентраций в
организмах выработалось на протяжении всего хода эволюции органического мира.
Значительные отклонения от этих соотношений вызывают отрицательные, часто
губительные, последствия для живых организмов. Наконец, являясь одним из
главных природных ресурсов, непременным условием поддержания и развития
современной цивилизации, металлы образуют группу наиболее опасных загрязнителей
биосферы.
По биологической роли в живых организмах тяжелые
металлы включают в себя как типичные микроэлементы (Co,
Cu, Zn,
Mo, Cr,
Mn, Ni,
V), биохимические
функции которых подробно изучены, так и металлы, чья биологическая роль в живых
организмах не столь многогранна и важна или вообще сомнительна (Sc,
Ru, Rh,
Pd, Ag,
Cd, W,
La и лантаноиды, Hf,
Pt, Au,
Hg, Pb,
As, Ge,
Sn, Sb,
Tl, Bi
и другие).
Все химические элементы, в том числе и тяжелые
металлы, в определенном количестве необходимы растительному организму.
Элементы, из которых состоят растения, можно условно разделить на две группы. В
одну входят структурные элементы, из которых построены молекулы основных
органических соединений (белков, жиров, углеводов), в другую - функциональные.
Последние активно участвуют в синтезе структурных соединений, но, как правило,
не входят в них. Функциональные элементы обладают высокой биологической
активностью, часто являются кофакторами различных ферментов, влияют на
проницаемость биомембран, способствуют лучшему перераспределению метаболитов
внутри растения [1].
Микроэлементы (к которым относятся многие тяжелые металлы) в основном являются
функциональными элементами, так как входят в состав ферментов, витаминов и
других биологически активных веществ. По абсолютному их содержанию в
растительном веществе тяжелые металлы можно разделить на четыре групп: элементы
повышенной концентрации - Mn,
Zn, Fe;
средний - Cu, Ni,
Pb, Cr;
низкой - Co, Mo,
Cd, Sn;
очень низкой - Hg,
Ag [2].
Исключительно велика каталитическая роль
микроэлементов, особенно в окислительно-восстановительных процессах. Медь
играет важную роль в ходе ферментативного катализа, в частности, во время его
первой стадии, т.е. во время связывания субстрата ферментом [3].
К настоящему времени в биологических системах обнаружен ряд медьсодержащих
протеинов, и частности связанный с кислородом гемоцианин, цитохромная оксидаза,
тиросиназа и лакказа. Медь, как и железо, участвует в природной селекции
аэробных клеток и в эволюции металлопротеинов и металлоферментов. Последнее
выражается в развитии Сu-Zn-фермеитов
(сверхкислая дисмутаза), Fe-Сu-ферментов
и богатых кислородом белков. Во всех названных протеинах медь связывается с
лигандами азота, кислорода и (или) серы. Вместе с тем доминирующая роль меди в
биологических системах определяется ее способностью стабилизировать серные
радикалы.
Многочисленными исследованиями растительных
организмов доказано положительное влияние меди на интенсивность фотосинтеза,
дыхание, перераспределение углеводов, восстановление и фиксацию азота,
проницаемость сосудов ксилемы для воды. Сu
контролирует образование ДНК и РНК, оказывает влияние на механизмы,
определяющие устойчивость к заболеваниям.
К числу давно известных и широко представленных
в растении активируемых медью окислительных ферментов относятся энзимы
фенолазного комплекса и аскорбатоксидаза. Предполагаемый механизм действия этих
катализаторов включает образование комплексов меди с кислородом и изменение
валентности металла фермента в ходе реакции.
Медь активирует процесс фиксации молекулярного
азота. Медь является единственным элементом, улучшающим рост в условиях
аммиачного питания. Растения на среде с аммиаком при хорошей аэрации и в
присутствии меди были сравнимы по росту с растениями на нитратном фоне. Участие
меди в фотосинтезе подтвердилось присутствием в хлоропластах цитохромоксидазы и
последующего открытия в хлоропластах пластоцианина, который встречается
исключительно в фотосинтезирующих органах, зеленых частях растений. Многие
медь-содержащие ферменты [4]
катализируют восстановление О2 до Н2О2 или Н2О.
Окисляя монофенолы, медь принимает участие в образовании сложных биополимеров,
таких как лигнин и меланин.
Марганец является катализатором в процессах
дыхания и усвоения нитратов. Показано [5], что марганец при нитратном питании
выступает в роли восстановителя, а при аммиачном - как окислитель. При
недостатке марганца в растениях разобщаются процессы фотосинтеза и биосинтеза
нуклеиновых кислот, снижается содержание ионов калия, а содержание натрия,
калия, магния, нитратов, фосфатов возрастает, что, очевидно, связано с
увеличением проницаемости клеточных мембран и с активным накоплением их в
вакуолях против градиента концентрации. Недостаток марганца сопровождается
повышением в корнях удельного веса фосфолипидов, холин- и инозитфосфатидов, что
так же может быть связано с изменением проницаемости мембран.
При любой степени недостаточности марганца
угнетается только та часть фотосинтеза, которая ответственна за образование
кислорода. При его добавлении в среду происходит быстрое восстановление обоих
процессов - завершение фотосинтеза и образование кислорода. Марганец включается
в процесс между фотолизом воды и образованием необходимым элементом в
жизнедеятельности свободноживущих азотфиксаторов [6].
Цинк входит в состав большого числа
разнообразных ферментов. Прочно удерживает цинк белок карбоангидразы, которая
активирует обратимое разложение угольной кислоты. Цинк является металлом -
активатором таких ферментов, как энолаза, альдолаза. Последняя участвует в
разложении фруктозодифосфата до фосфодиоксиацетона и фосфоглицеринового
альдегида. В отсутствии цинка нарушается процесс окислительного
фосфорилирования [7].
В молекуле фермента алкогольдегидрогеназа на одну молекулу белка приходится
четыре атома цинка, который обеспечивает не только каталитическую функцию
фермента, но и служит для его стабилизации.
Цинк участвует в метаболизме стимуляторов и
ингибиторов роста, а также ускоряет синтез и увеличивает содержание РНК в
растениях [8].
Влияние цинка на рост имеет прямое отношение к
его участию в обмене ауксина и особенно индолилуксусной кислоты, которая тесно
связана с аминокислотой триптофаном. При недостатке цинка
окислительно-восстановительное равновесие сдвигается и наступает коацервация,
окисление, нарушается синтез белка. Это определяет влияние цинка на фотосинтез,
образование хлорофилла и рост растений.
Ванадий стимулирует фиксацию атмосферного азота
и рост азотобактера в культурах, к которым азот в связанном виде не добавлялся.
Наблюдалось усиление (в 8 раз) скорости роста зеленых водорослей при добавлении
ванадия к очищенному питательному раствору. Имеются данные о значения ванадия в
процессе фотосинтеза [9].
Кобальт необходим бобовым растениям в отсутствие
связанного азота. Имеются данные о значении кобальта, входящего в состав
витамина В12, неорганического кобальта в фиксации азота
свободноживущими микроорганизмами. Кобальт является активатором многих
ферментов и играет важную роль в энергетическом обмене. Под его влиянием
значительно повышалось содержание АТФ в растениях, у которых под воздействием
засухи и высоких температур снизилось содержание последней. Кобальт
способствует росту тканевых культур эпикотиля и имеет значение для прорастания
пыльцы [9].
Физиологические функции ионов металлов тесно
связаны между собой. При этом наблюдаются как проявления синергизма, так и
антагонизма по отношению металлов друг к другу. В целом, взаимодействие ионов
является весьма сложным процессом, включающим не только конкуренцию их при
поступлении в растения, но и более глубокие биохимические и физиологические
изменения в процессе метаболизма. Иногда единственной причиной положительного
действия некоторых микроэлементов (йода, алюминия) является их
антагонистическое действие, их способность обезвреживать действие других ионов.
Чаще всего причина антагонизма ионов заключается в диаметрально противоположном
действии на коллоидно-химические свойства плазмы и на ход определенных важных
жизненных процессов ионов-антагонистов [10].
Анализируя явления антагонизма и синергизма, необходимо указывать, при каких
условиях они проявились. Например, при увеличении недостатка испытуемого
элемента явления синергизма переходят в антагонистические, а при избытке его
антагонизм переходит в синергизм. Известно, что молибден способствует улучшению
биодоступности железа. Это связано со способностью молибдена образовывать
комплекса с фосфором, что ведет к задержке осаждения железа в виде фосфата и
приводит благодаря этому к увеличению доступности железа. Напротив, торможение
поступления железа в растение при избытке марганца рассматривается как
результат конкуренции между двумя указанными элементами за место в
простетических группах ферментов. Антагонистические свойства некоторых металлов
лежат в основе их токсического действия на растительные организмы. Так,
например, способность кадмия замещать цинк во многих энзиматических реакциях
приводит к их разрыву или торможению. В то же время кадмий может ингибировать
токсичность меди. При совместном действии меди и свинца, меди и кадмия
отмечается антагонизм в их влиянии на растения, а в случае меди и никеля -
синергизм.
При резком увеличении содержания одного или
нескольких металлов-микроэлементов в среде наблюдается смена нормальных
физиологических функций металла токсическим воздействием. Токсичность тяжелых
металлов тесно связана с физико-химическими свойствами, со способностью к
образованию более или менее прочных соединений с рядом функциональных
группировок на поверхности или внутри клеток. При токсическом действии металлов
происходит не только грубое нарушение в коллоидах, но и денатурация белков, их
осаждение, а также блокирование активных центров ферментов. Именно нарушения
нормального и согласованного действия ферментных систем представляют основной
механизм действия токсических веществ [11].
Установлено, что в больших дозах металлы образуют ковалентные связи в отличие
от физиологически необходимых металлов, для которых характерны ионные связи [12].
Многие металлы связываются с компонентами мембраны, изменяя ее проницаемость и
энзиматическую активность. Такие металлы, как кадмий и ртуть, способны
индуцировать мутагенез, канцерогенез и вызвать макроскопические изменения.
Связываясь с ДНК никель вызывает снижение ее синтеза. Токсическое действие
свинца и хрома проявляется в нарушениях митотической активности растительных
клеток.
Воздействие загрязнителей на растительные
организмы приводит к возникновению у них разнообразных нарушений, приобретающих
в зависимости от силы воздействия, его направленности и специфичности характер
патологической реакции, патологического процесса, болезни или же
патологического состояния [13].
Патологические явления, вызываемые у растений загрязнителями, могут быть
объединены в две основные категории - категорию патологических явлений,
возникающих без нарушения генетической конституции растений, по существу
эпигеномных, и категорию патологических явлений, связанных с возникновением мутаций
в гаметах или же соматических клетках.
При обследовании водной растительности [14]
было установлено, что кадмий менее ядовит для растений, чем ртуть и медь, и
сопоставим по токсичности со свинцом, никелем и хромом. В зависимости от формы
нахождения и условий опыта приостановка роста и фотосинтеза происходит обычно
при содержании кадмия 0.02-1.0 мг/л. Однако, хронические эффекты наблюдались и
при низких концентрациях - 1 мкг/л. Токсичность кадмия может быть объяснена
способностью его замещать цинк, связанный с протеинами; соответственно
добавление цинка в среду заметно понижает повреждение клеток. В то же время
кадмий может ингибировать токсичность меди. У водорослей под действием кадмия
наблюдались набухание, вакуолизация и дегенеративные формы митохондрий,
указывающие на значительную цитотоксичность кадмия. Кадмий в количестве
0.01-0.1 мг/л понижает также концентрацию АТФ и хлорофилла у многих видов и
уменьшает продукцию кислорода. Ингибирование роста растений наблюдается при
концентрациях меди £0,1 мг/л. При содержании меди
0.003-0.03 мг/л отмечается уменьшение потребления углекислоты и кремневой
кислоты. Ртуть - единственный металл, который для растений более токсичен, чем
медь. Сублетальный эффект медной интоксикации проявляется в начальной потере калия,
что связано с увеличением проницаемости клеток. Это может приводить к
интенсивности фотосинтеза. При содержании меди ниже 0.05 мг/л отмечается
уменьшение объема клеток, содержании азота и углерода. Острое и хроническое
действие свинца проявляется при концентрациях около 0.1-5 мг/л. марганец и медь
могут парализовать стимулированную свинцом ингибицию, отражающую конкуренцию за
активные места в ферментах. Концентрация хлорида ртути 0.002-0.25 мг/л вызывает
у растений задержку роста. Существенное снижение интенсивности роста растений
отмечается при содержании 0.1-0.5 мг/л никеля. При совместном влиянии никеля и
ртути, никеля и меди на многие виды водных растений отмечается синергизм, а при
совместном воздействии никеля и кадмия, никеля и цинка - антагонизм.
Загрязненные растения не выполняют в полной мере
функцию «зеленых легких» планеты, уменьшается их роль в регуляции
температурного и светового режимов и водного баланса, в осуществлении
биохимических циклов, в предотвращении водной и ветровой эрозии, в возникновении
и воспроизведении трофических цепей.
1.2 Механизмы поступления и
накопление тяжелых металлов в растительных организмах
Процесс поглощения металлов растительным
организмом имеет поэтапный характер, с включением различных механизмов,
приуроченных к определенным структурным компонентам тканей растений.
1) обогащение
ионами свободного пространства апопласта (происходящее за счет обменной
адсорбции, диффузии, пассивной физико-химической адсорбции);
2) преодоление
мембранного барьера - проникновение ионов в симпласт;
3) радиальное
передвижение по тканям корня и сосудистым проводящим пучкам;
4) активное
включение поступающих ионов в метаболизм;
5) вертикальное
передвижение ионов по стеблям, черешкам и ветвящимся жилкам листьев;
6) поступление
в синтезирующие клетки, утилизация и реутилизация, отток в репродуктивные
органы;
7) транспорт
ассимилятов и ионов вниз по флоэме, в корни [15].
При поступлении в корни тяжелых металлов
наибольшее значение приобретают первые три этапа, а также передвижение ионов из
корней в надземные органы растений. Важнейшим этапом в процессе поглощения
растениями ионов металлов является преодоление ими структурного барьера -
биологической мембраны. При этом происходит сочетание быстрой адсорбции с
активным поглощением. [16].
Движение по свободному пространству и пассивное
поглощение имеют большое значение при поступлении тяжелых металлов, особенно
при повышенных концентрациях их в среде. Превалирование пассивного характера
поступления возрастает для металлов, концентрация которых в среде является
избыточной для растительного организма. После поглощения ионы могут
передвигаться в тканях корня как симпластическим, так и апопластическим путем.
Оба пути транспорта могут сменять друг друга.
Наряду с поглощением тяжелых металлов корневой
системой возможен другой путь их поступления в растительный организм, а именно,
адсорбция листовой поверхностью. Считается [17], что внекорневое поглощение
химических элементов происходит по безбарьерному типу. Исходя из этого,
загрязнение атмосферного воздуха тяжелыми металлами по сравнению с загрязнением
почвы представляет большую опасность для растений. В то же время проникновение
металлов в листья при их поглощении из воздуха зависит от многих причин. На
верхней стороне листа наиболее активное поступление наблюдается под жилками и
по его краям, а на нижней - в замыкающих клетках устьиц, околоустьичных
клетках, эпидермальных волосках и над антиклинальными стенками клеток
эпидермиса. Проявление токсического действия металлов в листьях в значительной мере
зависит от их подвижности и локализации в тканях.
Для того, чтобы противостоять избыточному
поступлению тяжелых металлов, растения располагают системой защитных реакций и
механизмов, выработанных в процессе эволюции и в ответ на изменение среды
обитания. При поступлении тяжелых металлов в растение из почвы первый барьер на
их пути - это корневая система. Избыточная аккумуляция металлов разными видами
растений ограничивается избирательной способностью корневого поглощения по
отношению к определенным элементам [17].
Другим механизмом устойчивости к тяжелым
металлам является ограничение поступления их из корней в надземную часть.
Немаловажная роль в ограничении вертикального передвижения металлов
принадлежит, вероятно, корневой шейке. В то же время высокое содержание
металлов способно вызвать нарушение структуры клеточных мембран. Это, в свою
очередь, может явиться дополнительным фактором усиления диффузного поступления
тяжелых металлов в клетки растений [18].
Селективная способность растений и наличие
физиологических барьеров поглощения в корнях не всегда могут защитить растение
от избыточного поступления тяжелых металлов. В таких случаях в работу
включаются механизмы, способствующие аккумуляции тяжелых металлов в
физиологически менее активных органах. В большинстве случаев наибольшее
количество металлов локализуется в подземной и значительно меньше - в надземной
частях растений. При этом у устойчивых видов, как правило, накапливается больше
металлов в корнях, чем в надземной части [19].
Таким образом, толерантность растений к металлам определяется не только
наличием барьеров, ограничивающих их поступление, но и способностью
регулировать их транспорт, в частности передвижение из корней в стебли и
листья. В некоторых случаях защитная реакция растений проявляется в увеличении
соотношения между корневой системой и надземной частью, но при оптимизации
питания оно снижается. Уменьшению уровня аккумуляции, а следовательно, и
токсического влияния металлов на растения в определенной мере способствует их
десорбция из тканей. Так, отмечено, что небольшие дожди не влияют на
концентрацию в листьях Fe,
Mn и Cu,
тогда как обильные осадки уменьшали их содержание на 35-65%
[20].
Наряду с рассмотренными защитными механизмами,
предотвращающими избыточное накопление металлов, в растении одновременно
действуют сложные механизмы их детоксикации, которые, с одной стороны,
определяются метаболическими особенностями самого растения, с другой -
физическими и химическими свойствами поглощенных металлов. Одним из возможных
механизмов детоксикации ионов некоторых металлов является их изоляция
небольшими по молекулярной массе, богатыми сульфгидрильными группами белков,
называемыми металлотионеинами, которые играют центральную роль в защите против
токсического действия тяжелых металлов в организме, и выводит их из
метаболизма. Это обусловливает толерантность растений к загрязнению среды и
накопление металлов в тканях до высоких концентраций без нарушения механизмов
гомеостаза. На этих свойствах металлотионеина основана одна из современных теорий
детоксикации, заключающаяся в том, что металлы не проявляют токсического
эффекта, если они не присутствуют в количествах, превышающих связывающую
способность металлотионеина. Если же содержание металлов превышают связывающие
способности металлотионеина, то они переносятся в металлоферменты и проявляют
токсическое свойство. Таким образом, критическим же фактором выживания
организмов являются не уровни содержания металлов, а то, где они находятся - в
металлотионеине или металлоферментах [12].
Устойчивость растений к токсическому воздействию
тяжелых металлов может также контролироваться перестройками генетического
аппарата. Например, в случае длительного, многолетнего, загрязнения
растительных популяций, страдающих от интоксикации, за короткое время могут образоваться
толерантные генотипы. Металлоустойчивые популяции ряда видов растений известны
для районов рудных месторождений. Описаны устойчивые к свинцу популяции,
сформировавшиеся в городах или вдоль автомобильных дорог.
Толерантность вырабатывается именно к тому
металлу, который присутствует в среде в избытке, то есть она специфична. Могут
формироваться популяции, устойчивые одновременно к двум или нескольким металлам
- множественная устойчивость. Для металлоустойчивых популяций характерны
карликовые формы, пониженная биологическая продуктивность, ослабление
прорастания семян и роста проростков при нормальном содержании металлов в
среде. Свойство металлоустойчивости наследуется, передаваясь в семенном
потомстве.
Способность вида формировать мсталлоустойчивые популяции
определяется его генетической изменчивостью, то есть наличием некоторого
количества устойчивых к металлам индивидуумов и исходной популяции. В условиях
загрязнения среды металлами действует отбор по признаку металлоустойчивости:
неустойчивые индивидуумы быстро выпадают, устойчивые отбираются.
Формирование видов металлоустойчивых популяций
имеет большое экологическое значение, так как позволяет им выжить при
загрязнении. Исследования в этой области находят практическое применение -
устойчивые популяции используют для рекультивации горнорудных отвалов и других
грунтов, обогащенных металлами.
Следует отметить, что устойчивость растений к
металлам не связана с ограничением их поступления. Более того,
металлоустойчивые виды и популяции чаще поглощают даже больше металлов, чем
чувствительные или обычные. Механизмы устойчивости растений к металлам в
условиях природного обогащения и при загрязнении среды имеют много общего. Они
действуют как в корнях, так и в надземной части растений. Возможно также, что при
атмосферном загрязнении приобретают значение механизмы, связанные с листьями,
которые обеспечивают барьерные функции кутикулы и эпидермиса, иммобилизацию
металлов в неактивных формах или выведение их из листа.
Таким образом, металлоустойчивость растений обеспечивается
различными механизмами в зависимости от природы металла, биологических
особенностей вида и факторов окружающей среды. При этом могут действовать
следующие механизмы:
- обезвреживание металла внутри растения:
связывание в нерастворимые комплексы; переведение (складирование) в вакуоли и
(или) клеточные стенки;
- выведение металла во внешнюю среду:
сбрасывание листьев;
вымывание осадками; выделение в воздух;
адаптация к металлу: перестройки в
метаболизме; потребность в металле.
Токсическое действие металлов на растение в
природе нередко с трудом поддастся объяснению, будучи результатом сложных
взаимоотношении металлов, находящихся в избытке в растении, с другими
необходимыми минеральными элементами. Данные процессы взаимодействия еще более
усложняются факторами окружающей среды, такими как температура и влажность
воздуха и почвы, интенсивность освещения и др., которые могут видоизменять,
ослаблять или усиливать, реакцию растения на токсическое действие металлов
[21].
1.3 Факторы, влияющие на содержание
тяжелых металлов в высших водных растениях
Концентрирующая способность водных растений по
отношению к химическим элементам определяется видом растения, его
физиологическими способностями, возрастом и стадией развития, условиями среды
обитания - типом и гидрологическим режимом водоема, гранулометрическим составом
грунта, а также географическим положением водоема и климатическими условиями.
Существенное влияние на микроэлементный состав
водных растений оказывают экологические особенности обитания. В настоящее время
принята следующая классификация водных макрофитов по взаимодействию со водной
средой:
Гидрофиты - настоящие водные растения, постоянно
растущие в воде:
эугидрофиты - погруженные растения,
плейстогидрофиты - плавающие растения,
аэрогидрофиты или гидрогигрофиты -
воздушно-водные или водноболотные растения.
Гигрофиты - наземные растения влажных,
переувлажненных и периодически затопляемых местообитаний с высокой влажностью
воздуха:
эугигрофиты - наземные околоводные растения,
гигрогелофиты - наземные болотные растения,
Свободноплавающие гидрофиты (ряска, водокрас,
трехдольница и др.) получают элементы минерального питания преимущественно из
воды, поэтому интенсивность накопления того или иного элемента в них зависит в
первую очередь от рН среды [23]. Высокая поглотительная способность растений
делает их идеальными тестовыми объектами для количественного и качественного
определения степени загрязнения водоема в течении вегетационного цикла.
Укорененные гидрофиты с плавающими листьями
помимо водной массы получают значительную часть металлов из донных отложений.
Наличие развитой корневой системы и активного транспорта из корней к листьям
позволяет использовать их для определения антропогенных химических нагрузок,
произошедших в течение не только текущего сезона (по химическому составу
листьев), но и предыдущих (корни, корневища). Полностью погруженные гидрофиты,
как укорененные так и неукорененные, на протяжении вегетационного сезона могут
менять источники поступления вещества в свои ткани. Для растений с мощной
корневой системой донные отложения являются основным источником поступления
вещества при значительной роли водной массы.
Укореняющиеся гелофиты извлекают питательные
вещества не только из воды, но и из околоводного почвенного слоя, что следует
учитывать при применении растений этой экологической группы в качестве
биоиндикаторов степени загрязнения водных экосистем.
Растения-гидрофиты поглощают ионы металлов из
водной среды и возвращают их при деструкции и метаморфизации органического
вещества в донные отложения. Последние депонируют металлы в формах с низкой
биодоступностью, поэтому часто отмечается даже снижение поступления металлов в
растения, несмотря на некоторое накопление их в донных грунтах [24]. Абсорбция
питательных веществ укореняющейся растительностью и их вымывание после
отмирания растений или частей растений существенно увеличивают количество
питательных веществ в воде. Укореняющиеся растения подобны «насосу питательных
веществ», особенно в литоральных экосистемах, где макрорастительность -
основная составляющая первичной продукции [25].
В зависимости от условий обитания содержание
тяжелых металлов в макрофитах сильно варьирует. Часто это вызывается
воздействием локального источника загрязнения. Так, в работе [26]
представлены исследования по изучению аккумулирующей способности водной
растительности Шекснинского плеса Рыбинского водохранилища, который
характеризуется высокой степенью минерализации вод, вызванной стоками
промышленных предприятий г. Череповца. Наиболее высокие концентрации тяжелых
металлов в тканях водных растений отмечались недалеко от города, несколько ниже
было загрязнение в центральном участке плеса, что связано с разбавлением водных
масс. При концентрации в воде северного участка плеса цинка -27, никеля - 2,
хрома - 0.5. в рдесте злаковом отмечались следующие величины накопления этих
металлов: цинка - 150.0 мкг/г, никеля - 98.2 мкг/г и хрома - 127.5 мкг/г. У
рдеста пронзеннолистного содержание цинка составляло - 145.0 мкг/г, Ni
- 20.2 мкг/г, Cr - 26.3
мкг/г. Наибольшей способностью к накоплению обладали свободноплавающие и
погруженные растения - ряска, рдесты гребенчатый и злаковый. Находящийся в этих
же условиях обитания представитель гигрофитов - горец земноводный накапливал
металлы в значительно меньшей концентрации, иногда не превышающей их содержания
в воде.
Сравнивая микроэлементный состав одноименных
растений, пробы которых взяты из различных водоемов в одно и то же время можно
выделить влияние каких-либо экологических факторов в том числе и антропогенного
происхождения [27]. Обычно наибольшие
концентрации тяжелых металлов в макрофитах приурочены к участкам с повышенной
антропогенной нагрузкой, в которых наблюдается увеличение общей минерализации
воды и содержания тяжелых металлов в донных отложениях.
Определенный вклад в накопление тяжелых металлов
водными растениями вносят абиотические факторы, такие как химический состав
воды, температура, смена сезона.
В работе [28] представлены результаты
исследования поглощающей способности роголистника в отношении меди при
изменении температурного и светового режима. Сравнение опытных и контрольных
растений показано, что с увеличением концентрации до 0.3 мг/л токсичность меди
в темноте проявилась уже на 2-е сутки независимо от температуры, а на свету -
только к концу опыта и выражалась сильнее с повышением температуры воды.
Концентрация меди 0.5 мг/л вызывает полную гибель растений в 1-е сутки во всех
вариантах. Отсутствие света, несомненно, усиливало токсичность меди на
роголистник.
Водные растения очень чутко реагируют на
химический состав среды. При увеличении концентрации элементов, как это
случается при загрязнении водоемов, большинство растений либо активно, либо
пассивно поглощает их в количествах, превышающих необходимость в питании.
Критерием устойчивости к высоким уровням металлов в среде, как правило,
являются темп роста и продуктивность растений.
Изучение сезонного распределения химических
элементов в высших воздушно-водных растениях (частуха подорожниковая и
стрелолист обыкновенный), распространенных преимущественно по мелководьям
пресных водоемов [29] показало, что их химический состав отражает типичную для
абсолютного большинства макрофитов картину количественного соотношения
металлов: высокое содержание железа, величина которого у стрелолиста в августе
достигает 3382 мкг/г сухого вещества; на один-два порядка ниже содержание
цинка; далее, в пределах 10 мкг/г, концентрируются медь, никель, свинец, хром и
кобальт и еще ниже - до 2 мкг/г содержится кадмия. Наиболее высокое содержание
определяемых элементов отмечено во второй половине вегетации. При анализе
содержания марганца в элодее канадской [30], установлено, что в зависимости от
сезона, концентрация этого элемента в тканях растения может варьировать до двух
раз. Повышение накопления металлов растениями к концу вегетационного периода,
очевидно, объясняется общим увеличением количества минеральных веществ в
растениях с возрастом (от весны к осени).
Распределение уже накопленных металлов по
органам и тканям макрофитов также имеет свои особенности. При этом наблюдается
преобладание всех без исключение элементов в подземных органах. Это явление
характерно для большинства укорененных макрофитов и объясняется тем, что
металлы не распределяются по всему растению равномерно, а концентрируются в том
органе, через который они поступают [31],
накапливаясь в основном в мембранных клеточных стенках корневых клеток. С
началом роста растений микроэлементы по мере их необходимости подаются в
надземную биомассу.
Таким образом способность водных макрофитов
накапливать преимущественно растворенные в воде металлы и удерживать их в
течение продолжительного времени в своих тканях позволяет исследователям
рекомендовать их в качестве организмов-биоиндикаторов загрязнения водных
экосистем.
2. Объект, программа и методика
исследований
.1 объект и программа исследований
В качестве объектов исследования были выбраны
высшие водные растения:
ряска малая- Lemma minor L.,
кубышка желтая-Nuphar luteum (L) Sm.,
рдест пронзеннолистный-Potamogeton perfoliatus
L.,
элодея канадская -Elodea
canadensis Rich.,
роголистник-Ceratophyllem
demersum L.,
стрелолист обыкновенный-Sagittaria
sagittifolia L.,
сусак зонтичный- Butomus
umbellatus L.,
частуха подорожниковая-Alisma
peantago-aquatica L.
В зависимости от способа обитания выбранные для
исследований виды растений составляют 4 экологические группы [32]:
I. плавающие неприкрепленные - ряска
малая;
II. плавающие прикрепленные растения -
кубышка желтая;. подводные растения - роголистник, элодея канадская, рдест
пронзеннолистный;. надводные растения - стрелолист обыкновенный, сусак
зонтичный, частуха подорожниковая.
Отбор проб растений производился на следующих
водоемах: озера, расположенные на территории г. Гомеля - Дедно, Шапор,
Любенское, Володькино, Круглое, Малое, Волотовское, Гребной канал, У-образное;
русло р. Сож ниже черты города по течению в районе д. Ченки и выше черты города
у д. Кленки; старое русло р. Сож у д. Поляновка (Ветковский район Гомельской
области).
По гидрологическому режиму озера Любенское,
Дедно, старица вблизи д. Поляновка - пойменные водоемы, не утратившие связь с
коренным руслом р. Сож. Гребной канал - связанный с рекой Сож водоем,
искусственно созданный для отвода избытка воды в половодье от д. Якубовка.
Озеро Шапор - старое русло р. Сож, в настоящее время представляющее ответвление
от основного русла; озеро Володькино - водоем, возникший в результате
расширения коренного русла р.Сож в месте впадения в него р. Ипуть.
Озера Малое, Круглое, Волотовское и У-образное
являются полностью замкнутыми непроточными водоемами, причем два последних
являются смежными, соединенными протоками.
Организованные выпуски промышленных и
хозяйственно-бытовых стоков производятся только в озера Шапор и Дедно, а также
озеро Круглое, принимающие стоки предприятия «Электроаппаратура». Озера Малое и
Круглое служат карьерами для добычи глины и находятся рядом с оживленной
автотрассой и железнодорожной линией. Озера Волотовское и У-образное также окружены
автотрассами. Озеро Володькино принимает воду р. Ипуть, в которую выше по
течению поступают стоки предприятий г. Добруша. Старое русло р. Сож у д.
Поляновка расположено на 5 км выше по течению от черты города. Она не
испытывает серьезной антропогенной нагрузки и загрязняется только поверхностным
стоком с прилегающих сельхозугодий и водами р. Сож во время весеннего паводка.
Целью настоящей работы явилось определение
содержания тяжелых металлов в высшей водной растительности в водоемах,
испытывающих различную антропогенную нагрузку.
В ходе исследований решались следующие задачи:
1) определение
содержания металлов Cu,
Mn, Pb
в растениях различных экологических групп, произрастающих в водоемах
опробования;
2) сравнительный
анализ степени накопления Cu,
Mn, Pb
в растениях водоемов с различной степенью антропогенной нагрузки.
2.2 Методика отбора проб. Подготовка
проб к анализу. Метод анализа
Пробы растений после тщательного ополаскивания
последовательно высушивали до воздушно-сухого, затем абсолютно сухого состояний
и озоляли до белой золы в муфельной печи при 450оС.
Содержание тяжелых металлов в золе растений
определяли атомно-эмиссионным спектральным методом на спектрофотометре IGSM в
лаборатории физико-химического анализа Института геологических наук НАН
Беларуси (аналитик И.Н. Тетерева).
Практической целью методов атомной спектроскопии
[33]
при анализе вещества является качественное полуколичественное или
количественное определение элементного состава анализируемой пробы. В настоящее
время достаточно широкое применение получили методы анализа по атомным спектрам
поглощения и флуоресценции в оптическом диапазоне, а также по эмиссионным и
флуоресцентным спектрам в рентгеновском диапазоне. Во всех случаях в основе
этих методов лежит квантовые переходы валентных или внутренних электронов атома
из одного энергетического состояния в другое. Одним из наиболее замечательных
свойств атомных спектров является их дискретность (линейчатая структура) и
сугубо индивидуальный характер, что делает такие спектры опознавательным
признаком атомов данного элемента. На этом основан качественный анализ.
Определение концентрации интересующего элемента производят путем измерения
интенсивности отдельных спектральных линий, называемых аналитическими. Для
получения спектра эмиссии частицам анализируемого вещества необходимо придать
дополнительную энергию. С этой целью пробу при спектральном анализе вводят в
источник света, где она нагревается, и испаряется, а попавшие в газовую фазу
молекулы диссоциируют на атомы, которые при столкновениях с электронами
переходят в возбужденное состояние.
В возбужденном состоянии атомы могут находиться
недолго, около (10-7-10-8 с). Самопроизвольно возвращаясь
в нормальное или промежуточное состояние, они испускают избыточную энергию в
виде квантов света. Интенсивность спектральной линии или мощность излучения при
переходе атомов из одного энергетического состояния в другое определяется
числом излучающих атомов и вероятностью перехода атомов из возбужденного
состояния в исходное.
Определение тяжелых металлов проводилось
сопряженно в воде и донных отложениях исследуемых водоемов (приложение А).
Содержание металлов в пробах воды определяли атомно-адсорбционным методом на
AAS «Perkin Elmer -406», в донных отложениях - атомно-эмиссионным спектральным
методом на спектрофотометре IGSM.
2.3 Методы статистической обработки
результатов исследований
В качестве основного статистического параметра
совокупности данных использовалось среднее арифметическое ряда вариант:
 ,
,
где  - среднее
значение ряда вариант;
- среднее
значение ряда вариант;
х1, х2 . . . .
хn - частные значения вариант;- число вариант.
Показатели вариации
экспериментальных данных оценивались по следующим критериям.
Стандартное отклонение:
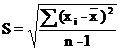
где  - среднее
значение ряда вариант;
- среднее
значение ряда вариант;
хi - частные значения
вариант;- число вариант.
Точность прямого измерения (доверительный
интервал):
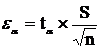 ,
,
где ea - точность
прямого измерения;a - критерий
Стьюдента;- стандартное отклонение;- число вариант.
Расчет статистических параметров производился с
использованием программного обеспечения ПЭВМ
3. Результаты исследований их
обсуждение
.1 Содержание меди, марганца и
свинца в макрофитах водоемов г. Гомеля
При анализе данных по содержанию Cu,
Mn и Pb
в тканях макрофитов, произрастающих в водоемах г. Гомеля выявлено, что
концентрация этих элементов в растениях в определенной мере зависит от их
видовой принадлежности. На рисунке 1 представлены данные по среднему содержанию
(с указанием интервала ошибки средней) Cu
у восьми видов макрофитов из различных водоемов города и прилегающих
территорий. Так, наибольшими значениями накопления меди характеризовались такие
виды, как частуха подорожниковая, роголистник и ряска малая. Затем следовали (в
порядке убывания концентрации) стрелолист обыкновенный, элодея канадская, сусак
зонтичный, рдест пронзеннолисный, кубышка желтая. По абсолютному значению
содержания меди можно выделить группу концентраторов, куда относятся частуха,
роголистник, ряска, стрелолист. Верхний предел концентрации в их тканях меди
составляет от 18 мг/кг сухой массы (частуха, роголистник) до 35 мг/кг сухой
массы (ряска, стрелолист). Группа среднего накопления этого металла включает
элодею и сусак, накопление Cu
у них в среднем составляет 7-8 мг/кг сухой массы. Кубышка желтая и рдест
пронзеннолистный характеризуются наиболее низким содержанием меди среди
изученных видов макрофитов (максимум составляет 4.0 и 5.4 мг/кг сухой массы
соответственно).
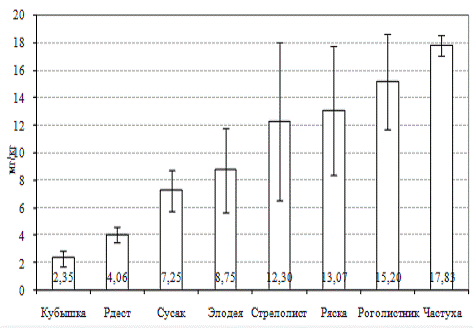
Рисунок 1 Содержание меди в тканях различных
видов водных растений, обитающих водоемах г. Гомеля
В отношении марганца наблюдается следующая
картина распределения содержания металла среди исследованных видов водных
растений: частуха подорожниковая <стрелолист обыкновенный <сусак
зонтичный <кубышка желтая <элодея канадская <рдест
пронзеннолистный<ряска малая <роголистник (рис. 2). При этом различия по
накоплению Mn между
крайними членами ряда составляют 7.9 раз. Концентраторами являются роголистник
и ряска. Верхний предел концентрации в их тканях Mn
примерно одинаков и достигает 4800-5000 мг/кг сухой массы. Группе среднего
накопления этого металла принадлежат растения элодея и рдест, с максимумами
концентраций 2100 и 2590 мг/кг сухой массы соответственно. Остальные виды,
кубышка желтая, сусак зонтичный, стрелолист обыкновенный, частуха
подорожниковая обладают незначительной способностью к накоплению марганца среди
изученных макрофитов (в среднем от 450 до 647 мг/кг сухой массы).
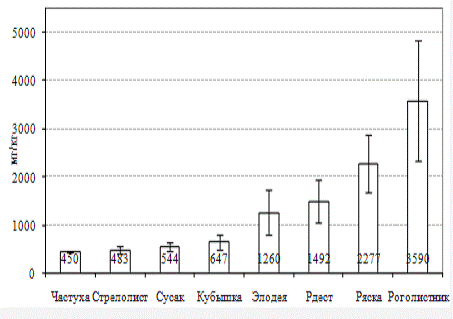
Рисунок 2 Содержание марганца в тканях различных
видов водных растений, обитающих водоемах г. Гомеля
Накопление свинца у исследованных видов
макрофитов увеличивается в следующем порядке: кубышка желтая < сусак
зонтичный < роголистник < рдест пронзеннолисный < стрелолист
обыкновенный < ряска малая < частуха подорожниковая < элодея канадская
(рис. 3). Для большинства изученных видов характерен широкий размах
индивидуальной изменчивости содержания Pb.
Наибольшее содержание отмечено у элодеи и частухи (максимальные зафиксированные
значения 15.8 и 14.0 мг/кг сухой массы при среднем содержании 8-10 мг/кг сухой
массы). За исключением кубышки желтой, средняя концентрация данного металла у
остальных видов составляет от 2.5 до 5 мг/кг сухой массы. Как и в отношении
меди, минимум накопления свинца характерен для кубышки желтой, у которой его
концентрация не превышала 1.1 мг/кг сухой массы. Таким образом, различия по
накоплению свинца отдельными видами макрофитов водоемов г. Гомеля могут
достигать 14 раз и более раз.
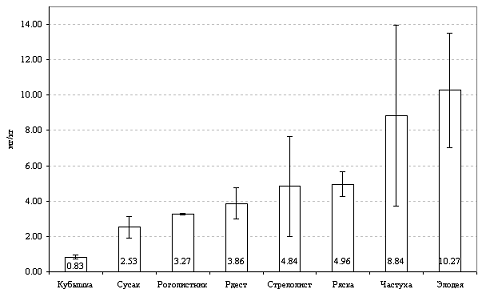
Рисунок 3 Содержание свинца в тканях различных
видов водных растений, обитающих водоемах г. Гомеля
В целом, по результатам наших исследований,
установлено, что для физиологически необходимых металлов - марганца и меди
свойственны значительные величины их концентраций в исследованных видах
макрофитов. Для свинца, с неустановленной его ролью в обменных процессах,
характерны незначительные уровни содержания в тканях водных растений.
Проведенные нами предварительные исследования
макрофитов водоемов г. Гомеля позволили выявить виды - концентраторы меди,
марганца и свинца. Однако, различия по степени накопления того или иного
элемента у обследованных нами видов растений могут быть вызваны несколькими
причинами: 1) видоспецифичностью, которая основывается на неодинаковой
физиологической потребности видов растений в том или ином элементе; 2)
принадлежностью к разным экологическим группам по типу произрастания; 3)
влиянием условий среды, включающих факты загрязнения водоема тяжелыми
металлами.
3.2 Влияние условий произрастания на
содержание меди, марганца и свинца в макрофитах водоемов г. Гомеля
Для выяснения влияния экологических особенностей
произрастания макрофитов (в соответствии с классификацией, приведенной в
разделе 2.1) на уровень концентрации в них тяжелых металлов, нами произведена
группировка данных по накоплению Cu,
Mn, Pb
растениями четырех экологических групп (табл. 1).
Наибольшей способностью к накоплению меди
обладали плавающие неприкрепленные растения I
экологической группы. Несколько меньшее содержание Cu
обнаружено у подводных и надводных растений III
и IV экологической
группы соответственно. Минимальной концентрацией этого металла характеризовались
плавающие прикрепленные растения II
экологической группы. Для макрофитов этой экологической группы отмечается и
значительно меньшая способность к аккумуляции свинца, иногда не превышающая его
содержания в воде (см. приложение).
Таблица 1 Содержание тяжелых металлов в
макрофитах разных экологических групп водоемов г. Гомеля (мг/кг сухой массы)
|
Экологическая
группа
|
Cu
|
Mn
|
Pb
|
|
I (Ряска малая)
|
0.9-35.2
11.1
|
43-5000
1922.9
|
0.4-7.0
4.3
|
|
II (Кубышка желтая)
|
0.8-4.0
1.9
|
53.7-1040.0
478.1
|
0.5-1.1
0.8
|
|
III (роголистник, элодея
канадская, рдест пронзеннолистный)
|
1.4-18.7
8.1
|
227.5-4840.0
1529.3
|
1.8-15.8
4.9
|
|
IV Стрелолист обыкновенный,
сусак зонтичный, частуха подорож.)
|
0.6-34.5
7.5
|
0.1-804.6
262.1
|
0.3-16.1
2.9
|
В целом, растения IV
экологической группы имеют более низкие значения анализируемых металлов по
сравнению с макрофитами I
и III экологическими
группами. Вероятно, это связано с тем, что микроэлементный состав надводных
растений, которые занимают переходное положение между водными и наземными
видами, значительно меньше определяется качеством вод по сравнению плавающими и
подводными макрофитами.
Интерпретацию данных по накоплению тяжелых
металлов растениями вследствие естественных процессов формирования их
химического состава значительно усложняет воздействие техногенного фактора. В
условиях сильного загрязнения среды обитания содержание и соотношение тяжелых
металлов в разных группах и отдельных видах макрофитов варьирует в широких
пределах при общей тенденции к увеличению концентраций.
Для выяснения роли места обитания в
аккумулирующей способности макрофитов по отношению к тяжелым металлам нами был
проведен анализ содержания меди, марганца и свинца в некоторых видах растений,
произрастающих в водоемах с различной степенью антропогенной нагрузки.
Так, при обследовании ряски малой из водоемов
У-образное, Круглое, Володькино, старица у д. Поляновка и р. Сож отмечено, что
наиболее высокое содержание свинца было отмечено у растений, отобранных из
озера У-образного (табл. 2).
Таблица 2 Содержание тяжелых металлов (мг/кг
сухой массы) в ряске малой
|
Водоем
|
Cu
|
Mn
|
Pb
|
|
Оз.
У-образное
|
14.0
|
2000.0
|
7.0
|
|
Cтарица р. Сож
|
12.4
|
5000.0
|
2.6
|
|
Оз.
Круглое
|
3.6
|
1400.0
|
3.0
|
|
Оз.
Володькино
|
6.6
|
1200.0
|
5.6
|
|
Р.
Сож
|
35.2
|
2860.0
|
5.9
|
В воде озера содержание металла было невысоким,
однако в донных отложениях данного водоема зафиксированы максимальные
количества элемента из всех обследуемых водоемов (см. приложение). Поскольку
свинец, как правило, связан с макрочастицами взвеси [26],
то в этом случае растения могли аккумулировать металл не из водных масс, а
адсорбируя взвешенные частицы. Высокими концентрациями свинца характеризовались
также растения озера Володькино и реки Сож, где в донных отложениях количество
металла были незначительными, а в водных массах они достигали высоких
концентраций. Можно сделать вывод, что растения, обитающие в этих водоемах
накапливали свинец непосредственно из водной среды. Необходимо иметь в виду,
что металлы находятся в растворенном виде или адсорбированы на частицах взвеси
в зависимости от условий окружающей среды. Озеро У-образное несет более высокую
антропогенную нагрузку, так как со всех сторон окружено автотрассами. Этим,
вероятно, можно объяснить нахождение свинца в водоеме во взвешенном состоянии,
а в двух других водоемах (озеро Володькино и река Сож) - в растворенном.
Минимальные и практически одинаковые количества свинца были определены у
растений из озера Круглого и старичного комплекса реки Сож у д. Поляновка. Вода
и донные осадки старицы не были загрязнены данным металлом, а в озере
отмечались довольно высокие концентрации свинца и в илах и в водных массах. Это
можно объяснить тем, что старица у д. Поляновка не несет высокой антропогенной
нагрузки, а озеро Круглое принимает стоки предприятия «Электроаппаратура» и
находится рядом с оживленной автотрассой железнодорожной линией.
Концентрация марганца у ряски малой в
зависимости от места произрастания колеблется в пределах от 1200 до 5000 мг/кг
сухой массы. Наиболее высоким содержанием этого металла обладали растения в
старичном комплексе р. Сож у д. Поляновка, хотя в воде и донных осадках не было
отмечено высоких концентраций Mn.
Высокими значениями микроэлемента характеризовались растения из р. Сож и озера
У-образного. Практически одинаковые количества марганца содержались у растений
из озер Круглого и Волотовского, в донных отложениях которых отмечаются высокие
значения элемента. Минимальное содержание соединений марганца было отмечено у
растений, произрастающих в озере Володькино.
Максимальная концентрация меди выявлена в ряске
из реки Сож. На следующем месте по накоплению меди находятся растения из озера
У-образного, в воде и донных отложениях которого наблюдаются значительные
количества этого элемента. Более низкие показатели накопления меди имели
растения старицы, водоема с минимальным содержанием металла в воде и донных
осадках. Образцы растений из озер Володькино и Круглое содержали минимальное
количество меди.
Таким образом установлено, что наиболее сильно
выраженной аккумуляцией анализируемых металлов обладали растения,
произрастающие в реке Сож. В то же время воды и донные осадки реки не
отличались заметным загрязнением свинцом, медью, марганцем. Возможно факт
наличия экстремальных концентраций металлов у растений может быть связан с
особенностями гидрологического режима данного водоема (высокая степень
проточности) и следовательно активацией процесса взаимодействия
«организм-среда». В таблице 3 представлены данные по содержанию определяемых
металлов в другом виде водных макрофитов, а именно в растениях рдеста
пронзеннолистного, произрастающего в озерах Шапор, Любенское, Круглое,
Володькино и в реке Сож.
Таблица 3 Содержание тяжелых металлов (мг/кг
сухой массы) в рдесте пронзеннолистном
|
Водоем
|
Cu
|
Mn
|
Pb
|
|
Оз.
Шапор
|
5.4
|
1200.0
|
4.0
|
|
Оз.
Любенское
|
4.0
|
1240.0
|
4.7
|
|
Оз.
Круглое
|
1.4
|
1320.0
|
|
Оз.
Володькино
|
4.4
|
440.0
|
2.6
|
|
Р.
Сож
|
4.7
|
3315.0
|
3.9
|
Установлено, что концентрация свинца и меди у
растений из водоемов Шапор, Любенское, Володькино и Сож варьирует
незначительно. Однако концентрация анализируемых металлов в поверхностных водах
и донных отложениях водоемов различается в большей степени. Вследствие этого,
сходные величины накопления Pb
и Cu возможно
обусловлены влиянием факторов иной природы. Это положение косвенно
подтверждается тем, что хотя в воде и донных осадках озера Круглого были
выявлены наиболее высокие концентрации Pb
и Cu, у растений
данного водоема содержание металла было минимальным.
Марганец интенсивно поглощался рдестом,
произрастающим в реке Сож, где донные илы и водные массы также не
характеризовались высокими концентрациями металла по сравнению с другими
водоемами. В месте с тем, в оз. Володькино, которое по сути является
расширением русла реки, в тканях рдеста отмечается минимальное содержание этого
элемента. В связи с этим, при применении макрофитов в качестве биоиндикаторов
необходимо учитывать, что значительное содержание какого-либо элемента в
растении не всегда является следствием высоких концентраций этого загрязнителя
среде обитания.
Таким образом, на уровень накопления тяжелых
металлов в водных растениях действует комплекс различных факторов (как
средовые, так и физиологические особенности самих растений), которые следует
принимать во внимание при оценке состояния водных экосистем.
Заключение
Анализ содержания меди, марганца и свинца в
макрофитах водоемов г. Гомеля выявил значительную вариабельность их
концентраций. В определенной мере это обусловлено видовыми особенностями
накопления микроэлементов. Из восьми обследованных видов макрофитов
концентраторами меди являются частуха подорожниковая, роголистник, ряска малая,
стрелолист обыкновенный. Марганец избирательно накапливали роголистник и ряска
малая. Максимальный уровень аккумуляции свинца отмечен у элодеи канадской и
частухи подорожниковой. В целом различия по накоплению Cu,
Mn, Pb
отдельными видами макрофитов в водоемах г. Гомеля составляют от 7-8 раз для
меди и марганца, до 14 раз для свинца.
В результате наших исследований, выявлено, что
для физиологически необходимых металлов - марганца и меди свойственны
значительные величины их концентраций в исследованных видах макрофитов. Для
свинца, с неустановленной его ролью в обменных процессах, характерны
незначительные уровни содержания в тканях водных растений.
При анализе параметров накопления тяжелых
металлов растениями различных экологических групп установлено, что содержание Pb,
Cu и Mn
достигает максимума у растений I
и III экологических
групп.
Сопоставление данных по содержанию Pb,
Cu и Mn
в поверхностных водах и донных отложениях исследуемых водоемов с концентрациями
этих элементов в ряске малой и рдесте пронзеннолистном показало, что
максимальное содержание металла в растении не всегда является следствием
высоких концентраций загрязнителя среде обитания.
Список
использованных источников
.Алексеев
Ю.В. Тяжелые металлы в почвах и растениях. - Л.: Агропромиздат, 1987.-142 с.
.Ильин
В.Б. Тяжелые металлы в системе почва - растение. - Новосибирск: Наука,
1991.-151 с.
3.Albert
A. Biochem I., 1953.-Vol. 59.-Р.646-654.
4.Неорганическая
биохимия / Под редакцией Г.Эйхгорн.- М.: Мир, 1978.-т. 1,2.-1447 с.
.Власюк
П.А., Климовицкая З.М. Физиологическое значение марганца для роста и развития
растений.- М.: Колос, 1969. - 164 с.
.Бобко
Е.В., Саввина А.Г. Значение молибдена для развития растений //Избранные
сочинения.-М.:Сельхозиздат,1963 - с. 353-359.
.Школьник
М.Я. Микроэлементы в питании растений. // Физиология сельскохозяйственных растений.-М.:
МГУ, 1967.- т.2.-с. 401-411.
.Власюк
П.А. микроэлементы в обмене веществ растений.- Киев: Навукова думка, 1976.-154
с.
.Чернавина
Е.А. Физиология и биохимия микроэлементов. - М.: Высшая школа, 1970.-389 с.
.Школьник
М.Я. О физиологической роли микроэлементов у растений.// Микроэлементы в жизни
растений и животных / Под ред. А.П. Виноградова.-М.: Ак. наук СССР, 1952.-с.
39-54.
.Лукина
Н.В. Сезонная динамика химического состава хвои и сосны обыкновенной на
Кольском полуострове // Лесоведение, 1996.-№1.-с.41-53.
.Чернаская
Н.М. Физиология растительных организмов и роль металлов.-М.: МГУ, 1989.-157 с.
.Слепняк
Э.И. Фитогигиена, загрязнение растений и мониторинг состояния окружающей среды
//Загрязнение атмосферы, почвы, природных вод и растительности.-М.:
Гидрометеоиздат, 1983.- с. 35-43.
.Мур
Д.В., Рамамурти С. Тяжелые металлы в природных водах. Контроль и оценка
влияния.-М.: Мир, 1987.-285 с.
.Вахмистров
Д.Б. Исследование механизмов поглощения солей растениями: (Обзор). - Агрохимия,
1968. - т.1. - с. 151-163.
16.Dogar
M.A., Tang Van Hai / Effect of increasing zinc concentration in nutrient
solution on growth and cinetica of zinc uptake by rice//
Z.Pflanzenhysiol.,1979.-vol. 93, №3.-Р.
207-217.
.Ковалевский
А.Л. О поглощении химических элементов растениями из твердой, жидкой и
газообразной фаз внешней среды//Физиология и продуктивность растений в
Забайкалье. - Улан-Уде: Бурят. кн. изд-во, 1977.-с. 163-1744.
.Кларксон
Д. Транспорт ионов структура растительной клетки.-М.:Мир, 1978.-368 с.
.Тарабрин
В.П. Устойчивость растений к промышленному загрязнению окружающей среды //
Промышленная ботаника.-Киев: Наукова думка, 1980.-с. 52-109.
.Ильин
В.Б., Степанов М.Д. О фоновом содержании тяжелых металлов в растениях // Изв.
Сиб. отд-ния АН УССР. Сер. биол. наук, 1981.- вып.I, №5.-с. 26-31
.Черных
Н.А., Овчаренко М.М. Тяжелые металлы и радионуклиды в биогеоценозах. - М.:
Агроконсалт, 2002. - 198 с.
.Распопов
И.М. Высшая водная растительность больших озер Северо-Запада СССР. - Л.: Наука,
1985. -200 с.
.Гигевич
Г.С., Власов Б.П. Мониторинг высшей водной растительности как метод контроля за
трансформацией природной среды / Сб.: Природопользование в условиях
дифференцированного антропогенного воздействия. - Минск: Sosnowies, 2000. - с.
186-192.
.Фокин
А.Д., Лурье А.А. Биофильность и ксенобиотичность как факторы корневого
поступления и распределения элементов по органам растений // Экология. - 1996.
- №6. - с. 415-419.
.Диклева
Д., Петрова М.А. Химический состав макрофитов и факторы, определяющие
концентрацию минеральных веществ в высших водных растениях //
Гидробиологические процессы в водоемах / Сб. статей под ред. Распопова И.М. -
Л.: Наука, 1983. - с.116-205.
.Микрякова
Т.Ф. Содержание тяжелых металлов в макрофитах Шекснинского плеса Рыбинского
водохранилища.//Биология Внутренних вод.-Л.:Наука, 1990. - №87.- с. 31-34.
.Коженкова
С.Н., Христофорова Н.К., Чернова Е.Н. Долговременный мониторинг загрязнения
морских вод северного Приморья тяжелыми металлами с помощью бурых водорослей //
Экология-2000.-№3.- с. 233-237.
.Микрякова
Т.Ф. Особенности накопления меди роголистником // Биология внутренних
вод.-Л.:Наука, 1989.-№ 81 - с. 47-49.
.Микрякова
Т.Ф. Сезонное распределение химических элементов в частухе подорожниковой и
стрелолисте обыкновенном // Экология.-2001.-№4.-с. 310-312.
.Вадзе
Дз. Р., Илзинь А.Э., Лейнерке М.П. Содержание микроэлементов в некоторых
макрофитах из озер Рушону, Илзес-Геранимовас и Питель Латвийской ССР //
Микроэлементы в гидробионтах и вопросы психофизиологии. - Рига:
Редакц.-издат.отдел ЛГУ, 1972. - Т.176. - с. 91-104.
31.Ozimek
T. Heavy metals content in macrophytes from ponds supplied with Post-Sewage
water. Heavy metals in water organisms // Simposia Biologica
Hungarica.-1985.-Vol. 29. - P.41-50.
32.Микрякова
Т.Ф. Тяжелые металлы в высших водных растениях Горьковского водохранилища //
Водные ресурсы. - 1996. - т.23, №2. - с.234-237.
.Физико-химические
методы анализа. Практическое руководство: Учебное пособие для вузов / Под
редакцией В.Б. Алесковского. - Л.: Химия, 1998. - 376 с.
Приложение
Таблица. Содержание тяжелых металлов в
поверхностных водах водоемов г. Гомеля, мг/л
|
Водоем
|
Металл
|
|
Cu
|
Mn
|
Pb
|
|
Гребной
канал
|
0.01700
|
0.16
|
0.00177
|
|
Оз.
Володькино
|
0.02170
|
0.18
|
0.00236
|
|
Оз.
Волотовское
|
0.01760
|
0.18
|
0.00324
|
|
Оз.
Дедно
|
0.16
|
0.00310
|
|
Оз.
Круглое
|
0.01390
|
0.11
|
0.00339
|
|
Оз.
Любенское
|
0.02580
|
0.15
|
0.00354
|
|
Оз.
Малое
|
0.01800
|
0.14
|
0.00369
|
|
Оз.
У-образное
|
0.02370
|
0.21
|
0.00177
|
|
Оз.
Шапор
|
0.01360
|
0.09
|
0.00265
|
|
Р.
Сож (д. Ченки)
|
0.01970
|
0.13
|
0.00177
|
|
Р.
Сож (д. Кленки)
|
0.04270
|
0.10
|
0.00531
|
|
Старица
(д. Поляновка)
|
0.01220
|
0.10
|
0.00177
|
Таблица. Содержание тяжелых металлов в донных
отложениях водоемов г. Гомеля, мкг/кг
|
Водоем
|
Металл
|
|
Cu
|
Mn
|
Pb
|
|
Гребной
канал
|
19.60
|
490.00
|
19.60
|
|
Оз.
Володькино
|
6.93
|
297.00
|
11.88
|
|
Оз.
Волотовское
|
22.54
|
666.40
|
24.50
|
|
Оз.
Дедно
|
13.86
|
198.00
|
17.82
|
|
Оз.
Круглое
|
126.10
|
582.00
|
97.00
|
|
Оз.
Любенское
|
14.55
|
824.50
|
17.46
|
|
Оз.
Малое
|
73.80
|
336.20
|
49.20
|
|
Оз.
У-образное
|
368.00
|
276.00
|
|
Оз.
Шапор
|
13.44
|
240.00
|
12.48
|
|
Р.
Сож (д. Ченки)
|
13.72
|
1470.0
|
14.70
|
|
Р.
Сож (д. Кленки)
|
19.60
|
15.68
|
10.78
|
|
Старица
(д. Поляновка)
|
4.95
|
297.00
|
6.93
|