Свойства газов и газовых смесей, применяемых для водолазных спусков
Контрольная
работа
Свойства
газов и газовых смесей применяемых для водолазных спусков
Основные свойства газов
Для нормального существования человека
необходимы вода, пища, определенные температурные условия и, конечно, воздух
при давлении близком к атмосферному.
Пребывание человека в водной среде, которая по
своим физическим свойствам существенно отличается от воздушной, невозможно без
снаряжения, защищающего его тело от воздействия водной среды и обеспечивающего
выполнение основных жизненных функций. Следовательно, подводному пловцу
необходимо знать физические свойства как воды, так и воздуха, а также
особенности их влияния на организм человека при повышенном давлении.
Знание законов газовой динамики и гидродинамики,
представление о физиологии человека при пребывании в несвойственных ему
условиях позволяют правильно решить многие вопросы, связанные с безопасной
эксплуатацией подводного снаряжения, понять устройство и принцип действия
акваланга, избежать травматизма и несчастных случаев под водой.
Физико-химические и физиолого-гигиенические
характеристики газов и дыхательных газовых смесей, применяемых для водолазных
спусков на глубины до 60 м
Для спусков водолазов на малые и средние глубины
используются кислород, 40%-ная кислородно-азотная смесь (40% КАС) и воздух.
Кислород применяется в снаряжении с замкнутой схемой дыхания для проведения
спусков на глубины до 20 м и в барокамере под давлением до 2 кг/см2 (20 м
вод.ст.). 40% КАС используется для спусков на глубины до 40 м в снаряжении с полузамкнутой
или открытой схемой дыхания, а также в некоторых образцах снаряжения с
замкнутой схемой дыхания. Воздух применяется для спусков в вентилируемом
снаряжении и в снаряжении с открытой схемой дыхания (рабочие спуски на глубины
до 60 м и спуски в аварийных ситуациях на глубины до 80 м), а также для спусков
в барокамере (тренировочные спуски и лечебная рекомпрессия) под давлением до 10
кгс/см2.
Физико-химические и физиолого-гигиенические
характеристики воздуха
Историческая справка.
Древнегреческий философ Анаксимен (VI век до
н.э.) считал среди всех четырех «первоэлементов» (воды, огня, воздуха и земли)
первоначалом воздух, который бесконечен, вечен и подвижен: сгущаясь, он
образует облака, затем воду и, наконец, твердые тела.
Величайший ученый древности Аристотель (384-322
гг. до н.э.) высказал предположение, что воздух обладает массой, но не смог это
доказать. Он ввел понятие «атмосфера» (по-гречески «атмос» - пар или дыхание,
«сфера» - шар). В русский язык этот термин ввел М.В.Ломоносов.
Первые указания на то, что не весь воздух, а
лишь его «активная» часть поддерживает горение, имеются в китайских рукописях
VIII века.
В 1260 г. английский философ и
естествоиспытатель Роджер Бэкон указал, что горение тел в закрытых сосудах
прекращается из-за отсутствия воздуха.
Леонардо да Винчи (1452-1519) рассматривал
воздух как смесь двух газов, лишь один из которых расходуется при горении и
дыхании.
В 1560 г. Джиовани Баптиста ставил в Неаполе
опыты, опровергавшие представления о невесомости атмосферы, однако, опасаясь
инквизиции, он отказался от своих «еретических воззрений».
Галилео Галилей (1564-1642) взвесил воздух,
доказав, что он обладает массой. Галилей установил, что сосуд со сжатым
воздухом весит больше, чем с воздухом при обычном давлении. Он впервые высказал
мысль о том, что воздух оказывает давление на поверхность Земли, применил закон
Архимеда к воздуху, хотя ошибся в расчете плотности воздуха.
В 1620 г. голландский естествоиспытатель Ян
Батист ван Гельмонт, изучая продукты горения, обнаружил пары, напоминающие
воздух, но тем не менее отличающиеся от него. Он назвал их «хаосом», что,
согласно фламандскому фонетическому строю, произносится как «газ». Этот термин
объединяет в настоящее время все вещества, находящиеся в воздухообразном, т.е.
газообразном, состоянии материи. До Яна Гельмонта единственным известным
воздухообразным веществом был сам воздух.
В 1643 г. итальянский физик и математик
Эванджелиста Торричелли показал, что воздух поддерживает столбик ртути высотой
28 дюймов (760 мм рт.ст.), причем высота столбика ртути не зависит от формы и
размеров трубки, а, следовательно, определяется не весом ртутного столбика, а
давлением у его основания. Так был изобретен барометр, открыто существование
атмосферного давления и вакуума. Выяснилось, что газы имеют массу, но их
плотность меньше, чем у жидких и твердых веществ. Торричелли заметил, что мы
живем на дне воздушного океана.
В 1654 г. немецкий физик Отто фон Герике впервые
публично в присутствии императора Фердинанда III продемонстрировал в Магдебурге
существование атмосферного давления. Из медного шара, состоящего из двух полых
полушарий, был выкачан воздух. С обеих сторон полушарий было впряжено по 8
лошадей. С первой попытки они с трудом разделили полушария, а после более
тщательной откачки воздуха разъединить полушария уже не удалось.
В 1660-1662 гг. выдающийся английский ученый
Роберт Бойль обратил внимание на то, что, чем сильнее сжимают воздух в закрытом
сосуде, тем сильнее он сопротивляется сжатию. Это явление Бойль назвал
«пружинистостью воздуха» и сформулировал первый газовый закон (зависимости
объема и давления газа), который через 16 лет был заново открыт французом Эдмом
Мариоттом. Бойль также создал первую барокамеру и объяснил принцип ее действия.
Он установил, что в разреженной атмосфере процессы дыхания и горения
значительно слабее.
В 1703 г. немецкий химик и врач Г.Э.Шталь
предложил «флогистонную теорию», объяснявшую процесс горения выделением из тел
особого, невидимого и невесомого вещества - флогистона («начала горючести»), а
в 1723 г. детально развил представление об этом веществе.
В 1748 г. М.ВЛомоносов написал труд «Опыт теории
упругости воздуха», в котором он объяснил упругость газов движением их частиц.
В 1754 г. шотландский химик и физик Джозеф Блэк
впервые показал, что воздух не является простым веществом или элементом, как
считал Р.Бойль, а состоит из собственно воздуха и углекислого газа.
В 1756 г. М.В.Ломоносов произвел опыты по
обжиганию металла в закрытом сосуде, в результате которых опытным путем доказал
сохранение вещества при химических реакциях и отметил роль воздуха в процессе
горения. Наблюдаемое при обжигании увеличение массы металлов он объяснил
соединением их воздухом. М.В.Ломоносов отказался от теории «флогистона»,
исключив его из числа химических агентов.
В конце XVIII века исследование газов приобрело
широкий размах и даже составило новое направление, названное «пневматической
химией». В 1771 г. шведский химик и аптекарь Карл Вильгельм Шееле путем
прокаливания селитры и других веществ получил «огненный воздух» (кислород), в
котором все предметы горели ярче. В 1774 г. независимо от него английский химик
и философ Джозеф Пристли, нагревая оксид ртути, вновь открыл кислород,
названный им «дефлогистированным воздухом». Пристли отметил, что этот газ
активно поддерживает горение, дает приятные ощущения при дыхании им
(«чувствовал себя легко и свободно»), но обнаружил, что животные, помещенные в
среду данного газа, заболевают и гибнут.
В 1772 г. шотландский химик Даниэль Резерфорд
сжигал на воздухе под стеклянным колпаком «углистые вещества», а образующуюся
СО2 связывал раствором едкой щелочи. Он нашел, что остающийся газ не
поддерживает горения и дыхания. По поручению Д. Блэка Резерфорд поставил
следующий опыт: в замкнутом объеме мышь дышала до смерти, затем там была
зажжена свеча, которая горела до тех пор, пока не погасла. В оставшемся воздухе
горел фосфор. После адсорбции углекислого газа остаток не поддерживал горения.
Этот газ был назван им «мефитическим (удушливым) воздухом». В 1772-1773 гг.
Карл В.Шееле вновь выделил этот газ, названный им «флогистированным воздухом»,
а в 1787 г. А.Лавуазье дал название «азот» - безжизненный.
В 1775-1778 гг. французский физик и химик Антуан
Лоран Лавуазье назвал «дефлогистированный воздух» кислородом, определил, что он
составляет 1/5 часть воздуха, установил жизненную необходимость кислорода для
органического мира на Земле и факт выделения в процессе жизнедеятельности
человека и животных углекислого газа, выяснил роль кислорода в процессах
горения, обжигания металлов и дыхания. Он определил, что процесс дыхания
сводится к окислению органических соединений кислородом. Лавуазье впервые
установил, что при соприкосновении выделенного газа с темной венозной кровью
она превращается в светлую артериальную. Он обнаружил, что зеленые растения
«исправляют» воздух, испорченный дыханием. В дальнейшем Лавуазье и Клод Бернар
установили, что в период пребывания животных в герметичных камерах содержание
кислорода снижается, а углекислого газа возрастает.
В 1781 г. английский физик и химик Генри
Кавендиш определил состав воздуха, а в 1784 г. выпустил книгу «Опыты с
воздухом».
В 1801-1803 гг. английский физик и химик Джон
Дальтон открыл законы парциальных давлений газов и растворимости газов в
жидкостях.
В 1802 г. выдающий французский ученый Жозеф Луи
Гей-Люссак опубликовал второй газовый закон, но настоял на том, чтобы закону
было присвоено имя его соотечественника Жака Шарля, который получил аналогичные
результаты еще в 1787 г., но не опубликовал их.
В 1803г. английский ученый Уильям Генри
установил зависимость количества газа, поглощенного жидкостью, от его давления,
а в 1808 г. открыл зависимость растворимости газов в воде от температуры (закон
Генри).
В 1823 г. издан труд российского гигиениста
И.С.Веселовского «О загрязнениях атмосферного воздуха, вредоносно действующих
на живой человеческий организм».
В 1877 г. французский физик Л.П.Кайэте и
швейцарский химик Амс Пикте впервые получили жидкий воздух.
В 1907 г. английский ученый Г.М.Верной определил
коэффициент растворения азота в жирах и воде.
В 1948 г. Н.В.Лазаревым введен термин
«индифферентные газы» для обозначения элементов 8-й группы инертных газов (Не -
Хе), а также азота и водорода. В 1986 г. термин был уточнен И.А. Саповым,
который назвал их «метаболически индифферентными газами».
Основные физико-химические свойства воздуха
Атмосферный воздух представляет собой смесь
азота, кислорода, углекислого газа, аргона и других газов. Кроме того, в
воздухе всегда содержится некоторое количество водяных паров.
Молекулярная масса сухого воздуха составляет
28,96, плотность - 1,2928 г/л, растворимость в воде - 29,18 см3 при +20°С,
температура кипения - 193°С.
Воздух имеет физические свойства, характерные
для других газов. Газ состоит из молекул, имеющих ничтожные размеры по
сравнению с объемом, занимаемым газом, поэтому расстояние между молекулами
значительно превышает собственные размеры молекул. Силы притяжения между
молекулами крайне малы, в связи с чем при различных расчетах используются
законы (Бойля - Мариотта, Гей-Люссака и др.) и формулы для «идеальных газов», молекулы
которых не обладают силами взаимного притяжения и при столкновении проявляют
только силы упругого удара. Воздух и такие газы, как азот, кислород и гелий,
приближаются к поведению идеальных газов, особенно при малых давлениях и
высоких температурах. Молекулы газов находятся в непрерывном беспорядочном
поступательном движении. Газы не имеют своего объема и формы, а принимают форму
и занимают объем сосуда, в который их помещают. Они равномерно заполняют объем
занимаемого сосуда, стремясь расшириться и занять возможно больший объем. Газы
обладают малым удельным весом. Они имеют большую сжимаемость, поскольку при
сжатии газа уменьшается лишь расстояние между молекулами, а сами молекулы при
этом не сдавливают друг друга, что характерно для жидкостей. Давление газа (его
упругость) является следствием совокупности ударов частиц газа о стенку сосуда.
Среднее давление на единицу площади сосуда во времени практически не
изменяется, поскольку, несмотря на хаотичность ударов молекул о стенки сосудов,
число ударов исключительно велико, а сила единичных ударов очень мала. При
сжатии газы нагреваются, а при расширении охлаждаются. Охлаждение газов
происходит потому, что на их расширение затрачивается работа, а при отсутствии
подвода тепла извне необходимая работа совершается за счет энергии движущихся
частиц газа, в результате чего скорость их движения замедляется и температура
снижается.
|
Наименование
газа
|
Содержание
газов
|
Содержание
газов в сухом чистом воздухе. При расчетах состава воздуха и искусственных
газовых смесей обычно учитываются объемные проценты.
|
|
в
объемных процентах
|
в
массовых процентах
|
|
|
Азот
Кислород Углекислый газ Аргон Другие газы
|
78,084
20,946 0,033 0,934 0,033
|
75,51
23,15 0,046 1,28 0,014
|
|
К другим газам относятся неон (содержание 18,0
мл в 1м3 воздуха = 0,0018 %), гелий (5,2 мл), метан (2,2 мл), криптон (1,0 мл),
закись азота (1,0 мл), водород (0,5 мл), ксенон(0,08 мл) и озон (0,01 мл).
Кроме того, в атмосфере находятся водяные пары,
содержание которых в процентах от объема атмосферы у земной поверхности
составляет от 0,00002% в Антарктиде до 3% в тропиках. В средних широтах
количество водяных паров колеблется от 0,1 до 2,8 % в зависимости от сезона,
климата и погоды. Воздух над океанами обычно близок к насыщению паром
(относительная влажность 80 % и выше), поэтому достаточно небольшой разницы
температур, чтобы пар начал оседать на металлических поверхностях, в жилых и
служебных помещениях на судне.
Все большее значение в последнее время придается
загрязнениям атмосферного воз духа, которые бывают двух видов: естественные (из
космоса и при извержениях вулканов) и антропогенные. Загрязнения подразделяются
на пылевое, газовое, химическое, ароматическое и тепловое. В городах 70-80 %
загрязнений приходится на транспорт. Из загрязнений от промышленных предприятий
34% падает на металлургическую промышленность, 27% - на ТЭЦ, 12% - на нефтяную
промышленность, 9% - на химическую и 7% - на газовую. В последние годы на
первое место по загрязнениям выдвигается сельское хозяйство. В воздухе жилой
среды обнаруживается около 100 веществ, относящихся к разным классам химических
соединений: предельные, непредельные и ароматические углеводороды, спирты,
фенолы, простые и сложные эфиры, альдегиды, кетоны, гетероциклические
соединения, аминосоединения и др.
Азот - химический элемент V группы периодической
системы Менделеева, атомный номер 7, атомная масса 14,0067. Азот широко
распространен в природе. В космосе он занимает 4-е место после водорода, гелия
и кислорода. Живые организмы содержат около 0,3 % азота в соединениях. Азот
состоит из двухатомных молекул (N2) c молекулярной массой 28,016. Представляет
собой бесцветный газ без запаха и вкуса. Плотность равна 1,2506 г/л, плотность
по отношению к воздуху 0,9673. Температура плавления -210,02 °С, температура
кипения - -195,81 °С. Коэффициент растворимости атмосферного азота (вместе с
аргоном и другими инертными газами) в воде при 20 °С составляет 0,016665, а при
38°С он равен 0,0139. Растворимость азота в крови при 38 °С составляет 0,01253.
Азот растворяется в воде вдвое хуже кислорода (при 20 °С в 1 л воды
растворяется 15,4 мл азота и 31 мл кислорода), что определяет отношение
кислорода к азоту в воде 1 : 2, а не 1 : 4, как в воздухе.
По химическим свойствам азот весьма
индифферентен (является в обычных условиях метаболически индифферентным газом).
По прочности молекула азота почти не имеет равных. Чтобы разорвать ее на
отдельные атомы, нужно затратить очень большую энергию. Для вступления в
реакцию требуется воздействие высоких температур, облучения, катализаторов и
др., вследствие чего молекула азота разрывается на атомы и может соединяться с
кислородом (образует окислы азота), с водородом (получается аммиак), с
некоторыми металлами и металлоидами, особенно в присутствии катализаторов. Азот
является одним из биогенных элементов, входит в состав белков и нуклеиновых
кислот.
Кислород - химический элемент IV группы, атомный
номер 8, атомная масса 15,9994. Самый распространенный на Земле элемент (49 %
массы всех элементов в природе), который в виде соединений входит в массу земной
коры, состав воды (88,81 % по массе) и многих тканей живых организмов (около 70
% по массе). Повсеместно распространен в природе. В свободном виде встречается
в двух модификациях: О2 («обычный» кислород) и 03 (озон). 02 - бесцветный газ
без запаха и вкуса с молекулярной массой 32,000. Плотность равна 1,42895 г/л,
плотность по отношению к воздуху 1,033. Температура кипения составляет -182,97
°С. Коэффициент растворимости в воде при 20 °С равен 0,03329, а в плазме крови
при 37 °С - 0,022. Химически самый активный (после фтора) неметалл. В условиях
обычной или высокой температуры кислород поддерживает горение горючих веществ,
непосредственно взаимодействует при окислении, горении, тлении и т.д. с
большинством элементов (почти со всеми веществами, кроме инертных газов, хлора,
брома, йода, некоторых благородных металлов), как правило, с выделением
энергии. При повышении температуры скорость окисления возрастает и может
начаться горение. Животные и растения получают необходимую для жизни энергию за
счет биологического окисления различных веществ кислородом, поступающим в
организм при дыхании. Свободный кислород атмосферы сохраняется благодаря
фотосинтезу растений.
Для дыхания водолазов под водой используется
сжатый воздух, содержащийся в баллонах дыхательного аппарата или подаваемый от
компрессора или водолазной помпы. Сжатый воздух оказывает на организм водолаза
механическое и биологическое действие.
Атмосферное давление и единицы измерения
давления
Механическое давление измеряется силой,
действующей перпендикулярно на единицу поверхности тела:
= F:S,
где Р - давление, кгс/см2 , F - сила, кгс; S -
площадь, см2 .
Согласно закону Паскаля внешнее давление на
жидкость или газ передается во все стороны равномерно. Столб жидкости или газа
создает давление, обусловленное весом этого столба.
В системе СИ за единицу величины давления принят
паскаль (Па), представляющий собой давление, создаваемое силой 1 ньютон (1 Н)
на площадь 1 м 2 (1Н - это такая сила, которая придает телу массой 1 кг
ускорение 1 м/с2 в направлении действия силы). Поскольку паскаль является малой
величиной, для измерения давления чаще пользуются кратными единицами -
килопаскаль (кПа = 103 Па) и мегапаскаль(Мпа = 106 Па).
В водолазной практике пока обычно используются
единица силы «кгс» и единица давления «кгс/см2», кратные метрам водяного столба
(м вод.ст}, что удобно для пользования режимами декомпрессии, предназначенными
для применения как в водной среде (величина давления выражается глубиной
нахождения в метрах), так и в газовой среде барокамеры (давление измеряется по
манометрам, имеющим шкалу в кгс/см2 или в м вод.ст.).
В отдельных случаях (в основном для оценки
физиологических характеристик систем дыхания и кровообращения в нормобарических
и гипербарических условиях) применяется внесистемная единица «миллиметры
ртутного столба» (мм рт.ст., торр). За рубежом нередко применяют единицу
«бар», равную1 . 105 Па = 0,1 МПа ≈ 1 кгс/см2. В англоязычных странах
используется также внесистемная единица фунт на квадратный дюйм (Psi) = 6895
Па. В практике водолазного дела обычно применяются приближенные расчеты и
условно принимается, что кгс/см2 кратна паскалю:
кгс = 9,80665 Н ≈ 10 Н;
кгс/см2 = 9,80665 . 104 Па ≈ 100кПа ≈
0,1 МПа;
Па = 1,019716 . 10-5 кгс/см2 : ≈ 1,02 .
10-4 м вод.ст.;
мм рт.ст. (торр) = 133,322 Па ≈ 0,13 кПа.
Масса воздуха, составляющая атмосферу Земли,
оказывает давление, называемое атмосферным. На широте 45° на уровне моря
имеется нормальное барометрическое давление воздуха, что составляет 1
физическую атмосферу (атм), которая равна 760 мм рт. ст., 1,033 кгс/см2 или
10,33 м вод. ст.
В технике и в водолазной практике за единицу
давления принимается техническая атмосфера (ат), под которой понимается
давление, оказываемое силой 1 кгс на 1 см2 поверхности. Одна техническая
атмосфера равна давлению 10,0 м вод.ст. = 735,6 мм рт.ст.
Соотношение между различными единицами давления
|
Единицы
|
Па
|
Кгс/см2,
ат
|
атм
|
мм
рт.ст.
|
м
вод.ст.
|
|
паскаль
(Па)
|
1
|
1,02
. 10-5
|
0,99
. 10-5
|
750,1
. 10-5
|
1,02
. 10-4
|
|
атм.
технич. (кгс/см2, ат)
|
0,98
105
|
1
|
0,97
|
735,6
|
10,0
|
|
атмосф.
физич. (атм)
|
1,01
. 105
|
1,03
|
1
|
760,0
|
10,3
|
|
торр
(мм.рт.ст)
|
1,33
. 102
|
1,36
. 10-3
|
1,32
. 10-3
|
1
|
1,36
. 10-2
|
|
м.
вод. ст.
|
0,98
. 104
|
0,1
|
0,097
|
73,56
|
1
|
С переходом на систему СИ участилось, в том
числе в медицинской и водолазной практике, употребление множителей и приставок
для десятичных кратных и дольных (положительных и отрицательных) единиц и их
наименований:
газ смесь водолазный спуск
|
Множитель,
на который умножается единица
|
Приставка
|
Обозначение
|
|
|
Русское
|
Международное
|
|
1015
|
пета
|
П
|
P
|
|
1012
|
тера
|
Т
|
Т
|
|
109
|
гига
|
Г
|
G
|
|
106
|
мега
|
М
|
M
|
|
103
|
кило
|
к
|
k
|
|
102
|
(гекто)
|
г
|
h
|
|
101
|
(дека)
|
да
|
da
|
|
10-1
|
(деци)
|
д
|
d
|
|
10-2
|
(санти)
|
с
|
c
|
|
10-3
|
милли
|
м
|
m
|
|
10-6
|
микро
|
мк
|
m
|
|
10-9
|
нано
|
н
|
n
|
|
10-12
|
пико
|
п
|
p
|
|
10-15
|
фемто
|
ф
|
f
|
Примечание. В скобках указаны приставки, которые
допускаются к применению только в наименованиях кратных и дольных единиц, уже
получивших широкое распространение (например, декалитр, дециметр, сантиметр и
др.)
Абсолютное давление
Тело водолаза, находящегося в воде, испытывает
не только атмосферное давление от столба воздуха, но также избыточное давление
массы столба воды. Суммарное давление (атмосферное + избыточное) называется
абсолютным давлением. Оно определяется по формуле:
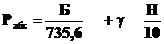 ,
,
где Рабс - абсолютное давление,
кгс/см2; Б - барометрическое давление (давление воздуха на уровне моря), мм
рт.ст.; 735,6 - атмосферное давление,соответствующее давлению 10 м вод.ст.,
выраженное в мм рт.ст.; γ
- удельный
вес (плотность) жидкости, кгс/см3 (кгс/л, в пресной воде γ = 1 кгс/л);
Н - глубина воды, м.
Абсолютное давление используется для
расчетов парциального давления газов, оценки биологического действия газовых
смесей, газовой и водной сред, расчетов запасов газов и газовых смесей,
вентиляции барокамер и др. Режимы декомпрессии и лечебной рекомпрессии
выбираются не по абсолютному, а по избыточному давлению.
Для упрощения расчетов атмосферное
давление считают постоянным и принимают равным 1 кгс/см2. Абсолютное давление в
данном случае выражается формулой:
Рабс = 1 + 0,1Н,
где Н - глубина воды, м.
При спусках в высокогорных условиях
учитывается величина барометрического давления (Б), а при спусках в жидкости с
высокой плотностью глубина спуска определяется с учетом удельного веса жидкости
(γ).
Избыточное давление может
создаваться действием не только столба воды, но и повышенного давления воздуха
или иной газовой среды в барокамере. В этом случае при давлении в барокамере по
манометру 2 кгс/см2, что является избыточным давлением, абсолютное давление
составит 3 кгс/см2.
Парциальное давление
Газы, входящие в состав воздуха или
другой газовой смеси, производят давление независимо друг от друга:
Р = р1 + р2 + ... + рn ,
где р1, р2 , …, рn - давление
каждого газа в отдельности.
Такое давление отдельного газа
называется парциальным давлением. Парциальное давление газа определяется из
выражения Дальтона:
 ,
,
где рг - парциальное давление газа в
смеси, кгс/см2, Рсм - абсолютное давление газовой смеси, кгс/см2; С -
абсолютное давление газовой смеси, %.
В водолазной практике удельное
давление водяных паров, как правило, не учитывается.
Следует, однако, отметить, что из-за
перемешивания поступающего и выдыхаемого воздуха в газовом объеме скафандра
содержание углекислого газа будет несколько выше, а кислорода - несколько ниже
расчетных величин, конкретные величины которых зависят от вентиляции скафандра.
Общее давление газовой смеси всегда
равно сумме парциальных давлений всех газов, входящих в газовую смесь.
Формула справедлива для любых единиц
измерения давления. Исходя из этой формулы, можно рассчитать также объемное или
массовое содержание газов, приведенное к условиям нормального давления, т.е.
характеризующее физиологическое действие газа при повышенном давлении,
соответствующее его действию при нормальном давлении. В этом случае приведенное
значение содержания газа (в %, мг/м3 или в других единицах):
Спр = С . Рсм ,
где Спр - процентное или массовое
содержание газа в смеси, приведенное к условиям нормального давления (%, мг/л,
мг/м3 или др.), С - содержание газа в смеси (%, мг/л, мг/м3 или др.), Рсм -
абсолютное давление газовой смеси (кгс/см2).
Данные расчеты имеют большое
значение, поскольку биологическое действие газов в условиях повышенного
давления определяется именно их парциальным давлением или приведенным к
условиям нормального давления содержанием в гипербарической газовой среде.
Плотность газов
Газы в отличие от жидкостей
характеризуются малой плотностью. Нормальной плотностью газа называется масса
одного его литра при 0°С и давлении 1 кгс/см2. Масса одной молекулы любого газа
пропорциональна его плотности.
Плотность газа ρ изменяется
пропорционально давлению и измеряется отношением массы газа m к занимаемому им
объему V:
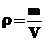
Для практических целей различные
газы удобно характеризовать по их плотности относительно воздуха при одинаковых
условиях давления и температуры. Поскольку молекулы разных газов имеют
различную массу, их плотности при одинаковом давлении пропорциональны молярным
массам.
Плотность газов и отношение их
плотности к плотности воздуха:
|
Газ
|
Химический
символ
|
Молярная
масса М, г/моль
|
Плотность
ρ,
кг/м3
|
Плотность
по отношению к воздуху
|
|
Азот
|
N2
|
28,016
|
l,251
|
0,967
|
|
Аммиак
|
NH3
|
17,032
|
0,711
|
0,597
|
|
Аргон
|
Аr
|
39,944
|
1,784
|
1,380
|
|
Водород
|
Н2
|
2,016
|
0,090
|
0,070
|
|
Воздух
|
-
|
28,98
|
1,293
|
1,000
|
|
Гелий
|
Не
|
4,003
|
0,178
|
0,138
|
|
Кислород
|
|
32,00
|
1,429
|
1,105
|
|
Криптон
|
Кr
|
83,7
|
3,739
|
2,868
|
|
Неон
|
Ne
|
20,183
|
0,900
|
0,696
|
|
Окись
углерода
|
СО
|
28,010
|
1,250
|
0,967
|
|
Углекислый
газ
|
СО2
|
44,010
|
1,977
|
1,529
|
Основные газовые законы
Характерным для газов является то, что они не
имеют своего объема и формы, а принимают форму и занимают объем того сосуда, в
который их помещают. Газы равномерно наполняют объем сосуда, стремясь
расшириться и занять возможно больший объем. Все газы обладают большой
сжимаемостью. Молекулы реальных газов обладают объемом и имеют силы взаимного
притяжения, хотя эти величины весьма незначительны. В расчетах по реальным
газам обычно используют газовые законы для идеальных газов. Идеальные газы -
это условные газы, молекулы которых не имеют объема и не взаимодействуют друг с
другом из-за отсутствия сил притяжения, а при столкновениях между ними не
действуют никакие другие силы, кроме сил упругого удара. Эти газы строго
следуют законам Бойля - Мариотта, Гей-Люссака и др.
Чем выше температура и меньше давление, тем
поведение реальных газов ближе соответствует идеальным газам. При малых
давлениях все газы можно рассматривать как идеальные. При давлениях около 100
кг/см2 отклонения реальных газов от законов идеальных газов не превышают 5 %.
Поскольку отклонения реальных газов от законов, выведенных для идеальных газов,
обычно ничтожны, законами для идеальных газов можно свободно пользоваться для
решения многих практических задач.
Закон Бойля - Мариотта
Измерения объема газа под влиянием внешнего
давления показали, что между объемом V и давлением Р имеется простая связь,
выражающаяся законом Бойля - Мариотта: давление данной массы (или количества)
газа при постоянной температуре обратно пропорционально объему газа:
Р1 : Р2 = V1 : V2,
где Р1 - давление газа при объеме V1; Р2 -
давление газа при объеме V2.
Отсюда следует,что:
Р1 • V1
= P2• V2
или Р • V= const
(при t = const).
Этот постулат формулируется так: произведение
давления данной массы газа на его объем постоянно, если температура не меняется
(т.е. при изотермическом процессе).
Если, например, взять 8 л газа под давлением Р =
0,5 кгс/см2 и менять давление при неизменной постоянной температуре, то будут
получены следующие данные: при 1 кгс/см2 газ займет объем 4 л, при 2 кгс/см2 -
2л, при 4 кгс/см2 - 1л; при 8 кгс/см2 - 0,5л.
Таким образом, при постоянной температуре всякое
повышение давления приводит к уменьшению объема газа, а уменьшение объема газа
- к повышению давления.
Зависимость между объемом газа и давлением при
неизменной температуре широко применяется для различных расчетов в водолазной
практике.
Законы Гей-Люссака и Шарля
Закон Гей-Люссака выражает зависимость объема и
давления газа от температуры: при постоян-ном давлении объем данной массы газа
прямо пропорционален его абсолютной температуре:
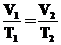
где Т1 и Т2 - температура в
Кельвинах (К), которая равна температуре в °С + 273,15; т.е. 0°С ≈ 273 К;
100 °С - -373 К, а 0оК = -273,15 оС.
Следовательно, всякое повышение
температуры приводит к увеличению объема, или, иными словами, изменение объема
данной массы газа V прямо пропорционально изменению
температуры t газа при постоянном давлении (т.е. при изобарическом процессе).
Это положение выражается формулой:
= V0(l+αt),
где V1 - объем газа при данной
температуре; V0 - исходный объем газа при 0°С; α - коэффициент
объемного расширения газа.
При нагревании различных газов на
одинаковое число градусов относительное приращение объема одинаково для всех
газов. Коэффициент α
является
постоянной для всех газов величиной приращения объема, равной 1/273 или 0,00367
оС-1. Этот коэффициент объёмного расширения газов показывает, на какую часть
объема, занимаемого при 0°С, возрастает объем газа, если его нагреть на 1°С при
постоянном давлении.
Соотношение между давлением и
температурой подчиняется той же закономерности, а именно: изменение давления
данной массы газа прямо пропорционально температуре при неизменном объеме (т.е.
при изохорном процессе: от греческих слов «изос» - равный и «хорема» -
вместимость), что выражается формулой:
Рt = Р0 (1 + αt),
где Рt - давление
газа при данной температуре; Р0 - исходное давление газа при 0° С; α - коэффициент
объемного расширения газа.
Эта зависимость была установлена
Ж.Шарлем за 25 лет до публикации Ж.Л.Гей-Люссака и нередко называется законом
Шарля. Зависимость объема от температуры при постоянном давлении также была
впервые установлена Шарлем.
При понижении температуры газа его
давление убывает, а при температуре -273,15 °С давление любого газа равно нулю.
Эта температура называется абсолютным нулем температуры. При этом прекращается
хаотическое тепловое движение молекул и количество тепловой энергии становится
равным нулю. Приведенные зависимости, выражающие законы Шарля и Гей-Люссака,
позволяют решать важные практические задачи при подготовке и планировании
подводных погружений, такие, например, как определение давления воздуха в
баллонах при изменении температуры, соответствующие ему изменение запасов
воздуха и времени пребывания на данной глубине и т. п.
Уравнение состояния идеального газа
Если зависимость между объемом,
давлением и температурой связать воедино и выразить одним уравнением, то
получается уравнение состояния идеального газа, которое объединяет законы Бойля
- Мариотта и Гей-Люссака. Это уравнение впервые было выведено Б.П.Клайпероном
путем преобразований уравнений, предложенных его предшественниками. Уравнение
Клайперона состоит в том, что произведение давления газа данной массы на объем,
деленное на абсолютную температуру, есть величина постоянная, не зависящая от
состояния, в котором находится газ. Одна из форм написания этого уравнения:
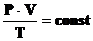
В этом случае газовая постоянная r
будет зависеть от природы газа. Если массой газа является моль
(грамм-молекула), то газовая постоянная R является
универсальной и не зависит от природы газа. Для массы газа, равной 1 молю,
уравнение примет следующий вид:
∙V0 = RT
Точное значение R cocтaвляeт
8,314510 Дж ∙ моль -1 ∙ К-1
Если брать не 1 моль, а любое
количество газа, имеющего массу m, то состояние идеального газа можно
выразить удобным для расчетов уравнением Менделеева - Клайперона в том виде, в
котором оно было впервые записано Д.И.Менделеевым в 1874 г.:
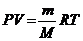 ,
,
где m - масса газа, г; М - молярная
масса.
Уравнение состояния идеального газа
может использоваться для расчетов в водолазной практике.
Пример. Определить, какой объем
занимают 2,3 кг водорода при температуре + 10 °С и давлении 125 кгс/см2
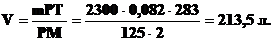 ,
,
где 2300 - масса газа, г; 0,082 -
газовая постоянная; 283 - температура Т (273+10); 2 - молярная масса водорода
М. Из уравнения следует, что давление, оказываемое газом на стенки сосуда,
равно:
Р = mRT
MV
Это давление исчезает или при m → 0
(когда почти исчезает газ), или при V→ ∞ (когда газ неограниченно
расширяется), или при Т → 0 (когда молекулы газа не движутся).
Уравнение Ван-дер- Ваалъса
Еще М. В Ломоносов указывал на то,
что закон Бойля - Мариотта не может быть верен при очень больших величинах
давления, когда расстояния между молекулами сравнимы с их собственными
размерами. Впоследствии полностью подтвердилось то, что отступления от
поведения идеальных газов будут значительны при очень высоких давлениях и очень
низких температурах. В этом случае уравнение идеального газа даст неверные
результаты без учета сил взаимодействия молекул газа и занимаемого ими объема.
Поэтому в 1873 г. Ян Дидерик Ван-дер-Ваальс предложил внести в это уравнение
две поправки: на давление и на объем.
Закон Авогадро
Авогадро выдвинул гипотезу, по
которой при одинаковых условиях температуры и давления все идеальные газы
независимо от их химической природы содержат в единице объема равное число
молекул. Отсюда следует, что масса равных объемов газа пропорциональна их
молекулярной массе.
Исходя из закона Авогадро, зная
объемы исследуемых газов, можно определить их массу и, наоборот, по массе газа
узнать его объем.
Законы газовой динамики
Закон Дальтона. Давление смеси газов
равно сумме парциальных (частичных) давлений отдельных газов, составляющих
смесь, т. е. тех давлений, которые производил бы каждый газ в отдельности, если
бы он был взят при той же температуре в объеме смеси.
Парциальное давление газа Pr
пропорционально процентному содержанию С данного газа и величине абсолютного
давления Рабс газовой смеси и определяется по формуле:
= Pa6с С/100 ,
где Pr - парциальное давление газа в
смеси, кг/см2; С - объемное содержание газа в смеси, %.
Проиллюстрировать данный закон
можно, сравнив смесь газов в замкнутом объеме с набором гирь различного веса,
положенных на весы. Очевидно, что каждая из гирь будет оказывать давление на
чашу весов независимо от наличия на ней других гирь.
Механическое действие на организм
сжатого воздуха
Механическое действие сжатого
воздуха идентично механическому действию водной среды с той лишь разницей, что
при этом существует только объемное сжатие организма без воздействия
неравномерного по высоте давления, характерного для водной среды.
Разность давлений может создаваться
в газовых полостях организма при изменении давления окружающей газовой среды, а
также в случае прилегания тела к устройствам барокамеры, через которые
происходит выпуск из нее газовой среды. Создающаяся при этом разность давлений
может вызывать травматические поражения прилегающих тканей. Чем больше разность
давлений и меньше механическая прочность тканей, тем раньше проявляются
повреждения и тем сильнее они бывают выражены. Разница давления в 0,5-1 кгс/см2
может привести к чрезвычайно сильным травматическим повреждениям.
В организме человека имеются
полости, содержащие воздух (среднее ухо и придаточные пазухи носа, легкие,
желудочно-кишечный тракт), которые при нормальных условиях сообщаются с
окружающей воздушной средой.
При нарушении проходимости
евстахиевых труб или каналов придаточных пазух носа возникает разность давлений
по обе стороны барабанной перепонки или в воздухоносных полостях по отношению к
окружающему давлению, что может сопровождаться болями и даже травматическими
повреждениями. Опыт водолазных погружений свидетельствует о том, что обученные
и натренированные водолазы с нормальной проходимостью евстахиевых труб и
каналов придаточных пазух носа могут безболезненно перенести скорость повышения
давления до 5 кгс/см2 в минуту и более.
Разность давления в легких по
отношению к давлению окружающей газовой среды может, например, создаться при
произвольной или непроизвольной задержке дыхания в период изменения давления в
барокамере.
В случае повышения наружного
давления воздух, попавший в желудочно-кишечный тракт при глотании пищи и
образующийся при ее переваривании, уменьшается в объеме, что сопровождается
уменьшением окружности живота. Если воздух попадает в желудочно-кишечный тракт
или образуется в нем в период пребывания под давлением, то при последующем его
снижении этот воздух будет увеличиваться в объеме и производить растяжение
желудка и отрезков кишечника, что может сопровождаться болями.
Постоянство уровня воздушной подушки
в скафандре (как правило, у нижнего края грудной клетки) поддерживается подачей
необходимого количества воздуха с поверхности, работой головного травящего
клапана, а также пропускной способностью травящих клапанов рубахи. При
уменьшении объема воздуха в скафандре может возникнуть общий обжим верхней
части тела, а также появляется вероятность падения водолаза на глубину, причем
падение на малых глубинах представляет большую опасность в связи с большим
перепадом давления, так как на этих глубинах объемные изменения газов более
значительны, чем на больших глубинах.
В сжатом воздухе физические
параметры воздуха, такие как плотность, теплоемкость, теплопроводность,
скорость распространения звуковой волны и т.д., изменяются пропорционально
величине давления. В процессе погружений под воду и тренировочных спусков в
барокамере развивается адаптация организма человека к этим необычным для
существования человека условиям.
Влияние сжатого воздуха на функции
анализаторов и речеобразование
В гипербарической воздушной среде в
связи с увеличением ее плотности изменяется скорость распространения звуковой
волны. Известно, что для генерирования звуковой волны необходимо передать
газовой среде периодические, следующие с определенной частотой импульсы сжатия
и разрежения, вызывая в ней продольные колебания плотности, которые
рас-пространяются в форме волн. Звуковые колебания находятся в области частот
20 Гц - 20 кГц. Сила генерируемого звука (связанная с амплитудой колебаний) и
скорость его распространения зависят от основных параметров газовой среды:
давления, плотности и др. Чем больше плотность газовой среды при повышении
давления, тем в большей степени требуется сжимать и разрежать среду, чтобы не
снижалась сила генерируемого звука. Таким образом, происходит демпфирующее
влияние гипербарической среды на процессы звукообразования. Кроме того, при
изменении плотности среды происходит смещение звука по высоте.
Функции слухового анализатора,
связанные с изменением акустических свойств гипербарической газовой среды,
зависят в первую очередь от ее плотности и проявляются в форме обратимого
повышения порогов воздушной проводимости. Эти пороги изменяются пропорционально
величине давления. В воздушной среде при давлении 10 кгс/см2 максимальное
понижение слуха на средних частотах составляет 30-40 дБ.
Ухудшение слухового восприятия при
пребывании человека в гипербарической среде может быть связано не только с
изменением ее акустических свойств, но и с ощущением заложенности в ушах
вследствие затрудненного выравнивания давления или катарального воспаления
верхних дыхательных путей, включая отечность тканей в районе глоточных
отверстий евстахиевых труб. В еще большей мере, чем восприятие звуков в
гипербарической среде, нарушается восприятие речи, особенно в гелиевой среде,
поскольку речевой звукоряд не только транспонируется, но и искажается на низких
частотах.
Изменение плотности и других свойств
гипербарической газовой среды сказывается также на артикуляции. Разборчивость
речевых сигналов по мере увеличения давления понижается на 50% на каждые 6
кг/см2. Резонансная частота голосового тракта, равная в нормальных условиях
150-200 Гц, возрастает как корень квадратный из плотности газа, достигая 350 Гц
при 5 кгс/см2 и 500 - 600 Гц при 10 кгс/см2.
Сохранение речевого общения лиц,
находящихся в условиях гипербарической газовой среды, требует функциональной
перестройки работы речевого аппарата и определенных навыков. При пребывании в
воздушной среде требуется овладеть артикуляцией с более активными движениями
речевого аппарата для образования привычных звуков, их распространения и
создания резонанса. Опытные водолазы стараются не употреблять лишних слов,
четко их произносить, предпочтительно пользуясь стандартным набором команд и
докладов.
При длительном пребывании в
кислородно-азотной среде первичные нарушения функции слухового анализатора
наступают на вторые-третьи сутки экспозиции в форме симметричного повышения
порогов воздушной проводимости в диапазоне звуковых частот 125-2000Гц, а
дальнейшие изменения слуха определяются динамикой развития отитов. В период
длительного пребывания под повышенным давлением происходит переучивание
речеобразования.
Функции зрительного анализатора не
претерпевают выраженных изменений в гипербарической воздушной среде, а после
двухнедельного пребывания под давлением отмечено существенное повышение порогов
периферического зрения.
Определялось изменение вкусовых
порогов: их повышение к сладкому и понижение к кислому. Отдельные случаи
проявления угнетения обонятельного анализатора в гипербарической среде обычно
связаны с гиперемией и воспалением слизистой оболочки носа.
Влияние сжатого воздуха на
центральную нервную систему
Азот воздуха при повышенном давлении
обладает наркотическим действием, клиническая картина которого определяется
величиной его парциального давления и временем воздействия. Начальные изменения
функций центральной нервной системы (ЦНС) проявляются при давлении воздуха 3-4
кгс/см2 характеризуются слабо выраженной эйфорией и снижением внимания без
существенного нарушения умственной и физической работоспособности. С
увеличением давления воздуха до 6 кг/см2 наркотическое действие азота
становится более выраженным, но водолазы обычно продолжают сохранять общее хорошее
самочувствие и почти нормальную работоспособность. При более высоких величинах
давления отмечаются значительное снижение объема и устойчивости внимания,
увеличение времени сенсомоторных реакций и увеличение числа ошибочных действий,
уменьшение количества точных ответов, снижение объема кратковременной и
долговременной памяти, увеличение размашистости движений. Эти изменения
свидетельствуют об ухудшении качественной стороны умственной работоспособности
вследствие нарушения регуляции основных нервных процессов (снижения силы
внутреннего торможения и преобладания возбудительных процессов). При этом
значительно снижается возбудимость центров вегетативной иннервации с
существенным преобладанием тонуса парасимпатического отдела. В ходе
декомпрессии выраженность этих функциональных сдвигов прогрессивно уменьшается,
а после окончания декомпрессии наступает практически полная нормализация, хотя
в исследованиях обнаружено, что полное восста-новление всех показателей
происходит в течение ближайших часов после выхода из барокамеры.
Выраженность симптомов в
значительной мере зависит также от индивидуальной чувствительности,
тренированности к азотному наркозу, функционального состояния организма и т.д.
Учитывая то, что на глубинах до 60 м максимальное парциальное давление азота
составляет 5,6 кгс/см2, при котором проявления азотного наркоза протекают у
тренированных лиц в умеренно выраженной форме, эта глубина считается безопасной
и является предельной глубиной для проведения рабочих водолазных спусков.
С целью поддержания адаптации
организма водолазов к наркотическому действию азота и готовности к работе под
водой с использованием для дыхания сжатого воздуха должны проводиться
тренировки в барокамере под давлением 80 м вод.ст. Лица, допущенные к
медицинскому обеспечению водолазных спусков, для поддержания готовности к
оказанию медицинской помощи в условиях повышенного давления проходят тренировки
в барокамере под давлением до 100 м вод.ст.
Действие на ЦНС повышенного до 2-3
кгс/см2 парциального давления кислорода, содержащегося в воздухе, носит
двухфазный характер. Субъективные ощущения человека в 1-й фазе (фазе активации)
выражаются улучшением самочувствия и памяти. Улучшаются нейрометрические
характеристики и психофизиологические возможности скорости восприятия и переработки
информации, сохраняются или улучшаются сложные формы умственной деятельности и
тонкой координации движений. В частности, уменьшается латентный период
сенсомоторных реакций, возрастают точность воспроизведения заданного мышечного
усилия и скорость переработки информации, улучшаются показатели точности
работы. С 45-60-й минуты наступает противоположно направленная реакция, при
которой активация корковых функций сменяется фазой торможения.
Влияние сжатого воздуха на систему
дыхания
Увеличение плотности сжатого воздуха
оказывает повышенное сопротивление потоку газа в дыхательных путях. Перемещение
в дыхательных путях необходимого для вентиляции легких количества газа
достигается созданием положительных и отрицательных градиентов окружающего
барометрического давления и альвеолярного давления. Вентиляция легких может
меняться от 6-8 до 120 л/мин при очень тяжелой физической нагрузке. Создаваемый
в дыхательных путях конвективный газовый поток имеет сложную структуру,
связанную с геометрией дыхательных путей. Вентиляция легких включает 3 разных
физических процесса: турбулентный и ламинарный конвективные потоки, а также
диффузионный поток. Кроме усилий, затрачиваемых на создание перепадов давления
для перемещения молекул газа (т.е. на преодоление неэластического
сопротивления), усилия дыхательной мускулатуры идут также на преодоление
эластической тяги легких, включающей действие сил поверхностного натяжения
альвеолярной жидкости.
В гипербарических условиях
эластическое сопротивление работе дыхания не претерпевает значительных сдвигов,
однако увеличиваются усилия, требующиеся для перемещения в дыхательных путях
газа, который содержит под давлением большее число молекул. Из всех компонентов
вентиляционного потока наибольшее значение в повышении сопротивления дыханию
имеет турбулентный поток, тогда как ламинарный и диффузионный потоки мало
меняются в гипербарической среде. В результате сопротивление дыханию возрастает
пропорционально повышению плотности с тенденцией к превышению сопротивления за
счет перехода части потока из ламинарного движения в турбулентное.
В связи с повышением сопротивления
дыханию в условиях повышенного давления воздуха в системе внешнего дыхания
развиваются приспособительные реакции по следующей схеме: повышение плотности
газовой среды → повышение сопротивления при перемещении газа в
дыхательных путях → уменьшение вентиляции → задержка СО2 в
организме (повышение парциального давления СО2 в альвеолах и напряжения СО2 в
артериальной крови) → возбуждение дыхательного центра → усиление
работы дыхательных мышц → утомление дыхательной мускулатуры.
Приспособительная реакция внешнего дыхания должна быть направлена на
поддержание необходимого уровня вентиляции при минимальных затратах работы
дыхания.
Практика водолазных спусков, а также
многочисленные данные специальных исследований показывают, что при 5-6-кратном
повышении сопротивления газовой среды люди переходят на ротовое дыхание,
которое становится более редким и глубоким, а дыхательный цикл - более
длительным и плавным. Тем самым система дыхания переходит на новый, более
экономный режим функционирования. Путем такой адаптации дыхательная система
организма получает возможность сохранять необходимую вентиляцию легких в
гипербарических условиях при возрастающем сопротивлении дыхательных смесей, затрачивая
значительно меньше усилий на перемещение газа, чем это требовалось бы при
отсутствии адаптации.
Патологическая реакция системы
внешнего дыхания в гипербарической газовой среде возникает в тех случаях, когда
сопротивление плотной дыхательной смеси возрастает настолько, что превышает
функциональные возможности дыхательной системы даже при запуске всех
приспособительных реакций.
Значительные нарушения внешнего
дыхания у человека в гипербарической среде были выявлены лишь в тех случаях,
когда эффект повышенной плотности суммировался с нагрузкой на дыхательную
мускулатуру, вызванную форсированным дыханием при тяжелой физической работе или
при искусственной гипервентиляции. Наибольшие изменения при повышенной
плотности претерпевает показатель максимальной вентиляции легких.
В исследованиях с применением
тяжелой физической нагрузки в гипербарических условиях недостаточность внешнего
дыхания проявилась в необычной форме. Превалировали не явления гипоксии и
гиперкапнии, а механические обструкционные поражения бронхиального дерева,
напоминающие симптоматику астматических явлений у больных при нормальном
атмосферном давлении. У здоровых испытуемых в гипербарической среде были
установлены феномены «воздушной ловушки» и «динамической компрессии дыхательных
путей». Если возросшее в гипербарической среде экспираторное усилие превышало
давление внутри мелких бронхов, то выход воздуха из альвеолярных пространств
прекращался. В результате этого во время физической работы под давлением 6
кгс/см2 перестает функционировать большинство альвеол.
Динамическая компрессия дыхательных
путей может возникнуть также в нормальных условиях, если вентиляционный поток
увеличивается до 6 л/с и возникает внутригрудное давление до 20-40 мм вод.ст.
При 4-кратном повышении плотности воздушной среды (спуск на глубину 30 м)
динамическая компрессия дыхательных путей возникает в тех случаях, когда
вентиляционный поток достигает 2,8 л/с, а внутригрудное давление - 15 см
вод.ст. Клиническим выражением процесса обструкции является тяжелое состояние, близкое
к обмороку.
Влияние сжатого воздуха на
сердечно-сосудистую систему
У взрослого человека сердце за день
перекачивает около 10 000 л крови. Общая длина кровеносных сосудов в организме
человека - примерно 100 тыс. км. Распределение крови в состоянии покоя: 1/4
общего объема крови - в мышцах, еще 1/4 - в почках, 15 % - в сосудах стенок
кишечника, 10 % - в печени, 8 % - в мозге, 4 % - в коронарных сосудах, 13 % - в
сосудах легких и других органов. За 1 мин через кожу проходит 460 мл крови.
В условиях повышенного давления
воздуха наиболее часто реакция со стороны сердечно-сосудистой системы
проявляется урежением частоты сердечных сокращений, которое может сохраняться
во время декомпрессии и после ее окончания. Наблюдается снижение макси-мального
артериального давления (и повышение минимального, что приводит к уменьшению
пульсового давления. С ростом величины давления газовой среды эти изменения
становятся более выраженными. Часто возникает гипертоническая реакция на
физическую нагрузку, что может свидетельствовать о недостаточном развитии
компенсаторных реакций. Отмечаются также замедление скорости кровотока,
уменьшение объема циркулирующей крови, ударного и особенно минутного объемов
крови, что следует рассматривать как приспособительную реакцию на избыточное
поступление кислорода.
Во время пребывания в
гипербарической воздушной среде и после окончания спуска на электрокардиограмме
выявляются синусовая аритмия, иногда экстрасистолия, некоторые другие
отклонения. Полное восстановление изменений показателей сердечно-сосудистой
системы происходит в течение первых часов или первых двух суток после окончания
спусков.
Многие исследователи считают, что
профессия водолаза связана с повышенным риском «изнашивания»
сердечно-сосудистой системы и развития раннего поражения миокарда в форме
кардиосклероза. Данные освидетельствований водолазов показывают, что эти
опасения небезосновательны, поскольку у водолазов заболевания
сердечно-сосудистой системы встречаются значительно чаще, чем улиц других
профессий.
Влияние сжатого воздуха на систему
пищеварения
Наблюдается также снижение секреции
кишечного сока, сопровождающееся некоторым увеличением его переваривающей силы.
В условиях повышенного давления отмечается некоторое усиление моторной функции
желудочно-кишечного тракта, что выражается повышением тонуса желудка и
кишечника, а также усилением их опорожнения.
При проведении декомпрессии
расширение газов в желудке и кишечнике вызывает усиление перистальтики, а также
явления метеоризма. В связи с этим водолазам в период спусков не рекомендуется
употреблять в пищу продукты, богатые клетчаткой и вызывающие усиленное
газообразование (горох, фасоль, квашеную капусту и др.).
В условиях повышенного давления и
после окончания спуска увеличивается спонтанное желчеотделение при некотором
снижении концентрации желчи.
Выраженность указанных изменений
находится в зависимости от величины давления и продолжительности воздействия, а
их нормализация наступает в течение 2-3 сут после спуска.
Влияние сжатого воздуха на
выделительную систему
Практика водолазных спусков
свидетельствует о том, что в период пребывания под повышенным давлением и в
течение некоторого времени после окончания спуска отмечается усиление диуреза.
Отмечено положительное влияние повторных спусков на адаптацию выделительной
системы к повышенному давлению.
Влияние сжатого воздуха на обмен
веществ и энергии
Снижение газообмена приводит к
изменению транспорта газов кровью, уменьшению потребления кислорода тканями,
замедлению выведения и накоплению СО2 в организме. В свою очередь, это приводит
к угнетению окислительно-восстановительных процессов и появлению в организме
недоокисленных продуктов.
Со стороны углеводного обмена
отмечаются умеренная гипергликемия, значительное увеличение содержания молочной
кислоты. Эти сдвиги связаны в основном с угнетением
окислительно-восстановительных процессов и переходом к анаэробному окислению
углеводов и приводят к значительному снижению энергообмена и физической
работоспособности.
Изменения обмена белков проявляются
некоторым повышением содержания общего белка крови. Увеличивается остаточный
азот крови, существенно уменьшается выделение общего азота с мочой. Это может
свидетельствовать о нарушении окисления белков.
В 1,5-2 раза повышается содержание
общих липидов, в крови появляются свободные жирные кислоты. Холестерин
изменяется разнонаправленно, но чаще в сторону повышения. Значительно
возрастает концентрация билирубина, что свидетельствует о нарушении функции
клеток печени и о повышенном разрушении эритроцитов.
Для водно-солевого обмена в условиях
повышенного давления характерно некоторое уменьшение количества плазмы,
концентрации калия, натрия и кальция в крови, а также увеличение их содержания
в моче, что можно объяснить усилением почечного кровотока.
Изучение витаминного обмена
показало, что при воздействии повышенного давления воздуха уменьшается
экскреция аскорбиновой кислоты, повышается выведение витаминов группы В.
Указанные изменения витаминного обмена свидетельствуют о необходимости
профилактической витаминизации водолазного состава и медицинского персонала,
подвергающихся воздействию повышенного давления.
Теплоемкость газов
Температура является мерой средней
кинетической энергии хаотического движения молекул в макроскопических телах.
Теплоемкость любого вещества
определяется количеством тепла, потребным для нагревания массовой единицы этого
вещества (например, 1 кг) на 1°С (или на 1К). Этот коэффициент называется
удельной теплоемкостью. Теплоемкость тела, рассчитанная на моль вещества,
называется молярной теплоемкостью.
У газов различают теплоемкость при
постоянном давлении (Ср); когда при нагревании увеличивается объем данного
количества газа, и теплоемкость при постоянном объеме (СV); когда
возрастает давление газа.
Теплоемкость данного газа при
постоянном давлении больше, чем его теплоемкость при постоянном объеме: Ср >
СV. Это
зависит от того, что всякий газ, расширяясь, совершает определенную работу. На
это и уходит часть энергии в виде тепла.
Молярная теплоемкость при постоянном
объеме для одноатомных (инертных) газов (гелия, неона, аргона и др.) равна 3
кал (СV = 3
кал/град). Это значит, что для нагревания 1 моля одноатомного газа на 1°С нужно
затратить при постоянном объеме 3 калории. Теплоемкость одноатомных газов при
постоянном давлении равна 5 кал (Ср = 5 кал/град), т.е. для нагревания 1 моля
одноатомного газа на 1°С нужно затратить при постоянном давлении 5 калорий.
Для двухатомных газов (водород,
кислород, азот и др.) теплоемкость при постоянном объеме Cv = 5 кал/град, а при
постоянном давлении Ср = 7 кал/град. Из этого следует различная удельная
теплоемкость разных газов.
Удельные теплоемкости газов
|
Газ
|
Удельная
молярная теплоемкость Сm при 0oС, Ккал/моль.град
|
Удельная
теплоемкость при постоянном давлении СР, ккал/кг.град
|
Удельная
теплоемкость при постоянном объеме СV,
ккал/кг.град
|
Отношение
СР / СV при
температуре 150С, k
|
|
Азот
|
4,95
|
0,251
|
0,179
|
1,4
|
|
Аргон
|
2,98
|
0,125
|
0,075
|
1,67
|
|
Водород
|
4,84
|
3,41
|
2,4
|
1,409
|
|
Воздух
|
6,94
|
0,243
|
0,17
|
1,403
|
|
Гелий
|
3,01
|
1,25
|
0,75
|
1,67
|
|
Кислород
|
4,98
|
0,22
|
0,157
|
0,401
|
|
Углекислый
газ
|
6,72
|
0,245
|
0,188
|
1,3
|
|
Окись углерода
|
4,95
|
0,24
|
0,171
|
1,4
|
В системе СИ теплоемкость измеряется в джоулях
на кельвин (Дж/К), а удельная теплоемкость - в джоулях, деленных на килограмм, умноженный
на кельвин: Дж/(кг . К). Джоуль равен работе силы 1 Н, перемещающей тело на
расстояние 1 м в направлении действия силы.
кал = 4,1868 Дж. Отношение Дж/К равно
теплоемкости системы, температура которой повышается на 1 К при подведении к
системе количества теплоты, равной 1 Дж. Старая единица удельной теплоемкости
переводится в систему СИ следующим образом:
кал/(г . оС) =4,1868 Дж. Отношение Дж/К равно
теплоемкости системы, температура которой повышается на 1 К при подведении к
системе количества теплоты, равной 1 Дж. Старая единица удельной теплоемкости
переводится в систему СИ следующим образом: 1 кал/г(г . оС) = 4, 1868 Дж/(кг .
К). Перевод молярной теплоемкости в систему СИ: 1кал/(моль . °С) = 4,1868
Дж/(моль . К).
Теплопроводность газов
Теплопроводность - это молекулярный перенос
теплоты в сплошной среде, обусловленный наличием градиента температуры. Иначе
говоря, это перенос энергии от более нагретых участков тела к менее нагретым в
результате теплового движения и взаимодействия частиц. В соответствии с законом
Фурье количество переносимой энергии, определяемое как плотность теплового
потока, обычно пропорционально градиенту температуры.
Теплопроводность газов (способность проводить
тепло) характеризуется коэффициентом теплопроводности λ,
ккал /м х ч х град, или ккал/см х с х град.
Значения коэффициента теплопроводности при
нормальном атмосферном давлении
|
Газ
|
λ
∙105
при 0оС, ккал/см х с х град.
|
λ
∙104,
ккал /м ∙ ч ∙ град
|
|
|
при
0оС
|
при
100оС
|
|
Воздух
|
5,80
|
206
|
277,5
|
|
Гелий
|
33,6
|
1065
|
1465
|
|
Азот
|
5,68
|
209
|
264
|
|
Аргон
|
4,0
|
139
|
180
|
|
Водород
|
40,0
|
1500
|
1860
|
|
Кислород
|
5,8
|
212
|
283
|
|
Углекислый
газ
|
3,38
|
119,1
|
186,5
|
|
Окись
углерода
|
5,37
|
198
|
-
|
|
Аммиак
|
5,33
|
190
|
275
|
В системе СИ теплопроводность измеряется в
ваттах на метр-кельвин. 1 Вт/(м∙К) равен теплопроводности вещества, в
котором при стационарном режиме с поверхностной плотностью теплового потока 1
Вт/м2 устанавливается температурный градиент 1 К/м. 1 килокалория на
метр-час-градус = 1,1630 Вт/(м ∙К). 1 килокалория на
сантиметр-секунду-градус = 4,1868 Вт/(м∙К).
По сравнению с жидкостями газы имеют не только
малую теплоемкость, но и малую теплопроводность, поэтому они являются хорошими
теплоизоляторами.
Количество тепла, перенесенное путем
теплопроводности, зависит от температуры, площади, через которую происходит
передача, и времени. Теплопроводность газов возрастает с температурой, но она
не зависит ни от давления, ни от плотности газа. В то же время повышение
давления вызывает некоторое увеличение скорости переноса тепла путем конвекции
(перемешивания газа), что имеет важное значение для водолазной практики.
Теплопроводности различных газов сильно различаются между собой. Например, если
условно принять коэффициент теплопроводности воздуха за единицу, то коэффициент
теплопроводности гелия будет в 6,18 раза больше теплопроводности воздуха.
Высокая по сравнению с воздухом теплопроводность
гелия заставляет применять специальные средства обогрева водолазов, выполняющих
спуски с использованием для дыхания кислородно-гелиевых или
кислородно-азотно-гелиевых смесей.
Влияние сжатого воздуха на тепловое состояние
Организм человека поддерживает постоянную
температуру тела, отличающуюся от внешней среды, на что специально расходуется
энергия метаболических процессов. В плане терморегуляции организм может быть
разделен на две части: сердцевину и оболочку. Сердцевина - это внутренние
органы, ткани и среды, где поддерживается постоянная температура в узком
диапазоне около 37 °С (пределом переносимости холода является снижение
ректальной температуры на 2-3 °С). Оболочка представляет собой кожные покровы,
подкожную клетчатку, мышечный слой, ткани конечностей, где тепло проводится от
центра к периферии по тканям и с током крови, осуществляя тепловой обмен
организма с внешней средой, как правило, холодной. В отличие от кожных покровов
через дыхательные пути происходит не потеря тепла из центрального кровотока, а
кондиционирование - обогрев и увлажнение выдыхаемого воздуха. Тепловой поток
«организм - внешняя среда» является смешанным, постоянные компоненты его
составляют конвекция, включающая теплопроведение (30 % от общих теплопотерь),
тепловая радиация (45 %) и испарение жидкости (25 %). Конвекция, радиация и
испарение с кожных покровов осуществляются непосредственно, а конвекция и
испарение с воздухоносных путей и легких - через посредство акта дыхания. В
обычных условиях дыхательный компонент потери тепла составляет 5-6 % от общих
теплопотерь организма и достигает 104-116 Вт.
В результате повышения охлаждающего действия
гипербарической среды комфортный для условий нормального давления диапазон
температур сдвигается в сторону более высоких значений температуры. В случае
отсутствия мероприятий по нормализации теплового состояния человека (коррекции
температуры гипербарической среды или использования адекватной одежды)
повышение теплопотерь с кожных покровов приводит к снижению температуры, в
первую очередь конечностей. Возрастает градиент температуры кожи и ректальной
температуры, что приводит к повышенному отводу тепла от внутренних органов и
тканей к наружной оболочке. Определенную роль в динамике процесса охлаждения
организма играют развитие жирового покрова, теплопроводность которого в 2 раза
ниже мышечной, и интенсивность реакций периферических сосудов. Охлаждение
внутренних органов существенно нарушает тепловой баланс организма и требует для
согревания включения механизмов повышения теплопродукции. Под давлением
значительно возрастают конвекционные потери с кожных покровов и даже при
подогреве газовой среды, снижающем потери за счет радиации и испарения, общие
теплопотери все же возрастают.
Особые соотношения создаются в дыхательной
системе. Если в нормальной среде потери тепла за счет испарения приближаются к
конвекционным теплопотерям, то в гипербарической среде начинают преобладать
потери тепла конвекцией. Возрастает также общая доля теплопотерь с дыханием.
В ответ на охлаждение организма в
гипербарической среде развиваются приспособительные реакции. Непосредственный
физиологический ответ организма на охлаждение тела - сужение кожных сосудов. В
результате этой реакции создается относительная тепловая изоляция организма от
внешней среды. Механизмы тепловой изоляции развиты неравномерно в разных частях
тела. Первыми реагируют сосуды конечностей, и благодаря тому, что глубокие вены
дублируют поверхностные, беспрепятственный отток крови сохраняется и при спазме
поверхностных сосудов. Сосуды туловища сужаются в меньшей степени, что
обусловливает большую потерю тепла. Сосуды головы практически не сужаются, и
относительна2耀местная потеря тепла здесь самая
большая.
Однако, несмотря на глубокое охлаждение
конечностей при определенных диапазонах температур внешней среды, центральная
масса тела (сердцевина) остается теплой. Если же защитная сосудистая реакция
оказывается недостаточной и температура головы и сердцевины туловища
понижается, то организм может запустить второй приспособительный механизм -
повышенный мышечный термогенез. Возрастает сократительная активность скелетных
мышц, что проявляется в холодовом треморе (холодовой дрожи). Включение
механизма термогенеза приводит к росту обшей теплопродукции организма в 2-5
раз: от 45-70 до 115-175 Вт/м2 . оС.
Развивающиеся процессы направлены на то, чтобы
восстановить общий тепловой баланс организма, компенсируя возросшие теплопотери
через кожные покровы и дыхательные пути.
Растворимость газов в жидкостях
Известно, что всякий газ, приведенный в
соприкосновение с жидкостью, будет в ней растворяться. По закону Генри
растворимость в жидкостях прямо пропорциональна приданной температуре давлению
(при отсутствии химического взаимодействия). Если в жидкости (воде, крови и
т.д.) растворяется одновременно несколько газов, то растворение каждого из них
происходит независимо друг от друга пропорционально величине его парциального
давления в данной газовой среде. Следовательно, растворение газа вжидкости
зависит от величины давления газа над жидкостью. Оно будет происходить до тех
пор, пока давление газа в жидкости не станет равным его давлению над жидкостью.
Кроме того, количество растворенного в жидкости газа и коэффициент
растворимости зависят от химической природы газа и его температуры.
Коэффициентом растворимости называется количество газа (см3), измеренного при
0°С и 760 мм рт.ст., которое может раствориться в 1 см3 (1 мл) жидкости при
данной температуре. Так, например, в 1 см3 воды при давлении кислорода в 1
кгс/см2 и температуре 40°С растворяется 0,0231 см3 кислорода. Поскольку в
атмосферном воздухе содержится около 21 % кислорода (парциальное давление 159
мм рт.ст.), количество кислорода, растворенного в 1 см3 воды в этих условиях
составит:
 см3 в 1 см3 воды.
см3 в 1 см3 воды.
Растворимость газов зависит также от
вида растворителя. Так, например, установлено, что один и тот же газ по-разному
растворяется в воде и в масле. Отношение количества газа, растворенного в
масле, по отношению к его количеству, растворенному в воде, называется
коэффициентом распределения, жиро-водным коэффициентом или по фамилиям авторов
установления этой закономерности - овертон-мейеровским коэффициентом.
Значение коэффициентов растворимости
различных газов и коэффициентов распределения позволяет ориентировочно узнать,
как тот или иной газ может раствориться в различных тканях организма человека,
находящегося в условиях повышенного давления газовой среды.
|
Газ
|
Коэффициент
растворимости (см3/см3) при давлении 1 кгс/см2 и температуре 37оС
|
Коэффициент
распределения
|
|
в
жирах
|
в
воде
|
|
|
Кислород
|
0,120
|
0,029
|
4,1
|
|
Углекислый
газ
|
1,28
|
0,57
|
2,2
|
|
Водород
|
0,040
|
0,013
|
3,1
|
|
Гелий
|
0,015
|
0,09
|
1,17
|
|
Неон
|
0,019
|
0,09
|
2,1
|
|
Азот
|
0,061
|
0,013
|
5,1
|
|
Аргон
|
0,140
|
0,026
|
5,3
|
|
Криптон
|
0,43
|
0,045
|
9,6
|
|
Ксенон
|
1,7
|
0,085
|
20,0
|
Сравнивая коэффициенты растворимости гелия,
азота и аргона, можно видеть, что гелия должно растворяться в жидких средах
меньше, чем азота. Кроме того, гелий в меньшем количестве по сравнению с азотом
переходит из крови в ткани вследствие меньшего коэффициента распределения.
Аргон растворяется в жидкостях вдвое больше азота, еще больше различие их
растворимости в отношении жировой ткани.
Коэффициенты растворимости газов в различных
жидкостях при температуре 38 °С.
|
Раствор
|
Коэффициенты
растворимости
|
|
кислорода
|
углекислого
газа
|
водорода
|
азота
|
|
Вода
|
0,02323
|
0,545
|
0,01620
|
0,01272
|
|
Плазма
крови
|
0,0209
|
0,510
|
0,0153
|
0,0117
|
|
Клетки
|
0,0261
|
0,440
|
0,0145
|
0,0146
|
|
Цельная
кровь
|
0,0230
|
0,470
|
0,0149
|
0,0130
|
Из таблицы следует, что в каждом литре крови при
температуре 38оС и давлении 1 кгс/см2 может раствориться 23 см3 кислорода, 470
см3 углекислого газа, 14,9 см3 водорода, и 13 см3 азота.
С увеличением температуры растворимость газов
уменьшается
|
Температура,
оС
|
Коэффициенты
растворимости в воде
|
|
кислорода
|
углекислого
газа
|
азота
|
|
0
|
0,0489
|
0,0239
|
1,713
|
|
10
|
0,0380
|
0,0196
|
1,194
|
|
20
|
0,0310
|
0,0164
|
0,878
|
|
30
|
0,0262
|
0,0138
|
0,665
|
|
40
|
0,0231
|
0,0118
|
0,530
|
Объем растворенного в организме газа будет
одинаков независимо от того, дышит человек воздухом под давлением 1 или 3
кгс/см2. Массовое же количество газа будет увеличиваться пропорционально
величине давления. Например, ткани, насыщенные азотом в обычных условиях
соответственно его парциальному давлению в атмосферном воздухе, содержат 0,0146
см3 азота на 1 г ткани. При погружении водолаза на глубину 20 м он будет дышать
воздухом под давлением 3 кгс/см2 . Тогда объем газа, растворенный в организме,
сразу уменьшается на 1/3, т.е. до 0,005 см3 на 1 г. Этот дефицит газа будет
пополняться из крови, а в крови - из легких. Такой переход газа будет
продолжаться до тех пор, пока не будет достигнут начальный объем насыщения,
т.е. 0,0146 см3 . В этот момент окажется, что общая масса растворенного азота
(или его объем, приведенный к нормальному давлению) будет в 3 раза больше, чем
при дыхании в условиях нормального давления. Для такого относительно полного
насыщения газом требуется 5-6 ч, хотя процесс насыщения, экспоненциально
замедляясь, продолжается еще 1 - 3 сут. При растворении газа в жидкости объем
ее незначительно увеличивается. При растворении одного объема кислорода или
водорода под давлением 1 кгс/см2 объем воды увеличится на 0,001 часть своего
первоначального объема. При растворении одного объема азота объем воды
увеличится на 0,0015, а углекислого газа - на 0, 0013 первоначального объема.
При уменьшении давления или повышении
температуры газ, растворенный в жидкости и тканях, будет снова выделяться из
нее.
Насыщение и рассыщение организма азотом
При существовании человека в земных условиях
жидкости и ткани его организма насыщены азотом, кислородом, углекислым газом и
в меньшей степени другими газами. При нормальном атмосферном давлении во всех
тканях организма, человека со средней массой тела (70 кг) содержится около 1000
см3 растворенного азота. При повышении окружающего давления, сопровождающемся
ростом парциального давления того или иного индифферентного газа (в частности,
азота), этот газ начинает растворяться в жидких средах и тканях организма.
Растворение газа, иначе называемое процессом насыщения, будет происходить до
тех пор, пока не установится динамическое равновесие между парциальным
давлением данного индифферентного газа в альвеолярном воздухе и напряжением
этого газа в растворенном состоянии в тканях организма. Основу процесса
насыщения составляют физические законы растворимости газа в жидкости, т.е.
коэффициент растворимости газа в жидкости, скорость диффузии, разность (или
отношение) между величиной парциального давления данного газа над жидкостью и
напряжением его в растворе, а также условия контакта газа с жидкостью. Переход
молекул газа в раствор происходит путем обычной диффузии, дополненной активным
физиологическим переносом газа с током крови. Каждый указанный параметр
накладывает отпечаток на интенсивность процесса насыщения во времени и на
количественную сторону этого сложного процесса.
Процесс насыщения организма индифферентным
газом, как и обратный процесс рассыщения, весьма продолжителен. Считается, что
сроки полного насыщения организма могут достигать 2 - 3 сут. Путь, который проделывают
молекулы индифферентного газа из внешней среды в организм при компрессии, может
быть разделен на следующие этапы: альвеолярный воздух → кровь (капилляры
малого круга) → кровь (капилляры большого круга) → межтканевая
жидкость → клеточные элементы. При декомпрессии этот процесс идет в
обратном направлении.
Схематично процесс насыщения организма протекает
в определенной последовательности. Вдыхаемый индифферентный газ, парциальное
давление которого превышает его напряжение в тканях, поступает в легкие,
диффундирует через стенки альвеол, растворяется в артериальной крови,
транспортируется кровью к тканям и через капиллярную стенку диффундирует в
ткань. Освобожденная от избыточно растворенного индифферентного газа кровь по
венозной системе возвращается в легкие, где вновь насыщается индифферентным
газом. Весь процесс насыщения идет путем диффузии индифферентного газа из зоны
более высокого парциального давления в легких в зону более низкого напряжения в
тканях. С каждым новым кругооборотом крови ткани сильнее насыщаются
индифферентным газом и постепенно их насыщение становится равным парциальному
давлению индифферентного газа во вдыхаемой газовой смеси.
В целях предупреждения декомпрессионной болезни
подъем водолазов с глубины на поверхность производится по специальным режимам
декомпрессии.
Режимы составлены таким образом, что скорость
снижения давления во времени обеспечивает в каждый отдельный момент
декомпрессии удержание избыточно растворенного в крови и тканях индифферентного
газа в состоянии пересыщенного раствора без образования газовых пузырьков. При
спусках водолазов с использованием для дыхания сжатого воздуха применяются
режимы декомпрессии.
Продолжительность декомпрессии по указанным
режимам зависит от глубины спуска, времени пребывания водолаза на грунте и
тяжести работы. Чем выше эти показатели, тем продолжительнее время
декомпрессии. В случае кратковременного пребывания водолаза на грунте может
производиться безостановочный подъем на поверхность .
При неадекватно быстрой декомпрессии в организме
может возникнуть декомпрессионная болезнь - комплекс патологических процессов в
результате образования свободного газа в тканях из-за их пересыщения
индифферентными газами.
Глубина погружения и допустимое время пребывания
на грунте при дыхании сжатым воздухом, позволяющие осуществлять безостановочный
подъем со скоростью 6 м/мин
|
Глубина
спуска, м
|
Экспозиция
на грунте, мин
|
|
12
|
360
|
|
15
|
105
|
|
18
|
45
|
|
21
|
35
|
|
24
|
25
|
|
27
|
20
|
|
30-33
|
15
|
|
34-45
|
10
|
|
46-60
|
5
|
Насыщение организма кислородом
При спусках водолазов под воду или в барокамере
с использованием для дыхания воздуха на организм водолаза помимо повышенного
парциального давления азота действует также повышенное парциальное давление
кислорода.
|
Глубина
спуска под воду, м
|
Избыточное
давление в барокамере, кгс/см2
|
Парциальное
давление кислорода в воздухе, кгс/см2
|
Парциальное
давление азота в воздухе, кгс/см2
|
|
0
|
0,0
|
0,21
|
0,8
|
|
10
|
1,0
|
0,42
|
1,6
|
|
20
|
2,0
|
0,63
|
2,4
|
|
30
|
3,0
|
0,84
|
3,2
|
|
40
|
4,0
|
1,05
|
4,0
|
|
50
|
5,0
|
1,26
|
4,7
|
|
60
|
6,0
|
1,47
|
5,6
|
|
70
|
7,0
|
1,68
|
6,3
|
|
80
|
8,0
|
1,89
|
7,1
|
|
-
|
9,0
|
2,09
|
7,9
|
|
-
|
10,0
|
2,30
|
8,7
|
Примечание. При расчетах парциального давления
азота воздуха обычно учитывают суммарное процентное содержание газов в воздухе
за вычетом кислорода (100 - 20,9 = 79%).
Ежеминутно через альвеолы при дыхании воздухом
проходит 250-350 мл кислорода в состоянии покоя и до 4500-5000 мл во время
работы. При пребывании в воздушной среде в условиях нормального давления
насыщение кислородом гемоглобина не достигает 100 %, а колеблется между 90,5 и
99,9 % вследствие шунтирования венозной крови в сосудах легких. Однако
достаточно повысить парциальное давление кислорода во внешней среде на 0,1
кгс/см2 чтобы гемоглобин стал полностью насыщенным кислородом. В процессе
водолазного спуска поступление кислорода в организм происходит не только с
помощью оксигемоглобина, но также за счет значительного дополнительного
физического растворения кислорода в плазме крови. Этот процесс осуществляется в
зависимости от величины парциального давления кислорода в альвеолярном воздухе
(закон Генри - Дальтона). Таким образом, дополнительное поступление кислорода в
организм в гипербарических условиях происходит так же, как и транспорт кровью
индифферентных газов. Однако главным и весьма существенным отличием динамики
распределения кислорода в организме является тот факт, что кислород постоянно
потребляется в клеточных структурах организма и обратно из них в кровь не
поступает (исключение из этого правила возможно в условиях снижения давления).
Известно, что 1 г чистого гемоглобина крови
связывает 1,39 см3 кислорода, превращаясь в оксигемоглобин. При содержании в 1
л крови 150 г гемоглобина в химической связи с ним находится 201 см3 О2, а в 5
л крови -1005 см3. Физически растворенного кислорода в 1 л крови содержится
всего 3 см3 а в 5 л - 15 см3. Учитывая то, что потребление кислорода человеком
в покое составляет 225-250 см3 в 1 мин, физически растворенного кислорода для
его доставки тканям явно недостаточно, а на долю гемоглобина приходится
доставка не менее 210-253 см3 в минуту.
При повышении парциального давления кислорода во
внешней среде изменяется кислородный режим организма. При парциальном давлении
кислорода 3 кгс/см2, т.е. при повышении его содержания во внешней среде в 15
раз по сравнению с воздухом, количество растворенного в плазме кислорода
достигает 6 об.% (15 см3 . 15 = 225 см3), что соответствует артериовенозной
разнице и обеспечивает потребности организма без участия оксигемоглобина,
который перестает диссоциировать. Пребывание в гипероксической среде приводит к
увеличению напряжения кислорода в жидких средах организма: плазма крови -
межтканевая жидкость - внутриклеточная среда. Кислородная емкость жидких сред
увеличивается, поскольку возросший кислородный поток из крови превышает
потребление кислорода в тканях. Венозная кровь артериализуется. Соотношение
поступления кислорода и его потребления в разных тканях организма варьирует
весьма значительно.
Процесс проникновения кислорода из внешней среды
в организм человека физиологически организован посредством систем внешнего
дыхания, кровообращения, крови и тканевого дыхания так, чтобы избежать
кислородного голодания при возможных условиях и формах деятельности организма.
В отличие от гипоксии гипероксия является новым биологическим фактором, не
встречавшимся в филогенезе, и поэтому на избыточное проникновение кислорода не
выработана специальная система регуляции. Ответная неспецифическая реакция,
наступающая в условиях гипероксии, может рассматриваться как результат
отраженной регуляции гипероксии - выключения постоянно действующего в обычных
условиях «гипоксического управления».
Избыточно растворенный кислород, действуя на
сосудистые и тканевые рецепторы, выступает как агент, вызывающий функциональную
денервацию регуляторной системы, заставляя организм довольствоваться одним
«гиперкапническим управлением». Кислород под давлением 2-3 кгс/см2 оказывает не
только рефлекторное, но и прямое угнетающее влияние на дыхательный центр. В
итоге всех воздействий снижается уровень функционирования внешнего дыхания
(урежение и углубление дыхания, снижение легочной вентиляции), общей
гемодинамики (брадикардия, снижение сердечного выброса, сужение сосудов,
повышение периферического сопротивления, уменьшение скорости кровотока,
депонирование крови), регионарной гемодинамики (сужение мозговых сосудов и
замедление кровотока) и системы крови (эритропения, лимфопения). Все эти
сдвиги, а также наступающая артериализация венозной крови приводят к
затруднению выведения углекислого газа, росту его напряжения, а также
содержания водородных ионов в крови, тканях и органах, в том числе в
дыхательном центре. Гиперкапния, в свою очередь, активизирует функцию внешнего
дыхания и гемодинамики, способствуя частичному восстановлению этих функций. Эту
реакцию следует рассматривать как приспособительную, компенсаторную,
направленную на то, чтобы уменьшить гуморальную генерализацию в организме
избыточно растворенного кислорода, выступающего при определенных значениях его
парциального давления как патогенное начало.
При водолазных спусках с использованием для
дыхания воздуха патологическая реакция организма, связанная с действием
повышенного парциального давления кислорода, как правило, не наступает.
Краткая физиолого-гигиеническая характеристика
40%-ной кислородно-азотной смеси
Кислородно-азотная смесь (КАС), применяемая для
дыхания водолазов на глубинах до 40 м, по физическим и физиологическим
показателям идентична сжатому воздуху, за исключением следующего:
• содержание кислорода в КАС составляет
40 %. На глубине 40 м парциальное давление кислорода составляет 2,0 кгс/см2 ,
следовательно, кислород на глубине 40 м будет оказывать более сильное действие
по сравнению со спуском на глубину 60 м при дыхании воздухом;
• содержание азота в КАС составляет 60 %.
На глубине 40 М парциальное давление кислорода составляет 3,0 кгс/см2 ,
следовательно, наркотическое действие азота на глубине 40 м практически не
будет проявляться. В связи с тем, что в КАС содержание азота меньше, чем в
воздухе, продолжительность режимов декомпрессии будет значительно короче, чем
после спусков с использованием для дыхания воздуха. Кроме того, на идентичных
глубинах спуска время пребывания под водой, не требующее проведения
декомпрессии, будет больше, чем при спусках с использованием для дыхания
воздуха. В связи с тем, что на глубине 40 м парциальное давление кислорода
составляет 2 кгс/см2', из-за возможности проявления его токсического действия
на организм водолаза максимальное время пребывания на грунте ограничено 80 мин,
тогда как при спусках на глубину 40 м с использованием для дыхания воздуха это
время составляет 145 мин.
Глубина погружения и допустимое время пребывания
на грунте при дыхании 40 % КАС, позволяющие осуществлять безостановочный подъем
со скоростью 6 м/мин
|
Глубина
спуска, м
|
Экспозиция
на грунте, мин
|
|
21
|
180
|
|
24
|
105
|
|
27
|
60
|
|
30
|
45
|
|
33-36
|
35
|
|
39
|
25
|
|
40
|
20
|
Данные по применению кислорода при водолазных
спусках
Кислород, применяемый для дыхания при спусках на
глубины до 20 м, оказывает действие, подобное тому, которое представлено при
рассмотрении характеристики воздушной среды, с учетом величины его парциального
давления.
Преимущество использования кислорода заключается
в том, что он не требует проведения декомпрессии после спуска. Кроме того, в
снаряжении с замкнутой схемой дыхания кислородом возможно скрытное передвижение
под водой, что важно для спецподразделений военных водолазов. Спуски в этом
снаряжении возможны на необорудованном участке акватории с маломерных,
неприспособленных специально для спусков плавсредств, с использованием
ограниченного перечня средств обеспечения спусков.
К недостаткам применения кислорода для дыхания
водолазов относятся:
• ограничение глубины спусков 20 метрами;
• ограничение времени пребывания на
грунте в связи с возможностью токсического действия кислорода;
• пожаро- и взрывоопасность;
• необходимость весьма тщательной и
достаточно продолжительной подготовки к спуску;
• сложность подготовки и использования
аппарата;
• более высокая опасность по сравнению с
другими типами водолазного снаряжения появления специфических и неспецифических
заболеваний водолазов (баротравмы легких, отравления кислородом и углекислым
газом, кислородного голодания);
• появление сухости слизистых оболочек
верхних дыхательных путей при дыхании кислородом.
Литература
1.
Агаджанян Н. А., Елфимов А. И. Функции организма в условиях гипоксии и
гиперкапнии, М., Медицина, 1986.
.
Алешин И.А., Коц Я.И., Либис P.A. Улучшение качества жизни больных
гипертонической болезнью после адаптации к периодической гипоксии в условиях
барокамеры П Hyp.Med.J. Т. 3, №3, с. 18-20., 1995.
.
Ассовская A.C. Гелий на Земле и во Вселенной. М., Недра, 1984.
.
Беляков Н. А., Сериков В.Б., Рамм М.С. Моделирование стационарного
массотеплообмена в респираторном тракте. // Биофизика 1986, т. 31(5), с.
901-907.
.
Бичев A.A., Чучалин А.Г. Механизмы утомления респираторной мускулатуры. //
Пульмонология,- 1992,- №4,- с. 82-89.
.
Болезни органов дыхания / Руководство для врачей: под общей ред. Н.Р. Палеева.
М.: М., 1989. Т.1, с. 302.
.
Бреслав И.С. Восприятие дыхательной среды и газопрефендум у животных и
человека. Л.: Наука, Ленингр. отделение, 1970.
.
Бреслав И.С., Исаева Г.Г. /Физиология дыхания СПб. Наука, 1994 г.11 .Вольфсон
М.Р. Механика, энергетика дыхания гелием у младенцев с бронхо-легочной
дисплазией. // Педиатрия,- 1984.- №10.- с.752-757.
.
Григорьев А.И., Павлов Б.Н., Логунов А.Т. «Способ подготовки и подачи лечебной
газовой смеси и устройство для его осуществления». Патент РФ № 2146536, 2001.
.
Григорьев И.С., Мейлихов Е.З. Физические величины: справочник. М.,
Энергоатомиздат, 1991.
.
Гриппи М. Патофизиология дыхания. / Пер. с англ. Под ред. Ю.В. Наточина. М.:
БИНОМ, 1997. с. 344.