Синтез твердого оксидного электролита на основе оксидов висмута и лантана методом химического соосаждения
Содержание
Введение
. Литературная часть
.1 Природа ионной проводимости в
твердых телах. Твердые оксидные электролиты
.2 Отклонения от стехиометрического
состава и характер электропроводности ионных соединений
.3 Устройства с твёрдыми оксидными
электролитами
.4 Структура и свойства оксида
висмута (III)
.5 Термический анализ
.5.1 Дифференциально-термический
анализ (ДТА)
.6 Рентгеновский фазовый анализ
. Методическая часть
.1 Исходные материалы и реактивы
.2 Методы исследования
.2.1 Дифференциальный термический
анализ
.2.2 Рентгеновский фазовый анализ
. Экспериментальная часть
.1 Совместное химическое осаждение
висмута и лантана
Выводы
Литература
Введение
Будущее человечества во многом зависит от того,
сможет ли оно обеспечить себя энергией. Уже сейчас налицо признаки обострения
энергетической проблемы. В настоящее время основную часть энергии мы получаем
из ископаемых энергетических ресурсов, которые ограничены. Разработка
высокоэффективных устройств для производства электроэнергии - задача
сегодняшнего дня, а стратегическая задача - создание высокоэффективной
энергетики, основанной на возобновляемых энергоносителях. Значительный, если не
основной, вклад в решение как первоочередной, так и стратегической задачи может
внести электрохимическая энергетика. Это научное направление изучает весь
комплекс проблем, связанных с взаимным преобразованием различных видов энергии
в электрохимических устройствах. Исследования показали, что эффективность
преобразования энергии в этих устройствах, если их основой служат твердые
оксидные проводники с ионной проводимостью, значительно выше, чем у
существующих ныне средств производства электроэнергии [1].
Повышенный интерес к твердым оксидным
электролитам (ТОЭ) проявляется как со стороны теоретического изучения, так и со
стороны их практического применения в ряде областей современной техники. ТОЭ
используются для создания разнообразных электрохимических устройств.
Кислородные ионные проводники занимают особое место в этой группе материалов.
Их используют в качестве кислородопроводящих мембран для топливных элементов, а
также в первичных химических источниках тока.
К числу перспективных ТОЭ принадлежат материалы
на основе оксида висмута. Повышенный интерес к этой группе материалов
обусловлен тем, что они проявляют ионопроводящие свойства в области низких
температур 600¸800 К, в которой использование
других ионных проводников не эффективно. Наиболее эффективный ионный перенос и,
соответственно, высокая кислородная проводимость реализуются в системах со
структурой флюорита типа d-Bi2O3
в присутствии стабилизирующих добавок - оксидов РЗЭ Me2O3
(Me
- Y, La,
Gd, Sc
и т.п.).
Целью данной работы является синтез твердого
оксидного электролита Bi2O3-La2O3
методом химического соосаждения с применением методов дифференциального
термического анализа и рентгеновского фазового анализа [2].
1. Литературная часть
.1 Природа ионной проводимости в
твердых телах. Твердые оксидные электролиты
Электролиты - это те вещества, которые в
растворенном или в расплавленном состоянии проводят электрический ток.
Электролиты - проводники второго рода. Передача тока в них осуществляется
движением положительных и отрицательных ионов, тогда как в проводниках первого
рода - движением электронного газа. Для удобства изучения электролиты делят на
сильные и слабые.
Сильные электролиты при растворении в воде
полностью диссоциируют на ионы. К ним относятся:
) почти все растворимые соли;
) многие неорганические кислоты;
) гидроксиды щелочных и щелочноземельных
металлов.
Слабые электролиты при растворении в воде лишь
частично диссоциируют на ионы. К ним относятся:
) почти все растворимые органические кислоты;
) некоторые неорганические кислоты;
) многие гидроксиды металлов (кроме гидроксидов
щелочных и щелочноземельных металлов) [3].
Так как ионная проводимость большинства твердых
веществ очень мала, то предложено определение, согласно которому твердыми
электролитами называются соединения с σi
≥
10-3 - 10-4 (Ом·см)-1, имеющие преимущественно
ионную проводимость[4].
Кристаллические твердые
электролиты по своей дефектной структуре, определяющей их транспортные
свойства, делятся на три основных класса:
· твердые электролиты
с собственной разупорядоченностью;
· твердые электролиты
с примесной разупорядоченностью;
· твердые электролиты
со структурной разупорядоченностью.
Особенности строения, механизма
проводимости позволяют выделить некоторые твердые электролиты в особые классы:
· аморфные твердые
электролиты.
Рассмотрим приведенные выше
классы.
Твердые электролиты
с собственной разупорядоченностью.
Условие электронейтральности требует, чтобы в
ионном кристалле одновременно присутствовали точечные дефекты, по крайней мере
двух типов, обладающие противоположными знаками эффективных зарядов. В
стехиометрических ионных кристаллах, где отсутствует электронная
разупорядоченность, этому требованию удовлетворяют четыре комбинации точечных
ионных дефектов:
1. Катионные вакансии и катион, внедренные в
междоузлия (дефекты Френкеля). Образование дефектов Френкеля может происходить
в любой области кристалла, когда катион, получив в результате тепловой
флуктуации достаточную энергию, переходит из нормального узла в соседнее
междоузлие, а затем удаляется от образовавшейся вакансии на достаточно большое
расстояние.
2. Анионные вакансии и анионы, внедренные в
междоузлия (антифренкелевские дефекты). Эта комбинация отличается от предыдущей
лишь зарядами дефектов.
. Вакансии в катионной и анионной
подрешетках (дефекты Шоттки). В этом случае ионы, покинув нормальные узлы, не
могут разместится в междоузлиях и выходят на поверхность кристалла, достраивая
кристаллическую решетку.
. Междоузельные катионы и анионы
(антишотткиевские дефекты). В этом случае ионы переходят в междоузлия с
поверхности, в результате чего число узлов решетки уменьшается.
Помимо рассмотренных дефектов,
в твердых электролитах могут возникать так же отклонения от стехиометрического
состава [5].
1.2 Отклонения от стехиометрического
состава и характер электропроводности ионных соединений
Отклонение от стехиометрического состава может
возникать в результате избыточного содержания в соединении
электроотрицательного (неметалла) или электроположительного(металла)
компонента. В первом случае компенсация заряда обеспечивается соответствующим
недостатком валентных электронов - электронными дырками (заряд носителей
положителен, проводимость р-типа), во втором заряд компенсируется
недостатком электронов (заряд носителей отрицателен, проводимости n-типа).
Отклонения от стехиометрического состава вызывают радикальные изменения в
характере проводимости ионных кристаллов, которые, самым тесным образом связаны
с важнейшими физико-химическими характеристиками твердых тел, такими как
диэлектрические, магнитные, диффузионные, термоэлектрические и
электрохимические характеристики, коррозионнозащитные свойства, реакционная
способность и так далее [5].
1.3 Устройства с твёрдыми оксидными
электролитами
Конструкций, в основе которых лежат твёрдые
оксидные электролиты, запатентовано очень много, но принцип их действия
одинаков и довольно прост. Схема электрохимического устройства приведена на
рисунке 1. Это пробирка с парой электродов на стенке, снаружи и внутри. Она
помещена в нагреватель; внутрь пробирки и в пространство, её окружающее, можно
подводить газ.
К таким устройствам относятся:
§ потенциометрические датчики;
§ кислородные насосы;
§ электрохимические насосы;
§ электролизеры;
§ теплоэлектрогенераторы;
§ топливные элементы.
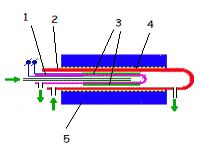
- пробирка из ТОЭ, 2 - корпус, 3 - электроды, 4
- нагреватель, 5 - теплоизоляция, стрелки - потоки газа.
Рисунок 1 - Схема электрохимического устройства
В настоящее время перспективным материалом для
создания твердых оксидных электролитов является оксид висмута Вi2О3,
проявляющий ионопроводящие свойства в области низких температур 600¸800
К, в которой использование других ионных проводников не эффективно [6].
1.4 Структура и свойства оксида
висмута (III)
Вi2О3
- устойчивый в обычных условиях оксид светло-желтого цвета. Оксид висмута
обладает сложным полиморфизмом, довольно инертен, нерастворим в воде, растворах
щелочей и большинства минеральных кислот, хорошо растворим в концентрированных
хлороводородной и азотной кислотах, причем растворение значительно ускоряется
при нагревании. В твердофазных реакциях оксид висмута (III)
очень активен и вступает в реакцию с большинством оксидов металлов уже при
температуре 723 - 823 К с образованием двойных оксидов. Температура плавления
1103 ± 3 К. Получают взаимодействием Bi(NO3)3 с избытком
щелочи. Применяют как вяжущее и антисептическое лекарственное средство, в
производстве эмалей, керамики, фарфора, хрусталя, специальных стекол. Его
используют для получения оксидов типа силленита, напр. силикосилленита Bi12SiO20
(служат материалами элементов линий ультразвуковой задержки, модуляторов света
и др. в акустооптике и электрооптике) и эвлитина, напр. Bi4Si3O12
(материалы чувствительных элементов сцинтилляционных счетчиков). В природе - минерал
бисмит.
Существует оксид висмута в двух стабильных (α
и δ)
и двух метастабильных (β и γ)
модификациях (см. табл.). Для α-Bi2O3:
8,9 г/см3;  114 Дж/(моль・К);
114 Дж/(моль・К);
 -
578 кДж/моль;
-
578 кДж/моль;  -298 151,6
Дж/(мольК); теплопроводность ~ 0,8 Вт/(мК); ρ
(Ом・см);
2,34108 (225°С), 1,44105 (424°С), 6,01103 (650 °С); полупроводник р-типа.
-298 151,6
Дж/(мольК); теплопроводность ~ 0,8 Вт/(мК); ρ
(Ом・см);
2,34108 (225°С), 1,44105 (424°С), 6,01103 (650 °С); полупроводник р-типа.
Полиморфные превращения Bi2O3
сопровождаются выделением или поглощением О2 и поэтому зависят от
давления О2. α-Форма
характеризуется полной занятостью узлов кислородной подрешетки, при нагревании
частично теряет кислород; при ~727°С превращается в δ-форму
Bi2O3-x (x = 0,045-0,37),  перехода
41 кДж/моль; температура плавления 825 С; 8,2 г/см3;
перехода
41 кДж/моль; температура плавления 825 С; 8,2 г/см3;  16,3
кДж/моль. Нагретая в среде кислорода δ-форма
(имеет вакантные узлы кислородной подрешетки) при охлаждении поглощает О2,
а при 635 °С превращается в γ-форму
(Bi2O3+x), представляющую собой твердый раствор кислорода
в Bi2O3. γ-Форма
стабильна при комнатной температуре, обладает пьезоэлектрическими,
электрооптическими и акустооптическими свойствами. При охлаждении нагретой на
воздухе δ-формы
при ~ 646 °С образуется β-форма, которая
при 620-605°С превращается в α-форму.
Увеличение парциального давления О2 повышает температуру этого
перехода и сужает температурный интервал существования β-формы;
она особенно устойчива, когда ее состав отвечает формуле Bi2O2,7-2,8.
После плавления Bi2O3 в среде О2 и
последующего охлаждения образуется только γ-форма.
Влияние примесей некоторых оксидов (например, SiO2, GeO2,
B2O3, ZnO) аналогично влиянию избытка кислорода [7].
16,3
кДж/моль. Нагретая в среде кислорода δ-форма
(имеет вакантные узлы кислородной подрешетки) при охлаждении поглощает О2,
а при 635 °С превращается в γ-форму
(Bi2O3+x), представляющую собой твердый раствор кислорода
в Bi2O3. γ-Форма
стабильна при комнатной температуре, обладает пьезоэлектрическими,
электрооптическими и акустооптическими свойствами. При охлаждении нагретой на
воздухе δ-формы
при ~ 646 °С образуется β-форма, которая
при 620-605°С превращается в α-форму.
Увеличение парциального давления О2 повышает температуру этого
перехода и сужает температурный интервал существования β-формы;
она особенно устойчива, когда ее состав отвечает формуле Bi2O2,7-2,8.
После плавления Bi2O3 в среде О2 и
последующего охлаждения образуется только γ-форма.
Влияние примесей некоторых оксидов (например, SiO2, GeO2,
B2O3, ZnO) аналогично влиянию избытка кислорода [7].
Таблица 1 - Характеристика кристаллических
модификаций Bi2O3
Модификация
|
|
α
|

|
δ
|
γ
|
β
|
|
Цвет
|
Бледно-желтый
|
Бледно-желтый
|
Оранжевый
|
Ярко-желтый
|
Ярко-желтый
|
|
Кристалл.
решетка
|
Псевдо-ромбич.
|
Моноклинная
|
Кубич.
|
Кубич.
|
Тетрагон.
|
|
Параметры
решетки  , нм , нм  ,
нм ,
нм  ,
нм β ,
нм β
|
0,585
0,8166 1,3827 -
|
0,585
0,8166 0,7510 112,95º
|
0,566
- - -
|
1,076
- - -
|
0,385
- 1,225 -
|
Получение материалов с заданным
составом и контролируемыми свойствами возможно при использовании методов
дифференциального термического (ДТА) и рентгеновского фазового (РФА) анализа.
1.5 Термический
анализ
Все термоаналитические методы служат для
изучения свойств веществ и процессов, происходящих в них при нагревании или
охлаждении по заданной программе; они производятся с помощью специальной
аппаратуры, и их основными техническими результатами являются термические
кривые - термограммы (кривые нагрева), которые зависят главным образом от
химического состава и структуры исследуемого объекта.
Химические реакции, физические превращения
сопровождаются всегда изменением внутреннего теплосодержания системы -
поглощением или выделением тепла. Такие теплоэффекты могут быть чувствительно
обнаружены методом дифференциально-термического анализа (ДТА). Во многих
случаях превращения связаны также и с изменением массы, которое может быть, в
свою очередь, с большой точностью определено при помощи термогравиметрического
метода (ТГ). Часто реакции, связанные с потерей массы вещества, следуют близко
одна от другой, частично перекрывают друг друга или протекают при чередующихся
больших и малых изменений массы, при этом термогравиметрические кривые
накладываются и возникает большая трудность в изучении этих процессов. В этом
случае применяют метод деривативной термогравиметрии (сокращено ДТГ).
Комплексные методы термического анализа используются для идентификации и
определения веществ; для определения термических констант; при изучении
кинетики, теплоты фазовых превращений и химических реакций.
Рассмотрим долее подробно сущность метода дифференциально-термического
анализа [8].
1.5.1 Дифференциально-термический
анализ (ДТА)
Самым распространенным и основным методом
термического анализа является дифференциально-термический (ДТА), который
позволяет выявить и исследовать фазовые превращения и химические реакции,
протекающие в веществе при нагревании или охлаждении, по термическим эффектам,
сопровождающим эти изменения. Анализ выполняется с помощью специальной
аппаратуры: пирометров, термических установок и т.д., позволяющей
регистрировать термические кривые (термограммы, кривые нагревания или
охлаждения), т.е. графики, выражающие зависимость температуры выбранной точки в
исследуемом веществе от времени, по заданной программе.
Наиболее существенная часть аппаратов
дифференциально-термического анализа состоит обычно из трех термопар (рисунок
2).
Одной из термопар измеряется температура печи
№3, остальными двумя термопарами №1,2, включенными навстречу друг другу по
схеме, показанной на рисунке 2, измеряется разность температур между инертным
веществом (эталоном) и испытуемым веществом. Блок - держатель пробы нагревается
с помощью регулируемой электрической печи. При такой схеме, если температуру
блока - держателя равномерно увеличивают, равномерно повышается температура,
как пробы, так и инертного вещества до тех пор, пока в испытуемом веществе не
начнется реакция.
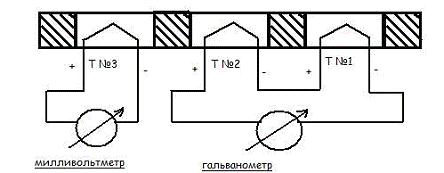
Рисунок 2 - Принципиальная схема
дифференциально-термического анализатора.
С этого момента, в зависимости от того, является
ли реакция эндотермической или экзотермической, прекращается равномерное
повышение температуры испытуемого вещества. В соответствии с этим разность
потенциалов между полюсами первой термопары начнет повышаться быстрыми темпами.
Так как эта разность уже не может компенсироваться равномерно увеличивающимся
напряжением второй термопары, прибор дает показания, соответствующие по
направлению и по величине разностям температур.
Зарегистрированная кривая называется кривой ДТА.
Если при нагревании исследуемое вещество не испытывает никаких превращений, то
разность температур будет равна нулю. В этом случае кривая ДТА регистрируется в
виде прямой линии, совпадающей с осью абсцисс, и называется нулевой линией.
Если исследуемое вещество отличается от эталона своими теплофизическими
свойствами, то кривая дифференциальной записи может отклониться от нулевого
положения вверх или вниз, а в дальнейшем кривая ДТА регистрируется параллельно
оси абсцисс или под некоторым углом к ней. Эта линия хода термической кривой
носит название базисной линии. Если в процессе нагревания при какой-либо
температуре в исследуемом образце произойдет фазовое превращение или химическое
изменение, сопровождающееся поглощением или выделением тепла, то возникает
разность температур между образцом и эталоном(её величина пропорциональна
количеству поглощенного или выделенного тепла), которая регистрируется
отклонением кривой ДТА (термический эффект). Термические эффекты,
соответствующие процессам, связанным с поглощением тепла и отображающиеся на
кривой ДТА в виде отклонения ниже базисной линии, называются эндотермическими,
а связанные с выделением тепла и регистрируемые отклонением кривой ДТА вверх,
экзотермическими (рисунок 3). В случае, если реакции сильно перекрывают друг
друга, возможно, что на кривой не покажется минимум, а появится только точка
перегиба. Кривые ДТА на практике регистрируются автоматически.
Градуировка термограммы производится на
основании температурной кривой и калибрационной температурной шкалы на
специальном планшете.
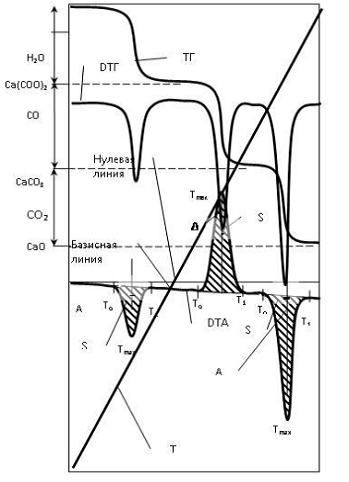
Рисунок 3 - Дериватограмма щавелевокислого калия
Большинство веществ имеет
индивидуальную термическую характеристику, которая отражает его поведение при
нагревании, зависящее от состава, свойств, его структуры, механизма и кинетики
превращения. Таким образом, по термограмме можно получать качественную
характеристику исследуемого образца, то есть определять фазовый состав. Кроме
того, кривая ДТА (S - площадь и A - высота пика) используются для оценки
количественного состава изучаемого объекта. Величина термического эффекта
(площадь пика) пропорционально количеству теплоты, поглощенной или выделенной в
процессе превращения.
Применяя метод ДТА возможно
скорректировать параметры термической обработки синтезируемого вещества.
Контроль фазового состава полученного материала осуществляют с применением
метода РФА [8].
1.6 Рентгеновский фазовый анализ
Рентгеновский фазовый анализ - это метод
качественного и количественного анализа фазового состава поликристаллических
материалов, основанный на изучении дифракции рентгеновских лучей.
Качественный анализ
Поскольку каждая фаза поликристаллического
образца имеет кристаллическую решетку с характерным набором расстояний d между
параллельными кристаллографическими плоскостями, рентгеновские лучи отражаются
от кристаллографических плоскостей (и дифрагируют) с характерным только для
данной фазы набором брэгговских углов Ѳ
(угол между падающим лучом и отражающей плоскостью) и относительных
интенсивностей дифракционных отражений. Последние регистрируют с помощью
дифрактометров (дифрактограммы) или, реже, на рентгеновской пленке
(рентгенограммы). Дифракционная картина многофазного образца представляет собой
наложение дифракционных картин отдельных фаз. По положению дифракционных
максимумов (пиков на дифрактограмме или линий на рентгенограмме) определяют
углы Ѳ,
а затем значения d рассчитывают в соответствии с условием Брэгга-Вульфа
по уравнению: 2d/sinѲ = l
(l
- длина
волны рентгеновского излучения) или из таблиц, в которых приводятся значения d(Ѳ)
при различных l.
Проведение РФА заключается в сравнении
экспериментальных значений d и относительных интенсивностей
дифракционных максимумов с набором соответствующих табличных значений для
каждой из предполагаемых фаз. Значения d и относительных интенсивностей
дифракционных максимумов многих неорганических и органических соединении,
минералов и синтетических материалов опубликованы. Наиболее полный и постоянно
пополняемый определитель фаз-картотека ASTM (Американского общества испытаний
материалов), в которой содержатся кристаллографические данные, сведения о
физических и других свойствах фаз. Фазу можно считать установленной при наличии
на дифрактограмме трех ее самых интенсивных пиков и примерного соответствия
отношений интенсивностей справочным данным. Исключая все пики обнаруженной фазы,
проводят такой же анализ с оставшимися дифракционными пика [9].
Количественный
анализ - определение количества тех или иных фаз в смеси: определение
средних размеров кристаллов, зерен в образце, функции распределения их по
размерам, по анализу профиля линий; изучение внутренних напряжений (анализ
профиля дифракционных линий и сдвига положения этих линий); изучение текстур
(характера преимущественной ориентации кристаллитов). Количественный
рентгеновский фазовый анализ основан на зависимости интенсивности
дифракционного отражения от содержания соответствующей фазы. Сравнивая
экспериментальные значения интенсивностей линий рентгеновского спектра с
эталонными и вводя необходимые поправки на поглощение, можно определять
содержание фазы.
Основной задачей рентгенофазового анализа
является идентификация различных фаз в их смеси на основе анализа дифракционной
картины, даваемой исследуемым образцом [10].
2. Методическая часть
2.1 Исходные материалы и реактивы
В работе для синтеза твёрдых электролитов
использовали неорганические оксиды: Bi2O3,
La2O3
марки ч.д.а. и х.ч., растворы HNO3
(7
М), NaOH (1 М)
Использовали следующее
оборудование:
1. Аналитические
весы лабораторные равноплечие 2 класса модели ВЛР-200. Основная погрешность по
шкале 0,15 мг;
2. Муфельная
печь SNOL 30/1300;
3. Сушильный
шкаф SNOL 58/350;
4. Дериватограф
фирмы «МОМ» Q-1500.
5. Рентгеновский
дифрактометр фирмы Shimadzu
XRD - 6000
2.2 Методы исследования
2.2.1 Дифференциальный термический
анализ
Дифференциальный термический анализ проводили с
использованием дериватографа фирмы «МОМ» Q-1500
в атмосфере воздуха при скорости нагревания 15 К/мин.
В термовесовом блоке дериватографа располагаются
равноплечные аналитические весы, снабженные пневмозатухающим устройством, на
одном плече которых через керамический стержень с термоэлементом смонтированы
два тигля, из которых в одном находится измеряемое, в другом инертное вещество.
Блок - держатель нагревается с помощью регулируемой электрической печи 1 (рис.
4). Тигель с пробой 3 устанавливается на фарфоровой 4х -канальной трубке
держателя 5, внутри которого находятся провода дифференциальной ПП термопары,
сигнал поступает непосредственно на 4х - канальный самописец, регистрирующий
дифференциальную кривую ДТА и кривую Т, регистрирующую температуру внутри исследуемого
образца. Магнитная катушка 7, подвешенная на второе плечо весов 9, двигаясь в
однородном магнитном поле, индуцирует напряжение, пропорциональное изменению
массы пробы и используется для регистрации скорости изменения массы ДТГ и
изменения массы пробы ТГ. Основные требования к выбору эталона следующие: в
исследуемом интервале температур эталон не должен иметь превращений, не быть
гигроскопичным, теплопроводность и теплоемкость его по возможности должны быть
близки к теплоемкости и теплопроводности исследуемого вещества.
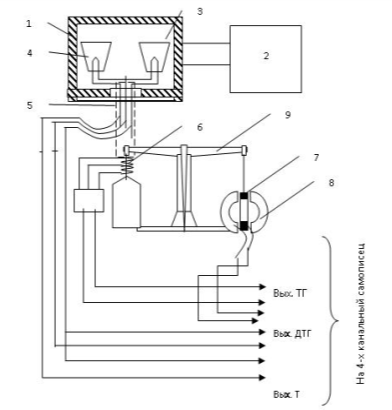
- печь; 2 - электронный регулятор температуры; 3
- тигель с исследуемым образцом; 4 - тигель с эталоном; 5- 4-х канальная
трубка-держатель; 6 - преобразователь сигнала ТГ; 7 - катушка сигнала ДТГ; 8 -
постоянный магнит; 9 - термовесы.
Рисунок 4 - Принципиальная схема дериватографа Q
- 1500D
Большинство веществ имеет индивидуальные
геометрические элементы термических эффектов, которые показывают, что кривая
ДТА принадлежит данному веществу, а не другому. Количество эффектов, их
тепловой знак и геометрические элементы, последовательность расположения экзо-
и эндотермических эффектов, обратимость или необратимость термического эффекта
(кривая охлаждения) составляют характеристику термограммы. В некоторых случаях
процессы, происходящие в веществе при нагревании могут быть однозначно
интерпретированы лишь при сопоставлении кривых ДТА и ТГ с кривой ДТГ, которая
позволяет установить скорость протекания реакции, а также выявить, что в данном
температурном интервале одновременно протекает два противоположных по знаку
процесса. Следовательно путем детального анализа геометрических элементов
кривой ДТА в сочетании с данными ТГ и ДТГ можно в ряде случаев установить
природу термического эффекта [8].
2.2.2 Рентгеновский фазовый анализ
Съемку рентгенограмм осуществляли на
рентгеновском дифрактометрическом оборудовании фирмы Shimadzu
XRD-6000 (излучение CuK2).
Рентгенограммы записывали в широком интервале углов дифракции 2Θ
от 5° до 80°. Исследование структуры мезопористых мезоструктурированных
материалов осуществляли методом рентгенофазового анализа в области малых углов
2Θ
1-7°, с шагом 0,04°. Устройство Рентгеновский дифрактометра фирмы Shimadzu
XRD - 6000 показано на
рисунке 5.
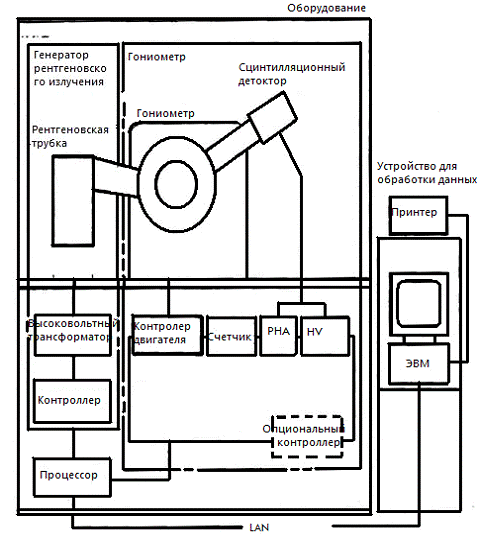
XRD-6000 состоит из основного блока и блока
обработки данных, контролирующего его. В состав основного блока входит
генератор рентгеновского излучения и гониометр с контролирующим его
процессором. Работа генератора рентгеновского излучения и гониометра (рисунок
6) контролируется блоком обработки данных, который соединяется с главным блоком
посредством LAN кабеля.
В рентгеновском дифрактометре обычно
используется линейная фокусировка источника излучения. Угол испускания рентгеновских
лучей от трубки ограничивается отклоняющей щелью (DS), как показано на рисунке
6, затем лучи попадают на образец, и дифрагируя на нем собираются на приемной
щели (RS), после этого они преобразуются в электрические сигналы детектором и
записываются в числовом виде (описывая интенсивность), совместно с его
положением. Детектор рентгеновского излучения (сцинтиляционный детектор)
вращается с удвоенной по сравнению с образцом скоростью, для того чтобы угол
падения и угол отражения рентгеновских лучей относительно образца совпадали
[11].
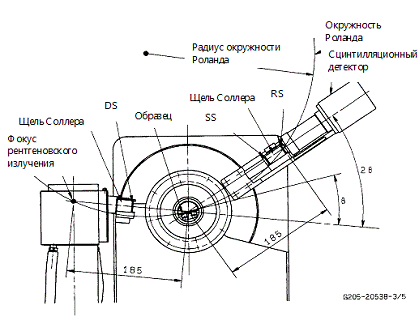
Рисунок 6 - Оптическая система гониометра
электролит оксид висмут лантан
3.
Экспериментальная часть
В качестве объекта исследования выбрали систему Bi2O3-La2О3,
реализующую структуру типа d-Bi2O3,
так как полученный твердый раствор по литературным данным стабилен в широком
диапазоне температур по сравнению с чистым Bi2O3.
Отличие данного исследования от других
заключалось в получении твердых оксидных электролитов химическим методом путем
совместного осаждения оксидов висмута и лантана. Данный метод имеет
преимущества перед твердофазным синтезом, поскольку гомогенизация фаз
достигается уже на стадии растворения и осаждения, что помимо достижения
высокой однородности позволяет сократить время и трудоёмкость процесса.
3.1 Совместное
химическое осаждение висмута и лантана
В термостойком стаканчике растворяли
определенное количество оксида висмута (III)
в 30-40 мл 6-7 М HNO3
при перемешивании и нагревании на электрической плите. Затем после растворения Bi2O3
в раствор добавляли рассчитанное количество оксида лантана. После полного
растворения оксида раствор охлаждался до комнатной температуры. Осаждение
проводили на магнитной мешалке добавлением по каплям из делительной воронки 1 М
раствора NaOH до рН =
9-10. Полученный осадок отфильтровывали, промывали дистиллированной водой,
высушивали при ~383 К и перетирали в агатовой
ступке.
С применением метода ДТА скорректировали
параметры сушки и обжига материала (рисунок 7).
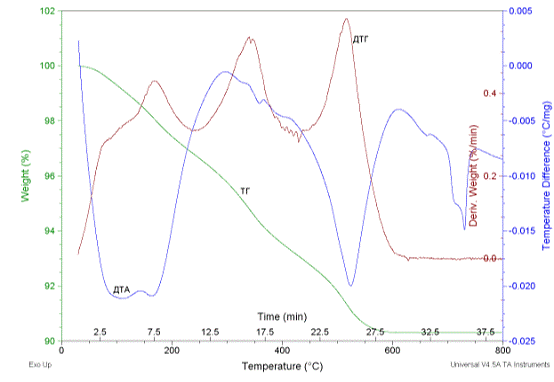
Рисунок 7 - Дериватограмма твердого электролита
на основе Bi2O3-La2О3
Из приведенных данных на рисунке 8 видно, что
имеется несколько эндотермических эффектов в интервале температур 150 - 575С,
которые, вероятно, соответствуют разложению гидроксидов, что подтверждается
потерями массы. Фазообразование начинается при температуре ≈ 730С
a-
Bi2O3
переходит в  - Bi2O3.
- Bi2O3.
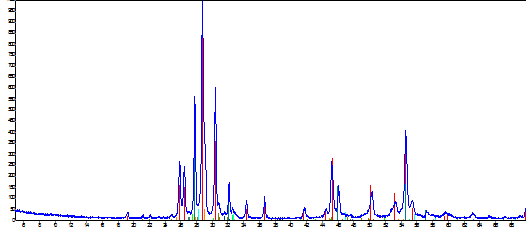
Образец после дифференциального термического
анализа исследовали с помощью метода рентгеновского фазового анализа. Данные
представлены на рисунке 8.
В результате РФА получили химический состав
вещества: висмут - 75,9%; лантан - 13,2% и кислород - 10,7%, а так же фазовый
состав: La0,176Bi0,824O1.5;
Bi1,88La0,12O3;
BiLa; Bi2O3;
La2О3;
BiO2-x;
Bi2O2,7;
Bi.
После отжига при температуре 600 С в течение 5
ч, провели повторный рентгенофазовый анализ (рисунок 9).
|
Интенсивность
(I)
|
|
|
Угол
2
|
Рисунок 8 - Рентгенограмма твердого электролита
на основе Bi2O3-La2О3
|
Интенсивность
(I)
|
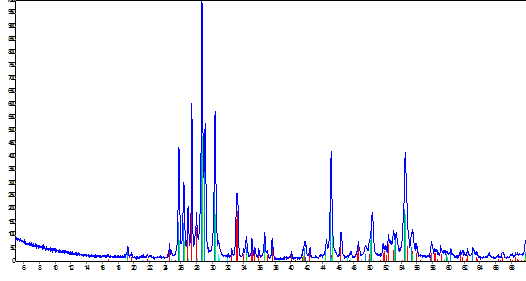
|
|
Угол
2
|
Рисунок 9 - Рентгенограмма твердого электролита
на основе Bi2O3-La2О3
Результаты проведенного РФА: химический состав -
кислород (15,5%); лантан (6,28%); висмут(72,8%); и фазовый состав - Bi2O3;
Bi0,775La0,225O1,5;
La0,176Bi0,824O1,5;
La2O3.
Из рисунка видно, что сформировались две
ионопроводящих фазы, однако остались не прореагировавшие оксиды Bi2O3
и La2О3.
Вероятно, для того, чтобы синтез был осуществлен до конца необходимо повысить
температуру синтеза (~730С),
либо увеличить время синтеза.
Выводы
. Предложен способ синтеза твердого оксидного
электролита на основе Bi2O3-La2О3.
. В результате эксперимента получен твердый
электролит на 40% состоящий из оксида висмута, и на 60% состоящий из
нестехиометрических оксидов лантана и висмута.
. Результаты эксперимента соответствуют
поставленным задачам, так как получены ионопроводящие фазы Bi0,775La0,225O1,5
и La0,176Bi0,824O1,5.
Литература
1. http://www.uran.ru/gazetanu
2. Воскресенская,
Е.Н. Роль решеточного кислорода оксидного катализатора в реакции окислительной
димеризации метана / Е.Н. Воскресенская, Л.И. Куртеева, С.И. Цыганкова, А.Г.
Аншиц // Химия твердого топлива. - 1993. - №2. - С. 79-84.
. Энциклопедический
словарь юного химика/ Э 68 Сост. В.А. Крицман, В.В. Станцо. - М.: Педагогика,
1982. - 368с., ил.
4. Мидьярд,
А. Ионная проводимость кристаллов /А. Мидьярд. - М.: Издатинлит, 1982. -222 с
5. В.Н.
Чеботин, М.В. Перфильев, Электрохимия твердых электролитов. Под ред. докт. хим.
наук В.Н. Чеботина. −М.: Химия, 1978. - 312 с., 15 табл., 126 рис.
6. http://wsyachina.narod.ru/chemistry/oxide_electrolyte.
7. http://www.iprit.ru/chemical_agentsaction.
. П.С.
Бычков, Методы физико-химического исследования: лабораторный практикум. -
Красноярск.
. http://XuMuK.ru.
10. http://ktf.oleg29.ru:88/courses.
11. Руководство
по эксплуатации рентгеновского дифрактометрического оборудования фирмы Shimadzu
XRD-6000.