Синтез енаминов с тиоамидной группой
Введение
Соединения, содержащие енаминовый фрагмент, обладают
различными видами биологической активности, а также широко применяются в
синтетической органической химии как исходные реагенты для синтеза витаминов и
фармацевтических препаратов [1].
Енамины примененяются в медицине, например как
кардиотонические средства [2], агонисты ГАМК-рецепторов [3], интибиторы
ВИЧ-протеазы.
Многие гетероциклические соединения, синтез которых основан
на различных превращениях енаминов также показали высокую противоопухолевую
активность, антидепрессантное действие, противовирусную активность.
Таким образом, разработка методов синтеза енаминов, и
изучение их реакций гетероциклизации является важным разделом гетероциклической
органической химии.
енамин тиоамидный бензил акриламид
1.
Синтез и свойства енаминов с тиоамидной группой (обзор литературы)
Наиболее изученными соединениями, в молекуле которых имеется
енаминовая группа и дополнительный функциональный фрагмент, являются енаминоны
[4-6]. Гораздо менее представлены соединения, в которых, наряду с енаминовой
функцией, имеется амидная или тиоамидная группа. Исследование реакций
енаминонов, в особенности реакций их гетероциклизации, показывает, что введение
дополнительных нуклеофильных или электрофильных центров в молекулу этих
соединений существенно расширяет возможности их использования для синтеза
гетероциклических соединений.
.1
Синтез фунционализированных енаминов
В литературе описан синтез функционализированных енаминов,
наиболее широко представлены методы синтеза карбокамидов и тиоамидов,
основанные на замещение легкоуходящих групп в акриламидах. Пропентиоамиды часто
получают при взаимодействии соединений, содержащих енаминовый фрагмент, с
изотиоцианатами. Следует отметить, сто акриламиды часто являются исходными соединениями
для получения соответствующих пропентиоамидов.
Получение енаминов с карбоксамидной группой
Кляйзен Л. [7] впервые обнаружил, что анилин может
взаимодействовать с этоксиметиленмалоновым эфиром Л4 с образованием β-анилино-α-карбэтоксиакрилового эфира
Л5. Ацетамиды Л3 взаимодействуют с триэтилортоформиатом Л2
с образованием β-анилино-α-карбэтоксиакриловых эфиров Л4, которые далее
реагируют с молекулой п-хлоранилина с образованием енаминов Л5 (схема
1.1). Кроме того, было обнаружено, что при использовании эфира (R2=CO2Et) реакция не
останавливается на стадии образования карбоксамида Л5, а идет дальше,
приводя к диамиду малоновой кислоты Л6 (схема 1.1) [8].
Схема 1.1

Использование в реакции конденсации гетероциклических и
ароматических аминов позволило авторам расширить ряд енаминов с карбоксамидной
группой. Карбоксамиды Л8 и Л9 были получены при нагревании
эквимолярных количеств арил- или пиридиламина, триэтилортоформиата и этилового
эфира или амида малоновой кислоты, а также цианацетамида. В результате были
получены 2-циано- и 2-этоксикарбонил-3-арил(пиридил) аминоакриловые кислоты Л8
и Л9 с хорошими выходами (схема 1.2) [9].
Схема 1.2

Удобным методом синтеза енаминов, содержащих карбоксамидную
группу, является замещение легко уходящей группы (NMe2, OEt) первичными или
вторичными аминами.
Так 2-циано-3-диметиламинокротонамид Л12, полученный
при взаимодействии диэтилацеталя N, N-диметилацетамида Л10 и α-цианоацетамида Л11 [10], вступает в реакцию
переаминирования с анилином или п-толуидином с образованием
3-ариламино-2-цианокротон-амидов Л13 (схема 1.3) [11].
Схема 1.3
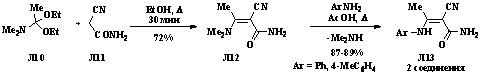
Необходимо отметить, что диметилацеталь N, N-диметилформамида (ДМФДМА) действует как формилирующий агент и
может быть использован в синтезе енаминов из активированных метиленов и
активных метильных групп [12]. Так, например, обработка ацетоацетанилида Л14
ДМФДМА приводит к образованию енамина Л15 [13].
Схема 1.4

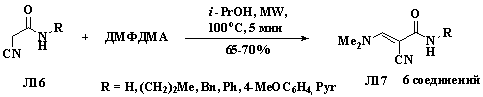
Аналогично проходит взаимодействие ДМФДМА с цианоацетамидами
Л16, имеющими активированную метиленовую группу, и приводит к образованию
цианопропенамидов Л17 с хорошими выходами (схеиа 1.5).
Схема 1.5
Удобным способом введения енаминового фрагмента в молекулу
ацетамида является реакция Вильсмейера. Взаимодействие цианоацетамида Л18
(R1=H, R2=Me), хлорокиси фосфора с
диметилформамидом (ДМФА) дает цианопропенамид Л19 с низким выходом (схема
1.6, метод 1). Использование ДМФДМА (схема 1.6, метод 2) позволило получить
аналогичные продукты Л19 с хорошими выходами. Следует отметить, что в
результате конденсации енаминов Л19 и циклических аминов (пирролидин,
пиперидин, морфолин, 1Н-имидазол) образуются карбоксамиды с циклической трет-аминогруппой
Л20 [14].
Схема 1.6

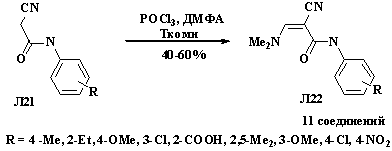
Ряд цианоакриламидов Л22 был получен в условиях реакции
Вильсмейера, которую проводили при комнатной температуре или при нагревании до
45 оС и 60 оС. Наибольший выход продукта Л22 был
получен при выдерживании реакционной смеси при комнатной температуре в течение
3-4 часов [15] (схема 1.7).
Схема 1.7
Енамины, содержащие карбоксамидную группу, могут быть получены
конденсацией первичных или вторичных аминов с 1,3-дикетонами. Так в результате
взаимодействия 1,3-дикарбонильных соединений Л23 с аминами Л24
были получены енамины Л25 с хорошими выходами (схема 1.8) [16, 17].
Схема 1.8

Анализ литературных данных по методам синтеза енаминов, содержащих
карбоксамидную группу, показал, что наиболее распространенным методом синтеза
этих веществ является конденсация соединений, содержащих активированную
метиленовую группу с триэтилортоформиатом или ацеталями, такими как
диметилформамиддиметилацеталь (ДМФДМА), с последующим нуклеофильным замещением.
Этот метод позволяет ввести в молекулу енаминов остатки алифатических,
ароматических, гетороароматических аминов и варьировать заместители у атома
азота в амидном фрагменте. Другис вариантом введения легкоуходящей группы
является реакция Вильсмейера, но в сравнении с реакцией, в которой участвут
ацетали, как правило, дает меньший выход продукта. Наиболее редко для синтеза
карбоксамидов применяют конденсацию первичных или вторичных аминов с
дикетонами. Возможности этого метода ограничены заместителями у атома азота
амидного фрагмента 1,3-дикарбонильных соединений.
Получение енаминов с тиоамидной группой
Удобным методом получения енаминов, содержащих тиоамидную
группу, является конденсация 2-цианобут-2-ентиоамидов Л26, содержащих
легкоуходящие группы у двойной связи (R2 = OEt, NMe2), с первичными или вторичными аминами. В
литературе имеются примеры таких конденсаций с алифатическими аминами (аммиак,
изобутиламин, пропиламин, диэтиламин) или с циклическими аминами (пиперидин), а
также с замещенными анилинами и фенилгидразинами (схема 1.9).
Схема 1.9
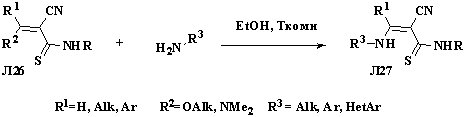
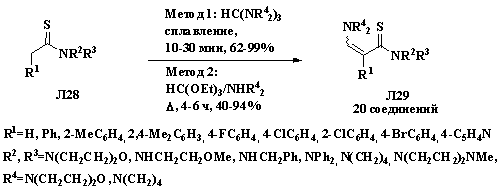
Для получения пропентилоамидов Л29 могут быть использованы такие
формилирующие агенты, как трис(морфолинометан) (схема 1.10, метод 1) и
триэтилортоформиат и амин (схема 1.10, метод 2). При сплавлении смеси
арилтиоацетамида или тиоацетилморфолина Л28 с трис(морфолинометаном)
(метод 1) были получены соответствующие 3-морфолино- или
3-пирролидинотиоакриламиды Л29. Кипячение арилтиоацетамида Л28 в
избытке триэтилортоформиата и амина привело к образованию аналогичных продуктов
с умеренными и хорошими выходами (схема 1.10) [18, 19].
Схема 1.10
При конденсации цианоацетамида Л30 с диметилацеталем N, N-диметилацетамида образуется 2-циано-3-диметиламинотиокротонамид Л31,
который способен вступать в реакцию переаминирования с анилином и п-хлоранилином
при кипячении в уксусной кислоте, что приводит к енаминам Л32 (схема
1.11) [11].
Схема 1.11

Часто для синтеза 3-аминопропентиоамидов используют методы,
основанные на введение тиоамидной группы в молекулы соединений, содержащих
енаминовый фрагмент, реакцией сульфгидрирования циано-группы. Так винилтиоамид Л34
был получен при взаимодействии ДМФДМА и тиоамида Л33 с очень маленьким
выходом (6,5%) [20]. Альтернативная методика синтеза этого соединения,
включающая сульфгидрирование 3-диметиламиноакрилонитрила Л33
(соотношение транс/цис-форм: 95/5) в пиридине в присутствии
триэтиламина, позволила получить винилтиоамид Л34 с хорошим выходом и
исключительно в Е-конфигурации (схема 1.12) [21].
Схема 1.12

Широко распространенным методом введения тиоамидной группы в
молекулы органических соединений является взаимодействие СН-кислот с
изотиоцианатами. Так, например, ацилизотиоцианаты Л36 реагируют с
3-аминокротонитрилом Л35 в ацетонитриле с образованием двух типов
соединений: продукта нуклеофильного замещения по аминогруппе с образованием
3-аминокротонитрилов Л37 и продуктов нуклеофильного присоединения
ацетамидов Л38 (схема 1.13) [22].
Схема 1.13

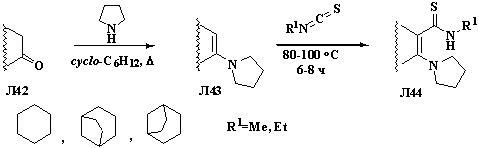
При взаимодействии аминопропенов Л39 с изотиоцианатами Л40
в бензоле образуется тиоамиды Л41 с хорошими выходами (схема 1.14) [23].
Схема 1.14
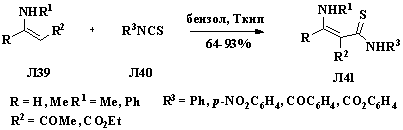
Конденсация циклических кетонов Л42 с аминами и
последующее взаимодействие полученного гетероциклического производного Л43 с
изотиоцианатом, позволила синтезировать соединения, содержащие
циклический енаминовый фрагмент и тиоамидную группу Л44. Реакцию
проводили при эквимолярном соотношении реагентов при повышенной температуре
[24].
Схема 1.15
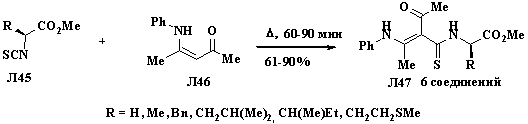
Для получения оптически активных енаминов с тиоамидной
функцией Л47 была использована хорошо известная методика синтеза
3-анилинотиокротонамидов из изотиоцианатов и енаминов [25]. Реакцию активных
изотиоцианатокарбоксилатов Л45, полученных из природных L-α-аминокислот и 4-анилинопентенона Л46 проводили при
кипячении без растворителя в течение часа. В результате были получены тиоамиды Л47
с умеренными и хорошими выходами [26].
Схема 1.16
Таким образом, методы синтеза пропентиоамидов можно разделить на
две основных группы. Первая группа основана на введении енаминового фрагмента
конденсацией тиоацетамидов с ортоэфиром или ацеталем и последующим взаимодействии
с амином. Другая группа состоит во взаимодействии енаминов с изотиоцианатами.
Эти методы позволили синтезировать енамины, содержащие как замещенную, так и
незамещенную тиоамидную группу, а также ввести остатки различных аминов в
енаминовом фрагменте.
.2
Свойства енаминов, содержащих карбоксамидную и тиоамидную группу
В литературе описан ряд превращений енаминов с карбоксамидной
и тиоамидной группой. Для этих соединений характерны реакции с электрофильными
агентами, такие как алкилирование, ацилирование, с биэлектрофильными агентами
(ДМАД), а также реакции окислительной циклизации.
Алкилирование и ацилирование
При алкилировании енаминов Л34, содержащих тиоамидную
группу, йодистым метилом образуются тиоимидиевые соли Л48 с диеновым
фрагментом. Реакция хорошо проходит при использовании избытка йодистого метила
при комнатной температуре в ТГФ. (схема 1.17) [21].
Схема 1.17
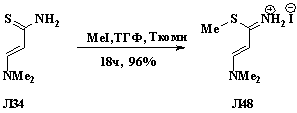
Ацилирование по атому азота ди-трет-бутилдикарбонатом в
присутствии 4-диметиламинопиридина (DMAP) и
триэтиламина (ТЭА) в дихлорметане при комнатной температуре дает
соответствующий N-трет-бутоксикарбонилпропен Л49 [27].
Схема 1.18
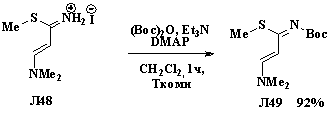
Взаимодействие с изоцианатами и изотиоцианатами
Реакция [4+2] - циклоприсоединения иодида диазадиена Л48
и гликозилизотиоцианата Л50 протекает с образованием
дигидропиримидинтионов Л53 с хорошими выходами. В процессе реакции
генерируется диметиламин, который может реагировать со вторым эквивалентом
диенофила, образуя гликозилтиомочевину Л52. Этот метод открывает новые
возможности для получения функционализированых шестичленных гетероциклов,
обладающих высокой биологической активностью.
Взаимодействие с ДМАД и другими биэлектрофильными
агентами
Взаимодействие тиоамидов Л48 с
диалкилацетилендикарбоксилатами приводит к образованию пиридиновых производных Л55
с умеренными выходами. Это превращение представляет собой тандем реакции [4+2]
- циклоприсоединения и деаминирования.
N-трет-бутоксикарбонилпропен Л49
взаимодействует с акриловыми диенофилами с образованием дигидропиридинов Л56.
Процедура удаления защитной группы в соединениях Л56 при обработке
трифторуксксной кислотой в дихлорметане [28], способствует одновременной
ароматизации. В результате всех превращений могут быть получены пиридины Л57.
Взаимодействие α-енаминокетонов с
хлористым акрилоилом Л59 приводит к образованию азинов [29]. Аналогично,
обработка енамина Л58 хлористым акрилоилом Л59 позволила
региоселективно получить 1,4,5,6-тетрагидропиридин Л60 [30].
Взаимодействие с ДМФДМА
Конденсация цианокротонамидов Л13 с ацеталями
протекает по двум центрам: аминогруппе амидного фрагмента и активированной метильной
группе у атома углерода енаминового фрагмента, и приводит к образованию
1,4-дигидропиримилинов Л62 [11, 31, 32].
Конденсация соединения Л32 с избытком ДМФДМА при
кипячении в сухом толуоле приводит к образованию пиримидинтионов Л64.
Следует отметить, что реакцию необходимо проводить в токе аргона, так как
кислород воздуха приводит к быстрому осмолению реакционной массы.
Пиримидинотионы Л64 в условиях щелочного гидролиза дают пиридинтионы Л65.
Енамины, содержащие тиоамидную группу, способны взаимодействовать
с диалкилацеталем N, N-диалкилформамида с образованием продуктов
циклизации (схема 1.25). При дальнейшем взаимодействии тиопиранов с α-галогенацетамидами в присутствии основания происходит образование
тиенопиридиновых производных.
Следует отметить, что взаимодействие с тиоамидов Л61 с
ацеталями возможно по двум центрам: аминогруппе тиоамидного фрагмента и
метильной группе у атома углерода енаминового фрагмента. В направлении «а»
реакцию тиоамида Л66 с N, N-диалкилформамиддиалкилацеталем проводили при двойном
избытке реагента в инертном растворителе (спирты, эфиры, ароматические
углеводороды, галогенпроизводные углеводородов). Полученный на первой стадии
продукт Л67 без дополнительной очистки нагревали с образованием
тиопиридонового производного Л69. В направлении «b» на первой стадии
использовался трехкратный избыток реагента при температуре от 0 оС
до температуры кипения. На второй стадии происходит щелочной гидролиз
интермедиата Л68 с образованием тиопиридонового производного Л69.
Реакция окислительной циклизации
Окислительная циклизация 3-амино-2-цианотиокротонамида Л71
приводит к образованию 5-амино-3-метилизотиазол-4-карбонитрила Л72 с
отличными выходами [23]. Надуксусная кислота, йод в смеси этанол-пиридин, бром
в хлороформе, пентасульфид аммония в воде, перекись водорода в воде или
метаноле являются эффективными окисляющими агентами и позволяют получать
соединение Л72 с высоким выходом.
При обработке тиоамидов Л75 йодом или бромом
образуется 2,5-дигидроизотиазол Л76 быстро и с хорошими выходами [23].
Циклодегидрирование β-анилиноакриламидов Л5
приводит к образованию хинолинов Л77, содержащих алкиламино- или
аминогруппу в положении 4 хинолинового цикла. Циклизация происходит под
действием хлорокиси фосфора или пентаоксида фосфора и дает в результате соответствующие
замещенные хинолины с умеренными и хорошими выходами.
Результатом изучения окисления карбоксамидов, полученных из
1,3-кетонов, в присутствии бис(трифторацетат) фенилиодида (III) (PIFA) [35] явился простой и
эффективный метод синтеза высоко замещенных пирролин-4-онов Л78
посредством циклизации легкодоступных енаминов. Взаимодействие енаминов Л25
с PIFA проводили в хлороформе в
присутствии трифторуксусной кислоты.
Исследование реакций аннелирования енаминов Л19, Л20
с различными реагентами, такими как ангидрид трифторметансульфокислоты (Tf2O), хлорокись фосфора,
трифторметансульфоновая кислота (TfOH), ангидридтрифторуксусной кислоты (TFAA), показало, что при
взаимодействии с Tf2O и TFAA происходит циклизация с образованием хинолонов Л79 с хорошими
выходами, в то время как TfOH и POCl3 в тех же условиях не приводят к образованию
продуктов циклизации.
На основании представленных данных по методам синтеза и
химическим свойствам енаминов с тиоамидной группой можно сделать вывод, что
наиболее удобным методом синтеза таких соединений является замена легкоуходящих
групп в ацетамидах при взаимодействии с первичными или вторичными аминами. На
основе этого метода был получен ряд тиоамидов, содержащих в структуре остатки
ароматических, циклических аминов.
Несмотря на разнообразие представленных реакций енаминов,
существует мало примеров синтеза новых соединений на их основе. Необходимо
отметить, что карбоксамиды малоактивны и, как правило, применяются для синтеза
других производных. Наиболее изученными превращениями для пропентиоамидов
являются реакции с электрофильными агентами (ацилирование, алкилирование,
реакции с ДМАД), а также окислительная циклизация, в результате которых был
получен ряд гетероциклических соединений, включающий пиридины, пиримидины и изотиазолы,
обладающие широким спектром биологической активности.
Некоторые аспекты реакционной способности енаминов с
тиоамидной группой мало изучены или совсем не рассматривались ранее.
Поэтому целью настоящего исследования является синтез
енаминов, содержащих в структуре тиоамидную группу и различные по электронным и
пространственным эффектами заместители, а также изучение структуры
синтезированных соединений спектральными методами и их химических свойств.
2.
Обсуждение результатов
Анализ литературных данных по методам синтеза и свойствам
енаминов показал, что эти соединения представляют интерес как удобные синтоны
для получения гетероциклических соединений. Введение дополнительных
функциональных групп (особенно тиоамидной группы) приводит к появлению новых
химических и физических свойств, а также открывает возможности для реализации
новых направлений гетероциклизации.
Следует отметить, что, несмотря на то, что енамины известны
уже давно, синтез и свойства пропентиоамидов и акриламидов по сравнению с другими
производными енаминов, изучены мало, реакции (схемы 1.17-1.31) часто
представлены единичными примерами, закономерности превращений и область их
распространения и ограничения не определены.
Все это определило цель настоящей работы: синтез, исследование
структурных особенностей и химических свойств аминопропентиоамидов и
аминоакриламидов.
В качестве объектов нашего исследования мы выбрали
3-амино-2-цианопропен-2-амиды и - тиоамиды 1 (Х=O, S) с различными
заместителями у атомов азота енаминового и амидного (тиоамидного) фрагмента
(схема 2.1).
Схема 2.1

Удобным подходом к изучению закономерностей реакционной
способности в ряду соединений является сравнение их свойств со свойствами
близких по структуре веществ. Для енаминов 1 такими соединениями
являются гидразоны 2, которые в литературе часто рассматриваются как
азаенамины (схема 2.1). Ранее в нашей лаборатории были проведены подробные
исследования реакционной способности арилгидразоноацетамидов и
арилгидразонотиоацетамидов. В результате этого исследования были обнаружены
новые реакции и получены новые гетероциклические соединения. С этой точки
зрения представляет интерес изучение аналогичных превращений в ряду
аминоакриламидов и аминопропентиоамидов и сравнение полученных результатов.
Для реализации намеченной цели необходимо решение следующих
задач:
· синтезировать
3-амино-2-цианопропен-2-тиоамиды 1, содержащие различные по электронным
и пространственным эффектам заместители в енаминовом фрагменте и тиоамидной
группе;
· провести теоретическое исследование
реакционной способности енаминов 1 квантово-химическими методами и
провести сравнение полученных результатов с индексами реакционной способности
(заряды на активных центрах, энергии граничных орбиталей) близких структурных
аналогов - арилгидразонотиоацетамидов;
· провести исследование структуры полученных
соединений с помощью спектральных методов;
· исследовать реакции аминопропентиоамидов с
диметиловым эфиром ацетилендикарбоновой кислоты и реакции окислительной
циклизации.
2.1
Синтез аминоакриламидов
Анализ литературных данных по методам синтеза енаминов,
содержащих амидную и тиоамидную группу и их химическим свойствам показал, что в
качестве основного метода синтеза этих соединений может быть использован метод,
основанный на замене легкоуходящих групп в цианоакриламидах и
цианопропентиоамидах при взаимодействии с аминами (схемы 1.1-1.7). В качестве
легкоуходящих групп могут быть использованы этокси- и диметиламиногруппа.
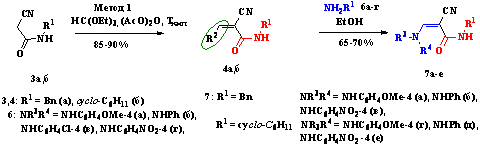
Синтез соответствующих 2-циано-3-этокси- и 2-циано-3 - (диметиламино)
акриламидов 4,5 (X=O) может быть осуществлен по методу 1 конденсацией цианоацетамида 3
с триэтилортоформиатом в присутствии уксусного ангидрида, а 2-циано-3 -
(диметиламино) акриламиды 5 - по методу Вильсмейера или при
взаимодействии цианоацетамида 3 с диметилформамиддиметилацеталем
(ДМФАДМА) (схема 2.2).
Схема 2.2

Исследования показали, что для получения
ариламиноцианопропенамидов 7а-е более предпочтительной является методика
1, при использовании которой нами были получена серия соединений 7а-е,
содержащих алкильный заместитель у атома азота амидной группы (схема
2.3).
Схема 2.3
Доказательство строения всех синтезированных пропенамидов 7а-е
проводили с помощью спектров ИК-, ЯМР 1Н, масс-спектрометрии и
данных элементного анализа.
В спектрах ЯМР 1Н акриламидов 7а-е наблюдается
два набора сигналов протонсодержащих групп. Это свидетельствует об образовании
двух изомеров относительно C=N-связи енаминового фрагмента (рис. 1). Следует отметить,
что в молекуле енамина 7а возможно образование внутримолекулярной
водородной связи, что может способствовать стабилизации транс-изомера.

Рис. 1. Спектр ЯМР 1Н 2-цианоакрил-амида 7а (соотношение
изомеров 4:1)
В спектрах ЯМР 1Н ариламинопропентиоамидов 7а-е
кроме сигналов протонов двух ароматических циклов и метокси-группы присутствуют
два дублета протонов СН-группы и NH-группы
енаминового фрагмента в области 8.0-9.0 и 10.0-12.0 м.д. соответственно, а так
же сигналы NH-группы амидного фрагмента в области 6.5 и
8.0 м.д.
В ИК-спектрах аминоакриламидов 7а-е наблюдаются полосы
поглощения валентных колебаний СН-связи в области 2850-3050 см-1, CN-связи в области
2200-2256 см-1, полоса поглощения валентных колебаний CO-связи в области
1641-1643 см-1 (рис. 2). Присутствие нескольких полос поглощения NH-связей в области
3300-3415 см-1 свидетельствует об участии этих групп в образовании
водородных связей (рис. 2).

Рис. 2. ИК-спектр метоксифенилцианоакриламида 7а
Расчет энергий образования (DHf) изомерных форм
соединения 7а полуэмпирическим методом АМ1 показал, что наиболее стабильным
изомером является Z, trans-изомер (схема 2.4),
энергия образования которого имеет наименьшее значение по сравнению с другими
изомерными формами.
Схема 2.4

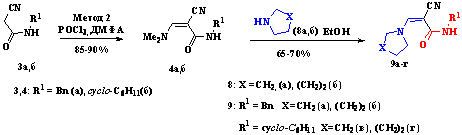
Синтез 3-трет-циклоалкиламинопропен-2-енамидов 9а-г
был осуществлен переаминированием соответствующих диметиламино-акриламидов 4а,
б (схема 2.5), полученных при взаимодействии цианоацетамидов 3а, б с
ДМФА и POCl3 (схема 2.5).
Схема 2.5
В спектрах ЯМР 1Н енаминов с трет-аминогруппой
в енаминовом фрагменте 9а-г присутствует синглет СН-группы
енаминового фрагмента в области 7.5-8.5, а так же сигнал NH-протона амидного
фрагмента с в области 6.2-7.6 м.д. и сигналы протонсодержащих групп в
заместителе R1 соответствующей мультиплетностью. Следует отметить, что в спектрах
ЯМР 1Н акриламидов 9а-г наблюдается только один набор
сигналов протонсодержащих групп (рис. 3).

Рис. 3. Спектр ЯМР 1Н 3 - (пирролидин-1-ил) акриламида 9а
Карбоксамиды 12а-е с трет-аминогруппой в амидном
фрагменте были получены по схеме, включающей на первой стадии формилирование
цианоацетамидов 10а, б диметилацеталем N, N-диметилформамида (ДМФДМА) и переаминирование полученных
3-аминоакрилонитрилов 11а, б ариламинами 12а-е на второй стадии
(схема 2.6).
Схема 2.6

В спектрах ЯМР 1Н ариламино - (2-трет-циклоалкиламино-1-карбонил)
акрилонитрилов 12а-е, также как и для ариламино -
(2-алкиламино-1-карбонил) акрилонитрилов 7а-е, наблюдается два набора
сигналов протонсодержащих групп, соответствующих двум геометрическим изомерам в
различных соотношениях (рис. 4). В спектрах ЯМР 1Н наблюдаются два
дублета СН- и NH-группы енаминового фрагмента в области
8.0-8.5 и 10.25-11.75 м.д., а также сигналы СН2-групп трет-аминогруппы
амидного фрагмента в области 1.5-4.00 м.д., синглет MeO-группы, сигналы протонов ароматического фрагмента и метиленовых
групп морфолина.
В ИК-спектрах аминоцианакриламидов 12а-е наблюдаются полосы
поглощения валентных колебаний СН-связей в области 2847-3057 см-1, CN-связи в области 2197-2200 см-1,
валентных колебаний CO-связи в области 1648-1650 см-1
и полосы поглощения NH-связей в области 3227-3260 см-1.
В УФ-спектрах енаминов 7а-в имеется две полосы поглощения в
области 207-212 нм и в области 320-365 нм. При изменении заместителя в
ароматическом кольце от электронодонорного (МеО-группа) до
электроноакцепторного (NO2-группа) наблюдается батохромный сдвиг на
7-35 нм, что свидетельствует о передаче электронных эффектов через систему
сопряжения в молекуле этих соединений.
Действительно, и в спектрах ЯМР 1Н происходит изменение
положения сигнала NH-протона амидной группы на 0.1-0.3 м.д. при изменении
природыьэлектронного эффекта заместителя в ароматическом цикле.
Следует отметить, что по сравнению с УФ-спектрами
арилгидразонокарбоксамидов 2а-в, в спектрах ариламинопропенамидов 7а-в
наблюдается гипсохромный сдвиг полосы поглощения динноволнового максимума на
10-35 нм.
2.2 Синтез
аминопропентиоамидов
Синтез 3 - (ариламино) - 2-цианопропентиоамидов 14 был
осуществлен реакцией цианотиоацетамида 13 с ДМФДМА в этаноле при
комнатной температуре. Дальнейшее взаимодействие полученного соединения с
ариламинами 6а-г привело к образованию тиоамидов 15а-г с хорошим
выходом.
В спектре ЯМР 1Н тиоамида 15а наблюдается
два набора сигналов протонсодержащих групп. Это свидетельствует об образовании
двух изомеров относительно С=С связи в соотношении 2:5. Следует отметить, что
соответствующие гидразонтиоацетамиды 2 существуют в форме одного
изомера.
Характерными сигналами в спектрах ЯМР 1Н тиоамидов
15а-г являются дублеты СН и NH-групп енаминового фрагмента в области 8.0-9.0 и
10.0-14.0 м.д. соответственно, а также сигналы аминогруппы тиоамидного
фрагмента в области 8.0-9.0 м.д.
Сравнение спектров ЯМР 1Н пропентиоамидов 15а-г
со спектрами соответствующих гидразонтиоацетамидов 2 показало, что для
енаминов характерно смещение сигнала NH-группы енаминового фрагмента по сравнению с
аналогичной группой гидрозонного фрагмента на 2.0-2.2 м.д. в слабое поле.
Енамины с вторичной тиоамидной группой были получены
тионированием соответствующих аминоакриламидов.
Для реакции тионирования обычно используется ряд тионирующих
агентов: пентасульфид фосфора, О, О-диэтилдитиофосфоновая кислота,
сульфид бора, дисульфид кремния и элементарная сера в гексаметилфосфортриамиде.
Удобным реагентом для мягкой и селективной трансформации амидов в
соответствующие тиоаналоги является 2,4-бис - (р-метоксифенил) -
1,3-дитиадифосфетан - 2,4-дисульфид или реагент Лавессона (LR) [36]. Механизм реакции
предположительно связан с образованием высоко полярного интермедиата типа
дитиофосфинилида.
Исследования стехиометрии и условий тионирования реактивом
Лавессона показали, [32] что превращение осуществляется интервале температур
80-150 оС при соотношении реагент / реактант 0.5:1, причем
практически с количественным выходом. Наряду с тиоамидом при этом образуется
тример А, выделенный в виде белых кристаллов с низкой растворимостью[36].
Следует отметить, что достоинством метода является то, что
при тионировании реагентом Лавессона не затрагиваются функциональные группы, в
частности, не происходит восстановления нитрогрупп в исходном карбоксамиде или
гидролиз этоксикарбонильных групп, что является ограничением при тионировании
пентасульфидом фосфора. Поэтому для тионирования енаминов 7а-в, 9а-г,
12а-з мы выбрали в качестве тионирующего реагента реагент Лавессона.
Ариламинопропентиоамиды 16а-г были получены с высокими
выходами при кипячении соответствующих карбоксамидов 7а, б, г,
д в толуоле с реактивом Лавессона.
В спектрах ЯМР 1Н аминопропентиоамидов 16а-г,
по сравнению со спектрами исходных аминоакриламидов 7а, б, г,
д, наблюдается смещение сигналов СН- и NH-групп енаминового
фрагмента в область более слабого поля на 0.2-1.35 м.д. и 0.3-2.0 м.д.,
соответственно.
В спектре ЯМР 1Н ариламинотиоамида 16а
наблюдается три набора сигналов протонсодержащих групп. Это свидетельствует об
образовании трех изомеров в соотношении 1:2:3.
В сравнении с соответствующими гидразонотиоацетамидами,
наблюдается смещение сигнала протонов NH-группы енаминового фрагмента в более слабое поле
на 0.3-2.0 м.д. и сигнала протонов NH - группы в сильное поле на 0.7-2.1 м.д.
Остальные сигналы идентичны сигналам в спектрах ЯМР 1Н
гидразонтиоацетамидов.
В ИК-спектрах полученных пропентиоамидов 16а-г (рис.
10) наблюдаются полосы поглощения валентных колебаний NH-связей в области
3131-3335 см-1 и CN-связи в области 2175-2203 см-1.
Расчет энергии образования различных изомерных форм
пропентиоамида 16а (АМ1) показал, что наиболее стабильным изомером
является Е, цис-изомер.
Следует отметить, что в структуре различных изомеров
пропентиоамидов 16а-г возможно образование водородной связи, что
повышает устойчивость изомерных форм.
Тионирование циано-3 - (трет-циклоалкиламино)
пропенамидов 9а-г реагентом Лавессона в толуоле привело к получению
енаминов 17а-г.
Следует отметить, что в спектрах циано-3 - (трет-циклоалкиламино)
пропентиоамидов 17а-г, как и в спектрах соответствующих карбоксамидов 9а-г,
наблюдается только один набор сигналов протонсодержащих групп.
Синтез тиоамидов, содержащих трет-аминогруппу в
тиоамидном фрагменте, 19а-и был осуществлен двумя способами. Первый
подход основан на конденсации акриламидов 4б или 11а, б с
ариламинами и последующем нагревании соответствующих енаминов 7а-в, 12а-з
с реактивом Лавессона в толуоле.
Второй метод включает тионирование цианопропентиоамидов 4б,
11а, б реактивом Лавессона, а затем следует конденсация
полученных тиоамидов 18а-в с ариламинами. Полученные экспериментальные
данные позволяют сделать вывод, о том, что для енаминов, содержащих
пирролидиновый фрагмент, лучшие результаты (выход, время превращения) более
подходит первый метод, в то время как для соединений с морфолиновым фрагментом 19ж-и
более целесообразно использование второго метода.
Доказательство строения синтезированных тиоамидов 19а-и
проводили с помощью ИК- и масс-спектров, спектров ЯМР 1Н и данных
элементного анализа.
Для исследования системы сопряжения в молекулах
пропентиоамидов 16а, б и гидразонотиоамидов 2г, д
были измерены УФ спектры. Анализ полученных данных показал, что максимум
поглощения енаминотиоамидов, по сравнению с гидразонотиоамидами, смещается в
коротковолновую область на 40 нм. Причем наибольшая интенсивность поглощения
наблюдается для соединений, не содержащих заместителей в ароматическом кольце (R1 = H).
Сравнение данных УФ-спектров карбоксамидов 7а, б
и тиоамидов 16а, б (таблица 3) показало, что максимум поглощения
пропентиоамидов 16а, б расположен на 10-20 нм в более
длинноволновой области, по сравнению с максимумами поглощения карбоксамидов 7а,
б. Полученные данные подтверждаются изменением окраски с белой - для
карбоксамидов 7а, б на бежевую - для тиоамидов 16а, б.
Таблица 2.2. Данные УФ-спектров аминопропенкарбоксамидов 7а,
б и аминопропентиоамидов 16а, б
|
№ п/п
|
Соединение, №
|
λмах
|
lg ε
|
Соединение, №
|
λмах
|
lg ε
|
|
1
|
7а
|
350
|
6.97
|
16а
|
360
|
6.76
|
|
2
|
7б
|
322
|
7.14
|
16б
|
343
|
6.85
|
2.3
Химические свойства енаминов с тиоамидной группой
Реакционная способность пропентиоамидов определяется в
основном наличием нескольких нуклеофильных центров, активность которых зависит
от имеющихся рядом с этим центром заместителей и функциональных групп.
Для прогнозирования реакционной способности полученных
пропентиоамидов 16а, б мы определили геометрические параметры, заряды на
атомах и энергии граничных орбиталей полуэмпирическим методом АМ1 и сравнили их
с аналогичными характеристиками для гидразонотиоацетамидов.
Рассчитанные величины зарядов на атомах азота показывают, что
для енаминов 16а, б при изменении электронной природы
заместителей в ароматическом цикле молекулы заместителей происходит небольшие
изменения величины заряда на атоме азота N(1), на атоме серы S(5), а так же на атоме
азота N(6)
тиоамидной группы. В сравнении с рассчитанными значениями зарядов на
нуклеофильных центрах для арилгидразонтиоамидов 2г, д, следует
отметить увеличение отрицательного заряда на атоме серы S(5). Остальные значения
остаются практически неизменными или изменяются незначительно. Таким образом,
можно сделать вывод, что по сравнению с соответствующими азааналогами 2г,
д, для пропентиоамидов 16а, б должно наблюдаться
увеличение нуклеофильных свойств атома серы тиоамидного фрагмента.
Согласно данным расчета геометрических параметров (АМ1),
можно сделать вывод, что длины связей в аминопропентиоамидах 16а, б
сильно отличаются от литературных данных (стандартное значение указано в
скобках).5 В структуре пропентиоамидов 16а, б происходит
уменьшение длины одинарных связей и увеличение длины двойных, что говорит о
выравнивании связей в результате их сопряжения. При изменении заместителей в
ароматическом кольце и у аминогруппы пропентиоамидов 16а, б
наиболее значительные изменения характерны для длин связей N-C и C=C енаминового фрагмента.
Одной из важных характеристик реакционной способности
органических соединений являются энергии граничных орбиталей. Представление об
орбиталях широко используется в химии для описания образования химической связи
и перераспределения электронной плотности при изменении строения молекул.
Изменения остовных МО и соответствующих орбитальных энергий используют для
интерпретации рентгеноэлектронных и фотоэлектронных спектров молекул. Высшие
занятые и низшие свободные МО наиболее сильно меняются при каких-либо воздействиях
на молекулу. Это позволяет использовать такие граничные МО для предсказания
направления химической реакции. Например, электрофильная атака наиболее
вероятна по положению, которому отвечает максимум плотности ВЗМО, а
нуклеофильная атака в положение, отвечающее максимуму плотности НСМО [37].
Таблица 4. Значения энергий граничных орбиталей
пропентиоамидов 2 и арилгидразонотиоацетамидов 1
|
Энергия, эВ
|
Соединение, №
|
|
17а
|
17б
|
2г
|
2д
|
|
ЕВЗМО
|
-8.82
|
-8.99
|
-8.83
|
-9.03
|
|
ЕНСМО
|
-0.95
|
-0.95
|
-1.31
|
-1.30
|
|
ЕВЗМО − ЕНСМО
|
7.87
|
8.04
|
7.52
|
7.72
|
Согласно полученным данным, при изменении заместителя в
ароматическом цикле от электронодонорного к электроноакцепторному, величина
энергии граничных орбиталей арилгидразонотиоамидов 1 изменяется более
значительно, чем в случае акриламидов 2.
Полученые с помощью полуэмпирического метода АМ1 данные
говорят о том, что для пропентиоамидов 15-17, 19 возможно
взаимодействие с электрофильными агентами по положениям 1, 5 и 6 и
взаимодействие с нуклеофильными агентами по положениям 2, 4 и 7.
Использование бифункциональных агентов (биэлектрофилов или
соединений, содержащих одновременно электрофильный и нуклеофильный фрагмент) в
реакциях с тиоамидами 15-17, 19 может привести к образованию
различных азот- и серусодержащих гетероциклических соединений.
Реакция окислительной циклизации пропентиоамидов
Реакцию окисления пропентиоамидов 15а-г проводили при
комнатной температуре при добавлении раствора брома в уксусной кислоте или
кристаллического N-хлорсукцинамида (NCS) к раствору соответствующего тиоамида. Продукты
реакции были выделены с помощью фильтрования после завершения реакции (ТСХ). В
результате были получены соответствующие 2,5-дигидроизотиазолы 20а-з в
виде гидрохлоридов или гидробромидов с хорошими выходами.
Механизм реакции окисления приламинопропентиоамидов 15-17,19
галогенами и их производными по-видимому аналогичен механизму окисления
гидразонотиоамидов 2 и проходит через образование промежуточного S-галогенаддукта А
и последующую циклизацию с участием атома азота енаминной группы.
Характерными изменениями в спектрах ЯМР 1Н
изотиазолов 20а-з по сравнению с исходными тиоамидами 15а-г
является отсутствие сигналов протонов NH-группы енаминового фрагмента в области 10.5-11.5
и 13.0-14. м.д. Смещение сигнала СН-протонов енаминового фрагмента в область
более слабого поля на 0.5-1.0 м.д. и изменение мультиплетности этого сигнала с
дублета на синглет также свидетельствует о превращении тиоамида 15а-г в
циклический продукт 20а-з.
Реакцию окисления ариламинопропентиоамидов 16а-г и 19а-в
проводили при комнатной температуре при добавлении раствора йода в этиловом
спирте, брома в уксусной кислоте или кристаллического N-хлорсукцинамида к
раствору соответствующего тиоамида (схема 2.19). В ходе реакции окисления N-хлорсукцинамидом продукт
образуется в виде белого или желтого кристаллического осадка, который был
отделен с помощью фильтрования после завершения реакции (ТСХ). В результате
были получены соответствующие 2,5-дигидроизотиазолы 21а-е в виде
гидрохлоридов с хорошими выходами.
Следует отметить, что ариламинопропентиоамиды 16а-г, 19а-в,
в отличие от арилгидразоноацеттиоамидов 2г, д, которые легко окисляются I2, Br2 и N-хлорсукцинимидом,
окисляются только при действии N-хлорсукцинимида. Данные квантово-химических
расчетов показывают, что значение потенциала ионизации
арилгидразоноацеттиоамидов (IM=8.826-9.190) больше, чем потенциал
ионизации соответствующих ариламинопропентиоамидов (IM=8.815-9.119), что
согласуется с полученными экспериментальными данными.
В спектрах ЯМР 1Н полученных 5-имино - 2,5-дигидроизотиазолов
21а-е, по сравнению со спектрами исходных соединений 16а-г, 19а-в,
отсутствуют сигналы протонов NH-групп енаминового и тиоамидного фрагментов, а
сигнал СН-группы енаминового фрагмента смещается в область слабого поля на
0.1-1.5 м.д. по сравнению с исходными соединениями 17а, б, д,
е, и 18а-м. Следует отметить, что в спектрах ЯМР 1Н
регистрируется сигнал протона иминиевой группы, как это ранее наблюдалось в
спектрах продуктов окисления соответствующих гидразонотиоацетамидов 2.
В ИК-спектрах полученных соединений 20, 21
имеются полосы поглощения валентных колебаний СН-связей в области 2831-3115 см-1
и полосы поглощения валентных колебаний CN-связей в области
2223-2225 см-1.
Реакция окисления пропентиоамидов с третичной тиоамидной
группой 19г-и проходит только при использовании NCS в этилацетате с хорошим
выходом.
Таким образом, в результате исследования реакции окисления
ариламинопропентиоамидов Br2 и NCS был синтезирован ряд 4-циано-2-фенилазотиазол-5
(2H) - иминий бромидов и хлоридов, содержащих различные заместители в
ароматическом цикле и у атома азота иминогруппы, с умеренными и хорошими
выходами.
Реакция аминопропентиоамидов с диметиловым эфиром
ацетилендикарбоновой кислоты
Реакции тиоамидов с активированными ацетиленами давно
привлекают внимание химиков-синтетиков. Особенно интересны соединения,
содержащие несколько нуклеофильных центров, такие, например, как тиомочевины,
тиоакриламиды, тиоацетамиды, а также гетероциклические производные. При этом
возможно образование различных гетероциклических систем при реализации
различных механизмов: циклоприсоединения [38, 39], циклоконденсации [40] и
присоединения [41].
В молекуле пропентиоамидов 18 имеется три
нуклеофильных центра, которые могут взаимодействовать с электрофильными
центрами ДМАД, а также других диенофилов. Результатом такого взаимодействия
может быть образование продуктов циклоконденсации (тиазолидинонов 24),
продуктов присоединения - циклоконденсации (тиазинов или тиадиазинов 25),
и продуктов циклоприсоединения (тиопиранов или тиазинов 26).
Взаимодействие пропентиоамидов 17а-з с ДМАД проводили
при комнатной температуре в хлороформе. В результате были получены
функционализированные тиопираны 28а, б с умеренными и хорошими
выходами.
В спектре ЯМР 1Н тиопирана 28а присутствуют
два синглета MeO-группы в области 3.83 м.д. и 3.88 м.д., двухпротонный синглет CH2-группы в области 4.5
м.д., сигналы протонов ароматического цикла в области 7.3-7.5 м.д; а также
однопротонный синглет СН-группы в области 7.84 м.д.
Образование тиопирана 28 происходит по механизму
Дильса-Альдера через промежуточный интермедиат 27 и последующее
отщепление молекулы ариламина.
Расчет энергий граничных орбиталей пропентиоамида 17а
и ДМАД полуэмпирическим методом АМ1 показал, что образование двух новых связей
происходит при перекрывании ВЗМО диена (тиоамида) и НСМО диенофила (ДМАД), что
соответствует реализации классического механизма реакции Дильса-Альдера.
Арилгидразонотиоамиды 2г, д в реакции с
диметиловым эфиром ацетилендикарбоновой кислоты (ДМАД) взаимодействуют по
механизму циклоконденсации с образованием тиазолидинонов 24 (схема 2.20,
X=N). Это является
существенным отличием реакционной способности енаминов 17а, б,
содержащих тиоамидный фрагмент и арилгидразонотиоацетамидов 2г, д.
3.
Экспериментальная часть
Контроль за ходом реакции и индивидуальностью полученных
веществ осуществляли с помощью ТСХ на пластинках Sorbfil UV-254 в системах
хлороформ; хлороформ: ацетон (10:1); этилацетат: гексан (1:2); хлороформ:
гексан (10:1); гексан: ацетон (3:1). ИК-спектры измерены на ИК-Фурье
спектрометре Bruker Alpha (НПВО, ZnSe). Спектры ЯМР измерены на спектрометре
Bruker Avance II (400 MHz для 1H and 100 MHz для 13C),
внутренний стандарт TMС. Масс-спектры зарегистрированы на спектрометре «Varian MAT 311A», ускоряющее напряжение
3 кВ, энергия ионизирующих электронов 70 эВ с прямым вводом образца в источник.
УФ-спектры записаны на УФ-спектрометре Perkin Elmer Lambda 35.
Разделение и очистку веществ проводили с помощью жидкостной
колоночной хроматографии на силикагеле 0.035-0.070 мм, 60Å (Acros Organics).
3.1 Синтез
аминоакриламидов
Метод А: К раствору 0.5 г. (2.2 ммоль)
2-циано-3-этоксиакриламида 4а, б в 50 мл этилового спирта при
охлаждении до 0−5 оС добавляют 0.32 г. (2.6 ммоль) ариламина 6а-г.
Через 9-10 часов кристаллы отфильтровывают.
Метод Б: Раствор 0.5 г. (2.2 ммоль)
диметиламиноакриламида 4а, б и 0.89 г. (5.5 ммоль) амина 8а,
б в 50 мл этилового спирта выдерживают 10-12 часов при температуре 60оС.
Выливают реакционную массу на лед, выпавшие кристаллы выделяют фильтрованием.
Метод В: Раствор 0.5 г. (2.5 моль) 3-аминоакрилонитрила 11а,
б, 0.49 г. ариламина 6а-г (3.75 ммоль) и 0.09 г. конц. соляной
кислоты (2.5 ммоль) в этиловом спирте выдерживают при температуре 60 оС
в течение 6-8 часов. Выпавшие кристаллы выделяют отфильтрованием.
N-Бензил-3 - (4-метоксифениламино) -
2-цианоакриламид (7а). Серый порошок, 0.508 г. (66%). Метод А.Т.пл. 166-167 оС.
ИК-спектр, ν, см-1: 1543 (C=О); 2202, 2256 (C≡N); 2962, 3061 (CH); 3300, 3415 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.75 (c, 3H, ОMe); 4.36 (д, 2H, J=6.0, СН2);
6.85 и 7.22 (AA'XX', 4H, J=9.2, HAr); 7.26-7.31 (м, 5H, HAr); 7.80-7.82 (м, 1H, NH); 7.95-7.97 (м, 1H, NH); 8.11 и 8.20 (оба д, 1H, J=14.0, СН); 10.09 и 11.56
(оба д, 1H, J=14.4, NH). Смесь Z- и E-изомеров в соотношении 1:4. УФ-спектр (EtOH), λмах/нм (lgε): 350 (6.97).
Масс-спектр, m/z (I,%): 307 (M+, 21). Найдено,%: C 70.6; H 5.0; № 14.1. C18H17N3O2. Вычислено,%: C 70.34; H 5.58; № 13.67.
N-Бензил-3-фениламино-2-цианоакриламид (7б). Бежевый порошок,
0.335 г. (58%). Метод А.Т.пл. 127-129 оС. ИК-спектр, ν, см-1: 1641 (C=О); 2210, 2264 (C≡N); 2958, 3071 (CH); 3302, 3409 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 4.34 и 4.43 (оба д, 2H, J=5.6, СН2);
6.91-7.43 (м, 10H, HAr); 7.73 и 7.92 (оба т, 1H, J=5.9, NH); 10.19 и 11.43 (оба д,
1H, J=13.3, NH). Смесь Z- и E-изомеров в соотношении 1:4. УФ-спектр (EtOH), λмах/нм (lgε): 322 (7.14). Масс-спектр, m/z (I,%): 277 (M+, 24). Найдено,%: C 73.8; H 5.2; № 15.4. C18H17N3O2. Вычислено,%: C 73.63; H 5.45; № 15.15.
3 - (4-Нитрофениламино) - 2-циано-N-бензил-акриламид (7в). Порошок желтого цвета,
0.397 г. (56%). Метод А.Т.пл. = 158-160оС. Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 4.29 и 3.37 (оба д, 2Н, J=5.2, CH2); 6.48-8.40 (оба шир,
1Н, NH); 7.20-7.29 (м, 5Н, HAr); 7.57 и 8.17 (AA'XX', 4H, J=8.8, HAr); 7.89 и 8.49 (оба д,
1Н, J=12.2, СНNH); 11.89 (д, 1Н, J=12.0, CHNH). Смесь Z- и E-изомеров в соотношении
1:5. Масс-спектр, m/z (I,%): 322 (M+, 27). Найдено,%: C 63.5; H 4.1; № 17.4. C17H14N4O3. Вычислено,%: C 63.35; H 4.38; № 17.38.
2-Циано-N-циклогексил-3
(4-метоксифениламино) акриламид (7г). Серый порошок, 0.257 г. (39%). Метод А.Т.пл. =
117-119 оС. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 1.18-1.39 (м, 5Н, cyclo-C6H11); 1.61-1.80 (м, 5Н, cyclo-C6H11); 3.66-3.38 (м, 1Н, СН);
3.76 (с, 3Н, OMe); 6.80 (д, 1Н, J=12.0, NH); 6.88 и 7.22 (AA'XX', 4H, J=8.8, HAr); 8.12 (д, 1Н, J=12.2, СНNH); 11.61
(д, 1Н, J=12.4, NHСН). Масс-спектр, m/z (I,%): 299 (M+, 18). Найдено,%: C 67.9; H 7.2; № 14.2. C17H21N3O. Вычислено,%: C 68.20; H 7.07; № 14.04.
2-Циано-N-циклогесил-3 - (фениламино)
акриламид (7д). Белый порошок, 0.368 г. (56%). Метод А.Т.пл. = 137-139 оС.
Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 1.19-1.37 (м, 5Н, cyclo-C6H11); 1.57-1.74 (м, 5Н, cyclo-C6H11); 3.65 (м, 1Н, СН); 6.80
(д, 1Н, J= 8.0, NH); 6.82-7.13 (м, 5H, HAr); 8.14 и 8.53 (оба д, 1Н, J=12.0, СНNH); 9.32
и 11.61 (оба д, 1Н, J=12.4, NHСН). Смесь Z- и E-изомеров в соотношении
2:3. Масс-спектр, m/z (I,%): 299 (M+, 18). Найдено,%: C 67.9; H 7.1; № 14.2. C17H21N3O. Вычислено,%: C 68.20; H 7.07; № 14.04.
- (4-Нитрофениламино) - 2-циано-N-циклогексил-акриламид
(7е).
Желтый порошок, 0.428 г. (62%). Метод А. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 1.16-1.33 (м, 5Н, cyclo-С6Н11);
1.60-1.80 (м, 5Н, cyclo-С6Н11); 3.62-3.65 (м, 1Н,
СН); 6.93-6.99 (м, 1Н, NH); 7.30-7.31 (м, 4H, HAr); 8.12-8.23 (м, 1Н, СНNH); 10.18 и 11.67 (оба д,
1Н, J= 12.0, CHNH). Смесь Z- и E-изомеров в соотношении
1:3. Масс-спектр, m/z (I,%): 314 (M+, 52). Найдено,%: C 60.9; H 5.9; № 17.4. C16H18N4O3. Вычислено,%: C 61.13; H 5.77; № 17.82.
N-Бензил-2-циано-3 - (пирролидин-1-ил) акриламид
(9а).
Желтый порошок, 0.353 г. (63%). Метод Б.Т.пл. 126-128 оС.
ИК-спектр, ν, (см-1): 1651 (С=О), 2181 (C≡N), 2875, 2919, 2972, 3023
(CH), 3386 (NH).Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.02-2.20 (м, 4H, СН2);
3.78-3.82 (м, 2H, СН2); 3.88-3.91 (м, 2H, СН2);
4.50 (д, 2H,
J=6.0, NHСН2); 7.35-7.36 (м, 1H, ArH); 7.42-7.45 (м, 4H, ArH); 7.60-7.63 (м, 1H, NH); 8.06 (с, 1H, СH). Масс-спектр (ЭУ, 70
эВ), m/z (Iотн (%)): 255 (M+, 29). Найдено (%): C, 70.5; H, 6.8; N, 16.4. C15H17N3O. Вычислено (%): C, 70.56; H, 6.71; N, 16.46.
2-Циано-N-циклогексил-3 -
(пирролидин-1-ил) акриламид (9б). Бежевый порошок, 0.451 г. (83%). Метод Б.Т.пл.
183-185 оС. ИК-спектр, ν, (см-1): 1647
(С=О); 2187 (C≡N), 2850, 2928, 2970, 3034
(CH); 3340 (NH).Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.22-1.32 (м, 5H, СН2);
1.60-1.63 (м, 1Н, СН2); 1.68-1.78 (м, 4Н, СН2); 1.85-1.88
(м, 2H,
СН2); 2.01-2.04 (м, 2H, СН2);
3.61-3.70 (м, 5Н, HAr); 6.20 (д, 1H, J=8.0, NH); 7.82 (с, 1Н, СН).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 247 (M+, 12). Найдено (%): C, 68.0; H, 8.6; N, 16.8. C14H21N3O. Вычислено (%): C, 67.98; H, 8.56; N, 16.99.
N-Бензил-2-циано-3 - (пиперидин-1-ил)
акриламид
(9в). Желтый порошок, 0.391 г. (66%).Метод Б.Т.пл. 113-115 оС.
ИК-спектр, ν, (см-1): 1645 (С=О), 2189 (C≡N), 2851, 2917, 2939,
3002, 3029, 3061, 3084 (CH), 3354 (NH).Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.70 (шир, 5H, СН2);
3.21-3.28 (м, 1H, СН2); 3.52 (шир, 2H, СН2); 3.86
(шир, 2H,
СН2); 4.34 (д, 2H, J=6.0, СН2); 7.19-7.20 (м, 1H, ArH); 7.26-7.29 (м, 4H, ArH); 7.47 (т, 1H, J=5.6, NH); 7.73 (с, 1H, СH). Найдено (%): C, 71.5; H, 7.0; N, 15.4. C16H19N3O. Вычислено (%): C, 71.35; H, 7.11; N, 15.60.
2-Циано-N-циклогексил-3 -
(пиперидин-1-ил) акриламид (9г). Белый порошок, 0.333 г. (58%). Метод Б. Т.пл.
197-181 оС. ИК-спектр, ν, (см-1): 1650
(С=О), 2178 (C≡N), 2851, 2927 (CH), 3364 (NH).Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.18-1.35 (м, 5Н, СН2);
1.59-1.79 (м, 11Н, СН2); 3.53 (м, 2Н, СН2); 3.62-3.64 (м,
1H, СН); 3.82 (шир, 2Н, СН2);
6.19 (д, 1H,
J=7.9, NH); 7.66 (с, 1H, СH). Найдено (%): C, 69.1; H, 8.8; N, 16.3. C15H23N3O. Вычислено (%): C, 68.93; H, 8.87; N, 16.08.
3 - (4-Метоксифениламино) - 2 -
(пиролидин-1-карбонил) акрилонитрил (12а). Серый порошок, 0.224 г. (33%).Метод
В.Т.пл. 157-159оС. ИК-спектр, ν, см-1: 1631
(С=О); 2186 (C≡N); 2842, 2873, 2941,
2972, 3045 (СH).
Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 1.90 (уш. с, 4Н, 2СН2);
3.46-3.68 (м, 4Н, 2СН2); 3.76 (с, 3Н, OMe); 6.86-6.89 (м, 2H, HAr); 7.21-7.25 (м, 2H, HAr); 8.11 и 8.17 (оба д,
1Н, J= 14.4, СН); 10.14 и 11.60 (оба д, 1Н, J= 14.4, NH). Смесь Z- и E-изомеров в соотношении
1:3. Масс-спектр, m/z (I,%): 271 (M+, 78). Найдено (%): C, 66.1; H, 6.6; N, 15.8. C15H17N3O2. Вычислено (%): C, 66.40; H, 6.32; N, 15.49.
- (Пиролидин-1-карбонил) - 3 - (4-хлорфениламино)
акрилонитрил (12б). Белый порошок, 0.372 г. (54%). Метод В.Т.пл. 199-201оС.
ИК-спектр, ν, см-1: 1648 (С=О); 2198 (C≡N); 2866, 2971, 3051 (C-H); 3227 (NH).Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.91 (шир, 4Н, 2СН2); 3.45-3.72
(м, 4Н, 2CH2); 7.29-7.37 (м, 4H, HAr); 8.22-8.26 (м, 1Н, СН); 11.29 и 11.63 (оба д,
1Н, J=14.1, NH). Смесь Z- и E-изомеров в соотношении 2:3. Найдено (%): C, 61.0; H, 5.4; N, 15.4. C14H14ClN4O. Вычислено (%): C, 60.98; H, 5.12; N, 15.24.
- (4-Нитрофениламино) - 2 -
(пиролидин-1-карбонил) акрилонитрил (12в). Желтый порошок, 0.500 г. (70%). Метод
В.Т.пл. 207-209оС. ИК-спектр, ν, см-1:1651
(С=О); 2203 (C≡N); 2888, 2982, 3089 (C-H). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.87-1.96 (м, 4Н, 2СН2);
3.45-3.72 (м, 4Н, 2СН2); 7.51-7.57 (м, 2Н, HAr); 8.14-8.17 (м, 2Н, HAr); 8.32 и 8.43 (оба д,
1Н, J=13.2, СН); 10.64 и 11.73 (оба д, 1Н, J=13.4, NH). Найдено (%): C, 59.0; H, 4.9; N, 19.9. C14H14N4O3. Вычислено (%): C, 58.73; H, 4.93; N, 19.57.
- (4-Метоксифениламино) - 2 -
(морфолин-4-карбонил) акрилонитрил (12г). Серый порошок, 0.387 г. (63%). Метод В.Т.пл.
143-145оС. ИК-спектр, ν, см-1: 1650
(С=О); 2194 (C≡N); 2824, 2859, 2902,
2928, 2960 (C-H); 3196 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.58-3.64 (м, 8Н, 4СН2); 3.77
(с, 3Н, OMe); 6.86-6.89 (м, 2Н, HAr); 7.23-7.28 (м, 2H, HAr); 8.06 и 8.12 (оба д,
1Н, J=14.3, СН); 10.28 и 10.96 (оба д, 1Н, J=14.3, NH). Смесь Z- и E-изомеров в соотношении
1:6. Масс-спектр, m/z (I,%): 287 (M+, 63). Найдено (%): C, 62.0; H, 5.8; N, 14.7. C15H17N3O3. Вычислено (%): C, 62.71; H, 5.96; N, 14.63.
- (Морфолин-4-карбонил) - 3 - (4-хлорфениламино)
акрилонитрил (12д). Белый порошок, 0.321 г. (44%). Метод В.Т.пл. 215-217оС.
ИК-спектр, ν, см-1: 1651 (С=О); 2197 (C≡N); 2847, 2916, 2967, 3058
(C-H); 3201, 3261 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.57-3.65 (м, 8Н, 4СН2); 7.29 -
7.39 (м, 4H,
HAr); 8.13 и 8.23 (оба д,
1Н, J=14.4, СН); 10.41 и 10.86 (оба д, 1Н, J= 14.0, NH). Смесь Z- и E-изомеров в соотношении
1:8. Найдено (%): C, 57.7; H, 4.7; N, 14.6. C14H14ClN3O2. Вычислено (%): C, 57.64; H, 4.84; N, 14.40.
- (Морфолин-4-карбонил)-3 - (4-нитрофениламино) -
акрилонитрил (12е). Желтый порошок, 0.574 г. (76%). Метод В.Т.пл. 207-209оС.
ИК-спектр, ν, см-1: 1651 (С=О); 2201 (C≡N); 2842, 2922, 2982,
3017, 3074 (C-H); 3203, 3246 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.60-3.66 (м, 8Н, 4СН2);
7.56-7.61 (м, 2Н, HAr); 8.16-8.19 (м, 2Н, HAr); 8.26 и 10.75 (оба с,
1Н, NH); 8.39 и 10.86 (оба д, 1Н, J=12.0, СН). Смесь Z- и E-изомеров в соотношении
1:1. Найдено (%): C, 56.0; H, 4.6; N, 18.7. C14H14N4O4. Вычислено (%): C, 55.63; H, 4.67; N, 18.53.
3.2 Синтез
аминопропентиоамидов
Метод А: Раствор 1.0 г. (3 ммоль) енамина 7а-е,
9а-г и 0.67 г. (1.7 ммоль) реактива Лавессона в 100 мл толуола кипятят 2-6
ч, охлаждают до комнатной температуры, растворитель упаривают, остаток
перекристаллизовывают из этилового спирта.
Метод Б: К раствору диметиламинопропентиоамида 14,
18а-в 0.5 г. (5.0 ммоль) в 50 млэтиловом спирте добавляли 0.97 г. (7,5
ммоль) ариламина 6а-г и 0.18 г. (5.0 ммоль) соляной кислоты. Полученную
смесь выдерживали при 60 оС и перемешивании с добавлением в течение
6-8 ч. Выпавшие кристаллы выделяли фильтрованием.
3 - (4-Метоксифениламино) - 2-циано-тиоакриламид
(15а).
Коричневый порошок, 0.862 г. (74%). Метод Б. Тпл=186-188 оС.
Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 3.76 (с, 3Н, ОМе); 6.86-6.95 (м, 2Н, HAr); 7.26-7.30 (м, 2H, HAr); 7.92 и 8.18 (оба уш.
с, 2Н, NH2); 8.29 и 8.70 (оба д, 1Н, J= 14.4, NHСН); 10.44 и 13.70 (оба д,
1Н, J= 14.4, NHCH). Смесь двух изомеров в соотношении 1:2. Спектр
ЯМР 13С (DMSO-d6, δ, м.д.) 55.8, 80.4, 85.7,
115.1, 115.4, 116.4, 117.0, 117.1. 117.8, 119.3, 119.5, 120.0, 132. 0,133.8,
142.0, 151.6, 152.8, 157.1, 157.5, 177.3, 182.0, 183.1, 190.1, 192.3.
Масс-спектр, m/z (I,%): 233 (M+, 63). Найдено (%): C, 56.4; H, 5.6; N, 18.4; S, 13.7. C11H11N3OS. Вычислено (%): C, 56.63; H, 4.75; N, 18.01; S, 13.74.
-Фениламино-2 цианотиоакриламид (15б). Оранжевый порошок,
0.470 г. (46%). Метод Б. Тпл=203-205 оС. ИК-спектр, ν, см-1: 2192 (C≡N); 2956, 3014, 3084, 3170 (СН), 3245, 3402 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 7.08-7.15 (м, 1Н, HAr); 7.30-7.38 (м, 4Н, HAr); 7.94 и 8.99 (оба шир,
1Н, NH); 8.04 и 8.27 (оба шир, 1Н, NH); 8.41 и 8.80 (оба д,
1Н, J= 14.2, NHСН); 10.52 и 13.75 (оба д, 1Н, J= 12.0, NHСН). Найдено (%): C, 69.9; H, 4.6; N, 20.8; S, 15.6. C10H9N3S. Вычислено (%): C, 59.09; H, 4.46; N, 20.67; S, 15.78.
3 - (4-Хлорфениламино) - 2-цианопроп-2-ентиомид
(15в).
Персиковый порошок, 0.831 г. (70%). Метод Б. ИК-спектр, ν, см-1: 2192 (C≡N); 2964,3091, 3187 (C-H); 3289, 3419 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 7.33 - 7.44 (м, 4H, HAr); 8.16 и 8.46 (оба шир,
1Н, NH2); 8.73 (д, 1Н, J= 13.4, СН); 9.00-9.08 (оба шир, 1Н, NH2); 10.51 и 13.76 (оба д,
1Н, J= 13.2, NH). Смесь Z- и E-изомеров в соотношении 1:3,5. Найдено (%): C, 50.9; H, 3.3; N, 14.8; S, 13.6. C10H8ClN3S. Вычислено (%): C, 50.53; H, 3.39; N, 14.68; S, 13.49.
- (4-Нитрофениламино)-2-циано-проп-2-ентиоамид
(15г).
Оранжевый порошок, 0.868 г. (70%). Метод Б. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 6.58 и 7.89, 7.63 и 8.26 (AA'XX', 4H, J=9.12, HAr); 8.57-8.76 (м, 2Н, СН+NH2); 9.21 и 9.57 (оба шир,
2Н, NH2); 10.73 и 13.86 (оба д, 1Н, J= 13.4, NH). Смесь Z- и E-изомеров в соотношении
1:3. Найдено (%): C, 47.9; H, 3.6; N, 22.8; S, 12.7. C10H8N4O2S. Вычислено (%): C, 48.38; H, 3.25; N, 22.57; S, 12.92.
N-Бензил-3 - (4-метоксифениламино) -
2-цианотиоакриламид (16а). Бежевые кристаллы, 0.911 г. (94%). Метод А.Т.пл.
158-159 оС. ИК-спектр, ν, см-1: 2191 (C≡N); 3272 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.75 и 3.76 и 3.77 (три с, 3Н, ОMe); 4.35 и 4.84 и 4.93
(три д, 2Н, J=6.2, СН2); 6.81-6.95 (м, 2Н, HAr); 7.38-7.45 (м, 7Н, HAr); 8.12 (д, 1Н, J=14.4,
СН); 8.24 и 8.82 (оба д, 1Н, J=14.3, СН); 7.99 и 9.26 и 9.32 (все шир,
1Н, NH); 10.45 и 11.58 и 13.57 (три д, 1Н, J=14.6, NH). Смесь трех
изомеров в соотношении 1:2:3. УФ-спектр (EtOH), λмах/нм (lgε): 402
(6.78).Масс-спектр, m/z (I,%): 323 (M+, 12). Найдено,%: C 66.6; H 5.2; № 13.1; S 10.0. C18H17N3OS. Вычислено,%: C 66.85; H 5.30; № 12.99; S 9.91.
N-Бензил-3-фениламино-2-цианотиоакриламид
(16б).
Оранжевые кристаллы, 0.659 г. (75%). Метод А.Т.пл. 178-179оС.
ИК-спектр, ν, см-1: 2203 (C≡N); 2916, 3026 (CH); 3274, 3335 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 4.85 и 4.94 (оба д, 2Н, J=5.6, СН2);
6.91-7.43 (м, 10H, HAr); 8.39 (д, 1Н, J=13.6, СН), 8.89 (д, 1Н, J=14.0, СН); 9.41-9.51 (м,
1Н, NН); 10.53 и 12.50 (оба д,
1Н, J=14.0, NН). Смесь изомеров в соотношении 1:1. УФ-спектр (EtOH), λмах/нм (lgε): 380
(7.08).Масс-спектр, m/z (I,%): 293 (M+, 13). Найдено,%: C 69.4; H 5.4; № 14.1; S 11.1. C17H15N3S. Вычислено,%: C 69.60; H 5.15; № 14.32; S 10.93.
2-Циано-N-циклогексил-3
(4-метоксифениламино) - тиоакриламид (16в). Порошок песочного цвета, 0.293 г. (34%).
Метод А. Тпл=115-118оС. ИК-спектр, ν, см-1: 2192 (C≡N); 3069, 2993, 2933, 2850, 2830 (СН); 3273, 3130
(NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.19-1.95 (м, 10Н, cyclo-С6Н11);
3.78 (с, 3Н, ОMe); 4.35 (уш. с, 1Н, СН); 6.83-6.92 (м, 2Н, HAr); 7.21-7.30 (м, 2H, HAr); 8.37 и 8.62 (оба д,
1Н, J=12.2, NН); 8.12 и 8.23 и 8.68 (все д, 1Н, J=12.0, СН); 10.36 и 11.61
и 13.52 (все д, 1Н, J=12.2, NН). Смесь трех изомеров в соотношении 1:2:7.
Найдено (%): C,
65.1; H,
6.3; N,
13.1; S,
10.5. C17H21N3ОS. Вычислено (%): C, 64.73; H, 6.71; N, 13.32; S, 10.17.
-Фениламино-N-циклогексил-2-цианотиоакриламид
(16г).
Кристаллы песочного цвета, 0.291 г. (34%). Метод А. Тпл=129-131оС.
ИК-спектр, ν, см-1: 2194 (C≡N); 3072, 2989, 2931, 2835
(СН); 3270, 3142 (NH). Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 1.17-1.96 (м, 10Н, cyclo-С6Н11);
4.35 (м, 1Н, СН); 6.83-7.05 (м, 5Н, HAr); 7.96 и 8.12 и 8.64
(все д, 1Н, J=12.6, NН); 8.17 и 8.37 и 8.69 (все д, 1Н, J=12.0, СН); 10.42 и 11.51
и 13.27 (все д, 1Н, J=12.4, NН). Смесь трех изомеров в соотношении 1:3:4.
Найдено (%): C,
67.5; H,
6.6; N,
15.0; S,
11.5. C16H19N3S. Вычислено (%): C, 67.33; H, 6.71; N, 14.72; S, 11.23.
N-Бензил-2-циано-3 - (пирролидин-1-ил) проп-2-ентиоамид
(17а).
Бежевые кристаллы, 0.745 г. (92%). Метод А.Т.пл. 163-165 оС.
ИК-спектр, ν, (см-1): 2186 (C≡N), 2872, 2979, 3026 (CH), 3275 (NH).Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.91-1.94 (м, 2Н, СН2);
2.06-2.09 (м, 2Н, СН2); 3.73-3.84 (м, 2Н, 2СН2); 4.92 (д,
2Н, J=5.8, СН2); 7.19-7.26 (м, 1H, ArH); 7.25-7.32 (м, 4H, ArH); 8.62 (с, 1Н, СН);
8.87-8.90 (м, 1Н, NH). Найдено (%): C, 66.5; H, 6.1; N, 15.4; S, 11.9. C16H19N3O. Вычислено (%): C, 66.39; H, 6.31; N, 15.48; S, 11.82.
N-Бензил-2-циано-3 - (пиперидин-1-ил)
проп-2-ентиоамид (17б). Желтые кристаллы, 0.499 г. (60%). Метод А.Т.пл. 208-210 оС.
Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 1.88-1.93 (м, 2Н, СН2);
2.01-2.06 (м, 2Н, СН2); 3.70-3.81 (м, 4Н, 2СН2); 4.89 (д,
2Н, J=12.0, СН2); 7.16-7.19 (м, 1Н, HAr); 7.22-7.29 (м, 4Н, HAr); 8.59 (с, 1Н, СН); 8.84
(шир, 1Н,
NH); Найдено (%): C, 67.5; H, 6.3; N, 14.4; S, 11.1. C16H19N3S. Вычислено (%): C, 67.33; H, 6.71; N, 14.72; S, 11.23.
2-Циано-N-циклогексил-3 -
(пирролидин-1-ил) проп-2-ентиоамид (17в).
Коричневые кристаллы, 0.742 г. (94%). Метод А.Т.пл. 183-185 оС.
ИК-спектр, ν, (см-1): 2175 (C≡N), 2847, 2931 (CH), 3330 (NH).Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.22-1.40 (м, 5Н, СН2);
1.63-1.76 (м, 3Н, СН2); 1.91-1.95 (м, 4Н, СН2); 2.05-2.08
(м, 2Н, СН2); 3.72-3.80 (м, 4H, 2СH2); 4.37-4.39 (м, 1Н, СН);
7.72 (д, 1H,
J=7.9, NH); 8.53 (с, 1Н, СН). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 263 (M+, 35). Найдено (%): C, 63.5; H, 8.1; N, 15.8; S, 12.0. C15H17N3S. Вычислено (%): C, 63.84; H, 8.04; N, 15.95; S, 12.17.
2-Циано-N-циклогексил-3 -
(пиперидин-1-ил) проп-2-ентиоамид (17г). Желтые кристаллы, 0.465 г. (92%). Метод А.Т.пл.
213-215оС. ИК-спектр, ν, см-1: 2174 (C≡N); 2850, 2937 (C-H); 3329 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.19-1.37 (м, 5Н, СН2);
1.59-1.69 (м, 9Н, CH2); 1.90 (шир, 2Н, СН2); 3.57-3.68 (м, 4Н, СН2);
4.35-4.36 (м, 1Н, СН); 7.67 (д, 1Н, J= 7.8, NH); 8.38 (с, 1Н, СН). Найдено (%): C, 65.1; H, 8.6; N, 15.4; S, 11.7. C15H23N3S. Вычислено (%): C, 64.94; H, 8.36; N, 15.15; S, 11.56.
3 - (4-Метоксифениламино) - 2-циано-N-метилпроп-2-ентиоамид
(19а).
Желтый порошок, 0.556 г. (45%). Метод Б.Т.пл. 174-176оС. ИК-спектр, ν, см-1: 2195 (C≡N); 2834, 2909, 2955, 3000, 3058 (C-H); 3297 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.04-3.11 (м, 3Н, Ме); 3.79 (с, 3Н, OMe); 6.89-6.98 (м, 2Н, HAr); 7.25-7.33 (м, 2H, HAr); 8.19 и 8.81 (оба д,
1Н, J= 14.4, СН); 8.88 - 8.94 (м, 1Н, NHМе); 10.38 и 13.57 (оба
д, 1Н, J= 14.3, NH). Смесь Z- и E-изомеров в соотношении 2:3. Найдено (%): C, 58.3; H, 5.1; N, 16.8; S, 12.6. C12H13N3OS. Вычислено (%): C, 58.28; H, 5.30; N, 16.99; S, 12.97.
3 - (4-Нитрофениламино) - 2-циано-N-метилпроп-2-ентиоамид
(19б).
Желтый порошок, 1.205 г. (92%). Метод Б.Т.пл. 273-275оС. Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.12 (д, 3Н, J=4.5, Ме); 7.53-7.60 (м,
2Н, HAr); 8.20-8.22 (м, 2Н, HAr); 8.55 и 8.83 (оба д,
1Н, J= 12.4, СН); 9.34-9.35 (м, 1Н, NHМе); 9.35 (уш. с, 1Н, NHМе); 10.76 и 13.69 (оба
д, 1Н, J= 12.2, NH). Смесь Z- и E-изомеров в соотношении 1:4. Найдено (%): C, 50.2; H, 4.1; N, 21.4; S, 12.1. C16H19N3O2S. Вычислено (%): C, 50.37; H, 3.84; N, 21.36; S, 12.23.
3 - (4-Хлорфениламино)-2-циано-N-метилпроп-2-ентиоамид
(19в).
Светло желтый порошок, 0.905 г. (72%). Метод Б.Т.пл. 212-214оС.
ИК-спектр, ν, см-1: 2202 (C≡N); 2963, 3035 (C-H); 3281, 3329 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.05-3.12 (м, 3Н, Ме); 7.32-7.40 (м, 4H, HAr); 8.35 и 8.80 (оба д,
1Н, J= 13.2, СН); 9.07 (м, 1Н, NHМе); 10.49 и 13.60 (оба
д, 1Н, J= 13.2, NH). Смесь Z- и E-изомеров в соотношении 2:3. Найдено (%): C, 66.5; H, 4.2; N, 16.3; S, 12.9. C11H10ClN3O. Вычислено (%): C, 52.48; H, 4.00; N, 16.69; S, 12.74.
3 - (4-Метоксифениламино) - 2 -
(пирролидин-1-карботионил) акрилонитрил (19г). Желтый порошок, 0.674 г.
(47%). Метод Б.Т.пл. = 215-217 оС. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 2.02 (шир, 4Н, СН2); 3.77 (с,
3Н, OMe); 3.83 (шир, 4Н, СН2); 6.88 и 7.22 (AA'XX', 4H, J=8.8, HAr); 7.96 и 8.63 (оба д,
1Н, J= 14.4, СН); 10.30 и 11.74 (оба д, 1Н, J= 14.4, NH). Смесь Z- и E-изомеров в соотношении
1:3. Найдено (%): C, 66.5; H, 6.1; N, 14.8; S, 11.2. C15H17N3OS. Вычислено (%): C, 62.69; H, 5.96; N, 14.62; S, 11.16.
3 - (4-Нитрофениламино) - 2 -
(пирролидин-1-карботионил) акрилонитрил (19д). Желтые кристаллы, 1.011 г. (67%). Метод
Б.Т.пл. 200-202оС. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 2.07-2.09 (м, 4Н, СН2);
3.80-3.89 (м, 4Н, СН2); 7.54 и 8.20 (AA'XX', 4H, J=9.3, HAr); 8.12 и 8.60 (оба д,
1Н, J= 13.0, СН); 10.79-10.72 (м, 1Н, NH). Смесь Z- и E-изомеров в соотношении
2:3. Найдено (%): C, 55.5; H, 4.4; N, 18.4; S, 10.9. C14H14N3O2S. Вычислено (%): C, 55.61; H, 4.67; N, 18.53; S, 10.61.
2 - (Пирролидин-1-карботионил) - 3 -
(4-хлорфениламино) акрилонитрил (19е). Ярко-желтый порошок, 0.815 г. (56%). Метод
Б.Т.пл. 162-164оС. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 2.04-2.06 (м, 4Н, СН2);
3.80-3.87 (м, 4Н, СН2); 7.31 - 7.35 (м, 4H, HAr); 8.06 и 8.61 (оба д,
1Н, J= 14.1, СН); 10.46 и 11.24 (оба д, 1Н, J= 14.0, NH). Смесь Z- и E-изомеров в соотношении
1:3. Найдено (%): C, 67.8; H, 4.5; N, 14.3; S, 11.7. C14H14ClN3S. Вычислено (%): C, 57.63; H, 4.84; N, 14.40; S, 10.99.
3 - (4-Метоксифениламино) - 2 -
(морфолин-4-карботионил) акрилонитрил (19ж). Желтые кристаллы, 1.985 г. (65%). Метод
Б.Т.пл. 167-169оС. ИК-спектр, ν, см-1: 2198 (C≡N); 2749, 2836, 2850,
2880, 32964, 2999, 3047, 3085 (C-H); 3194, 3269 (NH). Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 3.73-3.77 (м, 4Н, 2СН2); 3.78
(с, 3Н, OMe); 3.96-4.00 (м, 4Н, 2СН2); 6.88 и 7.24 (AA'XX', 4H, J=8.8, HAr); 7.80 и 8.40 (оба д,
1Н, J= 13.6, СН); 10.39 и 10.51 (оба д, 1Н, J= 13.2, NH). Смесь Z- и E-изомеров в соотношении
1:5. Найдено (%): C, 60.1; H, 5.7; N, 13.6; S, 10.9. C15H17N3O2S. Вычислено (%): C, 59.38; H, 5.65; N, 13.85; S, 10.57.
- (Морфолин-4-карботионил) - 3 -
(4-нитрофениламино) акрилонитрил (19з). Желтый порошок, 1.113 г. (70%). Метод Б. Выход
70%. Т.пл. 245-247оС. ИК-спектр, ν, см-1: 2205 (C≡N); 2859, 2903, 2978,
3023, 3092 (C-H). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.73-3.76 (м, 4Н, 2СН2);
4.04-4.06 (м, 4Н, 2СН2); 7.50-7.56 (м, 2H, HAr); 7.92 и 8.37 (оба д,
1Н, J= 12.9, СН); 8.37-8.40 (м, 2H, HAr); 10.00 и 10.80 (оба д,
1Н, J= 12.9, NH). Смесь Z- и E-изомеров в соотношении 2:5. Найдено (%): C, 52.5; H, 4.1; N, 17.3; S, 9.9. C14H14N4O3S. Вычислено (%): C, 52.82; H, 4.43; N, 17.60; S, 10.07.
2 - (Морфолин-4-карботионил) - 3 -
(4-хлорфениламино) акрилонитрил (19и). Желтый порошок, 1.001 г. (65%). Метод Б.Т.пл.
166-168оС. ИК-спектр, ν, см-1: 2191 (C≡N); 2866, 2903, 2972 (C-H); 3309 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.70-3.72 (м, 4Н, 2СН2);
4.01-4.03 (м, 4Н, 2СН2); 7.26 - 7.38 (м, 4H, HAr); 7.80 и 8.37 (оба д,
1Н, J= 13.2, СН); 9.97 и 10.57 (оба д, 1Н, J= 13.4, NH). Смесь Z- и E-изомеров в соотношении
1:4. Найдено,%: C 54.4 H 4.5; № 13.9; S 10.8. C14H14ClN3OS. Вычислено,%: C 54.63; H 4.58; № 13.65; S 10.42.
3.3 Окисление
минопропентиоамидов
Метод А: Раствор 0.25 г. (0.8 ммоль) тиоамида 16а-г,
16, 19 и 0.33 г. (2.5 ммоль) N-хлорсукцинимида в 50 мл
этилацетата выдерживали при комнатной температуре и перемешивании в течение 1
часа. Выпавшие кристаллы выделяли фильтрованием.
Метод Б: К раствору 0.25 г. (0.8 ммоль) тиоамида 15а-г
в 50 мл уксусной кислоты добавлли раствор 0.4 г. (2.5 ммоль) Br в 5 мл уксусной кислоты.
Смесь выдерживали при комнатной температуре и перемешивании в течение 1-3
часов. Выпавшие кристаллы выделяли фильтрованием.
2 - (4-Метоксифенил)-4-циано-изотиазол-5 (2H)
- аммоний хлорид (20а). Белый порошок, 0.141 г. (66%). Метод А.Т.пл. 225-227 оС.
Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 3.84 (с, 3Н, ОМе); 7.05 и 7.53 (AA'XX', 4H, J=9.0, HAr); 9.31 (с, 1Н, СН);
10.23 (шир, 1Н, NH); 10.40 (шир, 1Н, NH). Найдено (%): C, 49.5; H, 3.5; N, 15.4; S,
11.8. C10H11ClN3OS. Вычислено (%): C, 49.35; H, 3.76; N, 15.69; S,
11.98.
2 - (4-Метоксифенил)-4-циано-изотиазол-5
(2H) - аммоний бромид (20д). Коричневый порошок, 0.248 г. (100%). Метод
Б.Т.пл. 193-195оС. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 3.85 (с, 3Н, ОМе); 7.09 и 7.54 (AA'XX', 4H, J=8.2, HAr); 9.29 (с, 1Н, СН);
10.32 (шир, 1Н, NH); 9.84 (шир, 1Н, NH). Найдено (%): C, 42.5; H, 3.1; N, 13.3; S,
9.9. C11H10BrN3OS. Вычислено (%): C, 42.32; H, 3.23; N, 13.46; S,
10.27.
2 - (4-Хлорфенил) - 4-цианоизотиазол-5 (2H)
- аммоний бромид (20ж). Оранжевый порошок, 0.249 г. (99%). Метод Б.Т.пл. 267-269 оС.
ИК-спектр, ν, см-1: 2235 (C≡N); 2989, 3034, 3051,
3088, 3152 (C-H); 3252-3585 (NH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 7.53 и 7.64 (AA'XX', 4H, J=8.8, HAr); 9.42 (с, 1Н, СН); 9.87
(шир, 1Н, NH); 10.49 (уш. с, 1Н, NH). Найдено (%): C, 38.2; H, 2.4; N, 13.3; S,
9.9. C10H7BrClN3S. Вычислено (%): C, 37.94; H, 2.23; N, 13.27; S,
10.13.
N - (2 - (4-Метоксифенил) -
4-цианоизотиазол-5 (2H) - илиден) метанаммоний хлорид (21а). Белый порошок, 0.189 г.
(84%). Метод А. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 3.5 (д, 3Н, J=5.2 Me); 3.85 (с, 3Н, ОМе);
7.08 и 7.56 (AA'XX', 4H, J=9.0, HAr); 9.38 (с, 1Н, СН); 11.02 (шир, 1Н, NH). Найдено (%): C, 51.4; H, 4.1; N, 15.2; S,
11.4. C12H12ClN3OS. Вычислено (%): C, 51.15; H, 4.29; N, 14.91; S,
11.38.
N - (2 - (4-Метоксифенил) - 4-цианоизотиазол-5 (2H)
- иллиден) - 1-фенилметан-аммоний хлорид (21б). Бежевый порошок, 0.176 г.
(68%). Метод А.Т.пл. 142-143 оС. ИК-спектр, ν, см-1: 2223 (C≡N); 2835, 2905, 2954, 3000, 3039, 3115 (C-H). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.84 (c, 3Н, OМе); 5.10 и 5.12 (д, 2H, J=5.2, СН2);
7.08 и 7.57 (AA'XX', 4H, J=9.2, HAr); 7.34-7.48 (м, 5H, HAr); 9.39 (с, 1Н, СН);
11.58 (с, 1Н, NH). Масс-спектр, m/z (I,%): 323 (M+, 3). Найдено,%: C 67.5; H 5.0; № 13.3; S 10.1. C18H15N3ClOS. Вычислено,%: C 67.27; H 4.70; № 13.07; S 9.98.
N - ((4-Метоксифенил) - 4-циано-2
изотиазол-5 (2H) - илиден) циклогексан-аминий хлорид (21в). Порошок персикового
цвета, 0.234 г. (84%). Метод А. ИК-спектр, ν, см-1: 2216 (C≡N); 2846, 2901, 2921, 2980 (C-H).Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.20-1.57 (м, 6Н, СН2); 1.81
(шир, 2Н, СН2); 2.02 (шир, 2Н, СН2); 3.84 (с, 3Н, ОМе);
7.12 и 7.58 (AA'XX', 4H, J=8.2, HAr); 9.38 (с, 1Н, СН); 11.35 (уш. с, 1Н, NH). Масс-спектр, m/z
(I,%): 349 (M+, 6).Найдено (%): C, 58.1; H, 5.5; N, 12.2; S, 8.9. C17H20ClN3OS. Вычислено (%): C, 58.36; H, 5.76; N, 12.01; S, 9.16.
N - (2 - (4-Хлорфенил) - 4-цианоизотиазол-5
(2H) - илиден) метанаминий хлорид (21г). Бежевый порошок, 0.192 г.
(84%). Метод А. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 3.45-3.47 (м, 3Н, Me); 7.63-7.69 (м, 4Н, HAr); 9.73 (с, 1Н, СН);
11.05 (шир, 1Н, NH). Найдено (%): C, 46.4; H, 3.1; N, 14.3; S, 11.3. C11H9Cl2N3S. Вычислено (%): C, 46.17; H, 3.17; N, 14.68; S, 11.20.
N - (2-Фенилизотиазол-4-циано-5 (2H) -
иллиден) - 1-фенилметанаммоний хлорид (21д). Бежевый порошок, 0.217 г. (83%).
Метод А.Т.пл. 165-166 оС. ИК-спектр, ν,
см-1:
2225 (C≡N); 2831, 2942, 3056 (C-H). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 5.13 (д, 2H, J=5.6, СН2);
7.35-7.67 (м, 9H, HAr); 9.54 (с, 1Н, СН); 11.66 (м, 1Н, NH). Масс-спектр, m/z
(I,%): 291 (M+, 3). Найдено,%: C 62.5; H 4.4; № 12.7; S 9.9. C17H14ClN3S. Вычислено,%: C 62.28; H 4.30; № 12.82; S 9.78.
1 - (2 - (4-Метоксифенил) - 4-цианоизотиазол-5 (2H)
- илиден) пирролидиний хлорид (22а). Желтый порошок, 0.211 г. (82%). Метод А.Т.пл.
272-274 оС. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 2.16 (шир, 4Н, 2СН2); 3.56
(шир, 4Н, 2СН2), 7.16 и 7.71 (AA'XX', 4H, J=8.9, HAr); 9.78 (с, 1Н, СН).
Найдено (%): C, 55.8; H, 5.2; N, 13.1; S, 10.1. C15H16ClN3OS. Вычислено (%): C, 55.98; H, 5.01; N, 13.06; S,
9.96.
4 - (2 - (4-Метоксифенил) - 4-цианоизотиазол-5 (2H) - илиден) морфолин-4-ий
хлорид (22б). Белый порошок, 0.270 г. (100%). Метод А. Выход 100%. Т.пл.
199-201оС. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 3.85 (с, 3Н, ОМе); 3.87-3.92 (м, 8Н, 4СН2);
7.11 и 7.71 (AA'XX', 4H, J=8.9, HAr); 9.93 (с, 1Н, СН). Найдено,%: C 49.03; H 4.91; № 12.18; S 6.79. C15H16ClN3O2S. Вычислено,%: C 59.58; H 5.33; № 13.90; S 10.60. Найдено (%): C, 53.7; H, 4.1; N, 12.2; S, 9.6. C15H16ClN3O2S. Вычислено (%): C, 53.33; H, 4.47; N, 12.44; S, 9.49.
1 - (2 - (4-Хлорфенил) - 4-цианоизотиазол-5 (2H)
- илиден) пирролидиний хлорид (22в). Белый порошок, 0.232 г. (89%). Метод А.Т.пл.
217-220оС. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 2.14 (шир, 4Н, 2СН2); 3.48-3.50
(м, 2Н, СН2); 4.10-4.12 (м, 2Н, СН2); 7.72-7.74 (м, 2Н, НAr); 7.79-7.81 (м, 2Н, HAr); 9.86 (с, 1Н, СН).
Найдено (%): C,
51.3; H,
4.2; N,
12.9; S,
9.6. C14H13Cl2N3S. Вычислено (%): C, 51.54; H, 4.02; N, 12.88; S, 9.83.
4 - (2 - (4-Хлорфенил) - 4-цианоизотиазол-5 (2H) - илиден) морфолин-4-ий
хлорид (22г). Бежевый порошок, 0.246 г. (90%). Метод А.Т.пл. 204-206 оС.
ИК-спектр, ν, см-1: 2230 (C≡N); 2906, 2954, 3049, 3331
(C-H). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.89-3.96 (м, 8Н, 4СН2); 7.76 и
7.80 (AA'XX', 4H, J=8.1, HAr); 9.94 (с, 1Н, СН). Найдено (%): C, 48.8; H, 4.3; N, 12.4; S,
9.6. C14H13Cl2N2OS. Вычислено (%): C, 49.13; H, 3.83; N, 12.28; S,
9.37.
1 - (2 - (4-Нитрофенил) -
4-цианоизотиазол-5 (2H) - илиден) пирролидиний хлорид (22д). Светло желтый порошок, 0.235 г.
(87%). Метод А.Т.пл. 200-202оС. Спектр ЯМР 1Н (DMSO-d6, δ, м.д., J, Гц): 2.09 (м, 4Н, 2СН2); 3.58 (шир,
2Н, СН2); 4.19 (шир, 2Н, СН2); 8.10 и 8.46 (AA'XX', 4H, J=9.1, HAr); 10.24 (с, 1Н, СН). Найдено
(%): C,
50.1; H,
3.7; N,
14.3; S,
9.6. C14H13ClN4O2S. Вычислено (%): C, 49.94; H, 3.89; N, 14.64; S, 9.52.
4 - (2 - (4-Нитрофенил) - 4-цианоизотиазол-5 (2H) - илиден) морфолин-4-ий
хлорид (22е). Светло желтый порошок, 0.253 г. (90%). Метод А.Т.пл. 204-206оС.
ИК-спектр, ν, см-1: 2238 (C≡N); 2903, 2967, 3059, (CH). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.76-4.04 (м, 8Н, 4СН2); 8.16 и
8.44 (AA'XX', 4H, J=8.9, HAr); 10.30 (с, 1Н, СН). Найдено (%): C, 47.5; H, 3.5; N, 16.1; S, 9.2. C14H13ClN4O3S. Вычислено (%): C, 47.66; H, 3.71; N, 15.88; S, 9.09.
3.4
Взаимодействие аминопропентиоамидов с ДМАД
Общая методика: Раствор 0.7 ммоль тиоамида 16а-г,
17а-г и 0.11 г. (1.5 ммоль) ДМАД в 5 мл хлороформа выдерживают при
комнатной температуре и перемешивании до окончания реакции (ТСХ). Продукт
высаживают гексаном из хлороформа, выпавшие кристаллы фильтруют.
Диметиловый эфир 6-бензилимино-6Н-тиопиран-5-циано
- 2,3-дикарбоновой кислоты (28а).
Выход 56%. Т.пл. 170-171 оС. ИК-спектр, ν, см-1: 2205 (C≡N); 2913, 3026, 3276 (C-H). Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 3.83 (с, 3Н, OМе); 3.88 (с, 3Н, OМе); 4.45 (с, 2Н, СН2);
7.26-7.38 (м, 5H, HAr); 7.84 (с, 1Н, СН). Спектр ЯМР 13С (DMSO-d6, δ, м.д.) 138.1, 140.2 (2С); 48.5, 86.9, 116.5, 117.5, 117.9, 124.5,
126.9, 127.6, 128.3, 129.6, 129.8, 150.6, 180.7. Масс-спектр, m/z (I,%):
342
(M+,
7). Найдено,%: C 60.04; H 4.45; № 8.08; S 9.60. C17H14N2O4S. Вычислено,%: C 59.64; H 4.12; № 8.18; S 9.37.
Диметиловый эфир 3-циано-2-циклогексилимино-2Н-тиопиран
- 5,6-дикарбоновой кислоты (28б). Выход 49%. Спектр ЯМР 1Н
(DMSO-d6, δ, м.д., J, Гц): 1.36-1.50 (м, 5Н, СН2);
1.67-1.81 (м, 5Н, СН2); 3.29 (уш. с, 1Н, СН); 3.83 (с, 3Н, OМе); 3.88 (с, 3Н, OМе); 7.73 (с, 1Н, СН).
Спектр ЯМР 13С (DMSO-d6, δ, м.д.) 24.2, 25.5, 31.5, 53.7, 54.6, 62.1, 112.5, 115.5, 122.5,
141.3, 142.7, 144.7, 162.8, 163.1. Масс-спектр, m/z (I,%): 334 (M+, 8).Найдено (%): C, 57.51; H, 5.13; N, 8.17; S, 9.72. C16H19N3O. Вычислено (%): C, 57.47; H, 5.43; N, 8.38; S, 9.59.
4.
Описание технологического процесса
.1
Характеристика готовой продукции
Молекулярная масса: 307 г./моль.
Таблица 4.1. Характеристика технического продукта
|
Наименование показателя
|
Норма
|
|
1. Внешний вид
|
Бежевый порошок
|
|
2. Температура плавления
|
166-167оС
|
|
3. Содержание примесей
|
Не более 0,5%
|
|
4. Растворимость
|
Ацетон, толуол, хлороформ
|
Характеристика исходного образца:
1. Стандартный образец утверждается в соответствующем
порядке.
2. Стандартный образец подлежит замене вновь приготовленным и
утвержденным через 6 месяцев.
3.
Срок действия, продления и хранение стандартного образца устанавливается в
соответствии с «Инструкцией по отбору, испытанию, утверждению, хранению и
расходованию стандартных образцов», утвержденных в установленном порядке.
Стандартный образец хранится в герметично закрытой таре в сухом затемненном
месте при 20-25 оС.4.2. Характеристика сырья, материалов и
полупродуктов.
Таблица 4.2. Характеристика сырья, материалов и полупродуктов
|
Наименование
|
Обозначение НТД
|
Сорт или артикул
|
Показатель для проверки
|
Примечание
|
|
1. N-бензил-2-цианоацетамид
|
Полупродукт
|
98%
|
Кристаллическое вещество белого цвета,
содержание основного вещества не менее 98%
|
Технический продукт
|
|
2. Триэтилортоформиат
|
Acros organics
|
99%
|
Бесцветная жидкость с резким запахом, Ткип=143
°С, сод-е основного вещества не менее 99%
|
ЛВЖ
|
|
3. Уксусный ангидрид
|
ГОСТ 21039-75
|
97%
|
Бесцветная жидкость с резким запахом,
tкип 139,5 °С, сод-е основного вещества не менее 97%
|
Химический реактив
|
|
4. п-Анизидин
|
Acros organics
|
95%
|
Кристаллы, буреющие на воздухе, Тпл=57,2
°С, сод-е основного вещества не менее 95%
|
Химический реактив
|
|
5. ЭС
|
ГОСТ 11547-65
|
96%
|
Бесцветная жидкость, Ткип =78,4оС;
сод-е осн. вещества не менее 96%
|
Растворитель ЛВЖ
|
4.5
Описание стадий технологического процесса
Производство N-бензил-3 (4-метоксифениламино)
2-циано-акриламида является многостадийным, периодическим процессом.
1. Проверка и подготовка к работе оборудования.
Всё оборудование перед началом работы через люк визуально
проверяют на целостность покрытия аппарата, запорной арматуры, отсутствие
реакционной массы от предыдущей операции. Герметичность аппарата проверяют
созданием давления 2 атм внутри реактора, закрывают подачу сжатого воздуха. При
выдержке 10 мин давление не должно уменьшиться. На холостом ходу проверяют
работу мешалки, поступление пара в рубашку. Контролируют приборы КИПиА, пульт
управления.
2. Подготовка сырья.
В производство передается сырьё и полупродукты, принятые
входным контролем с соответствующей отметкой о качестве. Предварительно все
хранилища заполняют соответствующим сырьём.
ТП-1 Получение ЭАА (конденсация)
Аппаратурное оформление стадии
. Мерник для ТЭОФ М-2 - нержавеющий стальной аппарат,
вместимостью 0.016 м3, скоммуницирован с ЛУ, снабжен выносным мерным
стеклом.
. Мерник для УА М-4 - нержавеющий стальной аппарат,
вместимостью 0.010 м3, скоммуницирован с ЛУ, снабжен выносным мерным
стеклом.
. Реактор для конденсации Р-5 - нержавеющий стальной
аппарат, вместимостью 0.063 м3, снабжен якорной мешалкой, гладкой
рубашкой, змеевиком, приборами для измерения температуры и давления,
скоммуницирован с ЛУ.
. Хранилище ТЭОФ Х-1 - нержавеющий стальной аппарат,
вместимостью 0.063 м3, скоммуницирован с ЛУ.
. Хранилище уксусного ангидрида Х-3 - нержавеющий
стальной аппарат, вместимостью 0.040 м3, скоммуницирован с ЛУ.
. Теплообменник Т-6 - графитовый аппарат, условное
давление 1.6 МПА, одноходовой.
Таблица 4.3. Загружено на стадии ТП-1
|
Наименование полупродуктов и сырья
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
Объем, л
|
|
1. БК, в том числе
|
|
14,592
|
|
|
|
компонента
|
98,00
|
|
14,300
|
|
|
примеси
|
2,00
|
|
0,292
|
|
|
2. ТЭОФ, в том числе
|
|
12,173
|
|
|
|
ТЭОФ
|
98,00
|
|
11,930
|
13,404
|
|
вода
|
2,00
|
|
0,243
|
0,243
|
|
3. УА в том числе
|
|
8,474
|
|
|
|
УА
|
97,00
|
|
8,220
|
7,597
|
|
вода
|
3,00
|
|
0,254
|
0,254
|
|
|
|
|
|
|
Итого
|
|
35,240
|
35,240
|
21,498
|
Из хранилища Х-1 сжатым азотом подают ТЭОФ в мерник М-2 и из
хранилища Х-3 - УА в мерник М-4. В чистый и проверенный реактор Р-5, шнеком
загружается заданное количество БК (предварительно бункер шнекового питателя
заполняется соответствующим сырьём) и из мерника М-2 и М-4 подается заданное
количество ТЭОФ и УА соответственно. Включается перемешивание и в рубашку
аппарата подают пар, реакционная масса нагревается до 140 оС (к.т.
1). Полученная смесь выдерживается 12 часов при этой температуре. По окончании
выдержки отбирают пробу для определения конца реакции (к.т. 2). При
удовлетворительном результате реакционную массу передают на стадию охлаждения,
в противном случае выдержку увеличивают на 1 час. Выделяющиеся газы
улавливаются ЛУ. Полученная реакционная масса остается в том же аппарате для
осуществления стадии ТП-2.
Таблица 4.4. Получено на стадии ТП-1
|
Получено
|
|
Наименование продуктов, потерь и отходов
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. реакц. масса 1, в том числе
|
|
35,240
|
|
|
|
ЭАА
|
46,67
|
|
16,445
|
-
|
|
этилацетат
|
17,85
|
|
6,292
|
6,976
|
|
уксусная кислота
|
12,17
|
|
4,290
|
4,593
|
|
ЭС
|
9,33
|
|
3,289
|
4,163
|
|
БК (ост)
|
5,28
|
|
1,859
|
-
|
|
ТЭОФ (ост)
|
3,83
|
|
1,348
|
1,514
|
|
УА(ост)
|
2,63
|
|
0,927
|
0,857
|
|
примеси
|
0,83
|
|
0,292
|
-
|
|
вода
|
1,41
|
|
0,498
|
0,498
|
|
Итого
|
100,00
|
35,240
|
35,240
|
18,601
|
ТП-2 Кристаллизация ЭАА
Аппаратурное оформление стадии
. Реактор для кристаллизации Р-5 тот же, что и для
конденсации.
Таблица 4.5. Загружено на стадии ТП-2
|
Загружено
|
|
Наименование полупродуктов и сырья
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. реакц. масса 1, в том числе
|
|
35,240
|
|
|
|
ЭАА
|
46,67
|
|
16,445
|
-
|
|
этилацетат
|
17,85
|
|
6,292
|
6,976
|
|
уксусная кислота
|
12,17
|
|
4,290
|
4,593
|
|
ЭС
|
9,33
|
|
3,289
|
4,163
|
|
БК
|
5,28
|
|
1,859
|
-
|
|
ТЭОФ
|
3,83
|
|
1,348
|
1,514
|
|
УА
|
2,63
|
|
0,927
|
0,857
|
|
примеси
|
0,83
|
|
0,292
|
-
|
|
вода
|
1,41
|
|
0,498
|
0,498
|
|
Итого
|
100,00
|
35,240
|
35,240
|
18,601
|
Реакционная масса охлаждается подачей в рубашку аппарата
холодной воды, до 15-20 оС (к.т. 3), в течение 4 часов. Затем
полученную суспензию передают на стадию фильтрации ЭАА. Полученная реакционная
масса передается на стадию ТП-3 с помощью сжатого азота.
Таблица 4.6. Получено на стадии ТП-2
|
Получено
|
|
Наименование продуктов, потерь и отходов
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Суспензия, в том числе
|
|
35,240
|
|
|
|
ЭАА(осадок)
|
42,00
|
|
14,801
|
-
|
|
ЭАА (в р-ре)
|
4,67
|
|
1,645
|
-
|
|
примеси
|
51,92
|
|
18,297
|
-
|
|
вода
|
1,41
|
|
0,498
|
0,498
|
|
Итого
|
100,00
|
35,240
|
35,240
|
0,498
|
ТП-3 фильтрация ЭАА
Аппаратурное оформление стадии
1. Нутч-фильтр Ф-8 - стальной
эмалированный аппарат, закрытого типа, выгрузка с помощью ножа, рабочий объём
200 л.
2. Приемник фильтрата Сб-7 - нержавеющий
стальной аппарат, вместимостью 0.200 м3.
Таблица 4.7. Загружено на стадии ТП-3
|
Загружено
|
|
Наименование полупродуктов и сырья
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Суспензия, в том числе
|
|
35,240
|
|
|
|
ЭАА(осадок)
|
42,00
|
|
14,801
|
-
|
|
ЭАА (в р-ре)
|
4,67
|
|
1,645
|
-
|
|
примеси
|
51,92
|
|
18,297
|
-
|
|
вода
|
1,41
|
|
0,498
|
0,498
|
|
Б. Вода на промывку
|
|
148,005
|
148,005
|
148,005
|
|
Итого
|
|
183,245
|
183,245
|
148,503
|
Фильтрация проводится в нутч-фильтре Ф-8. Фильтрат
направляется в сборник Сб-7 и затем на регенерацию. Паста с помощью ножа
выгружается и передается на стадию сушки (ТП-4) в вакуумную полочную сушилку
СШ-9.
Таблица 4.8. Получено на стадии ТП-3
|
Получено
|
|
Наименование продуктов, потерь и отходов
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Паста, в том числе
|
|
17,064
|
|
|
|
ЭАА
|
85,00
|
|
14,504
|
-
|
|
примеси
|
13,00
|
|
2,218
|
-
|
|
вода
|
2,00
|
|
0,341
|
0,341
|
|
|
|
|
|
|
Б. Отходы: 1. Фильтрат, в том числе
|
|
166,180
|
|
|
|
примеси
|
10,66
|
|
17,723
|
-
|
|
вода
|
89,16
|
|
148,161
|
148,161
|
|
2. Потери:
|
|
|
|
|
|
ЭАА
|
|
|
0,296
|
-
|
|
Итого
|
|
183,245
|
183,245
|
148,502
|
ТП-4 сушка ЭАА
Аппаратурное оформление стадии
. Сушилка для ЭАА Сш-9 - полочная вакуумная сушилка из
коррозионностойкой стали, оснащена системой автоматического регулирования
температуры, внутрь полок подают горячую воду. Объём 0.025 м3.
Таблица 4.9. Загружено на стадии ТП-4
|
Загружено
|
|
Наименование полупродуктов и сырья
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
|
1. Паста, в том числе
|
|
17,064
|
|
|
ЭАА
|
85,00
|
|
14,504
|
|
примеси
|
13,00
|
|
2,218
|
|
вода
|
2,00
|
|
0,341
|
|
Итого
|
100,00
|
17,064
|
17,064
|
Полученную из нутч-фильтра Ф-8 пасту раскладывают на поддоны,
которые затем помещают на полки шкафа вакуумной полочной сушилки СШ-9. Нагрев
осуществляют подачей воды внутрь полок.
Сушку проводят при остаточном давлении 250 мм. рт. ст. и
температуре 80 ºС в течение 2 часов. По
окончании сушки массовая доля влаги в продукте должна составлять не более 1,0%
(к.т. 4). После сушки технический ЭАА отправляется на следующую стадию.
Таблица 4.10. Получено на стадии ТП-4
|
Получено
|
|
Наименование продуктов, потерь и отходов
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
|
А. Сухой ЭАА, в том числе:
|
|
14,504
|
|
|
ЭАА
|
98,00
|
|
14,214
|
|
примеси
|
1,00
|
|
0,145
|
|
вода
|
1,00
|
|
0,145
|
|
Б. Летучие компоненты, в том числе:
|
|
2,270
|
|
|
примеси
|
91,35
|
|
2,073
|
|
вода
|
8,65
|
|
0,196
|
|
В. Потери ЭАА
|
|
0,290
|
0,290
|
|
Итого
|
|
17,064
|
17,064
|
ТП-5 Получение ЕН
Аппаратурное оформление стадии
. Мерник для этилового спирта М-11 - нержавеющий
стальной аппарат, вместимостью 0.320 м3, скоммуницирован с ЛУ,
снабжен выносным мерным стеклом.
. Реактор Р-12 - эмалированный стальной аппарат,
вместимостью 0,250 м3, снабжен якорной мешалкой, гладкой рубашкой,
приборами для измерения температуры и давления, скоммуницирован с ЛУ.
. Хранилище ЭС Х-10 - нержавеющий стальной аппарат,
вместимостью 1.6 м3, скоммуницирован с ЛУ.
Таблица 4.11. Загружено на стадии ТП-5
|
Загружено
|
|
Наименование полупродуктов и сырья
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Полупродукты: 1. Сухой ЭАА, в том числе
|
|
14,504
|
|
|
|
ЭАА
|
98,00
|
|
14,214
|
-
|
|
примеси
|
1,00
|
|
0,145
|
-
|
|
вода
|
1,00
|
|
0,145
|
0,145
|
|
Б. Сырьё: 1. ПА, в том числе
|
|
8,002
|
|
|
|
ПА
|
95,00
|
|
7,602
|
-
|
|
примеси
|
5,00
|
|
0,400
|
-
|
|
2. ЭС, и т.ч.
|
|
72,522
|
|
|
|
ЭС
|
96,00
|
|
69,622
|
88,129
|
|
вода
|
4,00
|
2,901
|
|
Итого
|
|
95,029
|
95,029
|
91,175
|
Предварительно сжатым азотом из хранилища Х-10 в мерник М-11
подают этиловый спирт, бункер шнекового питателя заполняют необходимым
количеством ПА. ЭАА загружается шнеком в реактор Р-12. Самотеком из мерника
М-11 загружается заданное количество этилового спирта и шнеком загружают ПА.
Включается мешалка, в рубашку аппарата подается рассол и реакционная масса
охлаждается до 5 - 10оС (к.т. 5). Смесь выдерживают в течение 12
часов при этой температуре. По окончании выдержки отбирают пробу для
определения конца реакции (к.т. 6). При удовлетворительном результате
реакционная передаётся на ТП-6 в нутч-фильтр Ф-13, в противном случае выдержку
увеличивают на 1 час.
Таблица 4.12. Получено на стадии ТП-5
|
Получено
|
|
Наименование продуктов, потерь и отходов
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Рекц.масса 2, в том числе
|
|
95,029
|
|
|
|
ЕН
|
13,18
|
|
12,522
|
-
|
|
ЭС
|
75,24
|
|
71,498
|
90,504
|
|
ЭАА
|
5,09
|
|
4,833
|
-
|
|
ПА
|
2,72
|
|
2,585
|
-
|
|
примеси
|
0,57
|
|
0,545
|
-
|
|
вода
|
3,21
|
|
3,046
|
3,046
|
|
Итого
|
100,00
|
95,029
|
95,029
|
93,550
|
ТП-6 Фильтрация ЕН
Аппаратурное оформление стадии
. Нутч-фильтр Ф-16 - стальной эмалированный аппарат
фильтрующего действия, закрытого типа, выгрузка с помощью ножа, рабочий объём
300 л.
. Приемник фильтрата Сб-14 - нержавеющий стальной
аппарат, вместимостью 0.500 м3.
Таблица 4.13. Загружено на стадии ТП-6
|
Загружено
|
|
Наименование полупродуктов и сырья
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Рекц.масса, в том числе
|
|
95,029
|
|
|
|
ЕН
|
13,18
|
|
12,522
|
-
|
|
ЭС
|
75,24
|
|
71,498
|
90,504
|
|
ЭАА
|
5,09
|
|
4,833
|
-
|
|
ПА
|
2,72
|
|
2,585
|
-
|
|
примеси
|
0,57
|
|
0,545
|
-
|
|
вода
|
3,21
|
|
3,046
|
3,046
|
|
Б. ЭС на промывку, в том числе
|
|
125,223
|
|
|
|
ЭС
|
96,00
|
|
120,214
|
152,170
|
|
вода
|
4,00
|
|
5,009
|
5,009
|
|
Итого
|
|
220,251
|
220,251
|
250,729
|
Операцию проводят в нутч-фильтре Ф-16. Фильтрат собирается в
сборник Сб-14 и направляется на регенерацию. Паста выгружается с помощью ножа и
передается на стадию перекристаллизации (ТП-7) в Р-15.
Таблица 4.14. Получено на стадии ТП-6
|
Получено
|
|
Наименование продуктов, потерь и отходов
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Паста ЕН, в том числе
|
|
14,437
|
|
|
|
ЕН
|
85,00
|
|
12,272
|
-
|
|
ЭС
|
7,00
|
|
1,011
|
1,280
|
|
примеси
|
3,00
|
|
0,433
|
-
|
|
вода
|
5,00
|
|
0,722
|
0,722
|
|
Б. Отходы: Фильтрат, в том числе
|
|
205,814
|
|
|
|
ЭС
|
92,66
|
|
190,701
|
241,394
|
|
примеси
|
3,66
|
|
7,529
|
-
|
|
вода
|
3,56
|
|
7,333
|
7,333
|
|
В. Потери ЕН
|
|
|
0,250
|
-
|
|
Итого
|
|
220,251
|
220,251
|
250,729
|
ТП-7 Перекристаллизация ЕН
Аппаратурное оформление стадии:
. Мерник для ЭС М-11 - нержавеющий стальной аппарат,
вместимостью 0.320 м3, скоммуницирован с ЛУ, снабжен выносным мерным
стеклом.
. Реактор для перекристаллизации Р-15 - стальной
аппарат, вместимостью 0.250 м3, снабжен якорной мешалкой, гладкой
рубашкой, приборами для измерения температуры и давления, скоммуницирован с ЛУ.
. Хранилище ЭС Х-10 - нержавеющий стальной аппарат,
вместимостью 1.6м3, скоммуницирован с ЛУ.
. Теплообменник Т-16 - вертикальный теплообменник из
углеродистой стали, условное давление 1.6 МПА, одноходовой.
Таблица 4.15. Загружено на стадии ТП-7
|
Загружено
|
|
Наименование полупродуктов и сырья
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Полупродукты: Паста ЕН, в том числе
|
|
14,437
|
|
|
|
ЕН
|
85,00
|
|
12,272
|
-
|
|
ЭС
|
7,00
|
|
1,011
|
0,628
|
|
примеси
|
3,00
|
|
0,433
|
-
|
|
вода
|
5,00
|
|
0,722
|
0,354
|
|
Б. Сырьё: ЭС, в том числе
|
|
144,374
|
|
|
|
ЭС
|
96,00
|
|
138,599
|
175,441
|
|
вода
|
4,00
|
|
5,775
|
5,775
|
|
Итого
|
|
158,812
|
158,812
|
182,198
|
В реактор Р-15 через мерник М-11 подается самотеком
необходимое количество этилового спирта. Включается мешалка и осуществляется
подача горячей воды в рубашку аппарата, реакционная масса нагревается до 70-72 оС
(к.т. 7) и перемешивается в течение 30 минут. Далее отключается мешалка, и
реакционная масса охлаждается путём прекращения подачи воды в рубашку.
Образовавшуюся суспензию подают на фильтрацию давлением сжатого азота (стадия
ТП-8).
Таблица 4.16. Получено на стадии ТП-7
|
Получено
|
|
Наименование продуктов, потерь и отходов
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Реакционная масса 3, в том числе
|
|
156,848
|
|
|
|
ЕН
|
6,57
|
|
10,308
|
-
|
|
ЭС
|
89,01
|
|
139,610
|
176,721
|
|
примеси
|
0,28
|
|
0,433
|
-
|
|
вода
|
4,14
|
|
6,497
|
6,497
|
|
Б. Потери
|
|
1,963
|
1,963
|
-
|
|
Итого
|
|
158,812
|
158,812
|
183,218
|
ТП-8 фильтрация ЕН
Аппаратурное оформление стадии
. Центрифуга Ц-17 - аппарат фильтрующего действия,
горизонтальный, выгрузка с помощью ножа, рабочий объём 200 л. Материал рабочих
частей - сталь.
. Приемник фильтрата Сб-14 - нержавеющий стальной
аппарат, вместимостью 0.500 м3.
Таблица 4.17. Загружено на стадии ТП-8
|
Загружено
|
|
Наименование полупродуктов и сырья
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Реакционная масса, в том числе
|
|
156,848
|
|
|
|
ЕН
|
6,57
|
|
10,308
|
-
|
|
ЭС
|
89,01
|
|
139,610
|
176,721
|
|
примеси
|
0,28
|
|
0,433
|
-
|
|
вода
|
4,14
|
|
6,497
|
6,497
|
|
Итого
|
100,00
|
156,848
|
156,848
|
183,218
|
Фильтрация проводится в центрифуге Ц-17. Фильтрат
направляется в сборник Сб-14 и затем на регенерацию. Паста с помощью ножа
выгружается и передается на стадию сушки (ТП-9) в полочную сушилку СШ-18.
Таблица 4.18. Получено на стадии ТП-8
|
Получено
|
|
Наименование продуктов, потерь и отходов
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
Объем, л
|
|
А. Паста ЕН, в том числе
|
|
11,824
|
|
|
|
ЕН
|
85,00
|
|
10,051
|
-
|
|
ЭС
|
8,00
|
|
0,946
|
1,197
|
|
примеси
|
2,00
|
|
0,236
|
-
|
|
вода
|
5,00
|
|
0,591
|
0,591
|
|
Б. Отходы: Фильтрат, в том числе
|
|
144,766
|
|
|
|
примеси
|
0,14
|
|
0,197
|
-
|
|
вода
|
4,08
|
|
5,906
|
5,906
|
|
ЭС
|
95,78
|
|
138,664
|
175,524
|
|
В. Потери
|
|
0,258
|
0,258
|
-
|
|
Итого
|
|
156,848
|
156,848
|
183,218
|
|
|
|
|
|
|
|
|
|
ТП-9 Сушка ЕН
1. Сушилка для ЕН Сш-18 - вакуумная полочная сушилка из
коррозионностойкой стали, оснащена системой автоматического регулирования
температуры, внутрь полок подают горячую воду. Объём 0.016 м3.
Таблица 4.20. Загружено на стадии ТП-9
|
Загружено
|
|
Наименование полупродуктов и сырья
|
Сод-е,%(масс.)
|
Масса техн., кг
|
Масса 100%, кг
|
|
А. Паста ЕН, в том числе
|
|
11,824
|
|
|
ЕН
|
85,00
|
|
10,051
|
|
ЭС
|
8,00
|
|
0,946
|
|
примеси
|
2,00
|
|
0,236
|
|
вода
|
5,00
|
|
0,591
|
|
Итого
|
100,00
|
11,824
|
11,824
|
Полученную из центрифуги Ц-17 пасту раскладывают на поддоны,
которые затем помещают на полки шкафа вакуумной полочной сушилки СШ-18. Нагрев
осуществляют подачей воды внутрь полок.
Сушка проводится при остаточном давлении 250 мм. рт. ст. и
температуре 50 ºС в течение 2 часов. По
окончании сушки массовая доля влаги в продукте должна составлять не более 0,5%
(к.т. 8). После сушки получается технический ЕН, который отправляется на склад
готовой продукции.
Таблица 4.21. Получено на стадии ТП-9
|
Получено
|
|
Наименование продуктов, потерь и отходов
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
|
А. Продукт: Сухой ЕН, в том числе
|
|
10,000
|
|
|
ЕН
|
99,00
|
|
9,900
|
|
примеси
|
0,50
|
|
0,050
|
|
вода
|
0,50
|
|
0,050
|
|
Б. Отходы: Летучие компоненты, в том числе
|
|
1,674
|
56,52
|
|
0,946
|
|
примеси
|
11,14
|
|
0,186
|
|
вода
|
32,34
|
|
0,541
|
|
В. Потери
|
|
0,151
|
0,151
|
|
Итого
|
|
11,824
|
11,824
|
.6
Контроль производства
Основные технологические параметры и контроль производства
приведены в таблице 4.21.
Таблица 4. 21. Основные технологические параметры и контроль
производства
|
Контрольная точка
|
Наименование объекта контроля
|
Контролируемый параметр и размерность
|
Норматив
|
Метод и средство контроля
|
|
Реактор Р-5, КТ-1
|
реакционная масса
|
температура, оС
|
138-140 оС
|
датчик с выводом на щите аппаратуры
|
|
Реактор Р-5, КТ-2
|
реакционная масса
|
конец реакции
|
наличие ЭАА в реакционной массе
|
ТСХ (цеховая лаборатория)
|
|
Реактор Р-5, КТ-3
|
реакционная масса
|
температура, оС
|
15-20 оС
|
датчик с выводом на щите аппаратуры
|
|
Сушилка Сш-9, КТ-4
|
осадок
|
остаточная влажность
|
не более 1,0%
|
гравиметрически (цеховая лаборатория)
|
|
Реактор Р-12, КТ-5
|
реакционная масса
|
температура, оС
|
5-10 оС
|
датчик с выводом на щите аппаратуры
|
|
Реактор Р-12, КТ-6
|
реакционная масса
|
конец реакции
|
наличие ЕН в реакционной массе
|
ТСХ (цеховая лаборатория)
|
|
Реактор Р-15, КТ-7
|
реакционная масса
|
температура, оС
|
70-72 оС
|
датчик с выводом на щите аппаратуры
|
|
Сушилка Сш-18, КТ-8
|
осадок
|
остаточная влажность
|
не более 0,5%
|
гравиметрически (цеховая лаборатория)
|
5.
Расчёт материального баланса производства N-бензил - (4-метоксифениламино)
акриламида
.1
Исходные данные для расчёта
Масштаб расчёта
Материальный баланс составлен на 1 кг технического N - бензил - 3 -
(4-метоксифениламино) 2-циано - акриламида (ЕН).
Состав технического енамина:
ЕН-100% γЕН=0,99
Примеси γприм=0,005
Вода γвода=0,005
Выходы по стадиям (узлам) производства
Узел 1 Конденсация БК η1=0.87
Узел 2 Кристаллизация р.м. η2=0.90
Узел 3 Фильтрация ЭАА η3=0.98
Узел 4 Сушка ЭАА η4=0.98
Узел 5 Получение ЕН η5=0.66
Узел 6 Фильтрация ЕН η6=0.98
Узел 8 Перекристаллизация ЕН η8=0.85
Узел 9 Фильтрация ЕН η9=0.98
Узел 10 Сушка продукта η10=0.98
Общий выход:
η∑= η1 *
η2 * η3 * η4 *
η5 * η6 * η7 *
η8 * η9 * η10 = 0.87 * 0.90 * 0.98 * 0.98 * 0.66 * 0.98
* 0.85* 0.98 *0.98=0,40.
Составы полупродуктов, растворов, паст, нормативных
механических потерь и прочие исходные данные взяты из экспериментальных данных.
Таблица 5.1. Молекулярные массы (М) веществ участвующих в
процессе
|
Вещество
|
М., г/моль
|
|
1
|
N-бензил-2-цианоацетамид
|
174
|
|
2
|
Триэтилортоформиат
|
148
|
|
3
|
Уксусный ангидрид
|
102
|
|
4
|
п-Анизидин
|
123
|
|
5
|
Этиловый спирт
|
46
|
Таблица 5.2. Содержание основного вещества в загружаемом
сырье и плотность
|
Вещество
|
γ
|
ρ, г/см3
|
|
1
|
N-бензил-2-цианоацетамид
|
0,98
|
|
|
2
|
Триэтилортоформиат
|
0,99
|
0,89
|
|
3
|
Уксусный ангидрид
|
0,97
|
1,082
|
|
4
|
п-Анизидин
|
0,95
|
|
|
5
|
Этиловый спирт
|
0,96
|
0,79
|
Определение расхода ключевого вещества
Соотношение мольных масс исходного вещества и конечного
продукта.

На 1 кг продукта необходимо загрузить следующее количество 100% N-бензил-2-цианоацетамид (БК):
GБК100% = GЕН100%*МБК/МЕН*ηΣ
= 0,990*174/307*0,40 =
1,403 кг
Соответственно загрузка технического БК составит:
GБКтехн = GБК100%/γБК = 1,403/0,98 = 1,432 кг
Количество примесей в техническом БК:
GБКприм = GБКтехн - GБК100% = 1,432 - 1,403 = 0,029 кг
.3
Расчет материального баланса по узлам (стадиям производства)
Узел 1: Конденсация БК
Баланс мольных масс:
* 174+ 1*148+ 1*102 =424 1*230+ 1*88+ 1*60+ 1*46=424
Загружено:
Количество БК:
GБК100% = GЕН100%*МБК/МЕН*ηΣ = 0,990*174/307*0,40 = 1,403 кг
GБКтехн = GБК100%/γБК = 1,403/0,98 = 1,432 кг
GБКприм = GБКтехн - GБК100% =1,432 - 1,403 = 0,029 кг
Количество ТЭОФ:
G ТЭОФ 100% = GБК100%*М ТЭОФ *υТЭОФ/МБК*υБК = 1,403*148*1/174*1 =
1,193 кг,
GТЭОФтехн = GТЭОФ100%/γТЭОФ = 1,193/0,98 = 1,217 кг
GТЭОФприм = GТЭОФтехн - GТЭОФ100% = 1,217 - 1,193 = 0,024
кг
Количество УА:
GУА100% = GБК100%*МУА*υУА/МБК*υБК = 1,403*102*1/174*1 = 0,822 кг;
GУАтехн = GУА100%/γУА = 0,822/0,97 = 0,847 кг
GУАприм = GУАтехн - GУА100% = 0,847 - 0,822 = 0,025 кг
Итого в узле 1 загружено: GΣ = GБКтехн + GТЭОФтехн + GУАтехн = 1,432 + 1,217 + +0,847= 3,496 кг
Получено:
БК, вступивший в реакцию: GБКреакц = 1,403*η1 = 1,403*0,87 =1,221 кг
БК осталось: GБКост = GБК100% - GБКреакц = 1,403 - 1,221 = 0,182 кг
ТЭОФа прореагировало: GТЭОФреакц = GБКреакц*МТЭОФ*1/МБК
= 1,221*148*1/174*1 = 1,038 кг
ТЭОФа осталось: GТЭОФост = GТЭОФ100% - GТЭОФреакц =1,193 - 1,038 = 0,155
кг
УА прореагировало: GУАреакц = GБКреакц*МУА*1/МБК =
1,221*102*1/174*1 = 0,716 кг
УА осталось: GУАост = GУА100% - GУАреакц = 0,822 - 0,716 = 0,106 кг
Образовалось в ходе реакции:
ЭАА: GЭАА= GБКреакц*МЭАА*
υЭАА /МБК* υБК = 1,221*230*1/174*1 = 1,613 кг;
Этилацетата: Gэ = GБКреакц *Мэ*υэ/МБК*υБК = 1,221*88*1/ 174*1 = 0,617 кг
Этилового спирта: GЭС =GБКреакц *МЭС*υЭС/МБК*υБК=1,221*46*1/ 174*1=0,323 кг
Метилацетата: Gм =GБКреакц *Мм*υм/МБК*υБК=1,234*60*1/ 174*1= 0,421 кг
Без изменения остается загруженное количество воды и
примесей.
Gприм = 0,029 кг,
Gвод = 0,050 кг
Итого в узле 1 получено: GΣ = GЭААобр + Gэобр + GЭСобр + Gмобр +GБКост + GТЭОФост + GУАост + Gприм+ Gвод = 1,613 + 0,617 + 0,323
+ 0,421+0,182+0,155+0,106+0,029+ 0,050= 3,496 кг
Таблица 5.3. Стадия ТП-1. Материальный баланс конденсации БК
(узел 1)
|
Загружено
|
Получено
|
|
Сырьё
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
продукты
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
|
1. БКтехн, в том числе
|
|
1,432
|
|
1. реакц. масса, в том числе
|
|
3,496
|
|
|
БК
|
98,00
|
|
1,403
|
ЭАА
|
46,15
|
|
1,613
|
|
примеси
|
2,00
|
|
0,029
|
этилацетат
|
17,66
|
|
0,617
|
|
2. ТЭОФ, в том числе
|
|
1,217
|
|
метилацетат
|
12,04
|
|
0,421
|
|
ТЭОФ
|
98,00
|
|
1,193
|
ЭС
|
9,23
|
|
0,323
|
|
вода
|
2,00
|
|
0,024
|
БК (ост)
|
5,22
|
|
0,182
|
|
3. УА, в том числе
|
|
0,847
|
|
ТЭОФ(ост)
|
4,43
|
|
0,155
|
|
УА
|
97,00
|
|
0,822
|
УА(ост)
|
3,05
|
|
0,106
|
|
вода
|
3,00
|
|
0,025
|
примеси
|
0,82
|
|
0,029
|
|
|
|
|
вода
|
1,42
|
|
0,050
|
|
Итого
|
|
3,496
|
3,496
|
Итого
|
100,00
|
|
3,496
|
Узел 2: Кристаллизация ЭАА
Выход на стадии: η2=0,90
Загружено:
Реакционная масса из узла 1: GЭААрм=3,496 кг, в том числе GЭАА100%= 1,613 кг
Итого в узле 2 загружено: GΣ = GЭААрм = 3,496 кг
Получено:
Количество ЭАА с учетом выхода по стадии:
GЭАА = GЭАА100%* 0,90 = 1,452 кг
ЭАА, оставшийся в растворе:
GЭААраств = GЭАА100% - GЭАА = 1,613 - 1,452 = 0,161 кг
Количество остальных компонентов в осадке:
вода: Gводсусп. = Gводрм = 0,050 кг;
примеси: Gпримсусп.= Gпримрм + Gэрм + Gмрм +GЭСрм + GБКрм +GТЭОФрм+ GУАрм = 0,029 + 0,617 + 0,421+
0,323+0,182+0,155+0,106 = 1,833 кг;
Итого в узле 2 получено: GΣ = Gводсусп. + Gпримсусп.+ GЭААраств + GЭАА = 0,050 + 1,833 + 0,161
+1,452 = 3,496 кг
Таблица 5.4. Стадия ТП-2. Кристаллизация ЭАА (узел 2)
|
Загружено
|
Получено
|
|
Сырьё
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
продукты
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
|
1. реакц. масса, в том числе:
|
|
3,496
|
|
1. Суспензия, в том числе:
|
|
3,496
|
|
|
ЭАА
|
46,15
|
|
1,613
|
ЭАА(осадок)
|
41,53
|
|
1,452
|
|
этилацетат
|
17,66
|
|
0,617
|
ЭАА (в р-ре)
|
4,61
|
|
0,161
|
|
метилацетат
|
12,04
|
|
0,421
|
примеси
|
52,43
|
|
1,833
|
|
ЭС
|
9,23
|
|
0,323
|
вода
|
1,42
|
|
0,050
|
|
БК
|
5,22
|
|
0,182
|
|
|
|
|
|
ТЭОФ
|
4,43
|
|
0,155
|
|
|
|
|
|
УА
|
3,05
|
|
0,106
|
|
|
|
|
|
примеси
|
0,82
|
|
0,029
|
|
|
|
|
|
вода
|
1,42
|
|
0,050
|
|
|
|
|
|
Итого
|
100,00
|
|
3,496
|
Итого
|
100,00
|
|
3,496
|
Узел 3: Фильтрация ЭАА
Выход на стадии η3 = 0,98
Состав пасты ЭАА после фильтрации:
ЭАА γЭАА = 0,85;
вода γвода = 0,02;
примеси γприм = 0,13.
Загружено:
Суспензия ЭАА с ТП-2, в том числе ЭАА:G∑ = 3,496 кг, GЭАА=1,452 кг.
Вода на промывку: Gводпромыв= GЭАА100% * 10 = 1,452*10 = 14,521 кг
Итого в узле 3 загружено: GΣ = G∑ + Gводпромыв = 18,017 кг
Получено:
Количество ЭАА в пасте с учетом выхода по стадии:
GЭААпаста = GЭАА*η3 = 1,452 * 0,98 = 1,423
кг
Масса всей Пасты: Gпаста = GЭААпаста/0,85 = 1,423/0,85 = 1,674 кг
Количество остальных компонентов в пасте:
вода: Gводпаста = Gпаста*0,13 = 1,674*0,13 = 0,033 кг;
примеси: Gпримпаста = Gпаста *0,02 = 1,674 *0,02 =
0,218 кг
Количество компонентов в фильтрате:
потери ЭАА: GЭААпотерь = GЭАА - GЭААпаста = 1,452 - 1,423 = 0,029 кг;
вода: Gводфильтр = Gводсусп.п + Gводпромыв - Gводпаста = 0,050 +14,521 -0,033 = 14,537 кг;
примеси: Gпримфильтр = Gпримсусп.+ GЭААраств - Gпримпаста = 1,833 +0,161 - 0,218=
1,777 кг.
Итого в узле 3 получено: GΣ= GПаста + GЭААпотерь + Gводфильтр + Gпримфильтр = 1,674 + 0,029 + 14,537
+ 1,777 = 18,017 кг
Таблица 5.5. Стадия ТП-3. Фильтрация ЭАА (узел 3)
|
Загружено
|
Получено
|
|
Сырьё
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
Продукты
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
|
1. Суспензия, в том числе
|
|
3,496
|
|
1. Паста, в том числе
|
|
1,674
|
|
|
ЭАА(осадок)
|
41,53
|
|
1,452
|
ЭАА
|
85,00
|
|
1,423
|
4,61
|
|
0,161
|
примеси
|
13,00
|
|
0,218
|
|
примеси
|
52,43
|
|
1,833
|
вода
|
2,00
|
|
0,033
|
|
вода
|
1,42
|
|
0,050
|
2. Фильтрат, в том числе
|
|
16,343
|
|
|
2. Вода на промывку
|
|
14,521
|
14,521
|
ЭАА
|
0,18
|
|
0,029
|
|
|
|
|
примеси
|
10,87
|
|
1,777
|
|
|
|
|
вода
|
88,95
|
|
14,537
|
|
Итого
|
|
18,017
|
18,017
|
Итого
|
|
18,017
|
18,017
|
Узел 4: Сушка ЭАА
Выход на стадии η4 = 0,98
Загружено:
Вся Паста из узла 3: Gпаста = 1,674 кг, в том числе GЭАА = 1,423 кг
Итого в узле 4 загружено: GΣ = Gпаста = 1,674 кг
Получено:
Состав сухого ЭАА:
ЭАА γЭАА = 0,98;
вода γвода = 0,01;
примеси γприм = 0,01.
Количество ЭАА с учетом выхода: GЭАА100% = GЭААпаста *0,98 = 1,423 *0,98 =
1,395 кг;
Количество сухого ЭАА: GЭААсух = GЭАА100%/0,98 = 1,395/0,98 =
1,423 кг;
Количество остальных компонентов в сухом продукте:
вода: Gводсух = GЭААсух* γвод = 1,423 *0,01 = 0,014
кг;
примеси: Gпримсух = GЭААсух * γприм = 1,423 *0,01 = 0,014 кг
Количество летучих компонентов:
вода: Gводлетуч = Gводпаста - Gводсух = 0,033 - 0,014 = 0,019 кг;
примеси: Gпримлетуч = Gпримпаста - Gпримсух = 0,218 - 0,014 = 0,203
кг
Механические потери ЭАА: GЭААпотерь = GЭААпаста - GЭАА100% = 1,423 - 1,395 = 0,028
кг
Итого в узле 4 получено: GΣ = Gосад + Gводлетуч + Gпримлетуч + GЭААпотерь = 1,423 + 0,019 + 0,203
+ 0,028 = 1,674 кг
Таблица 5.6. Стадия ТП-4. Сушка ЭАА (узел 4)
|
Загружено
|
Получено
|
|
Сырьё
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
Продукты
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
|
1. Паста, в том числе
|
|
1,674
|
|
1. Сухой ЭАА, в том числе
|
|
1,423
|
|
|
ЭАА
|
85,00
|
|
1,423
|
ЭАА
|
98,00
|
|
1,395
|
|
примеси
|
13,00
|
|
0,218
|
примеси
|
1,00
|
|
0,014
|
|
вода
|
2,00
|
|
0,033
|
вода
|
1,00
|
|
0,014
|
|
|
|
|
2. Летучие, в том числе
|
|
0,223
|
|
|
|
|
|
примеси
|
91,35
|
|
0,203
|
|
|
|
|
вода
|
8,65
|
|
0,019
|
|
|
|
|
3. Потери
|
|
0,028
|
0,028
|
|
Итого
|
100,00
|
1,674
|
1,674
|
Итого
|
|
1,674
|
1,674
|
Узел 5: Получение ЕН
Баланс мольных масс:
*1 + 123*1 = 353 307*1 + 46*1 = 353
Выход на стадии: η5 = 0,66
Загружено:
ЭАА технический: GЭАА = 1,423 кг, в том числе GЭАА100% = 1,395 кг;
Количество ПА: GПА100% =GЭАА*МПА*υПА/МЭАА=1,395*123*1/230=0,746
кг;
GПАтехн = GПА100%/γПА = 0,746/0,95 = 0,785 кг;
GПАприм= GПАтехн - GПА100% = 0,785 - 0,746 = 0,039 кг
Количество этилового спирта с учетом удельной загрузки:
GЭС= GЭААтехн*10 = 1,423*5 = 7,115 кг;
GЭС100% = GЭСтехн*γЭС = 7,115*0,96 = 6,831 кг;
GЭСвод= GЭСтехн - GЭС100% = 7,115 - 6,831 = 0,285 кг
Итого в узле 5 загружено: GΣ = GЭААтехн + GПАтехн + GЭС = 1,423 +0,785+ 7,115 = 9,323 кг.
Получено:
ЭАА прореагировало: GЭААреакц = GЭАА*η5 = 1,395*0,66 = 0,931 кг;
ЭАА осталось: GЭААост = GЭАА - GЭААреак = 1,395 - 0,931 = 0,474 кг
С учетом выхода вступило в реакцию ПА: GПАреакц = GЭАА*МПА*η5*1/МЭАА*1 = 1,395*123*0,66*1/230*1 = 0,492 кг;
ПА осталось: GПАост = GПА100% - GПАреакц = 0,746 - 0,492 = 0,254 кг
В ходе реакции образуется:
ЕН: GЕНреак = GЭАА*МЕН*
η5/МЭАА =
1,395*307*0,66/230 = 1,229 кг;
Этилового спирта: GЭСрм = GЭАА*МЭС*υЭС* η5/МЭАА = 1,395*46*1* 0,66/230 = 0,184 кг
Без изменения остается загруженное количество примесей, воды
и этилового спирта:
Gприм = 0,014 + 0,039 = 0,053 кг;
Gвода = 0,014 + 0,285= 0,299 кг;
GЭС = 6,831 кг
Итого в узле 5 получено: GΣ = GЕН+ GЭААост + GПАост + GЭСрм+ Gприм + Gвода + GЭС= 1,229 + 0,474+ 0,254 + 0,184 + 0,053 + 0,299 + 7,015 = 9,323 кг
Таблица 5.7. Стадия ТП-5. Получение ЕН (узел 5)
|
Загружено
|
Получено
|
|
Сырьё
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
Продукты
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
|
1. Сухой ЭАА, в том числе
|
|
1,423
|
|
1. Рекц.масса, в том числе
|
|
9,323
|
|
|
ЭАА
|
98,00
|
|
1,395
|
ЕН
|
13,18
|
|
1,229
|
|
примеси
|
1,00
|
|
0,014
|
ЭС
|
75,24
|
|
7,015
|
|
вода
|
1,00
|
|
0,014
|
ЭАА
|
5,09
|
|
0,474
|
|
2. ПА, в том числе
|
|
0,785
|
|
ПА
|
2,72
|
|
0,254
|
|
ПА
|
95,00
|
|
0,746
|
примеси
|
0,57
|
|
0,053
|
|
примеси
|
5,00
|
|
0,039
|
вода
|
3,21
|
|
0,299
|
|
3. ЭС, и т.ч.
|
|
7,115
|
|
|
|
|
|
|
ЭС
|
96,00
|
|
6,831
|
|
|
|
|
|
вода
|
4,00
|
|
0,285
|
|
|
|
|
|
Итого
|
|
9,323
|
9,323
|
Итого
|
100,00
|
9,323
|
9,323
|
Узел 6: Фильтрация ЕН
Выход на стадии η6 = 0,98
Загружено:
Вся реакционная масса из узла 5: Gр.м = 9,323 кг, в том числе
енамина GЕНр.м = 1,229 кг
Этиловый спирт на промывку: GЭСтехн = 12,286 кг;
GЭС100% = 12,286 * 0,96 = 11,794 кг;
GЭСприм = 0,491 кг
Итого в узле 6 загружено: GΣ = Gр.м + GЭСтехн = 9,323 + 12,286 = 21,609 кг
Получено:
Состав пасты ЕН после фильтрации:
ЕН γен = 0,85;
вода γвода = 0,05;
примеси γприм = 0,03;
ЭС γЭС = 0,07.
Количество ЕН в пасте с учетом выхода по стадии: GЕНосад = GЕНр.м*η6 = 1,229 * 0,98 = 1,204 кг;
Масса всей пасты: Gпаста = GЕНосад/0,85 = 1,204 / 0,85 = 1,416 кг
Количество остальных компонентов в пасте:
вода: Gпаставод = Gпаста*0,05 = 1,416*0,05 =
0,071 кг;
примеси: Gпастаприм = Gпаста *0,03 = 1,416 *0,03 =
0,042 кг;
ЭС: Gпастаэа = Gпаста *0,07 = 1,416 *0,07 =
0,099 кг
Количество компонентов в фильтрате:
потери енамина: GЕНпотерь = GЕНр.м - GЕНпаста = 1,229 - 1,204 = 0,025 кг;
вода: Gводфильтр = Gводр.м +GводЭС - Gпаставод = 0,299+0,491 - 0,071 = 0,719 кг;
ЭС: GЭСфильтр = GЭСр.м + GЭСпромыв - GПастаЭС = 7,015 + 11,794 - 0,099 = 18,710 кг
примеси: Gпримфильтр= (Gпримрм + GЭАА + GПА) - Gпримпаста = (0,053+0,474+0,254)
-0,042=0,739 кг
Итого в узле 6 получено: GΣ= Gпаста + GЕНпотерь + Gводфильтр + GЭСфильтр + Gпримфильтр = 1,416 + 0,025 + 0,719 + 18,710+0,739 =
21,609 кг
Результаты расчета сводим в таблицу 5.8
Таблица 5.8. Стадия ТП-6. Фильтрация ЕН (узел 6)
|
Загружено
|
Получено
|
|
Сырьё
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
Продукты
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
|
1. Рекц.масса, в том числе
|
|
9,323
|
|
1. Осадок ЕН, в том числе
|
|
1,416
|
|
|
ЕН
|
13,18
|
|
1,229
|
ЕН
|
85,00
|
|
1,204
|
|
ЭС
|
75,24
|
|
7,015
|
ЭС
|
7,00
|
|
0,099
|
|
ЭАА
|
5,09
|
|
0,474
|
примеси
|
3,00
|
|
0,042
|
|
ПА
|
2,72
|
|
0,254
|
вода
|
5,00
|
|
0,071
|
|
примеси
|
0,57
|
|
0,053
|
2. Фильтрат, в том числе
|
|
20,193
|
|
|
вода
|
3,21
|
|
0,299
|
ЕН
|
0,12
|
|
0,025
|
|
2. ЭС на промывку, в том числе
|
|
12,286
|
|
ЭС
|
92,66
|
|
18,710
|
|
ЭС
|
96,00
|
|
11,794
|
примеси
|
3,66
|
|
0,739
|
|
вода
|
4,00
|
|
0,491
|
вода
|
3,56
|
|
0,719
|
|
Итого
|
|
21,609
|
21,609
|
Итого
|
100
|
21,609
|
21,609
|
Узел 7: Перекристаллизация ЕН
Выход на стадии η7 = 0,85
Загружено:
Осадок ЕН с ТП-6, в том числе ЕН: G∑осад = 1,416 кг,
GЕНосад = 1,204 кг
Этиловый спирт с учетом удельной загрузки: GЭСтехн= G∑осад*10 = 1,416 * 10 = 14,165
кг,
GЭС100% = GЭС * γЭС= 14,165* 0,96 = 13,598
кг;
Gвода = GЭСтехн - GЭС100% = 14,165 - 13,598 = 0,567 кг
Итого в узле 7 загружено: GΣ = Gосад + Gспирттехн = 1,416+ 14,165 = 15,581 кг
Получено:
Количество енамина с учетом выхода по стадии:
GЕН = GЕНосад * η7 = 1,204*0,85 = 1,023 кг
Количество воды: Gвод = Gводосад + Gводспирт = 0,071 + 0,567 = 0,637 кг;
Количество остальных компонентов в растворе:Gприм = 0,042 кг,
GЭС = 13,697 кг.
Потери ЕН: GЕНпотерь = GЕНосад - GЕН = 1,204 - 1,023 = 0,181 кг
Итого в узле 7 получено: GΣ = GЕН + Gприм + GЭС +Gвода + GЕНпотерь = 1,023 + 0,042 + 13,697 +0,637 + 0,181= 15,581 кг.
Таблица 5.9. Стадия ТП-7. Перекристаллизация ЕН (узел 7)
|
Загружено
|
Получено
|
|
Сырьё
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
продукты
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
|
1. Осадок ЕН, в том числе
|
|
1,416
|
|
1. Реакционная масса, в том числе
|
|
15,401
|
|
|
ЕН
|
85,00
|
|
1,204
|
ЕН
|
6,65
|
|
1,023
|
|
ЭС
|
7,00
|
|
0,099
|
ЭС
|
88,94
|
|
13,697
|
|
примеси
|
3,00
|
|
0,042
|
примеси
|
0,28
|
|
0,042
|
|
вода
|
5,00
|
вода
|
4,14
|
|
0,637
|
|
2. ЭС, в том числе
|
|
14,165
|
|
2. Потери
|
|
0,181
|
0,181
|
|
ЭС
|
96,00
|
|
13,598
|
|
|
|
|
|
вода
|
4,00
|
|
0,567
|
|
|
|
|
|
Итого
|
|
15,581
|
15,581
|
Итого
|
|
15,581
|
15,581
|
Узел 8: Фильтрация ЕН
Выход на стадии η8 = 0,98
Загружено:
Вся реакционная масса из узла 7: Gр.м = 15,401 кг, в том числе
ЕН
GЕНр.м = 1,023 кг
Итого в узле 7 загружено: GΣ = Gр.м = 15,401 кг
Получено:
Состав пасты ЕН после фильтрации:
ЕН γен = 0,85;
вода γвода = 0,05;
примеси γприм = 0,02;
ЭС γЭС= 0,08.
Осадок ЕН с учетом выхода по стадии: GЕНосад = GЕНр.м*η8 = 1,023 * 0,98 = 1,003 кг;
Масса всей пасты: Gпаста = GЕНосад/0,85 = 1,003 / 0,85 = 1,180 кг
Количество остальных компонентов в пасте:
вода: Gводпаста= Gпаста*0,05 = 1,180*0,05 = 0,059 кг;
примеси: Gпримпаста = Gпаста *0,03 = 1,180 *0,02 =
0,024 кг;
ЭС: GЭСпаста = Gпаста *0,07 = 1,180 *0,08 = 0,094 кг
Количество компонентов в фильтрате:
примеси: Gпримфильтр = 0,019 кг
потери ЕН: GЕНпотерь = GЕНр.м - GЕНпаста = 1,023 - 1,003 = 0,020 кг;
вода: Gводфильтр = Gводр.м - Gводпаста = 0,637 - 0,059 = 0,578 кг;
ЭС: GЭСфильтр = GЭСр.м - GЭСпаста = 13,697 - 0,094 = 13,603 кг
Итого в узле 8 получено: GΣ= Gпаста + GЕНпотерь + Gводфильтр + GЭСфильтр +Gпримфильтр = 1,180 + 0,020 + 0,578 +
13,603 + 0,019 = 15,401 кг
Таблица 5.10. Стадия ТП-8. Фильтрация ЕН (узел8)
|
Загружено
|
Получено
|
|
Сырьё
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
Продукты
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
|
1. Реакционная масса, в том числе
|
|
15,401
|
|
1. Паста ЕН, в том числе
|
|
1,180
|
|
|
ЕН
|
6,65
|
|
1,023
|
ЕН
|
85,00
|
|
1,003
|
|
ЭС
|
88,94
|
|
13,697
|
ЭС
|
8,00
|
|
0,094
|
|
примеси
|
0,28
|
|
0,042
|
примеси
|
2,00
|
|
0,024
|
|
вода
|
4,14
|
|
0,637
|
вода
|
5,00
|
|
0,059
|
|
|
|
|
2. Фильтрат, в том числе
|
|
14,200
|
|
|
|
|
|
примеси
|
0,13
|
|
0,019
|
|
|
|
|
вода
|
4,07
|
|
0,578
|
|
|
|
|
ЭС
|
95,79
|
|
13,603
|
|
|
|
|
3. Потери
|
|
0,020
|
0,020
|
|
Итого
|
100,00
|
15,401
|
15,401
|
Итого
|
|
15,401
|
15,401
|
Узел 9: Сушка ЕН
Выход на стадии η9 = 0,98
Загружено:
Вся паста из узла 8: Gосад = 1,180 кг, в том числе GЕН = 1,003 кг
Итого в узле 9 загружено: GΣ = Gосад = 1,180 кг
Получено:
Состав сухого ЕН:
ЕН γЕН = 0,99;
вода γвод = 0,005;
примеси γприм = 0,005.
Количество ЕН с учетом выхода: GЕНсух = GЕНпаста *0,98 = 1,003 *0,98 =
0,990 кг;
Количество технического ЕН: GЕН = GЕН сух/0,98 = 0,990/0,98 =
1,000 кг;
Количество остальных компонентов в сухом продукте:
вода: Gводсух = GЕН * γвод = 1,000*0,005 = 0,005
кг;
примеси: Gпримсух = GЕН * γприм = 1,000*0,005 = 0,005 кг
Количество летучих компонентов:
ЭС: GЭСлетуч = 0,094 кг;
примеси: Gпримлетуч = Gпастаприм - Gпримсух = 0,024 - 0,005 = 0,019
кг;
вода: Gводлетуч = Gпаставод - Gводсух = 0,059 - 0,005 = 0,054
кг
Механические потери ЕН: GЕНпотерь=GЕН - GЕНсух =1,003 - 0,990 =0,013
кг.
Итого в узле 9 получено: GΣ = Gосад + GЭСлетуч + Gпримлетуч + Gводалетуч + GЕНпотерь = 1,000 + 0,094 + 0,019
+ 0,054 + 0,013 = 1,180 кг
Таблица 5.11. Стадия ТП-9. Сушка ЕН (узел 9)
|
Загружено
|
Получено
|
|
Сырьё
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
Продукты
|
сод-е,%(масс.)
|
масса техн., кг
|
масса 100%, кг
|
|
1. Осадок ЕН, в том числе
|
|
1,180
|
|
1. Сухой ЕН, в том числе
|
|
1,000
|
|
|
ЕН
|
85,00
|
|
1,003
|
ЕН
|
99,00
|
|
0,990
|
|
ЭС
|
8,00
|
|
0,094
|
примеси
|
0,50
|
|
0,005
|
|
примеси
|
2,00
|
|
0,024
|
вода
|
0,50
|
|
0,005
|
|
вода
|
5,00
|
|
0,059
|
2. Летучие, в том числе
|
|
0,167
|
|
|
|
|
|
ЭС
|
56,53
|
|
0,094
|
|
|
|
|
примеси
|
11,14
|
|
0,019
|
|
|
|
|
вода
|
32,34
|
|
0,054
|
|
|
|
|
3. Потери
|
|
0,013
|
0,013
|
|
Итого
|
100,00
|
1,180
|
1,180
|
Итого
|
|
1,180
|
1,180
|
Получено 1,000 кг технического N-бензил -
(4-метоксифениламино) акриламид состава: ЕН 0,990 кг (99%), вода 0,005 кг
(0,5%), примеси 0,005 кг (0,5%).
.4
Сводка расходных коэффициентов сырья
Растворители в данном производстве
подвергаются регенерации, это необходимо учесть при составлении данных о
расходных коэффициентах. Процент регенерации составляет 90%.
Количество 100%-го ЭС на первую загрузку
составляет 32,223 кг. На все последующие операции количество загружаемого ЭС с
учетом регенерируемого ЭС составит: GЭСрег = 32,223 *(1-0,9) = 3,222 кг, GЭС.технрег = 3,357 кг
Таблица 5.12. Расходные нормы сырья на
производство 1 кг ЕН
|
Наименование сырья и материалов
|
Содержание основного вещества,%
|
Расходная норма на 1 кг ЕН
|
|
|
Масса техн-го вещества
|
Масса 100%-го вещества
|
|
N-бензил-2-цианоацетамид
|
0,98
|
1,432
|
1,403
|
|
Триэтилортоформиат
|
0,99
|
1,217
|
1,193
|
|
Уксусный ангидрид
|
0,97
|
0,847
|
0,822
|
|
п-Анизидин
|
0,95
|
0,785
|
0,746
|
|
ЭС
|
0,96
|
3,222
|
3,357
|
|
Вода
|
1,00
|
14,521
|
14,521
|
|
Материальный индекс производства (с учетом
регенерации растворителей) -22,042 кг/кг
|
6.
Технологические расчеты основного и вспомогательного оборудования
Материальный баланс стадий рассчитан исходя из возможной
потребности в наработке продукта в количестве 100 кг на 10 дней. Период
процесса получения ЕН:
конденсация 12 часов,
присоединение 12 часов,
Число операций в сутки для узкой стадии:
α = 24/τконден. = 24/12 = 2.
Принимаем, что за сутки производится 2 операции, но так как
объёмы поступаемого сырья конденсации невелики, целесообразнее производить 1
операцию в сутки, для всех остальных стадий принимаем α = const.
С каждой операции получается продукта G = 100/10 = 10 кг.
.1
Расчет основного оборудования
Для мелкосерийного производства (с учетом заданной мощности)
объём реактора рассчитывается по общей формуле:
Vа,расч = 100 кг*G1кг,i*(1+z)/10 дн*ρi*
α*φ, где
G1кг,I - количество
перерабатываемого материала на 1 кг готовой продукции на i-ой установке,
z - запас мощности на i-ой установке,
ρi - плотность реакционной
массы i-ой
установке,
α - число операций в сутки,
φ - коэффициент заполнения.
. Расчет реактора для конденсации (Р-5)
Vа,расч = 100*3,496*(1+0,1)/10*1*0,75 =51,275 л = 0,052
м3
Vа,ст =0,063 м3
. Расчет реактора для получения енамина (Р-12)
Vа,расч = 100*9,323*(1+0,1)/10*1*0,75 = 136,73 л = 0,137
м3
Vа,ст = 0,160 м3
. Расчет реактора для перекристаллизации (Р-15)
Vа,расч = 100*15,401*(1+0,1)/10*1*0,75 = 225,881 л =
0,226 м3
Vа,ст = 0,250 м3
6.2.
Расчет и выбор вспомогательного оборудования
Мерники
Расчет ведется по общей формуле:
Vм = Gопер/(ρi*φм), где
опер - масса операционной загрузки i-ого вида сырья в
реактор, кг/опер;
ρi - плотность i-ого вида сырья;
φм - коэффициент заполнения
мерника для i-ого
вида сырья.
1) мерник для ТЭОФ (М-2)
Vм = 12,173/(890*0,9) = 0,015 м3
Vм,ст = 0,016 м3
2) мерник для УА (М-4)
Vм = 8,474/(1082*0,9) = 0,009 м3
Vм,ст = 0,010 м3
3) мерник для раствора этилового спирта (М-11)
Vм = 72,522/(790*0,9) = 0,102 м3(в Р-12)
Vм = 144,374/(790*0,9) = 0,203 м3 (в
Р-15)
Vмсумм = 0,305 м3
Vм,ст = 0,320 м3
Сборники
Полный объем хранилища для i-ого вида сырья Va
рассчитывают по формуле:
Vхран = Vсут*Y/φхран,
где Vсут - суточный объемный расход i-ого вида сырья, м3/сут;
Y - коэффициент запаса i-ого вида жидкого сырья, сутки, Y = 1;
φхран - коэффициент заполнения
сборника, доли единицы, φхран = 0,9.
) Сборник для водной части (Сб-7)
Vсб = 148,161*10-3/0,9 = 0,165 м3
Vсб,ст = 0,200 м3
2) Сборник для спиртовой части (Сб-14)
Vсб = (241,394+175,524)*10-3/0,9 = 0,463
м3
Vсб,ст = 0,500 м3
Фильтры
Выбор фильтров
Для фильтрации ЭАА и ЕН выбираем стальные
эмалированные нутч-фильтры, предназначенные для фильтрования кристаллизующихся
неагрессивных сред под небольшим давлением (не более 0,4 Мпа). Тип фильтрующей
поверхности - бельтинг. Площадь фильтрующей поверхности - 0,4 м2.
Выгрузка с помощью ножа. Покрытие универсальное стекловидное высшего. Условное
обозначение НСэ 0,4-0,200-12-01 закрытого типа. (рабочий объем 200 л) и НСэ
0,4-0,300-12-01 (рабочий объём 300 л).
Для фильтрации готового ЕН выбираем
центрифугу для более тщательного разделения суспензий, детали центрифуги для ЕН
выполнены из стали. Условное обозначение: ФГН-1253К-01
Расчет ведется по общей формуле:
Gпаст i = Gpмоп · аj / γi,
Gпаст i - количество пасты,
которое образуется после фильтрования;
Gpмоп - общая масса смеси,
которая поступает на центрифугу;
аj - массовая доля j-того вещества, твердого
продукта, который необходимо отделить;
γi - содержание вещества в
пасте после фильтрования;
) Нутч-фильтр для реакционной массы 1
(Ф-8):
Gпаст i = 183,245 ·
0,079/0,85 = 17,03 кг;
) Нутч-фильтр для реакционной массы 2
(Ф-13):
Gпаст i = 220,251·
0,056/0,85= 14,51 кг;
) Центрифуга для реакционной массы 3
(Ц-17):
Gпаст i = 156,848 ·
0,065/0,85 = 11,99 кг;
Расчет объёмов хранилищ
Полный объем хранилища для i-ого вида сырья Va
рассчитывают по формуле:
Vхран = Vсут * Y / φхран,
Vсут - суточный объемный расход i-ого вида сырья, м3/сут;
Y - коэффициент запаса хранимого i-ого вида жидкого сырья, сутки,
Y =4;
φхран - коэффициент заполнения
хранилища, доли единицы, φхран =0,9.
). Хранилище для УА (Х-1)
Vхр = 13,404*4*10-3/0,9 = 0,061 м3
Vхр,ст = 0,063 м3
2). Хранилище для Уксусного ангидрида (Х-3)
Vхр = 7,851*4*10-3/0,9 = 0,035 м3
Vхр,ст = 0,040 м3
3). Хранилище для этилового спирта (Х-10)
Vхр = (91,03+157,179+181,216)*4*10-3/0,9
= 1,909 м3
Vхр,ст = 2,00 м3
Сушильное оборудование
Сушилка для ЭАА и готового продукта (ЕН) полочная вакуумная
во взрывозащищенном исполнении ПВ - 4,5-0,025ВК-01, ПВ - 4,5-0,016ВК-01 ТУ
26-01-808-80, в которой создан вакуум 250 мм. рт. ст. и внутрь полок подают
воду.
.3
Ведомость-спецификация оборудования
Таблица 6.1. Ведомость-спецификация оборудования
|
Обозначение
|
Кол-во единиц
|
Материал рабочей зоны
|
Техническая характеристика
|
|
Реакторы
|
|
Р-5
|
1
|
Сталь 12Х18Н10Т
|
Реакторная система Estrella, Швейцария,
обозначение ES-R-63 Стальной аппарат с эллиптическим днищем и съёмной
крышкой, снабжён трубой передавливания, огнепреградителем, гладкой
термостатируемой рубашкой. Вместимость аппарата 0,063 м3. Аппарат
снабжен якорной мешалкой, барометром, термометром, нижним сливом, устройством
для взятия проб и ввода добавок. Предназначен для проведения различных
химических и физических процессов с агрессивными средами. Мощность двигателя
0,75 кВт, частота вращения мешалки - 50 об/мин, условное давление 0,6 МПА.
Выгрузка сжатым азотом
|
|
Р-12
|
1
|
Сталь-эмаль
|
ГОСТ 9931-79 Обозначение ВЭЭ 2-3-0,250-0,6.
Эмалированный стальной аппарат с эллиптическим днищем и эллиптической съёмной
крышкой, снабжён трубой для передавливания и наполнения, гладкой рубашкой.
Аппарат снабжен якорной мешалкой, барометром, термометром, нижним сливом,
устройством для взятия проб и ввода добавок. Вместимость 0,250 м3.
Предназначен для проведения различных химических и физических процессов с
агрессивными средами. Мощность двигателя 0,75 кВт, частота вращения мешалки -
50 об/мин, условное давление 0,6 МПА. Загрузка самотеком, выгрузка сжатым
азотом.
|
|
Р-15
|
1
|
Сталь 12Х18Н10Т
|
ГОСТ 9931-79. Обозначение ВЭЭ 2-3-0,250-0,6.
Стальной аппарат с эллиптическим днищем и эллиптической съёмной крышкой,
снабжён трубой для передавливания и трубой наполнения, гладкой рубашкой.
Аппарат снабжен якорной мешалкой, барометром, термометром, нижним сливом,
устройством для взятия проб и ввода добавок. Вместимость 0,250 м3.
Предназначен для проведения различных химических и физических процессов с
коррозионными средами. Мощность двигателя 0,75 кВт, частота вращения мешалки
- 50 об/мин, условное давление 0,6 МПА. Загрузка самотеком, выгрузка сжатым
азотом.
|
|
Мерники
|
|
М-2
|
1
|
Сталь 12Х18Н10Т
|
ГОСТ 9931-79. Обозначение ВЭЭ1-1-0,016-0,6.
Вместимость - 0,016 м3. Нержавеющий стальной аппарат с нижним
сливом, вертикальный. Условное давление 0,6 МПА. Загрузка сжатым азотом,
выгрузка самотеком.
|
|
М-4
|
1
|
Сталь 12Х18Н10Т
|
ГОСТ 9931-79. Обозначение ВЭЭ1-1-0,010-0,6.
Вместимость - 0,010 м3. Эмалированный аппарат с нижним сливом,
вертикальный. Условное давление 0,6 МПА. Загрузка сжатым азотом, выгрузка
самотеком.
|
|
М-11
|
1
|
Сталь12Х18Н10Т
|
ГОСТ 9931-79. Обозначение ВЭЭ1-1-0,320-0,6. Вместимость
- 0,320 м3. Нержавеющий стальной аппарат с нижним сливом,
вертикальный. Условное давление 0,6 МПА. Загрузка сжатым азотом, выгрузка
самотеком.
|
|
Хранилища
|
|
Х-1
|
1
|
Сталь 12Х18Н10Т
|
ГОСТ 9931-79. Обозначение ВЭЭ1-6-0,063-0,6.
Вместимость - 0,063 м3. Предназначены для хранения и переработки
жидких химических коррозионных сред и пищевых продуктов. Условное давление
0,6 МПА. Выгрузка сжатым азотом.
|
|
Х-3
|
1
|
Сталь 12Х18Н10Т
|
ГОСТ 9931-79. Обозначение ВЭЭ1-6-0,040-0,6.
Вместимость - 0,040 м3. Предназначены для хранения и переработки
жидких химических коррозионных сред и пищевых продуктов. Условное давление
0,6 МПА. Выгрузка сжатым азотом.
|
|
Х-10
|
1
|
Сталь 12Х18Н10Т
|
ГОСТ 9931-79. Обозначение ВЭЭ1-6-1,6-0,6.
Вместимость - 1,6 м3. Предназначены для хранения и переработки
жидких химических коррозионных сред и пищевых продуктов. Условное давление
0,6 МПА. Выгрузка сжатым азотом.
|
|
Сборники
|
|
Сб-7
|
1
|
Сталь 12Х18Н10Т
|
ГОСТ 9931-79, ВЭЭ1-1-0,200-0,3 Вместимость
0,200 м3; Предназначены для хранения и переработки жидких химических
коррозионных сред и пищевых продуктов. Остаточное давление 40 кПА Условное
давление 0,3 МПА. Покрытие универсальное высшего класса.
|
1
|
Сталь 12Х18Н10Т
|
ГОСТ 9931-79, ВЭЭ1-1-0,32-0,3 Вместимость 0,500
м3; Предназначены для хранения и переработки жидких химических
коррозионных сред и пищевых продуктов. Остаточное давление 40 кПА Условное
давление 0,3 МПА. Покрытие универсальное высшего класса, снабжен
огнепреградителем.
|
|
Фильтровальное оборудование
|
|
Ц-17
|
1
|
Сталь 12Х18Н10Т
|
Рабочий объем V=200 л условное обозначение
ФГН-1253К-01. Центрифуга фильтрующего действия горизонтальная. Выгрузка
производится с помощью ножа. Предназначена для разделения суспензий.
|
|
Ф-8
|
1
|
Сталь-эмаль
|
ТУ 26-01-1106-91. Нутч-фильтр НСэ
0,4-0,200-12-01 закрытого типа. Рабочее давление не более 0,4 МПа. Тип
фильтрующей поверхности - бельтинг. Площадь фильтрующей поверхности - 0,4 м2.
Рабочий объем V=0,200 м3. Выгрузка с помощью ножа. Покрытие
универсальное стекловидное высшего класса.
|
|
Ф-13
|
1
|
Сталь-эмаль
|
ТУ 26-01-1106-91. Нутч-фильтр НСэ
0,4-0,300-12-01 закрытого типа. Рабочее давление не более 0,4 МПа. Тип
фильтрующей поверхности - бельтинг. Площадь фильтрующей поверхности - 0,5 м2.
Рабочий объем V=0,300 м3. Выгрузка с помощью ножа. Покрытие
универсальное стекловидное высшего класса.
|
|
Сушильное оборудование
|
|
СШ-9
|
1
|
Сталь 12Х18Н10Т
|
ПВ - 0,5-0,025ВК-01 ТУ 26-01-808-80. Полочная
вакуумная сушилка из коррозионно-стойкой стали, оснащена системой
автоматического управления для регулирования температуры в аппарате. Продукт
загружается на противни. Площадь поверхностной загрузки 0,5 м2,
объем аппарата 0,025 м3, остаточное давление в сушилке 2,63 кПА.
|
|
СШ-18
|
1
|
Сталь 12Х18Н10Т
|
ПВ - 0,8-0,016ВК-01 ТУ 26-01-808-80. Полочная
вакуумная сушилка из коррозионно-стойкой стали, оснащена системой автоматического
управления для регулирования температуры в аппарате. Продукт загружается на
противни. Площадь поверхностной загрузки 0,8 м2, объем
аппарата0,016 м3, остаточное давление в сушилке 2,63 кПА.
|
|
Теплообменники
|
|
Т-6
|
1
|
Графит
|
Вертикальный теплообменник GN1-04 (0,74 м2),
с неподвижными трубными решетками и условным давлением 1,6 МПА.
|
|
Т-16
|
1
|
Углеродистая сталь
|
Вертикальный теплообменник (159
ТКВ-16-М1-0/20-1-4 гр. Б, ГОСТ 15122-79) с неподвижными трубными решётками и
условным давлением 1,6 МПА.
|
|
|
|
|
|
|
7.
Экономическая часть
.1
Исходные данные
Лаборатория кафедры ТОС занимается
синтезом гетероциклических соединений, а так же разработкой новых методов
получения ранее не известных гетероциклических систем, представляющих интерес с
точки зрения их биологической активности. Данная работа носит характер
фундаментального исследования, цель которого - изучение методов синтеза
енаминов с тиоамидной группой.
Расчет затрат на
выполнение научно-исследовательской работы
Затраты на проведение
научно-исследовательской работы складывается из следующих составляющих:
· Затраты на материалы и
реактивы;
· Затраты на
электроэнергию;
· Затраты на заработанную
плату;
· Расходы на услуги
сторонних организаций;
· Накладные расходы.
Затраты на материалы и
реактивы
Таблица 7.1
|
№ п/п
|
Наименование материалов, реактивов
|
Единица измерения
|
Цена, руб./ед.
|
Количество израсходованного материала, реактива
|
Сумма, руб.
|
|
1
|
П-анизидин
|
г
|
108,62
|
15,00
|
1629,30
|
|
2
|
Анилин
|
мл
|
1,16
|
10,00
|
11,60
|
|
3
|
П-нитроанилин
|
г
|
11,56
|
10,00
|
115,60
|
|
4
|
П-хлоранилин
|
г
|
6,13
|
5,00
|
30,65
|
|
5
|
Реактив Лавессона
|
г
|
2,14
|
10,00
|
21,40
|
|
6
|
Этанол
|
л
|
140
|
1,00
|
140,00
|
|
7
|
Толуол
|
л
|
62,7
|
1,00
|
62,70
|
|
8
|
ДМАД
|
мл
|
0,57
|
10,00
|
5,70
|
|
9
|
N-хлорсукцинимид
|
г
|
7,60
|
10,00
|
76,00
|
|
10
|
Этилацетат
|
л
|
232,6
|
1
|
232,60
|
|
11
|
Триэтилортоформиат
|
л
|
17,23
|
0,20
|
3,45
|
|
12
|
Силикaгель
|
кг
|
1681,5
|
0,5
|
840,75
|
|
13
|
Ацетон
|
л
|
183,5
|
1
|
183,50
|
|
14
|
Гексан
|
л
|
224,13
|
1,5
|
336,20
|
|
15
|
Хлороформ
|
л
|
456,22
|
2,00
|
912,44
|
|
16
|
Соляная кислота
|
л
|
735,05
|
0,05
|
36,75
|
|
17
|
Уксусный ангидрид
|
л
|
819,99
|
0,10
|
82,00
|
|
18
|
ДМФА
|
л
|
1445,19
|
0,05
|
72,26
|
|
19
|
POCl3
|
мл
|
0,14
|
10
|
1,40
|
|
Всего
|
|
|
|
4794,29
|
Информация о ценах: [61, 62]
Использованы цены в рублях на 2013 год.
Курс валюты взят на 3 мая 2013 г. - 1EUR = 40.836 руб.
Затраты на электроэнергию
Таблица 7.2
|
№ п/п
|
Наименование оборудования
|
Мощность, кВт
|
Время, ч
|
Цена 1 кВт·ч, руб.
|
Сумма, руб.
|
|
1
|
Насос вакуумный мембранный
|
0,75
|
10
|
2,42
|
18,15
|
|
2
|
Насос вакуумный мембранный
|
0,25
|
10
|
2,42
|
6,05
|
|
3
|
Испаритель ротационный
|
1,4
|
10
|
2,42
|
33,88
|
|
4
|
Облучатель хроматографический
|
0,009
|
12
|
2,42
|
0,26
|
|
5
|
Весы электронные
|
0,01
|
12
|
2,42
|
0,29
|
|
6
|
Шкаф сушильный
|
2
|
160
|
2,42
|
774,40
|
|
7
|
Плитка электрическая
|
1
|
96
|
2,42
|
232,32
|
|
Итого
|
|
|
|
1065,35
|
Затраты на заработную плату
1) Сумма стипендии выплаченной студенту-дипломнику за время
преддипломной практики и дипломирования:

Ст - месячная стипендия, руб.;
,15 - учет выплат по районному коэффициенту (15%);
- кол-во месяцев выполнения работы при пятидневной рабочей
неделе.
2) Заработная плата руководителя и
консультантов с учетом должностных окладов и отработанного времени:
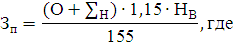
О - оклад, руб./мес.;
∑Н - сумма всех надбавок,
руб./мес.;
,15 - учет выплат по районному
коэффициенту (15%);
Нв - норма времени
консультаций, ч;
- номинальное время работы за месяц, ч.
Заработная плата руководителя проекта (профессор, д.х.н.):
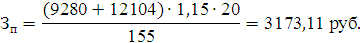
Заработная плата консультантов:
- по экономической части (доцент, к.э.н.):
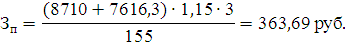
- по БЖД (доцент, к.х.н.):
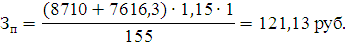
- по природопользованию и охране окружающей среды (профессор,
д.х.н.):
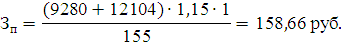
- по энергосбережению (профессор, д.х.н.):
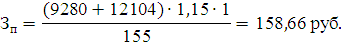
Таким образом, расчетная величина заработной платы
руководителя и консультантов составляет:
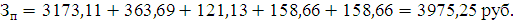
Всего затраты на заработную плату и стипендию составляют:
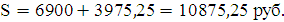
Таблица 7.3
|
Участники исследования с указанием должности и
степени
|
Норма времени, ч
|
Сумма, руб.
|
|
1 Руководитель (профессор, д.х.н)
|
20
|
3173,11
|
|
2 Консультанты: ● экономическая часть
(доцент, к.э.н) ● безопасность жизнедеятельности (доцент, к.х.н) ●
природопользование и охрана окружающей среды (профессор, д.х.н) ●
энергосбережение (профессор, д.х.н)
|
3 1 1 1
|
363,69 121,13 158,66 158,66
|
|
3 Студент
|
4 мес.
|
6900
|
|
Итого
|
|
10875,25
|
Страховые взносы (Сн)
принимаются в размере 30% от расчетной величины заработной платы:

Затраты на заработную плату с отчислениями
на социальные нужды:

Расходы на услуги сторонних организаций
Снятие спектров ядерного
магнитного резонанса (ЯМР).
Стоимость снятия одного спектра ЯМР 1Н
составляет 100 руб.
Всего произведено 20 съемок спектров ЯМР 1Н.
Итог затрат: У1Н =100 · 20 =
2000 руб.
Стоимость снятия одного спектра ЯМР 13С
составляет 150 руб.
Всего произведено 10 съемок спектров ЯМР 13С.
Итог затрат: У13С =150 · 10 = 1500
руб.
Снятие инфракрасных
спектров.
Стоимость снятия одного ИК-спектра
составляет 50 руб.
Всего произведено 20 съемок ИК-спектров.
Итог затрат: Уик= 60 · 20 =
1200 руб.
Итого расходы на услуги сторонних
организаций:
Уорг = У1Н + У13С + Уик
= 2000+1500+1200 = 4700 руб.
Накладные расходы
Накладные расходы (стоимость электроэнергии на освещение
лаборатории, обеспечение работы вытяжной вентиляции, амортизационные
отчисления, расходы на ремонт и содержание зданий, затраты на содержание
учебно-вспомогательного и административно-управленческого персонала, расходы на
охрану труда и др.) принимаются в размере 20% от суммы предыдущих статей:


где Нр - накладные расходы;
М - расходы на материалы и реактивы;
Э - расходы на электроэнергию;
ЗΣ - затраты на заработную
плату с отчислениями на социальные нужды;
Ур - расходы на услуги сторонних организаций. Смета
затрат на выполнение научно-исследовательской работы
Таблица 7.4
|
Наименование статей расходов
|
Сумма, руб.
|
Удельный вес в общей сумме затрат,%
|
|
1. Материалы и реактивы
|
4794,29
|
16,18
|
|
2. Электроэнергия
|
1065,35
|
3,59
|
|
3. Заработная плата
|
10875,25
|
36,70
|
|
4. Страховые взносы
|
3262,10
|
11,01
|
|
5. Услуги сторонних организаций
|
4700
|
15,86
|
|
6. Накладные расходы
|
4939,50
|
16,67
|
|
Всего
|
29636,49
|
100,00
|
7.2
Взаимосвязь с предыдущими исследованиями подобного направления
Сотрудниками лаборатории Х-252 ранее были получены и
достаточно изучены енамины и гидразоны, содержащие карбоксамидные и тиоамидные
функции, однако енамины с тиоамидной группой были представлены гораздо реже.
Задачами данной работы являются: синтез пропентиоамидов, изучение их свойств и
сравнение полученных данных с данными, накопленными ранее.
.3
Расчеты величины или характеристики составляющих ожидаемого экономического
эффекта
Ввиду того, что проведенная работа носит характер
фундаментального исследования, не представляется возможным определить
экономическую эффективность проекта. Это обусловлено отсутствием сведений о
цене на некоторые виды материалов и полуфабрикатов, невозможностью определить
точные расходные коэффициенты сырья и материалов на единицу продукции,
необходимостью более детального изучения полученных веществ.
Информационным эффектом данной работы являются тезисы «Реакции
пропентиоамидов с диметиловым эфиром ацетилендикарбоновой кислоты» в сборнике
докладов XXIII Российской студенческой научной конференции «Проблемы
теоретической и экспериментальной химии».
Научный эффект проведенного исследования состоит в разработке
удобного метода синтеза и изучении свойств ранее не изученных соединений, а так
же в получении ряда производных пропентиоамидов и их производных, обладающих
биологической активностью.
Заключение
1. В результате проведенного исследования осуществлен синтез
серии аминоакриламидов и аминопропентиоамидов, содержащих алифатические,
ароматические и трет-алкиламиногруппы в амидном или тиоамидном
фрагменте, а также остатки ароматических или трет-алкиламинов в
енаминовом фрагменте. Впервые получены енамины, содержащие фрагменты трет-алкиламинный
заместитель как в амидной или тиоамидной группе, так и в енаминовом фрагменте.
. Проведено сравнительное исследование особенностей
электронной структуры ариламинопропентиоамидов и арилгидразоноацетамидов и -
тиоамидов квантово-химическими и спектральными методами.
. Изучена окислительная циклизация
ариламинопропентиоамидов, синтезированы новые 5-имино - 2,5-дигидроизотиазолы и
показано, что ариламинопропентиоамиды окисляются хуже, чем соответствующие
арилгидразонотиоацетамиды.
. Изучено взаимодействие ариламинопропентиоамидов с
ДМАД и показано, что в отличие от соответствующих арилгидразонотиоамидов,
реакция протекает по механизму циклоконденсации с образованием тиопиранов.
. Разработана принципиальная технологическая схема
производства N-бензил-3 (4-метоксифениламино) 2-циано-акриламида. Выбрано
основное и вспомогательное оборудование. Рассчитан материальный баланс
производства на 1 кг технического продукта и дано описание технологического
процесса.
Предложены мероприятия по безопасности и экологичности
проекта, энергосберегающим технологиям, проведены экономические расчеты на
проведение исследовательской работы.
Библиографический
список
1. Ferraz H.M. Synthesis of enaminones // Quim. Nova. 2004.
Vol. 27. P. 89-95.
. Greenhill J.V. Enaminones // Chem. Soc. Rev. 1977. Vol.
6. P. 277-294.
. Lue P., Greenhill J.V. Enaminones in Heterocyclic
Synthesis // Adv. Heterocycl. Chem. 1997. № 67. P. 207-343.
. Auricchio S., Bini A., and Pastormerlo E. Iron dichloride
isomerization or reductive cleavage of isoxazoles: A facile synthesis of
2-carboxy-azirines // Tertrahedron. 1997. Vol. 53. № 31. P. 10911-10920.
. Negri G., Kascheres C., Kascheres A. Recent Development
in Preparation and Biological Activity of Enaminoketones and Enaminothiones and
Utilization to Prepare Heterocyclic Compound // J. Heterocycl. Chem. 2004. Р 461-491.
. Kostyuk N., M. Volochyuk D., Sibgatulin D.A. Reaction of Linear Push-Pull Enamines at the β’ - position //
Sinthesis. 2008. P. 0161-0184.
. Claisen L. Untersuchungen uber die
Oxymathelenverbindungen // Just. Liebigs Ann. Chem. 1897. Vol. 297. P. 77-98.
. Price C.C., Boekelheide V. A synthesis of substituted
4-aminoquinolines //J. Am. Chem. Soc. 1946. Vol. 68. Р.1246-1250.
. Mikhlaev A.I., Ukhov S.V., Konshin M.E. Synthesis and
properties of amides of 2-substituted 3-aryl or 3-pyridylaminoacrylic acid //
Chem. of Heterocycl. Comp. 1994. Vol 30. № 5. Р.551-555.
10. Граник
В.Г. Ацетали амидов и лактамов. ХГС. 1976. С. 1509-1512.
11. Иванов
А.С., Тугущева Н.З., Алексеева Л.М., Граник В.Г. Синтез и гетеролитическое
расщепление 1-арил-5-циано-6 (-2-диметиламино) - 4-оксо(тиоксо) -
1,4-дигидропиримидинов // Известия Акаденмии Наук. Серия химическая. 2004. Том. 53. № 4. Стр. 873-881.
. Abdulla R.F., Brinkmeyer R.S. The chemistry of formamide
acetals // Tetrahedron. 1979. Vol. 35. № 14. Р. 1675-1735.
. Abu-Shanab F.A., Sherif Sh.M., Mousa S.A.S.
Dimethylformamide dimethyl acetal as a buildind block in heterocyclic synthsis
// J. Heterocycl. Chem. 2009. № 46. Р. 801-827.
14. Kobayashi Y., Nakatani T., Tanaka R., Okada M., Torii E.,
Harayama T., Kimachi T. α-Dimethylaminomethylenation-induced
Houben-Hoesch-type cyclization of cyanoacetanilides: a practical synthesis of
3-formyl-4-hydroxyquinolin-2 (1H) - ones // Tetrahedron. 2011. № 67. Р. 3457-3463.
15. Selvi S., Perumal P.T. Synthesis of
2-cyano-3-dimethylamino-n-phenylacrylamides using the vilsmeer reaction // Org.
Prep. Proced. Int.: New J. Org. Synth. 2001. Vol. 33. № 2. Р. 194-198.
. Stefani H.A.; Costa I.M.; Silva D.O. An easy synthesis of
enaminones in water as solvent // Synthesis. 2000. № 11. Р. 1526-1528.
. Huang J., Liang Y., Pan W., Yang Y., Dong D. Efficient
synthesis of highly substituted pyrrolin-4-ones via pifa-mediated cyclization
reactions of enaminones // Org. Lett. 2007. Vol. 9. №. 26. Р. 5345-5348.
. Scheeren J.W., Nivard R.J.F. Synthesis and stability of
tri-sec-aminomethanes // Recl. Trav. Chim. Pays-Bas. 1969. № 88. Р. 289-300.
. Rolfs A., Leibscher J. Efficient synthesis of
3-aminothioacrylamides by iminoformylation of thioacetamides // Synthesis.
1994. Р. 683-684.
. Rajappa S., Advani B.G. // Indian J. Chem. 1978. № 16. Р. 819-821.
. Pearson M.S.M., Robin A., Bourgougnon N., Meslin J.C.,
Deniaud D. An efficient route to pyrimidine analogues by [4+2] cycloaddition
reaction // J. Org. Chem. 2003. № 68. Р. 8583-8587.
. Uher M., Ilavsky D., Foltin J., Skvareninova K. Reactions
of carbonyl isothiocyanates with enamines of type CH3-C(NH2)=CH-X
// Coll. Czech. Chem. Commun. 1981. Vol. 46. Р. 3128-3133.
. Massaroli G. / US patent № 3520901 // 1970.
25. Behrend R, Meyer F.C, Buchholz J. // Liebigs Ann. Chem.
1901. Vol. 314. Р. 224-226.
. Ciez D., Szneler E. Synthesis of optically active
isothiazole derivatives from l - (α) - amino
acids // Monatsh. Chem. 2005. № 136. Р. 2059-2066.
. Robin A., Julienne K., Meslin J.C., Deniaud D. Synthesis
of pyridone and pyridine rings by [4+2] hetero-cyclocondensation // Tetrahedron
lett. 2004. № 45. Р. 9557-9559.
. Sakai N., Ohfune Y. Total synthesis of galantine.
Acid-catalyzed cyclization of galantic acid // J. Am. Chem. Soc. 1992. Vol.
114. Р. 998-1010.
. Paulvannan K., Stille J.R. Heterocycle formation through
aza-annulation: A stereochemically controlled route to (±) - lupinine //
Tetrahedron Lett. 1993. Vol. 34. Р. 8197-8200.
. Paulvannan K., Stille J.R. Heterocycle formation through
aza-annulation: stereochemically controlled syntheses of (±) - 5-epitashiromine
and (±) - tashiromine // J. Org. Chem. 1994. № 59. Р. 1613-1620.
31. Азимов В.А., Граник В.Г., Гризик С.И., Ершов Л.В., Сметская Н.И., Ушаков С.Д., Машковский М.Д., Яхотов Л.Н. Изучение β-адреноблокаторов в 2 - (2’ - гидрокси-3’ - изопропиламинопропокси) - 3-циано- 4 аминопиридинах // Хим.-фарм. журнал. 1985. № 8. Стр. 947-952.
32. Фаемрик
И.Ф., Гусь Л.Т, Ершов Л.В., Шварц Г.Я., Граник В.Г. Синтез и биологическая
активность 3,4-дизамещённых 2-аминопиридинов и 2 - пиридонов // Хим.-фарм.
журнал 1990. № 5. Стр. 27-30.
. Anderson R.C., Hsiao Y.Y. Synthesis of isothiazolo[5,4-d]
pyrimidines (1,2) // Isothiazoles. 1975. Vol. 3. Р. 883-887.
. Unverferth K., Engel E., Hofgen N., Rostock A., Gunther
R., Lankau H.-J., Menzer M., Rolfs A., Liebscher J., Muller B., Hofmann H.-J.
Synthesis, anticonvulsant activity, and structure-activity relationship of
sodium channel blocking 3-aminopyrroles // J. Med. Chem. 1998. № 41. Р. 63-73.
. Huang J., Lu Y., Qiu B., Liang Y., Li N., Dong D. One-pot
synthesis of substituted isotiozol-3 (2H) - ones: intramolecular annulations of α-carbamoyl ketene-S, S-acetals
via PIFA-madiated N-S bond formation // Synthesis. 2007. Р. 2791-2796.
. Ozturk T., Ertas E., Mert O. Use of Lawesson’s Reagent in
organic sintesys // Chem. Rev. 2007. Vol. 107. P. 5210-5278.
37. Минкин
В.И., Симкин Б.Я., Миняев Р.М. Теория строения молекул // Учебники и учебные
пособия. Феникс. 1997. Стр. 108.
. Valle Y., Chavant P.Y., Pinet S., Pelloux-Leon N., Arnaud
R., Barone V. [4π+2π] Cycloaddition of N-acyl-thioformamides // Phosphorus,
Sulfur, and Silicon. 1997. Vol. 120. P 245-258.
. Arnaud R., Chavant P.Y., Molvinger K., Vallee Y.
Theoretical approach and first examples of N-acyl-thioformamides as dienophiles
in the dies-alder reaction // J. Chem. Soc., Chem. Commun. 1995. P.
1897-1898.
. Bhatia S.H., Buckey D.M., McCabe R.W., Avent A., Brown
R.G., Hitchcock P.B. Novel photochemical rearangments of dihydro -
1,3-thiazines // J. Chem. Soc., Perkin Trans. 1998. P. 569-574.
. Giammona G., Neri M., Carlisi B., Palazzo A., La Rosa C.
Reaction of azoesters and dimethyl acetylendicarboxylate with 3-methyl -
1,2,4-triazole-5-thione // J. Heterocyclic Chem. 1991. Vol. 28. P.
325-327.
42. Безопасность
жизнедеятельности, безопасность технологических процессов и производств / П.П.
Кукин, В.Л. Лапин, Н.Л. Пономарев и др. М.: Высш. шк., 2009.-319 с.
. ГОСТ
12.2.033-78 ССБТ. Рабочее место при выполнении работ стоя. Общие эргономические
требования.
. ГОСТ
12.1.005-85 ССБТ. ПДК вредных веществ в воздухе рабочей зоны.
. Лазарев
Н.В., Левина Э.И. Вредные вещества в промышленности./ Л.: Химия, 1976.-624 с.
. Безопасность
жизнедеятельности: конспект лекций. ч. 3: БЖД в условиях производства (охрана
труда) / А.А. Волкова, В.Г. Шишкунов, А.А. Вершинин, г.В. Тягунов.
Екатеринбург: ГОУ ВПО УГТУ-УПИ, 2006.-112 с.
. СанПиН
2.2.4.548-96 Гигиенические требования к микроклимату производственных
помещений. Санитарные правила и нормы.
. ГОСТ
12.1.005-88 ССБТ. Воздух рабочей зоны. Общие санитарно-гигиенические
требования.
. ГОСТ
12.1.003-83 ССБТ. Шум. Общие требования безопасности.
. СН
2.2.4/2.1.8.562-96. Шум на рабочих местах, в помещениях жилых, общественных
зданий и на территории жилой застройки.
. ГОСТ
12.1.012-90 ССБТ. Вибрационная безопасность. Общие требования.
. СН
2.2.4/2.1.8.566-96 Производственная вибрация, вибрации в жилых и общественных
зданиях. Санитарные нормы.
. СП
52.13330.2011. Строительные нормы и правила. Нормы проектирования. Естественное
и искусственное освещение.
. ГОСТ
12.1.019-79 ССБТ. Электробезопасность. Общие требования.
. ПУЭ
Правила эксплуатации электроустановок 7-ое изд, М: НЦ ЭНАС, 2010-704 с.
. ГОСТ
12.1.030-81 ССБТ. Электробезопасность. Защитное заземление. Зануление.
. ГОСТ
12.1.004-91 ССБТ. Пожарная безопасность. Общие требования.
. НПБ
105-03. Определение категорий помещений, зданий и наружных установок по
взрывопожарной и пожарной опасности.
. СНиП
2.01.02-85. Огнестойкость строительных конструкций.