|
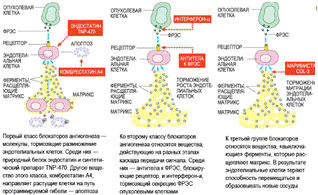 Рис.1.6
Классы блокаторов ангиогенеза Рис.1.6
Классы блокаторов ангиогенеза
|
К третьей группе веществ, подавляющих
прорастание сосудов, а, следовательно, и рост опухоли, относятся блокаторы
(ингибиторы) активности опухолевых ферментов - металлопротеаз, которые
разрушают внеклеточный матрикс и оболочку сосуда, давая клеткам эндотелия
возможность мигрировать в сторону опухоли. Разработка препаратов такого типа
действия - приномастата, маримастата и СOL-3 - находится на стадии клинических
испытаний.
1.3 Современные методы исследования строения
кровеносных сосудов
В настоящее время существует ряд методов
исследования строения сосудов.
Наливка сосудистого русла смесью тушь-желатин
Это одна из первых методик исследования строения
сосудистого русла. Методика заключается в следующем: сосуды промываются от
крови, готовится раствор тушь-желатин и приготовленный теплый раствор вводится
в сосудистую систему.
Приготовленные препараты изучаются с помощью
светового микроскопа.
Недостатки методики:
. Возможно изучение только тонких препаратов или
тонких оболочек (капсула почек, брыжейка).
. Невозможно реконструировать 3-ехмерную модель.
. Толстые препараты необходимо нарезать, что
влечет потерю препарата.
Окраска сосудистого русла азотнокислым серебром
(AgNO3)
Повторение методики заполнения сосудистого русла
раствором тушь-желатин, только контрастным веществом является AgNO3.
Недостатки методики:
. Возможно изучение только тонких препаратов или
тонких оболочек (капсула почек, брыжейка).
. Невозможно реконструировать 3- мерную модель.
. Толстые препараты необходимо нарезать, что
влечет потерю препарата.
Растровая электронная микроскопия сосудистых
слепков из пластмассы
Методика заключается во введении в отмытые от
крови сосуды быстрополимеризующегося мономера, обычно метилметакрилата (ММА).
После того, как мономер заполимеризовался в сосудах ткань вокруг полимера
удаляют, подвергая препарат щелочному гидролизу (обработка щелочами NaOH или
KOH). Полимерный слепок изучают на растровом электронном микроскопе.
Недостатки:
Сложная технология.
Толстые образцы сложно приготовить для
электронной микроскопии (на их поверхности происходит накопление зарядов, что
приводит к появлению дефектов изображения).
Поэтому возникла идея разработки нового метода исследования
строения сосудистого русла, которая позволила бы преодолеть многие из
недостатков.
Разработанная нами методика состоит в том, чтобы
а) заполнить сосудистое русло микросферами,
окрашенными флуоресцентным красителем;
б) использовать флуоресцентную конфокальную
микроскопию для исследования строения сосудов.
По нашему мнению, метод лишен недостатков
перечисленных выше и обладает некоторыми достоинствами:
возможность реконструировать 3-ехмерную модель
сосудистого русла;
препарат остается целым после исследования.
1.4 Флуоресцентная конфокальная микроскопия
Конфокальная микроскопия и созданные на ее
основе конфокальные лазерные сканирующие микроскопы (КЛСМ) - принципиально
новое направление в световой микроскопии. С возникновением методов конфокальной
сканирующей микроскопии появилась возможность путем послойного сканирования
просматривать детали объемного препарата на некоторой его глубине, что не
позволяет делать обычный, даже самый совершенный микроскоп из-за рассеяния и
преломления света на оптически неоднородных фрагментах.
Конфокальный микроскоп дает две неоценимые
возможности - исследование тканей на клеточном уровне в состоянии
физиологической жизнедеятельности и демонстрации результатов исследования (т.е.
клеточной активности) в четырех измерениях - высота, ширина, глубина и время.
Для качества изображения и глубины исследования наиболее важную роль играет
способность ткани к пропусканию света, иначе говоря, прозрачность ткани [10].
Большинство современных конфокальных микроскопов
построено на базе люминесцентного (прямого или инвертированного) микроскопа.
Следовательно, объекты исследований должны быть предварительно окрашены
соответствующим люминесцентным красителем или обладать собственной
люминесценцией. Иногда микроскоп имеет т.н. «детектор проходящего света»,
который позволяет наблюдать и неокрашенные объекты в режиме интерференционного
контраста.
Способ конфокального сканирования трёхмерных
микрообъектов был предложен ещё в 50-х годах прошлого столетия, но первые
коммерческие 3D-микроскопы появились только к концу 80-х. В настоящее время
наибольшее распространение получила лазерная сканирующая конфокальная
микроскопия (LSCM - Laser Scanning Confocal Microscopy). Объёмное изображение в
LSCM получается при помощи регистрации флуоресценции в фокусе лазерного луча.
Излучаемые фотоны фокусируются объективом на небольшом (~ 50 мкм) отверстии,
которое ослабляет флуоресцентный сигнал от участков, находящихся не в фокусе
(рис. 1.7).

Рис. 1.7 Оптическая схема конфокальной
сканирующей системы [11].
Устройство современных LSCM - микроскопов
намного сложнее и включает лазерные модули, несколько фотоумножителей (PMT),
акустооптические туннельные фильтры (AOTF), светоделительные пластинки,
сканерный модуль и многое другое.
Подобное усложнение обеспечивает широкий выбор
спектральных линий когерентного освещения и возможность параллельной
регистрации флуоресценции с различными длинами волн. Скорость сканирования
зависит от разрешения и у микроскопа LCM 510 при разрешении 512х512 составляет
примерно 1/5 секунды на слой [11]. При максимальном разрешении 2048х2048
сканирование каждого слоя занимает более секунды, и считывание объёмного
изображения может продолжаться десятки минут.
Максимальная глубина сканирования при использовании
объективов с минимальным увеличением и водной иммерсией достигает 3…4 мм, что
вполне приемлемо для не слишком толстых образцов, но для сканирования крупных
объектов с высоким разрешением необходима панорамная съёмка объёмных блоков с
последующей компьютерной стыковкой нескольких десятков или сотен трёхмерных
изображений. Даже при минимальном разрешении микроскопа продолжительность
такого сканирования будет измеряться часами, что неприемлемо для большинства
биологических объектов.
Значительно более высокая скорость сканирования
характерна для SDCM (Spinning Disk Confocal Microscopy). [12] В микроскопах
подобного типа используется вращающийся диск с тысячами отверстий. Его
прототипом стало датируемое ещё 1884 годом изобретение германского учёного, обеспечивающее
передачу изображений на расстояние. Принцип такой передачи показан на рис. 1.8.
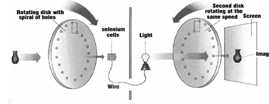
Рис. 1.8 Принцип передачи изображения на
расстоянии при помощи Nipkow-диска [12]
Современный аналог Nipkow-диска содержит 20
тысяч расположенных по спирали отверстий, причём лазерный луч фокусируется на
них при помощи дополнительного диска с 20 тысячами микролинз. При вращении
такого двойного диска объект сканируется сразу множеством (~1000) световых
фокусов, обеспечивая считывание 360 кадров (плоскостей) в секунду [13] или даже
1 кадр за миллисекунду. [14] Схема этого устройства показана на рис. 1.9.

Рис. 1.9
Схема устройства дисковой системы CSU10 [15]
Каждый оптический фокус, образуемый парой
микролинза-отверстие и объективом, при вращении диска перемещается по слегка
искривлённой (дуговой) траектории. Линзы и отверстия расположены на диске по
спирали, поэтому траектория каждого следующего фокуса немного смещена и
вращение диска обеспечивает сканирование всей фокальной плоскости объекта.
Регистрирующим устройством в такой системе служит камера с CCD-матрицей, на
которой конфокальная оптика формирует изображение перемещающихся фокусов.
Дисковым сканирующим микроскопам присущи два
основных недостатка. Первый связан с необходимостью точной синхронизации
скорости вращения диска (1800 об./мин. у CSU10) и частоты считывания сигнала
CCD. Без такой синхронизации на изображении появляются многочисленные полосы. В
последней модели дисковой системы корпорации Yokogawa (CSU22) предусмотрена
возможность варьирования скорости вращения диска, упрощающая настройку
микроскопа. [16]
Вторая проблема заключается в недостаточной
чувствительности обычных CCD при высоких скоростях сканирования и необходимости
применения ICCD (Intensified CCD), имеющих встроенный фотоумножитель, или EMCCD
(Electron Multiplying Charge-Coupled Device), способных работать в режиме
счётчика фотонов. Это существенно повышает стоимость регистрирующей системы.
Общим недостатком сканирующих микроскопов типа
LSCM и SDCM является заметная фоновая флуоресценция объектов, находящихся не в
фокусе лазерного луча. Более контрастные объёмные изображения можно получить
при помощи сканирующей двухфотонной или мультифотонной (MPE - MultiPhoton Exitation)
микроскопии. Нелинейность зависимости MPE от интенсивности освещения
обеспечивает максимальную флуоресценцию центральной части светового фокуса и
повышает разрешающую способность микроскопов этого типа и контрастность
изображения (рис. 1.10).
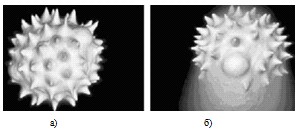
Рис. 1.10 Трёхмерные изображения поверхности
гранул пыльцы [14]
а) мультифотонная сканирующая микроскопия;
б) обычная конфокальная сканирующая микроскопия.
Благодаря отсутствию внефокусной флуоресценции
MPE-микроскопы могут работать без обычного для LSCM фильтрования света через
микроотверстие. В мультифокусных системах сканирования (SDCM) при
мультифотонном возбуждении флуорофоров диск с отверстиями тоже излишен.
Достаточно одного диска с микролинзами
Современные 3D-микроскопы, как правило, способны
работать и в обычном, и в MPE режимах. Кроме того, в них сохраняется
возможность визуального наблюдения сканируемых объектов. Следствием является
непомерная (для России) стоимость приборов данного типа.
Получаемые с помощью сканирующих микроскопов
виртуальные трёхмерные изображения высокого разрешения позволяют заглянуть в
микромир и по информативности несопоставимы с обычными двухмерными картинками.
На рисунке 1.12 показан конфокальный микроскоп
Nikon


Рис.1.12 а) блок лазеров (аргоновый λ=488
нм;
геленеоновый λ=596 нм); б) слева -
система управления сканированием лазеров в микроскопе; в центре - блок питания
ртутной лампы; справа (вверху) - блок питания лампы накаливания; справа (внизу)
- блок детекторов; в) микроскоп.
1.5 Сканирующая электронная микроскопия
В последнее время сканирующие электронные
микроскопы (СЭМ) заняли прочное место среди исследовательских приборов
универсального применения. Исследователи, работающие на современных моделях
СЭМ, отмечают такие качества этих приборов, как большую наглядность, легкую
интерпретируемость изображений, высокую разрешающую способность, хорошую
информативность сканирующей электронной микроскопии. К этому можно добавить
относительную простоту приготовления образцов для СЭ микроскопии в сравнении с
методами подготовки препаратов для просвечивающей электронной микроскопии.
В основу СЭМ положен принцип формирования
изображений на экране электронно-лучевой трубки (ЭЛТ) с помощью развертки,
синхронной с разверткой электронного луча, последовательно облучающего
сканируемую поверхность изучаемого объекта. При этом яркость каждой точки
экрана ЭЛТ соответствует интенсивности одного из вторичных излучений,
возникающих при взаимодействии электронного луча с веществом объекта в
определенной точке его поверхности.
Выбор вторичного излучения, несущего информацию
о поверхности, производится путем подключения нужного детектора к входу
видеоусилителя. Естественно, что для регистрации каждого вида вторичного
излучения требуется свой детектор, чувствительность которого к данному
излучению максимальна. Количество детекторов, имеющихся в СЭМ, зависит от
класса прибора (чем выше класс, тем их больше).
Любой современный научный прибор, дающий
информацию об объекте исследования в форме изображения, снабжается блоком
фиксирования этой информации. Только в этом случае возможна объективная оценка
и последующая обработка полученных данных. СЭМ в этом смысле весьма удобен, так
как позволяет представить визуальную информацию в удобной для фотографирования
форме.
Для получения высококачественных микрофотографий
используют медленные развертки с числом строк не менее 2000 и вертикальной
скоростью не менее 50 с на кадр, повышая, таким образом, плотность электронного
облучения поверхности и улучшая отношение сигнал/шум.
С помощью СЭМ можно получать
стереомикрофотографии (стереопары). Для этого делают 2 снимка с одного и того
же участка образца, причем для второго снимка его наклоняют на 5-10° по отношению
к первоначальному положению, сохраняя при этом центральную деталь поля зрения в
центре экрана. Полученные фотоотпечатки монтируют на одном листе бумаги с
соблюдением взаимного расположения правого и левого снимков и рассматривают в
стереоскоп. Существуют специальные стереометрические устройства, позволяющие
рассчитывать по стереопарам истинные расстояния между точками изображенной
поверхности и восстанавливать взаимное расположение структур в пространстве.
Если биологический объект обладает низкой электропроводностью
и (или) неплотно прилегает к поверхности держателя, то при сканировании
электронным зондом объект будет заряжаться. Для достижения высокой степени
разрешения приходится прибегать к специальным мерам обеспечения
электропроводности. Главной мерой является покрытие объекта слоем металла.
Покрытие металлом предотвращает образование
электрических зарядов на поверхности объекта, способствует отведению тепла,
генерируемого взаимодействием электронов зонда с объектом (перегревание объекта
в процессе СЭ микроскопии может вызвать смещение и повреждение объекта),
способствует достижению более высокой разрешающей способности и механически
стабилизирует поверхность объекта.
Для создания покрытия используют тяжелые металлы
и их сплавы: Au, Pt, Ag, Au/Pd, Pt/Pd.
Покрытие объекта производится в специальной
вакуумной камере и может быть осуществлено двумя способами: путем испарения
нагреваемого металла и путем «выбивания» атомов металла, бомбардируемого ионами
инертного газа.
.6 Флуоресцентные метки
Полупроводниковые нанокристаллы или квантовые
точки (КТ)
Использование полупроводниковых нанокристаллов в
качестве флуоресцентных меток позволяет получать многоцветные изображения
биологических сред, таких как, например, живые ткани. Наиболее распространены
водорастворимые КТ из селенида кадмия-сульфида цинка. КТ имеют полосу
поглощения в разы большую, чем соответствующая у других типов меток,
используемых для мультифотонной микроскопии. Метки визуализировались
динамически через кожу на глубине сотен микрометров. КТ - яркие, фотостабильные
флуорофоры. КТ учитывают фактор многоцветности биологических образцов [17],
поэтому они особенно полезны для флуоресцентного изображения живых тканей, где
сигналы могут быть искажены рассеянием. Мультифотонная микроскопия дает возможность
получать изображения различных биологических объектов на большой глубине без
каких-либо размытостей, какие имеются, например при широкопольной или
конфокальной микроскопии, и сейчас мультифотонная микроскопия стала основным
методом флуоресцентного исследования толстых образцов [18,19].
Было разработано несколько методик синтеза КТ,
таких как функционализация поверхности водорастворимыми лигандами [20,21],
силанизация поверхности [22,23] и инкапсуляция в мицеллы блок-сополимеров [24].
Исследовались фотофизические свойства водорастворимых CdSe-ZnS нанокристаллов,
полученных методом энкапсуляции нанокристаллов в амфифильный полимер [25].
Размер КТ подходит для ангиографических исследований, и является аналогом
общепринятых для использования в этих целях флуоресцентных декстранов [26].
Были исследованы изображения 2-х типов тканей - кожи и жировой ткани. При
исследовании здоровой кожи, толщина дермы у мышей составляла 900 нм, были
обнаружены четко видимые сосуды, содержащие КТ (рис. 1.13 В). Концентрация КТ в
крови составляла примерно 1 мкмоль/л при этом полученные изображения имели
яркость в 5 раз более высокую (рис. 1.13 А), чем при исследовании образца,
заполненного FITC-декстраном (флуоресцеина диизоционатом) с концентрацией в
крови примерно 40 мкмоль/л (предел растворения декстрана в крови) (рис. 1.13
D).
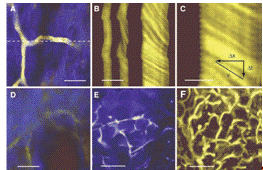
Рис. 1.13 In vivo изображения сосудов,
помеченных водорастворимыми КТ (длина волны 550 нм). A - капилляры, содержащие
КТ концентрацией 1 мкмоль/л хорошо видны через кожу (на глубине ~100 мкм).
Голубой фон - это флуоресценция коллагена. Пунктирной линией показано положение
среза B. B - Скорость сканирования (13,7 мс/линия). Диаметр капилляра 5 мкм. C
- увеличенное изображение с рисунка B. D - сравнительное изображение той же
области, что и на A, но полученное при заполнении сосудов FITC-декстраном, с
концентрацией равной его пределу растворимости в крови. E - Изображение жировой
ткани (голубой цвет - аутофлуоресценция жировой ткани, желтый цвет - 20 нм КТ).
F - Проекция капиллярной структуры в препарате глубиной 250 мкм (жировая ткань,
50 изображений, срезы через 5 мкм).
Получение биосовместимых водорастворимых
полупроводниковых CdSe/ZnS КТ, покрытых полисилоксановой оболочкой
Гидрофобные нанокристаллы CdSe/ZnS типа
ядро-оболочка с размером ядра 2-5 нм помещались в полисилоксановую оболочку и
функционализировались меркапто- или аминогруппами. Полученная полисилоксановая
оболочка имела толщину 1-5 нм, в итоге полученные частицы имели размер 6-17 нм,
в зависимости от размера затравочных частиц CdSe. Покрытие КТ полисилоксановой
оболочкой значительно не измененяет оптических свойств нанокристаллов. Их длина
волны флуоресцентного излучения составляла 32-35 нм - полная ширина кривой
испускания на уровне полумаксимума и КТ могли быть настроены на цвета от
голубого до красного с квантовым выходом более 18%. КТ покрытые
полисилоксановой оболочкой демонстрируют большую фотохимическую стабильность по
сравнению с другими органическими флуорофорами. Они также показывают высокую
стабильность в буферах при физиологических условиях (<150 ммоль/л NaCl).
Введение функциональных групп на поверхность полисилоксановой оболочки может
обеспечить возможность конъюгации нанокристаллов для биологического
применения./ZnS ядро/оболочка нанокристаллы были получены в
триоктилфосфиноксиде (TOPO) согласно процедуре описанной в статьях [27,28-30].
Нанокристаллы хранились при комнатной температуре в смеси бутанол/TOPO (1/2 по
объему) с концентрацией CdSe ядер 5-10 мг в 1 мл раствора и были стабильны в
течение месяца. Для последующего оксидирования ядер не проводилось никакой
специальной подготовки.
Типовой синтез нанокристаллов, покрытых
полисилоксановой оболочкой, изображен на рис.1.14 Количества исходных веществ
могут быть легко померены и рассчитаны для получения нанокристаллов с любым
размером в интервале 2-8 нм. 1 мл нанокристаллов в смеси бутанол/TOPO
(оптическая плотность нанокристаллов примерно 2) осаждались, используя
дегидрированный метанол. Влажный осадок разбавлялся 50 мкл
меркаптопропилтриметоксисилана (MPS, HS(CH2)3Si(OCH3)3). После взбалтывания добавляли
5 мкл раствора гидроксида тетраметиламмония (TMAH) в метаноле и раствор
становился оптически прозрачным. Эта смесь разбавлялась 120 мл дегидрированного
метанола, доведенного до pH=10, путем добавления 750 мкл TMAH, и выдерживалась
под азотом в трехгорлой колбе. После одного часа медленного размешивания
раствор нагревали до 60°С в течение 30 минут. После охлаждения до комнатной
температуры добавляли 90 мл метанола, 10 мл воды, 600 мкл
3-(тригидроксисилил)пропилметилфосфоната ((OH)3Si-(CH2)3-PO3-Na+) и 20 мкл
меркаптопропилтриметоксисилана, размешивали 2 часа, затем нагревали до 60°С
менее чем за 5 минут и охлаждали до 30ºС.
Оставшиеся гидроксильные группы сшивались после добавления 20 мл метанола и 2
мл хлортриметилсилана и раствор снова размешивали в течение 2 часов. Раствор
нагревали до 60ºС в течение
30 минут и оставляли при комнатной температуре на 2-4 дня, перемешивая его в
атмосфере азота. На следующей стадии раствор концентрировали в 2-5 раз в РПИ
(роторно-пленочном испарителе) и снова оставляли на 24 часа. Затем проводили
диализ раствора в трубке, отсекающей фракцию с молекулярной массой 10000
метанолом в течение 1 дня с последующей фильтрацией через нейлоновый фильтр с
диаметром пор 0,45 мкм. Избыток непрореагировавшего хлортриметилсилана удаляли
с помощью устройства для фильтрования при центрифугировании. Объем раствора
после этого уменьшался до 2 мл. Раствор нанокристаллов, покрытых
полисилоксановой оболочкой в метаноле оставляли на 12 часов перед тем, как
пропустить его через экстракционную колонку. Использовали колонки длиной 20 см
с диаметром 0,7 см заполненные раствором примерно 5 г Sephadex G25 (сшитый гель
декстрана), уравновешенного 10 ммолярным фосфатным буфером до pH=7. Объем
вытесненного раствора (элюата) составлял примерно 3 мл. Экстракция продолжалась
в течение нескольких часов, и затем элюат фильтровали через ацетатный фильтр с
размером пор 0,22 мкм. Дополнительно проводили еще один диализ этого раствора
дистиллированной водой в течение 1-4 дней, пропускали через фильтр с размером пор
0,22 мкм и концентрировали до нужной концентрации в вакуумном концентраторе при
60ºС.
На последней стадии раствор центрифугировали при 20000g в течение 30 минут и
осадок удаляли. А супернатант хранили до использования при н.у.
Рис.1.14 Описание метода инкапсуляции CdSe/ZnS
нанокристаллов типа ядро-оболочка в полисилоксановую оболочку. Частицы CdSe/ZnS
типа ядро/оболочка помещали в чистый меркаптопропилтриметоксисилан и получали
их гидролизованную форму, как изображено на рисунке. После повышения pH
меркаптопропилтриметоксисилан замещал TOPO (триоктилфосфиноксид) молекулы на
поверхности нанокристаллов. Метоксисиланольные группы (Si-OCH3) гидролизовались
в силанольные группы (Si-OH) и образовывали первичный полимерный слой. При
нагревании свободные гидроксильные группы взаимодействовали, образуя
силоксановые связи и выделяя молекулы воды. Затем добавляли
3-(тригидроксисилил)пропилметилфосфонат, который соединялся с оболочкой и
фунционализировал поверхность нанокристаллов. На последней стадии (не показана)
оставшиеся гидроксильные группы превращали в метокси-группы; эта последняя
стадия предотвращала дальнейший рост кремнийорганической оболочки.
Свойства и преимущества применения
полупроводниковых КТ в биологических целях
Полупроводниковые нанокристаллы полученные в
качестве флуоресцентных проб для биологического окрашивания и диагностики по
сравнению с обычными флуорофорами имеют узкий, настраиваемый и симметричный
спектр излучения и они фотохимически стабильны. Преимущества широкого
непрерывного спектра возбуждения были показаны в эксперименте на мышиных
фибробластах.
Флуоресценция это широко используемый в
биологических целях инструмент. Стремление к измерению большего числа
биологических индикаторов одновременно налагает новые требования к флуорофорам,
используемым в этих экспериментах. К примеру, восьмицветовая, трехлазерная
система используется для измерения 10 параметров клеточных антигенов при
проточной цитометрии [31] и в цитогенетике, комбинированное меченье используется
для генерирования 24-ех окрашенных проб [32]. Молекулы общепринятых красителей
налагают строгие требования к оптической системе, используемой для измерений;
их узкий спектр возбуждения одновременно затрудняет возбуждение во многих
случаях.
В полупроводниковых нанокристаллах оптическая
плотность и максимум испускания сдвигаются к более высокой энергии с
уменьшением размера [33]. Отслеживание спектров возбуждения и поглощения
привело к выводу, что это настраиваемые флуорофоры, которые могут возбуждаться при
любой длине волны короче максимума испускания, при этом испуская с одинаковым
спектром (узким, симметричным) рис.1.15 В. Изменение материала, используемого
для получения нанокристаллов, и изменение их размеров приводит к сдвигу пика
испускания в спектральном диапазоне от 400 нм до 2 мкм (рис.1.16), с типичной
шириной пика 20-30 нм (ширина пика при половинном максим (FWHM)) в видимой
области спектра и большими коэффициентами гашения в видимой и УФ областях
(примерно 105 моль-1см-1). Поэтому нанокристаллы различных размеров могут
возбуждаться одноволновым источником света, что приводит к различным цветам
испускания, которые можно детектировать одновременно.

Рис.1.15 Спектры возбуждения (пунктирная линия)
и флуоресценции (жирная линия) флуоресцеина (А) и типичных КТ в фосфатном
буфере (В). Флуоресцеин возбуждается при 476 нм и КТ при 355 нм. Спектр
возбуждения регистрировался при 550 нм для флуоресцеина и при 533 нм для КТ
из-за различия их спектров излучения. КТ имеют более узкий спектр излучения (32
нм против 45 нм при половинном максимуме и 67 нм против 100 нм при 10% от
максимума у флуоресцеина), не имеют хвоста в красной области и имеют широкий
непрерывный спектр возбуждения.
Нанокристаллы, помещенные в полисилоксановую
оболочку, широко использовались в биологических экспериментах [34,35].
Использование КТ в биологических целях на самом деле более проблематично из-за
большой площади поверхности КТ, что может приводить к тушению люминесценции и
фотохимическому распаду. Помещая ядро нанокристалла из одного материала в
оболочку из другого, ограничивается возбуждения ядра, ликвидируются
безизлучательные переходы, и предотвращается фотохимический распад КТ. Синтез
КТ и наращивание оболочки, методами, описанными в литературе, дает на выходе
граммовые количества КТ с узким распределением по размерам (5%), покрытых
ПАВом, но растворимых только в неполярных растворителях [36].
Биологическое применение требует, чтобы КТ были
водорастворимы. Для этого на КТ типа ядро/оболочка наносят третий слой -
полисилоксановый, что делает КТ водорастворимыми. Модификация полисилоксановой
оболочки различными функциональными группами может использоваться для контроля
взаимодействия с биологическими образцами. КТ типа ядро/оболочка, полученные таким
методом, растворимы и стабильны в воде или буферных растворах, и они сохраняют
большой четкий квантовый выход (до 20 %, по сравнению с общепринятыми
красителями у которых он составляет от 14 до 71% [37] (рис.1.16 В). Ожидается,
что дальнейшее развитие возможностей КТ приведет к более высокому квантовому
выходу и увеличению других иммиссионных свойств [38]. Эту методику применили к
ряду КТ типа ядро/оболочка различных размеров, образовав спектрально
настроенный набор образцов, каждый из которых подвергся одинаковой модификации
поверхности (в отличие от органических красителей, химия которых обычно
специфична в каждом случае).
Чтобы установить полезность КТ для
биологического применения помечали 3Т3 мышиные фибробласты, используя СdSe/CdS
КТ типа ядро/оболочка 2-х различных размеров. Меньшие КТ (ядро 2 нм) имели
зеленую флуоресценцию (максимум 550 нм, квантовый выход 15%), большие (ядро 4
нм) имели красную флуоресценцию (максимум 630 нм, квантовый выход 6%).
Поверхность КТ может быть функционализирована таким образом, чтобы КТ
связывались с биологическим образцом посредством ковалентных связей,
электростатического взаимодействия или водородных связей.
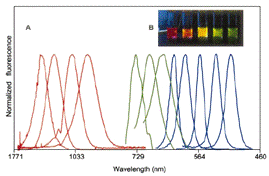
Рис.1.16 (А) - спектры нескольких наборов КТ
различных размеров, покрытых полисилоксановой оболочкой. Синяя серия - КТ CdSe
[39] с диаметрами 2,1; 2,4; 3,1; 3,6 и 4,6 нм (слева направо). Зеленая серия -
КТ InP [40] с диаметрами 3,0; 3,5 и 4,6 нм. Красная серия - КТ InAs [39] с
диаметрами 2,8; 3,6; 4,6 и 6,0 нм.
(В) - фотография серии нанокристаллов, покрытых
полисилоксановой оболочкой, с ядром CdSe и оболочкой ZnS или CdS в водном
буфере, все одновременно облучались переносной УФ-лампой.
.7 Методы окрашивания полимерных микросфер
флуоресцентными красителями
Известно большое количество люминесцентных
веществ, способных придавать яркий цвет ряду пластиков, таких как полистирол и
полиметилметакрилат. Одним из важных параметров, которые необходимо учитывать
при выборе красителя, является стоксов сдвиг (разница между длинами волн пиков
возбуждения и эмиссии) [41-43]. В том случае, когда длина света возбуждения
близка к длине волны пика эмиссии, требуется использовать специальные фильтры
для разделения и оценки интерферирующих волн. Применение таких фильтров
уменьшает интенсивность флуоресцентного сигнала. Поэтому желательно применять
красители, которые обладали бы широким стоксовым сдвигом, так как он
увеличивает доступность считываемости флуоресцентного сигнала [44].
Другим плюсом применения красителей с широким
стоксовым сдвигом является возможность детектирования ими окрашенных материалов
в присутствии других флуоресцентно окрашенных материалов. Это особенно важно
при применении этих красителей в биотехнологии для создания материалов,
вводимых в живые организмы. Желательно, чтобы в этом случае флуоресцентный
сигнал вводимого материала излучал при длине волны, на которой флуоресценция
фона минимальна [45-48].
Третьим преимуществом применения флуоресцентных
красителей с широким стоксовым сдвигом является возможность детектирования смеси
анализируемых веществ в одном объеме при действии волны возбуждения одной
длины. Используя два или более различных флуоресцентных красителей, каждый из
которых может возбуждаться при одной и той же длине волны, пики их эмиссии
можно детектировать при различных длинах волн, где каждый спектр эмиссии
является характеристикой одного из анализируемых веществ. При этом пики эмиссий
флуоресцентных меток хорошо разделимы друг от друга, и, следовательно, факторы
корреляции между различными красителями минимальными.
Флуоресцентные красители с широким стоксовым
сдвигом могут быть использованы в сочетании с флуоресцентными красителями с
меньшим значением этого параметра, при этом оба материала могут возбуждаться
при одной и той же длине волны, а излучать при разных, давая несколько
сигналов, разделимых на оптическом фильтре монохроматора [49].
Отметим, что важным параметром при выборе
красителей также является стабильность флуоресцентной метки.
Все методы окрашивания микросфер можно разделить
на три группы: (а) окрашивание путем ковалентного присоединения красителя к
поверхности частицы, (б) окрашивание путем введения красителя на стадии
полимеризации частиц, (в) окрашивание уже заполимеризованных частиц путем
диффузии молекул красителя в их объем.
В первом случае флуоресцентно окрашенные
микросферы получают путем ковалентного присоединения функциональных групп
молекул одного или нескольких красителей к функциональным группам полимера,
расположенным на поверхности частиц [50-52]. Недостатком данного метода является
то, что молекулы красителя располагаются на поверхности частиц, не проникая при
этом в объем микросфер, что ограничивает применение данного метода.
Равномерного окрашивания по объему частицы можно
добиться при добавлении флуоресцентного красителя во время процесса
полимеризации. Некоторые исследователи предлагали проводить полимеризацию
мономеров в присутствии красителя, некоторые - использовать красители,
способные участвовать в процессе полимеризации [53]. Однако, первая группа
исследователей столкнулась с проблемой, связанной с тем, что при действии на
частицы, окрашенные двумя флуоресцентными красителями, светом одной длины
волны, они получали один ответный сигнал [54]. А значит, такие частицы являются
непригодными для многокомпонентного анализа особенно в проточных цитометрах с
одним источником возбуждения.
Во втором случае молекула красителя должна быть
способна к полимеризации. Но в этом случае можно ожидать, что флуоресцентный
краситель будет ингибировать процесс полимеризации или что произойдет обесцвечивание
красителя под действием одного из веществ реакции.
В статье [55] описан метод флуоресцентного
окрашивания при проведении затравочной полимеризации. Один или несколько
гидрофобных флуоресцентных красителей растворяют в растворе, содержащем мономер
и инициатор, а затем этот раствор добавляют к частицам затравки. Авторы
отмечают, что этим методом можно окрасить частицы тремя красителями. Однако
этот метод также имеет все выше перечисленные недостатки.
Кумачева и др. предложили метод получения окрашенных
частиц типа ядро-оболочка. На первом этапе проводили полимеризацию смеси двух
мономеров и флуоресцентного красителя. А затем на частицах затравочной
суспензии создавали оболочку путем сополимеризации метакрилата и
бутилметакрилата в присутствии додецилмеркаптана. Таким способом были получены
монолитные микросферы [56].
Другие ученые на последнем этапе полимеризации
при создании оболочки к полимеризуемой смеси добавляли мономер с
функциональными группами на поверхности, способными ковалентно связываться с
объектами дальнейшего исследования. Весь процесс состоял из трех этапов:
приготовление флуоресцентно окрашенного ядра частицы, инкапсулирование оксида
метала в полистирольную оболочку, покрывающую окрашенное ядро, путем
радикальной полимеризации в отсутствие эмульгатора, но с избытком инициатора, и
обволакивание магнитной флуоресцентной частицы слоем функционального полимера.
Таким образом, были получены частицы с карбоксильными, амино-, гидрокси- и
сульфоновыми группами на поверхности.
Третий метод окрашивания полимерных микросфер
основан на использовании в качестве начального материала готовых полимерных
микросфер [57]. Окрашивание частиц происходит путем диффузии молекул красителя
внутрь частицы. Жирорастворимый или гидрофобный краситель добавляют к растворителю
или смеси растворителей, содержащих микросферы и набухают их в течение
некоторого времени. В этом методе используют гидрофобные микросферы, так как
это позволяет провести их набухание в неполярных растворителях, содержащих
гидрофобные красители. В этом случае степень набухания частиц красителем
зависит от степени сшивания полимера в частицах и регулируется временем
набухания, природой и количеством растворителя (ей), а также количеством
добавленного красителя. Изменяя эти параметры, можно получить частицы либо
окрашенные равномерно по всему своему внутреннему объему, либо частицы,
содержащие флуоресцентно окрашенные слои или сферические зоны желаемого размера
и формы. Удаление растворителя останавливает процесс окрашивания. Микросферы,
окрашенные таким способом, не «кровоточат» красителем в водных растворах или в
присутствии анионных, неионных, катионных, амфотерных и цвиттерионных ПАВ.
Частицы, окрашенные этим методом стабильны и однородны. Однако, во многих
случаях, в зависимости от выбора системы растворителей, требуется большой
избыток красителей для получения желаемой интенсивности окраски, что приводит к
значительной потере дорогостоящего красителя [58].et at. [59] получили
микросферы, окрашенные двумя красителями. Эти микросферы состояли из флуоресцентного
сферического диска и флуоресцентного кольца. Однако их микросферы, используемые
для калибровки цитометров, не могли применяться для комплексного анализа, так
как метод не давал возможность варьировать интенсивности красителя.
.8 Устойчивость суспензий полимерных микросфер
как дисперсных систем
Наиболее общее и важное свойство суспензий - их
устойчивость. Вопрос о стабильности дисперсных систем широко обсуждается в
литературе, однако и в настоящее время эта проблема далека от окончательного решения
и является дискуссионной.
Полимерные суспензии, как и эмульсии,
представляют собой неустойчивые системы [60, 61]. Наличие развитой поверхности
раздела обеспечивает значительный избыток энергии Гиббса, которая всегда
положительна. Все самопроизвольные процессы в таких системах протекают в одном
направлении и приводят к сокращению межфазной поверхности раздела, т. е. к
коагуляции частиц и, в конечном счёте,- к коалесценции, т.е. разделению системы
на две фазы, с минимальной поверхностью раздела. Однако, практически полимерные
суспензии довольно стабильны, что обусловлено наличием потенциального
энергетического барьера, препятствующего слиянию глобул. Как и в эмульсиях,
различают две составляющие этого барьера - электростатическое взаимодействие
заряженных коллоидных частиц и создание вокруг них структурно - механического
барьера, реологические свойства которого препятствуют сближению и,
соответственно, слиянию частиц.
Агрегативная устойчивость полимерных суспензий,
то есть способность сохранять во времени первоначальный размер частиц,
является, основным показателем качества этих суспензий [62]. Агрегативная
устойчивость полимерных суспензий обусловлена наличием на поверхности частиц
межфазного адсорбционного слоя поверхностно-активных веществ, создающих защитный
потенциальный барьер, препятствующий наступлению коагуляции. От состояния и
свойств этого слоя зависят условия взаимодействия полимерных частиц друг с
другом.
Элементарный акт коагуляции, т. е. соединение
частиц при столкновении, возможен в том случае, когда этот барьер либо снят тем
или иным способом, либо преодолен вследствие, например, быстрого сближения
частиц, обладающих достаточным уровнем кинетической энергии.
Коагуляцию полимерных суспензий можно вызвать
различными способами (введением электролитов, механическим перемешиванием,
замораживанием), но во всех случаях она связана со снятием или преодолением
защитного барьера. В этом смысле можно говорить о единой физической природе
агрегативной устойчивости полимерных суспензий.
Имеющиеся литературные данные [63-65]
показывают, что устойчивость полимерных суспензий определяется совместным
действием нескольких различных факторов, обусловливающих в своей совокупности
единство стабилизующего действия создаваемого ими потенциального барьера.
В качестве главного фактора, ответственного за
стабильность коллоидных частиц, многие авторы выдвигают силы
электростатического отталкивания, противостоящие вандерваальсовым силам
притяжения, т. е. привлекают количественную теорию устойчивости дисперсных
систем, сформулированную Дерягиным, Ландау, Фервеем и Овербеком (ДЛФО) [66-68].
При контакте раствора электролита с твердой
фазой (в случае стабилизации латексов ионогенными эмульгаторами) между фазами
возникает разность потенциалов; поверхность приобретает заряд, а в растворе у
поверхности образуется слой раствора, обогащенный ионами противоположного
знака, - возникает двойной электрический слой. Такое пространственное
разделение заряда обуславливает ряд характерных свойств дисперсных систем, в
частности возникновение в них электрокинетических явлений.
Теория электрокинетических явлений связывает их
интенсивность - скорость взаимного смещения фаз или величину возникновения
токов и потенциалов - с так называемым электрокинетическим, или дзета (ξ)
- потенциалом, который определяется как потенциал некоторой границы скольжения,
отделяющий связанный с поверхностью силами адгезии слой дисперсионной среды от
её остального, свободного объёма. В большинстве случаев
ξ-потенциал
рассматривается как критерий устойчивости частиц. Роль электростатической
составляющей расклинивающего давления в устойчивости дисперсных систем, в том
числе и латексов, подробно рассмотрена в монографиях [61,69].
Однако теория ДЛФО не учитывает стерические
препятствия при сближении частиц, окружённых адсорбционно-гидратными слоями.
Авторы этой теории не принимают во внимание то обстоятельство, что коагуляция
полимерной суспензии протекает через стадию образования агрегатов, внутри
которых взаимодействуют не пары, а большее число частиц. Наконец, теория ДЛФО
рассматривает устойчивость коллоидных систем лишь по отношению к электролитам.
В теории ДЛФО не учитывается также структура
межфазных адсорбционных слоев на поверхности частиц. Величина этого слоя может
быть большой протяжённости и плотности особенно в присутствии длинноцепочечных
ПАВ, несущих собственные сольватные оболочки (структурно-механический барьер).
Явления сольватации или гидратации (в водных
системах) обусловлены взаимодействием растворённых или
коллоидно-диспергированных веществ и твёрдообразных макроповерхностей с
молекулами окружающей жидкой среды, например воды в латексах.
Многочисленными исследованиями [70] установлено,
что жидкость в граничных сольватных или гидратных прослойках обладает особой
структурой, и вследствие этого свойствами, отличающими её от обычной жидкости в
объёме. Так, вода в граничных гидратных слоях имеет повышенную вязкость,
упругость на сдвиг. Изменяются и другие её свойства: плотность, растворяющая
способность, температура замерзания и т. д.
Существование гидратных слоев с их особой
структурой и свойствами приводит к возникновению между коллоидными частицами
или макроповерхностями при их сближении в жидкой среде отталкиваний
неэлектростатической природы.
Неэлектростатические факторы стабилизации
полимерных суспензий [71-75], синтезированных в присутствии ионогенных
эмульгаторов, объясняют гидратацией и структурированием адсорбционных слоев на
поверхности частиц. Эти факторы усиливаются по мере уплотнения и насыщения
адсорбционных слоев эмульгатора, что, в частности приводит к коагуляции
полимерных суспензий электролитами. Возникновение граничных гидратных прослоек
на поверхности полимерных частиц было обнаружено различными методами [76].
Многочисленные исследования свойств межфазных
адсорбционных слоев, проводившиеся Ребиндером и его школой [71-75, 77,78],
показали, что такие слои образуют структурно-механический барьер,
препятствующий контакту частиц.
Поверхностно-активные вещества различной
природы, являющиеся эффективными стабилизаторами дисперсных систем, образуют на
легкоподвижных границах раздела фаз плёнки различной толщины. В зависимости от
условий эксперимента на соответствующих границах могут формироваться монослои,
межфазные адсорбционные слои (толщина которых может заметно превышать толщину
монослоя), а также двусторонние тонкие плёнки. Тонкие плёнки ПАВ проявляют
специфические реологические свойства, что позволяет их рассматривать как тело
или материал, несмотря на малость одного из линейных параметров - толщины и
характеризовать их макроскопическими параметрами (вязкость, упругость и др.).
Именно эти макрореологические свойства межфазных
адсорбционных слоев определяют в ряде случаев как устойчивость самих слоев и
фазовые переходы в них, так и стабилизацию ими разнообразных дисперсных систем.
Они обусловливают возникновение структурно-механического фактора устойчивости.
Повторим, что по Ребиндеру, структурно-механический барьер возникает при
адсорбции молекул ПАВ, которые могут быть не сильно поверхностно-активными для
данной границы раздела фаз, но способны к образованию гелеобразного
структурированного слоя на межфазной границе. Этот слой подобен трёхмерной
структуре - гелю, который может возникать в растворах ряда веществ при
достаточной их концентрации. Коагуляция частиц предотвращается тем, что
адсорбционный слой, являющийся механическим препятствием, не позволяет частицам
приближаться друг к другу на близкие расстояния. Их встреча в результате
теплового движения приводит лишь к упругому столкновению адсорбционных слоев, а
образовавшаяся в системе структурная сетка ограничивает движение частиц [79].
Согласно П. А. Ребиндеру [71-75], для понимания
механизма стабилизации дисперсий, прежде всего, необходимо изучение
закономерностей адсорбции ПАВ на границах раздела фаз и измерение
структурно-реологических характеристик их поверхностных и межфазных слоев ПАВ.
Имеется ряд исследований [80-83], проведенных в
последние годы и подтверждающих определяющую роль структурно-механического
барьера в стабилизации. Изучая свободные эмульсионные пленки, стабилизированные
белками, авторы [69] установили взаимосвязь между устойчивостью пленок и
реологическими свойствами структурированных межфазных адсорбционных слоев.
В результате адсорбции высокомолекулярных
поверхностно-активных веществ (ПАВ) на легкоподвижных границах раздела фаз
образуются межфазные слои, характеризующиеся определенной прочностью, причина
которой объяснена резким увеличением поверхностной концентрации вещества и
выделением вследствие этого, в соответствии с фазовой диаграммой новой фазы с
образованием контактов сцепления между элементами структуры.
Научная основа для описания реологического
поведения структурированных дисперсных систем на базе измерений полных
реологических кривых, позволяющих рассчитывать модули эластичности, вязкости и
предельные сдвиговые напряжения была создана П.А. Ребиндером. Разработанный
подход использовался как при изучении объемного, так и поверхностного
структурообразования В.Н. Измайловой с сотр. [78]. Схемы кривых течения и
изменения эффективной вязкости различных систем приведены на рис. 1.17.

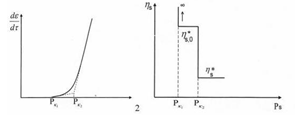
Рис. 1.17 Кривые течения и изменения эффективной
вязкости жидкообразных (1) и твердообразных (2) межфазных адсорбционных слоев,
формирующих структурно-механический барьер:
Pm - напряжение сдвига, при котором достигается
полное разрушение структуры; ηm - вязкость
системы с полностью разрушенной структурой; 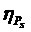 -
структурная вязкость;
-
структурная вязкость; 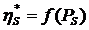 - поверхностная
бингамовская вязкость;
- поверхностная
бингамовская вязкость; 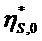 - вязкость
неразрушенной структуры; Pk1 и Pk2 - пределы текучести.
- вязкость
неразрушенной структуры; Pk1 и Pk2 - пределы текучести.
Кривые течения адсорбционных слоев вещества
имеют упруго пластичные области до предела текучести Рк1; здесь деформации
межфазных слоев полностью обратимы и механические свойства характеризуются
модулем эластичности Es, типичной для тела Гука. Обратимы также
условно-мгновенные деформации до Рk1 причем обратимость деформаций является
следствием изменения энтропии, связанной с изменением ориентации элементов
структуры межфазного слоя. В этих условиях межфазный слой характеризуется
термодинамической обратимостью. Структурно-механический барьер может выступать
как термодинамический фактор устойчивости при рассмотрении баланса энергий
притяжения или отталкивания.
При значениях напряжениях сдвига, больших Рk1
регистрируется участок медленной (шведовской) ползучести с постоянной
пластической вязкостью η0. В этой
области происходят незначительные разрушения связей в квазидвумерной структуре
межфазного слоя, которые при малых скоростях не успевают восстановиться. При
определенном напряжении сдвига структурная сетка не выдерживает стационарного
течения и разрушается. Это напряжение соответствует переходу кривой течения в
область пластического течения. Выше бингамовского предела текучести Рk2
-напряжения межфазный адсорбционный слой течет с минимальной пластической
вязкостью η*. Здесь проявляется
кинетический фактор структурно-механического барьера.
Следует отметить некоторые признаки
структурно-механического барьера, вытекающие из структурных особенностей
адсорбционных слоев, существенные для разработки термодинамического фактора
устойчивости при проявлении структурно-механического барьера, которые подробно
описаны в монографии [77]. Адсорбционные слои ПАВ снижают поверхностную энергию
на границе раздела фаз. Значение сложной константы Гамакера А* близко к
значению, соответствующему притяжению тех же фаз через прослойку дисперсионной
среды, например воды (А*~10-20÷10-21
Дж). В общем случае межфазный адсорбционный слой ПАВ имеет константу Гамакера,
отличную от константы Гамакера внутренней части дисперсной фазы и дисперсионной
среды. Если константа Гамакера межфазного слоя близка к константе Гамакера
дисперсионной среды, межфазный слой действует как барьер, препятствующий
контакту диспергированных частиц; частицы удерживаются на таком расстоянии друг
от друга, при котором ван-дер-ваальсовые силы становятся незначительными.
Процесс образования плоского контакта между двумя окруженными
структурированными слоями каплями жидкости или газовыми пузырьками состоит из
нескольких стадий. На больших расстояниях между частицами действуют
ван-дер-ваальсовые силы притяжения.
При сближении частиц происходит вытекание
дисперсионной среды из зазора между ними, затем деформирование, уплощение
сближающихся поверхностей и изменение их радиусов кривизны. На этом этапе
притяжение поверхностей вызывается молекулярной составляющей расклинивающего
давления 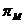 и
капиллярным давлением
и
капиллярным давлением 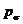 :
:
 ;
; 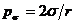
А* - сложная константа Гамакера; Н - расстояние
между сближающимися поверхностями; σ
- поверхностное натяжение на границе раствора ПАВ с воздухом или неполярной
жидкостью.
По мере дальнейшего сближения поверхностей происходит
контакт адсорбционных слоев. При непосредственном соприкосновении межфазных
слоев в зоне плоского контакта молекулярное притяжение способствует утончению
пленки (расстояние Н между поверхностями сокращается). Величине молекулярного
притяжения противодействует сила упругого отталкивания структурированных
(гелеобразных или кристаллоподобных) слоев толщиной d.
Принимая предположение о равномерном характере
распределения деформации по толщине адсорбционного слоя, упругую составляющую
структурно-механического барьера πупр
можно выразить по закону Гука:
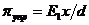
- модуль упругости на сжатие (растяжение)
адсорбционного слоя; х - абсолютная упругая деформация одного адсорбционного
слоя, т.к. H=2(d-x), то x=d-H/2.
Тогда:
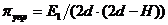
Для плоского контакта двух адсорбционных слоев,
покрывающих поверхности капель или пузырьков в водных растворах
высокомолекулярных ПАВ, суммарное расклинивающее давление πΣ
можно выразить как:
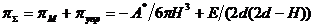
Исследование структурно-реологических свойств
межфазных слоев ПАВ стало возможным благодаря созданию Ребиндером и
Трапезниковым уникального прибора [84, 85]. Несмотря на то, что в последние
годы разработаны новые приборы и установки для исследования реологических
свойств адсорбционных слоев различных ПАВ [86, 87], прибор Ребиндера и
Трапезникова не потерял актуальности.
Образование прочных межфазных слоев ПАВ на
легкоподвижных границах раздела фаз является сложным процессом и включает
стадии адсорбции, ориентации, латерального взаимодействия, конформационных
изменений (особенно для гибких цепей), двумерного фазового разделения,
распределения компонентов между фазами. В зависимости от вкладов различных
стадии в процессе формирования межфазного слоя и от конформационного состояния
ПАВ в растворе были выделены два типа межфазных слоев: гелеобразные или
квазикристаллические (жидкокристаллические). Модели адсорбционных слоев
соответствуют структурам с коагуляционными или
кристаллизационно-конденсационными контактами, определяющими, согласно П.А.
Ребиндеру [71-74], структурообразование в дисперсных системах. Результаты этих
исследований необходимы для понимания механизма формирования межфазных
адсорбционных слоев ПАВ на поверхности полимерных частиц.
Глава 2. Экспериментальная часть
.1 Исходные вещества
Стирол - технический продукт, очищали от
стабилизатора 5%-ным водным раствором едкого натра, промывали водой до
нейтральной реакции, сушили над прокаленным хлористым кальцием и дважды
перегоняли в вакууме. Использовали фракцию, кипящую при t = 41 ºC
(10
мм.рт.ст.) d420=0,906г/см3, nd20=1,5450.
Додецилсульфат натрия (ДСН) - эмульгатор
ионогенного типа, использовали марки "чда".
Этиловый спирт - продукт марки “ч”
Поливинилпирролидон, стабилизатор, применяли тип
с молекулярной массой 40000.
Метилметакрилат (ММА) - продукт марки «ч» дважды
перегоняли и использовали мономер со следующими константами: Tкип=33ºС
(55 мм.рт.ст.), d420=0,936г/см3, nd20=1,413.
Персульфат калия (ПК) (Sigma Aldrich) - K2S2O8,
применяли продукт марки «хч», содержащий 99,9% активного вещества.
Динитрилазоизомасляной кислоты (ДАК), очищали
перекристаллизацией из метанола.
Кремнийорганическое соединение:
(α,ω-бис[10-карбоксидецил]полидиметилсилоксан)
(КС2) общей формулы:
|
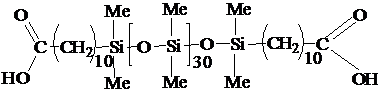
|
,
где Me = CH3-
|
Синтезирован в ГНИХТЭОС, имеет ММ=2728 г/моль, %
COOHпракт = 3.60 %; η25º=132 сСт;
Вода - бидистиллят;
Ацетон - Ткип = 56,2оС;
Этанол - Ткип = 78,40С;
Флуоресцеин (водный раствор 0,3 моль/л);
Магдаловый красный (спиртовой раствор 0,3
моль/л);- буфер - рН=7,4, продукт фирмы «Sigma»;фруктоза - марки «чда»;
Сахароза - марки «чда»
2.2 Получение полистирольных микросфер диаметром
6 мкм с карбоксильными группами на поверхности
Затравочную полимеризацию проводили в стеклянном
реакторе (рис.2.1) объемом 100 мл, снабженным теплообменной рубашкой,
двухрядной стеклянной пропеллерной мешалкой и системой для продувки инертного
газа (азота или аргона). Для поддержания необходимой температуры полимеризации
через теплообменную рубашку реактора с помощью термостата прокачивалась вода,
температура которой поддерживалась на уровне 60 ± 0.5°С.
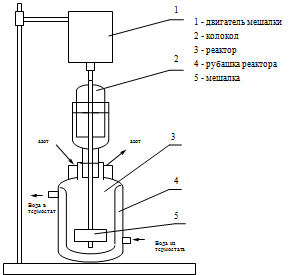
Рис. 2.1 Схема реактора.
В реактор загружают затравочную полистирольную
суспензию, в которой растворены водорастворимые компоненты и проводят дегазацию
в течение 15-20 минут. В смеси мономеров растворяют ДАК и вводят смесь в
реактор. Дегазацию ведут еще в течение 2-3 минут. Сначала идет процесс
набухания исходной полистирольной суспензии в смеси мономеров при комнатной
температуре в течение 24 часов. После этого реактор подключают к термостату,
доводят температуру до 60,0±0,5ºС
и отмечают время начала полимеризации. При необходимости через 2 часа после
начала самой полимеризации вводят раствор персульфата калия [88].
.3 Получение ПММА микросфер диаметром 0,4 мкм с
карбоксильными группами на поверхности.
Для полимеризации метилметакрилата использовали
стеклянный разборный дилатометр на шлифовом соединении, заполняли его на
вакуумной установке (рис. 2.2). Подготовку опытов проводили следующим образом:
в реторту (4) заливали рассчитанное количество метилметакрилата, в реторту (5)
заливали воду. Инициатор (ПК) и ПАВ взвешивали в широкую часть дилатометра (1).
Проводили дегазацию мономера и раствора эмульгатора посредством трёх циклов
замораживание - откачивание - размораживание. Установку откачивали до
остаточного давления р = 10-3÷10-4
мм. рт. ст. После удаления растворенного воздуха мономер через поворотные шлифы
(7,8) сливали в дилатометр, в мономере растворяли ПАВ, а затем сливали воду.
Дилатометр отделяли от установки в токе азота и помещали в термостат, в котором
поддерживали постоянную температуру 80ºС.
Колебания температуры в термостате не должны превышать ± 0,1ºС.
Перемешивание эмульсии в дилатометре
осуществляли с помощью магнитной мешалки (3). Термостатировали дилатометр в
течение 5 минут, открывали пробку и пипеткой отбирали избыток жидкости из
дилатометра, так чтобы её уровень находился непосредственно в капилляре. После
этого начинали измерение уровня жидкости в капилляре, замеряя его через
определенные промежутки времени в зависимости от скорости опускания столба
жидкости. Глубину полимеризации, то есть отношение количества
заполимеризовавшегося мономера к исходному количеству, рассчитывали по формуле:
P= (ΔH/ΔHmax)*100%, где:
- степень полимеризации (%);
ΔH - текущее изменение уровня в капилляре дилатометра
(см);
ΔHmax - изменение уровня в капилляре дилатометра,
соответствующее 100%-ной конверсии, см, рассчитанное по формуле:
Hmax=Vm*(ρn-ρm)/(S*ρn),
где
Vm - объем мономера (см3);
ρm - плотность мономера (г/см3);
ρn - плотность полимера (г/см3); S - площадь сечения
капилляра (см2).
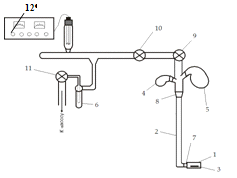
Рис.2.2 Вакуумная установка для загрузки
дилатометра: 1 - широкая часть дилатометра, 2 - капилляр, 3 - мешалка, 4, 5 -
реторты, 6 - ловушка, 7, 8 - шлифы, 9, 10, 11 - краны; 12 - вакуумметр.
2.4 Определение размера частиц в суспензии
Размер частиц в суспензиях определяли методом
сканирующей электронной микроскопии (СЭМ). Каплю разбавленной полимерной
суспензии наносили на предметный столик микроскопа, который предварительно
подвергали гидрофилизации для равномерного распределения суспензии по
поверхности. Суспензию высушивали в течение 20 минут на воздухе при нормальных
условиях (н.у.). Столик помещали в вакуумную камеру ионного напылителя IB-3,
EIKO ENGINEERING (производство Япония), где при силе ионного тока - 6 мА,
напряжении на электродах - 900 В и вакууме 0,05 торр образец напыляли золотом.
Образец изучали с помощью электронного микроскопа S-570 "Hitachi"
(производство Япония) и определяли средний размер частиц суспензии путём их
измерения на соответствующих микрофотографиях.
Анализ фотографий был осуществлен с помощью
программы ImageJ. Обсчет характеристик проводился по следующим формулам:
Средневесовой диаметр:
Dw = 
 , где ni -число
частиц, имеющих диаметр Di
, где ni -число
частиц, имеющих диаметр Di
Среднечисловой диаметр:
= 
Коэффициент распределения (полидисперсности): К
= Dw / Dn
Среднеквадратичное отклонение:
s = 
Коэффициент вариации: Кв = s
/ D *100 %.
.5 Определение сухого остатка суспензии
Сухой остаток суспензии определяли следующим
образом: взвешивали чистую фарфоровую чашечку на аналитических весах. В чашечку
брали навеску около 1г полимерной суспензии и еще раз взвешивают на
аналитических весах. Определяют точный вес навески полимерной суспензии. Далее
чашечку ставили в инфракрасный испаритель и выпаривали жидкость. Затем чашечку
с образовавшейся пленкой полимера остужали и снова взвешивали. Вычисляли
массовую долю полимера (сухой остаток) в % массовых по отношению к взятому
количеству полимерной суспензии по следующей формуле:
 ,
,
где mс, mв, mч - масса чашечки с суспензией,
после выпаривания и чистой, соответственно.
.6 Подбор флуоресцентного красителя
Подбор красителя осуществлялся исходя из
следующих параметров:
максимум поглощения красителя лежит в области
длин волн λ = 488±10 нм, это необходимо
для исследований, так как ряд конфокальных микроскопов в частности находящийся
в нашем распоряжении конфокальный лазерный сканирующий микроскоп имеет блок
лазеров, генерирующий волны с λ=488 нм
нерастворим или плохо растворим в воде
хорошо растворим в ацетоне
Были выбраны 2 красителя:
Флуоресцеина динатриевая соль (уранин)
Магдаловый красный
Флуоресцеин.
Жёлтые кристаллы, плохорастворимые в воде, лучше
- в спирте и водных щелочах, температура плавления 314-316°С (с разложением). В
водных растворах существует в виде смеси (1: 1) бензоидной и хиноидной форм и
обладает сильной жёлто-зелёной флуоресценцией (отсюда и название). Имеет
максимум поглощения 494 нм и люминесценции 521 нм (водного раствора). Получают
флуоресцеин конденсацией фталевого ангидрида с резорцином:

Уранин
Перекристализованный из метилового спирта
флуоресцеин высушивают при 140-150°С для удаления кристаллизованного метанола.
При этом он переходит в темно-красную модификацию. Затем чистый флуоресцеин и
чистый карбонат натрия в эквимолярном соотношении растворяют в воде и упаривают
раствор на водяной бане. Полученный светло-оранжевый препарат - динатриевая
соль флуоресцеина.

Магдаловый красный
Образуется при сплавлении 1-аминоазонафталина с
уксуснокислым α-нафтиламином и
состоит из смеси моноамино- и диаминонафтилнафтазониевых солей. Очень плохо
растворим в воде, лучше в спирте и ацетоне. Максимум поглощения 482 нм и
люминесценции 508 нм.
2.7 Подбор концентрации красителя
. Первая серия экспериментов
Первая серия экспериментов по подбору
концентрации красителя выполнялась для того, чтобы выбрать наиболее подходящий
диапазон концентрации красителя, при которой флуоресценция микросфер была бы
максимальна. И не наблюдалось бы концентрационное гашение флуоресценции.
Полистирольные микросферы.
Сухие ПС микросферы диаметром 6 мкм (сшитые ДВБ)
диспергировались в этиловом спирте. Готовилась суспензия с с.о.=1%. Микросферы
осаждали, отбирали супернатант и переводили микросферы в ацетон (диметилкетон,
чда).
Далее для подбора концентрации красителя
готовили 8 суспензий (4 с флуоресцеином и 4 с магдаловым красным) с
концентрациями красителей в конечных суспензиях: 0,2; 0.02; 0,002 и 0,0002%
Полученные суспензии инкубировались в термостате
при 37°С в течение 3 суток. После чего подвергались десятикратной промывке
дистиллированной водой.
Полиметилметакрилатные микросферы.
Исходную суспензию ПММА микросфер в воде
(с.о.=14%) разбавляли водой для получения суспензии с с.о.=1%. Затем переводили
суспензию в 30%-ый раствор ацетона в воде.
Готовили 8 суспензий (4 с флуоресцеином и 4 с
магдаловым красным) с концентрациями красителей в конечных суспензиях: 0,2;
0,02; 0,002 и 0,0002%
Полученные суспензии инкубировались в термостате
при 37°С в течение 3 суток.
После чего подвергались двукратной промывке
30%-ым раствором ацетона в воде и восьмикратной промывке дистиллированной
водой.
Полученные таким образом суспензии окрашенных ПС
и ПММА микросфер раскапывались на предметные стекла. После чего образцы
изучались с помощью конфокального лазерного сканирующего микроскопа, для оценки
равномерности окрашивания микросфер по диаметру и интенсивности флуоресценции.
. Вторая серия экспериментов.
Вторая серия экспериментов по подбору
концентрации красителя выполнялась для того, чтобы выбрать наиболее подходящую
концентрацию красителя из выбранного в первой серии экспериментов диапазона,
при которой флуоресценция микросфер была бы максимальна. А так же для проверки
фиксации красителя в микросферах (не будет ли диффундировать краситель из
частиц в раствор, в котором затем просветляли препараты) для чего образцы
заключались в раствор фруктозы.
Полистирольные микросферы.
Сухие ПС микросферы диаметром 6 мкм (сшитые ДВБ)
диспергировались в этиловом спирте. Готовилась суспензия с с.о.=1%. Микросферы
осаждали, отбирали супернатант и переводили микросферы в ацетон (диметилкетон,
чда).
Далее для подбора концентрации красителя
готовили 3 суспензии с магдаловым красным с концентрацией красителя в конечных
суспензиях: 0,05; 0,1; 0,2%
Полученные суспензии инкубировались при
комнатной температуре в течение 2 суток. После чего подвергались восьмикратной
промывке дистиллированной водой.
Полиметилметакрилатные микросферы.
Исходную суспензию ПММА микросфер в воде
(с.о.=14%) разбавляли дистиллированной водой для получения суспензии с с.о.=1%.
Затем переводили суспензию в 50%-ый раствор ацетона в воде.
Готовили 3 суспензии с магдаловым красным с
концентрацией красителя в конечных суспензиях: 0,05; 0,1; и 0,2%
Полученные суспензии инкубировались при
комнатной температуре в течение 2 суток.
После чего подвергались восьмикратной промывке
дистиллированной водой.
Суспензии ПММА после инкубирования были
разбавлены в 10 раз.
Полученные таким образом суспензии окрашенных ПС
и ПММА микросфер раскапывались на предметные стекла. После чего образцы
изучались с помощью конфокального лазерного сканирующего микроскопа, для оценки
равномерности окрашивания микросфер по диаметру и интенсивности флуоресценции.
2.8 Определение агрегативной устойчивости
микросфер
Определение агрегативной устойчивости ПС и ПММА
микросфер проводили визуально.
На стекло наносили капли среды, объемом 10 мкл и
10 мкл суспензии микросфер с сухим остатком 1% (масс.). Капли перемешивали и
выдерживали в течение 10 минут при н.у. В качестве контрольного образца
использовали каплю водной суспензии микросфер объемом 20 мкл с сухим остатком
0,5% (масс.). Образование агрегатов контролировали визуально. В случае
агрегативной неустойчивости микросфер наблюдалось просветление капли суспензии
и образование крупных агрегатов частиц.
Была проверена устойчивость микросфер в
следующих средах:
Раствор NaCl 0,15 моль/л;
Раствор NaCl 0,075 моль/л;
Поливидон (ММ = 25000 г/моль);
Стабизол (гидроксиэтилкрахмал + NaCl);
Раствор сахарозы 2,6% (масс.);
Раствор фруктозы 2,6% (масс.).
Микросферы были окрашены жирорастворимым
красителем, магдаловым красным, методом диффузии красителя из раствора в объем
частицы.
Для окраски ПММА и ПС микросферы из
дистиллированной воды переводились в 30% раствор ацетона в воде. Для чего
суспензии микросфер в воде осаждали центрифугированием, отбирали супернатант и
добавляли аликвотное забранному супернатанту количество 30% раствора ацетона в
воде. Затем суспензии разделяли по пробиркам объемом 5 мл, для удобства работы
с большими объемами суспензий, заливая в каждую 4,5 мл суспензии и добавляя в
каждую 500 мкл магдалового красного с концентрацией 0,5%. Таким образом, было
приготовлено 20 мл суспензии ПС микросфер и 20 мл суспензии ПММА микросфер с
концентрацией магдалового красного в конечных суспензиях 0,05% (об.) и сухим
остатком 5% (масс.).
Данные суспензии выдерживались в течение 24
часов в темноте, при комнатной температуре. После чего процесс окраски считали
завершенным.
Окрашенные ПС и ПММА микросферы необходимо было
отмыть от красителя, не диффундировавшего внутрь частиц. Для чего проводилось 6
промывок каждой суспензии. 1-ая промывка проводилась 10% раствором ацетона в
воде, промывки 2-5 дистиллированной водой и заключительная 6-ая промывка
проводилась 2,6% водным раствором сахарозы. После последней промывки микросферы
переводились в 2,6% водный раствор сахарозы. Отмывку суспензии окрашенных
микросфер проводили следующим образом: микросферы осаждали, отбирали
супернатант, добавляли аликвотное количество раствора для промывки и
ресуспендировали суспензию, давали ей отстояться в течение 10 минут, затем
операцию отмывки повторяли.
Отмытые и переведенные в раствор сахарозы
микросферы были готовы к перфузии.
.10 Перфузия
Исследование проводилось на лабораторных белых
крысах линии Вистар. Крысы под хлороформным наркозом фиксировались на
операционном столике. После этого вскрывалась грудная клетка.
Схема перфузии представлена на рисунке 2.3.

Рис. 2.3 Схема перфузионной системы.
Игла, соединенная с перфузионной системой
вводилась в аорту через левый желудочек и закреплялась лигатурой. Для
обеспечения оттока перерезалось правое предсердие.
Первоначально проводили перфузию 2,6%
изотоническим раствором сахарозы с добавлением гепарина (в качестве
антикоагулянта, предотвращая свертывания крови) для того чтобы вымыть кровь из
сосудов и капилляров. Перфузировали около 250 мл раствора для очистки сосудов
от крови. Контролировали отмывку сосудов от крови визуально, наблюдая за
сосудами в брыжейке, т.к. она практически прозрачна и в ней хорошо видно
сосуды.
Затем перфузировали 20 мл 5% суспензии
микросфер. Заполнение сосудов микросферами так же контролировали визуально,
наблюдая за заполнением сосудов брыжейки.
После перфузии у крысы изымали следующие органы:
мозг и брыжейку.
Фрагменты мозга и брыжейки заключали в
пластиковые кассеты.
2.11 Просветление препаратов
Существует несколько методик, с помощью которых
можно сделать ткани оптически прозрачными.
Нами была выбрана методика просветления,
основанная на плавном переводе препаратов через серию водных растворов фруктозы
с восходящей концентрацией. Эта методика была выбрана, поскольку используемый в
работе краситель практически нерастворим в воде.
Методика основана на пропитывании тканевых
препаратов фруктозой с показателем преломления 80% раствора n=1,49, который
близок к показателю преломления неокрашенных тканей.
Для этого было приготовлено 6 растворов
фруктозы, объемом по 100 мл с концентрациями 25%, 50%, 75%, 90%, и 2 раствора
98% (масс.). 98% раствор готовили, взвешивая 100г фруктозы и добавляя по каплям
дистиллированную воду, непрерывно перемешивая, доводя объем раствора до 100 мл.
Кассеты с препаратами помещались сначала в 25%
раствор фруктозы и выдерживались в нем в течение 3 часов, после чего кассеты
перемещали на 3 часа в 50% раствор фруктозы и затем на 18 часов в 75% раствор.
Далее по такой же схеме препараты проводили через растворы фруктозы с
концентрациями 90% и 2-ух растворов по 98%.
Глава 3. Результаты и их обсуждение
.1 Исследование свойств суспензии полистирольных
и полиметилметакрилатных микросфер с карбоксильными группами на поверхности
частиц
На первом этапе создания микросфер, пригодных
для исследования строения сосудистого русла осуществлялся синтез полимерных
суспензий с узким распределением частиц по размеру, устойчивых в
физиологических растворах и при хранении.
В этом случае полимерные частицы должны
характеризоваться узким распределением по размерам и иметь диаметр частиц 0,4 и
6,0 мкм, быть устойчивыми в физиологических растворах, в которых они
используются.
При создании микросфер для исследования
сосудистого русла важным вопросом является диаметр частиц полимерной суспензии.
Для исследования строения сосудистого русла были
выбраны полистирольные микросферы диаметром 6 мкм и полиметилметакрилатные
микросферы диаметром 0,4 мкм, исходя из того, что средний диаметр сосудов
составляет 4-5 мкм. Предполагали, что при заполнении сосудистого русла микросферами
диаметром 6 мкм суспензией окажется заполнено только лишь артериальное русло,
при этом капилляры окажутся незаполненными. Однако возможно появление микросфер
диаметром 6 мкм и в венозном русле, из-за наличия артерио-венозных анастомоз
(сосудов, соединяющих артериальную и венозную части сосудистого русла, минуя
капилляры), размер которых достаточен для прохождения через них микросфер
диаметром 6 мкм.
Для обеспечения прохождения флуоресцентных
носителей в капилляры их диаметр принимаем на порядок ниже, чем диаметр
сосудов, то есть 0,2-0,6 мкм. Так же ограничили нижний предел размера
микросфер, их диаметр не должен превышать 0,1 мкм, так как объекты с диаметрами
порядка 0,05-0,1 мкм захватываются сосудистой мембраной и затем уносятся за
пределы сосудистого русла, вследствие чего возможно размытие контуров сосудов.
Поэтому для выявления структуры артериального, венозного и капиллярного русла
было предложено использовать полиметилметакрилатные микросферы с диаметром 0,4
мкм.
В качестве затравочных частиц при полимеризации
стирола использовали полистирольные микросферы диаметром 5 мкм. Рецептура
получения полистирольной суспензии 6мкм представлена в таблице 3.1.
Таблица 3.1 Рецептура проведения затравочной
полимеризации на основе полимерной суспензии 5 мкм.
|
Наименование
компонента
|
Массовые
части
|
|
Полимерная
суспензия 5 мкм
|
100
|
|
Стирол
|
10
|
|
Вода
|
2400
|
|
ДАК
|
2*10-4
|
|
ДСН
|
2.4
|
|
ПВП
|
1
|
|
ПК
|
0.31
|
|
StSNa
|
1
|
|
Si-орг
|
2,5
|
В результате на основе полимерной суспензии 5
мкм были получены полимерные микросферы диаметром 6,0 мкм. Основные
коллоидно-химические свойства полученных полистирольных суспензий представлены
в таблице 3.2.
Таблица 3.2 Коллоидно-химические свойства
полимерной суспензии 6мкм Si-орг.
|
Наименование
полимерной суспензии
|
Средний
диаметр, мкм
|
Кв,
%
|
Кполидисп-и
|
ζ-потенциал
|
Агрегативная
устойчивость, Молярность (М) раствора NaCl
|
|
6мкм
Si-орг
|
6,0
|
37,58
|
1,014
|
-31,6
|
0,20
|
Как видно из результатов, представленных в
таблице 3.2, синтезированные полистирольные частицы с карбоксильными группами
на поверхности сохраняют устойчивость в растворе электролита с концентрацией не
менее 0,15 М.
Полученные полимерные суспензии имеют узкое
распределение частиц по размерам, о чем свидетельствуют данные
микроскопического исследования частиц, приведенные на рис. 3.1, 3.2.

Рис. 3.1 Микрофотография частиц полимерной
суспензии 6мкм Si-орг.
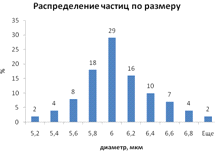
Рис. 3.2 Распределение частиц полимерной
суспензии 6мкм Si-орг по размерам.
Полиметилметакрилатные микросферы получали
методом полимеризации в дилатометре. Рецептура получения представлена в таблице
3.3.
Таблица 3.3 Рецептура проведения полимеризации
метилметакрилата.
|
Наименование
компонента
|
Количество
|
|
Соотношение
фаз вода: ММА
|
1:9
|
|
ПК
|
1%(масс.)
|
|
Si-орг
|
1%(масс.)
|
В результате были получены полимерные микросферы
диаметром 0,4 мкм. Основные коллоидно-химические свойства полученных
полиметилметакрилатных суспензий представлены в таблице 3.4.
Таблица 3.4 Коллоидно-химические свойства
полимерной суспензии 0,4 мкм Si-орг.
|
Наименование
полимерной суспензии
|
Средний
диаметр, мкм
|
Кв,
%
|
Кполидисп-и
|
ζ-потенциал
|
Аггрегативная
устойчивость, Молярность (М) раствора NaCl
|
|
0,4
мкм Si-орг
|
0,4
|
52,4
|
1,024
|
-
|
0,075
|
Как видно из результатов, представленных в
таблице 3.4, синтезированные полиметилметакрилатные частицы с карбоксильными
группами на поверхности сохраняют устойчивость в растворе электролита с
концентрацией 0,075 моль/л.
Полученные полимерные суспензии имеют узкое
распределение частиц по размерам, о чем свидетельствуют данные микроскопического
исследования частиц, приведенные на рис. 3.3, 3.4.

Рис. 3.3 Микрофотография частиц полимерной
суспензии 0,4 мкм Si-орг.

Рис. 3.4 Распределение частиц полимерной суспензии
0,4 мкм Si-орг по размерам.
Очень важно было изучить агрегативную
устойчивость полимерной суспензии в физиологических средах, для того чтобы
исключить агрегацию микросфер и как следствие закупорку сосудов агрегатами при
перфузии. Для применения были пригодны полимерные микросферы, устойчивые в
растворе электролита (NaCl) с концентрацией не менее 0,15 М.
Многочисленные литературные и патентные данные
по синтезу монодисперсных полимерных суспензий показывают, что узкое
распределение частиц по размерам в процессе затравочной полимеризации стирола
сохраняется при использовании кремнийорганических ПАВ, содержащих
функциональные группы (-C00H,-C0H,-0H,-NH2 и др.).
Результаты исследования агрегативной
устойчивости ПС и ПММА микросфер представлены в таблице 3.5.
Таблица 3.5 Агрегативная устойчивость микросфер.
|
NaCl
0,15 М
|
NaCl
0,075 М
|
Поливидон
|
Стабизол
|
Фруктоза
(10%р-р)
|
Сахароза
(2,6%р-р)
|
|
ПС
|
+
|
+
|
+
|
-
|
+
|
+
|
|
ПММА
|
-
|
+
|
+
|
-
|
+
|
+
|
Примечание: Знак «+» означает, что система была
агрегативно устойчива и коагуляция микросфер не наблюдалась. «-» - наблюдалась
коагуляция микросфер.
В связи с неустойчивостью суспензии ПММА
микросфер в физиологическом растворе, было решено использовать в качестве
физиологической среды изотонический раствор сахарозы (2,6% водный раствор сахарозы
в воде).
.2 Окрашивание микросфер флуоресцентным
красителем
По результатам патентного поиска была предложена
методика получения окрашенных флуоресцентным красителем полистирольных и
полиметилметакрилатных микросфер. В качестве исходного материала использовали
готовые суспензии полистирольных микросфер диаметром 6 мкм с карбоксильными
группами на поверхности. Окрашивание проводили флуоресцентным красителем
магдаловым красным.
В основе методики лежит принцип окрашивания
полимерных микросфер путем их набухания в растворителе, содержащем краситель
требуемой концентрации. Этот растворитель должен неограниченно смешиваться со
средой, в которой суспендированы микросферы. В качестве такого растворителя для
полистирольных микросфер был выбран ацетон, в котором растворяли магдаловый
красный.
Исследование интенсивности флуоресценции
окрашенных полистирольных и полиметилметакрилатных микросфер проводили при
помощи конфокального лазерного сканирующего микроскопа Nikon. Результаты
приведены в таблице 3.6.
Таблица 3.6 Величина, обратная интенсивности
флуоресценции (усиление на ФЭУ, у.е.) окрашенных ПС и ПММА микросфер.
|
Заключены
во фруктозу
|
Без
заключения
|
|
№
|
Суспензия
|
λ=488
нм
(зеленый)
|
λ=596
нм
(красный)
|
λ=488
нм
(зеленый)
|
λ=
596 нм
(красный)
|
|
1.
|
1-0,05
|
100
|
115
|
95
|
100
|
|
2.
|
1-0,1
|
105
|
110
|
90
|
100
|
|
3.
|
1-0,2
|
110
|
110
|
85
|
95
|
|
4.
|
2-0,05
|
110
|
110
|
105
|
105
|
|
5.
|
2-0,1
|
110
|
105
|
100
|
100
|
|
6.
|
2-0,2
|
105
|
110
|
100
|
105
|
Примечание: 1-ПММА микросферы; 2 - ПС
микросферы; 0,05; 0,1; 0,2 - концентрация красителя в суспензии микросфер, %
(об).
3.3 Просветление препаратов
Препараты просветлялись по методике основанной
на их плавном переводе через серию водных растворов фруктозы с восходящей
концентрацией. Эта методика была выбрана поскольку используемый в работе
краситель, магдаловый красный практически не растворим в воде.
Методика основана на пропитывании препаратов
фруктозой с показателем преломления 80% раствора n=1,49, который близок к
показателю преломления неокрашенных тканей.
Фотографии были выполнены на световом
микроскопе. Результаты просветления показаны на рисунке 3.5.
На микрофотографии 3.5 А представлен фрагмент
микрососудистого русла, заполненного микросферами диаметром 6 мкм, окрашенными
магдаловым красным. Четко видны микросферы и хорошо видно, что микрососуд (1)
имеет несколько ветвей (2,3,4), 2 из которых (2 и 4) находятся не в фокусе и
выглядят размытыми. Видно, что в сосуде (1) по диаметру расположены 3
микросферы диаметром 6 мкм, следовательно, диаметр сосуда 18 мкм. В сечении
сосуда может располагаться 9 микросфер диаметром 6 мкм. Ветвь (3) сосуда,
очевидно, имеет диаметр 6 мкм и заполнена не полностью, что говорит об
уменьшении диаметра сосуда, микросферы не смогли пройти дальше. Размытые линии
(5) на
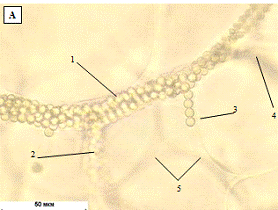
Рис. 3.5 Фотографии со светового микроскопа
образцов заполненных микросферами диаметром 6 мкм, увеличение х40 (А) и
микросферами диаметром 0,4 мкм, увеличение х10 (Б).
Видно, что полимерные микросферы плотно
заполнили сосудистое русло. Так же видно, что микросферы останавливаются в том
месте, где диаметр сосуда становится меньше диаметра микросфер и понятно, что
микросферы диаметром 6 мкм не могут заполнить капиллярное русло. Следовательно,
данный подход позволяет анализировать артериальную часть сосудистого русла. Как
говорилось выше, в строении артериального русла существуют «шунты», позволяющие
крови, минуя капилляры попадать в венозное русло, и диаметр которых сопоставим
с диаметром артерий. Поэтому не исключается возможность попадания микросфер диаметром
6 мкм в венозное русло. Однако, в тех участках, где мы проводили исследования,
вен, заполненных микросферами, обнаружено не было. Но это необходимо принимать
во внимание при дальнейших исследованиях.
На микрофотографии 3.5 Б представлен фрагмент
микрососудистого русла, заполненного микросферами диаметром 0,4 мкм,
окрашенными магдаловым красным. Четко виден сосуд диаметром около 30 мкм (1)
имеющий 2 ответвления (2 и 3). Хорошо видно, что сосуд заполнен окрашенными
микросферами, красный цвет. И вена (4) диаметром около 100 мкм, незаполненная
микросферами.
3.4 Исследование препаратов методом конфокальной
лазерной микроскопии. Создание трехмерной модели сосудов
Просветленные препараты, заполненные 0,4 мкм
полиметилметакрилатными и 6 мкм полистирольными микросферами, окрашенными
флуоресцентным красителем, магдаловым красным, исследовались на конфокальном
микроскопе Nikon Eclipse C1 plus.
На микрофотографии 3.6 А представлен фрагмент
микрососудистого русла, заполненного микросферами диаметром 6 мкм, окрашенными
магдаловым красным. Четко видны микросферы и видно, что микрососуд (1) имеет
диаметр 6 мкм, в сечении сосуда лежит одна микросфера.
На микрофотографии 3.6 Б представлен фрагмент
микрососудистого русла, заполненного микросферами диаметром 0,4 мкм, окрашенными
магдаловым красным. Виден раздваивающийся сосуд (1), диаметром около 6 мкм,
плотно заполненный микросферами. И вена (2), диаметром около 40 мкм,
заполненная микросферами лишь частично.
На микрофотографии 3.6 В видна артериола (1)
диаметром около 30 мкм, от которой вправо и влево отходят 4 ветви (2,3)
диаметром около 20 мкм. Ветви (2) и (3) делятся на капилляры со средним
диаметром 4 мкм. Интенсивность флуоресценции артериолы (1) в левом верхнем углу
фотографии меньше, чем по всей длине артериолы, что говорит о том, что эта
часть артериолы находится выше или ниже плоскости оптического среза (4).

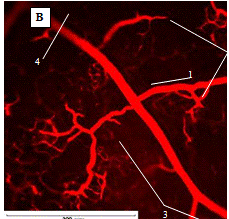
Рис. 3.6 А - капилляр, заполненный латексом 6
мкм, увеличение х40; Б - артерия и вена, заполненные латексом 0,4 мкм,
увеличение х40; В - разветвленный сосуд, латекс 0,4 мкм, увеличение х10.
Основным преимуществом исследования сосудов
методом конфокальной лазерной микроскопии является возможность построения 3-х
мерной модели, что дает возможность проанализировать плотность (количество)
сосудов в объеме препарата, а так же определить их пространственное положение.
На первом этапе была выполнена серия оптических
срезов (ОС) препарата, заполненного полиметилметакрилатными микросферами
диаметром 0,4 мкм. Оптические срезы были сделаны при увеличении 10х, и через
каждые 5 мкм по глубине препарата (от поверхности до основания). Исследуемый
препарат имел толщину 250 мкм.
На рисунке 3.7 показана серия оптических срезов,
сделанных на расстоянии 25 мкм друг от друга по глубине препарата.

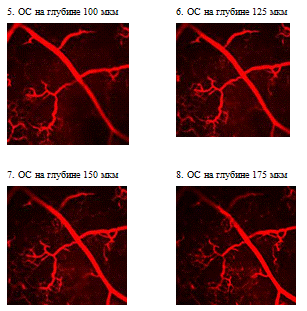

Рис. 3.7 Серия оптических срезов, сделанных на
расстоянии 25 мкм друг от друга по глубине препарата.
На втором этапе проводилась компьютерная
обработка изображений с помощью программы ImageJ, для решения следующих задач:
. Определение плотности (количества) сосудов в
объеме препарата.
. Построение 3-х мерной модели препарата.
Для определения плотности (количества) сосудов в
объеме препарата в программе ImageJ была сделана проекция всех ОС на основании
препарата. По схеме, приведенной на рис. 3.8. Из полученного изображения, рис.
3.9, возможно определить площадь сосудов в препарате. И, зная толщину
препарата, представляется возможным рассчитать количество сосудов в его объеме.
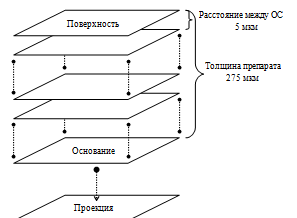
Рис. 3.8 Схема получения проекции всех
оптических срезов препарата.
Рис. 3.9 Проекция оптических срезов препарата,
на плоскость параллельную основанию препарата.
Глава 4. Охрана труда
.1 Введение
Создание безопасных, благоприятных условий
труда, проведение мероприятий по охране труда являются важным условием для
повышения эффективности научных исследований;
Под охраной труда понимают систему
законодательных и нормативных актов РФ, экономических, организационных,
технических, гигиенических и лечебно-профилактических мероприятий и средств,
обеспечивающих безопасность, сохранение здоровья и работоспособности человека в
процессе труда [60].
Предметом охраны труда является разработка и
внедрение способов и средств создания условий труда для работающего, полной
безопасности и безвредности при обеспечении максимальной производительности.
Цель охраны труда - исключить воздействие на
человека опасных и производственных факторов. В научных исследованиях вопросы
безопасности приобретают особое значение. В связи с этим разработка раздела
охраны труда дает возможность обеспечить благоприятные и безопасные условия
труда в процессе проведения исследования.
Цель разработки данного раздела - это
определение потенциально опасных и вредных факторов при выполнении
экспериментальных исследований, а также выбор средств защиты экспериментатора
при возможных неполадках и способов их устранения.
Работа выполнялась в отделении морфологии
НИИФХМ.
4.2 Пожароопасные свойства горючих веществ и
материалов и меры безопасности при работе с ними
Пожарная безопасность - это состояние
защищенности населения, объектов национальной экономики иного назначения, а
также окружающей природной среды от опасных факторов и воздействий пожаров
[61]. Из пожаровзрывоопасных веществ в работе использовался только ацетон
(диметилкетон). Справочные данные:
. Агрегатное состояние: жидкость
. Плотность пара по воздуху: 0,79 г/см3
. Температуры:
вспышки: -18 ºС
самовоспламенения: 535 ºС
воспламенения: 500 ºС
. Предел воспламенения:
концентрационный: 2,91 % (об.)
температурный: -18 ºС
. Средства пожаротушения: распыленная вода, все
виды пен.
В соответствии с документом «Определение
категорий помещений и зданий по взрывопожарной и пожарной опасности. НПБ
105-03», существуют следующие категории производственных помещений: А,Б,В1-В4,
Г и Д.
Лаборатория, в которой проводилась работа,
относится к категории В4.
Для отнесения лаборатории, в которой выполнялась
дипломная работа, к одной из категорий производственных помещений было
определено избыточное давление взрыва.
Избыточное давление взрыва ΔP
рассчитывалось
по формуле:
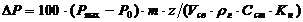 ,
,
где Рmax - максимальное давление взрыва
стехиометрической газовоздушной или паровоздушной смеси в замкнутом объеме,
кПа; допускается принимать Рmах = 900 кПа;
Р0 - начальное давление, соответствующее
атмосферному, кПа; для Москвы можно принять Р0 = 100 кПа; - масса паров
легковоспламеняющихся (ЛВЖ) и горючих жидкостей (ГЖ), вышедших в результате
расчетной аварии в помещение, соответствует массе жидкости, испарившейся с
поверхности разлива, кг; m=0,2 кг
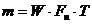
Интенсивность испарения W, кг/(с*м2) допускается
определять по формуле:
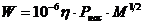 ,где
,где
η - коэффициент,
зависящий от температуры и скорости воздушного потока над поверхностью
испарения, при скорости воздушного потока 0,2 м/с и температуре в помещении 20ºС,
η
= 3,5
Pнас - давление насыщенного пара при расчетной
температуре жидкости, определяется по формуле:
Рнас = 7,06542 - 2123,057/(272,988+tвсп)Рнас =
7,06542 - 2123,057/(272,988-18)= -1,26
Рнас = 10-1,26 =0,06 кПа
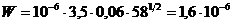 кг/(с*м2)
кг/(с*м2)
Fи - площадь испарения принимается из расчета
что 1 л вещества разливается на 1 м2 пола, Fи = 40 м2, и T - время испарения -
3600с
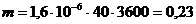 кг
кг
- коэффициент участия горючего во взрыве,
допускается принимать его значение по табл. п.1.2; z=0,3
ρг - плотность газа
или пара при расчетной температуре tp, кг/м3, вычисляемая по формуле:
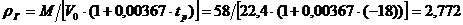 ,где
,где
М - молярная масса, кг/кмоль; V0 - мольный
объем, равный 22,4 м3/кмоль; tp - расчетная температура, ºС,
допускается принимать ее равной температуре вспышки;
ССТ - стехиометрическая концентрация паров ЛВЖ и
ГЖ, %(об.), вычисляемая по формуле:
ССТ = 100/ (1 + 4,84 β)
= 100/ (1 +4,84*2,6) = 7,36
β = nс + (nн- nх) / 4 -
nо/ 2 = 3+ (6-0) / 4 -0,5 = 2,6, где
β - стехиометрический
коэффициент кислорода в реакции сгорания; nс, nн, nх, nо - число атомов
углерода, водорода, галоидов и кислорода в молекуле горючего; КН - коэффициент,
учитывающий негерметичность помещения и неадиабатичность процесса горения;
допускается принимать КН = 3.
Избыточное давление взрыва:
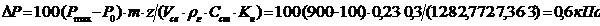
Так как, рассчитанное ΔP
<5 кПа,
то лаборатория относится к категории В1-В4,
Производили уточняющий расчет.
Определение пожароопасной категории помещения
осуществляется путем сравнения рассчитанного значения удельной пожарной
нагрузки (далее по тексту - пожарная нагрузка) с величиной удельной пожарной
нагрузки, приведенной в табл. 4.1.
Данные для определения помещений категории «В»
Таблица 4.1 Величина пожарной нагрузки.
|
Категории
|
Удельная
пожарная нагрузка q на участке, МДж/м2
|
|
В1
|
более
2200
|
|
В2
|
1401
- 2200
|
|
В3
|
181
- 1400
|
|
В4
|
1-180
|
Пожарная нагрузка Q (МДж) определялась из
соотношения:
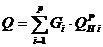 ,где
,где
- количество i-ro материала пожарной нагрузки,
кг; QPн i - низшая теплота сгорания i-ro материала пожарной нагрузки, МДж/кг.
Определение теплоты сгорания ацетона.
Низшая теплота может быть определена по
следующему уравнению:
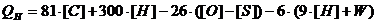 ,где
,где
[C],[H],[O],[S] и W - содержание в горючем
веществе углерода, водорода, кислорода, горючей серы и влаги, %.
[C]=30%; [H]=60% и [O]=10%, тогда

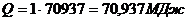
Удельная пожарная нагрузка g (МДж/м2)
определяется из соотношения:
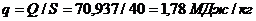
Сравнивая рассчитанное значение q с табличным,
можно сделать вывод, что наша лаборатория относится к категории В4.
Мероприятия по пожарной безопасности
подразделяются на две основные группы - предупреждение пожаров и ликвидация уже
возникших пожаров. Особое внимание уделяется пожарной профилактике.
Пожарная профилактика - это сумма мероприятий,
направленных на предупреждение пожара, предотвращение распространения огня и
создание условий, способствующих быстрой ликвидации начавшегося пожара.
Для ликвидации пожара применяют различные
вещества, которые выбрасываются на огонь с помощью специальных аппаратов и
приборов. Прежде всего, это вода, химическая и воздушно-механическая пена,
водяной пар. Иногда горящую поверхность засыпают песком, минеральными порошками
или покрывают специальными асбестовыми одеялами.
В лаборатории, в которой выполнялась работа,
установлены 3 огнетушителя ОП-3.
4.3 Характеристика токсичных веществ и меры
безопасности
При работе в лаборатории единственным
используемым токсичным веществом являлся ацетон. Токсикологическая
характеристика ацетона [62]:
. Характер воздействия на организм: при вдыхании
паров и приема внутрь: состояние опьянения, головная боль, общая слабость,
царапанье горла, тошнота, слезотечение.
. Меры и средства первой помощи: При попадании в
глаза - срочно промыть широко раскрытый глаз. При случайном приеме внутрь:
обильное промывание желудка. Защитные маски из прозрачных полимерных
материалов.
. ПДК: 200 мг/м3
. Класс опасности: IV
.4 Вопросы электробезопасности в соответствии с
"Правилами устройства электроустановок" (ПУЭ)
Помещение лаборатории по опасности поражения
электрическим током относится к помещениям без повышенной опасности (класс I),
то есть высокая влажность, высокие температуры, токопроводимые полы,
токопроводящая пыль отсутствует. При проведении работ нами использованы приборы
с напряжением 220 В. Все эти приборы представляют собой потенциальную опасность
- поражение человека электрическим током, поэтому при работе с ними нами
контролировались:
исправность изоляции электропроводов, вилок и
др.;
соответствие действительного напряжения в сети
номинальному напряжению для данного прибора.
4.5 Анализ потенциальных опасностей и вредностей
при выполнении экспериментальных исследований
Был произведен анализ потенциальных опасностей и
вредностей при выполнении исследования, который представлен в таблице 4.2.
Таблица 4.2 Анализ потенциальных опасностей и
вредностей при выполнении исследования.
|
Наименование
технологической операции
|
Оборудование,
на котором осуществлялась технологическая операция
|
Реактивы,
используемые при проведении операции
|
Выявленные
опасности и вредности
|
Меры,
обеспечившие безопасное проведение технологической операции
|
|
Определение
размера микросфер
|
Сканирующий
электронный микроскоп, диодный спуттер
|
-
|
Поражение
электротоком
|
-
|
|
Перевод
сухих микросфер в суспензию
|
Автоматическая
пипетка, встряхиватель, эпиндорфы 500/1000 мкл
|
Дистиллированная
вода
|
нет
|
-
|
|
Отмывка
суспензии микросфер
|
Автоматическая
пипетка, встряхиватель, эпиндорфы 500/1000 мкл, центрифуга
|
Дистиллированная
вода
|
нет
|
-
|
|
Окрашивание
микросфер
|
Автоматическая
пипетка, встряхиватель, пробирки пластиковые 2,5/5 мл
|
Ацетон
или 30% раствор ацетона в воде, магдаловый красный (флуорофор).
|
Действие
паров ацетона, попадание брызг и аэрозолей на открытые участки тела
|
Проведение
операции в вытяжном шкафу
|
|
Отмывка
окрашенных микросфер
|
Автоматическая
пипетка, встряхиватель, пробирки пластиковые 2,5/5 мл, центрифуга
|
Дистиллированная
вода
|
нет
|
-
|
|
Перфузия
суспензии микросфер в сосудистое русло животного
|
Перфузионная
установка, автоматическая пипетка, встряхиватель, пробирки пластиковые 2,5/5
мл
|
Растворы
фруктозы и сахарозы
|
нет
|
-
|
|
Просветление
препаратов
|
Кассеты
для препаратов, стаканы химические 500 мл
|
Формальдегид,
растворы фруктозы
|
нет
|
-
|
|
Оценка
заполнения сосудистого русла суспензией
|
Световой
микроскоп
|
-
|
нет
|
-
|
|
Исследование
сосудистого русла в препаратах
|
Люминесцентный
конфокальный лазерный микроскоп
|
-
|
нет
|
-
|
Из приведенной таблицы видно, что проведение
работы безопасно для человека. За исключением этапа окрашивания микросфер, на
котором используется токсичный реагент - ацетон.
Для нормальной работы в лаборатории
поддерживаются определенные необходимые санитарные нормы. Полы в лаборатории и
поверхности рабочих столов покрыты линолеумом. Для обеспечения необходимого
микроклимата лаборатория оборудована приточно-вытяжной вентиляцией,
обеспечивающей кратность рециркуляции воздуха 5 объемов в час.
В соответствии с СанПиН 2.2.4.548-96
«Гигиенические требования к микроклимату производственных помещений» категория
работ в данном помещении относится к категории Iа. К категории Iа относятся
работы с интенсивностью энергозатрат до 120 ккал/ч (до 139 Вт), производимые
сидя и сопровождающиеся незначительным физическим напряжением (например, ряд
профессий на предприятиях точного приборо- и машиностроения, на часовом,
швейном производствах, в сфере управления и т.п.).
Таблица 4.3 Оптимальные нормы микроклимата в
рабочей зоне производственных помещений.
|
Период
года
|
Категория
работ по уровню энергозатрат, Вт
|
Температура,
˚С
|
Относительная
влажность, %
|
Скорость
движения воздуха, м /с
|
|
|
по
СанПиН 2.2.4.548-96
|
в
помещении
|
по
СанПиН 2.2.4.548-96
|
в
помещении
|
по
СанПиН 2.2.4.548-96
|
в
помещении
|
|
Холодный
|
Iа
(120-139)
|
22-24
|
24
|
60-40
|
45
|
0,1
|
0,1
|
|
Теплый
|
Iа
(120-139)
|
23-25
|
25
|
60-40
|
45
|
0,1
|
0,1
|
Таблица 4.4 Допустимые нормы микроклимата в
рабочей зоне производственных помещений
|
Период
года
|
Категория
работ по уровню энергозатрат, Вт
|
Температура,
˚С
|
Относительная
влажность, %
|
Скорость
движения воздуха, м /с
|
|
|
по
СанПиН 2.2.4.548-96
|
в
помещении
|
по
СанПиН 2.2.4.548-96
|
в
помещении
|
по
СанПиН 2.2.4.548-96
|
в
помещении
|
|
Холодный
|
Iа
(120-139)
|
20-25
|
21-23
|
40-60
|
44-46
|
0,1
|
0,1
|
|
Теплый
|
Iа
(120-139)
|
21-28
|
22-25
|
40-60
|
44-46
|
0,1
|
0,1
|
ТНС-индекс не рассчитывается.
Эти условия поддерживаются за счет отопления
горячей водой и притяжной вентиляции (с кратностью воздухообмена 5) и
соответствуют допустимым условиям по СанПиН.
.7 Освещение
При проведении работ необходимо различать
предметы размером 0,5-1 мм. Освещение в лаборатории комбинированное.
Естественная освещенность создается за счет оконных проемов, искусственная -
люминесцентными лампами, которые должны обеспечивать освещенность не менее 150
Лк. Нормы освещенности рабочих зон представлены в таблице
Таблица 4.5 Коэффициенты использования светового
потока
|
Индекс
помещения i
|
коэффициент
отражения потолка ρп, %
|
|
70
|
50
|
30
|
|
коэффициент
отражения стен ρс, %
|
|
50
|
30
|
10
|
|
коэффициент
использования η,
%
|
|
0,5
|
25
|
23
|
22
|
|
1,0
|
43
|
40
|
37
|
|
1,5
|
50
|
46
|
44
|
|
2,0
|
54
|
50
|
48
|
Расчет освещения по методу коэффициента
использования светового потока.
Для расчета освещенности помещения Е (лк)
использовали выражение:
E = Fnη /SКz,
где F - световой поток одной лампы, лм;
определяется в зависимости от напряжения питания и мощности ламп (для
люминесцентных ламп дневного света ЛД-80 световой поток одной лампы F=2340 лм;-
площадь пола помещения, м2 (S=40 м2);- коэффициент запаса освещенности,
учитывающий падение напряжения в электрической сети, изношенность и
загрязненность ламп, светильников, стен помещения и т. д.; принимается равным
1,5- поправочный коэффициент светильника, учитывающий неравномерность
освещения, имеющий значения z = 0,8 ÷ 0,9 - для
ламп накаливания (приняли z = 0,8);- количество ламп в помещении (n=10);
η - коэффициент
использования светового потока, доли единицы; для различных типов светильников
в зависимости от ρс и ρп
и индекса помещения i определяют по табл. 4.7.1.
ρс и ρп
- коэффициенты отражения стен и потолка, %; ρс=30%,
ρп
=50%.В лаборатории используются светильники типа ЛСП 01с.
Индекс помещения рассчитывался по формуле:
= А В / [Нр (А + В)],
где А и В - длина и ширина помещения, м (А=8 м,
В=5 м);
Нр - высота подвеса светильника над рабочей
поверхностью (расстояние от светильника до рабочей поверхности), м (Нр =3,0).
= 5·8 / [3(5 + 8)] =1,02.
Таким образом, η=0,4
В соответствии с заданными характеристиками
освещения искусственная освещенность в помещении лаборатории:
= 2340 · 10 · 0,4 / 40 · 1,5 · 0,8 , (лк)= 195
лк.
Помещение лаборатории соответствует классу III
г.
.8 Заключение
В данном разделе были рассмотрены:
. Оценена пожароопасность веществ и токсичность.
. По ПУЗ определена категория взрыво- и
пожароопасности помещения.
. Проанализированы потенциально опасные операции
при проведении исследований и указаны меры предосторожности при работе с ними.
. Определены санитарно-гигиенические условия в
лаборатории - микроклимат рабочей зоны.
. Проведен расчет освещения, а также осуществлен
расчет количества ламп для осуществления норм безопасности.
Глава 5. Экологическая безопасность
Загрязнение окружающей среды, воздушного
бассейна и океанов, истощение природных ресурсов приобрело вследствие развития
научно-технического прогресса, колоссальные масштабы. Одна из важнейших проблем
охраны окружающей среды - защита воздушного бассейна. В соответствии с
требованиями, содержание вредных примесей в атмосферном воздухе не должно
вызывать патологические реакции в организме человека или приводить к заметным
воздействиям на флору и фауну.
Химическая лаборатория относится к числу
источников загрязнения воздуха и канализационной сети. В связи с этим
предусмотрен ряд мер и правил работы с химическими веществами, которые
способствуют снижению количества вредных отходов.
В данной экспериментальной работе использовались
вещества не представляющие существенной угрозы для окружающей среды.
В процессе эмульсионной полимеризации
использовался кремнийорганический ПАВ, нерастворимый в воде. Все отходы,
образующиеся при проведении экспериментов, относятся к классу малоопасных
веществ, выбросы опасных веществ в окружающую среду отсутствовали. Степень
времени воздействия на окружающую среду полученных отходов низкая. Утилизация
отходов, возникающих при проведении экспериментов, производилась вместе с
обычными бытовыми отходами.
Глава 6. Экономическая часть
Расчет затрат на проведение эксперимента
.1 Расчет затрат на сырье и материалы
Расчет затрат на сырье и материалы, используемые
в экспериментальной работе представлен в таблице 6.1.
Таблица 6.1 Затраты на сырье и материалы.
|
№
|
Наименование
материала
|
Фасовка
|
Цена
|
Использованное
количество
|
Сумма
|
|
|
|
руб.
|
$
|
|
руб.
|
$
|
|
1.
|
Суспензия
микросфер ПС с с.о. 5% (масс.)
|
10мл
|
400
|
13,8
|
40мл
|
1600
|
55,2
|
|
2.
|
Суспензия
микросфер ПММА с с.о. 5% (масс.)
|
10мл
|
450
|
15,5
|
20мл
|
900
|
31
|
|
3.
|
Ацетон
|
1л
|
65
|
2,3
|
1л
|
65
|
2,2
|
|
4.
|
Магдаловый
красный
|
25г
|
841
|
29
|
20г
|
673
|
23,2
|
|
5.
|
Динатриевая
соль флуоресцеина
|
25г
|
696
|
24
|
10г
|
279
|
9,7
|
|
6.
|
Фруктоза
|
500г
|
94
|
3,3
|
1кг
|
188
|
6,5
|
|
7.
|
Сахароза
|
1кг
|
62
|
2,2
|
1кг
|
62
|
2,2
|
|
8.
|
Эпиндорфы
500 мкл
|
500
|
1160
|
40
|
100
|
232
|
8
|
|
9.
|
Эпиндорфы
1000 мкл
|
500
|
1450
|
50
|
150
|
435
|
15
|
|
10.
|
Пробирки
пластиковые 5 мл
|
250
|
435
|
15
|
20
|
34,8
|
1,2
|
|
11.
|
Наконечники
для пипеток
|
1000шт
|
690
|
23,8
|
600
|
414
|
14,3
|
|
Итого:
|
4882,8
|
168,4
|
Примечание: 1$ = 29 руб.
Транспортно-заготовительные расходы составляют
10% от суммы затрат на сырье материалы и реактивы:

Всего затрат на материалы:
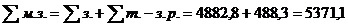
.2 Определение энергетических затрат на
проведение исследования
Расчет затрат на электроэнергию определяется по
формуле:
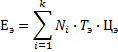
где: Ni - мощность электроприборов по паспорту;
Тэ - время использования электроприбора, ч; Цэ - цена одного кВт/ч.
Расходы на электроэнергию сведены в таблицу 6.2.
Цена 1 кВт/ч = 1,66 руб.
Таблица 6.2 Затраты на электроэнергию.
|
Наименование
|
Использование
|
Мощн.
эл.пр., кВт
|
Время
исп., ч
|
Кол-во
израсх. эн.,кВт/ч
|
Сумма
|
|
|
|
|
|
руб.
|
|
Весы
аналитические
|
Взвешивание
веществ
|
0,015
|
20
|
0,3
|
1,7
|
|
Центрифуга
|
Осаждение
суспензий
|
0,35
|
50
|
17,5
|
29
|
|
У/з
излучатель
|
Разбивание
агрегированных суспензий
|
0,3
|
10
|
3
|
5
|
|
Диодный
спуттер
|
Нанесение
пленки металла на пов-ть образцов для СЭМ
|
1,5
|
3
|
4,5
|
7,5
|
|
Сканирующий
электронный микроскоп
|
Определение
размеров микросфер
|
3,5
|
5
|
17,5
|
29
|
|
Конфокальный
лазерный сканирующий микроскоп
|
Получение
3-х мерных изображений
|
2,5
|
5
|
12,5
|
20,8
|
|
Встряхиватель
Vortex
|
Встряхивание
суспензий
|
0,3
|
100
|
30
|
49,8
|
|
Итого:
|
142,8
|
6.3 Затраты на воду для технологических целей
Затраты на воду, использованную в ходе
выполнения экспериментов представлены в таблице 6.3.
Таблица 6.3 Затраты на воду.
|
Наименование
ресурса
|
Израсходованное
количество, м3
|
Цена,
руб/м3
|
Сумма
|
|
|
|
руб.
|
|
Вода
дистиллированная
|
0,1
|
68
|
6,8
|
|
Вода
холодная
|
0,6
|
5,70
|
3,42
|
|
Водоотвод
|
0,7
|
5,50
|
3,85
|
|
Итого:
|
14
|
6.4 Расчет затрат на стеклянную посуду
Используемая посуда и ее стоимость указана в
таблице 6.4.
Таблица 6.4 Затраты на посуду.
|
Наименование
|
Количество
штук
|
Цена,
руб/ед
|
Сумма,
руб
|
|
Стакан
химический 50 мл
|
2
|
29
|
58
|
|
Стакан
химический 600 мл
|
1
|
95
|
95
|
|
Бутыль
стеклянная, 250 мл
|
6
|
210
|
1260
|
|
Итого:
|
1413
|
6.5 Расчет амортизации установок, приборов и
оборудования
Амортизация - исчисленный в денежном выражении
износ основных средств в процессе их применения, производственного
использования. Амортизация есть одновременно средство, способ, процесс
перенесения стоимости изношенных средств труда на произведенный с их помощью
продукт.
Стоимость оборудования и расчет амортизации
представлен в таблице 6.5
Затраты определяются в виде амортизации по
формуле:
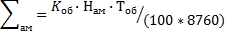
где: Коб - стоимость прибора; Нам - норма
амортизации (составляет 10% от его стоимости); Тоб - время работы на приборе за
период исследования.
Таблица 6.5 Амортизация оборудования.
|
Наименование
|
Стоимость
прибора, руб
|
Время
работы на приборе, ч
|
Норма
амортизации, %
|
Сумма
амортизации, руб
|
|
|
Весы
аналитические
|
35200
|
20
|
10
|
8
|
|
|
Центрифуга
|
36200
|
50
|
|
20,5
|
|
|
У/з
излучатель
|
10
|
|
4,6
|
|
|
Диодный
спуттер
|
120000
|
3
|
|
4,1
|
|
|
Сканирующий
электронный микроскоп
|
2500000
|
5
|
|
142,7
|
|
|
Конфокальный
лазерный сканирующий микроскоп
|
1500000
|
5
|
|
86
|
|
|
Встряхиватель
Vortex
|
4900
|
100
|
|
6
|
|
|
Одноканальные
пипетки
|
4500
|
90
|
|
4,6
|
|
|
Итого:
|
|
276,5
|
|
|
|
|
|
|
|
|
6.6 Расчет затрат на заработную плату
Заработная плата исполнителей работы
рассчитывается, исходя из стипендии студента (1 100 руб.).
Заработная плата руководителя дипломной работы и
консультантов определяется из должностного оклада и времени руководства (23
часа руководителю от института, 2 часа консультанту по экономике, и 1 час - по
охране туда).
Начисления на заработную плату составляют 26,2%.
Таблица 6.6 Заработная плата.
|
Категория
работника
|
Часовая
ставка, оклад, руб.
|
Отработанное
время, ч
|
Сумма,
руб.
|
|
|
Руководитель
экспериментальных работ от МИТХТ
|
90
|
10
|
900
|
|
|
Руководитель
экспериментальных работ от НИИФХМ
|
90
|
13
|
1080
|
|
|
Консультант
по экономической части
|
60
|
2
|
120
|
|
|
Консультант
по охране труда
|
60
|
1
|
60
|
|
|
Студент-дипломник
|
1100*
|
5**
|
5500
|
|
|
Итого
заработная плата:
|
7660
|
|
|
Начисления
на заработную плату (26,2 %)
|
2007
|
|
|
Итого
заработная плата с начислениями:
|
9667
|
|
|
*сумма
стипендии за месяц **количество месяцев
|
6.7 Накладные расходы
Накладные расходы составляют 100% от заработной
платы без единого социального налога.
В=7660*100%=7660руб.
6.8 Суммарные затраты
Расчет суммарных затрат на выполнение
исследования представлены в таблице 6.7.
Таблица 6.7 Суммарные затраты
|
Наименование
затрат
|
Сумма,
руб
|
Доля
в общих затратах,%
|
|
Затраты
на заработную плату с начислениями на социальное страхование
|
9667
|
39,1
|
|
Затраты
на сырье материалы и реактивы
|
4882,8
|
19,7
|
|
Затраты
на стеклянную посуду
|
1413
|
5,7
|
|
Транспортно-заготовительные
затраты
|
488,3
|
1,9
|
|
Энергетические
затраты
|
142,8
|
0,6
|
|
Затраты
на воду
|
14
|
0,1
|
|
Амортизационные
отчисления
|
472,3
|
1,9
|
|
Накладные
расходы
|
7660
|
31
|
|
Итого:
|
24740,2
|
100
|
Глава 7. Выводы
. Отработана методика синтеза
полиметилметакрилатных микросфер диаметром 0,4 мкм и полистирольных микросфер
диаметром 6 мкм.
. Отработана методика окраски
полиметилметакрилатных и полистирольных микросфер флуоресцентным красителем
(магдаловым красным).
. Показано, что заполнение сосудистого русла
суспензией полиметилметакрилатных микросфер (с.о. 5%), окрашенных
люминесцентным красителем, позволяет увидеть с помощью конфокальной микроскопии
архитектуру сосудистого русла, которая включает в себя артериальную, венозную и
капиллярную части.
. Показано, что заполнение сосудистого русла
суспензией полистирольных микросфер (с.о. 5%), окрашенных люминесцентным
красителем, позволяет увидеть с помощью конфокальной микроскопии архитектуру
только артериального русла.
Список литературы
В.
Прозоровский. Кровеносные сосуды и рак. // Наука и жизнь № 9, 2006.
Ole
Goertz et al. Burn model for in vivo investigations of microcirculatory
changes.// Open access journal of plastic surgery. 3, 2009. Higuchi et al. Gut
hyperpermiability after ischemia and reperfusion: attenuation with
adrenomedullin and its binding protein treatment. // International Journal of
Clinica and Experimental Pathology. 2008; 1(5): 409-418. A. Akova. Роль
флуоресцентной
ангиографии.
// EuroTimes January 2008.. Zacharakis, H. Kambara, H. Shih, J. Ripoll, J.
Grimm, Y. Saeki, R. Weissleder, V. Ntziachristos Volumetric tomography of
fluorescent proteins through small animals in vivo // PNAS.- 2005.- V. 102.- N.
51.- P.18252-18257. . Cai, A. R. Hsu, Z. Li, X. Chen Are quantum dots ready for
in vivo imaging in human subjects? // Nanoscale Res Lett (2007) 2:265-281. B.,
Fisher G., Waggoner A., et al. Tumor labeling in vivo using cyanine-conjugated
monoclonal antibodies // Cancer Immunology. Immunother. 1995. 41 (4) 257-263.
М.В.
Ширманова,
М.А.
Сироткина,
М.С.
Клешнин,
И.В.
Балалаева,
Е.В.
Загайнова.
Прижизненная
флуоресцентная визуализация экспериментальных опухолей. // Нижегородская
государственная медицинская академия, проект № 02.522.11.2002.
X.
Gao, Y.Cui, R. M. Levenson, et. al. In vivo cancer targeting and imaging with
semiconductor quantum dots // Nature Biotechnology.- 2004. D., Petroll M.,
Alizadeh H., et al. Clinical and diagnostic use of in vivo confocal microscopy
in patients with corneal disease. Ophthalmology. Vol.100, N10, 1993, pp 1444
1453. 510 and LSM 510 META. Laser Scanning Microscopes. Operating Manual.
Release 3.2.
Введение
в
клеточную
биологию:
Учебник
для
вузов.
- 4-е
изд.,
перераб.
и
доп.
/ Ю.С.
Ченцов.
- М.:
ИКЦ
«Академкнига»,
2004. - 495 с.: ил.
S., Inoue T. Direct-view high-speed confocal scanner: the CSU-10 // Methods in
Cell Biology. - 2002. - Vol.70. - P.87-127. speed 1-frame/ms scanning confocal
microscope with a microlens and Nipkow disks"/ T. Tanaami, S. Otsuki, N.
Tomosada, Y. Kosugi, M. Shimizu, H. Ishida // Applied Optics. - 2002. - Vol.41.
- P.4704-4708. A. Spinning-disk confocal microscopy - a cutting-edge tool for
imaging of membrane traffic //Cell. Struct. Funct. - 2002. - Vol.27, №5. -
P.349-55. low-light microscopy with back-illuminated electron multiplying
charge-coupled device: enhanced sensitivity, speed, and resolution / Coates
C.G., Denvir D.J., McHale N.G., Thornbury K.D., Hollywood M.A. // J. Biomed.
Opt. - 2004. - Vol., 9, №6. - P.1244-1252.. Chan et al., Curr. Opin. Biotechnol.
13, 40 (2002).. Denk, J. H. Strickler, W. W. Webb, Science 248, 73 (1990).. M.
Williams, W. R. Zipfel, W. W. Webb, Curr. Opin. Chem. Biol. 5, 603 (2001).. C.
W. Chan, S. Nie, Science 281, 2016 (1998).. Mattoussi et al., J. Am. Chem. Soc.
122, 12142 (2000).. Gerion et al., J. Phys. Chem. B 105, 8861 (2001).. Bruchez,
M. Moronne, P. Gin, S. Weiss, P. A. Alivisatos, Science 281, 2013 (1998)..
Dubertret et al., Science 298, 1759 (2002).. Y. Wu et al., Nature Biotechnol.
21, 41 (2003).. J. Yoder, D. Kleinfeld, Microsc. Res. Technique 56, 304
(2002)., C. B.; Norris, D. J.; Bawendi, M. G. J. Am. Chem. Soc. 1993, 115,
8706., B. O.; Rodriguez-Viejo, J.; Mikulec, F. V.; Heine, J. R.; Mattoussi, H.;
Ober, R.; Jensen K. F.; Bawendi M. G. J. Phys. Chem. B 1997, 101, 9463., M. A.;
Guyot-Sionnest, Ph. J. Phys. Chem. 1996, 100, 468., X.; Schlamp, M. C.;
Kadavanich, A. V.; Alivisatos, A. P. J. Am. Chem. Soc. 1997, 119, 7019..
Roederer et al., Cytometry 29, 328 (1997).. Schro¬ck et al., Science 273, 494
(1996).. P. Alivisatos, J. Phys. Chem. 100, 13226 (1996).. Miltenyi, W. Muller,
W. Weichel, A. Radbruch, Cytometry 11, 231 (1990).. M. Lackie, Histochem. Cell
Biol. 106, 9 (1996).. B. Murray, D. J. Norris, M. G. Bawendi, ibid. 115, 8706
(1993).. Waggoner, Methods Enzymol. 246, 362 (1995).. G. Peng, J. Wickham, A.
P. Alivisatos, ibid. 120, 5343 (1998).. A. Guzelian et al., ibid. 100, 7212
(1996).. M. Lizmarzan, M. Giersig, P. Mulvaney, Langmuir 12, 4329 (1996)..-B.
Wu et al. Fluorescent polystyrene microspheres with large Stokes shift /
Journal of Physics and Chemistry of Solids 69 (2008) 76-82.E. Johnson,
Macromolecules 13 (1980) 145-152.. Sivakumar, K.P. Rao, React. Funct. Polym. 46
(2000) 29-37..T. Birnbaum, J.D. Kosmala, D.B. Henthorn, L. Brannon-Peppas, J.
Controlled Release 65 (2000) 375-387..J. Paine, J. Polym. Sci. Part A 28 (1990)
2485-2490.. Tuncel, R. Kahraman, J. Appl. Poly. Sci. 50 (1993) 303-307..T.
Braunholtz, F.G. Mann, J. Chem. Soc. (1952) 3046-3051..I. Ittyeeah, F.G. Mann,
J. Chem. Soc. (1956) 3179-3183..R. Lakowicz, Principles of Fluorescence
Spectroscopy, Plenum Press, New York, 1999, pp. 425-442.. Imhoff, M. Megens,
J.J. Engelberts, D.T.N. de Lange, R. Sprik, W.L. Vos, J. Phys. Chem. B 103
(1999) 1408-1415..K.J. Kinnunen, A.-P. Tulkki, H. Lemmetyinen, J. Paakkola,
J.A. Virtanen, Chem. Phys. Lett. 136 (1987) 539-545..Z. Chen, Z.Q. Huang, Z.Z.
Zheng, Fluoroimmunoassay, Science Press, Beijing, 1990, pp. 64-81..J. Kelly,
J.R. Ewen, S.L. Bernard, R.W. Glenny, C.H. Barlow, Rev. Sci. Instrum. 71 (2000)
228-234..F.M. Van Oosterhout, H.M.M. Willigers, R.S. Reneman, F.W. Prinzen, Am.
J. Physiol. 269 (1995) H725-H733.. Wang, C.Y. Yang, W.H. Tan, Nano Lett. 5
(2005) 37-43..S. Pat. No. 5,952,131 to Kumaceheva et.al..S. Pat. No. 5,267,235
to Rembaum et.al..S. Pat. No. 5,073,498 to Schwartz et.al..S. Pat. No.
6,472,131 to Zlhiag et.al.
И.А.
Роздин, Е.И. Хабарова, О.Н. Вареник. Безопасность производства и труда на
химических предприятиях / - М.: Химия, КолосС, 2005. -
254 с.
А.Н.
Баратов, А.Я. Корольченко, Г.Н. Кравчук и др. Пожаровзрывоопасность веществ и
материалов и средства их тушения: Справ. изд.: в 2 книгах - М.: Химия, 1990.
Под
редакцией Н.В.Лазарева и Э.М.Левиной. Вредные вещества в промышленности. 7-е
изд. Л.: Химия, т.1, 590с.; т.2, 624с:, под ред.Н.В.Лазарева, И.Д.Гадискиной.
Л., Химия, 1977, т.3, 608с.