Покисление оксида азота в производстве азотной кислоты
Московский
Государственный Университет
Инженерной
Экологии
Курсовой
проект
По
дисциплине: «Основы химической технологии»
по
теме: «Окисление оксида азота в производстве азотной кислоты»
Москва 2001
Содержание
Введение
.
Технологическая схема процесса
.
Составление материального баланса потоков в аппаратах
.1
Вход в контактный аппарат
.2
Вход в котел-утилизатор
.3
Вход в окислитель
.4
Выход из окислителя
.
Определение температуры газа на выходе из окислителя
.
Определение объема окислителя
Вывод
Литература
Введение
Азотная кислота является одним из важнейших
продуктов многотоннажных продуктов химической промышленности. Она занимает
второе место по объему производства после серной кислоты. Азотная кислота
широко применяется для производства многих продуктов, используемых в
промышленности и сельском хозяйстве. В частности, азотная кислота используется
для производства удобрений, синтетических красителей, взрывчатых веществ,
нитролаков, пластических масс, лекарственных синтетических веществ и других
важнейших продуктов.
Процесс производства разбавленной азотной
кислоты складывается из трех стадий:
Конверсии аммиака с целью получения оксида азота
NH3 + 5O2 = 4NO + 6H2O
Окисление оксида азота до диоксида азота
NO + O2 = 2NO2
Абсорбция оксида азота водой
NO2 + O2 + 2H2O = 4HNO3
Суммарная реакция производства азотной кислоты:
+ 2O2 = HNO3 + H2O
В моей работе идет расчет параметров для второй
стадии производства азотной кислоты - окисление оксида азота (II).
Нитрозные газы, полученные при окислении
аммиака, содержат оксид азота (II), азот, кислород и пары воды. При переработке
нитрозных газов в азотную кислоту необходимо окислить оксид азота (II) до
диоксида. Реакция окисления обратима, протекает с уменьшением объема и
сопровождается выделением теплоты. Следовательно, в соответствии с принципом Ле
Шателье снижение температуры и повышение давления способствуют смещения
равновесия реакции в сторону образования NO2. При температурах до 1000С
равновесие реакции практически полностью сдвинуто в сторону образования NO2.
При более высокой температуре равновесие смещается в левую сторону и при
температуре выше 7000С образования диоксида азота практически не происходит. В
связи с этим в горячих нитрозных газах, выходящих из контактного аппарата, NO2
отсутствует, и для его получения газовую смесь необходимо охладить её ниже
температуры 1000С.
Окисление оксида азота (II) - самая медленная
стадия производства азотной кислоты. Скорость реакции сильно зависит от
концентрации реагентов, давления и температуры. Применение в производстве
азотной кислоты воздуха, обогащенного кислородом, или чистого кислорода
позволяет получать нитрозные газы с повышенным содержанием оксида азота (II) и
увеличить скорость реакции окисления. Реакция окисления ускоряется также при
понижении температуры, а с повышением температуры замедляется почти до полного
прекращения.
Неуклонный рост производства азотной кислоты
тесно связан с увеличением объема отходящих газов, а, следовательно, с
увеличением количества выбрасываемых в атмосферу оксидов азота. Оксиды азота
опасны для любых живых организмов. Некоторые растения повреждаются уже через
один час пребывания в атмосфере, содержащей 1 мг оксидов в 1 м3 воздуха. Оксиды
азота вызывают раздражение слизистой оболочки дыхательных путей, ухудшение
снабжения тканей кислородом и другие нежелательные последствия.
Хвостовые газы производства азотной кислоты
содержат после абсорбционных колонн от 0.05 до 0.2% оксидов азота, которые по
санитарным требованиям без дополнительной очистки запрещено выбрасывать в
атмосферу.
Решением проблемы очистки хвостовых газов -
каталитическое восстановление оксидов азота горючими газами - водородом,
природным газом, оксидом углерода, аммиаком. Условие проведения процесса и тип
используемого катализатора определяется видом применяемого газа. Восстановление
оксидов азота снижает их содержание в очищенном газе до 0.001-0.005%, что
обеспечивает санитарные нормы по содержанию оксидов азота в приземном слое
воздуха при мощностях производства кислоты до 1 млн. тонн в год,
сосредоточенных в одной точке, и при высоте выброса 100-150 м.
1. Технологическая схема процесса
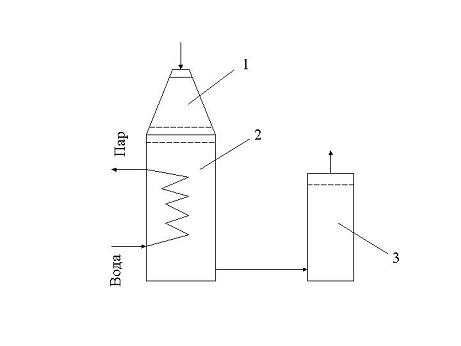
Рис. 1 - 1 - Контактный аппарат; 2 -
Котел-утилизатор; 3 - Окислитель
В контактный аппарат (1) подается аммиачно-воздушная
смесь на конверсию. Конверсия аммиака протекает на платинородиевых сетках при
температуре 870-9000С, причем степень конверсии составляет 96%. Нитрозные газы
при температуре 890-9100С поступают в котел-утилизатор (2), расположенный под
контактным аппаратом. В котле за счет охлаждения газов до 1700С происходит
испарение химически очищенной деаэрированной воды, питающей котел-утилизатор;
при этом получают пар с давлением 1,5 Мпа и температурой 2300С, который
выдается потребителю.
После котла утилизатора нитрозные газы поступают
в окислитель нитрозных газов (3). Он представляет собой полый аппарат, в
верхней части которого установлен фильтр из стекловолокна для улавливания
платинового катализатора. Частичное окисление нитрозных газов происходит уже в
котле-утилизаторе (до 40 %). В окислителе степень окисления возрастает до 85%.
За счет реакции окисления нитрозные газы нагреваются до 300-3350С.
2. Составление материального баланса
потоков в аппаратах.
.1 Вход в контактный аппарат
Мощность производства азотной кислоты:
по 53% кислоте - 175 тысяч т/год
по 100% кислоте - 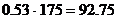 тысяч т/год
тысяч т/год
Мощность производства в кг/ч будет
составлять - 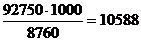 кг/ч
кг/ч
Суммарная реакция образования
азотной кислоты:
+ 2O2 = HNO3 + H2O
Определение массового расхода NH3
(по реакции):
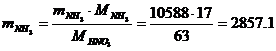 кг/ч
кг/ч
Определение фактического расхода
NH3:
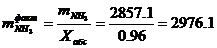 кг/ч; Xабс=0.96- коэффициент
абсорбции
кг/ч; Xабс=0.96- коэффициент
абсорбции
Определение объемного расхода NH3:
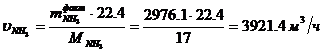
Определение массового расхода O2 (по
реакции):
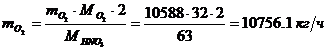
Определение действительного расхода
O2:
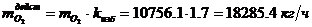 ;
;
изб=1.7- коэффициент избытка воздуха
(исходные данные)
Определение объемного расхода O2:

Определение объемного расхода N2 (по
составу воздуха):
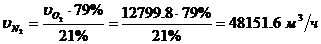
Определение массового расхода N2:
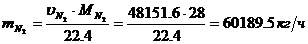
Определение действительного
парциального давления водяных паров:

Определение объемного расхода водяных паров:
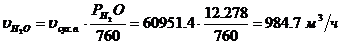
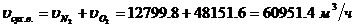 - объем сухого воздуха
- объем сухого воздуха
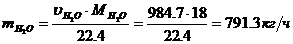
Объемная доля в процентах:
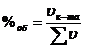
Таблица входных данных в контактный
аппарат:
Таблица 1
|
Компонент
|
m,
кг/ч
|
м3/ч
|
%,
об
|
|
NH3
|
2976,1
|
3921,4
|
5,95
|
|
O2
|
18285,4
|
12799,8
|
19,44
|
|
N2
|
60189,5
|
48151,6
|
73,11
|
|
H2O
|
791,3
|
984,7
|
1,50
|
|
82242,3
|
65857,5
|
100
|
2.2 Вход в котел-утилизатор
Целевая реакция, протекающая на катализаторе
между аммиаком и кислородом:
4NH3 + 5O2 = 4NO + 6H2O H
= -946 кДж
Определение массового расхода O2 (по
реакции): 
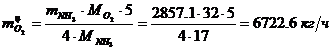
Определение объемного расхода O2:
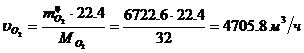
Определение массового расхода NO (по
реакции):
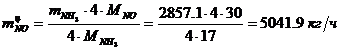
Определение объемного расхода NO:
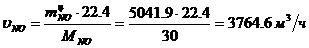
Определение массового расхода H2O
(по реакции):
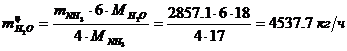
Определение объемного расхода H2O:
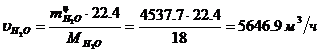
Побочная реакция, протекающая на
катализаторе между аммиаком и кислородом:
NH3 + 3O2 = 2N2 + 6H2O H =
-1328 кДж
Определение массового расхода NH3:

Определение массового расхода O2 (по
реакции):
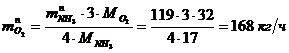
Определение объемного расхода O2:
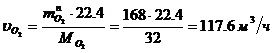
Определение массового расхода N2 (по
реакции):

Определение объемного расхода N2 :
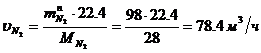
Определение массового расхода H2O
(по реакции):
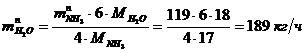
Определение объемного расхода H2O:
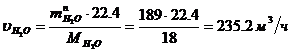
Определение массового расхода O2 на
входе в котел-утилизатор:

Определение объемного расхода O2 на
входе в котел-утилизатор:
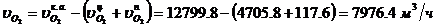
Определение массового расхода N2 на
входе в котел-утилизатор:

Определение объемного расхода N2 на
входе в котел-утилизатор:
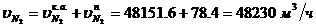
Определение массового расхода H2O на входе в
котел-утилизатор:
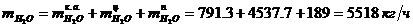
Определение объемного расхода H2O на
входе в котел-утилизатор:
Таблица входных параметров в
котел-утилизатор:
Таблица 2
|
Компонент
|
m,
кг/ч
|
м3/ч
|
%,
об
|
|
NO
|
5041,9
|
3764,6
|
5,63
|
|
O2
|
11394,8
|
7976,4
|
11,93
|
|
N2
|
60287,5
|
48230
|
72,16
|
|
H2O
|
5518
|
6866,8
|
10,27
|
|
82242,2
|
66837,8
|
100
|
2.3 Вход в окислитель
Реакция окисления оксида азота до диоксида
азота:
+ 0.5O2 = NO2
Определяем массовый расход NO необходимый на
реакцию:

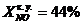 - степень превращения NO в
котле-утилизаторе (исходные данные)
- степень превращения NO в
котле-утилизаторе (исходные данные)
Определение объемного расхода NO:
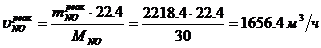
Определение массового расхода O2 (по
реакции):

Определение объемного расхода O2:

Определение массового расхода NO2
(по реакции):
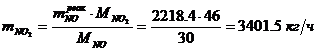
Определение объемного расхода NO2 :
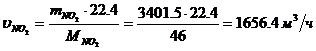
Определение массового расхода NO на
входе в окислитель:
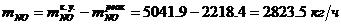
Определение объемного расхода NO на входе в
окислитель:
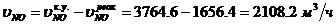
Определение массового расхода O2 на
входе в окислитель:
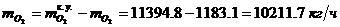
Определение объемного расхода O2 на
входе в окислитель:

Таблица входных данных в окислитель:
Таблица 3
|
Компонент
|
m,
кг/ч
|
м3/ч
|
%,
об
|
|
N2
|
60287,5
|
48151,6
|
73,03
|
|
NO
|
2823,5
|
2108,2
|
3,20
|
|
O2
|
10211,7
|
7148,2
|
10,84
|
|
NO2
|
3401,5
|
1656,4
|
|
H2O
|
5518
|
6866,8
|
10,42
|
|
82242,2
|
65931,2
|
100,00
|
2.4 Выход из окислителя
Реакция окисления оксида азота до диоксида
азота:
+ 0.5O2 = NO2
Определяем массовый расход NO выходящий из
окислителя:
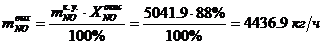
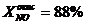 - степень превращения NO на выходе
из окислителя (исходные данные):
- степень превращения NO на выходе
из окислителя (исходные данные):
Определение объемного расхода NO:
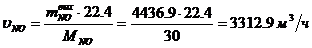
Определение массового расхода O2 (по
реакции):
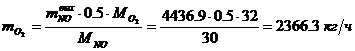
Определение объемного расхода O2:
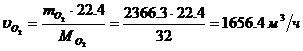
Определение массового расхода NO2
(по реакции):
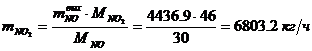
Определение объемного расхода NO2 :
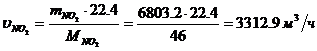
Определение массового расхода NO на
входе в окислитель:
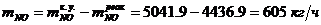
Определение объемного расхода NO на
входе в окислитель:
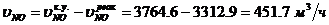
Определение массового расхода O2 на
входе в окислитель:
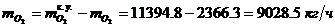
Определение объемного расхода O2 на
входе в окислитель:
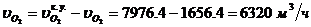
Таблица выходных данных из
окислителя:
Таблица 4
|
Компонент
|
m,
кг/ч
|
м3/ч
|
%,
об
|
|
N2
|
60287,5
|
48151,6
|
73,96
|
|
NO
|
605
|
451,7
|
0,69
|
|
O2
|
9028,5
|
6320
|
9,71
|
|
NO2
|
6803,2
|
3312,9
|
5,09
|
|
H2O
|
5518
|
6866,8
|
10,55
|
|
82242,2
|
65103
|
100,00
|
3. Определение температуры газа на
выходе из окислителя
+ 0.5O2 = NO2 H = -124 кДж
Принимаем Твых = Т0 + 40
Тср = Т0 + 20
Из уравнения теплового баланса:

- температура на входе в окислитель,
К; T0 = 548 K (исходные даннае)
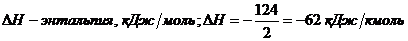
Из уравнения материального баланса:
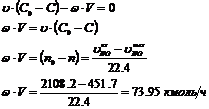
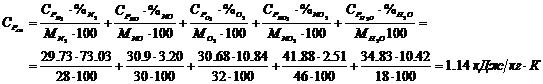
Определение средних теплоемкостей
компонентов:
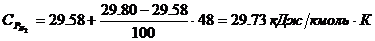
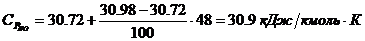
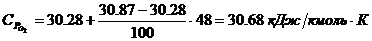
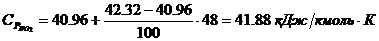
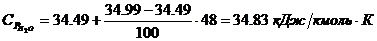
4. Определение объема окислителя
окислитель газ температура
NO + 0.5O2 = NO2 H = -124 кДж
Из уравнения материального баланса:
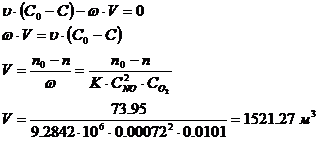
- константа равновесия химической
реакции, 
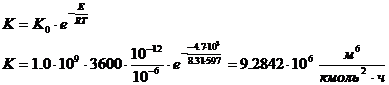
Е - энергия активации, кДж/моль; E =
-4.7 кДж/моль[2, 206]- предэкспоненциальный множитель,  ;
; 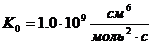 [2, 206]-
универсальная газовая постоянная; R = 8.31 Дж/К моль
[2, 206]-
универсальная газовая постоянная; R = 8.31 Дж/К моль
Определение концентраций
компонентов:
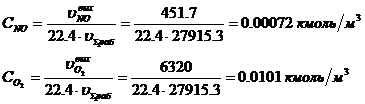
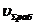 - суммарный рабочий объемный расход,
м3/ч;
- суммарный рабочий объемный расход,
м3/ч;
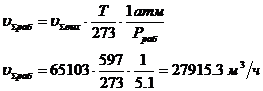
раб - рабочее давление в аппарате,
атм; Pраб = 5.1 атм (исходные данные).
Вывод
В процессе работы была рассчитана одна из стадий
процесса производства азотной кислоты, а именно окисление оксида азота. Был
составлен материальный баланс входящих и выходящих из окислителя потоков. На
основе теплового баланса была рассчитана температура газа на выходе из
окислителя, при условии, что он является адиабатическим реактором, то есть
отсутствует теплообмен с окружающей средой. Затем на основе уравнения
материального баланса был рассчитан объем окислителя, по заданному давлению в
аппарате.
Литература
1.
Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. “Общая химическая технология”;
Москва; Высшая школа; 1990 г.
.
Краткий справочник физико-математических величин; Москва; Химия; 1983 г.