Окисно-відновні реакції в аналітичній хімії
Окисно-відновні
реакції в аналітичній хімії
Вступ
Головним предметом вивчення в хімії є хімічна
реакція. Глибоке знання сутності та закономірностей протікання хімічних реакцій
дає можливість керувати ними і використовувати для синтезу нових речовин.
Засвоєння загальних закономірностей протікання хімічних реакцій необхідно для
подальшого вивчення властивостей неорганічних і органічних речовин. Більшість
хімічних процесів, що протікають в природі і здійснювані людиною в її
практичній діяльності, являють собою окислювально-відновні реакції. Як приклад
можна навести такі процеси: фотосинтез, горіння природний газ, отримання
металів з руд, синтез аміаку.
Застосування окисно-відновних реакцій величезне.
Вони використаються в якісному та кількісному аналізі речовин, біохімічних
процесах, для отримання нових важливих речовин. Рівняння цих реакцій цікаві
своєю складністю і особливістю.
1. Основні поняття. Фактори, що впливають на перебіг
окисно-відновних реакцій
.1 Основні поняття та визначення
Характерною особливістю реакцій
окиснення-відновлення являється перехід електронів між реагуючими частинками.
Частинку, що приймає електрон, зазивають окисником, а ту, що віддає, -
відновником. Наприклад, у реакції
2+ + Ce4+ = Fe3+
+ Ce3+ (1.1)
електрони від Fe2+ переходять до Ce4+,
у результаті чого ступінь окиснення (і позитивний заряд) іона церія
зменшується, а іона феруму збільшується. Іон Ce4+ в даному випадку
являється окисником, а іон Fe2+ - відновником. Таким чином, процес
окиснення однієї речовини виявляється нерозривно пов’язаним з відновленням
іншого, тому реакції такого типу називаються окисно-відновними.
Кожну окисно-відновну реакцію можна представити
як суму двох напівреакцій, одна з яких відображає перетворення окисника, а інша
- відновника. Наприклад, в реакції (1.1) рівняння напівреакції з окисником має
вигляд
4+ + е- = Ce3+ (1.2)
а з відновником
2+ = Fe3+ + е - (1.3)
Підсумовування (1.2) та (1.3) дає рівняння
хімічної реакції (1.1). Цілком зрозуміло, що при підсумовуванні необхідно
передбачити, щоб у відповідності з законом електронейтральності розчину число
електронів, що віддаються відновником, точно дорівнювало числу електронів, що
приймаються окисником. На цьому ґрунтується електронно-іонний метод підбору
коефіцієнтів в окисно-відновних реакціях, найбільш наочний та універсальний.
Еквівалентом окисника або відновника називається його
частка (реальна або умовна), яка, відповідно, приєднує або віддає один
електрон.
Молярна маса еквівалента 1/z
М (Х) окисника або відновника дорівнює їх молярної масі М(Х), помноженої на
фактор їх еквівалентності 1/z в даній реакції.
Фактор еквівалентності окисника або відновника дорівнює 1/z,
де z - число електронів, прийнятих або відданих однією часткою (молекулою,
атомом, іоном) окисника або відновника. Тому молярна маса еквівалента окисника
або відновника обчислюється за рівнянням:
М(1/z Х)
= М(Х)/z.
1.2 Фактори, що впливають на протікання окисно-відновних реакцій
Характер протікання окисно-відновних реакцій
залежить від:
· концентрації реагенту;
+ H2SO4 (розв.) ZnSO4
+ H2 окисник Н+;
3Zn + 4H2SO4
(конц.) 3ZnSO4 + S + 4H2O окисник S+6.
· температури реакції;
на холоді:
Cl2 + 2KOH KCl + KClO + H2O;
при нагріванні:
Cl2 + 6 KOH 5KCl + KClO3 +
3H2O.
· наявності каталізатора;
без каталізатора:
NH3 + 3O2 2N2 +
6H2O;
з каталізатором:
NH3 + 5O2 4NO + 6H2O.
· вплив характеру
середовища
кисле середовище:
KMnO4 + 5Na2SO3
+ 3H2SO4 2MnSO4 + K2SO4
+ 5Na2SO4 + 3H2O;
| MnO4- + 8H+ +
5e - Mn2+ + 4H2O;
| SO32- + H2O -
2e - SO42- + 2H+.
нейтральне середовище:
KMnO4 + 3Na2SO3
+ H2O 2MnO2 + 3Na2SO4 + 2KOH;
| MnO4- + H2O +
3e - MnO2 + 4OH-;
| SO32- + 2OH- -
2e - SO42- + H2O.
лужне середовище:
2KMnO4 + Na2SO3
+ 2KOH 2K2MnO4 + Na2SO4 + H2O;
| MnO4- + 1e -
MnO42-;
| SO32- + 2OH- -
2e - SO42- + H2O.
В окисно-відновних реакціях, що протікають у
водних розчинах, часто беруть участь вода або її іони, які не тільки сприяють
передачі електронів від відновника до окисника, а й пов'язують компоненти даних
перетворень. Особливо це важливо для біохімічних окисно-відновних реакцій, що
завжди протікають у водних розчинах.
2. Напрямок протікання окисно-відновних реакцій
В основі визначення напрямку мимовільного
протікання окисно-відновних реакцій лежить наступне правило: окисно-відновні
реакції мимовільно протікають завжди в бік перетворення сильного окисника в
слабкий зв'язаний відновник або сильного відновника в слабкий зв'язаний
окисник.
Кількісною мірою окисно-відновної здатності даної
сполученої окисно-відновної пари є величина її відновного потенціалу, яка залежить
від:
· природи окисненої і
відновленої форми даної пари;
· співвідношення
концентрацій окисненої і відновленої форми даної сполученої пари;
· температури.
Суть окисно-відновних реакцій полягає в
конкуренції за приєднання електрона між окисниками, що беруть участь. При цьому
електрон приєднує та пара, окиснена форма якої сильніше його утримує.
Зіставляючи потенціали сполучених пар, що беруть
участь в окисно-відновній реакції, можна заздалегідь визначити напрямок, в
якому буде мимовільно протікати та чи інша реакція.
При взаємодії двох сполучених окисно-відновних
пар окисником завжди буде окиснена форма тієї пари, потенціал якої має більш
позитивне значення.
Для визначення напрямку окисно-відновної реакції
можна також користуватися величиною її ЕРС.
ЕРС окисно-відновної реакції в стандартних умовах чисельно
дорівнює різниці стандартних потенціалів сполучених окисно-відновних пар, що
беруть участь в реакції:
Е° = 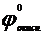 -
- 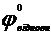
Умовою мимовільного протікання окисно-відновної реакції є
позитивне значення її ЕРС, тобто
Е° = 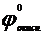 -
- 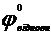 > 0
> 0
Кількісною характеристикою протікання будь-яких оборотних
процесів є константа рівноваги К, яка пов'язана зі зміною стандартної енергії
Гіббса:
ΔG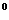 = -2,3RT lg K
= -2,3RT lg K
Окисно-відновні реакції лежать в основі
метаболізму будь-яких організмів. У разі аеробного метаболізму основним
окисником є молекулярний кисень, що надходить в процесі дихання, а відновником
- органічні сполуки, які надходять з продуктами харчування. При анаеробному
метаболізмі в його основі лежать переважно окисно-відновні реакції, в яких і
окисниками, і відновниками є органічні сполуки.
3. Окисно-відновні титрування. Теоретичні основи
.1 Методи редоксметрії
Реакції окиснення-відновлення лягли в основу
групи методів титриметричного аналізу, які називають методами окисно-відновного
титрування, або редоксметрії. Залежно від типу реакцій і робочих розчинів
розрізняють такі методи:
. Перманганатометричне титрування, титрант -
розчин КМnO4.
. Йодометричне титрування - в основі лежить
взаємодія з йодом.
. Броматометричне титрування, титрант - розчин
KBrO3.
. Дихроматометричне титрування, титрант - розчин
K2Cr2O7.
. Нітритометричне титрування, титрант - розчин
NaNO2.
В якості титрантів в окисно-відновному титруванні
застосовують розчини окисників і відновників. Вони в залежності від умов можуть
вступати в реакції, у яких передається різна кількість електронів, тому часто
окисники і відновники не мають постійного еквівалента.
3.1.1 Перманганатометричне титрування
Основна реакція. У
перманганатометричному титруванні застосовують титрант - розчин калій
перманганату. Титрування найчастіше проводять у кислому середовищі, у
присутності Н2SО4.
Приготування титранту. Розчини КМnО4
готують звичайно 0,1 н. Для приготування 1 дм3 розчину беруть
наважку дещо більше 3,161 г. КМnО4 являється сильним окисником і
здатний в розчинах змінювати свою концентрацію у присутності різних
відновлюючих речовин - органічних домішок аміаку. При приготуванні розчинів КМnО4
їх витримують кілька днів у темному місці для того, щоб пройшли всі
окисно-відновні процеси з домішками, що містяться у воді. Тільки після
відстоювання концентрація розчину КМnО4 стає постійною і розчин
стандартизують.
Стандартизація титранта. Розчин КМnО4
стандартизують за щавлевою кислотою. Індикатором у методі служить титрант, при
найменшому надлишку якого розчин, що титрують, забарвлюється в рожевий колір,
тому титрування розчином КМnО4 проводять до появи рожевого
забарвлення аналізованого розчину. При титруванні розчином КМnО4 (та
інших окислювачів) використовують бюретки зі скляним краном. Застосування
бюреток з гумовими трубками неприпустимо, так як гума окислюється, і розчини
КМnО4 у підсумку змінюють свою концентрацію. Залишати розчин КМnО4
на тривалий час у бюретках не рекомендується, тому що на стінках бюреток
з’являється коричневий наліт марганець діоксиду. Але він легко відмивається
розчинами НСl і Н2С2О4. Концентрацію розчину
КМnО4 регулярно перевіряють.
Застосування. Перманганатометричне титрування
застосовують для аналізу відновників - гідроген пероксиду Н2О2,
магній пероксиду МgО2 + МgО, натрій нітриту NaNО2, заліза
відновленого та ін.
Титрант. Застосовують розчини натрій тіосульфату
і йоду 0,1 і 0,01 н. концентрації. Розчини натрій тіосульфату застосовують для
титрування вільного йоду. При проведенні цієї реакції йод відновлюється до
йодид-іонів, тіосульфат-іони окиснюються до тетратионат. Йод малорозчинний у
воді, його розчини готують у присутності КI, що утворює розчинний у воді
комплекс.
Наважку йоду беруть дещо більше розрахункової,
враховуючи можливість присутності домішок. Йод летючий і при відважуванні може
випаровуватися, тому всі операції відважування та приготування розчину йоду
проводять, використовуючи бюкси і за можливістю швидко. Наважку йоду (13 г.)
розчиняють у концентрованому розчині потрійної (39 г. КI на 50 см3
води) кількості КI і після повного розчинення йоду розчин доводять у мірній
колбі водою до 1000 см3. Концентрацію приготованого розчину йоду
встановлюють за розчином натрій тіосульфату, для чого 15-20 см3
розчину йоду титрують 0,1 н. розчином тіосульфату. В якості індикатора
використовують розчин крохмалю, синє забарвлення якого при досягненні точки
еквівалентності знебарвлюється. 0,1 н. розчин тіосульфату натрію готують, зважуючи
наважку Na2S2O3 ∙ 5Н2О,
приблизно рівною 0,1 моль. Наважку розчиняють в 500 см3 води,
додають 0,1 г Na2CO3 і доводять водою до 1000 см3.
Na2СО3 додають для стабілізації Na2S2O3,
який взаємодіє з О2 і СО2 повітря:
У присутності Na2СО3 ці
реакції сповільнюються. Після приготування розчин натрій тіосульфату залишають
на 7-10 днів у темному місці для того, щоб концентрації розчину
стабілізувалася. Титр і нормальність розчину Na2S2O3
встановлюють за допомогою калій дихромата. Калій дихромат кількісно виділяє йод
з калій йодиду, а йод, що виділився, відтитровують розчином натрій тіосульфату:
Близько 0,15 г. (точна наважка) висушеного до
постійної маси K2Cr2O7 розчиняють у склянці з
притертою пробкою в 50 см3 води, додають 10 см3 20%
розчину КI, 5 см3 розчину НСI. Після 10-хвилинного стояння в темному
місці до розчину додають 200 см3 води і титрують розчином Na2S2O3
до зелено-жовтого забарвлення. Потім додають 2-3 см3 розчину
крохмалю і титрують до переходу синього забарвлення розчину у світло-зелене. За
обсягом розчину Na2S2O3 розраховується титр,
нормальність або поправочний коефіцієнт. Розчини йоду і натрій тіосульфату
зберігають у темному місці в закритих склянках і періодично перевіряють їх
концентрацію. Індикатором методу є 1% розчин крохмалю, який готують, розтираючи
1 г крохмаль у ступці з 5 см3 холодної води; суміш вливають при
перемішуванні в 100 см3 киплячої води. Після 2-3-хвилинного
кип'ятіння розчин охолоджують. Розчин крохмалю швидко псується і може
використовуватися не більше 2-3 днів. Для консервації до нього додають 1 г
саліцилової кислоти або ZnCl2. 5 см3 розчину крохмалю
повинні давати з 2 краплями 0,1 н. розчину йоду синє забарвлення. Якщо
забарвлення стає червоно-бурим, розчин не придатний для використання. Розчин
крохмалю не можна додавати в концентровані розчини йоду - синє забарвлення тоді
довго не зникає. Розчин крохмалю додають наприкінці титрування, коли основну
частину йоду відтитрували і розчин приймає жовте забарвлення.
Застосування йодометрії. З неорганічних з'єднань
йодометрії аналізують йод, калій перманганат, натрій арсенат, каломель, купрум
сульфат і багатоорганічні лікарські препарати (форіалін, антшірін та ін.)
Прямим титруванням розчину Na2S2O3 аналізують
йод і настойку йоду. Зворотне титрування використовують в аналізі формальдегіду,
антипірину.
3.1.3 Броматометричне і бромометричне титрування
Броматометричне титрування. В основі цього
титрування лежить реакція відновлення бромід-іонів у кислому середовищі до
бромід-іонів.
Титрант. Застосовують 0,1 н розчин калій бромату
КВrО3, який в кислому середовищі є одним із сильних окиснювачів. 2,8
г калій бромату (точна наважка) розчиняють в ~ 500 см3 Н2О
і доводять об'єм розчину в мірній колбі до 1 дм3. Титр і
нормальність розчину встановлюють йодометрично, методом титрування заступника.
КВrO3 у присутності НСI кількісно взаємодіє з KI, виділяючи при
цьому елементний йод I2.
Йод, що виділився, титрують 0,1 н. розчином Nа2S2О3
до знебарвлення у присутності крохмалю.
У методі застосовують індикатори метиловий
оранжевий і метиловий червоний, які в точці еквівалентності знебарвлюються
бромом, що виділяється при взаємодії калій бромату з калій бромідом, який
дододають до аналізованого розчину:
Застосування. Методом
броматометричного титрування аналізуються препарати, що містять миш'як - миш'яковистий
ангідрид, новарсенол, міарсенол і осарсол.
Бромометричне титрування. Засноване на взаємодії
калій бромату з калій бромідом. Вільний бром, що виділяється при цій реакції,
володіє властивостями окисника і здатний відновлюватися до бромід-іонів.
При броматометричному титруванні наважку речовини
розчиняють у воді, додають розчин КВr. Одержану суміш титрують 0,1 н. розчином
КВrО3.
Для визначення фенолу і резорцину використовують
титрування заступника. Розчин речовини змішують з певним обсягом 0,1 н. КВrО3,
додають КВr і НСI. Суміш залишають на 10 хв, за цей час відбувається бромування
речовини бромом, що виділився.
3.1.4 Нітритометричне титрування
Титрант. Застосовують 0,5 М і 0,1 М. розчини NaNO2,
які готують, розчиняючи 36,5 г NaNO2 (для 0,5 М розчину) або 7,3 г
(для 0,1 М розчину) в 100 см3 води. Розчин NaNO2
стандартизують за сульфаніловою кислотою.
Точну наважку сульфанілової кислоти,
перекристалізованої і висушеної до постійної маси, та невелику кількість NаНСО3
(або розчину NН3) розчиняють у воді, додають НСI, КВr і при
перемішуванні титрують NаNО2. Швидкість титрування повинна бути
уповільненою - спочатку 2 см3/хв, в кінці титрування - 0,05 см3/хв.
Реакція діазотування проходить повільно, для прискорення додають калій бромід.
Індикатори. У нітритометрії
застосовують зовнішній індикатор - йо-дидкрохмальний папір, який готують,
просочуючи фільтрувальний папір розчинами КI і крохмалю; потім папір висушують.
У точці еквівалентності в розчині з'являється надлишок NаNО2 в
кислому середовищі, що взаємодіє з КІ йодидкрохмального паперу. При цьому
виділяється елементний йод, фарбуючи крохмаль у синій колір.
Йодидкрохмальний папір - зовнішній індикатор; в
розчини, що титруються, опускати його не можна. Наприкінці титрування, після
додавання кожної порції титранту, краплини титрованої суміші наносять і на
йодидкрохмальний папір. У точці еквівалентності папір синіє. Паралельно
проводять контрольний дослід.
В якості внутрішніх індикаторів у нітритометрії
використовують редокс-індикатори - тропеолін 00, суміш тропеоліну 00 з
метиленовим синім. При застосуванні тропеоліну 00 забарвлення розчину в точці
еквівалентності змінюється від червоного до жовтого, суміші тропеоліна 00 з
метиленовим синім - від малинового до синього. Аналіз нітритометричним методом
проводять аналогічно визначенню сульфанілової кислоти.
3.2 Індикатори
У методах окиснення-відновлення застосовується
декілька типів індикаторів:
а) індикатори, які змінюють колір при певній
зміні окисно-відновного потенціалу системи - редокс-індикатори;
б) індикатори, що змінюють свій колір або за
появою в розчині надлишку реагенту, або при зникненні визначених речовин -
специфічні индикатори.
Редокс-індикатори. Існують у двох формах -
окисненої і відновленої, причому колір однієї форми відрізняється від іншої.
Перехід індикатора з однієї форми в іншу і зміна забарвлення відбувається при
певному потенціалі переходу забарвлення індикатора, який для зменшення помилок
повинен знаходитися в межах стрибка титрування.
Специфічні індикатори. Крохмальний - індикатор
на присутність вільного йоду. У присутності вільного йоду крохмаль при
кімнатній температурі синіє. Синє забарвлення крохмалю виникає внаслідок
адсорбції йоду на його молекулах.
Амоній тіоціанат. Застосовується при титруванні солей Fе3+.
У точці еквівалентності при його застосуванні титрований розчин з червоного
стає безбарвним.
Висновок
За допомогою окисно-відновних реакцій проводиться
величезна кількість кількісного та якісного аналізу. Окисно-відновні реакції є
основою майже всіх біохімічних процесів.
На окисненні-відновленні в аналітичній хімії
засновані методи об'ємного аналізу: перманганатометрія, йодометрія,
броматометрія та ін., що відіграють важливу роль при контролюванні виробничих
процесів і виконанні наукових досліджень.
Використана література
відновний титрування редоксметрія реакція
1. Васильев В.П. Аналитическая химия. Гравиметрический и
титриметрический методы анализа: Учеб. для химико-технол. спец. вузов/ В.П.
Васильев. - М.: Высш. шк., 1989. - 320 с.: ил.
. Леенсон И.А. Почему и как идут химические реакции/ И.А.
Леенсон. - М.: Мирос, 1994. - 176 с.
. Слесарев В.И. Химия: основы химии живого: Учеб. для
вузов/ В.И. Слесарев. - СПб: Химизат, 2001. - 784 с.
. Егоров А.С. Химия. Пособие-репититор для поступающих в
вузы/ А.С. Егоров. - Ростов-на-Дону: Феникс, 2003. - 768 с.
. Суворов А.В. Общая химия/ А.В. Суворов, А.Б. Никольский.
- СПб: Химия, 1995. - 624 с.