Кристаллическая структура металлов и сплавов системы Nb-V
Реферат
Работа содержит 20 страниц, 1 таблицу, 9 рисунков и 2 источника
литературы.
В работе приведены данные кристаллической структуры ниобия и золота, а
также их сплавов. Приведена диаграмма состояния системы Nb-V, график зависимости периода кристаллической решетки от
состава сплава по литературным данным и по правилу Вегарда. Также в работе
присутствуют формулы для кристаллографических расчетов.
Ключевые слова: фазовые равновесия, симметрия кристаллической структуры,
плотность упаковки, междоузлия, кристаллическая решетка.
Содержание
Введение
.
Расчетно-эксперементальная часть
1.1
Характеристика кристаллической структуры Nb и V
.2 Симметрия
кристаллической структуры
.3 Междоузлия
кристаллической решетки
.4 Фазовые
равновесия системы
.5 Формулы
для кристаллографических расчетов
2.
Стереографические проекции
Заключение
Использованная
литература
Введение
Ниобий (лат. Niobium) - химический элемент V группы
периодической системы Менделеева; атомный номер 41, атомная масса 92,9064;
металл серо-стального цвета. Элемент имеет один природный изотоп 93Nb.
Н. открыт в 1801 английским
учёным Ч. Хатчетом (1765-1847) в минерале, найденном в Колумбии, и назван им
"колумбием". В 1844 немецкий химик Г. Розе (1795-1864) обнаружил
"новый" элемент и назвал его "ниобием" в честь дочери
Тантала Ниобы, чем подчеркнул сходство между Н. и танталом. Позднее было
установлено, что Н. тот же элемент, что и колумбий.
Распространение в природе.
Среднее содержание Н. в земной коре (кларк) 2·10-3% по массе. Только в щелочных
изверженных породах - нифелиновых сиенитах и др., содержание Н. повышено до
10-2-10-1%. В этих породах и связанных с ними пегматитах, карбонатитах, а также
в гранитных пегматитах обнаружено 23 минерала Н. и около 130 др. минералов,
содержащих повышенные количества Н. Это в основном сложные и простые окислы. В
минералах Nb связан с редкоземельными элементами и с Та, Ti, Ca, Na, Th, Fe, Ba
(тантало-ниобаты, титанаты и др.). Промышленные месторождения Н. связаны с
массивами щелочных пород (например, на Кольском полуострове), их корами
выветривания, а также с гранитными пегматитами. Важное значение имеют и россыпи
тантало-ниобатов.
Можно отметить такие свойства
ниобия как высокая температура плавления и кипения, более низкая работа выхода
электронов по сравнению с другими тугоплавкими металлами - вольфрамом и
молибденом. Последнее свойство характеризует способность к электронной эмиссии
(испусканию электронов), что используется для применения ниобия в
электровакуумной технике. Ниобий также имеет высокую температуру перехода в
состояние сверхпроводимости. При обычной температуре ниобий устойчив на
воздухе. Характерное свойство ниобия - способность поглощать газы - водород,
азот и кислород. Небольшие примеси этих элементов сильно влияют на механические
и электрические свойства металла. При низкой температуре водород поглощается
медленно, при температуре примерно 360°С водород поглощается с максимальной
скоростью, причём происходит не только адсорбция, но и образуется гидрид NbH.
Поглощённый водород придаёт металлу хрупкость, но при нагревании в вакууме выше
600°С почти весь водород выделяется и прежние механические свойства
восстанавливаются. Ниобий устойчив против действия соляной, серной, азотной,
фосфорной и органических кислот любой концентрации на холоду и при 100-150°С.
Металл растворяется в плавиковой кислоте и особенно интенсивно - в смеси
плавиковой и азотной кислот. Менее устойчив ниобий в щелочах. Горячие растворы
едких щелочей заметно разъедает металл, в расплавленных щелочах и соде он
быстро окисляется с образованием натриевой соли ниобиевой кислоты.
Из ниобиевых листов и
штабиков изготовляют «горячую арматуру» (т.е. нагреваемые детали) - аноды,
сетки, катоды косвенного накала и другие детали электронных ламп, особенно
мощных генераторных ламп. Коррозионная стойкость ниобия в кислотах и других
средах, в сочетании с высокой теплопроводностью и пластичностью делают его
ценным конструкционным материалом для аппаратуры в химических и
металлургических производствах. Ниобий обладает сочетанием свойств,
удовлетворяющих требования атомной энергетики к конструкционным материалам.
Ниобий широко используется как легирующая добавка в сталях. Добавка ниобия в
количестве, в 6-10 раз превышающем содержание углерода в стали, устраняет
межкристаллитную коррозию нержавеющей стали и предохраняет сварные швы от
разрушения.
Ванадий (лат. Vanadium) - химический элемент V группы
периодической системы элементов Д.И. Менделеева, обозначается символом V.
Имеет атомный номер 23, атомную массу 50,9415. Чистый ванадий - это ковкий
твердый металл серебристо-серого цвета.
Соединения ванадия довольно
широко распространены в природе. Его содержание в земной коре составляет
0,009%. Вместе с тем, ванадийсодержащие минералы (ванадинит, чилеит, патронит,
карнотит) в виде самостоятельных залежей не встречаются, а рассеяны в железных
рудах (которые и являются важным источником промышленной добычи ванадия), в
нефтяных месторождениях, в залежах асфальтов, битумов, горючих сланцев, углей
(например, в Перу) и т.п. Поэтому ванадий относят к числу достаточно редких
элементов.
Чистый ванадий - химически
стойкий металл. Он не подвержен воздействию воды, в том числе морской. Он также
не реагирует с соляной и слабой серной кислотами, растворами щелочей.
Растворяется в концентрированной серной кислоте, в плавиковой (фтористоводородной)
и азотной кислотах, а также в "царской водке".
В силу своих свойств ванадий
находит применение как легирующий компонент при производстве специальных сталей
и сплавов, применяемых в автомобильной, авиационной и космической технике,
морском судостроении. В меньшей степени соединения ванадия используют в
процессе производства резины, керамики, некоторых химикатов, а также в
текстильной, лакокрасочной и стекольной промышленности.
Основным источником
поступления ванадия в подземные воды являются железные и полиметаллические
руды, содержащие небольшую примесь ванадия, а также экологические факторы:
сточные воды предприятий черной и цветной металлургии, добыча и переработка
нефти, сжигание углеводородного топлива (например, выбросы автомобилей).
Ванадий имеет свойство связываться с другими элементами и частицами и поэтому в
основном задерживается в почве, где и остается длительное время. В растениях
обнаруживаются только незначительные следы ванадия, что свидетельствует о его
слабом накоплении в растительных тканях.
1. Расчетно-экспериментальная часть
1.1 Характеристика
кристаллической структуры Ni и Au
а)
Структурный тип Nb и V-А1.
б) Кристаллическая решетка ГЦК
Рисунок 1 - Кристаллическая решетка ГЦК
Период кристаллической решетки - длинна ребра элементарной ячейки
кристаллической решетки. Т.е. это наименьшее расстояние, при сдвиге на которое
решетка точно воспроизводит свой первоначальный вид, то есть в каждом ее узле
оказываются такие же атомы как и до сдвига.
a=b=c; α=β=γ=90º
Для Ni
a= 0,3524 нм;
Для Au a= 0,4078 нм.
в) Базис - это число атомов приходящееся на элементарную ячейку
N=4
[[000]], [[½½0]],
[[½0½]], [[0½½]]
г) Координационное число - число ближайших равноотстоящих атомов от
данного атом. К=12
д) Соотношение между атомным радиусом и периодом решетки
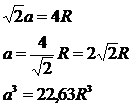

Рисунок 2 - Плоскость (001) с упаковкой атомов
е) Плотность упаковки показывает, какая часть объема занята атомами

1.2
Симметрия кристаллической структуры
По симметрии и числу единичных направлений кристаллы делятся на три
категории: высшую, среднюю и низшую. Три категории в свою очередь делятся на 7
сингоний: триклинная, моноклинная, ромбическая, тригональная, гексагональная,
тетрагональная и кубическая.
Nb,
как и V имеет решетку ГЦК кубической
сингонии, относящейся к высшей категории.
Кристаллы высшей категории не имеют единичных направлений. У них
обязательно есть несколько осей порядка выше, чем 2, в частности четыре оси 3,
расположенные как пространственные диагонали куба. Любому направлению в
кристалле высшей категории соответствуют симметрично эквивалентные направления.
Многие физические свойства (электропроводность, теплопроводность) в этих
кристаллах изотропны, как в аморфных веществах, а анизотропия других свойств
(упругость, электрооптический эффект) гораздо слабее, чем у кристаллов других
категорий. Внешняя форма кристаллов, как правило, изометрична, т.е. развита
примерно одинаково во всех направлениях, как куб, октаэдр, тетраэдр.
Для кубической сингонии характерно четыре оси и отсутствие единичных
направлений.
Классом симметрии называют полную совокупность операций симметрии
(возможных симметричных преобразований) этого объекта.
Nb и V, как и все металлы с кубической
решеткой относятся к классу симметрии m3m (имеет 4 оси симметрии проходящие по
биссектрисам координатных углов, ось 4-го порядка, центр симметрии, три
координатные и шесть диагональных плоскостей симметрии)
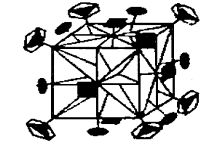
Рисунок 3 - Комплекс элементов симметрии m3m
1.3 Междоузлия кристаллической решетки
Междоузлие в идеальном кристалле - это свободное пространство между
занятыми атомами узлами кристаллической решетки. Разделяют два вида междоузлий:
октаэдрические (октапоры) и тераэдрические (тетрапоры) пустоты, в зависимости
от формы. Междоузлия характеризуются размером, за который принимают радиус
шарика, который вписывается в эту пору
В ГЦК решетке на ячейку приходится 4 октапоры (1 октапора на атом) с
координатами:
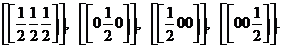
На
Рисунке 4 крестиками обозначены центры октапор в ячейке решетки ГЦК
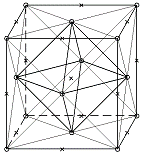
Рисунок 4 - Расположение октапор в ячейке ГЦК решетки
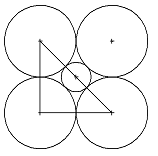
Рисунок 5 - Расположение атомов в плоскости (002)
Вычислим размер октапоры:
В ГЦК решетке соотношение между атомным радиусом и периодом решетки
 ,
,
из
рисунка 1.6 с применением теоремы Пифагора получаем:
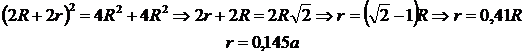
На
ячейку решетки ГЦК приходится 8 тетрапор (по 2 тетрапоры на атом), с
координатами
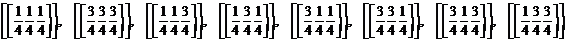
На
Рисунке 6 крестиками показаны центры тетрапор.

Рисунок 6 - Расположение тетрапор в ячейке ГЦК решетки
а)
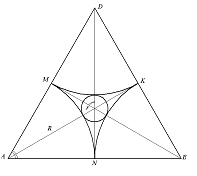
б)
Рисунок 7 - Тетрапора (а) и одна из плоскостей в ней (б)
Для вычисления размера тетрапоры вынесем тетрапору на отдельный рисунок
(рисунок 1.8а) и выделим один из треугольников (рисунок 1.8б)
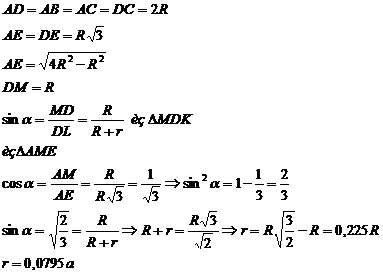
1.4
Фазовые равновесия
кристаллический стереографический ниобий золото
Кристаллическая
структура
Кривая
изменения параметра решетки в зависимости от состава сплавов показывает
небольшое положительное отклонение от правила Вегарда, параметр решетки
измерялся с точностью ±0,005 нм.
Закон Вегарда - эмпирическое правило, которое гласит, что существует
линейная зависимость при постоянной температуре между свойствами
кристаллической решетки сплава и концентрацией отдельных его элементов.
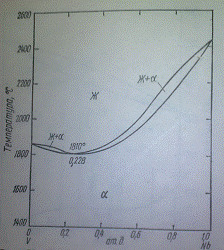
Рисунок 8 - Диаграмма состояний системы Nb-V
Таким
образом, параметры кристаллической решётки (a) твердого раствора (сплава)
материалов с одинаковой структурой решётки, могут быть найдены путем линейной
интерполяции
<#"660816.files/image017.gif">
где р - атомная концентрация одного из элементов системы

(1)
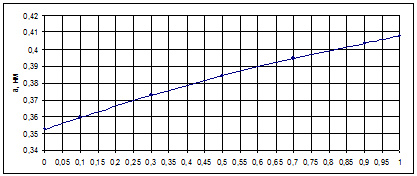
(2)
Рисунок 9 - График зависимости периода решетки твердого раствора от
состава 1 - по правилу Вегарда, 2- по литературным данным
1.5 Формулы
для кристаллографических расчетов
а) Период идентичности − это кратчайшее расстояние между соседними
узлами (атомами) вдоль заданного направления.

Для ГЦК решетки
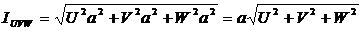
б)
Угол между двумя направлениями 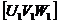 и
и 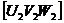
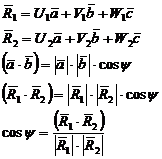
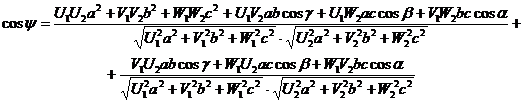
Для
ГЦК решетки
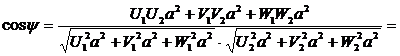
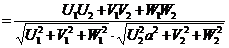
в)
Соотношение между периодами прямой и обратной решёток
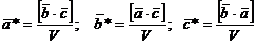
Для
ГЦК решетки
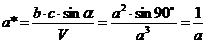 ,
,
так
как а=b=с, и sinα=sinβ=sinγ=90˚,
то ;
;
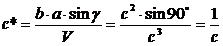
г)
Соотношение между углами прямой и обратной решёток
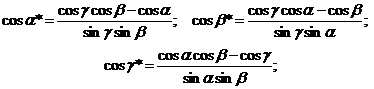
Для
ГЦК решетки
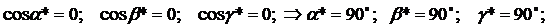
д)
Угол между двумя плоскостями 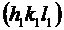 и
и 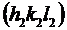
Воспользуемся
свойством вектора обратной решетки
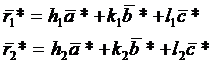
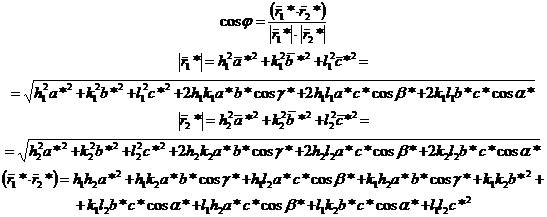
Для
ГЦК решетки
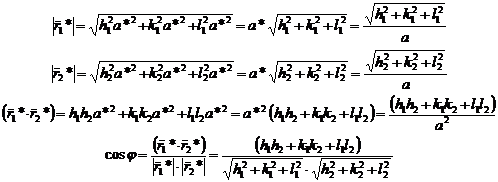
е)
Межплоскостное расстояние
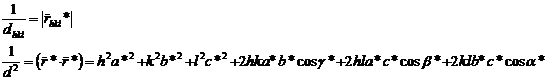
Для
решетки ГЦК
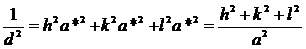
2. Стереографические проекции
Углы для построения стереографических проекций ГЦК решетки были
рассчитаны по формуле:
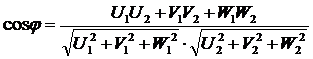
Таблица 1
Угловые расстояния между направлениями
|
Индекс оси
|
001
|
010
|
100
|
|
Индекс направления
|
110
|
101
|
011
|
111
|
110
|
101
|
011
|
111
|
110
|
011
|
111
|
|
φ˚
|
90
|
45
|
55
|
45
|
45
|
90
|
45
|
55
|
45
|
45
|
90
|
55
|
Для точности построения стереографических проекций элементов симметрии
кристалла и гномостереографических проекций элементов граней их сферические
координаты - результат гониометрических исследований кристалла - наносятся на
проекцию с помощью сеток, позволяющих графически, без дополнительных расчетов
решать многие задачи геометрической кристаллографии, с помощью сетки Вульфа.
Заключение
В работе исследована система Nb-V, в частности определены тип
кристаллической решетки никеля и золота, симметрия кристаллической структуры,
количество и положение междоузлий кристаллической решетки, фазовые равновесия
системы а также выведены основные формулы для кристаллографических расчетов в
решетке ГЦК. Построены стереографические проекции с осью [001], для направлений
<100>, <110>, <111>.
Использованная
литература
1. Егоров-Тисменко
Ю.К. Кристаллография и кристаллохимия: учебник / Ю.К. Егоров-Тисменко; под ред.
Академика В.С. Урусова. - М.: КДУ, 2005. - 592 с.: ил.
. Диаграммы
состояния двойных металлических систем: Д44 Справочник: В 3 т.: Т. 1 / Под общ.
Ред. Н.П. Лякишева. - М.: Машиностроение, 1996. - 992 с.: ил.