|
Физические
свойства
|
Бесцветная
жидкость с характерным запахом. Растворимость в воде 0,073% по массе (25°С),
воды в бензоле 0,05% (26°С). Неограниченно растворяется в углеводородах,
эфирах, хуже - в метаноле; не растворяется в этиленгликоле, глицерине;
растворяет жиры, каучуки, гудрон, серу, фосфор, йод. Образует азеотропные
смеси с водой, муравьиной кислотой, метанолом, этанолом, пропанолом,
изопропанолом и др.
|
Бесцветная
жидкость, не растворяется в воде, хорошо растворяется в органических
растворителях.
|
Бесцветная
легколетучая жидкость <#"660684.files/image108.gif">, (2.1)
где 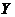 - парциальное давление чистых компонентов,
Па, - парциальное давление чистых компонентов,
Па,
T - температура кипения чистых компонентов, К,
 - коэффициенты уравнения Лайбрари. - коэффициенты уравнения Лайбрари.
Для МЭК:  , , 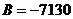 , , 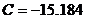 , , 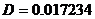 , ,  . .
Для ПФБ: 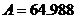 , ,  , , 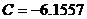 , , 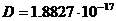 , , 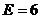 . .
Итак, точка Банкрофта в системе МЭК-ПФБ отвечает следующим
условиям: PБ=4949 мм рт. ст.; TБ=152,168°C.
Для бинарной составляющей МЭК-ПФБ экспериментальные данные по
фазовому равновесию жидкость-пар в литературе отсутствуют, поэтому при оценке
малых параметров уравнения Вильсона (табл. 2.10) нами использован полный массив
псевдоэкспериментальных данных (UNIFAC) по ПЖР (с включением точек азеотропов).
Для моделирования парожидкостного равновесия и эволюции биазеотропии в системе
метилэтилкетон - перфторбензол в заданном диапазоне давлений было выбрано
уравнение Вильсона с допущением идеального поведения паровой фазы вдали от
критических условий.
При оценке параметров бинарного взаимодействия по полному
набору псевдоэкспериментальных данных по ПЖР следует обращать внимание на то,
включает ли этот набор характеристики азеотропов. Дело в том, что параметры,
полученные без учета азеотропных точек, и с их учетом, количественно
отличаются, но их порядок остается тем же. При использовании этих наборов
параметров наблюдается различие в характеристиках азеотропов, особенно по
составу.
Таблица 2.10. Малые параметры уравнения Вильсона для системы
МЭК (1) - ПФБ (2)
|
Давление, мм рт. ст.
|
Параметры
уравнения Вильсона
|
|
л12
|
л21
|
|
50
|
1339,503
|
-785,500
|
|
180
|
1418,544
|
-850,640
|
|
320
|
1529,416
|
-896,906
|
|
340
|
1504,561
|
-892,813
|
|
400
|
1533,466
|
-904,635
|
|
440
|
1520,805
|
-908,834
|
|
500
|
1526,797
|
-914,356
|
|
560
|
1530,594
|
-919,501
|
|
760
|
1493,369
|
-935,228
|
|
1000
|
1538,152
|
-957,302
|
|
1500
|
1576,237
|
-981,909
|
|
2000
|
1482,781
|
-979,133
|
|
3000
|
-380,898
|
424,048
|
|
4500
|
-316,754
|
290,276
|
|
4900
|
-324,769
|
314,172
|
|
4949
|
-332,558
|
329,640
|
|
6500
|
-401,364
|
458,506
|
Проверим принадлежность больших параметров уравнения Вильсона
на плоскости 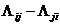 к области, соответствующей бинарным
биазеотропным смесям [98].
Большие параметры уравнения Вильсона определяются по уравнению [10, 91]: к области, соответствующей бинарным
биазеотропным смесям [98].
Большие параметры уравнения Вильсона определяются по уравнению [10, 91]:
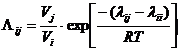 , (2.2) , (2.2)
где 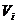 и и 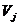 - мольные объемы
жидкости компонентов i и j, - мольные объемы
жидкости компонентов i и j,  , ,
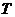 - средняя температура кипения смеси, К, - средняя температура кипения смеси, К,
 - универсальная газовая постоянная, - универсальная газовая постоянная, 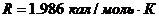 . .
Значение мольного объема равно обратному значению мольной
плотности. Мольные плотности МЭК и ПФБ рассчитаем по уравнению [94]:
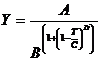 , (2.3) , (2.3)
где 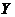 - мольная плотность, - мольная плотность, 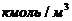 , ,
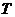 - температура кипения компонента, К, - температура кипения компонента, К,
 - коэффициенты уравнения, взятые из [94]. - коэффициенты уравнения, взятые из [94].
При различных давлениях нами рассчитаны мольные объемы
метилэтилкетона и перфторбензола и определены большие параметры уравнения
Вильсона (табл. 2.11).
Таблица 2.11. Мольные объемы компонентов и значения больших
параметров уравнения Вильсона для системы метилэтилкетон (МЭК) - перфторбензол
(ПФБ)
|
Давление, мм
рт. ст.
|
VМЭК,
см3/моль
|
VПФБ,
см3/моль
|
ЛМЭК-ПФБ
|
ЛПФБ-МЭК
|
|
50
|
88,7
|
114,3
|
0,12
|
0,32
|
|
180
|
92,0
|
118,6
|
0,13
|
0,33
|
|
320
|
93,9
|
121,1
|
0,13
|
0,33
|
|
340
|
94,1
|
121,3
|
0,13
|
0,33
|
|
400
|
94,7
|
122,2
|
0,13
|
0,33
|
|
440
|
95,1
|
122,6
|
0,13
|
0,33
|
|
500
|
95,6
|
123,3
|
0,13
|
0,33
|
|
560
|
96,1
|
124,0
|
0,14
|
0,34
|
Полученные нами параметры  и и 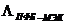 находятся в указанной области, и,
следовательно, их использование позволяет корректно описать ПЖР и биазеотропию
в системе метилэтилкетон - перфторбензол (табл. 2.12). находятся в указанной области, и,
следовательно, их использование позволяет корректно описать ПЖР и биазеотропию
в системе метилэтилкетон - перфторбензол (табл. 2.12).
Таблица 2.12. Характеристики азеотропов МЭК (1) - ПФБ (2)
|
P, мм рт. ст.
(атм)
|
T1,°C
|
T2,°C
|
Характеристики
азеотропов
|
|
|
|
(+) Az
|
(-) Az
|
|
|
|
x1, мол. д.
|
T,°C
|
x1, мол. д.
|
T,°C
|
|
50 (0,07)
|
11,813
|
14,678
|
0,0410
|
14,622
|
0,2900
|
14,858
|
|
180 (0,24)
|
39,403
|
41,568
|
0,0200
|
41,553
|
0,3675
|
42,211
|
|
320 (0,42)
|
53,974
|
55,741
|
55,722
|
0,4055
|
56,688
|
|
340 (0,45)
|
55,602
|
57,325
|
0,0165
|
57,309
|
0,4110
|
58,255
|
|
400 (0,53)
|
60,061
|
61,663
|
0,0162
|
61,644
|
0,4200
|
62,667
|
|
440 (0,58)
|
62,742
|
64,272
|
0,0160
|
64,263
|
0,4260
|
65,352
|
|
500 (0,66)
|
66,417
|
67,849
|
0,0145
|
67,840
|
0,4300
|
68,970
|
|
560 (0,74)
|
69,753
|
71,098
|
0,0125
|
71,089
|
0,4350
|
72,262
|
|
760 (1,00)
|
79,128
|
80,235
|
-
|
-
|
0,4430
|
81,688
|
|
1000 (1,32)
|
88,067
|
88,961
|
-
|
-
|
0,4570
|
90,567
|
|
1500 (1,97)
|
102,253
|
102,846
|
-
|
-
|
0,4800
|
104,604
|
|
2000 (2,63)
|
113,095
|
113,496
|
-
|
-
|
0,4810
|
115,411
|
|
3000 (3,95)
|
129,595
|
129,770
|
-
|
-
|
0,5480
|
132,137
|
|
4500 (5,92)
|
147,678
|
147,701
|
-
|
-
|
0,5570
|
150,335
|
|
4900 (6,45)
|
151,694
|
151,695
|
-
|
-
|
0,5550
|
154,285
|
|
4949 (6,51)
|
152,168
|
152,168
|
-
|
-
|
0,5540
|
154,756
|
|
6500 (8,55)
|
165,602
|
165,553
|
-
|
-
|
0,5560
|
168,378
|
В расчетном эксперименте показано, что положительный азеотроп
обедняется, а отрицательный обогащается метилэтилкетоном при увеличении
давления, что находится в соответствии со вторым законом Вревского и
подтверждается соотношением теплот испарения компонентов [99]:
 ккал / моль, ккал / моль, 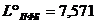 ккал / моль, т.е. ккал / моль, т.е.  , где , где 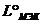 , , 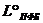 - мольные теплоты испарения компонентов при 25 єС. - мольные теплоты испарения компонентов при 25 єС.
2.4
Математическое моделирование парожидкостного равновесия при давлении 500 мм рт.
ст. в системе бензол - перфторбензол - метилэтилкетон
Для изучения влияния давления на эволюцию структуры диаграммы
фазового равновесия системы бензол - перфторбензол - метилэтилкетон выбрали Р =
500 мм рт. ст.
Система бензол - перфторбензол
Поскольку экспериментальные данные по ПЖР при Р = 500 мм рт.
ст. в системе бензол-перфторбензол [30] не позволяют получить параметры
уравнения для данной бинарной составляющей, с использованием которых можно
удовлетворительно описать биазеотропию в этой системе, для оценки малых
параметров уравнения Вильсона (табл. 2.19) нами использован полный массив
псевдоэкспериментальных данных (UNIFAC) по ПЖР (с включением точек азеотропов).
В таблице 2.13 приведены псевдоэкспериментальные данные, а
также отклонения при описании и относительные ошибки. На рис. 2.17 и рис. 2.18
представлены фазовые диаграммы жидкость-пар для данной бинарной системы.
Таблица 2.13. Описание ПЖР при P = 500 мм рт. ст. в
системе Б (1) - ПФБ (2) моделью Вильсона
|
Псевдоэкспериментальные
данные (UNIFAC)
|
ДТ,°С
|
Дy1,
мол. д.
|
Относительная
ошибка
|
|
T,°C
|
x1,
мол. д.
|
y1,
мол. д.
|
|
|
∆Tr, %
|
∆y1r, %
|
|
67,849
|
0,0000
|
0,0000
|
0,000
|
0,0000
|
0,00
|
0,00
|
|
67,903
|
0,0500
|
0,0485
|
-0,012
|
0,0004
|
0,02
|
0,76
|
|
67,939
|
0,1000
|
0,0983
|
-0,022
|
0,0006
|
0,03
|
0,61
|
|
67,957
|
0,1500
|
0,1492
|
-0,031
|
0,0008
|
0,05
|
0,48
|
|
67,956
|
0,2000
|
0,2012
|
-0,039
|
0,0007
|
0,06
|
0,35
|
|
67,935
|
0,2500
|
0,2540
|
-0,045
|
0,0006
|
0,07
|
0,25
|
|
67,893
|
0,3000
|
0,3074
|
-0,049
|
0,0005
|
0,07
|
0,15
|
|
67,829
|
0,3500
|
0,3612
|
-0,052
|
0,0003
|
0,08
|
0,08
|
|
67,745
|
0,4000
|
0,4150
|
-0,054
|
0,0001
|
0,08
|
0,02
|
|
67,641
|
0,4500
|
0,4687
|
-0,055
|
-0,0001
|
0,08
|
0,02
|
|
67,518
|
0,5000
|
0,5218
|
-0,054
|
-0,0003
|
0,08
|
0,04
|
|
67,380
|
0,5500
|
0,5740
|
-0,054
|
-0,0003
|
0,08
|
0,05
|
|
67,231
|
0,6000
|
0,6250
|
-0,054
|
-0,0002
|
0,08
|
0,04
|
|
67,077
|
0,6500
|
0,6745
|
-0,056
|
-0,0001
|
0,08
|
0,01
|
|
66,925
|
0,7000
|
0,7221
|
-0,059
|
0,0002
|
0,09
|
0,02
|
|
66,786
|
0,7500
|
0,7678
|
-0,063
|
0,0005
|
0,10
|
0,06
|
|
66,674
|
0,8000
|
0,8116
|
-0,070
|
0,0006
|
0,10
|
0,08
|
|
66,605
|
0,8500
|
0,8540
|
-0,076
|
0,0005
|
0,11
|
0,07
|
|
66,608
|
0,9000
|
0,8962
|
-0,081
|
0,0000
|
0,12
|
0,00
|
|
66,733
|
0,9500
|
0,9417
|
-0,073
|
-0,0011
|
0,11
|
0,11
|
|
67,130
|
1,0000
|
1,0000
|
0,000
|
0,0000
|
0,00
|
0,00
|
|
Средняя
ошибка
|
0,048
|
0,0004
|
0,07
|
0,16
|
Таблица 2.14. Коэффициенты распределения компонентов между
паровой и жидкой фазами в системе Б-ПФБ
|
xБ, мол. д.
|
yБ, мол. д.
|
xПФБ,
мол. д.
|
yПФБ,
мол. д.
|
KБ
|
KПФБ
|
|
0,0000
|
0,0000
|
1,0000
|
1,0000
|
-∞
|
1,0000
|
|
0,0500
|
0,0489
|
0,9500
|
0,9511
|
0,9775
|
1,0012
|
|
0,1000
|
0,0989
|
0,9000
|
0,9011
|
0,9890
|
1,0012
|
|
0,1500
|
0,1500
|
0,8500
|
0,8500
|
0,9997
|
1,0000
|
|
0,2000
|
0,2019
|
0,8000
|
0,7981
|
1,0096
|
0,9976
|
|
0,2500
|
0,2546
|
0,7500
|
0,7454
|
1,0185
|
0,9938
|
|
0,3000
|
0,3079
|
0,7000
|
0,6921
|
1,0263
|
0,9887
|
|
0,3500
|
0,3615
|
0,6500
|
0,6385
|
1,0327
|
0,9824
|
|
0,4000
|
0,4151
|
0,6000
|
0,5849
|
1,0378
|
0,9748
|
|
0,4500
|
0,4686
|
0,5500
|
0,5314
|
1,0413
|
0,9662
|
|
0,5000
|
0,5215
|
0,5000
|
0,4785
|
1,0431
|
0,9569
|
|
0,5500
|
0,5737
|
0,4500
|
0,4263
|
1,0431
|
0,9473
|
|
0,6000
|
0,6248
|
0,3752
|
1,0413
|
0,9381
|
|
0,6500
|
0,6744
|
0,3500
|
0,3256
|
1,0375
|
0,9303
|
|
0,7000
|
0,7223
|
0,3000
|
0,2777
|
1,0318
|
0,9257
|
|
0,7500
|
0,7683
|
0,2500
|
0,2317
|
1,0243
|
0,9270
|
|
0,8000
|
0,8122
|
0,2000
|
0,1878
|
1,0153
|
0,9388
|
|
0,8500
|
0,8545
|
0,1500
|
0,1455
|
1,0053
|
0,9698
|
|
0,9000
|
0,8962
|
0,1000
|
0,1038
|
0,9958
|
1,0381
|
|
0,9500
|
0,9406
|
0,0500
|
0,0594
|
0,9901
|
1,1884
|
|
1,0000
|
1,0000
|
0,0000
|
0,0000
|
1,0000
|
+∞
|
По результатам вычислительного эксперимента нами установлено,
что при давлении 500 мм рт. ст. система бензол - перфторбензол является
биазеотропной (имеются положительный и отрицательный азеотропы) с содержанием
0,8750 мол. д. и 0,1620 мол. д. бензола и T=66,52°С и Т=67,93°С,
соответственно. В [30] приведены следующие характеристики азеотропов:
положительный - Т=66,80°С, содержание бензола 0,8200 мол. д., отрицательный -
Т=68,00°С, содержание бензола 0,2000 мол. д.
Система метилэтилкетон - перфторбензол
Для бинарной составляющей метилэтилкетон - перфторбензол
экспериментальные данные по фазовому равновесию жидкость-пар при давлении 500
мм рт. ст. в литературе отсутствуют, поэтому для оценки малых параметров
уравнения Вильсона (табл. 2.19) нами использован полный массив
псевдоэкспериментальных данных (UNIFAC) по ПЖР (с включением точек азеотропов).
Таблица 2.15. Описание ПЖР при P = 500 мм рт. ст. в
системе МЭК (1) - ПФБ (2) моделью Вильсона
|
Псевдоэкспериментальные
данные (UNIFAC)
|
ДТ,°С
|
Дy1,
мол. д.
|
Относительная
ошибка
|
|
T,°C
|
x1,
мол. д.
|
y1,
мол. д.
|
|
|
∆Tr, %
|
∆y1r, %
|
|
67,849
|
0,0000
|
0,0000
|
0,000
|
0,0000
|
0,00
|
0,00
|
|
68,039
|
0,0500
|
0,0439
|
-0,148
|
0,0016
|
0,22
|
3,66
|
|
68,219
|
0,1000
|
0,0892
|
-0,167
|
-0,0018
|
0,25
|
2,09
|
|
68,388
|
0,1500
|
0,1360
|
-0,134
|
-0,0047
|
0,20
|
3,56
|
|
68,543
|
0,2000
|
0,1842
|
-0,082
|
-0,0056
|
0,12
|
3,15
|
|
68,681
|
0,2500
|
0,2340
|
-0,034
|
-0,0047
|
0,05
|
2,05
|
|
68,801
|
0,3000
|
0,2852
|
-0,003
|
-0,0024
|
0,00
|
0,85
|
|
68,897
|
0,3500
|
0,3377
|
0,008
|
0,0007
|
0,01
|
0,21
|
|
68,967
|
0,4000
|
0,3915
|
-0,007
|
0,0040
|
0,01
|
1,00
|
|
69,007
|
0,4500
|
0,4464
|
-0,042
|
0,0068
|
0,06
|
1,51
|
|
69,013
|
0,5000
|
0,5020
|
-0,094
|
0,0089
|
0,14
|
1,74
|
|
68,980
|
0,5500
|
0,5582
|
-0,156
|
0,0099
|
0,23
|
1,74
|
|
68,903
|
0,6000
|
0,6145
|
-0,219
|
0,0097
|
0,32
|
1,55
|
|
68,778
|
0,6500
|
0,6705
|
-0,276
|
0,0082
|
0,40
|
1,22
|
|
68,602
|
0,7000
|
0,7255
|
-0,319
|
0,0060
|
0,47
|
0,81
|
|
68,371
|
0,7500
|
0,7791
|
-0,340
|
0,0030
|
0,50
|
0,39
|
|
68,084
|
0,8000
|
0,8305
|
-0,333
|
0,0000
|
0,49
|
0,01
|
|
67,740
|
0,8500
|
0,8790
|
-0,295
|
-0,0024
|
0,44
|
0,27
|
|
67,343
|
0,9000
|
0,9238
|
-0,225
|
-0,0036
|
0,33
|
0,40
|
|
66,899
|
0,9500
|
0,9644
|
-0,124
|
-0,0031
|
0,19
|
0,32
|
|
66,417
|
1,0000
|
1,0000
|
0,000
|
0,0000
|
0,00
|
0,00
|
|
Средняя
ошибка
|
0,143
|
0,0041
|
0,21
|
1,33
|
Таблица 2.16. Коэффициенты распределения компонентов между
паровой и жидкой фазами в системе МЭК-ПФБ
|
xМЭК,
мол. д.
|
yМЭК,
мол. д.
|
xПФБ,
мол. д.
|
yПФБ,
мол. д.
|
KМЭК
|
KПФБ
|
|
0,0000
|
0,0000
|
1,0000
|
1,0000
|
-∞
|
1,000
|
|
0,0050
|
0,0052
|
0,9950
|
0,9948
|
1,032
|
1,000
|
|
0,0100
|
0,0101
|
0,9900
|
0,9899
|
1,011
|
1,000
|
|
0,0150
|
0,0149
|
0,9850
|
0,9851
|
0,992
|
1,000
|
|
0,0200
|
0,0195
|
0,9800
|
0,9805
|
0,975
|
1,001
|
|
0,0250
|
0,0240
|
0,9750
|
0,9760
|
0,961
|
1,001
|
|
0,0300
|
0,0284
|
0,9700
|
0,9716
|
0,948
|
1,002
|
|
0,0350
|
0,0328
|
0,9650
|
0,9672
|
0,937
|
1,002
|
|
0,0400
|
0,0371
|
0,9600
|
0,9629
|
0,927
|
1,003
|
|
0,0450
|
0,0413
|
0,9550
|
0,9587
|
0,918
|
1,004
|
|
0,0500
|
0,0455
|
0,9500
|
0,9545
|
0,911
|
1,005
|
|
0,0550
|
0,0497
|
0,9450
|
0,9503
|
0,904
|
1,006
|
|
0,0600
|
0,0539
|
0,9400
|
0,9461
|
0,898
|
1,007
|
|
0,0650
|
0,0580
|
0,9350
|
0,9420
|
0,893
|
1,007
|
|
0,0700
|
0,0622
|
0,9300
|
0,9378
|
0,889
|
1,008
|
|
0,0750
|
0,0664
|
0,9250
|
0,9336
|
0,885
|
1,009
|
|
0,0800
|
0,0705
|
0,9200
|
0,9295
|
0,882
|
1,010
|
|
0,0850
|
0,0747
|
0,9150
|
0,9253
|
0,879
|
1,011
|
|
0,0900
|
0,0789
|
0,9100
|
0,9211
|
0,877
|
1,012
|
|
0,0950
|
0,0831
|
0,9050
|
0,9169
|
0,875
|
1,013
|
|
0,1000
|
0,0874
|
0,9000
|
0,9126
|
0,874
|
1,014
|
|
0,1500
|
0,8500
|
0,8687
|
0,875
|
1,022
|
|
0,2000
|
0,1786
|
0,8000
|
0,8214
|
0,893
|
1,027
|
|
0,2500
|
0,2293
|
0,7500
|
0,7707
|
0,917
|
1,028
|
|
0,3000
|
0,2828
|
0,7000
|
0,7172
|
0,943
|
1,025
|
|
0,3500
|
0,3384
|
0,6500
|
0,6616
|
0,967
|
1,018
|
|
0,4000
|
0,3955
|
0,6000
|
0,6045
|
0,989
|
1,008
|
|
0,4500
|
0,4532
|
0,5500
|
0,5468
|
1,007
|
0,994
|
|
0,5000
|
0,5109
|
0,5000
|
0,4891
|
1,022
|
0,978
|
|
0,5500
|
0,5681
|
0,4500
|
0,4319
|
1,033
|
0,960
|
|
0,6000
|
0,6242
|
0,4000
|
0,3758
|
1,040
|
0,940
|
|
0,6500
|
0,6787
|
0,3500
|
0,3213
|
1,044
|
0,918
|
|
0,7000
|
0,7315
|
0,3000
|
0,2685
|
1,045
|
0,895
|
|
0,7500
|
0,7821
|
0,2500
|
0,2179
|
1,043
|
0,871
|
|
0,8000
|
0,8305
|
0,2000
|
0,1695
|
1,038
|
0,847
|
|
0,8500
|
0,8766
|
0,1500
|
0,1234
|
1,031
|
0,823
|
|
0,9000
|
0,9202
|
0,1000
|
0,0798
|
1,022
|
0,798
|
|
0,9500
|
0,9613
|
0,0500
|
0,0387
|
1,012
|
0,774
|
|
1,0000
|
1,0000
|
0,0000
|
0,0000
|
1,000
|
+∞
|
По результатам вычислительного эксперимента сделан вывод, что
при давлении 500 мм рт. ст. система метилэтилкетон - перфторбензол является
биазеотропной (положительный азеотроп: T=67,840°C, xМЭК=0,0145 мол. д.;
отрицательный азеотроп: T=68,970°C, xМЭК=0,4300 мол. д).
Система метилэтилкетон - бензол
Так как для системы метилэтилкетон - бензол экспериментальные
данные по фазовому равновесию жидкость-пар при давлении 500 мм рт. ст. в
литературе отсутствуют, для оценки малых параметров уравнения Вильсона (табл.
2.19), с использованием которых в дальнейшем смоделировано парожидкостное
равновесие исследуемой системы, нами использован полный массив
псевдоэкспериментальных данных (UNIFAC) по ПЖР (с включением точек азеотропов).
В таблице 2.17 приведены псевдоэкспериментальные данные, а
также отклонения при описании и относительные ошибки. На рис. 2.24 и рис. 2.25
представлены фазовые диаграммы жидкость-пар для данной бинарной системы.
Таблица 2.17. Описание ПЖР при P = 500 мм рт. ст. в
системе МЭК (1) - Б (2) моделью Вильсона
|
Псевдоэкспериментальные
данные (UNIFAC)
|
Абсолютная
ошибка
|
Относительная
ошибка
|
|
T,°C
|
x1,
мол. д.
|
y1,
мол. д.
|
∆T,°C
|
∆y1,
мол. д.
|
∆Tr, %
|
∆y1r, %
|
|
67,130
|
0,0000
|
0,0000
|
0,000
|
0,0000
|
0,00
|
0,00
|
|
66,769
|
0,0500
|
0,0609
|
0,011
|
-0,0003
|
0,02
|
0,55
|
|
66,461
|
0,1000
|
0,1181
|
0,02
|
-0,0006
|
0,03
|
0,51
|
|
66,199
|
0,1500
|
0,1720
|
0,029
|
-0,0007
|
0,04
|
0,44
|
|
65,979
|
0,2000
|
0,2235
|
0,036
|
-0,0008
|
0,06
|
0,38
|
|
65,796
|
0,2500
|
0,2729
|
0,042
|
-0,0008
|
0,06
|
0,30
|
|
65,647
|
0,3000
|
0,3208
|
0,048
|
-0,0007
|
0,07
|
0,23
|
|
65,530
|
0,3500
|
0,3675
|
0,051
|
-0,0006
|
0,08
|
0,16
|
|
65,442
|
0,4000
|
0,4134
|
0,054
|
-0,0004
|
0,08
|
0,09
|
|
65,382
|
0,4500
|
0,4587
|
0,055
|
-0,0001
|
0,08
|
0,03
|
|
65,349
|
0,5000
|
0,5039
|
0,055
|
0,0000
|
0,08
|
0,02
|
|
65,341
|
0,5500
|
0,5491
|
0,054
|
0,0003
|
0,08
|
0,06
|
|
65,359
|
0,6000
|
0,5946
|
0,051
|
0,0005
|
0,08
|
0,09
|
|
65,401
|
0,6500
|
0,6407
|
0,048
|
0,0007
|
0,07
|
0,11
|
|
65,469
|
0,7000
|
0,6876
|
0,043
|
0,0008
|
0,07
|
0,12
|
|
65,562
|
0,7500
|
0,7356
|
0,037
|
0,0008
|
0,06
|
0,12
|
|
65,680
|
0,8000
|
0,7848
|
0,031
|
0,0009
|
0,05
|
0,10
|
|
65,824
|
0,8500
|
0,8357
|
0,023
|
0,0007
|
0,04
|
0,08
|
|
65,994
|
0,9000
|
0,8883
|
0,016
|
0,0005
|
0,02
|
0,06
|
|
66,191
|
0,9500
|
0,9430
|
0,008
|
0,0003
|
0,01
|
0,03
|
|
66,417
|
1,0000
|
1,0000
|
0,000
|
0,0000
|
0,00
|
0,00
|
|
Средняя ошибка
|
0,034
|
0,0005
|
0,05
|
0,17
|
На основе полученного массива данных по ПЖР с целью
локализации азеотропа проведен расчет коэффициентов распределения компонентов
между паровой и жидкой фазами (табл. 2.18), построена диаграмма КМЭК,
КБ = f(xМЭК) системы МЭК-Б при P = 500 мм рт. ст. (рис. 2.26).
Таблица 2.18. Коэффициенты распределения компонентов между
паровой и жидкой фазами в системе МЭК-Б
|
xМЭК, мол. д.
|
yМЭК,
мол. д.
|
xБ, мол. д.
|
yБ, мол. д.
|
KМЭК
|
KБ
|
|
0,0000
|
0,0000
|
1,0000
|
1,0000
|
-∞
|
1,0000
|
|
0,0500
|
0,0606
|
0,9500
|
0,9394
|
1,2121
|
0,9888
|
|
0,1000
|
0,1175
|
0,9000
|
0,8825
|
1,1746
|
0,9806
|
|
0,1500
|
0,1713
|
0,8500
|
0,8287
|
1,1418
|
0,9750
|
|
0,2000
|
0,2227
|
0,8000
|
0,7773
|
1,1133
|
0,9717
|
|
0,2500
|
0,2721
|
0,7500
|
0,7279
|
1,0885
|
0,9705
|
|
0,3000
|
0,3201
|
0,7000
|
0,6799
|
1,0669
|
0,9713
|
|
0,3500
|
0,3669
|
0,6500
|
0,6331
|
1,0483
|
0,9740
|
|
0,4000
|
0,4130
|
0,6000
|
0,5870
|
1,0325
|
0,9784
|
|
0,4500
|
0,4586
|
0,5500
|
0,5414
|
1,0190
|
0,9844
|
|
0,5000
|
0,5039
|
0,5000
|
0,4961
|
1,0079
|
0,9921
|
|
0,5500
|
0,5494
|
0,4500
|
0,9989
|
1,0014
|
|
0,6000
|
0,5951
|
0,4000
|
0,4049
|
0,9918
|
1,0122
|
|
0,6500
|
0,6414
|
0,3500
|
0,3586
|
0,9867
|
1,0247
|
|
0,7000
|
0,6884
|
0,3000
|
0,3116
|
0,9834
|
1,0387
|
|
0,7500
|
0,7364
|
0,2500
|
0,2636
|
0,9819
|
1,0544
|
|
0,8000
|
0,7857
|
0,2000
|
0,2143
|
0,9821
|
1,0717
|
|
0,8500
|
0,8364
|
0,1500
|
0,1636
|
0,9840
|
1,0908
|
|
0,9000
|
0,8888
|
0,1000
|
0,1112
|
0,9876
|
1,1117
|
|
0,9500
|
0,9433
|
0,0500
|
0,0567
|
0,9929
|
1,1345
|
|
1,0000
|
1,0000
|
0,0000
|
0,0000
|
1,0000
|
+∞
|
На основе полученных результатов можно сделать вывод, что при
давлении 500 мм рт. ст. система метилэтилкетон - бензол является
моноазеотропной (положительный азеотроп: T=65,395°C, xМЭК=0,5420 мол. д.).
Для расчета парожидкостного равновесия в системе бензол -
перфторбензол - метилэтилкетон выбрали уравнение Вильсона с допущенного
идеального поведения паровой фазы. Выбор исходных составов жидкой фазы для
моделирования ПЖР проводили по методу секущих и сечений. Параметры, оцененные
нами, приведены в таблице 2.19.
Таблица 2.19. Малые параметры уравнения Вильсона для бинарных
составляющих системы Б-ПФБ-МЭК (при 500 мм рт. ст.)
|
1
|
2
|
Параметры
уравнения Вильсона
|
|
|
л12
|
л21
|
|
Б
|
ПФБ
|
-443,221
|
1166,336
|
|
МЭК
|
Б
|
171,631
|
-33,022
|
|
МЭК
|
ПФБ
|
1526,797
|
-914,356
|
С использованием обширного вычислительного эксперимента
(рассчитаны 200 точек) получены полные данные по ПЖР в системе Б-ПФБ-МЭК (табл.
2.20).
Таблица 2.20. Данные по ПЖР при P = 500 мм рт. ст. и
коэффициенты распределения компонентов между паровой и жидкой фазами в системе
Б-ПФБ-МЭК
|
xБ, мол. д.
|
xПФБ, мол. д.
|
xМЭК, мол. д.
|
yБ, мол. д.
|
yПФБ, мол. д.
|
yМЭК, мол. д.
|
T,°C
|
KБ
|
KПФБ
|
KМЭК
|
|
0,0020
|
0,9970
|
0,0010
|
0,0019
|
0,9970
|
0,0010
|
67,850
|
0,9614
|
1,0000
|
1,0414
|
|
0,0040
|
0,9950
|
0,0010
|
0,0038
|
0,9951
|
0,0010
|
67,852
|
0,9619
|
1,0001
|
1,0321
|
|
0,0060
|
0,9930
|
0,0010
|
0,0058
|
0,9932
|
0,0010
|
67,854
|
0,9625
|
1,0002
|
1,0229
|
|
0,0080
|
0,9910
|
0,0010
|
0,0077
|
0,9913
|
0,0010
|
67,856
|
0,9630
|
1,0003
|
1,0140
|
|
0,0100
|
0,9890
|
0,0010
|
0,0096
|
0,9894
|
0,0010
|
67,858
|
0,9636
|
1,0004
|
1,0051
|
|
0,0120
|
0,9870
|
0,0010
|
0,0116
|
0,9874
|
0,0010
|
67,860
|
0,9641
|
1,0004
|
0,9965
|
|
0,0100
|
0,9880
|
0,0020
|
0,0096
|
0,9884
|
0,0020
|
67,858
|
0,9594
|
1,0004
|
1,0011
|
|
0,0120
|
0,9860
|
0,0020
|
0,0115
|
0,9865
|
0,0020
|
67,861
|
0,9600
|
1,0005
|
0,9926
|
|
0,0140
|
0,9840
|
0,0020
|
0,0134
|
0,9846
|
0,0020
|
67,863
|
0,9606
|
1,0006
|
0,9843
|
|
0,0160
|
0,9820
|
0,0020
|
0,0154
|
0,9827
|
0,0020
|
67,865
|
0,9612
|
1,0007
|
0,9760
|
|
0,0020
|
0,9930
|
0,0050
|
0,0019
|
0,9930
|
0,0051
|
67,846
|
0,9444
|
1,0000
|
1,0231
|
|
0,0030
|
0,9920
|
0,0050
|
0,0028
|
0,9921
|
0,0051
|
67,848
|
0,9448
|
1,0001
|
1,0188
|
|
0,0040
|
0,9910
|
0,0050
|
0,0038
|
0,9911
|
0,0051
|
67,849
|
0,9452
|
1,0001
|
1,0145
|
|
0,0050
|
0,9900
|
0,0050
|
0,0047
|
0,9902
|
0,0051
|
67,851
|
0,9456
|
1,0002
|
1,0103
|
|
0,0070
|
0,9880
|
0,0050
|
0,0066
|
0,9884
|
0,0050
|
67,854
|
0,9463
|
1,0004
|
1,0019
|
|
0,0080
|
0,9870
|
0,0050
|
0,0076
|
0,9874
|
0,0050
|
67,856
|
0,9467
|
1,0004
|
0,9978
|
|
0,0100
|
0,9850
|
0,0050
|
0,0095
|
0,9856
|
0,0049
|
67,859
|
0,9474
|
1,0006
|
0,9896
|
|
0,0010
|
0,9890
|
0,0100
|
0,0009
|
0,9890
|
0,0101
|
67,842
|
0,9283
|
1,0000
|
1,0106
|
|
0,0020
|
0,9880
|
0,0100
|
0,0019
|
0,9881
|
0,0100
|
67,844
|
0,9251
|
1,0001
|
1,0027
|
|
0,0040
|
0,9860
|
0,0100
|
0,0037
|
0,9863
|
0,0099
|
67,849
|
0,9261
|
1,0004
|
0,9949
|
|
0,0060
|
0,9840
|
0,0100
|
0,0056
|
0,9846
|
0,0099
|
67,853
|
0,9270
|
1,0006
|
0,9873
|
|
0,0100
|
0,9800
|
0,0100
|
0,0093
|
0,9810
|
0,0097
|
67,861
|
0,929
|
1,001
|
0,972
|
|
0,0200
|
0,9700
|
0,0100
|
0,0187
|
0,9720
|
0,0094
|
67,880
|
0,934
|
1,002
|
0,937
|
|
0,0990
|
0,8910
|
0,0100
|
0,0955
|
0,8972
|
0,0073
|
67,993
|
0,965
|
1,007
|
0,730
|
|
0,1980
|
0,7920
|
0,0100
|
0,1972
|
0,7971
|
0,0057
|
68,045
|
0,996
|
1,006
|
0,574
|
|
0,2970
|
0,6930
|
0,0100
|
0,3027
|
0,6925
|
0,0048
|
68,006
|
1,019
|
0,999
|
0,477
|
|
0,3960
|
0,5940
|
0,4102
|
0,5857
|
0,0041
|
67,878
|
1,036
|
0,986
|
0,412
|
|
0,4950
|
0,4950
|
0,0100
|
0,5173
|
0,4790
|
0,0037
|
67,666
|
1,045
|
0,968
|
0,369
|
|
0,5940
|
0,3960
|
0,0100
|
0,6216
|
0,3750
|
0,0034
|
67,387
|
1,046
|
0,947
|
0,345
|
|
0,6930
|
0,2970
|
0,0100
|
0,7204
|
0,2761
|
0,0034
|
67,077
|
1,040
|
0,930
|
0,341
|
|
0,7920
|
0,1980
|
0,0100
|
0,8118
|
0,1844
|
0,0038
|
66,803
|
1,025
|
0,931
|
0,375
|
|
0,8910
|
0,0990
|
0,0100
|
0,8963
|
0,0986
|
0,0051
|
66,696
|
1,006
|
0,996
|
0,512
|
|
0,9200
|
0,0700
|
0,0100
|
0,9208
|
0,0731
|
0,0061
|
66,729
|
1,001
|
1,045
|
0,607
|
|
0,9500
|
0,0400
|
0,0100
|
0,9473
|
0,0450
|
0,0077
|
66,815
|
0,997
|
1,125
|
0,772
|
|
0,9800
|
0,0100
|
0,0100
|
0,9766
|
0,0126
|
0,0108
|
66,977
|
0,997
|
1,259
|
1,082
|
|
0,0985
|
0,8865
|
0,0150
|
0,0940
|
0,8950
|
0,0110
|
68,030
|
0,954
|
1,010
|
0,733
|
|
0,1970
|
0,7880
|
0,0150
|
0,1949
|
0,7963
|
0,0088
|
68,107
|
0,989
|
1,011
|
0,586
|
|
0,2955
|
0,6895
|
0,0150
|
0,3002
|
0,6924
|
0,0074
|
68,087
|
1,016
|
1,004
|
0,492
|
|
0,3940
|
0,5910
|
0,0150
|
0,4077
|
0,5858
|
0,0064
|
67,972
|
1,035
|
0,991
|
0,430
|
|
0,4925
|
0,4925
|
0,0150
|
0,5152
|
0,4790
|
0,0058
|
67,769
|
1,046
|
0,973
|
0,388
|
|
0,5910
|
0,3940
|
0,0150
|
0,6199
|
0,3746
|
0,0055
|
67,496
|
1,049
|
0,951
|
0,366
|
|
0,6895
|
0,2955
|
0,0150
|
0,7194
|
0,2751
|
0,0055
|
67,185
|
1,043
|
0,931
|
0,365
|
|
0,7880
|
0,1970
|
0,0150
|
0,8113
|
0,1826
|
0,0061
|
66,904
|
1,030
|
0,927
|
0,404
|
|
0,8865
|
0,0985
|
0,0150
|
0,8957
|
0,0961
|
0,0082
|
66,775
|
1,010
|
0,976
|
0,547
|
|
0,9200
|
0,0650
|
0,0150
|
0,9236
|
0,0665
|
0,0099
|
66,800
|
1,004
|
1,023
|
0,663
|
|
0,0980
|
0,8820
|
0,0200
|
0,0925
|
0,8927
|
0,0147
|
68,067
|
0,944
|
1,012
|
0,737
|
|
0,1960
|
0,7840
|
0,0200
|
0,1927
|
0,7953
|
0,0120
|
68,169
|
0,983
|
1,014
|
0,598
|
|
0,2940
|
0,6860
|
0,0200
|
0,2978
|
0,6921
|
0,0102
|
68,166
|
1,013
|
1,009
|
0,508
|
|
0,3920
|
0,5880
|
0,0200
|
0,4053
|
0,5857
|
0,0089
|
68,066
|
1,034
|
0,996
|
0,447
|
|
0,4900
|
0,4900
|
0,0200
|
0,5130
|
0,4788
|
0,0082
|
67,873
|
1,047
|
0,977
|
0,408
|
|
0,5880
|
0,3920
|
0,0200
|
0,6183
|
0,3740
|
0,0077
|
67,605
|
1,051
|
0,954
|
0,387
|
|
0,6860
|
0,2940
|
0,0200
|
0,7182
|
0,2740
|
0,0078
|
67,294
|
1,047
|
0,932
|
0,389
|
|
0,7840
|
0,1960
|
0,0200
|
0,8106
|
0,1808
|
0,0086
|
67,005
|
1,034
|
0,922
|
0,432
|
|
0,8200
|
0,1600
|
0,0200
|
0,8424
|
0,1483
|
0,0093
|
66,925
|
1,027
|
0,927
|
0,467
|
|
0,8820
|
0,0980
|
0,0200
|
0,8946
|
0,0937
|
0,0116
|
66,850
|
1,014
|
0,957
|
0,581
|
|
0,9200
|
0,0600
|
0,0200
|
0,9257
|
0,0600
|
0,0143
|
66,860
|
1,006
|
1,000
|
0,717
|
|
0,9700
|
0,0100
|
0,0200
|
0,9668
|
0,0112
|
0,0220
|
66,955
|
0,997
|
1,116
|
1,102
|
|
0,0970
|
0,8730
|
0,0300
|
0,0898
|
0,8878
|
0,0224
|
68,139
|
0,926
|
1,017
|
0,746
|
|
0,1940
|
0,7760
|
0,0300
|
0,1886
|
0,7928
|
0,0186
|
68,289
|
0,972
|
1,022
|
0,621
|
|
0,2910
|
0,6790
|
0,0300
|
0,2930
|
0,6908
|
0,0161
|
68,324
|
1,007
|
1,017
|
0,538
|
|
0,3880
|
0,5820
|
0,0300
|
0,4006
|
0,5849
|
0,0145
|
68,252
|
1,032
|
1,005
|
0,482
|
|
0,4850
|
0,4850
|
0,0300
|
0,4778
|
0,0134
|
68,080
|
1,049
|
0,985
|
0,447
|
|
0,5820
|
0,3880
|
0,0300
|
0,6147
|
0,3724
|
0,0129
|
67,822
|
1,056
|
0,960
|
0,430
|
|
0,6790
|
0,2910
|
0,0300
|
0,7156
|
0,2713
|
0,0131
|
67,511
|
1,054
|
0,932
|
0,437
|
|
0,7760
|
0,1940
|
0,0300
|
0,8085
|
0,1769
|
0,0146
|
67,201
|
1,042
|
0,912
|
0,487
|
|
0,8730
|
0,0970
|
0,0300
|
0,8915
|
0,0893
|
0,0193
|
66,985
|
1,021
|
0,920
|
0,642
|
|
0,9200
|
0,0500
|
0,0300
|
0,9278
|
0,0476
|
0,0246
|
66,941
|
1,008
|
0,951
|
0,821
|
|
0,9600
|
0,0100
|
0,0300
|
0,9565
|
0,0101
|
0,0335
|
66,922
|
0,996
|
1,006
|
1,116
|
|
0,0950
|
0,8550
|
0,0500
|
0,0851
|
0,8767
|
0,0382
|
68,278
|
0,896
|
1,025
|
0,764
|
|
0,1900
|
0,7600
|
0,0500
|
0,1810
|
0,7857
|
0,0333
|
68,517
|
0,953
|
1,034
|
0,665
|
|
0,2850
|
0,6650
|
0,0500
|
0,2841
|
0,6861
|
0,0299
|
68,625
|
0,997
|
1,032
|
0,597
|
|
0,3800
|
0,5700
|
0,0500
|
0,3913
|
0,5811
|
0,0276
|
68,610
|
1,030
|
1,019
|
0,551
|
|
0,4750
|
0,4750
|
0,0500
|
0,5000
|
0,4739
|
0,0262
|
68,479
|
1,053
|
0,998
|
0,523
|
|
0,5700
|
0,3800
|
0,0500
|
0,6069
|
0,3674
|
0,0257
|
68,241
|
1,065
|
0,967
|
0,514
|
|
0,6650
|
0,2850
|
0,0500
|
0,7087
|
0,2648
|
0,0265
|
67,919
|
1,066
|
0,929
|
0,531
|
|
0,7600
|
0,1900
|
0,0500
|
0,8016
|
0,1689
|
0,0295
|
67,554
|
1,055
|
0,889
|
0,590
|
|
0,8550
|
0,0950
|
0,0500
|
0,8813
|
0,0814
|
0,0373
|
67,194
|
1,031
|
0,857
|
0,746
|
|
0,9000
|
0,0500
|
0,0500
|
0,9126
|
0,0425
|
0,0450
|
67,025
|
1,014
|
0,849
|
0,900
|
|
0,9400
|
0,0100
|
0,0500
|
0,9349
|
0,0085
|
0,0566
|
66,840
|
0,995
|
0,851
|
1,131
|
|
0,0900
|
0,8100
|
0,1000
|
0,0761
|
0,8427
|
0,0812
|
68,598
|
0,846
|
1,040
|
0,812
|
|
0,1800
|
0,7200
|
0,1000
|
0,1653
|
0,7583
|
0,0765
|
69,003
|
0,918
|
1,053
|
0,765
|
|
0,2700
|
0,6300
|
0,1000
|
0,2638
|
0,6632
|
0,0730
|
69,260
|
0,977
|
1,053
|
0,730
|
|
0,3600
|
0,5400
|
0,1000
|
0,3684
|
0,5608
|
0,0709
|
69,362
|
1,023
|
1,038
|
0,709
|
|
0,4500
|
0,4500
|
0,1000
|
0,4757
|
0,4543
|
0,0700
|
69,305
|
1,057
|
1,010
|
0,700
|
|
0,5400
|
0,3600
|
0,1000
|
0,5819
|
0,3475
|
0,0706
|
69,082
|
1,078
|
0,965
|
0,706
|
|
0,6300
|
0,2700
|
0,1000
|
0,6823
|
0,2443
|
0,0734
|
68,693
|
1,083
|
0,905
|
0,734
|
|
0,7200
|
0,1800
|
0,1000
|
0,7713
|
0,1491
|
0,0796
|
68,139
|
1,071
|
0,828
|
0,796
|
|
0,8100
|
0,0900
|
0,1000
|
0,8417
|
0,0663
|
0,0919
|
67,423
|
1,039
|
0,737
|
0,919
|
|
0,8500
|
0,0500
|
0,1000
|
0,8645
|
0,0346
|
0,1009
|
67,043
|
1,017
|
0,692
|
1,009
|
|
0,8900
|
0,0100
|
0,1000
|
0,8800
|
0,0064
|
0,1135
|
66,604
|
0,989
|
0,643
|
1,135
|
|
0,0850
|
0,7650
|
0,1500
|
0,0697
|
0,8013
|
0,1291
|
68,874
|
0,819
|
1,047
|
0,861
|
|
0,1700
|
0,6800
|
0,1500
|
0,1524
|
0,7204
|
0,1272
|
69,365
|
0,897
|
1,059
|
0,848
|
|
0,2550
|
0,5950
|
0,1500
|
0,2453
|
0,6287
|
0,1260
|
69,701
|
0,962
|
1,057
|
0,840
|
|
0,3400
|
0,5100
|
0,1500
|
0,3450
|
0,5293
|
0,1257
|
69,862
|
1,015
|
1,038
|
0,838
|
|
0,4250
|
0,4250
|
0,1500
|
0,4481
|
0,4254
|
0,1265
|
69,825
|
1,054
|
1,001
|
0,843
|
|
0,5100
|
0,3400
|
0,1500
|
0,5501
|
0,3212
|
0,1287
|
69,571
|
1,079
|
0,945
|
0,858
|
|
0,5950
|
0,2550
|
0,1500
|
0,6457
|
0,1329
|
69,084
|
1,085
|
0,868
|
0,886
|
|
0,6800
|
0,1700
|
0,1500
|
0,7289
|
0,1312
|
0,1399
|
68,357
|
1,072
|
0,772
|
0,933
|
|
0,7650
|
0,0850
|
0,1500
|
0,7926
|
0,0558
|
0,1516
|
67,397
|
1,036
|
0,657
|
1,011
|
|
0,0800
|
0,7200
|
0,2000
|
0,0645
|
0,7544
|
0,1810
|
69,094
|
0,807
|
1,048
|
0,905
|
|
0,1600
|
0,6400
|
0,2000
|
0,1413
|
0,6756
|
0,1831
|
69,605
|
0,883
|
1,056
|
0,915
|
|
0,2400
|
0,5600
|
0,2000
|
0,2279
|
0,5870
|
0,1851
|
69,958
|
0,950
|
1,048
|
0,926
|
|
0,3200
|
0,4800
|
0,2000
|
0,3214
|
0,4912
|
0,1874
|
70,120
|
1,004
|
1,023
|
0,937
|
|
0,4000
|
0,4000
|
0,2000
|
0,4183
|
0,3916
|
0,1901
|
70,061
|
1,046
|
0,979
|
0,951
|
|
0,4800
|
0,3200
|
0,2000
|
0,5140
|
0,2925
|
0,1934
|
69,754
|
1,071
|
0,914
|
0,967
|
|
0,5600
|
0,2400
|
0,2000
|
0,6035
|
0,1988
|
0,1976
|
69,180
|
1,078
|
0,828
|
0,988
|
|
0,6400
|
0,1600
|
0,2000
|
0,6810
|
0,1157
|
0,2032
|
68,336
|
1,064
|
0,723
|
1,016
|
|
0,7200
|
0,0800
|
0,2000
|
0,7407
|
0,0482
|
0,2111
|
67,253
|
1,029
|
0,602
|
1,055
|
|
0,0750
|
0,6750
|
0,2500
|
0,0602
|
0,7037
|
0,2361
|
69,251
|
0,802
|
1,043
|
0,945
|
|
0,1500
|
0,6000
|
0,2500
|
0,1313
|
0,6266
|
0,2420
|
69,734
|
0,876
|
1,044
|
0,968
|
|
0,2250
|
0,5250
|
0,2500
|
0,2115
|
0,5412
|
0,2473
|
70,056
|
0,940
|
1,031
|
0,989
|
|
0,3000
|
0,4500
|
0,2500
|
0,2980
|
0,4499
|
0,2520
|
70,182
|
0,993
|
1,000
|
1,008
|
|
0,3750
|
0,3750
|
0,2500
|
0,3877
|
0,3561
|
0,2562
|
70,077
|
1,034
|
0,950
|
1,025
|
|
0,4500
|
0,3000
|
0,2500
|
0,4763
|
0,2639
|
0,2598
|
69,715
|
1,058
|
0,880
|
1,039
|
|
0,5250
|
0,2250
|
0,2500
|
0,5593
|
0,1777
|
0,2630
|
69,080
|
1,065
|
0,790
|
1,052
|
|
0,6000
|
0,1500
|
0,2500
|
0,6317
|
0,1025
|
0,2658
|
68,180
|
1,053
|
0,683
|
1,063
|
|
0,6750
|
0,0750
|
0,2500
|
0,6891
|
0,0423
|
0,2686
|
67,063
|
1,021
|
0,565
|
1,074
|
|
0,0700
|
0,6300
|
0,3000
|
0,0563
|
0,6505
|
0,2933
|
69,343
|
0,804
|
1,032
|
0,978
|
|
0,1400
|
0,5600
|
0,3000
|
0,1221
|
0,5755
|
0,3024
|
69,766
|
0,872
|
1,028
|
1,008
|
|
0,2100
|
0,4900
|
0,3000
|
0,1958
|
0,4939
|
0,3103
|
70,029
|
0,932
|
1,008
|
1,034
|
|
0,2800
|
0,4200
|
0,3000
|
0,2752
|
0,4081
|
0,3168
|
70,096
|
0,983
|
0,972
|
1,056
|
|
0,3500
|
0,3500
|
0,3000
|
0,3573
|
0,3210
|
0,3217
|
69,938
|
1,021
|
0,917
|
1,072
|
|
0,4200
|
0,2800
|
0,3000
|
0,4386
|
0,2365
|
0,3249
|
69,531
|
1,044
|
0,845
|
1,083
|
|
0,4900
|
0,2100
|
0,3000
|
0,5152
|
0,1586
|
0,3262
|
68,865
|
1,051
|
0,755
|
1,087
|
|
0,5600
|
0,1400
|
0,3000
|
0,5831
|
0,0912
|
0,3257
|
67,958
|
1,041
|
0,652
|
1,086
|
|
0,6300
|
0,0700
|
0,3000
|
0,6388
|
0,0377
|
0,3235
|
66,863
|
1,014
|
0,539
|
1,078
|
|
0,0650
|
0,5850
|
0,3500
|
0,0526
|
0,5958
|
0,3516
|
69,371
|
0,809
|
1,018
|
1,005
|
|
0,1300
|
0,5200
|
0,3500
|
0,1133
|
0,5237
|
0,3630
|
69,716
|
0,872
|
1,007
|
1,037
|
|
0,1950
|
0,4550
|
0,3500
|
0,1808
|
0,4467
|
0,3725
|
69,905
|
0,927
|
0,982
|
1,064
|
|
0,2600
|
0,3900
|
0,3500
|
0,2531
|
0,3671
|
0,3798
|
69,908
|
0,973
|
0,941
|
1,085
|
|
0,3250
|
0,3250
|
0,3500
|
0,3278
|
0,2875
|
0,3847
|
69,699
|
1,009
|
0,885
|
1,099
|
|
0,3900
|
0,2600
|
0,3500
|
0,4019
|
0,2112
|
69,261
|
1,031
|
0,812
|
1,105
|
|
0,4550
|
0,1950
|
0,3500
|
0,4724
|
0,1415
|
0,3861
|
68,591
|
1,038
|
0,725
|
1,103
|
|
0,5200
|
0,1300
|
0,3500
|
0,5360
|
0,0816
|
0,3824
|
67,710
|
1,031
|
0,627
|
1,093
|
|
0,5850
|
0,0650
|
0,3500
|
0,5902
|
0,0340
|
0,3759
|
66,673
|
1,009
|
0,523
|
1,074
|
|
0,6400
|
0,0100
|
0,3500
|
0,6272
|
0,0043
|
0,3684
|
65,747
|
0,980
|
0,433
|
1,053
|
|
0,0600
|
0,5400
|
0,4000
|
0,0491
|
0,5408
|
0,4101
|
69,339
|
0,818
|
1,001
|
1,025
|
|
0,1200
|
0,4800
|
0,4000
|
0,1049
|
0,4724
|
0,4227
|
69,598
|
0,874
|
0,984
|
1,057
|
|
0,1800
|
0,4200
|
0,4000
|
0,1664
|
0,4008
|
0,4328
|
69,710
|
0,924
|
0,954
|
1,082
|
|
0,2400
|
0,3600
|
0,4000
|
0,2319
|
0,3279
|
0,4402
|
69,651
|
0,966
|
0,911
|
1,101
|
|
0,3000
|
0,3000
|
0,4000
|
0,2994
|
0,2561
|
0,4445
|
69,401
|
0,998
|
0,854
|
1,111
|
|
0,3600
|
0,2400
|
0,4000
|
0,3667
|
0,1879
|
0,4453
|
68,947
|
1,019
|
0,783
|
1,113
|
|
0,4200
|
0,1800
|
0,4000
|
0,4313
|
0,1261
|
0,4425
|
68,294
|
1,027
|
0,701
|
1,106
|
|
0,4800
|
0,1200
|
0,4000
|
0,4908
|
0,0732
|
0,4360
|
67,462
|
1,023
|
0,610
|
1,090
|
|
0,5400
|
0,0600
|
0,4000
|
0,5432
|
0,0308
|
0,4260
|
66,501
|
1,006
|
0,513
|
1,065
|
|
0,5900
|
0,0100
|
0,4000
|
0,5803
|
0,0043
|
0,4153
|
65,661
|
0,984
|
0,432
|
1,038
|
|
0,0500
|
0,4500
|
0,5000
|
0,0422
|
0,4324
|
0,5254
|
69,117
|
0,843
|
0,961
|
1,051
|
|
0,1000
|
0,4000
|
0,5000
|
0,0887
|
0,3740
|
0,5373
|
69,212
|
0,887
|
0,935
|
1,075
|
|
0,1500
|
0,3500
|
0,5000
|
0,1390
|
0,3148
|
0,5462
|
69,188
|
0,927
|
0,899
|
1,092
|
|
0,2000
|
0,3000
|
0,5000
|
0,1919
|
0,2563
|
0,5517
|
69,030
|
0,960
|
0,854
|
1,103
|
|
0,2500
|
0,2500
|
0,5000
|
0,2464
|
0,2000
|
0,5536
|
68,732
|
0,986
|
0,800
|
1,107
|
|
0,3000
|
0,2000
|
0,5000
|
0,3011
|
0,1474
|
0,5516
|
68,290
|
1,004
|
0,737
|
1,103
|
|
0,3500
|
0,1500
|
0,5000
|
0,3546
|
0,0999
|
0,5455
|
67,711
|
1,013
|
0,666
|
1,091
|
|
0,4000
|
0,1000
|
0,5000
|
0,4057
|
0,0590
|
0,5353
|
67,012
|
1,014
|
0,590
|
1,071
|
|
0,4500
|
0,0500
|
0,5000
|
0,4531
|
0,0255
|
0,5214
|
66,226
|
1,007
|
0,511
|
1,043
|
|
0,0400
|
0,3600
|
0,6000
|
0,0351
|
0,3297
|
0,6352
|
68,729
|
0,878
|
0,916
|
1,059
|
|
0,0800
|
0,3200
|
0,6000
|
0,0729
|
0,2835
|
0,6436
|
68,697
|
0,911
|
0,886
|
1,073
|
|
0,1200
|
0,2800
|
0,6000
|
0,1129
|
0,2380
|
0,6491
|
68,579
|
0,941
|
0,850
|
1,082
|
|
0,1600
|
0,2400
|
0,6000
|
0,1545
|
0,1939
|
0,6516
|
68,372
|
0,966
|
0,808
|
1,086
|
|
0,2000
|
0,2000
|
0,6000
|
0,1973
|
0,1520
|
0,6507
|
68,072
|
0,986
|
0,760
|
1,084
|
|
0,2400
|
0,1600
|
0,6000
|
0,2405
|
0,1131
|
0,6464
|
67,682
|
1,002
|
0,707
|
1,077
|
|
0,2800
|
0,1200
|
0,6000
|
0,2835
|
0,0780
|
0,6386
|
67,207
|
1,012
|
0,650
|
1,064
|
|
0,3200
|
0,0800
|
0,6000
|
0,3256
|
0,0471
|
0,6273
|
66,657
|
1,017
|
0,589
|
1,045
|
|
0,3600
|
0,0400
|
0,6000
|
0,3662
|
0,0210
|
0,6127
|
66,050
|
1,017
|
0,526
|
1,021
|
|
0,0300
|
0,2700
|
0,7000
|
0,0277
|
0,2348
|
0,7374
|
68,224
|
0,924
|
0,870
|
1,053
|
|
0,0600
|
0,2400
|
0,7000
|
0,0568
|
0,2018
|
0,7413
|
68,117
|
0,947
|
0,841
|
1,059
|
|
0,0900
|
0,2100
|
0,7000
|
0,0871
|
0,1698
|
0,7430
|
0,968
|
0,809
|
1,061
|
|
0,1200
|
0,1800
|
0,7000
|
0,1184
|
0,1392
|
0,7424
|
67,747
|
0,986
|
0,773
|
1,061
|
|
0,1500
|
0,1500
|
0,7000
|
0,1503
|
0,1102
|
0,7395
|
67,485
|
1,002
|
0,735
|
1,056
|
|
0,1800
|
0,1200
|
0,7000
|
0,1828
|
0,0832
|
0,7340
|
67,173
|
1,015
|
0,693
|
1,049
|
|
0,2100
|
0,0900
|
0,7000
|
0,2154
|
0,0585
|
0,7262
|
66,813
|
1,026
|
0,650
|
1,037
|
|
0,2400
|
0,0600
|
0,7000
|
0,2479
|
0,0362
|
0,7159
|
66,412
|
1,033
|
0,604
|
1,023
|
|
0,2700
|
0,0300
|
0,7000
|
0,2800
|
0,0167
|
0,7033
|
65,975
|
1,037
|
0,557
|
1,005
|
|
0,0200
|
0,1800
|
0,8000
|
0,0197
|
0,1486
|
0,8318
|
67,647
|
0,983
|
0,826
|
1,040
|
|
0,0400
|
0,1600
|
0,8000
|
0,0399
|
0,1284
|
0,8318
|
67,520
|
0,997
|
0,802
|
1,040
|
|
0,0600
|
0,1400
|
0,8000
|
0,0606
|
0,1088
|
0,8305
|
67,369
|
1,011
|
0,777
|
1,038
|
|
0,0800
|
0,1200
|
0,8000
|
0,0819
|
0,0902
|
0,8280
|
67,196
|
1,023
|
0,751
|
1,035
|
|
0,1000
|
0,1000
|
0,8000
|
0,1034
|
0,0724
|
0,8242
|
66,999
|
1,034
|
0,724
|
1,030
|
|
0,1200
|
0,0800
|
0,8000
|
0,1253
|
0,0556
|
0,8191
|
66,780
|
1,044
|
0,695
|
1,024
|
|
0,1400
|
0,0600
|
0,8000
|
0,1474
|
0,0399
|
0,8126
|
66,540
|
1,053
|
0,665
|
1,016
|
|
0,1600
|
0,0400
|
0,8000
|
0,1697
|
0,0254
|
0,8049
|
66,281
|
1,061
|
0,634
|
1,006
|
|
0,1800
|
0,0200
|
0,8000
|
0,1920
|
0,0121
|
0,7959
|
66,003
|
1,067
|
0,603
|
0,995
|
|
0,0100
|
0,0900
|
0,9000
|
0,0106
|
0,0707
|
0,9188
|
67,034
|
1,059
|
0,785
|
1,021
|
|
0,0200
|
0,0800
|
0,9000
|
0,0213
|
0,0617
|
0,9170
|
66,943
|
1,066
|
0,771
|
1,019
|
|
0,0300
|
0,0700
|
0,9000
|
0,0322
|
0,0530
|
0,9148
|
66,846
|
1,073
|
0,757
|
1,016
|
|
0,0400
|
0,0600
|
0,9000
|
0,0432
|
0,0446
|
0,9123
|
66,743
|
1,079
|
0,743
|
1,014
|
|
0,0500
|
0,0500
|
0,9000
|
0,0543
|
0,0364
|
0,9093
|
66,634
|
1,085
|
0,728
|
1,010
|
|
0,0600
|
0,0400
|
0,9000
|
0,0655
|
0,0285
|
0,9060
|
66,520
|
1,091
|
0,713
|
1,007
|
|
0,0700
|
0,0300
|
0,9000
|
0,0768
|
0,0209
|
0,9023
|
66,400
|
1,097
|
0,698
|
1,003
|
|
0,0800
|
0,0200
|
0,9000
|
0,0882
|
0,0136
|
0,8982
|
66,275
|
1,102
|
0,682
|
0,998
|
|
0,0900
|
0,0100
|
0,9000
|
0,0996
|
0,0067
|
0,8937
|
66,145
|
1,107
|
0,666
|
0,993
|
Полученные результаты нагляднее представить в
концентрационном треугольнике ходом характеристических изо-линий (Т=const, Кi=const). На рис. 2.27
показан общий ход изотермо-изобар при Р = 500 мм рт. ст. в системе бензол -
перфторбензол - метилэтилкетон. В концентрационном треугольнике также построены
единичные К-линии (рис. 2. 28), ход которых указывает на наличие двух тройных
азеотропов в системе Б-ПФБ-МЭК. Нами определены характеристики этих азеотропов:
тройной седловинный азеотроп - T=66,92°C, xБ=0,9550 мол. д., xМЭК=0,0300 мол. д.; тройной узловой азеотроп - T=70,18°C, xБ=0,3000 мол. д., xМЭК=0,2400 мол. д. На основе
этой информации получена структура диаграммы дистилляционных линий в данной
системе (рис. 2.29).
В соответствии с классификацией диаграмм различных типов
биазеотропных тройных смесей [8] нами установлен класс, тип и подтип структуры
диаграммы ПЖР изученной системы: 3. [2.2.1].2-31а. До настоящего времени ни
одной структуры диаграммы парожидкостного равновесия, относящейся к этому
классу, найдено не было.
.5
Эволюция структуры диаграммы системы бензол - перфторбензол - метилэтилкетон
при варьировании давления
В результате математического моделирования парожидкостного
равновесия в системе бензол - перфторбензол - метилэтилкетон нами выявлено, что
при давлении 760 мм рт. ст. структура диаграммы фазового равновесия относится к
классу 3. [2.1.1].2 по классификации биазеотропных тройных смесей [8], т.е.
трехкомпонентная система образована одной биазеотропной составляющей (Б-ПФБ) и
двумя моноазеотропными составляющими (МЭК-ПФБ и МЭК-Б) и содержит два тройных
азеотропа. При давлении 500 мм рт. ст. - к классу 3. [2.2.1].2, т.е. уже две
бинарные составляющие исследуемой системы (Б-ПФБ и МЭК-ПФБ) биазеотропны и одна
(МЭК-Б) моноазеотропна, в системе также содержится два тройных азеотропа.
Выводы
1. Выявлены новые биазеотропные системы: бинарная -
метилэтилкетон - перфторбензол и трехкомпонентная - бензол - перфторбензол -
метилэтилкетон.
2. Впервые обнаружена трехкомпонентная система,
относящаяся к классу 3. [2.2.1].2, тип 31, подтип а, образованная
моноазеотропной и двумя биазеотропными составляющими и содержащая два тройных
азеотропа.
. Показана возможность математического моделирования
парожидкостного равновесия в трехкомпонентной системе, содержащей две
биазеотропные бинарные составляющие и два тройных азеотропа, уравнением
Вильсона.
. Установлены классы, типы и подтипы структур диаграмм
фазового равновесия системы бензол - перфторбензол - метилэтилкетон при разных
давлениях.
. Проведено исследование эволюции структуры диаграммы
фазового равновесия системы бензол - перфторбензол - метилэтилкетон при
варьировании давления.
Список литературы
1. Челюскина Т.В. Термодинамико-топологический
анализ трехкомпонентных систем с двумя тройными азеотропами / Челюскина Татьяна
Владимировна // Дис. … канд. техн. наук - М.: МИТХТ, 2001. 169 с.
2. Челюскина Т.В., Кушнер Т.М. Диаграмма
парожидкостного равновесия в системе бензол - перфторбензол - метилпропионат с
двумя тройными азеотропами // Журнал физической химии. 2001. Т. 75. №7. С. 1324-1330.
3. Челюскина Т.В., Кушнер Т.М. Диаграмма
парожидкостного равновесия в системе бензол - перфторбензол - трет-амиловый
спирт с двумя тройными азеотропами // Журнал физической химии. 2002. Т. 76. №2.
С. 369-373.
4. Кушнер Т.М., Малых Г.Б. Системы бензол -
перфторбензол - спирты с двумя тройными азеотропами при различных давлениях //
Журнал физической химии. 2003. Т. 77. №11. С. 2084-2089.
5. Frolkova A.K., Chelyuskina T.V.
The simulation of vapor-liquid equilibrium in ternary systems with two ternary
azeotropes // Distillation and Absorption 2010, 12-15 September 2010.
Eindhoven. The Netherlands. Proceedings. P. 349.
6. Усольцева О.О., Писаренко Ю.А., Челюскина
Т.В. Исследование эволюции тройных азеотропов в зависимости от давления в
биазеотропных трехкомпонентных смесях // Тезисы докл. XII Международной
научно-технической конференции «Наукоемкие химические технологии - 2008».
Волгоград, 2008. С. 51.
7. Cheluskina T.V., Frolkova A.K.
Evolution of ternary biazeotropy in three-component systems // Abstracts of the
XVIII International Conference on Chemical Thermodynamics in Russia: Vol. 1. -
Samara: Samara State Technical University, 2011. 242 p.
8. Серафимов Л.А, Челюскина Т.В. Принципы
классификации диаграмм различных типов биазеотропных тройных смесей // Журнал
физической химии. 2011. Т. 85. №5. С. 854-863.
. Морачевский А.Г., Смирнова Н.А.,
Пиотровская Е.М. и др. / под редакцией Морачевского А.Г. Термодинамика
равновесия жидкость-пар. Л.: Химия, 1989. 344 с.
10. Тимофеев В.С.,
Серафимов Л.А., Тимошенко А.В. Принципы технологии основного органического и
нефтехимического синтеза: учебное пособие для вузов. Изд. 3-е, перераб. и доп.
М.: Высшая школа, 2010. 408 с.
11. Серафимов Л.А., Фролкова А.К., Раева В.М.
Термодинамический анализ полного пространства избыточных функций смешения
бинарных растворов // ТОХТ. 1996. Т. 30. №6. С. 611-617.
12. Фролкова А.К., Раева В.М., Серафимов Л.А.
Основные законы фазового поведения бинарных систем: методическое пособие. М.:
МИТХТ, 2001. 38 с.
13. Демусенко Е.В.,
Мозжухин А.С. Правило Банкрофта и возможность его использования при разработке
технологических схем ректификации // ТОХТ. 1997. Т. 31. №5. С. 491-494.
14. Жаров В.Т.,
Серафимов Л.А. Физико-химические основы дистилляции и ректификации. Л.: Химия,
1975. 240 с.
15. Свентославский В.В. Азеотропия и
полиазеотропия. М.: Химия, 1968. 242 с.
16. Серафимов Л.А.
Правило азеотропии и классификация многокомпонентных смесей. VIII. Общие закономерности
тангенциальной азеотропии // Журнал физической химии. 1971. Т. 45. №5. С.
1140-1147.
17. Серафимов Л.А.
Правило азеотропии и классификация многокомпонентных смесей. IX. Тангенциальная
азеотропия и общее соотношение между особыми точками разных типов // Журнал
физической химии. 1971. Т. 45. №6. С. 1473-1476.
. Серафимов Л.А.
Правило азеотропии и классификация многокомпонентных смесей. XI. Тангенциальная
азеотропия в трехкомпонентных смесях и цепи топологических структур // Журнал
физической химии. 1971. Т. 45. №10. С. 2448-2450.
. Серафимов Л.А.
Тангенциальная азеотропия. I. Условия сопряжения азеотропных точек // Сб. трудов
«Физико-химические основы ректификации». М.: МИТХТ, 1970. С. 39-48.
. Серафимов Л.А.
Тангенциальная азеотропия. II. Бинарные смеси // Сб. трудов «Физико-химические
основы ректификации». М.: МИТХТ, 1970. С. 48-55.
. Серафимов Л.А.
Тангенциальная азеотропия. III. Взаимная трансформация диаграмм фазового
равновесия жидкость-пар трехкомпонентных смесей // Сб. трудов «Физико-химические
основы ректификации». М.: МИТХТ, 1970. С. 55-64.
. Серафимов Л.А.
Правило азеотропии и классификация многокомпонентных смесей. X. Двукратно
тангенциальные азеотропы // Журнал физической химии. 1971. Т. 45. №7. С.
1620-1625.
23. Серафимов Л.А. Дополнительная глава к
монографии: Свентославский В.В. Азеотропия и полиазеотропия: пер. с англ. / под
ред. Серафимова Л.А.М.: Химия, 1968. С. 186.
24. Кушнер Т.М., Шутова
Г.В., Серафимов Л.А. Эволюция диаграмм парожидкостного равновесия биазеотропных
бинарных систем при изменении давления // Сб. трудов «Вопросы термодинамики
гетерогенных систем и теории поверхностных явлений». СПб.: Изд-во
С.-Петербургского университета, 1992. Вып. 4. С. 64-81.
25. Шутова Г.В.
Физико-химические закономерности биазеотропии в бинарных системах. Дис. … канд.
хим. наук. М.: МИТХТ, 1992. 193 с.
26. Раева В.М., Фролкова А.К., Серафимов Л.А.
Изменение состава азеотропов при варьировании внешних условий // ТОХТ. 1996. Т.
30. №1. С. 27-33.
27. Хазанова Н.Е. Системы с азеотропизмом при
высоких давлениях. М.: Химия, 1978. 216 с.
28. Gaw W.J., Swinton
F.L. Occurrence of a Double Azeotrope in Binary System Hexafluorobenzene +
Benzene // Nature. 1966. Vol. 212. P. 283-284.
29. Gaw W.J., Swinton
F.L. Thetmodynamic Properties of Binary Systems containing Hexafluorobenzene.
Part. 4. - Excess Gibbs Free Energies of the Three System Hexafluorobenzene +
Benzene, Toluene, and p-Xylene // Trans. Faraday Soc. 1968. Vol. 64. №8. Р. 2023-2034.
. Коган И.В.,
Морачевский А.Г. Равновесие жидкость-пар в системе перфторбензол - бензол
(образование двух азеотропов) // Журнал прикладной химии. 1972. Т. 45. №8. C.
1888-1890.
. Chinikamala A.,
Houth G.N., Taylor Jr. Z.L. Vapor-Liquid Equilibria of Binary System Containing
Selected Hydrocarbons with Perfluorobenzene // J. Chem. Eng. Data. 1973. Vol.
18. №3. P. 322-325.
. Aucejo A.,
Monton J.B., Munoz R., Wisniak J. Double Azeotropy in the Benzene +
Hexafluoobenzene System // J. Chem. Eng. Data. 1996. Vol. 41. №l. P. 21-24.
33. Srivastava R., Smith B.D.
Total-Pressure Vapor-Liquid Equilibrium Data for Binary System of Diethyl amine
with Acetone, Acetonitrile and Methanol // J. Chem. Eng. Data. 1985. Vol. 30.
№3. P. 308-313.
34. Chai Kao C.-P., Paulaitis M.E.,
Yokozeki A. Double Azeotropy in Binary Mixtures of NH3 and CHF2CF3
// Fluid Phase Equilibria. 1997. Vol. 127. P. 191-203.
. Burguet M.C., Monton J.B., Munoz
R., Wisniak J., Segura H. Polyazeotropy in Associating Systems: The
2-Methylpropyl Ethanoate + Ethanoic Acid System // J. Chem. Eng. Data. 1996.
Vol. 41. №5. P. 1191-1195.
. Chai Kao C.-P., Miller R.N.,
Sturgis J.F. Double Azeotropy in Binary Mixtures 1,1,1,2,3,4,4,5,5,5-Decafluoropentane
+ Tetrahydrofuran. // J. Chem. Eng. Data. 2001. Vol. 46. P. 229-233.
37. Кушнер Т.М., Шутова Г.В., Раева В.М.,
Серафимов Л.А. Исследование биазеотропии в системе пропионовая кислота -
бутилпропионат // Журнал физической химии. 1992. Т. 66. №3. С. 832-836.
. Кушнер Т.М., Шутова Г.В., Раева В.М.,
Серафимов Л.А. Исследование биазеотропии в системе масляная кислота -
бутилбутират // Журнал общей химии. 1993. Т. 63. №1. С. 171-176.
39. Нисельсон Л.А., Третьякова К.В., Тюрин В.И.
Равновесие кристаллы-жидкость и жидкость-пар в системах NbCl5-NbF5
и TaCl5-TaF5 // Журнал неорганической химии. 1973. Т. 18.
№11. С. 3063-3067.
40. Нисельсон Л.А., Астахова Т.О. О равновесии
жидкость-пар в системе сера-фосфор, имеющей три экстремальные точки // Доклады
Академии наук СССР. 1970. Т. 192. №6. С. 1311-1312.
. Серафимов Л.А., Челюскина Т.В., Шаронова
Е.А. Биазеотропия в трехфазных системах // Вестник МИТХТ. 2010. Т. 5. №5. С.
52-57.
. Челюскина Т.В., Серафимов Л.А.
Закономерности поведения биазеотропных систем: учебное пособие. М.: МИТХТ им.
М.В. Ломоносова, 2003. 44 с.
43. Кушнер Т.М., Никитский А.В., Серафимов
Л.А. Точки Банкрофта различного рода в тройных системах // ТОХТ. 1998. Т. 32.
№1. С. 33-41.
. Никитский А.В. Закономерности эволюции
тройных азеотропов при изменении внешних параметров как основа разделения
тройных смесей. Дис. … канд. тех. наук. - М.: МИТХТ, 1999. 273 с.
45. Челюскина Т.В., Кушнер Т.М. Основные типы
эволюции тройной биазеотропии в трехкомпонентных системах при изменении
давления // Журнал физической химии. 2003. Т. 77. №11. С. 2090-2093.
46. Жванецкий И.Б.,
Решетов С.А., Слученков В.Ю., Орлова Е.В. Переходы в областях К-упорядоченности
трехкомпонентных систем с тройным азеотропом // Журнал физической химии. 1990.
Т. 64. №8. С. 2186-2190.
47. Жванецкий И.Б.,
Решетов С.А., Слученков В.Ю., Орлова Е.В., Алуханова Б.М. Диаграммы областей
К-упорядоченности трехкомпонентных систем // ТОХТ. 1993. Т. 27. №2. С. 112-120.
48. Огородников С.К., Лестева Т.М., Коган В.Б.
Азеотропные смеси. Справочник. Л.: Химия, 1971. 1406 с.
49. Gmehling J., Bolts R.
Azeotropic Data for Binary and Ternary Systems at Moderate Pressures // J.
Chem. Eng. Data. 1996. Vol. 41. P. 202-209.
50. Сторонкин А.В., Морачевский А.Г., Кудрявцева
Л.С. О влиянии температуры и давления на состав тройных азеотропов // Журнал
физической химии. 1957. Т. 31. №2. С. 395-402.
51. Сусарев М.П.,
Кудрявцева Л.С., Матушкевич Э.А. О концентрационных областях расположения и
температурного смещения тройных азеотропов. I. // Журнал физической
химии. 1963. Т. 37. №12. С. 2672-2677.
52. Сусарев М.П.,
Кудрявцева Л.С. О концентрационных областях расположения и температурного
смещения тройных азеотропов. II. // Журнал физической химии. 1964. Т. 38. №1. С.
47-51.
. Сусарев М.П.,
Тойкка А.М. О составах и температурных смещениях тройных азеотропов. XIII. Величины азеотропных
параметров, допускаемые условиями устойчивости // Журнал физической химии.
1974. Т. 48. №11. С. 2680-2683.
. Сусарев М.П.,
Тойкка А.М. Условия устойчивости и ограничения на азеотропные параметры
многокомпонентных смесей // Сб. трудов «Вопросы термодинамики гетерогенных
систем и теории поверхностных явлений». Л.: Изд. ЛГУ, 1977. С. 37-51.
. Тойкка А.М.,
Сусарев М.П. О составах и температурных смещениях тройных азеотропов. XIV. О связи между составом n-компонентного азеотропа
и отступлениями от идеальности составляющих l-компонентных систем (l<n), вытекающей из условий
устойчивости // Журнал физической химии. 1975. Т. 49. №2. С. 489-491.
. Сусарев М.П.,
Тойкка А.М. О взаимном расположении изолиний величин термодинамических свойств
// Журнал физической химии. 1977. Т. 51. №8. С. 1953-1957.
. Сусарев М.П.,
Тойкка А.М. Составы и температурные смещения тройных азеотропов. XVIII. Расположение изолиний
коэффициентов активности и относительных летучестей в окрестности азеотропа //
Журнал физической химии. 1978. Т. 52. №2. С. 317-320.
. Раева В.М.,
Серафимов Л.А. Выявление концентрационных областей существования тройных
азеотропов. I.
Системы с одноименными отклонениями от идеального поведения // ТОХТ. 2004. Т.
38. №6. С. 683-692.
. Фролкова А.В.
Физико-химические основы ректификации многокомпонентных азеотропных смесей.
Дис. … канд. тех. наук. М.: МИТХТ, 2008. 162 с.
. Раева В.М.,
Серафимов Л.А., Фролкова А.В. Концентрационные области существования тройных азеотропов
в системах с разноименными отклонениями от идеального поведения // ТОХТ. 2006.
Т. 40. №1. С.
42-50.
. Раева В.М.,
Фролкова А.В., Серафимов Л.А. Выявление концентрационных областей существования
тройных азеотропов. Системы со смешанными отклонениями от идеального поведения
// ТОХТ. 2009. Т. 43. №5. С. 580-585.
. Серафимов Л.А.,
Фролкова А.К. Зависимость состава многокомпонентных азеотропов от давления //
ТОХТ. 2003. Т. 37. №6. С. 584-593.
63. Серафимов Л.А., Писаренко Ю.А., Усольцева
О.О. О проявлении идеальности в неидеальных тройных смесях // ТОХТ. 2009. Т.
43. №4. С. 429-435.
64. Серафимов Л.А.,
Кушнер Т.М., Челюскина Т.В. Термодинамико-топологический анализ диаграмм
парожидкостного равновесия в тройных системах с двумя тройными азеотропами // Сб.
трудов «Вопросы термодинамики гетерогенных систем и теории поверхностных
явлений». СПб.: Изд. С.-Петербургского университета, 1996. Вып. 10. С.
26-55.
65. Кушнер Т.М.,
Челюскина Т.В., Серафимов Л.А. Термодинамико-топологический анализ диаграмм
равновесия пар-жидкость в тройных системах с двумя тройными азеотропами //
Журнал физической химии. 1999. Т. 73. №3. С. 426-434.
66. Усольцева О.О., Серафимов Л.А., Писаренко
Ю.А. Возникновение внутреннего тангенциального азеотропа в тройных системах //
ТОХТ. 2010. Т. 44. №3. С. 308-314.
67. Серафимов Л.А.
Теоретические принципы построения технологических схем ректификации неидеальных
многокомпонентных смесей: автореф. дис. … докт. техн. наук. М.: МИТХТ, 1968. 44
с.
68. Жаров В.Т.
Термодинамико-топологическое исследование открытых фазовых процессов и
нелокальных закономерностей диаграмм фазового равновесия в гетерогенных
системах различного типа: автореф. дис. … докт. хим. наук. Л.: ЛГУ, 1969. 22
с.
. Серафимов Л.А.
Термодинамико-топологический анализ и проблемы разделения многокомпонентных
полиазеотропных смесей // ТОХТ. 1987. Т. 21. №1. С. 74-85.
. L.A. Serafimov.
Thermodynamic and Topological Analysis of Liquid-Vapor Phase Equilibrium
Diagrams and Problems of Rectification of Multicomponent Mixtures // L.: Gordon
and Breach Publishes, 1996. Ch. 10. P. 557-605.
71. Серафимов Л.А.
Термодинамико-топологический анализ диаграмм гетерогенного равновесия
многокомпонентных смесей // Журнал физической химии. 2002. Т. 76. №8. С.
1351-1365.
. Серафимов Л.А.
Правило азеотропии и классификация многокомпонентных смесей. III. Распределение особых
точек на диаграммах фазового равновесия жидкость-пар в четырехкомпонентных
смесях // Журнал физической химии. 1968. Т. 42. №1. С. 252-256.
. Серафимов Л.А.
Правило азеотропии и классификация многокомпонентных смесей. VI. Смеси, содержащие n компонентов // Журнал
физической химии. 1969. Т. 43. №7. С. 1753-1758.
. Жаров В.Т. О
нелокальных закономерностях в диаграммах равновесия жидкость-пар
многокомпонентных систем // Журнал физической химии. 1969. Т. 43. №11. С.
2784-2791.
. Серафимов Л.А.,
Бабич С.В. Новые формы правил азеотропии // ТОХТ. 1996. Т. 30. №2. С. 140-150.
. Гуриков Ю.В.
Некоторые вопросы структуры диаграмм двухфазного равновесия жидкость-пар
тройных гомогенных растворов // Журнал физической химии. 1958. Т. 32. №9. С.
1980-1996.
. Серафимов Л.А.
Правило азеотропии и классификация многокомпонентных смесей. VII. Диаграммы
трехкомпонентных смесей //
Журнал физической химии. 1970. Т. 44. №4. С. 1021-1027.
. Серафимов Л.А.
Общие закономерности хода К-линий в трёхкомпонентных системах жидкость-пар //
Сб. трудов «Физико-химические основы ректификации». М.: МИТХТ, 1970. С. 20-30.
. Серафимов Л.А.,
Тимофеев В.С., Писаренко Ю.А., Солохин А.В. Технология основного органического
и нефтехимического синтеза. Совмещенные процессы. М.: Химия, 1993. 412 с.
. Комарова Л.Ф.,
Серафимов Л.А., Гарбер Ю.Н. Классификация диаграмм трехкомпонентных смесей,
включающих биазеотропные составляющие // Журнал физической химии. 1974. Т. 48.
№6. С. 1391-1393.
. Бабурина Л.В.,
Маклашина Н.С., Платонов В.М. б-структура трехкомпонентных азеотропных диаграмм
парожидкостного равновесия // ТОХТ. 1993. Т. 27. №5. С. 542-547.
. Бабурина Л.В.,
Платонов В.М. Классификация бинарных систем парожидкостного равновесия в
зависимости от их неидеальности // Журнал физической химии. 1989. Т. 63. №8. С.
2252-2256.
83. Doherty M.F.,
Perkins J.D. On the dynamics of distillation process - III. The topological
structure of ternary residue curve maps // Chem. Eng. Sci. 1979. Vol. 34. P. 1401-1414.
. Мозжухин А.С.,
Митропольская В.А., Тихонова Н.К. Анализ структуры диаграмм парожидкостного
равновесия: учебное пособие. М.: МИТХТ, 1988. 92 с.
. Tamir A.,
Wisniak J. Correlation and prediction of boiling temperatures and azeotropic
conditions in multicomponent systems // Chem. Eng. Sci. 1978. Vol. 33. P. 657-672.
86. Мягкова Т.О.
Физико-химические основы разделения биазеотропных смесей. Дис. … канд. тех.
наук. М.: МИТХТ, 2007. 175 с.
87. Андронов А.А., Леонтович Е.А., Гордон И.И.,
Майер А.Г. Теория бифуркаций динамических систем на плоскости. М.: Наука, 1967.
487 с.
88. Serafimov L.A., Zharov V.T.,
Timofeyev V.S. Rectification of multicomponent mixtures, I. Topological
analysis of liquid-vapour phase equilibrium diagrams // Acta Chimica Academiae
Scientiarum Hungaricae. 1971. T. 69.
№4. P. 383-396.
. Коган В.Б. Азеотропная и экстрактивная
ректификация. Изд. 2-е. Л.: Химия, 1971. 432 с.
90. Челюскина Т.В. Теоретические основы
ректификационного разделения биазеотропных смесей / Челюскина Татьяна Владимировна
// Дис. … док. техн. наук. М.: МИТХТ, 2011. 197 с.
91. Уэйлес С. Фазовые равновесия в химической
технологии. Т.1. М.: Мир, 1989. 304 с.
92. Челюскина Т.В., Фролкова А.К.
Моделирование парожидкостного равновесия в бинарных биазеотропных системах //
Тезисы докл. XVII Международной научной конференции «Математические методы в
технике и технологиях. Кострома, 2004. С. 5.
. Зефиров Н.С. Химическая энциклопедия.
М.: Большая Российская энциклопедия. 1995. Т. 4. 641 с.
94. ChemCad 5.2.0. Professional.
Chemstations, Inc. Houston, Texas. 2002.
95. Челюскина Т.В., Марченкова М.Ю., Кулакова
А.А. Математическое моделирование и исследование парожидкостного равновесия в
системах этанол - вода - этилендиамин и этанол - вода - бутиламин // Вестник
МИТХТ. 2010. Т. 5. №3. С. 18-25.
. Коган В.Б., Фридман В.М, Кафаров В.В.
Равновесие между жидкостью и паром: в 2 кн. Л.: Наука, 1966. 1426 с.
. Челюскина Т.В., Митюшкина И.А.,
Чернышова М.А., Фролкова А.К. Математическое моделирование эволюции
биазеотропии в системе изобутилацетат - уксусная кислота // Вестник МИТХТ.
2011. Т. 6. №4. С. 47-50.
99. Рид Р., Праусниц Дж., Шервуд Т. Свойства
газов и жидкостей: справочное пособие. Л.: Химия, 1982. 592 с.
Похожие работы на - Исследование структуры диаграммы фазового равновесия системы бензол–перфторбензол–метилэтилкетон при изменении давления
|