Изучение окисления наноразмерных частиц переходных металлов подгрупп железа
ФЕДЕРАЛЬНОЕ
АГЕНТСТВО ПО ОБРАЗОВАНИЮ И НАУКЕ РФ
ФГБОУ ВПО
«КЕМЕРОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ХИМИЧЕСКИЙ
ФАКУЛЬТЕТ
КАФЕДРА ХИМИИ ТВЕРДОГО ТЕЛА
Магистерская
диссертация
Изучение окисления наноразмерных частиц
переходных металлов подгруппы железа
Научный руководитель: д.х.н., профессор Захаров Ю.А.
Магистрант Патюков Н.Е.
Кемерово 2012
РЕФЕРАТ
Представляемая магистерская диссертация посвящена исследованию процессов
окисления наноразмерных частиц переходных металлов подгруппы железа, полученных
методом жидкофазного восстановления.
Целью данного исследования являлось изучение влияния состава НРЧ переходных
металлов и способов их защиты на окисление.
Задачи:
Изучить окисление системы Fe-Co от состава компонентов, полученных в
результате синтеза;
Изучить влияние ПАВ на стабильность к окислению системы Fe-Co;
Рассмотреть возможность совместной защиты двухкомпонентных систем.
Научная новизна.
Впервые изучено влияние добавления ПАВ при синтезе НРЧ переходных
металлов подгруппы железа на стабильность порошков к окислению.
Впервые изучено влияние преобладающей фазы в наноразмерных порошках
системы железо - кобальт на стабильность к окислению.
Впервые изучено влияние металлов входящих в состав твердого раствора на
стабильность порошков к окислению.
Структура работы:
Диссертация состоит из введения, трех глав, выводов, списка литературы.
В первой главе содержится аналитический обзор имеющихся экспериментальных и
теоретических данных по основным вопросам синтеза НРЧ, их свойств, коррозионной
стойкости, стабилизации частиц при синтезе.
Вторая глава посвящена описанию методов исследования коррозионной
стойкости порошков, при окислении кислородом в разных температурных режимах.
В третьей главе представлены результаты:
. Изучения влияния металлов входящих в состав твердого раствора на
стабильность к окислению порошков;
. Исследования зависимости преобладающей фазы в твердом растворе
на стабильность наноразмерных порошков системы железо - кобальт к окислению;
. Изучения влияния ПАВ добавляемых при синтезе наноразмерных
порошков подгруппы железа, на устойчивость их к кислороду.
Четвертая глава посвящена выводам.
В конце работы приведен список литературы.
ABSTRACT
master's thesis is devoted to research the oxidation of
nanoparticles of transition metals of the iron subgroup, obtained by
liquid-phase recovery.
The purposeof the present work was studying the
effect of the composition and methods of protection for the oxidation.
Structure of project work:dissertation consists of the
introduction, three chapters, conclusions, the list of the literature and
contains 82 pages, 19 figures, 4 tables, 71 literary references.the first
chapter contains the analytical review available experimental and theoretical
data on the major questions of synthesis a nanoparticles, their properties,
corrosion resistance, and stability of the particles during synthesis.second
chapter describes methods of investigation of corrosion resistance of powders
by oxidation with oxygen at different temperatures.In the third chapter results
of research and their discussions are presented.fourth chapter is devoted to
conclusions.list of the literature is resulted in the end of work.
Список сокращений
НРЧ─ Наноразмерные частицы.
НРП ─ Наноразмерный порошок.
НРЧПМ─ Наноразмерные частицы переходных металлов.
УДП ─ Ультрадисперсный порошок.
УЗ ─ Ультразвуковой.
УЗД ─ Ультразвуковое диспергирование.
ПАВ ─ Поверхностно-активное вещество.
МУР ─ Малоугловое рассеяние.
ШУР ─ Широкоугловое рассеяние.
РЭМ ─ Растровая электронная микроскопия.
РМА ─ Рентгеновский микроанализ.
РФА ─ Рентгенофлюоресцентный анализ.
РСА ─ Рентгеноструктурный анализ.
КСС─ Кобальт содержащие соли
НП─Наноразмерный порошок
ВМС─ Высокомолекулярные соединения
ВЧ─ Высокочастотный
Оглавление
Введение
Глава
1. ОБЗОР ЛИТЕРАТУРЫ
1.1 Свойства наноразмерных
металлических порошков
.2 Обзор способов получения
НРП металлов
.2.1 Физические методы
получения НРЧ
.2.2 Химические методы
получения наночастиц
.3 Основные принципы
стабилизации УДП металлов
.4 Твердые растворы
.4.1 Основные параметры
твердых растворов
.4.2 Фазовые состояния
системы Fe-Со
.5 Коррозия
.5.1 Классификация процессов
коррозии
.5.2 Некоторые виды коррозии
Глава
2. Методика эксперимента
2.1 Объекты исследования и
оборудование
.2 Пробоподготовка
.3 Принципиальная схема
экспериментальной установки для изучения процесса окисления при комнатной
температуре
.4 Принципиальная схема
экспериментальной установки для изучения процесса окисления при заданной
температуре
.5 Вспомогательные методы
исследования
.5.1 Рентгенография
.5.2 Растровая электронная
микроскопия
.6 Обработка результатов
эксперимента
.6.1 Вычисление объема
поглощаемого кислорода при комнатной температуре
.6.2 Вычисление объема поглощенного
кислорода при заданных температурах
Глава
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
3.1 Изучение кинетики
НРПпереходных металлов систем Co-Fe и Co-Ni при окислении кислородом
.2 Изучение влияния природы,
концентрации ПАВ при синтезе НРП на стабильность к окислению при различных
температурных режимах
.3 Изучение влияния состава
наноразмерных порошков на стабильность к окислению кислородом системы Co-Fe
Глава
4. ВЫВОДЫ
СПИСОК
ЛИТЕРАТУРЫ
Ââåäåíèå
Современное развитие химической промышленности, разработка новых
технологических процессов, протекающих в агрессивных средах, предъявляют к
конструкционным материалам высокие требования. Наиболее важными
конструкционными материалами до сих пор являются металлы и их сплавы.
В настоящее время технология достигла критической точки своего развития,
когда применение микрообъектов уже невозможно. Нужно переходить на новый -
наноуровень. Устойчивый интерес к наноструктурам, возникший в последние
десятилетия, обусловлен возможностью значительной модификации и принципиального
изменения качеств известных материалов при переходе в нанокристаллическое
состояние. Такие материалы используют при создании материальной базы новейших
технологий, например, в качестве композиционных информационных сред.
Исследование и закономерности регулирования свойств наноматериалов представляют
несомненный интерес для физикохимии современного материаловедения.
Исследования в области наноразмерных (и наноструктурированных) материалов
и работы по созданию на этой основе новых, зачастую с уникальными свойствами
деталей, узлов и целых агрегатов относятся к числу наиболее актуальных и
перспективных и являются в настоящее время самыми быстроразвивающимися и
наиболее активно обсуждаемыми областями науки и техники [1-9].
Одним из интенсивно развиваемых в этих областях направлений является
получение и материаловедение наноразмерных переходных металлов группы железа и
их взаимных двухкомпонентных систем [10 - 14, 71].
Повышенное внимание к этим объектам вызвано в значительной степени
особенностями магнитных свойств как массивных, так и тонкодисперсных систем -
высокими значениями намагниченности насыщения в относительно невысоких
магнитных полях в сочетании с малыми временами перемагничивания (для
магнитомягких систем), возможностью варьирования при легировании составов
величины коэрцитивной силы [15, 16].
По этим причинам высокодисперсные (в т.ч. наноразмерные) порошки металлов
группы железа выделяются как весьма перспективные главным образом для создания
магнитных материалов, в т.ч. сверхминиатюрных узлов и элементов,
магнитопроводов, магнитных жидкостей [17,18].
Также переходные металлические (Fe, Co, Ni) наночастицы нашли широкое
применение как катализаторы, в системах утилизации солнечной энергии [20], их
используют в составе катализаторов на носителях, в системах магнитной записи и
хранения информации, источниках тока и ряде других направлений.
Порошки, содержащие наночастицы переходных металлов, имеют развитую
поверхность и существенные искажения кристаллической решетки, что определяет их
чрезвычайно высокую активность. Вследствие этих причин такие объекты
взаимодействуют с любыми веществами, содержащимися в среде, где они
формируются: следами кислорода, влаги, органики и т.д. При этом наряду с
обычными элементами адсорбции на высокоразвитой поверхности происходят
интенсивные химические превращения, сопровождающиеся в том числе и образованием
оксидных пленок [20].
Кроме того, образовавшиеся «голые» кластерные частицы при обычных
условиях самопроизвольно компактируются и переходят в порошки с обычной
степенью дисперсности.
Данные процессы недостаточно изучены в настоящее время, а особый интерес
представляет изучение взаимодействия получаемыхнаночастиц с кислородом. Процессы окисления были всегда под пристальным вниманием
ученых [20, 21]. В настоящей работе в качестве объектов исследования
использованы наночастицы переходных металлов никеля, кобальта, железа и их взаимных систем. На защиту выносятся следующие
положения:
· Влияние состава и свойств нанопорошков на устойчивость к
воздействию кислородом воздуха.
· Влияние ПАВ, добавляемых при синтезе, на стабильность
образцов к окислению кислородом.
· Влияние преобладающей фазы в твердом растворе на характер
окисления в атмосфере чистого кислорода.
Научная новизна.
Впервые изучено влияние добавления ПАВ при синтезе НРЧ переходных
металлов подгруппы железа на стабильность порошков к окислению.
Впервые изучено влияние преобладающей фазы в наноразмерных порошках
системы железо - кобальт на стабильность к окислению.
Впервые изучено влияние металлов входящих в состав твердого раствора на
стабильность порошков к окислению.
Актуальность работы заключается в том, что анализ литературных данных
позволяет считать, что исследование таких практически значимых химических
свойств НРМ, как коррозионная стойкость, каталитическая активность,
адсорбционная способность, пока развиваются не слишком интенсивно, и,
следовательно, представляют огромный интерес для изучения.
При переходе в наноразмерное состояние в материалах часто изменяются:
механические свойства - повышается твердость, в сочетании с высокой
пластичностью, увеличивается предел текучести, снижается порог хладноломкости;
теплофизические и электрические - повышается теплоемкость и коэффициент
термического расширения, увеличивается удельное электросопротивление, магнитные
- изменяются коэрцитивная сила, остаточная намагниченность, проявляется эффект
суперпарамагнетизма (при размере частиц меньше 1 домена);тепловые - снижаются
температуры: оптические - изменяются спектры излучение и поглощения, возможно
полное поглощение - «черное» тело и химические - повышается растворимость (до
20%) в кислотах, снижаются температуры протекания реакций, проявляется
отсутствие «инкубационного» периода.
Как следствие, на основе уникальных свойств наноразмерных мате-риалов,
которые не всегда объяснимы в рамках законов классической физики и химии,
разрабатываются материалы с прочностью значительно выше стали при малом
удельном весе; удаляются самые мелкие и вредные примеси из воздуха, воды и др.
жидкостей; удваивается КПД солнечных батарей; используются для направленной
поставки лекарственных форм к определенным человеческим органам и многое
другое.
Порошковые нанотехнологии можно условно разделить на 2 группы. В одной из
них НРЧ, составляющие порошки, за счет своих особых свойств придают новое
качество потребительскому продукту, а в другой - благодаря своим свойствам
позволяют реализовать новые технологические процессы, приводящие к качественно
новым продуктам [71].
К продуктам нанотехнологий первой группы могут быть отнесены: краски,
удобрения, присадки к моторным маслам и другие продукты с добавками НРП. Также
НП рассматриваются для применений в медицине в качестве носителей для адресной
доставки лекарств или биометок, сигнализирующих о вирусных или опухолевых
заболеваниях. На избирательной способности клеток злокачественных опухолей
захватывать металлические НРЧ основан метод локальной гипертермии для лечения
раковых заболеваний (при облучении электромагнитным полем НРЧ аккумулируют его
энергию и разогреваются, что приводит к гибели опухолевых клеток).
Во второй группе нанотехнологий НРП используются как промежуточный
продукт, который позволяет создавать материалы с качественно новыми свойствами
благодаря тонкой структуре: сплавы и различные нанокомпозиты. Актуальным
примером широко разрабатываемых композиционных наноматериалов являются
металломатричные наноструктурные композиты. Известна масса применений НП для
синтеза новых материалов или структур, выполняющих функциональные задачи,
например, по созданию новых магнитных, оптических и электропроводных материалов,
новых источников энергии.
Можно привести еще большее множество других примеров, где НРП уже
позволяют решить актуальные технические задачи или будут использованы в
ближайшей перспективе. Использование НРП в различных областях техники и
производства - перспективное направление современного материаловедения.
Управляя технологическими параметрами процессов их синтеза, можно регулировать
дисперсность, форму, химический состав и другие свойства получаемых порошков,
расширяя области их применения.
Анализ литературных данных позволяет считать, что исследование таких
практически актуальных химических свойств НРМ, как коррозионная стойкость,
каталитическая активность, адсорбционная способность, пока развиваются не
слишком интенсивно.
Материалы диссертации опубликованы в:
1. Иванов А.В., Патюков Н.Е.Окисление
наноразмерных частиц переходных металлов, полученных методом жидкофазного
восстановления / А.В. Иванов, Н.Е.Патюков// Образование, наука, инновации -
вклад молодых; исследователей: материалы V (XXXVII) Международной
научно-практической конференции / Кемеровский госуниверситет. - Кемерово: ООО
"ИНТ" 2010. - Вып.11. - Т.2. - С.407-408.
. Патюков, Н.Е. Перспективные направления современного материаловедения / Н.Е.Патюков // Тезисы БИТ - Сибирь 2012 / Барнаул: изд-во БИТ-Сибирь, 2012. - С.45-47.
Ãëàâà 1.
ÎÁÇÎÐ
ËÈÒÅÐÀÒÓÐÛ
.1 Свойства наноразмерных металлических порошков
Наноразмерные металлические порошки обладают химическими, физическими и
технологическими свойствами [17, 18, 23], часто существенно отличными от
свойств металлических систем в макросостоянии. Выделяют следующие характерные
особенности [20] кластерных (нано-) частиц металлов, отличающих их от массивных
металлов:
· доля поверхностных атомов соизмерима с числом атомов в объеме
частицы;
· поверхностная и внутренняя энергии отдельно взятой частицы
также соизмеримы, что приводит, например, к значительному снижению температуры
плавления нанокристаллов [21];
· внутренняя структура кластера отличается от структуры
массивного металла: часто отсутствует плотная упаковка, изменены расстояния
между атомами и слоями атомов, форма и структура кластеров носят ярко
выраженный неравновесный характер и соответствуют энергонасыщенным состояниям.
Основным отличием между молекулярными кластерными соединениями и НРЧ
является тот факт, что молекулярные кластеры - это
индивидуальные химические вещества, имеющие строго дискретное значение
молекулярной массы и точный химический состав. Частицы коллоидных металлов
характеризуются распределением по размеру и химическому составу [22].
Более того, молекулярные кластерные соединения могут быть выделены из
среды и существовать в изолированном виде неопределенное время. НРЧ
представляют собой неравновесную систему в метастабильном (система находится в
промежуточном минимуме) или в кинетически заторможенном состоянии [23].
По размерам металлические частицы могут быть подразделены на три типа:
ультрадисперсные - от 1 до 50 нм; высокодисперсные (до 100-500 нм) и микронные
(до 103-104 нм). Последние, как правило, состоят из
отдельных частиц и их агломератов, представляющих собой моно- и поликристаллы
фрактального типа.
В зависимости от размера кластеров их свойства очень сильно изменяются.
При содержании в кластере менее 13 атомов реализуются только такие плотные
упаковки, когда все атомы поверхностные [24]. Причем, наиболее стабильными
являются структуры, в которых все межатомные расстояния приблизительно равны -
это правильный треугольник, тетраэдр, пентагональная бипирамида, декаэдр,
икосаэдр или кубоктаэдр. С 13 до 150 атомов (0,8-2 нм) появляется возможность
образования плотноупакованных структур, в которых число поверхностных атомов
больше, чем внутренних. Наиболее энергетически выгодными в данном случае
являются структуры частиц в форме икосаэдра и кубоктаэдра [24].
Более крупные частицы (2-10 нм) характеризуются тем, что у них количество
поверхностных и внутренних атомов сравнимо. Именно в этой области наблюдаются
основные аномалии физических свойств [24]. Для их получения применяют методы
газофазнойнуклеации паров металлов [25], низкотемпературной соконденсации,
синтез в полимерной матрице [26, 27] и другие.
У частиц дисперсностью (10-30 нм) нестабильна четкая огранка, характерная
для кристаллов, и имеется тенденция к образованию частиц шарообразной формы,
ребра и вершины которых округляются, а грани становятся выпуклыми. В центре
кластера появляется все больше внутренних слоев, упаковка которых начинает
соответствовать структуре данного компактного металла. В результате, в частицах
возникает два типа упаковки атомов - внутренняя кристаллическая и внешняя
икосаэдрическая, что неизбежно связано с возникновением внутренних пустот и
упругих деформаций. Таким образом, уникальные свойства (активированная
электропроводность, повышение температуры перехода в сверхпроводящее состояние,
экранирование электромагнитного излучения и другие) проявляются у УДП с
размерами частиц до 30 нм [24], что и делает их интересным объектом для
дальнейших исследований.
У частиц более 30 нм доля поверхностных атомов ничтожно мала (<2%), а,
следовательно, и влияние поверхностной энергии незначительно. Для таких частиц
внутренняя структура, как правило, соответствует строению кристаллов данного
металла, несмотря на то, что свойства их все еще отличаются от свойств
массивного металла [28].
Таким образом, с увеличением размера кластера происходит постепенный
переход от свойств кластера к свойствам массивного металла. При образовании
димера уровень энергии атома расщепляется на два компонента. С увеличением
размера кластера уровни продолжают расщепляться и наконец сливаются в
квазинепрерывное поглощение твёрдого вещества. Полосы начинают наполняться
электронами, появляется уровень Ферми, возникает проводимость [21].
С дальнейшим увеличением числа атомов в частице энергия Ферми, энергия
сродства к электрону и энергия связи увеличиваются, а потенциал ионизации
уменьшается, таким образом, данные параметры стремятся к таковым для массивного
металла. Причем, при обобществлении d-электронов переходных металлов в
формировании электронной структуры определяющим является ближний характер.
Вследствие этого электронная структура, соответствующая массивному металлу,
может наблюдаться у малых частиц Ni, Cu, Ag, содержащих 10-30 атомов (около 1
нм), в некоторых же случаях, переход от молекулярных к металлическим свойствам
осуществляется в кластерах, состоящих из нескольких сотен атомов [15].
При работе с НРП учитывают их токсичность и пирофорность. Пирофорность
НРП, т.е. способность к самовозгоранию при соприкосновении с воздухом, может
привести к воспламенению порошка и даже взрыву [30]. Поэтому при работе с
порошками строго соблюдают специальные меры безопасности.
Изучение НРП показало их чрезвычайно высокую химическую активность,
которая проявляется в изменении температуры, скорости, тепловых эффектов
различных взаимодействий, степени превращения при данных условиях, повышенной
пирофорности, особых каталитических свойствах.
Во многом физические и химические свойства определяются фазовым составом
НРП металлов. Варьируя фазовый состав, можно добиться изотропности или сильной
анизотропии материала, модифицировать структуру и форму НРЧ, изменять
растворимость компонентов друг в друге, снизить уровень дефектности и др.
В веществах нанометровых размеров наблюдается ряд особенностей фазового
состояния, нехарактерный для массивных материалов. В настоящее время накоплен
достаточный экспериментальный материал [28, 32]
показывающий, что в наноразмерных материалах происходит смещение температуры
фазовых превращений по сравнению с массивными образцами. В частности,
наблюдается смещение температуры полиморфного превращения, стабилизация
неравновесных состояний, а также образование фаз, которые в массивных образцах
не наблюдаются.
На термодинамические условия фазовых превращений в НРЧ сказывается
влияние поверхностной энергии ввиду развитости их поверхности.
1.2 Обзор способов получения НРП металлов
.2.1 Физические методы получения НРЧ
Диапазон способов получения металлических НРЧ весьма
широк, сформировались два основных подхода: “физический” (фазовые превращения
первого рода в отсутствие химических реакций) и “химический”. Наибольшее
распространение в первом подходе получили конденсационные методы, заключающиеся
в “сборке” наноразмерных частиц из отдельных атомов (молекулярных и кластерных
пучков) металла. Реже используют методы получения НРЧ диспергированием
грубодисперсных частиц (коллоидные мельницы, встряхивающие аппараты,
ультразвуковое, высокочастотное и электродуговое дробление).
Конденсационные методы
Метод молекулярных пучков. Молекулярные пучки представляют собой непрерывные
потоки нейтральных частиц в вакууме. Сущность метода состоит в том, что
компактный источник, нагретый до высокой температуры в вакууме, испускает атомы
(молекулы), которые конденсируются на подложке [31]. Способы нагрева могут быть
различными: резистивный (нагрев джоулевым теплом), индукционный и ВЧ - нагрев,
оптический (лазерный) и электронно-лучевой, который в настоящее время считается
одним из наиболее совершенных, так как позволяет получить высокую локальную
температуру.
Основным достоинством метода молекулярных пучков является возможность
достаточно точно регулировать интенсивность пучка и, следовательно, управлять
скоростью подачи частиц в зону конденсации.
Сверхзвуковое истечение газов из сопла. Данный метод отличается от
предыдущего использованием молекулярных пучков большей интенсивности и с более
низкой температурой [33].
Для получения металлических кластеров в пучках при сверхзвуковом
расширении газа наиболее распространены два способа испарения: термический и
лазерный, используемый для большинства переходных металлов. Лазерное излучение
средней интенсивности фокусируется на поверхности мишени (металлической
проволоке) и вызывает интенсивное испарение атомов. Из-за высокой температуры
испаряемой поверхности наряду с атомами в паре присутствует примесь ионов - потенциальных
центров конденсации. Они попадают в поток буферного газа, где из них
формируются кластеры.
Метод хорошо разработан как в практическом, так и в теоретическом
аспектах и позволяет получать граммовые количества порошков, состоящих из
наноразмерных частиц.
Аэрозольный метод («газовое испарение»). Суть метода получения
высокодисперсных частиц заключается в испарении металла в разреженной атмосфере
инертного газа при пониженной температуре (ниже комнатной) с последующей
конденсацией паров в реакторе [34]. В зависимости
от условий проведения конденсации средний размер частиц варьируется от двух до
нескольких сотен нанометров.
К аэрозольному методу следует отнести и получение НРЧ металлов при
электрическом взрыве проводников в атмосфере инертного газа (N2, Ar, He) [30].
Вакуумное испарение. Метод заключается в испарении и последующей конденсации
металлсодержащего образца в вакууме на твердую или жидкую поверхность. Этим
способом получены порошки НРЧ Ag, Au, Pd, Cu/Fe, Ni, Co со средним
диаметром частиц 2,0 - 8,0 нм [35].
Низкотемпературная плазма. Важнейшим способом получения порошков НРЧ металлов,
сочетающим высокие температуры парогазовой металлсодержащей смеси и большие
скорости ее охлаждения, способствующие формированию аэрозольных металлических
частиц, является технология низкотемпературной плазмы [36,37].
Таким способом были получены порошки НРЧ Al, Li, Ni, Fe, W, Mo с формой
частиц, близкой к сферической, и средним диаметром 5-100 нм. Основными
недостатками рассмотренного способа являются периодичность и малый ресурс
работы, связанный с расходованием материала анода.
Получение НРЧ путём диспергирования
Механическое диспергирование. Аппараты, применяемые для измельчения
твёрдых веществ, как правило, одновременно сочетают различные виды
механического воздействия: раздавливание (сжатие), раскалывание, свободный и
стесненный удар, истирание, разрыв и др. В аппаратах для измельчения хрупких
материалов в основном используют раздавливающие и ударные воздействия. Мягкие
материалы обычно диспергируют в машинах на истирание.
Наиболее перспективными, высокоэнергонапряженными измельчительными
аппаратами, отвечающими современным технологическим требованиям, являются
планетарные и дифференциальные центробежные мельницы, в некоторых случаях
непрерывного действия [38].
Ультразвуковое диспергирование. Метод широко используется в
лабораторной практике при получении высокодисперсных (средний размер частиц
менее 1000 нм) и однородных суспензий ряда металлов с целью создания
металлсодержащих жидкостей и сред в качестве прекурсоров нового поколения
эффективных гетерогенных катализаторов.
Обычно дробление металлов посредством ультразвука осуществляется в
дисперсионной среде. При этом используют воду или органические соединения с
добавками ПАВ, которые выполняют функцию стабилизатора НРЧ и одновременно
изменяют акустические параметры дисперсионной среды, повышая эффективность
диспергирования [39, 40, 41].
В отличие от механического УЗ - диспергирование позволяет получать
эмульсии с химически чистыми высокодисперсными металлами и узким (близким к
монодисперсному) распределением по размерам. Последнее можно регулировать
изменением частоты ультразвуковых колебаний.
1.2.2 Химические методы получения наночастиц
Химические свойства металлических НРП зависят от химического состава, который
соответственно зависит от метода получения порошка, химического состава и
степени чистоты исходных материалов [29]. Так, при газофазном восстановлении
химических соединений часть газов-восстановителей и газообразных продуктов
реакции не успевают выйти наружу и находятся либо в растворенном состоянии,
либо в виде нанопузырьков. Электролитические порошки содержат водород,
выделяющийся на катоде одновременно с осаждением на нем металла. В карбонильных
порошках присутствуют растворенные кислород, окись и двуокись углерода, а в
распыленных порошках - газы, механически захваченные внутрь частиц.
Из “химических” методов наибольшее распространение получило
восстановление соединений металлов в растворе в присутствии различных
стабилизаторов, используемое более ста лет. В качестве восстановителей
применяют водород и водородсодержащие соединения, тетрагидробораты и цитраты
щелочных металлов, гипофосфиты, спирты, металлорганические соединения,
воздействие высокоэнергетических излучений и др. К химическим же методам
относятся и всевозможные варианты электрохимических синтезов, термическое
разложение металлсодержащих соединений молекулярных комплексов.
Синтез НРЧ в
реакциях восстановления
Восстановление до металлов может осуществляться как в газовой, так и в
конденсированной, в том числе и твердой, фазах. Факторы, влияющие на полноту и
скорость окислительно-восстановительной реакции, весьма разнообразны и
определяются характером проведения процесса.
Наряду с подбором эффективных пар окислитель - восстановитель, на получение
металлсодержащих частиц оказывают влияние среда, температура, концентрация
реагентов, рН среды, диффузионные и сорбционные характеристики реагирующих
частиц, в том числе и стабилизирующих веществ (например, ПАВ, функциональные
полимеры и др.).
В настоящее время наиболее распространены вследствие своей доступности и
достаточно высокой скорости реакции восстановления металлсодержащих соединений
в водных и неводных средах. В то же время не утратили свое значение и методы
гетерогенного восстановления в системах газ - твердое тело, в частности
водородом и водородсодержащими соединениями.
Химическое восстановление в жидких средах. Реакции химического осаждения
являются одним из основных методов получения УДП металлов, так как
осуществляются при относительно невысоких температурах и дают возможность
варьировать размеры НРЧ. Различные восстановители имеют свои особенности и
действуют в зависимости от окислительно-восстановительного потенциала системы и
условий проведения реакции, что и определяет свойства получаемых УДП [22].
Поведение металлической частицы в растворе определяется разностью
равновесного окислительно-восстановительного потенциала частицы и
соответствующего потенциала раствора [21]: если она положительна, наблюдается
рост частиц, если отрицательна - их растворение. В случае если разность между
редокс-потенциалом восстановителя и восстанавливаемого металла велика,
происходит быстрое, иногда почти мгновенное образование высокодисперсного
порошка, если же разность потенциалов незначительна, то можно получить металл в
виде сплошного слоя.
Окислительно-восстановительные потенциалы восстановителей (таблица 1)
очень сильно зависят от значения рН [42].
Таблица 1 Окислительно-восстановительные потенциалы (Е) некоторых восстановителей в водных
растворах
|
Восстановитель
|
Электродные реакции
|
Е, В
|
|
Борогидрид
|
BH4-+
8OH- = BO2- + 6H2O + 8ē BH4- + 8OH- = H2BO3-
+ 5H2O
+ 8ē
|
-0,45-0,06pH -0,4-0,06pH
|
|
Гидразин
|
N2H4 +
4OH- = N2 + 4H2O + 4ē N2H4 + 2OH- = 2NН2ОН+
2ē
|
-0,31-0,06pH 1,57-0,06pH
|
|
Гипофосфит
|
H2PO2-
+ 3OH- = HPO32- + 2H2O + 2ē H2PO2-
+ H2O = H2PO3- + 2H+ + 2ē H3PO2 + H2O = H3PO3
+ 2H+ +
2ē H3PO2 + H2O
= H2PO3- + 3H+ + 2ē H2PO2-
+ H2O = HPO3-2- + 3H+ +
2ē
|
-0,31-0,09pH
-0,504-0,06pH -0,499-0,06pH -0,446-0,09pH -0,323-0,09pH
|
Тетрагидробораты щелочных металлов МВН4 являются сильными
восстанавливающими реагентами. Они проявляют восстановительные свойства в любой
водной среде - кислой, нейтральной, щелочной. При этом восстановительная
активность тетрагидроборатных растворов возрастает с повышением кислотности. Это
связано с ускорением реакции гидролиза тетрагидроборат аниона и образованием
промежуточных продуктов - как молекулярных [В2Н6, ВН2ОН,
ВН(ОН)2], так и ионных [ВН3ОН, ВН2(ОН)2-,
BH(OH)3-], которые являются еще более
сильными восстановителями, чем ВН4-анион.
При взаимодействии борогидрид-иона с водой происходит его гидролиз с
выделением водорода [42]:
ВН4- + 4НОН → В(ОН)4- +
4Н2↑
При наличии в растворе ионов металлов, в частности, никеля, происходят
следующие превращения:
Ni2+ + BH4-
+ 4OH-→2 Ni ↓
+ B(OH)4- + 2H2↑
4 Ni 2+ +BH4- + 8OH- = 4 Ni ↓
+ BO2- + 6H2O
Ni 2+ + BH4- + 8OH- =
4 Ni ↓ + H2BO3- + 5H2O
Образование бора, по всей вероятности, обусловлено каталитическим
распадом восстановителя при участии протонов, источниками которых является
вода:
ВН4- + Н+ → ВН3↑+
Н2↑ → В↓ + 2,5 Н2↑
В результате восстановления соединениями бора: боранами, борогидридами
получаются УДП (20-40 нм), содержащие 1-3% бора [43], в то время как при
использовании диметил или диэтиламиноборанов содержание бора в металлических
порошках незначительно.
Таким образом, восстановление соединениями бора, с одной стороны, весьма
эффективно (низкая температура, время реакции от 0,25 до нескольких минут,
высокая дисперсность); с другой стороны, приводит к загрязнению получаемых УДП
бором. Кроме того, это достаточно редкие реактивы.
Восстановление различных соединений металлов (Ni, Cu, Ag и др.) можно проводить и с помощью
фосфорноватистой кислоты или ее солей. Скорость восстановления зависит от рН
среды, концентрации восстановителя, температуры и возрастает с их увеличением.
В настоящее время существуют разногласия по поводу того, что выступает
восстановителем: гипофосфит-ион или атомарный водород, образующийся при
гидролизе гипофосфит-иона. Долгое время [44] считалось, что восстановителем является
атомарный водород, выделяющийся в результате реакции взаимодействия
гипофосфит-иона с водой:
H2PO2- + H2O → H2PO3- + 2H↑
наночастица
окисление коррозия металл
Тогда суммарную реакцию металлизации можно представить следующим образом:
Ni2++ Н2РО2-+
Н2О → Ni ↓ + Н2РО3-
+ 2Н+
Совсем иной механизм предложен в работе [42]. В данном случае гидролиз
гипофосфит-иона рассматривается как двустадийный процесс:
Н2РО2-+ Н2О → Н2РО3-
+Надс + ē + Н+ → Н2РО3-
+ Н2↑
И суммарная реакция представляется в следующем виде:
Ni2++ 2Н2РО2-+
2Н2О → Ni ↓ + 2Н2РО3-
+ 2Н+ + Н2↑
Одновременно может протекать каталитический распад гипофосфит-иона на
поверхности выделяемого металла с образованием элементного фосфора, который
захватывается частицами восстанавливаемого металла. Содержание его в осаждаемом
металле возрастает с увеличением кислотности и в зависимости от природы металла
может достигать 25% (мол.).
Данный метод заслуживает особого внимания, так как позволяет в широких
пределах регулировать дисперсность. Более того, продукты реакции
(гипофосфит-ион и водород)способствуют значительной стабилизации частиц в
растворе. Недостатком этого метода является загрязнение полученных УДП
примесями фосфора и его соединений, устранить которые из осадка практически
невозможно.
Более распространенными восстановителями являются соединения гидразина. В
зависимости от рН редокс-потенциал гидразина меняется в пределах -0,5 В (рН ≈
3) − -1,15 В (рН ≈ 14), иона гидразония N2H5+
от -0,4 В до -1,26 В, а гидроксиламина соответственно от -0,4 В до -1,05 В.
Реакции восстановления металлов гидразином и его производными проводят обычно в
слабокислых или щелочных растворах. Скорость реагирования, как правило,
возрастает с увеличением щелочности раствора и концентрации компонентов.
Следует отметить, что гидразин, по сравнению с борогидридами и
гипофосфитами, имеет большое преимущество: образование в ходе реакции в
качестве побочных продуктов только газообразного азота N2, в результате чего, значительно снижается содержание
примесей в УДП.
Ni2+ + N2H4 + 4OH- → 2Ni ↓ + N2↑ + 4H2O
При восстановлении металлов, которые в щелочной среде образуют трудно
растворимые гидроксиды, вначале следует получать их комплексы с гидразином
[44], разлагающиеся при действии щелочи с выделением металла.
Получение НРЧ в реакциях, стимулированных
высокоэнергетическим излучением
Важным преимуществом методов получения металлсодержащих порошков НРЧ в
стимулированных излучением реакциях является возможность их синтеза в различных
средах и при низких температурах, а также возможность получения достаточно
чистого целевого продукта, лишенного примесей, сопутствующих, в частности,
химическим методам восстановления (неметаллических продуктов превращения
реагентов) [47].
Кроме того, данные методы дают возможность контролировать ход превращения
во времени и пространстве, в отличие от большинства чисто химических методов,
связанных с термодинамически и кинетически нестабильными системами.
Фотохимическое восстановление наиболее широко используемый метод, в
частности, при синтезе коллоидов благородных металлов и металлов платиновой
группы. Суть метода сводится к фотопереносу электрона непосредственно в акте
поглощения фотона при возбуждении квантами света полосы переноса заряда (ПЗ)
комплексов донорно-акцепторного типа лиганд - металл [47].
Следует отметить, что при получении коллоидов таким путём в растворы
также добавляют различные стабилизаторы.
Формирование металлсодержащих НРЧ в стимулированных облучением
твердофазных процессах связано в основном с реакциями распада и протекает с
образованием, как правило, единственного твердого продукта - металлсодержащих
частиц. В качестве таких соединений используют соли неорганических и
органических кислот, содержащих катионы благородных, тяжелых и переходных
металлов [48].
Криохимический синтез
Высокая активность кластеров металлов в отсутствие стабилизаторов
обусловливает их агрегацию в более крупные частицы. Процесс агрегации идёт
практически без энергии активации. Стабилизацию НРЧ практически всех элементов
удалось осуществить при низких (77) и сверхнизких (4-10) температурах методом
матричной изоляции [49].
Разработано несколько способов получения металлсодержащих НРЧ с
применением низких температур. Однако в основе каждого из них заложен общий
физический принцип осуществления - конденсация атомов металлов в матричную
систему или соконденсация соединений, выполняющих функцию матрицы, с парами
металлов. Чаще всего в качестве матриц используют аргон и ксенон. Пары атомов
металлов конденсируют с большим избытком инертного газа на охлаждаемую до 10-12
К поверхность.
На формирование наночастиц в процессе криоконденсации наиболее сильное
влияние оказывают: скорость достижения атомами охлаждаемой поверхности,
скорость потери атомами избыточной энергии через взаимодействие с конденсатом,
давление паров реагентов в криостате [49]. Получение наночастиц металлов путём
соконденсации на холодной поверхности позволяет легко вводить в их состав
различные добавки, изменяющие физико-химические свойства системы.
Наиболее распространен метод получения металлсодержащих наночастиц и их
органозолей путем совместной конденсации паров металла и органического
растворителя на охлаждаемую до 77 К поверхность. Полученный соконденсат затем
нагревают до комнатной температуры.
Этим способом были получены НРЧ разных металлов и металлсодержащие
коллоидные дисперсии, - например, фрактальные кластеры серебра с размером
частиц 9,4 - 21,0 нм, кобальта (4,0 - 50,0 нм) [49].
Электрохимические методы получения НРЧ
Электрохимический синтез металлических НРЧ - новая, быстро развивающаяся
область. Его основными достоинствами являются экспериментальная доступность и
возможность контроля и управления процессом получения наночастиц.
В основе метода лежит восстановление ионов металлов, образующихся при
растворении анода в электролите. В качестве электролитов обычно используют
водные растворы. Катодом служит медь или графит. Электролиз проводится при
50-90 0С. На текстуру образующегося металлсодержащего осадка, влияют
многие факторы: природа металла и растворителя, природа и концентрация ионов
(целевого металла и посторонних примесей), адгезионные свойства осаждаемых
частиц, температура, потенциал, определяющий плотность тока, условия диффузии и
др.
Введение в электролит стабилизаторов приводит к образованию в объеме
раствора металлических НРЧ, так как молекулы ПАВ, стабилизируя, переводят
осажденные частицы вновь в раствор [54]. Размер формирующихся частиц в
значительной мере определяется силой тока электролиза: варьирование силы тока
позволяет изменять размер частиц в несколько раз.
Реакции термического распада
Существует большой класс соединений металлов [21], разлагающихся при
нагревании с образованием УДП металлов: соли органических кислот, комплексы с
органическими лигандами (этаноламинами, этилендиамином и др.) и неорганические
соединения (карбонилы, азиды и др.). В зависимости от природы исходного
соединения, условий среды (фазовый состав, температура, атмосфера и так далее)
удается в широких пределах варьировать дисперсность, форму частиц и количество
примесей в получающихся УДП. Термолиз карбонилов металлов. Карбонильные прекурсоры представляют собой достаточно
обширный класс соединений d-металлов
с большим числом форм у одного металла [51, 52].
Механизм термического превращения карбонилов металлов заключается в
последовательном элиминировании лиганда - монооксида углерода [52], продуктами
термолиза являются только соответствующий металл и оксид углерода (II).
Mx(CO)y → xM + yCO↑
Тем не менее, при более тщательном исследовании в получаемых порошках
были обнаружены примеси оксидов, карбидов и сажи [52].
Термолиз карбонилов металлов в жидких средах позволяет получать
высокодисперсные частицы металлов, средний диаметр которых 6,0 - 11,0 нм.
Газофазный распад карбонилов широко используется на практике в виде варианта
CVD-метода для получения высокодисперсных металлических катализаторов
(например, термолиз на чистой поверхности угля в атмосфере водорода или гелия
[21]).
Недостатком этого метода является высокая токсичность исходных веществ и
относительно низкая дисперсность получаемого металлического порошка.
Термолиз азидов металлов. Наноразмерные частицы могут быть синтезированы при
термическом (иногда взрывном) распаде в твердой фазе инициирующих взрывчатых
веществ неорганической природы - азидов [51], перхлоратов ряда металлов,
например Ag, Pb, Cd и др.
M(N3)n→
M + 3/2nN2↑
Термический распад этих соединений в целом аналогичен фотохимическому и
радиолитическому, различия состоят лишь в размерах и концентрациях образующихся
частиц [52]. Средний размер металлических частиц в конце превращения составляет 50-200 нм и возрастает в следующем ряду: γ-радиолиз < фотолиз < термолиз.
Восстановление КСС различными восстановителями
Восстановление металлсодержащих солей до металлов
может осуществляться как в газовой, так и в конденсированной фазах. Факторы,
влияющие на полноту и скорость окислительно-восстановительной реакции, весьма
разнообразны и определяются характером проведения процесса. Наряду с подбором
эффективных пар окислитель ─ восстановитель, на получение
металлсодержащих частиц оказывают влияние среда, температура, концентрация
реагентов, рН среды (при проведении реакции в растворе; диффузионные и
сорбционные характеристики реагирующих частиц, в том числе и стабилизирующих
веществ (например, ПАВ, функциональные полимеры и др.). В настоящее время наиболее
распространены вследствие своей доступности и достаточно высокой скорости
реакции восстановления металлсодержащих соединений в водных и неводных средах.
В то же время не утратили свое значение и методы гетерогенного восстановления в
системах газ ─ твердое тело, в частности водородом и водородсодержащими
соединениями. Эти пути получения НРЧ наиболее эффективны, когда не удается
осуществить восстановление в растворах (несовместимость восстанавливаемого
соединения и продуктов со средой, недостаточная или плохая его растворимость и
т. п.).
Восстановление водородом и газообразными водородсодержащими
соединениями
Эти процессы могут осуществляться как в газовой
(различные варианты метода химического газофазного осаждения, плазмохимический
синтез и др.), так и в конденсированной, в том числе и твердой, фазах. Как
правило, их проводят при повышенной температуре (десятки, а иногда и сотни
градусов) и достаточно продолжительно.
Метод эффективен при получении порошков НРЧ кобальта.
Особенности и закономерности восстановления в гетерогенных реакциях подробно
изложены в широко известных монографиях (см., например, [40, 41]).
Восстановлением водородом растворенного в ТГФ прекурсора Co(η3-C8H12)(η4-C8H2) при давлении около 0,3 Мпа и в интервале 273-333 К в
присутствии поливинилпирролидона можно получить НРЧ кобальта размером < 1 нм
(273 К), 1,5 нм (293-333 К) [60].
Весьма интересным аспектом взаимодействия водорода с
металлическими и интерметаллическими частицами типа М'М" (М' ─
редкоземельные металлы, Ti, Zr, Са; М" ─ Ni, Co, Fe) представляется
«гидридное диспергирование», связанное с явлением охрупчивания и
самопроизвольного, без применения механических воздействий, самоизмельчения
металлов при обратимом воздействии водорода [61]. Процесс диспергирования
металла является следствием химического взаимодействия Н2 с
металлической фазой по уравнению М + Н2 → МН3 + Q [Q ≈ 30÷60 кДж/(моль Н2), 300-900 К]
с образованием гидридной фазы. Локальное увеличение объема твердой фазы из-за
появления гидрида (на 20-25%, что может соответствовать давлению в несколько
десятков МПа, приводит к возникновению напряжений и растрескиванию.
Многократное (до 100 и более) повторение циклов адсорбция - десорбция Н2позволяет
получать частицы порядка 1000 нм с узким распределением по размерам и состоящие
из кристаллитов менее 100 нм.
Химическое восстановление ионов кобальта в жидких средах
Образование НРЧ Со при химических реакциях в водных
или неводных средах, как правило, связано с протеканием
окислительно-восстановительных процессов. Стандартные окислительно-восстановительные
потенциалы наиболее часто используемых водных растворов металлсодержащих систем
приведены в [62]. Однако многие термодинамически возможные реакции настолько
кинетически заторможены, что без создания специальных условий скорость их
протекания чрезвычайно мала. Проведение восстановления в неводных средах (при
соответствующем подборе растворителя) позволяет избежать влияния среды на
полноту восстановления. Неводные среды, например диэтиловый эфир, ТГФ, бензол,
толуол и др., используются также для проведения реакции с применением
водоагрессивных, сильных восстановителей, таких как гидрид алюминия и его
производные. Для получения НРЧ Со наиболее широко используются все же
окислительно-восстановительные реакции в водных растворах (подробно с
современным состоянием и тенденциями исследований в этой области можно
ознакомиться в монографии [42]).
Следует подчеркнуть, что при получении НРЧ Со в водных
растворах восстановитель присутствует в определенной концентрации и при
заданном рН, следовательно, реальный редокс-потенциал среды может значительно
отличаться от стандартных значений. Зависимость его от рН среды представляет
собой линейную зависимость: Е = Е° + aрН. К имеющим практическое значение относятся такие восстановители, как
гидразин, тетрагидробораты и боразотоводородные соединения, гипофосфиты и
формальдегид с E ~ - (0,3 + 1,3)
В, которые более отрицательны, чем Е (Н2/2Н+) = 0.
Для получения высокодисперсных металлических порошков
и золей весьма существенно, чтобы разностьΔЕмежду редокс-потенциалами
восстановителя и восстанавливаемого металла была достаточно велика. Это условие
позволяет обеспечить высокую скорость протекания реакции и создать
благоприятные условия для образования большого числа зародышей новой фазы уже
на ранних этапах получения продукта.
Различие в методах получения золей и порошков НРЧ Со
отражается на их дисперсном составе. Как правило, металлсодержащие золи
формируют в среде, способствующей их стабилизации, т.е. препятствующей
коагуляции и росту частиц. В этих условиях восстанавливаемый металл тратится в
основном на создание новых зародышей, в результате чего дисперсность частиц
чрезвычайно высока (менее 10 - 15 нм). Такие среды создаются введением защитных
коллоидов или стабилизаторов. В качестве стабилизаторов используют органические
соединения трех основных групп [63]:
· природные и синтетические полимеры:
желатин, агар-агар, крахмал, поливиниловый спирт, полиэтиленгликоли,
поливинилпирролидон и др.;
· высокомолекулярные органические
кислоты и ПАВ в основном катионного типа;
· лиганды акцепторного типа: пиридин,
1,1′-дипиридил, фенантролин, фосфины и др.
В некоторых случаях роль стабилизатора могут играть
молекулы восстановителя.
Получение металлических коллоидов проводится в
условиях максимально высокой концентрации восстановителя [35], которая не
приводит к потере агрегативной устойчивости образующихся частиц. Для получения
порошков НРЧусловия менее жестки и после восстановления дисперсность
металлсодержащих частиц ниже, чем у золей, вследствие чего возможны рост частиц
и их агрегация.
Большое влияние на дисперсность образующихся при
восстановлении металлсодержащих частиц оказывают кинетические характеристики,
которые обусловлены природой и концентрацией восстановителя, его соотношением с
количеством редуцируемых истов, температурой и рН среды и др. [42]. Уменьшению
среднего размера частиц порошков способствуют понижение концентрации реагентов,
повышение температуры среды, введение в раствор ПАВ или комплексообразователей
[42]. При образовании металлических коллоидов соотношение восстановитель ─
восстанавливаемый ион металла обычно выше, а их абсолютная концентрация ниже,
чем при получении порошков.
Восстановление ионов кобальта гипофосфитом
Редокс-потенциал гипофосфита в зависимости от рН среды
меняется от -0,5 В (рН ≈ 2) до -1,57 В (рН ≈ 14), и восстановление
Со2+ может осуществляться как в щелочной, так и в кислой среде [42].
Одновременно может протекать каталитический распад гипофосфит-иона на
поверхности выделяемого металлического кобальта с образованием элементного
фосфора, который захватывается частицами восстанавливаемого металла. Содержание
его в осаждаемом металле возрастает с увеличением кислотности и в зависимости
от природы металла может достигать 25% (мол.). Порошки и золи металлов в
пирофосфатном способе синтезируют при 323-368 К. Коллоиды металлов получают в
присутствии стабилизаторов, аналогичных по своей природе используемым при
восстановлении тетрагидроборатами. Скорость восстановления зависит от рН среды,
концентрации восстановителя, температуры, и возрастает с их увеличением.
1.3 Основные принципы стабилизации УДП металлов
УДП металлов обладают развитой поверхностью и существенными искажениями
кристаллической решетки, что определяет их повышенную активность. Вследствие
чего они взаимодействуют с любыми веществами, содержащимися в среде, где их
формируют: следами кислорода, влаги, органики и даже инертными газами. При этом
наряду с обычными элементами сорбции на высокоразвитой поверхности происходят
интенсивные химические превращения, сопровождающиеся образованием карбидных,
оксидных и других пленок.
Кроме того, образовавшиеся "голые" кластерные частицы при
обычных условиях самопроизвольно компактируются и переходят в порошки с обычной
степенью дисперсности. Это приводит к частичной или полной потере уникальных
свойств, характерных для кластеров. Поэтому получение ультрадисперсных частиц,
особенно в жидких средах, должно сопровождаться процессами стабилизации [56].
Наиболее простым путем стабилизации металлических частиц кластерных
размеров является покрытие их поверхности лигандами; в качестве последних могут
выступать как небольшие молекулы (CO, NO, CH2=CH2), так и
полимеры - органические и неорганические [52].
Для получения наночастиц широко используют органические растворители
(сюрфактанты), выполняющих роль стабилизаторов. Они связывают поверхность
растущих кристаллов, образуют комплексы с атомными частицами в растворе,
контролируя, таким образом, их реакционную способность и диффузию к поверхности
формируемой частицы [57].
Стабилизация дисперсных металлов в органических средах зависит от ряда
факторов - температуры, дисперсности и концентрации металлической фазы,
химического строения и состава дисперсионной среды, а также соотношения
поверхности и объёма образующихся частиц [58].
Для стабилизации УДП можно использовать поверхностно-активные вещества
(ПАВ). В [58] показано, что соотношение вода/ПАВ влияет на дисперсность и форму
частиц: c увеличением содержания воды дисперсность снижается, и частицы приходят в непосредственный
контакт. Увеличение концентрации ПАВ приводит к увеличению дисперсности,
причем, чем ниже концентрация воды, тем более эффективное влияние оказывает
ПАВ.
Большинство исследований в данной области относится к синтезу наночастиц
сферической формы. Вместе с тем большой научный и практический интерес
представляет получение асимметричных частиц (нити, диски, эллипсоиды и др.).
Изменяя природу ПАВ, его концентрацию и другие факторы, можно управлять
размерами и формой мицелл - нанореакторов, что открывает перспективы для
получения частиц металла заданной формы [58].
Возможность стабилизации наночастиц полимерами определяется тем, что
пространственные размеры даже сравнительно низкомолекулярных соединений
сопоставимы с диапазоном действия сил притяжения между частицами или превышают
его (при молекулярной массе полимера выше 104).
В качестве стабилизаторов УДП, в основном, используют водорастворимые
полимеры: поливиниловый спирт, поли-N-винилпирролидон, полиэтиленимин [59]
природные высокомолекулярные соединения (ВМС) - желатин, гуммиарабик, агар-агар,
крахмал, белковые вещества и продукты их гидролиза, а также ВМС, растворимые в
органических средах (например, каучук, ланолин, нафтеновые кислоты).
Присутствие ВМС резко увеличивает агрегативную устойчивость образующихся золей
металлов, создавая стерические препятствия, мешающие агрегации коллоидных
частиц.
1.4 Твердые растворы
.4.1 Основные параметры твердых растворов
Способ восстановления различных прекурсоров (солей, комплексов металлов)
из водных растворов при контролируемых условиях реакции является одним из
немногих методов получения наноразмерных твердых растворов металлов в виде
порошков. Н.С. Курнаковым и С.Ф. Жемчужным еще в 1906 г. было показано [66],
что свойства твердых растворов отличаются (иногда очень сильно) от свойств
чистых компонентов. В частности, при образовании металлических твердых
растворов возрастает твердость и уменьшается электропроводность вещества.
Изменение состава твердых растворов позволяет изменять в широких пределах
свойства материалов и получать материалы с нужными свойствами. Свойства твердых
растворов могут изменяться в результате термической обработки, которая
позволяет получать их либо в неравновесном состоянии (закалка), либо в
состоянии, в той или иной степени приближенном к равновесному (отжиг, отпуск).
Твердые растворы исследуемой системы Fe-Co,
которая имеет обширную концентрационную область, относятся к типу твердых
растворов замещения (атомы растворенного элемента замещают атомы
элемента-растворителя в его кристаллической решетке, при этом число атомов в
элементарной кристаллической ячейке остается постоянным). Это подтверждается
следующими определяющими факторами :
) размерный фактор замещающих друг друга атомов: согласно правилу
установленному В. Юм-Розери (1934) [67], для образования широких по составу
областей гомогенности твердых растворов при температурах, далеких от температур
плавления компонентов, разница Δr в атомных радиусах замещающих друг
друга атомов не должна превышать 15%, т.е.
отношение Δr/r
≤ 15% (r - меньший
радиус).
В настоящее время чаще используется другой размерный фактор - межатомное
расстояние R [68]: непрерывные твердые растворы замещения образуются при всех
температурах при условии ΔR/R < 4 - 5%, ограниченные - при ΔR/R
< 6 - 12%, и
компоненты не растворяются друг в друге - при ΔR/R >
12%. Однако размерный
фактор не всегда является решающим;
2) химическое подобие компонентов. В качестве
параметра, определяющего возможность образования твёрдых растворов замещения,
используют близость температур плавления компонентов: для образования
непрерывных твёрдых растворов замещения требуется, чтобы ДТпл/Тпл< 27% [69];
) структурный фактор - кристаллические решётки атомов
растворителя и растворимого компонентов должны быть изоморфны, т.е. структурно
подобны.
.4.2 Фазовые состояния системы Fe-Со
В массивном состоянии система железо-кобальт при
повышенных температурах характеризуется непрерывной растворимостью компонентов
в твердой фазе (рис. 1.3) [58 - 60, 108]. В соответствии с диаграммой состояния
Fe-Co, твердый раствор на основе Fe с ОЦК-решеткой стабилен при пониженных температурах в
интервале концентраций до 75 ат. % Со. В интервале концентраций 90 - 93 ат. %
Со стабилен твердый раствор на основе у-Fe(Co) с ГЦК-решеткой
(высокотемпературная модификация). Чистый Со при комнатной температуре стабилен
в форме а фазы с ГПУ решеткой (низкотемпературная модификация). Тем не менее,
необходимо отметить тот факт, что наноразмерный Co, входящий в состав Fe-Coкомпозиций, также как и
индивидуальный массивный, присутствует в виде двух структурных модификаций:
низкотемпературной а Со (ГПУ) и высокотемпературной р -Со (ГЦК). В соответствии с диаграммой состояния Fe-Co, р -Со (ГЦК) стабилен при температуре свыше 985 °С во всем
интервале составов. Ниже
этой температуры в сплавах с содержанием кобальта до 81,6 ат. % происходит образование
неупорядоченною твердого раствора Со
(ГПУ), который при температурах ниже 790 °С и содержании кобальта (в % по
массе) от 20,88 до 80.85 % способен к упорядочению с образованием
сверхструктур. В исследуемых системах образования твердых растворов на основе
соединений Fe3Co, FeCo и FeCo3 выявлено не было.
Известен ряд работ, посвященных исследованию сплавов
системы Fe-Co. Полученные в разных работах данные о границах областей
существования фаз достаточно плохо согласуются друг с другом. По данным работы
[65], при содержании Со < 80 ат. %, образовывался твердый раствор на основе Fe с ОЦК-решёткой, а при содержании Со ~
90 ат. % - твердый раствор на основе с ГЦК-решёткой. По данным же [68], ОЦК фаза образуется при содержании Со < 80%, в интервале
65-80 ат. % Co наблюдается смесь ГЦК и ОЦК фаз, а
при содержании Со > 80 ат. % - монофазный твердый раствор на основе Co с ГЦК-решёткой. Электроискровое
диспергирование в спирте или воде [69] позволяет получать порошки сплавов Fe72Co28, Fe80Co20, Fe85Co15. При охлаждении в спирте, наряду с
ОЦК фазой, зафиксировано присутствие ГЦК фазы, что объясняется большими
скоростями охлаждения. При охлаждении в воде отмечается присутствие оксидов FeO и Fe3O4суммарно до 10 %.
1.5 Коррозия
В процессе эксплуатации изделий, вследствие химического или
электрохимического взаимодействия их с окружающей средой происходит коррозия,
что приводит к разрушению металлических конструкций.
Коррозия начинается с поверхности металла и, при дальнейшем развитии
этого процесса, распространяется вглубь. Средой, в которой происходит коррозия
металлов, являются различные жидкости и газы [70]. Коррозионный процесс
протекает на границе двух фаз: металл - окружающая среда, т. е. является
гетерогенным процессом взаимодействия жидкой или газообразной среды с металлом.
Широкое применение в химической промышленности находят сплавы железа, меди,
алюминия, никеля, кобальта, титана и др. Дальнейшее развитие техники выдвигает
проблему применения таких металлов, как тантал, цирконий, рений, германий,
торий, иридий.
Масштабы коррозии и убытки, причиняемые ею, станут очевидными, если
учесть, что около 10% всего производимого металла безвозвратно теряется
вследствие разрушающего действия коррозии.
Для правильной постановки практической работы по защите химических машин
и аппаратов от коррозии необходимо знание теории процессов коррозии и методов
борьбы с ней.
1.5.1 Классификация процессов коррозии
Коррозией называют процесс разрушения металлов при химическом,
электрохимическом и биохимическом взаимодействии их с окружающей средой.
Коррозия металлов классифицируется по механизму и условиям протекания процесса
и характеру коррозионного разрушения.
По механизму протекания процесса различают химическую, электрохимическую
и биохимическую коррозию.
Химическая коррозия - взаимодействие металла и коррозионной среды, при
котором окисление металла и восстановление окисленного компонента коррозионной
среды (деполяризатора) протекают в одном акте. Это процесс, протекающий за счет
гетерогенной химической реакции.
По условиям протекания к этому виду относятся:
газовая коррозия, т.е. окисление металла в газовой среде при высокой температуре и невозможности конденсации влаги на поверхности
металла;
коррозия в неэлектролитах, т.е. в жидкостях, непроводящих электрический
ток.
Электрохимическая коррозия - взаимодействие металла с коррозионной средой
(раствором электролита), при котором окисление металла и восстановление
окисленного компонента коррозионной среды (деполяризатора) протекают не в одном
акте. При этом виде коррозии одновременно протекают две реакции - окисления и
восстановления, локализованные на определенных участках поверхности
корродирующего металла. При электрохимической коррозии процесс растворения
металла сопровождается появлением электрического тока, т.е. передвижением
электронов по поверхности металла и ионов в растворе электролита от одного
участка к другому.
По условиям протекания к этому виду коррозии относятся:
атмосферная коррозия во влажной газовой или воздушной атмосфере;
коррозия в электролитах - жидкостях, проводящих электрический ток;
почвенная или подземная коррозия металлических сооружений, находящихся
под землей;
электрокоррозия под действием внешнего источника тока, т.е. коррозия
изделий, находящихся под землей, вызванная блуждающими токами;
контактная коррозия металлов - разрушение металла в растворе электролита
вследствие контакта с другим металлом, имеющим более положительный электродный
потенциал, чем потенциал основного металла;
коррозия под напряжением - разрушение металла при одновременном
воздействии агрессивной среды и механических напряжений. Различают коррозионное
растрескивание, коррозионную усталость, коррозию при трении и коррозионную
кавитацию.
Биохимическая коррозия - это процесс, связанный с воздействием
микроорганизмов на металл. При этом металл разрушается вследствие того, что он
служит питательной средой для микроорганизмов, или под действием продуктов,
образующихся в результате их жизнедеятельности. Биохимическая коррозия, как
правило, протекает в растворах электролитов, поэтому параллельно может
протекать и электрохимическая коррозия.
1.5.2 Некоторые виды коррозии
Атмосферная коррозия
Атмосферной коррозией называют разрушение металлов и сплавов во влажном
воздухе при обычной температуре. Это самый распространенный вид коррозии.
Примерно 80% металлических конструкций эксплуатируется в атмосферных условиях.
Атмосферная коррозия металлов носит, в основном, электрохимический характер и
протекает в тонких слоях влаги, сконденсировавшейся на поверхности металла.
Основными факторами, определяющими скорость коррозии в атмосфере,
являются степень увлажненности поверхности корродирующих металлов, наличие
загрязнений и температура.
По степени увлажненности поверхности металла различают следующие типы
атмосферной коррозии: сухая, влажная и мокрая.
Сухая атмосферная коррозия - это коррозия при полном отсутствии пленки
влаги на поверхности металла. Механизм сухой коррозии металлов представляет
собой чисто химический процесс взаимодействия агрессивных газов с окисленной
поверхностью. В сухом воздухе на поверхности металла образуются оксидные
пленки, которые снижают дальнейшее окисление металла. Если в воздухе имеются
другие газы, например сернистые соединения, защитные свойства пленки могут
снизиться и скорость коррозии в связи с этим возрастет.
Влажная атмосферная коррозия протекает при наличии на поверхности металла
тончайшей невидимой пленки влаги, которая образуется в результате конденсации
при относительной влажности воздуха ниже 100%. Конденсация влаги в такой
атмосфере может быть различной:
Капиллярная.
Адсорбционная.
Химическая.
Механизм коррозии металлов во влажной атмосфере преимущественно
электрохимический. На работу коррозионного микрогальванического элемента
оказывает существенное влияние сопротивление пленки влаги на поверхности
металла.
Влажность воздуха является одним из главных факторов, способствующих
образованию на поверхности металла пленки влаги.
На скорость атмосферной коррозии металлов оказывает влияние также состав
пленки влаги, температура, контакт с другими металлами.
На скорость атмосферной коррозии значительно влияет контакт двух
металлов, обладающих различными значениями электродных потенциалов.
При решении вопроса о допустимости контакта между металлами или сплавами
следует руководствоваться следующими данными. Все металлы и сплавы разделены на
пять основных групп: 1 - магний; 2 - цинк, алюминий, кадмий; 3 - железо,
углеродистая сталь, свинец, олово; 4 - никель, хром, хромистая сталь,
хромоникелевые стали; 5 - медно-никелевые сплавы, медь, серебро. Контакт металлов,
входящих в одну группу, считается допустимым, но металлы каждой последующей
группы усиливают коррозию металлов предыдущей группы.
Для защиты металлов от атмосферной коррозии широко используются следующие
методы.
Легирование металлов.
Снижение относительной влажности воздуха.
Использование ингибиторов.
Применение защитных покрытий.
Локальная коррозия
Локальной коррозией называют коррозию, при которой разрушение металлов и
сплавов происходит на отдельных участках, в то время как остальная часть поверхности
изделия почти не разрушается. К локальной коррозии относятся межкристаллитная,
точечная, контактная и щелевая.
Межкристаллитная коррозия
К межкристаллитной коррозии склонны нержавеющие стали, алюминиевые и
никелевые сплавы. Этот вид коррозии один из наиболее опасных видов местной
коррозии, вызывающий избирательное разрушение по границам зерен, в результате
происходит потеря пластичности и прочности сплава, т. е. преждевременное
разрушение изделий. Причиной склонности сплавов к межкристаллитной коррозии
является электрохимическая неоднородность структуры сплава, когда границы зерен
или приграничные зоны являются более электрохимически отрицательными по
сравнению с зерном.
Точечная (питтинговая) коррозия
Питтинговая коррозия - один из опасных видов локального коррозионного
разрушения, характерного для условий, когда пассивное состояние поверхности
металла или сплава может частично нарушаться. При этом коррозии подвергаются
весьма ограниченные участки металла, а вся остальная поверхность находится в
устойчивом пассивном состоянии, что приводит к появлению точечных язв или
глубоких питтингов. Обычно такой коррозии подвергаются легко пассивирующиеся
металлы и сплавы: хромистые и хромоникелевые стали, алюминий и его сплавы,
никель, титан и др.
Основное условие образования питтинга - смещение электрохимического
потенциала, за счет наличия окислителей в растворе, положительнее некоторого
критического значения, так называемого потенциала питтингообразования, при этом
поверхность питтинга является анодом и разрушается с высокой скоростью
вследствие контакта с остальной поверхностью, находящейся в пассивном состоянии
и представляющей собой, благодаря относительно большой площади, почти
неполяризуемый катод.
При развитии питтинговой коррозии следует различать три стадии:
возникновение, развитие питтинга и репассивация.
Возникновение точечной коррозии металлов и сплавов в сильной степени
зависит от природы анионов и их концентрации. Наиболее сильными
анионами-активаторами являются Cl−, Br−.
Такие анионы, как OH−, CrO42−,NO3−,
SO42−, ClO3−затрудняют
возникновение точечной коррозии нержавеющей стали в растворе хлорида натрия.
На возникновение точечной коррозии оказывают влияние состав сплава,
природа металла, состояние поверхности и т. д. Например, с повышением
содержания никеля и хрома сопротивление сталей точечной коррозии повышается.
Термическая обработка повышает склонность сталей к точечной коррозии.
Для защиты от точечной коррозии используют электрохимические методы,
ингибиторы и легирование металла. Так, легирование сталей хромом, кремнием,
молибденом повышает их стойкость к точечной коррозии.
Контактная коррозия
Контактной коррозией называется электрохимическая коррозия, вызванная
контактом металлов, имеющих разные стационарные потенциалы в данном
электролите. При этом возникает коррозионный гальванический
элемент, работа которого влияет на скорость коррозии контактирующих металлов.
На контактную коррозию металлов большое влияние оказывают площади катодов и
анодов, состав среды, перемешивание нейтрального раствора и др.
С увеличением площади катода при постоянной площади анода скорость
контактной коррозии растет. Если скорость коррозии контролируется скоростью
диффузии, например диффузией кислорода при коррозии с кислородной
деполяризацией, то с увеличением площади катода скорость контактной коррозии
повышается. При перемешивании нейтрального раствора растет диффузия кислорода к
поверхности катода, следовательно, увеличивается контактная коррозия.
Контактная коррозия может проявляться и в атмосферных условиях. При этом максимальная
скорость коррозии наблюдается на участках, непосредственно прилегающих к месту
контакта. По мере удаления от места контакта плотность тока коррозионного
элемента падает и, следовательно, скорость контактной коррозии снижается.
Для защиты от контактной коррозии в основном применяются следующие
методы:
− подбор контактируемых металлов и сплавов с минимальной разницей
потенциалов;
− изоляция металлов в местах контакта;
− введение в закрытые системы ингибиторов, снижающих коррозию
контактируемых металлов.
Щелевая коррозия
Щелевой коррозией называется усиление коррозии в щелях и зазорах между
металлами, прокладочными материалами и металлом, в морских условиях (между
слоем микроорганизмов и обшивкой корабля). Наиболее чувствительны к щелевой
коррозии пассивирующиеся металлы (нержавеющие стали, алюминиевые сплавы, титан
и др.).
В зависимости от вида контроля электрохимической коррозии затруднение
доступа кислорода может вызывать увеличение или уменьшение скорости коррозии
металла в зазоре. Если скорость коррозии контролируется анодным процессом, то
торможение доступа кислорода вызывает увеличение скорости коррозии металла в
зазоре. Если же скорость коррозии контролируется катодным процессом,
затруднение доступа кислорода вызывает уменьшение скорости коррозии металла в
зазоре.
Газовая коррозия
Многие металлические конструкции подвергаются коррозионному разрушению
при воздействии на них сухих газов (воздуха, продуктов горения топлива при
высоких температурах и др.), а также жидких не электролитов (нефть, бензин,
жидкая сера, бром и др.). В этом случае протекает гетерогенная химическая
реакция газообразной или жидкой среды с металлом, при которой окисление металла
и восстановление окислительного компонента коррозионной среды протекают в одном
акте. Это химическая коррозия. Наиболее распространенным видом химической
коррозии является газовая коррозия - это коррозия металлов в газах при высоких
температурах.
Газовая коррозия имеет место при высокотемпературной обработке металлов
(ковка, штамповка, прокатка, термообработка и др.), при эксплуатации многих
металлических изделий (газовые турбины, химические аппараты, двигатели
внутреннего сгорания и др.).
Эксплуатируемые при высоких температурах металлические изделия должны
сохранять высокие механические свойства: длительную прочность и сопротивление
текучести (жаропрочность), а также сопротивляться коррозионному воздействию
(жаростойкость).
Термодинамическая возможность протекания процесса газовой коррозии может
быть определена путем сопоставления упругости диссоциации оксида металла при
данных условиях и парциального давления кислорода в газовой фазе.
Химическая реакция окисления металла Me + 1/2O2 = MeO будет
находиться в равновесии, если упругость диссоциации оксида ( MeO P ) и
парциальное давление кислорода в газовой фазе ( O2P ) равны. Если O2P
>MeO P, то будет протекать реакция окисления металла, если же MeO P >O2P
, то реакция протекает в обратном направлении, т. е. в сторону восстановления
данного оксида до чистого металла и кислорода. упругость диссоциации оксидов возрастает с повышением
температуры, т.е. сродство металла с кислородом падает. При Т = 2000 К медь
становится неокисляемым металлом. Для остальных металлов, даже при высоких
температурах, протекание реакции окисления термодинамически вероятно. Однако
если резко снизить парциальное давление кислорода в газовой фазе, то для Fe,
Zn, Ni станет термодинамически вероятным не процесс окисления, а процесс
восстановления из оксидов, что и используется при выплавке металлов из руд. При
этом температурная зависимость реальной скорости окисления металлов совершенно
иная, чем для термодинамической вероятности процесса окисления: с повышением
температуры скорость окисления металлов растет.
При газовой коррозии происходит непосредственное взаимодействие атомов
металла и кислорода с образованием пленки оксида данного металла.
Молекулы кислорода, достигшие поверхности металла, адсорбируются наней.
Различают два типа адсорбции:
− физическую, осуществляемую за счет Ван-дер-Ваальсовых сил;
− химическую, или хемосорбцию, осуществляемую за счет сил
химического взаимодействия.
Обычно кислород хемосорбируется на поверхности металла с высоким тепловым
эффектом, близким к тепловому эффекту образования оксида. Поэтому адсорбцию
кислорода можно рассматривать как химическое взаимодействие, приводящее к
образованию зародышей новой фазы - оксида металла. Следовательно, адсорбция
кислорода является начальной стадией окисления металла.
Процесс окисления протекает следующим образом. Вначале на чистой
поверхности металла происходит физическая адсорбция кислорода, которая приводит
к ослаблению связей между атомами в молекуле кислорода. Молекулы диссоциируют,
и атомы кислорода оттягивают электроны от атомов металла. Наступает стадия
химической адсорбции, когда смещение электронов к кислороду с образованием О2−равносильно
образованию зародышей оксида. Таким образом,
при взаимодействии кислорода с металлом образуется оксидная пленка.
Образование оксида может происходить на поверхности металла, на
поверхности или внутри оксидной пленки. Первый случай имеет место, если
превалирует скорость диффузии кислорода, второй - если превалирует скорость
диффузии ионов металла. В большинстве случаев скорости диффузии ионов (или
атомов) кислорода и ионов металла соизмеримы и зона роста оксидной пленки
находится внутри.
В соответствии с ионно-электронной теорией окисления Вагнера, в оксидной
пленке протекает встречная диффузия ионов металла и кислорода. При этом
поверхность металла является анодом и на ней протекает реакция ионизации атомов
металла. Положительные ионы металла и освободившиеся электроны перемещаются в
пленке раздельно.
Электроны перемещаются со значительно большей скоростью, диффузия ионов
металла протекает по дефектным местам кристаллической решетки или по ее
междоузлиям. На скорость перемещения электронов и ионов оказывают влияние
удельная электропроводность оксидной пленки и размеры ионов металла, атомов и
ионов кислорода.
Адсорбировавшиеся из газовой фазы молекулы кислорода диссоциируют на
внешней поверхности оксида. Атомы кислорода диффундируют внутрь оксидной
пленки, где, принимая электроны, превращаются в ионы О2−. Ионы
кислорода продолжают диффундировать вглубь навстречу ионам металла. Таким
образом, внешняя поверхность пленки, на которой кислород принимает электроны,
является катодом. Следовательно, встречная диффузия ионов металла и кислорода
протекает в электрическом поле.
Скорость газовой коррозии принято выражать через скорость роста оксидной
пленки
ок = dy/dττ,
где Uок - скорость газовой коррозии; y - толщина оксидной
пленки; ττ
- время окисления
металла.
В одних случаях пленки могут расти до заметных толщин, в других они будут
чрезвычайно тонкими, порядка нескольких молекулярных слоев.
Одним из основных условий, определяющих способность образованного
первичного слоя оксида тормозить дальнейшее окисление металла, является
сплошность получаемой пленки.
Если объем получаемого оксида Voк меньше объема металла VMe,
то образуется несплошная пористая пленка, обладающая низкими защитными
свойствами. Наоборот, если объём пленки больше объема окислившегося металла (Voк/VMe>1),
то можно ожидать образования сплошных пленок, обладающих способностью защищать
металл от коррозии.
В зависимости от характера образующихся пленок возможны различные
закономерности роста оксидных пленок.
Линейный закон роста пленок. Для металлов, образующих не сплошные пленки,
скорость роста пленки остается постоянной во времени:
/dτ= к∙С,
где у - толщина пленки; τ - время окисления; к - постоянная
величина,
С -концентрация окислителя на поверхности металла, независимая от времени
из-за большой легкости адсорбции.
После интегрирования
y = kτ + A,
где А − постоянная интегрирования. Следовательно, толщина пленки,
или величина химической коррозии, пропорциональна времени окисления. Константа
интегрирования А определяет толщину пленки в начальный момент окисления (τ
= 0). Если принять, что
окисление начинается на чистой металлической поверхности, то А = 0.
Линейный закон роста оксидных пленок наблюдается на щелочных и
щелочноземельных металлах, имеющих отношение (Voк/VMe)<1).
При определенных условиях (достаточно высокая температура) этому закону
подчиняются также металлы, образующие летучие, легко возгоняющиеся оксиды.
Скорость коррозии таких металлов, в основном, определяется скоростью сублимации
их оксидов. К ним относятся осмий, молибден, рутений, иридий, ванадий, вольфрам
и сплавы, содержащие достаточное количество этих элементов.
Параболический закон роста пленок. Для металлов, у которых
(Voк/VMe)>1, процесс коррозии будет тормозиться
диффузией кислорода через сплошную пленку и все больше замедляться по мере ее
роста.
Рассмотрим не начальный момент окисления, а такое состояние, когда на
металле уже имеется некоторая сплошная пленка толщиной y . Тогда можно
записать:
dn= Kd P (dc/dy)∙dτ,
где dn- масса диффундирующего вещества, г;d- коэффициент
диффузии,см2/c,
Р- поперечное сечение, cм2;/dy-
градиент концентрации кислорода, г/см3;τ - время диффузии, c.
Если считать режим диффузии
стационарным, то dc/dy можно заменить отношением (С0− С1)/y,
где С0 -
концентрация кислорода на внешней поверхности пленки;
С1 - концентрация
кислорода на границе пленки с металлом.
При этом C1≈
0 , так как при имеющейся толщине пленки у весь кислород, проникающий через пленку, сразу же
вступает в реакцию.
Тогда скорость диффузии на
единицу поверхности металла равна,
d =dn/P = K d∙(C0 / y) (1)
Если скорость роста пленки Uок
равна скорости диффузии кислорода,
Ud=dy / dτ=Kd ∙ (C0
/y ) (2) или ydy=KdC0 dτ (3)
Интегрируя это выражение,
получаем:
2= Kτ + A, (4)
где К- константа, учитывающая
коэффициент диффузии и концентрацию кислорода, зависящая от температуры; A -
постоянная интегрирования, которая характеризует толщину пленки в начальный
момент (ее можно принять равной нулю).
Исходя из уравнения (1),
можно заключить, что в данном случае окисление металлов протекает по
параболической кривой. Скорость роста пленки
/dτ= tgφ (5)
представляет собой тангенс
угла наклона касательной, проходящей через данную точку (рис 1).
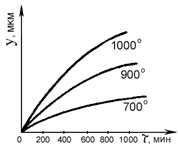
Рис.
1 Параболические кривые окисления железа на воздухе при повышенных температурах
По параболическому закону наблюдается окисление для ряда технически
важных металлов, таких, как железо, кобальт, никель, медь, а также марганец,
бериллий, цирконий, титан.
Логарифмический закон роста пленок.
Для некоторых металлов рост пленки во времени происходит медленнее, чем
это следует из закона стационарной диффузии, т.е. параболического закона
окисления металлов. Наблюдается логарифмическая зависимость скорости окисления
= ln(Kτ) (6)
Экспериментально логарифмический закон роста пленок установлен при
окислении алюминия и цинка в интервале температур 225-280°С, железа до 375°С,
никеля до 650°С.
Линейный ход кривых в полулогарифмических координатах доказывает
существование логарифмической зависимости окисления. Наличие такого закона
окисления у алюминия, цинка, хрома, кремния, объясняют уплотнением внешних
слоев пленки с увеличением толщины ее, в связи с чем уменьшается скорость
диффузии кислорода во времени.
Приведенные законы роста окисных пленок справедливы для определенных
условий. На практике для одного и того же металла, в зависимости от температуры
окисления, времени, состава атмосферы, могут иметь место все случаи окисления.
Влияние различных факторов на газовую коррозию
Скорость газовой коррозии в значительной степени меняется в зависимости
от внутренних и внешних факторов.
К внутренним факторам относятся природа металла, состав сплава, его
структура, обработка поверхности, наличие напряжений.
Состав сплава влияет на скорость газовой коррозии сталей. Значительное
повышение устойчивости к газовой коррозии происходит при легировании сталей хромом, алюминием, кремнием, что связано с
образованием на поверхности оксидных пленок с высокими защитными свойствами.
Высокой жаростойкостью обладают сплавы никеля с хромом - нихромы,
содержащие 80% никеля и20% хрома. Углерод не вызывает заметных изменений в
скорости коррозии.
Структура сплава в незначительной степени влияет на скорость газовой
коррозии. При переходе стали из ферритной структуры в аустенитную наблюдается
некоторое замедление окисления при повышении температуры.
Характер обработки поверхности металла влияет на скорость газовой коррозии
лишь в начальной стадии окисления: гладкие поверхности имеют несколько меньшую
скорость газовой коррозии.
К внешним факторам относятся температура, состав газовой среды, скорость
движения газа, условия нагревания и так далее.
С повышением температуры скорость окисления металлов значительно
возрастает. Это связано с увеличением константы скорости реакции и коэффициента
диффузии кислорода. Металлы при высоких температурах
могут взаимодействовать с кислородом, парами воды, оксидом углерода (IV),
оксидом серы (IV) по реакциям:
2Me + O2 = 2MeO;+ CO2 = MeO + CO;+ H2O
= MeO + H2;
Me + SO2 = 2MeO + MeS.
Защитные свойства образующихся пленок различны, что влияет на скорость
окисления металлов в указанных средах. Так, при температуре900°С скорость
окисления железа возрастает в ряду Н2О →→СО2 →→
О2 →→ SO2.
Значительное увеличение скорости окисления металлов наблюдается при
повышении концентрации кислорода в атмосфере инертных газов, содержащих
небольшие примеси кислорода. При переходе же от атмосферы воздуха к атмосфере
чистого кислорода не наблюдается увеличения скорости коррозии пропорционально
увеличению парциального давления кислорода.
Скорость движения газа заметно влияет на скорость коррозии в начальной
стадии окисления. Однако при очень больших скоростях движения газовой среды
возникает опасность эрозионного разрушения оксидных пленок, что может сильно
увеличить скорость коррозии. Наличие резких колебаний температуры в процессе
нагревания может привести к разрушению защитных
оксидных пленок. Коэффициент термического расширения оксида, как правило,
значительно ниже, чем для чистого металла. Вследствие этого резкие колебания
температуры способствуют возникновению добавочных внутренних напряжений и
механическому разрушению оксидной защитной пленки
Ãëàâà 2. Ìåòîäèêàýêñïåðèìåíòà
.1 Объекты исследования и оборудование
Таблица 2 Исходные объекты, используемые для исследования общей стабильности к
окислению в зависимости от состава НРП.
|
Состав образцов
|
Соотношение металлов в
образцах
|
|
Ni Сo
FeCo NiCo CoFe CoFe FeCo
|
100% Ni 100% Co
60% Fe, 40% Co 85% Ni, 15% Co 55% Fe, 45% Co 1% Fe, 99% Co 80% Fe, 20% Co
|
Таблица 3 Исходные объекты, используемые для исследования влияния
состава и концентрации, и природы ПАВ на стабильность к окислению.
|
Название исследуемого
образца
|
Соотношение металлов в
системе
|
Комментарии
|
|
1 2 3 4 5 6
|
30% Co 70% Fe
30% Co 70% Fe 30% Co 70% Fe 30% Co 70% Fe 30% Co 70% Fe 30% Co 70% Fe
|
Чистый образец 1 условная
часть этанола 2 условных части этанола 3 условных части этанола 1 условная
часть диметилглиоксима 2 условных части диметилглиоксима
|
Таблица 4 Исходные объекты, используемые для исследования влияния
соотношения металлов в твердом растворе системы Co-Fe.
|
Наименование системы
|
Соотношение металлов в
системе
|
|
CoFe CoFe CoFe
CoFe CoFe CoFe CoFe CoFe CoFe CoFe
|
95% Co, 5% Fe
90% Co, 10% Fe 80% Co, 20% Fe 75% Co, 25% Fe 70% Co, 30% Fe 65% Co, 35% Fe
60% Co, 40% Fe 50% Co, 50% Fe 40% Co, 60% Fe 30% Co, 70% Fe
|
2.2 Пробоподготовка
Перед началом анализа образцы сушились под вакуумом в течение суток,
данная процедура позволяет полностью удалить влагу имеющуюся в образце в
результате синтеза. Затем отбор подходящих образцов проводился в результате
анализа кривых малоуглового рассеяния. Выбирались образцы с похожим распределением,
для того чтобы сравнение их было достаточно корректным. Следующая операция это
взвешивание, бралась навеска наноразмерного порошка, из выбранных образцов,
взвешивалось не более чем 0,2 грамма, затем порошок засыпался в стеклянную
трубку. После разогрева реакционного объема, образец перемещается в реакционный
сосуд и после этого начинается измерение. Данная трубка герметична, и до начала
измерения образец не контактирует с кислородом до начала анализа. Некоторая
часть образцов, что будет описано ниже, выдерживалась в атмосфере воздуха в
течение 12 часов при комнатной температуре, а другая часть порошков была
исследована в диапазоне температур от комнатной до 150 градусов на
экспериментальной установке по изучению газовой коррозии.
2.3 Принципиальная схема экспериментальной установки для
изучения процесса окисления при комнатной температуре
Моделирование процессов окисления осуществлялось посредством
экспериментальной установки собственного производства, принципиальная схема
которой приведена на рис. 2.
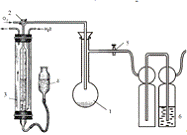
Рис.
2. Экспериментальная установка для определения устойчивости к коррозии
металлических порошков
-
реакционный сосуд; 2 - трехходовой кран; 3- газовая бюретка (газометр); 4 -
стеклянная груша с запорной жидкостью; 5 - кран; 6 - запорная емкость.
Для поддержания постоянной температуры газа газовая бюретка частично
помещается в сосуд с водой. В качестве запорной жидкости применяются растворы
КОН или NaCl. При опускании груши уровень жидкости в газометре должен в первый
момент уменьшится, а затем стабилизируется на определенной высоте.
Навеска испытуемого образца помещена в реакционный сосуд и закрывается
пробкой с трубкой для продувки газом. Для этого кран 2 переводят в режим
продувки реакционного сосуда, кран 5 необходимо открыть.
Переводим кран 2 в положение измерение и стеклянной грушей 4 выставляем
уровень «0» в газовой бюретке и закрываем кран 5.
Груша закрепляется на такой высоте, чтобы уровень запорной жидкости в
газометре и груше совпали.
Давление в газометре в ходе испытания регулируется перемещением груши
вверх. При этом необходимо добиться, чтобы высота столба жидкости в газометре и
груше была все время одинаковой.
При использовании данной методике были получены зависимости степени
окисления рассматриваемых образцов от времени окисления.
2.4 Принципиальная схема экспериментальной установки для
изучения процесса окисления при заданной температуре
Моделирование процессов окисления осуществлялось посредством
экспериментальной установки собственного производства, принципиальная схема
которой приведена на рис. 3.
Измерение с помощью данной установки отличается от измерения при помощи
установки для измерения при комнатной температуре тем, что нам следует ждать
установление термического равновесие, и только затем перемещать порошок в
реакционный термостатированный сосуд. И только после перемещения и
уравновешивание общего объема газа, мы можем начинать измерение изменения
объема газа.
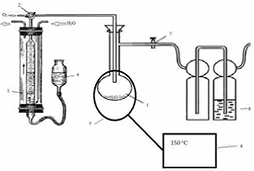
Рис.
3. Экспериментальная установка для определения устойчивости к коррозии металлических порошков при заданной температуре
-
реакционный сосуд; 2 - трехходовой кран; 3- газовая бюретка
(газометр); 4 - стеклянная груша с запорной жидкостью; 5 - кран; 6 - запорная
емкость; 7 - термостат; 8 - термоконтроллер.
.5 Вспомогательные методы исследования
.5.1 Рентгенография
Фазовый состав и дисперсную структуру нанометрических порошков никеля
исследовали методами мало - и широкоугловой рентгенографии: по кривым
малоуглового рассеяния рассчитывались массовые функции распределения
неоднородностей по размерам и сопоставлялись с функциями распределения по
размерам кристаллитов, рассчитанными по профилю дифракционного пика (111). Все
расчеты выполнены в приближении сферической формы частиц.
Методика измерения
Измерения интенсивности малоуглового рассеяния проводили на установке
КРМ-1 (рис. 4) в медном излучении (Ni-фильтр) посредством подсчёта импульсов в отдельных точках в интервале
углов от 0.06° до 3 ° (по 20¢). Образцы помещались в кювету с лавсановыми окошками (толщина лавсановой
пленки 20 мкм, толщина слоя образца 0.5 мм). Для устранения рассеяния
рентгеновских лучей на воздухе проводили вакуумирование рабочей камеры при
помощи форвакуумного насоса. Режим работы рентгеновской
трубки: U = 30 кВ, I = 20 мА.
Расчет функций распределения по размерам
В качестве рабочей модели были выбраны однородные сферы. Оптимальные
значения расчетных параметров: число точек на кривой распределения, ширина
интервала, плотность точек на разных участках кривой подбирались эмпирически.
Основным критерием отбора было соответствие расчетных и экспериментальных
кривых рассеяния.

Полученные экспериментальные данные были нормированы на интенсивность
падающего пучка, после чего в них вводилась поправка на коллимационные
искажения. Для обработки данных использовалось программное обеспечение,
разработанное авторами [64, 65].
Рентгенофазовый анализ профиля дифракционного пика
(111) (от 42° до 47° по 20¢) для расчета функций распределения по размерам кристаллитов выполнены на
дифрактометре ДРОН-2.0 также в медном излучении (Ni-фильтр).
Описание установки.
В аппарате ДРОН-2.0 используется монохроматическое
излучение, источником которого является рентгеновская трубка. Питание трубки
осуществляется от высокостабильного источника питания высоковольтного ВИП
2-50-60М. Измерение углового положения дифракционных отражений осуществляется
гониометрическим устройством ГУР-8.
Методика измерений
Схема фокусировки по Брэггу-Брентано представлена на
рис 5.При такой фокусировке рентгеновское излучение от источника 1,
находящегося на круге фокусировки, через систему щелей Соллера 2, системы 3 и
4, ограничивающих расходимость пучка в горизонтальном и вертикальном
направлениях, падает на исследуемый образец 5, плоскость которого касается
фокусирующей окружности. Дифрагированное излучение от исследуемого образца
через систему щелей Соллера 6, аналитическую щель 7, находящуюся на
фокусирующей окружности, и ограничивающую пучок в вертикальном направлении щель
8 попадает в детектор, в котором кванты рентгеновского излучения преобразуются
в электрические импульсы.
Импульсы поступают в устройство
электронно-вычислительное унифицированное УЭВУ-МI-2, усиливаются и подаются в одноканальный дискриминатор,
который может ограничивать импульсы, как по нижнему уровню, так и по верхнему и
нижнему уровням, то есть пропускает лишь импульсы, соответствующие энергии
квантов характеристического излучения.
Рис.
5. Рентгенооптическая
схема.
После дискриминатора импульсы могут быть направлены в
интенсиметр, где измеряется скорость счета, и в пересчетное устройство, в
котором производится счет импульсов за выбранный промежуток времени или
считывается время, за которое набрано определенное количество импульсов. В
первом случае регистрация производится прямопоказывающим прибором интенсиметра
и самописцем, во втором ─ световым табло пересчетного устройства,
цифропечатающей машинкой и (или) перфоратором [66].Запись дифракционной картины
производили в интервале углов 15-45 градусов (2Θ).
Пробоподготовка.
В дифрактометрии поликристаллов используют плоский
препарат. Обычно это либо порошок, тем или иным способом нанесенный на
плоскость держателя, либо таблетка, спрессованная из порошка, либо срез
массивного поликристаллического агрегата [67].В данном случае исследовали
нанометричесий порошок никеля, который равномерным слоем наносили в стеклянную
лунку диаметром 20 и глубиной 2 мм. Указанные размеры лунки позволяют избежать
потерь первичного пучка по площади и глубине.
Затем на порошок накладывали стеклянную пластину и, слегка покачивая её и
постепенно увеличивая давление, разравнивали порошок и прессовали. Избыток его
срезали в одно касание ребром пластины. Причем, не следует приглаживать
поверхность препарата, так как это приводит к текстурированию. В случае
неудачного среза порошок снова перемешивали и операцию повторяли.
2.5.2 Растровая электронная микроскопия
Электронно-микроскопические исследования проводились
на растровом сканирующем электронном микроскопе JEOLJSM 6390, блок-схема которого приведена на рис. 6.
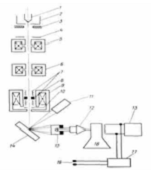
Рис.
6. Схема электронной и рентгеновской оптики комбинированного РЭМ-РМА.
-
катод; 2 - модулятор; 3 - анод; 4 - ограничивающая диафрагма; 5 -
первая конденсорная линза; 6 - вторая конденсорная линза; 7 - катушка
двойного отклонения; 8 - стигматор; 9 - конечная (объективная) линза; 10 - диафрагма, ограничивающая
размер пучка; 11 - детектор рентгеновского излучения (кристалл-дифракционный
или с дисперсией по энергии); 12 -
усилитель фотоумножителя; 13- генераторы развертки; 14- образец; 15 - детектор вторичных электронов; 16 -
к катушке двойного
отклонения; 17 - управление увеличением; 18 - ЭЛТ.
Электронная оптика РЭМ дает возможность исследователю
сформировать электронный пучок, который характеризуют три параметра: ток пучка i(диапазон изменения 10−12
- 10−6A),
диаметр пучка d(5 нм-l мкм) и расходимость α (10-4-10-2).
Электронный пучок, определяемый параметрами d, iи α, входит в камеру объекта и попадает на определенное место
образца. Внутри области взаимодействия происходит как упругое, так и неупругое
рассеяние, в результате чего в детекторах возникают сигналы за счет упругих,
вторичных и поглощенных электронов, характеристического и непрерывного
рентгеновского излучения, катодолюминесцентного излучения. Измеряя величину
этих сигналов с помощью соответствующих детекторов, можно определить в месте
падения электронного пучка некоторые свойства объектов, например локальную
топографию, состав и так далее.
Чтобы исследовать объект не только в одном месте,
пучок нужно перемещать от одной точки к другой с помощью системы сканирования.
Типичная система сканирования с двойным отклонением,
как показано на рис. 6, имеет две пары отклоняющих катушек, расположенных в
полюсном наконечнике конечной (объективной) линзы, которые отклоняют пучок
сначала от оси, затем возвращают его на оптическую ось, причем второе
пересечение оптической оси происходит в конечной диафрагме. Такая система
обладает преимуществом: при уменьшении рабочего расстояния уменьшается
коэффициент сферической аберрации.
Пучок за счет «процесса сканирования» перемещается во
времени через последовательные положения на образце (например, 1, 2, 3 на
рис.7), зондируя свойства образца в контролируемой последовательности точек. В аналоговой
системе сканирования пучок движется непрерывно вдоль линии (развертка по
строке), например в Х-направлении. После завершения сканирования вдоль линии
положение линии слегка сдвигается в Y-направлении (развертка по кадру), и процесс повторяется, образуя на
экране растр. В цифровой системе развертки пучок адресуется в определенное
место X − Y-растра. В этом случае пучок может занимать только
определенные дискретные положения по сравнению с непрерывным движением в
аналоговой системе; однако суммарный эффект остается одним и тем же.
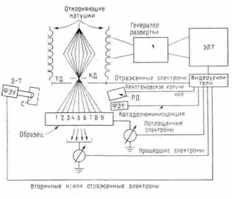
Рис.
7. Схема сканирующей системы растрового электронного микроскопа.
КД
- конечная диафрагма; ТД - твердотельный
детектор электронов; Э - Т -
детектор Эверхарта-Торнли;ФЭУ -фотоумножитель; С- сцинтиллятор; РД -
рентгеновские спектрометры (кристалл-дифракционные и/или с дисперсией по
энергии); ЭЛТ - электронно-лучевые трубки, предназначенные для наблюденияи
фотографирования изображения. Цифры 1-9 обозначают последовательные положения пучка
при сканировании.
Пробоподготовка
Для получения электронной микрофотографии использовали коллоидную взвесь
наночастиц никеля в ацетоне. Для приготовления суспензии брали навеску 0,1 г,
помещали её в пробирку с притёртой крышкой на 20 мл и добавляли ацетон в
количестве 10 мл.
При взбалтывании полученной смеси образуется коллоидный раствор
наночастиц никеля в ацетоне. Затем при помощи дозатора на 5мкл отбирали пробу и
помещали на графитовый столик. После испарения ацетона на графитовом столике
остается слой наночастиц. Образец готов для исследования.
.6 Обработка результатов эксперимента
.6.1 Вычисление объема поглощаемого кислорода при комнатной
температуре
Объём поглощенного кислорода приводится к нормальным условиям (Т0=273,15
К, Р0=760 мм.рт.ст). Расчет ведется по формуле:
V0=V*( P-W)*T0/(T*P0) (7)
где Vo- объём кислорода при нормальных условиях, л;н=Р-
W - парциальное давление кислорода в газометре, мм. Т. Ст.;
Р - барометрическое давление, мм. Т. Ст.;- упругость паров воды над
запорной жидкостью, мм. Т. Ст.
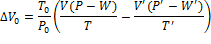
Эксперимент проводится дважды. Абсолютные допускаемые расхождения
параллельных испытаний не должны превышать 0,5%.
Степень превращения
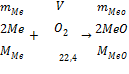
mMe-масса навески металла, г;
MMe-молярная масса металла, г/моль;
V-объем
поглощенного кислорода, л;
mMeO-масса оксида металла, г;
MMeO-молярная масса оксида металла, г/моль.

α-степень превращения, %;
m0-масса навески металла до окисления,
г.

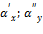 -степень превращения металлов, %;
-степень превращения металлов, %;
Vобщ- объем кислорода, поглощенный
взаимными системами, л.
По результатам вычислений построены зависимости степени превращения по
времени.
2.6.2 Вычисление
объема поглощенного кислорода при заданных
температурах
Объём поглощенного кислорода приводится к нормальным условиям (Т0=273,15
К, Р0=760 мм.рт.ст). Расчет ведется по формуле:
V0=V*Pн *T0/(T*P0) (11)
где Vo- объём кислорода при нормальных условиях, л;н=Р-
W - парциальное давление кислорода в газометре, мм. Т. Ст.;
Р - барометрическое давление, мм. Т. Ст.;- упругость паров воды над
запорной жидкостью, мм. Т. Ст.
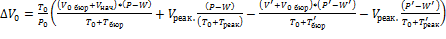
где ∆V0 - изменение объема в ходе эксперимента;
T0, P0 - температура и давление при нормальных условиях;
V0
бюр - объем газа в
бюретке до начала эксперимента;
Vнач - объем газа в бюретке при начале
измерения;
Tбюр - температура при начале измерения;
Vреак - реакционный объем;
Tреак - температура реакционного сосуда;
V - объем газа при прошествии определенного времени;
- объем газа при прошествии определенного времени;
P , W
, W - барометрическое давление и
упругость паров воды над запорной жидкостью при прошествии определенного
времени;
- барометрическое давление и
упругость паров воды над запорной жидкостью при прошествии определенного
времени;
T бюр - температура бюретки по прошествии определенного времени;
бюр - температура бюретки по прошествии определенного времени;
T реак - температура реакционного сосуда по прошествии определенного времени.
реак - температура реакционного сосуда по прошествии определенного времени.
Эксперимент проводится дважды. Абсолютные допускаемые расхождения
параллельных испытаний не должны превышать 0,5%.
Степень превращения
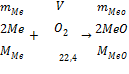
mMe-масса навески металла, г;
MMe-молярная масса металла, г/моль;
V-объем
поглощенного кислорода, л;
mMeO-масса оксида металла, г;
MMeO-молярная масса оксида металла, г/моль.

α-степень превращения, %; m0-масса навески металла до окисления, г.

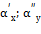 -степень превращения металлов, %;
-степень превращения металлов, %;
Vобщ- объем кислорода, поглощенный
взаимными системами, л.
По результатам вычислений построены зависимости степени превращения по
времени.
Ãëàâà 3.
ÐÅÇÓËÜÒÀÒÛ
È ÈÕ
ÎÁÑÓÆÄÅÍÈÅ
.1 Изучение кинетики НРП переходных металлов систем Co-Fe и Co-Ni при окислении кислородом
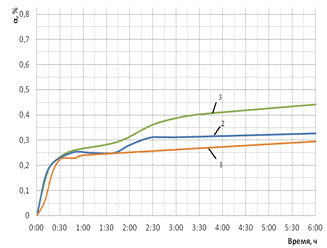
Рис.
8. Влияние состава порошков на кинетику окисления при комнатной температуре
где:1 - FeCo(3:2); 2 - FeCo(1:99); 3 - Co(100).
Типичная кривая окисления наноразмерных порошков переходных металлов
представлена на рисунке 8. Из которого видно, что значительного эффекта в
присутствии железа в системе не достигается. Образцы ведут себя практически
одинаково при окисления при комнатной температуре.

Рис.
9. Кинетика окисления порошков содержащих никель и кобальт при комнатной
температуре где: 1 - Ni(100%); 2 - CoNi(15:85).
На рисунке 9 показывает, различие скорости и глубины окисления системы
никель-кобальт выше, чем у чистого никеля. Поведение частиц содержащих как
никель, так и кобальт схоже с представленными результатами на рисунке 8.
Исходя из данных, мы делаем предположение, что никель обладает
пассивирующими свойствами, а образцы с содержанием железа переходят в
шпинельные формы, что также затрудняет дальнейшее окисление порошков.
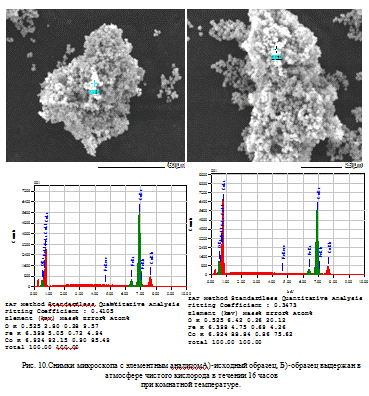
В связи с тем что ренгеноструктурный анализ не дает полной картины
окисляемости наших образцов, был проведен эксперимент на растровом электронном
микроскопе с элементным анализом. Был взят образец до окисления и снят на
микроскопе, затем образец был выдержан в атмосфере чистого кислорода в течении 16 часов и также
была сделана его фотография. Анализируя данные фотографии мы пришли к
следующему предположению, что в начальных стадиях окисления, оксид образуется
аморфный вследствие чего не виден в ренгеноструктурном анализе.
3.2 Изучение влияния природы, концентрации ПАВ при синтезе
НРП на стабильность к окислению при различных температурных режимах
Для изучения данной проблемы были выбраны наиболее “стабильный” состав
системы кобальт-железо в твердорастворной области, для этого были получены
следующие образцы: система Co-Fe (30% Co, 70% Fe),
ПАВ - этанол и диметилклиоксим, в различных концентрациях, которые были
подобраны опытным путем.

Рис.
11. Кинетика окисления чистого образца, и образцов, содержащих разными ПАВ, в
различных концентрациях при 75˚С, где: 1 - 2 части диметилглиоксима; 2 -1
часть диметилглиоксима; 3 - 3 части этанола; 4 - 1 часть этанола; 5 - образец
без ПАВ.
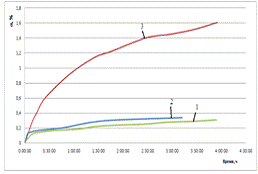
Рис.
12. Влияние концентрации этанола на кинетику окисления при 100˚C,
где: 1 - 3 части этанола; 2 - 1 часть этанола; 3 - 2 части этанола.

Рис.
13. Влияние этанола на кинетику окисления системы CoFe при 150˚C,
где: 1 - 1 условная часть этанола; 2 - 2 условных части этанола.
Анализируя рисунки 11-13, мы пришли к выводу, что большое количество ПАВ
влияет на дисперсность частиц, так как, при добавление большой концентрации ПАВ
при синтезе, после образования мелких частиц не дает им расти дальше,
вследствие чего уменьшая дисперсность, и такие порошки легче окисляются за счет
большей удельной поверхности. А малое количество ПАВ приводит к образованию
поверхностной пленки, которая в свою очередь защищает частицы от сильного
окисления газообразным кислородом.
Также рассмотрено влияние температуры на данные объекты, и были сделаны
следующие выводы, что с увеличением температуры степень превращения растет, и
после 150 градусов, когда ПАВ у нас сгорает, образцы очень сильно окисляются.

Рис.
14. Кинетика окисления железа с глицерином и без него, где: 1- железо с
глицерином; 2 - железо без содержания глицерина.
На рисунке 14 рассмотрено влияние добавления глицерина при синтезе
наноразмерных частиц железа, и сделан вывод, что глицерин очень хорошо
покрывает защитной пленкой частицы железа, уменьшая окисляемость кислородом
почти в 4 раза.
3.3 Изучение влияния состава наноразмерных порошков на
стабильность к окислению кислородом системы Co-Fe
Образцы для исследования получены в “оптимальных” условиях согласно[71].
Для изучения стабильности к окислению кислородом при температурном диапазоне от
50 - 75 ˚C. Были взяты образцы различного состава от 95% Co,
до 30% Co.
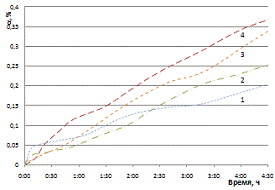
Рис.
15. Влияние фазового состава системы Co-Feна кинетику
окисления при 50˚C, где: 1 - Co 80%; 2 - Co
60%; 3 - Co 75%; 4 - Co 50%.

Рис.
16. Кинетика окисления системы Co-Feв зависимости от состава Fe при 50˚C,где:
1 - Fe 30%; 2 - Fe 35% ; 3 - Fe
70%; 4 - Fe 5%; 5 - Fe 10%; 6 - 60%.

Рис.
17. Влияние соотношения металлов в системе Co-Feна
кинетику окисления при Т= 75˚С, где:1 - Co 75%; 2 - Co
80%; 3 - Co 60%; 4 - Co 50%; 5 - Co
70%; 6 - Co 65%.
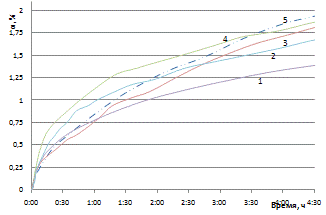
Рис.
18. Влияние содержания железа в системе Co-Fe на кинетику окисления при 75˚С,
где:1 - Fe 70%; 2 - Fe 50%; 3 - Fe 5%; 4 - Fe 60%; 5 - Fe 10%.
Фазовый портрет очень сложным образом влияет на окисляемость системы
Co-Fe. При низких температурах больший вклад добавляет дисперсность порошков, и
агломерация образцов. А при более высоких температурах больший вклад в
окисляемость уже вносит фазовый портрет.

Рис.
19. Функции распределения частиц по размеру системы Co-Fe,
где: 1 - Co 50%; 2 - Co 30%; 3 - Co
40%; 4 - Co 95%; 5 - Co 90%; 6 - Co
80%; 7 - Co 75%; 8 -Co 65%; 9 - Co
70%; 10 -Co60%; 11 - Co50%.
ВЫВОДЫ
• Позитивная роль образующихся при
синтезе в качестве побочных продуктов шпинелей заключается в том, что они,
формируя на поверхности наноразмерных металлических частиц плотные
пассивирующие покрытия, защищают их от более глубокого окисления, а также,
вероятно, ограничивают их рост.
• ПАВ, в больших концентрациях не
защищают наноразмерные порошки, а делают их мельче, вследствие чего, активность
в реакциях окисления становится выше, чем у
обычных наноразмерных металлов. А заметные защитные свойства проявляют ПАВ при
добавлении их в незначительных концентрациях. Также стоит отметить влияние
глицерина, как защитного реагента. Разница между чистым наноразмерным порошком
железа и таким же порошком железа, но с добавлением глицерина, состоит в том,
что стабильность к окислению газообразным кислородом возрастает примерно в 4
раза.
• На окисление также влияет, какая фаза
преобладает в образце, так например, чистая ГЦК подвергается более сильному
окислению, чем ОЦК, а большей устойчивостью к
окислению обладают образцы, в которых присутствуют обе фазы. Также было
отмечено, что при низких температурах, ниже 50
градусов Цельсия, больший вклад в окисляемость вносит дисперсность исследуемого
порошка, а не какая фаза преобладает.
СПИСОК ЛИТЕРАТУРЫ
1. Сысоев,
Н.Н. Нанотехнологии и физика / Н.Н. Сысоев, А.И. Осипов, А.В. Уваров // Вестник
МГУ им. Ломоносова. - 2009. - С. 3 - 9.
. Третьяков,
Ю.Д. Уроки зарубежного нанобума / Ю.Д. Третьяков, Е.А. Гудилин // Вестник РАН.
- 2009. - Т. 79. - № 1. - С. 3 - 17.
. Мелихов,
И.В. Золотое сечение нанотехнологической науки /И.В. Мелихов // Вестник РАН. -
2007. - № 11. - С. 988.
. Третьяков,
Ю.Д. Проблемы развития нанотехнологий в России и за рубежом / Ю.Д. Третьяков //
Вестник РАН. - 2007. - № 1. - С. 88 - 99.
. Алферов,
Ж.И. Навстречу золотому веку / Ж.И. Алферов // Поиск: еженедельная газета
научного сообщества. - № 4. - 2008. - С. 11 - 13.
. Алферов,
Ж.И. О программе Российской академии наук в области нанотехнологий / Ж.И. Алфѐров // Вестник РАН. - 2008. - № 5. -
С. 427 - 435.
. Губин,
С.П. Что такое наночастица? Тенденции развития нанохимии и нанотехнологии /
С.П. Губин // Российский химический журнал. - 2000. - - Т. XLIV. - № 6. - С. 23
- 31.
. Кобаяси,
Н. Введение в нанотехнологию: [перевод с японского А.В. Хачояна]; под ред. Л.Н.
Патрикеева / Н. Кобаяси - М.: БИНОМ, Лаборатория знаний, 2005. - 134 с.
. Фостер,
Л. Нанотехнологии. Наука, инновации и возможности: [пер. с англ.] / Л. Фостер -
М :Техносфера, 2008. - 352 с.
. Новиков,
В.П. Получение наноразмерных порошков никеля, железа, кобальта путем
восстановления их солей раствором натрия в жидком аммиаке / В.П. Новиков, В.В.
Паньков, Л.И Куницкий // Неорганические материалы. - 2004. - Т. 40. - № 8. - С.
928 - 934.
11. Chaubey,
G.S. Synthesis and Stabilization of FeCoNanoparticles / G.S. Chaubey, C.
Barcena, et al. // J. Am. Chem. Soc. - 2007. - P. 7214 - 7215.
. Chen,
J.P. Magnetic Properties of nanophase cobalt particles synthesized in inversed
micelles / J.P. Chen, C.M. Sorensen, K.J. Klabunde, G.C. Hadjipanayis // J.
Appl. Phys. - 1994. - V. 76. - № 10. - P. 6316 - 6318.
. Дзидзигури,
Э.Л. Свойства ультрадисперсных порошков металлов, полученных химическим
диспергированием / Э.Л. Дзидзигури, Д.В. Кузнецов и др. // Перспективные
материалы. - 2000. - № 6. - С. 87 - 92.
. Захаров,
Ю.А. Наноразмерные металлы группы железа / Ю.А. Захаров, В.М.
Пугачев,А.Н.Попова и другие. // Физико-химические процессы в неорганических
материалах (ФХП - 10): сборник докладов Десятой международной конференции: в 2
т. [гл. ред. Ю.А. Захаров]; ГОУ ВПО «КемГУ». - Кемерово: Кузбассвузиздат -
2007. - Т. 2. - С. 293 - 299.
15. Hormes,
J. The Influence of various coatings on the electronic, magnetic, and
geometrical properties of cobalt nanoparticles (invited) / J. Hormes, H.
Modrow, H. Bonnemann, C.S.S.R. Kumar // J. Appl. Phys. - 2005. - V. 97 (10R102).
- P.6.
. Толочко,
О.В. Структура и магнитные свойства наночастиц на основе железа в оксидной
оболочке / О.В. Толочко, Д.-В. Ли и др. // Письма в ЖТФ. - 2005. - Т. 31. -
Вып. 18. - С. 30 - 36.
. Гусев,
А.И. Эффекты нанокристаллического состояния в компактных материалах и
соединениях / А.И. Гусев // Успехи физ. наук. - 1998. - Т. 168 - С. 53 - 83.
. Губин,
С.П. Получение, строение и свойства магнитных материалов на основе
кобальтсодержащих наночастиц / С.П. Губин, Ю.А. Кокшаров // Неорганические
материалы. - 2002. - Т. 38. - № 11. - С. 1287 - 1304.
. Степина,
И.М. Синтез, изучение дисперсной структуры и некоторых свойств нанометрических
порошков никеля и кобальта / Колмыков Р.П., Степина И.М. // Исследовательская и
инновационная деятельность учащейся молодёжи: проблемы, поиски, решения:
сборник трудов областной научно-практической конференции молодых ученых
Кузбасса / ИУУ СО РАН -
Кемерово,
2006. - Т.1. - С. 64-71.
. Федоров,
В.Б. Энергонасыщенные системы и кластеры / В.Б. Федоров, И.В. Тананаев // Журн.
Всесоюзн. хим. о-ва им. Д.И. Менделеева.- 1987.- Т. 32.- № 1.- С. 43-47.
. Сергеев,
Г.Б. Нанохимия / Г.Б. Сергеев. - М.: КДУ. - 2006. - С.230.
. Варгафтик,
М.Н. От полиядерных комплексов к коллоидным металлам / М.Н. Варгафтик // Журн.
Всесоюзн. хим. о-ва им. Д.И. Менделеева.-1987.- Т. 32.- № 1.- С. 36-42.
. Федоров,
В.Б. Энергонасыщенные системы и кластеры / В.Б. Федоров, И.В. Тананаев // Журн.
Всесоюзн. хим. о-ва им. Д.И. Менделеева.- 1987.- Т. 32.- № 1.- С. 43-47.
. Губин,
С.П. Химия кластеров. Основы классификации и строение / С.П. Губин.- М.: Наука.
- 1987.- С.263.
. Блинков,
И.В. Физикохимия металлов и неметаллических материалов / И.В. Блинков. - М.:
Наука. - 1990.- С.109.
. Сергеев,
В.А. Парофазный метод синтеза кластерных металлических катализаторов / В.А.
Сергеев, А.Ю. Васильков, Г.В. Лисичкин // Журн. Всесоюзн. хим. о-ва им. Д.И.
Менделеева.- 1987. - Т. 32.- № 1. - С. 96-100.
27. Васильков,
А.Ю. Криохимический синтез нанометровых металлических частиц контролируемой
нуклеарности / А.Ю. Васильков, А.Ю. Оленин, П.В. Прибытков, В.А. Сергеев и др.
// Тез.докл. 1 Всесоюзн. конф. «Кластерные материалы». - Ижевск, 1991. -С.18.
28. Семененко,
К.Н. Кластер-глобула-металлическая фаза / К.Н. Семененко // Журн. Всесоюзн.
хим. о-ва им. Д.И. Менделеева.- 1987.- Т.32.- № 1.- С. 24-30.
. Гусев,
А.И. Наноматериалы, наноструктуры, нанотехнологии /
. А.И.
Гусев - М.: Физ - матлит, 2005. - 416 с.
. Лернер,
М.И. Технология получения, характеристики и некоторые области применения
электровзрывных нанопорошковметаллов / М.И. Лернер, Н.В. Сваровская, С.Г.
Псахье, О.В. Бакина // Российские нанотехнологии. - 2009. - Т. 4. - № 11 - 12.
- С.56 - 68.
. Рамзей,
Н. Молекулярные пучки / Н. Рамзей. - М.: Издатинлит. - 1960. --С.71.
. Рыжонков,
Д.И. Наноматериалы: учеб. пособие. / Д.И. Рыжонков, В.В. Левина,
Э.Л.Дзидзигури-М.: БИНОМ. Лаборатория знаний, 2008.-365 с.
. Александров,
М.Л. Газодинамические молекулярные ионные и кластерированные пучки / М.Л.
Александров, Ю.С. Кусиер // Л.: Наука. - 1989. - С.83-87
. Петров,
Ю.И. Кластеры и малые частицы / Ю.И Петров. - М.: Наука. - 1986. - С.121.
. Помогайло,
А.Д. Наночастицы металлов в полимерах / А.Д. Помогайло, А.С. Розенберг, И.Е.
Уфлянд // М.: Химия. - 2000. - С.166.
. Полак,
Л.С. Химия плазмы / Л.С. Полак, Г.Б. Синярев, Д.И. Соловецкий // Новосибирск:
Наука. - 1991. - С.198.
. Сальянов,
Ф.А. Основы физики низкотемпературной плазмы плазменных аппаратов и технологий
/ Ф.А. Сальянов. - М.: Наука. - 1997. - С.133.
. Авакумов,
Е.Г. Механохимические методы активации химических процессов / Е.Г. Авакумов -
Новосибирск: Наука. - 1986. - С.70.
. Дзидзигури,
Э. Л. Свойства УДП металлов, полученных химическим диспергированием. / Э. Л.
Дзидзигури, Д. В. Кузнецов, В. В. Лёвина, Е. Н. Сидорова // Перспективные
материалы. - 2000. - №6. - С. 87 - 92.
. Барре,
П. Кинетика гетерогенных процессов. Пер. с франц. под ред. В.В. Болдырева / П.
Барре. - М.: Мир - 1976. - С.117.
. Дельмон,
Б. Кинетика гетерогенных реакций. Пер. с франц. под ред. В.В. Болдырева / Б.
Дельмон. - М.: Мир. - 1972. - С.133.
. Свиридов,
В.В. Химическое осаждение металлов в водных растворах / В.В. Свиридов, Т.Н.
Воробьева, Т.В. Гаевская, Л.И. Степанова // Минск: Изд-во «Университетское».
- 1987. - С. 7.
. Хаин,
В.С. О восстановительной активности водных растворов ВН4-иона / B.C. Хаин, А.А. Волков // Химия неорганических гидридов: Сб.
научн. трудов. Отв. ред.- Р.Т. Кузнецов. - М.: Наука. - 1990. -С.38.
. Соцкая,
Н.В. Влияние фосфит-ионов на кинетику осаждения никеля гипофосфитом / Н.В.
Соцкая, Л.Г. Гончарова, Т.А. Кравченко, Е.В. Животова // Электрохимия. - 1997.-
Т. 33.- № 5.- С.529-533.
. Ключников,
Н.Г. Неорганический синтез / Н.Г. Ключников. - М.: Просвещение - 1988. - C.
224-225.
. Горбунова,
К.М. Осаждение металлических покрытий химическим восстановлением / К.М.
Горбунова // Журн. Всесоюзн. хим. о-ва им Д.И. Менделеева.- 1980.- Т. 25.- №
2.- С. 175-188.
. Бугаенко,
Л.Т. Химия высоких энергий / Л.Т. Бугаенко, М.Г. Кузьмин, Л.С. Полак // М.:
Химия. - 1988. - C.53.
. Болдырев,
В.В. Реакционная способность твердых веществ (на примере реакций термического
разложения). / В.В. Болдырев - Новосибирск: Изд-во СО РАН. / 1997. - С.127-143.
. Сергеев,
Г.Б. Криохимиянаночастиц металлов / Г.Б. Сергеев // Вест. Моск. Ун-та. Сер.2,
Химия. - 1999. - Т.40. - С.312-322.
. Браун,
М. Реакции твердых тел / М. Браун, Д. Доллимор, А. Галвей (пер. с англ. под
ред. В.В. Болдырева).- М.: Мир.- 1984.- С.360.
. Сыркин,
В.Г. Карбонилы металлов / В.Г. Сыркин. - М.: Химия. - 1984. -
С.74-75.
. Баев,
А.К. Структура и энергетика карбонилов металлов / А.К. Баев. - Минск: Высшая
школа. - 1986. - С.79.
. Рябых,
С.М. Образование и свойства ультрадисперсных частиц металла при разложении
азидов тяжелых металлов / С.М. Рябых, Ю.Ю. Сидорин // Сб.науч.тр. «Физикохимия
ультрадисперсных систем» (ред. И.В. Тананаева).- М.: Наука. - 1987.- С.127-132.
. Горбунова,
К.М. О новых областях применения и своеобразии строения химически осажденных
покрытий / К.М. Горбунова, М.В. Иванов // Журн. Всесоюзн. хим. о-ва им. Д.И.
Менделеева.- 1988.- Т. 33.- № 2.- С. 157-164.
. Колесников,
В.Н. Некоторые особенности формирования фазы серебра и меди при разложении
оксалатов / В.Н. Колесников // Укр. хим. журн.- 1993.- Т. 59.- № 3.- С.
249-253.
. Губин,
С.П. Химия кластеров - достижения и перспективы / С.П. Губин // Журн. Всесоюзн.
хим. о-ва им. Д.И. Менделеева.- 1987.- Т. 32.- № 1.- С. 3-11.
. Лунина,
М.А. О природе устойчивости высокодисперсных металлов в органических средах /
М.А. Лунина // Автореф. дисс. … докт. хим. наук.- М: Изд-во МХТИ.- 1970.- С.36.
. Сумм,
Б.Д. Объекты и методы коллоидной химии в нанохимии / Б.Д. Сумм, Н.И. Иванова //
Успехи химии.- 2000.- Т. 69.- № 11.- С. 995-1099.
. Литманович,
А.А. Фазовые равновесия в системах типа полимер-частицы-растворитель:
несовместимость и комплексообразование / А.А. Литманович, Ю.Е. Кузовлев, Е.В.
Полякова // Высокомолекулярные соединения. Сер. Б.- 1997.- Т.39.- № 9.- С.
1527-1530.
. Салова,
О.В. Адсорбция и гидрогенизация СОнаультрадисперсном порошке железа / О.В. Салова,
Н.Н. Михаленко, И.И. Михаленко, В.М. Грязнов // Журн. физ. химии. ─ 1998.
─ Т. 72. ─ С. 27.
. Семененко,
К.Н. Диспергирование соединений переходных металлов / К.Н. Семененко, В.В.
Буркашева // Ж. общ.химии. ─ 1992. ─ Т. 62. ─ С. 1448.
. Лидин,
Р.А. Константы неорганических веществ: Справочник / Р.А. Лидин, Л.Л. Андреева,
В.А. Молочко; Под ред. Р.А. Лидина. ─ 2-е изд., перераб. и доп. ─
М.: Дрофа, 2006. ─ 685 c.
. Логинов,
А.В. Методы получения металлических коллоидов. / А.В. Логинов, В.В. Горбунова,
Т.Б. Бойцова // Журн. общ.химии. ─ 1997. ─ Т. 67. ─ С. 189.
. Мальцева,
Н.Н. Борогидрид натрия / Н.Н. Мальцева, B.C. Хаин. ─
М.: Наука, 1985. ─ С 49.
. Морохов,
И.Д. Физические явления в ультрадисперсных средах / И.Д. Морохов, Л.И. Трусов,
В.Н. Лаповок. - М.: Энергоатомиздат, 1984. - 224с.
. Китайгородский,
А.И. Смешанные кристаллы / А.И. Китайгородский - М.: Наука, 1983. - 277 с.
. Юм -
Розери, В. Введение в физическое металловедение / В. Юм - Розери - М.:
Металлургия, 1965. - 204 с.
. Урусов,
В.С. Теоретическая кристаллохимия: Учебное пособие / В.С. Урусов - М.: Изд - во
МГУ, 1987. - 275 c.
. Мальцева
Г. Н. Коррозия и защита оборудования от коррозии:Учеб. Пособие /Г.Н.Мальцева -
Пенза:Изд-во Пенз. гос. ун-та, 2000. - 211 с.
. Попова,
А.Н. Синтез и некоторые физико-химические свойства наноразмерных систем Fe-Co и
Fe-Ni: дис. … канд. техн. наук: 02.00.04 / Попова Анна Николаевна. - Кемерово,
2011. - 187 с.