Влияние ионов на совместное определение платины, родия и иридия вольтамперометрическим методом
Введение
Платиновые металлы, соединения и материалы на их
основе (сплавы, катализаторы, порошки, покрытия, оксидные пленки) сочетают в
себе уникальные физические и химические свойства, благодаря чему играют важную
роль в разных отраслях промышленности. Россия входит в тройку лидеров по
производству платиновых металлов, которые образуют валютный фонд государства
[1].
Современный уровень развития науки и техники
выдвигает задачу определения малых количеств веществ во все более сложных
объектах, поэтому требования, предъявляемые к методам анализа следовых
количеств веществ, постоянно повышаются.
Актуальным также является разработка
условий анализа многокомпонентных систем.
Интерес к хлоридным и нитритным комплексам был
обусловлен тем, что при вскрытии руд платиновых металлов они присутствуют в
основном в виде хлоридных комплексов, а при аффинаже - в виде нитритных.
Вольтамперометрическому определению платиновых металлов в растворе их нитритных
комплексов предшествует стадия пробоподготовки: переведение нитритного
комплекса в хлоридный путем длительного упаривания с хлороводородной кислотой.
Недостатками данного способа являются длительность, трудоемкость и выделение
токсичных газов.
Целью данной работы является исследование
возможности инверсионно-вольтамперометрического определения платины, родия и
иридия при совместном присутствии в растворах их хлоридных и нитритных
комплексов.
Глава 1 ЛИТЕРАТУРНАЯ
ЧАСТЬ
1.1 Физико-химические
свойства платины, родия, иридия
Платина - химический элемент VIII
группы периодической системы, атомный номер 78, атомная масса 195,08, внешняя
электронная конфигурация 4f145d96s1. Серовато-белый пластичный металл.
Температуры плавления и кипения - 1769°С и 3800°С,удельное электрическое
сопротивление <#"660431.files/image001.gif">
а - электронакопление; б - окисление концентрата
Рисунок 1 - Схематическое изображение принципа
инверсионной вольтамперометрии
В последние годы активно применяют
модифицированные электродыдля устранения влияния так называемых «химических
шумов» - совокупности токов разряда примесей и емкостных составляющих [22].
Инверсионный вольтамперометрический метод
является одним из самых чувствительных методов используемых в микро- и даже
суб-микро анализе количества органических и неорганических веществ [23].
Основные метрологические характеристики -
коэффициент чувствительности, границы определяемых содержаний и предел
обнаружения, систематическая и случайная погрешности существенно зависят от
условий проведения анализа (времени электронакопления, потенциала электролиза,
природы фонового электролита) [24].
Существенными преимуществами инверсионных
электрохимических методов перед другими методами определения следовых количеств
неорганических и органических веществ в растворах являются:
· возможность определения значительного числа
химических элементов Периодической системы и многих органических веществ;
· низкие пределы обнаружения,
достигающие для некоторых элементов (Cd, Bi, Tl, Pb, Sb, Ni) и органических
веществ уровня 10-9 - 10-11 М;
· высокая селективность и хорошие
метрологические характеристики методик на их основе;
· легкость компьютеризации и
автоматизации аналитических определений;
· относительная простота и
сравнительная дешевизна приборов;
· наличие приборов новых моделей,
выпускающихся в последнее время в Санкт-Петербурге и Томске [25].
1.6 Постановка задач
исследования
В последние годы число публикаций, посвященных
инверсионным методам, неуклонно растет. Это связано с появлением новых
приборов, а также с переходом к использованию ртутных пленочных и твердых
электродов.
В опубликованных до сих пор обзорных работах и
книгах по электрохимическому инверсионному анализу платиновых металлов основное
внимание уделялось хлоридным комплексам [3,256,27]. В настоящее время известно
немного работ посвященных исследованию ниритных комплексов данных металов,
среди них [28,29]. Поэтому представляет определенный интерес рассмотреть
возможности применения ИВ для определения платины, родия и иридия в составе
нитритных комплексов, используемых в аффинаже, без
предварительного переведения их в хлоридные.
Актуальным также является разработка условий
анализа многокомпонентных систем. Известны методики инверсионного
вольтамперометрического определения родия и иридия из одной аликвоты [30].
Разность потенциалов анодного растворения платины, родия и иридия указывает на
возможность раздельного определения металлов при их совместном присутствии в
растворе.
Таким образом, целью данной работы явилось
исследование возможности инверсионно-вольтамперометрического определения
платины, родия и иридия при совместном присутствии в растворах их хлоридных и
нитритных комплексов. Данная проблема представляет в настоящее время большой
научный и практический интерес в связи с поступлением огромных объемов растворов
платиновых металлов в смывные воды аффинажных производств по причине
проблематичности экспрессного детектирования микроконцентраций этих металлов.
Для достижения поставленной цели предстояло
решить ряд задач:
· исследовать возможность
индивидуального определения хлоридных и нитритных комплексов платины, родия,
иридия, используя различные фоновые электролиты;
· проверить возможность раздельного
определения хлоридных и нитритных комплексов следующих пар платиновых металлов
из одной аликвоты: платина и родий, родий и иридий, платина и иридий;
· определить аналитические
характеристики метода инверсионно-вольтамперометрического определения платины,
родия и иридия при совместном присутствии, руководствуясь литературными данными
[31].
Глава
2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Реактивы, приборы и
посуда
H2[PtCl6],
х.ч.,
H3[RhCl6],
х.ч.,
H3[IrCl6], х.ч.,[Pt(NO2)4]·6
H2O, х.ч.,[Rh(NO2)6]·6
H2O, х.ч.,[Ir(NO2)6],
х.ч.,
концентрированная, х.ч.,
KCl, ч.д.а.,
H2SO4, ч.д.а.,,
ч.д.а.,,
ч.д.а.,
Муравьиная
кислота,
ч.д.а.,
Дистиллированная вода,
Аналитические весы METTLER
TOLEDO,
Спектрофотометр Analytic Jena SPEKOL 1300,
Кварцевые кюветы l=1см,
Анализатор вольтамперометрический ТА-4 (OOO
«НПП Томьаналит»),
Стаканчики из оптически прозрачного кварца
вместимостью 20 мл,
Рабочий электрод - углеродсодержащий,
Электрод сравнения - хлорсеребряный,
Вспомогательный электрод - хлорсеребряный,
Пипетки стеклянные вместимостью 0,1;0,5; 1,0;
2,0; 5,0; 10,0 мл,
Мерные колбы на 25, 50, 100 мл,
Дозатор пипеточный, ТУ 64 - 1 - 3329 - 81,
5-50мкл.
2.2 Планирование
эксперимента для оптимизации условий инверсионно-вольтамперометрического
определения платины, родия и иридия
Планирование проводим путем
полного факторного эксперимента. Параметр оптимизации - сила тока. Факторы,
влияющие на определение платины, родия и иридия:
х1 - время накопления (80 - 300
с);
х2 - потенциал накопления (-0,8
- (-0,4))В;
х3 - рН фонового электролита
(1-7).
Матрица планирования в
кодированной форме представлена в таблице 2.
Таблица 2 - Матрица
планирования ПФЭ 23
|
№
опыта
|
х1
|
х2
|
х3
|
у1
|
у2
|
у3
|
уср
|
|
1
|
-1
|
-1
|
-1
|
0,81
|
0,83
|
0,8
|
0,81
|
|
2
|
1
|
-1
|
-1
|
1,21
|
1,32
|
1,41
|
1,31
|
|
3
|
-1
|
1
|
-1
|
0,45
|
0,51
|
0,33
|
0,43
|
|
4
|
1
|
1
|
-1
|
0,91
|
1,08
|
1,09
|
1,03
|
|
5
|
-1
|
-1
|
1
|
0,76
|
0,71
|
0,85
|
0,77
|
|
6
|
1
|
-1
|
1
|
1,31
|
1,43
|
1,45
|
1,40
|
|
7
|
-1
|
1
|
1
|
0,53
|
0,59
|
0,65
|
0,59
|
|
8
|
1
|
1
|
1
|
0,98
|
1,09
|
1,07
|
1,05
|
По методу Йейтса рассчитали
коэффициенты регрессии (bi).
Дисперсию (su2) считали
по формуле:
Su2
= ((yср - y1)2
+ (yср - y2)2
+ (yср - y3)2)
/ (n-1). (13)
Полученные данные представлены
в таблице 3.
Таблица 3 - Значения
коэффициентов регрессии и дисперсии
|
№
опыта
|
уср
|
I
|
II
|
III
|
bi
|
su2
|
|
1
|
0,81
|
2,12
|
3,58
|
7,39
|
0,924
|
0,0001
|
|
2
|
1,31
|
1,46
|
3,81
|
2,19
|
0,274
|
0,0029
|
|
3
|
0,43
|
2,17
|
1,10
|
-1,19
|
-0,149
|
0,0024
|
|
4
|
1,03
|
1,64
|
1,09
|
-0,07
|
-0,009
|
0,0029
|
|
5
|
0,77
|
0,50
|
-0,66
|
0,23
|
0,029
|
0,0014
|
|
6
|
1,40
|
0,60
|
-0,53
|
-0,01
|
-0,001
|
0,0016
|
|
7
|
0,59
|
0,63
|
0,10
|
0,13
|
0,016
|
0,0010
|
|
8
|
1,05
|
0,46
|
-0,17
|
-0,27
|
-0,034
|
0,0010
|
По формулам (14-15) рассчитали
дисперсию эксперимента (Sср2)
и дисперсию коэффициентов регрессии (Sbi2):
Sср2
= ∑su2 / N
=0,0016 (14)
Sbi2
= Sср2 / N
= 0,0002 (15)
По критерию Граббса проверили
однородность дисперсии:
Gэкс=s2max/∑s2u=0,2 (16)
Gтабл=
0,5 (17)
Так как Gтабл
> Gэкс, дисперсия
однородна.
По формуле (18) нашли
погрешность коэффициентов регрессии:
Δbi
= ±t(p;f)·
Sbi = ±0,06 (18)
Сравнили абсолютные значения
коэффициента регрессии и его погрешности. Получили математическую модель:
у =0,92 + 0,27 х1 - 0,15 х2 (19)
Следовательно, влияющие факторы на параметр
оптимизации: x1 и х2.
Проверили адекватность математической
модели по критерию Фишера.
Fэкс=2,8 (20)
Fтабл=3,2 (21)
Так как Fтабл
> Fэкс, модель
адекватна.
Значения параметра оптимизации опыта центра
плана отражены в таблице 4.
Таблица 4 - Значения параметра оптимизации в
опыте в центре плана
|
х1
|
х2
|
х3
|
у1
|
у2
|
у3
|
yср
|
|
190
|
-0,6
|
4
|
1,06
|
1,01
|
0,88
|
0,98
|
По формуле (22) нашли оптимум:
|y0
- b0| = |Δb| (22)
|0,06|
= |0,06| (23)
Из полученных данных следует,
что кривизна поверхности значительна, оптимум близок.
2.3 Подготовка к
проведению вольтамперометрического определения
.3.1 Подготовка
электродов
Углеродсодержащий электрод применяют в качестве
рабочего. При подготовке поверхности электрода к работе срезают торец толщиной
0,3 - 0,5 мм и промывают дистиллированной водой.
Хлорсеребрянный электрод принимают в качестве
электрода сравнения и вспомогательного электрода. Перед работой серебряную
спираль выкручивали против часовой стрелки из корпуса электрода.
Корпус заполняли с помощью шприца раствором KCl
1М. Аналогичным образом готовили все шесть электродов, используемых в работе.
2.3.2 Приготовление
растворов
Растворы хлорида калия, нитрата калия и нитрита
натрия готовили путем разбавления точных навесок в дистиллированной воде.
Растворы соляной и серной кислот готовили путем
разбавления концентрированных кислот в дистиллированной воде.
Растворы хлоридных комплексов платины, родия и
иридия концентрацией 1 мг/л готовили разбавлением более концентрированных
растворов в 1М соляной кислоте.
Растворы нитритных комплексов платины, родия и
иридия концентрацией 1 мг/л готовили кипячением хлоридных комплексов с
насыщенным раствором NaNO2.
2.4 Идентификация
исследуемых растворов по электронному спектру поглощения
Сняли спектры поглощения исследуемых растворов.
Полученные спектры приведены на рисунках 2 - 4.
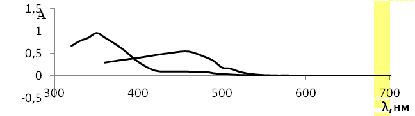
а -H2[Pt(NO2)4],
С=1 г/л; b-H2[PtCl6],
С=1 г/л; l=1 см
Рисунок 2 - Спектры поглощения растворов H2[PtCl6]и
H2[Pt(NO2)4]
Максимум оптической плотности при длине волны
460 нм в растворе хлоридного комплекса платины свидетельствует о том, что в
растворе отсутствуют какие-либо комплексы, кроме формы [PtCl6]2-.
Максимум оптической плотности в растворе нитритного комплекса платины при длине
волны 350 нм свидетельствует о том, что в растворе отсутствуют какие-либо
комплексы платины, кроме формы [Pt(NO2)4]2-
[32].
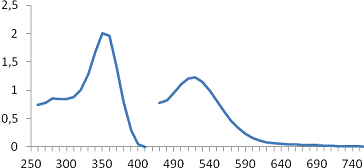
а -H3[Rh(NO2)6],
С=5мг/л; b-H3[RhCl6],
С=5 г/л; l=1 см
Рисунок 3 - Спектры поглощения растворов H3[RhCl6]и
H3[Rh(NO2)6]
Максимумы оптической плотности растворов родия
при длинах волн 354 нм и 518 нм свидетельствует о том, что в растворе
отсутствуют какие-либо комплексы, кроме [Rh(NO2)6]3-
и [RhCl6]3-.

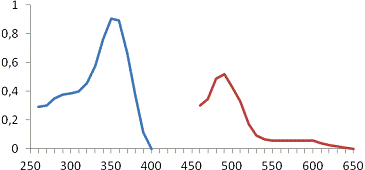
а -H3[Ir(NO2)6],
С=5мг/л; b-H3[IrCl6],
С=0,1 г/л; l=1 см
Рисунок 4 - Спектры поглощения растворов H3[IrCl6]и
H3[Ir(NO2)6]
Максимумы оптической плотности растворов иридия
при длинах волн 356 нм и 488 нм свидетельствует о том, что в растворе
отсутствуют какие-либо комплексы, кроме [Ir(NO2)6]3-
и [IrCl6]3-.
2.5 Методика выполнения
измерений на анализаторе ТА-4
Выполнение измерений проводят в три этапа:
отмывка электрохимической ячейки; проверка стаканчиков, фонового раствора и
электродов на чистоту; измерение концентраций определяемых элементов в
анализируемой пробе и в пробе с добавкой. Проводят проверку методики и
работоспособности электродов методом «введено-найдено».
Перед анализом каждой пробы проводят отмывку
стаканчиков и электродов: наливают по 10 мл дистиллированной воды в стаканчики
и устанавливают их в анализатор. Проводят отмывку ячеек при потенциале 0,5 Вв
течении 120 секунд , операцию повторят трижды, меняя воду.
Проверяют стаканчики, фоновый раствор и
электроды на чистоту: в стаканчики вносят 10 мл дистиллированной воды и
добавляют 0,2 мл фонового электролита.
Стаканчики с полученным фоновым раствором и
электроды устанавливают в анализатор и начинают регистрацию вольтамперограмм
фона.
Регистрируют три воспроизводимые
вольтамперограммы.
Стаканчики, фоновый раствор и электроды считают
чистыми, если на вольтамперограммах отсутствуют пики определяемых элементов.
В проверенный фоновый электролит добавляют
аликвотную часть анализируемой пробы и приступают к проведению измерений
величины силы тока, соответствующей концентрации определяемого элемента.
Регистрируют три воспроизводимые вольтамперограммы пробы.
Далее в ячейки вносят добавку стандартных
образцов исследуемых металлов и запускают регистрацию вольтамперограмм пробы с
добавкой.
Обрабатывают полученные вольтамперограммы фона,
пробы и пробы с добавкой: усредняют и при необходимости корректируют линии
остаточного тока.
2.6 Результаты
эксперимента и их обсуждение
.6.1 Выбор оптимальных
параметров вольтамперометрического определения платины, родия и иридия
Природа фонового электролита, потенциал и время
электрохимического накопления определяемого элемента на рабочем электроде -
предопределяющие параметры при вольтамперометрическом определении металлов.
2.6.1.1 Влияние природы
фонового электролита
Фоновый электролит кроме уменьшения
сопротивления раствора, может выполнять ряд дополнительных функций:
- образовывать
комплексы с определяемыми элементами и тем самым способствовать их
концентрированию на электроде;
- устранять
мешающее влияние компонентов, присутствующих в пробе, на процесс накопления или
регистрации пика исследуемого элемента;
- выполнять
роль буфера для стабилизации рН раствора.
При выборе фонового электролита для
вольтамперометрического определения платины руководствовались литературными
данными [33,34], на основании которых пригодными были выбраны электролиты
следующего состава:
) 2 М HCl,
1 M H2SO4,
концентрированная муравьиная кислота для определения платины из хлоридных
комплексов.
) Пример вольтамперограммы восстановления
платины представлен на рисунке 5.
a -
вольтамперограмма фона; b
- вольтамперограмма пробы;
c -
вольтамперограмма пробы с добавкой; CPt=2,50
мг/л; фон - 2 М HCl;
Енак = - 0,6 В; tнак
= 80 с
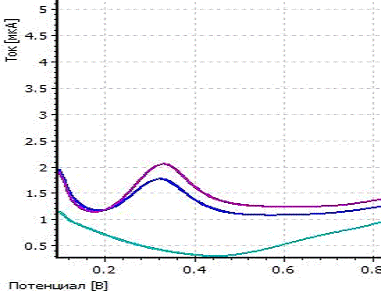
Рисунок 5 - Экспериментальные вольтамперограммы
определения платины из раствора ее хлоридного комплекса H2[PtCl6]
Максимум кривой анодного растворения платины из
раствора ее хлоридного комплекса H2[PtCl6]
находится при потенциале 0,35 В.
Критерием выбора фонового электролита,
пригодного для анализа, послужило наличие четко выраженного пика определяемого
элемента на вольтамперной кривой.
) 1 M
KNO3, 1 M
H2SO4,
концентрированная HCOOH
для определения платины из нитритных комплексов. Пример вольтамперограммы
восстановления платины представлен на рисунке 6.
) Максимум кривой анодного растворения
платины из раствора ее нитритного комплекса H2[Pt(NO2)4]
находится при потенциале 0,35 В.
Следовательно, форма нахождения платины не
влияет на положение максимума на вольтамперной кривой.
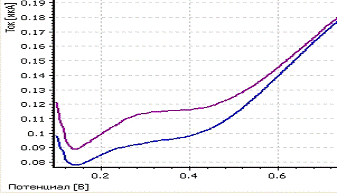
a -
вольтамперограмма фона; b
- вольтамперограмма пробы; c
- вольтамперограмма пробы с добавкой; CPt=
0,1 мг/л; фон - HCOOH;
Енак = - 0,6 В; tнак = 200 с
Рисунок 6 - Экспериментальные вольтамперограммы определения платины из раствора
ее нитритного комплекса H2[Pt(NO2)4]
Пригодными фоновыми электролитами для
вольтамперометрического определения хлоридных и нитритных комплексов родия (III)
являются: 1 M
H2SO4
и концентрированная муравьиная кислота. Пример вольтамперограмм представлен на
рисунке 7.
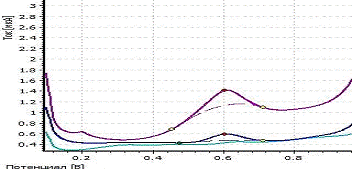
a -
вольтамперограмма фона; b
-вольтамперограмма пробы;
c -
вольтамперограмма пробы с добавкой; CRh= 1 мг/л; фон - HCOOH; Енак = - 0,6 В;
tнак = 150 с Рисунок 7 - Экспериментальные вольтамперограммы определения родия
из раствора его хлоридного комплекса H3[RhCl6]
Максимум кривой анодного растворения
родиянаходится при потенциале 0,60 В.
Пригодными фоновыми электролитами для
вольтамперометрического определения хлоридных комплексов иридия является 2M
HCl, концентрированная
муравьиная кислота, а нитритных - концентрированная муравьиная кислота. Пример
вольтамперограмм представлен на рисунке 8.
Максимум кривой анодного растворения иридия
находится при потенциале 0,80 В.
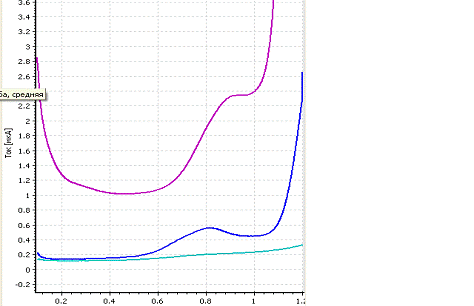
a -
вольтамперограмма фона; b
-вольтамперограмма пробы; c-вольтамперограмма
пробы с добавкой; CIr=2,50
мг/л; фон - HCOOH; Енак = -
0,8 В; tнак = 80 с
Рисунок 8 - Экспериментальные вольтамперограммы
определения иридия из раствора его хлоридного комплекса Н3[IrСl6]
Универсальным фоновым электролитом для
определения платины, родия и иридия при совместном присутствии является
концентрированная муравьиная кислота.
2.6.1.2 Выбор
оптимального потенциала накопления металлов
Потенциал накопления, подаваемый на рабочий
электрод, должен поляризовать его таким образом, чтобы протекал процесс
накопления только определяемого элемента на поверхности электрода.
Изменяя потенциал накопления в диапазоне от
-0,400 до -0,800 В, установили оптимальное значение для электровосстановления
платины, родия и иридия на электродах.
Полученные данные представлены в таблице 5.
Таблица 5 - Данные влияния потенциала накопления
на точность вольтамперометрического определения платины, родия и иридия
|
Определяемый
металл (Ераст, В)
|
Введено,
мг/л
|
Потенциал
накопления, В
|
Найдено,
мг/л
|
Относительное
стандартное отклонение, Sr
|
|
Pt (0,35)
|
0,100
|
-0,400
|
0,077±0,009
|
0,045
|
|
|
-0,500
|
0,093±0,009
|
0,038
|
|
|
-0,600
|
0,103±0,009
|
0,033
|
|
|
-0,700
|
0,107±0,022
|
0,084
|
|
Rh (0,60)
|
0,100
|
-0,400
|
0,092±0.006
|
0,028
|
|
|
-0,500
|
0,086±0.011
|
0,052
|
|
|
-0,600
|
0,101±0,001
|
0,003
|
|
|
-0,700
|
0,105±0,024
|
0,091
|
|
Ir (0,80)
|
0,100
|
-0,600
|
0,093±0,006
|
0,024
|
|
|
-0,700
|
0,091±0,008
|
0,033
|
|
|
-0,800
|
0,101±0,001
|
0,004
|
Из полученных данных видно, что наименьшая
ошибка определения наблюдается при потенциалах накопления: -0,600 В для платины
и родия, -0,800 В для иридия. Данные влияния потенциала накопления на
определение платины, родия и иридия из одной аликвоты представлены в таблице 6.
Таблица 6 - Данные влияния потенциала накопления
на точность вольтамперометрического определения платины, родия и иридия при
совместном присутствии в растворе; фон - HCOOH;
tнак = 200 с
|
Введено,
мг/л
|
Потенциал,
В
|
Найдено,
мг/л
|
|
|
Pt
|
Rh
|
Ir
|
|
0,40
|
-0,600
|
0,40±0,13
|
0,32±0,10
|
0
|
|
-0,700
|
0,49±0,17
|
0,44±0,13
|
0,47±0,13
|
|
-0,800
|
0,40±0,02
|
0,39±0,04
|
0,44±0,04
|
2.6.1.3 Определение
оптимального времени накопления
Время накопления варьируют от 80 до 300 секунд.
Полученные данные зависимости
вольтамперометрического определения платины, родия и иридия от изменения
времени накопления металлов представлены в таблице 7.
Таблица 7 - Влияние времени накопления металлов
на эффективность их определения
|
Определяемый
металл (Ераст, В)
|
Введено,
мг/л
|
Найдено,
мг/л
|
|
|
|
|
|
|
t=80 c
|
t=150 c
|
t=200 c
|
t=250 c
|
t=300
c
|
|
Pt (0,35)
|
0,001
|
0
|
0
|
0,0006
|
0,001
|
0,001
|
|
0,100
|
0,036
|
0,085
|
0,097
|
0,114
|
0,125
|
|
0,500
|
0,080
|
0,213
|
0,503
|
0,841
|
0,898
|
|
1,000
|
0,410
|
0,965
|
1,007
|
1,439
|
1,742
|
|
Rh (0,60)
|
0,001
|
0
|
0
|
0,0009
|
0,001
|
0,0012
|
|
0,100
|
0,084
|
0,087
|
0,094
|
0,103
|
0,116
|
|
0,500
|
0,456
|
0,486
|
0,507
|
0,524
|
0,568
|
|
1,000
|
0,934
|
0,987
|
1,002
|
1,109
|
1,151
|
|
|
Ir (0,80)
|
0,001
|
0
|
0
|
0,0007
|
0,001
|
0,001
|
|
|
0,100
|
0,068
|
0,086
|
0,097
|
0,107
|
0,121
|
|
|
0,500
|
0,458
|
0,472
|
0,507
|
0,535
|
0,597
|
|
|
1,000
|
0,925
|
0,975
|
0,998
|
1,087
|
1,198
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Из полученных данных видно, что оптимальное
время накопления металлов составляет 250 с для растворов с концентрацией меньше
0,1 мг/л; 200 с - для растворов с концентрацией выше 0,1 мг/л.
2.6.2 Нахождение
диапазона определяемых концентраций
Диапазон определяемых концентраций платины,
родия и иридия исследуют методом «введено-найдено». В стаканчики с проверенным
на чистоту фоновым раствором добавляют 0,1 мл раствора исследуемого металла с
концентрацией 1 мг/л и проводят измерение тока, соответствующего определяемого
элемента в растворе. Далее в каждую ячейку вносят 0,1 мл добавки с
концентрацией 1 мг/л и запускают регистрацию вольтамперограмм пробы с добавкой.
Получают три воспроизводимые вольтамперограммы и обрабатывают их. Такие же
операции проводят для серии растворов определяемого металла с различными
концентрациями. Результаты значений диапазона определяемых концентраций
платины, родия и иридия приведены в таблицах 8-11.
Экспериментально установленный диапазон
определяемых концентраций платины в растворе его нитритного комплекса на фоне
нитрата калия составил 0,1 - 3,0 мг/л.
Таблица 8 - Результаты определения концентрации
платины из раствора хлоридного комплекса на фоне 2М соляной кислоты; Енак = -
0,6 В
|
Введено
Pt (IV),
мг/л
|
Найдено
Pt (IV),
мг/л
|
Относительное
стандартное отклонение, Sr
|
|
0,010
|
0,013
± 0,017
|
0,538
|
|
0,050
|
0,037 ± 0,020
|
0,216
|
|
0,100
|
0,094 ± 0,015
|
0,064
|
|
0,400
|
0,367 ± 0,010
|
0,010
|
|
1,000
|
0,985 ± 0,050
|
0,020
|
|
1,500
|
1,378 ± 0,273
|
0,080
|
|
2,000
|
1,850 ± 0,388
|
0,084
|
|
2,500
|
2,490 ± 0,035
|
0,006
|
Экспериментально установленный диапазон
определяемых концентраций платины в растворе его хлоридного комплекса на фоне 2
М соляной кислоты составил 0,1 - 2,5 мг/л.
Экспериментально установленный диапазон
определяемых концентраций платины в растворе его нитритного комплекса на фоне
концентрированной муравьиной кислоты составил 0,05 - 1,50 мг/л.
Таблица 9 - Результаты определения концентрации
платины из раствора нитритного комплекса на фоне концентрированной муравьиной
кислоты; Енак = - 0,6 В
|
Введено
Pt, мг/л
|
Найдено
Pt,
мг/л
|
Относительное
стандартное отклонение, Sr
|
|
0,001
|
0,001±0,001
|
0,240
|
|
0,010
|
0,012±0,012
|
0,411
|
|
0,050
|
0,051±0,008
|
0,066
|
|
0,100
|
0,112±0,033
|
0,119
|
|
0,500
|
0,500±0,030
|
0,025
|
|
1,000
|
1,098±0,246
|
0,090
|
|
1,500
|
1,420±0,163
|
0,046
|
Таблица 10 - Результаты определения концентрации
родия на фоне концентрированной муравьиной кислоты; Енак = - 0,6 В
|
Комплекс
|
Введено
Rh, мг/л
|
Найдено
Rh,
мг/л
|
Относительное
стандартное отклонение, Sr
|
|
[RhCl6]3-
|
0,001
|
0,001
|
0,006
|
|
1,000
|
1,000±0,0744
|
0,030
|
|
[Rh(NO2)6]3-
|
0,001
|
0,001
|
0,143
|
|
1,000
|
1,000±0,236
|
0,095
|
Экспериментально установленный диапазон
определяемых концентраций родия на фоне концентрированной муравьиной кислоты в
растворе его хлоридных и нитритных комплексов составил от 0,001 мг/л до 1,000
мг/л.
Таблица 11 - Результаты определения концентрации
иридия на фоне концентрированной муравьиной кислоты; Енак = - 0,8 В
|
Комплекс
|
Введено
Ir, мг/л
|
Найдено
Ir, мг/л
|
Относительное
стандартное отклонение, Sr
|
|
[IrCl6]3-
|
0,0005
|
0,0005
|
0,007
|
|
3,5000
|
3,5017±0,0087
|
0,001
|
|
[Ir(NO2)6]3-
|
0,0010
|
0,0010±0,0001
|
0,050
|
|
1,5000
|
1,5168±0,0376
|
0,010
|
Экспериментально установленный диапазон
определяемых концентраций иридия на фоне концентрированной муравьиной кислоты в
растворе его нитритного комплекса составил от 0,001 мг/л до 1,500 мг/л,
хлоридного - от 0,0005 мг/л до 3,5000 мг/л.
2.6.3 Определение
платиновых металлов при совместном присутствии в растворе
Разность потенциалов анодного растворения
платины (0,35 В), родия (0,60 В) и иридия (0,80 В) указывает на возможность
раздельного определения металлов при их совместном присутствии в растворе.
Данные определения платины и родия при
совместном присутствии представлены на рисунке 9 и в таблице 12.
Таблица 12 - Результаты вольтамперометрического
определения массовых концентрации платины и родия в растворе, содержащем их
нитритные комплексы; фон - 1М H2SO4;
Енак = - 0,6 В
|
Введено
Pt,Rh,
мг/л
|
Найдено,
мг/л
|
Относительное
стандартное отклонение, Sr
|
|
Pt
|
Rh
|
Pt
|
Rh
|
|
0,10
|
0,12
± 0,07
|
0,10 ± 0,02
|
0,18
|
0,06
|
|
0,40
|
0,38 ± 0,13
|
0,42
± 0,02
|
0,11
|
0,01
|
|
1,00
|
1,02
± 0,05
|
1,00 ± 0,07
|
0,02
|
0,02
|
Диапазон определяемых концентраций платины и
родия при совместном присутствии составил 0,1 - 1,0 мг/л.
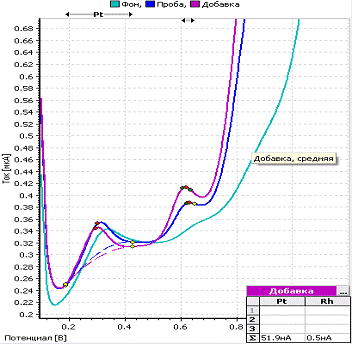
a -
вольтамперограмма фона; b
- вольтамперограмма пробы; c
- вольтамперограмма пробы с добавкой; CPt=CRh=0,01
мг/л; фон - 1М H2SO4;
Енак = - 0,6 В; tнак = 250 с
Рисунок 9 - Вольтамперограмма определения
платины и родия при совместном присутствии их в растворе
На вольтамперограмме видны два четко выраженных
пика платины и родия при потенциалах, соответствующих определяемым элементам.
Данные определения родия и иридия при совместном
присутствии представлены на рисунке 10 и в таблице 13.
Таблица 13 - Результаты вольтамперометрического
определения массовых концентрации родия и иридия в растворе, содержащем их
нитритные комплексы; фон - HCOOH;
Енак = - 0,8 В
|
Введено,
мг/л
|
Комплекс
|
Найдено,
мг/л
|
Относительное
стандартное отклонение, Sr
|
|
|
Rh
|
Ir
|
Rh
|
Ir
|
|
0,10
|
нитритный
|
0,10±0,03
|
0,10±0,02
|
0,12
|
0,10
|
|
хлоридный
|
0,10±0,03
|
0,10±0,03
|
0,10
|
0,11
|
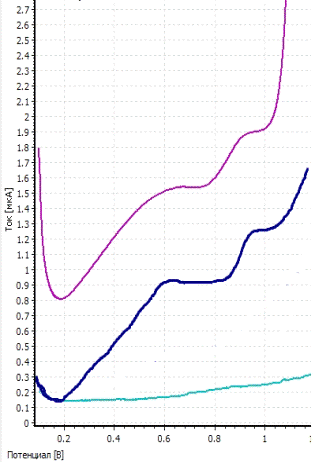
a -
вольтамперограмма фона; b
- вольтамперограмма пробы; c
- вольтамперограмма пробы с добавкой; CRh
= CIr = 1 мг/л; фон - HCOOH;
Енак = - 0,8 В; tнак = 150 с
Рисунок 10 - Вольтамперограмма определения родия
и иридия при совместном присутствии их в растворе
На представленной вольтамперограмме видны два
пика: родия и иридия.
Данные определения платины и иридия при
совместном присутствии представлены на рисунке 11 и в таблице 14.
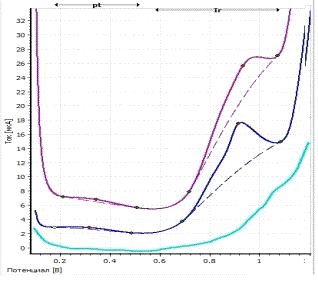
a - вольтамперограмма
фона; b -
вольтамперограмма пробы; c
- вольтамперограмма пробы с добавкой; CPt=CIr=
1 мг/л; фон - HCOOH; Енак = -
0,8 В; tнак = 150 с Рисунок
11 - Вольтамперограмма определения платины и иридия при совместном присутствии
их в растворе
На представленной вольтамперограмме видны два
пика: платины и иридия.
Таблица 14 - Результаты вольтамперометрического
определения массовых концентрации платины и иридия в растворе, содержащем их
нитритные комплексы; фон - HCOOH;
Енак = - 0,8 В
|
Введено
Pt,Ir,
мг/л
|
Найдено,
мг/л
|
Относительное
стандартное отклонение, Sr
|
|
|
|
Pt
|
Ir
|
Pt
|
Ir
|
|
0,010
|
0,008±0,005
|
0,012±0,012
|
0,250
|
0,431
|
|
0,100
|
0,120±0,027
|
0,109±0,015
|
0,089
|
0,054
|
|
0,400
|
0,444±0,040
|
0,372±0,038
|
0,094
|
0,041
|
|
1,000
|
1,076±0,058
|
0,966±0,062
|
0,022
|
0,026
|
|
1,500
|
1,496±0,063
|
1,393±0,052
|
0,017
|
0,015
|
Диапазон определяемых концентраций платины и
иридия при их совместном присутствии в растворе составил 0,1 - 1,50 мг/л.
Данные определения платины, родия и иридия при
совместном присутствии представлены на рисунке 12 и в таблицах 15-16.
На представленной вольтамперограмме видны три
четко выраженных пика: платины, родия и иридия соответственно.
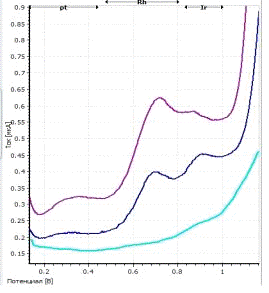
a -
вольтамперограмма фона; b
- вольтамперограмма пробы; c
- вольтамперограмма пробы с добавкой; CPt=CRh=CIr=0,1
мг/л; фон - HCOOH; Енак = -
0,8 В; tнак = 200 с
Рисунок 12 - Вольтамперограмма определения
платины, родия и иридия при совместном присутствии их в растворе
Таблица 15 - Результаты вольтамперометрического
определения массовых концентрации платины, родия и иридия в растворе,
содержащем их нитритные комплексы; фон - HCOOH;
Енак = - 0,8 В
|
Введено
Pt,Rh,Ir,
мг/л
|
Найдено,
мг/л
|
Относительное
стандартное отклонение, Sr
|
|
Pt
|
Rh
|
Ir
|
Pt
|
Rh
|
Ir
|
|
0,05
|
0,05±0,02
|
0,06±0,02
|
0,04±0,02
|
0,18
|
0,16
|
0,23
|
|
0,10
|
0,11±0,03
|
0,09±0,02
|
0,08±0,02
|
0,11
|
0,09
|
0,09
|
|
0,40
|
0,45±0,12
|
0,48±0,09
|
0,40±0,03
|
0,11
|
0,08
|
0,03
|
|
1,00
|
1,15±0,38
|
1,18±0,17
|
0,97±0,19
|
0,13
|
0,06
|
0,08
|
Экспериментально установленный диапазон
определяемых концентраций платины, родия и иридия при совместном присутствии в
растворе, содержащем их нитритные комплексы на фоне концентрированной
муравьиной кислоты составил 0,1 - 1,0 мг/л.
Таблица 16 - Результаты вольтамперометрического
определения массовых концентрации платины, родия и иридия в растворе, содержащем
их хлоридные комплексы; фон - HCOOH;
Енак = - 0,8 В
|
Введено
Pt,Rh,Ir,
мг/л
|
Найдено,
мг/л
|
Относительное
стандартное отклонение, Sr
|
|
Pt
|
Rh
|
Pt
|
Rh
|
Ir
|
|
0,010
|
0,014±0,005
|
0,024±0,018
|
0,012±0,001
|
0,148
|
0,300
|
0,046
|
|
0,100
|
0,119±0,033
|
0,109±0,023
|
0,119±0,011
|
0,112
|
0,083
|
0,039
|
|
0,400
|
0,405±0,023
|
0,399±0,045
|
0,442±0,042
|
0,022
|
0,046
|
0,038
|
|
1,000
|
0,955±0,052
|
1,160±0,089
|
0,909±0,054
|
0,022
|
0,031
|
0,024
|
Экспериментально установленный диапазон
определяемых концентраций платины, родия и иридия при совместном присутствии в
растворе, содержащем их хлоридные комплексы на фоне концентрированной
муравьиной кислоты составил 0,1 - 1,0 мг/л.
Полученные данные не превышают погрешность,
предусмотренную возможностями метода, равную 20%.
2.6.4 Оценка мешающего
влияния сопутствующих ионов
Изучено влияние следующих ионов металлов:
никеля, меди, серебра, золота, палладия и рутения. Потенциалы анодного
растворения данных металлов представлены в таблице 17.
Таблица 17 - Потенциалы анодного растворения
металлов
|
Металл
|
Ni
|
Cu
|
Ag
|
Pt
|
Rh
|
Pd
|
Ir
|
Au
|
Ru
|
|
Е,
В
|
-1,05
|
-0,10
|
0,20
|
0,35
|
0,60
|
0,60
|
0,80
|
0,80
|
1,20
|
Оценку влияния мешающих ионов проводили
добавлением к исследуемому раствору 1, 10, 100, 1000 - кратных количеств ионов.
Влияние оценивали вольтамперометрически по изменению определяемой концентрации
образца, содержащего определяемые и мешающий ионы.
Экспериментально установлено, что медь и никель
не влияют на совместное определение платины, родия и иридия при десятикратном
избытке, серебро, золото и палладий - при стократном, а рутений - при
тысячекратном.
Результаты выполненной работы были представлены
на российских и международных конференциях: на VII
Всероссийской научно-технической конференции студентов, аспирантов и молодых
ученых «Молодежь и наука» (Красноярск, 2011), на XXI
Российской молодежной научной конференции «Проблемы теоретической и
экспериментальной химии», посвященной 150-летию со дня рождения академика
Н.Д.Зелинского (Екатеринбург, 2011), на XIX
Менделеевском съезде по общей и прикладной химии (Волгоград, 2011), на XXII
Российской молодежной научной конференции «Проблемы теоретической и
экспериментальной химии», посвященной 100-летию со дня рождения А.А. Тагер
(Екатеринбург, 2012), на VI
Всероссийской конференции молодых ученых, аспирантов и студентов с
международным участием «Менделеев-2012» (Санкт-Петербург, 2012), на VIII
Всероссийской конференции по электрохимическим методам анализа «ЭМА-2012»
(Уфа-Абзаково, 2012). Подана заявка на патент.
платина родий иридий электролит
ВЫВОДЫ
. Показана возможность прямого определения
микроколичеств платины, родия и иридия в растворах их хлоридных и нитритных
комплексов методом инверсионной вольтамперометрии с использованием в качестве
индикаторного углеродсодержащего электрода в диапазоне концентраций 0,1 - 1,0
мг/л. Ошибка определения не превышает 20% .
. Исследована серия фоновых электролитов, из
которых универсальным фоновым электролитом для определения платины, родия и
иридия при совместном присутствии является концентрированная муравьиная
кислота.
. Экспериментально установлены диапазоны
определяемых концентраций индивидуальных металлов и при их попарном присутствии
в растворе: платина и родий (0,1 - 1,0 мг/л), платина и иридий (0,1 - 1,5
мг/л).
. Установлено оптимальное время накопления
платины, родия и иридия. Оно составляет 250 с для растворов с концентрацией
меньше 0,10 мг/л; 200 с -для растворов с концентрацией выше 0,10 мг/л.
. Выбрана величина потенциала накопления: -0,600
В для растворов платины и родия, -0,800 В для иридия. Потенциал определения
данных металлов при совместном присутствии составил -0,800 В.
. Изучено влияние некоторых сопутствующих ионов
на совместное определение платины, родия и иридия вольтамперометрическим
методом. Установлено, что многократный избыток меди, никеля, серебра, золота,
палладия, рутения не оказывает мешающего влияния на совместное определение
платины, родия и иридия.
СПИСОК ЛИТЕРАТУРЫ
1.
Буслаева, Т.М. Платиновые металлы и их роль в современном обществе / Т.М.
Буслаева. - М.: Химия, 1999. - 327 с.
2. Карапетьянц, М.Х. Общая и неорганическая
химия / М.Х. Карапетьянц, С.И. Дракин. - М.: Химия, 1981. - 632 c.
3. Колпакова, Н. А. Определение платины методом
инверсионной вольтамперометрии в биологических тканях у больных раком легкого /
Н. А. Колпакова, Е.А. Смышляева, А.А. Завьялов // Известия Томского
политехнического университета. - 2003. - Т.306, №4. - С. 84 - 86.
. Третьяков, Ю. Д. Неорганическая химия под ред.
Ю. Д. Третьякова. Т.3: Химия переходных элементов. Кн.2: учебник для студ.
высш. учеб. заведений М.: Академия, 2007.-400с.
5.
Ливингстон, С. Химия рутения, родия, палладия, осмия, иридия, платины / С.
Ливингстон. - М.: Мир, 1978. - 367 с.
6.
Реми, Г. Курс неорганической химии/ Г.Реми.- М.: Мир, 1974.-755с.
7.
Зайцев, Н.К. Альтернативные методы вскрытия маслорастворимых проб в инверсионной
вольтамперометрии / Н.К. Зайцев,Е. А. Осипова, В. И. Игнатов Аналитическая
химия - новые методы и возможности: сб. мат. конф., май 2010, МГУ. - М., 2010.
- С. 178- 182.
8.Клебанов,
О.Б. Справочник технолога по обогащению руд цветных металлов / О.Б. Клебанов,
Л.Я. Шубов, Н.К. Щеглова.-М.: Недра, 1974.- 472с.
9.
Химия / В. Шретер, К.Х. Лаутеншлегер, А. Бибрак; пер. с нем.-М.: Химия, 1989. -
648 с.
10. Гинзбург, С.И.
Аналитическая химия платиновых металлов / С.И. Гинзбург. - М.: Наука, 1972. -
614 с.
11.
Хвостова, В. П., Химические методы вскрытия платиносодержащих руд и горных
пород / В.П. Хвостова, В. Головня // Заводская лаборатория. - 1982. - Т. 48, №7
- С. 3.
12.
Колпакова, Н. А. Определение платиновых металлов в рудах и концентратах методом
инверсионной вольтамперометрии / Н. А. Колпакова, Ю. А. Иванов, А. Ф.
Коробейников // Платина России. Проблемы развития минерально - сырьевой базы
платиновых металлов. - М.: Геоинформмарк, 1995. - Т. II, Кн. 1.- С. 181.
13.
Звягинцев, О. Е. Аффинаж золота, серебра и металлов платиновой группы О. Е.
Звягинцев. - М.: Химия, 1945. - 245 с.
14.
Барышников, И. Ф.Пробоотбирание и анализ благородных металлов /И.Ф. Барышников.
- М.: Металлургия, 1978. - 431с
15. Zimmermann, S., Messerschmidt
J., Von Bohlen A., Sures B. Determination of Pt, Pd and Rh in biological
samples by electrothermal atomic absorption spectrometry as compared with
adsorptive cathodicsripping voltammetry and total-reflection X-ray fluorescence
analysis Anal. Chim.Acta.
- 2003. - № 498. - P. 93 - 104.
.Петрухин, О.М. Химические методы анализа / О.М.
Петрухин. - М.: Химия, 2009. - 400 с.
. Воробьёва, С.В. Методы анализа металлов
платиновой группы, золота и серебра / С. В. Воробьёва. - Оренбург: ГОУ ВПО ОГУ,
2004. - 18 с.
18.
Зайдель, А.Н. Основы спектрального анализа / А. Н. Зайдель. - М.: Химия,1965. -
245 с.
19.
Harvey, D. Modern analytical chemistry / D. Harvey. - New York: McGraw-Hill,
2000. - 805 p.
20.
Электроаналитические методы: теория и практика / под ред. Ф. Шольца; пер. с
англ. под ред. В. Н. Майстренко. - М.: БИНОМ, 2009. - 326 с.
.
Нейман, Е. Я. Руководство по эксплуатации анализатора вольтамперометрического
ТА - 4 Е. Я. Нейман - Томск: Томь Аналит, 2010. - 125 с.
22.
Будников Г. К. Модифицированные электроды для вольтамперометрии в химии, биологии
и медицине / Г. К. Будников, Г. А. Евтюгин, В. Н. Майстренко. - М.: БИНОМ,
2010. - 416 с.
23.
Kozielec, T. The influence of magnesium supplementation on concentrations of
chosen bioelements and toxic metals in adult human hair / TadeuszKozielec, Anna
Sałacka,
BeataKarakiewicz // Magnesium Research. - 2006. - V. 17, № 3. - Р.
12.
24.
Vos, J.G. Analytical Voltammetry / J.G. Vos. - Dublin: School of Chemical
Sciences, 2009. - 123 p.
25. Будников, Г.К. Основы современного электрохимического
анализа / Г. К. Будников. - М.: Мир, 2008. - 325 с.
26.
Колпакова, Н.А. Определение платиновых металлов в золоторудном сырье методом
инверсионной вольтамперометрии / Н.А. Колпакова, Э.В. Горчаков, С.В. Романенко
// Успехи современного естествознания. - 2007. - №10. - С. 87 - 88.
.
Езерская, Н.А. Вольтамперометрическое определение платиновых металлов // Журн.
аналит. химии. - 1981. - №4. - С. 675.
.
Пат.2406995 РФ, МПК G01N27/48. Способ инверсионно-вольтамперометрического
определения родия в нитритной среде/ В. Н. Лосев, Г. В. Волкова, Н. В. Щеглова,
О. В. Буйко. - № 2009136718/28; Заявлено 05.10.2010; Опубл. 20.12.2010. - 4 с.
.
Пат. 2436079 РФ, МПК G01N27/48. Способ инверсионно-вольтамперометрического
определения иридия в нитритной среде/ Г. В. Волкова, Н. В. Щеглова, Н. В.
Сычев. - № 2010130921/28; Заявлено 05.10.2010; Опубл. 20.12.2010. - 4 с.
.
Волкова, Г. В. Вольтамперометрическое определение родия (III)
и иридия (III,IV)
в различных средах / Г. В. Волкова, Н. В. Щеглова // Теория и практика электроаналитической
химии: мат. Симпозиума. - Томск, 2010.
.
Гармаш А. В. Метрологические основы аналитической химии / А. В. Гармаш, Н. М.
Сорокина. - М.: МГУ,2012. - 47 с.
.
Бельская, О.Б. Исследование молекулярного механизма формирования нанесенных
платиновых катализаторов семейства Pt/Al2O3. Автореф. дисс. канд. хим. наук:
02.00.04. / О.Б. Бельская. - Новосибирск, 2009. - 20 с.
33.
Выдра, Ф. Инверсионная вольтамперометрия / Ф. Выдра, Э. Юлакова, К. Штулик -
М.: Мир, 1980. - 278с.
34.
Husza, S. Simultaneous Determination of Platinum and Rhodium with Hydroxylamine
and Acetone Oxime by Catalytic Adsorptive Stripping Voltammetry (CAdSV) / S.
Husza, J. Kowalska, M. Sadowska, J. Golimowski // Electroanalysis. - 2005. - V.
17. - № 20. - Р. 1841 - 1846.