Организация работы испытательной лаборатории (центра) по контролю качества лекарственных средств
Государственное бюджетное образовательное учреждение высшего
профессионального образования «Пятигорская государственная фармацевтическая
академия» Министерства здравоохранения и социального развития Российской
Федерации
КАФЕДРА
ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
МЕТОДИЧЕСКИЕ
УКАЗАНИЯ
ДЛЯ СТУДЕНТОВ
3 КУРСА
«ОРГАНИЗАЦИЯ
РАБОТЫ ИСПЫТАТЕЛЬНОЙ ЛАБОРАТОРИИ (ЦЕНТРА) ПО КОНТРОЛЮ КАЧЕСТВА ЛЕКАРСТВЕННЫХ
СРЕДСТВ»
(ВАРИАТИВНЫЙ
КУРС)
Пятигорск
2011
УДК
ББК 22.172я73+52.82
Г 12
Рецензент: доц. канд. фармац. наук О.М. Маркова
Е.Н. Вергейчик, А.Б. Саморядова
Г 12 Организация и управление работы испытательной лаборатории (центра)
по контролю качества лекарственных средств (вариативный курс). - Е.Н.
Вергейчик, А.Б.Саморядова. - Пятигорск: ГОУ ВПО Пятигорская ГФА Росздрава,
2011. - 44с.
Зав. кафедрой фармацевтической химии
доктор фарм. наук, профессор Е. Н. Вергейчик
В методических указаниях описана структура испытательной лаборатории
(центра) по контролю качества лекарственных средств, ее основные задачи,
правила поверки и аттестации лабораторного оборудования.
Допущено к внутривузовскому изданию.
Председатель ЭМС В.В.Гацан
Протокол № от « » ноября 2011 г.
© Пятигорская государственная фармацевтическая академия, 2011.
1. ВВЕДЕНИЕ
При подготовке специалиста-провизора необходимо выработать у студентов
определенные теоретические знания и практические умения, позволяющие решать
профессиональные задачи, связанные с обеспечением населения качественными
лекарственными средствами.
Для профессионального овладения практическими навыками и умениями
наибольший интерес представляют задания, которые сочетаются с элементами
практической работы
Самостоятельному решению студентами этих заданий способствуют вариативные
курсы, разработанные на кафедре фармацевтической химии.
Настоящий вариативный курс предусматривает более детальное и
целенаправленное изучение организации работы контрольно-аналитического центра.
2. ЦЕЛИ И ЗАДАЧИ ВАРИАТИВНОГО КУРСА
Целью вариативного курса является обучение студентов навыкам организации
работы контрольно-аналитического центра.
При выполнении заданий вариативного курса студенты должны ознакомиться:
ü с системой контроля качества лекарственных средств
ü с понятием «надлежащих практик», с принципами GLP, GPCL.
ü со структурой испытательной лаборатории (центра) по контролю
качества лекарственных средств
ü с основными задачами испытательной лаборатории (центра) по
контролю качества лекарственных средств
ü общие требования к компетентности испытательной лаборатории
(центра) по контролю качества лекарственных средств
ü с правилами поверки и аттестации лабораторного оборудования
3.
ИНФОРМАЦИОННАЯ ЧАСТЬ
Важнейшей составляющей государственной политики в сфере здравоохранения
является обеспечение качества, эффективности и безопасности всех лекарственных
средств, поступающих в обращение в РФ.
Гарантии подобного рода невозможны без создания системы обеспечения
качества лекарственных средств, отвечающей современным международным
требованиям, внедрения надлежащей практики разработки, исследований,
производства, хранения и продажи лекарственных препаратов, приведения
законодательства в области обращения и регистрации лекарственных средств в
соответствие с международной регуляторной практикой, гармонизации отечественных
стандартов качества лекарственных средств с международными стандартами
(Стратегия развития фармацевтической промышленности Российской Федерации на
период до 2020 г., Федеральный закон «Об обращении лекарственных средств»).
.1 СИСТЕМА
КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Лекарственные средства - особый вид продукции, потребляемой населением.
От её качества и безопасности во многом зависит жизнь и здоровье человека.
Поэтому все лекарственные средства, произведенные на территории Российской
Федерации и ввезенные из-за границы, подвергаются государственному контролю.
3.1.1 Контроль качества лекарственных средств
В соответствии с действующим законодательством «контроль качества
лекарственных средств при их гражданском обороте проводится уполномоченными
федеральными органами исполнительной власти и органами исполнительной власти
субъектов Российской Федерации».
При этом практикуются следующие формы контроля:
. Предварительный контроль при регистрации ЛС (организация
проведения экспертизы качества, эффективности и безопасности ЛС, сбор и анализ
информации о побочных эффектах применения ЛС).
. Выборочный контроль проводится на основании планов выборочного
контроля качества Росздравнадзора, формируемого по результатам сбора и анализа
информации о качестве ЛС.
. Повторный выборочный контроль при выявлении несоответствия
лицензионным требованиям и условиям производства и внутризаводского контроля
качества продукции, несоблюдения правил оптовой и розничной торговли
лекарственными препаратами, правил хранения.
При государственной регистрации заявленные лекарственные средства
проходят тщательную экспертизу с целью обеспечения гарантии соответствия
современным требованиям безопасности, качества и эффективности. Но этим дело не
ограничивается. Для того чтобы зарегистрированные препараты могли
производиться, владелец регистрационного удостоверения должен получить
соответствующую лицензию на промышленный выпуск данного лекарственного средства
и строго соблюдать лицензионные условия. То же самое касается дистрибуции,
реализации, хранения и уничтожения лекарственных средств.
В последнее время в регистрационную систему были внесены значительные
изменения в направлении ее сближения с международной практикой и сокращения
различий в отношении отечественных и зарубежных препаратов (Административный
регламент Росздравнадзора по регистрации лекарственных средств, 2006).
В 2005 г. в целях совершенствования системы контроля качества в его
структуре организовано Федеральное государственное учреждение «Научный центр
экспертизы средств медицинского применения» (НЦЭСМП) Росздравнадзора» с 15 филиалами
в субъектах РФ, осуществляющее экспертизу ЛП.
Государственный контроль начинается задолго до регистрации лекарственного
препарата как такового. Другими словами, он начинается практически уже на этапе
научных разработок, т.е. лабораторных, доклинических и клинических испытаний.
3.1.2 Надлежащие практики в фармации
Работники фармацевтической отрасли, задействованные на всех этапах
жизненного пути препарата (рис. 1), от разработки до уничтожения, призваны
соблюдать правила и другие нормативные документы, которые составляют
нормативно-правовую базу. Эта база находится в состоянии модернизации и
совершенствования. Более того, грядущая интеграция России в ВТО диктует
необходимость гармонизации отечественной нормативно-правовой базы с
международной практикой обращения лекарственных средств.
Уже сейчас в фармации активно внедряются надлежащие практики (правила),
которые, исходя из сокращений, можно объединить в одну формулу GxP,
где х - различные сферы применения практики (правил).
Это - надлежащие:
лабораторная практика (GLP)
клиническая практика (GCP)
производственная практика (GMP)
практика хранения (GSP)
практика дистрибуции (GDP)
аптечная практика (GPP)
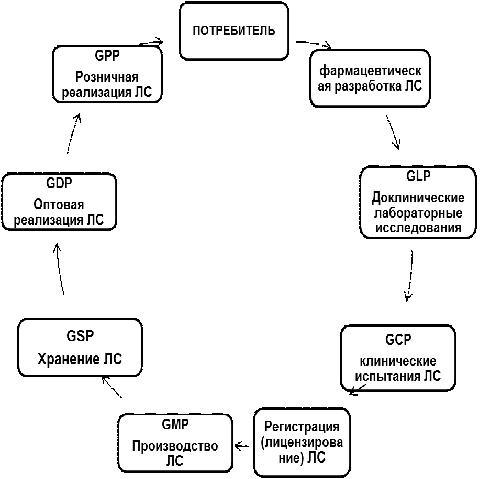
Рис. 1. Этапы жизненного цикла ЛС
Согласно современным представлениям «на каждом этапе разработки,
изготовления и распределения лекарственных средств принимаются специфические
для этого этапа меры по недопущению ошибок и отклонений в работе, которые могут
отрицательно повлиять на качество.
Таким образом, взаимосвязь перечисленных стандартов GxP составляет
систему обеспечения качества лекарственных средств, охватывающую весь жизненный
цикл препарата.
На фармацевтический рынок РФ поступают лекарственные средства,
произведенные как в условиях соблюдения международных стандартов GMP, так и лекарственные средства из
развивающихся стран, в которых предприятия работают по национальным стандартам.
Как правило, препараты из стран СНГ выпускаются на предприятиях, не
аттестованных на соответствие GMP.
В РФ из 400 производителей лекарственных средств только 30 располагают
производственными площадками, соответствующими международным правилам
надлежащей производственной практики (Голикова Г.А., 2010). ФЗ «Об обращении
лекарственных средств» установлен срок перехода отечественных производителей на
требования GMP - начало 2014 г.
<#"660038.files/image002.gif"> )
)
|
Титриметрия
|
10
|
17
|
3.2 ИСПЫТАТЕЛЬНАЯ ЛАБОРАТОРИЯ (ЦЕНТР) ПО КОНТРОЛЮ КАЧЕСТВА ЛЕКАРСТВЕННЫХ
СРЕДСТВ - ЧАСТЬ СИСТЕМЫ КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
.2.1 Понятие об испытательной
лаборатории (центре) по контролю качества лекарственных средств
Обеспечение
качества лекарственных средств - первостепенная задача государства. Этого
требуют федеральные законы РФ «Об обращении лекарственных средств»
<#"660038.files/image003.jpg">
Этап. Проверка полной вместимости бюретки
. Для сравнения определите полную вместимость бюретки
. Взвесить на аналитических весах сухой стакан (бюкс). Во
взвешенный стакан налить воду очищенную из бюретки в интервале 0-25, взвесьте
стакан с водой.
. По разности определите массу воды, а по ней - объем в указанном
интервале делений бюретки, используя значение плотности (ρ)
воды приведенной к 20 °С
(табл. 4).
. Результаты внесите в таблицу 5 (рабочий журнал).
ГОСТом допускается ∆V =
±0,05 мл.
ЛАБОРАТОРНАЯ РАБОТА 2
ПОВЕРКА ЛАБОРАТОРНЫХ ВЕСОВ WTB
200
Настоящая методика поверки распространяется на весы лабораторные WTB 200 II класса точности и устанавливает методы и средства их
первичной и периодических поверок. Весы должны соответствовать ГОСТ 24104-2001
«Весы лабораторные. Общие технические требования».
Межповерочный интервал -1 год.
Таблица 5 - Технические параметры весов WTB 200
|
Технические параметры
|
WTB 200
|
|
Наибольший предел
взвешивания НПВ
|
200 г
|
|
Наименьший предел
взвешивания НмПВ
|
0.05г
|
|
Дискретность,d
|
0.001г
|
|
Повторяемость
|
0.003г
|
|
Номинальное значение масс
гирь для определения погрешности
|
При центрально-симметричном
положении груза на чашке
|
50 мг, 100 мг, 200 мг, 500
мг, 1 г, 2 г, 5г, 10г
|
|
При
нецентральносимметричном положении груза на чашке
|
|
|
Пределы допускаемых значений
погрешности
|
При центрально-симметричном
положении груза на чашке
|
До 50 г включ.- ±1,0%
|
|
при
нецентрально-симметричном положении груза на чашке
|
±1,0%
|
. УСЛОВИЯ ПОВЕРКИ
При проведении поверки должны быть соблюдены следующие условия:
· температура окружающего воздуха (20 ±2)°С;
· изменение температуры в помещении в течение 1 часа не должно
превышать 0,5°С;
· относительная влажность воздуха от 30 до 80 %.
· весы не должны устанавливаться вблизи отопительных систем и
окон, не защищенных теплоизоляцией.
. ПОДГОТОВКА К ПОВЕРКЕ
При подготовке к проведению поверки должны быть выполнены следующие
операции:
· время выдержки распакованных весов в лабораторном помещении
перед началом поверки должно быть не менее 12 часов;
· перед проведением поверки весы должны быть установлены по
уровню;
· перед проведением поверки весы должны быть включены в сеть и
выдержаны во включенном состоянии в течение 30 минут.
. ПРОВЕДЕНИЕ ПОВЕРКИ
.1. Внешний осмотр
При внешнем осмотре должно быть установлено соответствие весов следующим
требованиям:
· обеспечение сохранности лакокрасочных покрытий;
· наличие маркировки и комплектующих изделий согласно комплекту
поставки.
.2. Опробование
· После прогрева в течение 30 минут весы должны быть приведены
в рабочее состояние. Изображение цифр на индикаторе должно быть четким.
· Калибровка весов должна быть выполнена в соответствии с
Руководством по эксплуатации.
.3. Определение метрологических характеристик
· Определение погрешности весов
Определение погрешности весов следует производить при центральносимметричном
и нецентральном положении груза на чашке.
I. При
определении погрешности весов при центрально-симметричном положении груза на
чашке следует поочередно нагружать и разгружать весы нагрузками, указанными в
таблице 5, в следующей последовательности:
. установить нулевые показания весов.
. поместить гирю в центр чашки весов;
. после появления символа единицы измерения снять показания весов;
. снять гирю с чашки, дождаться установления показаний;
. выполнить операции по п. п. 1-4 для следующих нагрузок: 50 мг -
50 г.
. Операцию следует проводить при возрастающей и убывающей
нагрузке.
7. Определить
погрешность весов при каждом i -ом измерении (
 ) по
формуле:
) по
формуле:

 (1)
(1)
где
Li - i-ое показание весов;
mi -
действительное значение массы гирь, помещаемых на чашку весов;
i-порядковый
номер измерения (i=1,2, … 10).
8. Результаты измерений и вычислений занести в таблицу 1 (рабочий
журнал).
. Погрешность весов при каждом i-ом измерении не должна превышать пределов допускаемой
погрешности в интервалах взвешивания, указанных в таблице 5.
II.
Погрешность весов при нецентральном положении груза на чашке определить
следующим образом:
. Однократно нагрузить центра каждой четверти чашки, как показано
на рис. 7, гирями, (не более 2-х) суммарной массой, близкой к 1/3 значения НПВ
(таблицу 5), при этом гири следует установить одна на другую при
нецентрально-симметричном положении груза на чашке.
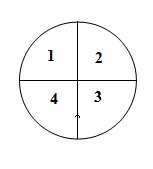
Рис. 7.
. Определить погрешность весов при нецентральном положении груза
на чашке при каждом i-ом измерении
определяется как разность показаний весов и действительного значения массы гири
по формуле (1).
. Результаты измерений и вычислений занести в занести в таблицу 2
(рабочий журнал).
. Погрешность весов при каждом i-ом измерении не должна превышать пределов допускаемой
погрешности, указанных в таблице 5.
III.
Определение среднего квадратического отклонения показаний (CKO) весов
СКО показаний весов следует определять при нагрузке, равной НПВ
номинальное значение массы которой указано в таблице 5, в следующей
последовательности:
. установить нулевые показания весов нажатием клавиши;
. поместить гири в центр чашки весов и снять 1-е показание весов L1 снять гири с чашки.
. вновь поместить гири в центр чашки весов и снять 2-е показание
весов L2.
. операции повторять до получения 10 показаний весов с нагрузкой,
при этом, если при отсутствии нагрузки на весах не установились нулевые
показания, то их следует установить нажатием клавиши.
. Результаты измерений занести в таблицу 3 (рабочий журнал).
6. Вычислить
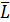
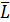 -
среднее арифметическое значение показаний нагруженных весов по формуле (2):
-
среднее арифметическое значение показаний нагруженных весов по формуле (2):
 (2)
(2)
Где Li - i-ое показание весов,
i -
порядковый номер измерений
. Затем вычислить СКО показаний весов (S) по формуле (3):
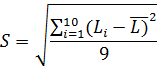 (3)
(3)
. Результаты вычислений занести в протокол.
. Среднее квадратическое отклонение (CКО) показаний весов не должно превышать значения,
приведенного в таблице 5.
КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ
1. Контроль
качества лекарственных средств.
2. Формы
контроля качества л.с.
3. Надлежащие
практики в фармации.
4. Правила GLP.
5. Российские нормативные документы, регламентирующие производство
Л.С.
6. Государственная фармакопея РФ.
7. Международные и региональные сборники унифицированных требований
и методов испытаний лекарственных средств
8. Понятие об испытательной лаборатории (центре) по контролю
качества лекарственных средств
9. Правила GPCL.
10. Основные
задачи испытательной лаборатории (центра) по контролю качества лекарственных
средств. <http://www.medbrak.ru/ckkls/index.htm>
11. Структура испытательной лаборатории (центра) по контролю качества
лекарственных средств
12. Функции испытательной лаборатории (центра) по контролю качества
лекарственных средств
. Основные положения паспорта испытательной лаборатории (центра)
по контролю качества лекарственных средств
14. Общие требования к компетентности испытательной лаборатории
(центра) по контролю качества лекарственных средств
15. Перечень оборудования, необходимого при проведении аккредитации на
техническую компетентность испытательной лаборатории
16. Требования к оборудованию испытательной лаборатории
. Метрология - наука об измерениях
18. Законодательные акты РФ об обеспечении единства измерений
. Виды весов и их поверка
20. Краткая характеристика лабораторных, прецизионных весов
21. Краткая характеристика аналитических электронных весов
22. Краткая характеристика технохимических весов
. Краткая характеристика компаратора массы
. Калибровка весов
. Средства калибровки
. Поверка средств измерений
. Виды поверок весов
. В чем заключается методика поверки лабораторных весов?
29. В чем заключается методика поверки аналитических весов?
30. Точность взвешивания.
31. Правила взвешивания на аналитических, лабораторных, аптечных весах
32. Из каких материалов изготавливается химическая посуда?
. Типы химической посуды по назначению.
34. Виды мерной посуды.
35. Определение возможности использования номинальной вместимости
мерной посуды.
. Правила измерения объема жидкостей.
. Правило использования поправок к вместимости мерной посуды;
. Правило снятия показаний бюретки;
. Правило доведения до метки растворов в мерной колбе;
. Правило отмеривания объемов растворов с помощью пипетки;
. Формула взаимосвязи массы и объема растворов веществ.
. Определение объёма 1 и ½ капли бюретки
. Проверка вместимости пипетки
. Проверка вместимости мерной колбы
. Проверка вместимости мерной колбы
. Проверка вместимости бюретки
. Проверка вместимости участков бюретки, отличающихся на 5 мл
. Проверка полной вместимости бюретки
. В чем заключается подготовка весов к поверке?
. Основные этапы поверки лабораторных весов WTB 200.
Учебное издание
Е.Н. Вергейчик, А.Б. Саморядова
«ОРГАНИЗАЦИЯ РАБОТЫ
ИСПЫТАТЕЛЬНОЙ ЛАБОРАТОРИИ (ЦЕНТРА) ПО КОНТРОЛЮ КАЧЕСТВА ЛЕКАРСТВЕННЫХ
СРЕДСТВ»
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ДЛЯ СТУДЕНТОВ 3 КУРСА
Технический редактор Браташова Т.М.
Подписано к печати «___» ___________2011 г.
Формат 60х84 1/16. Бумага писчая белая.
Усл. печ. л. 1,83. Уч. изд. л. 1,83
Тираж ____экз. Заказ №_____
Пятигорская государственная фармацевтическая академия
, г. Пятигорск, пр. Калинина, 11.