Методологія генетичної трансформації рослин
Контрольна
робота
Методологія
генетичної трансформації рослин
Вміст
. Цілі та етапи трансформації
рослин
. Векторні системи для переносу
генів
. Методи переносу генів в
рослину
.1. Основні етапи
агробактеріальної трансформації рослин
. Гени-маркери для відбору
трансформантів та регенерація трансформантів
Література
Вступ
Одним із шляхів підвищення
продуктивності сільського господарства, і зокрема рослинництва, є максимальне
використання біологічного потенціалу сільськогосподарських культур. Великі
надії в цьому напрямі покладають на використання досягнень генетичної інженерії
- як комплексу підходів та методів, що дозволяють вносити спрямовані зміни в
геном рослин.
Генетична трансформація - це
спрямована модифікація геному рослинної клітини очищеною чи рекомбінантною ДНК
з клітин іншого організму, яка інтегрується в геном модифікованої
(реципієнтної) клітини.
1. Цілі та етапи трансформації
рослин
В загальному вигляді процес
трансформації складається з наступних етапів:
· виділення послідовності генів,
що відповідають за ознаку, яку необхідно надати реципієнтній клітині;
· вбудовування
цільового гену в спеціально сконструйовану молекулу ДНК - так званий вектор;
· перенесення вектору
в рослинну клітину, де відбувається інтеграція цільового гену в геном клітини;
· відбір на
спеціальних середовищах трансформованих клітин;
· регенерація
трансгенних рослин.
Напрями створення трансгенних
рослин:
· створення рослин з
покращеними споживчими характеристиками;
· створення рослин,
стійких до гербіцидів;
· створення рослин,
стійких до абіотичних стресів (посуха, засолені ґрунти);
· створення рослин,
стійких до шкідників та збудників хвороб (рис. 1).
Отримання таких традиційних
продуктів, як вуглеводи (цукор, крохмаль), ліпіди (різні олії) та білки в звичайних
та трансгенних рослинах, що застосовуються для їжі, для годівлі худоби, у
промисловості, також є економічно вигідним, що підтверджується щорічним збором
мільйонів тон урожаю із сільськогосподарських угідь. У цьому зв'язку широко
ведуться дослідження з метою удосконалення якісних характеристик продукції
рослинництва. Зокрема, шляхом генетичної трансформації рослин ведуться роботи,
спрямовані на зменшення накопичення шкідливих речовин, збільшення накопичення
корисних, а також на підвищення дієтичних, харчових, смакових якостей
продукції. Прикладом робіт зі зменшення накопичення токсичних речовин може бути
створення батату, який не накопичує ціаногенні глікозиди в коренях та листках.
Такі ціаногенні глікозиди, як лінамарин та лотаустралін, викликають різні
захворювання, разом з тим батат є важливим продуктом харчування близько 400
млн. чоловік.

Рис. 1. Основні напрями створення
генетично модифікованих сільськогосподарських культур
Серед генів, експресія яких у рослинах
вважається екзотичною, найбільш важливими є гени, що кодують синтез
поліпептидів, важливих для медицини. При цьому трансгенні рослини володіють
низкою переваг порівняно з культурою клітин мікроорганізмів, тварин та людини
для виробництва рекомбінантних білків. Серед переваг трансгенних рослин
основними є можливість великомасштабного отримання, дешевизна, простота
очистки, відсутність домішок, що мають алергенну, імуносупресивну,
канцерогенну, тератогенну та інші побічні дії на організм людини. Рослини можуть
синтезувати, глікозилювати та складати із субодиниць білки ссавців. При
споживанні сирих овочів та фруктів, що несуть гени, які кодують синтез
білків-вакцин, відбувається оральна імунізація. Це має величезне економічне
значення, особливо для країн, що розвиваються, в зв'язку зі значним
здешевленням отримання оральних вакцин і відсутністю необхідності очистки у
випадку переносу цих генів у фрукти та овочі, що вживаються в сирому вигляді.
Виробництво фармацевтичних білків,
антитіл, вакцин на основі генно-інженерних підходів є яскравим прикладом тих
переваг, які надає сучасна біотехнологія рослин. Такі білки та пептиди
називають рекомбінантними, тому що їх отримують з використанням технології
рекомбінантних молекул ДНК.
Рослина як природний
"біореактор" з виробництва рекомбінантних білків, важливих для
медицини, має певні переваги порівняно з клітинами тварин, людини та
мікроорганізмів:
• рекомбінантні білки, синтезовані в
рослині, не потрібно піддавати денатурації та ресинтезу;
• рослини здатні не лише до синтезу
і збирання, а й до глікозилювання білків тварин; це абсолютно необхідно для
синтезу антитіл і деяких інших функціонально повноцінних білків;
• рослини, порівняно із клітинами
ссавців і трансгенними тваринами, забезпечують значне здешевлення виробництва
рекомбінантних білків, причому без обмежень, пов'язаних зі зростанням обсягів
такого виробництва; наприклад, якщо середня вартість очищених пептидів,
отриманих за допомогою інших сучасних методів, становить 100 тис. - 1 млн. дол.
США за 1 кг, то їх вартість у разі отримання із трансгенних рослин дорівнює 1
тис. дол. за 1 кг;
• у препаратах, отриманих із рослин,
порівняно з препаратами тваринного чи мікробіологічного походження, значно
менше або й зовсім відсутні небажані віруси; відсутні домішки, що мають
алергічну, імуносупресивну, канцерогенну, тератогенну дію на організм людини;
це зумовлює порівняну легкість очищення синтезованих рослинами фармацевтичних
пептидів;
• під час вживання сирих овочів і
фруктів, що містять гени, які кодують синтез білків-вакцин, відбувається
імунізація організму.
Існує кілька підходів у індукції
синтезу рекомбінантних білків у рослинах, основними з яких є:
● • отримання
трансгенних рослин із вбудованими генами рекомбінантних білків. Такі рослини,
представники різних видів, що несуть різноманітні гени синтезу рекомбінантних
білків, вже отримані, деякі з них випробовують для комерційного використання;
недоліком цього підходу є відносно невисока концентрація рекомбінантного білка,
що зменшує можливість використання таких рослин для виробництва очищених
препаратів; тому ця технологія застосовується для виробництва їстівних вакцин
або інших білків, які можуть споживатись в неочищеному стані; модифікації, що
ґрунтуються на можливості як спонтанної, так і індукованої секреції (ексудації)
рекомбінантних білків у поживне середовище у разі вирощування трансгенних
рослин в умовах гідропоніки, застосовують для отримання очищених препаратів
рекомбінантних білків;
● •
використання трансформації хлоропластів. Цей метод дає змогу різко збільшувати
кількість потрібного білка в листках трансформованих рослин; так, накопичення
соматотропіну людини (гормон росту), ген якого було внесено в хлоропласти
тютюну, становило до 7% усього розчинного білка трансформованої рослини; в
окремих випадках рівень рекомбінантного білка може навіть досягати понад 40%
сумарного розчинного білка; проте широке застосування цієї технології поки що
стримується труднощами трансформації хлоропластів;
● •
використання позаклітинних генетичних елементів. Перші подібні генетичні
конструкції створено на базі РНК-вмісного вірусу тютюнової мозаїки (ВТМ); ген
біосинтезу цільового білка клонують під контролем промотору вірусу (звичайно
використовують субгеномний промотор білка оболонки вірусу) у бактеріальному
векторі, який містить повну ДНК копію вірусної РНК; потім у безклітинній
системі на основі отриманого вектора синтезується вірусна РНК, яка наноситься
на пошкоджені листки тютюну або споріднених видів; протягом 1 - 2 тижнів
відбувається накопичення вірусних часточок, що містять рекомбінантний білок;
така система дає змогу за короткий термін накопичувати значну кількість
цільового рекомбінантного білка в листках інфікованої рослини (2 - 10%, іноді
до 20% загальної кількості рослинного білка).
Отже, сучасна біотехнологія рослин
ґрунтується і використовує останні досягнення різних напрямів біологічної науки
і широко застосовується у господарській діяльності: в сільському господарстві,
переробній, харчовій, парфумерній, косметичній промисловості, медицині тощо.
2. Векторні системи для переносу
генів
Загалом процес трансформації
рослинної клітини може бути здійснено або за використання механізмів природного
обміну генетичним матеріалом в ході взаємодії з рослиною бактерій роду
Agrobacterium, або шляхом прямого введення рекомбінантних ДНК в клітини рослин.
Вектор - молекула ДНК здатна до
автономної реплікації і включення в себе чужорідної ДНК.
Вектор крім цільового гену повинен
містити елементи необхідні для його реплікації і інтеграції в геном реципієнта,
а також регуляторні елементи для експресії гена і селективні маркери, за
допомогою яких здійснюється відбір трансформантів.
Для створення трансгенних рослин
використовують вектори на основі плазмід, вірусів, хлоропластної і
мітохондріальної ДНК, транспозонів.
Вектори на основі агробактеріальних
плазмід.
У 70 роках минулого сторіччя було
встановлено, що трансформація рослин може відбуватися в природних умовах.
Чинником такої трансформації є Agrobacterium tumefaciens. Клітини цього
патогену містять велику плазміду, яку прийнято позначати як Ti - tumor indusing
(індукуюча пухлини).
Важливою особливістю будови Т-ДНК є
наявність прямих повторів по 25 пар нуклеотидів на обох кінцях сегменту Т-ДНК.
Включення будь-якого фрагменту ДНК між цими двома нуклеотидними послідовностями
призводить до його переносу в рослинний геном. На основі Ті- плазмід розроблені
векторні системи, які дозволяють переносити та добиватися експресії в рослинних
клітинах практично будь-яких генів.
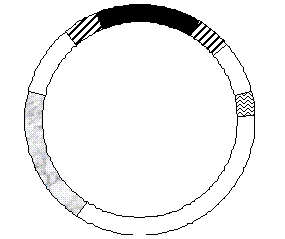
Рис. 2. Схема Ті - плазміди Agrobacterium
tumefaciens.
Т-ДНК частина ДНК (до 10%), що
інтегрується в геном рослини, RB та LB повторювані послідовності, Vir - гени
вірулентності, опіни - гени, що відповідають за синтез опінів.
Ті -плазміда здатна природним шляхом
проникати в рослинні клітини і вбудовувати певну ділянку ДНК (Т-ДНК) в
рослинний геном. В результаті цієї трансформації суттєво змінюється метаболіз
рослинної клітини і починається утворення пухлини. Генетичний аналіз дозволив
ідентифікувати у Ті-плазміді гени, що контролюють пухлиноутворення у рослини,
гени, що відповідають за синтез унікальних амінокислот опінів, гени, що
контролюють процес інтеграції і переносу Т-ДНК в рослину (ці гени знаходяться
за межами Т-ДНК ділянки). Vir ділянка містить 6 локусів: Vir А - хеморецептор, Vir
Д білок, що зв’язується з Т-ДНК в RB ділянці, Vir Е транспортний білок, Vir В
білок, що утворює пору в мембрані рослинної клітини. Оскільки Ті-плазміда
містить гени, що експресуються в бактеріальній клітині, і гени, що
експресуються в рослинній клітині, її вважають природною химерою.
Найбільш простим способом
використання A. tumefaciens для трансформації рослин є введення цільового гену
в ділянку Т-ДНК, а потім використання природної здатності Ті-плазміди до
перенесення в рослинну клітину задля доставки цільового гену. Не зважаючи на
природну здатність Ті- плазміди до інтеграції в рослинні клітини, у разі
використання її в якості вектору виникає низка перешкод:
· фітогормони
(ауксини і цитокініни), що синтезуються рослинними клітинами в культурі,
пригнічують регенерацію цілої рослини;
· Ті- плазміди мають
великий розмір (200 - 800 т.п.н.), що ускладнює маніпуляції з ними;
· Ті- плазміди не
реплікуються в E.coli, що робить неможливим використання цих бактерій для
роботи з рекомбінантними плазмідами.
Тому для використання в якості
вектора Ті- плазміди модифікують видаляючи гени, що відповідають за синтез
гормонів і опінів, та вбудовуючи сайт ініціації реплікації в E.coli.

Рис. 3. Схема бінарного вектору
Оскільки, Ті- плазміди, що
використовуються в якості векторів не містять vir-генів, вони не можуть
самостійно забезпечити перенесення та інтегрування в рослинний геном Т-ДНК. Для
вирішення цієї проблеми можна використати бінарну векторну систему. Бінарний
клонуючий вектор містить сайти ініціації реплікації для двох видів бактерій
E.coli та A. tumefaciens, але не має vir-генів (рис. 3). Всі стадії клонування
здійснюють в E.coli, а потім вектор вводять в A. tumefaciens. Штам-реципієнт A.
tumefaciens містить модифіковану неонкогенну Ті- плазміду, що позбавлена Т-ДНК,
але містить vir-гени. Продукти vir-генів, що синтезуються цією плазмідою,
забезпечують перенесення Т-ДНК бінарного клонуючого вектору в рослинну клітину.
Природній спектр рослин-хазяїв для
Agrobacterium tumefaciens обмежений дводольними рослинами. Тому крім
використання цього підходу для трансформації рослинних клітин використовують
також інші методи.
3. Методи переносу генів в рослину
Об’єктами для введення вектору
можуть бути протопласти, окремі клітини, сегменти стебла, диски з листової
пластинки, зародки, пильники.
Метод біологічної балістики.
Метод полягає в «обстрілі» клітин
рослин-реципієнтів за допомогою спеціальної вакуумної пушки металевими
мікрочастинками з напиленими на поверхні ДНК-векторами. Частинки металу
(вольфраму) розміром 0,6 - 1,2 мкм з напиленою на них ДНК наносять на
целофанову підложку і розміщують навпроти вихідного отвору пушки. На відстані
10 - 15 см від них розміщують суспензію клітин, калюс або інші рослинні
клітини. Після пострілу мікрочастинки пронизують рослинні клітини, частково
залишаючись в середині клітин. Клітини, які здатні до регенерації, після цього
відбирають на спеціальних поживних середовищах. Метод є універсальним для
трансформації клітин будь-якого походження.
Суть методу полягає в тому, що на
найдрібніші частинки вольфраму, платини або золота, діаметром 0,6 - 1,2 мкм,
напилюють ДНК вектора, що містять необхідну для трансформації генну
конструкцію. Вольфрамові, платинові або золоті частинки, що несуть ДНК, на
целофановій підкладці поміщають всередину біобалістичної гармати (рис. 6.4).
Калюс або суспензію клітин вносять до чашки Петрі з агаризованим середовищем і
поміщають під біобалістичну гармату на відстані 10 - 15 см. У гарматі вакуумним
насосом зменшують тиск до 0,01 МПа. У момент скидання тиску вольфрамові або
золоті частинки з величезною швидкістю викидаються з гармати і розривають
клітинні стінки, які входять в цитоплазму та ядро клітин. Зазвичай клітини,
розташовані безпосередньо по центру, гинуть через величезну кількість і тиск
вольфрамових або золотих частинок, тоді як в зоні 0,6 - 1 см від центру
знаходяться трансформовані клітини. Далі клітини обережно переносять на
середовище для подальшого культивування і регенерації.
За допомогою біобалістичної гармати
трансформовано однодольні рослини, зокрема кукурудза, рис, пшениця, ячмінь, і
отримані стабільні трансгенні рослини. Окрім цього біобалістичну трансформацію
застосовують для прямого перенесення ДНК в ембріогенний пилок і отримання
трансгенних дигаплоїдних рослин, які є важливим етапом в селекційній роботі.
Цим методом була проведена трансформація рослин тютюну, і після регенерації
гаплоїдних рослин отримані стабільні трансформанти.
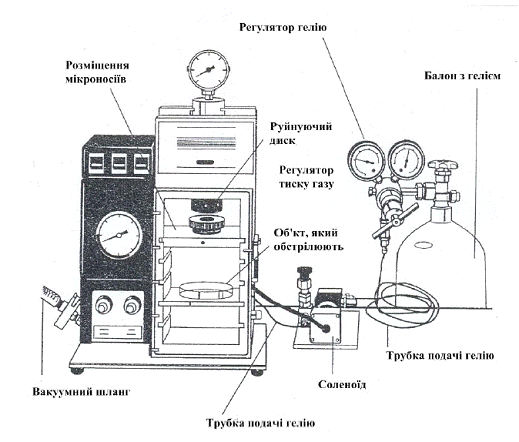
Рис. 4. Схема установки PDS-1000/He.
Електропорація.
Трансформація рослинних
протопластів.
При злитті протопластів, оброблених
хімічними індукторами зливання на фоні високих концентрацій іонів кальцію,
можливий захват молекул ДНК з розчину, результатом чого є трансформація клітин.
Метод має невисоку ефективність, однак перевагою цього методу є простота
реалізації. Він не потребує спеціальних пристроїв для введення ДНК в клітину і
інтеграції її в рослинний геном.
Мікроін’єкції.
За використання цього методу
чужорідна ДНК вводиться в клітини за допомогою мікроголки з діаметром близько 2
мкм після фіксації протопласту на склі полілізином (рис. 5). Ефективність
трансформації за використання цього методу 10 - 20%. Метод вважають
універсальним.
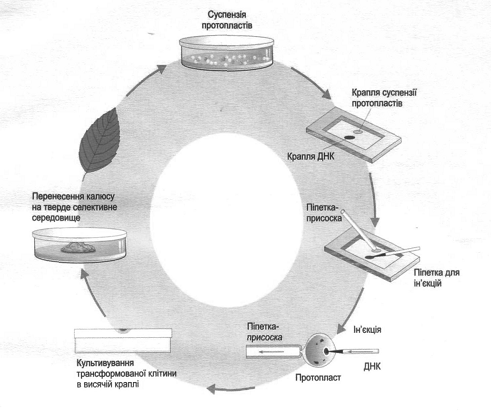
Рис. 5. Схема трансформації клітин
рослин методом мікроін’єкцій (за Мельничук, 2011).
Упаковка в ліпосоми. Це один з
методів, який використовується для захисту екзогенного генетичного матеріалу,
який вводиться в протопласти рослин, від дії нуклеаз, які руйнують нуклеїнові
кислоти.
Ліпосоми - це сферичні утворення,
оболонки яких складаються з фосфоліпідів. Їх можна отримати в результаті
різкого струшування або обробки ультразвуком водних емульсій фосфоліпідів. За
допомогою ліпосом в протопласти рослин були введені РНК вірусу тютюнової
мозаїки, ДНК Тi-плазміди A. tumefaciens, а також цілі метафазні хромосоми. До
переваг систем перенесення за допомогою ліпосом можна віднести їх низьку
токсичність по відношенню до клітин і можливість використання на багатьох рослинах,
клітини яких здатні утилізувати ліпосоми. В даний час цей спосіб трансформації
застосовується все рідше із-за його технічної складності і низької
трансформуючої активності (0,5 - 1 %).
.1 Основні етапи агробактеріальної
трансформації рослин
Внесення генетичного матеріалу в
рослини можна здійснювати шляхом агробактеріальної інфільтрації (рис. 6). У
цьому випадку генетичний матеріал потрапляє в клітину після ін'єкції в листки
рослини агробактерій, які містять відповідний вектор. Агробактерії переносять
свою Т-ДНК в клітини мезофілу листка. У Т-ДНК агробактерій вбудовані гени
рекомбінантного білка.
На основі описаних технологій
створено трансгенні рослини, які використовують для виробництва оральних
вакцин, що має велике економічне значення у зв'язку із значним здешевленням їх
отримання і відсутністю потреби очищення у випадках перенесення відповідних
генів у фрукти і овочі, що вживаються у сирому вигляді.
За допомогою агробактеріальної
трансформації отримано трансгенні рослини тютюну, що несуть ген білка оболонки
вірусу лихоманки свиней, трансгенні рослини і калюсні тканини тютюну, які
експресують білки вірусу гепатиту Б. Під час годування мишей цими трансгенними
рослинними продуктами у них був ідентифікований синтез специфічних антитіл.
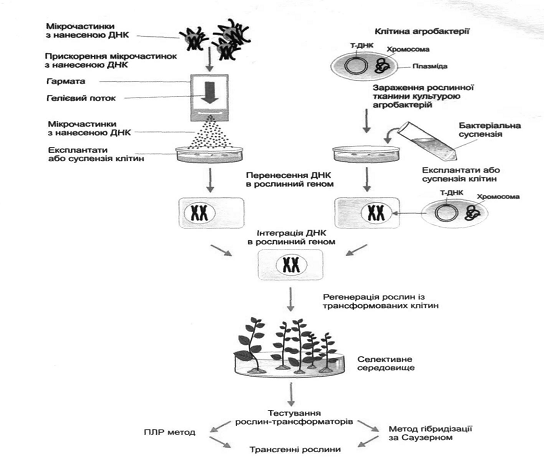
Рис. 6. Схема трансформації
рослинних клітин за допомогою Agrobacterium tumefaciens (за Мельничук, 2011).
4. Гени-маркери для відбору
трансформантів та регенерація трансформантів
Оскільки частота трансформації
зазвичай є невеликою, то до векторів, як правило, вводять гени-маркери для
зручності відбору трансформантів на селективних середовищах. В якості маркерних
генів найчастіше використовують гени стійкості до антибіотиків з Еsherichia
coli (канаміцину, хлорамфеніколу та ін.), до яких чутливі більшість рослинних
клітин (табл. 1). Крім генів стійкості до антибіотиків в якості маркерних
використовують гени, що кодують біосинтез ферменту люциферази, виділеної з
бактерій роду Vibrio. В цьому випадку трансформовані клітини набувають здатності
світитися. Зручним маркером є також ген бактеріальної b-глюкуронідази,
який дозволяє виявляти трансформовані клітини за специфічним забарвленням
селективних середовищ.
Таблиця
1.
Маркерні гени, що використовують при
трансформації рослин
|
Маркерний ген
|
Фермент, який кодується цим геном
|
Відбір за стійкістю
|
|
npt II
|
неоміцинфосфотрансфераза
|
Неоміцин, канаміцин
|
|
cat
|
хлорамфеніколацетилтрансфераза
|
хлорамфенікол
|
|
ДГФР
|
дигідрофолатредуктаза
|
метатрексат
|
|
hpt
|
гігроміцинфосфотрансфераза
|
гігроміцин
|
|
gus
|
глюуронідаза
|
-
|
|
lux
|
люцифераза
|
-
|
|
bar
|
фосфінотрицинацетилтрансфераза
|
фосфінотрицин
|
Необхідно пам’ятати, що ефективність
експресії трансгена залежить від використаного у векторі типу промотора та
інших регуляторних елементів. Відібрані за селективним маркером трансформанти
можуть не експресувати цільовий ген, або експресія може бути не стабільною -
зникати в другому поколінні або навпаки з’являтися. Для того, щоб переконатися
в отриманні трансгенних рослин і сталій експресії чужорідного гену проводять
молекулярний аналіз.
Література
генетичний модифікований сільськогосподарський
1. Патыка
Т.И., Патыка В.Ф. Формирование популяционной резистентности у насекомых к
энтомопатогенным бактериям Bacillus thuringiensis // Науковий вісник
Національного аграрного університету. - 2008. - Вип.125. - С. 28-36.
2. Курдиш
І.К. Інтродукція мікроорганізмів у агроекосистеми. - К.: Наук. думка, 2010. -
254 с.
. Вейзер
Я. Микробиологические методы боротьбы с вредными насекомыми .- М. Колос, 1972.-
312 с.
. Франц
И., Криг А. Биологические методы боротьбы с вредителями - М.: Колос, 1984.- 357
с.
. Кунах
В.А. Біотехнологія лікарських рослин. Генетичні та фізіолого-біохімічні основи.
- Кю: Логос, 2005. - 730 с.
. Писаренко
В.М., Писаренко П.В. Захист рослин: екологічно обгрунтовані системи - П.:
ІнтерГрафіка, 2002. - 288 с.
. Мельничук
М.Д., Григорюк І.П., Новак Т.В., Кляченко О.Л., Коломієць Ю.В., Спиридонов
В.Г., Клюваденко А.А., Антіпов І.О., Оверченко В.В., Облап Р.В., Новак Н.Б.
Біотехнологія рослин: Навч.посіб. - К.: Видавничий центр НУБіП України, 2011. -
216 с.