Технологии переработки цирконового концентрата
Введение
Природный цирконий состоит из 5 изотопов с
массовыми числами 90, 91, 92, 94 и 96. Кроме того, известно восемь
искусственных радиоактивных изотопов циркония с массовыми числами 86, 87, 88,
89 (два изомера), 93, 95, 97.
Природный гафний состоит из 11 изотопов с
массовыми числами от 170 до 180, причем 99,8% общего количества элемента
приходится на долю изотопов 176-180. Известно также 9 искусственных
радиоактивных изотопов гафния с массовыми числами 170, 171, 172, 173, 175, 179,
180 (последние три - изомеры природных изотопов), 181 и 183.
Цирконий и гафний относятся к числу тугоплавких
элементов, входящих в четвертую и пятую группы периодической системы. Металлы
эти отличаются высокой прочностью кристаллической решетки, что определяет
повышенную твердость их, высокую температуру плавления и значительную стойкость
против коррозии.
По положению в периодической системе цирконий и
гафний во всех важнейших соединениях четырехвалентны. Известны некоторые двух-
и трехвалентные соединения их, но соединения эти неустойчивы и обладают сильно
восстановительными свойствами. В технологии производства циркония и гафния в
основном применяют четырехвалентные соединения циркония и гафния; однако в
процессах разделения этих элементов используют также различие в свойствах
соединений низшей валентности.
Близость свойств аналогичных соединений циркония
и гафния носит совершенно исключительный характер и может быть сопоставлена
лишь с близостью свойств соединений РЗЭ. Это дало даже повод некоторым авторам
называть гафний тяжелым «изотопом» циркония.
Многие важнейшие области современной техники
предъявляют все возрастающий спрос на чистые цирконий и гафний и сплавы на их
основе.
Получение циркония и гафния - чрезвычайно
сложная задача. Несмотря на относительную одинаковость сырья, технологические
схемы его передела на металл довольно многообразны и только в последнее время с
достаточной определенностью начал оконтуриваться основной технологический
вариант.
Первая стадия переработки рудного сырья -
механическое обогащение. Далее следует вскрытие концентратов, осуществляемое по
основному технологическому варианту: хлорирование карбонитридов металлов
газообразным хлором и фракционная конденсация хлоридов циркония и гафния (без
их разделения). После очистки хлоридов от посторонних примесей следует
разделение циркония и гафния, которое по основной технологической схеме
выполняется избирательной экстракцией метилизобутил - кетоном из солянокислых
растворов в присутствии роданида с преимущественным извлечением гафния в
органическую фазу и раздельным получением обоих металлов в форме окислов.
Окислы металлов хлорируют, а полученные хлориды очищают от оставшихся
посторонних примесей и подвергают металлотермическому восстановлению. Продукт
восстановления - губку циркония или гафния - в специальных условиях,
порожденных высокой температурой плавления и химической активностью этих
элементов, плавят на компактный металл.
Наряду с хлорированием до сих пор используют и
другие методы вскрытия сырья, например спекание и сплавление с различными добавками;
в этих случаях ряд операций последующего передела отличается от тех, которые
применяли в схемах, основанных на хлорировании. Да и само хлорирование
стремятся осуществлять без формирования карбонитридов, подвергая воздействию
газообразного хлора подшихтованный восстановителем цирконовый концентрат.
Упомянутое выше разделение циркония и гафния экстракцией МИК - также не
единственное технологическое решение.
Наряду с металлотермическим восстановлением
возможно получение циркония и гафния электролизом расплавленных сред. Для
производства гафния решающее значение имеет процесс йодидного рафинирования.
Наконец, серьезную проблему представляет получение компактных металлов высокого
качества дуговой или электронной плавкой.
Целью настоящей курсовой работы является
знакомство с технологиями переработки цирконового концентрата и рассмотрение
технологии получения тетрахлорида циркония хлорированием циркона с системой
улавливания хлоридов.
1. Общие сведения
.1 История открытия металла
Двуокись циркония выделена впервые Клапротом в
1789 г. из драгоценного камня джаргона или яргона, представляющего собой
разновидность минерала циркона. Металлический цирконий получен Берцелиусом в
1824 г. в виде сильно загрязненного порошка. Только через столетие- в 1925 г.
Ван-Аркель и де-Бур, применив йодидное рафинирование, получили пластичный
металл. Такой разрыв во времени обусловлен высокой химической активностью
циркония, которая затрудняла как его выделение из природного сырья и
искусственных соединений, так и получение в пластичном виде.
В 1923 г. Кюстер и Хевеши сообщили об открытии в
циркониевом сырье элемента с атомным номером 72, который они назвали гафнием.
Пластичный гафний был получен одновременно с пластичным цирконием также
йодидным рафинированием.[1]
.2 Нахождение в природе и минералы
Содержание циркония в земной коре относительно
высокое - 0,025 % (по массе). По распространенности он превосходит медь, цинк,
олово, никель и свинец. Известно около 20 минералов циркония. Они
концентрируются главным образом в гранитных и щелочных (нефелин-сиенитовых)
пегматитах. Основными промышленными источниками в настоящее время служат
минералы бедделеит и циркон. Сырьем могут служить также минералы эвдиалит и
эвколит, но они значительно бедней по содержанию циркония.
Бадделеит представляет собой почти чистый
диоксид циркония. В наиболее чистых образцах до 98 % ZrО2.
Обычно содержит примесь гафния, изредка уран (до 1%) и торий (до 0,2%).
Месторождения редки. Плотность минерала 5,5-6. Наиболее крупное месторождение
найдено в Бразилии.
Основные методы обогащения руд - гравитационные.
Для отделения минералов железа и ильменита используют электромагнитное
обогащение.
Циркон - ортосиликат циркония ZrSiО4
(67,2 % ZrО2,
32,8 % SiО2).
Это наиболее распространенный минерал циркония. Концентрируется главным образом
в пегматитах гранитной и особенно щелочной магмы. Часто встречается в россыпях,
образующихся при разрушении коренных пород. Циркон большей частью имеет
коричневый цвет, плотность минерала 4,4-4,7 г/см3, твердость 7,5 по
минералогической шкале. Минерал обычно содержит гафний (0,5-4%).
Руды, содержащие циркон, обогащают
гравитационными методами в сочетании с магнитной и электростатической
сепарациями.
Выпускаемые цирконовые концентраты первого сорта
должны содержать не менее 65% ZrО2.
В них лимитируется содержание следующих примесей, % (не 6oлее):
FeO 0,1; TiО2
0,4; A12O3
2,0; СаО и MgO 0,1; P2O5
0,15. Концентраты второго сорта должны содержать не менее 60% ZrО2.
Наиболее крупные месторождения циркона за
рубежом расположены в Австралии, Индии, Бразилии, ЮАР, США. В России циркон
найден на Урале.
Эвдиалит и эвколит. Состав эвдиалита может быть
выражен общей эмпирической формулой: (Na,
Ca)6Zr[Si6О18]
[ОН,С1]2.
Эвколит - разновидность эвдиалита, содержащего
ионы Fe2+.
Химический состав эвдиалита, %: Na2O
11,6-17,3; ZrО2
12-14,5; FeO 3,1-7,1; SiО2
47,2-51,2; Cl 0,7-1,6.
Цвет минерала - розовый или малиновый. Минерал легко разлагается кислотами.
Эвдиалит и эвколит встречаются в магматических
щелочных породах (нефелиновых сиенитах). Известны месторождения в СССР (на
Кольском полуострове), Португалии, Гренландии, Трансваале, Бразилии и других
странах.[2]
1.3 Свойства и области применения
.3.1 Физические свойства
Компактный
металлический цирконий внешне очень похож на сталь. Он ничем не проявляет своей
химической активности и в обычных условиях по отношению к атмосферным газам
ведет себя исключительно инертно. Кажущаяся химическая пассивность циркония
объясняется довольно традиционно: на его поверхности всегда есть невидимая
окисная пленка, предохраняющая металл от дальнейшего окисления. Чтобы полностью
окислить цирконий, надо повысить температуру до 700°C. Только тогда окисная
пленка частично разрушится, а частично растворится в металле.
Итак, 700°C - тот
температурный предел, за которым кончается химическая стойкость циркония. К
сожалению, и эта цифра слишком оптимистична. Уже при 300°C цирконий начинает
более активно взаимодействовать с кислородом и другими компонентами атмосферы:
водяными парами (образуя двуокись и гидрид), с углекислым газом (образуя карбид
и двуокись), с азотом (продукт реакции - нитрид циркония). Но при температурах
ниже 300°C окисная пленка - надежный щит, гарантирующий высокую химическую
стойкость циркония.
Иначе, чем
компактный металлический цирконий, ведут себя на воздухе его порошок и стружка.
Это пирофорные вещества, которые легко самовозгораются на воздухе даже при
комнатной температуре. При этом выделяется много тепла. Циркониевая пыль в
смеси с воздухом способна даже взрываться.
Интересно отношение
циркония к воде. Явные признаки взаимодействия металла с водой долгое время не
видны. Но на поверхности смоченного водой циркония происходит не совсем обычный
для металлов процесс. Как известно, многие металлы под действием воды
подвергаются гальванической коррозии, которая заключается в переходе их
катионов в воду. Цирконий же и под действием воды окисляется и покрывается
защитной пленкой, которая в воде не растворяется и предотвращает дальнейшее
окисление металла.
Перевести ионы
циркония в воду проще всего растворением некоторых его солей. Химическое
поведение четырехвалентного иона циркония в водных растворах очень сложно. Оно
зависит от множества химических факторов и процессов, протекающих в водных
растворах.
Атомная масса - 91,22; Атомный номер - 40;
Атомный радиус - 1,452 Ȧ; Плотность - 6,45 г/см3 ; Температура
плавления - 1852 °С; Температура кипения - 3580 °С.
1.3.2 Химические
свойства циркония
Цирконий существует
в двух кристаллических модификациях: a-формы с гексагональной плотноупакованной
решёткой (а = 3,228 ; с = 5,120 ) и b-формы с кубической объёмноцентрированной
решёткой (а = 3,61 ). Переход a -> b происходит при 862 °C. Плотность
a-циркония (20 °C) 6,45 г/см3; tпл 1825 °C; tкип 3580 °C; удельная теплоёмкость
(25-100 °C) 0,291 кдж/(кг×К) [0,0693 кал/(г×°C)], коэффициент теплопроводности (50 °C) 20,96 вт/(м×К) [0,050 кал/(см×сек ×°C)]; температурный
коэффициент линейного расширения (20-400 °C) 6,9×10-6;
удельное электрическое сопротивление циркония высокой степени
чистоты (20°C) 44,1 мком×см. температура перехода в состояние сверхпроводимости 0,7 К.
цирконий парамагнитен; удельная магнитная восприимчивость увеличивается при
нагревании и при -73 °C равна 1,28×10-6,
а при 327 °C - 1,41×10-6. Чистый цирконий пластичен, легко поддаётся холодной и горячей
обработке (прокатке, ковке, штамповке). Наличие растворённых в металле малых
количеств кислорода, азота, водорода и углерода (или соединений этих элементов
с цирконием) вызывает хрупкость циркония Модуль упругости (20 °C) 97 Гн/м2
(9700 кгс /мм2); предел прочности при растяжении 253 Мн/м2 (25,3 кгс/мм2);
твёрдость по Бринеллю 640-670 Мн/м2 (64-67 кгс/мм2); на твёрдость очень сильное
влияние оказывает содержание кислорода: при концентрации более 0,2% цирконий не
поддаётся холодной обработке давлением.
Внешняя электронная
конфигурация атома Zr 4d25s2. Для циркония характерна степень окисления +4.
Более низкие степени окисления +2 и +3 известны для циркония только в его
соединениях с хлором, бромом и йодом. Компактный цирконий медленно начинает
окисляться в пределах 200-400 °C, покрываясь плёнкой циркония двуокиси ZrO2;
выше 800 °C энергично взаимодействует с кислородом воздуха. Порошкообразный
металл пирофорен - может воспламеняться на воздухе при обычной температуре.
Цирконий активно поглощает водород уже при 300 °C с образованием гидридов (ZrH
и ZrH2); при 1200-1300 °C в вакууме гидриды диссоциируют и весь
водород может быть удалён из металла. С азотом цирконий образует при 700-800 °C
нитрид ZrN. цирконий взаимодействует с углеродом при температуре выше 900 °C с
образованием карбида ZrC. Карбид и нитрид циркония - твёрдые тугоплавкие
соединения; карбид циркония - полупродукт для получения ZrCl4.
Цирконий вступает в реакцию с фтором при обычной температуре, а с хлором,
бромом и йодом при температуре выше 200 °C, образуя высшие галогениды ZrX4
(где Х - галоген). Цирконий устойчив в воде и водяных парах до 300 °C, не
реагирует с соляной и серной (до 50%) кислотами, а также с растворами щелочей
(Цирконий - единственный металл, стойкий в щелочах, содержащих аммиак). С
азотной кислотой и царской водкой взаимодействует при температуре выше 100 °C.
Растворяется в плавиковой и горячей концентрированной (выше 50%) серной
кислотах. Из кислых растворов могут быть выделены соли соответствующих кислот
разного состава, зависящего от концентрации кислоты. Так, из концентрированных
сернокислых растворов циркония осаждается кристаллогидрат Zr (SO4)2×4H2O; из разбавленных растворов - основные сульфаты общей формулы
xZrO2×ySO3×zH2O (где х: y > 1).
Сульфаты циркония при 800-900 °C полностью разлагаются с образованием двуокиси
циркония. Из азотнокислых растворов кристаллизуется Zr (NO3)4×5H2O или ZrO (NO3)2×xH2O (где х = 2-6), из солянокислых растворов - ZrOCl2×8H2O, который обезвоживается при 180-200 °C.
металл цирконий
концентрат реагент
1.3.3 Потребление
Мировое потребление
цирконового концентрата в середине 90-х гг. оценивалось в 920 тыс. т. В
последующие годы оно постепенно росло и в 2001 г. составило 1,07 млн т.
Основные потребители цирконового концентрата - страны Западной Европы (Италия,
Испания, Германия и др.) - 366 тыс. т в 2001 г., а также Китай - 150-170 тыс.
т, США - 120-130 тыс. т, Япония - 110-120 тыс. т и страны Юго-Восточной Азии.
Большая часть
цирконового концентрата используется в керамике (500 тыс. т/год), литейном
производстве (170 тыс. т/год) и огнеупорах (155 тыс. т/год), а также в
производстве диоксида циркония и других химических соединений (94 тыс. т).
Структура потребления цирконового концентрата в различных странах неодинакова.
В США наибольшее его количество используют в производстве литейных смесей, в
Японии - огнеупоров, в Италии, Испании и Китае - строительной и сантехнической
керамики.
В последнее время
потребление огнеупоров из циркона сократилось, что связано с ростом спроса на
высококачественные легированные стали, производство которых не требует
использования цирконовых огнеупоров. Постепенно уменьшается и потребление
циркона в литейном производстве из-за появления более экономичных заменителей.
Однако в мире в
целом это сокращение с лихвой было компенсировано ростом спроса на циркон в
производстве керамики и общим ростом потребления в Китае (с 10 до 160 тыс. т в
период 1989-2001 гг.). На производство керамических изделий теперь приходится
около половины мирового потребления циркона (в 1980 г. всего 25 %).
Прирост потребления
циркона в производстве керамики в 2001 г. составил 9 %, тогда как в целом его
использование увеличилось на 5 %. Интенсивно росло потребление в производстве
экранов мониторов и телевизоров (8 %), а также химических соединений циркония
(7 %).
Потребление
диоксида циркония активно растет. В конце 90-х гг. оно составляло 36 тыс. т, из
которых половина использовалась в производстве огнеупоров, по 6 тыс. т -
керамических пигментов, металла и химических соединений, остальное - в
абразивах, электронике, катализаторах, конструкционной керамике и других
областях. В 2000-2001 гг. наблюдался значительный рост потребления
стабилизированного иттрием оксида циркония для тонкой керамики при производстве
оптоволоконного кабеля и других высокотехнологичных продуктов, используемых в
коммуникационных сетях, а также порошка оксида циркония для электронной
промышленности.
Потребление
металлического циркония в мире стабильно и составляет 4-5 тыс. т.
В России в условиях
экономической стабильности до начала 90-х гг. потребление цирконовых
концентратов (65 % ZrO2) составляло 40-45 тыс. т и при этом потребность
удовлетворялась лишь на 50 %. В структуре потребления циркона до 1991 г.
основную роль играли огнеупоры (около 40 %) и формовочные смеси для литейного
производства (24 %); по 12 % расходовалось для производства металлического
циркония и его соединений, строительной керамики и в прочих областях
(радиоэлектроника, легкая промышленность и т.д.).
Основной товарной
циркониевой продукцией служит цирконовый концентрат, на который приходится
более 97 % добычи, в небольшом объеме используются бадделеитовый и калдаситовый
концентраты.
Производство
цирконового концентрата из комплексных циркон-рутил-ильменитовых
прибрежно-морских россыпей возрастает, перемежаясь периодами незначительных
спадов. Только за 90-е гг. оно увеличилось на 20 % (1,07 млн т концентрата в
2001 г.).
Добыча
титансодержащих минералов (к которым относится и цирконий) в мире в 2007
г., по оценке Геологической службы США, составила 6,1 млн. т (в пересчете на
диоксид титана), увеличившись по сравнению с 2006 г. на 5%. Мировым лидером в
добыче титана стабильно выступает Австралия, располагающая огромными ресурсами
т.н. тяжелых песков, содержащих титан и цирконий, и обеспечивающая четверть
мировой добычи - 1,55 млн. т в 2007 г. Второе место также прочно занимает ЮАР,
добывшая в 2007 г. почти 1,2 млн. т титана, третье - Канада, с объемом добычи
порядка 0,8 млн. т в год.
Производство
циркониевых концентратов в мире в 2007 г., по оценке Геологической службы США,
увеличилось по сравнению с 2006 г. на 5% - до 1,24 млн. т. Основной прирост
обеспечила Австралия, крупнейший продуцент циркония, благодаря чему ее удельный
вес в мировом показателе возрос на 3 процентных пункта - до 44,5%. Также
несколько увеличился выпуск циркониевых концентратов в ЮАР (на 2%), в остальных
крупных продуцентах (в Китае, на Украине, в Бразилии, Индии), согласно оценкам
Геологической службы США, объёмы производства не изменились.
На 2013 год цена на
цирконовый концентрат кцп - 63 составляет от 76000 до 95000 рублей за тонну.
[4]
2. Переработка цирконовых
концентратов
.1 Обработка щелочными реагентами
В литературных источниках описаны следующие
щелочные методы вскрытия циркона: сплавление с едким натром, обработка
растворами едкого натра при нагревании в автоклавах, спекание с содой, спекание
с известью или известняком в присутствии добавок, снижающих температуру
процесса.
Сплавление цирконового концентрата с трехкратным
теоретическим количеством едкого натра при 500-550°С обеспечивает полное разложение
сырья по реакции 2.1.1.
ZrSiО4
+ 4 NaOH = Na2ZrО3
+ Na2SiO3
+ 2H2О
(2.1.1)
Однако в результате такого сплавления образуется
обычно очень твердая труднодробящаяся масса. Это явление можно устранить, если
измельченный концентрат, смешанный с 50%-ным раствором едкого натра,
предварительно прокалить при 250-300°С, а образовавшийся пористый материал
измельчить, нагреть до 600° С и выдержать при этой температуре в течение часа.
Плав выщелачивают водой в стальных реакторах с мешалками или же в обогреваемых аппаратах
типа шаровых мельниц. Во избежание гидролиза силиката и цирконата натрия при
промывке содержание свободного NaOH
поддерживают около 3-5%; однако небольшая часть цирконата натрия гидролизуется
по уравнению 2.1.2
Na2Zr03
+ 2Н2О = ZrO(OH)2
+ 2 NaOH. (2.1.2)
Образующаяся гидроокись цирконила остается в
осадке вместе с цирконатом натрия, в то время как силикат натрия переходит в
раствор; присутствие гидроокиси цирконила затрудняет фильтрацию.
Осадок, содержащий цирконий, отделяют от
раствора силиката натрия на центрифугах непрерывного действия. Осадок содержит
цирконат натрия, гидроокись цирконила, неотмытый силикат натрия, кремневую
кислоту, титанат натрия, окислы железа, а также некоторые количества
цирконсиликата натрия.
Таким образом, в результате переработки
продуктов щелочного или известкового спекания получаются серно- или
солянокислые растворы, содержащие ион цирконила.
Цирконий из этих растворов можно выделять
следующими методами:
1) осаждением основных сульфатов циркония из
серно- или солянокислых растворов путем гидролиза;
2) выделением оксихлорида цирконила ZrOCl2
• 8Н20 из солянокислых растворов.
Описанным выше методом получают технический
продукт, загрязненный многими примесями. Предложен метод его очистки осаждением
циркония из концентрированного раствора основного сульфата в серной или соляной
кислоте крепкой серной кислотой в виде малорастворимого кристаллогидрата
цирконилсерной кислоты в соответствии с уравнениями 2.1.3 или 2.1.4:
ZrОSО4
+ H2SО4
= H2[ZrО(SО4)2]
(2.1.3)
или
ZrOCl2
+ 2H2SО4
= H2[ZrO(SО4)2]
+ 2HCl (2.1.4.)
Так как цирконилсерная кислота хорошо растворима
в воде, осадок, в зависимости от требуемой степени чистоты, можно
перекристаллизовывать один или несколько раз. Для этого его растворяют в воде
при отношении т:ж=1:1 и из раствора концентрированной серной кислотой, вновь
осаждают кристаллогидрат цирконилсерной кислоты, который затем прокаливают.
Таким образом, можно получить двуокись циркония высокой чистоты, содержащую
менее 0,00001% железа, меди и серебра и менее 0,001% кальция, магния, натрия и
кремния (каждого).
Возможно также выделить цирконий из
солянокислого раствора в виде кристаллогидрата хлорида цирконила. Если исходная
концентрация НС1 в растворе, содержащем 100-120 г/л циркония, составляет
50 г/л, то при выпаривании раствора до концентрации НС1, равной
200-220 г/л, и охлаждении его 95% циркония выделяется в виде
кристаллогидрата ZrОCl2•8H20.
Железо и многие другие примеси остаются в растворе. Дополнительно соль очищают
перекристаллизацией с последующей промывкой кристаллов концентрированной
соляной кислотой. Оксихлорид сушат при 85° С. Для получения двуокиси оксихлорид
растворяют в воде и аммиаком осаждают гидроокись циркония, которую промывают,
сушат и прокаливают.
Таким образом, щелочные методы служат
преимущественно для получения смеси двуокисей циркония и гафния различной
степени чистоты; однако продукты щелочного разложения циркона иногда
используются для разделения циркония и гафния.
2.2 Обработка фторсодержащими
реагентами
Тонкоизмельченный цирконовый концентрат может
быть вскрыт 40%-ной плавиковой кислотой. При выпаривании полученного осадка
досуха кремний удаляется в виде летучего SiF4;
остаток от упаривания растворяют в воде и цирконий осаждают из раствора в виде
гидроокиси.
Имеются сообщения о вскрытии тонкоизмельченного
циркона сплавлением с 4- и 6-кратным по массе количеством KHF2
или NaHF2.
Плав затем измельчают, выщелачивают горячей водой, подкисленной плавиковой
кислотой, а двойной фторид циркония и щелочного металла, выпадающий при
охлаждении раствора, отфильтровывают. Методы не нашли промышленного применения
в связи с высокой стоимостью реагентов.
Н. П. Сажин и Е. А. Пепеляева описывают
проверенный в промышленном масштабе метод вскрытия циркона спеканием с
кремнефторидом калия. Смесь измельченного до -0,074 мм цирконового
концентрата с кремнефторидом калия и хлористым калием спекают во вращающейся
печи при 650-700° С.
Процесс протекает по реакции 2.2.1:
ZrSiO4
+ K2SiF6
→ K2ZrF6
+ 2SiO2 (2.2.1)
Хлористый калий способствует более полному
разложению циркона, которое достигает 97,0-98,0%.
Продукты реакции при 700-900° С взаимодействуют
по уравнению 2.2.2
2ZrF6
+ SiО2
= 2KF +SiF4 + ZrO2 ( 2.2.2)
Для предотвращения этого процесса, влекущего
образование нерастворимой в воде двуокиси циркония, необходим избыток
четырехфтористого кремния в исходной шихте и продуктах реакции. Это достигается
повышением избытка реагента в шихте, спеканием в герметичном аппарате (чтобы
уменьшить потери SiF4
от улетучивания), а также осуществлением процесса при возможно более низкой
температуре без снижения вскрытия циркона. Следует заметить, что окислы
металлов по своей способности к реакции с кремнефтористым калием располагаются
в следующий ряд:
ZrO2
> A12O3
> ТiO2
> Fe2O3.
Продукт спекания, состоящий из гранул размером
0,5-10 мм, измельчают до крупности -0,147 мм и выщелачивают
слабой соляной кислотой при 85° С и отношении т:ж=1 :7 в течение 1,5-2 ч.
Кремневую кислоту отделяют отстаиванием осадка и декантацией раствора при
температуре около 80° С. Затем раствор охлаждают, и основная часть выпадающих
кристаллов фторцирконата калия K2ZrF6
вместе с соответствующей солью гафния выпадает из раствора. Фторцирконат калия
подвергают дробной кристаллизации, для отделения циркония от гафния.[1]
2.3 Обработка минеральными кислотами
и их солями
В обычных условиях обработки циркон лишь в
незначительной степени поддается воздействию минеральных кислот (за исключением
плавиковой). Однако обработкой серной или соляной кислотой можно в некоторой
степени вскрыть циркон, если минерал предварительно нагрет до 300° С и быстро
охлажден водой (декриптация).
Описывается вскрытие циркита (руда из Бразилии,
представляющая смесь бадделеита с цирконом) четырехкратным по массе количеством
серной кислоты в течение 1-2- ч при 400° С. К концу процесса температуру
повышают до 650° С и выдерживают в течение еще 1 ч. Извлечение циркония
в водный раствор колеблется в пределах 60-90% в зависимости от содержания
циркона в исходном материале.
Упоминается о сплавлении тонкоизмельченного
цирконового концентрата с 20-кратным количеством бисульфата калия; полученный
продукт выщелачивают водой. Этот метод был первым промышленным процессом
разложения циркона.
Следует отметить, что обработку циркона серной
кислотой производят в промышленном масштабе и в настоящее время, но для
специфической цели удаления из концентрата железа без существенного разложения
самого циркона. В результате передела получают так называемый «белый циркон».
Состав: ZrO2
58,2 - 60,2; SiО2 32,5
- 34,5;Fe2O3
0,06
-0,13;A12O3
3,2-3,8.[1]
3. Основная часть
.1 Хлорирование цирконового
концентрата
Цирконовый концентрат в смеси с углеродистым
материалом хлорируется с достаточной для практических целей скоростью при
900-1000 °С. Основные реакции процесса:
ZrSiО4
+ 4 С12 + 2 С = ZrCl4
+ SiCl4
+ 2 СО2;
СО2 + С ↔ 2СО.
Теплоты реакции ~125кДж недостаточно для
самопроизвольного протекания процесса, необходим постоянный подвод тепла. При
относительно низкой температуре (700 - 800°С) расход энергии на подогрев шихты
и расход кокса меньше. Но при этой температуре процесс протекает в кинетической
области (энергия активации 270 кДж/моль) и идет во всем объеме брикетов,
которые вследствие этого начинают разрушаться. В результате при хлорировании в
шахтном хлораторе (ШХ) газопроницаемость шихты ухудшается, возникают нарушения
процесса. При высокой температуре увеличивается расход кокса, вследствие
преимущественного образования СО, увеличивается расход энергии на подогрев
шихты. В интервале 850 - 1000°С лимитирующей стадией становится внутренняя
диффузия. Реакция проходит на поверхности брикетов, и они не разрушаются.
Для подвода дополнительного тепла, необходимого для
поддержания нужной температуры, предложены разные способы, но, видимо, введение
в шихту термодобавок является наиболее приемлемым. Такими добавками могут быть
карбиды циркония и кремния, ферросилиций, элементарный кремний. При
использовании электронагрева брикетированной шихты вследствие колебаний
электропроводности слоя брикетов сложнее стабилизировать температуру
реакционной зоны. При содержании в брикетах 25-30% углерода брикеты при
температуре хлорирования обладают достаточной электропроводностью, что
позволяет нагревать шихту с помощью графитовых электродов, вмонтированных в
стенках хлоратора. Для прохождения тока через горячую шихту требуется
напряжение порядка 25В. Выгружаемый из печи остаток неполно прохлорированных
брикетов возвращается на шихтовку.
Система улавливания состоит из пылевых камер для
улавливания ZrCl4
и оросительных конденсаторов (орошение охлажденным до -10 °С TiCl4)
для конденсации SiCl4.
Смесь жидких TiCl4
+ SiCl4
затем разделяют ректификацией. Состав технического тетрахлорида циркония
следующий, %: Zr 33-36; Cl
58-60; Fe 0,2-0,8; Al
1-1,6; Ti 0,05-0,1; Si
≤
0,01. Технический хлорид очищают возгонкой. Тетрахлорид кремния используют для
получения кремния и в производстве кремнийорганических соединений. На рисунке
3.1 представлена принципиальная схема переработки цирконового концентрата
хлорированием.
В промышленности хлорирование цирконового
концентрата может быть осуществлено в ШХ непрерывного действия и в хлораторах с
расплавом хлоридов щелочных металлов. Для хлорирования в ШХ шихта, содержащая
до 20 - 25% углерода (нефтяной или каменноугольный кокс), термодобавки и
связующее, брикетируется и коксуется при 800°С в течение 16 - 20 ч. Температура
в реакционной зоне ШХ поддерживается на уровне 800 - 1000°С, температура ПГС
600 - 700°С, содержание в ней СО до 70%. Извлечение циркония в технический
хлорид - около 85-86%.[3]
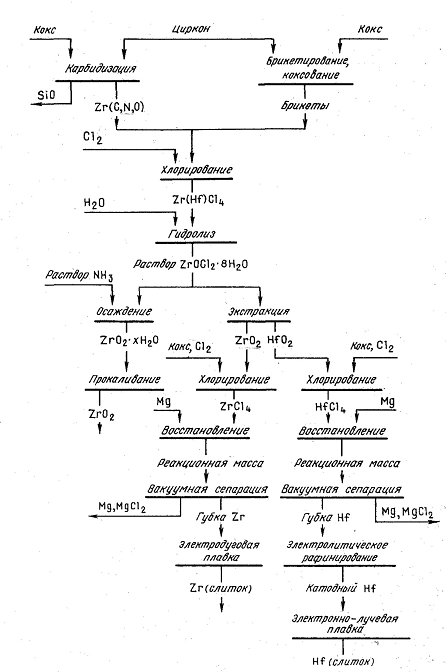
Рисунок 3.1 - Принципиальная схема переработки
цирконового концентрата хлорированием
3.2 Конденсация и очистка
тетрахлорида циркония
Паро-газовая смесь (ПГС), выходящая из
хлоратора, направляется в конденсационную систему (рисунок 3.2). В первом
охлаждаемом воздухом конденсаторе, снабженном скребками, поддерживается
температура 150 - 200°С. В нем конденсируется основная масса ZrCl4
и
HfCl4,
а также FeCl3
и А1С13, после чего ПГС попадает в рукавный фильтр, в котором
улавливаются остатки твердых хлоридов, а также частицы кокса, циркона.
Тетрахлорид кремния улавливается в двух последовательно расположенных
конденсаторах, которые орошаются охлажденным до -10°С TiCl4.
Тетрахлориды разделяют ректификацией, TiCl4
возвращают на орошение конденсаторов. В техническом тетрахлориде циркония,
полученном при хлорировании циркона, содержание примесей, %: до 3 Fe,
0,5 А1, 0,15 Si, 0,05 Ti,
0,5 О и 0,4 нерастворимого остатка. При хлорировании диоксида и карбонитрида
циркония получают более чистые продукты. Для очистки технического тетрахлорида
используется ряд способов.
При малом содержании примесей ограничиваются
переплавкой под давлением (> 2,3 МПа), при которой происходит очистка
главным образом от кислорода. Гидроксохлорид циркония, образующийся при
гидролизе ZrCl4,
при нагревании разлагается на С12 и ZrO2,
который концентрируется в верхних слоях расплава и может быть отделен. Для
очистки тетрахлоридов от железа используют сублимацию в присутствии
восстановителя - водорода или углеводородов (С2Н6, С3Н8,
С2Н2), которые восстанавливают FeCl3
до малолетучего FeCl2.
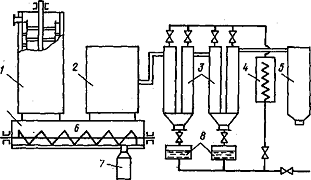
Рисунок 3.2 Схема конденсационной системы для улавливания
тетрахлоридов циркония и кремния
1 - конденсатор, охлаждаемый водой или воздухом
и снабженный скребками; 2 - рукавный фильтр; 3 - оросительные
конденсаторы; 4 - теплообменники для охлаждения TiCl4
(SiCI4);
5 - хвостовой скруббер; 6 - разгрузочный шнек; 7 - приемник ZrCl4;
8 - приемник SiCl4
и TiCl4
Более универсальна и эффективна солевая очистка,
основанная на использовании различия в свойствах комплексных соединений
тетрахлоридов циркония и гафния, хлоридов железа и алюминия с хлоридами щелочных
и щелочноземельных металлов. Давление пара ZrCl4
и HfCl4
над расплавами, содержащими NaCl,
КС1 и гексахло- роцирконаты и -гафнаты, значительно выше давления паров NaFeCl4
и
NaAlCl4,
которые имеют высокие температуры кипения и перегоняются почти без разложения
(таблица 3.2). Трихлориды алюминия и железа, кроме того, вытесняют тетрахлориды
циркония и гафния из состава комплексных хлоридов, благодаря чему повышается
возможность отгонки чистых тетрахлоридов (реакция 3.2)
M2ZrCl6
+ 2А1С13 = ZrCl4
+ 2 МА1С14. (3.2)
На практике применяют два варианта солевой
очистки. Первый способ - периодический и состоит в том, что сначала готовят при
300 °С расплав хлоридов, отгоняют легколетучие компоненты и газы, а затем при
400 - 600°С отгоняют тетрахлориды циркония и гафния.
Таблица 3.2 - Давление пара МС14 и
МС1, над комплексными соединениями
|
Соединение
|
Давление
пара, кПа, при температуре, °С
|
|
500
|
600
|
700
|
|
Na2ZrCl6
|
2,32
|
16,9
|
>60
|
|
Na2HfCl6
|
1,71
|
11,9
|
>50
|
|
K2ZrCl6
|
-
|
0,1
|
1,7
|
|
K2HfCl6
|
-
|
0,03
|
1,2
|
|
NaAlCl4
|
0,07
|
0,88
|
7,0
|
|
NaFeCl4
|
0,075
|
2,85
|
Второй вариант реализуется как непрерывный
двухстадийный процесс (рисунок 3.2.2). Технический тетрахлорид подается из
бункера шнековым питателем в сублиматор, в котором с помощью
электронагревателей поддерживается температура 350 - 450°С. В сублиматоре
отделяется основная масса примесей. Загрязненный расплав периодически
выгружается из сублиматора, а пары ZrCl4
непрерывно поступают в барботер с температурой 500 - 600°С - вторую ступень
очистки. Очищенный ZrCl4
поступает из барботера в конденсатор и рукавный фильтр, а расплав из него может
быть использован на первой ступени очистки. Содержание примесей в тетрахлориде
циркония уменьшается приблизительно на два порядка; для А1, Fe,
Ti и Si
оно не превышает л-10-3%. Пары ZrCl4
и HfCl4,
особенно при высокой температуре, агрессивны, поэтому вся аппаратура должна
выполняться из коррозионностойких материалов (никеля и его сплавов).
1 - бункер
для технического ZrCl4;
2 - шнековый питатель; 3 - сублиматор с мешалками; 4 -
барботер; 5 - конденсатор со скребками, водяной и воздушной рубашками;
6-рукавный фильтр; 7-сборники отработанного расплава; 8 - сборники
очищенного ZrCl4.
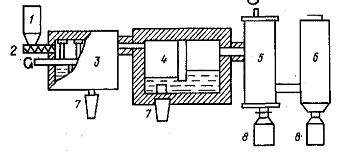
Рисунок 3.2.2 - Схема установки солевой очистки
тетрахлорида циркония непрерывным способом
Получение ZrО2
из тетрахлорида циркония.
Хлорный метод переработки цирконийсодержащих
материалов является одним из основных, a
Zr02 -
один из важнейших видов циркониевой продукции, поэтому, естественно, необходимы
эффективные методы переработки ZrCl4
в ZrО2.
Простейший путь - растворение ZrCl4
в воде, гидролиз, выделение циркония из раствора в виде тех или иных соединений
и прокалка. Таким образом получают и исходные соединения для экстракционного
разделения циркония и гафния. Возможно и "сжигание" тетрахлорида по
реакции, которая протекает с приемлемой скоростью выше 1100°С. [3]
.3 Восстановление тетрахлоридов
циркония и гафния магнием
Термодинамическая возможность реакций (3.3.1),
(3.3.2) определяется тем, что в широком интервале температур изменение энергии
Гиббса для них имеет отрицательный знак (рисунок 3.3.1)
ZrCl4
+2Mg ↔
Zr + 2MgCl2;
(3.3.1)
-∆G0802°C=
200 кДж; -∆H°298
= 332 кДж:
HfCl4+
2Mg Hf
+ 2MgCl2;
(3.3.2)
-∆G0802°C
= 105кДж; -∆H°298
= 232 кДж.
Взаимодействие магния с тетрахлоридом циркония
начинается при 410 - 470°С, а с тетрахлоридом гафния при 460 - 520°С, но ниже
650°С оба тетрахлорида восстанавливаются только до низших хлоридов. В
адиабатических условиях тепла, выделяющегося при восстановлении тетрахлоридов
жидким магнием до металлов, достаточно для поддержания реакции.
Температурный интервал, в котором проводят
процесс восстановления, определяется температурой плавления MgCl2
(714°С). Верхний предел ограничивается температурой начала взаимодействия
циркония с материалом реторты (железом) - 935°С и нарушением расслоения магния
и MgCl2 выше
920°С вследствие увеличения растворимости циркония в магнии и дихлорида
циркония в MgCl2.
Гафниевая губка начинает взаимодействовать с материалом реторты при температуре
выше 1000°С.
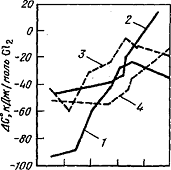
Рисунок 3.3.1 - Зависимость энергии Гиббса
восстановления хлоридов Zr
и Hf от температуры
500 1000 1500 2000 Т,К
- ZrCl4+Mg
= ZrCl2+
MgCl2;
- ZrCi2+Mg
= Zr+MgCl2
;
- HfCI4+Mg=
= HfCl2+
MgCl2;
- Hf'Cl2+Mg
= Hf+MgCl2.
При восстановлении тетрахлорида титана
температура в реакторе и скорость процесса довольно просто регулируются подачей
жидкого TiCl4.
При восстановлении тетрахлоридов циркония и гафния такая возможность
отсутствует при любом способе доставки их в реактор. При полной загрузке
тетрахлоридов сразу на весь процесс, при подаче паров тетрахлорида из
отдельного испарителя и непрерывной подаче твердых тетрахлоридов температуру и
скорость процесса можно регулировать только косвенно. Вследствие
неравномерности поступления тетрахлорида в зону реакции и развития реакций в
газовой фазе в реакционном объеме возникают значительные температурные
градиенты, пульсация и неустойчивость процесса, сопровождающиеся резким
повышением давления.
В промышленности наиболее распространен способ
единовременной загрузки исходных веществ, так как другие способы не дают
каких-либо заметных преимуществ, но значительно усложняют аппаратуру. На
рисунке 3.3.2 представлен аппарат восстановления.
Рисунок 3.3.2 - Схема аппарата для
восстановления ZrCI4
магнием
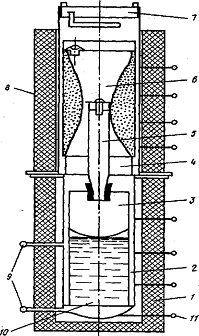
- печь реакционной зоны;
- реторта;
- реакционный стакан;
- переходная вставка;
- патрубок для вывода паров ZrCl4 в
реакционный стакан;
- стакан с очищенным ZrCl4;
- крышка со штуцером для вакуумирования и
напуска аргона; 8 - печь испарителя ZrCl4;
- штуцеры для слива MgCl,;
-реакционная масса;
- термопара
В реакционный стакан из хромистой стали
загружают металлический магний. Над реакционной зоной реторты монтируют стакан
с очищенным тетрахдоридом циркония. После загрузки магния и тетрахлорида
циркония аппарат проверяют на герметичность, вакуумируют и заполняют аргоном.
Затем нижнюю часть реторты нагревают до 750 - 780°С для расплавления магния,
после чего нагревают зону испарения. Во время процесса температуру стенок в
нижней части реторты поддерживают при 720 - 920°С, в верхней части 300 - 360°С,
давление в реторте 0,11 - 0,18 МПа (1,1 - 1,8 атм). На один цикл,
продолжающийся 48 ч, загружают исходные вещества, необходимые для получения 700
- 800 кг циркониевой губки. Коэффициент использования магния 68 - 72% при
получении циркония и 55 - 60% при получении гафния, коэффициент использования
тетрахлорида циркония 94 - 95%. Реакционная масса содержит, %: Zr
58, Mg 32, MgCl210,
в случае гафния: Hf
74, Mg 20 и MgCl2
6. Губка состоит из относительно слабоспеченных частиц металла.
Для восстановления тетрахлоридов можно
использовать натрий, восстановление натрием идет более энергично, с большим
выделением тепла. Для натриетермического восстановления предложены аппараты
непрерывного действия, в которых получают порошок циркония (реакция 3.3.3).
ZrCl4
+4Na ↔
Zr + 4NaCl
(3.3.3)
∆G0927°C
= 482 кДж; -∆H°927°C
= 1032 кДж.
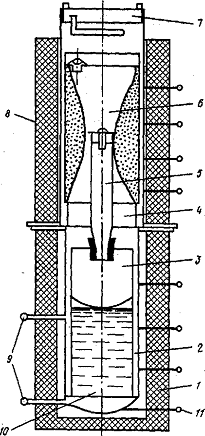
Рнс.11.24. Схема аппарата для восстановления ZrCI4
магнием:
- печь реакционной зоны; 2 -
реторта; 3 - реакционный стакан; 4 - переходная
вставка; 5 - патрубок для вывода паров ZrCl4
в реакционный стакан; 6 - стакан с очищенным ZrCl4;
7 - крышка со штуцером для вакууми- рования и напуска аргона; 8 -
печь испарителя ZrCl4;
9- штуцеры для слива MgCl,;
10 -реакционная масса; 11 - термопара
Следующая стадия процесса - отделение хлорида
магния и избытка магния от полученных металлов. Гидрометаллургическая обработка
разбавленной соляной кислотой непригодна для получения высококачественного
металла вследствие окисления циркония и гафния. Содержание кислорода может
доходить до 0,2 %, кроме того, получаемые при гидрометаллургической обработке
порошки металлов пирофорны.
В промышленности для разделения продуктов
восстановления применяют вакуумную сепарацию, которую проводят при нагревании
реакционной массы до 1000°С и давлении 1,3-10 -2 - 1,3-10-4 Па.
Вакуумная сепарация может быть осуществлена в двух вариантах: с нижним и с
верхним конденсатором. В установке с нижним конденсатором сначала при 720 -
750°С и давлении n*100 Па
выплавляют часть магния и MgCl2
и только после этого выходят на указанный выше режим. Печь, которая используется
для нагревания реторты, должна быть герметичной. В ней создается контрвакуум,
чтобы перепад давлений внутри и снаружи реторты не превышал 6-8 кПа (рисунок
3.3.3). Процесс длится 50-60 ч. Охлаждают реторту 12- 13 ч, в нее подают аргон,
а в печь - воздух, не допуская больших перепадов давлений между ретортой и
печью.
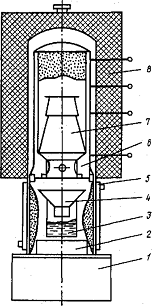
Рисунок 3.3.3 - Установка вакуумной
сепарации реакционной массы восстановления ZrCl4
магнием с нижним конденсатором
- фундамент; 2 - конденсатор; 3 - стакан; 4 -
воронка для слива MgCl,
(Mg);
- водяная рубашка для охлаждения конденсатора; 6
- реторта;
- вставка для крепления реторты;
- колпачковая печь
В ходе сепарации структура губки изменяется за
счет спекания частиц металла и рекристаллизации, тем не менее в ней остаются
тонкодисперсные частицы, обладающие пирофорностью. В гафниевой губке больше
мелких частиц, поэтому она пирофорнее циркониевой. Перед выгрузкой из аппарата
губку пассивируют: после ее охлаждения до 35 - 40°С аппарат вакуумируют и
заполняют влажным воздухом. Активные участки губки окисляются, и пирофорность
ее уменьшается. Гафниевую губку вакуумированием и подачей воздуха обрабатывают
четыре раза.
Блок циркониевой губки относительно слабо связан
со стенками реакционного стакана и извлекается из него легче, чем титановая
губка. Поверхностные слои губки имеют повышенное содержание примесей железа,
никеля и хрома - их удаляют. Для извлечения блока из стакана и его очистки
применяют бронзовый инструмент. Очищенный блок дробят на различного вида дробилках
до -70 мм и направляют на переплавку. Некондиционная губка рафинируется.
Извлечение циркония (гафния) из тетрахлорида в кондиционную губку составляет 70
- 75%. [3]
3.4 Разделение циркония и гафния
Для применения в атомной
энергетике необходим цирконий, содержащий менее 0,01% гафния. Между тем
минералы циркония всегда содержат гафний. Его содержание в цирконе составляет
0,5-2,5% (по отношению к цирконию). Представляет интерес также попутное
получение чистого гафния. Среди разработанных методов разделения циркония и
гафния промышленное значение имеют:
) фракционная кристаллизация
комплексных фторидов;
) жидкостная экстракция;
) ректификация хлоридов;
) избирательное восстановление
хлоридов (субхлоридный способ).
Возможно разделение гафния и
циркония ионообменными способами, но в настоящее время их не применяют в
промышленности из-за малой производительности по сравнению с экстракционными
методами.[2]
Заключение
В курсовой работе рассмотрены общие сведения о
цирконии, способах переработки циркониевых концентратов, в частности, способ
переработки цирконового концентрата способом хлорирования. В расчетной части
было рассчитан материальный баланс процесса хлорирования цирконового
концентрата производительностью 1400 т в год.
Список использованных источников
1. Веллер Р.Л., Ольхов Н.П.,
Румянцев М.В. Основы металлургии. Редкие металлы: Изд-во «Металлургия».,
1967.643 с.
2. Зеликман А. Н., Коршунов Б.Г.
Металлургия тугоплавких редких металлов: Изд-во «Металлургия».,1991.431 с.
. Коровин
С.С., Дробот Д.В., Федоров П.И. Редкие и рассеянные элементы. Химия и
технология : МИСИС, 1999. 461 с.
. «Наука и техника»: Электронная
библиотека.