Сорбция хрома (III) из сульфатных растворов
Реферат
Данная дипломная работа содержит: Табл. __, __ c., илл. __, приложений 6,
библ. 35 наименований.
Ключевые слова: хром, сорбция, десорбция, ионит, кинетика,
динамика, равновесие.
Изучена сорбция хрома (III) из 0,5 М раствора
сульфата натрия на сульфокатионите С150, карбоксильном катионите С107,
фосфорнокислотном катионине D5041, анионите с полиэтиленполиаминными группами S985 и
иминодикарбоксильном ионите S930/4757. Показано, что ион хрома (III) начинает сорбироваться
на ионитах с различными функциональными группами при рН~ 1,5 - 2,0. При этом из
опробованных ионитов наиболее высокую емкость имеет иминодикарбоксильной ионит S930/4757, вслед за ним
следуют анионит с полиэтиленполиаминными функциональными группами S985, карбоксильный
катионит С107 и затем фосфорнокислотный катионит D5041. Вопреки
литературным данным, на сульфокатионите С150 ион хрома (III) не сорбируются. В
результате изучения кинетики сорбции хрома (III) на ионите S930/4757 установлено, что
скорость этого процесса может лимитироваться одновременно внутренней диффузией
и скоростью химической реакции. Дана оценка энергии активации процесса сорбции
хрома (III) (44,3 ± 5,9 кДж/моль). Установлено, что скорость лимитирующей
стадий десорбции хрома (III) из ионита S930/4757 раствором
1моль/л H2SO4 является скорость химической реакции. Энергия активации процесса
десорбции хрома (III) составила 65,9 ± 4,7кДж/моль. При изучении сорбции хрома (III) на иминодикарбоксильном
ионите S930/4757
в динамических условиях показано, что повышение температуры позволяет повысить
как емкость до проскока, так и полную динамическую емкость ионита по хрому (III). Еще в большей степени
повышение температуры облегчает проведение десорбции хрома (III) и способствует
повышению полноты десорбции.
Содержание
Введение
1. Аналитический обзор
1.1 Сырьевые источники
1.2 Хром и его свойства
1.3 Отделение хрома от сопутствующих элементов
1.3.1 Методы очистки сточных вод от соединений хрома
1.4 Ионообменная хроматография
2. Цели и задачи
3. Экспериментальная часть
3.1 Методика проведения экспериментов
3.1.1 Материалы и их подготовка
3.1.2 Условия проведения экспериментов
3.1.3 Метод анализа
4. Результаты и обсуждения
4.1 Изучение сорбции хрома (III) в статических условиях
4.2 Изучение кинетики сорбции хрома (III)
4.2.1 Изучение влияние температуры на кинетику сорбции хрома (III)
на иминодикарбоксильном ионите S930/4757
4.3 Изучение кинетики десорбции хрома (III)
4.4 Изучение сорбции и десорбции хрома (III) в динамических
условиях
4.4.1 Изучение сорбции хрома (III) в динамических условиях на
иминодикарбоксильном ионите S930/4757
4.4.2 Изучение десорбции хрома (III) в динамических условиях
Заключения и выводы
Список использованных источников
Приложения
Введение
Металлический хром благодаря высокой температуре плавления и
стойкости к воздействию окислителей и агрессивных сред широко применяют в
качестве легирующих добавок к металлам. Многие хромовые стали отличаются
высокой твердостью, прочностью и пластичностью; их употребляют для изготовления
инструментов и различных частей машин. Большое количество хрома используют для
хромирования; специфические свойства силицидов хрома используют при раскислении
сталей. Соединения хрома применяют в лакокрасочной, химической,
нефтеперерабатывающей, парфюмерной, фармацевтической и других отраслях промышленности.
Старейшим потребителем соединений хрома является текстильная промышленность.
Большие количества бихромата натрия и хромовых квасцов расходуются в кожевенной
и меховой промышленности. Окись хрома используют при изготовлении масляных и
акварельных красок, а также как катализатор реакций получения NH3 и органических веществ.
Примесь Cr (III) в рубиновых лазерах позволяет получить очень интенсивный
монохроматический и когерентный пучок света, применяемый в технике связи и в
качестве источника энергии для самых разных целей.
В процессах хромирования и дубления образуются большие объемы
стоков, содержащих соединения хрома. Между тем, соединения хрома относятся к
числу наиболее токсичных загрязнений. Традиционный способ очистки сбросных
растворов от хрома, основанный на осаждении малорастворимого гидроксида хрома (III), не всегда обеспечивает
требуемую степень очистки. Существует проблема очистки от хрома в технологии
некоторых химических реактивов. При попытке применение для глубокой очистки
растворов от хрома (III) ионообменных методов, в том числе, основанных на применении
комплексообразующих ионитов, возникают затруднения, связанные с тем, что хром (III) присутствует в
растворах в виде чрезвычайно инертных соединений. Имеются данные, что сорбция
хрома (III) на аминокарбоксильных и иминодикарбоксильных ионитах и десорбия
его из этих ионитов при комнатной температуре протекают с крайне низкой
скоростью, и что повышение температуры позволяет заметно увеличить скорость
этих процессов. Однако детально кинетика сорбции и десорбции хрома (III) на комплексообразующих
ионитах до сих пор не была изучена.
Целью данной дипломной работы явилось изучение равновесия
сорбции хрома (III) на ионитах с различными функциональными группами, равновесии,
кинетики и динамики сорбции и десорбции хрома (III) при различной
температуре на ионите с иминодикарбоксильными группами.
1.
Аналитический обзор
1.1 Сырьевые
источники
Впервые хром был выделен из минерала крокоита (хромата
свинца) в 1797 г.Л.Н. Вокеленом [1]. Хромовые руды используются для
производства соединений хрома с начала XIX столетия. К этому же времени
относятся работы русского ученого Т.Е. Ловица по химии хрома; оп получил почти
исчерпывающие сведения об аналитических реакциях обнаружения хрома.
По распространенности в земной коре хром занимает 21-е место.
Среднее содержание хрома в земной коре составляет 0,0083 вес. % [2].
Космическая распространенность хрома равна 1,27 - 104 атомов на 106
атомов кремния; распространенность его в атмосфере Солнца соответствует lg NCr = 5 69 ± 0,10 (при lg NH = 12,0).
В табл.1 приведены данные по распространенности хрома в
различных природных объектах. В земной коре хром встречается во многих рудных
месторождениях; в силикатных породах его находят в виде акцессорных минералов:
хромита, уваровита (хромовый гранат), фуксита (хромовая слюда), тавмавита
(хромовый эпидот) и др. [3]. Основные земные минералы хрома: хромошпинелиды (Mg, Fe) (Сr, Al, Fe) 2O4, стихтит Mg6Cr3 [OH] 16· [СO3] ·4Н2O, крокоит РbСrO4, феникохроит Рb3 [СrO4] 2O, вокеленит Pb2Cu [CrO4] [РO4], уваровит Ca3Cr2 [SiO4] 3. В
метеоритах и лунных породах хром встречается в основном в виде хромита и
хромшпинелидов. Описано около 40 минералов хрома, в том числе минералы, которые
встречаются только в метеоритах (дабреилит FeCr2S4, брезинаит Cr3S4).
сорбция хром сульфатный раствор
Таблица 1 - Распространенности хрома в различных природных
объектах

* Концентрация в г/л.
Хром относится к литофильным элементам, хотя при наличии серы и
недостатке кислорода он проявляет халькофильные свойства.
1.2 Хром и
его свойства
В периодической системе элементов Д.И. Менделеева хром
располагается в группе VI четвертого периода. Электронная структура его
атомов - ls22s22p6 3s23p63d54s1. Хром относится к главной d-группе переходных
элементов, у которых d-орбитали заполнены лишь частично. Это обусловливает
способность хрома образовывать парамагнитные соединения, его переменную
валентность и окраску многих соединений. Ион Cr (III) имеет конфигурацию d3 в октаэдрическом поле,
вследствие этого орбитальная составляющая его магнитного момента противоположна
по знаку спиновой составляющей.
Хром имеет следующие состояния окисления: 2-, 1-, 0, 1+, 2+,
3+, 4+, 5+, 6+. Наиболее устойчивы соединения Cr (III). Нормальный стандартный
электродный потенциал реакции Cr3+ + 3е = Cr0 равен 0,71 в. Соединения
Cr (VI) - сильные окислители, а
соединения Cr (II) - сильные восстановители. Значения ионных радиусов Cr (VI), Cr (III) и Cr (II) равны соответственно
0,35, 0,64 и 0,83 А.
Характерной особенностью хрома как переходного элемента d-группы является
способность к образованию многочисленных комплексных соединений с различными
структурой, валентностью и типами связей [4]. Образование комплексных
соединений с нейтральными молекулами приводит к стабилизации низших состояний
окисления d-элементов.
Вследствие этого существуют соединения хрома в состоянии окисления 0 (система d6).
Соединения хрома (III) (система d3) весьма стабильны.
Катион Cr (III) в водных растворах существует в виде кинетически инертного
аквокомплекса [Cr (Н2O) 6] 3+. Химия Cr (III) в водных растворах определяется
очень малой скоростью обмена молекул воды в этом комплексе на другие
лиганды. По данным [5], период полуобмена для него измеряется днями, в то время
как в большинстве аналогичных комплексов других металлов время замещения
молекул воды много меньше 1 мсек. По данным, приведенным в [5], период
полуобмена в 1 М растворе сульфата хрома превышает 32 ч [6].
Большой устойчивостью обладают также аквокомплексы Cr (III) и в кристаллическом
состоянии; об этом свидетельствуют фиолетовые твердые соединения типа [Cr (Н2O) 6] Вr3, [Сr (Н2O) 4Вr2] Вr·2Н2O, а также ряд квасцов
состава MICr (SO4) 2 · 12Н2O [5].
Благодаря малой скорости процесса замещения молекул воды в
аквокомплексе Cr (III) на другие лиганды обычно образуются разноокрашенные изомеры -
фиолетовые и зеленые [5]. Эти окраски характерны для большинства соединений Cr (III) как в кристаллических
солях, так и в их растворах. Ионы Сr (III) образуют много разнообразных химически
инертных комплексных соединений с координационным числом 6 и октаэдрической
конфигурацией [5]. К ним относятся комплексы с нейтральными группами (Н2O, NH3, SO2, NO, NO2, CO, S, PH3, N2H4, NH2OH, C2H5OH, C6H6 и др.) и с анионами (F-, CI-, Br-, J-, CN-, SCN-, OH-, NO2-, NO3-, SO32-, SO42-, СО32-,
С2О42 - и др.).
Способность лигандов к образованию комплексов уменьшается в
ряду [9]:
ОН - > С2O42
- > SO32 - > CH3COO - >
HCOO - > SO42 - > CI
- > NO3-.
Подробнее всего изучены аминные комплексы Сr (III) [7]; к ним относятся комплексы типа [CrAm6]
3+ и смешанные комплексы типов [CrAm6-n
(H2O) n] 3+ (n=1, 2, 3, 4,6), [Сr Am6-n Rn]
(3-n) + (n = 1, 2, 3, 4,6) и [СrАm6-n-m (H2O) n Rm]
(3-m) +; Am означает либо монодентатный лиганд типа NH3,
либо половину бидентатного амина, например этилендиамина; R - анион кислоты (галогенид-, нитрат-, сульфат-ионы). Среди указанных
соединений можно найти изомеры всех типов, возможных в октаэдрических
комплексах. Комплексы Cr (III) легко образуют полиядерные формы, содержащие
гидроксильные, кислородные, аминные и роданидные мостики.
Гидриды. Максимальное содержание водорода в
металлическом хроме соответствует формуле гидрида СrН1,7 [8]. При
электролизе раствора хромовой кислоты образуется гидрид состава СrН - кристаллы с
гексагональной решеткой и плотностью 6, 198 г/см3.
Окислы и гидроокиси. Закись хрома СrО получают при окислении
воздухом или HNO3 амальгамы хрома или термическим разложением в вакууме Сr (СО) 6.
Существует две разновидности закиси хрома: мелкие гексагональные кристаллы
красного цвета и пирофорный черный порошок. Закись хрома СrО интенсивно окисляется
до Сr2O3 на воздухе выше 100°С; восстанавливается водородом при 1000°С до
металлического хрома; нерастворима в воде и разбавленных (HNO3 и H2SO4; реагирует с НСl с выделением водорода.
Гидрат закиси хрома Сr (ОН) 2 осаждается щелочами из растворов солей Сr (II) в отсутствие кислорода
воздуха в виде коричневого осадка, нерастворимого в воде и разбавленных
кислотах; медленно растворяется в концентрированных кислотах. Произведение
растворимости равно 2,0·10-20 при 18°С. Гидрат закиси хрома легко
восстанавливается до металла.
Окись хрома Сr2O3 - соединение зеленого цвета с твердостью корунда
(т. пл. 2435°С, т. кип. 3000°С). Окись хрома получают при горении металла в
кислороде, термическом разложении СrO3, бихроматов аммония и ртути, а также другими
способами. Сr2O3 нерастворима в воде, этаноле, ацетоне; тонкодисперсный порошок
слегка растворим во всех кислотах и щелочах. В 70% -ном растворе НСIO4 окись хрома окисляется
до СrO3. При повышенной температуре окись хрома восстанавливается до
металлического хрома водородом, окисью углерода, кремнием, алюминием, кальцием,
магнием, щелочными металлами. Сr2O3 легко окисляется до СrO3 расплавленными нитратом,
хлоратом и перманганатом калия, а также воздухом в присутствии сильных
оснований [9]. При взаимодействии Сr2O3 и окислов металлов образуются хромиты типа MIIСr2O4 (где MII = Сu, Рb, Be, Mg, Са, Ва, Zn, Cd, Mn, Fe, Со, Ni). Они имеют, как
правило, структуру шпинели, в которой ионы Сг3+ занимают
октаэдрические пустоты. Получены хромиты других составов. При растворении Сr2O3 в концентрированных
щелочах, вероятно, образуются комплексы [Сr (ОН) 6] 3
- и [Сr
(ОН) 5 (Н2O)] 2-, из таких растворов выделяются
кристаллические соли состава MnICr (OH) 3+n (n = 3 ÷ 5). Химический состав гидратов окиси Сr (III) выражается двумя
формулами: СrООН
и Сr (ОН) 3.
Найдено три модификации СrООН: ромбоэдрическая α-модификация
серо-фиолетового цвета, образующаяся при смешивании растворов СrO3 и Cr (NO3) 3 в
атмосфере водорода, ромбическая γ-СrООН и зеленая
орторомбическая модификация, соединение зеленого цвета. α-CrOOH является единственным соединением типа МООН с короткой и
симметричной водородной связью. Гидроокиси Сr (III) растворимы в кислотах и
щелочах, но плохо растворимы в аммиаке.
Двуокись хрома получают нагреванием Сr2O3 в атмосфере кислорода
при 320-400°С; термическим разложением хромата или бихромата аммония при
200-250°С; восстановлением хромата гидросульфитом натрия или этанолом; окислением
солей Сr
(III) гипохлоритом натрия.
Существуют две модификации СrO2: черный парамагнитный гигроскопичный порошок и
черные ферромагнитные кристаллы тетрагональной сингонии [9]. Двуокись хрома
нерастворима в холодной воде, но хорошо растворима в HNO3; разлагается при
нагревании выше 300°С с выделением кислорода.
Трехокись хрома СrO3 (хромовый ангидрид) - красные с фиолетовым
оттенком кристаллы, очень гигроскопичны и расплываются на воздухе. Получают
действием конц. H2SO4 на бихромат натрия и при окислении Сr2O3 кислородом при давлении
12 атм. и 460°С в присутствии катализаторов (окислов серебра, магния и
др.) или озоном, а также окислением солей Сr (III) перманганатом калия или
РbO2 [9]. Трехокись хрома -
сильный окислитель; легко окисляет S, Р, As, H2S, NH3, SO2; вызывает загорание некоторых органических
соединений (спирта, бумаги); не реагирует с HNO3. При 200-550°С СrO3 разлагается с выделением
кислорода.
Трехокись хрома хорошо растворима в воде с образованием
хромовых кислот общей формулы Н2O·xCrO3 = Н2СrхO3х+1 (х = 1÷4), которые существуют только в водных растворах. Монохромовая
(хромовая) кислота Н2СrO4 относительно слабая (К2 = 3·10-2),
двухромовая Н2Сr2O7 (К2 = 2·10-2),
трихромовая Н2Сr3О10 и тетрахромовая Н2Сr4O13 - более сильные кислоты
[9]. Большинство металлов растворяется в растворах хромовой кислоты, a Fe и Аl пассивируются за счет
образования окисной пленки. Гидроокиси металлов и хромовая кислота
взаимодействуют с образованием хроматов. Монохроматы щелочных металлов, аммония
и магния хорошо растворимы в воде, хромат кальция - значительно хуже, а хроматы
бария, свинца и ряда других металлов трудно растворимы. Растворимость
бихроматов, как правило, выше растворимости монохроматов [9]. Класс хроматов
очень разнообразен; существует также множество двойных хроматов. Сведения о
составе, структуре, растворимости и других свойствах хроматов приведены [9].
Известны и другие окислы хрома, например Сr2O5, Сr3O8. Последний является
двойным соединением СrO3·Сr2О5. Окисел Сr2O5 обладает
антиферромагнитными свойствами и электрическим сопротивлением.
Перекисные соединения. При действии на
растворы хроматов перекиси водорода в зависимости от условий опыта образуются
пероксохроматы или аддукты перекиси хрома СrO5. Известно два ряда
пероксохроматов: фиолетовые пероксохроматы состава М2I [СrО6] и
красно-коричневые пероксохроматы состава M3I [CrO8] - соли надхромовой
кислоты Н3СrO8. Последние соединения парамагнитны и имеют один
неспаренный электрон. Соль К3СrO8 довольно устойчива и
разлагается (со взрывом) лишь при температуре выше 170°С. Красные
цероксохроматы разлагаются кислотами с выделением кислорода и образованием
окрашенных в синий цвет соединений. Перекись хрома СrO5 образуется в кислой
среде по уравнению
H2CrO4 + 2Н2O2 = CrО5 + 3Н2O
В свободном состоянии СrO5 не существует; она
устойчива в диэтиловом эфире (темно-голубой раствор). Реакцией ее образования
пользуются для открытия хрома. При добавлении пиридина к эфирному раствору
выделяется диамагнитное соединение СrO5, мономерное в бензоле.
Четырехокись хрома существует только в виде двойных
соединений с аммиаком, цианидами щелочных металлов и некоторыми органическими
соединениями.
Сульфиды. Известны сульфиды CrS, Cr7S8, Cr5S6, Cr3S4, Cr2S3, Cr5S8 и полисульфид Cr2S5. Получают сульфиды при
24-часовом нагревании в электрической печи при 1000° С смесей соответствующих
эквивалентных количеств электролитического хрома и очищенной серы в запаянных
кварцевых ампулах. Низшие сульфиды хрома CrS, Cr7S8, Cr5S6 и Cr3S4 можно получить также при
разложении полуторного сульфида хрома Cr2S3 в токе водорода или методом
химических транспортных реакций с использованием АlСl3 в качестве
транспортирующего агента. CrS устойчив только при высоких температурах, при
охлаждении диспропорционирует на высший сульфид и хром. Cr2S3 получают при действии
сероводорода на чистый хром и различные соединения Сr (III). Cr2S3 устойчив при кипячении в
воде и в растворах щелочей, нерастворим в НСl, Н3РO4, Н2С2O4, но полностью
разлагается HNO3 и конц. H2SO4·Cr3S4 - серо-черный порошок, разлагающийся при 1350°С
на CrS и серу. Получают при
взаимодействии металлического хрома и серы в вакууме при 500°С с последующим
сплавлением продукта при 1700°С. Это труднорастворимое соединение, медленно
разлагаемое водой. Растворимость в кислотах растет в ряду H2SO4 < НСl < HNO3 [10]. Полисульфид хрома
(III) - Cr2S5 - получают при
10-дневном нагревании Cr2S3 с серой при 250°С. Все сульфиды хрома
парамагнетики [9]. Известны двойные сульфиды составов M2I Cr2S4, и M2II Cr2S4.
Сульфиты. Средний сульфит хрома (III) неизвестен. Обработка
растворов хромовых квасцов избытком NaHSO3 дает гидраты гидросульфита Cr (HSO3) 3·nH2O.
Сульфаты. Сульфат хрома (II) известен только в форме
гидратов. Моногидрат CrSO4·H2O образуется при действии конц. H2SO4 на ацетат хрома (II) в
отсутствие кислорода воздуха. Это белый порошок, более устойчивый, чем
гептагидрат CrSO4·7H2O, который получают в отсутствие кислорода воздуха растворением
ацетата хрома (II) в разб. H2SO4, обработкой металлического хрома или его
амальгамы раствором H2SO4 или электролитическим восстановлением Cr2 (SO4) 3 на Pt-катоде. Эта соль
нерастворима в этаноле. Растворы бесцветного моногидрата CrSO4·H2O и синего CrSO4·7H2O быстро окисляются на
воздухе. Раствор CrSO4 в разб. H2SO4 является превосходным поглотителем кислорода.
Известны двойные сульфаты составов M2I SO4·CrSO4·6H2O и MIICr (SO4) 2·xH2O [9].
Безводный Cr2 (SO4) 3 получают нагреванием
кристаллогидратов при ~ 400°С на воздухе или при 280°С в токе СO2; при обычных условиях
нерастворим в воде и кислотах, однако при наличии даже следов СrСl2 или сильного
восстановителя энергично растворяется в воде. Из раствора выделяется в виде
фиолетового кристаллогидрата состава [Cr2 (H2O) 12] (SO4) 3·xH2O (х = 2 ÷ 6). Известны также зеленые кристаллогидраты [Cr2 (H2O) 10SO4] (SO4) 2·xH2O, [Cr2 (H2O) 8 (SO4) 2] SO4·H2O и [Cr2 (H2O) 6 (SO4) 3] ·xH20. Фиолетовая соль при
растворении в воде гидролизуется с образованием [Сr (ОН) (Н2O) 62+
(в концентрированных растворах) и [Сг (ОН) 2 (Н2O) 4] +
(в разбавленных растворах). Зеленая соль в водных растворах образует основную
соль [Cr (H2O) 3 (OH) SO4] [13] и комплексы [Cr (H2O) 4SO4] +, [Cr (H2O) 2 (SO4) 2] - , [Cr (SO4) 3] 3-.
Безводный сульфат хрома (III) нерастворим в холодной воде и кислотах, плохо
растворим в этаноле [7].
Нагреванием сульфата хрома с соответствующим количеством H2SO4 можно получить кислоты H2 [Cr2 (H2O) 4 (SO4) 4], H4 [Cr2 (H2O) 2 (SO4) 6] и H6 [Cr2 (SO4) 6]. В этих
соединениях СrO4 может замещать часть или все группы SO42-. Они дают
соответствующие двойные соли [9].
Известны многочисленные двойные сульфаты хрома и
одновалентных катионов (Na+, К+, Rb+, Cs+, NH4+, Тl+), среди них квасцы MI [Cr (H2O) 6 [ (SO4) 2·6H2O. Калиевые квасцы KCr (SO4) 2·12Н2O получают насыщением
подкисленного раствора К2Сг2O7 сернистым газом. Известны
смешанные хромоалюминиевые и хроможелезистые квасцы, в которых атом хрома
замещен на атомы соответствующих элементов; NH4-группa может быть замещена на
другие группы (гидроксиламин, метиламин, гидразин, гуанидин). Калиевые и
аммониевые квасцы образуют ряд непрерывных растворов [7].
Получены двойные сульфаты, производные хромисерных кислот,
например K2H2Cr2 (SO4) 5, и соли типа M3I Cr (SO4) 3 (где = Li, Na, К, NH4). Это зеленые трудно
растворимые в воде соединения. Известны также различные зеленые хлорсульфаты, например
[CrCI (H2O) 5] SO4·3H2O, [CrSO4 (H2O) 5] CI, и бромсульфаты [Cr (H2O) 6Br] SO4; последнее соединение
образует ряд непрерывных растворов с соответствующими солями Al (III), Fe (III), V (III) [7].
Галогениды. Фторид CrF2 - синевато-зеленые
кристаллы, слабо растворимые в воде; на воздухе окисляются до Сг2O3. Получают CrF2 пропусканием газ. HF над порошком
металлического хрома при температуре красного каления. Известны двойные фториды
с катионами NH4+ и К+ состава MICrF3 [7].
Фторид хрома (III) существует в безводной и гидратированных
формах. Безводный CrF3 получают прокаливанием СrСI3 в токе HF. Зеленоватые иглы CrF3 нерастворимы в воде,
спирте, аммиаке, плохо растворимы в кислотах. При температуре - 210°С CrF3 становится
ферромагнитным. Гидратированную форму [Cr (H2O) 6] F3·3H2O получают добавлением NH4F к холодному раствору
сульфата хрома (III). Это соединение нерастворимо в этаноле, слегка растворимо в
воде. С НСI
дает фиолетовый раствор, с КОН - зеленый. Фиолетовый нитрат хрома (III), обработанный KF с минимальным
количеством воды, дает фиолетовый [Cr (H2O) 6] F3; последний при
нагревании при 60 - 70°С образует [Cr (H2O) 6] CrF3, зеленую нерастворимую в
воде соль. При вливании фиолетового фторидного раствора в горячий этанол
образуется зеленый кристаллический порошок [CrF3 (H2O) 3] 2·H2O, растворимый в воде.
Известны разнообразные двойные фториды хрома (III) зеленого цвета, имеющие
состав MICrF4, M2I [CrF5 (H2O)], M3ICrF6 [13]. CrF4 - коричневое,
разъедающее стекло аморфное соединение - получают нагреванием до 300-350°С
порошка хрома в медленном токе газообразного фтора; гидролизуется водой.
Известны двойные соли со щелочными металлами. При нагревании порошка хрома с
фтором до 400°С в Ni-бомбе под давлением 200 атм образуются значительные
количества огненно-красного CrF8 и малые количества лимонно-желтого CrF6. Последний легко
разлагается на CrF5 и F2 при высоком вакууме и низких температурах (около - 100°С).
Диоксифторид хрома (фтористый хромил) CrO2F2 образуется в виде
красно-коричневых паров при нагревании смеси К2Сг2O7, CaF2 и дымящей H2SO4. Он действует на стекло
и реагирует с хроматами с образованием NH4CrO3F, KCrO3F, (NH4) 2Cr3O9F2 и др.
Хлорид СгС12 - бесцветное кристаллическое
гигроскопичное соединение, растворимое в воде; образует ряд кристаллогидратов с
1-4 молекулами Н2O. Получают СrСI2 пропусканием газ. НСI над порошкообразным хромом при температуре
красного каления или восстановлением солей Cr (III) водородом. Известны
продукты присоединения аммиака состава CrCI2·xNH3 (x = 1 ÷ 6).
Хлорид хрома (III) получают многими способами [7]. Безводный СrСI3 - красно-фиолетовые
кристаллы, плохо растворимые в воде, однако в присутствии следов
восстановителей его растворимость увеличивается. Нерастворим в абсолютном
этаноле и метаноле, ацетальдегиде, ацетоне, диэтиловом эфире. Существует
большое число кристаллогидратов; в концентрированных растворах стабильной
формой является темно-зеленый гексагидрат: его растворимость в воде
увеличивается от 40 % при 0°С до 60 % при 30°С. Разбавленные растворы хлорида хрома
(III) имеют фиолетовую
окраску, более концентрированные или кислые растворы окрашены в зеленый цвет.
Цвет растворов обусловлен равновесием между разными соединениями, зависящим от
концентрации хрома [5].
Бромид СrВr3 - черное кристаллическое соединение, которое получают действием
брома на нагретый хром или смесь с Сr2O3. Растворим в горячей воде. СrВr3·6Н2O существует в двух
изомерных модификациях: серо-голубой ("фиолетовой") - [Сr (Н2O) 6] Вr3 и зелепой - [СrВr2 (Н2O) 4] Вr·2Н2O. Эти соли растворимы в воде
и этаноле, но нерастворимы в диэтиловом эфире.
Иодид CrI2, соединение бледно-серого цвета, получают
нагреванием СrI3 до 300-350°С в токе водорода или при синтезе из Сr и J2 при 800°С; растворим в
воде. Черный CrI3 получают нагреванием иода с хромом при 500°С в вакуумированной
трубке. Трудно растворяется в воде [5].
Нитриды. Известно два нитрида хрома Cr2N и CrN. Последний получают
пропусканием тока азота над нагретым при 600 - 900°С тонким порошком
пирофорного хрома. Получают нитриды и возгонкой амальгамы хрома в атмосфере
азота. При обработке борида хрома аммиаком при 735°С образуется CrN, а при 1180°С - Cr2N. Нитрид CrN значительно устойчивее к
действию минеральных кислот, чем Cr2N. Оба нитрида разлагаются хлорной кислотой, a Cr2N, кроме того, НСI и H2SO4. В атмосфере кислорода CrN сгорает с образованием Сr2O3.
Нитраты. Cr (NO3) 2 существует
только в растворе; получают его растворением свежеосажденного Сr (ОН) 2 в
разб. HNO3. Кристаллогидрат Cr (NO3) 2·9H2O стабилен в фиолетовой
форме, растворим в воде и этаноле. Растворы при нагревании имеют зеленый цвет,
при охлаждении - красно-фиолетовый.
Нитрат хрома (III) образуется при выпаривании нитратных растворов
Сr2O3. Известны
кристаллогидрат Cr (NO3) 3·3H2O, два основных зеленых нитрата, смешанные
нитратохлориды CrCl (NO3) 2, CrCl2NO3, сульфато-нитрат CrSO4NO3 и гексаммино-нитрат Cr (NH3) 6 (NO3) 3. Последнее
соединение хорошо растворимо в воде.
Фосфиды. Достоверно изучены только дифосфид СrР2,
образующийся при синтезе из элементов при высоких температурах, монофосфид СrР, образующийся при
синтезе из элементов или пропускании фосфина над нагретым до 850°С порошком
хрома, и субфосфид Сr3Р. Описаны их физические свойства.
Фосфаты. Ортофосфат хрома (III) СrРO4·6Н2O выпадает в виде
бледно-фиолетового аморфного осадка при смешении холодных растворов Na2HPO4 и хромовых квасцов [11].
После двухдневного стояния осадок становится кристаллическим и
темно-фиолетовым; он слегка растворим в воде, быстро растворяется в H2SO4 и НС1, растворим в едких
щелочах. Раствор Na2CO3 переводит осадок в зеленое основное соединение. При добавлении
избытка Na2HPO4 к горячему раствору хромовых квасцов образуется зеленое аморфное
соединение - тетрагидрат фосфата хрома (III). Зеленый
кристаллический СrРO4·2Н2O получают кипячением фиолетового СrРO4·6Н2O с уксусным ангидридом.
Все они при нагревании до слабо-красного каления дают нерастворимый в кислотах
безводный СrРO4 черного цвета.
Карбонаты. Получен карбонат СrСO3 в виде аморфного
серовато-белого порошка, разлагающегося при нагревании на Сr2O3, СO2 и СО [8]. Известны
двойные карбонаты хрома (II), например (NH4) 2Cr (CO3) 2·H2O, Li2Cr (CO3) 2, Na2Cr (CO3) 2·10H2O, K2Cr (CO3) 2·2Н2O, MgCr (CO3) 2 [14].
Трехвалентный хром образует лишь двойной карбонат с калием [9].
Цианиды. Цианид Cr (CN) 3 образуется
при кипячении раствора KCN с нейтральным раствором СrС13 в виде
светлого зелено-голубого осадка, нерастворимого в избытке KCN. Растворим в кипящей НСl, в реакции с КОН дает K3Cr (CN) 6 и Сr2O3.
Роданиды. Cr (SCN) 3 получают
растворением свежеосажденного осадка гидратированной Сг2O3 в HSCN и выпариванием
зелено-фиолетового раствора над конц. H2SO4. Серое аморфное соединение, быстро растворяется
в воде с образованием фиолетового раствора, который при стоянии на свету
окрашивается в зеленый цвет. Фиолетовые растворы не показывают реакция на Сr (III) и SCN - ионы; зеленые растворы
образуют осадки с AgNO3 или аммиаком, Cr (SCN) 3 растворим в большинстве
органических растворителей. В водных растворах может существовать анион сильной
тиоцианатохромовой кислоты, которая образует соли, содержащие комплексный ион [Cr (SCN) 6] 3-.
Двойные роданиды с NH4+, К+, Na+ и Ва2+ растворимы в воде; ионы Ag+, Hg+, Hg2+, Pb2+ образуют с Cr (SCN) 3
нерастворимые окрашенные осадки.
Соединения хрома с органическими реагентами
Известно большое число простых и комплексных соединений Сr (III) с органическими
кислотами. Хром (III) образует комплексы со щавелевой кислотой: [Сr (Н2O) 4 (С2O4)] +, [Сr (Н2O) 3 (С2O4) (ОАс)]° (где
ОАс - ацетат-ион), [Сr (Н2O) 2 (С2O4) 2] - , [Сr (С2O4) 3] 3-.
Изучены реакции комплексообразования Сr (III) с малоновой и янтарной
кислотами; получены комплексы составов 1: 1, 1: 2, 1: 3; ступенчатые константы
устойчивости (в единицах lg βn) равны 7,06; 5,79; 3,3
для первой и 6,42; 4,57; 2,86 для второй кислоты соответственно. Аналогичные
составы комплексов получены при взаимодействии Cr (III) и фталевой кислоты,
ступенчатые константы устойчивости которых равны lg β1 = 5,52, lg β2 = 4,48 и lg β3 = 2,48. Комплексы Сr (III) с адипиновой кислотой (Ad) имеют составы [Cr (OH) Ad]° и [Cr (Ad) 2] - ;
значения β равны 7·104 и 7,7·106
соответственно. Изучены комплексы Сr (III) с аскорбиновой и ализаринсульфоновой кислотами.
Получены комплексы Сr (II) и Сr (III) с пиколиновой кислотой составов СrА+ и СrА2+;
константы устойчивости характеризуются величинами lg β1 = 5,96 для первого и lg β2 = 12,22 для второго комплекса.
Хром (III) образует комплексы с этилендиаминтетрауксусной
кислотой (H4Y) и ее производными очень медленно; этот процесс ускоряется при
нагревании. В водных растворах при разных рН существует четыре различных
комплекса: фиолетовые H [Cr (H2O) Y] (lg β1 = 2,27) и [Cr (H2O) Y] - (lg β2 = 7,41), голубой [Cr (OH) Y] 2 - (lg β3 = 12,2) и в сильно щелочном растворе - зеленый [Cr (OH) 2Y] 3-. С
нитрилотриуксусной кислотой (Н3Х) в щелочных растворах Cr (III) образует
гидроксокомплексы [СrХ (ОН)] - (фиолетовый) и [СrХ (ОН) 2] 2
- (зеленый).
Изучено комплексообразование Сr (III) с двунатриевой солью
1,2-пропилендиаминтетрауксусной кислоты. В растворах с рН 7-8 Сr (III) образует смешанный
красный комплекс с HY и Н2O2 состава Cr: HY: Н2O2 = 1: 3: 12.
Cr (II), Сr (III) и Cr (VI) образуют множество других внутрикомплексных
соединений. Наиболее детально изучены комплексы Сr (III) с ацетилацетоном и его
фторпроизводными. В системе гексафторацетилацетон (НГФА) - трифторацетилацетон
(НТФА) обнаружено семь комплексов трехвалентного хрома: Сr (ГФА) 3, Сr (ГФА) 2
(ТФА), три изомера Сr (ГФА) · (ТФА) 2 (цис-цис-, цис-транс - и транс-цис-структуры),
транс - и цис-изомеры Сr (ТФА) 3. Описаны хелаты Сr (III) с бензоилацетоном,
теноилтрифторацетоном. С последним Сr (III) образует ряд комплексов: CrL3 (рН 3-5,5), CrL2 (OH) (H2O), (рН > 5,7),
CrL (SO4) 22 - (0,5 М H2SO4).
Исследованы реакции комплексообразования Сr (II) и Cr (III) с 8-оксихинолином и его
производными, N-бензоил-N-фенилгидроксиламином и
N-фypoил-N-фeнилгидpoкcилaминoм. Детально изучены реакции Сr (III) и Cr (VI) с 8-меркаптохинолином в
растворах различной кислотности (от 10 М H2SO4 до рН 7).
Влияние температуры на скорость образования хелатов Сr (III) изучено на примере его
комплексов с диэтилдитиокарбаминатом натрия; в растворе с рН ~ 6 при
продолжительности нагревания 2-6 мин. получены следующие данные:
Температура, °С 20 50 70
80 100
Полнота образования, % 30 55 80 97,0
93,0
Эриохромцианин R при рН 2,0-5,0 образует с Сr (III) окрашенный комплекс
состава 1: 1 (β = 6,6·108) [16]. Молекулы
эриохромцианина R при нагревании замещают молекулы Н2O во внутренней сфере акво-иона
[Сr (Н2O) 6] 3+.
Трехвалентный хром образует с пирокатехиновым фиолетовым три комплекса с
соотношением компонентов 1: 1, 1: 2 и 1: 3. Изучены комплексы Сr (III) с тайроном и другими
реагентами, используемыми для фотометрического определения хрома (см. раздел
"Фотометрические методы"). Хелаты Сr (III) растворимы в
органических растворителях.
1.3 Отделение
хрома от сопутствующих элементов
1.3.1 Методы
очистки сточных вод от соединений хрома
Для очистки воды от соединений Cr (VI) применяют: восстановление,
осаждение и ионитную очистку. Изучается метод флотации бихромат-иона.
При восстановлении железным купоросом в кислой среде
протекает реакция:
2СrO3 + 6FeSO4 + 6H2SO4
= 3Fe2 (SO4) 3 + Cr2 (SO4)
3 + 6H2O;
Из полученных сульфатов осаждают гидроокиси хрома и железа
известковым молоком. Восстановление в щелочной среде можно производить,
например, по реакции:
CrO3 + 6FeSO4 + 6 Са (ОН) 2 + 6Н2O = 2Cr (OH) 3 + 6Fe (OH) 3 + 6CaSO4
Аналогичная реакция может протекать и с Mg (ОН) 2. Кроме
FeSO4 применяют для
восстановления SO2, Na2SO3 или NaHSO3, а также Na2S, сульфитцеллюлозные щелока (при 120-130°С) и
железные стружки. Восстановление бисульфитом натрия ведут при рН = 2 с
последующей нейтрализацией основаниями до рН = 8-9,5 [11]:
2CrO42 - + 3HSO3
- + 7H+ = 2Cr3+ + 3SO42 - +
5H203+ + 3ОН - = Cr (OH) 3
Оптимальное значение рН для осаждения гидрата окиси хрома
связано с тем, что выше и ниже указанных пределов растворимость гидрата окиси
хрома возрастает. Описано восстановление остаточного Сr6+ сточных вод процесса
хромирования (после регенерации Н2СrO4 ионообменном и
выпариванием в вакууме) SO2 при рН = 2,5 с последующим осаждением Сr3+ известью с доведением рН
до 9,5:
Cr2 (SO4) 3 + 3Са (ОН) 2
= 2Cr (OH) 3 + 3CaSO4
Воды, содержащие 0,5-1 г СrО3/л и выше, должны
быть использованы в производстве как оборотные. В нормально действующем
производстве оборотная вода шламоотстойных прудов, содержащая 3-11 г/л Na2CrO4 (рН = 11-12), не должна
накапливаться [13]. Она используется нормально для смывания в шламоотстойные
пруды шлама с фильтров второй, стадии фильтрации и для промывки шлама на первой
стадии фильтрации. Сброс этой оборотной воды может потребоваться лишь в
исключительных случаях. Исследованиями выявлено, что очистка ее железным
купоросом протекает достаточно полно при 20°С, рН не выше 7 и расходе FeSO4 в количестве - 130 % от
стехиометрически необходимого: при этих условиях содержание Cr (VI) снижается за 15 мин до
сотых и тысячных долей мг/л (санитарная норма - 0,1 мг/л). Вероятно, FeSO4 дает с имеющимися в
растворе ОН - ионами Fe (OH) 2, который окисляется хроматом до Fe (OH) 3, так что
весь хром переходит в осадок в виде гидрата окиси хрома, а железо - в виде Fe (OH) 3.
Разработана схема автоматизированной установки для очистки
сточных (ливневых и паводковых) вод, содержащих до 500 мг/л СrО3. Сточные
воды обрабатывают в каскаде из двух реакторов известковым молоком (40-50 г/л
СаО) и раствором железного купороса (35-45 г/л FeSO4); затем пульпу
отстаивают в отстойнике, из которого осветленную воду, содержащую не более 0,1
мг/л Cr (VI), 0,5 мг/л Cr (III) и 0,5 мг/л Fe, сливают в водоемы, а
шлам, после уплотнения на отстойной центрифуге, сбрасывают в шламовый пруд. В
первом реакторе поддерживают рН = 10,5÷11,8, во втором - 7-8; время
пребывания в каждом реакторе 6 мин. Расход FeSO4 и СаО на 1 кг СrO3 зависит от содержания СrO3 в сточной воде: при
100-70 мг/л СrO3 он составляет соответственно 10 и 4, а при 30-25 мг/л СrO3 - 25 и 10 кг.
Также разработан электроионитный метод очистки сточных вод от
соединений Cr (VI), заключающийся в том, что стоки пропускают через многокамерный
электролизер, разделенный попеременно расположенными полупроницаемыми
катионитовыми и анионитовыми диафрагмами. При этом концентрация солей в одних
камерах (обессоливания) падает, а в других (камеры концентрирования) растет.
При очистке заводских стоков, содержащих ~ 4 г/л СrO3, 2 г/л Na2SO4 и 0,21 г/л Na2S2O3, на пилотной установке с
17-камерными электролизерами с катионитовыми диафрагмами ДПУ-2 (катионит КУ-2
на полиэтиленовой связке) и анионитовыми ДПВ-17 (анионит АВ-17 на
полиэтиленовой связке) получена степень обессоливания порядка 80%. С
применением трехстадийного электролиза можно понизить содержание СrO3 в стоках с 4 до 3-5 мг/л
и получить из первого электролизера концентрированный раствор с 60-70 г/л СrO3, который может быть
использован в производстве [11]. При доочистке в колонке с анионитом АВ-17
содержание СrO3 в стоках может быть понижено до десятых долей мг/л. Ионит
регенерируют 15 % раствором Na2CO3. Расход энергии на обессоливание 1 м3
раствора составляет 34 кВт·ч. Электроионитная очистка, в отличие от химической,
позволяет утилизировать содержащиеся в стоках соединения хрома.
Очистка сточных вод химическими методами приводит к
образованию объемистых осадков. Наименьший объем шлама получается при
применении солей бария, наибольший-при восстановлении хрома солями
двухвалентного железа и осаждении известковым молоком.
Химические методы имеют ряд недостатков: процесс обработки,
как правило, состоит из многих операций и требует громоздкой аппаратуры,
неизбежно теряются все или почти все основные вещества. Очистка разбавленных
стоков экономически невыгодна, отделение осадков от воды, подлежащей возврату в
производство, занимает много времени. Более рациональными являются методы,
основанные на применении ионообменных смол, особенно при недостатке
производственных площадей и в случае необходимости обработки разбавленных
сточных вод.
В этой связи разработке способов очистки сточных вод от хрома
методом ионного обмена уделяется большое внимание.
В ряде научно-исследовательских институтов проводились и
проводятся работы по подбору ионитов и условий сорбции (десорбции) ионов хрома
из промышленных стоков различных производств, в основном из промывных вод цехов
гальванических покрытий.
Ю.Ю. Лурье и П.С. Антипова исследовали ряд смол для очистки
сточных вод с концентрацией бихромат-ионов до 200 мг/л. Изучены смолы АВ-17Х6,
АВ-17Х16, АВ-28, ЭДЭ-ЮП АН-1, АН-2ФН, АН-2ФГ, АН-18, АН-22, АН-23Х8, АН-12,
АН-25 и АН-31. Указанные исследователи отмечают, что аниониты ЭДЭ-ЮП, АН-2ФН,
АН-22, АН-23, АН-25 и АН-31 окисляются бихромат-ионами. Для очистки стоков от
хрома рекомендованы к применению аниониты АВ-17 и АВ-28 в Cl-форме. Обменная емкость
для анионита АВ-17 составляет 12 % от массы смолы и для анионита АВ-28Х8 - 13
%. Извлечение шестивалентного хрома из этих смол достигает 100 %.
Ю.Ю. Лурье и П.С. Антипова предлагают технологическую схему с
применением указанных анионитов. Рекомендуемая скорость фильтрования 3-10 м/ч,
отношение диаметра к высоте загрузки в колонке 1: 4. При изучении очистки
стоков от трехвалентного хрома на катионитах КУ-21 и КБ-4ПХ2 выявлено, что Сr3+ регенерируется с
катионита на 90-94%.
Во ВНИИводгео исследовали извлечение хрома из растворов с
содержанием от 15 до 850 мг/л хроматов. На основании экспериментальных данных
очистку растворов предлагается проводить на установках, состоящих из
катионитовых и анионитовых фильтров. В качестве анионита рекомендуется АВ-17
[обменная емкость 17,7 % (по массе), скорость фильтрации от 5 до 10 м/ч]. Регенерация
анионита предлагается проводить смесью 2% -ной NaOH и 6 % -ной NaCl со скоростью 0,25 м/ч, а
регенерацию катионита-10 % -ной НС1 с последующим элюированием 20 % -ной серной
кислотой. Извлечение и возврат хрома с анионита составляет 91-96 %) от сорбированного
количества.
Зарубежные исследователи изучали удаление хроматов из сточных
вод с содержанием хроматов 30 мг/л. Сорбцию проводили анионитами Дауэкс-SBK в ОН-, SO2-, Сl-формах в среде с рН = 6.
Обменная емкость анионита составляла 46 кг/м3 по хромат-иону.
Установлено, что обменная емкость ионита уменьшается с повышением кислотности
среды и с увеличением скорости фильтрования. Хроматы удаляются с анионита на 95
%, остаточное содержание ионов хрома в стоках составляет менее 3 мг/л.
Полученные результаты были проверены на экспериментальном стенде по удалению
хроматов из охлаждающих вод; хроматы были удалены на 99,7 %.
В хромсодержащих стоках хром может находится не только в
степени окисления 6+, но и 3+. Описанные выше анионообменные методы не обеспечивают
очистку стоков от хрома 3+.
Очистка стоков от соединений хрома может быть сведена к
следующим операциям: а) фильтрации сточных вод от взвесей, катионированию для
удаления катионов и анионированию для извлечения хромовой кислоты; б)
регенерации катионита кислотой и анионита щелочью; в) отмывке катионита и
анионита водой от регенерирующего раствора; г) катионированию части щелочного
регенерата и возврату в производство хромовой кислоты. Из отечественных ионитов
для этих целей могут быть использованы смолы типа КУ-2 и АВ-17 [14].
1.4
Ионообменная хроматография
Разделение на катионитах [15]. Отделение
хрома на сульфокатионитах осложняется образованием координационной связи между
кислой сульфогруппой сульфокатионитов и основными комплексами Cr (III). Это затрудняет
количественное удаление хрома с катионита. Кроме того, поведение комплексных
ионов хрома (III) в системах катионит-растворы кислот очень сложное: в растворах
образуются нейтральные, отрицательно и положительно заряженные комплексы,
относительные количества которых зависят от состава растворов и условий их
приготовления. Так, фиолетовые растворы солей Cr (III) с аналитической точки
зрения малоинтересны из-за их большой инертности. При нагревании образуются
комплексные ионы, окрашивающие растворы в зеленый цвет. Применение метода
ионного обмена к таким растворам возможно только в присутствии анионов: CI-, Br-, J-, NO3-, СIO3 - и СIO4-. Значения коэффициентов
распределения Сr (III) между катионитами и растворами соответствующих кислот
уменьшаются с увеличением их концентраций.
Таблица 2 - Коэффициенты распределения Cr (III) между
сульфокатионитами и растворами кислот
|
Концентрация
кислоты, N
|
Коэффициент
распределения хрома (III) в растворе
|
|
НСI
|
НNО3
|
H2SO4
|
|
0,1
|
1130
|
5100
|
198
|
|
0,2
|
262
|
1620
|
176
|
|
0,5
|
73
|
418
|
126
|
|
1,0
|
27
|
112
|
55
|
|
2,0
|
8
|
27,8
|
18,7
|
|
3,0
|
5
|
19,2
|
0,9
|
|
4,0
|
3
|
10,9
|
0,2
|
Из 4,5 М НСI Сr (III) практически не
сорбируется сульфокатионитами. Из концентрированных растворов НСIO4 степень сорбции Cr (III) выше, чем из растворов
НСI одинаковой концентрации;
например, значения коэффициента распределения (Kd) ионов Сr (III) между катионитом
Дауэкс-50Х8 и 9 М НСI составляет менее 1, а 9 М НСIO4 - 3,5. Отделение Сr (III) от U (VI) основано на
преимущественном поглощении последнего катионитом Амберлит IR-120 из 1 М НСIO4.
Сорбция Сr (III) в 6-12 М НВr незначительная; на этом основано отделение Сr (III) от Fe (III) из 9 М НВr. В смесях HNO3 (0,1 М) - HF (0,1 ÷1,0 М) и H2SO4 (0,1 N) - HF (0,1÷1,0 М) степень сорбции Сr (III) резко снижается, что
позволяет отделить Cr (III) от Ag, Cd и других элементов. На катионите КУ-2 осуществлено разделение Cr (III), Be (II), V (IV), Ti (III), Ni (II), Аl (III) элюированием растворами
НСI разной концентрации.
Эффективным элюентом для отделения 51Сr от других элементов на
катионите Амберлит IR-120 является 3 М НСI.
Значения коэффициентов распределения Cr (III) между катионитом и
растворами НСI
увеличиваются в присутствии спиртов (табл.3).
Таблица 3-Коэффициенты распределения Cr (III) между катионитом AG 50 W-X8 и растворами НСI в присутствии этанола
|
Содержание
этанола, %
|
D при
|
|
Концентрация НСI, М
|
|
0,5
|
1,0
|
2,0
|
3,0
|
|
0
|
73
|
26,7
|
7,9
|
4,8
|
|
20
|
93
|
35,9
|
7,5
|
3,9
|
|
40
|
118
|
53
|
12,3
|
4,9
|
|
60
|
170
|
83
|
27,2
|
11,4
|
|
70
|
-
|
-
|
33,3
|
-
|
|
80
|
279
|
114
|
-
|
-
|
|
90
|
421
|
-
|
-
|
-
|
Приведенные величины являются средневзвешенными значениями
коэффициентов распределения различных комплексов Cr (III), существующих в
растворах: [СrСI3 (Н2O) 3] 0
(зеленый), [СrСI2 (Н2O) 4] + (зеленый),
[СrСI (Н2O) 5] 2+
(грязно-сине-фиолетовый) и [Сr (Н2O) 6] 3+ (красно-фиолетовый).
Незаряженный комплекс не поглощается катионитом; коэффициенты распределения для
других комплексов соответственно равны 50, 400 и > 2000 в смеси 1,0 M НСI - 8 % этанола и 5, 60 и
400 в смеси 2,0 М НСI - 60 % этанола.
Вследствие того, что скорости образования акво- и хлорокомплексов
в этанольных растворах НСI много меньше, чем в соответствующих водных растворах, можно
получить количественное разделение комплексов хроматографическим методом.
Однако отделение Сr (III) от многих элементов, за исключением Th (IV), Zr (IV), Ва (II) и некоторых
редкоземельных элементов, затруднительно из-за того, что разные комплексы Cr (III) элюируют в существенно
различных условиях. Значения Кd увеличиваются c ростом длины углеродной
цепи в молекулах спиртов, изомерия последних не оказывает влияния.
При анализе растворов зеленого комплекса хрома (III) с фосфат-ионом
разделение в обычных условиях протекает не полностью: небольшое количество Н3РO4 поглощается катионитом,
но значительная часть хрома проходит через колонку.
Изучено хроматографическое поведение ряда растворимых полифосфатов
металлов в присутствии избытка полифосфата натрия на колонке, заполненной
катионитом Амберлит JR-120 в Н+ - форме. Найдено, что зеленый комплекс Cr (III) полностью переходит в
элюат; на этом основано отделение хрома от Zn, Со, Ni и Сu. При высоких значениях
рН (> 7) Сr
(III) образует с пирофосфатом
натрия устойчивое комплексное соединение Na6 [Cr2 (P2O7) 3]; оно
используется для разделения Сr (III) и Mn (II). Ионы Мn2+ поглощаются катионитом, а хром проходит через колонку.
Разделение 59Fe (III) и 51Сr (III) основано на различной
устойчивости в кислых средах их пирофосфатных комплексов; при рН=2 комплекс Сr (III) неустойчив. Ионы Сr (III) и Fe (III) сорбируются на
катионите КУ-2, затем колонку промывают кислым раствором пирофосфата натрия для
элюирования Fe (III); Cr (III) элюируют 10 % -ным раствором H2SO4.
Способность Cr (III) образовывать при нагревании прочное комплексное
соединение с роданид-ионом используется для его отделения от Fe (III), Fe (III), Со (II) и Ni (II). Ниже приведены
значения коэффициентов распределения Сr (III) между катионитом СБС и растворами NH4SCN разной концентрации:
NH4SCN, М < 4·10-2
0,16 0,7 1,4 5,6
Kd Полное поглощение
102,0 95,2 72,0 72,0
При хроматографическом разделении элементов в роданидных
растворах следует иметь в виду, что вымывание со смолы сорбированного хрома
может быть чрезвычайно затруднено, особенно при использовании слабоосновных
катионов.
Ионы Cr (III) образуют прочные комплексы с органическими
кислотами (уксусной, щавелевой, лимонной и др.), которые не сорбируются
катионитами: этим пользуются для отделения хрома от других элементов, например
от Fe (III). Используют также и
инертность аквокомплексов Сr (III) при замещении Н2O на С2O42 - ионы. При определенных
условиях Сr
(III) прочно удерживается
катионитом и не элюируется растворами щавелевой кислоты. Метод используют при
анализе бинарных смесей Cr-Аl и Cr-Fe. Исследуемый раствор пропускают через колонку с
катионитом Дауэкс-50X8 в Н+ - форме; колонку промывают водой, а
затем Fe (III) и АI (III) элюируют охлажденным 2 % -ным раствором Н3С2O4 до отрицательных реакций
с SCN-ионом и ализарином
соответственно. Сr (III) десорбируют с катионита после перенесения его в стакан
обработкой горячим щелочным раствором Н2O2.
Для отделения хрома используются также растворы комплексонов.
Это основано на различной устойчивости комплексонатов Сr (III) в кислых и щелочных
средах. В определены значения Kd для различных катионов
(катионит Дауэкс-5OWX1O,
[Me] = 2·10-3 М,
[HNO3] = 0,03-0,8 М и [ЭДТА] = 5 М. Для Сr (III) значения коэффициентов
распределения увеличиваются с ростом концентрации ионов Н+.
Например, lg Kd изменяется от нуля при
[Н+] = 0,05 М до ~ 0,45 при [Н+] = 0,8 М. Ионы Сr (III) практически не
сорбируются катионитами из 0,08-0,1 М растворов HNO3 и НCI. На этом основано его
отделение от Аl
(III), Fe (III) и Со (II). В щелочных растворах
получены высокие значения Kd Cr (III) между катионитом СБС и
0,5 % -ным раствором комплексона III; Kd = 1122-12+30
при рН 2,05-5,10.
На этом основано разделение Сr (III) и Ti (IV), Cr (III) и V (V) [14]. Для получения
препарата 51Сr высокой удельной активности облучают нейтронами [Сr (Н2O) 6] 3+,
сорбированный на катионите Дауэкс-50; образующиеся ионы 51Сr2+ элюируют 0,01-0,1 N раствором
Н2С2O4, насыщенным O2 или Н2.
Степень обогащения увеличивается при снижении температуры до 0,5°С и равна 103-104.
Для многих аналитических целей применяют окисление Сr (III) до Cr (VI) с последующей сорбцией
катионов других элементов на катионитах. Таким путем отделяют хром от Fe (III), Fe (II), Al (III), V (V). Проведение таких
анализов осложняется интенсивным восстановлением Cr (VI) катионитами в
слабощелочных растворах; только при рН~11 ионы СrО42 - практически
полностью остаются в элюате.
Для отделения хромат-ионов от ионов, образующих прочные
катионные комплексы в аммиачной среде, используют катиониты с карбоксильными
группами, например Амберлит IRC-50. На колонке, заполненной катионитом в NН4+
- форме, отделяют СrO42 - от аммиачного комплекса Cu (II).
Изучена сорбция Сr (III) и других катионов из ацетатных растворов
активированным углем СКГ. Найдено, что в растворе 0,45 М СН3СООН
+ 0,05 М CH3COONH4 может быть достигнуто эффективное разделение хрома и урана.
Сорбцию Сr
(III) на окисленном угле
марки БАУ и на монофункциональном карбоксильном катионите КБ-4П-2 в Na+-форме используют для
определения хрома в морской воде.
Разделение на анионитах [15]. Ионы Сr (III) слабо поглощаются
анионитами из растворов кислот НСI, HNO3, HF, НВr, а также из растворов роданида аммония и LiCI.
Ионы Cr (VI) сорбируются из НСI, H2SО4, НСIO4 и ее солей и HF. Коэффициенты
распределения ионов Сr (III) и Cr (VI) между анионитом AG-1X8 и растворами H2SO4 разной концентрации приведены ниже [15]:
H2SO4, М 0,005
0,015 0,05 0,1 0,5 1,0 2,0
Cr (VI) (n·10-3) 25
12 12 7,8 2,1 0,8 0,3 (III)
5,1 3,4 2,1 0,7 <0,5 <0,5 <0,5
Уменьшение сорбции Cr (III) с ростом концентрации растворов H2SO4 обнаружено и для
анионита Дауэкс-1Х8. Изучена сорбция Cr (VI) анионитом АВ-17 из растворов, содержащих ионы NO3-, СI-, SO42-, СIO4-, РO43-. Исследована сорбция
хлорокомплексов Сr (III) и Мn (II) на анионите Дауэкс-2Х8 из 7 и 10,5 М НСI. Установлено, что с
повышением температуры коэффициент распределения Мn (II) повышается, а значения
коэффициента распределения Сr (III) изменяются по сложной кривой (в интервале 1-25°С они остаются
постоянными, затем скачкообразно возрастают, после чего довольно быстро
снижаются). С уменьшением основности анионита сорбируемость Сr (III) возрастает, особенно в
слабокислых растворах HF. Показано увеличение Кd для Сr (III) с ростом концентрации
НСI и H2SO4 в случае использования
слабоосновного анионита ЭДЭ-10; в 1 N НСI и H2SO4 соответствующие значения
равны 20 ± 0,5. Наблюдается также рост значений Kd по мере увеличения
концентрации NH4SCN от 6,5 (для 0,012 М) до 37,6 (для 1,4 М).
Сильноосновные аниониты используются для отделения Сr (III) от Mo (VI), W (VI), Fe (III), V (V), Mo (VI), W (VI) [16]. Значительно более
часто используются аниониты для отделения хрома в виде СrO42-, однако следует иметь в
виду возможность восстановления этого иона до Сr (III) некоторыми анионитами,
что приводит к снижению качества разделения [14]. Аниониты используют при
анализе сталей и сплавов, руд. Разделение MnO4-, [Ce (SO4) 3] 2 - и
Сr2O72 - осуществляют на анионите
АВ-17, модифицированном гидразином. Mn (VII) вымывают 0,1 N раствором N2H4·2HCI, Ce (IV) - 0,05 М H2SO4 и Cr (VI) - 1 М H2SO4.
Описаны методы отделения хрома на анионитах в растворах
органических комплексообразующих веществ. В частности, благодаря инертности
аквокомплекса Сr (III) при замещении Н2O на С2O42 - он может быть отделен от Fe (III) и Аl (III), которые сорбируются на
анионитах Амберлит IRA-400 или IRA-401 в виде оксалатных комплексов. Оптимальной
средой для отделения Сr (III) от Fe (III) и АI (III) является раствор 0,3 М НСI + 0,0018 М Н2С2O4.
Детально изучена сорбция Сr (III) из тартратных
растворов. Значения Kd увеличиваются с ростом рН
раствора (вплоть до рН 6) и зависят от концентрации тартрат-иона. Найдены
условия разделения Cr (III), Ni (II), Fe (III), Mo (VI) на колонке анионита Дауэкс-2Х8 длиной 5 см; в качестве
элюента для Сr
(III) и Ni (II) применяют 8,5·10-2
М раствор винной кислоты с рН 3,5; Fe (III) элюируют 8,5 ·10-2
М раствором винной кислоты в 0,1 М НСI, a Mo (VI) - 3 M раствором NaOH.
Коэффициенты распределения Cr (III) между анионитами и
растворами ЭДТА уменьшаются с увеличением ее концентрации от значения 60 (0,01 М
ЭДTANa) до 9 (0,10 М ЭДТАNa); в 0,5 % -ном растворе
комплексона III они мало зависят от рН раствора, но существенно возрастают в
присутствии NH4CI. Найдены условия разделения смесей Ba (II), Sc (III), Cr (III), V (IV), Cr (III) и V (V) и Fe (III), Cr (III) и VO2+.
На основе разной устойчивости комплексов с нитрозо-R-солью найден способ
разделения Сr
(III) и Со (II). Аниониты в ОН--форме
используются в качестве осадителей при концентрировании элементов из
разбавленных растворов с последующим их разделением. Описаны методы
концентрирования и разделения Cu (II), Cr (III), Pb (II), Fe (III), Al (III), Cr (III), Mn (II), Fe (III), Cr (III); щелочных и щелочноземельных металлов, Ni (II), Ag (I), Mn (II), Cr (III), РЗЭ.
Для разделения сложных смесей элементов используют наиболее
рациональные сочетания анионитов и катионитов. Весьма любопытно поведение Сr (III) в 4,5M HCI, из
которой он плохо сорбируется как катионитами, так и анионитами; это позволяет
производить его отделение от большого числа катионов и анионов.
Разделение на неорганических ионообменниках [15]. Для
отделения Cr (VI) от Cu (II), Ni (II), Zn (II), Cd (II) применяют очищенный силикагель. В анализируемый аммиачный
раствор (рН ~ 11,5) вводят очищенный силикагель. Выдерживают 10 мин. и раствор
декантируют. Промывают аммиачной водой, объединяют декантат и промывные
воды, которые содержат Cr (VI).
Разработаны методы разделения ионов Сr (III) и СrO42 - на колонке с окисью
алюминия. Сорбционная способность ионов на активированной АI2O3 в НСI и HNO3 уменьшается в ряду: As (III) > Sb (III) > Bi (III) > Sn (IV) > Sn (II) > > Cr (III) > Fe (III) > Pb (II) > Cu (II). Для
хроматографического отделения Cr (III) его совместно с другими металлами осаждают
8-оксихинолином или 8-оксихинальдином. Осадок растворяют в хлороформе, раcтвор разбавляют бензолом
и пропускают через колонку с активированной окисью алюминия. Хром остается в
растворе, в то время как другие металлы задерживаются на колонке. Отделение Cr (III), Co (II), Sr (II) от PO43-, SO42 - производят на колонке с
окисью алюминия в СI - форме. Метод группового разделения радиоактивных Cs; Sr, Ва; Mo, Ni, Со; U, Al; Zr, Nb; Fe, Pb, Сr, Те; РЗЭ; Ru на A12O3.
Ионы Cr (III) необратимо сорбируются на арсените олова SnO (AsO3OH) · Н2O в Н+-форме и
отделяются от Fe (II), Zn (II), Mn (II), Mg (II), которые элюируют 1 М раствором NH4NO3. Коэффициент
концентрирования Сr (III) из морской воды на гранулах Ti (OH) 4 очень
высок (после 30-суточного контакта равен 1000). Сорбцию на Fe (OH) 3 используют
для получения радиохимически чистого 51Сr и отделения от вещества
мишени (51V) и радиоактивных загрязнений (Ti и Sc). Степень сорбции Сr (III) на гидроокиси, фосфате,
молибдате и вольфрамате циркония увеличивается с ростом рН раствора.
Методы ионообменной хроматографии используют для
нейтронно-активационного анализа чистых веществ - алюминия, двуокиси кремния и
кварца, циркония, биологических образцов, химико-спектральном анализе галлия и
арсенида галлия, сурьмы, нептуния, спектрофотометрическом и титриметрическом
определении хрома в сталях и сплавах, рудах, огнеупорных материалах, при
получении и анализе радиоактивных препаратов хрома, радиохимических анализах
метеоритов и лунных пород и при концентрировании примесей из морской воды.
Разделение на хелатообразующих ионитах [17]. Для отделения Cr (III) от Cu, Pb, Ni, Cd, Mn, Zn, Co, Al, РЗЭ, щелочных и
щелочноземельных элементов используются хелатообразующие ионообменники. Ионы Сr (III) при 70-90°С образуют со
всеми хелатными смолами исключительно инертные комплексы, которые медленно
разлагаются лишь при температуре выше 90° С раствором 1 М H2SO4. Предложен метод
группового отделения Сu, U (VI), Bi, Cr (III) от Ni, Со, Zn, Mn (II), Cd, Pb, Be, Ti (I), NH4+, щелочных и щелочноземельных элементов и РЗЭ, основанный на
образовании первыми элементами прочных комплексов с N-метил-β-аминопропионовокислой смолой. Остальные элементы при определенных
значениях рН этой смолой не поглощаются.
Как на монофункциональной саркозиновой смоле,
так и на монофункциональной иминодиуксусной смоле ощутимые количества Сг3+
связываются лишь при повышенных температурах. Из сернокислого раствора
образуются смешанные зеленоватые сульфато-комплексы, которым приписана формула
[CrY (SО4) (H2О)]. При охлаждении
колонки происходит медленное изменение окраски до темной серо-фиолетовой. Это
связано с происходящим обменом лигандов, который ведет к образованию смешанного
акво-комплекса приблизительно следующего строения: [CrY (H2О) 3] +.
При повторном нагревании колонки зеленая окраска появляется вновь.
При наполнении из 0,05 М раствора Cr2 (SО4) 3
с рН 2,7 и температуре 90°С емкость определяется величиной 0,53 моля Сr3+ на 1 моль
монофункциональной иминодиуксуснои смолы. Элюирование удается лишь посредством
раствора 5 н. H2SО4 при 90°C. В элюате не обнаруживаются ионы Сr3+ при элюировании
раствором 1 н. НСl и комнатной температуре.
Таким образом все ионы с нормальными
ионообменными свойствами можно отделить от Сr3+. Для этого наполнение
проводят при 90°C, после чего в рубашку ионообменной колонки подают водопроводную
воду, и, таким образом, комплексы хрома (III) на монофункциональной
иминодиуксуснои смоле "замораживаются". Тогда нормально
обменивающиеся связанные в комплекс ионы металлов отделяются от смолы раствором
холодной 1 н. НСl.
Выделение хрома (III) на хелоновых смолах [17]. Ионы хрома (III) при 70-90°C образуют со всеми
хелоновыми смолами исключительно инертные комплексы, которые медленно
разлагаются лишь при температуре выше 90°C раствором 2 н. H2SO4, причем во всех случаях
не количественно. Лишь если колонку с определенной хелоновой смолой уже
неоднократно используют для одного и того же разделения, получаемые результаты
приобретают воспроизводимость и достаточную точность. Однако для анализа
неизвестной смеси последующее отделение и определение Сr (III) весьма ненадежно. Тем
не менее для аналитических целей этот метод [при помощи которого Сr (III) можно выделить из смеси
перечисленных выше ионов] пригоден вплоть до определения следов. По Херингу и
Неске [17] анализируемый раствор фильтруют при рН 3-5 и температуре 80°C через колонку с
монофункциональной саркозиновой смолой. Затем в обогревательную рубашку колонки
подают ледяную воду, вследствие чего комплексы Сr (III) на хелоновой смоле
становятся инертными ("замораживаются"). После этого все остальные
ионы сразу отделяются 1 н. раствором HNO3, охлажденной льдом, не затрагивая при этом хром
(III) из четко ограниченной
зоны. Исследования Херинга и Мурра [16] показали, что нет смысла затем отделять
Сr (III) от смолы
продолжительным элюированием раствором 2 н. H2S04 при 90°C. Кюн затем исследовал
для этих целей монофункциональную N-метил-3-аминопропионовую смолу и получил
принципиально те же результаты. По-видимому, из всех хелоновых смол последняя
является наиболее подходящей для этих целей, так как почти все ионы металлов,
за исключением Hg2+, можно отделить от хрома (III) по методу Неске
("кинетическое маскирование"). "Замораживание" комплексов Сr (III) на монофункциональной N-метил-р-аминопропионовой
смоле Кюн не изучал.
2. Цели и
задачи
Целью данной дипломной работы явилось изучение равновесия
сорбции хрома (III) на ионитах с различными функциональными группами, равновесии,
кинетики и динамики сорбции и десорбции хрома (III) при различных
температурах на ионите с иминодикарбоксильными группами.
Для достижения поставленной цели необходимо решить следующие
задачи:
· Исследовать равновесие сорбции хрома (III) из сульфатных растворов
на ионитах с различными функциональными группами с целью выявления наиболее эффективного
ионита;
· изучить кинетику и динамику сорбции и
десорбции хрома (III) при различных температурах на ионите с иминодикарбоксильными
группами;
3.
Экспериментальная часть
3.1 Методика
проведения экспериментов
3.1.1
Материалы и их подготовка
В работе исследовалась сорбция хрома (III) на различных
ионообменниках, производимых компаниями "Пьюролайт" Великобритания. В
таблице 4 приведены основные характеристики опробованных ионитов.
Подготовка сорбентов проводилась по стандартной методике
[20]. Исходные растворы готовились растворением точно взятых навесок, рабочие
растворы - разбавлением исходных растворов.
В работе использовались реактивы квалификации ХЧ и ЧДА.
Концентрация растворенных веществ уточнялась с помощью аналитических методов.
Таблица 4 - Основные характеристики используемых сорбентов
|
Наименование
сорбента
|
Матрица
|
Структура
|
Функциональные
группы
|
Уд. объём, мл/г
|
|
Purolite S930/4757
|
стирольная
|
макропористая
|
-N (CH2COOH) 2
|
2.9
|
|
Purolite S985
|
акрилатная
|
гелевая
|
-NC2Hn (NHC2Hn)
nNH2 n=3-6
|
3,9
|
|
Purolite
C107
|
акрилатная
|
макропористая
|
-COOH
|
4.0
|
|
Purolite
С150
|
стирольная
|
макропористая
|
-SO3Н
|
2,4
|
|
Purolite
D5041
|
стирольная
|
макропористая
|
PO3H2
|
3,8
|
3.1.2 Условия
проведения экспериментов
Эксперименты по изучению сорбции и десорбции хрома (III) изучались в
статических, кинетических и динамических условиях.
Опыты в статических условиях производились по следующей
методике [18]. Навески ионитов 0,25 г в пересчете на сухой сорбент помещались в
колбы вместимостью 50 мл и заливались 25 мл растворов заданного состава с
переменной концентрацией хрома. Колбы, содержащие растворы в смеси с ионитом,
выдерживались в течение 2 дней при комнатной температуре при периодическом
перемешивании. Концентрация хрома, сопутствующих компонентов и серной кислоты в
растворах задавалась заранее. По истечении 2 дней растворы анализировались на
концентрацию хрома (III).
Значения емкости сорбента рассчитывалось по уравнению:
 (3.1)
(3.1)
где Е - емкость сорбента, ммоль/г;
С0 и Ср - соответственно
начальная и равновесные концентрации хрома, ммоль/л (мг/л);
V - объем раствора, мл;
m - навеска сорбента, г
и
ЕV = Е / Vуд. об., (3.2)
где ЕV - объемная емкость
сорбента, ммоль/мл;
Е - емкость сорбента, ммоль/г;
Vуд. об. - удельный объем набухшего
ионита, мл/г.
Кинетика сорбции хрома проводилась по методу ограниченного
объема. В стакан вводился раствор хрома объемом 100 мл. Стакан помещался в
термостат. Затем в стакан вводились навески ионитов 1,0 г в пересчете на сухую
массу определенного зернения, и включалась мешалка. Через определенные
промежутки времени отбирались пробы по 1 мл, которые анализировались на
содержание хрома. Расчет значений емкости ионита, достигаемой в каждый момент
времени, проводился с учетом изменения объема раствора за счет отбираемых проб.
При изучении влияния температуры на равновесие сорбции и десорбции, колбы,
содержащие растворы в смеси с ионитами, помещались в термостат, снабженный
перемешивающим устройством. Выдерживались в нем при фиксированной температуре и
при перемешивании каждые сутки, в течение не менее 8 ч. По прошествии
указанного времени растворы отделялись от ионитов, после чего на следующий день
снова приводились в контакт с теми же навесками ионитов при той же температуре
при термостатировании и перемешивании. Тот же прием был использован при
изучении кинетики десорбции хрома при комнатной температуре.
Исходя из данных о влияние зернения ионитов и скорости перемешивания,
на скорость установления равновесия, а также по характеру зависимостей F от  и - lg (1-F) от t определялась стадия, лимитирующая скорость процесса.
и - lg (1-F) от t определялась стадия, лимитирующая скорость процесса.
Степень достижения равновесия в данный момент времени t определялась из следующего уравнения:
F (t) = Et/Eравн, (3.3)
где F (t) - степень достижения равновесия;
Et. - емкость хрома в данный момент времени,
ммоль/мл;
Eравн - равновесная емкость, ммоль/мл.
Значение эффективной энергии активации сорбции и десорбции
процессов (ЕА, кДж/моль) рассчитывались на основании времени
достижения определенной степени равновесия по уравнению Аррениуса.
Изучение кинетики десорбции хрома из предварительно насыщенных до
определенной емкости ионитов после сорбции проводилось раствором 1М серной
кислоты. Растворы после сорбции предварительно промывались дистиллированной водой,
после чего подсушивались на фильтре и заливались десорбирующим раствором
объемом 100 мл. Далее изучение кинетики десорбции проводилось по тому же
методу, что и кинетика сорбции, т.е. по методу ограниченного объема [19].
Опыты в динамических условиях проводились в колонках, содержащих
по 20 мл ионита (S930/4757), при соотношении H: D =10:
. Насыщение первой колонки проводилось при комнатной температуре
(~20 оС), а второй - в термостате, при 60 оС. Растворы
подавались снизу вверх, средняя линейная скорость пропускания растворов при
сорбции составляла ~0,8 к. о. /ч. Пробы раствора отбирались на выходе колонн и
анализировались по соответствующим методикам, приведённым ниже.
После насыщения хромом, колонки промывали водой.
Десорбцию проводили раствором 1М серной кислоты, при 20 оС
и 60 оС.
3.1.3 Метод
анализа
Концентрация хрома в растворах определялась
фотоколориметрическим методом. Методика заключалась в следующем: аликвоту
раствора помещаем в мерную колбу вместимостью 25 мл, к ней добавляем немного NH2OH ∙ HCl, 5 мл раствора
комплексона III, 2,5 мл буферного раствора (до pH ~ 4-5), затем мерную
колбу греем на кипящей водяной бане в течение 2 - 3 минут, охлаждаем. После
охлаждения объем раствора доводим до метки водой, раствор перемешиваем, после
чего измеряем оптическую плотность раствора при 540 нм на фотоколориметре
КФК-2МП [18]. Измерение оптической плотности проводим в кювете с толщиной слоя
30 мм. Раствор сравнения - вода. Для определения содержания хрома в растворах
был построен калибровочный график. Для построения графика был приготовлен
раствор, содержащий различную концентрацию хрома. Проводили анализ на хром по
описанной выше методике, измеряли оптическую плотность. Далее был построен
график зависимости оптической плотности от содержания хрома в растворе,
который, представлен на рисунке 1.

Рисунок 1 - Калибровочный график для определения концентрации
хрома в растворах
В ходе проведения экспериментов выяснилось, что для определения
хрома в десорбатах, емкости буферного раствора не достаточно для создания рН 4
- 5 и поэтому, после ввода всех реагентов, необходимо добавлять 0,6 - 0,7 мл NH4OH.
4. Результаты
и обсуждения
4.1 Изучение
сорбции хрома (III) в статических условиях
4.1.1 Изучение сорбции хрома (III) в зависимости от рН
раствора
Одним из основных факторов, от которого зависит емкость и
избирательность ионитов вообще и, в частности, хелатообразующих ионитов к
присутствующим в растворах ионам металлов являются значения рН. От рН растворов
зависит степень диссоциации (или, иными словами, степень протонирования)
функциональных групп ионитов, а также формы существования ионов металлов в
растворах.
В связи с этим в первой части работы была изучена сорбция
ионов хрома (III) от равновесных значений рН, на различных ионитах S930/4757, С150, С107, S985, D5041. Сорбция проводилась
из растворов с постоянной концентрацией сульфата натрия 0,5 моль/л. Исходная
концентрация хрома (III) 0,02 моль/л. Полученные данные приведены на рисунке 2.
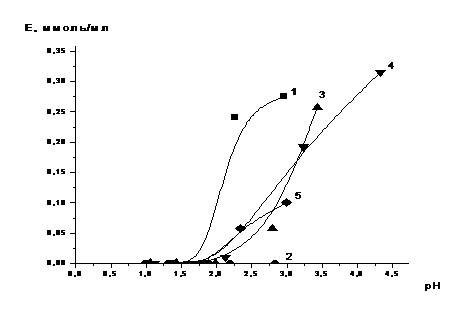
- S930/4757, 2 - С150, 3 - С107, 4 - S985, 5 - D5041
Рисунок 2 - Зависимость емкости по хрому от рН среды на различных
ионитах
Исходя из полученных данных, следует, что с повышением рН емкость
всех ионитов по хрому увеличивается, что и естественно, хотя и в разной
степени. Повышение емкости с увеличением рН растворов связано с тем, что с
повышением рН увеличивается степень диссоциации (уменьшается степень
протонирования) функциональных групп ионитов, что приводит к повышению емкости
ионитов по ионам хрома (III).
Чем более избирателен ионообменник к иону, тем при более низких
значениях рН раствора он проявляет способность к сорбции иона. Поэтому величину
рН начала сорбции, можно связать с избирательностью ионита к иону.
Ионы хрома (III) начинают
сорбироваться только при рН не менее 1,5-2. Из опробованных ионитов наибольшую
избирательность к ионам хрома, проявляют: иминодикарбоксильный ионит S930/4757, карбоксильный катионит С107 и
полиэтиленполиаминный анионит S985.
На основе данного исследования можно сделать вывод, что вопреки
литературным данным, ионы хрома (III) практически
не сорбируются сульфокатионитом С150, и дальнейшее его использование не
целесообразно.
.1.2 Изотермы сорбции хрома (III) на различных ионитах из сульфатных растворов
Важной характеристикой равновесия ионообменной сорбции являются
изотермы сорбции ионов. Из них можно оценить величину емкости ионита по
сорбируемому компоненту, при той или иной концентрации последнего. Был проведен
эксперимент по снятию изотерм сорбции хрома (III) из сульфатного раствора.
Был приготовлен модельный раствор, состава: 0,5 моль/л по Na2SO4 и с
концентрацией хрома 0,004; 0,008; 0,02; 0,04 моль/л. Ниже, на рисунке 3
приведены изотермы сорбции хрома.
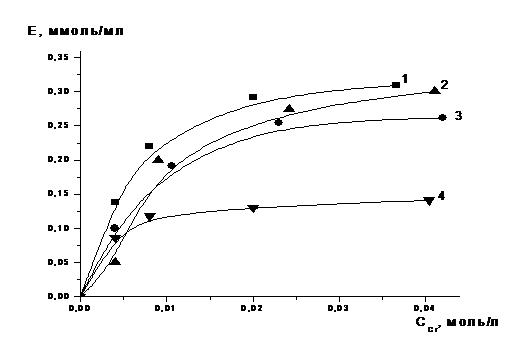
- S930/4757, 2 - S985, 3 - С107, 4 - D5041
Рисунок 3 - Изотермы сорбции хрома (III) на различных ионитах
Из полученных зависимостей можно сделать выводы, что наиболее
высокую емкость по хрому во всем интервале его равновесных концентраций имеет
иминодикарбоксильный ионит S930/4757.
Несколько уступает ему ионит S985. Еще хуже
сорбция протекает на ионитах С107 и D5041.
Дальнейшие исследования по изучению кинетики сорбции, десорбции
хрома (III) и динамики этих процессов проводились на
иминодикарбоксильном ионите S930/4757, как
обладающем наиболее высокой избирательностью к хрому (III).
4.2 Изучение
кинетики сорбции хрома (III)
Возможность использования ионитов в тех или иных процессах
определяется не только их избирательностью, но и скоростью протекания
ионообменного процесса. Исследование кинетических особенностей сорбции
позволяет определить скорость лимитирующую стадию этого процесса. Скорость
лимитирующей стадией может быть: диффузия иона через плёнку раствора, окружающую
зерно ионита - внешняя диффузия; диффузия иона внутри зерна ионита - внутренняя диффузия;
химическое взаимодействие - реакция между сорбируемым компонентом и
функциональными группами ионита. Последняя из перечисленных стадий протекает,
обычно, за незначительный промежуток времени по сравнению со стадиями внешней и
внутренней диффузии, которые по отдельности или совместно в большинстве случаев
определяют скорость сорбции. До сих пор не было выявлено ионообменной системы,
в которой скорость лимитирующей стадией является химическая реакция [19-21].
Выявление вида кинетики сорбции возможно проведением
исследований зависимости скорости процесса от размера зёрен ионита,
интенсивности перемешивания системы ионит-раствор и др. Если первый из
указанных факторов не влияет на скорость сорбции, то скорость лимитирующей
стадией является химическая реакция. В противоположном случае скорость сорбции
лимитируется диффузионными процессами: либо диффузией через пленку окружающую
сорбент, либо диффузией внутри зерна сорбента.
4.2.1
Изучение влияние температуры на кинетику сорбции хрома (III) на
иминодикарбоксильном ионите S930/4757
Было произведено сравнение кинетических характеристик ионита S930/4757 при сорбции
хрома (III) из сульфатных растворов, при разных температурах. Предварительно
была определена равновесная емкость ионита при разных температурах (время
контактирования раствора с ионитом при постоянном перемешивании при температуре
20 оС составило 10 суток, при 60 оС - 6 ч, при прочих
температурах время контактирования колебалось от 8 до 12 ч). Полученные данные
приведены в таблице 5.
Таблица 5 - Равновесная емкость иминодикарбоксильного ионита S930/4757 при разных
температурах
|
Температура, 0С
|
Емкость по
хрому, ммоль/ г
|
|
20
|
1,12
|
|
30
|
1,17
|
|
40
|
1,23
|
|
50
|
1,28
|
|
60
|
1,32
|
На первой стадии исследований было изучено влияние размера
гранул ионита и скорости вращения мешалки на степень достижения равновесия при
сорбции хрома (III) на иминодикарбоксильном ионите S930/4757 при 20 оС.
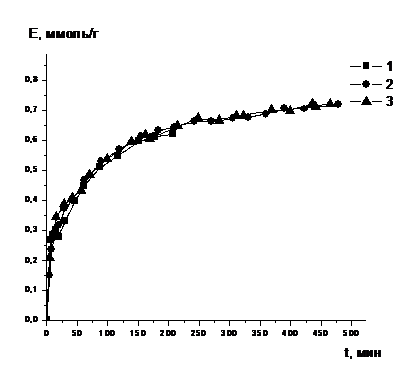
- 200 об/мин, d=0,5-1,0мм; 2 -
200 об/мин, d=0,25-0,5мм; 3 - 300 об/мин, d=0,5-1,0мм
Рисунок 4 - Зависимость емкости ионита S930/4757 от скорости перемешивания и от диаметра зерен ионита
Из рисунка 4 видно, что ни скорость перемешивания, ни зернение
ионита не оказывают влияния на емкость ионита. Это говорит о том, что скорость
лимитирующей стадией процесса сорбции может являться химическая реакция.
Отсутствие влияния интенсивности перемешивания на скорость этого процесса
свидетельствует о том, что внешняя диффузия не может лимитировать скорость
этого процесса.
Далее было изучено влияние температуры. Полученные данные
приведены на рисунках 5 и 6.

1 - 20, 2 - 30, 3 - 40, 4 -
50, 5 - 60 оС
Рисунок 5 - Зависимость емкости ионита S930/4757 от температуры

- 20 оС, 2 - 30 оС, 3 - 40 оС, 4
- 50 оС, 5 - 60 оС
Рисунок 6 - Зависимость степени достижения равновесия сорбции
хрома (III) от времени при одинаковой скорости
перемешивания 200 об/мин и зернении d=0,5-1,0
мм, при С исх. (Cr) = 0,02 моль/л и разных Т
На основании полученных данных были построены критериальные
зависимости - lg (1-F) от t и F от √t, которые
приведены на рисунках 7 и 8.
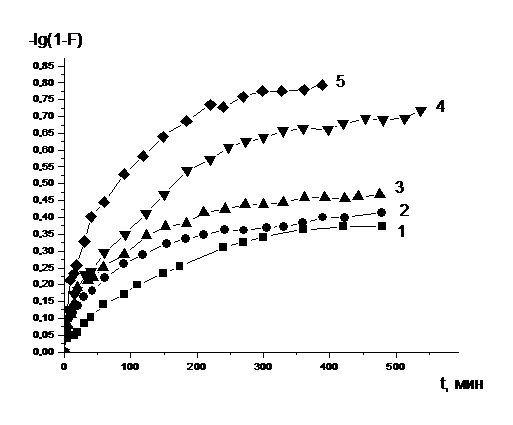
1 - 20, 2 - 30, 3 - 40, 4 -
50, 5 - 60 ºС
Рисунок 7 - Зависимость - lg (1-F) от t при сорбции хрома (III) на ионите S930/4757 при разной Т, Сисх (Cr) = 0,02 моль/л; d=0,5-1,0 мм
Как видно, результаты обработки первичных экспериментальных данных
оказались неоднозначны. Ход зависимостей - lg (1-F) от t, а именно, выпуклый характер этих зависимостей, а именно,
отклонении от прямой на начальном участке графиков, что характерно для
процессов, протекающих во внутридиффузионной области, казалось бы,
свидетельствует о том, что скоростьопредляющей стадией сорбции хрома (III) должна являться внутренняя диффузия. В
то же время, отклонение от прямой при низких значениях F зависимостей F от Öt должны свидетельствовать о том, что скоростьлимитирующей
стадией этого процесса, должна являться внешняя диффузия или химическая реакция
(ход критериальных зависимостей ионнообменных процессов, протекающих во
внешнедиффузионной области, и процессов, скорость которых определяется
скоростью химической реакции, одинаков [21]). О том, что скоростьлимитирующей
стадией процесса сорбции хрома (III) на
иминодикарбоксильном ионите может являться химическая реакция свидетельствуют и
тот факт, что скорость достижения равновесия не зависит от размера зерен
ионита.

- 20, 2 - 30, 3 - 40, 4 - 50, 5 - 60 ºС
Рисунок 8 - Зависимость F от √t при сорбции хрома на ионите S930/4757 при разных Т, Сисх (Cr) =0,0 2 моль/л; d=0,5-1,0 мм
Исходя из этого, можно предположить, что влияние на скорость
сорбции хрома (III) на иминодикарбоксильном ионите S930/4757 может оказывать и скорость реакции комплексообразования
хрома (III), и внутренняя диффузия. Т.е., возможно,
имеет место смешанный механизм сорбции. Для более точного определения скорость
определяющей стадии кинетики сорбции хрома (III) необходимо провести дополнительные эксперименты.
На основании температурных зависимостей времени полусорбции хрома
(III) была произведена оценка значений
эффективной энергии активации. Зависимости логарифмов времени полусорбции хрома
(III) на иминодикарбоксильном ионите S930/4757 от обратной температуры приведены на рисунке 9.
Полученное значения энергии активации (44,3 ± 5,9 кДж\моль) свидетельствуют
о том, что скорость лимитирующей стадий процесса сорбции хрома (III) на иминодикарбоксильном ионите S930/4757 не может быть внешняя диффузия, поскольку значения
энергии активации при внешнедиффузионной кинетике не должны превышать 15
кДж\моль. Значения энергии активации, характерные для внутридиффузионных
процессов, не могут превышать 50 кДж\моль. Значения энергии активации
процессов, скорость определяющей стадией которых является химическая реакция,
как правило, еще выше.

Рисунок 9 - Зависимость логарифмов времени полусорбции хрома (III) на иминодикарбоксильном ионите S930/4757 от обратной температуры
Таким образом, определенное в работе значения энергии активации
сорбции хрома (III) на иминодикарбоксильном ионите S930 находится на верхней границе значений, характерные для
внутридиффузионных процессов. Поэтому вполне вероятно, что скорость процесса
сорбции хрома (III) на ионите S930, определяется одновременно, и скоростью химической реакции и
скоростью диффузии внутри зерен ионита.
4.3 Изучение
кинетики десорбции хрома (III)
Эффективность десорбции определяется не только полнотой
десорбции в условиях достижения равновесия, но и скоростью десорбции. Для
оценки скорости десорбции хрома были проведены опыты по изучению кинетики
десорбции хрома из предварительно насыщенного им ионита S930/4757. Емкость всех
навесок ионита после насыщения хромом (III), составила 1,32
ммоль/г. Десорбцию проводим 1 М раствором серной кислоты.
Предварительные опыты показали, что скорость десорбции при
комнатной температуре из ионита S930 низка и заметно увеличивается с повышением температуры.
Тем не менее, при контактировании насыщенного хромом ионита с 1 М раствором
серной кислоты при комнатной температуре в течение 2 месяцев привело к
практически полной десорбции хрома. Таким образом, при проведении десорбции при
любой температуре (начиная с 20 оС) достигается полная десорбция
хрома.
Результаты изучения кинетики десорбции хрома (III) приведены на рисунках
10 - 13.

- 20 оС, 2 - 30 оС, 3 - 40 оС, 4
- 50 оС, 6 - 60 оС (d=0,5 - 1,0 мм),
- 60 оС (d=0,25 - 0,5 мм)
Рисунок 10 - Зависимость значений степени достижения равновесия десорбции
хрома (III) из ионите S930/4757 от времени при разных температурах и зернении
Из рисунков 10 и 11 видно, что скорость десорбции хрома (III) весьма сильно зависит от температуры,
еще в большей степени, чем скорость его сорбции на том же ионите.
Далее были построены критериальные зависимости - lg (1-F) от t и F от √t при десорбции
хрома (III), которые приведены на рисунках 11 и 12.
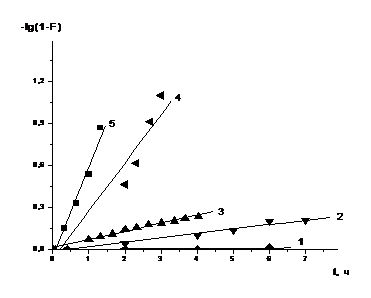
1 - 20, 2 - 30, 3 - 40, 4 - 50, 5 - 60 оС
Рисунок 11 - Зависимость - lg (1-F) от t при десорбции хрома (III) из
ионита S930/4757 при разной температуре, d=0,5-1,0
мм

- 20, 2 - 30, 3 - 40, 4 - 50, 6 - 60 ºС (d=0,5-1,0 мм), 5 - 60 ºС (d=0,25-0,5 мм)
Рисунок 12 - Зависимость F от Öt при десорбции хрома (III) из ионита S930/4757 при
разной температуре
Из характера зависимостей F от Öt и - lg (1-F) от t, а также с учетом независимости скорости десорбции хрома от
размера гранул ионита можно высказать предположение, о том, что скорость
лимитирующей стадией процесса десорбции хрома из иминодикарбоксильного ионита S930/4757 является химическая реакция.
На основании температурной зависимости значений времени,
необходимого для достижения 20% -ной десорбции хрома (III) из иминодикарбоксильного ионита S930/4757 (рисунок 13) была дана оценка энергии активации.

Рисунок 13 - Зависимость логарифмов времени, необходимого для
достижения 20 % -ной десорбции хрома (III) из
иминодикарбоксильного ионита S930/4757 от
обратной температуры
Полученное значения энергии активации (65,9 ± 4,7кДж\моль) однозначно
свидетельствуют о том, что скорость лимитирующей стадий процесса десорбции
хрома (III) на иминодикарбоксильном ионите S930/4757 являться стадия химической реакции обмена ионов
хрома (III), связанных с функциональными группами
ионита, на протоны.
4.4 Изучение
сорбции и десорбции хрома (III) в динамических условиях
4.4.1
Изучение сорбции хрома (III) в динамических условиях на иминодикарбоксильном
ионите S930/4757
Из литературных источников известно, что сорбция хрома на
иминодикарбрксильных ионита не проходит при комнатной температуре [17]. Тем не
менее, решено было провести исследования по изучению сорбции в динамических
условиях, сорбцию проводили при комнатой температуре (~20 оС) и при
температуре 60 оС.
Сорбция проводилась из растворов состава: 0,5 моль/л по Na2SO4, и 0,022 моль/л по хрому
(III).
Выходные кривые сорбции хрома (III) на ионите S930/4757 приведены на
рисунке 14.
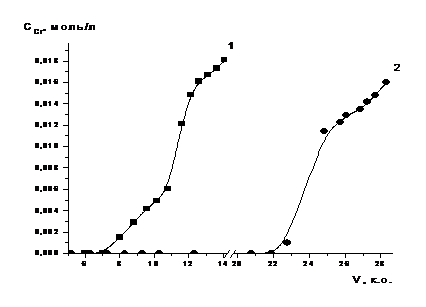
1 - 20 оС, 2 - 60
оС
Рисунок 14 - Выходные кривые сорбции хрома (III) на ионите S930/4757
Из рисунка 14 видно, что проскок хрома, при температуре 20 оС,
наблюдается уже после 7 к. о. пропущенного раствора. Это говорит о том, что
вопреки литературным данным при температуре 20 оС
иминодикарбоксильный ионит в динамических условиях способен к сорбции хрома (III). Концентрация его в растворе на выходе
из колонки быстро возрастает и после пропускания более 14 уд. об. раствора
достигает 75 % от его концентрации в исходном растворе.
При 60 оС проскок наступает только после пропускания 22
к. о., а состояние, близкое к насыщению, - 28 к. о. раствора. Это говорит о
том, что повышение температуры значительно увеличивает способность
иминодикарбоксильного ионита S930 к сорбции
хрома (III).
4.4.2
Изучение десорбции хрома (III) в динамических условиях
Ионит после сорбции промываем водой и проводим десорбцию при
температуре 20 оС и 60 оС, раствором 1 моль/л серной
кислоты. В ходе исследования было выявлено, что при 60 оС десорбция
раствором 1 моль/л серной кислоты протекает медленно, поэтому было решено
повысить концентрацию H2SO4 до 3 моль/л.
Выходные кривые десорбции хрома (III) из ионита S930/4757 приведены на
рисунке 15 - 16.
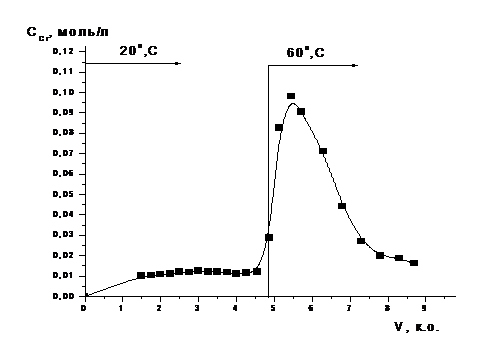
Рисунок 15 - Выходная кривая десорбции хрома (III) из ионита S930/4757
Из рисунка 15 видно, что десорбция при 20 оС протекала
медленно и без существенного концентрирования, поэтому после первого дня
десорбции было решено колонку с ионитом, поместить в термостат и дальнейшую
десорбцию проводить при 60 оС. Повышение температуры привело к
резкому повышению интенсивности десорбции хрома. Сводные данные о сорбции,
десорбции хрома на ионите S930/4757
представлены в таблице 6.
Таблица 6 - Сводные параметры сорбции и десорбции хрома (III) из ионита S930/4757, при 20 оС
и 60 оС
|
Сорбировано,
мг/см3
|
Темпе-ратура, оС
|
Десорбиро-воно,
мг/см3
|
% десорбции
|
Σ
десорбированного
|
|
ДОЕ
|
ПДОЕ
|
|
|
|
мг/см3
|
%
|
|
0,154
|
0,252
|
20
|
0,05
|
19,8
|
0,24
|
95,2
|
|
|
60
|
0, 19
|
75,4
|
|
|
Как следует из таблицы 6, основное количество хрома
десорбируется из ионита при температуре 60 оС, что, как следует из
предыдущего раздела, связано с ускорением процесса десорбции.

Рисунок 16 - Выходная кривая десорбции хрома при 60 оС
из ионита S930/4757
Из рисунка 16 видно, что из ионита, насыщенного хромом при 60 оС
и имеющем емкость в 2,2 раза более высокую по сравнению с ионитом, насыщенным
при 20 оС, 1М раствором H2SO4. хром десорбируется, но выходная кривая десорбции растянута.
Повышение концентрации H2SO4 до 3 моль/л привело к обострению кривой десорбции и, тем
самым, эффективности десорбции. Сводные данные о сорбции и десорбции хрома на
ионите S930/4757 при температуре 60 оС
представлены в таблице 7.
Таблица 7 - Сводные параметры сорбции и десорбции хрома (III) из ионита S930/4757 при 60 оС
и разной концентрации H2SO4
|
Сорбировано, мг/см3
|
СH2SO4, моль/л
|
Десорбировано,
мг/см3
|
% десорбции
|
Σ
десорбированного
|
|
ДОЕ
|
ПДОЕ
|
|
|
|
мг/см3
|
%
|
|
0,484
|
0,554
|
1
|
0,295
|
53,2
|
0,52
|
93,8
|
|
|
3
|
0,225
|
40,6
|
|
|
Заключения и
выводы
1. Показано, что ион хрома (III) начинает сорбироваться
на ионитах с различными функциональными группами при рН~ 1,5 - 2,0. При этом из
опробованных ионитов наиболее высокую емкость имеет иминодикарбоксильной ионит S930/4757, вслед за ним
следуют анионит с полиэтиленполиаминными функциональными группами S985, карбоксильный
катионит С107 и затем фосфорнокислотный катионит D5041. Вопреки
литературным данным, на сульфокатионите С150 ион хрома (III) не сорбируются.
2. В результате изучения кинетики сорбции хрома (III) на ионите S930/4757 установлено, что
скорость этого процесса может лимитироваться одновременно внутренней диффузией
и скоростью химической реакции. Дана оценка энергии активации процесса сорбции
хрома (III) (44,3 ± 5,9 кДж/моль)
. Установлено, что скорость лимитирующей стадии
десорбции хрома (III) из ионита S930/4757 раствором 1моль/л H2SO4 является скорость
химической реакции. Энергия активации процесса десорбции хрома (III) составила 65,9 ±
4,7кДж\моль.
. При изучении сорбции хрома (III) на иминодикарбоксильном
ионите S930/4757
в динамических условиях показано, что повышение температуры позволяет повысить
как емкость до проскока, так и полную динамическую емкость ионита по хрому (III). Еще в большей степени
повышение температуры облегчает проведение десорбции хрома и способствует
повышению полноты десорбции.
Список
использованных источников
1. Джуа,
М. История химии / М. Джуа. - М.: "Мир", 1966. - 452с.
2. Виниградов,
А.П. Геохимия / А.П. Виноградов. - 1966. - 555 с.
. Джеффери,
П. Химические методы анализа горных пород
. / П.
Джеффери. - М.: "Мир", 1973. - 472с.
. Гринберг,
А.А. Введение в химию комплексных соединений / А.А. Гринберг. - Изд. Химия. - 3
изд., 1966. - 632с.
. Лаврухина,
А.К. Аналитическая химия хрома / А.К. Лаврухина, Л.В. Юкина и др. - М.:
"Наука", 1979. - 219 с.
. Даймонд,
Р. Уитней Д. Селективность ионитов в разбавленных и концентрированных растворах
/ Под ред.Я. Маринского - М.: Мир, 1968. - С.174-280.
. Авербух,
Т.Д. Технология соединений хрома / Т.Д. Авербух, П.Г. Павлов. - Л:
"Химия", 1973. - 336 с.
. Коттон,
Ф. Современная неорганическая химия / Ф. Коттон, Дж. Уилкенсон. - М.:
"Мир", 1969. - 592с.
. Роде,
Т.В. Кислородные соединения хрома и хромовые катализаторы / Т.В. Роде. - Изд АН
СССР, 1962. - 280с.
. Есин,
О.А. Физическая химия пирометаллургических процессов / О. А Есин, П.В. Гельд. -
Гидрометаллургиздат, 1962. - 674с.
. Самсонов,
В.Г. Свойства элементов. Справочник. Физические свойства / Под ред.В.Г.
Самсонова. - М.: "Металлургия", 1976. - 384с.
. Лурье,
Ю.Ю. Химический анализ производственных сточных вод / Ю.Ю. Лурье, А.И.
Рыбникова. - М.: "Химия", 1958. - 210с.
. Тютюнова,
Ф.И. Анализ химического состава подземных вод, загрязненных промышленными
стоками / Ф.И. Тютюнова. - М.: Стройиздат, 1974. - 114с.
. Лебедев,
К.Б. Иониты в цветной металлургии / Под ред.К.Б. Лебедева - М.:
"Металлургия", 1975. - 350с.
. Самуэльсон,
О. Ионообменные разделения в аналитической химии / О. Самуэльсон.М. - Л.:
"Химия", 1966. - 416с.
. Пономарев,
А.И. Методы химического анализа железных, титаномагнетитовых и хромовых руд /
А.И. Пономарев. - М.: "Наука", 1966. - 408с.
. Херинг,
Р. Хелатообразующие ионообменники / Р. Херинг. - М.: Мир, 1971. - 194 с.
. Марченко,
З. Фотометрическое определение элементов / З. Марченко. - М.: Мир, 1971. -
502с.
. Мархол
М. Ионообменники в аналитической химии: в 2-х частях. - М.: Мир, 1985. - 545с.
. Гельферих
Ф. Иониты. Основы ионного обмена. М.: ИЛ, 1962.491 с.
. Кокотов
Ю.А., Пасечник В.А. Равновесие и кинетика ионного обмена. М.: Химия, 1970.336 с.
. ГОСТ
12.0.003-74 ССБТ Опасные и вредные производственные факторы. Классификация
. НБП-05-95
Определение категорий помещений и зданий по взрывопожарной и пожарной
опасности.
. Вредные
вещества в промышленности: Справ. / Под. ред. Н.В. Лазарева. -
Т.2-Неорганические и металлорганические вещества. - Химия, 1971. - 624с.
. Бандман,
А.Л. Вредные химические вещества. Неорганические соединения элементов I-IV групп: Справ. Изд. / А.Л. Бандман, Г.А. Гудзовский, Л.С.
Дубейковская и др.; Под ред.В.А. Филова и др. - Л.: Химия, 1988-512с.
. ГОСТ
12.1.005-88 ССБТ Воздух рабочей зоны. Общие санитарногигиенические требования.
. Пряников,
В.И. Техника безопасности и промышленная санитария: Справ. Для работников
химической промышленности. - Т2/В.И. Пряников, А.И. Родионова. - М.: Химия,
1979-270с.
. Правила
эксплуатации электроустановок потребителей (ПЭЭП-92) М.: Энергоатом издат,
1992. - 228 с.
. Инструкция
по безопасности проектирования ИБП 105-95. Определение категорий помещений и
зданий по взрывопожарной и пожарной опасности. - М.: Стройиздат, 1995. - 26 с.
. СНиП
23-5-95 Естественное и искусственное освещение производственных помещений. -
М.: Стройиздат. - 1980
. ГОСТ
12.4.021-88 ССБТ Системы вентиляционные. Общие требования.
. СТП
СПбГТИ 017-97 Виды учебных занятий. Положение о выпускной работе
дипломированного специалиста. Общие требования / 21 с.
. Р01-2007 Библиографическое описание
документа. Примеры оформления. - Введ. 2008-01-01. - М.: Госстандарт России:
Изд-во стандартов, 2008. - 11с.
. СТП
СПбГТИ 006 - 2005 Подготовка и оформление авторских текстовых оригиналов для
издания / 2005. - 32с.
. ГОСТ
8.417-2002 ГСИ. Единицы величин. - взамен ГОСТ 8.417-81; введен. 2003-09-01. -
Минск: Межгос. Совет по стандартизации, метрологии и сертификации; М.: Изд-во
стандартов, 2003. - 27с. - (Государственная система обеспечения единства
измерений)
Приложения
Приложение А
Патентный поиск
Целью патентного поиска являлось выявление аналогов и
прототипов разрабатываемого технологического процесса. В ходе работы были
изучены следующие патенты и авторские свидетельства, посвященные проблеме
извлечения хрома:
Таблица А.1 - Перечень отобранных в процессе поиска аналогов
|
Страна
|
№ заявки или
охранного документа (а. с. или патента)
|
Название
изобретения
|
Дата публикации
|
|
РФ
|
2094377
|
Способ
извлечения хрома (VI) на анионите АМ - 2Б
|
1997
|
|
РФ
|
2230794
|
Способ
регенерации отработанных растворов хромового дубления
|
20.06.2004
|
Приложение Б
Маркетинговое исследование
Настоящая дипломная работа носит поисковый характер. Целью
НИР, в составе которой выполнена работа, является ионообменное извлечение хрома
(III) из сульфатных
растворов.
Потенциальными потребителями данной идеи является
промышленное производство. Наиболее привлекательной стратегией для продвижения
результатов разработки на рынок представляется стратегия целевого маркетинга. С
целью анализа рынка возможной реализации результатов работы были проведены
маркетинговые исследования, в ходе которых в качестве целевого сегмента рынка
была выбрана отрасль по очистке сточных вод.
В настоящее время потенциальным потребителем результатов
проведенных исследований ионообменного извлечения хрома из сульфатных растворов
могут быть, как промышленные предприятия стран СНГ (Украина, Белоруссия,
Узбекистан, Кыргызстан), так и стран дальнего зарубежья (Израиль, Китай), так и
финансовые структуры (банки, фирмы), готовые вложить средства в разработку данной
технологии, которые и могут стать наиболее вероятными потребителями. А также в
качестве потенциальных инвесторов может выступать и государство. Перечисленные
ниже характеристики разработки, а также получение высоких степеней извлечения
данного металла из содержащих примеси растворов делают настоящую идею
привлекательной для инвестирования средств.
Предлагаемая к промышленному освоению идея обладает
следующими принципиальными отличиями (преимуществами):
1) Метод ионообменного извлечения хрома обладает высокой
эффективностью
) Возможность экономии дорогостоящих реагентов
) Возможность применения более простого и дешевого
оборудования
Любое усовершенствование технологии принесет весьма ощутимые
прибыли. Одним из препятствий является малоизученность данного метода, а так же
отсутствие практических рекомендаций для крупнотоннажного производства.
В ходе анализа запатентованных работ были обнаружены сведения
по извлечению хрома из сточных вод, но эти методики с практической точки зрения
не рентабельны, по причине их сложной технологической составляющей и больших
экономических затрат.
Приложение В
Стандартизация
Состав работы и содержание ее основных частей соответствует
СТП СПбГТИ 017-97. Виды учебных занятий. Положение о выпускной квалификационной
работе дипломированного специалиста (инженера). Общие требования.
Библиографическое описание соответствует рекомендациям Р 01-97.
Библиографическое описание. Оформление пояснительной записки выполнено согласно
требованиям СТП СПБГТИ 006-2005. Подготовка и оформление авторских текстовых
оригиналов для издания. Порядок проведения научно-исследовательских работ
соответствовал ГОСТ 7.32-2001 СИБИД. Отчет о научно-исследовательской
работе. Общие требования и правила оформления.
При составлении библиографического описания сокращения слов и
словосочетаний руководствовались ГОСТ 7.12-77 СИБИД. Сокращение
русских слов и словосочетаний в библиографическом описании.
Единицы физических величин приведены в соответствии с ГОСТ
8.417-2002. Единицы величин.
При выполнении экспериментальной части дипломной работы
соблюдались санитарные нормы и правила согласно:
1) ГОСТ 12.0.003-74 ССБТ. Опасные и
вредные производственные факторы.
2) ГОСТ 12.1.005-88 ССБТ. Воздух рабочей
зоны. Общие санитарно-гигиенические требования.
3) СНиП 23-05-95 Естественное и
искусственное освещение производственных помещений.
4) ГОСТ 12.4.021-75 ССБТ. Системы
вентиляционные. Общие требования.
Использованные в работе сырье и материалы соответствовали:
|
Серная кислота
|
ГОСТ 4204-77
|
|
Хлорид натрия
|
ГОСТ 4233-77
|
|
Тиомочевина
|
ГОСТ 6344-73
|
|
Иодид калия
|
ТУ
6-09-3909-75
|
|
Соляная кислота
|
ГОСТ 3118-77
|
|
Хлорид олова
|
ТУ
6-09-5393-88
|
|
Хлорид меди (II)
|
ГОСТ 4167-61
|
|
Карбонат свинца
|
ГОСТ 3177-52
|
|
Хлорид алюминия
|
ГОСТ 4452-48
|
|
Хлорная кислота
|
ТУ ОРУ-87-57
|
|
Гексахлорородиат
(ΙΙΙ) натрия
|
ТУ 6-09-2024-78
|
|
Аскорбиновая
кислота
|
ГОСТ 3652-69
|
|
Хлорид железа (ΙΙΙ)
|
ГОСТ 4147-74
|
|
Карбонат церия
|
ТУ 48-4-523-90
|
При постановке экспериментов и обработке их результатов
использовался:
СТП ЛТИ 2.075.008-81 КС УКДВ. Методы
обработки результатов наблюдений. Прямые измерения с многократными
наблюдениями.
Приложение Г
Охрана труда и окружающей среды
Охрана окружающей среды и здоровья людей - первоочередная
задача любого государства, которое хочет иметь свое будущее. Поэтому необходимо
повышать эффективность мер по охране природы, шире внедрять малоотходные и, по
возможности, безотходные технологические процессы, развивать комбинированные
производства, обеспечивающие полное и комплексное использование природных
ресурсов, сырья и материалов, исключающие или существенно снижающие вредное
воздействие на окружающую среду.
Экспериментальная часть настоящей дипломной работы была
выполнена в лаборатории Санкт-Петербургского государственного Технологического
института (Технического университета), № 10 кафедры технологии редких и
рассеянных элементов.
Опасные и вредные производственные факторы, имевшие место в
данной работе подразделяются на физические и химические [22]. К физическим
факторам относятся:
напряжение в электрической цепи, замыкание которой может
произойти через тело человека;
острые кромки стеклянной посуды
Химические факторы по характеру воздействия на организм
человека делятся на токсические и на раздражающие, также они подразделяются по
пути проникновения в организм человека:
через органы дыхания
через кожные покровы.
Характеристика основных производственных отходов сведена в
таблицу П. Г.2.
Характеристика использованных в работе веществ и материалов
представлена в таблице П. Г.3.
Технологические операции, проводившиеся в работе, рассмотрены
в таблице П. Г.4.
1.
Общая характеристика помещения
Помещение лаборатории по НПБ 105 - 95 [23] относится к
категории В4 (q=40
МДж/м2) пожарной опасности, как помещение, где проводятся работы с
небольшими количествами легковоспламеняющихся жидкостей (ЛВЖ) и горючих
веществ, недостаточных для создания взрывоопасной смеси в зоне, превышающей 5%
свободного объема помещения [24].
Лаборатория, где проводилась данная работа, по ПУЭ относится
к классу В-1б [25, 26], как помещение, в котором работа ведётся с небольшими
Продолжение приложения Г
количествами легковоспламеняющихся веществ и горючих газов в
вытяжных шкафах. Работа с ЛВЖ проводится без применения открытого пламени
(пожарная зона П - II).
Основными источниками тепловой энергии в лаборатории, представляющими
потенциальную пожарную опасность являются: газовая горелка, муфельная печь,
электроплитка, а также прочие электроприборы в случае их неисправности.
Для устранения указанных опасностей были предприняты
следующие меры:
перед работой был проведен инструктаж по ТБ, согласно [29]
разработанным на кафедре инструкциям;
все виды работ проводились в халате;
все работы с едкими жидкостями, и токсичными веществами
проводились на подносе под вытяжным шкафом;
при работе соблюдались правила электробезопасности (все
приборы имели зануление, перед и во время работы производилась проверка
состояния изоляции, качества зануления);
·
при
возникновении неисправностей приборы, отключались от сети, и об этом немедленно
сообщалось руководителю работ.
2.
Техника безопасности при работе с электрооборудованием
Лаборатория характеризуется следующими условиями, создающими
опасность поражения электрическим током:
Возможность одновременного прикосновения человека к имеющим
соединения с землей металлоконструкциям зданий, технологическим аппаратам,
механизмам и т.п., с одной стороны, и к металлическим корпусам
электрооборудования - с другой;
) Химически активная или органическая среда (разрушающая
изоляцию и токоведущие части электрооборудования);
Класс помещения по опасности поражения человека электрическим
током относится к помещениям с повышенной опасностью [28], так как существуют
условия, создающие опасность поражения электрическим током:
Все приборы, использовавшиеся при проведении работ, питались
от сети с напряжением 220В и промышленной частоты 50 Гц. Для обеспечения
электробезопасности все работы проводились в соответствии с ГОСТ 12.1.019-79
ССБТ.
Для исключения поражения электрическим током были проведены
следующие мероприятия:
· перед началом работы, при монтаже электроустановки
проверялась исправность всех приборов, их заземление и качество изоляции
проводов.
Продолжение приложения Г
· приборы эксплуатировались согласно
правилам техники безопасности принятым в лаборатории, в строгом соответствии с
техническими описаниями и инструкциями по эксплуатации указанных приборов.
· во время перерывов подачи электроэнергии,
при неисправностях в работе приборов все оборудование немедленно выключалось.
Работа относится к разряду IV-в (средней точности). Норма
освещенности составляла 200 Люкс СНиП 23-05-95. Доля естественного освещения в
лаборатории составляет 25%. Для искусственного освещения используются лампы
дневного света. Работы с концентрированными растворами кислот проводились в
вытяжном шкафу [31]. Скорость движения воздуха в рабочем проеме - 1,6 м/с.
соответствует классу опасности веществ по ГОСТ 12.1.007 - 74. Вентиляция
обеспечивается приточно-вытяжной вентиляцией и местной вентиляцией - два
вытяжных шкафа (Кв=3,5-3,8 ч-1) [31].
Средства тушения пожара:
вода;
ящик с песком;
асбестовое одеяло.
В коридоре кафедры находится огнетушитель ОХВП - 10, ОУ - 2.
3.
Меры первой медицинской помощи пострадавшим
1. При химических ожогах пораженное место промывают струёй
воды из под крана в течении длительного времени (15 мин). Далее при ожогах
кислотами и кислотоподобными прижигающими веществами накладывают примочки 2 %
раствором бикарбоната натрия, а при ожоге щелочами - 2 % -ным раствором
уксусной кислоты (лимонной). При попадании в глаза необходимо немедленное
промывание глаз водой с помощью душа или водяного фонтанчика в течении 10 - 15
мин. Затем промывают 2% бикарбонатом натрия. При резких болях закапывают 1-2
капли 1 % -го раствора новокаина. Если в глаза попала щелочь, то сначала
промывают их водой 5-10 мин. и затем изотоническим раствором хлорида натрия
30-60 мин. После промывки немедленно обратиться к врачу.
. При отравлениях необходимо вывести пострадавшего на свежий
воздух или в проветриваемое помещение. Пострадавшего необходимо уложить,
создать ему полный покой, укрыть и ждать врача.
. При порезах: если при порезе вытекает кровь темная, то
необходимо наложить на рану давящую повязку. Если кровь алая и вытекает
пульсирующей струйкой, то остановку кровотечения проводят путем наложения жгута
или полного сгибания конечности в суставе и фиксации ёё в таком положении с
помощью ремня или бинта. Промывка раны только при необходимости. Далее
немедленно вызвать врача или доставить пострадавшего в здравпункт.
. Поражение электрическим током: необходимо освободить
пострадавшего от действия тока (выключением общего рубильника). Затем
немедленно вызвать врача. При потере сознания необходимо проверить пульс и
дыхание если есть, то положить пострадавшего на спину и повернуть голову в
сторону. Для приведения в чувства обрызгать лицо холодной водой, дать понюхать
вату, смоченную нашатырным спиртом. Если пульс и дыхание слабое или
отсутствует, то до прихода врача необходимо срочно сделать искусственное
дыхание и массаж сердца.
. При термическом ожоге следует обработать область ожога и
прилегающую к ней бактерицидным средством, например, слабым раствором
марганцовокислого калия, и наложить сухую марлевую повязку.
В лаборатории находилась аптечка для оказания пострадавшим
первой медицинской помощи. В ее состав входят следующие медикаменты:
приготовленный 2 % раствор бикарбоната натрия, раствор борной кислоты, перекись
водорода, анальгин, амидопирин, 2.5 % раствор перманганата калия, нашатырный
спирт, йод, бинты, вата, жгут [27].
При проведении работы руководствовались следующими
инструкциями по технике безопасности:
Инструкция по охране труда при работе с едкими веществами.
рег. № 451, срок действ. до 17.06.2009
Инструкция по охране труда при работе эксплуатации
электроприборов и электроустановок и оказанию первой помощи пораженным
электрическим током. рег. № 732, срок действ. до 17.06.2009
Инструкция по охране труда и техники безопасности при работе
на персональных ЭВМ рег. № 123, срок действ. до 17.06.2009.
Инструкция по технике безопасности и охране труда при работе
со стеклянной химической посудой рег. № 152, срок действ. до 17.06.2009
Инструкция по охране труда при эксплуатации множительной
техники рег. № 751, срок действ. до 17.06.2009
О мерах пожарной безопасности на кафедре технологии редких и
рассеянных элементов рег. № 772, срок действ. до 17.06.2009
4. Аптечка и ее содержание
В препараторской на кафедре находится аптечка,
укомплектованная в соответствии с ТУ 9398-001-46930922-97. Содержимое аптечки
представлено в таблице Г.1.
Таблица Г.1 - Содержимое аптечки на кафедре ТРРЭ
|
Название
препарата
|
Количество, шт.
|
|
корвалол
|
2
|
|
настойка
пустырника
|
2
|
|
настойка
боярышника
|
2
|
|
настойка
валерианы
|
2
|
|
перекись
водорода 3% раствор
|
2
|
|
аммиак водный
10% раствор
|
1
|
|
настойка йода
|
1
|
|
бинт стерильный
5Х10
|
3
|
|
вата 250гХ60
|
1
|
|
кордиамин
|
1
|
|
анальгин
|
2
|
|
парацетамол
|
2
|
|
цитрамон
|
2
|
|
андипал
|
2
|
|
уголь
активированный
|
3
|
|
валидол
|
2
|
|
нитроглицерин
|
1
|
5. Санитария и гигиена
Таблица Г.2 - Характеристика производственных отходов
|
Наименование
отходов
|
Агрегатное
состояние
|
Характеристика
отходов
|
Место сброса
|
Количество
отходов
|
|
1) Водные
растворы после анализа
|
жидк.
|
ПАВ, реактивы
|
хранение и
дальнейшая утилизация после нейтрализации
|
100 л.
|
|
2) Битое стекло
|
Тверд.
|
-
|
Сборник твердых
отходов
|
0,05 кг.
|
|
Наименование
отходов
|
Агрегатное
состояние
|
Характеристика
отходов
|
Место сброса
|
Количество
отходов
|
|
3)
Вентиляционные выбросы
|
газ.
|
Пары реактивов
|
Атмосфера
|
0,03 м3
|
Водные, соляно-кислые растворы, содержащие редкие металлы
собирались в специальные емкости для последующей переработки;
отработанные растворы сливались в специальные емкости и в
дальнейшем централизованно вывозились на захоронение [25].
Таблица Г.3 - Физико-химические и токсические свойства
используемых веществ
|
Вещества
|
Физико-химические
свойства [25]
|
Токсические
свойства [25]
|
|
Агрегатное
состояние
|
T кип, °С
|
T пл, °С
|
Плотность, г/см3
|
Характеристика
действия на организм человека
|
Класс опасности
|
ПДКр. з., мг/м3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4
|
ж
|
330
|
10,35
|
1,834
|
Тяжелые ожоги,
раздражает слизистые, токсодействие.
|
1
|
1
|
|
HNO3
|
ж
|
83
|
-41,6
|
1,513
|
Токсична,
вызывает пожелтение кожи, хим. ожоги, язвы
|
II
|
|
NaOH
|
ж
|
1388
|
328
|
2,130
|
Тяжелые ожоги
кожи и глаз.
|
II
|
0.5 (аэразоль)
|
|
|
|
|
|
|
|
|
|
Таблица Г.4 - Анализ технологических операций с точки зрения
опасности и вредности их проведения [27]
|
Наименование
технологических операций
|
Оборудование
для проведения операций
|
Необходимые
реактивы и материалы
|
Возможные
опасности и вредности
|
Причины
появления опасности
|
Меры по
безопасному проведению данной операции
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
Приготовление
растворов
|
Термостойкий
стеклянный стакан, стеклянная палочка, плитка.
|
Концентрированная
серная кислота, сульфаты металлов, дистилл. вода.
|
1) Химический
ожог; 2) Раздражение слизистых оболочек глаз, носа и рта
|
Попадание на
кожу, вдыхание паров, попадание в глаза
|
Работать под
тягой, в халате и резиновых перчатках
|
|
Приготовление
растворов для сорбции
|
Мерная посуда,
стеклянная пипетка, резиновая груша.
|
Растворы
сульфатов металлов, сорбент, дистилл. вода.
|
1) Порезы, 2)
Отравление, 3) Химический ожог.
|
Бой посуды,
попадание в-в на кожу
|
Работать в
халате, резиновых перчатках, осторожно пользоваться посудой
|
|
Проведение
сорбции.
|
Колбы
|
То же
|
1) Порезы.
|
Бой посуды
|
Работать в
халате, резиновых перчатках
|
|
Анализ
растворов.
|
Мерная посуда,
колбы, пипетки, эл. плитка.
|
Рабочие
растворы.
|
1) Химический
ожог,2) порезы, 3) поражение электрическим током.
|
Попадание
растворов на кожу, бой посуды, нарушение изоляции или зануления.
|
Работать в
халате, резиновых перчатках, перед включением проверить исправность изоляции
и зануления.
|
Приложение Д
Технико-экономическая оценка результатов исследования
1. Расчет затрат на проведение исследовательской работы
Затраты на проведение разработок состоят из текущих и
капитальных. Капитальные затраты в данной работе не имеют места, так как
специальные приборы и монтаж дополнительного оборудования не потребовались для
проведения опытов.
В состав текущих затрат входят
· затраты на реактивы,
· затраты на различные виды энергии,
· заработную плату исполнителя,
руководителя, привлеченных лиц,
· затраты на стеклянную посуду,
· амортизационные отчисления от стоимости
лабораторного оборудования и приборов, а также накладные расходы.
Для определения общей суммы текущих затрат составляется
смета, содержащая все текущие затраты на выполнение работы.
Затраты на реактивы, израсходованные на проведение исследования,
определяются следующим образом:
Зр = åРi ∙ Цi,
где Рi− расход i−го вида материальных ресурсов, натур. ед.,
Цi− планово-заготовительная цена i−го вида
материальных ресурсов, руб.
Результаты расчета затрат на реактивы приведены в таблице
Д.1.
Таблица Д.1 - Расчет затрат на реактивы
|
Наименование
сырья, материалов, реактивов
|
Техническая
характеристика
|
Ед. изм.
|
Количество
израсходованного материала
|
Цена по
каталогу, руб.
|
Сумма, руб.
|
|
H2SO4
|
ЧДА
|
л
|
0,1
|
52,00
|
5, 20
|
|
Na2SO4
|
ЧДА
|
кг
|
1,0
|
52,00
|
52,00
|
|
HCl
|
ХЧ
|
кг
|
0,1
|
40,90
|
4,9
|
|
Аммиак водный
|
ЧДА
|
л
|
0,2
|
42,00
|
8,40
|
|
NaOH
|
ЧДА
|
л
|
0,2
|
54,00
|
10,80
|
|
CH3COOH
|
ХЧ
|
л
|
0,2
|
82,00
|
16,4
|
|
Cr2
(SO4) 3·18H2O
|
ИМП
|
кг
|
0,2
|
220,00
|
44,00
|
|
ЭДТА
|
ЧДА
|
кг
|
0,2
|
425,00
|
85,00
|
|
Гидроксиламин
гидрохлорид гидрохлорид гидрогидрохлорид
|
ЧДА
|
кг
|
0,05
|
465,00
|
23,25
|
|
S930
|
|
л
|
0,1
|
198,00
|
19,80
|
|
C107
|
|
л
|
0,05
|
165,00
|
8,25
|
|
C150
|
|
л
|
0,05
|
165,00
|
8,25
|
|
D
5041
|
|
л
|
0,05
|
198,00
|
9,9
|
|
S985
|
|
л
|
0,05
|
231,00
|
11,55
|
|
Итого:
|
307,1
|
2. Расчет энергетических затрат
В состав энергетических затрат входят затраты на электроэнергию,
воду, израсходованных в процессе исследования.
а) Затраты на электроэнергию определяются следующим образом:
Зэ = М ∙ Ки ∙ Т ∙ Ц,
где М − потребляемая мощность электроприборов,
использованных при проведении исследования, кВт;
Ки = 0,8 − коэффициент использования
мощности электрооборудования;
Т − время работы электрооборудования за все время
работы, часов;
Ц − цена 1 кВт×ч электроэнергии, руб.
Результаты расчета энергетических затрат представлены в
таблице Д.2. Цена за 1 кВт×час энергии составляет 1,70 руб.
Таблица Д.2 - Расчет потребляемой энергии
|
Наименование
приборов
|
Потребляемая
мощность М, кВт
|
Время работы Т,
час.
|
Количество эл.
- энергии, кВт∙ч
|
|
1. Сушильный
шкаф
|
2
|
100
|
200
|
|
2. Дистиллятор
|
7,2
|
200
|
1440
|
|
3. Вытяжной
шкаф
|
1,5
|
400
|
600
|
|
4. Термостат
|
1
|
90
|
90
|
|
5.
Электронагреватель
|
1
|
90
|
90
|
|
6.
Аналитические весы
|
0,006
|
50
|
0,3
|
|
7. ЭВМ
|
0,5
|
100
|
50
|
|
8. pH метр
|
0,2
|
100
|
20
|
|
Итого:
|
2490,3
|
Продолжение приложения Д
Зэ = 2490,3 ∙ 0,8 ∙ 1,70 = 3386,8 руб.
б) Расчет затрат на воду:
Зв = åqi ∙ цi,
где
Зв − сумма затрат на воду, руб.;
qi −объем
израсходованной воды, м3;
цi - цена холодной и дистиллированной воды за 1 м3,
руб. /м3.
Источником горячей и дистиллированной воды в лаборатории
является дистиллятор, поэтому расход холодной воды представляет собой сумму
расходов на лабораторные нужды, на охлаждение дистиллятора и на получения
дистиллированной воды.
Суммарный расход воды с учетом канализации составил 27 м3.
Цена обычной холодной воды 30 руб. /м3, тогда затраты на воду
составят:
Зв = 30 ∙ 27 = 810 руб.
3. Расчет затрат на стеклянную посуду
Таблица Д.3 − Расчет затрат на стеклянную посуду
|
Наименование
|
Объем, мл.
|
Количество, шт.
|
Цена, руб/шт.
|
Сумма, руб.
|
|
Колба мерная
|
25
|
10
|
50, 20
|
502,00
|
|
Колба мерная
|
100
|
3
|
51,40
|
154, 20
|
|
Колба мерная
|
500
|
1
|
107,40
|
107,40
|
|
Колба мерная
|
1000
|
1
|
393,80
|
393,80
|
|
Стакан хим.
|
500
|
1
|
68,90
|
68,90
|
|
Стакан хим.
|
250
|
1
|
37,40
|
37,40
|
|
Стакан хим.
|
100
|
2
|
9,40
|
18,8
|
|
Пипетка
стеклянная
|
1
|
2
|
48,00
|
96,00
|
|
Пипетка
стеклянная
|
2
|
2
|
48,00
|
96,00
|
|
Пипетка
стеклянная
|
5
|
2
|
48,00
|
96,00
|
|
Пипетка стеклянная
|
10
|
2
|
55,00
|
110,00
|
|
Пипетка
стеклянная
|
20
|
2
|
73,50
|
147,00
|
|
Цилиндр мерный
|
25
|
2
|
77,40
|
154,80
|
|
Цилиндр мерный
|
100
|
1
|
112,00
|
112,00
|
|
Колба
коническая
|
50
|
40
|
13, 20
|
528,00
|
|
Итого:
|
2622,30
|
Так как после завершения исследовательской работы посуда была
сдана, то в состав текущих затрат включается только сумма амортизационных
отчислений, которые принимаем 40 % от ее стоимости:
Зп = 0,4 ∙ 2622,30 = 1048,92 руб.
4. Расчет затрат на амортизационные отчисления
Сумма амортизационных отчислений на реновацию А определена,
исходя из стоимости по данным кафедры использованных для выполнения
исследовательской работы оборудования и приборов, годовых норм их амортизации
на реновацию и времени их использования для данного исследования по следующей
формуле:
А = Ф ∙ На ∙ Т / (12 ∙ 100),
где А − сумма амортизационных отчислений;
Ф - стоимость оборудования;
На - годовая норма амортизационных отчислений на
реновацию;
Т - время использования оборудования, мес.
Стоимость, время работы оборудования и результаты вычисления
амортизационных отчислений на реновацию представлены в таблице Д.4
Таблица Д.4 - Стоимость и время работы оборудования
|
Наименование
приборов и оборудования
|
Ф, руб.
|
На, %
|
Т, мес.
|
А, руб.
|
|
Дистиллятор
|
17000
|
8
|
1,4
|
158,7
|
|
Электронагреватель
|
1300
|
9
|
0,2
|
2,0
|
|
Термостат
|
600
|
9
|
0,2
|
0,9
|
|
Сушильный шкаф
|
16400
|
9
|
0,7
|
86,1
|
|
Шкаф вытяжной
|
15800
|
9
|
2,8
|
331,8
|
|
ЭВМ
|
25000
|
17
|
0,7
|
247,9
|
|
pH метр
|
11000
|
10
|
0,7
|
64,2
|
|
Аналитические
весы
|
4300
|
10
|
0,4
|
|
Итого:
|
905,9
|
5. Расчет затрат на заработную плату
Затраты на заработную плату складываются из заработной платы
исполнителя, руководителя, консультантов.
Заработная плата исполнителя (Зисп) исследования
определена путем умножения размера месячной стипендии на число месяцев,
отводимых на выполнение дипломной работы:
Зисп = 2200 ∙ 4 = 8800 руб.
Основная заработная плата руководителя работы (Зрук),
консультанта (Зконс) определяется исходя из суммарной нормы затрат
их рабочего времени на одну дипломную работу (33 и 2 часа соответственно) и
среднечасовой заработной плате (профессор 400 руб/ч; консультант 235 руб/ч).
Зрук = 33 ∙ 400= 13200 руб.
Зконс = 2 ∙ 235 = 470 руб.
Дополнительная заработная плата (Здоп) составляет
20 % от статьи "Основная заработная плата". Отчисления на социальное
страхование (Ззп) составляет 26 % от основной и дополнительной
заработной платы. Итого по заработной плате:
Здоп = (8800+13200+470) ∙ 0,2 = 4494,00 руб.
Ззп = (8800 + 13200 + 470 + 4494) ∙ 0,26 =
7010,64 руб.
Накладные расходы, включающие затраты на содержание
учебно-вспомогательного и управленческого персонала и на хозяйственные нужды,
принимаются в размере 50 % от суммы всех затрат.
Смета текущих затрат на выполнение дипломной работы приведена
в таблице Д.5.
Таблица Д.5 - Смета текущих затрат на проведение работы
|
Наименование
статей затрат
|
Сумма, руб.
|
Доля статей в
общей сумме затрат, %
|
|
1. Сырье,
материалы и реактивы:
|
307,1
|
0,48
|
|
2.
Энергетические затраты: а) электроэнергия б) вода (холодная,
дистиллированная) Итого:
|
|
|
|
3386,8
|
|
|
810,00
|
|
|
4196,8
|
6,68
|
|
3. Основная
заработная плата: а) исполнителя б) руководителя, консультантов Итого:
|
|
|
|
8800,00
|
|
|
13670,00
|
|
|
22470,00
|
35,54
|
|
4.
Дополнительная заработная плата
|
4494,00
|
7,1
|
|
5. Отчисления
на социальное страхование
|
7010,64
|
11,09
|
|
6. Стеклянная
посуда
|
2622,30
|
4,15
|
|
7.
Амортизационные отчисления
|
1048,92
|
1,66
|
|
Итого прямых
затрат
|
42149,76
|
66,70
|
|
8. Накладные
расходы
|
21074,88
|
33,30
|
|
Всего затрат:
|
63224,64
|
100,00
|
. Определение договорной цены на НИР
Договорная цена на НИР рассчитывается по формуле:
ЦНИР = ЗНИР ∙ (1 + Р / 100) ∙
К
где ЗНИР − затраты на выполнение
исследовательской работы,
Р − уровень рентабельности, %,
К − коэффициент, учитывающий поощрительную надбавку за
качество работы.
Уровень рентабельности при выполнении
научно-исследовательских работ, не принадлежащих к государственному, республиканскому
или отраслевому заказам, составляет 20%.
Поощрительная надбавка за качество работы для исследований,
имеющих практическое значение, определяется коэффициентом равным 1,1.
Таким образом:
ЦНИР =63224,64 ∙ (1 + 0,2) ∙ 1,1 =
83456,52 руб.
. Выводы по технико-экономической оценке результатов НИР
Поскольку работа посвящена в основном изучению влияния
различных факторов на процесс сорбции металлов, а также нахождение оптимальных
условий ионного обмена, то на данной стадии выполнения работы не представляется
возможным проведение экономического анализа. Данная работа носит характер
начальных разработок и поиска оптимальных условий проведения процесса. Она
будет дальше продолжена на кафедре редких и рассеянных элементов.
Делая выводы о текущих затратах на выполнение данной
дипломной работы, можно сказать, что основными статьями расходов являются:
· затраты на сырье, материалы и реактивы;
· накладные расходы
Приложение Е
Виды и объемы, выполненных с использованием ЭВМ
При выполнении работ настоящей дипломной работы широко
использовалась электронно-вычислительная техника. Как указано в разделе "
Технико-экономическая оценка результатов исследования", общие затраты
машинного времени составили 50 часов.
Наиболее активно вычислительная техника применялась для
построения графиков, таблиц и общего оформления дипломной работы.
Все работы были проведены в лаборатории вычислительной
техники и инструментальных методов анализа кафедры технологии редких и
рассеянных элементов на персональной ЭВМ IBM PS/AT Pentium.
При помощи ЭВМ были реализованы:
обработка экспериментальных данных
построение графиков, таблиц и общее оформление дипломной
работы.
Для обработки экспериментальных данных и построения графиков,
применялись следующие готовые программные средства: Microcal Origin (версия 6.1), Microsoft Word (версия Office 2007). В результате
применения электронно-вычислительной техники была значительно увеличена
скорость обработки экспериментальных данных, а также повышена точность её
результатов.