Резистентность мембран эритроцитов при действии 1,1-диметилгидразина, тяжелых металлов и биологически активных веществ
ИНСТИТУТ
ФИЗИОЛОГИИ ЧЕЛОВЕКА И ЖИВОТНЫХ ЦБИ МОН РК
УДК 612.11+577.16: 612.014.46
На правах рукописи
МОЛДАКАРИМОВ САДАТ БОЛАТУЛЫ
Резистентность мембран эритроцитов
при действии 1,1-диметилгидразина, тяжелых металлов и биологически активных веществ
.00.13 - Физиология
Диссертация на соискание ученой
степени
кандидата биологических наук
Научный руководитель
доктор биологических наук
Мурзахметова
М.К.
Алматы, 2007
ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
АО - антиоксиданты
АОС - антиоксидантная система
БАВ - биологически активные вещества
БАД - биологически активная добавка
ГП - глутатионпероксидаза
,1-ДМГ - 1,1-диметилгидразин
ОРЭ - осмотическая резистентность эритроцитов
ПГЭ - перекисный гемолиз эритроцитов
ПОЛ - перекисное окисление липидов
ПЭМ - проницаемость эритроцитарных мембран
СИ - среда инкубации
СОД - супероксиддисмутаза
α - ТФ - α-токоферол
МДА - малоновый диальдегид
ВВЕДЕНИЕ
Актуальность проблемы. Интенсификация промышленного и
сельскохозяйственного производства, нарушение природосберегающих технологий,
последствия многолетних испытаний ядерного и других видов вооружений, приводят
к нарушению экологического равновесия между организмом и средой его обитания и
представляют серьезную угрозу для здоровья населения [1-7]. В современных
условиях происходит интенсивное загрязнение окружающей среды токсичными
веществами, что ведет к нарушению природного баланса [8-10]. В окружении
человека насчитываются тысячи химических соединений, и их количество растет из
года в год. Многие вещества, окружающие человека в быту, медицине, на
производстве, в сельском хозяйстве, обладают различной степенью токсичности,
что приводит к возникновению как острых, так и хронических отравлений
[2,3,11-13].
Особенно остро проблема ухудшения состояния окружающей среды стоит в Казахстане,
на огромных территориях которого экологическая обстановка оценивается как
неблагоприятная, а в некоторых регионах - как тревожная и даже катастрофическая
[4,10,14-16]. Среди большого разнообразия неблагоприятных антропогенных
факторов, особо следует выделить химическое соединение 1,1-диметилгидразин
(1,1-ДМГ), используемое как один из основных компонентов азотоводородного
ракетного топлива [14,17-22]. Развитие авиакосмической промышленности, и,
особенно, аварии, имеющие место при запусках космических аппаратов, приводят к
выбросам ракетного топлива в окружающую среду [14,23-26]. При падении первых
ступеней космических ракет на землю в них остается до 3т недогоревшего топлива
[14,26], что представляет чрезвычайную опасность для населения районов, прилегающих
к космодрому «Байконыр». 1,1-диметилгидразин относится к группе экологических
токсикантов из-за значительной стабильности в почве и растениях, неограниченной
растворимости в воде, высокой летучести, способности к миграции и накоплению во
всех средах, включая продукты растительного и животного происхождения
[19,22,27-29]. 1,1-диметилгидразин - высокотоксичное соединение [14,21,22,26],
вызывающее острые и хронические формы интоксикации с преимущественным
поражением центральной нервной системы, печени, крови, а также других органов
человека [16,19,30-34]. Установлены его мутагенные и канцерогенные свойства
[35-40].
Биотрансформация гидразинов может не приводить к детоксикации этих
соединений, как прежде считали, эти вещества, в свою очередь, могут проявлять
токсические эффекты [41]. При этом создаются условия для длительного
комплексного поступления малых количеств токсиканта в организм, что оказывает
неблагоприятное воздействие на здоровье людей [19]. В организм гидразин и его
производные могут проникать различными путями, и их относительная токсичность
не зависит от способов поступления [18]. При этом метаболизм гидразина в
организме животных и человека до конца не изучен, поэтому, данная проблема
остается открытой [17].
Среди многочисленных неорганических соединений естественного
происхождения особую опасность для здоровья населения представляют широко
распространенные в окружающей среде соли тяжелых металлов [42-46]. Свинец и
ртуть наряду с кадмием, входят в так называемую, «большую тройку». Свинец занимает
приоритетное положение в связи с его большой распространенностью,
политропностью действия, высокой токсичностью и выраженным кумулятивным
свойством. Одним из основных источников выбросов свинца в атмосферу являются
антидетонационные добавки к бензину. Другими источниками поступления свинца в
атмосферу являются производство красок, полиграфическое дело, сжигание
каменного угля и т.д. [44-46]. Ртуть относится к тиоловым ядам и вступает в
химическое взаимодействие с сульфгидрильными группами белков [45,46], которым
принадлежит исключительная роль в осуществлении биохимических процессов и
поддержании жизнедеятельности. Пары ртути, проникая в организм, поражают
желудочно-кишечный тракт, почки, нервную систему с характерным развитием
психических и двигательных расстройств [43,47,48]. Проблема ртутного
загрязнения является одной из актуальных проблем для нашей страны [49-50].
Большинство описанных в литературе исследований, касающихся действия
токсикантов на организм, посвящены влиянию отдельных соединений, и недостаточно
сведений о сочетанном влиянии веществ. Тогда как в повседневной жизни человек
подвергается воздействию комплекса токсикантов, а совместный эффект нескольких
соединений может существенно отличаться от их изолированного воздействия [51].
Сочетанное действие 1,1-ДМГ с другими токсикантами, к примеру, ионами тяжелых
металлов, исследовано недостаточно.
Неблагоприятное действие токсических веществ проявляется на различных
структурных уровнях организма, начиная с молекулярного и клеточного [52]. Биологическим
мембранам принадлежит ключевая роль в обеспечении и регуляции физиологической
активности клеток. В них осуществляются важнейшие биохимические реакции [53].
Это чрезвычайно активные, постоянно функционирующие ферментативные комплексы,
обеспечивающие такие проявления жизнедеятельности, как передача нервного
импульса, дыхание, иммунитет, пищеварение и другие процессы [53].
Одним из механизмов токсического действия химических соединений является
образование свободных радикалов и интенсификация окислительных процессов [52].
Свободные радикалы постоянно образуются в организме как часть нормального
метаболизма [54]. Однако при повышенном образовании радикалов и нарушении
баланса между оксидантной и антиоксидантной системами, свободные радикалы
вызывают повреждение различных биомолекул, в том числе липидов, составляющих
основу биологических мембран [55]. Нарушение свойств биологических мембран
приводит к развитию различных патологических состояний [55].
Свободнорадикальные процессы лежат в основе многих патологических
состояний, и использование антиоксидантов является одним из перспективных путей
повышения резистентности организма [54,55]. Среди множества соединений,
обладающих антиоксидантными свойствами, особое место занимают витамины С и Е
[54,55]. По физико-химическим свойствам витамин С является водорастворимым и
выполняет свои функции в водном окружении, а витамин Е - жирорастворимым и
соответственно проявляет свои свойства в липидном окружении [54,55]. При этом
характер их взаимодействия говорит о том, что особые перспективы представляет
их совместное использование [56]. На фоне многочисленных исследований по оценке
витаминной обеспеченности проблеме микроэлементозов уделяется недостаточное
внимание [57]. Между тем микроэлементы играют важную роль в системе
антиоксидантной защиты [58]. Один из важных микроэлементов для организма,
селен, входит в состав фермента глутатионпероксидазы [58], утилизирующей
потенциально опасную перекись водорода [54].
В настоящее время при исследовании биологических мембран часто используют
эритроциты как модель, отражающую состояние мембран всего организма [59].
В связи с вышеизложенным представляет интерес исследование механизма
изолированного и совместного действия 1,1-диметилгидразина и ионов тяжелых
металлов (Pb2+ и Hg2+) на состояние мембран эритроцитов. Кроме того,
перспективным является использование витаминов (С, Е), микроэлементов (селен)
для повышения резистентности биологических мембран при действии токсических
веществ.
Цель и задачи исследования. Целью работы явилось изучение изолированного
и сочетанного действия 1,1-диметилгидразина и ионов свинца и ртути на состояние
мембран эритроцитов и возможности повышения резистентности мембран с помощью
биологически активных веществ (витаминов С, Е, селенита натрия и препарата
«Селевит»).
Исходя из поставленной цели, были сформулированы следующие задачи:
1. Изучить изолированное и сочетанное
действие 1,1-диметилгидразина, Pb2+, Hg2+ на резистентность мембран
эритроцитов в условиях in vitro.
2. Исследовать влияние витаминов С, Е и
селенита натрия на резистентность мембран эритроцитов в условиях in vitro.
3. Изучить эффект сочетанного действия
1,1-диметилгидразина и биологически активных веществ (витаминов С, Е и селенита
натрия) на мембраны эритроцитов в условиях in vitro.
4. Исследовать в условиях in vivo роль препарата «Селевит» в повышении резистентности
мембран эритроцитов к действию 1,1-диметилгидразина.
Научная новизна. Впервые получены экспериментальные данные о сочетанном
действии 1,1-ДМГ, Pb2+ и Hg2+ на состояние мембран эритроцитов в
условиях in vitro. Показано, что 1,1-ДМГ, ацетат свинца и хлорид ртути
оказывают повреждающее действие на эритроцитарную мембрану, а при сочетанном
действии эти соединения оказывают более выраженный токсический эффект.
Выявлено, что витамины С, Е и селенит натрия повышают резистентность
мембран эритроцитов в условиях in vitro.
Установлено, что в условиях in vitro витамины С,
Е и селенит натрия оказывают протекторный эффект на мембрану эритроцитов от
повреждающего действия 1,1-ДМГ, а сочетанное действие этих биологически
активных веществ более эффективно по сравнению с их изолированным влиянием.
Впервые показано, что в условиях in vivo препарат «Селевит» защищает мембрану эритроцитов от
повреждающего действия 1,1-диметилгидразина.
Основные положения, выносимые на защиту.
. В условиях in vitro повреждающий эффект
1,1-диметилгидразина, ацетата свинца и хлорида ртути на резистентность мембран
эритроцитов выше при их сочетанном действии по сравнению с их изолированным
влиянием.
. Биологически активные вещества (витамины С, Е, селенит натрия) в
условиях in vitro повышают устойчивость мембран эритроцитов.
. В условиях in vitro витамины С, Е и селенит натрия
снижают повреждающий эффект 1,1-диметилгидразина. Протекторный эффект выше при
совместном использовании этих биологически активных веществ по сравнению с их
изолированным действием.
. Препарат «Селевит» в условиях in vivo снижает
повреждающий эффект 1,1-диметилгидразина.
Теоретическая и практическая ценность диссертации.
Использованный в работе комплексный подход при определении влияния
токсикантов и биологически активных веществ на мембраны эритроцитов позволяет
выявить характер происходящих в мембране изменений, взаимные изменения
параметров состояния мембран при действии токсических и протекторных
соединений, и может быть рекомендован в качестве экспериментальной модели для
исследования свойств новых потенциальных мембранопротекторов и токсикантов.
Результаты исследований влияния 1,1-ДМГ, Pb2+, Hg2+
на мембраны эритроцитов полезны для понимания механизмов токсического действия
соединений при их изолированном и совместном воздействии на биологическую
систему, а также могут быть использованы для разработки методов диагностики,
профилактики, лечения токсических отравлений и в качестве скрининг-теста при
определении степени повреждающего эффекта неблагоприятных факторов окружающей
среды.
Полученные результаты совместного использования витаминов С, Е и селенита
натрия для снижения эффекта 1,1-диметилгидразина вносят вклад в более глубокое
понимание межвитаминных взаимоотношений при действии токсических соединений.
Данные, полученные при исследовании роли препарата «Селевит» в снижении
повреждающего действия 1,1-диметилгидразина, позволяют рекомендовать
использование этого препарата для повышения резистентности организма при
действии неблагоприятных факторов окружающей среды.
Апробация работы. Основные положения диссертации доложены и обсуждены на:
III международной научной конференции
молодых ученых и студентов, посвященной памяти М.А.Айтхожина (Алматы, 2003); 31
Конгрессе Федерации Европейских Биохимических Обществ «Molecules in Health & Disease»
(Стамбул, 2006), Международном симпозиуме «Физиология и патология лимфатической
системы» (Алматы, 2006), международной научно-практической конференции «Современные
проблемы сохранения биоразнообразия», посвященной 90-летию со дня рождения
академика НАН РК Т.М.Масенова (Алматы, 2006), научно-теоретическом семинаре
Института физиологии человека и животных ЦБИ МОН РК (Алматы, 2006).
Публикации. По теме диссертации опубликовано 9 научных работ, перечень
которых приводится в конце автореферата.
Связь данной работы с другими НИР и различными государственными и
международными программами. Работа выполнена в рамках программы МНТЦ
(2003-2006, К-452.1) и программы фундаментальных исследований Института
физиологии человека и животных ЦБИ МОН РК (2006-2008, № госрегистрации,
0106РК00409).
Структура и объем диссертации. Диссертация изложена на 110 страницах,
состоит из введения, обзора данных литературы, главы с описанием методов
исследования, 4 глав с изложением результатов собственных исследований,
обсуждения, заключения и списка цитированных источников, включающего 308 работ.
Работа иллюстрирована 45 рисунками и содержит 2 таблицы.
ЭКОЛОГИЧЕСКИЕ ТОКСИКАНТЫ И РОЛЬ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ В
ПОВЫШЕНИИ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА
1.1 Гидразины, окружающая среда и здоровье
человека
Гидразины - химические соединения, которые содержат 2 атома азота,
соединенные одиночной ковалентной связью. Они схожи по химической структуре и реактивности.
На рис.1 представлены структурные формулы наиболее известных гидразинов.
H
H H3C H H3C СH3
> N - N < > N - N <
> N - N <
H
H H3C H H H
гидразин 1,1-диметилгидразин 1,2-диметилгидразин
Рисунок 1 - Структурные формулы гидразинов.
,1-диметилгидразин (1,1-ДМГ) - производное гидразина, так же известное
под названиями несимметричный диметилгидразин, димазин, является одним из
основных компонентов азотоводородного ракетного топлива [17]
Помимо 1,1-ДМГ, существует огромное число производных гидразина,
большинство из которых вредны для здоровья людей. Исследование 98 гидразинов
показало, что 84 из них являются канцерогенами [60]. Это означает, что
население в различной степени находится под воздействием этих вредных для
здоровья агентов. Следовательно, гидразины, подобно полициклическим
ароматическим углеводородам, N-нитрозосоединениям и ароматическим аминам, представляют
большой риск окружающей человека среде.
1,1-диметилгидразин при комнатной температуре - бесцветная жидкость, с
неприятным аммиачным запахом, легко испаряется и в воздухе находится в
паро-газовой фазе. Химическая формула: N2С2H8.
Молекулярная масса - 60. Удельный вес - 0,78. Температура кипения - 63ºС, замерзания - минус 57ºС. Легко адсорбирует из воздуха
влагу. Хорошо растворим в воде, водных растворах кислот, спиртах,
углеводородах, эфирах [17]. 1,1-диметилгидразин - высокореакционное соединение,
легко вступающее во взаимодействие с множеством реагентов различной природы.
1,1-ДМГ вступает в окислительно-восстановительные реакции, реакции
комплексообразования и реакции с органическими соединениями, содержащими
карбоксильную группу. Как органическое основание с сильно выраженными
восстановительными свойствами, несимметричный диметилгидразин легко окисляется
кислородом воздуха и другими окислителями (калий марганцовокислый, калий йодид,
окись ртути, перекись водорода, азотная и азотистая кислоты, хлор, гипохлорид)
[17,61]. При этом в зависимости от условий (температура, продолжительность
окисления, наличие каталитически активных металлов) образуются диметиламин,
тетраметилтетразен, нитрозодиметиламин, метилендиметилгидразин, формальдегид и
другие продукты окисления [17-19,62-64]. 1,1-ДМГ при взаимодействии с кислотами
образует соли [17,61].
Гидразины производятся из химических веществ, таких как аммиак,
диметиламин, перекись водорода, мочевина, гипохлорит натрия. Большинство
методов получения гидразина основано на кетазиновом процессе - одной из
разновидностей реакции Рашига [17]. 1,1-ДМГ получают каталитическим
гидрированием нитрозодиметиламина, получаемого из диметиламина, и
взаимодействием хлорамина, получаемого из хлора и аммиака, с диметиламином в
присутствии щелочи [17,18,62].
Помимо использования в качестве основного компонента ракетного топлива
гидразины используются в качестве ингибитора коррозии, окислителя в
гальванопластике, воспламенителя взрывчатых веществ, форсажного горючего,
катализаторов полимеризации, фармацевтических препаратов, для восстановления
металлов, в качестве антиоксидантов в нефтяной промышленности, как
промежуточные продукты при синтезе сельскохозяйственных химикатов (малеиновый
гидразид), вспучивателей для производства пластмасс, лекарственных средств
(изониазид, гидралазин), флюсов, применяемых при пайке (гидразинбромид и
гидразинхлорид) и в фотографии [17,18].
Один из основных путей попадания 1,1-диметилгидразина в окружающую среду
- в результате его использования в качестве ракетного топлива, хотя аварийные
выбросы 1,1-ДМГ могут возникать при хранении, переработке, транспортировке, а
также при неправильном удалении отходов [17,18]. Большое количество ракетного
топлива попадает в окружающую среду при авариях ракет-носителей [23,24]. В
результате испарения 1,1-ДМГ концентрация его в воздухе может достигать 4 мг/м3
на расстоянии 2 км по ветру от места разлива [17]. Человек может подвергаться
воздействию 1,1-ДМГ на предприятиях по его производству, а также по
производству его солей и дериватов, при испытании двигателей и в местах запуска
ракет, а также в тех местах, где базируются или заправляются самолеты [17,18].
Концентрации 1,1-ДМГ на предприятиях по его производству могут составлять в
нормальных условиях 0,35 мг/м3, а иногда достигают 1,18 мг/м3. Рабочие тех
предприятий, на которых используются паровые котлы высокого давления,
подвергаются потенциальной опасности воздействия сравнительно разбавленных
растворов 1,1-ДМГ. Вода из систем центрального отопления является потенциальным
источником воздействия 1,1-ДМГ на человека [18]. 1,1-ДМГ присутствует в
недостаточно очищенных лекарственных препаратах или в медикаментах с истекшим
сроком годности (изониазид, гидралазин) [17,65-67]. 1,1-ДМГ может также
образовываться в процессе метаболизма этих лекарственных препаратов [68,69].
1,1-ДМГ может воздействовать на людей при курении или вдыхании сигаретного дыма
(23-43 нг/сигарету) [17,70].
,1-ДМГ легко сорбируется поверхностями строительных конструкций и
вследствие десорбции может явиться причиной вторичного загрязнения воздушной
среды [18,22].
Предельно допустимые концентрации 1,1-ДМГ в воздухе - 0,001 мг/м3, в воде
- 0,02 мг/л [71].
Исследования, проведенные в районах падения отделяющихся частей
ракетоносителей, показывают, что для каждого типа ландшафта характерны свои
условия миграции гидразинов [17,20,61,72]. Концентрации 1,1-ДМГ сосредоточены в
местах стока талых, грунтовых и подземных вод, в понижении рельефа [72]. В этих
местах отмечается высокое содержание 1,1-ДМГ в растениях, что связано с хорошей
растворимостью в воде и усвояемостью растениями [20,72]. Бедность плодородного
слоя почв азотосодержащими веществами, структурные особенности 1,1-ДМГ, наличие
в составе молекулы активных атомов азота способствуют включению его в
метаболические процессы в растениях [72]. Следует отметить, что в отличие от
гидразина, 1,1-ДМГ обладают в достаточной степени высокой кумулятивностью и
стабильностью в объектах окружающей среды, что приводит к тяжелым последствиям
для здоровья населения и животного мира по трофической цепи (почва - вода -
растения - животные - человек) [27-29,73].
До 40% 1,1-ДМГ, в зависимости от типа почв, могут сохраняться до 1 года и
более. Известен случай, когда 1,1-диметилгидразин обнаружен через 9 лет после
аварийного пролива (20 тонн) не только в поверхностных, но и в глубоких слоях
грунта [73].
В почве гидразины при аэробных условиях адсорбируются и подвергаются
разложению на поверхности глиноземов [17]. Они подвергаются метаболизму главным
образом до азота нитрифицирующей бактерией Nitrosomas [74]. Гидразины могут
восстанавливаться до аммиака нитрогеназой, выделенной из азотфиксирующей
бактерии Azobacter vinelandii [75].
В воздушной среде 1,1-ДМГ быстро разлагается в результате реакций с
гидроксильными радикалами, озоном и диоксидом азота [17]. Время полужизни
1,1-ДМГ, связанное с гидроксильными радикалами составляет около 3 часов, с
наличием озона - приблизительно 1 час. Время существования 1,1-ДМГ в
загрязненной воздушной среде несколько минут, в чистом воздухе приблизительно 1
час. В результате этих реакций образуются диазен, пероксид водорода, а также
небольшие количества закиси азота и аммиака [17].
В водной среде основными факторами, способствующими абиотической
деградации гидразинов, являются присутствие некоторых ионов металлов,
органического материала в целом и некоторых органических окислителей в
частности, содержание кислорода, повышенная жесткость и высокие значения рН
[76]. Гидразин подвергается биодеградации микроорганизмами, присутствующими в
активном иле [77,78].
,1-ДМГ представляет опасность при любых путях поступления в организм
(через желудочно-кишечный тракт, органы дыхания, кожу, слизистые) [14]. В ряде
исследований на животных показано, что острая летальность наступает после
воздействия гидразинов большинством из путей.
Исследования рабочих, подвергавшихся ингаляционному воздействию 1,1-ДМГ,
выявили изменения, указывающие на гепатотоксический эффект, следовательно,
печень является мишенью для гидразинов. Имеются данные, что 1,1-диметилгидразин
оказывает
сильное сенсибилизирующее действие на кожу [1]. Выявлено, что повторные
воздействия на кожу вызывают эпителиоидную саркому
[79].
Исследования на животных показывают, что 1,1-ДМГ одинаково быстро
всасывается в кровь и легко распределяется в тканях независимо от способа
воздействия [62,80-84]. Адсорбция и распределение 1,1-ДМГ зависят от вида
животных. Так, у крыс, после введения 1,1-ДМГ (11-60 мг/кг массы тела),
определялись низкие уровни 1,1-ДМГ (приблизительно 0,1-3,1 % дозы) в тканях без
предпочтительной аккумуляции 1,1-ДМГ в каком-либо органе [77,78]. Тогда как у
кроликов после введения внутривенно или внутрибрюшинно 1,1-ДМГ самые высокие
концентрации определялись в печени (8,9 %) и толстой кишке (11,6 %), а уровень
в других тканях варьировал в пределах 0,02- 4,18 % дозы [83].
Выведение 1,1-ДМГ происходит преимущественно с мочой и выдыхаемым
воздухом [62]. Так у крыс, которым вводили 1,1-ДМГ в дозе 0,78-80 мг/кг массы
тела, через 53 часа, приблизительно 76 % дозы выводились с мочой и 23 % дозы
выводились с выдыхаемым воздухом [85].
Типы механизмов, вовлеченных в метаболизм гидразинов, и образованные
метаболиты не зависят от способа воздействия [17]. Процесс биотрансформации
1,1-ДМГ осуществляется в основном в печени [18]. Соединения, генерируемые
метаболизмом 1,1-ДМГ, могут быть свободными радикалами. Микросомы печени и
гепатоциты крыс способны метаболизировать 1,1-ДМГ с образованием метил-радикалов.
Присутствие ионов меди также может содействовать образованию свободных
радикалов. При метаболических превращениях гидразинов образуется значительное
количество азота, которое выводится через легкие [18,86]. Из метаболитов
1,1-ДМГ, выделяемых с мочой, 40-60% составляет ацетилированные производные
1,1-ДМГ, 3-10% - глюкозогидразон, 20-25% - тетраметилтетразен, углекислота,
метан и другие соединения [18].
Эти данные показывают, что 1,1-ДМГ подвергается деметиляции. Большинство
метаболических превращений катализируется монооксигеназами, локализованными в
мембранах эндоплазматического ретикулума [17,62]. Так, в экспериментах in vitro было показано, что при добавлении флавин-содержащего
ингибитора монооксигеназы (метимазол) снижается деметиляция 1,1 ДМГ и
образование метил-радикалов [87].
По-видимому, липооксигеназа и циклооксигеназа также могут быть
вовлеченными в метаболизм 1,1 ДМГ, так как при добавлении ингибиторов
липооксигеназы и циклооксигеназы (индометацин и эйкозатетрановая кислота)
снижалось образование формальдегида микросомами толстой кишки крыс, а при
добавлении жирных кислот - повышалось [87].
Для обезвреживания реакционно-способных продуктов биотрансфор-мации
1,1-ДМГ особое значение имеют глутатион-зависимые ферментные системы [88]. 40-60%
метаболитов, выделяемых с мочой, составляют ацетилированные производные
гидразиновых соединений, а ацетилирование часто является четвертым этапом
глутатионовой конъюгации [62].
Вследствие биотрансформации молекулы 1,1-ДМГ становятся более полярными,
уменьшается их растворимость в липидной фазе, что способствует быстрому
выведению из организма [18].
Эти данные показывают, что в метаболизм 1,1 ДМГ могут быть вовлечены по
меньшей мере две независимые ферментные системы и одна неферментная [87].
,1-ДМГ чрезвычайно токсичен для животных и человека [18]. При острых
отравлениях на первый план выступают симптомы поражения ЦНС (судорожный эффект)
и в меньшей степени - печени [33]. При хронических отравлениях преобладают
признаки поражения печени, при этом страдают центральная нервная,
сердечно-сосудистая, выделительная, кроветворная системы [18]. Токсичность
1,1-ДМГ в значительной степени зависит от вида животного, в то же время внутри
одного вида токсичность практически не зависит от путей введения. Порог острого
действия 1,1-ДМГ для мышей - 15 мг/м3, порог хронического ингаляционного
действия 1,1-ДМГ - 0,17 мг/м3 [18]. В таблице 1 приведены данные по
чувствительность различных видов животных к гидразину и его производным при
разных путях воздействия.
Картина острого отравления у животных характеризуется нарушениями крово-
и ликворообращения в головном мозге, дистрофическими и некробиотическими
изменениями нейронов, распространенными изменениями сосудистой системы
(дистония стенок сосудов внутренних органов, повышение их проницаемости). В
печени возникает белковая и жировая дистрофия. В миокарде и почках наблюдаются
дистрофические изменения и нарушения гемодинамики. В пульпе селезенки
повышается количество железосодержащего пигмента [18,62].
При хронических отравлениях производными гидразина наибольшие изменения
развиваются в печени. Нарушаются ее антитоксическая, экскреторная и
белковообразовательная функции. Кроме того, страдают функции центральной
нервной системы, обмен веществ (углеводный, жировой), сердечно-сосудистая,
эндокринная и другие системы [18]. В периферической крови определяется
тенденция к полиглобулии (начальная стадия гиперкомпенсированного скрытого
гемолиза). В костном мозге наблюдается некоторое усиление миелопоэза с
преимущественной активацией эритропоэза [18]. Результаты патологоанатомического
исследования: мелкокапельное и пылевидное ожирение печени, снижение содержания
гликогена; белковая дистрофия миокарда и почек; слабые структурные изменения
клеток центральной нервной системы, в том числе нейронов вегетативных ганглиев
[62,89].
Таблица 1 - Чувствительность различных видов животных к гидразину и его
производным, LD50, мг/кг [Белов, 1999].
|
Вид животного
|
Путь введения
|
Гидразин
|
Метил-гидразин
|
1,2-ДМГ
|
1,1-ДМГ
|
|
Собаки
|
внутривенно
|
25
|
12
|
100
|
60
|
|
Мыши
|
Внутривенновнутрибрюшинно
перорально
|
57±7,5 62±4 59±7,2
|
33,2±5,4 32,3±0,3 33,0±6
|
29±1,5 35±5 36±8
|
250±19 290±38 265±22
|
|
Крысы
|
Внутривенно внутрибрюшинно
перорально
|
55±2,7 59±3,8 60±3,8
|
33±4,5 32,0±3,8 32±1,4
|
175±11,6 163±3,7 160±3,2
|
119±3,8 131±5,1 122±10,6
|
|
Морские свинки
|
Внутривенно внутрибрюшинно
перорально
|
26
|
-
|
-
|
-
|
|
Кролики
|
Внутривенно внутрибрюшинно
перорально
|
26 35
|
-
|
-
|
-
|
Существует, по меньшей мере, два определенных механизма действия
гидразинов: один, включающий прямое связывание гидразинов, имеющих свободные
аминогруппы, (гидразин и 1,1-ДМГ) с ключевыми молекулами клетки, и другой,
включающий образование реактивных видов, таких как свободнорадикальные
соединения или ионы метилдиазония как результат метаболизма [90].
Среди множества биохимических процессов, нарушаемых гидразинами, можно
выделить круг реакций, имеющих непосредственную связь с возникновением и
развитием ведущих эффектов отравления. К ним в первую очередь следует отнести
энзимы, катализирующие процессы окисления, переаминирования, дезаминирования и
фосфорилирования. Блокирование названных ферментов опосредовано взаимодействием
гидразинов с кофакторами [91]. Связываясь с производными витамина В6 и образуя
гидразоны, 1,1 ДМГ способен ингибировать реакции, которые требуют витамин В6 как
кофактор. Эти реакции включают реакции трансаминирования, декарбоксилирования и
другие преобразования аминокислот, метаболизм липидов и нуклеиновых кислот и
фосфорилирование гликогена. Нехватка витамина В6 может вызывать судороги,
дерматиты и анемию. Кроме того, некоторые авторы предположили, что для
образования гидразона необходимы свободные аминогруппы, как в гидразине и
1,1-ДМГ. Это объясняет тот факт, почему судороги отмечаются при воздействии
гидразина и 1,1-ДМГ, а не 1,2-ДМГ. Необходимо отметить, что пиридоксин (одна из
форм витамина В6) обычно используется для лечения людей, подвергшихся
воздействию гидразина или 1,1-ДМГ [87].
В последние годы в литературе появились сообщения, касающиеся новых
молекулярных критериев оценки токсического действия производных гидразина,
которые, на наш взгляд, дополняют уже известные механизмы токсичности.
Установлено, что под влиянием гидразинов увеличивается концентрация
супероксидных радикалов в клеточных мембранах, причем оно достигается двумя
путями - в результате окислительного метаболизма производных гидразина и в
результате ингибирования кислород-детоксицирующей системы микросом, которое в
конечном итоге также приводит к увеличению генерации супероксидных радикалов
[31]. В свою очередь эти радикалы, образующиеся в окислительно-восстановительных
реакциях производных гидразина, могут давать различные токсические эффекты, в
том числе и усиливать процессы ПОЛ.
Гидразин и его производные вмешиваются в реакции с одноэлектронным
переносом и как следствие нарушают процессы микросомального метаболизма и
перекисного окисления липидов [18]. Во время метаболизма 1,1-ДМГ происходит
образование свободных радикалов, включающих метильные, ацетильные,
гидроксильные и водородные радикалы. Многочисленные пути, как ферментные, так и
неферментные, по-видимому, вовлечены в образование свободных радикалов.
Поражение гемоглобина связано со свободными радикалами, из чего следует, что
свободные радикалы могут быть вовлечены в анемические эффекты гидразинов.
Образование реактивных видов во время метаболизма гидразинов может также
объяснить их генотоксический эффект, такой как образование аддуктов ДНК и РНК in vivo. Показано, что гидразины вызывают мутацию тимидина и
индукция мутации коррелирует с токсичностью гидразинов [92]. Аддукты ДНК и РНК
вполне могут быть ответственны за мутацию генов, наблюдаемых в ряде
исследований in vitro, и могут также служить началом заболевания раком,
вызываемыми гидразинами in vivo [87].
Анализ последствий воздействия компонентов ракетного топлива на состояние
здоровья населения и лиц, имевших контакт с токсичными составляющими ракетного
топлива, показал, что прослеживается высокий риск возникновения хронических
заболеваний, болезней органов дыхания, сердечно-сосудистой системы, крови и
кроветворных органов, печени, злокачественных новообразований,
иммунно-генетической системы и других болезней [90,93-95].
Таким образом, из литературных данных следует, что 1,1-ДМГ оказывает
неблагоприятное влияние на организм человека и животных. 1,1-ДМГ -
высокотоксичное соединение, обладает канцерогенным и мутагенным эффектом,
способен образовывать при окислении другое соединение - нитрозодиметиламин,
обладаюший большим токсическим действием.
1.2 Свинец и здоровье человека
Свинец является одним из наиболее токсичных металлов и включен в списки
приоритетных загрязнителей рядом международных организаций, в том числе
Всемирной Организацией Здравоохранения, Американским агентством по контролю за
токсичными веществами и заболеваниями (CDC), и другими аналогичными
государственными организациями в различных странах [96]. По классификации
Международного Агентства по Исследованию Рака свинец и его неорганические
соединения относятся к группе 2Б (возможные канцерогены для человека) [97]. В
земной коре содержится сравнительно немного свинца - в тысячи раз меньше, чем
алюминия или железа. Однако он стал известен человеку еще в глубокой древности
- примерно за 7000-5000 лет до н.э. В отличие от многих других металлов, свинец
имеет низкую температуру плавления (327°С) и находится в природе в виде довольно
непрочных химических соединений. Это определяло возможность даже случайного его
получения. Несмотря на использование свинца в течение такого продолжительного
периода, все еще наблюдаются случаи отравления этим металлом [98]. Причем
человек может подвергаться значительному воздействию свинца, занимаясь
деятельностью, которая не считается потенциально опасной с этой точки зрения
[99].
Содержание свинца в окружающей среде растет сейчас небывало быстрыми
темпами в результате деятельности человека. В воздухе большинства европейских
городов содержание свинца обычно колеблется от 0,15 до 0,5 мкг/м3. Вне
городской черты средняя концентрация свинца составляет обычно меньше 0,15
мкг/м3 [100,101]. По некоторым данным, повышение содержания свинца в количестве
более 250 мкг/м2 в сутки увеличивает его концентрацию в крови.
Ежегодное мировое потребление свинца составляет около 3 млн.тонн, из
которых 40% используют для производства аккумуляторных батарей, 20% -
тетраэтилсвинца (ТЭС) и тетраметил свинца, антидетонационных добавок к бензину,
12% - в строительстве, 6% - для производства оболочки кабелей в
электротехнической промышленности [102]. Значительные количества его
расходуются для изготовления припоев. На химических заводах и предприятиях
цветной металлургии распространена освинцовка внутренней поверхности камер и
башен для производства серной кислоты, труб, травильных и электролитных ванн.
Подшипниковые антифрикционные сплавы свинца с другими металлами можно встретить
во многих машинах и механизмах. Вместе с сурьмой и оловом он входит в состав
типографского сплава-гарта, из которого изготовляют шрифты для книг, газет и
журналов. Основное оборудование в сернокислотной промышленности - камеры,
промывные башни, желобы, трубы, холодильники, детали насосов - все это изготовляется
из свинца или свинцом облицовывается. В стекольной и керамической
промышленности этот металл необходим для производства хрусталя, специальных
глазурей. Окислы и соли свинца применяют в лакокрасочной промышленности
(свинцовые белила, свинцовый крон, сурик). В медицине соединения свинца
используют как вяжущие, болеутоляющие и противовоспалительные средства.
Уксуснокислый свинец, например, известен как «свинцовая примочка». При
производстве гликохолевой и таурохолевой кислот для медицины используют
уксуснокислый свинец. Но главная работа свинца в медицине связана с защитой
врачей от постоянного рентгеновского облучения. Свинцовые экраны применяют в
атомной энергетике, в ядерной технике. От радиоактивного излучения защищает и
стекло, в состав которого входят окислы свинца. Также свинец используется в
полупроводниковой промышленности, лазерной технике, в гальванотехнике, в
огнестрельном оружии, виниловых мини-жалюзи, в качестве инициирующих взрывчатых
веществ (азид и тринитрорезорцинат свинца (ТНРС)) [103].
В настоящее время ежегодные промышленные и транспортные выбросы свинца
превышают 400 тысяч тонн, угрожая здоровью миллионов людей, особенно детей
[97]. Основными источниками поступления свинца в окружающую среду и его
воздействия на здоровье людей, как взрослых, так и детей, являются выбросы
промышленных предприятий, использование этилированного бензина в
автотранспорте, применение в консервной индустрии свинецсодержащих припоев,
свинцовой глазури, которой покрывают керамическую и стеклянную посуду для
хранения напитков, применение свинцовых материалов в водопроводных системах
производство красок, в состав которых входят свинцовые пигменты (свинцовый
сурик, желтый крон, типографские краски), а также поверхности, покрытые такой
краской, например, подоконники, перила, двери, мебель, металлические
конструкции [96,104].
В воду свинец может попадать из загрязненных им почв. В свинцовых трубах
и других местах, где возможен контакт этого металла с водой и кислородом
воздуха, идут процессы окисления:
Pb + O2 + 2H2O = 2Pb (OH)2.
В подщелоченной воде свинец может накапливаться в значительных
концентрациях в результате образования растворимых плюмбитов:
Pb(OH)2 + 2OH- = PbO22- + 2H2O.
Если в воде присутствует СО2, то это приводит к образованию довольно
хорошо растворимого гидрокарбоната свинца [102].
Значительные количества свинца выбрасываются автомобильными двигателями с
выхлопными газами. Концентрация свинца в воздухе некоторых городов ежегодно
увеличивается на 5% [102]. За год только над океанами и морями северного
полушария выпадает около 50 тысяч тонн этого металла, образующегося главным
образом из добавок к бензину (меньше 1 грамма на литр). Свинец «автомобильного
происхождения» был обнаружен даже в снегах Арктики. Во многих странах
концентрация свинца в бензине снижена до 1-0,3 г/л. Однако даже 1 г свинца
способен загрязнить на уровне ПДК около 1 400 000 м3 воздуха [102].
Главными источниками поступления свинца в организм человека являются
почва (пыль и пищевые цепочки), атмосферный воздух, загрязненные и
консервированные пищевые продукты [96]. Выполненные специалистами свыше 500
тысяч анализов пищевых продуктов показывают, что в 3,5 % проб присутствует
свинец в количествах, превышающих предельно допустимые [104]. Источником
воздействия свинца на маленьких детей являются присыпки, газеты и журналы с
цветной печатью, т.к. в цветных типографских красках содержатся высокие
концентрации свинца [104]. Кроме того, могут представлять серьезную опасность
аккумуляторные батареи, вода из свинцовых труб и кранов в старых водопроводных
системах.
Все растворимые соединения этого элемента ядовиты. Свинец снижает
резистентность организма и повышает смертность экспериментальных животных
[105]. Причем органические соединения свинца более токсичны. Поступающий даже в
малых порциях в организм свинец задерживается в нем и постепенно замещает
кальций, который входит в состав костей, становясь постоянным источником
отравления [102]. Так же свинец накапливается в теле и поверхностных тканях.
Это приводит к хроническим заболеваниям. Клинические проявления свинцового
токсикоза многочисленны. В первую очередь поражаются органы кроветворения
(анемия микроцитарная, нормохромная, морфологически неотличимая от
железодефицитной анемии), нервная система, наблюдаются двигательные расстройства
(полиневриты, параличи, порезы), гормональные и обменные изменения, которые
ведут к нарушениям детородной и менструальной функции, расстройствам обмена
веществ; желудочно-кишечные расстройства - изжога, тошнота, свинцовые колики;
изменения сердечно-сосудистой системы (аритмия, повышение кровяного давления);
нарушения почечных функций, приводящие к недостаточности работы почек [97,104].
Прямым и самым оптимальным из имеющихся индикаторов степени воздействия
свинца на организм является содержание свинца в крови [96,102]. Полагают, что
свинец в крови даже в низких концентрациях может способствовать рождению
младенцев с небольшим весом [106]. Свинец, при концентрации в крови выше 200
мкг/л, оказывает воздействие на нейропсихологическое развитие детей, вызывая
умственную отсталость, заболевания мозга. При увеличении уровня свинца в крови
отмечается субъективное повышение напряженности, депрессии, усталости [107],
нарушается речевая, зрительная и слуховая функции. Ухудшение памяти, внимания
наблюдаются при содержании свинца в крови выше 500 мкг/л [108-111]. Эффекты
воздействия свинца на центральную нервную систему, которые оценивались по
нейроповеденческим признакам, наблюдаются при его концентрации ниже 200 мкг/л.
При содержании свинца в крови 100-150 мкг/л, наблюдаются снижение «показателя
интеллекта» (IQ) [112,113]. В некоторых эпидемиологических исследованиях
обнаружено влияние свинца на умственные способности при его содержании в крови
менее 100 мкг/л. Однако в других исследованиях изменения в познавательных
способностях не обнаружены при концентрации свинца в крови 400 мкг/л [114,115],
но при содержании свинца 300 мкг/л было обнаружено снижение скорости нервной
проводимости [116,117]. Опыты на животных подтверждают данные о том, что свинец
является причиной указанных изменений [113]. Отмечается увеличение случаев
заболеваний раком при воздействии свинца [118,119]. Однако, эти данные
считаются недостаточными, чтобы признать канцерогенный эффект свинца [120].
Свинец вызывает симпатическую гиперактивность и повышенную чувствительность β-
и дофаминергических
рецепторов [121,122]. Некоторые исследования показали линейную связь между
уровнем креатинина в плазме и уровнем свинца в крови выше 400 мкг/л [123-125].
Соединения свинца (Pb2+) нарушают обмен веществ и являются ингибиторами
ферментов [102]. Механизм токсического действия свинца, как и других тяжелых
металлов, заключается в блокировании функциональных SH-групп белков. Наиболее
сильному воздействию свинца подвержена гидратаза δ-аминолевулиновой кислоты, катализирующая
процесс формирования протобилиногена и гемсинтетазы, связывающих железо в
протопорфирин [97]. Так, при содержании свинца в крови 200-300 мкг/л
наблюдается повышение уровня свободного протопорфирина в эритроцитах, а
ингибирование дегидрогеназы δ-аминолевулиновой кислоты наблюдается
при концентрации свинца в крови около 100 мкг/л [126]. При концентрациях свинца
в крови около 400 мкг/л наблюдается снижение уровня гемоглобина [127].
Установлено, что в местах расположения свинцовых производств наблюдаются
существенные отклонения в состоянии здоровья населения в целом, и детей в
особенности [104]. По сравнению с взрослыми дети в десять раз более
чувствительны к действию свинца [104]. При этом на здоровье негативно влияют не
только высокие, но и постоянно действующие низкие концентрации свинца. Для
взрослых следует рассматривать критическое воздействие свинца на повышение
уровня свободного протопорфирина в эритроцитах, тогда как для детей решающими
факторами являются снижение умственной деятельности, ухудшение слуха и
нарушения в метаболизме витамина D [128,129]. Измеряемые в настоящее время
базовые уровни свинца в крови, обусловленные минимальным антропогенным
фактором, составляют от 10 до 30 мкг/л. Как выявили различные международные
экспертные группы, минимальное неблагоприятное действие свинца на маленьких
детей начинается с уровня 100-150 мкг/л. Хотя нельзя исключить, что действие
свинца может происходить и при меньших значениях.
Основным источником попадания свинца в организм является воздух. Врачи-гигиенисты
и инженеры по охране труда постоянно следят за тем, чтобы содержание свинца в
воздухе не превышало допустимой нормы- 0,00001 миллиграмма на литр. Хотя
концентрация свинца в воздухе, равная 1 мкг/м3 непосредственно дает вклад в его
концентрацию в крови, равную примерно 19 мкг/л у детей, и около 16 мкг/л у
взрослых.
Поступление свинца в организм с пищей составляет 200-300 мкг/сут.
Количество поступающего свинца зависит от возраста, пола, места проживания,
профессии. При пероральном поступлении соединений свинца из желудочно-кишечного
тракта всасывается около 10 % введенного свинца. Поступивший в кровь свинец
быстро распределяется по органам, затем происходит перераспределение.
Образуются два обменных пула свинца: быстрый - кровь, мягкие ткани и медленный
- скелет [46].
У человека и млекопитающих основным путем выведения свинца из тканей
являются почки. Выведение свинца из организма имеет двухфазный характер. Время
полувыведения из крови и мягких тканей составляет 20 дней. Из скелета - 20 лет
[46].
Введение свинца в желудок крысам в течение 8 недель приводит к
значительному накоплению свинца во всех отделах мозга [130]. Перекисное
окисление липидов во всех исследованных образцах после действия свинца
усиливается и наблюдается линейная корреляция между увеличением ПОЛ и уровнем
свинца в ткани. Усиление ПОЛ сопровождается значительным угнетением активности
антиоксидантных ферментов: СОД, каталазы, глутатионпероксидазы и
глутатионредуктазы.
Действие свинца приводит также к ингибированию мембраносвязанного фермента
ацетилхолинэстеразы, при этом также наблюдается линейная корреляция между
увеличением ПОЛ и снижением активности ацетилхолинэстеразы. Эти результаты
показывают, что свинец оказывает нейротоксический эффект посредством
окислительного повреждения мембран. Изучение механизмов токсического действия
свинца на печень выявило, что в печени тоже наблюдается значительная
аккумуляция свинца, которая приводит к усилению липидной пероксидации и
ингибированию активности антиоксидантных ферментов [131]. Следовательно, свинец
усиливает окислительное повреждение мембран, и таким образом нарушает клеточные
функции, повреждение клеточных мембран является в данном случае следствием
отравления свинцом.
1.3 Ртуть и ее соединения
Ртуть
является тяжелым металлом, который встречается в окружающей среде в различных
формах. Наиболее важными с токсикологической точки зрения является
металлическая форма, также называемая элементной формой, дивалентные
неорганические формы и метилртуть. Пары ртути распределяются в атмосфере и с
осадками попадают в почву и водоемы [48]. Неорганическая ртуть в водной среде,
особенно кислой, подвергается бактериальному преобразованию до метилртути,
которая более токсична, чем элементная форма ртути [48,132,133]. Расчеты ученых
показали, что в ближайшие 50 лет выбросы ртути в атмосферу удвоятся [134].
Все соли ртути ядовиты и это требует большой осторожности при работе с
ними. Ртуть относится к первой группе чрезвычайно токсичных веществ. Пары ртути
в 7 раз тяжелее воздуха. Они хорошо поглощаются всеми предметами окружающей
среды (цементные, деревянные конструкции, штукатурка, ковры, меховые изделия,
ткани, мебель и др.). Десорбция осуществляется медленно и резко увеличивается с
повышением температуры [135]. Ртуть - единственный металл, находящийся в жидком
состоянии в условиях, которые мы называем нормальными [136]. Ртуть - в 13,6
раза тяжелее воды, температура плавления - 38,9°С [135,136]. У ртути довольно
большой коэффициент температурного расширения - всего в полтора раза меньше,
чем у воды, и на порядок, а то и два больше, чем у обычных металлов [137].
Человек подвергается воздействию соединений ртути в основном из трех
источников: пресноводная рыба, содержащая высокие концентрации метилртути,
амальгамы, используемые в стоматологии и вакцины, в которые добавляется
этилртуть, а также вдыхая пары ртути из атмосферы [43,48,138-142]. Пары ртути
быстро входят в клетку ввиду хорошей растворимости в липидах [143]. Метилртуть
проникает через мембраны, образуя водорастворимые комплексы, чьи структуры напоминают
структуры эндогенных веществ, переносимых посредством определенных транспортных
систем [143].
Соединения ртути, особенно ртутьорганические, токсичны [135]. Жидкая
ртуть опасна, прежде всего, своей летучестью: если хранить ее открытой в
лабораторном помещении, то в воздухе создается парциальное давление ртути 0,001
мМ. Это много, тем более, что предельно допустимая концентрация ртути в
промышленных помещениях 0,01 мг на м3 воздуха [137]. Безопасная доза,
рекомендованная Всемирной Организацией Здравоохранения равна 430 нг/кг/день
[142,143], однако некоторые ученые считают, что безопасная доза должна быть
60-110 нг/кг [142]. Летальная доза солей двухвалентной ртути около 1 г [135].
При отравлении ртутью и ее соединениями поражаются почки [48,135,137].
Ртуть действует и на центральную нервную систему, в основном на мозг
[47,48,132]. Дети в 5-10 раз более чувствительны, чем взрослые [47,132].
Метилртуть легко проникает через плаценту и в высоких дозах может причинять
серьезное повреждение развивающемуся мозгу [47]. У детей, подвергавшихся
внутриутробному воздействию ртути, может наблюдаться задержка развития
[48,142], отмечаются серьезные повреждения мозга [132]. Органические соединения
ртути, в основном метилртуть, аккумулируются в эритроцитах и особенно много в
головном мозге.
Высокое сродство связывания иона Hg2+ с тиоловыми или сульфгидрильными группами белков, как
полагают, является основным механизмом биологического действия ртути [144-146].
В результате действия ртути, возможно, происходит инактивация различных
ферментов, структурных белков, или транспортных процессов [147]; или изменение
проницаемости клеточных мембран [148]. Ртуть может взаимодействовать так же и с
другими участками белков, например, амино- или карбоксильными группами.
Исследованы разнообразные изменения, вызванные действием ртути, включая
повышение окислительного стресса, увеличение проницаемости
гемато-энцефалического барьера, нарушение синтеза белка, репликации ДНК,
разрушение мембран, ухудшение иммунного ответа, нарушение гомеостаза кальция.
Ртуть действует на активность ферментов микросом печени [149].
Интраперитональное введение ацетата ртути 6,2 мкмоль/кг/день в течение 6 дней
или введение разовой дозы 15,68 мкмоль/кг приводило к повышению веса почек и
значительному снижению содержания цитохрома P-450.
Посредством изменения тиолового статуса внутри клетки, ртуть может
содействовать окислительному стрессу, перекисному окислению липидов,
митохондриальной дисфункции [150]. HgCl2 вызывает деполяризацию внутренней
мембраны митохондрий, с последовательным увеличением образования H2O2 [151].
Было предположено, что изменения кальциевого гомеостаза митохондрий может
усилить, вызванный Hg2+ окислительный
стресс в клетках почек, в результате которого происходят многочисленные
биохимические изменения биомолекул [152].
Взаимоотношение между связыванием тиолов и клеточной дисфункцией или
повреждением недостаточно ясно. Было предположено, что ртуть или метилртуть
входят в проксимальные трубчатые эпителиальные клетки и, пройдя через
базолатеральную мембрану, ртуть взаимодействует с тиол-содержащими
соединениями, преимущественно с глутатионом и металлотионеионом. Это
взаимодействие вызывает изменения в проницаемости мембран к ионам кальция и
ингибирование функций митохондрий. В почках, повреждение эпителиальных клеток
происходит как результат повышения образования свободных радикалов и
перекисного окисления липидов [153]. Кроме того, предполагается, что ртуть
приводит к истощению клеточных механизмов защиты против окислительного
повреждения, таких как глутатион, супероксиддисмутаза, каталаза,
глутатионпероксидаза [153].
В настоящее время большое количество работ посвящено исследованиям
влияния ртути и ее соединений на разные функции организма: иммунную систему
человека и животных, нейроэндокринную и сердечно-сосудистую системы
[142,154-156]. Сегодня ртуть является одним из наиболее известных потенциальных
нейротоксинов, оказывающих ряд неблагоприятных эффектов на здоровье человека и
животных. Поскольку источников поступления ртути в окружающую среду много,
население подвергается влиянию ртути в повседневной жизни, в профессиональной
деятельности, и при случайных воздействиях. Несмотря на многочисленные
исследования последствий ртутной интоксикации организма человека и животных,
исследование механизмов токсического действия ртути и ее соединений необходимы
для решения задач по охране здоровья населения.
1.4 Механизмы токсического действия химических
соединений
В настоящее время человечеству известно около 10 миллионов химических
соединений. Из них более 60 тысяч широко используются в быту, медицине, на
производстве и в сельском хозяйстве. Количество веществ продолжает расти из
года в год (по некоторым данным примерно на 1000 наименований ежегодно). И
большая их часть при определенных обстоятельствах может причинить серьезный
вред здоровью [52].
Почти 70 % токсичных металлов попадает в организм с пищей, а поскольку в
настоящее время именно пищевые продукты являются предметом интенсивной
международной торговли, то объединенная комиссия ФАО (международная организация
в области продовольствия) и Всемирная Организация Здравоохранения по Пищевому
Кодексу (Сodex Alimentarius) включила в число пищевых компонентов, подвергаемых
контролю в международной торговле, восемь наиболее опасных токсичных элементов:
ртуть, кадмий, свинец, мышьяк, медь, олово, цинк, железо. В России к ним
добавили еще семь: сурьма, никель, селен, хром, алюминий, фтор, йод [135].
Механизмом токсического действия называется взаимодействие токсиканта или
продуктов его превращения в организме со структурными элементами биосистем,
лежащее в основе развивающегося токсического процесса. Чаще в основе
токсического действия лежат химические реакции токсиканта с определенным
структурным элементом живой системы («рецептором» или «мишенью»). Механизмы
токсического действия подавляющего большинства химических веществ в настоящее
время неизвестны [52]. Структурными элементами клеток, с которыми
взаимодействуют токсиканты, как правило, являются: белки, нуклеиновые кислоты,
липидные элементы биомембран [151,157-160 ].
Токсический эффект развивается при нарушении любой из функций белков.
Токсикант нарушает свойства белка различными способами (денатурация белка,
блокада его активных центров, связывание активаторов и молекул, стабилизирующих
протеин, и т.д.). К числу веществ, денатурирующих белки, относятся крепкие
щелочи, кислоты, окислители, ионы тяжелых металлов. В основе денатурации лежит
повреждение внутрибелковых связей, поддерживающих вторичную, третичную
структуру протеина. При этом наиболее часто токсиканты взаимодействуют с СООН-,
NH-, OH-, SH-группами аминокислот, образующих белки. Многочисленные токсиканты,
связывающиеся с SH-группами, называются тиоловыми ядами. К числу тиоловых ядов
прежде всего следует отнести тяжелые металлы, такие как ртуть, мышьяк, сурьма,
таллий, органические соединения этих металлов (метилртуть, люизит и т.д.).
Другие металлы более активно взаимодействуют с карбоксильными группами (свинец,
кадмий, никель, медь, марганец, кобальт) [52].
Особое значение имеет действие ксенобиотиков на ферменты. Роль ферментов
в обеспечении процессов жизнедеятельности огромна. Неудивительно, что вещества,
модулирующие их активность, обладают высокой биологической активностью, порой
являются высокотоксичными веществами.
Снижение активности ферментов при действии токсикантов может быть
следствием трех эффектов: подавления процессов синтеза апофермента и
кофакторов, активации разрушения, угнетения специфической активности. Кофакторы
частично синтезируются в организме, а частично поступают с пищей в форме витаминов.
Некоторые вещества являются конкурентами кофакторов ферментов, а некоторые
токсиканты нарушают образование коферментов, предшественники которых поступают
в организм с пищей. Так, гидразин и его производные, взаимодействуя с
пиридоксалем, содержащимся в клетках, образуют пиридоксальгидразоны (рисунок
2), которые, в свою очередь, угнетают активность пиридоксалькиназы и блокируют
тем самым синтез в организме пиридоксальфосфата [52]. В итоге понижается
активность большого числа ферментов, кофактором которых является
пиридоксальфосфат (декарбоксилазы, трансаминазы и т.д.).

Рисунок
2 - Взаимодействие гидразина с пиридоксалем с образованием пиродоксальгидразона
Наиболее часто в основе интоксикации лежит угнетение токсикантом
специфической активности ферментов [130]. Связывание токсикантами ионов
металлов, необходимых для осуществления ферментативной активности, приводит к
угнетению активности ферментов [151].
Поскольку все процессы в живых организмах протекают при участии
ферментов, и все фундаментальные свойства живых систем неразрывно связаны с
нормальным течением этих процессов, теоретически любые проявления жизни могут
быть нарушены теми или иными токсикантами, изменяющими активность ферментов
[52].
Многие ксенобиотики вступают во взаимодействие с нуклеиновыми кислотами,
изменяя их свойства [159,162]. К числу веществ, вступающих в химическое
взаимодействие с нуклеиновыми кислотами, относятся гидразин и его производные,
нитрозамины. Эти токсиканты, образуют ковалентные связи с аминогруппами
пуриновых и пиримидиновых оснований, входящих в структуру нуклеиновых кислот.
Измененные таким образом молекулы ДНК могут подвергаться дальнейшей
ферментативной и неферментативной трансформации вплоть до разрушения под
воздействием эндонуклеаз. Токсиканты способны вступать во взаимодействие не
только с пуриновыми и пиримидиновыми основаниями, но и с углеводно-фосфатной
основой молекулы нуклеиновой кислоты. При этом происходит её денатурация.
Ряд токсикантов оказывает опосредованное мембранотоксическое действие,
повышая уровень внутриклеточного Са2+, активируя эндогенные фосфолипазы,
свободнорадикальные процессы в клетках и т.д. В результате образования
свободных радикалов повреждаются самые разные структуры-мишени: липидные
мембраны, свободные аминокислоты, полисахариды, нуклеиновые кислоты,
рецепторные молекулярные комплексы, транспортные протеины [158,163]. Итогом
такого действия является изменение функционального состояния и гибель клетки,
мутация её генетического кода, что, как уже указывалось, на уровне
макроорганизма приводит к явлению массивной клеточной гибели (некроз),
разрастанию соединительной ткани в органе (фиброз), мутагенезу, развитию
новообразований в отдаленные периоды после действия токсиканта.
Токсическое действие многих веществ сопряжено с их влиянием на состояние
мембранных структур. Мембрана образована двумя слоями молекул липидов,
гидрофобные части которых направлены друг к другу, а гидрофильные в сторону
окружающей и внутренней среды клетки [53,164-166]. Основные группы липидов -
фосфолипиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин,
сфингомиелин), гликолипиды, нейтральные липиды (холестерол и т.д.). Молекулы
липидов легко диффундируют в липидных слоях. Время нахождения отдельной
молекулы на неизменной позиции составляет 10-8 - 10-9 сек. Обмен молекулами
между слоями осуществляется редко. Распределение молекул различного строения
между слоями асимметрично. В мембрану встроены белковые молекулы, которые часто
пронизывают всю ее толщу, либо погружаются на различную глубину, локализуясь на
внешней или внутренней стороне. Углеводный компонент клеточной мембраны
представлен главным образом гликопротеинами. Они располагаются на внешней
поверхности мембраны. Мембраны различных клеток существенно различаются по своему
строению и функциям [53]. В клеточной мембране печени обнаруживается около 20
ферментов [167]. Активность ферментов во многом зависит от липидного состава
мембран. Особыми свойствами обладают возбудимые мембраны нервной, мышечной и
железистой тканей. Изменение их свойств в ответ на стимул являются важнейшим
звеном цепи биологических процессов, лежащих в основе формирования реакции
организма на внешние и внутренние раздражители. Клеточные мембраны чрезвычайно
динамичный элемент. Их строение изменяется в соответствии с условиями
окружающей среды и потребностями клетки [53].
Благодаря ненасыщенности углеводородной цепи жирных кислот, фосфолипиды
клеточных мембран предрасположены к реакции окисления, инициируемой свободными
радикалами, образующимися в клетке [168-170].
Наиболее вероятным механизмом опосредованного повреждения биологических
мембран при интоксикациях является активация перекисного окисления липидов
[170]. Существенная активация процесса образования свободных радикалов при
химических воздействиях приводит к усилению перекисного окисления липидов и
повреждению биологических мембран.
В результате действия многочисленных токсикантов (бензола, толуола,
динитробензола, хлороформа, тяжелых металлов и других денатурирующих агентов)
может нарушаться проницаемость и структурная целостность мембран, что приводит
к деформации, лизису клетки и её гибели. При действии таких веществ на мембраны
эритроцитов развивается гемолиз.
Следует отметить, что в настоящее время большое внимание уделяется
исследованиям регуляторной функции эритроцитарных мембран, отражающей
возникновение и развитие патологических изменений во внутренних органах. В то
же время эритроцитарным мембранам присущи общие принципы организации
биологических мембран, и они выполняют ряд функций, характерных для других
мембран [171-173].
Имеются данные, что ионы тяжелых металлов вызывают гемолиз эритроцитов
[174]. Результаты исследований показали, что гемолиз, вызванный действием
металлов, связан с развитием перекисных процессов в мембране. Было предположено,
что перекисное окисление мембранных липидов является возможным механизмом
повреждения эритроцитарных мембран, и развитие перекисных процессов
предшествует гемолизу, вызванному ионами тяжелых металлов. Окислительная
модификация увеличивает хрупкость мембран эритроцитов [175-176].
Свободные радикалы могут активировать молекулярный кислород путем
одновалентного восстановления последнего до супероксид-аниона (О2-*) [177,178].
Супероксид при взаимодействии с водой с большой скоростью дисмутирует с образованием
перекиси водорода (Н2О2) и чрезвычайно активного оксиданта - гидроксильного
радикала (*ОН). Некоторые металлы с переменной валентностью (медь, железо)
способны катализировать в организме реакции такого типа [55]. Эти, так
называемые, вторичные радикалы представляют высокую опасность для клетки.
Обладая достаточной стабильностью, они взаимодействуют с самыми разными
биомолекулами, и не только повреждают их, но и провоцируют цепные реакции
дальнейшего образования активных радикалов из липидов, аминокислот, нуклеиновых
кислот и т.д. [170]. Интегральный эффект такого каскада радикал-инициирующих
реакций приводит к значительному нарушению физиологии клетки, её повреждению.
Таким образом, в основе токсического действия веществ лежит повреждение
клеток, сопровождающееся их функциональными, либо структурно-функциональными
изменениями.
1.5 Значение витамина С для организма
Широко известный витамин С в химическом отношении является простейшим
среди витаминов. Аскорбиновая кислота обнаружена и в животном и в растительном
мире, во всех частях растений, и часто в достаточно больших количествах [56].
Витамин С является γ-лактоном, близким по структуре к глюкозе [179]. Его
молекула имеет два асимметрических атома углерода (4С и 5С) и четыре оптических
изомера. Биологически активна только L-аскорбиновая кислота.
Биосинтез L-аскорбиновой
кислоты из D-глюкозы у растений осуществляется
посредством биохимических процессов, отличных от тех, которые имеют место у
животных, способных к ее биосинтезу. Организм человека не способен
синтезировать аскорбиновую кислоту в связи с отсутствием L-гулонолактоноксидазы. Поэтому
человек целиком зависит от поступления витамина С с пищей [56].
У человека
аскорбат действует как необходимый кофактор для нескольких ферментов,
катализирующих реакции гидроксилирования [54]. В процессе биосинтеза коллагена
гидроксилирование аминокислот пролина и лизина катализируется
пролилгидроксилазой и лизилгидроксилазой - ферментами, которые функционируют
при участии аскорбиновой кислоты, ионов Fe2+ и α-кетоглутарата. Очевидно, роль
аскорбиновой кислоты заключается в сохранении восстановленного состояния
кофактора гидроксилазы - атома железа.
В дополнение к его роли как кофактора фермента, другая главная функция
аскорбата - ловушка для радикалов в водной фазе [180]. Витамин С занимает
доминирующее положение во внеклеточной антиоксидантоной защите [54]. Он
является также важнейшим внутриклеточным антиоксидантом. Антиоксидантная
функция аскорбиновой кислоты объясняется ее способностью легко отдавать два
атома водорода, используемых в реакциях обезвреживания свободных радикалов
[179,181].
О важности витамина С для организма человека свидетельствуют последствия
его дефицита в течение даже короткого периода времени [182]. Кроме цинги
существует много других патологических состояний, для лечения которых
используют витамин С. Есть данные, что витамин С эффективен для профилактики и
лечения не менее сорока патологических состояний [54,183-187]. Помимо
использования в медицине, аскорбиновая кислота применяется для стимулирования
прорастания семян и роста корней, для защиты растений от вредного воздействия
озона, в качестве добавки к кормам для животных. В пищевой промышленности
аскорбиновая кислота применяется в качестве пищевой добавки с целью повышения
питательности и в качестве антиоксиданта [56].
Сама аскорбиновая кислота является восстановителем и, следовательно, не
может непосредственно способствовать окислению. Но внутри живой клетки витамин
С может существовать в различных формах, которые образуют окислительно-восстановительные
пары. Эти пары способны осуществлять как окисление, так и восстановление
компонентов других пар в зависимости от их окислительно-восстановительного
потенциала [179].
Все известные биохимические реакции с участием витамина С можно разбить
на 3 группы: окислительные (гидроксилирование), восстановительные (например,
защита сульфгидрильной группы легко окисляемого трипептида глутатиона и
устранение потенциально опасных окислительных свободных радикалов) и
окислительно-восстановительные (имеющие отношение к переносу электронов и
мембранному потенциалу через установление протонного градиента)
[54,180,184-186,188-190].
В процессе метаболизма липидов жирные кислоты с нечетным числом атомов
углерода подвергаются α-окислению монооксигеназой и последующему
декарбоксилированию, давая производные с четным числом атомов углерода. Эта
реакция также требует присутствия витамина С [56].
Сочетание аскорбата и ионов металлов переходной валентности и пероксида
водорода (H2O2) является эффективной системой генерирующей гидроксильные
радикалы. Хотя прооксидантная роль аскорбата в этой системе была хорошо
характеризована в условиях in vitro, нет уверенности, действует ли аскорбат
также как прооксидант при физиологических условиях [191]. Имеются данные
доказывающие, что даже в присутствии потенциал-активного железа или меди, или
H2O2, аскорбат действует как антиоксидант, который предотвращает перекисное
окисление липидов и не содействует окислению белка в плазме человека в условиях
in vitro [191].
Аскорбиновая кислота на границе раздела липиды/водная фаза обеспечивает
защиту витамина Е или восстанавливает его окисленную форму после атаки
свободных радикалов [179].
Витамин C
предотвращает образование гидроперекисей липидов липопротеинов плазмы
[192-194], например липопротеионов низкой плотности (ЛНП), и таким образом
витамин C выполняет важную функцию в
предупреждении формирования атеросклеротических бляшек.
Свободные
радикалы включаются и в инициирование рака, и в стимулирование опухоли.
Аскорбиновая кислота может блокировать некоторые из этих процессов [183]. Кроме
того, аскорбиновая кислота, действуя как ловушка нитритов, ингибирует
формирование канцерогенного нитрозоамина из пищевых предшественников [56].
Так как
антиоксидантная функция витамина C общепринята и важна для здоровья человека,
то заболеваемость и смертность от двух главных свободнорадикальных болезней -
рака и сердечно-сосудистой болезни - должна быть использована как критерий для
определения необходимости витамина C. Результаты эпидемиологических и клинических
исследований показывают, что защитная концентрация витамина C в плазме для
минимального риска свободнорадикальных заболеваний выше, чем 50 мкмоль/л [187,
195].
Следующие животные ткани содержат витамин С в убывающем порядке:
надпочечники, гипофиз и лейкоциты, мозг, хрусталики глаз и поджелудочная
железа, почки, селезенка и печень, сердечная мышца, молоко, плазма. В
большинстве этих тканей функция витамина С заключается в поддержании
структурной целостности посредством участия в биосинтезе коллагена. Повышенное
содержание витамина С в одних органах по сравнению с другими отражает
специфические функции, выполняемые аскорбиновой кислотой в этих органах [56].
Даже сегодня не прекращается полемика об оптимальных дозах витамина С,
которые следует принимать: рекомендации различных авторов колеблются от 30 мг
до 10 г в день [182,196]. В медицине существует направление, рекомендующее
прием мегадоз (1-10 г в день). Однако организм человека способен аккумулировать
не более 4г. Избыточные количества, которые не успевают метаболизироваться
(скорость метаболизма 5-20 мг в день) выводятся почками в неизмененном
состоянии. В некоторых случаях прием мегадоз может стать причиной заболевания
[56].
Рекомендуемые диетические нормы (РДН) на протяжении последних десятилетий
испытывали большие колебания, изменяясь от 10 мг витамина С в день до
количеств, в тысячи раз больших [182,196]. В настоящее время цифры, приведенные
в таблице 2, считаются оптимальными.
Таблица 2 - Рекомендуемые диетические нормы (РДН) ежедневного потребления
витамина С
|
РДН / мг в день
|
|
Младенцы
|
35
|
|
Дети
|
45
|
|
Подростки
|
50
|
|
Взрослые
|
60
|
|
Беременные женщины
|
80
|
|
Кормящие матери
|
100
|
|
Старики
|
150
|
Уровень аскорбиновой кислоты в плазме порядка 1,4-2,0 мг% отражает
насыщение всех тканей организма витамином С (1500-3000 мг). Уровень в плазме
снижается при многих патологических состояниях. Норма содержания витамина С в
плазме колеблется в широких пределах - от 0,6 до 2,5 мг % [56].
1.6 Роль витамина Е в организме
Витамин Е - один из наиболее важных жирорастворимых витаминов. Термин
витамин Е используется для 8 природных жирорастворимых биоактивных веществ,
включающих 4 токоферола (α-, β-, γ- и δ-токоферол) и 4 токотриенола (α-,
β-, γ- и δ-токотриенол). Различные формы
витамина отличаются друг от друга по биологической активности [197]. Из всех
изомеров витамина Е, a-токоферол
обладает наибольшей биологической активностью [198]. Эта разновидность витамина
Е используется организмом селективно и встречается в достаточно большом
количестве в крови и тканях человека [199]. Например, при том, что количество γ-токоферола в пище выше, чем
количество α-токоферола, концентрация γ-токоферола в плазме составляет лишь
~10 % от плазменной концентрации α-токоферола.

Молекула
a-токоферола состоит из двух циклов с гидроксильной
группой (хроманольная часть) и гидрофобной углеводородной цепи (фитольная
группировка). Такая структура a-токоферола определяет его
амфифильные свойства и различные механизмы его защитной функции в биологических
мембранах. Углеводородная цепь во втором положении, вероятно, облегчает
включение и сохранение витамина Е в биомембранах. Фитольная боковая цепь может
быть важной и в распределении витамина в более подходящей позиции в мембране
для улавливания перекисных радикалов [200]. Предполагают, что хроманольная
часть a-токоферола расположена около поверхности мембраны, а
гидроксильная группа может быть связана водородной связью с карбонильным эфиром
фосфатидилхолина [201]. Вероятно, образование водородной связи удерживает
молекулу a-токоферола в мембране на близком расстоянии от
поверхности.
В организме человека и животных a-токоферол найден в больших количествах в крови и тканях. Он
преимущественно локализован в мембранах субклеточных органелл, таких как
митохондрии, эндоплазматический ретикулум, а также в Рисунок 3 - α-Токоферол плазматической мембране
клеток [202-204].
При недостатке витамина Е, животные обычно более чувствительны к влияниям
неблагоприятных факторов среды, у них развиваются неврологические повреждения и
мозжечковая атаксия. Дефицит витамина Е в пище вызывает перекисное окисление в
тканях печени крыс, тогда как добавление α-токоферола в рацион действует как
защитный фактор при генерации свободных радикалов [205]. Установлено, что
недостаток витамина Е в миокарде приводит к активации ПОЛ в сердечной мышце и
повреждению мембран кардиомиоцитов [206]. В настоящее время не вызывает
сомнения тот факт, что все проявления Е-авитаминоза у человека и животных
вызываются нарушениями ультраструктуры клеточных мембран, что, в свою очередь,
связано с изменениями их физико-химических свойств и функций клеток.
В вопросе
адекватной дозы витамина Е для человека нет единого мнения [207,208]. По
некоторым данным (данные US Food and Nutrition Board) рекомендуется 8 мг в день витамина Е для женщин и 10
мг в день - для мужчин.
Как
липофильная молекула, витамин E
плохо растворим в гидрофильной среде плазменных, внеклеточных и
цитоплазматических жидкостей. Подобно другим липофильным витаминам, токоферол
может быть связан со специфическими протеинами или липопротеинами в период
абсорбции, транспорта и распределения в тканях. Все формы витамина E связываются интестинальными клетками
и попадают в кровообращение с хиломикронами. В печени из всех поступающих
токоферолов специфический протеин, альфа-TTP, селективно выделяет альфа-токоферол для включения в
липопротеиды очень низкой плотности (ЛПНП) [209,210]. Другие формы выделяются с
желчью и мочой в виде карбоксиэтилгидрорксихроманов (CEHCs). Альфа-TTP-дефицитные пациенты имеют чрезвычайно низкую плазменную концентрацию
альфа-токоферола и страдают от неврологических симптомов, типичных для дефицита
витамина E, включая мозжечковую атаксию
[211,212]. Низкие концентрации альфа-TTP также были обнаружены в мозге, селезенке, легком и почках [213]. Дефицит
витамина E сильно увеличивает концентрацию mRNA альфа-TTP [214,215]. Внутриклеточный транспорт может
происходить с помощью недавно обнаруженных токоферол-ассоциированных протеинов
(ТАР). TAP также может действовать как
молекулярный “наставник”, который защищает токоферол от
токоферол-метаболизирующих ферментов. TAP может иметь функцию регулирования встраивания токоферола в мембраны,
регулировать концентрацию альфа-токоферола [216] и распределение
альфа-токоферола [217]. Норма абсорбции альфа-токоферола постоянна при
фракционном увеличении дозировки (до 150 милиграмм) [218]. Однако возможность
увеличения плазменной концентрации альфа-токоферола ограничена [219-222]. Была
замечена существенная вариация (в 6 раз) абсорбции альфа-токоферола эритроцитами.
Причины этого могут включать вариации активности альфа-TTP, уровень метаболизма, содержание липидов и их состав,
статус других микроэлементов, которые участвуют в метаболизме альфа-токоферола
и условия окружающей среды.
Несмотря на
то, что многие ферменты и соединения вовлекаются в защиту клеток от
неблагоприятных эффектов окислительного стресса, витамин Е занимает
значительное и уникальное положение в общей антиоксидантной защите [223-227].
Витамин Е выступает в качестве липофильного антиоксиданта, способного
реагировать с перекисными радикалами для предотвращения свободнорадикального
процесса [228]. Имеются данные, что достаточное потребление витамина Е и других
антиоксидантов может обеспечить защиту от чрезмерно высоких концентраций
свободных радикалов, образующихся в результате действия неблагоприятных
факторов среды [229,230].
Предполагают,
что витамин Е защищает от повреждающего действия свободных радикалов, которые
могут вносить вклад в развитие хронических болезней типа рака [231,232].
Попытка предотвратить рак с помощью витамина E основана на данных, что онкогенез является следствием
воздействия свободных радикалов на ДНК. Как антиоксидант, витамин E может ингибировать развитие рака,
удаляя соединения реактивного кислорода или азота. Показано, что прием в
течение нескольких лет α -токоферола изолированно и в сочетании с селеном и
бета-каротином снижает заболеваемость раком [233-235]. Витамин E также может блокировать образование
нитрозоаминов, которые являются канцерогенами сформированными в желудке от
нитритов пищи. Он также может защищать от развития раковых образований, повышая
иммунную функцию [236]. Витамин E
может иметь антиканцерогенное действие, так как дефицит витамина E ослабляет иммунную функцию, включая T- и B-клеточные функции [237].
Витамин Е
используют при различных патологических состояниях. Из-за своих антиоксидантных
свойств, витамин E, как полагают,
предотвращает болезни, связанные с окислительным стрессом, в том числе
сердечно-сосудистые болезни, рак, хроническое воспаление и неврологические
нарушения [223, 238-240].
Окислительная
модификация липопротеидов низкой плотности (ЛНП), рассматривается как ключевой
шаг в инициировании и развитии сердечно-сосудистых болезней. Способность
α-токоферола
ингибировать окисление ЛНП была показана in vitro. Было предположено, что витамин E также способен предотвратить
атеросклероз, поскольку ингибирование окисления ЛНП антиоксидантами приводит к
ингибированию ранних атерогенных событий. Есть данные, что потребление α
-токоферола снижает
смертность от сердечно-сосудистых болезней [241]. Кроме того, показано, что
витамин E восстанавливает ослабление иммунной
функции, связанное со старением [242,243]. Эти эффекты не зависят исключительно
от антиокислительной способности токоферолов.
Витамин E включается в разнообразные
физиологические и биохимические процессы, и, кроме роли как антиоксиданта,
витамин E, особенно альфа-токоферол, может
иметь альтернативные функции.
Влияние
альфа-токоферола на активность некоторых генов - одно из наиболее интересных
наблюдений, сделанных в области исследования витамина E [244]. Было показано регулирование α-тропомиозина α-токоферолом, но не b-токоферолом [245]. Экспрессия α-тропомиозина может играть роль в
индуцированном α-токоферолом ингибировании пролиферации клеток гладких
мышц. Эти результаты поддерживают более ранние предложения, что α-токоферол не только антиоксидант, но
также является транскрипционным регулятором экспрессии гена [244,246].
В дополнение к классической роли витамина как антиоксиданта,
предполагают, что витамин Е включается в структурные взаимоотношения с
полиненасыщенными жирнокислотными остатками мембранных фосфолипидов [247,248].
Являясь необходимым компонентом липидного бислоя биологических мембран, он
обеспечивает их структурно-функциональную стабильность [249,250]. Образование
комплексов a-ТФ с жирными
кислотами осуществляется посредством образования водородной связи с
гидроксильной группой хроманового ядра a-ТФ и карбоксильной группой жирной кислоты, а также
взаимодействием ацильной цепи жирной кислоты с метильными группами
ароматического кольца (хроманового ядра) токоферола [251,252]. Фитольная цепь a-ТФ облегчает включение и удержание
витамина Е в мембране и может играть значительную роль в распределении витамина
Е в наиболее подходящей позиции для создания локальных концентраций в мембране,
способствующей его антиоксидантной деятельности [200]. При этом, за счет
достаточно жесткой фиксации в липидном бислое, снижается ее подвижность [200].
Таким образом, можно предположить, что для реализации полифункционального
действия витамина Е в мембране необходимым является как наличие хроманового
ядра с гидроксильной группой, так и гидрофобная боковая цепь a-токоферола.
1.7 Селен и его биологическая роль
На фоне многочисленных исследований по оценке витаминной обеспеченности
проблеме микроэлементозов уделяется недостаточное внимание. Среди различных
причин можно выделить недостаточное понимание важности адекватной
обеспеченности организма эссенциальными микроэлементами, а также значительные
трудности диагностики недостаточной обеспеченности такими микроэлементами как
цинк, медь, хром, селен [57]. Эссенциальность селена для человека установлена в
середине 20 века [253] и еще сравнительно недавно гораздо большее количество
публикаций было посвящено токсичности высоких доз селена. В настоящее время
ситуация кардинально изменилась и во всем мире проблема использования селена в
питании здорового человека и лечебно-профилактическом питании обсуждаются очень
активно [57].
Селен (Se) - 34-й элемент в Периодической системе элементов
Д.И.Менделеева, находится в 4-м периоде, 6-й (главной) подгруппе и является
химическим “двойником” серы. Подобно ей, он образует ряды неорганических
соединений, в которых проявляет валентность +2 (селениды), +4 (селениты) и +6
(селенаты). В своих элементоорганических соединениях селен двухвалентен и
близок по ковалентному радиусу к сере.
Главным источником Se в питании являются зерновые, особенно пшеница
[254-258]. Основными факторами, определяющими накопление Se в зерне, являются
химическая форма и уровень этого элемента в почвах, который может колебаться в
очень широких пределах [254,255,259,260]. В рыхлых, щелочных, хорошо аэрируемых
почвах Se присутствует в значительной мере в форме селенатов, которые хорошо
растворимы и легко усваиваются растениями. В кислых, заболоченных почвах Se
находится в виде малорастворимых комплексов с Fe, обладающих крайне низкой
биодоступностью.
Содержание в земной коре селена составляет 1∙10-5 % (0,1 ppm)
[261]. Уровень селена в основных тканях и биологических жидкостях организма
человека незначительно превосходит это значение. С другой стороны, некоторые
представители растительного царства, например астрагал [262] могут накапливать
до 0,1% (1000 ppm) Se. Токсичность некоторых дикорастущих растений и мухоморов
может быть обусловлена наличием в них соединений селена в очень больших
количествах. Много селена при высоком уровне этого элемента в среде обитания
могут накапливать дрожжи и прокариоты, в частности спирулина.
Селен поступает в организм человека обычно с различными продуктами
животного и растительного происхождения. Весь этот Se находится в двухвалентной
органической форме, причем в животных продуктах преобладает селеноцистеин
(Se-Cys), а в растительных - селенометионин (Se-Met) [255]. Искусственное снабжение
организма селеном может осуществляться также в виде неорганических солей:
селенита или селената натрия. Как органический, так и неорганический селен
легко всасываются в желудочно-кишечном тракте. Однако судьба органического и
неорганического селена в организме оказывается существенно различной.
Селенат- и селенитанионы, поступающие с пищей, быстро восстанавливаются
под действием белка тиоредоксина до селеноводорода, присутствующего при
физиологических значениях рН, в основном, в виде гидроселениданиона (HSe-).
Некоторое количество образующегося селеноводорода присоединяется к особым
селенсвязывающим белкам [57,266-268]. Емкость этого пула довольно ограничена.
Строго определенное количество селена, входящего в состав пула селеноводорода,
через стадию селенофосфата включается в высокоспецифический процесс синтеза
т.н. Se-специфических селенопротеинов[57,269-271], в числе которых находятся
компоненты жизненно важных антиоксидантных систем и другие ферменты. В состав
этих белков Se входит у позвоночных исключительно в виде остатка селеноцистеина
[57].
Избыточные количества селеноводорода медленно подвергаются
ферментативному метилированию с образованием, последовательно,
метилгидроселенида, диметилселенида и катиона триметилселенония. Эти соединения
Se экскретируются с мочой [272], а диметилселенид - в больших количествах также
и с потом [58]. Перечисленные возможности утилизации селеноводорода в организме
ограничены в количественном отношении и при поступлении в организм избыточных
количеств неорганического селена он может накапливаться в тканях в форме
свободного гидроселенид-аниона. Эта форма Se чрезвычайно токсична! В отличие от
животных, растительные организмы способны синтезировать селенометионин
(Se-Met). При потреблении в пищу растительных селенопротеинов селенометионин
всасывается и ассимилируется организмом [58,264]. Ввиду большого сходства
физико-химических свойств метионина и селенометионина последний способен
замещать первый в различных тканевых белках, включаясь по специфическому для
метионина механизму. Часть Se-Met метаболизируется с образованием
селеноцистеина. Последний может далее, во-первых, неспецифически включаться в
тканевые белки вместо цистеина. Во-вторых, часть селеноцистеина деселенируется
с образованием селенита, либо селеноводорода. Хотя в состав Se-специфических
селенопротеинов Se входит именно в составе селеноцистеина (Se-Cys), включение
Se-Cys в тканевые белки зависит от обеспеченности организма серусодержащими
аминокислотами так же, как и включение Se-Met.
Со способностью Se-Met депонироваться в тканевых белках, образуя мало
лабильный пул, связана, по всей видимости, гораздо его меньшая токсичность в
сравнении с селенитом и селенатом при пероральном поступлении.
При физиологических поступлениях Se с пищей (0,1-0,3 ppm) и нормальной обеспеченностью
серой эффективность Se-Met, селенита и селената как источников для синтеза
селен-специфических селенопротеинов одинакова. Однако, если уровень потребления
Se низок (менее 0,05 ppm) или организм плохо обеспечен метионином,
эффективность добавки неорганического Se выше, чем Se-Met [264]. Однако
токсичность Se-Met (органического селена) гораздо ниже, чем неорганического, то
есть гораздо меньше опасность передозировки. Кроме этого, ретенция
органического селена в организме как правило выше, чем неорганического.
Поэтому, большинство авторов рекомендуют органическую форму селена как
предпочтительную при снабжении организма селеном в профилактических целях
[57,273].
Селен, поступая в организм в виде селенита или селенсодержащих
аминокислот, включается в большое число белков - селенопротеинов [57,269-271].
В настоящее время идентифицировано и выделено в чистом виде от 10 до 12
селен-специфических селенопротеинов эукариот. Первым открытым у эукариот
селен-специфическим белком оказался фермент глутатионпероксидаза (GPX)
эритроцитов, известная в настоящее время как глутатионпероксидаза I (GPX-I).
Она катализирует равновесие следующей основной реакции:
H2O2 + 2 GSH= GSSG+ 2H2O
Другим известным селенопротеином является глутатионпероксидаза II
(GPX-II) - это тканевой фермент (главным местом ее синтеза являются печень и
сердце). Она катализирует реакцию:
ROOH +
2 GSH= GSSG+ ROH+H2O,
где R- алкильный радикал (обычно, фосфолипид).
Селен играет значительную роль в защите организма от свободнорадикальных
процессов [274-279].
Исследования Se-дефицитных
животных показали, что наряду с изменением антиоксидантной защитной системы
(снижается уровень Se и активность
глутатионпероксидазы, содержание восстановленного глутатиона [278]) дефицит
селена ведет к увеличению перекисного окисления липидов, снижению уровня
витамина Е в плазме и активации супероксиддисмутазы [276,279]. Введение
однократной дозы селенита натрия животным через 24 часа восстановило
оптимальный уровень селена в плазме и активность глутатионпероксидазы [276,279].
Уровень селена увеличился также в печени, мозге и почках [276]. Селен снижал
количество свободных радикалов, повышал активность глутатионтрансферазы, SH-групп и ослаблял токсические эффекты
алюминия при 30-дневном введении дозы 200 мкг/кг/день [274]. При введении 300
мкг/кг/день селенита натрия в течение 25 дней снижалось накопление малонового
диальдегида в эритроцитах, мышцах, печени, и повышались содержание витамина Е в
плазме и печени и активность глутатионпероксидазы в эритроцитах [275].
Получены данные о положительной корреляции между концентрацией селена и
активностью глутатионпероксидазы в плазме [276,277]. Результаты также
показывают, что наличие Se, и Cu в эритроцитах повышает
антиоксидантный статус организма, который в первую очередь зависит от
концентрации этих микроэлементов.
При глубоком недостатке соединений Se в диете человека возможно развитие
т.н. селенодефицитных состояний, таких как болезнь Кешан (кардиомиопатия) и
синдром Кашин-Бека (остеоартропатия). Географическое распространение этой
патологии достаточно однозначно коррелирует с особенностями геохимического
статуса Se. Для значительного числа регионов СНГ характерен “субоптимальный”
статус Se, не сопровождающийся специфической патологией, но способный привести
к снижению общей противоинфекционной, противоопухолевой резистентности
организма, его устойчивости к стрессам. В пределах этих местностей могут быть
выявлены отдельные категории населения (беременные женщины, дети, лица,
пострадавшие от радиации в Чернобыле), обеспеченность которых Se оказывается
еще значительно ниже среднего уровня. С другой стороны, при чрезвычайно высоком
содержании селена в пище (зерновых) у части популяции, может развиться
селеновая интоксикация (эндемичный селеноз). Границы области дефицита Se простираются
у взрослого человека от предельно низких уровней до 16-21 мкг/день. Ниже этого
предела потери Se не восполняются его поступлением с пищей, и наступает
практически полная инактивация GPX и других, связанных с Se, ферментативных
систем. Согласно рекомендациям ВОЗ, истинно безопасным уровнем потребления Se
является такой его прием, при котором активность GPX-I составляет 66% (2/3) от
максимальной. Для взрослых мужчин это составляет 40 мкг/день.
Заключение
Таким образом, из представленного обзора литературы следует, что
токсические вещества оказывают неблагоприятное действие на организм.
Используемое в качестве ракетного топлива высокотоксичное соединение
1,1-диметилгидразин представляет реальную опасность для населения. К веществам,
оказывающим неблагоприятное воздействие на организм, относятся тяжелые металлы,
среди которых свинец и ртуть являются одними из наиболее опасных ядов.
Механизмы токсического действия подавляющего большинства химических веществ в
настоящее время неизвестны. В основе токсического действия веществ лежит
повреждение клеток, сопровождающееся их функциональными, либо
структурно-функциональными изменениями. Изменению структуры и функции клеточных
мембран способствует образование активных форм кислорода. Увеличение генерации
реактивных форм кислорода в тканях могут повреждать липиды, белки, ДНК и
углеводороды. Эндогенная антиоксидантная защита организма (супероксиддисмутаза,
Н2О2-удаляющие ферменты, металл-связывающие белки) является недостаточной,
чтобы предотвратить повреждение полностью. Добавление антиоксидантов в пищу
снижает повреждающее действие токсических соединений. Антиоксиданты защищают
клеточные структуры от повреждения свободными радикалами и играют главную роль
в сохранении здоровья, оберегая целостность клеток и, в конечном счете, весь
организм.
Так как повреждающее действие многих неблагоприятных факторов реализуется
на клеточном и молекулярном уровнях, актуальным является исследование влияния
1,1-ДМГ, ртути и свинца на состояние клеточных мембран. Кроме того, особо важное
значение представляет скриниг биологически активных веществ для защиты
организма от вредного действия токсических соединений.
. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В соответствии с целью и задачами работы эксперименты проводились как в
условиях in vivo, так и in vitro.
Эксперименты в условиях in vitro проводили на эритроцитах человека.
Донорскую кровь (2+) получали в Республиканском центре крови.
Эксперименты в условиях in vivo проводили на кроликах-самцах породы
«Шиншилла» весом 3,5-4,0 кг. Животные содержались в стандартных условиях
вивария.
Эксперименты по изучению влияния 1,1-диметилгидразина (1,1-ДМГ) и
препарата «Селевит» на резистентность мембран эритроцитов проводили на 15
животных, разделенных на 3 группы. Животным контрольной группы вводили подкожно
физиологический раствор (1 группа). Животным второй группы вводили раствор
1,1-ДМГ из расчета 50 мг на кг массы тела, а животным третьей группы подкожно -
раствор 1,1-ДМГ (50 мг/кг массы тела) и перорально - препарат «Селевит» из
расчета 1 мл на кг массы тела. Биопрепарат «Селевит» представляет собой водный
раствор β-каротина, витаминов С, Е и селена.
Кровь у животных отбирали до введения препаратов, затем через 3, 6, 12 и
24 часа. Для получения крови сбривали шерсть по краю уха кролика. Бритвой
делали надрез вдоль краевой вены, кровь собирали в пробирку с гепарином. После
получения необходимого объема крови на область надреза накладывали тампон и
зажимали зажимом.
Выделение эритроцитов. Кровь центрифугировали 10 минут при 1000 g. Плазму
и лейкоциты удаляли, а эритроциты дважды промывали средой инкубации (СИ),
содержащей 150 мМ NaCl, 5 мМ Nа2НРО4 (рН-7,4). Полученную суспензию
эритроцитов использовали для проведения исследований. Перед опытом эритроциты
предварительно разводили в 10 раз СИ и инкубировали 5мин при 37оС.
Исследование влияния токсических или протекторных соединений в условиях in vitro проводили путем преинкубации эритроцитов с веществами
в среде инкубации при температуре 37ºС в течение 30 минут. Затем образцы
использовали для определения осмотической и перекисной резистентности
эритроцитов, проницаемости эритроцитарных мембран и активности каталазы
эритроцитов.
Осмотическая резистентность эритроцитов. Резистентность мембран
эритроцитов изучали, инкубируя пробы в термостате при 37оС в течение 20 мин в
растворах NaCl (0,35-0,9 г/100мл). Затем пробы центрифугировали 10 минут при
1000 g. и определяли оптическую плотность надосадочной жидкости при длине волны
540 нм. Уровень гемолиза клеток рассчитывали в процентах по отношению к
100%-ному гемолизу, вызванному раствором Na2CO3 в концентрации 0,1г/100мл..
Проницаемость эритроцитарных мембран (ПЭМ) определяли по методу [280].
Принцип метода определения ПЭМ - гемолиз в смесях изотонических растворов
мочевины и хлористого натрия, обусловленный способностью мочевины быстро
диффундировать через клеточную мембрану и, создавая гиперосмолярную
концентрацию внутри эритроцита, вызывать его набухание с последующим гемолизом.
Суспензию эритроцитов добавляли в среду, содержащую растворы мочевины (18
г/л) и NaCl (0,9 г/100 мл) в различном соотношении (65:35; 60:40; 55:45; 50:50;
45:55; 40:60). 100%-ный гемолиз вызывали, помещая суспензию эритроцитов в
раствор Na2CO3 в концентрации 0,1г/100мл. После 3 минутной инкубации пробы
центрифугировали при 1000 g 10 минут. и определяли оптическую плотность
надосадочной жидкости при длине волны 540 нм. Уровень гемолиза клеток
рассчитывали в процентах по отношению к 100%-ному гемолизу, вызванному
раствором Na2CO3
Перекисная резистентность эритроцитов. Интенсивность перекисного гемолиза
эритроцитов (ПГЭ) определяли по методу [281] в модификации [282]. Эритроциты
разводили в 5 раз СИ, инкубировали 10 мин при температуре З7oС и центрифугировали в течение 10 мин
при 1000g. К осадку эритроцитов добавляли
такой же объем СИ и по 100 мкл суспензии эритроцитов вносили в 2 мл среды
инкубации. Перекисный гемолиз проводили с использованием 1 М раствора Н2О2. Для
получения полного гемолиза использовали раствор додецилсульфата натрия в
концентрации 8 г/100мл. Все пробы инкубировали в течение 2 час при 37ºС, затем центрифугировали при 1000g 10 мин. Оптическую плотность
супернатанта измеряли при длине волны 540 нм.
Активность каталазы эритроцитов определяли по методу [283]. В суспензию
эритроцитов добавляли 1 мМ раствор перекиси водорода. Пробы инкубировали 10
минут и добавляли 1мл 4%-ного раствора молибдата аммония. Оптическую плотность
раствора регистрировали при длине волны 410 нм. Активность каталазы
рассчитывали в процентах по количеству разрушенной перекиси водорода
Характеристика использованных реактивов. В работе использовали реактивы
фирмы «Reanal» (Венгрия), «Алтей», «Реахим»
(Россия) квалификации «х.ч.» или «ос.ч.». Додецилсульфат натрия - «Serva».
Статистическая обработка данных. Полученные результаты статистически
обрабатывали с использованием программы Microsoft Excel, рассчитывая среднюю арифметическую параметра,
среднее квадратическое отклонение, ошибку средней арифметической. С учетом
критерия Фишера-Стьюдента зарегистрированные изменения показателей считали
достоверными при р£ 0.05.
3 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
3.1 Изолированное и сочетанное влияние
1,1-диметилгидразина, ионов Pb2+ и Hg2+на
состояние мембран эритроцитов в условиях in vitro
Влияние 1,1-диметилгидразина на состояние мембран эритроцитов в условиях in vitro.
Для изучения влияния 1,1-ДМГ на состояние клеточных мембран нами были
проведены исследования действия возрастающих концентраций токсиканта на гемолиз
эритроцитов в изотонических и гипотонических средах, перекисную резистентность
эритроцитов, проницаемость эритроцитарных мембран, активность каталазы
эритроцитов человека в условиях in vitro.
На рис.4 представлены результаты экспериментов по определению гемолиза
эритроцитов человека в растворе NaCl
0,9 г/100мл при действии 1,1-ДМГ. Из рисунка видно, что концентрации 1,1-ДМГ
1,3-2,6 мМ не оказывают влияния на степень гемолиза эритроцитов, и количество
гемолизированных клеток остается на уровне контроля. Повышение концентрации
токсиканта приводит к постепенному увеличению выхода гемоглобина из эритроцитов
до 3,2% в 65 мМ растворе. При концентрации 1,1-ДМГ 130 мМ наблюдается повышение
гемолиза до 18,9%, а в 650 мМ растворе уровень гемолиза достигает максимального
значения и составляет 74,7 %.

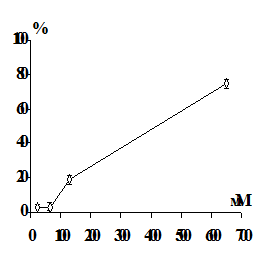
По
оси абсцисс: концентрация 1,1-ДМГ, мМ; по оси ординат: величина гемолиза в %
Рисунок
4 - Влияние 1,1-диметилгидразина на осмотическую резистентность эритроцитов в
условиях in vitro (раствор NaCl 0,9 г/100мл).
В
следующей серии экспериментов были проведены исследования влияния 1,1-ДМГ на
осмотическую резистентность эритроцитов в растворе NaCl 0,5 г/100мл
(рис.5). Как видно из рисунка, в контроле гемолиз составляет 3,3%. В растворе с
содержанием 1,1-ДМГ в концентрации 0,65 мМ выход гемоглобина из эритроцитов
практически не изменяется. С повышением концентрации токсиканта до 65 мМ
наблюдается постепенное увеличение гемолиза до 5%. Дальнейшее увеличение
количества 1,1-ДМГ до 130 мМ приводит к резкому повышению гемолиза до 79%, а
при 650 мМ отмечается максимальное количество гемолизированных эритроцитов -
82%.


По
оси абсцисс: концентрация 1,1-ДМГ, мМ; по оси ординат: величина гемолиза в %.
Рисунок
5 - Влияние 1,1-диметилгидразина на осмотическую резистентность эритроцитов в
условиях in vitro (раствор NaCl 0,5 г/100мл)
Результаты
экспериментов по исследованию действия 1,1-ДМГ на перекисную резистентность
эритроцитов представлены на рисунке 6. Уровень гемолиза в контроле составляет
30% (р£ 0.001). При
наличии в среде инкубации 1,1-ДМГ в концентрации от 0,65 мМ до 2,6 мМ
повышается перекисная резистентность эритроцитов относительно контрольной
величины, и гемолиз снижается до 2%. Минимальный уровень гемолиза сохраняется
до концентрации 1,1-ДМГ равной 26 мМ. При дальнейшем повышении концентрации токсиканта
наблюдается увеличение выхода гемоглобина из эритроцитов, и при концентрациях
от 65 до 130 мМ наблюдается резкое увеличение гемолиза эритроцитов от 3,9 до
33,5% .
Следовательно,
низкие концентрации 1,1-ДМГ (до 26 мМ) снижают перекисный гемолиз, тогда как
высокие концентрации резко увеличивают гемолиз эритроцитов.
На
рисунке 7 представлены результаты экспериментов по определению влияния 1,1-ДМГ
на проницаемость эритроцитарных мембран. Контрольный уровень гемолиза
составляет 14,1%.


По
оси абсцисс: концентрация 1,1-ДМГ, мМ; по оси ординат: величина гемолиза в %.
Рисунок 6 -
Влияние 1,1-диметилгидразина на перекисный гемолиз эритроцитов в условиях in vitro

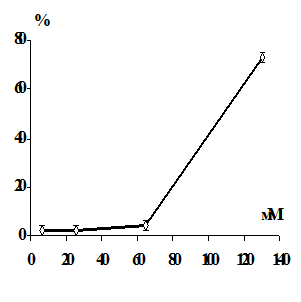
По
оси абсцисс: концентрация 1,1-ДМГ, мМ; по оси ординат: величина гемолиза в %.
Рисунок
7 - Влияние 1,1-диметилгидразина на проницаемость эритроцитарных мембран в
условиях in vitro
При
добавлении в среду инкубации 1,1-ДМГ до концентрации 6,5 мМ наблюдается
постепенное снижение проницаемости мембран эритроцитов и выход гемоглобина из
клеток снижается до 2%, который сохраняется и в 26 мМ растворе. Дальнейшее
повышение концентрации токсиканта до 65 мМ наблюдается постепенное увеличение
уровня гемолиза. При высоких концентрациях 1,1-ДМГ (от 65 до 130 мМ) количество
гемолизированных клеток увеличивается и достигает 73,2%.
В
следующей серии экспериментов, результаты которых приведены на рисунке 8,
исследовали активность каталазы эритроцитов в зависимости от содержания в среде
1,1-ДМГ.

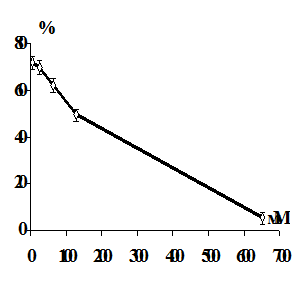
По
оси абсцисс: концентрация 1,1-ДМГ, мМ; по оси ординат: активность каталазы в %
Рисунок 8 -
Влияние 1,1-диметилгидразина на активность каталазы эритроцитов в условиях in vitro
Как видно из рисунка, в контроле активность каталазы составляет 62,5%.
При увеличении концентрации 1,1-ДМГ в среде инкубации от 0,65 мМ до 2,6 мМ
наблюдается повышение активности фермента, которая достигает максимальной
величины 72%. Такая величина активности антиоксидантного фермента сохраняется
до концентрации 1,1-ДМГ 6,5 мМ. При более высоких концентрациях 1,1-ДМГ
отмечается небольшое снижение активности фермента, которая в растворе 1,1-ДМГ
26 мМ составляет 69,7% и остается выше контроля, а в 65 мМ практически
равняется контрольной величине, составляя 62%. Дальнейшее увеличение содержания
в среде 1,1-ДМГ снижает активность каталазы, которая составляет 49,3 и 5,1% при
концентрации токсиканта 130 и 650 мМ, соответственно.
Таким образом, результаты наших экспериментов показывают, что при
увеличении концентрации 1,1-ДМГ повышается гемолиз эритроцитов в растворах NaCl. При этом гемолиз выше в 0,5 г/100
мл растворе NaCl, чем 0,9 г/100 мл. Это можно
объяснить тем, что раствор хлорида натрия 0,5 г/100 мл является гипотоническим,
где гемолизу подвергаются эритроциты, обладающие низкой осмотической
резистентностью, тогда как 0,9 г/100 мл - изотонический раствор, осмотическое давление
которого равно осмотическому давлению крови и в таком растворе гемолиз
практически отсутствует. Как показали наши эксперименты, 1,1-ДМГ повышает
гемолиз и в изотонической среде. По-видимому, это связано с интенсификацией
перекисного окисления липидов мембран, т. к. имеются данные, что под влиянием
гидразинов увеличивается концентрация супероксидных радикалов, которые способны
усиливать процессы ПОЛ [31]. Следовательно, перекисное окисление липидов
является причиной интенсификации гемолитических процессов при действии 1,1-ДМГ
как в изотонической, так и в гипотонической среде. Перекисная резистентность
эритроцитов тесно связана с активностью каталазы - антиоксидантного фермента,
функцией которого является преобразование токсичной для клетки перекиси водорода
до воды и молекулярного кислорода. Наши эксперименты показали четкую
зависимость между этими показателями. При низких концентрациях 1,1-ДМГ
повышается активность каталазы, следовательно, концентрация перекиси водорода в
среде снижается, что и приводит к снижению уровня гемолиза эритроцитов. С
повышением концентрации 1,1-ДМГ снижение способности каталазы утилизировать
субстрат приводит к увеличению количества H2O2 в среде,
следствием которого является усиление процесса гемолиза. С увеличением
активности каталазы при действии низких концентраций 1,1-ДМГ, вероятно, связано
и снижение уровня гемолиза в экспериментах по определению проницаемости
эритроцитарных мембран. Можно полагать, что повышение активности
антиоксидантных ферментов приводит к подавлению перекисных процессов в мембране
и снижению проницаемости мембраны для мочевины. При увеличении концентрации
токсиканта выше 65 мМ резко увеличивается гемолиз эритроцитов, что,
по-видимому, обусловлено изменением проницаемости мембран. Результаты по определению
активности каталазы тоже показали, что при концентрациях 1,1-ДМГ 65 мМ и выше
активность фермента резко снижается. При этих же концентрациях токсиканта было
зарегистрировано резкое снижение осмотической резистентности эритроцитов в
растворе 0,5 г/100 мл хлорида натрия.
Таким образом, результаты наших исследований показали, что при действии
высоких концентраций токсиканта антиоксидантная система не способна защитить
клеточную мембрану от повреждающего действия 1,1-ДМГ. Следовательно, при
концентрации 1,1-ДМГ 65 мМ и выше происходят изменения физико-химического
состояния мембран эритроцитов, в основе которых лежит интенсификация процессов
перекисного окисления мембранных фосфолипидов, что и является причиной
изменения проницаемости клеточных мембран и увеличения выхода гемоглобина из
клетки.
Влияние ацетата свинца на состояние мембран эритроцитов в условиях in vitro.
Результаты экспериментов по определению влияния различных концентраций
ацетата свинца на осмотическую резистентность эритроцитов в 0,5 г/100мл и 0,9
г/100мл растворах NaCl представлены
на рисунке 9. Как видно из рисунка, в контроле в гипотоническом растворе NaCl (0,5 г/100мл) гемолиз составляет
4,17 (р£0.005). При концентрации ацетата свинца 0,1
мМ количество гемолизированных эритроцитов составляет 4,52 %. С повышением
концентрации токсиканта до 2,5 мМ наблюдается постепенное увеличение гемолиза
до 8,52 %.
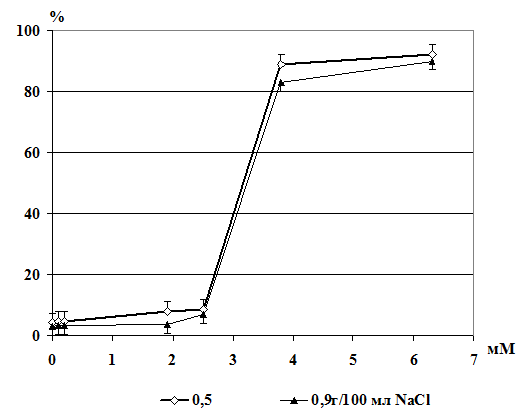
По
оси абсцисс: концентрация ацетата свинца, мМ; по оси ординат: величина гемолиза
в %.
Рисунок
9 - Влияние ацетата свинца на осмотическую резистентность эритроцитов в
условиях in vitro.
Дальнейшее
увеличение количества ацетата свинца в среде инкубации приводит к резкому
повышению гемолиза, который составляет 88,87 % при концентрации токсиканта 3,8
мМ. При более высоких концентрациях токсиканта степень гемолиза повышается
постепенно и незначительно, достигая значения 92,17 % при концентрации 6,3 мМ.
В
физиологическом растворе NaCl (0,9 г/100мл) гемолиз без добавления токсиканта
составляет 2,87 % (р£0.005).
Из рисунка видно, что концентрации ацетата свинца 0,1-1,9 мМ не оказывают
влияния на степень гемолиза эритроцитов, и количество гемолизированных клеток
остается на уровне контроля. Повышение концентрации токсиканта приводит к
постепенному увеличению выхода гемоглобина из эритроцитов до 6,81% в 2,5 мМ
растворе. Увеличение концентрации ацетата свинца до 3,8 мМ приводит к резкому
повышению гемолиза до 82,8 %, а при более высоких концентрациях токсиканта
количество гемолизированных эритроцитов увеличивается постепенно, составляя 90
% при концентрации свинца 6,3 мМ.
Сравнение
результатов осмотической резистентности эритроцитов в 0,5 г/100мл и 0,9 г/100мл
растворах NaCl выявило, что при всех исследованных концентрациях Pb2+
гемолиз эритроцитов выше в гипотоническом растворе, хотя кривая осмотического
гемолиза в этих двух растворах имеет одинаковый вид. Резкое увеличение гемолиза
в обоих растворах наблюдается при концентрации ацетата свинца равной 2,5 мМ.
При концентрациях токсиканта 3,8 мМ и выше уровень гемолиза эритроцитов
достигает максимального значения. В физиологическом растворе NaCl
(0,9 г/100мл) гемолиз без добавления токсиканта составляет 2,87 % (р£0.005). Из рисунка видно, что концентрации ацетата свинца
0,1-1,9 мМ не оказывают влияния на степень гемолиза эритроцитов, и количество
гемолизированных клеток остается на уровне контроля.
В
следующей серии экспериментов было исследовано действие ацетата свинца на
проницаемость эритроцитарных мембран (рис.10). Как видно из рисунка контрольная
величина гемолиза составляет 40% (р£0.005).
В растворе с содержанием ацетата свинца в концентрации 0,1-0,2мМ количество
гемолизированных эритроцитов остается на уровне контроля, а при повышении
концентрации токсиканта наблюдается плавное снижение гемолиза эритроцитов,
которое составляет 37,17% в 1,9 мМ растворе. Дальнейшее увеличение концентрации
токсиканта приводит к резкому снижению гемолиза до 19,29 % в 2,5 мМ растворе, а
затем к резкому повышению количества гемолизированных клеток до 90,97 % в 3,8
мМ растворе.
При
более высоких концентрациях свинца отмечается незначительное повышение степени
гемолиза, которое составляет 94,16 % при концентрации токсиканта 6,3 мМ.

По
оси абсцисс: концентрация ацетата свинца, мМ; по оси ординат: величина гемолиза
в %.
Рисунок
10 - Влияние ацетата свинца на проницаемость эритроцитарных мембран в условиях
in vitro
Результаты опытов по изучению эффектов ацетата свинца на перекисную
резистентность эритроцитов представлены на рисунке 11. В контроле уровень гемолиза
составляет 21,43 %. Как видно из рисунка, наличие в среде инкубации токсиканта
в концентрации до 0,2 мМ не оказывает влияния на резистентность эритроцитов и
количество гемолизированных клеток остается на уровне контроля. С повышением
концентрации свинца до 1,9 мМ наблюдается плавное увеличение степени гемолиза
до 29 %, после чего увеличение количества токсиканта приводит к более крутому
подъему уровня гемолиза эритроцитов, который составляет 72 % в 3,8 мМ растворе.
При дальнейшем повышении концентрации исследуемого вещества количество
гемолизированных клеток продолжает увеличиваться, но с более плавным приростом,
достигая значения 79 % в 6,3 мМ растворе свинца.
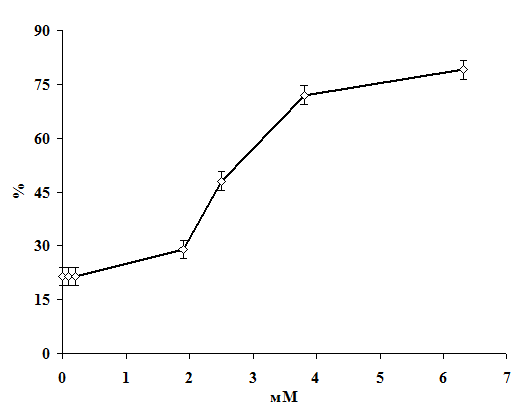
По
оси абсцисс: концентрация ацетата свинца, мМ; по оси ординат: величина гемолиза
в %.
Рисунок
11 - Влияние ацетата свинца на перекисный гемолиз эритроцитов в условиях in
vitro
В следующей серии экспериментов, результаты которой представлены на
рисунке 12, было исследовано влияние ацетата свинца на активность каталазы
эритроцитов. Как видно из рисунка, в контроле активность каталазы составляет
53,33 %, которая сохраняется и при содержании в среде токсиканта в концентрации
0,1 мМ. Увеличение концентрации токсиканта приводит к резкому снижению
активности фермента до 49 % в 0,2 мМ, а при концентрации свинца 1,9 мМ
количество утилизированной перекиси водорода составляет 41 %. При дальнейшем
повышении количества ацетата свинца отмечается повышение активности каталазы,
которая в 2,5 мМ и 3,8 мМ растворах составляет 46 % и 49 % и остается на уровне
ниже контрольного, и только при концентрации 6,3 мМ повышается до контрольной
величины.
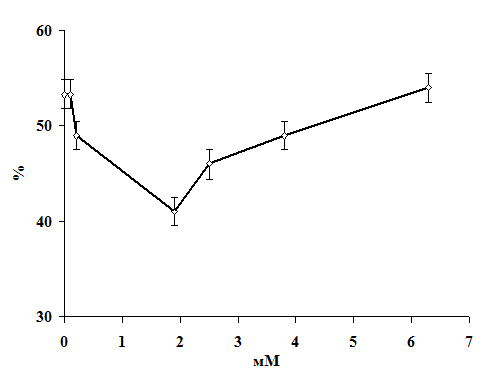
По
оси абсцисс: концентрация ацетата свинца, мМ; по оси ординат: активность
каталазы в %.
Рисунок
12 - Влияние ацетата свинца на активность каталазы эритроцитов в условиях in
vitro
Влияние
хлорида ртути на состояние мембран эритроцитов в условиях in vitro.
На
рисунке 13 представлены результаты экспериментов по определению влияния
различных концентраций хлорида ртути на осмотическую резистентность эритроцитов
в растворе NaCl 0,4 г/100мл. В контроле уровень гемолиза составил 50 %. При
наличии в среде хлорида ртути в концентрациях 0,1-0,35 мМ наблюдалось
доза-зависимое снижение гемолиза до 16 %. дальнейшее повышение концентрации
токсиканта до 1,4 мМ приводило к повышению гемолиза до 48 %, однако, степень
гемолиза оставалась ниже контрольной величины.
Из
рисунка видно, что при более высоких концентрациях хлорида ртути наблюдалось
дальнейшее увеличение степени гемолиза, которая достигла максимального уровня
98 % при концентрации токсиканта 6,9 мМ.
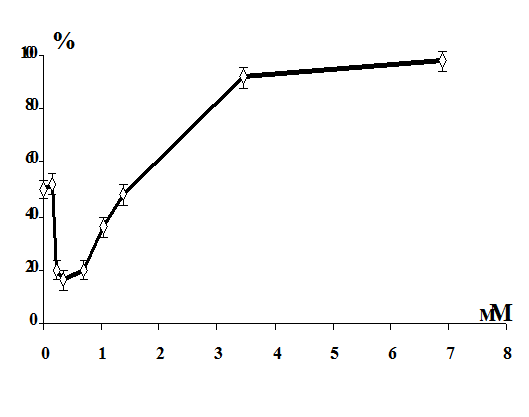
По оси абсцисс: концентрация хлорида ртути, мМ; по оси ординат: величина
гемолиза в %.
Рисунок 13 - Влияние хлорида ртути на осмотическую резистентность
эритроцитов в условиях in vitro
В следующей серии экспериментов было исследовано действие хлорида ртути
на проницаемость эритроцитарных мембран (рис.14). Как видно из рисунка
контрольная величина гемолиза составляет 85 %. Хлорид ртути в концентрациях до
0,1 мМ не вызывал каких-либо изменений в степени гемолиза. При увеличении
концентрации токсиканта до 0,3 мМ наблюдалось снижение гемолиза до 32 %,
который сохранялся на том же уровне и при концентрации 0,7 мМ. С дальнейшим
увеличением количества ртути в среде отмечалось повышение степени гемолиза,
которая составила 60, 95 и 98 % при концентрации 1,4; 3,5 и 6,9 мМ,
соответственно.
Результаты опытов по изучению эффектов хлорида ртути на перекисную
резистентность эритроцитов представлены на рисунке 15. Контрольный уровень
гемолиза составил 33 %. При повышении концентрации токсиканта до 0,7 мМ степень
гемолиза увеличивалась незначительно, а при концентрациях 0,7-1,4 мм повышалась
с 36 до 47 %. Дальнейшее увеличение концентрации токсиканта вызывало небольшой
рост количества гемолизированных эритроцитов, которое составило 49 % при
концентрации ртути 3,5 мМ.

По
оси абсцисс: концентрация хлорида ртути, мМ; по оси ординат: величина гемолиза
в %.
Рисунок
14 - Влияние хлорида ртути на проницаемость эритроцитарных мембран в условиях
in vitro

По
оси абсцисс: концентрация хлорида ртути, мМ; по оси ординат: величина гемолиза
в %.
Рисунок
15 - Влияние хлорида ртути на перекисный гемолиз эритроцитов в условиях in
vitro
В следующей серии экспериментов, было исследовано влияние хлорида ртути
на активность каталазы эритроцитов (рисунок 16). Активность каталазы в контроле
составила 44 % (р£0.005). Наличие в среде хлорида ртути в концентрациях
до 0,23 мМ не вызывали каких-либо изменений в активности каталазы. При
повышении концентрации токсиканта от 0,23 до 1,4 мМ наблюдалось увеличение
активности фермента.
Из рисунка видно, дальнейшее повышение концентрации ртути в среде
вызывало снижение активности каталазы, которая составила 40 и 39 % при
концентрациях токсиканта 3,5 и 6,9 мМ, соответственно.
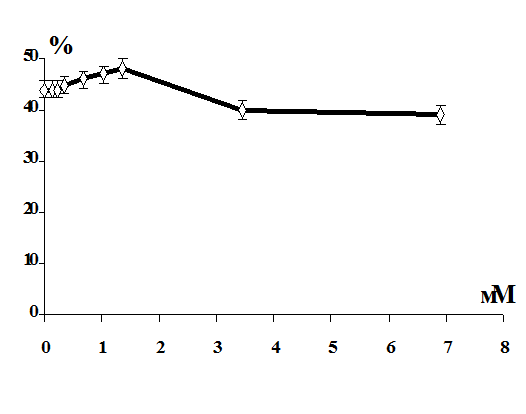
По оси абсцисс: концентрация хлорида ртути, мМ; по оси ординат:
активность каталазы в %.
Рисунок 16 - Влияние хлорида ртути на активность каталазы эритроцитов в
условиях in vitro
Таким образом, в результате наших исследований было показано, что низкие
концентрации хлорида ртути (0,3-0,7 мМ) вызывают снижение осмотического
гемолиза эритроцитов человека. При этих же концентрациях токсиканта уменьшается
и проницаемость эритроцитарных мембран. Дальнейшее повышение концентрации ионов
ртути приводит к увеличению проницаемости мембран эритроцитов и как следствие
повышается и осмотический гемолиз. При низких концентрациях токсиканта (0,3-1,4
мМ) наблюдается увеличение активности каталазы с чем, вероятно, связано
снижение проницаемости и осмотического гемолиза эритроцитов.
Известно, что ртуть относится к металлам, действие которых приводит к
снижению активности основных антиоксидантов клетки, особенно тиол-содержащих
антиоксидантов и ферментов.
Кроме того, эти токсичные металлы могут вызывать увеличение образования
реактивных форм кислорода, таких как гидроксильный и супероксидный радикал и
перекись водорода. По-видимому, поэтому и при действии низких концентраций
хлорида ртути наблюдается увеличение перекисного гемолиза эритроцитов.
Изучение совместного действия 1,1-диметилгидразина и ионов Pb2+ и Hg2+на состояние мембран эритроцитов в условиях in vitro.
Известно, что помимо самостоятельного влияния на различные функции
организма многие чужеродные для человека вещества при комбинированном
воздействии оказывают влияние друг на друга, усиливая или ослабляя токсическое
действие [284,285]. Поэтому в следующей серии экспериментов были исследованы
изолированное действие на эритроциты человека 1,1-ДМГ и в сочетании с Pb2+ и Hg2+. Были подобраны по 2 концентрации токсикантов, действие
которых вызывает одинаковый гемолиз.
На рисунке 17 представлены результаты исследования изолированного и
сочетанного действия 1,1-ДМГ и Pb2+
на осмотический гемолиз эритроцитов человека.

По
оси абсцисс: концентрация ацетата свинца и 1,1-ДМГ, мМ; по оси ординат:
величина гемолиза, %.
Рисунок
17 - Изолированное и совместное влияние 1,1-ДМГ и Pb2+ на
осмотическую резистентность эритроцитов в условиях in vitro
Видно,
что при концентрациях 3,4 мМ для ионов свинца и 100,0 мМ для 1,1-ДМГ уровень
гемолиза составляет 60±2% (р£0.005). Для того, чтобы
проверить эффект совместного действия исследованных соединений на осмотический
гемолиз эритроцитов уменьшили концентрации ацетата свинца и 1,1-ДМГ в 2 раза,
т.е. были использованы 1,7 и 50,0 мМ растворы токсикантов, соответственно.
Результаты исследования показали, что при сочетанном действии этих соединений
наблюдается резкое увеличение выхода гемоглобина из эритроцитов и гемолиз
повышается до 74±2% (р£0.005). Таким образом, полученные данные выявили, что
комбинированное действие Pb2+ и 1,1-диметилгидразина приводит к еще большему
повышению гемолиза эритроцитов по сравнению с их изолированным действием.
Результаты влияния совместного действия Pb2+ и 1,1-ДМГ на проницаемость мембран эритроцитов человека
приведены на рисунке 18.

По оси абсцисс: концентрация ацетата свинца и 1,1-ДМГ, мМ; по оси
ординат: величина гемолиза, %.
Рисунок 18 - Изолированное и совместное влияние 1,1-ДМГ и Pb2+ на проницаемость эритроцитарных
мембран в условиях in vitro
И в этом эксперименте нами были подобраны концентрации токсикантов, при
изолированном действии которых гемолиз составляет 60±2% (р£0.005). Из рисунка видно, что уровень
гемолиза, равный 60% вызывают 3,2 мМ ацетата свинца и 118 мМ 1,1-ДМГ. Для
выяснения эффекта их совместного действия также уменьшили в 2 раза концентрации
исследованных токсикантов. Из рисунка видно, что гемолиз эритроцитов увеличился
(71±2,5%, р£0.005) по
сравнению с изолированными действиями этих токсикантов.
Следовательно, при комбинированном действии 1,1-ДМГ и Pb2+ увеличивают
проницаемость эритроцитарных мембран и тем самым увеличивают выход гемоглобина
из эритроцитов.
Таким образом, результаты исследований показали, что эффект совместного
действия 1,1-ДМГ и ацетата свинца выше по сравнению с их изолированным
действием. Следует отметить, что эффекты исследованных токсикантов не
суммируются, так как гемолиз при их совместном действии значительно превосходил
(на 12-15%) значения, полученные при изолированном действии токсикантов.
В следующей серии экспериментов были проведены исследования по изучению
изолированного и совместного действия 1,1-ДМГ и хлорида ртути. Из рисунка 19
видно, что гемолиз при действиях 2 мМ Hg2+ или 100 мМ 1,1-диметилгидразина
составляет 60±2,0% (р£0.001). Совместное действие половины концентраций исследованных токсических
соединений приводит к увеличению гемолиза до 79±2,8% (р£0.05).
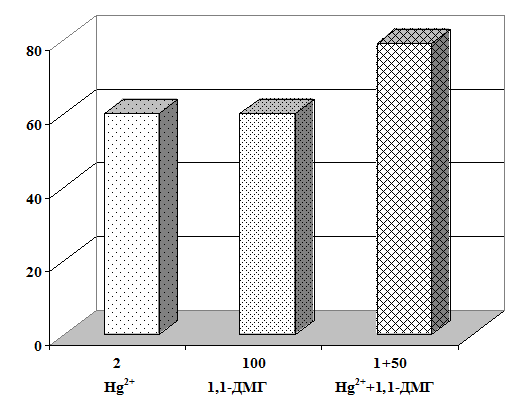
По
оси абсцисс: концентрация хлорида ртути и 1,1-ДМГ, мМ; по оси ординат: величина
гемолиза, %.
Рисунок
19 - Изолированное и совместное влияние 1,1-ДМГ и Hg2+ на
осмотическую резистентность эритроцитов в условиях in vitro
Следовательно,
при сочетанном действии 1,1-ДМГ и Hg2+ на осмотическую
резистентность эритроцитов тоже наблюдается увеличение гемолиза эритроцитов по
сравнению с изолированным действием исследованных токсикантов.
Для
того, чтобы проверить какое влияние оказывают 1,1-ДМГ и хлорид ртути при
совместном действии на проницаемость эритроцитарных мембран были проведены
следующие исследования. Как видно из рисунка 20, гемолиз равный 60±2,2% (р£0.005) вызывают концентрации 1,4 и 118 мМ растворов
Hg2+ и 1,1-ДМГ, соответственно. Уменьшение в 2 раза этих концентрации для
совместного эффекта исследованных токсикантов приводит к увеличению гемолиза до
73±2,5% (р£0.05).
По
оси абсцисс: концентрация хлорида ртути и 1,1-ДМГ, мМ; по оси ординат: величина
гемолиза, %.
Рисунок
20 - Изолированное и совместное влияние 1,1-ДМГ и Hg 2+ на
проницаемость эритроцитарных мембран в условиях in vitro.
Таким
образом, результаты исследований по сравнению комбинированного действия 1,1-ДМГ
и ионов тяжелых металлов с их изолированным влиянием показали, что при
совместном действии эффект исследованных токсикантов значительно превосходил
значения, полученные при их изолированном действии. Необходимо отметить, что
1,1-диметилгидразин при сочетанном с ацетатом свинца и хлоридом ртути действии
вызывает более выраженные нарушения мембран эритроцитов, что проявляется в
большем по сравнению с изолированным действием уровне гемолиза эритроцитов.
Сопоставление данных по проницаемости эритроцитарных мембран и осмотической
резистентности эритроцитов, позволяет заключить, что наблюдается корреляция:
чем больше проницаемость при совместном действии токсикантов, тем выше уровень
гемолиза эритроцитов.
3.2 Влияние витаминов С, Е и селенита натрия на
состояние мембран эритроцитов в условиях in vitro
Влияние
витамина С на состояние мембран эритроцитов в условиях in vitro.
Для
изучения влияния витамина С на состояние клеточных мембран нами были проведены
исследования действия возрастающих концентраций аскорбиновой кислоты на
осмотическую и перекисную резистентность эритроцитов, проницаемость
эритроцитарных мембран, активность каталазы эритроцитов человека в условиях in vitro.
На рисунке 21
представлены результаты экспериментов по определению влияния различных
концентраций витамина С на осмотическую резистентность эритроцитов в растворе NaCl 0,45 г/100мл.

По
оси абсцисс: концентрация витамина С, мМ; по оси ординат: величина гемолиза в
%.
Рисунок
21 - Влияние витамина С на осмотическую резистентность эритроцитов в условиях
in vitro
В контроле
гемолиз составляет 22,6% (р£0.05). При концентрации витамина С 2,7 мМ количество
гемолизированных эритроцитов снижается и составляет 19,8%. С увеличением
количества аскорбиновой кислоты в среде происходит дальнейшее снижение степени
гемолиза до 2% при концентрации витамина 53,2 мМ. В растворах с более высоким
содержанием витамина С степень гемолиза сохраняется на таком же низком уровне.
В следующей серии экспериментов было исследовано действие витамина С на
проницаемость эритроцитарных мембран (рис.22). Как видно из рисунка контрольная
величина гемолиза составляет 25% (р£0.05). В растворе с содержанием витамина С в концентрации 2,7
мМ количество гемолизированных эритроцитов снижается и составляет 20,8 %. С
увеличением количества витамина в среде наблюдается дальнейшее снижение степени
гемолиза до 1,4 % в растворе с концентрацией аскорбиновой кислоты 53,2 мМ. При
более высоких концентрациях исследуемого вещества степень выхода гемоглобина из
эритроцитов сохраняется на таком же низком уровне.
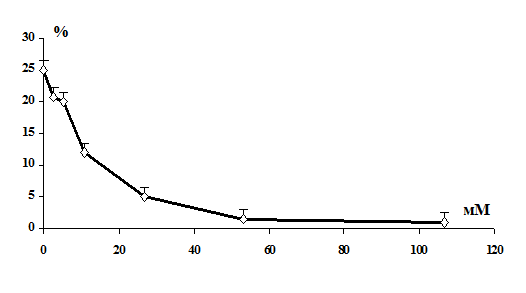
По
оси абсцисс: концентрация витамина С, мМ; по оси ординат: величина гемолиза в
%.
Рисунок
22 - Влияние витамина С на проницаемость эритроцитарных мембран в условиях in
vitro
Результаты опытов по изучению эффектов витамина С на перекисную
резистентность эритроцитов представлены на рисунке 23.
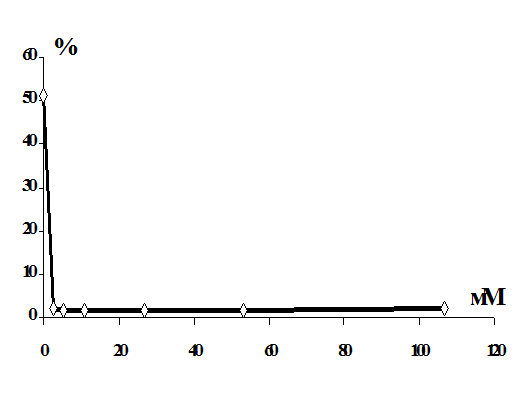
По оси абсцисс: концентрация витамина С, мМ; по оси ординат: величина
гемолиза в %.
Рисунок 23 -
Влияние витамина С на перекисный гемолиз эритроцитов в условиях in vitro
В контроле уровень гемолиза составляет 51,1% (р£0.01). Наличие в среде инкубации
аскорбиновой кислоты в концентрации 2,7 мМ вызывает резкое снижение гемолиза до
2,3 %. При дальнейшем повышении концентрации исследуемого вещества количество
гемолизированных клеток остается на этом уровне.
В следующей серии экспериментов, результаты которой представлены на
рисунке 24, было исследовано влияние витамина С на активность каталазы
эритроцитов. В контроле активность каталазы составляет 34,3% (р£0.01). При содержании в среде
инкубации витамина в концентрации 2,7 мМ количество утилизированной перекиси
водорода снижается и составляет 33,4% (р£0.05). С повышением количества витамина наблюдается снижение
активности каталазы до 16 % в среде с концентрацией аскорбиновой кислоты 106,5
мМ.

По
оси абсцисс: концентрация витамина С, мМ; по оси ординат: активность каталазы в
%.
Рисунок 24 -
Влияние витамина С на активность каталазы эритроцитов в условиях in vitro
Таким образом, результаты наших экспериментов показали, что витамин С
повышает резистентность эритроцитов. Вероятно, это связано с антиоксидантными
свойствами этого соединения. Известно, что аскорбиновая кислота активизирует
антиоксидантный фермент супероксиддисмутазу (СОД), которая снижает концентрацию
супероксидных радикалов. Вероятно, что это приводит к ингибированию двухстадийной
реакции Хабера-Вейса, в результате которой образуются гидроксильные радикалы,
и, следовательно, к торможению процессов перекисного окисления липидов.
Подтверждением этому могут служить результаты наших экспериментов по
определению перекисного гемолиза. Сама по себе перекись водорода малоактивна по
отношению к молекулярным компонентам клетки. Повреждающий эффект этого вещества
реализуется через образование гидроксильных радикалов, для чего необходимо
присутствие ионов восстановленного железа и супероксидных радикалов. К тому же
супероксидные радикалы способствуют восстановлению железа [286]. Следовательно,
при активизации СОД повреждающее действие перекиси водорода снижается, что
выражается в подавлении гемолиза.
Однако, при воздействии витамина С наблюдалось снижение активности
каталазы, ключевого антиоксидантного фермента, функцией которого является
удаление перекиси водорода. В результате реакции, катализируемой СОД, помимо
снижения количества супероксидных радикалов, происходит образование перекиси
водорода. Очевидно, что повышение активности СОД и снижение активности каталазы
могло привести к чрезмерному накоплению перекиси водорода. Вероятно, этого не
происходит вследствие утилизации перекиси водорода ферментом
глутатионпероксидазой, т. к. есть данные, что витамин С способствует
восстановлению глутатиона.
Влияние витамина Е на состояние мембран эритроцитов в условиях in vitro.
Для изучения влияния витамина Е на состояние клеточных мембран нами были
проведены исследования действия возрастающих концентраций α-токоферола на осмотическую и
перекисную резистентность эритроцитов, проницаемость эритроцитарных мембран,
активность каталазы эритроцитов человека в условиях in vitro.
На рисунке 25
представлены результаты экспериментов по определению влияния различных
концентраций витамина Е на осмотическую резистентность эритроцитов в 0,45
г/100мл растворе NaCl.

По
оси абсцисс: концентрация витамина Е, мг/мл; по оси ординат: величина гемолиза
в %.
Рисунок
25 - Влияние витамина Е на осмотическую резистентность эритроцитов в условиях
in vitro
Как видно из
рисунка в контроле гемолиз составляет 28,83%, который сохраняется и при
концентрации витамина Е равной 3,125 мг/мл. С увеличением количества α-токоферола в среде происходит
постепенное снижение степени гемолиза, которая составляет 24,27 (р£0.01); 22 (р£0.005); 20,85% (р£0.01) при концентрациях витамина 9,4;
15,6; 21,92 мг/мл, соответственно. При дальнейшем увеличении концентрации
витамина Е отмечаются незначительные изменения в количестве гемолизированных
эритроцитов.
В следующей серии экспериментов было исследовано действие витамина Е на
проницаемость эритроцитарных мембран (рис.26). Как видно из рисунка контрольная
величина гемолиза составляет 30%. В растворе с содержанием витамина Е в
концентрации 3,125 мг/мл количество гемолизированных эритроцитов снижается до
уровня 27,1%, который сохраняется и при концентрации
α-токоферола 9,4
мг/мл. С увеличением количества витамина в среде наблюдается снижение степени
гемолиза до 23,49 % в растворе с концентрацией витамина Е 15,6 мг/мл. При
дальнейшем повышении концентрации исследуемого вещества степень выхода
гемоглобина из эритроцитов практически не изменяется.

По
оси абсцисс: концентрация витамина Е, мг/мл; по оси ординат: величина гемолиза
в %.
Рисунок
26 - Влияние витамина Е на проницаемость эритроцитарных мембран в условиях in
vitro
Результаты опытов по изучению эффектов витамина Е на перекисную
резистентность эритроцитов представлены на рисунке 27.
Как видно из рисунка контрольный уровень гемолиза составляет 56,13 %.
Наличие в среде инкубации α-токоферола в концентрации 3,125 мг/мл
вызывает незначительное снижение гемолиза до 55,62 %. При повышении
концентрации витамина количество гемолизированных клеток снижается, составляя
48; 39,3; 34,68; 31,11 % при концентрациях α-токоферола 9,4; 15,6; 21,9; 31,3
мг/мл, соответственно.
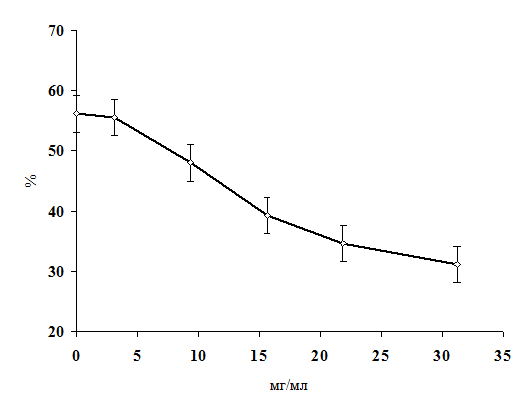
По
оси абсцисс: концентрация витамина Е, мг/мл; по оси ординат: величина гемолиза
в %.
Рисунок 27 -
Влияние витамина Е на перекисный гемолиз эритроцитов в условиях in vitro
В следующей серии экспериментов, результаты которой представлены на
рисунке 28, было исследовано влияние витамина Е на активность каталазы
эритроцитов. Как видно из рисунка в контроле активность фермента составляет
35,53 %. α-токоферол в концентрации 3,125 мг/мл не оказывает влияния на
активность каталазы и количество утилизированной перекиси водорода сохраняется
на уровне контроля. С повышением количества витамина в среде инкубации
наблюдается снижение активности каталазы до 34,59 и 33,67 % при концентрации α-токоферола 9,4 и 15,6 мг/мл,
соответственно. При дальнейшем повышении количества витамина Е в среде
инкубации активность каталазы подвергается незначительным изменениям.
Полученные данные по влиянию витамина Е на резистентность мембран
эритроцитов показали, что под действием α-токоферола снижается осмотический и
перекисный гемолиз эритроцитов. Следует отметить, что существенный эффект
витамина Е проявляется в защите мембран от перекисного гемолиза.
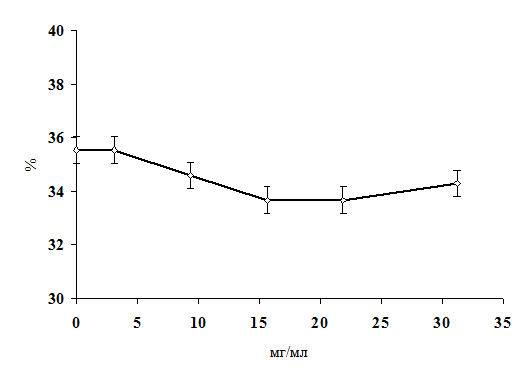
По
оси абсцисс: концентрация витамина Е, мг/мл; по оси ординат: активность
каталазы в %.
Рисунок 28 -
Влияние витамина Е на активность каталазы эритроцитов в условиях in vitro
Влияние
селенита натрия на состояние мембран эритроцитов в условиях in vitro.
На рисунке 29
представлены результаты экспериментов по определению влияния различных
концентраций селенита натрия на осмотическую резистентность эритроцитов в 0,45
г/100мл растворе NaCl. Как видно из
рисунка в контроле гемолиз составляет 30,29% (р£0.01). При концентрации селенита
натрия 47 мкг/мл количество гемолизированных эритроцитов незначительно
снижается и отмечается на уровне 29,7 %. С увеличением количества селенита
натрия в среде наблюдается более выраженное снижение степени гемолиза, которая
составляет 22% (р£0.005) при концентрации вещества 125 мкг/мл.
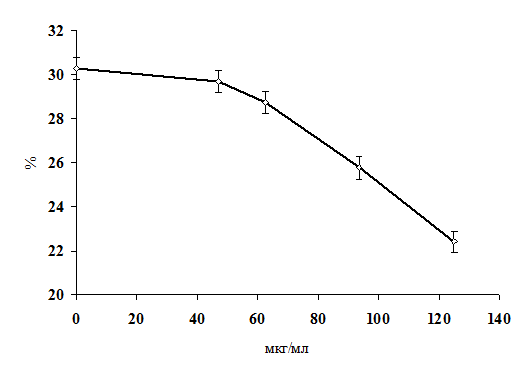
По
оси абсцисс: концентрация селенита натрия, мкг/мл; по оси ординат: величина
гемолиза в %.
Рисунок
29 - Влияние селенита натрия на осмотическую резистентность эритроцитов в
условиях in vitro
В следующей серии экспериментов было исследовано действие селенита натрия
на проницаемость эритроцитарных мембран (рис.30). Как видно из рисунка контрольная
величина гемолиза составляет 31,48%. В растворе с содержанием селенита натрия в
концентрации 47 мкг/мл количество гемолизированных эритроцитов повышается и
составляет 35,93 %. Степень гемолиза сохраняется на этом же уровне при
увеличении количества селенита натрия в среде до 62,5 мкг/мл. При дальнейшем
увеличении концентрации селенита натрия в среде наблюдается резкое снижение
количества гемолизированных эритроцитов, которое составляет 23,37 % при
концентрации Na2SeO3 94 мкг/мл и 18,76 % при концентрации 125 мкг/мл.
Результаты опытов по изучению эффектов селенита натрия на перекисную
резистентность эритроцитов представлены на рисунке 31. В контроле уровень
гемолиза составляет 21,91% (р£0.01). Наличие в среде инкубации Na2SeO3 в
концентрации 47 мкг/мл вызывает значительное повышение гемолиза до 60,35 %. При
повышении концентрации исследуемого вещества степень гемолиза относительно
снижается, но остается выше контрольной величины, составляя 54,26 и 39,48 % при
концентрации Na2SeO3 62,5 и 93,8 мкг/мл, соответственно. Дальнейшее
увеличение количества селенита натрия вызывает дальнейшее снижение количества
гемолизированных клеток до 18,26 % при концентрации Na2SeO3 125 мкг/мл.

По оси абсцисс: концентрация селенита натрия, мкг/мл; по оси ординат:
величина гемолиза в %.
Рисунок 30 - Влияние селенита натрия на проницаемость эритроцитарных
мембран в условиях in vitro
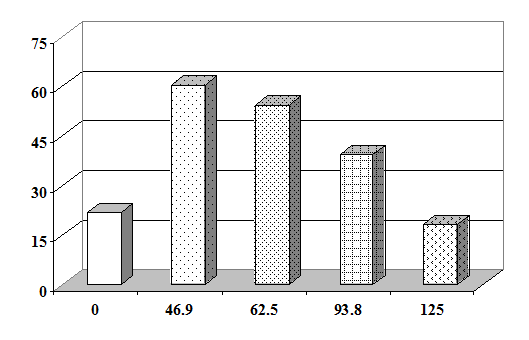
По оси абсцисс: концентрация селенита натрия, мкг/мл; по оси ординат:
величина гемолиза в %.
Рисунок 31 - Влияние селенита натрия на перекисный гемолиз эритроцитов в
условиях in vitro
В следующей серии экспериментов было исследовано влияние селенита натрия
на активность каталазы эритроцитов (рисунок 32). В контроле активность каталазы
составляет 31,61% (р£0.01). При содержании в среде инкубации Na2SeO3 в
концентрации 47 мкг/мл количество утилизированной перекиси водорода снижается и
составляет 30,71%. С повышением количества исследуемого вещества до 62,5 мкг/мл
наблюдается незначительное снижение активности каталазы до 30,3%, которая
сохраняется на этом же уровне и при концентрации селенита натрия 94 мкг/мл.
Дальнейшее повышение концентрации Na2SeO3 до 125 мкг/мл вызывает снижение
активности каталазы до 28,4 %.
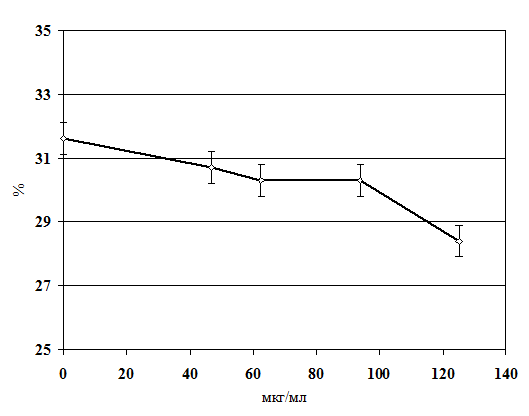
По оси абсцисс: концентрация селенита натрия, мкг/мл; по оси ординат:
активность каталазы в %.
Рисунок 32 -
Влияние селенита натрия на активность каталазы эритроцитов в условиях in vitro
Таким образом, результаты исследований по влиянию селенита натрия на
состояние мембран эритроцитов показали, что Na2SeO3 снижает осмотическую
резистентность и проницаемость эритроцитарных мембран при свех исследованных
концентрациях препарата. Следует отметить, что при концентрациях селенита
натрия до 47 мкг/мл наблюдается значительное увеличение перекисного гемолиза
эритроцитов (на 38±2,5%). Вероятно, это связано с тем, что перекись водорода
является окислителем умеренной силы и обладает цитотоксическим свойством, и
поэтому при низких концентрациях Na2SeO3 не защищает эритроциты от
повреждающего действия Н2О2. При дальнейшем увеличении концентрации селенит
натрия уменьшает перекисный гемолиз эритроцитов. На основании полученных
результатов, можно заключить, что селенит натрия при концентрациях выше 47 мкг/мл
проявляет протекторный эффект и защищает эритроцитарную мембрану от действия
перекиси водорода, повышает осмотическую резистентность и снижает проницаемость
мембран эритроцитов.
3.3 Исследование влияния витаминов С, Е и
селенита натрия на резистентность мембран эритроцитов при действии
1,1-диметилгидразина в условиях in vitro
В предыдущих сериях экспериментов было показано, что в условиях in vitro витамины Е, С и селенит натрия повышают
резистентность мембран эритроцитов человека, а 1,1-ДМГ при изолированном
действии оказывает повреждающее действие на мембрану эритроцитов и вызывает
выход гемоглобина из клетки. Было предположено, что причиной изменения
проницаемости клеточных мембран являются изменения физико-химического состояния
мембран эритроцитов, в основе которых лежит интенсификация процессов
перекисного окисления мембранных фосфолипидов. В связи с этим были проведены
исследования по влиянию витаминов С и Е и селенита натрия на состояние
биологических мембран при действии 1,1-диметилгидразина в условиях in vitro. В предварительных исследованиях были подобраны
эффективные концентрации витаминов С и Е и селенита натрия (20мМ, 20 мг/мл и
100 мкг/мл, соответственно) и 1,1-диметилгидразина (65 мМ).
Определение осмотической резистентности эритроцитов проводили в
0,45мг/100 мл растворе NaCl
(рисунок 33).
Из рисунка видно, что в контроле гемолиз составляет 28,83±0,56% (р£0,001), добавление к эритроцитам
1,1-ДМГ приводит к резкому увеличению гемолиза (79,04±1,28%). При совместном
действии 1,1-диметилгидразина с витаминами Е или С, или селенитом натрия
уровень гемолиза снижается на 22,01; 39,39 и 9,86% соответственно по сравнению
с изолированным действием токсиканта. Добавление к эритроцитам с 1,1-ДМГ смеси
витаминов и селенита натрия приводит к уменьшению уровня гемолиза на 50,4% по
сравнению с действием только 1,1-ДМГ. Анализ результатов показывает, что
наибольшим протекторным действием обладает витамин С, затем Е, и в меньшей
степени защитные свойства проявляет селенит натрия. При совместном действии
смесь биологически активных соединений предотвращают повреждающий эффект
1,1-ДМГ.
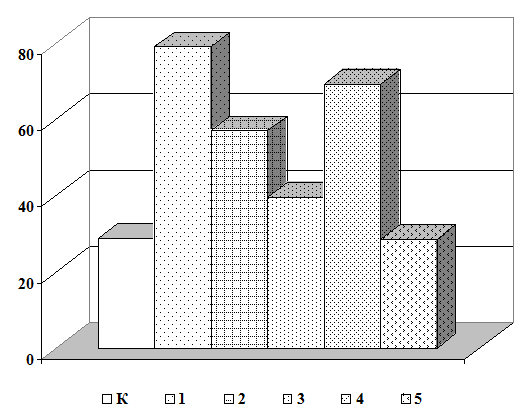
По
оси абсцисс: гемолиз, %. К - контроль, 1 - 1,1ДМГ, 2 - витамин Е+1,1-ДМГ, 3 -
витамин С+1,1-ДМГ, 4 - Se+1,1-ДМГ, 5 - Е+С+Se+1,1-ДМГ (NaCl -
0,45мг/100 мл).
Рисунок
33 - Изолированное влияние 1,1-диметилгидразина и в сочетании c
витаминами С, Е и селенитом натрия на осмотическую резистентность эритроцитов в
условиях in vitro
На
рисунке 34 приведены данные по влиянию биологически активных соединений и
1,1-диметилгидразина на проницаемость эритроцитарных мембран при соотношении
мочевины и NaCl - 60/40.
Результаты
исследований показали, что увеличение гемолиза при действии 1,1-ДМГ (до
82,04±2,28%) снижается при дополнительном введении витамина Е или С, или
селенита натрия и составляет 67,03±1,98%, 49,65±1,28% и 71,18±2,06%
соответственно. Добавление 1,1-диметилгидразина в сочетании с витаминами Е, С и
селенитом натрия вызывает дальнейшее снижение проницаемости эритроцитарных
мембран и, следовательно, уменьшение гемолиза эритроцитов по сравнению с
отдельным действием исследованных биологически активных веществ.
Сопоставление
полученных данных по осмотической резистентности эритроцитов и проницаемости
эритроцитарных мембран выявили, что с уменьшением проницаемости в присутствии
протекторных соединений снижается уровень гемолиза эритроцитов.

По
оси абсцисс: гемолиз, %. К - контроль, 1 - 1,1ДМГ, 2 - витамин Е+1,1-ДМГ, 3 -
витамин С+1,1-ДМГ, 4 - Se+1,1-ДМГ, 5 - Е+С+Se+1,1-ДМГ
Рисунок
34 - Изолированное влияние 1,1-диметилгидразина и в сочетании c
витаминами С, Е и селенитом натрия на проницаемость эритроцитарных мембран в
условиях in vitro
3.4 Роль препарата «Селевит» в повышении
резистентности мембран эритроцитов при действии 1,1-диметилгидразина в условиях
in vivo
В
предыдущих сериях экспериментов в условиях in vitro
нами было показано, что витамин Е и С и селенит натрия повышали резистентность
мембран эритроцитов и защищали эритроциты от повреждающего действия 1,1-ДМГ.
Поэтому в серии экспериментов в условиях in vivo
исследовали влияние 1,1-ДМГ на мембраны эритроцитов при изолированном
воздействии и в сочетании с препаратом «Селевит». Разработанный в Казахской
академии питания новый биопрепарат «Селевит» представляет собой водный раствор b-каротина, селена и витаминов Е и С. В экспериментах определяли
суточную динамику изменения состояния мембран эритроцитов кроликов-самцов после
однократного введения препаратов. Животные были разделены на 3 группы. 1 группа
- контрольная, животным второй и третьей группы вводили 1,1-ДМГ и 1,1-ДМГ
совместно с препаратом «Селевит», соответственно. Первый забор крови
производили непосредственно перед введением препаратов. Затем кровь отбирали
через 3, 6, 12 и 24 часа после введения препаратов.
Влияние
1,1-диметилгидразина и препарата «Селевит» на осмотическую резистентность
эритроцитов в условиях in vivo.
Результаты
исследований изолированного и сочетанного с биопрепаратом «Селевит» влияния
1,1-диметилгидразина на осмотическую резистентность эритроцитов представлены на
рисунках 35-38.
На
рисунках приведены данные осмотической резистентности эритроцитов в
гипотонических растворах NaCl (0,35-0,5г/100 мл) при однократном воздействии
1,1-ДМГ и в сочетании с селевитом. Как видно из рисунка 35, через 3 и 6 часов
после начала эксперимента гемолиз эритроцитов в контрольной и в первой опытной
группах незначительно увеличивается. Причем эритроциты животных опытной группы
подвергаются гемолизу в большей степени. Гемолиз эритроцитов животных второй опытной
группы через 3 и 6 часов снижается.
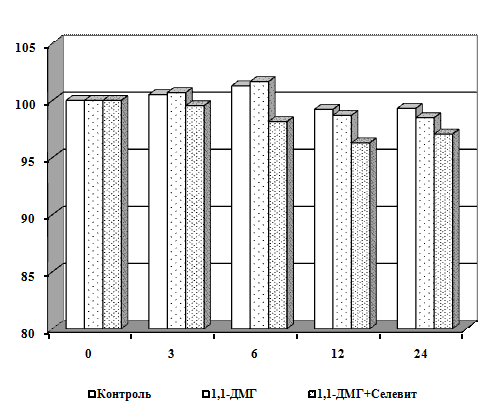
По
оси абсцисс: время в часах; по оси ординат: величина гемолиза в %. (раствор NaCl
- 0,35 г/100 мл).
Рисунок
35 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на осмотическую резистентность эритроцитов в условиях in vivo
Из
рисунка 35 видно, что в растворе NaCl 0,35 г/100 мл резистентность эритроцитов животных,
после 6 часов по сравнению с эритроцитами контрольных животных практически не
изменяется, тогда как в присутствии селевита наблюдается тенденция к снижению
гемолиза эритроцитов. Эффект введения 1,1-ДМГ и совместно с биопрепаратом на
гемолиз эритроцитов можно заметить после 12 и 24 часов. Следует отметить, что
снижается гемолиз эритроцитов и контрольных, и опытных животных на 1±0,02,
2±0,03 и 3±0,03% соответственно.
Результаты исследования осмотической резистентности эритроцитов в 0,4
г/100 мл растворе NaCl показали, что
через 3 часа снижается гемолиз эритроцитов контрольной и в меньшей степени
гемолиз эритроцитов опытных групп животных (на 2-3%) (рисунок 36).
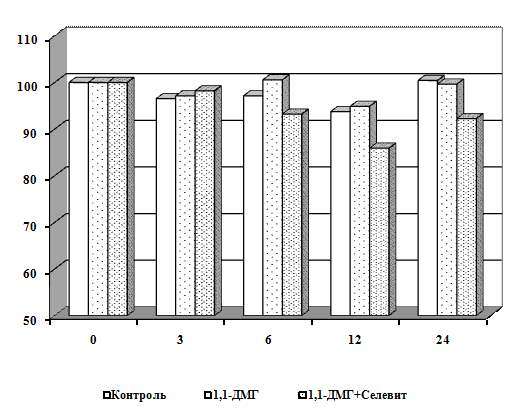
По
оси абсцисс: время в часах; по оси ординат: величина гемолиза в % (раствор NaCl
- 0,4 г/100 мл).
Рисунок
36 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на осмотическую резистентность эритроцитов в условиях in vivo
Различия
в уровне гемолиза контрольных и опытных животных можно наблюдать через 6-24
часа. Через 6 часов гемолиз эритроцитов контрольных практически не изменился, а
гемолиз эритроцитов после введения 1,1-ДМГ даже повысился до 99,68±1,12%, тогда
как присутствие селевита уменьшило уровень гемолиза до 92,82±1,07%. Дальнейшее
снижение гемолиза эритроцитов 3-ей группы наблюдается через 12 и 24 часа после
введения препаратов (85,82±1,17% и 92,02±1,27% соответственно). Из рисунка
видно, что через 24 часа резистентность эритроцитов контрольных и 2-ой опытной
группы практически не отличаются. Сравнение осмотической резистентности
эритроцитов контрольной и опытных групп животных в разные периоды после начала
эксперимента выявило, что через 12 часов гемолиз эритроцитов всех групп
животных снижается и к 24 часам наблюдается повышение гемолиза. Аналогичные
результаты были получены при определении осмотического гемолиза эритроцитов
контрольной и опытных групп животных в 0,45 г/100 мл растворе NaCl
(рисунок 37). Следует отметить, что гемолиз эритроцитов контрольной группы
животных через 3 часа после начала эксперимента снижается (до 72,64±1,26; р£0,005), через 6 часов уровень гемолиза повышается (до
83,43±2,12; р£0,005).

По
оси абсцисс: время в часах; по оси ординат: величина гемолиза в %. (раствор NaCl
- 0,45 г/100 мл)
Рисунок
37 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на осмотическую резистентность эритроцитов в условиях in vivo
Гемолиз
эритроцитов животных после введения 1,1-ДМГ через 6 и 24 часа выше по сравнению
с осмотическим гемолизом эритроцитов животных, получивших дополнительно
селевит, тогда как через 12 часов при низком уровне гемолиза эритроцитов и
контрольной и опытных групп животных резистентность эритроцитов 1-ой опытной
группы выше (гемолиз контрольной составляет 51,13±1,22; 1-ой группы -
65,05±2,04; и 2-ой - 45,03±1,12).
Определение
осмотической резистентности эритроцитов в 0,5 г/100 мл растворе NaCl
выявило (рисунок 38), что показатели осмотического гемолиза эритроцитов 1-ой
опытной группы через 3 и 24 часа после введения 1,1-ДМГ выше значений гемолиза
эритроцитов 2-ой опытной группы (на 16,21 и 36,89% соответственно). При этой концентрации
раствора NaCl (0,5г/100 мл) показатели гемолиза эритроцитов
контрольных животных в каждом интервале времени после начала экспериментов
значительно ниже по сравнению с уровнем гемолиза эритроцитов опытных групп
животных.

По
оси абсцисс: время в часах; по оси ординат: величина гемолиза в % (раствор NaCl
- 0,5 г/100 мл)
Рисунок
38 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на осмотическую резистентность эритроцитов в условиях in vivo
Через
6 часов после введения препаратов практически не наблюдается различий между
показателями осмотической резистентности эритроцитов 2-х опытных групп, хотя и
наблюдается тенденция к снижению гемолиза эритроцитов 2-ой опытной группы.
Через 12 часов гемолиз эритроцитов кроликов после введения 1,1-ДМГ составляет
51,38±1,24 (р£0,005), тогда уровень гемолиза эиртроцитов после
сочетанного действия 1,1-ДМГ с селевитом приближается к контрольным значениям.
Резкие изменения в резистентности эритроцитов наблюдаются через 24 часа после
введения препаратов: гемолиз эритроцитов 1-ой опытной группы составляет
118,34±2,26 (р£0,005), а в присутствии селевита - 81,45±1,65 (р£0,005), в контрольной группе - 45,38±1,28 (р£0,005).
Таким
образом, результаты определения осмотической резистентсноти эритроцитов
контрольной и опытных групп животных показали, что 1,1-диметилгидразин
увеличивает гемолиз эритроцитов, а введение дополнительно селевита снижает
повреждающий эффект 1,1-ДМГ. Различие показателей гемолиза эритроцитов в
растворах NaCl различной концентрации, вероятно, связаны с тем, что
концентрация равная 0,35г/100 мл близка к нижней границе резистентности
(0,32-0,28г/100мл), в которой должны гемолизироваться все эритроциты, а
концентрация равная 0,5г/100 мл близка к верхней границе резистентности
(0,48-0,44г/100 мл), в которой должны разрушаться наименее резистентные
эритроциты. Поэтому в 0,35г/100 мл растворе NaCl мы не
заметили особых различий в резистентности эритроцитов контрольной и опытных
групп животных, тогда как с увеличением концентрации растворов NaCl
до 0,5 г/100 мл видно, что резистентность эритроцитов после действия 1,1-ДМГ
снижается, а при совместном действии с селевитом повреждающий эффект токсиканта
уменьшается.
Влияние
1,1-диметилгидразина и препарата «Селевит» на проницаемость эритроцитарных
мембран в условиях in vivo.
Для
того, чтобы выяснить с чем связано изменение осмотической резистентности
эритроцитов в следующей серии экспериментов исследовали изолированное и
сочетанное с селевитом влияние 1,1-диметилгидразина на проницаемость
эритроцитарных мембран. ПЭМ изучали при разных соотношениях изотонических
растворов мочевины и NaCl (рисунки 1-5).
На
рисунке 39 приведены данные по исследованию ПЭМ при соотношении растворов
мочевины и NaCl - 40:60.
Видно,
что уже через 3 часа после введения препаратов наблюдается резкое увеличение
уровня гемолиза эритроцитов 1-ой опытной группы (125,23±2,26; р£0,005), при совместном действии с селевитом величина
гемолиза ниже контрольной величины и составляет 53,54±0,76 (р£0,001). При сравнении показателей ПЭМ в разные
интервалы времени от начала эксперимента видно, что при сочетанном с селевитом
влиянии 1,1-ДМГ уровень гемолиза ниже изолированного действия токсиканта.
Следует отметить, что сопоставление изменений ПЭМ в зависимости от времени
последействия выявило увеличение гемолиза эритроцитов контрольных животных
через 12 часов после начала эксперимента по сравнению с эритроцитами опытных
групп животных.
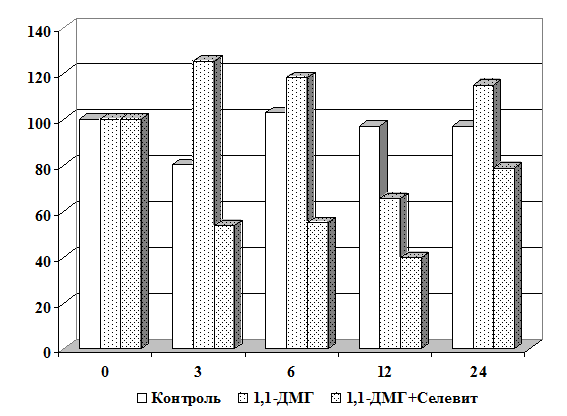
По
оси абсцисс: время в часах; по оси ординат: величина гемолиза в % (соотношение
растворов мочевины и NaCl - 40:60).
Рисунок
39 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на проницаемость эритроцитарных мембран в условиях in vivo.
Такого
же типа изменение в проницаемости мембран эритроцитов контрольных животных
зарегистрировано и при соотношении растворов мочевины и NaCl
- 45:55 (рисунок 40). Из рисунка 40 видно, что через 3, 6 и 12 часов после
начала эксперимента показатель проницаемости мембран эритроцитов 1-ой опытной
группы выше по сравнению с эритроцитами животных, подвергнутых действии 1,1-ДМГ
совместно с селевитом. Через 24 часа ПЭМ контрольной и опытных групп животных
практически не отличается.
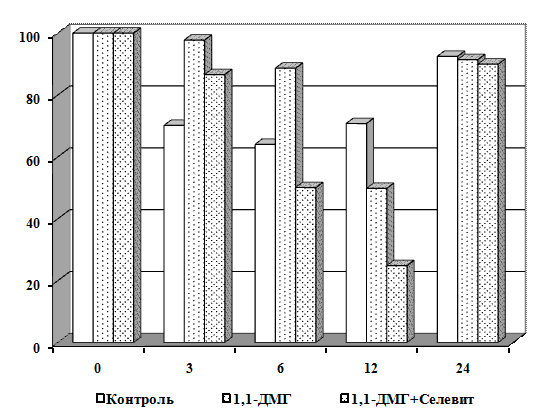
По
оси абсцисс: время в часах; по оси ординат: величина гемолиза в %. (соотношение
растворов мочевины и NaCl - 45:55)
Рисунок
40 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на проницаемость эритроцитарных мембран в условиях in vivo
На
рисунке 41 представлены данные по определению ПЭМ при соотношениях растворов
мочевины и NaCl - 50:50. Из рисунка видно, что в разные интервалы
времени после действия препаратов тенденция увеличения проницаемости
эритроцитов при однократном действии 1,1-диметилгидразина и снижения - при
совместном действии 1,1-ДМГ с селевитом сохраняется. Необходимо отметить, что
через 12 часов от начала эксперимента показатель проницаемости мембран
эритроцитов как контрольной, так и опытных групп животных снижается.

По
оси абсцисс: время в часах; по оси ординат: величина гемолиза в % (соотношение
растворов мочевины и NaCl - 50:50)
Рисунок
41 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на проницаемость эритроцитарных мембран в условиях in vivo
Влияние
изолированного и в сочетании с препаратом «Селевит» действия
1,1-диметилгидразина на проницаемость эритроцитарных мембран приведены на
рисунках 42 и 43 при соотношениях растворов мочевины и NaCl 55:45 и
60/40. Сравнение показателей ПЭМ после действия исследованных препаратов также
выявили тенденцию снижения проницаемости при совместном действии 1,1-ДМГ и
селевита. Снижение уровня гемолиза эритроцитов контрольных и опытных групп
животных сохраняется в 12-часовом интервале. Можно предположить, что к 12 часам
после начала эксперимента в крови увеличивается содержание более резистентных
эритроцитов в результате эритропоэза.
Сопоставление
данных, полученных при определении показателей ПЭМ в растворах с разными
соотношениями мочевины и NaCl, показали, что проницаемость мембран эиртроцитов при
однократном действии 1,1-диметигидразина снижается по сравнению с эритроцитами
контрольной и 2-ой опытной группой животных.
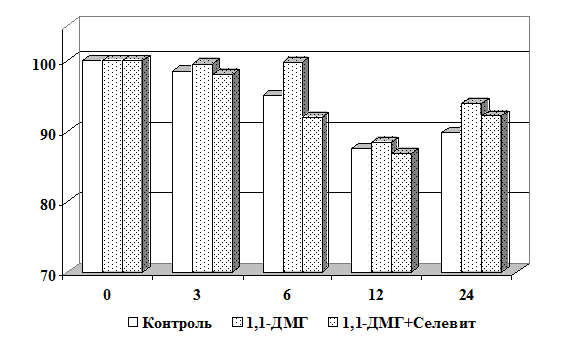
По
оси абсцисс: время в часах; по оси ординат: величина гемолиза в %. (соотношение
растворов мочевины и NaCl 55:45).
Рисунок
42 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на проницаемость эритроцитарных мембран в условиях in vivo.
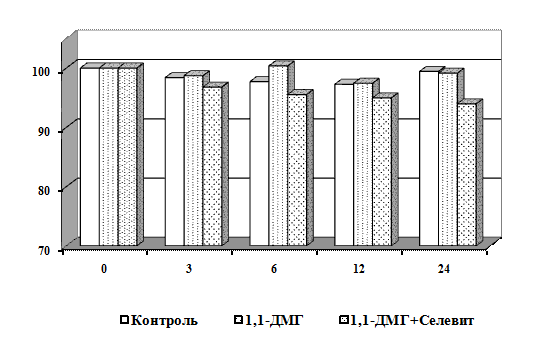
По
оси абсцисс: время в часах; по оси ординат: величина гемолиза в %. (соотношение
растворов мочевины и NaCl - 60:40).
Рисунок
43 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на проницаемость эритроцитарных мембран в условиях in vivo
Влияние
1,1-диметилгидразина и препарата «Селевит» на перекисный гемолиз эритроцитов в
условиях in vivo.
В
следующей серии экспериментов определяли перекисный гемолиз эритроцитов
кроликов, подвергнутых изолированному и сочетанному с селевитом действию
1,1-ДМГ. Следует отметить, что
перекись водорода легко проникает через биологические мембраны внутрь клеток и
может оказывать повреждающее действие на клеточную мембрану. Поэтому
устойчивость эритроцитов к действию H2O2 зависит от
состояния клеточных мембран. Из
рисунка 44 видно, что с увеличением времени последействия исследованных
препаратов изменяется устойчивость эритроцитов к действию перекиси водорода.
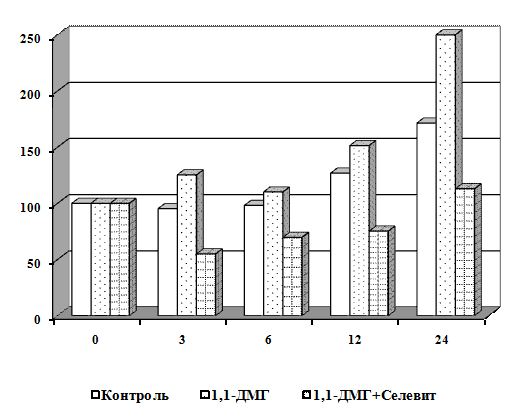
По
оси абсцисс: время в часах; по оси ординат: величина гемолиза в % (H2O2 -
250 мМ)
Рисунок
44 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на перекисную резистентность эритроцитов в условиях in vivo
Через 3 часа у эритроцитов
кроликов 1-ой опытной группы уровень гемолиза выше по сравнению с эритроцитами
контрольных животных и животных 2-ой группы и составляет 125,29±1,78 (р£0,001), 95,24±1,96 (р£0,005),
55,05±0,86 (р£0,005) соответственно. С увеличением интервала времени
до 6 часов перекисный гемолиз эритроцитов кроликов после действия 1,1-ДМГ
несколько снижается (до 110,09±1,48; р£0,005) по
сравнению с 3-х часовым интервалом, хотя уровень гемолиза остается выше
контрольной величины и выше гемолиза эритроцитов контрольной и 2-ой опытной
групп животных. При дальнейшем увеличении интервала времени после начала
эксперимента перекисная резистентность эритроцитов и контрольных и опытных
животных снижается, хотя гемолиз эритроцитов животных, получивших разовую дозу
1,1-диметилгидразина, сохраняет более высокие значения по сравнению с
эритроцитами остальных групп животных. Необходимо отметить, что при всех
исследованных интервалах времени после действия препаратов в присутствии
селевита показатели гемолиза значительно ниже значений контрольных животных и
животных, получивших дозу 1,1-ДМГ.
Таким
образом, результаты экспериментов
по определению перекисной резистентности эритроцитов показали, что препарат «Селевит»
повышает резистентность мембран эритроцитов и защищает клеточную мембрану от
повреждающего действия 1,1-диметилгидразина.
Влияние
1,1-диметилгидразина и препарата «Селевит» на активность каталазы эритроцитов в
условиях in vivo.
Перекись водорода относится к активным формам кислорода, в организме Н2О2 разрушается каталазой. Каталаза широко распространена в организме человека и
животных, причем наибольшее количество фермента обнаружены в эритроцитах,
печени и почках. Функцией фермента является предотвращение накопления
перекиси водорода, оказывающей повреждающее действие на клеточные компоненты. В связи с этим представляло интерес изучить влияние
однократного действия 1,1-ДМГ в отдельности и в сочетании с препаратом
«Селевит» на активность этого фермента в эритроцитах кролика.
Результаты
экспериментов представлены на рисунке 45. Активность каталазы оценивали по
количеству разрушенной перекиси водорода в растворе и выражали в процентах. Как
видно из рисунка активность каталазы эритроцитов контрольных животных
составляла 44 % и активность фермента практически не изменилась в разные интервалы
времени 24-х часового наблюдения. После действия 1,1-ДМГ активность каталазы
повышалась к 6-ти часовому интервалу и далее к 24 часам активность фермента
снизилась. Присутствие селевита до 6 часов практически не оказало влияния, а
при дальнейшем увеличении интервала времени активность уменьшилась.
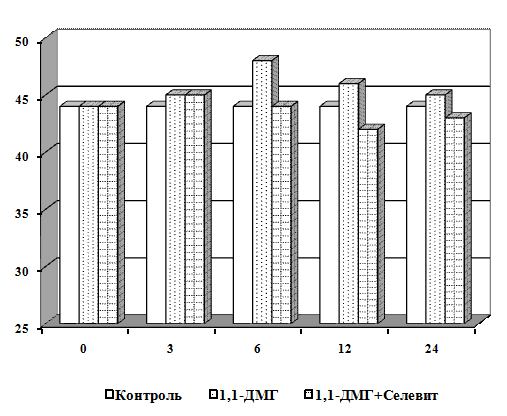
По оси абсцисс: время в часах; по оси ординат: активность каталазы в %
Рисунок 45 - Изолированное влияние 1,1-диметилгидразина и в сочетании с препаратом
«Селевит» на активность каталазы эритроцитов в условиях in vivo
Так как активность фермента в эритроцитах контрольных животных
практически не меняется, а активность каталазы эритроцитов животных,
подвергнутых действию 1,1-ДМГ в сочетании с селевитом, уменьшается, то можно
предположить, что повышение активности каталазы эритроцитов при действии на
организм 1,1-диметилгидразина является следствием интенсификации перекисных
процессов в мембране эритроцитов животных 2 группы.
3.5 Обсуждение результатов исследований
В настоящей работе представлены экспериментальные данные о влиянии
экстремальных факторов (1,1-ДМГ, ионов Pb2+ и Hg2+)
на структурно-функциональное состояние биологических мембран в условиях in vitro (на эритроцитах человека) и in vivo (на эритроцитах кролика) и изучена возможность
использования биологически активных соединений для повышения резистентности
клеточных мембран при действии стрессового фактора.
Исследование влияния 1,1-ДМГ на состояние мембран эритроцитов в условиях in vitro показало, что при концентрациях токсиканта 0,65-6,5
мМ происходит снижение проницаемости эритроцитарных мембран, перекисного
гемолиза эритроцитов, повышение активности каталазы эритроцитов, а концентрации
выше 65 мМ вызывают обратный эффект. Следовательно, существует четкая корреляция
между активностью каталазы, проницаемостью эритроцитарных мембран и
осмотической и перекисной резистентностью эритроцитов. Вероятно, собственная
защитная система может справиться с действием низких концентраций 1,1-ДМГ, а
при увеличении концентрации токсиканта она не в состоянии контролировать
процессы, возникающие в мембране, что проявляется в нарушении структурной
целостности мембран.
Тяжелые металлы, являясь продуктами производственной и бытовой
деятельности человека, особо опасны и вредны для организма человека [158].
Ранее было показано, что некоторые металлы, такие как медь, при инкубации с
суспензией эритроцитов человека вызывают образование метгемоглобина, повышают
интенсивность перекисного окисления липидов и степень гемолиза эритроцитов [287].
Как показали наши исследования, ионы Hg2+ при концентрации до 0,35 мМ повышали осмотический гемолиз
и снижали проницаемость эритроцитарных мембран. При низких концентрациях
хлорида ртути наблюдалось увеличение активности каталазы. Повышение
концентрации токсиканта до 3,5 мМ приводило к повышению проницаемости
эритроцитарных мембран и практически полному гемолизу эритроцитов. Исследование
влияния ионов Pb2+ на состояние мембран эритроцитов
показало, что при низких концентрациях (до 2,5 мМ) ионы свинца практически не
оказывают влияния на осмотическую резистентность эритроцитов. При этих же
концентрациях токсиканта снижается проницаемость мембран, тогда как при
дальнейшем повышении концентрации до 3,8 мМ резко увеличивается проницаемость и
осмотический гемолиз эритроцитов.
Таким образом, результаты наших исследований показали, что гемолиз
эритроцитов повышается с увеличением концентраций исследуемых токсических
соединений. Ранее было показано, что Pb2+ повышает проницаемость мембран эритроцитов для катионов, снижает
деформируемость эритроцитов, непосредственно взаимодействуя с гемоглобином, cпособен вызывать образование
супероксидных радикалов [174]. В литературе имеются сведения, что гемолиз
эритроцитов под действием тяжелых металлов связан с развитием перекисных
процессов в мембране эритроцитов [174]. Ранее было также предположено, что
активация перекисного окисления липидов может вносить вклад в токсическое
действие ионов Pb2+ у человека [288]. Кроме того, имеются данные, что
перекисное окисление предшествует гемолизу [287]. Активные формы кислорода,
генерируемые металл-индуцированным автоокислением гемоглобина, способны к
инициации процессов перекисного окисления липидов мембран, в результате чего
изменяется физико-химическое состояние мембран [174]. Имеются данные, что под
влиянием гидразинов увеличивается концентрация супероксидных радикалов в
клеточных мембранах, причем это достигается двумя путями - в результате
окислительного метаболизма производных гидразина и в результате ингибирования
кислород-детоксицирующей системы микросом, которое в конечном итоге также
приводит к увеличению генерации супероксидных радикалов [31]. В свою очередь
эти радикалы, образующиеся в окислительно-восстановительных реакциях
производных гидразина, могут давать различные токсические эффекты, в том числе
и усиливать процессы ПОЛ.
Известно, что нарушение баланса между образованием свободных радикалов и
системой антиоксидантной защиты связано с повреждением липидов, белков и
нуклеиновых кислот, а также мембран, липиды которых подвергаются перекисному
окислению [54]. Так как каталаза является одним из ключевых ферментов
антиоксидантной системы, то можно предположить, что при снижении активности
фермента изменение показателей резистентности мембран в присутствии 1,1-ДМГ, Hg2+ или Pb2+ происходят в результате активации перекисных процессов в
мембране эритроцитов. Следовательно, увеличение гемолиза эритроцитов при
действии ионов свинца, ртути и 1,1-диметилгидразина происходит при участии
процессов липопероксидации в повреждении клеточных мембран.
К настоящему времени большое значение приобретают исследования
комбинированного действия токсикантов на организм. Изучение комбинированного
действия химических веществ особо важно потому, что в окружающей среде
содержатся тысячи видов вредных химических веществ и человек подвергается
воздействию не одного какого-то соединения, а комплекса токсикантов. Кроме
того, при комбинированном действии токсических соединений эффекты могут
отличаться от их изолированного воздействия [51,289,290]. Помимо самостоятельного
влияния на различные функции организма многие чужеродные для человека вещества
при комбинированном воздействии оказывают влияние друг на друга, усиливая или
ослабляя токсическое действие.
Комбинированное влияние 1,1-диметилгидразина, ионов свинца и ртути
приводит к увеличению уровня гемолиза эритроцитов по сравнению с их
изолированным действием. Изменение проницаемости мембраны эритроцитов под
действием исследованных токсических соединений, по-видимому, происходит в
результате изменения физико-химического состояния липидного бислоя мембран, что
и способствует выходу гемоглобина из эритроцитов.
Как показали наши исследования, совместное действие 1,1-ДМГ с ионами Pb2+ или Hg2+ приводит к резкому увеличению выхода гемоглобина из
эритроцитов. Необходимо отметить, что при сочетанном действии токсикантов
гемолиз значительно выше, чем сумма показателей гемолиза при их изолированном
действии. Можно предположить, что при комбинированном действии происходит
взаимная активация гемолитических эффектов 1,1-ДМГ и ионов тяжелых металлов.
Таким образом, результаты наших исследований показали, что ионы тяжелых
металлов и 1,1-диметилгидразин при изолированном и совместном действии
оказывают неблагоприятное влияние на состояние мембран эритроцитов. В связи с
этим определенное значение приобретают исследования влияния биологически
активных соединений обладающих антиоксидантными свойствами на мембраны
эритроцитов, и их использование для защиты организма от вредных для здоровья
химических агентов.
Имеются данные, что доза витамина C в 40 раз превышающая минимальную
ежедневную потребность, увеличивает общую антиоксидантную активность и
оказывает защитный эффект против эндогенного окисления липидов и белков в
печени при нормальных нестрессовых условиях [291]. В настоящее время активно
исследуются микроэлементы в связи с их влиянием на мембранные процессы
[292,293]. В частности, установлено, что селен усиливает
защитно-приспособительные реакции организма при стрессе [294], стабилизирует
состояние эритроцитарных мембран, активизируя активность ферментов АОС [295].
Исследования влияния витамина С, Е и селенита натрия на состояние мембран
эритроцитов показали, что все исследованные биологически активные вещества
повышают резистентность мембран эритроцитов. Были подобраны эффективные
концентрации витаминов С, Е и селенита натрия (20 мМ, 20 мг/мл, и 100 мкг/мл,
соответственно) и использованы в серии экспериментов для защиты мембран
эритроцитов от повреждающего действия 1,1-диметилгидразина в условиях in vitro. Витамины С, Е, селенит натрия при совместном
действии с 1,1-диметилгидразином снижают уровень гемолиза (на 22,01; 39,39 и
9,86%, соответственно) по сравнению с изолированным действием токсиканта.
Добавление комплекса витаминов и селенита натрия с 1,1-ДМГ к эритроцитам
приводит к уменьшению уровня гемолиза на 50,4% по сравнению с изолированным
действием 1,1-ДМГ. Совместное действие биологически активных соединений
практически полностью подавляет повреждающее действие 1,1-ДМГ.
Ранее было установлено, что комбинированное действие таких природных
регуляторов как витамины и микроэлементы является весьма эффективным в
поддержании достаточно высокой активности АОС [177,296]. Имеются данные, что
комбинированное действие нескольких антиоксидантов более эффективно, чем
действие каждого отдельного компонента [297]. Так, было показано, что при
совместном влиянии витамина Е и селена на процессы липопероксидации, результат
подавления более существенен, нежели при действии только витамина Е [177,298].
Следовательно, результаты наших исследований согласуются с данными, полученными
другими авторами, что эффект комплекса биологически активных препаратов
увеличивает спектр их защитного действия.
Ранее было показано, что снижение уровня антиоксидантных
ферментов и увеличение содержания малонового диальдегида (МДА) при действии
стрессового фактора можно изменить и довести до контрольных значений введением
в диету витаминов Е и С [299]. Было
также обнаружено, что сочетание витаминов Е и С является более эффективным, чем
изолированное их применение. Известно, что добавление антиоксидантов в пищу
предотвращает перекисное окисление липидов (ПОЛ) [300], и что комплекс
антиоксидантов проявляет большие протекторные свойства, чем отдельные его
компоненты [301]. Имеются данные, что добавление антиоксидантов в пищу приводит
к снижению повреждения ДНК и, таким образом, к улучшению иммунологического
статуса организма, а также уменьшению свободнорадикальных повреждений,
связанных с дегенеративными нарушениями [302].
В последнее десятилетие широкое распространение получили биологически
активные добавки (БАД). В БАД содержится суточная доза того или иного витамина
или микроэлемента. БАДы активизируют защитные механизмы и регулируют обменные и
энергетические процессы, обеспечивают нормальное функционирование и коррекцию деятельности
органов и систем организма человека.
Факторы питания могут играть существенную роль в поддержании достаточно
высокой активности АОС, поэтому применение биологически активных добавок может
стать одним из самых эффективных способов профилактики заболеваний [303]. В
этой связи большое внимание уделяется исследованию защитных свойств витаминов и
биологически активных добавок. Одним из широко известных и достаточно хорошо
зарекомендовавших себя не только в превентивной, но и в клинической медицине антиоксидантом
является α-токоферол, а также его производные. Широко изучается
протекторное действие витамина А, роль которого в нейтрализации свободных
радикалов неоднозначна, поскольку зависит от природы и интенсивности действия
как внешних факторов, так и состояния параметров внутренней среды организма.
Антиоксидантными свойствами обладает и аскорбиновая кислота, однако, при
определенных условиях это вещество может проявлять прооксидантные свойства.
Установлен эффект снижения ПОЛ при сочетанном действии аскорбиновой кислоты и
витамина Е на фоне окислительного стресса [304] и действии фосфорорганического
инсектицида - метидатиона [305].
В последнее время накоплены данные о том, что содержание в БАД
биологически активных веществ, обладающих антиоксидантными свойствами имеет
важное значение в лечении и профилактике свободнорадикальной патологии
[306,307]. И в этом направлении достигнуты определенные успехи по применению,
так называемых, биологически активных добавок, обладающих протекторными
свойствами.
В связи с этим в условиях in vivo нами было изучено изолированное и
совместное с препаратом «Селевит» действие 1,1-ДМГ на резистентность мембран
эритроцитов. Селевит - смесь витаминов С, Е, β-каротина и селена.
Исследование возможности повышения резистентности организма при действии
1,1-ДМГ с помощью биопрепарата «Селевит», разработанного в Казахской Академии
питания, являющегося биологически активной добавкой к пище показало, что
использованный препарат повышает резистентность клеточных мембран и снижает
действие стрессового фактора. Ранее было показано, что при совместном действии
витамина Е и селена, протекторный эффект значительно выше по сравнению с
изолированным действием этих биологически активных соединений [298,308].
Результаты наших исследований показали, что витамины и микроэлементы в
исследованном нами биопрепарате «Селевит» дополняют друг друга, обеспечивают
широкий спектр протекторных свойств и являются предпочтительным комплексом для
защиты организма от повреждающего действия стрессовых факторов окружающей
среды. На основании полученных данных можно заключить, что новый биопрепарат
повышает резистентность клеточных мембран, снижает действие стрессового фактора
и может обеспечить защиту организма при действии неблагоприятных факторов
среды. В связи с этим разработка новых продуктов питания, состоящих из ряда
необходимых организму биологически активных веществ, обладающих широким
спектром протекторного действия, является важным для сохранения здоровья. Таким
образом, применение биологически активной добавки «Селевит» повышает
резистентность организма и защищает мембрану эритроцитов от повреждающего
действия 1,1-диметилгидразина. Анализ полученных результатов позволяет
заключить, что уникальное сочетание витаминов-антиоксидантов и селена в
«Селевите» обеспечивает широкий спектр протекторных свойств и способствует
повышению резистентности организма к действию стрессового фактора.
ЗАКЛЮЧЕНИЕ
ион
свинец ртуть мембрана
На основании полученных данных были сделаны следующие выводы:
1. 1,1-диметилгидразин и ионы тяжелых металлов (Pb2+, Hg2+) в условиях in vitro снижают резистентность мембран
эритроцитов. Выявлено, что существует корреляция между активностью каталазы,
проницаемостью эритроцитарных мембран, осмотической и перекисной
резистентностью эритроцитов.
2. Совместное действие 1,1-диметилгидразина и ионов тяжелых металлов
на состояние мембран эритроцитов человека в условиях in vitro сопровождается снижением резистентности клеточных
мембран. Показано, что эффект комбинированного действия 1,1-диметилгидразина,
ионов Pb2+ и Hg2+ значительно превосходит значения, полученные при их
изолированном влиянии.
. Витамины С, Е, селенит натрия повышают осмотическую и перекисную
резистентность мембран эритроцитов, снижают проницаемость эритроцитарных
мембран в условиях in vitro.
. Установлено, что витамины С, Е, селенит натрия защищают
эритроциты от повреждающего действия 1,1-диметилгидразина в условиях in vitro. Протекторный эффект использованных биологически
активных соединений значительно выше при их совместном действии.
. Исследование суточной динамики изменения резистентности мембран
эритроцитов при введении кроликам разовой дозы 1,1-диметилгидразина и 1,1-ДМГ в
сочетании с препаратом «Селевит» выявило, что токсикант вызывает снижение
резистентности мембран эритроцитов, а препарат «Селевит» нивелирует эффект
1,1-ДМГ.
Оценка полноты решений поставленных задач.
Поставленные в диссертационной работе задачи решены полностью.
1,1-диметилгидразин при сочетанном действии с ионами свинца и ртути оказывает
более выраженный повреждающий эффект по сравнению с изолированным влиянием.
Витамины С, Е, селенит натрия в условиях in vitro, препарат «Селевит» в условиях in vivo снижают эффект 1,1-диметилгидразина.
Разработка рекомендаций и исходных данных по конкретному использованию
результатов.
Результаты исследования протекторных свойств биологически активных
соединений (витаминов С, Е, селенита натрия, препарата «Селевит») могут быть
использованы для разработки мероприятий по защите организма от неблагоприятных
факторов окружающей среды. Полученные в результате наших экспериментов данные
могут быть использованы в лекционных курсах по физиологии питания,
токсикологии, экологии, физиологии мембран.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1
Hess E.V. Environmental chemicals and autoimmune disease: cause and effects
Toxicology. - 2002. - Vol. 27. - P. 65-70, 181-182.
Efroymson
R.A., Murphy D.L. Ecological risk assessment of multimedia hazardous air
pollutants: estimating exposure and effects // Sci. Total Environ. - 2001. - Vol. 274, № 1-3. - Р. 219-230.
Saric
М. Health effects studies
related to occupational and environmental exposure // Arh Hig Rada Toksikol. - 1999. - Vol. 50, № 3. - P. 309-326.
4 Джунусов
И.Ш. Антропогенное влияние космической и хозяйственной деятельности на экологию
Жезказганского региона // Вестник КарГУ. - 2001. № 1. С. 203-206.
5 Пиментал
Дж., Кунрод Дж. Химия и состояние окружающей среды // Возможности химии сегодня
и завтра. - М., 1992. - С. 32-36.
6 Агаджанян
Н.А., Проблемы адаптации и экологии человека // Экология человека. Основные
проблемы. - М., 1988. - С. 93-104.
7 Ерзинкян
К.Л. Антропогенные факторы окружающей среды и проблема здоровья // Вестник АМН
СССР. -1989. - №8. - С.59-67.
Кусаиынов К.,
Сакипова С.Е., Корабейникова В.К., Данбаев З.Б. Экологический анализ вредных выбросов
в атмосферу на основе моделирования уровня токсичности // Вестник КарГУ. - 2001. - № 1. - С.
110-115.
Султангазин
У.М., Закарин Э.А., Суйменбаев Б.Т. Принципы построения геоинформационной
системы для решения экологических проблем эксплуатации ракетно-космических
комплексов на космодроме «Байконур» // Вестник КарГУ. - 2001. - № 1. - С. 146-148.
Алимбаев А.А.
Социально-экономические проблемы качества окружающей среды в центральном
Казахстане // Вестник КарГУ. - 2001. - № 1. - С. 156-158.
Рязанова Р.А.
Гигиеническое значение отдаленных последствий действия химических соединений
при регламентировании // Гигиена и санитария. - 1990. - №
11. - С. 72-75.
12 Шепотько
А.О., Дульский В.А., Сутурин А.Н. и др. Свинец в организме животных и человека
(обзор) // Гигиена и санитария. - 1993.
- № 8. - С. 70-73.
13
Оксенгендлер Г.И. Яды и противоядия. - Л.: Наука, 1982. - 192 c.
14 Зимовина
Е.П. Влияние деятельности космодрома « Байконур» на демографические процессы в
Кызылординской области // Вестник КарГУ. - 2001. - № 1. - С. 89-93.
15 Нурушев А.
Арал - море общих проблем // Экономика и жизнь. - 1998. - Т. 144, №16. - С. 16.
Ермекбаев
К.К. Обоснование проведения мониторинга состояния здоровья населения в связи с
деятельностью космодрома «Байконур» // Вестник КарГУ. - 2001. - № 1. - С. 198-203.
Гидразин.
Гигиенические критерии состояния окружающей среды. - Женева: Совместное издание Программы ООН и Всемирной
организации здравоохранения, 1991. - 84 с.
Белов А.А. К
вопросу о токсичности и опасности гидразина и его производных (обзор) //
Промышленная токсикология. -
1999. - №5. - С. 3-15.
Акылбаев
Ж.К., Бактыбеков К.С., Быйстро В.К., Рамазанова Р.А., Чунаева В.Д.
Несимметричный диметилгидразин и продукты его превращения как фактор
загрязнения окружающей среды // Вестник КарГУ. - 2001. - № 1. - С. 54-56.
Ворожейкин
А.П., Касимов Н.С., Королева Т.В., Проскуряков Ю.В. Эколого-гигиеническая
ситуация в районах падания первой и второй ступеней ракет-носителей на
территории Республики Казахстан // Вестник КарГУ. - 2001. - №
1. - С. 82-83.
Ергожин Е.Е.,
Соломин В.А., Ляпунов В.В. Химико-экологический мониторинг объектов окружающей
среды - одно из основных направлений изучения экологических аспектов влияния
космодрома «Байконур» // Вестник КарГУ. - 2001. - № 1. - С. 93-96.
Гранкин М.С.,
Айтуганов К.А., Хамзин Б.С., Жуковский В.И., Рахметкалиев А.Н. К вопросу о
проведении геоэкологического мониторинга в районах падения отделяющихся
фрагментов ракет // Вестник КарГУ. - 2001. - № 1. - С. 191-193.
Боровский
Е.Э. Озоновый слой земли: проблемы и прогнозы // Химия в школе. - 2000. - №3. -
С. 4-12.
24 Адекенов С.М., Айтуганов
К.А., Ержанов Е.Т., Бекишев К.Б. Изучение репродуктивной возможности
перспективных деревьев и кустарников для восстановления нарушенных земель // Вестник КарГУ. - 2001. - № 1. - С.
63-65.
Жакатаева
Б.Т. Влияние космодрома «Байконур» на тепловой режим атмосферы центрального
Казахстана // Вестник КарГУ. - 2001. - № 1. - С. 88-89.
Наурызбаев
М.К., Батырбекова С.Е., Зебрева А.И., Уразалин А.К., Злобина Е.В., Долгова
Н.Д., Иванова Н.В., Сапаркина Н.П. Основные аспекты экологической оценки
районов падения отделяющихся частей ракет-носителей // Вестник КарГУ. - 2001. - № 1. - С.
134-137.
Вишневский
Е.П., Бильчук И.В., Зенов С.Н. Экологические проблемы создания и применения
ракетно-космической техники. - М.,
1991. - С. 111-117.
Касимов Н.С.,
Гребенюк В.Б., Королева Т.В., Проскуряков Ю.С. Поведение компонентов ракетного
топлива в почвах, водах и растениях // Почвоведение. - 1994. - №9. - С. 110-120.
Суйменбаев
Б.Т., Максин Д.Г., Куликов С.А. Экологическая безопасность эксплуатации
ракетно-космических комплексов. - М.,
1997. - 43 с.
30
Gorshtein E.S., Kopylova T.N. Effect of hydrazine hydrochloric acid on the
hepatic microsomal hudroxylation system of rats // Eksp. Med. - 1983. - Vol. 15, № 1. - P. 22-26.
31 Авакян
А.X. Новые молекулярные критерии оценки токсического действия производных
гидразина. Активные формы кислорода как ключевые агенты в механизме токсичности
// Фармакология и токсикология. -
1990. - Т.53, №1. - С. 70-73.
Муравлева
Л.Е., Калинич Е.А., Тритэк В.С. Характеристика спектра нуклеиновых кислот
лейкоцитов крови людей, проживающих в сфере влияния космодрома «Байконур» //
Вестник КарГУ. - 2001. - № 1. - С.
217-218.
Филиппов
В.Л., Криницын Н.В., Радилов А.С., Филиппова Ю.В. Особенности клинического
проявления воздействия несимметричного диметилгидразина на организм человека и
подходы к дифференциальной диагностике // Вестник КарГУ. - 2001. - № 1. - С. 231-232.
Кольбай И.С.,
Сейткулова Л.М., Наурызбаев М.К., Батырбекова С.Е., Уразалин А.К.,
Тлепбергенова Л.Н. Сравнительный анализ действия несимметричного
диметилгидразина и ионов Cd2+
на уровень протеолитической активности ряда тканей // Вестник КарГУ. - 2001. - № 1. - С.
206-209.
35
Bhide S.V., D¢Souza R. A., Saway M.M., Ranadive K. J. Lung tumour incidence
in mice treated with hidrazine sulfate // Int. J. Cancer. - 1976. - №18. - Р. 530-535.
Wald
N., Boreham J., Doll R., Bonsall J. Occupational exposure to hydrazine and
subsequent risk of cancer // Br. J. Ind. Med. - 1984. - № 41. - Р. 31-34.
37
Steinhoff D, Mohr U. The question of carcinogenic effects of hydrazine // Exp.
Pathol. - 1988. - Vol. 33, № 3. - Р. 133-43.
38
Bleich M., Ecke M., Schwartz M., Frazer M., Greder R. Effects of the carcinogen
dimethylhydrazine (DMH) on the function of rat colonic crypts // Pflugers
Archiv. - 1996. - Vol. 433, №3. - Р. 254-259.
Ernst
H, Rittinghausen S, Wahnschaffe U, Mohr U. Induction of malignant peripheral
nerve sheath tumors in European hamsters with 1,1-dimethylhydrazine (UDMH) //
Cancer Lett. - 1987. - Vol. 35, № 3. - Р. 303-311.
40 Beije B, Olsson U,
Onfelt A. Effect of dietary selenium on biotransformation and excretion of
mutagenic metabolites of N nitrosodimethylamine and 1,1-dimethylhydrazine in
the liver perfusion cell culture system // IARC Sci Publ. - 1987. - Vol. 84. - Р. 178-180.
41
Godoy HM, Diaz Gomez MI, Castro JA.. Metabolism and activation of 1,1-dimethylhydrazine and
methylhydrazine, two products of nitrosodimethylamine reductive biotransformation,
in rats // J. Natl. Cancer Inst. - 1983. - Vol. 71, № 5. Р. 1047-1051.
Панин М.С.
Влияние техногенных факторов и агрохимической деятельности человека на
содержание, миграцию тяжелых металлов в системе «почва-растение» // Состояние и
рациональное использование почв Республики Казахстан: сб. материалов
науч.-техн. конф. - Алматы, 1998. - С. 76-79.
43
Clarkson TW, Magos L. The toxicology of mercury and its chemical compounds //
Crit. Rev. Toxicol. - 2006.
- Vol. 36, № 8. - P. 609- 662.
Gidlow
D.A. Lead toxicity // Occupational Medicine. - 2004. - Vol. 54, № 2. - P. 76-81.
45 Вредные
химические вещества. Неорганические соединения элементов 1-4 групп. Справочник.
Под редакцией В.А.Филова. - Л.:
Химия, 1988. - 512 c.
46 Ершов
Ю.А., Плетенева Т.В. Механизмы токсического действия неорганических соединений.
- М.: Медицина, 1989. - 272 с.
47
Johnson CL. Mercury in the environment: sources, toxicities, and prevention of
exposure. // Pediatr. Ann. - 2004. - Vol. 33, № 7. - P. 437-442.
Clarkson
TW. The toxicology of mercury // Crit. Rev. Clin. Lab. Sci. - 1997. - Vol. 34, № 4. - P. 369-403.
49 Иванова
И.А., Прибыловский В.С. Эколого-геохимические особенности загрязнения городов
Карагандинской области // Материалы республиканской научно-практической
конференции «Современные проблемы экологии центрального Казахстана». -
Караганда, 1996. - С. 194-197.
Александрова
С.И, Новикова И. Некоторые аспекты современного экологического состояния
бассейна реки Нуры // Материалы республиканской научно-практической конференции
«Современные проблемы экологии центрального Казахстана». - Караганда, 1996. -
С. 205-209.
51
Carpenter D.O., Arcaro K.F., Bush B., Niemi W.D., Pang S., Vakharia D.D. Human
health and chemical mixtures: an overview // Environ. Health Perspect. - 1998. - Vol. 106, № 6. - P. 1263-1270.
Куценко С.А.
Основы токсикологии: научно-методическое издание. - СПб: Фолиант, 2004. - 720 с.
53 Введение
в мембранологию: Учеб.пособие. Под редакцией Болдырева А.А. - М.: МГУ, 1990. - 208 с.
54.
Young S., Woodside J.V. Antioxidants in health and disease // J. Clin. Pathol. - 2001. - Vol. 54, № 3. - P. 176-186.
Владимиров
Ю.А. Свободные радикалы и антиоксиданты // Вестник РАМН. - 1998. - №7. - С. 43-51.
Девис М.,
Остин Дж., Патридж Д. Витамин С. Химия и биохимия. - М.: Мир, 1999. - 176
с.
Гмошинский
И.В., Мазо В.К. Селен в питании: краткий обзор // Medicina Altera. -
1999. - № 4. - С. 18-22.
58
Sunde R.A. Molecular biology of selenoproteins // Annu. Rev. Nutr. -
1990. - Vol. 10. - P. 451- 474.
Леднева И.Т. Мембраны
эритроцитов - возможная модель для исследования // Физ.-хим. биол. и биотехн. - 1989. - №10. - С.
17-25.
60
Toth B. A review of the natural occurrence, synthetic production and use of
carcinogenic hydrazines and related chemicals // In Vivo. - 2000. - Vol. 14, № 2. P. 299-319.
61 Горшкова
Р.Б. Эколого-гигиеническая значимость и особенность поведения несимметричного
диметилгидразина и продуктов его разложения в объектах окружающей среды //
Вестник КарГУ. - 2001. - № 1. - С. 196-198.
Жидкие ракетные
топлива. Справочник. - М.: Институт
биофизики, 1991. 263 с.
Иоффе Б.Ф.,
Кузнецов М.А., Потехин А.А. Химия органических производных гидразина. - Л.: Химия, 1979. - С. 66-68.
Большаков
Г.Ф., Гулин Е.И., Торичнев Н.Н. Физико-химические основы применения моторных,
реактивных и ракетных топлив. - Л.:
Химия, 1965. - 215 c.
65
Spinkova. Determination of small amounts of hydrazine in isoniazid solutions //
Pharm. Acta. Helv. - 1971.
- Vol. 46. - P. 643-648.
Matsui
F., Robertson D.L., Lovering E.G. Determination of hydrazine in
pharmaceuticals. III. Hydrazine and isoniazid using GLC // J. pharmacol. Sci. - 1983. - Vol. 72. - P. 948-951.
Blair
I.A., Tinoco R.M., Brodie M.J. et al. Plasma hydrazine concentrations in man
after isoniazid and hydralazine administration // Human Toxicol. - 1985. - № 4. - P. 195-202.
Noda
A., Goromaru T., Matsuyama K., Sogabe K., Hsu K.-Y., Iguchi S. Quantitative
determination of hydrazinea derived from izoniazid in patients // I. J. Pharm.
Dyn. - 1978. - № 1. P. 132-141.
Timbre11
J.A., Harland S.J. Identification and quantitation of hydrazine in the urine of
patients treated with hydralazine // Clin. Pharmacol. Ther. - 1979. - Vol. 26. - P. 81-88.
Liu
Y.Y., Schmeltz I., Hoffman D. Chemical studies on tobacco smoke. Quantitative
analysis of hydrazine in tobacco and cigarette smoke // Anal. Chem. - 1974. - Vol. 46. P. 885-889.
Савин Ю.И.,
Халиков И.С. Оценка основных путей трансформации несимметричного
диметилгидразина в природных водах // 5-ое Всесоюзное совещание по загрязнению
атмосферы и почвы. - М.:
Гидрометеоиздат, 1991.
Карасартов Д.
О необходимости изучения почвенного и растительного покрова на территории
комплекса «Байконур» // Вестник КарГУ. - 2001. - № 1. - С.
100-102.
Акпамбетова
К.М., Айтуганов К.А., Абиева Г.Б. Ландшафтно-геохимические исследования
Центрального Казахстана // Вестник КарГУ. - 2001. - № 1. - С. 67-69.
74
Kane D.A., Williamson K.J. Bactherial toxicity and metabolism hydrazine fuels
Arch. environ. Contam. Toxicol. - 1983. - №12. - P. 447-453.
Davis
L.C. Hydrazine as a substrate and inhibitor of Azobacter vinelandii nitrogenase
// Arch. Biochem. Biophys. - 1980. - № 204. - P. 270-276.
Slonim
A.R., Gisclard J.B. Hydrazine degradation in aquatic systems // Bull. environ.
Contam. Toxicol. - 1976. - № 16. - P. 301-309.
Mitz
M.A., Aldrich F.L., Vasta B.M. Study of intermediary metabolic pathways of
1,1-dimethylhydrazine (UDMH) AMRL-TDR-62-110. - 1962.
Reed
D.J., Dost F.N., McCutcheon R.S. et al. Biochemical and pharmacological studies
of 1,1-dimethylhydrazine AMRL-TDR-63- 127. - 1963.
Helmers
S., Ruland R.T., Jacob L.N. Epithelioid sarcoma of the thumb
associated with hydrazine fuel exposure: a case report // Mil. Med. - 2004. - Vol. 169, № 1. - P. 41-44.
Богданов Н.А.
Патология, клиника и терапия поражений жидкими ракетными топливами. - Л.: ВМОЛА, 1970. - С. 36-38.
81
Smith E.B., Clark D.A. Absorption of unsymmetrical dimethylhydrazine (UDMH)
through canine skin // Toxicol. Appl. Pharmacol. -1971. - № 18. - P. 649-659.
Smith
E.B., Clark D.A. Absorption of hydrazine through canine skin // Toxicol. Appl.
Pharmacol. -
1972. - № 21. P. 186-193.
Back
K.C., Pinkerton M.K., Cooper A.B. et al. Absorption, distribution, and
excretion of 1,1-dimethylhydrazine (UDMH) // Toxicol. Appl. Pharmacol. -1963. № 5. - P. 401-413.
Fiala
E.S., Kulakis C. Separation of hydrazine, monomethylhydrazine,
1,1-dimethylhydrazine and 1 ,2-dimethylhydrazine by high performance liquid
chromatography with electrochemical detection // J. Chromatogr. - 1981. - Vol. 214. - P. 229-233.
Dost
F.N., Reed D.J., Wang C.H. The metabolic fate of monomethylhydrazine and
unsymmetrical dimethylhydrazine // Biochem. Pharmacol. - 1966. - Vol. 15. - P. 1325-1332.
Nelson
S.D., Gordon W.P. Metabolic activation of hydrazines // Adv. exp. Med. biol. - 1982. - № 136 B. - P. 971-981.
Toxicological
profile for Hydrazines. - U.S. department of health and human services, Public health service,
Agency for toxic substances and disease registry. - 1997. P. 224.
Пентюк А.А.,
Михайленко В.А., Рубенин Б.Л. Влияние витамина А на эндогенный синтез и систему
детоксикации N-нитрозодиметиламина в печени крыс //
Экспериментальная онкология. -
1987. - Т. 9, № 5. - С. 64-68.
НДМГ.
Токсикология, гигиена и профпатология. Под редакцией С.Д. Заугольникова. - М.: Институт биофизики, 1982. - С. 260-263.
90
Choudhary G., Hansen H. Human health perspective on environmental exposure to
hydrazines: a review // Chemosphere. - 1998. - Vol. 37, № 5. - P.
801-43.
91 Портянная
Н.И., Осипенко Б.Г., Москадынова Г.А. К биохимическому механизму токсического
действия гидразинов // 1-й съезд токсикологов России: Тезисы докладов. - М., 1999. - С. 306.
92
Rogers A.M., Back K.C. Comparative mutagenicity of hydrazine and 3 methylated
derivatives in L5178Y mouse lymphoma cells // Mutat. Res. - 1981. - Vol. 89, № 4. - Р. 321-328.
Morgenstern
H., Ritz B. Effects of radiation and chemical exposures on cancer mortality
among Rocketdyne workers: a review of three cohort studies // Occup. Med. - 2001. - Vol. 16, № 2. - P. 219-237.
Morris
J., Densem J.W., Wald N.J., Doll R. Occupational exposure to hydrazine and
subsequent risk of cancer // Occup. Environ. Med. - 1995. - Vol. 52, № 1. - P. 43-45.
Ritz
B., Morgenstern H., Froines J., Moncau J. Chemical exposures of rocket-engine
test-stand personnel and cancer mortality in a cohort of aerospace workers J.
Occup. Environ. Med. - 1999. - Vol. 41, № 10. - P. 903-910.
Егорова Г.Л.,
Худолей В.В. Свинец в окружающей среде: опасность
для здоровья детей и ее предупреждение // Материалы сети Интернет. -
http://www.eco.nw.ru/lib/data/06/1/120106.htm.
Белоусова
Ю.А. Отравление свинцом - невидимая угроза современного города // Материалы
сети Интернет. -
http://zhurnal.lib.ru/b//belousowa_j_a/bel1.shtml.
98
Levin S.M., Goldberg M., Doucette J.T. The effects of OSHA lead exposure in
construction standard on blood lead levels among iron workers employed in
bridge rehabilitation // Am. J. Ind. Med. - 1997. - Vol. 31. - P. 303-309.
Sen
D., Wolfson H., Dilworth M. Lead exposure in scaffolders during refurbishment
construction activity - an observational study // Occup. Med. (Lond). - 2002. - Vol. 52. - P. 49-54.
Delumyea
R., Kalivretenos A. Elemental carbon and lead content of fine particles from
American and French cities of comparable size and industry // Atmospheric
environment. - 1985. - Vol. 21. - P. 1643-1647.
Ducoffre
G. et al. Lowering time trend of blood lead levels in Belgium since 1978 //
Environmental research. - 1990. - Vol. 51. - P. 25-34.
102 Титова
Е.Н. Свинец // Материалы сети Интернет. - http://www.eco.nw.ru/lib/data/06/3/040306.htm.
103 Популярная библиотека химических
элементов. Свинец // Материалы сети Интернет. - http://n-t.ru/ri/ps/pb082.htm.
104 Худолей
В.В. Свинец и здоровье ваших детей // Материалы сети Интернет. - http://www.eco.nw.ru/lib/data/06/3/070306.htm.
105
Koller L.D. Immunological effects of lead. In: Mahaffey KR, ed. Dietary and
Environmental Lead: Human Health Effects. - Amsterdam: Elsevier Science
Publishers, 1985. - P.
339-354.
Nordstrom
S., Beckman L., Nordenson I. Occupational and environmental risks around a
smelter in northern Sweden: V. Spontaneous abortion among female employees and
decreased birth weight in their offspring // Hereditas. - 1979. - Vol. 90. - P. 291-296.
Baker
E.L., White R.A., Pothier L.J., et al. Occupational lead neurotoxicity:
improvement in behavioural effects after reduction of exposure // Br. J. Ind.
Med. - 1985. - Vol. 42. - P. 507-516.
Hogstedt
C., Hane M., Agrell A., Bodin L. Neuropsychological test results and symptoms
among workers with well-defined long-term exposure to lead // Br. J. Ind. Med. - 1983. - Vol. 40. - P. 99-105.
Mantere
P., Hanninen H., Hernberg S., Luukkonen R. A prospective follow-up study on
psychological effects in workers exposed to low levels of lead // Scand. J. Work. Environ. Health. - 1984. - № 10. - P. 43-50.
Campara
P., D’Andrea F., Micciolo R., Savonitto C., Tansella M., Zimmermann-Tansella
Ch. Psychological
performance of workers with blood lead concentrations below the current
threshold limit value // Int. Arch. Occup. Environ. Health. - 1984. - Vol. 53. - P. 233-246.
Hanninen
H., Aitio A., Kovala T. et al. Occupational exposure to lead and
neuropsychological dysfunction // Occup. Environ. Med. - 1998. - Vol. 55. - P. 202-209.
Schwartz
J. Low level lead exposure and children’s IQ: a metal analysis and search for a
threshold // Environmental research. - 1994. - Vol. 65. - P. 42-55.
Inorganic
lead. - Geneva: World Health
Organization, 1995 (Environmental Health Criteria, No. 165).
Stollery
B.T. et al. Cognitive functioning in lead workers // British journal of
industrial medicine. - 1989.
- Vol. 46. - P. 698-707.
Stollery
B.T. et al. Short term prospective study of cognitive functioning in lead
workers // British journal of industrial medicine. - 1991. - Vol. 48. - P. 739-749.
Seppalainen
A.M., Hernberg S. A follow up study of nerve conduction velocities in lead
exposed workers // Neurobehavioral toxicology and teratology. - 1982. - № 4. - P. 721-723.
Davis
J.M., Svendsgaard D.J. Nerve conduction velocity and lead: a critical review
and metal analysis. In: Johnson, B.L., ed. Advances in neurobehavioral
toxicology. - Chelsea: Lewis
Publishers, 1990. - P.
353-376.
Wong
O., Harris F. Cancer mortality study of employees at lead battery plants and
lead smelters, 1947-1995 // Am. J. Ind. Med. - 2000. - Vol. 38. - P. 255-270.
Lundstrom
N.-G., Nordberg G., Englyst V. et al. Cumulative lead exposure in relation to mortality and
lung cancer morbidity in a cohort of primary smelter workers // Scand. J. Work.
Environ. Health. - 1997. - Vol. 23. - P. 24-30.
Monographs
on the evaluation of the carcinogenic risk of chemicals to humans //
International Agency for Research on Cancer. - 1987. - P. 230-232.
Boscolo
P., Carmignani M. Neurohumoral blood pressure regulation in lead exposure //
Environ. Health Perspect. - 1988. - Vol. 78. - P. 101-106.
Victery
W. Evidence for effects of chronic lead exposure on blood pressure in
experimental animals: an overview // Environ. Health Perspect. - 1988. - Vol. 78. P. 71-76.
Loghman-Adham
M. Renal effects of environmental and occupational lead exposure // Environ.
Health Perspect. - 1997. - Vol. 105. - P. 928-938.
Ehrlich
R., Robins T., Jordaan E. et al. Lead absorption and renal dysfunction in a
South African battery factory // Occup. Environ. Health. - 1998. - Vol. 55. - P. 453-460.
Gerhardsson
L., Chettle D.R., Englyst V. et al. Kidney effects in long-term exposed lead
smelter workers // Br. J. Ind. Med. - 1992. - Vol. 49. P. 186-192.
Hernberg
S., Nikkanen J. Enzyme inhibition by lead under normal urban conditions //
Lancet. - 1970. - № 1. - P. 63-64.
Schwartz
J. et al. Lead induced anemia: dose-response relationships and evidence for a
threshold // American journal of public health. - 1990. - Vol. 80. - P. 165-168.
128
Mahaffey K.R. et al. Association between age, blood lead concentration, and serum
dihydroxycholecalciferol levels in children // American journal of clinical
nutrition. - 1982. - Vol. 35. - P. 1327-1331.
Rosen
J.F. et al. Reduction in 1,25-dihydroxyvitamin D in children with increased
lead absorption // New England journal of medicine. - 1980. - Vol. 302. - P. 1128-1131.
Saxena
G., Flora S.J. Lead-induced oxidative stress and hematological alterations and
their response to combined administration of calcium disodium EDTA with a thiol
chelator in rats // J. Biochem. Mol. Toxicol. - 2004. - Vol. 18. № 4. - P. 221-233.
Sandhir
R., Gill K.D. Effect of lead on lipid peroxidation in liver of rats // Biol.
Trace Elem. Res. - 1995. - Vol. 48, № 1. - P. 91-97.
An
old problem, mercury pollution, reappears in a troublesome new form // Mатериалы сети интернет. -
http://www.ejnet.org/rachel/rhwn291.htm.
Bhan
A., Sarkar N.N. Mercury in the environment: effect on health and reproduction
// Rev. Environ. Health. - 2005. - Vol. 20, № 1. - P. 39-56.
William
D. Watson, Jr. Economic considerations in controlling mercury pollution in J.
O. Nriagu, editor, the biogeochemistry of mercury in the environment. - NY: Elsevier/North-Holland
Biomedical Press, 1979. - P. 41-77.
135 Юфит С. Токсичные металлы
- ne quid nimis // Экологический журнал "Волна". - 2000. - № 22.
136 Gochfeld M.
Cases of mercury exposure, bioavailability, and absorption // Ecotoxicol.
Environ. Saf. - 2003. -
Vol. 56. - № 1. - P. 174-179.
137
Популярная библиотека химических элементов. Ртуть // Материалы сети Интернет. - http://n-t.ru/ri/ps/pb080.htm.
138 Clarkson T.W.
<http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11834460&dopt=Abstract>
The three modern faces of mercury // Environmental Health Perspectives. - 2002. - Vol. 110, № 1. - P.
11-23.
139
Kazantzis G. Mercury exposure and early effects: an overview // Med. Lav. - 2002. - Vol. 93, № 3. - P. 139-147.
Satoh
H. Occupational and environmental toxicology of mercury and its compounds //
Ind. Health. - 2000. - Vol. 38, № 2. - P. 153-164.
Clarkson
T.W. Mercury // Journal of the American College of Toxicology. - 1989. - Vol. 8, №.7. - P. 1291-1295.
.
Clarkson T.W. Human Health Risks From Methylmercury in Fish // Environmental
toxicology and chemistry. - 1990. - Vol. 9. - P. 957-961.
Gail
E., Mckeown-Eyssen, Ruedy J. Prevalence of Neurological Abnormality in Cree
Indians Exposed to Methylmercury in Northern Quebec // Clinical &
investigative medicine Vol. 6, No. 3 (1983), pgs. 161-169.
Clarkson
T.W. Recent advances in toxicology of mercury with emphasis on the alkyl
mercurials // Crit. Rev. Toxicol. - 1972. - Vol. 1. - P. 203-234.
Hughes
W.L. A physicochemical rationale for the biological activity of mercury and its
compounds // Ann. NY Acad. Sci. - 1957. - Vol. 65. - P. 454-460.
Passow
H., Rothstein A., Clarkson T. The general pharmacology of the heavy metals //
Pharmacol. Rev. - 1961. - Vol. 13. - P. 185-224.
Bulger
R.E. Renal damage caused by heavy metals // Toxicol. Pathol. - 1986. Vol. 14. - P. 58-65.
Sahaphong
S., Trump B.F. Studies of cellular injury in isolated kidney tubules of the
flounder // Am. J. Pathol. - 1971. - Vol. 63. - P. 277-290.
Alexidis
A.N., Rekka E.A., Kourounakis P.N. Influence of mercury and cadmium
intoxication on hepatic microsomal CYP2E and subfamilies // Res. Commun. Mol.
Pathol. Pharmacol. - 1994.
- Vol. 85, № 1. - P. 67-72.
Zalups
R.K., Lash L.H. Advance in understanding the renal tranport and toxicity of
mercury // J. Toxicol. Environ. Health. - 1994. - Vol. 42. - P. 1-44.
Lund
B.O., Miller D.M., Woods J.S. Studies on Hg(II)-induced H2O2 formation and
oxidative stress in vivo and in vitro in rat kidney mitochondria // Biochem.
Pharmacol. - 1993. - Vol. 45, № 10. - P. 2017-2024.
Miller
D.M., Woods J.S. Redox activities of mercury-thiol complexes: Implications for
mercury-induced porhyria and toxicity // Chem. Biol. Interactions. 1993. - Vol. 88. - P. 23-35.
Gstraunthaler
G., Pfaller W., Kotanko P. Glutathione depletion and in vitro lipid
peroxidation in mercury or maleate-induced acute renal failure // Biochem.
Pharmacol. - 1983. - Vol. 32. - P. 2969-2972.
Bartolucci
G.B., Boffetta P., Mantovani A., Chiesara E. Evaluation of the effects
following low doses of inorganic mercury from environmental and occupational
exposures // Med. Lav. - 2002.
- Vol. 93, № 3. - P. 290-298.
Soleo
L., Colosio C., Alinovi R. et.аl.
Immunologic effects of exposure to low levels of inorganic mercury // Med. Lav.
- 2002. - Vol. 93, № 3. - P. 225-232.
Weil
M., Bressler J., Parsons P. et. аl. Blood mercury levels and neurobehavioral function // JAMA. - 2005. - Vol. 293, № 15. - P. 1875-1882.
Britton
R.S. Metal-induced hepatotoxicity // Semin. Liver Dis. - 1996. - Vol. 16, № 1. - P. 3-12.
Ercal
N., Gurer-Orhan H., Aykin-Burns N. Toxic metals and oxidative stress part I:
mechanisms involved in metal-induced oxidative damage // Curr. Top. Med. Chem. - 2001. - Vol. 6. - P. 529-539.
Valko
M., Morris H., Cronin M.T. Metals, toxicity and oxidative stress // Curr. Med.
Chem. - 2005. - Vol. 12, № 10. - P. 1161-1208.
Valko
M., Rhodes C.J., Moncol J., Izakovic M., Mazur M. Free radicals, metals and
antioxidants in oxidative stress-induced cancer // Chem. Biol. Interact. 2006. - Vol. 160, № 1. - P. 1-40.
Saxena
G., Flora S.J. Lead-induced oxidative stress and hematological alterations and
their response to combined administration of calcium disodium EDTA with a thiol
chelator in rats // J. Biochem. Mol. Toxicol. - 2004. - Vol. 18, № 4. - P. 221-233.
Kappus
H. Oxidative stress in chemical toxicity // Arch. Toxicol. - 1987. - Vol. 60, № 1-3. - P. 144-149.
Stohs
S.J., Bagchi D., Hassoun E., Bagchi M. Oxidative mechanisms in the toxicity of
chromium and cadmium ions // J. Environ. Pathol. Toxicol. Oncol. - 2001. - Vol. 20, № 2. - P. 77-88.
Болдырев А.А. Введение в биохимию мембран. - М.: Высшая школа, 1986. - 109 с.
165 Сим Э.
Биохимия мембран. - М.: Мир, 1985. - 110 с.
Котык А.,
Яначек К. Мембранный транспорт. - М:
Мир, 1980. - 338 с.
Рыбальченко
В.К., Курский М.Д. Молекулярная организация и ферментативная активность
биологических мембран. - Киев: Наукова
думка, 1977. - 181 с.
168
Agostini C., Bruzzese M.G. Fatty acids: their biochemical and functional
classification // Pediatr. Med. Chir. - 1992. - Vol. 14, № 5. - P.
473-479.
Comporti
M. Lipid peroxidation. Biopathological significance // Mol. Aspects Med. - 1993. - Vol. 14, № 3. - P. 199-207.
Girotti
A.W. Lipid hydroperoxide generation, turnover, and effector action in
biological systems // J. Lipid Res. - 1998. - Vol. 39. - P. 1529-1542.
Stibenz
D. Structure of the erythrocyte membrane // Acta Histochem. Suppl. - 1986. - Vol. 33. - P. 99-106.
Catania
A, Caimi G. The erythrocyte membrane: the interrelations between lipids,
proteins and the dynamic properties // Minerva Med. - 1992. - Vol. 83, № 4. - P. 187-192.
Discher
D.E. New insights into erythrocyte membrane organization and microelasticity //
Curr. Opin. Hematol. - 2000.
- Vol. 7, № 2. - P. 117-122.
Ribarov
S.R., Benov L.C. Relationship between the hemolytic action of heavy metals and
lipid peroxidation // Biochim. Biophys. Acta. - 1981. - Vol. 640, № 3. P. 721-726.
Stern
A. Red cell oxidative damage // In: Oxidative Stress (Sies, H., ed.). - London: Academic Press, 1986. - P. 331-349.
Wagner
G.M., Lubin B.H., Chiu D.T.-Y. Oxidative damage to red blood cells In:
Cellular Antioxidant Defense Mechanisms (Chow, C. K., ed.). - Boca Raton: CRC Press Inc, 1988. - Vol. 1. - P. 185-195.
Droge
W. Free Radicals in the Physiological Control of Cell Function // Physiol. Rev.
- 2002. - Vol. 82, № 1. - P. 47-95.
Davies
K.A.J. Oxidative stress: the paradox of aerobic life // Biochem. Soc. Symp.
“Free Radicals and Oxidative Stress: Environment, Drugs and Food Additives” . - 1995. - Vol. 61. - P. 1-31.
179 Морозкина
Т.С., Мойсеенок А.Г. Витамины. - Минск: Асар, 2002. - 112 с.
180
Levine M., Rumsey S.C., Daruwala R. et. al. Criteria and recommendations for
vitamin C intake // JAMA. - 1999. - Vol. 281. - P. 1415-1423.
181
Pietri S., Seguin J.R., Darbigny P. et al. Ascorbyl free-radical - a noninvasive marker of oxidative
stress in human open heart surgery // Free Radic. Biol. Med. - 1994. - Vol. 16. - P. 523-528.
Fain
O. Vitamin C deficiency // Rev. Med. Interne. - 2004. - Vol. 25. - P. 872-880.
Bendich
A., Langseth L. The health effects of vitamin C supplementation (a review) //
J. Am. Coll. Nutr. - 1995.
- Vol. 14. - P. 124-136.
Nakamura
M., Michitaka Ozaki, Shohei Fuchinoue, Satoshi Teraoka, Kazuo Ota. Ascorbic
acid prevents ischemia-reperfusion injury in the rat small intestine //
Transplant International. - 1997. - Vol. 10, № 2. - P. 89-95.
Cadenas
S., Rojas C., Perez-Campo R., Lopez-Torres M., Barja G. Effect of dietary
vitamin C and catalase inhibition of antioxidants and molecular markers of
oxidative damage in guinea pigs // Free Radic. Res. - 1994. - Vol. 21, № 2. - P. 109-118.
Robert
J., Hillstrom, Angela K. Yacapin-Ammons, Sean M. Lynch biochemical and
molecular actions of nutrients. Vitamin C inhibits lipid oxidation in human HDL
// J. Nutr. - 2003. - Vol. 133. - P. 3047-3051.
Gey
K.F. Ten year retrospective on the antioxidant hypothesis of arteriosclerosis,
threshold plasma levels of antioxidant nutrients related to minimum
cardiovascular risk // J. Nutr. Biochem. - 1995. - Vol. 6. - P. 206-236.
Levine
M. New concepts in the biology and biochemistry of ascorbic acid // N. Engl. J.
Med. -1986. - Vol. 314. - P. 892-902.
Jialal
I., Vega G.L., Grundy S.M. Physiologic levels of ascorbate inhibit the
oxidative modification of low density lipoprotein // Atherosclerosis. - 1990. - Vol. 82. - P. 185-191.
190 Nordberg J., Arner
E.S.J. Reactive oxygen species, antioxidants and the mammalian thioredoxin
system // Free Rad. Biol. Med. - 2001. - Vol. 31. - P. 1287-1312.
191
Suh J., Zhu B.Z., Frei B. Ascorbate does not act as a pro-oxidant towards
lipids and proteins in human plasma exposed to redox-active transition metal
ions and hydrogen peroxide // Free Radic. Biol. Med. - 2003. - Vol. 34, № 10. - P. 1306-1314.
192 Hillstrom
R.J., Yacapin-Ammons A.K., Lynch S.M. Vitamin C inhibits lipid oxidation in
human HDL <http://jn.nutrition.org/cgi/content/full/133/10/3047> // J.
Nutr. - 2003. - Vol. 133. - P.
3047-3051.
Carr A. C.,
Tijerina T., Frei B. Vitamin C protects against and reverses specific
hypochlorous acid- and chloramine-dependent modifications of low-density
lipoprotein // Biochem. J. - 2000. -
Vol. 346. - P. 491-499.
195
Krajcovicová-Kudlácková M., Blažícek P.,
Spustová V., Valachovicová M., Ginter E. Cardiovascular risk
factors in young Gypsy population // Bratisl. Med. J. 2004. - Vol. 105. - P. 256-259.
196
Carr A.C., Frei B. Toward a new recommended dietary allowance for vitamin C
based on antioxidant and health effects in humans // Am. J. Clin. Nutr. - 1999. - Vol. 69. - P. 1086-1107.
Wilson
G.J., Lin C.Y., Webster R.D. Significant differences in the electrochemical
behavior of the alpha-, beta-, gamma-, and delta-tocopherols (vitamin E) // J.
Phys. Chem. B. Condens. Matter. Mater. Surf. Interfaces Biophys. 2006. - Vol. 110, № 23. - P. 11540-11548.
Liu
Z.Q. The «unexpected role» of vitamin E in free radical-induced hemolysis of
human erythrocytes: alpha-tocopherol-mediated peroxidation // Cell Biochem.
Biophys. - 2006. - Vol. 44, № 2. - P. 233-239.
Traber
M.G. Utilization of vitamin E // Biofactors. - 1999. - Vol. 10, № 2-3. - P. 115-120.
200
Niki E., Kawakami A., Saito M. et al. Effect of phytyl side chain of vitamin E on its
antioxidant activity // J. Biol. Chem. - 1985. - Vol. 260, № 4. - P. 2191-2196.
Urano
S., Matsuo M., Sakanaka T. et al. Mobility and molecular orientation of vitamin E in
liposomal membranes as determined by 19F NMR and fluorescence polarization
techniques // Arch. Biochem. Biophys. - 1993. - Vol. 303, № 1. - P.
10-14.
Bjorneboe
A., Bjorneboe G.E., Drevon C.A. Absorption, transport and distribution of
vitamin E // J. Nutr. -
1990. - Vol. 120, № 3. - P. 233-242.
Wassal
S.R., Thewalt J.L., Wоng L. et al. Deuterium NMR study of the interaction of α-tocopherol
with a phospholipid model membrane // Biochemistry. 1986. - Vol. 25, № 25. - P. 319-326.
Burton
G. W., Traber M.G. Vitamin E: antioxidant activity, biokinetics, and
bioavailability // Annu. Rev. Nutr. - 1990. - № 10. - P. 357-382.
Vanucchi
H., Jordao Junior A.A., Iglesias A.C. et al. Effect of different dietary levels
of vitamin E on lipid peroxidation in rats // Arch. latinoam. Nutr. - 1997. - Vol. 47, № 1. - P. 34-37.
Джапаридзе Д.М., Белкина Л.М., Досмагамбетова Р.С. и др. Влияние различной обеспеченности витамином Е на
сократительную функцию сердечной мышцы // Вопр. питания. - 1986. - №
3. - С. 41-45.
207 Kohlschetter A. Abetalipoproteinemia. In: Klockgether T, ed. Handbook of ataxia
disorders. - New York: Marcel Dekker,
2000. - P. 205-221.
208
Food and Nutrition Board, Institute of Medicine. Dietary reference intakes for
vitamin C, Vitamin E, selenium and carotinoids. - Washington, DC: National Academy
Press, 2000.
209
Kayden H.J., Traber M.G. Absorption, lipoprotein transport, and regulation of
plasma concentrations of vitamin E in humans // J. Lipid Res. - 1993. - Vol. 34. - P. 343-358.
210
Hosomi A., Arita M., Sato Y. et al. Affinity of -tocopherol transfer protein as a
determinant of the biological activities of vitamin E analogs // FEBS Lett. - 1997. Vol. 409. - P. 105-108.
211 Gotoda T., Arita M., Arai H.,
et al. Adult-onset
spinocerebellar dysfunction caused by a mutation in the gene for the
-tocopherol-transfer protein // N. Engl. J. Med. - 1995. - Vol. 333. - P. 1313-1318.
Hentati
A., Deng H.X., Hung W.Y. et al. Human alpha-tocopherol transfer protein: gene
structure and mutations in familial vitamin E deficiency // Ann. Neurol. - 1996. - Vol. 39. - P. 295-300.
Hosomi
A., Goto K., Kondo H. et al. Localization of alpha-tocopherol transfer protein
in rat brain // Neurosci. Lett. - 1998. - Vol. 256. - P. 159-162.
Fechner
H., Schlame M., Guthmann F., Stevens P. Tocopherol induce expression of hepatic
-tocopherol-transfer-protein mRNA // Biochem. J. - 1998. - Vol. 331. - P. 577-581.
Kim
H.-S., Arai H., Arita M. et al. Effect of α-tocopherol status on
tocopherol transfer protein expression and its messenger RNA level in rat liver
// Free. Radic. Res. - 1998.
- Vol. 28. P. 87-92.
Dutta-Roy
A.K. Molecular mechanism of cellular uptake and intracellular translocation of
alpha-tocopherol: role of tocopherol-binding proteins // Food Chem. Toxicol. - 1999. - Vol. 37. - P. 967-971.
Dutta-Roy
A.K., Leishman D.J., Gordon M.J., Campbell F.M., Duthie G.G. Identification of
a low molecular mass (14.2 kDa) alpha-tocopherol-binding protein in the cytosol
of rat liver and heart // Biochem. Biophys. Res. Commun. - 1993. - Vol. 196. P. 1108-1112.
Traber
M.G., Rader D., Acuff R.V., Ramakrishnan R., Brewer H.B., Kayden H.J. Vitamin E
dose-response studies in humans with use of deuterated RRR-alpha-tocopherol //
Am. J. Clin. Nutr. - 1998. - Vol. 68. - P. 847-853.
Dimitrov
N.V., Meyer C., Gilliland D., Ruppenthal M., Chenoweth W., Malone W. Plasma
tocopherol concentrations in response to supplemental vitamin E // Am. J. Clin.
Nutr. - 1991. - Vol. 53. - P. 723-729.
Reaven
P.D., Witztum J.L. Comparison of supplementation of RRR-alpha-tocopherol and
racemic alpha-tocopherol in humans. Effects on lipid levels and lipoprotein
susceptibility to oxidation // Arterioscler. Thromb. Vasc. Biol. - 1993. Vol. 13. - P. 601-608.
Jialal
I., Fuller C.J., Huet B.A. The effect of alpha-tocopherol supplementation on
LDL oxidation. A dose-response study // Arterioscler. Thromb. Vasc. Biol. - 1995. - Vol. 15. - P. 190-198.
Schultz
M., Leist M., Petrzika M., Gassmann B., Brigelius-Floh R. Novel urinary metabolite
of α-tocopherol, 2,5,7,8-tetramethyl-2(2'-carboxyethyl)-6-hydroxychroman,
as an indicator of an adequate vitamin E supply? // Am. J. Clin. Nutr. - 1995. - Vol. 62. P. 1527-1534.
Stahl
W., Sies H. Antioxidant defence: vitamins E and C and carotenoids // Diabetes. - 1997. - Vol. 2. - P. 14-18.
Koyu
A., Ozguner F., Caliskan S., Karaca H. Preventive effect of vitamin E on iron-induced
oxidative damage in rabbit // Toxicol. Ind. Health. - 2005. - Vol. 21, № 9. - P. 239-242.
Ognjanovic
B.I., Pavlovic S.Z., Maletic S.D. et al. Protective influence of vitamin E on
antioxidant defense system in the blood of rats treated with cadmium Physiol.
Res. - 2003. - Vol. 52, № 5. - P. 563-570.
Chow
С.K. Vitamin E and oxidative stress // Free radic. Biol. Med. - 1991. - Vol. 11, № 2. - P. 215-232.
Packer
L. Interactions among antioxidants in health and disease: vitamin E and its
redox cycle // Proc. Soc. Exp. Biol. Med. - 1992. - Vol. 200, № 2. - P. 271-276.
228 Liebler D.C., Kling D.S., Reed D.J.
Antioxidant protection of phospholipid bilayers by α-tocopherol. Control
of α-tocopherol status and lipid peroxidation by ascorbic acid and
glutathione // J. Biol. Chem. - 1986. - Vol. 261, № 26. - P. 12114-12119.
Sies
H., Stahi W., Sundquist A.R. Antioxidant functions of vitamins. Vitamins E and
C, beta-carotene, and other carotenoids // Ann. N.Y. Acad. Sci. - 1992. - Vol. 669. - P. 7-20.
Packer
L. Protective role of vitamin E in biological systems // Am. J. Clin. Nutr. - 1990. - Vol. 53. Suppl. 4. - P. 1050S-1055S.
231
Wu K., Willett W.C., Chan J.M., Fuchs C.S., Colditz G.A., Rimm E.B.,
Giovannucci E.L. A prospective study on supplemental vitamin E intake and risk
of colon cancer in women and men // Cancer Epidemiol. Biomarkers Prev. - 2002. -№ 11. - P. 1298-1304.
Jacobs
E.J., Henion A.K., Briggs P.J., Connell C.J., McCullough M.L., Jonas C.R.,
Rodriguez C., Calle E.E., Thun M.J. Vitamin C and vitamin E supplement use and
bladder cancer mortality in a large cohort of US men and women // American
Journal of Epidemiology. - 2002. - Vol. 156. - P. 1002-1010.
233
Kontush A.,
Finckh B., Karten B., Kohlschetter A., Beisiegel U. Antioxidant and prooxidant
activity of α-tocopherol in human plasma and low density lipoprotein // J. Lipid
Res. - 1996. - Vol. 37. - P. 1436-1448.
Albanes
D., Heinonen O.P., Huttunen J.K. et al. Effects of alpha-tocopherol and
beta-carotene supplements on cancer incidence in the Alpha-Tocopherol
Beta-Carotene Cancer Prevention Study // Am. J. Clin. Nutr. - 1995. - Vol. 62. - P. 1427S-1430S.
Heinonen
O.P., Albanes D., Virtamo J. et al. Prostate cancer and supplementation with
alpha-tocopherol and beta-carotene: incidence and mortality in a controlled
trial // J. Natl. Cancer. Inst. - 1998. - Vol. 90. - P. 440-446.
236
Weitberg A.B., Corvese D. Effect of vitamin E and beta-carotene on DNA strand
breakage induced by tobacco-specific nitrosamines and stimulated human
phagocytes // J. Exp. Clin. Cancer Res. - 1997. - Vol. 16. - P. 11-14.
237
Meydani S.N. Vitamin E enhancement of T cell-mediated function in healthy
elderly: mechanisms of action // Nutr. Rev. - 1995. - Vol. 53. - P. 52-58.
Kline
K., Yu W., Sanders B.G. Vitamin E and Breast Cancer // Sciences J. Nutr. - 2004. - Vol. 134, № 12. - P. 3458S-3462S.
Diplock
A.T. Will the good fairies please prove to us that vitamin E lessens human
degerative disease // Free Radic. Res. - 1997. - Vol. 27, № 5. - P.
511-532.
Kline
K., Yu W., Sanders B.G. Vitamin E: Mechanisms of
Action as Tumor Cell Growth Inhibitors // Journal of Nutrition. - 2001. - Vol. 131, № 1. - P. 161S-163S.
Neuzil
J., Weber C., Kontush A. The role of vitamin E in atherogenesis: linking the
chemical, biological and clinical aspects of the disease // Atherosclerosis. - 2001. - Vol. 157. - P. 257-283.
242
Meydani M., Lipman R.D., Han S.N. et al. The effect of long-term dietary
supplementation with antioxidants // Ann. N.Y. Acad. Sci. - 1998. - Vol. 854. - P. 352-360.
243
Wu D., Mura C., Beharka A.A. et al. Age-associated increase in PGE2 synthesis and COX
activity in murine macrophages is reversed by vitamin E // Am. J. Physiol. - 1998. - Vol. 275. - P. 661-668.
244
Azzi A., Boscoboinik D., Fazzio A. et al. RRR-alpha-tocopherol regulation of
gene transcription in response to the cell oxidant status // Z. Ernahrungswiss.
- 1998. - Vol. 37. - P. 21-28.
245 Aratri E., Spycher S.E., Breyer I.,
Azzi A. Modulation of tropomyosin expression by α-tocopherol in rat
vascular smooth muscle cells // FEBS Lett. - 1999. - Vol. 447. - P. 91-94.
Yamauchi
J., Iwamoto T., Kida S., Masushige S., Yamada K., Esashi T.
Tocopherol-associated protein is a ligand-dependent transcriptional activator
// Biochem. Biophys. Res. Commun. - 2001. - Vol. 285. - P. 295-299.
Diplock
A.T., Lucy J.A. The biochemical modes of action of vitamin E and selenium: a
hypothesis // FEBS Letts. - 1973. - Vol. 29. - P. 205-210.
Diplock
A.T., Lucy J.A., Verrinder M., Zieleniewski A. Alpha-tocopherol and the
permeability to glucose and chromate of unsaturated liposomes // FEBS Lett. - 1977. - Vol. 82, № 2. - P. 341-344.
Tappel
A.L. Vitamin E and radical peroxidation of lipids // Annal. N.Y. Аcad. Sci. - 1972. - Vol. 203, № 12. - P. 12.
Urano
S., Inomori Y., Sugawara T. et al. Vitamin E inhibition of retinol-induced hemolysis and
membrane-stabilizing behavior // J. Biol. Chem. - 1992. - Vol. 267. - P. 18365-18370.
Erin
A.N., Skrypin V.V., Kagan V.E. Formation of alpha-tocopherol complexes with
fatty acids. Nature of complexes // Biochim. Biophys. Acta. - 1985. - Vol. 815, № 2. - P. 209-214.
Urano
S., Iida M., Otani I., Matsuo M. Membrane stabilization of vitamin E; interaction
of alpha-tocopherol with phospholipids in bilayer liposomes // Biochem.
Biophys. Res. Commun. - 1987.
- Vol. 146, № 3. - P. 1413-1418.
Авцын А.П., Жаворонков А.А., Рош М.А., Строчкова Л.С. Микроэлементозы человека. - М: Медицина, 1991. - 496 c.
254 Голубкина
Н.А. Содержание Se в пшеничной и ржаной муке России, стран СНГ и Балтии //
Вопр. питания. - 1997. - №3. - C. 17-20.
255
Aaseth J. Optimum selenium levels in animal products for human consumption //
Norweg. J. Agr. Sci. - 1993.
- Suppl. 11. - P. 121-126.
Ciapellano
S., Testolin G., Allegrini M., Porrini M. Availability of selenium in dough and
bisquits in comparison to wheat meal // Ann. Nutr. Metab. - 1990. - Vol. 34. - P. 343-349.
Meltzer
H.M., Norheim G., Loken E.B., Holm H. Supplementation with wheat selenium
induces a dose-dependent responce in serum and urine of a Se-replete population
// Brit. J. Nutr. - 1992.
- Vol. 67. - P. 287-294.
258
Van der Torre H., Dokkum W., Schaafsma G., et al. Effects of various levels of Se in
wheat and meat on blood Se status indices and on Se balance in Dutch men //
Brit. J. Nutr. - 1991. - Vol. 65. - P. 69-80.
Burk
R.F. Recent developments in trace element metabolism and function: novell roles
of selenium in nutrition // J. Nutr. - 1989. - Vol. 119, № 7. - P.
1051-1054.
260
Longnecker M.P., Taylor P.R., Levander O.A. et al. Selenium in diet, blood and toenails
in relation to human health seleniferous area // Amer. J. Clin. Nutr. - 1991. Vol.
53. - P. 1288-1294.
Некрасов Б.В.
Основы общей химии. - М.: Химия, 1973.
- Т. 1. - С. 351.
262
Bedwal R.S., Nair N., Sharma M.P., Mathur R.S. Selenium - its biological
perspectives // Med. Hypotheses. - 1993. - Vol. 41. - P. 150-159.
263
Waschulewski I.H., Sunde R.A. Effect of dietary methionine on tissue selenium
and glutathione peroxidase activity in rats given selenomethionine // Brit. J.
Nutr. - 1988. - Vol. 60, № 1. - P. 57-68.
Waschulewski
I.H., Sunde R.A. Effect of dietary methionine on utilization of tissue selenium
from dietary selenomethionine for glutathione peroxidase activity in the rat //
J. Nutr. - 1988. - Vol. 118, № 3. - P. 367-374.
Whanger
P.D., Butler J.A. Effects of various dietary levels of selenium as selenite or
selenomethionine on tissue selenium levels and glutathione peroxidase activity
in rats // J. Nutr. - 1988.
- Vol. 118, № 7. P.
846-852.
Janghorbani
M., Lynch N.E., Mooers C.S., Ting B.T. Comparison of the magnitude of the
selenite exchangeable pool and whole body selenium in adult rats J. Nutr. - 1990. - Vol. 120, № 2. P. 190-199.
Janghorbani
M., Martin R.F., Kasper L.J. et al. The selenite-exchangeable metabolic pool in
humans: a new concept for the assessment of selenium status // Amer. J. Clin.
Nutr. - 1990. - Vol. 51. - P. 670-677.
Janghorbani
M., Mooers C.S., Smith M.A. et al. Correlation between the size of the
selenite-exchangeable metabolic pool and total body or liver selenium in rats
J. Nutr. - 1991. - Vol. 121. - P. 345-354.
Beilstein
M.A., Whanger P.D. Deposition of dietary organic and inorganic selenium in rat
erythrocyte proteins // J. Nutr. - 1986. - Vol. 116, № 9. - P. 1701-1710.
Brigelius-Flohe
R., Fridrichs B., Maurer S., Streicher R. Determinants of PHGPx expression in a
cultured endothelial cell line // Biomed. Environ. Sci. - 1997. - Vol. 10, № 2-3. - P. 163-167.
Amberg
R., Mizutani T., Wu X.Q., Gross-H.J. Selenocysteine synthesis in mammalia: an
identity switch from tRNA(Ser) to tRNA(Sec) // J. Mol. Biol. - 1996. - Vol. 263, № 1. - P. 8-19.
Sayato
Y., Nakamuro K., Hasegawa T. Selenium methylation and toxicity mechanism of
selenocystine // Yakugaku Zasshi. - 1997. - Vol. 117, № 10-11. - P. 665-672.
273
Гореликова Г.А., Маюрникова Л.А., Позняковский В.М. Нутрицевтик селен:
недостаточность в питании, меры профилактики // Вопр. питания. - 1997. - № 5. - С. 18-21.
274
Demerdash F.M. Antioxidant effect of vitamin E and selenium on lipid
peroxidation, enzyme activities and biochemical parameters in rats exposed to
aluminium // J. Trace Elem. Med. Biol. - 2004. - Vol. 18, № 1. - P.
113-121.
Naziroglu.
Protective role of intraperitoneally administered vitamin E and selenium on the
antioxidative defense mechanisms in rats with diabetes induced by
streptozotocin // Biol. Trace Elem. Res. - 2001. - Vol. 79, № 2. - P.
149-159.
276 Agay D
<http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Agay+D%22%5BAuthor%5D>.,
Sandre C
<http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Sandre+C%22%5BAuthor%5D>.,
Ducros V
<http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Ducros+V%22%5BAuthor%5D>.,
Faure H <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Faure+H%22%5BAuthor%5D>.,
Cruz C
<http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Cruz+C%22%5BAuthor%5D>.,
Alonso A <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Alonso+A%22%5BAuthor%5D>.,
Roussel A.M
<http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Roussel+AM%22%5BAuthor%5D>.,
Chancerelle Y <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=pubmed&cmd=Search&itool=pubmed_AbstractPlus&term=%22Chancerelle+Y%22%5BAuthor%5D>.
Optimization of selenium status by a single intraperitoneal injection of Se in
Se-deficient rat: possible application to burned patient treatment // Free
Radical Biology and Medicine. - 2005. -
Vol. 39, № 6. - P. 762-768.
Rukgauer M.,
Neugebauer R.J., Plecko T. The relation between selenium, zinc and copper
concentration and the trace element dependent antioxidative status // J. Trace
Elem. Med. Biol. - 2001. -
Vol. 15, № 2-3. - P. 73-78.
278
Avanzo J.L., de Mendonca C.X., Jr Pugine S.M., de Cerqueira Cesar M. Effect of
vitamin E and selenium on resistance to oxidative stress in chicken superficial
pectoralis muscle // Comp. Biochem. Physiol. Toxicol. Pharmacol. - 2001. - Vol. 129, № 2. - P. 163-173.
Sandre
C., Agay D., Ducros V., Faure H., Cruz C., Alonso A., Chancerelle Y., Roussel
A.M. Kinetic changes of oxidative stress and selenium status in plasma and
tissues following burn injury in selenium-deficient and selenium-supplemented
rats // J. Trauma. - 2006.
- Vol. 60, № 3. - P. 627-634.
280 Колмаков
В.Н., Радченко В.Г. Значение определения проницаемости эритроцитарных мембран
(ПЭМ) в диагностике хронических заболеваний печени // Терапевтический архив. - 1982. - T.54, № 2, С. 59-62.
Покровский
А.А., Абрарова А.А. К вопросу o
перекисной резистентности эритроцитов // Вопр. Питания. - 1964. - №
16. - С. 44-49.
Мирошина
Т.Н., Мурзахметова М.К., Утегалиева Р.С. и др. Корригирующее влияние
индоламинов на состояние мембран эритроцитов при действии ионов кадмия //
Вестник КазНУ им. Аль-Фараби. Серия биол. - 2002. - № 3.
- С. 80-86.
Королюк М.А.,
Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы
// Лабораторное дело. - 1988. - № 1. - С. 16-18.
Нагорный П.А.
Комбинированное действие химических веществ и методы его гигиенического
изучения. - М.: Медицина, 1984. - 184 с.
Фурдуй Ф.И.,
Хайдарлиу С.Х., Мамалыга Л.М. Комбинированное воздействие на организм
экстремальных факторов. -
Кишинев: Штиина, 1985. - 140 с.
Владимиров
Ю. А. Роль нарушеннй свойств липидного слоя мембран в развитии патологических
процессов //
Патологическая физиология и экспериментальная терапия. - 1989. - №4. - С. 7-19.
287
Fernandes A., Mira M.L., Azevedo M.S., Manso C. Mechanisms of hemolysis induced
by copper // Free Radic. Res. Commun. - 1988. - Vol. 4, № 5. - P.
291-298.
Quinlan
G.J., Halliwell B., Moorhouse C.P., Gutteridge J.M. Action of lead (II) and
aluminium (III) ions on iron-stimulated lipid peroxidation in liposomes,
erythrocytes and rat liver microsomal fractions // Biochim. Biophys. Acta. - 1988. Vol. 962, № 2. - P. 196-200.
Skoczynska
A., Smolik R. The effect of combined exposure to lead and cadmium on serum
lipids and lipid peroxides level in rats // Int. J. Occup. Med. Environ.
Health. - 1994. - Vol. 7, № 3. - P. 263-271.
Honcharuk
Ie.H., Bardov V.H., Kartysh A.P., Korshun M.M., Verpivs'kyi O.M. An
experimental study of the mechanism of the combined action on the body of
ionizing radiation, pesticides, nitrates and lead and cadmium salts // Lic.
Sprava. 1995. - № 5-6. - P. 7-12.
Barja
G., Lopez-Torres M., Perez-Campo R., Rojas C., Cadenas S., Prat J., Pamplona R.
Dietary vitamin C decreases endogenous protein oxidative damage,
malondialdehyde, and lipid peroxidation and maintains fatty acid unsaturation
in the guinea pig liver // Free Radic. Biol. Med. - 1994. - Vol. 17, № 2. - P. 105-115.
Magalova
T., Beno I., Brtkova A., Mekinova D. et al. Levels of Cu, Zn, Se and their
relation to levels of ceruloplasmin and the activity of antioxidative enzymes
// Bratisl. Lek. Listy. - 1997. - Vol. 98, № 1. - P. 8-11.
Якобсон Г.С.,
Антонов А.Р., Головатюк А.В., Маркель А.Л., Якобсон М.Г. Содержание селена и
антиоксидантная активность крови у крыс с наследственной артериальной
гипертензией в динамике экспериментального инфаркта миокарда // Бюл. эксп.
биол. и мед. - 2001. - Т. 132, № 7. - С.
38-41.
294
Diplock A.T. Indexes of selenium status in human populations // Am. J. Clin.
Nutr. - 1993. - Vol. 57, № 2. - P. 256-258.
Yang
F.Y., Wo W.H. Role of Se in stabilization of human erythrocyte membrane
skeleton // Biochem. Int. - 1987. - Vol. 15, № 2. - P. 475-482.
Turan
B., Dalay N., Afrasyap L., Delilbasi E., Sengun Z., Sayal A., Isimer A. The
effects of selenium supplementation on antioxidative enzyme activities and
plasma and erythrocyte selenium levels // Acta Physiol. Hung. - 1993. - Vol. 81, № 1. - Р. 87-93.
Stahl
W., Junghans A., De-Boer B., Driomina E.S. et al. Carotenoid mixtures protect
multilamelar liposomes against oxidative damage: synergistic effects of
lycopene and lutein // FEBS Lett. - 1998. - Vol. 427, № 2. - Р. 305-308.
Lee
H.S., Csallany A.S. The influence of vitamin E and selenium on lipid
peroxidation and aldehyde dehydrogenase activity in rat liver and tissue //
Lipids. - 1994. - Vol. 29, № 5. - Р. 345-350.
Zaidi
S.M., Al-Qirim T.M., Banu N. Effects of antioxidant
vitamins on glutathione depletion and lipid peroxidation induced by restraint
stress in the rat liver // Drugs R. D. - 2005. - Vol. 6, № 3. - P. 157-165.
300
Brufau G., Quilez J., Angel Canela M., Salas-Salvado J., Bullo M.M., Rafecas M. Evaluation of lipid oxidation after
ingestion of bakery products enriched with phytosterols, beta-carotene and
alpha-tocopherol // Clin. Nutr. - 2004. - Vol. 23, № 6. - P. 1390.
Kanter
M., Coskun O., Armutcu F., Uz Y.H., Kizilay G. Protective effects of
vitamin C, alone or in combination with vitamin A, on endotoxin-induced
oxidative renal tissue damage in rats // Tohoku J. Exp. Med. - 2005. - Vol. 206, № 2. - P. 155-162.
302
Heaton P.R., Reed C.F., Mann S.J., Ransley R., Stevenson J., Charlton C.J., Smith B.H., Harper E.J., Rawlings J.M. Role of Dietary Antioxidants to Protect against
DNA Damage in Adult Dogs // J. Nutr. - 2002. - Vol. 132,№ 6. - P.
1724.
303 Тутельян
В.А. Биологически активные добавки к пище: прошлое, настоящее и будущее //
Тезисы второго международного симпозиума «Питание и здоровье. Биологически активные добавки к пище». - М., 1996. - С. 164-166.
Oncu
M., Gultekin F., Karaoz E., Altuntas I., Delibas N. Nephrotoxicity in rats
induced by chlorpryfos-ethyl and ameliorating effects of antioxidants // Hum.
Exp. Toxicol. - 2002. - Vol. 21, № 4. - P. 223-230.
Sutcu
R., Altuntas I., Yildirim B., Karahan N., Demirin H., Delibas N. The effects of
subchronic methidathion toxicity on rat liver: Role of antioxidant vitamins C
and E // Cell Biol. Toxicol. - 2006. - Vol. 22, № 3. - P. 221-227.
Хусаинова
Г.С. Использование СПЛАТа в комплексной терапии профаллергозов // Актуальные
вопросы проф. патологии в Казахстане: сб. статей. - Караганда, 2003. - С.
228-231.
Бужикеева
А.Б. Влияние металлов на состояние липопероксидации и активность
антиоксидантной системы в условиях разнохарактерного питания: автореф. … канд.
биол. наук. - Алматы, 1998. - 24 с.
308
Wedekind K.J., Zicker S., Lowry S., Paetau-Robinson I. Antioxidant status of
adult beagles is affected by dietary antioxidant intake // J. Nutr. - 2002. - Vol. 132, № 6. - P. 1658S-1660S.