Мікроклональне розмноження рослин
Контрольна
робота
Мікроклональне
розмноження рослин
Зміст
.
Культура тканин та клітин рослин як об’єкт біотехнології
.
Етапи клонального мікророзмноження
.
Методи оздоровлення посадкового матеріалу від вірусної інфекції
.1
Метод апікальних меристем
.2
Термотерапія
.3
Хіміотерапія
.
Технологія отримання оздоровленого посадкового матеріалу картоплі
Література
. Культура тканин та клітин рослин
як об’єкт біотехнології
Культурою клітин, тканин і органів рослин
називають вирощування окремих клітин, а також тканин і органів, на штучних
поживних середовищах в асептичних умовах (in vitro).
Вперше ізольовані клітини рослин (моркви) було
отримано в лабораторії Р.Готре (Франція) в середині минулого століття.
Для отримання культури клітин вищих рослин
достатньо в асептичних умовах взяти шматочок рослинної тканини (експлантат) і
розмістити його на спеціальне середовище. Через деякий час відбудеться
дедиференціація клітин - тобто, клітини втратять свою вихідну спеціалізацію.
Клітинна маса буде швидко збільшуватися утворюючи калюс. Калюс - це особливий
тип тканини, що є накопиченням недиференційованих клітин (рис. 1). Якщо
шматочки калюсу періодично пересаджувати на нове поживне середовище (пасувати),
вони можуть рости необмежений час.

Рис. 1. Калюсна тканина цукрового
буряку
Найважливіша властивість ізольованої
клітини рослини - здатність давати початок цілій рослині. Процес утворення
диференційованих структур рослини із недиференційованих клітин отримав назву
морфогенезу in vitro, а поява інтактної рослини з окремої клітини, протопласту,
групи клітин - регенерація (рис. 2). В основі цієї здатності лежить унікальна
властивість рослинних клітин - тотипотентність.

Рис. 2. Рослина-регенерант цукрового
буряку
Тотипотентність - це здатність
клітини реалізовувати генетичну інформацію, що забезпечує її диференціювання і
розвиток цілого організму. В природних умовах тотипотентність у рослин
реалізується при загоєнні ран. В цьому випадку на рановій поверхні відбувається
розвиток калюсу.
Культури ізольованих клітин та
тканин рослин використовуються у біотехнології в декількох напрямах (рис. 3).

Рис. 3. Основні напрями використання
культури клітин, тканин, органів рослин у біотехнології.
Використання калюсних клітин рослин
у біотехнології пов’язане з їх здатністю продукувати при культивуванні in vitro
біологічно активні речовини, які утворюються цілими рослинами. Це має важливе
значення для медицини, парфумерії, харчової промисловості. Клітини рослин in
vitro використовують для отримання алкалоїдів, стероїдів, глікозидів, гормонів,
ефірних олій. Перевагами використання рослин in vitro порівняно з вирощуванням
рослин традиційними методами для отримання біологічно активних речовин є:
· отримання
екологічно чистих продуктів не залежно від клімату та пори року;
· можливість
оптимізувати та стандартизувати умови вирощування;
· можливість
підвищення продуктивності клітинних ліній за використання методів індукованого
мутагенезу та генно-інженерних підходів;
· можливість
отримувати біологічно активні речовини з рідких видів рослин та тих, що
занесені до Червоної книги.
На сьогодні розроблено технології
промислового отримання з використанням культури клітин рослин протипухлинних
препаратів типу таксол, кампотецин; антивірусних препаратів; адаптогенних та
стимулюючих препаратів; терпеноїдних глікозидів.
Культури рослинних клітин in vitro
також можуть бути використані для трансформації попередників для отримання
біологічно активних речовин.
Ще одним напрямом використання
ізольованих клітин та тканин рослин є селекція рослин. Сомаклональна
варіабельність притаманна ізольованим клітинам рослин є надзвичайно багатим
джерелом для створення нових форм рослин. Для селекціонерів є цікавим також
метод сомаклональної гібридизації - метод отримання гібридних рослин в
результаті злиття протопластів, ізольованих із батьківських соматичних клітин.
Культури рослинних клітин та тканин
у біотехнології також використовують для створення нових форм рослин методами
генетичної інженерії.
Незамінною культура рослинних клітин
in vitro є для збереження видів рослин, що знаходяться на межі вимирання.
Клітини рослин при цьому можуть зберігатися як в живій колекції (яка потребує
постійних пересівів), так і в замороженому стані (кріоконсервація в рідкому
азоті).
Важливим напрямом використання
культури ізольованих тканин рослин є розмноження і, головне, оздоровлення
посадкового матеріалу. Цей метод отримав назву клонального мікророзмноження
рослин, або мікроклонального розмноження. Цей метод дозволяє отримувати з
однієї меристеми сотні тисяч рослин на рік. Цей метод став комерційним.
Термін
"клон" (від грецьк. - паросток, пагін) був запропонований Вебером у
1903 р. для вегетативно розмножуваних рослин. Мікророзмноження рослин за
допомогою експлантатів, які містять меристемні тканини або меристемні групи
клітин (зародок, ембріоїди, апекс, пазушні, сплячі бруньки та пагони) широко
застосовується для розмноження різних видів рослин. Вперше мікроклональне розмноження
було використано французьким дослідником Ж.Морелем у 1960 році для отримання
посадкового матеріалу орхідей. За рік досліднику вдалося отримати більше
чотирьох мільйонів нових рослин орхідей з одного експлантату. Наразі цей метод
посідає важливе місце у прискореному клонуванні плодових, ягідних, декоративних
видів рослин деяких овочів і деревних порід.
Розмноження є
мікроклональним, коли отримані паростки (клони) є ідентичні вихідній рослині і
між собою. Успішно цей процес відбувається, якщо в якості експлантатів
використовують апекси та пазушні бруньки органів стеблового походження, тому що
вони є генетично стабільні і їх меристемні тканини, організовані у вигляді
множинних дискретних зон, підтримуються протягом тривалого росту рослин у
активному стані.
Перевагами методу мікроклонального
розмноження рослин порівняно з традиційними методами розмноження є :
· високий коефіцієнт
розмноження рослин;
· можливість
проведення робіт впродовж всього року;
· економія площ
необхідних для вирощування посадкового матеріалу;
· отримання генетично
однорідного посадкового матеріалу;
· отримання рослин,
що важко розмножуються традиційними методами;
· розмноження культур
з тривалим життєвим циклом (деревні породи);
· звільнення рослин
від вірусної інфекції за рахунок використання методу меристемної культури.
Успішне
мікроклональне розмноження, його коефіцієнт залежать від генотипу донорської
рослини, її фізіологічного стану (стадії розвитку), від розміру експлантату і
його компетентності. Вихід повноцінних рослин, отримуваних із меристеми,
залежить від складу поживного середовища, умов культивування та укорінення. Для
отримання життєздатних клонів на всіх етапах процесу велике значення мають
співвідношення гормонів та умови освітлення. Ці чинники широко варіюють і визначаються
для кожного виду і сорту дослідним шляхом.
На сьогодні
технологія мікророзмноження відпрацьована для понад 500 видів рослин. Для
клонування багатьох рослин розроблено і оптимізовано умови для всіх етапів
процесу, що зумовлює його високу відтворюваність та результативність і дає
змогу створювати комерційні підприємства для масового отримання посадкового
матеріалу.
Мікроклональне
розмноження використовується для створення колекцій сортів та видів, необхідних
для селекційно-генетичних робіт та для збереження зникаючих, рідкісних рослин.
Особливо часто цим методом розмножують нові сорти багатьох декоративних
культур, оскільки це зумовлює значну економію витрат на початкових етапах їх
впровадження у виробництво.
Останнім часом
комерційні фірми різних країн, виробники гібридного насіння почали
використовувати цей метод для розмноження першого покоління гібридів цвітної
капусти, інших овочевих культур.
За необхідності
підтримання цінних ліній з чоловічою стерильністю, наприклад, цибулі, в
порівнянні з трудомістким способом зворотних схрещувань (беккросування), їх
вигідно виробляти шляхом мікророзмноження.
Таблиця 1. Склад середовища
Мурасіге - Скуга
|
Компоненти
|
Концентрація солей в 1 л маточного розчину, мг
|
Об’єм маточного розчину для приготування 1л
середовища
|
|
Маточний розчин макроелементів
|
|
NH4NO3
|
33000
|
50 мл
|
|
KNO3
|
38000
|
|
|
CaCl2 * 2H2O
|
8800
|
|
|
MgSO4 * 7H2O
|
7400
|
|
|
KH2PO4
|
3400
|
|
|
Маточний розчин мікроелементів
|
|
KJ
|
166
|
5 мл
|
1240
|
|
|
MnSO4 * H2O
|
4460
|
|
|
ZnSO4 * 7H2O
|
1720
|
|
|
Na2MoO4 * 2H2O
|
50
|
|
|
CuSO4 * 5H2О
|
5
|
|
|
CoCl2 * 6H2O
|
5
|
|
|
Маточний розчин хелатного заліза
|
|
FeSO4 * 7H2O
|
5560
|
5 мл
|
|
Na2ЭДТА * 2H2O
|
7460
|
|
|
Вітаміни і органічні речовини
|
|
Мезоінозит
|
20000
|
5 мл
|
|
Нікотинова кислота
|
100
|
|
|
Пірідоксин-HCl
|
100
|
|
|
Тіамін-HCl
|
100
|
|
|
Гліцин
|
400
|
|
|
Додають в середовище безпосередньо при
приготуванні: Сахароза - 30 г/л Агар-агар - 7 г/л рН готового середовища -
5,6-5,8
|
Особливий інтерес
представляє мікроклональне розмноження для деревних культур внаслідок значної
тривалості їх розвитку до початку фази плодоношення і отримання насіння, яке до
того ж має тривалий період спокою, що перешкоджає швидкому отриманню насіннєвої
репродукції, необхідної для лісництва. Велике значення мають роботи з
мікроклонального розмноження для інтродукції деревних та декоративних видів
рослин в нові умови росту.
Мікроклональне розмноження рослин є
аналогом вегетативного розмноження рослин, що відбувається в пробірках за
асептичних умов із використанням дуже малої кількості рослинного матеріалу. Це
дозволяє значно прискорити процес отримання і оздоровити посадковий матеріал
рослин.
інфекція рослина
вірусний мікророзмноження
. Етапи клонального мікророзмноження
Метод
мікроклонального розмноження ґрунтується на індукованому фітогормонами
розростанні верхівкових та пазушних меристем, кожна з яких започатковує
осередок пагонів. Після формування такого осередку його поділяють на дрібніші
групи пагонів, переносять на свіже середовище, і процес повторюється. Швидкість
мікроклонального розмноження варіює і залежить від виду і, навіть, сорту чи
лінії рослини, часто можливо отримувати із окремої бруньки до кількох мільйонів
рослин за рік.
Залежно від
характеру морфогенетичних процесів (способів одержання рослин-регенерантів) в
культурі тканин розрізняють різні типи (методи) мікроклонального розмноження, в
основі яких лежать відмінності одержання рослин (з уже існуючих у рослині in
vivo чи новоутворених in vitro ініціалей) (рис. 4). Відповідно, дещо різними
будуть і отримані рослини-регенеранти.
Перший тип рослин
утворюється внаслідок активації існуючих в інтактній рослині меристем (апекс
стебла, пазушні і сплячі бруньки стебла), тобто шляхом прямого морфогенезу. Ці
рослини, регенеровані з меристем, генетично ідентичні батьківським формам, тому
що апекси в умовах культури здебільшого генетично стабільні (рис. 4 г).
Другий тип рослин
утворюється в результаті індукції виникнення бруньок або ембріоїдів (рис. 4 д).
Ці рослини, отримані зі спеціалізованих і калюсних клітин, яким властива
генетична мінливість, нерідко відрізняються від батьківських. Отже, цей метод
застосовується лише до тих рослин, у яких калюс відрізняється генетичною
стабільністю і коли варіабельність між рослинами-регенерантами не перевищує
рівня природної мінливості.
Бруньки або
ембріоїди можуть виникати:
• безпосередньо із
спеціалізованих тканин експлантату (тканин і клітин репродуктивних органів,
епідермісу, субепідермальних тканин, мезофілу листка тощо);
• з первинного
калюсу, утвореного клітинами експлантату;
• із субкультивованої калюсної
тканини або клітин суспензійної культури.

Рис. 4. Схема
мікроклонального розмноження рослин: а - вихідна рослина; б - різні типи
експлантатів, які використовуються для мікророзмноження; в - ті самі
експлантати в культурі in vitro; г - пряма регенерація рослин з існуючих в
ізольованих експлантатах меристем або з меристем які утворюються з
диференційованих клітин (наприклад, епідермісу) без виникнення калюсу; д -
регенерація рослин з калюсу шляхом органогенезу (за: Кунах, 2005).
Вважається, що
утворення рослин-регенерантів безпосередньо з експлантату (шляхом активації
існуючих меристем, утворення бруньок чи ембріоїдів) характеризує прямий
морфогенез.
Утворення
рослин-регенерантів із первинного чи субкультивованого калюсу характерне для
непрямого морфогенезу.
Активація росту
пазушних бруньок і використання пазушних пагонів - найпоширеніший тип
мікроклонального розмноження рослини. На рослині в умовах in vitro ріст
пазушних бруньок пригнічується апікальним домінуванням. Ріст пазушних меристем
стимулюється видаленням верхівки стебла або обробкою цитокінінами.
Введення в поживне
середовище цитокінінів пробуджує бічні бруньки і спричинює розвиток численних
нових бруньок, так званих розеток бруньок. Утворюється пучок пагонів, що швидко
росте, його розділяють на дрібніші пучки із загальною кореневою системою або на
окремі пагони, які спроможні утворювати під час вирощування на свіжому
поживному середовищі такі самі пучки (розетки).

Рис. 5. Етапи клонального
мікророзмноження рослин.
. Методи оздоровлення посадкового
матеріалу від вірусної інфекції
Невеликий розмір
експлантату для мікроклонального розмноження, його поверхнева стерилізація,
асептичне перенесення на поживне середовище і культивування в умовах, що
виключають інфікування, оздоровлюють отримані рослини від нематод, грибних і
більшості бактеріальних патогенів. Однак цього недостатньо для оздоровлення
створеного звичайним мікроклональним розмноженням посадкового матеріалу від
вірусів, віроїдів, мікоплазм. Відомо, що багато видів рослин (наприклад, соя,
цукрові буряки) передають віруси нащадкам під час насінного розмноження, тобто
багато сортів поступово накопичують вірусні інфекції.
Створення безвірусного посадкового
матеріалу багатьох рослин залишається актуальним завданням біотехнології. На
сьогодні найефективніший для досягнення цієї мети засіб - культивування
меристем стебла або деяких органів стеблового походження, які, як правило,
вільні від фітопатогенів.
Вперше вільний від вірусних інфекцій
посадковий матеріал жоржини методом меристемних культур одержали французькі
дослідники Морель і Мартен у 1952 р. Метод меристемних культур ґрунтується на
тому, що, як було встановлено ще в 1949 р., в інфікованих рослин меристеми
розміром близько 0,1 мм є вільними від вірусів. Це відкриття дозволило за
допомогою культури меристем рятувати зникаючі сорти внаслідок зараження
вірусами. Зокрема, у Франції після робіт Мореля і Мартена з жоржинами цінний
сорт картоплі Бель-де-Фонтене, який практично зник внаслідок зараження
вірусами, був відроджений із здорової меристеми, виділеної із зараженої
рослини. Крім методу культури меристем одержувати здоровий посадковий матеріал
можна і шляхом регенерації рослин із калюсних і суспензійних культур, в яких
віруси, як правило, не розмножуються. Проте в цьому разі не завжди можна
забезпечити генетичну стабільність рослин-регенерантів.
Оздоровлення посадкового матеріалу
від вірусної (бактеріальної, грибної) інфекції можливе за використання одного з
трьох методів:
▪ метод
апікальних меристем
▪ метод
термотерапії
▪ метод
хіміотерапії
У багатьох випадках
для оздоровлення плодових, квіткових, інших корисних видів рослин від вірусів
застосовують мікроклональне розмноження верхівковою меристемою з одночасною
термотерапією - тепловою обробкою при температурі 30-40 °С, яка знищує
фітовіруси. В Нікітському ботанічному саду (Ялта) було розроблено модель
системи звільнення рослин від вірусів, яка складається із 6 блоків-методів, що
є єдиним біотехнологічним процесом (рис. 6). Основоположними елементами моделі
є 4 взаємодоповнюючі методи: тестування на віруси вихідних рослин, термотерапія
хворих рослин, культивування рослинних тканин і регенерація рослин,
ретестування рослин-регенерантів на віруси.
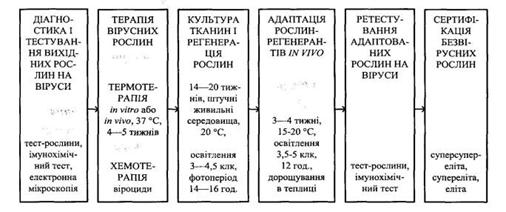
Рис. 6.
Біотехнологічний процес оздоровлення рослин (Митрофанова и др., 2000).
Метод отримання рослин з апікальної
меристеми, що складається з конуса наростання й одного або двох листкових
зачатків, вже давно відпрацьований і широко застосовується.
Можна створити
умови і для одержання рослини з тканини тільки конуса наростання без листкових
зачатків. Проте чим більший розмір меристемного експлантату, тобто чим більше
листкових зачатків і тканини стебла він має, тим легше йде процес морфогенезу,
що закінчується одержанням цілої, нормальної пробіркової рослини. Водночас
зона, вільна від вірусних часточок, дуже різноманітна для різних вірусів. Це
залежить також від виду і сорту рослини. Так, після виділення апікальної
меристеми картоплі розміром 0,2 мм (конус наростання апекса з одним листковим зачатком)
серед отриманих рослин лише 10% вільні від Х-вірусу, а 70% - від Y-вірусу
картоплі. Тому перевага віддається використанню експлантату гранично малого
розміру (0,075- 0,1 мм) і розробляються оптимальні умови для одержання
нормальної пробіркової рослини. Іноді віддають перевагу поєднанню термотерапії
і культури меристем.
Попередня термотерапія вихідних
рослин дає змогу оздоровлювати їх від вірусів за допомогою використання
меристемних експлантатів розміром 0,3-0,8 мм. Проте застосування термотерапії у
деяких випадках призводить до відставання у рості і деформації органів
меристемних рослин, посилення латентної вірусної інфекції. Тому для підвищення
ефективності виходу оздоровлених меристемних рослин використовують
хіміотерапію.
Останнім часом отримано позитивні
результати за використання в середовищі, на якому культивують меристеми,
аналога гуанозину - 1р-Д-рибофуранозил-1,2,4- триазолкарбоксаміду. Цей
препарат, що одержав комерційну назву "віразол" (синтетичний
рибавірин), доданий до поживного середовища в концентрації 40 - 200 мМ,
збільшує відсоток безвірусних меристемних рослин до 80 - 100% за 0 - 41% у
контролі. Подібну дію мають також НЕО-ДНТ та ДІАС-ДНТ. Оздоровлені
застосуванням меристемної культури рослини розмножують далі звичайним методом мікроклонального
розмноження.
Винятком є техніка мікрощеплення,
яку застосовують для оздоровлення цитрусових рослин, персиків і яблуні. Для
цитрусових потреба у застосуванні цієї техніки пов'язана із слабким ефектом у
разі використання меристем маленького розміру. Більш успішних результатів
досягають у разі щеплення меристеми лимонів і апельсинів розміром 0,14 - 0,18
мм на пробіркові підщепи, отримані з насіння. Можна одержати 30 - 50% успішних
щеплень, 95% щеплених рослин зберігається при висаджуванні у ґрунт. Пагони
цитрусових позбавлені ювенільних ознак, цвітіння і плодоношення їх
прискорюється. Із семи вірусів, поширених у цитрусових, для п'ятьох
оздоровлення спостерігали на рівні 100% щеплених рослин, для двох - 80 -98%.
.1 Метод апікальних меристем
Відбір апікальної меристеми
мінімального розміру та висадка її в поживне середовище призводить до зниження
концентрації або повної елімінації вірусів в дочірній рослині, отриманій
регенерацією з такої апікальної меристеми.
Меристема - конус клітин, що активно
діляться, розташований на кінчику погону або кореня. Для оздоровлення
використовують меристему пагонів шириною 0,1 мм і довжиною 0,2 - 0,4 мм.
Теоретичною основою методу є
нерівномірний розподіл вірусних часток в рослині. Найменша концентрація вірусів
спостерігається в зоні апікальної меристеми. Є декілька теорій, які пояснюють
саме такий розподіл вірусних часток у рослині: повільний розподіл вірусів в
клітинах, що активно діляться, пригнічення розмноження вірусів високою
концентрацією ауксинів, впливом компонентів поживного середовища.
Термотерапія - лікування заражених
вірусами рослин тривалим впливом підвищених температур в культурі in vivo або
in vitro. Термотерапія зазвичай поєднується з методом апікальних меристем.
Термотерапії можуть підлягати рослини до виділення з них апікальної меристеми
або культури рослинних клітин.
3.3 Хіміотерапія
Метод базується на використанні
хімічних речовин - інгібіторів вірусів. В практиці цей метод поєднують з
методом апікальних меристем.
Хімічні речовини, що інгібують
віруси додають в поживне середовище на якому здійснюють культивування
апікальної меристеми рослини. Найчастіше з цією метою використовують віразол
(1-бета-Д-рибофуринозил-1H-1,2,4-тіазол-3-карбоксамід).
Віразол стерилізують за використання
бактеріальних фільтрів та додають до охолодженого поживного середовища.
Концентрація препарату залежить від виду рослини (1 - 100 мг/л), тривалість
обробки підбирають експериментально. Необхідно пам’ятати, що препарат є
фітотоксичним, тому при збільшенні концентрації зменшується темп росту рослини
і можливість отримання рослини-регенеранта. Віразол добре зарекомендував себе
при оздоровленні картоплі, черешні, сливи, малини, декоративних рослин.
Методи контролю вірусної інфекції.
Використання тих чи інших методів оздоровлення посадкового матеріалу не
гарантує повної елімінації вірусів в рослинах. В зв’язку з цим в технології
виробництва оздоровленого матеріалу обов’язковим є контроль вірусної інфекції
при клональному мікророзмноженні, а також заходи з захисту рослин від
повторного інфікування, оскільки оздоровлений матеріал не набуває стійкості до
вірусу.
Для діагностики наявності вірусів в
рослинному матеріалі переважно використовують методи електронної мікроскопії,
імуноферментного аналізу, а також рослини-індикатори, які чутливі до вірусу.
Метод електронної мікроскопії.
Принцип методу базується на використанні потоку електронів, які витікають із
вольфрамової нитки (катод) в напрямі до аноду. Ці процеси відбуваються в
сталевій вакуумній трубці, до якої підключається напруга 60 000 В. Між катодом
і анодом розміщується екран, покритий флуоресцентною речовиною. Якщо на шляху
електронів поставити який-небудь предмет, то на екрані буде видна його тінь.
Вірусний препарат поміщають на спеціальну колодієву плівку, прозору для
електронів. Для більшої контрастності роблять напилення інертними металами
(золотом, платиною, хромом і ін). Відображення направляється, переломлюється і
фокусується за допомогою електромагнітних лінз. Роздільна здатність
електронного мікроскопу - 40 - 60 тис раз, що дозволяє побачити в полі зору
вірусну частинку.
За допомогою цього методу можна
визначити відносну концентрацію вірусних частинок в соку або препараті і
підрахувати їх кількість на одиницю площі листка або в одиниці маси досліджуваної
тканини. Перевагою електронної мікроскопії як методу діагностики вірусів є
можливість використання невеликої кількості соку або рослинної тканини. Висока
чутливість методу дозволяє виявляти віруси, які знаходяться в рослинах у
низькій концентрації.
Імуноферментний аналіз (ІФА). Метод
ґрунтується на взаємодії антиген-антитіло і кількісному визначенні частинок,
які взаємодіяли. При введенні в організм тварин (кролика, миші) вірусів
(антигенів) імунна система виробляє в крові тварини специфічні антитіла - імуноглобуліни,
здатні з‘єднуватися з антигенами і нейтралізувати їх дію. Антитіла знаходяться
в рідкій частині крові - сироватці, яка і використовується для їх одержання.
Найрозповсюдженіший варіант ІФА - „сендвіч-метод”. Аналіз здійснюють в
спеціальних платах із полістиролу, які мають здатність адсорбції антитіл на
своїй поверхні. На першому етапі аналізу в кожну із 96 лунок плати вносять
антитіла, які адсорбуються в лунках і здатні утримуватися на поверхні після їх
промивки. На другому етапі в лунки вносять сік листків рослин, що аналізуються.
За наявності в ньому вірусів відбувається взаємодія антитіло-антиген. На
третьому етапі в лунки вносять мічені ферментом антитіла (кон’югат), які
зберігають активність ферменту і імунну активність. Кон’югат приєднується до
комплексу антитіло-антиген. На четвертому етапі додають субстрат - речовину,
яка здатна окислюватися під дією ферменту, фарбуючи розчин в жовто-коричневий
колір. Шляхом спектрофотометрії за оптичною щільністю визначають концентрацію
вірусів.
Рослини-індикатори. Метод базується
на чутливості окремих видів або сортів рослин до певних вірусів. Спостерігають
три типи реакцій рослин- індикаторів на віруси: локальна - прояв некротичних
плям на листках в місцях інфікування, системна - мозаїка, деформація листків,
некрози різних органів, змішана реакція - прояв симптомів вірусу в місцях
інфікування, а потім по рослині. Інфекція переноситься на індикатор механічною
інокуляцією соком за допомогою комах-перенощиків або щепленням. Ознаки
захворювання проявляються за локальної реакції через 5 - 12 діб, при системній
- через 15 - 30 діб. Наприклад, для аналізу Х-вірусу картоплі використовується
дурман звичайний, тютюн.
4. Технологія отримання
оздоровленого посадкового матеріалу картоплі
Основні етапи отримання оздоровленого
посадкового матеріалу картоплі наведено на рис. 7.

Рис.7. Схема отримання оздоровленого
посадкового матеріалу картоплі
Для термотерапії відбирають бульби,
типові для даного сорту за зовнішніми ознаками без видимих уражень, миють їх та
розміщують в кюветах з піском. Кювети з бульбами витримують при температурі
37°С і вологості 75% протягом 35- 50 днів. Через 7-10 днів бульби підкормлюють
розчином мікроелементів для отримання етіолованих паростків, концентрація
вірусів у яких менша ніж у зелених. Термотерапія дозволяє повністю позбавитися
від вірусу скручування листя картоплі, але не дозволяє позбавитися від інших
вірусів картоплі в повному обсязі.
Паростки бульб після термотерапії
довжиною 2 см стерилізують у 0,1% розчині діациду 30 - 50 хв. і тричі
промивають стерильною водою. Стерилізувати паростки можна в 1 - 6 % розчині
гіпохлориду кальцію або 0,1 % розчині сулеми. Меристему розміром 0,1 - 0,25 мм
виділяють в ламінарному боксі під мікроскопом за допомогою медичної голки.
Меристему висаджують на модифіковане середовище Мурасіге-Скуга і вирощують при
температурі 25°С, вологості 70%, освітленні
6000 люкс, фотоперіоді 16 год. В поживне середовище може бути внесений віразол.
Отриману з меристеми рослину черенкують
і перевіряють на наявність вірусної інфекції методом імуноферментного аналізу
та електронної мікроскопії. В подальшому здійснюють розмноження оздоровлених
рослин. Рослини черенкують на черенки з одним листочком, які розміщують на
середовищі Мурасіге-Скуга і вирощують при температурі18 - 25°С,
вологості 70%, освітленні 6000 - 8000 люкс, фотоперіоді 16 год. Через 20 - 30
днів отримують рослину з кореневою системою придатну до нового черенкування.
Рослини, що розмножені в пробірках, висаджують в теплиці для отримання першого
клубневого покоління.
Можлива інша технологія отримання
першого клубневого покоління: отримання мініклубней. Для цього пробіркові
рослини картоплі висаджують в теплиці дуже щільно - це дозволяє економити площу
теплиці і отримувати максимальну кількість мінібульб з одиниці площі.
Мінібульби мають розмір 15 - 30 мм і можуть бути використані як для повторної
висадки в теплиці, так і для висадки в умовах відкритого ґрунту.
Література
Бурьянов
Я.И., Кадо К.И. Стратегия создания трансгенных растений с устойчивостью к
фитопатогенам и вредителям // Биоорган. химия, 1999. - Т. 25. - С. 903 - 910.
Бурьянов
Я.И. Успехи и перспективы генно-инженерной биотехнологии растений // Физиология
растений, 1999. - Т.46. - С. 930 - 944.
Озерецковская
О.Л. Индуцирование устойчивости растений биогенными элиситорами фитопатогенов
// Прикладная биохимия и микробиология, 1994. - Т. 30. - С. 325 - 339.
Бондаренко
Н. В. Биологическая защита растений. - М.: Агропромиздат, 1986. - 278 с.
Муровцев
Г.С., Бутенко Р.Г., Тихоненко Т.И., Прокофьев М.Н. Основы сельскохозяйственной
биотехнологии. - М.: Агропромиздат, 1990. - 287 с.
Биорегуляция
микробно-растительных систем / Под ред. Иутинской Г.А., Пономаренко С.П. - К.:
Ничлава, 2010. - 464 с.
Патыка
В.Ф., Патыка Т.И. Экология Bacillus thuringiensis // К.: Изд. ПГАА, 2007. - 216
с.
Кандыбин
Н.В., Патыка Т.И., Ермолова В.П., Патыка В.Ф. Микробиоконтроль численности
насекомых и его доминанта Bacillus thuringiensis / Под ред. Кандыбина Н.В. ─
Санкт-Петербург, Пушкин: Изд. ВИЗР, 2009. - 252 с.
Патыка
Т.И., Патыка В.Ф. Формирование популяционной резистентности у насекомых к
энтомопатогенным бактериям Bacillus thuringiensis // Науковий вісник
Національного аграрного університету. - 2008. - Вип.125. - С. 28-36.
Курдиш
І.К. Інтродукція мікроорганізмів у агроекосистеми. - К.: Наук. думка, 2010. -
254 с.
Вейзер
Я. Микробиологические методы боротьбы с вредными насекомыми .- М. Колос, 1972.-
312 с.
Франц
И., Криг А. Биологические методы боротьбы с вредителями - М.: Колос, 1984.- 357
с.
Кунах
В.А. Біотехнологія лікарських рослин. Генетичні та фізіолого-біохімічні основи.
- Кю: Логос, 2005. - 730 с.
Писаренко
В.М., Писаренко П.В. Захист рослин: екологічно обгрунтовані системи - П.:
ІнтерГрафіка, 2002. - 288 с.
Мельничук
М.Д., Григорюк І.П., Новак Т.В., Кляченко О.Л., Коломієць Ю.В., Спиридонов
В.Г., Клюваденко А.А., Антіпов І.О., Оверченко В.В., Облап Р.В., Новак Н.Б.
Біотехнологія рослин: Навч.посіб. - К.: Видавничий центр НУБіП України, 2011. -
216 с.