Биотехнологический способ получения меченого стабильными изотопами липид-транспортирующего белка чечевицы (Lens culinaris)
ВВЕДЕНИЕ
Растительные липид-транспортирующие белки (LTP)
широко распространены в белковых профилях растений, и, как полагают, играют
важную роль в выживании многих видов. LTP из различных видов растений разделяют
структурное сходство и высоко консервативные мотивы, которые распознаваясь
клетками иммунной системы организма обуславливают развитие симптомов
аллергических заболеваний. LTP-опосредованная аллергия связана с широким
спектром клинических реакций, включая оральный аллергический синдром, крапивницу,
отек Квинке, анафилактический шок, респираторный дистресс, и отек голосовой
щели. Компонент-специфическая диагностика играет фундаментальную роль в
идентификации и характеристике LTP-опосредованной аллергии и в будущем,
вероятно, сыграет существенную роль в лечении пациентов с аллергией на
растительные продукты. Существующая на сегодняшний день тенденция отказа или
умеренного проведения иммунотерапии фармакологическими средствами всё больше
ведёт к выбору такого альтернативного подхода лечения как аллерген-специфическая
терапия с применением рекомбинантных аналогов природных аллергенов. В последние
годы индукция иммунной толерантности стала главной задачей профилактики в
стратегии лечения многих аллергических заболеваний, в патогенезе которых
наблюдается нарушение регуляции иммунной системы. Дальнейшие исследования
связанные с точным количественным определением содержания LTP в пищевых
продуктах и пыльце, введением в широкую медицинскую практику подкожной и
сублингвальной иммунотерапии, и разработкой гипоаллергенных и иммуногенных
рекомбинантных форм ведут к появлению наиболее эффективных и широкодоступных
вариантов лечения аллергии, в том числе для применения их в контексте
персонифицированной медицины.
Ранее в Учебно-научном центре ИБХ РАН из семян
чечевицы обыкновенной Lens culinaris был выделен белок Lc-LTP2, относящийся к
первому подклассу липид-транспортирующих белков, аминокислотная
последовательность и структура кДНК, которого уже установлены. Помимо того, для
проведения дальнейших структурно-функциональных исследований на основе плазмид
pET и штамма Escherichia coli BL21(DE3) была разработана система для
гетерологической экспрессии Lc-LTP2 в виде гибридной конструкции с
тиоредоксином А и октагистидиновой последовательностью. Для исследования
пространственной структуры Lc-LTP2 был получен его рекомбинантный аналог. Для
дальнейших исследований структуры Lc-LTP2 и установления изотопной чистоты
полученного препарата методами гетероядерной ЯМР-спектроскопии и
автоматического микросеквенирования по методу Эдмана требовалось получить
меченный стабильными изотопами 13C15N-Lc-LTP2.
Цель дипломной работы: явилась разработка
биотехнологического способа получения рекомбинантного липид-транспортирующего
белка чечевицы Lc-LTP2, тотально меченного стабильными изотопами 13C и 15N,
основанного на его гетерологической экспрессии в клетках E. coli.
Для этого были осуществлены следующие задачи:
) Подбор оптимальных условий экспрессии
13C15N-меченного рекомбинантного аналога Lc-LTP2 в клетках E. coli,
трансформированных плазмидой pET-His8-TrxL-Lc-LTP2;
) Установление идентичности очищенного
рекомбинантного 13C15N-меченного Lc-LTP2 природному белку.
) Установление степени включения изотопной метки
в молекулы 13C15N-Lc-LTP2.
1. ЛИПИД-ТРАНСПОРТИРУЮЩИЕ БЕЛКИ
РАСТЕНИЙ В ДИАГНОСТИКЕ И ТЕРАПИИ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ (ОБЗОР ЛИТЕРАТУРЫ)
.1 Cтруктурно-биохимические черты и
биологические функции LTP растений
Неспецифические липид-танспортирующие белки
(nsLTPs) - небольшие, основные белки, которые широко представлены в белковых
профилях различных представителей высших растений. nsLTPs обладают способностью
обратимо связывать и переносить различные липидные молекулы и предположительно
вовлечены в межмембранный транспорт липидов на интра- и экстраклеточном
уровнях. «Неспецифическими» данные белки были названы в связи с их
предполагаемой способностью к мобилизации достаточно широкого спектра полярных
липидов, фосфолипидов и гликолипидов, включая 4-пальмитиновую кислоту, ацильные
цепи 1,2-димиристоилфосфатидилглицерина и ацетил- и олеоил-КоА, а также
гидроксильные и цетоксильные группы гидрофобных мономеров кутина и суберина
(например, жирных спиртов, фенолов и гидроксилированных жирных кислот), которые
входят в состав внешних защитных слоёв растений, а также такие липидсодержащие
соединения, как цитохром C митохондрий и простагландин B2 [1-4].традиционно
делятся на два основных подкласса в соответствии с их молекулярной массой: LTP1
(7 кДа) и LTP2 (9 кДа). Молекулярная масса nsLTPs может варьировать в пределах
от 7 до 10 кДа, но у некоторых представителей, например, nsLTP из пшеницы,
может достигать 13-15 кДа в связи с N-или С-концевыми модификациями зрелого
белка [5]. nsLTPs, как правило, представляют собой основные белки с
изоэлектрической точкой 8.5-12, имеющие полипептидную основу, которая на уровне
вторичной структуры характеризуется наличием четырёх α-спиралей,
разделенных гибкими петлями, и характерного мотива: восьми остатков цистеина
(Cys) в основе структурной последовательности
Cys1-Xn-Cys2-Xn-Cys3Cys4-Xn-Cys5XCys6-Xn-Cys7-Xn-Cys8, образующих четыре
дисульфидных мостика[5]. Различия в количестве цистеиновых остатков были
отмечены для nsLTPs из арабидопсиса, риса и пшеницы [6]. На основании
расстояния между остатками Cys, а также некоторыми другими варьирующими у
разных групп остатками, nsLTPs были разделены на девять подсемейств. N-концевые
последовательности всех подсемейств nsLTP обнаруживают высокую степень
структурной гомологии, в том числе между nsLTP из растений классов двудольные и
однодольные, а именно: полную консервативность положения остатков Val и почти
полное сходство относительно позиций остатков Gly, Ser и Pro, а также
сохранение локализации многих гидрофобных остатков [7].
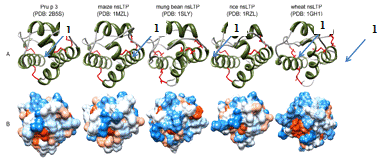
Рис. 1 - Трёхмерная структура nsLTPs. А - 4 α-спирали
окрашены зелёным цветом, стабилизирующе их дисульфидные мостики - красным
цветом; 1 - гидрофобная полость для связывания лиганда. B - распределение
гидрофильных (синим) и гидрофобных (красным) остатков по поверхности молекулы
Почти для всех nsLTPs характерно отсутствие
остатков триптофана (Trp), за исключением нескольких изоформ из арабидопсиса и
риса, которые в составе цепи имеют 1-2 Trp [6]. При сопоставлении
последовательностей N-концевого сегмента nsLTP1 из различных растительных
источников, обнаруживается высокая консервативность позиций заряженных
остатков, расположенных в виде двух консенсусных пентапептидных
последовательностей: Thr/Ser-X1-X2-Asp-Arg/Lys и Pro-Tyr-X-Ile-Ser (фрагменты
цепи в пределах остатков 43-47 и 81-85, соответственно), которые, по-видимому,
имеют критическое значение в субстрат-специфическом связывании лиганда.
Таким образом, компактная достаточно стабильная
геометрия глобулы, конфигурация α-спиралей,
формирующих гидрофобную полость, с наличием в С-коневой области сайтов
связывания липидов, а также слабая адсорбция этих белков в липидном бислое
биомембран, обусловленная преимущественной гидрофильностью поверхностных
участков молекулы. В контексте рассмотрения биологической роли, nsLTPs были
отнесены к группе, так называемых, ассоциированных с патогенезом белков
(Pathogenesis Related Proteins, PRP). Общепринятое название «PR-белки»
предполагает, что их синтез индуцируется только патогенами. Однако эти белки
образуются и в здоровых растениях при цветении, а также при различных абиотических
стрессовых воздействиях (засуха, жара, холод, засоление). В 1999 году на основе
аминокислотной последовательности, серологических свойств, энзиматической и
биологической активности была создана унифицированная для всех растений
номенклатура PR-белков, включающая 17 семейств (PR-1 - PR-17). Некоторые
PR-белки имеют протеазную, рибонуклеазную, 1,3-b-глюканазную, хитиназную
активности или являются ингибиторами протеаз. К группе PR-14 относятся
низкомолекулярные (5-10 кДа) белки - модификаторы клеточных мембран грибов и
бактерий: тионины, дефенсины и липид-транспортирующие белки.
При заражении растений патогенами увеличивается
активность литического компартмента клеток растений. К литическому компартменту
клеток растений относится центральная вакуоль, мелкие вакуоли - производные
эндоплазматического ретикулума и аппарата Гольджи, функционирующие эквивалентно
первичным лизосомам животных (то есть как структуры, в которых содержатся
гидролазы, но отсутствуют субстраты для этих ферментов), а также плазмалемма и ее
производные, в том числе парамуральные тела, и внеклеточные гидролазы,
локализованные в клеточной стенке и в пространстве между стенкой и
плазмалеммой. В пределах данного компонента и осуществляется молекулярная
функция nsLTPs, обуславливающая на макроуровне важную роль этих белков в
развитии и физиологии растений.
На основе имеющихся знаний об уровнях экспрессии
генов LTP на различных стадиях эмбрио- и онтогенеза растений, структуре белка и
активности nsLTPs in vitro, сделаны предположения о важной роли nsLTPs в таких
ключевых физиологических процессах растений, как формирование восковых и
кутикулярных слоёв на поверхности различных морфологических структур растений,
сопротивление абиотическим стрессовым воздействиям, эмбриогенез и устойчивость
к фитопатогенным бактериям и грибам. Гены nsLTPs многих растений
экспрессируются в клетках эпидермиса листовых пластинок, где восковой и
кутикулярный слои, как правило, наиболее обильны. Тем не менее, описанное в
ряде экспериментов, исследование белковых профилей различных тканей растений,
свидетельствует о локализации nsLTPs в таких гистологических структурах, как
ксилема, луб, устьица и трихомы, что может привести к обнаружению совершенно
непредсказуемых функций nsLTPs.
1.2 LTP как потенциальные инициаторы
аллергии
Аллергены - вещества, в основном
белки, с молекулярной массой от 5 до 100 кДа, или низкомолекулярные соединения,
гаптены, которые при первом поступлении в организм, предрасположенный к
развитию аллергии, вызывают сенсибилизацию, то есть образование специфических
IgE-антител, а при последующих - развитие симптомов аллергических заболеваний.
До сих пор, в качестве аллергенов, были охарактеризованы 63 члена семейства
nsLTPs, 46 из которых синтезируются в съедобных частях растений, причём почти
все из них принадлежат к классу LTP1, и всего в два, предположительно, к классу
LTP2 (www.allergome.org <#"650081.files/image002.gif">
Рис. 2 - Мимотопное картирование Pru p 3 и Tri
14. A - Аминокислоты, включённые в состав мимотопов на ленточных моделях Pru p
3 (верхний ряд) и Tri 14 (нижний ряд) в водном растворе, показывающих боковые
цепи остатков в области петли между спиралями 2 и 3 (сиреневый цвет) и - Б - аминокислотные
остатки мимотопов на участке неструктурированной С-концевой петли (синим
цветом). Поверхностные остатки электростатического потенциала отображается на
поверхностью. C - электростатический потенциал изоповерхностей -1 (красным) и
+1 (синим) в пространстве вне поверхности белка
Три IgE-связывающих региона Tri a 14 были
определены при IgE-иммунодетекции синтетических декапептидов: Tri a 1431-40,
Tri a 1451-60 и Tri a 1466-80. При сравнении с последовательными
IgE-связывающими регионами Pru p 3, а именно Pru p 311-20, Pru p 331-40 и Pru p
371-91, описанными ранее [77], обнаруживается существенное перекрывание
IgE-свяывающх эпитопов, показывают, наличие двух общих регионов, участвующих в
связывании IgE (Tri 1431-40 / Pru p 331-40 и Tri 1466-80 / Pru p 371-91),
которые потенциально участвуют в перекрестных реакциях между данными
аллергенами. В противоположность этому, Tri a 1451-60 и Pru p 311-20
представляют собой индивидуальные регионы, что частично объясняет
дифференцированную сенсибилизацию данными аллергенами, описанную у некоторых
пациентов.
Картина, отражающая локализацию эпитопов была
дополнена при идентификации мимотопных последовательностей в обоих nsLTPs
методом фагового пептидного дисплея. Таким образом, олигпептид
N36R39H35D43G74S40V75L77P78Y79T80 был идентифицирован как основной мимотоп Tri
a 14, который получен путём объединения перекрывающихся линейных эпитопов Tri a
1431-40 и Tri a 1466-80, определеных методом пептидного сканирования. Подобным
образом ранее был охарактеризован конформационный эпитоп Pru p 3,
N36L37R39R44T40D43G74V75I77S76P78Y79, [78]. Остатки, содержащиеся в эпитопах
Tri a 1451-60 и Pru p 311-20, не были определены при обогащении (биопэннинге)
библиотеки фагового пептидного дисплея. Картирование мимотопов Tri a 14 - и Pru
p 3 привело к обнаружению ключевых сайтов связывания IgE, которые могут быть
вовлечены в перекрестные реакции: N36R39T/S40D43G74 S42V75I/L77P78 Y79. Эти
основные остатки, расположенные в двух отдаленных районах аминокислотной
последовательности, были локализованы на пространственных моделях, что привело
к выявлению двух дифференцированных поверхностных регионов с различными
электростатическими свойствами. Электростатические потенциалы (ЭП) сегментов
цепей Tri a 1431-40/Pru p 331-45, проявляют аналогичную положительную
заряженность на сопоставимых в пределах моделей поверхностях. Напротив,
сегменты Tri a 1465-80/Pru p 371-80, обладают различными ЭП. Хотя данные
фрагменты довольно похожи, Tri a 14 обнаруживают, в основном, отрицательные
значения ЭП тогда как Pru p 3 - нейтральный, либо положительный потенциал
поверхностных участков. Кроме того, эпитопы, участвующие в развитии пищевой
аллергии, по-видимому, совпадают с теми, которые связаны с другим типом
сенсибилизации - осуществляемой ингаляционными аллергенами через респираторный
тракт [76]. Следовательно, мимотопы Pru p 3, определенные с использованием IgE
сыворотки пациентов с «астмой пекаря» практически идентичны Tri a 14. Это
открытие может иметь отношение к разработке новых гипоаллергенных мутантов для
использования в альтернативных стратегиях иммунотерапии. Различие ЭП
описываемых синтетических пептидов в конформационных регионах Tri 1451-60 и Pru
p 311-20, участвующих в IgE-связывании, может объяснить специфическую
сенсибилизацию к каждому из аллергенов в отдельности.
1.4 LTP растений в диагностике и
иммунотерапии аллергии
.4.1 Экстракты и рекомбинантные
формы LTP
Экстракты аллергенов из природных источников,
как правило, имеют многочисленные недостатки, которые не могут быть преодолены
при помощи существующих технических средств. Аллергенные экстракты содержат
неопределенное количество балластных примесей, из которых некоторые обладают
способностью инициировать Th2-зависимый иммунный ответ. Нередко мажорный
аллерген может присутствовать лишь в небольших количествах, и его биологическая
активность может характеризоваться сильной изменчивостью под влиянием побочных
компонентов экстракта. В отличие от этого, искусственно синтезируемые аллергены
могут быть получены с высокой степенью чистоты в виде генно-инженерно-модифицированных
молекул с известными иммунологическими и биологическими характеристиками [80].
Выделение клонов кДНК кодирующих nsLTP аллергены
и получение их рекомбинантных форм в гетерологичных системах экспрессии
позволило использовать их в качестве аллергенных компонентов, моделирующих
реакции их природных аналогов в аллергодиагностике in vitro [121]. На
сегодняшний день в диагностических тестах уже используется 10 рекомбинантных
форм липид-транспортирующих белков (rLTPs) из различных источников растительной
пищи и пыльцы. К препаратам rLTPs, полученным с использованием прокариотической
белок-синтезирующей системы Escherichia coli, относятся: rPar J 1, rPru av 3,
rHev b 12, rCor a 8 и rLyc e 3. В эукариотической системе гетерологичной
экспрессии Pichia pastoris были синтезированы rAmb 6, rPru p 3, rMal d 3, rCit
s 3 и rFra 3. Доскональная проверка иммунологической эквивалентности
соответствующему природному аналогу была выполнена для rPru p 3. Было проведено
сравнение конформации и IgE-связывающей активности природного и рекомбинантного
варианта Pru p 3, которое позволяет подтвердить их эквивалентность.
При диагностике аллергии, связанной с
употреблением пива, в состав которого могут входить такие аллерген-содержащие
компоненты, как рис, ячмень, кукуруза и пшеничный солод, учитывается тот факт
что все растительные ингредиенты подвергаются процессам ферментации,
температурной обработки, пастеризации, фильтрации и хранения, в следствие чего
сохранение аллергенного потенциала сохраняется только у чрезвычайно устойчивых
к данному физическому воздействию белков.
.4.2 Спектр LTP, используемых в
диагностических панелях аллергенов
Для северной части Европы характерны
аллергические симптомы на фрукты и овощи, в частности такие аллергены как LTPs
могут вызывать достаточно легко протекающие местные реакции полости рта или
горла - оральный аллергический синдром, в то время как у пациентов в южной
Европе чаще имеют место системные реакции, в частности анафилаксия. Объяснение
этому отличию - географическое распределение профилей сенсибилизации.
Статистический анализ многочисленных проведённых тестов показывает, что, в
северной части Европы доминирует Bet v 1-сенсибилизация, вызванная основным
аллергеном пыльцы березы. В южной части, наоборот, в диагностических тестах
доминируют антитела к LTP, что указывает на преобладание в данном регионе
истинной пищевой аллергии [90]. Поскольку для пациентов с поллинозом характерны
сезонные проявления симптомов аллергии, то наиболее приемлемым является
профилактика и лечение аллергии в сезон цветения растительного источника
аллергена, предотвращение развития аллергии на растительную пищу имеет важное
значение для пациентов с сенсибилизацией к LTP независимо от возможности
экстракции аллергенного компонента из природного источника, то есть
круглогодично [91]. Поэтому основные инструменты, для диагностирования
LTP-опосредованной аллергии - одно-компонентные тест-системы с рекомбинантными
аллергенами (представлены в таблице 1).
Таблица 1
|
Источник
природного аллергена
|
rLTP
|
Перекрёстные
реакции
|
|
|
фрукты
|
овощи
|
орехи
и семена
|
бобовые
|
пищевые
злаки
|
пряности
|
пыльца
трав
|
пыльца
сорных растений
|
пыльца
деревьев
|
латекс
|
|
Parietaria
judaica, пыльца
|
Par
j 1/2
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
+
|
-
|
-
|
|
Prunus
aviums
|
Pru
av 1
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
+
|
-
|
-
|
|
Pru
av 4
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
+
|
-
|
-
|
|
Prunus
persica
|
Pru
p 3
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
|
Triticum
album
|
Tri
a 14
|
-
|
-
|
-
|
-
|
+
|
-
|
+
|
+
|
-
|
-
|
|
Corylus
avelana
|
Cor
a 8
|
+
|
+
|
+
|
+
|
+
|
+
|
-
|
-
|
-
|
-
|
|
Ambrosia
artemisiifolia
|
Amb
a 6
|
+
|
-
|
-
|
-
|
-
|
-
|
+
|
+
|
+
|
-
|
|
Artemisia
vulgaris
|
Art
v 3
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
+
|
-
|
-
|
|
Olea
europea
|
Ole
e 7
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
-
|
|
Lens
culinaris
|
Len
c 3
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
-
|
|
Arahis
hipogaea
|
Ara
h 9
|
+
|
+
|
+
|
+
|
+
|
+
|
-
|
-
|
-
|
-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
являются одними из основных компонентов
аллергодиагностических панелей, а профили их сенсибилизации имеют
географические различия. В связи с этим, необходима разработка уникальных
композиций LTPs для аллергологических панелей того или иного региона.
1.4.3 Механизм
аллерген-специфической иммунотерапии
В соответствии с современными представлениями,
ASIT имеет два различных, возможно, последовательных, механизма действия:
стимулирует генерацию Т-регуляторных клеток (Treg) и переключает иммунный ответ
с Тh2 на Тh1. Описано, что в условиях проведения аллерген-специфической
иммунотерапии, основным источником IL-10 после повторной стимуляции аэроаллергеном
является пролиферация субпопуляции аллерген-специфических Treg клеток,
секретирующих IL-10 и трансформирующий фактор роста (TGF-β),
вызывающих
cупрессию как Тh2, так и Тh1. Treg регулируют силу иммунного ответа через
влияние на функции Т-эффекторных клеток (Т-хелперов и Т-цитотоксических
клеток). Эти клетки экспрессируют фактор FoxP3, контролирующий транскрипцию
генов, ответственных за дифференцировку Т-клеток и экспрессию цитокинов и
других факторов, участвующих в супрессии иммунного ответа. Тreg клетки выделяют
цитокины: TGF-β, IL-10, IFN-γ, IL-35, а
также экспрессируют на своей поверхности рецептор CTLA-4. Мишенями действия
Тreg клеток являются как Т-эффекторные клетки, так и дендритные клетки,
презентирующие антиген и активирующие Т-клетки [16].
Было обнаружено, что у пациентов с аллергией на
персик, взаимодействие Pru p 3 с дендритными клетками, повышает уровень
продукции IL-10 и TNF-α (Tumor Necrosis Factor-α - фактор
некроза опухоли α), стимулирующих
активацию и созревание дендритных, которые, в свою очередь, презентируют
эпитопы Pru p 3 процессированные в комплексе с IgE T-клеткам, что приводит к
активации и пролиферации специфических Тh2, секретирующих провоспалительные
цитокины. В то же время, у Pru p 3-толерантных индивидов, наблюдается преобладание
Th0/Th1 цитокинового профиля [17].
Механизм ASIT заключается в следующем IL-2 при
помощи CD25 - рецептора Treg к IL-2 и секвестрация рецептора у эффекторных
Т-клеток, что препятствует активации после связывания комплекса MHC с
антигеном, так как известно, что IL-2 является основным аутокринным
стимулирующим фактором, поддерживающим дифференцировку и клональную экспансию
Т-клеток. Тreg клетки, взаимодействуя с рецептором CD86 на дендритных клетках
при помощи CTLA-4, способны ингибировать функцию активации дендритными клетками
Т-клеток [79]. В ряде исследований подтверждена важная роль в механизме ASIT
специфических IgG1, IgG4, IgA, которым отводится роль блокирующих антител. В
процессе ASIT возможно образование антиизотипических антител, т. е. анти-IgЕ-антител.
Переключение Th2-ответа на Th1-ответ приводит к переключению с IgE-иммунного
ответа на IgG-ответ или формированию Т-клеточной толерантности.
Ранние эффекты ASIT связаны с десенситизацией
тучных клеток и базофилов и снижением их способности к выбросу медиаторов,
затем уменьшается их содержание в тканях. Промежуточный эффект ASIT связан с
иммунологическими механизмами Т-клеточной пролиферации, индукцией Тreg,
секрецией IL-10 и TGF-β, супрессией
Тh2-клеток и их цитокинов, и уменьшением количества Т-клеток в поздней фазе
аллергической реакции. В клинических условиях, данный эффект установлен, как
для подкожной, так и для сублингвальной версии иммунотерапии [95]. Последними
включаются механизмы, связанные с В-клетками (начальное увеличение и последующее
уменьшение продукции аллерген-специфических IgE) и эффекторными клетками
воспаления. Угнетение накопления клеток воспаления (эозинофилов, нейтрофилов,
базофилов, моноцитов), в свою очередь, приводит к уменьшению накопления в
тканях медиаторов воспаления, высвобождаемых из этих клеток, уменьшению
секреции хемотаксических посредников, инициирующих позднюю фазу аллергического
воспаления и неспецифическую тканевую реактивность [95].
Совсем недавно были проведены рандомизированные
двойные-слепые плацебо-контролируемые исследования активности экстракта Pru p 3
на 56 пациентах. Сублингвальная терапия в течение 6 месяцев показала повышение
толерантности к Pru p 3 от трёх до девяти раз длительнее, чем при
фармакотерапии.
Европейский мультицентровый консорциум легализовал
сублингвальную иммунотерапию рекомбинантными гипоаллергенными LTP из видов
растений семейтва Rosacea (абрикос, слива, вишня, яблоня) [92].
белок растение клетка вакцинация
1.4.4 Создание гипоаллергенных и
иммуногенных аналогов LTP и перспективы вакцинации
Сущность аллерген-специфической иммунотерапии в
настоящее время состоит в последовательном введение увеличивающейся дозы
экстракта аллергена. Однако из-за неблагоприятного соотношения риск / польза
данного подхода, ASIT не используется для лечения пищевой аллергии [107].
Аллергены в нативной конформации несут на своей
поверхности весь набор IgE-эпитопов, в связи с чем, обладают полным аллергенным
потенциалом и могут вызывать аллергические симптомы, стимулируя высвобождение
медиаторов воспаления из тучных клеток и базофилов. Химически-модифицированные
экстракты аллергенов (аллергоиды) и гипоаллергенные белки со сниженной
IgE-связывающей способностью, рассматриваются в качестве вакцин нового
поколения с уменьшенной вероятностью побочных реакций во время проведения ASIT,
что позволяет применять увеличенные дозы аллергена, по сравнению c вакцинами на
основе экстрактов нативных аллергенов [108,109].
Рекомбинантные аллергены могут быть получены в
трёх основных вариациях: в виде молекул, точно имитирующих свойства природных
аллергенов (т.е. рекомбинантные аллергены дикого типа), в виде модифицированных
вариантов с улучшенными свойствами, такими как снижение аллергенной активности
или повышение иммуногенности или в виде гибридных молекул, напоминающих эпитопы
нескольких различных аллергенов [110,111]. Хотя, на данный момент, ни один
рекомбинантный аллерген или его гипоаллергенный аналог не получил разрешение на
коммерциализацию и введение в широкую медицинскую практику, разработка новых
вакцинных препаратов с ограниченным IgE-связывающим потенциалом в настоящее
время является предметом доклинических и клинических исследований [93].
На основе клонов кДНК аллергенов также возможно
создание гипоаллергенных мутантных nsLTPs для потенциального применения в
аллерген-специфической иммунотерапии. Гипоаллергенные изоформы и варианты могут
быть получены путем разрушения конформационных IgE-связывающих эпитопов, либо
посредством химической модификации или генной инженерии [97,98,99].
Иммуногенность достигается за счёт сохранения на поверхности аллергена всех
необходимых детерминант для индукции и поддержания Т-клеток [100,101]. В
соответствии с этим, модифицированный вариант основного аллергена берзёы Bet 1
- его денатурированная форма обладала сниженным аллергенным потенциалом, в то
время как реактивность Т-клеточных линий человека и иммуногенность у мышей
сохранялись [102]. Дальнейшие генетические модификации могут включать:
генерацию олигомеров, гибридных аллергенов, перекомбинацию генов, фрагментацию
аллергена и одну / несколько точечных мутаций [103]. Чаще всего осуществляется
сайт-направленный мутагенез аминокислотных остатков критически ответственных за
связывание IgE. Целью такого подхода является снижение реактивности IgE, без
влияния на Т-клеточный ответ. Для трёх эпитопов Pru p 3, охватывающих остатки
11-25, 31-45, и 71-80 аминокислотной цепи, были обнаружены, схожие структурные
мотивы с гевеином латекса Hev B 12 (остатки 2 -23, 27 -46 и 62-84). Кроме того,
пространственное моделирование Pru p 3 позволило определить позиции критически
важных для связывания IgE аминокислотных остатков R39, T40 и R44 в конце
второго эпитопа (Pru p 331-45) данного аллергена. На основании этой информации
был получен тройной мутант R39A/T40A/R44A. Этот потенциально гипоаллергенный
вариант Pru p 3 показал 5-кратное уменьшение IgE-связывающей активности по
сравнению с рекомбинантным Pru р 3, но обладал при этом более низкой
биологической активностью.
В отличие от аллергенных фрагментов и мутантов,
конформационные варианты аллергена сохраняют все Т-клеточные эпитопы, потому
что их первичная структура не меняется. Для конформационных вариантов некоторых
аллергенов показано, что ликвидация внутримолекулярных дисульфидных связей
эпитопов IgE, инициирует денатурацию белка и снижение аллергенности. В данном
контексте, аллерген пыльцы Parietaria judaica Par J 1 также был объектом ряда
исследований. Модель его пространственной структуры демонстрирует наличие
конформационного иммунодоминантного эпитопа в N-концевой области (остатки 1 -
30), который включает критически важные остатки: два цистеина (C14 и C29)
образующих дисульфидный мостик и несколько заряженных аминокислот (K21, K23,
E24 и K27). Гипоаллергенный мутантый LTP - аналог аллергена пыльцы Parietaria
species rPar J 1 - был создан с запрограммированным посредством
сайт-направленного мутагенеза дефектом дисульфидных мостиков [104,105,106]. В
то время как уже несколько гипоаллергенных LTP из пыльцы были исследованы на
наличие иммуногенных свойств, разработка гипоаллергенных LTP из растительной пищи
для ASIT ограничена. В частности, гипоаллергенные аналоги nsLTPs полученные из
растительной пищи не были оценены как потенциальные вакцины [96].
Решению проблемы может помочь использование при
создании вакцин пептидов, отличающихся по аминокислотной последовательности от
антигенных детерминант LTP, но сохраняющих способность связываться с
комплиментарными антителами.
Такие пептиды являются имитаторами антигенных
детерминант.
Пептиды-имитаторы могут быть достаточно
вырожденными и обнаруживать перекрестную реактивность с антителами к разным
видам LTPs, обладающими частичной структурной гомологией. Вырожденные пептиды
могут иметь свойство индуцировать при иммунизации антитела, перекрестно
реагирующие с антигенными вариантами одного и того же вида LTP, то есть
проявлять молекулярную мимикрию.
2. МАТЕРИАЛЫ И МЕТОДЫ
.1 Оборудование
Настольная микроцентрифуга MiniSpin (Eppendorf);
спектрофотометр «Ultraspec 3300 PRO» (Amersham); весы электронные (Sartorius);
весы электронные «JP2-3000» (Chyo); pH-метр «501А» (Orion Research); мешалка
магнитная «MM3M» (Завод комплектных лабораторий); встряхиватель для пробирок
«ВП» (Россия); МАЛДИ-времяпролетный масс-спектрометр Reflex III (Bruker);
спектрополяриметр J-810 (Jasco); микроволновая печь (Samsung); настольные ламинарные
боксы «Gelaire» (Flow Laboratories) и «ВЛ-22» (Сампо); сухой термостат 132000
(Boekel); aвтоклав ВК-75 (Тюменский завод медицинского оборудования и
медицинской техники); низкоскоростная центрифуга с охлаждением «Minifuge GL»
(Heraeus); термостатируемые качалки «Environ-Shaker» и «Incubator-Shaker»
(Lab-line); термостат для микропробирок «Termostat 5320» (Eppendorf);
встряхиватель для микропробирок «5432» (Eppendorf); система для заливки гелей
«Mighty Small SE 245 Dual Gel Caster» (Amersham); камера для вертикального
электрофореза «2050 Midget Electrophoresis Unit» (Hoefer) c источником питания
«EPS 500/400» и системой охлаждения «2219 Multitemp II Thermostatic Circulator»
(LKB); ультразвуковой гомогенизатор «5/75.MK2»; вакуумный концентратор «SpeedVac»
(Savant); препаративная центрифуга «J2-21» (Beckman); насос перистальтический
«2120 Varioperpex II» (LKB); система для фильтрования (Millipore); лазерный
денситометр «2202» (LKB); хроматограф «Gillson-303»; двухканальный самописец
«REC-481».
2.2 Реактивы и расходные материалы
Уксусная кислота (Лекбиофарм); этанол (Ферейн);
трис(гидроксиметил)-аминометан (трис) (Serva); соляная кислота (Реахим); калия
хлорид (Реахим); магния хлорид (Merck); кальция хлорид (Sigma); магния сульфат
(Merk); тиамина хлорид (витамин В1) (Мосхимфармпрепараты); железа (III) хлорид
(Реахим); глицерин (Merck, Serva); бакто-агар (Ferak); бакто-триптон (Difco);
дрожжевой экстракт (Difco); ампициллина натриевая соль (Ферейн); канамицина
сульфат (Биохимик); тетрациклин (Синтез); [15N]-меченный хлорид аммония
(15NH4Cl) (CIL); [13C]-меченая глюкоза (CIL); изопропилтио-β-D-галактопиранозид
(IPTG) (Promega); D-глюкоза (Ferak); β-меркаптоэтанол
(BME) (Fluka); изопропанол (Реахим); акриламид (Bio-Rad);
N,N'-метиленбисакриламид (Bio-Rad); мочевина (Bio-Rad); персульфат аммония
(PSA) (Bio-Rad); метанол (Реахим); Кумасси G-250 (Serva); натрия гидрофосфата
додекагидрат (Fluka); натрия дигидрофосфат (Fluka); фенилметилсульфонилфторид
(PMSF) (Sigma); Ni2+-сефароза (Amersham Biosciences); гуанидина гидрохлорид
(Gu-HCl) (Fluka); трицин (Serva); глицин (Bio-Rad); натрия хлорид (Реахим);
додецилсульфат натрия (SDS) (Bio-Rad); N,N,N',N'-тетраметилен-1,2-диамин
(TEMED) (Fluka); белковый маркерный набор (Fermentas); пептидно-белковый
маркерный набор (2,512-16,949 кДа) (Amersham); имидазол (Sigma); мембрана
диализная (Sigma); трифторуксусная кислота (ТФУ) (Applied BioSystems); бромциан
(Sigma); бромфеноловый синий (LKB); ацетонитрил (Реахим); азид натрия (Fluka);
2,5-дигидроксибензойная кислота (Sigma).
Колонка для ВЭЖХ Dr. Masch GmbH Reprosil-Pur
C18-AQ (d=5 мкм, 250x10 мм); микрошприцы на 25 и 1000 мкл (Hamilton); шприц для
стерильной фильтрации Multifit Luer-Lok® 50cc (Becton Dickinson); фильтры для
стерильной фильтрации Millex-GV PVDF 0,22 мкм (Millipore); наконечники для
автоматических дозаторов сменные на 10, 200, 1000 мкл (QSP); микропробирки
полипропиленовые на 0,6, 1,5 и 2 мл (QSP).
При проведении экспериментов использовалась
деионизированная вода, полученная на установке «Milli-Q» (Millipore). Водные растворы
твердых веществ очищались с помощью фильтров Туре НVLP 0,45 мкм и 0,22 мкм
(Millipore).Экспрессию рекомбинантного белка проводили в штамме E. coli BL-21
(DE3) фирмы Novagen.
.3 Методы
.3.1 Приготовление компетентных
клеток
Консервированную при -70°С суспензию клеток
штамма BL21 (DE3) E. coli оттаивали при комнатной температуре, после чего
высевали в 10 мл жидкой среды LB (Luria-Bertani) без антибиотика и растили в
течение ночи (16-20 ч) при 37˚С и 200 об/мин-1 до конечной OD600=2,0-3,0.
Ночную культуру клеток в объёме 2 мл инокулировали в 200 мл жидкой среды LB без
антибиотика и подращивали до оптической плотности 0,3-0,5, снижая температуру с
37˚С до 20-25˚С. После этого культуру центрифугировали при 3000
об/мин-1 при 5˚С в течение 10 мин в двух пробирках на 50 мл (в два
приема), супернатант выливали. Дальнейшую работу с клетками проводили на льду.
Клеточный осадок ресуспендировали в 5-10 мл охлажденного до 4˚С 0,1 М
CaCl2, объединяли, доводили объем охлажденным 0,1 М CaCl2 до 45-50 мл, перемешивали
и центрифугировали в тех же условиях, супернатант выливали. Клеточный осадок
ресуспендировали в 10 мл холодного буфера TB (Transformation Buffer),
выдерживали 20 мин на льду, после чего повторно перемешивали и разливали в
охлажденные стерильные 0,5 мл пробирки по 40 мкл. Приготовленные таким образом
компетентные клетки замораживали в жидком азоте, хранили при температуре 70˚С.
Состав среды LB:
|
Компоненты
|
Концентрация,
m/V
|
|
Бакто-триптон
|
1%
|
|
Дрожжевой
экстракт
|
0,5%
|
|
NaCl
|
1%
|
Состав буфера ТВ:
|
Компоненты
|
Концентрация
|
|
HEPES
|
10
мM
|
|
CaCl2×2H2O
|
15
мM
|
|
KCl
|
250
мM
|
|
Глицерин
|
15%
(m/V)
|
|
MnCl2×4H2O
|
55
мM
|
|
H2O
|
|
2.3.2 Химическая трансформация
клеток E.coli
Производили химическую трансформацию клеток
штамма BL(DE3) плазмидами pET-His8-TrxL-Lc-LTP2. 50 мкл взвеси компетентных
клеток в 200 мкл в пробирках до 0°С и смешивали с 5 мкл лигазной смеси и по 0,5
мкл плазмиды в концентрации 1 нг/мкл. Инкубировали на льду в течение 20 мин.
Осторожно смешивали носиком автоматической пипетки, не пипетируя и инкубировали
на льду в течение 15 минут. Далее охлаждённую смесь опускали в водяную баню с
температурой воды 42○ С и выдерживали в течение 45 секунд.
Затем быстро вынимали пробирки из воды и
переносили на лёд, где клеточная суспензия охлаждалась при 0°С в течение 3 минут.
К содержимому пробирок добавляли по 800 мкл питательной среды SOC. Затем
полученную в объёме 1 мл суспензию клеток в среде SOC термостатировали при 37°С
в течение 40 мин, после чего центрифугировали при 4000 об/мин-1 в течение 2 мин
при комнатной температуре. Далее из каждой пробирки отбирали по 800 мкл
супернатанта, а клеточный осадок ресуспендировали в оставшихся 200 мкл и
высевали на чашки Петри с LB-агаром c добавлением 20 мМ глюкозы и 50 мкг/мл
ампициллина. Чашки с трансформантами инкубировали при температуре 37°С в
течение ночи (16-20 ч).
Состав среды SOC:
|
Компоненты
|
Концентрация
|
|
Бакто-триптон
|
2%
|
|
Дрожжевой
экстракт
|
0,55%
|
|
NaCl
|
10
мМ
|
|
KCl
|
10
мМ
|
|
MgCl2
|
10
мМ
|
|
MgSO4
|
10
мМ
|
|
Глюкоза
|
20
мМ
|
2.3.3 Препаративная экспрессия в
клетках E. coli на 13 C15N-меченной среде
Препаративную экспрессию гибридного белка
[15N]-His8-TrxL-Lc-LTP2 проводили в клетках E. coli штамма BL21 (DE3). Объём
культуральной жидкости составлял 2 л. Добавили по 3 колонии трансформированных
клеток в каждую из восьми пробирок с 10 мл питательной среды LB с добавлением
20 мМ глюкозы и 100 мкг/мл ампициллина. Клетки выращивали при температуре 37°С
и перемешивании с частотой 200 обмин-1 пока OD600 не стала равной 1,35.
Центрифугировали при 4000 обмин-1 при температуре 4°С в течение 12 мин.
Полученный клеточный осадок три раза промывали не содержащей 15NH4Cl и
13C-D-глюкозы средой M9 от компонентов богатой среды. Для этого клетки каждый
раз ресуспендировали в небольшом объеме бедной среды и осаждали
центрифугированием в тех же условиях. Затем клеточный осадок, отмытый и
ресуспендированный в небольшом объеме (0,5-1 мл) содержащей 15NH4Cl
и13C-D-глюкозу среды М9, в объем 2 л культуральной среды. Засевали клетки в
выращивали в колбах на 2 л, в каждой из которых предварительно было налито по
312 мл среды М9, при температуре 25-37°С и перемешивании с частотой 200 обмин-1.
Индукцию экспрессии гибридного белка проводили, добавляя 0,2 мМ IPTG на стадии
логарифмического роста культуры при OD600=0,8. Инкубировали в течение 10 ч.
Состав среды М9 (10x), pH 7,2:
|
Компоненты
|
Концентрация,
г/л
|
|
Na2HPO412H2O
|
171,9
|
|
KH2PO4
|
30
|
|
NaCl
|
5
|
|
15NH4Cl
|
10
|
|
[13C]-меченая
глюкоза
|
3,6
|
Состав среды M9 (1x):
|
Компоненты
|
Концентрация
|
|
M9
|
1х
|
|
[13C]-меченая
глюкоза
|
20
мМ
|
|
MgSO4
|
2
мМ
|
|
CaCl2
|
0,1
мМ
|
|
FeCl3
|
10
мкМ
|
|
Тиамина
хлорид (витамин В1)
|
1
мМ
|
|
Ампициллин
|
100
мкг/мл
|
2.3.4 SDS-электрофорез в ПААГ
Анализ полученных на разных стадиях выделения
фракций и клеточных образцов проводили c помощью SDS-электрофореза по методу
Леммли и в оптимизированной для разделения небольших белков и пептидов
трис-трициновой системе. Аликвоты образцов смешивали с денатурирующим буфером,
кипятили на водяной бане в течение 3-5 мин и вносили микрошприцом в лунки геля.
При анализе клеточного материала в лунку вносили эквивалент 0,1 опт. ед.
Электрофорез белков проводили при постоянной
силе тока: 15 мА в концентрирующем геле, 20 мА на границе раздела и 25 мА в
разделяющем геле. Продолжительность электрофореза составляла приблизительно 1,5
часа. По окончании электрофореза проводили одновременное окрашивание и
фиксирование белковых полос (1 час), а затем отмывку геля до обесцвечивания
фона.
Электрофорез в трис-трициновой системе проводили
при постоянном напряжении 90-100 В в течение 4 часов. По окончании
электрофореза проводили одновременное фиксирование и окрашивание белковых полос
(40 мин) и отмывку геля (до обесцвечивания фона).
Растворы для проведения вертикального
электрофореза:
) Растворы для проведения белкового
электрофореза.
Стоковые растворы для заливки ПААГ:
Раствор I: раствор акриламида 30%Т, 3%С (29,1%
акриламид, 0,9% метиленбисакриламид, вода);
Раствор II: 1,875 М трис-HCl, pH 8,8;
Раствор III: 1,25 М трис-HCl, pH 6,8;
Раствор IV: 10% SDS;
Раствор V: 10% ТЕМЕД;
Раствор VI: 10% PSA (свежеприготовленный).
Состав концентрирующего и разделяющего гелей:
|
Компоненты
|
Разделяющий
(15%Т, 3%С)
|
Концентрирующий
(5%Т, 3%С)
|
|
Раствор
I
|
8
мл
|
1,3
мл
|
|
Вода
|
4,48
мл
|
6
мл
|
|
Раствор
II
|
3,2
мл
|
-
|
|
Раствор
III
|
-
|
830
мкл
|
|
Раствор
IV
|
160
мкл
|
83
мкл
|
|
Раствор
V
|
160
мкл
|
164
мкл
|
|
Раствор
VI
|
120
мкл
|
60
мкл
|
Буфер для образцов:
мМ трис-HCl, pH 6,8, 2% SDS, 5% BME, 12%
глицерин, 0,01% бромфеноловый синий.
Растворы для обработки гелей:
. Раствор для окрашивания белковых полос: 25%
изопропиловый спирт, 10% уксусная кислота, 0,1% Кумасси G-250;
. Раствор для отмывания гелей после окрашивания:
10% уксусная кислота.
Электродный буфер (10x):
,93 М глицин, 0,25 М трис, рН 8,3, 1% SDS.
) Растворы для проведения пептидного
электрофореза.
Стоковые растворы для заливки ПААГ:
Раствор I: раствор акриламида 49,5%Т, 3%С (48%
акриламид, 1,5% метиленбисакриламид, вода);
Раствор II: раствор акриламида 49,5%Т, 6%С
(46,5% акриламид, 3% метиленбисакриламид, вода);
Раствор III: 3 М трис-HCl, 0,3% SDS, pH 8,45;
Раствор IV: 10% раствор PSA
(свежеприготовленный);
Раствор V: 10% раствор ТЕМЕД.
Состав концентрирующего, спейсорного и
разделяющего гелей:
|
Компоненты
|
Концентрирующий
(5%Т, 3%С)
|
Спейсорный
(10%Т, 3%С)
|
Разделяющий
(16,5%Т, 6%С)
|
|
Раствор
I
|
500
мкл
|
610
мкл
|
-
|
|
Раствор
II
|
-
|
-
|
5
мл
|
|
Вода
|
4,2
мл
|
1,4
мл
|
1
мл
|
|
Раствор
III
|
1,55
мл
|
1
мл
|
5
мл
|
-
|
-
|
5,4
г
|
|
Раствор
IV
|
50
мкл
|
20
мкл
|
90
мкл
|
|
Раствор
V
|
80
мкл
|
25
мкл
|
80
мкл
|
Буфер для образцов:
мМ трис-HCl, pH 6,8, 1% SDS, 1% BME, 8 М
мочевина, 0,05% Кумасси G-250.
Растворы для обработки гелей:
. Фиксатор: 10% уксусная кислота, 50% метанол;
. Раствор для окрашивания белковых полос: 0,025%
Кумасси G-250, 10% уксусная кислота;
. Раствор для отмывания гелей после окрашивания:
10% уксусная кислота.
Электродные буферы:
Анодный: 0,2 М трис-HCl; pH 8,9;
Катодный: 0,1 M трис; 0,1 M трицин; pH 8,25;
0,1% SDS.
2.3.5 Выделение и очистка гибридного
белка
Лизирование клеток
Клеточную культуру
BL-21(DE3)/pET-His8-TrxL-Lc-LTP2 центрифугировали при 8000 об.мин-1 в течение
30 мин для получения клеточного осадка, который далее ресуспендировали в 10-30
мл буфера А1 (50 мМ трис-HCl, 0,5 M NaCl, 20 мМ имидазола, pH 7,8) с
добавлением 1 мМ PMSF и гомогенизировали на льду с помощью ультразвука (6
циклов по 30 сек, затем 2 цикла по 45 сек). Лизат центрифугировали при 15 000
обмин-1 в течение 30 мин. После этого полученный осветленный лизат
разделяли с помощью аффинной хроматографии на колонке нормального давления.
Металлохелатная хроматография и диализ
Очистку гибридного белка [15N]-His8-TrxL-Lc-LTP2
проводили с помощью металлохелатной хроматографии на колонке с Ni2+-сефарозой
при скорости потока 0,7 мл/мин. Осветленный лизат наносили на металлохелатную
колонку, уравновешенную буфером А1. Далее колонку тщательно промывали буфером
А1 для удаления неспецифически связавшихся с ней примесей. Элюцию проводили
буфером В1 (50 мМ трис-HCl, 0,5 M NaCl, 0,5 М имидазола, pH 7,8).
Детектирование вели при длине волны 280 нм. Наличие и чистоту гибридного белка
в элюате оценивали методом SDS-электрофореза.
Далее элюат диализовали против 3 л
тридистиллированной воды (MWCO 12 кДа) в течение ночи при температуре 4°С и
постоянном перемешивании. Выпавший осадок отделяли центрифугированием при 14
000 об.мин-1 в течение 10 мин, полученный супернатант лиофильно высушивали.
2.3.6 Расщепление гибридного белка
Расщепление гибридного белка [15N]-His8-TrxL-Lc-LTP2
проводили с помощью реакции с бромцианом в кислой среде. Навеску гибридного
белка растворяли в 80% (v/v) ТФУ в концентрации 10-20 мг/мл, добавляли
100-кратный молярный избыток бромциана и инкубировали в темноте 16-20 ч при
комнатной температуре. Реакцию останавливали добавлением трехкратного объема
воды, после чего упаривали образец на вакуумном концентраторе SpeedVac. К
высушенному препарату добавляли воду, и образец снова упаривали. Процедуру
добавления воды и упаривания повторяли не менее трех раз. Степень расщепления
гибридного белка оценивали методом SDS-электрофореза.
2.3.7 Выделение и очистка целевого
белка
Повторная аффинная хроматография и обессоливание
образца
Очистку целевого белка от нерасщепленного
гибридного белка и белка-партнера проводили с помощью повторной металлохелатной
хроматографии в той же буферной системе на колонке с Ni2+-сефарозой в системе
буфер А1 (50 мМ трис-HCl, 0,5 M NaCl, 20 мМ имидазола, pH 7,8) / буфер B2 (50
мМ трис-HCl, 20 мМ имидазола, pH 7,8), содержащей 6М гуанидина гидрохлорид, в
концентрации 20-25 мг/мл (см. п. 2.3.5.2.). Образцы для нанесения на
металлохеллатную колонку готовили, растворяя упаренный после расщепления
бромцианом образец в буфере (50 мМ трис-HCl, 20 мМ имидазола, pH 7,8),
содержащем 6М гуанидина гидрохлорид, в концентрации 20-25 мг/мл. Остатки
кислоты нейтрализовали, добавляя раствор щелочи (1 М NaOH) до pH 7-8. Затем
производили процедуру обессоливания образца.
Проводили очистку фракции образца от 6М
гуанидина гидрохлорида. Производили разбавление в 10 раз, прибавляя к 50 мкл
образца к 450 мкл воды. Затем добавляли 500 мкл 20% ТХУ, перемешивали и
оставляли при температуре -20○ С в течение 20 минут.
Далее смесь центрифугировали при 14 000 об/мин-1
при температуре +4○ С в течение 15 минут, после чего супернатант
отбрасывали, а к осадку добавляли 500 мкл ацетона. После центрифугирования
повторяли операцию отмывки ацетоном и осаждения образца. Полученный осадок
ресуспедировали с добавлением воды и высушивали при помощи вакуумного
концентратора SpeedVac.
Высокоэффективная жидкостная хроматография
Финальную стадию очистки рекомбинантного
[15N]-меченного Lc-LTP2 проводили методом обращённо-фазовой высокоэффективной
жидкостной хроматографии (ОФ-ВЭЖХ) на колонке Reprosil-Pur C18-AQ (d=5 мкм,
250x10 мм) в системе буферов, содержащих ацетонитрил и ТФУ: А2 - 5%
ацетонитрил, 0,1% ТФУ; В2 - 80% ацетонитрил, 0,1% ТФУ. Аликвоту полученного
после повторной металлохеллатной хроматографии проскока наносили на колонку,
предварительно уравновешенную буфером А2.
Разделение смеси продуктов проводили при
скорости потока 2 мл/мин в линейном градиенте концентрации ацетонитрила от 5 до
80% за 60 мин в присутствии 0,1% ТФУ.
Для этого использовали следующую программу
контроллера:
|
Время,
мин
|
Содержание
буфера В2, %
|
Продолжительность,
мин
|
|
0
|
0
|
0
|
|
15
|
0
|
15
|
|
75
|
100
|
60
|
|
85
|
100
|
10
|
|
95
|
0
|
10
|
Детекцию осуществляли при длине волны 214 нм.
Фракции элюата, соответствующие основным пикам на хроматограмме, собирали и
лиофильно высушивали на вакуумном концентраторе SpeedVac.
2.3.8 Масс-спектрометрический анализ
Масс-спектрометрический анализ был проведен в
НИИ Биомедицинской химии им. В.Н. Ореховича РАМН на MALDI-времяпролетном
масс-спектрометре Reflex III (Bruker), оснащенном УФ-лазером с рабочей длиной
волны 337 нм. В качестве матрицы использовали 2,5-дигидроксибензойную кислоту в
20% ацетонитриле, 0,1% ТФУ в концентрации 10 мг/мл.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее в УНЦ ИБХ РАН из семян чечевицы
обыкновенной Lens culinaris был выделен ряд изоформ белка Lc-LTP, относящегося
к первому подклассу липид-транспортирующих белков растений. Для данных изоформ
были установлены полные аминокислотные последовательности и структуры кДНК, а
также был произведён анализ антимикробной активности. В частности,
антимикробная активность была показана для изоформы Lc-LTP2, которая помимо
этого обладает достаточно высокой устойчивостью к протеолитическому расщеплению
трипсином, что было установлено экспериментально. Lc-LTP2 обладает
антимикробной активностью и является перекрестным аллергеном, внесенным в базу
данных по аллергенам Международного союза иммунологических обществ
(www.allergen.org) под аббревиатурой Len c 3. Полная последовательность данного
белка образуется в результате посттрансляционного процессинга пребелка длиной
118 аминокислотных остатков (а.о.), при котором происходит отщепление
сигнального пептида, состоящего из 25 а.о., с C-конца молекулы и высвобождение
активного белка длиной 93 а.о., содержащего восемь консервативно расположенных
остатков цистеина.
Незаменимым источником информации на различных
стадиях исследования механизмов межмолекулярного взаимодействия с участием
белков, является исследование их пространственного строения такими методами
высокого разрешения как гетероядерная спектроскопия ядерного магнитного
резонанса (ЯМР) и масс-спектрометрия. Спектроскопия ядерного магнитного
резонанса (ЯМР) позволяет изучать динамические характеристики сложных
соединений, распределение электронной плотности в них и даёт представление о
стехиометрии и конформационной подвижности белковой глобулы. Всё это делает
метод ЯМР-спектроскопии одним из наиболее полезных для описания поверхностных
структурных мотивов и предсказания структурно обусловленных аллергенных
потенций белка.
Сигналы в спектрах ЯМР могут давать только ядра
атомов, обладающих нечетным спиновым числом, поэтому для используемой в широкой
практике спектроскопии ЯМР наибольшее значение имеют ядра, имеющие I = ½.
Из
ядер атомов, наиболее часто встречающихся в органических соединениях, магнитным
моментом обладают изотопы 1H, 13C, 19F, 31P, 15N (спиновое число ½).
Спектроскопия
ЯМР используется для регистрации сигналов данных ядер. Предпочтительное
применение стабильных изотопов по сравнению с их радиоактивными аналогами
обусловлено отсутствием радиационной опасности и возможностью определения
локализации метки в молекуле белка.
Технология включения атомов стабильных изотопов
(дейтерия 2H, углерода 13C, азота 15N) в молекулы с использованием
биотехнологических приёмов имеет ряд преимуществ перед альтернативным методом
химического синтеза изотопно-меченых соединений: в частности, является более
экономически выгодной, менее трудоёмкой и гарантирует образование
L-стереоизомеров синтезированных макромолекул, благодаря чему и определяет одну
из главных стратегий биохимического и структурно-функционального исследования
того или иного белка.
Как известно, высокий уровень экспрессии белков
эукариотического происхождения может быть достигнут в прокариотических
экспрессионных системах. Но существуют некоторые ограничения применения данной
технологии, накладываемые физиолого-биохимическими особенностями бактериальной
клетки. Процесс ко-трансляционного формирования структуры эукариотического
белка в бактериальной клетке характеризуется тем, что при сравнительно малом
уровне продукции гетерологичного полипептида (0,01-0,1% от суммарного
клеточного белка) соответствующий белок, как правило, растворим, при повышении
уровня экспрессии обнаруживаются как растворимые, так и нерастворимые формы
белка, а при дальнейшем возрастании уровня экспрессии до 5-10% или выше от
суммарного клеточного белка - практически весь синтезируемый рекомбинантный
белок обнаруживается в виде нерастворимых «телец включения» (inclusion body).
Для получения биологически активного целевого
продукта, белки, заключенные в тельца включения, должны быть ренатурированы и
подвергнуты рефолдингу при жестких условиях, включающих в себя хаотропные
агенты и восстановление тиолов. Как было показано в предшествующих
экспериментах в УНЦ ИБХ РАН, процедура рефолдинга Lc-LTP2 не приводит к желаемым
результатам, в связи с чем, было решено с акцентировать внимание на оптимизации
стадий получения промежуточного гибридного продукта, с использованием
высокоэффективного штамма-продуцента, а также получения максимального
количества функционально-активной формы очищенного препарата методами выделения
и очистки.
Для того чтобы добиться максимального выхода
растворимой формы гибридного полипептида необходимо, во-первых, оптимизировать
скорость его биосинтеза, во-вторых - влиять на процессы котрансляционного формирования
его третичной структуры, посттрансляционного процессинга (в частности -
ограниченного протеолиза) и межкомпартментного транспорта (секреция гибридного
белка в культуральную среду). Другим аспектом подбора системы экспрессии
являлась необходимость эффективного униформного введения атомов стабильных
изотопов в молекулы белков, для чего большое значение имеет правильный выбор
штамма микроорганизма-продуцента, способного к устойчивому росту на среде,
содержащей стабильные изотопы и высокий уровень экспрессии продукта,
содержащего целевой полипептид. Кроме того, при выборе системы экспрессии,
учитывалось то, что исследуемые в данной работе белки содержат в своей
структуре 4 дисульфидных связи. Исходя из этих условий, для стадии экспрессии
была выбрана система штамма Escherichia coli BL21 (DE3) и плазмидного вектора
pET. В бакериальную хромомсому данного штамма E. coli встроена
последовательность, кодирующая T7 РНК-полимеразу, а также имеется область
lacUV5 промотора. Целевой ген клонирован в плазмиде рЕТ под контролем сильного
промотора бактериофага Т7, способного специфически распознаваться Т7
РНК-полимеразой клетки-хозяина. Т7 РНК-полимераза является чрезвычайно
селективным и высокопроцессивным ферментом, следствием его активности является
мобилизация практически всех пластических и энергетических ресурсов клетки на
обеспечение высокого уровня экспрессии гетерологичной генетической
последовательности. В случае «протечки» промотора данной системы, синтезируемый
продукт может составлять более 50% от общей массы клеточного белка уже через
несколько часов после индукции. Подобная нестабильность плазмиды, ведущая к
гиперсинтезу чужеродного метаболита, является потенциально токсичной для
клетки-хозяина. Дополнительный уровень жесткости промотора Т7 обеспечивается
наличием в системе белка-репессора lacI, способного регулировать базальный
уровень экспрессии чужеродной последовательности. В промоторной области имеется
последовательность lacI оператора длиной 25 пар оснований. В отсутствие
индуктора, на данном участке происходит связывание lacI репрессора, что
эффективно снижает уровень транскрипции T7 РНК-полимеразой. Индуктором, как
правило, является искусственный молекулярный миметик алло-лактозы (природного
триггера транскрипции lac оперона) - изопропилтио-β-D-галактопиранозид
(IPTG). Одна из субъединиц тетрамерного lacI-репрессора оказывается
аллостерически связанной с эффекторной молекулой IPTG и уже не может
препятствовать Т7 РНК-полимеразной активности.
Важным преимуществом данной конструкции является
то, что плазмида pET дает возможность экспрессировать полипептиды в виде
слитного белка с фрагментом тиоредоксина. Являясь хорошо растворимым белком,
фрагмент тиоредоксина способствует замыканию дисульфидных связей и обеспечивает
высокий уровень секреции слитного белка в раствор. Это, с одной стороны, не
позволяет получить большого выхода целевого продукта, как в случае наработки
белков в составе телец включения, но позволяет исключить дополнительную стадию
ренатурации полипептидов в активную форму. Кроме того, ещё одним блоком на
С-конце химерного полипептида является синтетически полученный гистидиновый
октамер. Наличие октагистидиновой последовательности делает возможным выделение
белка непосредственно из реакционной смеси при помощи аффинной колонки с
Ni-сефарозой. В состав вектора также входит сайт инициации репликации (Ori)
плазмиды pBR322. Для удобства идентификации, трансформированных данной
плазмидой клонов, при выращивании на соответствующей селективной среде помимо
гена гибридного белка, в неё встроен маркерный ген β-лактамазы,
определяющий устойчивость трансформированных клеток к ампициллину. Поскольку
расщепление гибридного белка с высвобождением Lc-LTP2 предполагается проводить
при помощи реакции с бромцианом, в качестве таргетного сайта для щепящего агента
в состав плазмиды между тиоредоксином и последовательностью гена Lc-LTP2 был
встроен фрагмент, кодирующий последовательность из трёх аминокислотных
остатков: Asp-Pro-Met, синтезированный химико-ферментативным способом с помощью
полимеразной цепной реакции (ПЦР). Как известно, бромциан проявляет высокую
селективность лишь по отношению к пептидным связям, в которых карбоксильная
группа принадлежит остатку метионина. Это позволяет проводить расщепление
аминокислотной цепи по данному остатку в условиях кислого pH. Тиоредоксин в
данных условиях не подвергается фрагментации, благодаря тому, что единственный
остаток метионина в его первичной структуре был предварительно замещён на
остаток лейцина (M37L) при помощи сайт-специфического мутагенеза. Кроме того, существует
дополнительная возможность расщепления пептидной связи между остатками Asp и
Pro, поскольку пептидная связь Asp-Pro особенно лабильна в условиях кислотного
гидролиза при повышенной температуре.
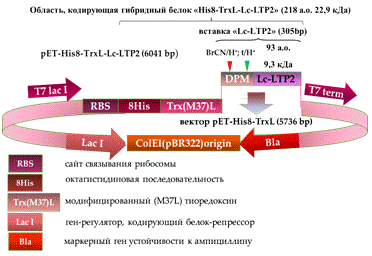
Рис. 3 - Схема плазмидного вектора,
сконструированного для экспрессии слитного белка тиоредоксина I E. сoli c
белком Lc-LTP2
На основании результатов, проведённых ранее в
УНЦ ИБХ РАН, эксперементов по гетерологической экспрессии Lc-LTP2 в клетках E.
coli BL21(DE3)/pET-His8-TrxL-Lc-LTP2 на богатой питательной среде при
температуре 30-37°С было установлено, что гибридный белок накапливается в
клетках E. coli преимущественно в растворимой фракции. Схема выделения целевого
белка включала лизирование клеток и центрифугирование, очистку гибридного белка
с помощью аффинной хроматографии в нативных условиях, диализ, расщепление
гибридного белка бромцианом, повторную металлохеллатную хроматографию и
финальную очистку Lc-LTP2 методом ОФ-ВЭЖХ. С помощью сравнительного анализа
методами MALDI масс-спектрометрии, N-концевого секвенирования по методу Эдману,
SDS-электрофореза в ПААГ и ОФ-ВЭЖХ, была показана идентичность очищенного
рекомбинантного Lc-LTP2 природному белку.
3.1 Экспрессия гибридного белка в
клетках E.coli
Целью данной работы являлось получение
высокоочищенного препарата 13C15N-меченого рекомбинантного аналога Lc-LTP2, для
исследования его пространственной структуры методом гетероядерной
ЯМР-спектроскопии.
Метод заключается в выращивании
штамма-продуцента E. coli на бедной ростовой среде, содержащей
13C15N-изотопномодифицированные субстраты.
Начальным этапом данной работы являлась
процедура химической трансформации предварительно подготовленных компетентных
клеток E.coli BL21 (DE3) ранее полученной плазмидой pET-His8-TrxL-Lc-LTP2.
Клетки микроорганизма-продуцента предварительно выращивались на богатой среде
LB при температуре роста 37°С, оптимальной для данного штамма. В целях
облегчения детекции трансформированых клонов в среду для культивирования
штамма-продуцента добавляли ампициллин, выступающий в роли селектируемого
маркера. Далее культуру E. coli BL21(DE3)/pET-His8-TrxL-Lc-LTP2 выращивали при
температуре 30-37°С на обеднённой среде М9, которая содержит в качестве
единственного источника азота хлорид аммония и в качестве единственного
источника углерода D-глюкозу. Причём в нашем случае была использована среда М9
с [13C]-меченой глюкозой и [15N]-меченым хлоридом аммония. Чтобы исключить
возможность включения в молекулы экспрессируемого белка изотопов 12C и 14N,
ночную культуру трансформированных клеток подвергали отмывке средой М9, не
содержащей D-глюкозы и хлорида аммония, и далее осуществляли культивирование на
меченой среде М9. В связи с тем, что в ряде экспериментальных работ было
показано увеличение содержания растворимой формы рекомбинантных белков при
понижении температуры культивирования [112], после добавления IPTG клеточные
культуры обоих штаммов инкубировали при пониженной температуре 28оС. Культуру
выращивали до достижения средней экспоненциальной фазы роста клеток, которая
характеризуется постоянной максимальной скоростью деления клеток (Escherichia
coli при 37°С делится примерно каждые 20 мин). Величина клеток и содержание в
них белка тоже остаются в экспоненциальной фазе постоянными. Можно сказать, что
бактериальная культура в этом случае состоит из «стандартных клеток».
В этот момент производили индукцию экспрессии,
добавляя в среду индуктор IPTG. Снижение температуры привело к уменьшению
скорости роста клеточной биомассы и увеличению времени культивирования. После
5-часовой экспрессии и процедуры выделения и очистки по описанным выше
методикам, были произведены оценка эффективности экспрессии и анализ
растворимости гибридного белка при помощи SDS-электрофореза в ПААГ.
Препаративная экспрессия проводилась в объеме 2
л питательной среды и при культивировании клеткок E. coli штамма BL-21(DE3)
после индукции IPTG в течение 5 часов при температуре 28°С до конечной
оптической плотности 2,4.
Для анализа эффективности экспрессии и оценки
содержания растворимой фракции гибридного белка в культуральной жидкости
BL-21(DE3)/pET-His8-TrxL-Lc-LTP2 клетки E. coli подвергали ультразвуковому
лизированию и далее центрифугировали полученый лизат. Было обнаружено, что в
результате экспрессии 13C15N-меченый His8-TrxL-Lc-LTP2 накапливался в трёх
вариантах: в растворимой форме в культуральной жидкости, в составе телец
включения (неструктурированный, либо обладающий дефектами конформации
13C15N-меченый Lc-LTP2) и в небольших количествах присутствовал в цитоплазме (в
связи с нарушенной секрецией во внешнюю среду). При этом было обнаружено, что
накопление гибридного белка происходило преимущественно в растворимой форме в
цитоплазме, что, по видимому, было связано с уменьшением при понижении
теапературы темпов его экспрессии, посттрансляционного прцессинга и секреции во
внешнюю среду (рис. 6). Причём накопление белка подобным образом происходило в
следующих концентрациях: в виде растворимой фракции, в концентрации 26,3 мг/л;
в нерастворимой форме в составе телец включения - 14,5 мг/л. То есть
приблизительная пропорция растворимой и нерастворимой фракций белка оказалась
2:1. При сравнении результатов экспрессии не меченного изотопами
рекомбинантного His8-TrxL-Lc-LTP2, проведённых в УНЦ ИБХ РАН ранее, и
13C15N-меченного His8-TrxL-Lc-LTP2 было показано, что выход продукта экспрессии
в клетках E. coli снижается в условиях бедной среды.
Формирование подобных нерастворимых белковых
включений, обусловлено, в первую очередь, гидрофобными взаимодействиями
молекул. Известно, что причиной повышения гидрофобности эукариотических белков
при экспрессии их в прокариотических системах может являться отсутствие у
последних системы гликозилирования, либо образование аномальных межмолекулярных
дисульфидных связей. В бактериальных клетках отсутствует система гликозилирования
белков, поэтому синтезируемые в них эукариотические полипептиды менее
гидрофильны, чем их природные варианты, а, следовательно, обладают сниженной
растворимостью и формируют тельца включения. Кроме того, внутриклеточные белки
Е. coli характеризуются низким содержанием остатков цистеина и малым числом
дисульфидных связей по сравнению с эукариотическими белками.
Восстановительно-окислительные потенциалы бактериальных и эукариотических
клеток также различаются, что, вероятно, приводило к неправильному образованию
дисульфидных связей Lc-LTP2, продуцируемого клетками E. coli, и агрегации его в
виде нерастворимых телец.
Данный вывод был сделан на основании анализа
результатов SDS-электрофореза в ПААГ. Помимо этого контроль индукции
производили также при добавлении к образцам, нанесённым на дорожку, β-меркаптоэтанола.
Как известно, белки содержащие дисульфидные связи в присутствие β-меркаптоэтанола
имеют склонность к денатурирации. Это происходит по причине того, что β-меркаптоэтанол
образует аддукты со свободными цистеинами с последующим их восстановлением и
потерей нативной конформации белка. Данная реакция происходит по схеме:
cys
<#"650081.files/image004.gif">
Рис. 4 - Контроли экспрессии и
растворимости гибридного белка: 1 - суммарный клеточный лизат до индукции; 2,3
- суммарный клеточный лизат после индукции без и в присутствии β-меркаптоэтанола,
соответственно; 4 - растворимая фракция клеточного белка (осветлённый лизат); 5
- нерастворимая фракция клеточного белка (осадок); М - смесь белков-стандартов
молекулярных масс
Экспрессия и очистка рекомбинантного 13С,
15N-меченого Lc-LTP2 проводилась по схеме, изображенной на рис. 5.

Рис. 5 - Схема экспрессии и очистки
рекомбинантного 13С15N-меченного Lc-LTP2
Также было показано, что такой фактор как
количество видов изотопов, вводимых в молекулярный скелет полипептида, никак не
влияет на уровень его экспрессии в E. coli, что было установлено при сравнении
результатов экспрессии 13C15N- и 15N-меченого His8-TrxL-Lc-LTP2, показавших
приблизительно одинаковый выход гибридного белка.
3.2 Выделение и очистка 13С,
15N-меченого Lc-LTP2
Осадок биомассы, полученный при
центрифугировании после экспрессии, подвергали ультразвуковому лизису. Для
того, чтобы не допустить деградацию гибридного белка и сохранить его
целостность, процедура лизиса проводилась на льду и с добавлением в буфер
ингибитора сериновых протеиназ PMSF. Далее методом центрифугирования получали
осветлённый клеточный лизат, содержащий гибридный белок 13С, 15N
-His8-TrxL-Lc-LTP2. Наличие гистидинового октамера на N-конце гибридного белка
позволило провести аффинной очистку методом металлохелатной хроматографии в
нативных условиях на колонке с Ni2+-сефарозой.
Данный метод очистки белков основан на
способности аминокислот (в основном остатков гистидина) образовывать
мультидентатные комплексы с катионами переходных металлов (Co2+, Ni2+, Cu2+, Zn2+),
фиксированными в виде хелатов на нерастворимой матрице. Матрица представляет
собой поперечносшитую агарозу и содержит такие хелатирующие группы, как
иминодиацетат (IDA), нитрилотриацетат (NTA) или карбоксиметиласпартат (CMA,
TALON). Сила связывания между белком и ионами металла зависит от некоторых
факторов, включая длину и положение аффинной метки в белке, тип используемых
ионов металла и pH буфера. Элюция целевого белка после отмывки может
проводиться путем подкисления буфера до pH 4,5-5,5 (при этом остатки гистидина,
pKa которых составляет около 6,0, переходят в протонированную форму),
пропускания через колонку градиента имидазола, который конкурирует с гистидином
за связывание с ионами металлов, либо хелатированием ионов металла с помощью
ЭДТА.
При пропускании осветленного лизата через
металлохелатную колонку происходило связывание гибридного белка 13С, 15N
-His8-TrxL-Lc-LTP2 со смолой в результате формирования комплексов гистидинов с
ионами никеля. Для того чтобы снизить неспецифическую сорбцию примесных белков,
содержащих сближенные остатки гистидина или цистеина, на колонку в рабочий
буфер добавляли небольшое количество имидазола, которым после нанесения образца
длительно промывали колонку. Для предотвращения ионообменных эффектов на
колонке в состав рабочего буфера вводили также 0,5 M NaCl. Элюирование
гибридного белка с колонки осуществляли ступенчатым градиентом имидазола.
Контроль за очисткой осуществляли с помощью
SDS-электрофореза в ПААГ (рис. 6).
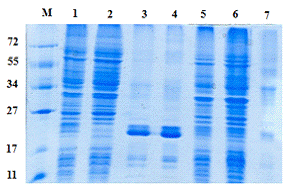
Рис. 6 - Электрофореграмма результатов очистки
гибридного белка. Из раствора: 1 - растворимая фракция белка; 2- проскок; 3 -
элюат; 4 -диализат. Из осадка: 5 - нерастворимая фракция белка; 6 - проскок; 7
- диализат. М - маркер молекулярных масс
Компоненты буфера, содержащиеся в элюате,
удаляли диализом против воды в течение ночи. В ходе проведения диализа выпадал
незначительный осадок, который удаляли центрифугированием. С помощью
SDS-электрофореза было показано, что гибридный белок содержится как в
полученном диализате, так и в осадке (рис. 9). Гибридный белок, выпадающий в
осадок при обессоливании в ходе диализа, предположительно имеющий неправильную
пространственную укладку цепи или аранжировку дисульфидных связей, в дальнейшем
не использовался. Снижение электрофоретической подвижности гибридного белка в
присутствии BME свидетельствовало о наличие в его структуре дисульфидных
связей.
Для выделения рекомбинантного 13С, 15N -меченого
Lc-LTP2 из состава гибридного белка далее проводилась реакция расщепления
полипептидной цепи бромцианом по карбоксильной группе искусственно введенного
остатка метионина. Реакция расщепления бромцианом является наиболее
высокоселективной и проходит с образованием промежуточного циансульфониевого
производного метионина, спонтанно превращающегося в кислых условиях в
иминолактон гомосерина, который, в свою очередь, быстро гидролизуется с
разрывом иминной связи.
Благодаря высокой специфичности мишени для
нуклеофильной атаки BrCN, удалось получить эффективность выхода продуктов
реакции менее 75%. Данный метод фрагментации гибридного белка по специфическому
сайту полипептидной цепи Asp-Pro-Met был выбран в связи с отсутствием
внутренних остатков метионина как в последовательности целевого белка, так и в
последовательности мутантного по данной аминокислоте белка-партнера Trx (M37L).
Реакция расщепления гибридного белка 13С, 15N -His8-TrxL-Lc-LTP2 бромцианом
проводилась в 80% ТФУ и завершалась образованием 13С, 15N -His8-TrxL,
содержащего C-концевой гомосерин-лактон, и 13С, 15N -меченого Lc-LTP2.
Анализ полученных фрагментов гибридного белка,
очищенных от остатков бромциана и летучих продуктов реакции расщепления,
производили методом SDS-электрофореза (рис. 7).

Рис. 7 - Электрофореграмма продуктов реакции:
1,2 - диализат без и в присутствии β-меркаптоэтанола;
3,4 - продукты реакции расщепления без и в присутствии β-меркаптоэтанола
В соответствии с результатами электрофореза продуктов
расщепления Lc-LTP2, после диализа Lc-LTP2 обнаруживался в виде трёх фракций,
соответствующих нерасщепленному гибридному белку (23,65 кДа), 13С15N -Lc-LTP2 в
комплексе с белком-партнёром тиоредоксином (14 кДа) и индивидуальным молекулам
13С15N -Lc-LTP2 (9,8 кДа). В присутствие BME происходило восстановление
сульфиднгидрильных групп в молекулах гибридного белка, что приводило к снижению
электрофоретической подвижности гибридного белка, но не снижало подвижности
тиоредоксина. В в отсутствии BME 13С15N-меченый Lc-LTP2 на электрофореграмме
присутствовал в виде полосы, соответствующей димеру белка с расчетной М.м. 20,6
кДа. Подобная изменчивость в условиях электрофореза обусловлена восстановлением
внутримолекулярных дисульфидных связей гибридного белка, которое способствует
нарушению его компактной пространственной укладки, а также к диссоциации
образующегося в условиях электрофореза димера 13С15N-Lc-LTP2. Анализ
электрофоретической картины образования продуктов при расщеплении BrCN показал,
что эффективность данной реакции составляла приблизительно 75%.
С целью высвобождения максимального количества
целевого белка из образовавшегося набора продуктов реакции расщепления была
проведена повторная очистка с помощью металлохеллатной хроматографии на колонке
с Ni2+-сефарозой в системе с гуанидин гидрохлоридом (GuHCl). Перед проведением
дополнительной аффинной очистки целевого белка из осветлённого лизата, на
данной колонке проводилась процедура нативной металлохеллатной хроматографии
этого же белка в комплексе с белком-носителем Trx из телец включения, что
требовало перевода колонки в систему буферов с 6 M гуанидин гидрохлоридом.
Гуанидин гидрохлорид (CH6ClN3 / CH5N3.ClH) является сильным хаотропным агентом.
В его 6 М растворе практически все белки с упорядоченной структурой теряют свою
третичную и вторичную структуру, поэтому он используется для денатурации и
последующего рефолдинга белка. Известно, что при помощи
высококонцентрированного (6-8 M) гуанидин HCl можно солюбилизировать
нерастворимые или денатурированные белки, в том числе, находящиеся в составе
телец включения. Гуанидин HCl нарушает гидрофобные взаимодействия, содействуя
растворимости гидрофобных остатков в водном растворе, инициирует разрыв
дисульфидной связи с восстановлением двух -SH радикалов. Для повышения
солюбилизации продуктов реакции расщепления BrCN, полученный образец, очищенный
от остатков бромциана и летучих компонентов, также подвергался дополнительной
аффинной очистке в системе с 6 М гуанидина гидрохлорид. Плюс ко всему, гуанидин
HCl является ингибитором РНКаз и антимикробным агентом, что было важно для
исключения бактериальной контаминации очищенного препарата.
В процессе нанесения смеси продуктов реакции
расщепления на аффинную колонку, со смолой связывались только комплексы
меченного белка-партнёра 13С15N -His8-TrxL и остаточной нерасщепленной
гибридноый белок 13С15N -His8-TrxL-Lc-LTP2. Рекомбинантный 13С15N-меченный
Lc-LTP2 не задерживался на колонке и выходил при ее промывании рабочим буфером.
Для снятия с колонки продуктов реакции расщепления с колонки осуществляли
элюирование ступенчатым градиентом имидазола.
Освобождение от соли гуанидина производилось
путём осаждения трихлоруксусной кислотой (CCl3СООН). Как известно, при низких
температурах (0 - 10° С) осаждение высаливанием, протекает без денатурации,
поэтому в данной работе инкубация раствора, содержащего белок, с ТХУ
производилась при температуре -20○ С.
Для фракционирования белков имеет преимущество
применение несмешивающихся с водой органических растворителей, так как после
осаждения белков нет необходимости избавляться от солей. В данной работе
разделение белковой и солевой фракций производилось при добавлении такого
полярного апротонного растворителя, как ацетон. При этом происходило
фракционирование смеси, основанное на различной растворимости белковых
макромолекул и низкомолекулярного неорганического детергента - гуанидина
гирохлорида, что вело к снижению диэлектрической проницаемости системы. В
результате снижались гидратация и растворимость белка и при достаточно высокой
концентрации органического растворителя происходило осаждение белковой фракции.
Финальная стадия очистки рекомбинантного белка
представляла собой ВЭЖХ на обращенно-фазовой колонке Reprosil-Pur С18-AQ. При
данном виде хроматографического разделения применяюся «обращенные» по отношению
к полярным, то есть неполярные неподвижные фазы. Подвижная фаза в ОФ ВЭЖХ
является полярной и представляет собой смесь полярного органического
растворителя с водой. При том, чем гидрофобнее соединение, тем сильнее оно
удерживается.
В нашем случае использовался наиболее
распространённый вариант неподвижной фазы для ОФ ВЭЖХ - силикагель, химически
модифицированный алкилсиланом, а именно, октадецилсисилированный силикагель, у
которого алкильная цепь представлена восемнадцатью атомами углерода
(Сl-Si(CH3)2-С18). Основной характеристикой обращенно-фазного адсорбента на
основе силикагеля является массовая доля углерода. Эта величина отражает
гидрофобность неподвижной фазы и, таким образом, и ее адсорбционную способность
и у стандартной С18 фазы использованной нами колонки составляет величину
порядка - 16-20%. Подобная эффективность и чувствительность разделения фракций
при сорбции гидрофобных соединений достигается благодаря применению сорбентов с
размером частиц 3-10 мкм. В качестве подвижной фазы в ОФ-ВЭЖХ могут быть
использованы такие растворители, как ацетонитрил, вода, спирты и их смеси,
способные самые различные биологически активные вещества детектируемые в
широком УФ-диапазоне.
Хроматографическая очистка 13С15N-меченного
Lc-LTP2 проводилась в системе растворителей ацетонитрил-вода с добавлением ТФУ
при скорости потока 2 мл/мин в линейном градиенте концентрации ацетонитрила от
5 до 80% за 60 минут. Сначала осуществляли нанос проскока, полученного при
проведении повторной металлохеллатной хроматографии на колонку С18. Далее
промывали её буфером А2, за счёт чего происходила адсорбция целевого белка на
силикагеле. Десорбция белка с колонки осуществлялась путем увеличения в элюенте
концентрации ацетонитрила, препятствующего гидрофобным взаимодействиям белков с
неполярным сорбентом колонки. Картина разделения проскока после повторной
металлохелатной хроматографии на обращённо-фазовой колонке в используемом
градиенте характеризовалась выходом основного пика 3 на 31 мин при 47%
ацетонитрила, что соответствовало времени удерживания на колонке природного
Lc-LTP2 (рис. 8).

Рис. 8 - Очистка рекомбинантного
13С,15N-меченного Lc-LTP2 методом ОФ-ВЭЖХ
Анализ полученной после ОФ-ВЭЖХ фракции (3)
проводили методами MALDI-TOF масс-спектрометрии и пептидного SDS-электрофореза
(рис. 20б, 21). На масс-спектре фракции 3 после ОФ-ВЭЖХ был обнаружен
единственный пик с m/z 9790,860, который соответствовал однозарядному иону
природного Lc-LTP2, тотально меченного стабильным изотопом 13С, 15N (расчетная
М.м. 9790,700 Да).

Рис. 9 - Масс-спектрометрический анализ фракции
3 после ОФ-ВЭЖХ
Полученный результат свидетельствовал о том, что
нами был выделен чистый 13С, 15N -меченный Lc-LTP2, стабилизированный четырьмя
дисульфидными связями.
Методами гетероядерной ЯМР-спектроскопии и
автоматического микросеквенирования по методу Эдмана была установливлена
высокая (около 99%) степень включения изотопной метки в структуру молекулы
Lc-LTP2.
ВЫВОДЫ
Оптимизированы условия экспрессии гибридного
изотопномодифицированного Lc-LTP2, благодаря чему стали возможными высокая
степень включения изотопной метки, а также более полное выделение растворимой
формы синтезированного продукта в концентрации 26, 3 мг/л питательной среды.
Проведена оптимизация условий выделения и
очистки 13С, 15N меченного Lc-LTP2 на этапах повторной аффинной хроматографии и
ОФ-ВЭЖХ, что позволяет получать не менее 3,5 мг препарата на 1 л среды.
С помощью методов электрофореза в ПААГ, МАЛДИ-времяпролётной
масс-спектрометрии и автоматического микросеквенирования по методу Эдмана
установлена гомогенность полученных препаратов и их идентичность природному
белку.
С помощью метода гетероядерной ЯМР-спектроскопии
подтверждена высокая степень включения изотопной метки в молекулы Lc-LTP2.
Получено 6,92 мг препарата 13С, 15N -меченого
рекомбинантного Lc-LTP2 для дальнейших исследований.
СПИСОК ЛИТЕРАТУРЫ
1. J.C.
Kader. Lipid-transfer proteins in plants. // 1996, Annu. Rev. Plant Physiol.
Plant Mol. Biol., Vol. 47, pp.: 627- 654.
2. J.
Douliez, T. Michon, K. Elmorjani, D. Marion, Structure, biological and
technological functions of lipid transfer proteins and indolines, the major
lipid binding proteins from cereal kernels. // 2000, J. Cereal Sci., Vol. 32,
pp.: 1 -20.
. S.
Tassin-Moindrot, A. Caille, J.P. Douliez, D. Marion, F. Vovelle, The wide
binding properties of a wheat nonspecific lipid transfer protein. Solution
structure of a complex with prostaglandin B2. // 2000, Eur. J. Biochem., Vol.
267 pp.: 1117 -1124.
. J.P.
Douliez, S. Jegou, C. Pato, D. Molle, V. Tran, D. Marion, Binding of two
mono-acylated lipid monomers by the barley lipid transfer protein, LTP1, as
viewed by fluorescence, isothermal titration calorimetry and molecular
modeling. // 2001, Eur. J. Biochem., Vol. 268 pp.: 384-388.
. Mrinal
Bhavel, Dinesh Raj Methuku1. Small cysteine-rich proteins from plants: a rich
resource of antimicrobial agents. // 2011,
Science against microbial pathogens: communicating current research and technological
advances A. Méndez-Vilas (Ed.), pp.: 1074-1083.
. Freddy
Boutrot, Nathalie Chantret and Marie-Françoise Gautier Genome-wide
analysis of the rice and arabidopsis
non-specific lipid transfer protein (nsLtp) gene families and identification of
wheat nsLtp genes by EST data mining. // 2008, BMC Genomics, Vol. 9, N. 86,
pp.: 1-19.
. E.A.
Rogozhin, T. I. Odintsova, A. Kh. Musolyamov, A. N. Smirnov, A. V. Babakov Ts.
A., E.V. Grishin. The purification and characterization of a novel lipid
transfer protein from caryopsis of barnyard grass (Echinochloa crusgalli). //
2009, Prikl Biokhim Mikrobiol., Vol. 45, N. 4, pp.: 363-368.
. Laurian
Zuidmeer-Jongejanet, Montserrat Fernandez- Rivas, Lars K PoulsenAngela
Neubauer, Juan Asturias, Lars Blom, Joyce Boye, Carsten Bindslev-Jensen,
Michael Clausen, Rosa Ferrara, Paula Garosi, Hans Huber, Bettina M Jensen, Stef
Koppelman, Marek L Kowalski, Anna Lewandowska -Polak, Birgit Linhart, Bernard
Maillere, Adriano Mari, Alberto Martinez, Clare EN Mills, Claudio Nicoletti, Dirk-Jan
Opstelten, Nikos G Papadopoulos, Antonio Portoles, Neil Rigby, Enrico Scala,
Heidi J Schnoor, Sigurveig T Sig urdardottir G, Frank Stolz, Ines Swoboda,
Rudolf Valenta Rob van den Hout, Serge A Versteeg, Marianne Witten, Ronald van
Ree. FAST: towards safe and effective subcutaneous immunotherapy of persistent
life-threatening food allergies. // 2012, Clinical and Translational Allergy,
Vol. 2, N. 5.
. O.
Quercia, G. Zoccatelli, G. F. Stefanini, G. Mistrello, S. Amato, M. Bolla, F.
Emiliani, R. Asero // Allergy to beer in LTP-se nsitized patients : beers are
not all the same // 2012, Allergy, Vol. 67, pp.: 1186-1189.
10. Sofía
Sirvent, Oscar Palomares, Javier
Cuesta-Herranz, Mayte Villalba, Rosalia Rodriguez. Analysis of the Structural
and Immunological Stability of 2S Albumin, Nonspecific Lipid Transfer Protein,
Profilin Allergens from Mustard Seeds. // 2012, J. Agric. Food Chem., Vol. 60,
pp.: 6011− 6018.
. Chaves
P, Torres MJ, Aranda A, et al. Natural killer-dendritic cell interaction in
lymphocyte responses in hypersensitivity reactions to betalactams. // 2010,
Allergy, Vol. 65, pp.: 1600-1608.
. E.A.
Pastorello,M. Monza, V. Pravettoni, R. Longhi, P. Bonara, J. Scibilia, L.
Primavesi, R. Scorza. Characterization of the T-Cell Epitopes of the Major Peach
Allergen Pru p 3. // 2010, Int Arch Allergy Immunol., Vol. 153, pp.: 1-12.
. Tordesillas
L, Cuesta-Herranz J, Gonzalez-Munoz M, Pacios LF, Compes E, Garcia-Carrasco B,
Sanchez-Monge R, Salcedo G, Diaz-Perales A: T-cell epitopes of the major peach
allergen, Pru p 3: identification and differential T-cell response of
peach-allergic and non-allergic subjects. // 2009, Mol Immunol., Vol. 46, pp.:
722-728.
. Schulten
V, Radakovics A, Hartz C, Mari A, Vazquez-Cortes S, Fernandez-Rivas M, Lauer I,
Jahn-Schmid B, Eiwegger T, Scheurer S, Bohle B: Characterization of the
allergic T-cell response to Pru p 3, the nonspecific lipid transfer protein in
peach. // 2009, J Allergy Clin Immunol., Vol. 124pp.: 100-107.
. Enrique
Gomez, Araceli Diaz-Perales, Leticia Tordesillas, Inmaculada Dooa, Maria J.
Torres, Ana B. Blazquez, Francisca Gomez, Miguel Blanca, Cristobalina Mayorga.
Effect of Pru p 3 on dendritic cell maturation and T-lymphocyte proliferation
peach allergic patients. // 2012, Allergy Asthma Immunol., Vol. 109, pp.:
52-58.
. Akdis
CA, Akdis M. Mechanisms of allergen-specific immunotherapy. // 2011, J Allergy
Clin Immunol., Vol. 127, pp.: 18-27.
. Wambre
E, Delong JH, James EA, Lafond RE, Robinson D, Kwok WW. Differentiation stage
determines pathologic and protective allergen-specific CD4+ T-cell outcomes
during specific immunotherapy. // 2012, J Allergy Clin Immunol., Vol. 129, pp.:
544-551.
. Valeria
Cavatorta, Stefano Sforza, Giancarlo Aquino, Gianni Galaverna, Arnaldo Dossena,
Elide Anna Pastorello, Rosangela Marchelli. In vitro gastrointestinal digestion
of the major peach allergen Pru p 3, a lipid transfer protein: Molecular
characterization of the products and assessment of their IgE binding abilities.
// 2010, Mol. Nutr. Food Res, Vol. 54, pp.: 1452-1457.
. J.
M. Rolland, R. E. O’Hehir. Latex allergy: a model for therapy. // 2008, Clinical
and Experimental Allergy, Vol. 38, pp.: 898-912.
. R
Asero. Lipid Transfer Protein Cross-reactivity Assessed In Vivo and In Vitro in
the Office: Pros and Cons. // 2011, J Investig Allergol Clin Immunol., Vol. 21,
N. 2, pp.: 129-136.
. S.
Denery-Papini, M. Bodinier, F. Pineau, S. Triballeau, O. Tranquet, K.
Adel-Patient, D.A. Moneret-Vautrin, B. Bakan, D. Marion, T. Mothes, H. Mameri,
D. Kasarda. Immunoglobulin-E-binding epitopes of wheat allergens in patients
with food allergy to wheat and in mice experimentally sensitized to wheat
proteins. // 2011, Clinical & Experimental Allergy, Vol. 41, pp.:
1478-1492.
. Christina
Hartz, Iris Lauer, Maria del Mar, San Miguel Moncin, Anna Cistero-Bahima, Kay
Foetisch, Jonas Lidholm, Stefan Vieths, Stephan Scheurer. Comparison of
IgE-Binding Capacity, Cross-Reactivity and Biological Potency of Allergenic
Non-Specific Lipid Transfer Proteins from Peach, Cherry and Hazelnut. // 2010,
Int Arch Allergy Immunol., Vol. 153, pp.: 335-346.
. V.
Schulten, B. Nagl, E. Scala, M. L. Bernardi, A. Mari, M. A. Ciardiello, I.
Lauer, S. Scheurer, P. Briza, A.Jurets, F. Ferreira, B. Jahn-Schmid, G. F.
Fischer, B. Bohle. Pru p 3, the nonspecific lipid transfer protein from peach,
dominates the immune response to its homolog in hazelnut. // 2011, Allergy, 66,
pp.: 1005-1013.
. Leckie
MJ, ten Brinke A, Khan J, Diamant Z, Okonnor BJ, Walls CM, et al. Effects of an
interleukin-5 blocking monoclonal antibody on eosinophils, airway
hyperresponsiveness, and the late asthmatic response. // 2000, Lancet, Vol.
356, pp.: 2144-2148.
. Garcia-Casado
G, Crepo JF, Rodriguez J, Salcedo G. Isolation and characterization of barley
lipid transfer protein and protein Zas beer allergens. // 2001, J Allergy Clin
Immunol, Vol. 108, pp.: 647-649.
26. П.В.
Колхир, Л.В. Лусс, И.В. Андреев. Пищевые аллергены: классификация и
характеристика. // 2006, Аллергология и иммунология, Т. 7. - С. 276.
27. Martin
D. Chapman. Allergen Nomenclature. // 2004, Indoor Biotechnologies, - P.12.
28. П.В.
Колхир, Л.В. Лусс, И.В. Андреев. Пищевые аллергены: классификация и
характеристика. // 2006, Аллергология и иммунология, Т. 7. - С. 276.
29. Jenkins
J. A., Griffiths-Jones S., Shewry P. R., Breiteneder H., Mills E. N. Structural
relatedness of plant food allergens with specific reference to cross-reactive
allergens: An in silico analysis. // 2005, J Allergy Clin Immunol, Vol. 115 N.
1, pp. 163 -170.
. Chapman
MD, Smith AM, Vailes LD, et al. Recombinant allergens for diagnosis and therapy
of allergic disease. // 2000, J Allergy Clin Immunol, Vol. 106, N. 3, pp.
409-418.
. Aalberse
RC. Structural biology of allergens. // 2000, J Allergy Clin Immunol, Vol. 106,
N. 2, pp. 228-238.
. Larche
M, Akdis C A, Valenta R. Immunological mechanisms of allergen-specific
immunotherapy. // 2006, Nat Rev Immunol, Vol. 6, pp.: 761-771.
. Radauer
C., Willerroider M., Fuchs H. Cross-reactive and species-specific
immunoglobulin E epitopes of plant profilins: an experimental and
structure-based analysis. // 2006, Clin Exp Allergy, Vol. 36, N. 7, pp.
920-929.
. Pene
J., Rousset F., Briere F., Chretien et al. IgE production by normal human B
cells induced by alloreactive T cell clones is mediated by IL-4 and suppressed
by IFN-gamma. // 1988, J. Immunol., Vol. 141, pp.: 1218-1224.
. Punnonen
J., Aversa G., Cocks B. G., McKenzie A. N., et al. Interleukin 13 induces
interleukin 4-independent IgG4 and IgE synthesis and CD23 expression by human B
cells. // 1993, Proc. Natl. Acad. Sci. USA, Vol. 90, pp.: 3730-3734.
. Breiteneder
H, Radauer C. A classification of plant food allergens. // 2004, J Allergy Clin
Immunol, Vol. 113, N. 5, pp. 821-830.
. Vieths
S, Scheurer S, Ballmer-Weber B. Current understanding of cross-reactivity of
food allergens and pollen. // 2002, Ann N Y Acad Sci, Vol. 964, pp. 47-68.
. Cevdet
Ozdemir, Mubeccel Akdis, Cezmi A. Akdis. T-Cell Response to Allergens. // 2010,
Chem Immunol Allergy. Basel, Karger, Vol 95, pp.: 22-44.
. Mathur
M, Herrmann K, Li X, Qin Y, Weinstock J, Elliott D, et al. TRFK-5 reverses
established airway eosinophilia but not established hyperresponsiveness in a
murine model of chronic asthma. // 1999, Am J Respir Crit Care Med, Vol.159,
pp.: 580-587.
. Leckie
MJ, ten Brinke A, Khan J, Diamant Z, Okonnor BJ, Walls CM, et al. Effects of an
interleukin-5 blocking monoclonal antibody on eosinophils, airway
hyperresponsiveness, and the late asthmatic response. // 2000, Lancet, Vol.
356, pp.: 2144-2148.
. Martin
D. Chapman. Allergen Nomenclature. // 2004, Indoor Biotechnologies, - P.12.
42. П.В.
Колхир, Л.В. Лусс, И.В. Андреев. Пищевые аллергены: классификация и
характеристика. // 2006, Аллергология и иммунология, Т. 7. - С. 276.
43. Jenkins
J. A., Griffiths-Jones S., Shewry P. R., Breiteneder H., Mills E. N. Structural
relatedness of plant food allergens with specific reference to cross-reactive
allergens: An in silico analysis. // 2005, J Allergy Clin Immunol, Vol. 115 N.
1, pp. 163 -170.
. Chapman
MD, Smith AM, Vailes LD, et al. Recombinant allergens for diagnosis and therapy
of allergic disease. // 2000, J Allergy Clin Immunol, Vol. 106, N. 3, pp.
409-418.
. Aalberse
RC. Structural biology of allergens. // 2000, J Allergy Clin Immunol, Vol. 106,
N. 2, pp. 228-238.
. Radauer
C, Breiteneder H. Pollen allergens are restricted to few protein families and
show distinct patterns of species distribution. // 2006, J Allergy Clin
Immunol, Vol. 117, N. 1, pp. 141-147.
. Radauer
C., Willerroider M., Fuchs H. Cross-reactive and species-specific
immunoglobulin E epitopes of plant profilins: an experimental and
structure-based analysis. // 2006, Clin Exp Allergy, Vol. 36, N. 7, pp.
920-929.
. Gadermaier
G, Dedic A, Obermeyer G, et al. Biology of weed pollen allergens. // 2004, Curr
Allergy Asthma Rep, Vol. 4, N. 5, pp. 391-400.
. Gershoni
J. M., Roitburd-Berman A., Siman-Tov D. D., Tarnovitski Freund N., Weiss Y.
"Epitope mapping of allergen ovalbumin using biofunctionalized magnetic
beads packed in microfluidic channels: The first step towards epitope-based
vaccines". // 2007, BioDrugs, Vol. 21, N. 3, pp. 145-156.
. Breiteneder
H, Radauer C. A classification of plant food allergens. // 2004, J Allergy Clin
Immunol, Vol. 113, N. 5, pp. 821-830.
. Vieths
S, Scheurer S, Ballmer-Weber B. Current understanding of cross-reactivity of
food allergens and pollen. // 2002, Ann N Y Acad Sci, Vol. 964, pp. 47-68.
. Cevdet
Ozdemir, Mubeccel Akdis, Cezmi A. Akdis. T-Cell Response to Allergens. // 2010,
Chem Immunol Allergy. Basel, Karger, Vol 95, pp.: 22-44.
. John
A. Jenkins, Sam Griffiths-Jones, Peter R. Shewry, Heimo Breiteneder, and E.N.
Clare Mills. Structural relatedness of plant food allergens with specific
reference to cross-reactive allergens: An in silico analysis. // 2005, J Allergy
Clin Immunol, Vol. 115, pp. 163-170.
. Asero
R, Mistrello G, Roncarolo D, Amato S, Caldironi G, Barocci F, van Ree R.
Immunological cross-reactivity between lipid transfer proteins from botanically
unrelated plant-derived foods: a clinical study. // 2002, Allergy, Vol. 57,
pp.: 900-906.
. Diaz-Perales
A, Lombardero M, Sanchez-Monge R, Garcia-Selles FJ, Pernas M, Fernandez-Rivas
M, Barber D, Salcedo G. // 2000, Lipid-transfer proteins as potential plant
panallergens: cross-reactivity among proteins of Artemisia pollen, Castanea nut
and Rosaceae fruits, with different IgE-binding capacities. Clin Exp Allergy,
Vol. 30, pp.: 1403-1410.
. Pastorello
E.A., Robino A.M. Clinical role of lipid transfer proteins in food allergy. //
2004, Mol Nutr Food Res., Vol. 48, pp.: 356-362.
. Zuidmeer
L., van Ree R. Lipid transfer protein allergy: primary food allergy or
pollen/food syndrome in some cases. // 2007, Curr Opin Allergy Clin Immunol.,
Vol. 7, pp.: 269-273.
. Werfel
T., Ahlers G., Schmidt P., Boeker M., et al. Milk-responsive atopic dermatitis
is associated with a casein-specific lymphocyte response in adolescent and
adult patients. // 1997, J. Allergy Clin. Immunol., Vol. 99, pp.: 124-133.
. Barbara
Bohle. T lymphocytes and food allergy. // 2004, Mol. Nutr. Food Res., Vol. 48,
pp.: 424 433.
. Pastorello
E.A., Pravettoni V., Farioli L., Rivolta F., Conti A., Ispano M., Fortunato D.,
Bengtsson A., Bianchi M. Hypersensitivity to mugwort (Artemisia vulgaris) in
patients with peach allergy is due to a common lipid transfer protein allergen
and is often without clinical expression. // 2002, J Allergy Clin Immunol.,
Vol. 110, pp. 310-317.
. Martin
D. Chapman. Allergen Nomenclature. // 2004, Indoor Biotechnologies, - P.12.
. Asero
R., Pravettoni V. Anaphylaxis to plant-foods and pollen allergens in patients
with lipid transfer protein syndrome. // 2013, Curr Opin Allergy Clin Immunol.
. Akdis
M. Healthy immune response to allergens: T regulatory cells and more. // 2006,
Curr Opin Immunol., Vol.18, pp.: 738-744.
. Larche
M, Akdis CA, Valenta R. Immunological mechanisms of allergen-specific
immunotherapy. // 2006, Nat Rev Immunol., Vol. 6, pp.: 761-771.
. Wang
M, Takeda K, Shiraishi Y, Okamoto M, Dakhama A, Joetham A. Peanut-induced
intestinal allergy is mediated through a mast cell-IgE-FcepsilonR I-IL-13
pathway. // 2010, J Allergy Clin Immunol., Vol.26, pp.: 306-316.
. Cezmi
A. Akdis, Mubeccel Akdis. Mechanisms of allergen-specific immunotherapy. //
2011, J Allergy Clin Immunol., Vol. 127, pp.: 18-27.
. Romagnani
S. Immunologic influences on allergy and the Th1/Th2 balance. // 2004, J
Allergy Clin Immunol, Vol. 113, pp.: 395-400.
. Burgler
S., Ouaked N., Bassin C., Basinski T.M., Mantel P.Y., Siegmund K.Differenti
ation and functional analysis of human Th17 cells. // 2009, J Allergy Clin
Immunol., Vol. 123, pp.: 588-595.
. van
Hage-Hamsten M., Kronqvist M., Zetterstrom O., Johansson E., Niederberger V.,
Vrtala S. Skin test evaluation of genetically engineered hypoallergenic
derivatives of the major birch pollen allergen, Bet v 1: results obtained with
a mix of two recombinant Bet v 1 fragments and recombinant Bet v 1 trimer in a
Swedish population before the birch pollen season. // 1999, J Allergy Clin
Immunol., Vol. 104, pp.: 969-977.
. Purohit
A., Niederberger V., Kronqvist M., Horak F., Gronneberg R., Suck R. Clinical
effects of immunotherapy with genetically modified recombinant birch pollen Bet
v 1 derivatives. // 2008, Clin Exp Allergy, Vol. 38, pp.: 1514-1525.
. Pree
I., Shamji M.H., Kimber I., Valenta R., Durham S.R., Niederberger V. Inhibition
of CD23-dependent facilitated allergen binding to B cells following vaccination
with genetically modified hypoallergenic Bet v 1 molecules. // 2010, Clin Exp
Allergy, Vol. 40, pp.: 1346-1352.
. Pacios,
L.F., Tordesillas, L., Cuesta-Herranz, J., Compes, E., Sanchez-Monge, R.,
Palacin, A., Salcedo, G., Diaz-Perales, A., 2008. Mimotope mapping as a
complementary strategy to define allergen IgE-epitopes: peach Pru p 3 allergen
as a model. Mol. Immunol., Vol. 45, pp.: 2269-2276.
. Tang
Q, Bluestone JA.The Foxp3+ regulatory T cell: a jack of all trades, master of
regulation. // 2008, Nat Immunol., Vol. 9, N. 3, pp.: 239-244.
. Birgit
Linhart, Rudolf Valenta. Vaccines for allergy. // 2012, Current Opinion in
Immunology, Vol. 24, pp.: 354 - 360.
. Heimo
Breiteneder and Clare Mills. Structural bioinformatic approaches to understand
cross-reactivity. // 2006, Mol. Nutr. Food Res., vol. 50, pp. 628-632.
. Dardalhon
V., Awasthi A., Kwon H., Galileos G., Gao W., Sobel R.A. IL-4 inhibits TGF
-beta-induced Foxp3+ T cells and, together with TGF-beta, generates IL-9 1
IL-101 Foxp3-effector T cells. // 2008, Nat Immunol., Vol. 9, pp.: 1347-1355.
. Veldhoen
M., Uyttenhove C., van Snick J., Helmby H., Westendorf A., Buer J. Transforming
growth factor-beta ‘‘reprograms’’ the differentiation of T helper 2 cells and
promotes an interleukin 9-producing subset. // 2008, Nat Immunol., Vol. 9, pp.:
1341-1346.
. Fiers
M.W., Kleter G.A., Nijland H., Peijnenburg A.A., Nap J.P., van Ham R.C.: Allermatch,
webtool for the prediction of potential allergenicity according to current
FAO/WHO Codex alimentarius guidelines. // 2004, BMC Bioinformatics, Vol. 5,
pp.: 133.
. Li
K.B., Issac P., Krishnan A. Predicting allergenic proteins using wavelet
transform // 2004, Bioinformatics, Vol. 20, N. 16, pp.: 2572-2578.
. Takagi
K., Teshima R., Sawada J. Determination of human linear IgE epitopes of
Japanese cedar allergen Cry j 1. // 2005, Biol. Pharm. Bull., Vol. 28, N. 8,
pp.: 1496-1499.
. Rudolf
Valenta, Verena Niederberger. Recombinant allergens for immunotherapy. // 2007,
J Allergy Clin Immunol., Vol. 119, pp.: 826-830.
. Leticia
Tordesillas, Javier Cuesta-Herranz, Miguel Gonzalez-Munoz. T-cell epitopes of
the major peach allergen, Pru p 3: Identification and differential T-cell
response of peach-allergic and non-allergic subjects. // 2009, Molecular
Immunology, Vol. 46, pp.: 722-728.
. Turcanu
V, Maleki SJ, Lack G. Characterization of lymphocyte responses to peanuts in
normal children, peanut-allergic children, and allergic children who acquired
tolerance to peanuts. // 2003, J Clin Invest, Vol. 11, pp.: 1065-1072.
. Judith
A. Woodfolk. T-cell responses to allergens. // 2007, J Allergy Clin Immunol,
Vol. 119, Num. 2, pp.: 280-294.
. Janet
M. Davies, Robyn E. O’Hehir, Cenk Suphioglu. Use of phage display technology to
investigate allergen-antibody interactions. // 2000, J Allergy Clin Immunol.,
Vol. 105, pp.: 1085-1092.
. Leticia
Tordesillas, Luis F. Pacios, Arancha Palacin, Santiago Quirce, Alicia Armentia,
Domingo Barber, Gabriel Salcedo, Araceli Diaz-Perales. Molecular basis of
allergen cross-reactivity: Non-specific lipid transfer proteins from wheat
flour and peach fruit as models. // 2009, Molecular Immunology, Vol. 47, pp.:
534-540.
. Garcia-Casado,
G., Pacios, L.F., Diaz-Perales, A., Sanchez-Monge, R., Lombardero, M.,
Garcia-Selles, F.J., Polo, F., Barber, D., Salcedo, G. Identification of
IgE-binding epitopes of the major peach allergen Pru p 3. // 2003, J. Allergy
Clin. Immunol., Vol. 112, pp.: 599-605.
. Pacios,
L.F., Tordesillas, L., Cuesta-Herranz, J., Compes, E., Sanchez-Monge, R.,
Palacin, A., Salcedo, G., Diaz-Perales, A., 2008. Mimotope mapping as a
complementary strategy to define allergen IgE-epitopes: peach Pru p 3 allergen
as a model. Mol. Immunol., Vol. 45, pp.: 2269-2276.
. Tang
Q, Bluestone JA.The Foxp3+ regulatory T cell: a jack of all trades, master of
regulation. // 2008, Nat Immunol., Vol. 9, N. 3, pp.: 239-244.
. Birgit
Linhart, Rudolf Valenta. Vaccines for allergy. // 2012, Current Opinion in
Immunology, Vol. 24, pp.: 354 - 360.
. Heimo
Breiteneder and Clare Mills. Structural bioinformatic approaches to understand
cross-reactivity. // 2006, Mol. Nutr. Food Res., vol. 50, pp. 628-632.
. Jean-Philippe
Borges, Annick Barre, Raphael Culerrier. How reliable is the structural
prediction of IgE-binding epitopes of allergens? The case study of plant lipid
transfer proteins. // 2007, Biochimie, Vol. 89, pp.: 83-91.
. Garcia-Casado
G, Pacios LF, Diaz-Perales A, et al. Identification of IgE-binding epitopes of
the major peach allergen Pru p 3. // 2003, J Allergy Clin Immunol, Vol. 112,
pp.: 599-605.
. Luis
F. Pacios, Leticia Tordesillas, Javier Cuesta-Herranz, Esther Compes, Rosa
Sanchez-Monge, Arantxa Palacin et al. Mimotope mapping as a complementary
strategy to define allergen IgE-epitopes: Peach Pru p 3 allergen as a model. //
2008, Molecular Immunology, Vol. 45, pp.: 269-276.
. G.
Salcedo, R. Sanchez-Monge, D. Barber, A. Diaz-Perales. Plant non-specific lipid
transfer proteins: An interface between plant defence and human allergy. //
2007, Biochimica et Biophysica Acta, Vol. 1771, pp.: 781-791.
. Moreau
P, Bessoule J, Mongrand S, Testet E, Vincent P, Cassagne C. Lipid trafficking
in plant cells. // 1998, Prog Lipid Res, Vol. 37, p.3711.
. De
Palma R, Wu S, Sallusto F. Use of antagonist peptides to inhibit in vitro T
cell responses to Par j 1, the major allergen of Parietaria judaica pollen. //
1999, J Immunol, Vol. 162, pp.: 1982-1987.
. Leticia
Tordesillas, Javier Cuesta-Herranz, Miguel Gonzalez-Munoz. T-cell epitopes of
the major peach allergen, Pru p 3: Identification and differential T-cell
response of peach-allergic and non-allergic subjects. // 2009, Molecular
Immunology, Vol. 46, pp.: 722-728.
. Veronique
Schulten, Astrid Radakovics, Christina Hartz. Characterization of the allergic
T-cell response to Pru p 3, the nonspecific lipid transfer protein in peach. //
2009, J. Allergy Clin Immunol., Vol. 124, N.1, pp.: 100-107.
. Asero
R. Plant Food Allergies: A Suggested Approach to Allergen-resolved Diagnosis in
the Clinical Practice by Identifying Easily Available Sensitization Markers. //
2005, Int Arch Allergy Immunol., Vol. 138, pp.: 1-11.
. Jutel
M et al. Allergen-specific immunotherapy with recombinant grass pollen
allergens. // 2005, J Allergy Clin Immunol, Vol. 116, pp.: 608-13.
. R.
Christopher Van Winkle, Christopher Chang. The Biochemical Basis and Clinical
Evidence of Food Allergy Due to Lipid Transfer Proteins: A Comprehensive
Review. // 2012, Clinic Rev Allerg Immunol.
. Birgit
Linhart, Rudolf Valenta. Mechanisms underlying allergy vaccination with
recombinant hypoallergenic allergen derivatives. // 2012, Vaccine 30, pp.:
4328- 4335.
. Greenhawt
MJ. Oral and sublingual peanut immunotherapy is not ready for general use. //
2013, Allergy Asthma Proc., Vol. 34, N. 3, pp.: 197-204.
. Yukselen
A, Kendirli SG, Yilmaz M, Altintas DU, Karakoc GB. Effect of one-year
subcutaneous and sublingual immunotherapy on clinical and laboratory parameters
in children with rhinitis and asthma: a randomized, placebo-controlled,
double-blind, double-dummy study. // 2012, Int Arch Allergy Immunol., Vol. 157,
N. 3, pp.: 288-298.