Полиморфизмы промоторной области гена Fas
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ РФ
Федеральное
государственное бюджетное образовательное учреждение высшего профессионального
образования «Нижегородский государственный университет им. Н.И. Лобачевского»
БИОЛОГИЧЕСКИЙ
ФАКУЛЬТЕТ
Кафедра
молекулярной биологии и иммунологии
Работа
выполнена на базе лаборатории молекулярной биологии и генной инженерии НИИ
молекулярной биологии и региональной экологии ННГУ им. Н.И. Лобачевского
Дипломная
работа
Полиморфизмы
промоторной области гена Fas
Студента 5 курса Шарова
М.А.
Научный руководитель:
м.н.с. Сахарнов Н.А.
Научный консультант:
доц.,к.б.н. Казацкая
Ж.А.
Нижний
Новгород
2012
Оглавление
Введение
. Обзор литературы
.1 Общая характеристика однонуклеотидных полиморфизмов
.2 Строение, функции, значение Fas-антигена
.3 Однонуклеотидные полиморфизмы гена Fas 10
. Материалы и методы исследований
.1 Ферменты и биопрепараты
.2 Выделение тотальной РНК
.4 Полимеразная цепная реакция
.5 Визуализация результатов ПЦР методом электрофореза нуклеиновых
кислот в 1,5% агарозном геле
. Результаты и их обсуждение
Выводы
Цитированная литература
Список сокращений
ATL - Т-клеточная лейкемия
CD - кластер дифференциации
DD - домен смерти
FasL - лиганд Fas
GCA - аденокарцинома кардиального отдела желудка - HTLV-1 связанная
миелопатия- вирус гепатита B - гепатоклеточная карцинома - Т-лимфотропный вирус
человека 1 типа- рак носоглотки - рак предстательной железы (СКВ) - системная
красная волчанка(ОНП) - однонуклеотидные полиморфизмы- специфический белок - 1
SSc - диффузный и кожный системный склероз - фактор сигнального
преобразования и активации транскрипции - 1 , NGF - факторы некроза опухолей
TSP- тропический спастический парапарез
Введение
Полиморфными принято называть гены,
которые представлены в популяции несколькими разновидностями - аллелями, что
обусловливает разнообразие признаков внутри вида. Различия между аллелями
одного и того же гена, как правило, заключаются в незначительных вариациях его
"генетического" кода. Большинство известных полиморфизмов выражаются
либо в заменах одного нуклеотида, либо в изменении числа повторяющихся
фрагментов ДНК. Полиморфизмы нуклеотидных последовательностей обнаружены во
всех структурных элементах генома. Вариации, затрагивающие кодирующие фрагменты
генов и отражающиеся на аминокислотной последовательности их продуктов,
встречаются относительно редко и не имеют отношения к анализируемой конкретной
проблеме (Льюин, 1987).
Одной из актуальных проблем биологии
и медицины является проблема исследования первичной структуры генов и их
функциональных элементов, поскольку изменение экспрессии жизненно важных генов
приводит к различным заболеваниям.
В последнее время широко
распространены исследования, направленные на выявление полиморфизмов, связанных
с индивидуальной предрасположенностью к заболеваниям и устойчивостью организма
к воздействию окружающей среды. Частота встречаемости однонуклеотидных
полиморфизмов (ОНП) может служить генетическими маркерами предрасположенности к
различным заболеваниям.
В популяционных исследованиях и картировании
генов широкое применение нашли ОНП, расположенные в некодирующих регионах и не
меняющие структуру и функцию белков (Cavalli - Sforza, 1998; Wang et al.,
1998).
ОНП используются как молекулярные
маркеры в генетических и фармакогеномных исследованиях при многих заболеваниях
(Brooks, 1999;Sobin, Ashish, 2007). При этом выявляется связь между
генетической структурой индивидуумов (генотипом) и ее ответом на лечение
препаратами (фармакогеномика); собирается информация относительно генетической
предрасположенности индивидуума к его состоянию здоровья или подтверждается
диагноз генетической болезни (генетическое тестирование); определяются
функциональные ОНП, которые изменяют структуру и функцию белков (функциональная
протеомика) (Kaleigh Smith, 2002).
Целью данной работы является анализ
частоты генотипов промоторной области гена Fas (CD95) (однонуклеотидные
полиморфизмы Fas-670A/G и Fas-1377A/G) при раке толстого кишечника и
герпесвирусной инфекции.
Для достижения данной цели были
поставлены следующие задачи:
Выявить генотипы промоторной области
гена Fas в клетках периферической крови больных раком толстого кишечника и
герпесвирусной инфекцией
Исследовать частоты генотипов
однонуклеотидных полиморфизмов Fas-670A/G и Fas-1377A/G промоторной области
гена Fas больных раком толстого кишечника и герпесвирусной инфекцией
Определить частоты генотипов
однонуклеотидных полиморфизмов Fas-670A/G и Fas-1377A/G промоторной области
гена Fas у мужчин и женщин, больных раком толстого кишечника и герпесвирусной
инфекцией
1. Обзор литературы
.1 Общая характеристика
однонуклеотидных полиморфизмов
Однонуклеотидный полиморфизм или SNP
(произносится «снип»), представляет собой замену в последовательности ДНК,
когда один нуклеотид, - А, Т, Г или Ц - в геноме (или другой последовательности)
расходится между членами вида (или в паре хромосом для особи). Такой
полиморфизм возникает в результате замены или потери отдельных нуклеотидов
(рис.1) (Melville, 2000). Однонуклеотидные полиморфизмы могут быть би-, три-, и
тетра-аллельными полиморфизмами. Однако, у человека, три-аллельные и
тетра-аллельные полиморфизмы настолько редки, что, можно считать, что вообще не
встречаются, поэтому под однонуклеотидными полиморфизмами часто понимают
би-аллельные маркеры (или ди-аллельные) (Фогель, 1990).
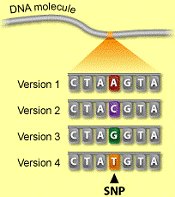
Рис.1. Варианты однонуклеотидных
замен в геноме (Colella et al., 2007)
ОНП очень многочисленны, стабильны и
рассредоточены внутри генома. Данный тип вариации связан с разнообразием в
популяции, индивидуальностью, и, хотя большинство таких вариаций, возможно, не
проявляются фенотипически, определенные ОНП могут предрасполагать к
заболеваниям, либо воздействовать на их остроту, прогрессирование, а также
индивидуальные реакции на лечение. Они могут располагаться в кодирующих
последовательностях генов, некодирующих регионах генов или в межгенных
регионах.
На молекулярном уровне, данные
функциональные ОНП могут влиять на человеческий фенотип вмешательством на обоих
уровнях механизма синтеза белка: некодирующие ОНП могут разрушать сайты
связывания транскрипционных факторов, сайты сплайсинга и другие функционально
важные сайты на транскрипционном уровне, в то время как кодирующие ОНП могут
становиться причиной аминокислотной замены и изменения функциональных или структурных
свойств транслированного белка. Аннотирование проявления ОНП для
индивидуального фенотипа должно быть сфокусировано на обоих уровнях: описание
изменений свойств гена и белка.
Замены в последовательности ДНК
человека могут приводить к развитию заболеваний и нетипичным реакциям на:
патогены, химикаты, лекарства, вакцины, а также другие факторы (Reumers et al.,
2008; Arnold, 2009).
ОНП кодирующих последовательностей
необязательно меняют аминокислотную последовательность закодированного белка.
ОНП, обе формы которых формируют одну и ту же последовательность полипептидов
называются синонимичными (иногда их еще называют молчащими мутациями), если же
продуцируется другая полипептидная последовательность, их соответственно
называют несинонимичными (Norrgard, Schultz, 2008).
Существуют ОНП, которые связаны с
аутоиммунными заболеваниями, такими как диабет 1 типа (Nagata, 1999),
множественный склероз (De Maria et al., 1996), ревматоидный артрит (Hampe et
al., 1999) и системная красная волчанка (De Maria et al., 1996; Hampe et al.,
1999) и опухолевыми заболеваниями - рак кишечника (Hampe et al.), легких
(Nagata, 1999), поджелудочной железы (Hampe et al.), различными видами карцином
(Hampe et al., 1999; Nagata, 1999), лейкемией (Nagata, 1999).
Большую актуальность приобретают
исследования по влиянию ОНП, на экспрессию проапоптотических белков. Известно,
что при развитии опухолевых процессов изменяются механизмы самоуничтожения
клеток таким образом, что злокачественно трансформированные клетки экранируют
цитотоксическое действие иммунной системы организма и приобретают конкурентные
преимущества в росте. Механизмы ухода опухолевых клеток из-под иммунного
надзора во многом касаются регуляции экспрессии проапоптотических белков, в
частности мембранного рецептора смерти Fas (CD95). Изменения экспрессии Fas
и/или FasL часто выявлются при опухолевых заболеваниях человека.
.2 Строение, функции, значение
Fas-антигена
/CD95/APO-1 антиген -
гликозилированный трансмембранный белок 2 типа с молекулярной массой 45 кДа,
содержащий в своем составе 320 аминокислотных остатков (рис.2). В
функциональном отношении Fas является биполярной молекулой. Ее внеклеточный
участок необходим для взаимодействия с FasL, а цитоплазматический регион (DD -
домен смерти) требуется для индукции апоптотического сигнала. Fas (CD95) -
трансмембранный протеин, опосредующий апоптоз, однако растворимая его форма
ответственна за патогенез аутоиммунных нарушений, а также за ускользание от
иммунологического надзора и развитие опухолей (Nagata, 1995; Барышников, Шишкин,
2002). Это член семейства рецепторов факторов некроза опухолей (TNF, NGF),
проводящий апоптотический сигнал в чувствительные к апоптозу клетки (Leithauser
et al., 1993; Kim et al., 2000).

Рис.2. Тримерная структура
мембранной формы Fas антигена (Барышников, Шишкин, 2002)
Ген Fas включает 9 экзонов и
охватывает более чем 26 килобаз ДНК. Длины интронов варьируют от 14 килобаз в
5'-конце гена до 152 пар оснований экзона, включая трансмембранный домен.
Промоторный регион не имел канонических (аминокислотная или нуклеотидная
последовательность, принимаемая за эталон в сравнительном анализе) TATA- и
CAAT-боксов, но включал GC-богатую последовательность (участок, обогащенный
гуанином и цитозином в терминирующей последовательности в матрице ДНК
(стоп-сигнал), сигнализирующей о конце транскрибируемого гена). Этот регион
охватывает последовательность в 2000 нуклеотидных пар и включает в себя
основной промотор, энхансер и сайленсер (Rudert et al., 1995).
Нормальное функционирование
CD95-рецепторно/лигандной системы поддерживает гомеостаз во многих системах
организма, а при нарушении функции этой системы развиваются многочисленные
заболевания (Барышников, Шишкин, 2002).
1.3 Однонуклеотидные полиморфизмы
гена Fas
В литературе описываются данные о
связях между наличием определенных генотипов ОНП промоторной части гена Fas с
опухолевыми и другими заболеваниями, обусловленными во многом различными
нарушениями апоптотических функций клеток.
ОНП Fas-1377A/G (rs2234767)
расположен в промоторной части гена Fas в составе консенсусной
последовательности фактора транскрипции SP-1.
ОНП Fas -670A/G (rs1800682)
находится в сайте связывания фактора STAT1 - фактора транскрипции, передающего
сигналы цитокинов и факторов роста в ядро, участвующего в поддержании
клеточного гомеостаза, в процессах пролиферации и апоптоза клеток иммунной
системы. Нарушения в функционировании этой молекулы способствуют развитию
опухолевых процессов.
Наличие различных вариантов
генотипов Fas-1377A/G и Fas -670A/G может изменять промоторную активность и, в
конечном итоге, влияет на экспрессию гена Fas (Huang et al., 1997; Kanemitsu et
al., 2002; Sibley et al., 2003; Bel, 2006).
Частоты аллельных вариантов
Fas-670A/G были ассоциированы с повышенной чувствительностью к ревматоидному
артриту (Lee et al., 2001).
Изучена также роль частот ОНП
Fas-670A/G и Fas -1377G/A в этиологии рака различных органов, включая рак шейки
матки (Lai et al., 2003; Dybikowska et al., 2004; Lai et al., 2005; Ueda et
al., 2005; Zoodsma et al., 2005; Sun et al., 2005; Ueda et al., 2006; Tamandani
et al., 2008), острую миелоидную лейкемию (Sibley et al., 2003; Farre et al.,
2008), молочной железы (Crew et al., 2007; Zhang B et al., 2007), мочевого
пузыря (Li et al., 2006), легких (Wang et al., 2003; Zhang X et al., 2005;
Zhang Z et al., 2006; Park et al., 2006;Gormus et al., 2007; Ter-Minassian et
al., 2008), предстательной железы (Lima et al., 2008), головы и шеи (Zhang Z et
al., 2006) и пищевода (Krippl et al., 2004; Sun et al., 2004; Bel, 2006),
остеосаркому (Koshkina et al., 2007), немеланомный рак кожи (Nelson et al.,
2001), аденокарциному желудка (Ikehara et al., 2006; Hsu et al., 2008),
злокачественную меланому кожи (Li et al., 2006; Zhang H et al., 2007), рак
сосочков щитовидной железы (Erdogan et al., 2007), рак эпителия яичника (Gormus
et al., 2007), рак поджелудочной железы (Yang et al., 2008).
Частота аллели G при снипе
Fas-670A/G понижает транскрипционную активность гена Fas. Сывороточный уровень
растворимой формы Fas антигена повышается при раке простаты и связан с
прогрессированием заболевания. Показано, что частота аллели G понижает уровни
sFas, предупреждая апоптотическое ингибирование, вызванное растворимой формой
(Lima et al., 2007). Частота промоторного ОНП гена FAS (-670A/G) ассоциирована
с канцерогенезом шейки матки в японской популяции (Ueda et al., 2005). Частота
генотипа Fas-670 GG связана с повышенным риском развития рака шейки матки по
сравнению с генотипом АА у японского населения. Частота аллели G ассоциирована
с повышенным риском развития рака шейки матки по сравнению с частотой аллели А
(Ueda et al., 2006). Частота ОНП Fas-670A/G ассоциирована с риском развития
рака шейки матки у населения Северной Индии (Kordi Tamandani et al., 2008) и с
повышенным риском развития рака шейки матки среди бразильских женщин до 48 лет
(Zucchi et al., 2009). Частота функционального ОНП промотора Fas -670A/G
связана с повышенной восприимчивостью, клиническими проявлениями, а также
выживанием при Т-клеточной лейкемии (ATL) (Farre et al., 2008). Частота ОНП
Fas-670А>G ассоциирована с восприимчивостью пациентов к плоскоклеточному
раку головы и шеи (Lei et al., 2010).
Частота ОНП Fas -1377G/A связана с
повышенной чувствительностью индивидуумов к развитию гепатоклеточной карциномы
(HCC), но не гепатита B (HBV) (Jung et al., 2007). Частота аллели Fas -1377A
ассоциирована с пониженным риском развития рака, частично среди курильщиков
(Zhang et al., 2009). Показано, что частота ОНП Fas -1377G>A связана с раком
молочной железы, а также с желудочной плоскоклеточной карциномой (Sun et al.,
2004). Частота функционального ОНП Fas-1377G/A ассоциирована с риском развития
рака носоглотки (NPC), и эта связь особенно заметна у курильщиков табака (Cao
et al., 2010). Частота аллели Fas-670 G является генетическим маркером риска
метастазирования у пациентов с раком носоглотки (NPC) (Zhu et al., 2010).
Частоты ОНП Fas-1377G>A и
Fas-670A>G ассоциированы с острой миелоидной лейкемией (Sibley et al.,
2003), раком шейки матки (Lai et al., 2003) и раком легкого (Wang et al.,
2003). Частоты ОНП Fas−1377G>A и Fas−670A>G связаны с риском
заболевания раком предстательной железы (PCa) в китайской популяции (Pengfei et
al., 2011). Частоты функциональных ОНП в Fas (−1377G/A и −670A/G)
ассоциированы с повышенным риском заболевания раком молочной железы (Zhang B.
et al., 2007). Частоты ОНП Fas-670А>G и Fas-1377G>А связаны с повышенным
риском плоскоклеточного рака головы и шеи (Zhang Z. et al., 2007).
С другой стороны, частоты ОНП Fas не
связаны с развитием некоторых аутоиммунных и онкологических заболеваний.
Частота ОНП Fas -670A>G не ассоциирована с риском заболевания раком молочной
железы (Krippl et al., 2004). Частота генотипа Fas-670АА связана с развитием
неоплазии шейки матки у поляков (Dybikowska et al., 2004). Снижение экспрессии
Fas и / или повышенная экспрессия FasL, как известно, существуют в некоторых
типах рака, включая рак легких (Zhang et al., 2005). Отсутствие экспрессии Fas
на клеточной поверхности является одним из основных путей сопротивления
апоптозу в опухолевых образованиях и их прогрессированию. Не существовало связи
между частотой ОНП Fas-1377G->A и развитием рака легких, но вероятность
образования рака легкого при генотипе Fas-1377AG больше, чем при других
генотипах (Gormus et al., 2007). В провинции Хэбэй частота ОНП Fas-1377G/А не ассоциирована
с риском заболеваемости аденокарциномой кардиального отдела желудка (GCA). Тем
не менее, частота генотипа Fas-670 A/G уменьшает риск GCA у курящих лиц (Zhou
et al., 2010).
Частота ОНП FAS-670A/G ассоциирована
также с общей выживаемостью пациентов с раком толстого кишечника. По данным
австрийских ученых (Hofmann et al., 2009) частота генотипа FAS -670AA
составляла 24,2%, генотипа FAS -670AG - 46,3%, генотипа FAS -670GG - 29,5%.
Генотип FAS -670GG был ассоциирован с пониженной выживаемостью по сравнению с
генотипами AA или AG.
2. Материалы и методы
исследований
Материалами для исследования явился
51 образец крови здоровых доноров (42 женщины и 9 мужчин) в качестве контроля,
44 образцов больных раком толстого кишечника (26 женщин и 18 мужчин),
предоставленные клиникой Областного онкологического центра, 35 образцов крови
больных герпесвирусной инфекцией инфекцией (14 женщин и 21 мужчина),
предоставленные инфекционной больницей №2 г. Нижнего Новгорода.
.1 Ферменты и биопрепараты
Дезоксинуклеозидтрифосфаты в
растворе - смесь 4-х дНТФ, по 2 мМ каждого из дНТФ (Fermentas, Латвия); Taq -
ДНК полимераза, укомплектованная 10Xбуфером (ООО «Генные и клеточные
технологии», Россия, Н.Новгород); M-MuLV обратная транскриптаза,
укомплектованная 5Xбуфером (Promega, США).
.2 Выделение тотальной РНК
(Chomczynski et al., 1987)
Образцы периферической крови
здоровых доноров были помещены в пластиковую пробирку (типа «Eppendorf») и
подвергались лизированию. К 200 мкл лизирующего раствора (6М ГИТЦ, 1% Тритон
X100, 100мМ ацетат Na, pH 7.0, 2% β-меркаптоэтанол) добавлялся такой же объем периферической крови и
перемешивался. Затем добавлялось 200 мкл смеси водонасыщенного фенола с
хлороформом (1/1 pH 5.0). Смесь интенсивно перемешивалась на миксере «Rotamix
RM-1» (ELMI, Латвия). Для разделения фракций проба центрифугировалась на
микроцентрифуге «Eppendorf MiniSpinPlus» при 14.5 тыс. об./мин в течение 15
минут. 200 мкл водной фазы отбиралось в чистую пробирку, депротеинизированная
РНК преципитировалась 200 мкл изопропилового спирта (20-60 минут при -20˚С).
РНК осаждали центрифугированием на микроцентрифуге «Eppendorf MiniSpinPlus» при
15 тыс об./мин в течение 20 минут. Осадок промывался 800 мкл 75% этанола,
центрифугировался 5 минут и сушился при комнатной температуре (или при 60˚C
в термостате) до исчезновения запаха спирта. Очищенная РНК ресуспендировалась в
20 мкл деионизированной воды, свободной от РНКаз и хранилась в холодильнике при
-20˚C до использования (не более 2 недель)
.3 Полимеразная цепная реакция
(Дейвис, 1990)
Для проведения ПЦР готовили
необходимое количество реакционной смеси для анализа необходимого числа проб в
пропорциях, представленных в таблице 1. Для устранения погрешности, вносимой
дозаторами при смешивании микрообъемов, общую смесь готовили из расчета на одну
пробу больше, чем необходимо.
Таблица 1 Состав реакционной смеси
для проведения ПЦР
|
Количество проб
|
1
|
2
|
3
|
4
|
5
|
|
10XБуфер (мкл)
|
2,5
|
5
|
7,5
|
10
|
12,5
|
|
dNTP(мкл)
|
2
|
4
|
6
|
8
|
10
|
|
F-праймер (GR-20)(мкл)
|
0,5
|
1
|
1,5
|
2
|
2,5
|
|
Tag-pol(мкл)
|
0,5
|
1
|
1,5
|
2
|
2,5
|
|
2d H2O(мкл)
|
17
|
34
|
51
|
68
|
85
|
|
R-праймер (Fas-OF) (мкл)
|
0,5
|
1
|
1,5
|
2
|
2,5
|
Смесь тщательно перемешивали на
миксере «Rotamix RM-1» (ELMI, Латвия), кратко центрифугировали в
микроцентрифуге «Eppendorf Centrifuge 5414» при 14 тыс. об/мин.
В маркированные пробирки объемом 0.5
мл вносили по 23 мкл полученной реакционной смеси и по 2 мкл ДНК, полученной в
результате реакции обратной транскрипции. Компоненты перемешивали на миксере
«Rotamix RM-1» (ELMI, Латвия), смесь кратко центрифугировали в микроцентрифуге
«Eppendorf Centrifuge 5414» при 14 тыс. об/мин. Для предотвращения испарения
жидкости реакционную смесь покрывали двумя каплями минерального масла.
Реакционную смесь инкубировали в амплификаторе «Терцик» («ДНК-Технология»,
Россия) по программе Fas Hot Start.
Условия инкубации реакционной смеси
в амплификаторе «Терцик»:
для однонуклеотидного полиморфизма
Fas -670 (A/G):
ºС
- 30с
65ºС - 30с 45 циклов
72ºС - 40с
для однонуклеотидного полиморфизма
Fas -1377 (A/G):
ºС
- 30с
67,5ºС - 40с 45 циклов
72ºС - 30с
Для выявления полиморфизмов были
использованы праймеры, нуклеотидная последовательность которых показана в
таблицах 2 и 3. Также указана первичная структура праймеров для амплификации
промоторного участка гена Fas (таблица 4).
Таблица 2 Структура праймеров для амплификации
промоторного участка гена Fas, содержащего олигонуклеотидный полиморфизм
Fas-670A\G
Нуклеотидная последовательность (5´-3´)
|
|
Fas ОНП F (A)
|
5'-ggTTAACTgTCCATTCCAgA-3'
|
|
Fas ОНП F(G) alt
|
5'-ggTTAACTgTCCATTCCAgg -3'
|
|
Fas ОНП R
|
5'-TggCATgCTCACTTCAggTg -3'
|
Таблица 3 Структура праймеров для
амплификации промоторного участка гена Fas, содержащего олигонуклеотидный
полиморфизм Fas-1377A\G
|
ПраймерыНуклеотидная последовательность (5´-3´)
|
|
|
Fas ОНП 1377 F A)
|
5'-TgTgTgCACAAggCTggCACA -3'
|
|
Fas ОНП 1377 F(G)
|
5'-TgTgTgCACAAggCTggCACg -3'
|
|
Fas ОНП R
|
5'-TCTgCACCTCACTCTgCAACCT -3'
|
Таблица 4 Первичная структура
праймеров для амплификации промоторного участка гена Fas, содержащего
олигонуклеотидный полиморфизм Fas-670A\G
|
Праймер
|
Нуклеотидная последовательность 5’- 3’
|
|
FasFp
|
AgTgTgTCCAgTCTggAACT
|
|
FasRp
|
CgAggTAACTAAgTCgTTgA
|
Результаты реакции анализировали
методом электрофореза в агарозном геле.
.4 Визуализация результатов ПЦР
методом электрофореза нуклеиновых кислот в 1,5% агарозном геле (Maniatis, 1982)
Готовили 1,5%-ный агарозный гель с
лунками для внесения проб. Для этого 1,5 г агарозы разводили в 100 мл рабочего
трис-ацетатного буферного раствора (24,2 г трис-(гидрокси)аминометана, 5,7 мл
ледяной уксусной кислоты, 10 мл 0,5 М раствора этилендиаминотетрауксусной
кислоты, pH 8.0) и добавляли 10мкл 10%-ного водного раствора бромида этидия.
Суспензию нагревали на водяной бане до полного растворения агарозы,
периодически помешивая. Раствору давали остыть примерно до 50˚С и заливали
в форму для агарозного блока, вставляли гребенку для образования лунок и давали
агарозе застыть до состояния геля.
Из-под слоя масла отбирали 10 мкл
раствора амплифицированной ДНК и смешивали с 10 мкл буферного раствора для
нанесения проб (50% глицерина, 0,25% бромфенолового синего в дистиллированной
воде). Полученную смесь переносили в лунки геля. Камеру для электрофореза
«Helicon» (г. Москва) подключали к источнику питания «Эльф-2» (Россия),
соблюдая полярность. Проводили электрофорез в течение 15 минут при напряжении
200 вольт (краситель должен пройти не менее 2 см геля). Отключали ток. Помещали
гель в окно трансиллюминатора «Biokom UVT-1» (Франция). Результат
регистрировали с использованием системы видеодокументирования «VITRan».
Статистическую обработку полученных
результатов проводили с помощью пакета программ Statistica v. 8.0. Данные
представляли в виде относительных и абсолютных частот. Анализ различий частот
признаков в группах проводили с использованием критерия % и двустороннего теста
точного критерия Фишера. Различия считали статистически значимыми при
р<0.05.
3. Результаты и их обсуждение
По данным литературы известны
ассоциации частот генотипов ОНП Fas-670A/G ОНП Fas-1377A/G в промоторной части
гена Fas с различными заболеваниями. Среди населения, проживающего на
территории Российской Федерации, не проводилось исследований по выявлению
частот генотипов ОНП Fas-670A/G ОНП Fas-1377A/G в промоторной области гена Fas,
что определяет практическую значимость данного исследования.
Анализ аллельных вариаций в составе
ОНП Fas -670A/G, Fas -1377G/A проводился методом аллель-специфической ПЦР с
помощью олигонуклеотидных праймеров.
Продукты реакции детектировали с
помощью электрофореза в 1.5 % агарозном геле, содержащем флуоресцентный краситель
бромид этидия.
На первом этапе настоящего
исследования проводилось генотипирование образцов периферической крови здоровых
доноров, больных раком толстого кишечника и герпесвирусной инфекцией по ОНП
Fas-670A/G.
Результаты исследований генотипов
ОНП Fas-670A/G представлены в таблице 5.
Таблица 5 Частота генотипов
однонуклеотидного полиморфизма Fas-670A/G в клетках периферической крови
больных раком толстого кишечника, герпесвирусной инфекцией и здоровых доноров
|
Тип образцов
|
Генотипы гена Fas
|
Частота генотипов ОНП Fas-670A/G
|
|
Здоровые доноры n = 51
|
гомозигота AА
|
3,9%
|
|
гомозигота GG
|
35,3%
|
|
гетерозигота AG
|
60,8%
|
|
Рак толстого кишечника n = 44
|
гомозигота AА
|
0%
|
|
гомозигота GG
|
0%*
|
|
гетерозигота AG
|
100%*
|
|
Герпесвирусная инфекция n = 35
|
гомозигота AА
|
8,6%
|
|
гомозигота GG
|
14,3%*
|
|
гетерозигота AG
|
77,1%
|
* - статистически значимые различия
по сравнению со здоровыми донорами (р<0,05)
У здоровых доноров частота генотипа
FAS-670AA составляла 3,9%, генотипа FAS-670AG -60,8%, генотипа FAS-670GG
-35,3%.
Генотип FAS-670AG встречался у всех
44 больных раком толстого кишечника (100%). У больных герпесвирусной инфекцией
частота генотипа FAS-670AA составляла 8,6%, генотипа FAS-670AG - 77,1%,
генотипа FAS-670GG - 14,3%.
Исследовали частоты генотипов
Fas-670A/G в клетках периферической крови больных раком толстого кишечника,
герпесвирусной инфекцией и здоровых доноров. Было показано, что у больных раком
толстого кишечника частота генотипа -670AG статистически значимо (в 1,65 раза)
была выше по сравнению со здоровыми донорами (р<0,001). При этом у больных
герпесвирусной инфекцией частота генотипа -670GG была в 2,5 раза ниже (p=0,034)
(рис.3).

Рис.3. Частота генотипов Fas-670A/G
в клетках периферической крови больных раком толстого кишечника и
герпесвирусной инфекцией
* - статистически значимые различия
(р<0,05) по сравнению со здоровыми донорами
Исследовали также частоты генотипов
ОНП Fas-670A/G у мужчин и женщин, больных раком толстого кишечника,
герпесвирусной инфекцией и у здоровых доноров. Результаты исследований
представлены в таблице 6.
Таблица 6 Частота генотипов
однонуклеотидного полиморфизма Fas-670A/G в клетках периферической крови мужчин
и женщин, больных раком толстого кишечника, герпесвирусной инфекцией и здоровых
доноров
|
Пол
|
Тип образцов
|
Генотипы гена Fas
|
|
Мужчины
|
Здоровые доноры n = 9
|
гомозигота AА
|
0%
|
|
|
гомозигота GG
|
11,1%
|
|
|
гетерозигота AG
|
88,9%
|
|
Рак толстого кишечника n = 18
|
гомозигота AА
|
0%
|
|
|
гомозигота GG
|
0%
|
|
|
гетерозигота AG
|
100%
|
|
Герпесвирусная инфекция n = 21
|
гомозигота AА
|
5%
|
|
|
гомозигота GG
|
14,3%
|
|
|
гетерозигота AG
|
80,7%
|
|
Женщины
|
Здоровые доноры n = 42
|
гомозигота AА
|
4,8%
|
|
|
гомозигота GG
|
40,5%
|
|
|
гетерозигота AG
|
54,8%
|
|
Рак толстого кишечника n = 26
|
гомозигота AА
|
0%
|
|
|
гомозигота GG
|
0%*
|
|
|
гетерозигота AG
|
100%*
|
|
Герпесвирусная инфекция n = 14
|
гомозигота AА
|
14,3%
|
|
|
гомозигота GG
|
14,3%
|
|
|
гетерозигота AG
|
71,4%
|
* - статистически значимые различия
по сравнению со здоровыми донорами (р<0,05)
При сравнении фрагмента генома мужчин,
больных раком толстого кишечника и герпесвирусной инфекцией, со здоровыми не
выявлены статистически значимые различия по частотам как гомозигот AА и GG, так
и гетерозигот AG по ОНП Fas-670A/G (рис.4).
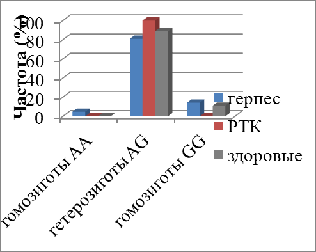
Рис.4. Частота генотипов Fas-670A/G
в клетках периферической крови мужчин, больных раком толстого кишечника и
герпесвирусной инфекцией
По сравнению со здоровыми донорами у
женщин, больных раком толстого кишечника, частота генотипа -670AG статистически
значимо (в 1,83 раза) была выше (р<0.001). При этом генотипы -670АА и -670GG
в образцах крови онкологических больных не выявлялись (рис.5).

Рис.5. Частота генотипов Fas-670A/G
в клетках периферической крови женщин, больных раком толстого кишечника и
герпесвирусной инфекцией
* - статистически значимые различия
(р<0,05) по сравнению со здоровыми женщинами
При сравнении мужчин и женщин,
больных раком толстого кишечника, а также мужчин и женщин, больных
герпесвирусной инфекцией, и здоровых мужчин и женщин не было обнаружено
статистически значимых различий по частотам как гомозигот AА и GG, так и
гетерозигот AG по ОНП Fas-670A/G.
На следующем этапе настоящего
исследования проводилось генотипирование образцов периферической крови здоровых
доноров, больных раком толстого кишечника и герпесвирусной инфекцией ОНП
Fas-1377AG. Результаты представлены в таблице 7.
Таблица 7 Частота генотипов
однонуклеотидного полиморфизма Fas-1377A/G в клетках периферической крови
больных раком толстого кишечника, герпесвирусной инфекцией и здоровых доноров
|
Тип образцов
|
Генотипы гена Fas
|
Частота генотипов ОНП Fas-1377A/G
|
|
Здоровые доноры n = 46
|
гомозигота AА
|
2,2%
|
|
гомозигота GG
|
30,4%
|
|
гетерозигота AG
|
67,4%
|
|
Рак толстого кишечника n = 36
|
гомозигота AА
|
22,2%
|
|
гомозигота GG
|
36,1%
|
41,7%*
|
|
Герпесвирусная инфекция n = 29
|
гомозигота AА
|
13,8%
|
|
гомозигота GG
|
65,5%*
|
|
гетерозигота AG
|
20,7%*
|
* - статистически значимые различия
по сравнению со здоровыми донорами (р<0,05)
У здоровых доноров частота генотипа
FAS-1377AA составляла 2,2%, генотипа FAS-1377AG -67,4%, генотипа FAS-1377GG
-30,4%.
Генотип FAS-1377AA встречался у
22,2% больных раком толстого кишечника, генотип FAS-1377AG - у 41,7%, генотип
FAS-1377GG - у 36,1%. У больных герпесвирусной инфекцией частота генотипа
FAS-1377AA составляла 13,8%, генотипа FAS-1377AG - 20,7%, генотипа FAS-1377GG -
65,5%. Было выявлено, что при сравнении со здоровыми донорами у больных раком
толстого кишечника частота генотипа Fas-1377AG статистически значимо была ниже
в 1,62 раза (р=0,03). В отношении других генотипов статистически значимых
различий обнаружено не было; по сравнению со здоровыми донорами у больных
герпесвирусной инфекцией частота генотипа Fas-1377GG статистически значимо (в
2,2 раза) была выше (p=0,004). Наряду с этим генотип -1377АG детектировался
реже в 3,26 раза, чем у здоровых доноров (р=0,002) (рис.6).
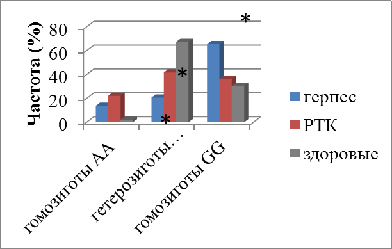
Рис.6. Частота генотипов Fas-1377A/G
в клетках периферической крови больных раком толстого кишечника и
герпесвирусной инфекцией
* - статистически значимые различия
(р<0,05) по сравнению со здоровыми донорами
Исследовали также частоты генотипов
ОНП Fas-1377A/G у мужчин и женщин, больных раком толстого кишечника и
герпесвирусной инфекцией, и у здоровых доноров. Результаты исследований
представлены в таблице 8.
Таблица 8 Частота генотипов
однонуклеотидного полиморфизма Fas-1377A/G в клетках периферической крови
мужчин и женщин, больных раком толстого кишечника, герпесвирусной инфекцией, и
здоровых доноров
|
Пол
|
Тип образцов
|
Генотипы гена Fas
|
Частота генотипов Fas-1377A/G
|
|
Мужчины
|
Здоровые доноры n = 9
|
гомозигота AА
|
0%
|
|
|
гомозигота GG
|
22,2%
|
|
|
гетерозигота AG
|
77,8%
|
|
Рак толстого кишечника n = 18
|
гомозигота AА
|
27,8%
|
|
|
гомозигота GG
|
27,8%
|
|
|
гетерозигота AG
|
44,4%
|
|
Герпесвирусная инфекция n = 19
|
гомозигота AА
|
15,8%
|
|
|
гомозигота GG
|
57,9%
|
|
|
гетерозигота AG
|
26,3%*
|
|
Женщины
|
Здоровые доноры n = 37
|
гомозигота AА
|
2,7%
|
|
|
гомозигота GG
|
32,4%
|
|
|
гетерозигота AG
|
64,9%
|
|
Рак толстого кишечника n = 18
|
гомозигота AА
|
16,7%
|
|
|
гомозигота GG
|
44,4%
|
|
|
гетерозигота AG
|
38,9%*
|
|
Герпесвирусная инфекция n = 10
|
гомозигота AА
|
10%
|
|
|
гомозигота GG
|
80%*
|
|
|
гетерозигота AG
|
10%*
|
* - статистически значимые различия
по сравнению со здоровыми донорами (р<0,05)
По сравнению со здоровыми донорами у
мужчин, больных герпесвирусной инфекцией, частота генотипа -1377АG
детектировалась на реже в 2,96 раза (р = 0,016) (рис.7).
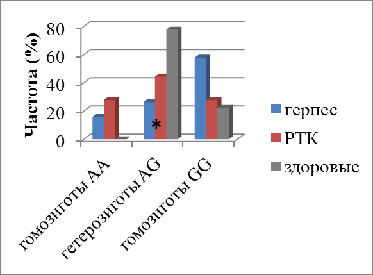
Рис.7. Частота генотипов Fas-1377A/G
в клетках периферической крови мужчин, больных раком толстого кишечника и
герпесвирусной инфекцией
* - статистически значимые различия
(р<0,05) по сравнению со здоровыми мужчинами
По сравнению со здоровыми донорами у
женщин, больных раком толстого кишечника, частота генотипа Fas-1377AG
статистически значимо (в 1,67 раза) была ниже (р=0,03). В отношении других
генотипов статистически значимых различий обнаружено не было.
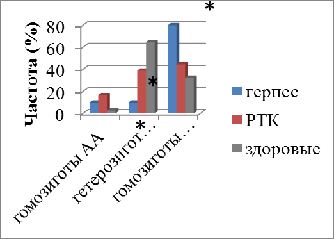
Рис.8. Частота генотипов Fas-1377A/G
в клетках периферической крови женщин, больных раком толстого кишечника и
герпесвирусной инфекцией
* - статистически значимые различия
(р<0,05) по сравнению со здоровыми женщинами
fas ген полиморфизм промоторный
При сравнении мужчин и женщин,
больных раком толстого кишечника, герпесвирусной инфекцией и здоровых мужчин и
женщин не было обнаружено статистически значимых различий по частотам как
гомозигот AА и GG, так и гетерозигот AG по ОНП Fas-1377A/G.
Полученные результаты показали, что
некоторые частоты генотипов однонуклеотидных полиморфизмов -670A/G и -1377G/A у
больных раком толстого кишечника и герпесвирусной инфекцией отличаются от
соответствующих значений частот генотипов здоровых доноров, что может
свидетельствовать о влиянии наличия соответствующих аллельных вариантов
генотипов на предрасположенность к данным заболеваниям. Кроме этого, были
выявлены статистически значимые различия частот некоторых исследованных генотипов
у мужчин и женщин с данными патологиями, что позволяет предположить о том, что
наличие исследованных генотипов по-разному влияет на предрасположенность к
данным заболеваниям у мужчин и женщин.
У пациентов с герпесвирусной
инфекцией частоты генотипов Fas -670A/G не отличались от частот соответствующих
генотипов здоровых доноров. В то же время у всех больных раком толстого
кишечника был выявлен только генотип FAS-670AG, что в 1,65 раза выше по
сравнению со здоровыми донорами. Частоты генотипов FAS-670AG, выявленные в
нашем исследовании, отличались от частот соответствующих генотипов,
представленных в литературе (Hofflman et al., 2009), где частоты генотипов были
более равномерными между собой (FAS -670AA 24,2%, FAS -670AG - 46,3%, FAS
-670GG - 29,5%), что, с одной стороны, отражает особенности частот генотипов в
разных популяциях, а, с другой стороны, может являться особенностью данной
патологии.
Не было выявлено различий между
частотами генотипов FAS-670AG у мужчин и женщин с раком толстого кишечника. Тем
не менее, было показано, что по сравнению со здоровыми донорами, у женщин,
больных раком толстого кишечника, частота генотипа FAS-670AG выше в 1,83 раза
при этом у мужчин таких особенностей выявлено не было. Данные говорят о
различном влиянии наличия генотипов FAS-670AG у мужчин и женщин на
предрасположенность к данной патологии.
У больных раком толстого кишечника
частоты генотипов FAS-1377A/G не отличались от здоровых доноров. У больных
герпесвирусной инфекцией частота генотипа Fas-1377 GG была в 2,2 раза выше по
сравнению со здоровыми донорами, при этом у мужчин частота генотипа -1377АG
была в 2,96 раза ниже по сравнению со здоровыми донорами, а у женщин, больных
герпесвирусной инфекцией, частота генотипа Fas-1377GG в 2,5 раза выше, чем у
здоровых доноров. Таким образом, в отличие от рака толстого кишечника, частота
генотипов FAS-1377A/G у больных герпесвирусной инфекцией различна как по
сравнению со здоровыми донорами, так и у мужчин и женщин по сравнению друг с
другом.
Выводы
. Выявлено, что у здоровых доноров частота генотипа FAS-670AA составляла 3,9%,
генотипа FAS-670AG -60,8%, генотипа FAS-670GG -35,3%; частота генотипа
FAS-1377AA составляла 2,2%, генотипа FAS-1377AG -67,4%, генотипа FAS-1377GG
-30,4%.
. Установлено, что генотип FAS-670AG
встречался у всех 44 больных раком толстого кишечника (100%). Генотип
FAS-1377AA встречался у 22,2% больных раком толстого кишечника, генотип
FAS-1377AG - у 41,7%, генотип FAS-1377GG - у 36,1%. По сравнению со здоровыми
донорами у больных раком толстого кишечника частота генотипа -670AG
статистически значимо в 1,65 раза была выше.
. Показано, что у больных
герпесвирусной инфекцией частота генотипа FAS-670AA составляла 8,6%, генотипа
FAS-670AG - 77,1%, генотипа FAS-670GG - 14,3%.; частота генотипа FAS-1377AA
составляла 13,8%, генотипа FAS-1377AG - 20,7%, генотипа FAS-1377GG - 65,5%. При
сравнении со здоровыми донорами у больных герпесвирусной инфекцией частота
генотипа Fas-1377GG статистически значимо в 2,2 раза была выше.
. При сравнении фрагмента генома
мужчин, больных раком толстого кишечника и герпесвирусной инфекцией, со
здоровыми не выявлены статистически значимые различия по частотам как гомозигот
AА и GG, так и гетерозигот AG по ОНП Fas-670A/G. У мужчин, больных
герпесвирусной инфекцией, частота генотипа -1377АG детектировалась реже в 2,96
раза в сравнении со здоровыми донорами.
. По сравнению со здоровыми донорами
у женщин, больных раком толстого кишечника, частота генотипа -670AG
статистически значимо в 1,83 раза была выше. У женщин, больных герпесвирусной
инфекцией, частота генотипа Fas-1377GG статистически значимо в 2,5 раза выше,
чем у здоровых доноров.
Цитированная литература
1. Барышников А.Ю., Шишкин Ю.В. Иммунологические проблемы
апоптоза. - М.: Эдиториал УССР, 2002. - 320с.
. Льюин Б. Гены: Пер. с англ.- М.:Мир,-1987-544с
. Фогель Ф., Мотульски А. Генетика человека: в 3-х т. Т.2.
Пер. с англ.- М.: Мир-1990-378с
. Arasteh J.M., Sarvestani E.K., Aflaki E., Amirghofran Z.
Fas gene polymorphisms in systemic lupus erythematosus and serum levels of some
apoptosis-related molecules. // Int. J. Gynecol. Cancer. 2006. Vol.16. P.
179-182.
. Arnold P. What are Single Nucleotide Polymorphisms? //
Int. J. Cancer. 2008. Vol. 103. P. 221-225.
. Bel Hadj Jrad B. A polymorphism in FAS gene promoter
associated with increased risk of nasopharyngeal carcinoma and correlated with
anti-nuclear autoantibodies induction. // Cancer Lett. 2006. Vol. 233. P.
21-27.
. Ben Aleya W., Sfar I., Mouelhi L. et al. Association of
Fas/Apo1 gene promoter (-670 A/G) polymorphism in Tunisian patients with IBD.
// World J. Gastroenterol. 2009. Vol. 15, №29. P. 3643-3648.
. Cao Y., Miao X.P., Huang M.Y. et al. Polymorphisms of
death pathway genes FAS and FASL and risk of nasopharyngeal carcinoma. // Mol.
Carcinog. 2010. Vol. 49, №11. P. 944-950.
. Crew K.D. et al. Genetic polymorphisms in the
apoptosis-associated genes FAS and FASL and breast cancer risk. //
Carcinogenesis. 2007. Vol. 28. P. 2548-2551.
. Dybikowska A., Sliwinski W., Emerich J., Podhajska A.J.
Evaluation of Fas gene promoter polymorphism in cervical cancer patients. //
Int J. Mol. Med. 2004. Vol. 14, №3. P. 475-478.
. Erdogan M. et al. Fas/Fas ligand gene polymorphism in
patients with papillary thyroid cancer in the Turkish population. // J.
Endocrinol. Invest. 2007. Vol. 30. P. 411-416.
. Farre L., Bittencourt A.L., Silva-Santos G. et al. Fas
670 promoter polymorphism is associated to susceptibility, clinical
presentation, and survival in adult T cell leukemia. // Virus Res. 2012. Vol.
163, №1. P. 178-182.
. Gormus U. et al. Fas-1377 A/G polymorphism in lung
cancer. // In Vivo. 2007. Vol. 21. P. 663-666.
. Gormus U. et al. Fas-1377A/G and FasL-844 T/C gene
polymorphisms and epithelial ovarian cancer. // Anticancer Res. 2007. Vol. 27.
P. 991-994.
. Hsu P.I. et al. Polymorphisms of death pathway genes FAS
and FASL and risk of premalignant gastric lesions. // Anticancer Res. 2008.
Vol. 28. P. 97-103.
. Huang Q.R., Morris D., Manolios N. Identification and
characterization of polymorphisms in the promoter region of the human Apo-1/Fas
(CD95) gene. // Mol. Immunol. 1997. Vol. 34. P. 577-582.
. Ikehara S.K. et al. A polymorphism of C-to-T substitution
at -31 IL1B is associated with the risk of advanced gastric adenocarcinoma in a
Japanese population. // J. Hum. Genet. 2006. Vol. 51. P. 927-933.
. Kanemitsu S., Ihara K., Saifddin A. et al. A functional
polymorphism in Fas (CD95/APO-1) gene promoter associated with systemic lupus
erythematosus. // J. Rheumatol. 2002. Vol. 29. P. 1183-1188.
. Koshkina N.V. et al. Exploratory analysis of Fas gene
polymorphisms in pediatric osteosarcoma patients. // J. Pediatr. Hematol.
Oncol. 2007. Vol. 29. P. 815-821.
. Krippl P., Langsenlehner U., Renner W. et al.
Polymorphisms of Death Pathway Genes FAS and FASL in Esophageal Squamous-Cell
Carcinoma. // J. Nat. Cancer Inst. 2004. Vol. 96, №19. Р. 1478-1479.
. Lai H.C. et al. Genetic polymorphisms of FAS and FASL
(CD95/CD95L) genes in cervical carcinogenesis: an analysis of haplotype and
gene-gene interaction. // Gynecol. Oncol. 2005. Vol. 99. P. 113-118.
. Lai H.C. et al. Single nucleotide polymorphism at Fas
promoter is associated with cervical carcinogenesis. // Int. J. Cancer. 2003.
Vol. 103. P. 221-225.
. Lei D., Sturgis E. M., Wang L.-E. et al. FAS and FASLG
Genetic Variants and Risk for Second Primary Malignancy in Patients with
Squamous Cell Carcinoma of the Head and Neck. // Cancer Epidemiol. Biomarkers
Prev. 2010. Vol. 19. P. 1484-1491.
. Li C. et al. Functional polymorphisms in the promoter
regions of the FAS and FAS ligand genes and risk of bladder cancer in south
China: a case-control analysis. // Pharmacogenet. Genomics. 2006. Vol. 16. P.
245-251.
. Li C. et al. Polymorphisms of the FAS and FAS ligand
genes associated with risk of cutaneous malignant melanoma. // Pharmacogenet.
Genomics. 2006. Vol. 16 P. 253-263.
. Lima L. et al. Association between FAS polymorphism and
prostate cancer development. // Prostate Cancer Prostatic Dis. 2008. Vol. 11.
P. 94-98.
. Lima L., Calais da Silva F. M., Calais da Silva F. E. et
al. Fas-670 polymorphism and prostate cancer. // J. Clin. Onc. 2007. Vol.25,
№18. Р. 21028.
. Marín L.A., Muro M., Moya-Quiles M.R. et al. Study of Fas (CD95) and
FasL (CD178) polymorphisms in liver transplant recipients. // Tissue Antigens.
2006. Vol. 67, №2. P. 117-126.
. Melville B. What are ОНП? // Eur. J. Hum. Genet. 2000.
Vol. 8, №2. Р. 154-165.
. Nelson H.H. et al. Fas/APO-1 promoter polymorphism is not
associated with non-melanoma skin cancer. // Cancer Epidemiol. Biomarkers Prev.
2001. Vol. 10. P. 809-810.
. Norrgard K., Schultz J. et al. Natural selection has
driven population differentiation in modern humans. // Nature Genetics. 2008.
Vol. 40. P. 340-345.
. Park S.H. et al. Polymorphisms in the FAS and FASL genes
and risk of lung cancer in a Korean population. // Lung Cancer. 2006. Vol. 54.
P. 303-308.
. Pengfei S., Qi D., Chao Q. et al. Functional
polymorphisms in cell death pathway genes FAS and FAS ligand and risk of
prostate cancer in a Chinese population. // The Prostate. 2011.Vol. 71, №10. P.
1122-1130.
. Sibley K. et al. Functional FAS promoter polymorphisms
are associated with increased risk of acute myeloid leukemia. // Cancer Res.
2003. Vol. 63. P. 4327-4330.
. Smith K., Lancia G., Lippert R., Schwartz R. ОНП
Problems, Complexity and Algorithms. // LNCS. 2002. Vol. 2161. P. 182-193.
. Sun T. et al. FASL -844C polymorphism is associated with
increased activation-induced T cell death and risk of cervical cancer. // J.
Exp. Med. 2005. Vol. 202. P. 967-974.
. Sun T. et al. Polymorphisms of death pathway genes FAS
and FASL in esophageal squamous-cell carcinoma. // J. Natl. Cancer Inst. 2004.
Vol. 96. P. 1030-1036.
. Sziller I., Nguyen D., Halmos A. et al. An A>G
polymorphism at position −670 in the Fas (TNFRSF6) gene in pregnant women
with pre-eclampsia and intrauterine growth restriction. // Mol. Hum. Reprod.
2005. Vol.11, №3. Р. 207-210.
. Tamandani D.M. et al. Association of Fas-670 gene
polymorphism with risk of cervical cancer in North Indian population. // Clin.
Exp. Obstet. Gynecol. 2008. Vol. 35. P. 183-186.
. Ter-Minassian M. et al. Apoptosis gene polymorphisms,
age, smoking and the risk of non-small cell lung cancer. // Carcinogenesis.
2008. Vol. 29. P. 2147-2152.
. Ueda M. et al. Fas gene promoter -670 polymorphism (A/G)
is associated with cervical carcinogenesis. // Gynecol. Oncol. 2005. Vol. 98.
P. 129-133.
. Ueda M. et al. Fas gene promoter -670 polymorphism in
gynecological cancer. // Int. J. Gynecol. Cancer. 2006. Vol. 16. P. 179-182.
. Vallinoto A.C., Santana B.B., Dos Santos E.L. et al. FAS
-670A/G single nucleotide polymorphism may be associated with human T lymphotropic
virus-1 infection and clinical evolution to TSP/HAM. // Eur. J. Gynaecol.
Oncol. 2009. Vol. 30, №2. P. 142-144.
. Wang L.E. et al. Fas A670G polymorphism, apoptotic
capacity in lymphocyte cultures, and risk of lung cancer. // Lung Cancer. 2003.
Vol. 42. P. 1-8.
. Yang M. et al. Functional variants in cell death pathway
genes and risk of pancreatic cancer. // Clin. Cancer Res. 2008. Vol. 14. P.
3230-3236.
. Zhang B., Sun T., Xue L. et al. Functional polymorphisms
in FAS and FASL contribute to increased apoptosis of tumor infiltration
lymphocytes and risk of breast cancer. // Carcinogenesis. 2007. Vol. 28, №5. P.
1067-1073.
. Zhang H. et al. Importance of FAS-1377, FAS-670, and
FASL-844 polymorphisms in tumor onset, progression, and pigment phenotypes of
Swedish patients with melanoma: a case-control analysis. // Cancer J. 2007.
Vol. 13. P. 233-237.
. Zhang X., Miao X., Sun T. et al. Functional polymorphisms
in cell death pathway genes FAS and FASL contribute to risk of lung cancer. //
J. of Med. Genet. 2005. Vol. 42, №6. P. 479-484.
. Zhang Z. et al. Polymorphisms of FAS and FAS ligand genes
involved in the death pathway and risk and progression of squamous cell
carcinoma of the head and neck. // Clin. Cancer Res. 2006. Vol. 12. P.
5596-5602.
. Zhang Z., Xue H., Gong W. et al. FAS promoter
polymorphisms and cancer risk: a meta-analysis based on 34 case-control
studies.// Carcin. 2009. Vol. 30, №3. Р.487-493.
. Zhou R.M., Wang N., Chen Z.F. et al. Polymorphisms in
promoter region of FAS and FASL gene and risk of cardia gastric adenocarcinoma.
// J. Gastroenterol. Hepatol. 2010. Vol. 25, №3. P. 555-561.
. Zhu Q., Wang T., Ren J. et al. FAS-670A/G polymorphism: A
biomarker for the metastasis of nasopharyngeal carcinoma in a Chinese
population. Clin. Chim. Acta. 2010. Vol. 411, №3, 4. P.179-183.
. Zoodsma M. et al. Interleukin-10 and Fas polymorphisms
and susceptibility for (pre)neoplastic cervical disease. // Int. J. Gynecol.
Cancer 2005. Vol. 15. P. 282-290.
. Zucchi F., da Silva I.D., Ribalta J.C. et al. Fas/CD95
promoter polymorphism gene and its relationship with cervical carcinoma. //
Immunol. Invest. 2010. Vol. 39, №1. P. 27-38.