Физиология возбудимых тканей. Механизмы регуляций физиологических функций
Приднестровский
государственный университет
им.
Т.Г. Шевченко
Медицинский
факультет
Кафедра
физиологии и фармакологии
Методические
указания к лабораторным занятиям по нормальной физиологии (для студентов II
курса)
тема:
Физиология возбудимых тканей. Механизмы регуляций физиологических функций
Тирасполь,
2007
Краткая аннотация
Методические указания помогают студентам в
изучении основных вопросов теории, акцентируют внимание на наиболее важных
понятиях.
Данные методические указания включают в себя все
необходимые разделы: теоретическое обоснование, подробное описание хода
лабораторных работ, целью которых является практическое закрепление полученных
теоретических знаний.
Тема №1. Предмет физиологии, задачи
практикума по физиологии. Методы физиологического исследования и регистрации
физиологических функций
Первое занятие по практическому курсу проводится
преподавателем в виде беседы и демонстрации аппаратуры и некоторых
экспериментальных приемов, используемых в физиологии.
План занятия:
1. Знакомство студентов с порядком работы
на практических занятиях и с соблюдением техники безопасности.
2. Изучение методов физиологических
исследований.
. Знакомство с аппаратурой для
раздражения и регистрации физиологических функций.
. Приготовление нервно-мышечного
препарата.
. Оформление протокола занятий.
Оснащение занятия:
кимограф, миограф, рычажок Энгельмана, электростимулятор, электроды, провода,
препаровальный набор, лягушка, салфетка, лоток, раствор Рингера.
Основные положения, с которыми
преподаватель знакомит студентов:. А. Студенты
приходят на практические занятия в белом халате и в шапочке. Опоздания
категорически запрещаются.
Б. За каждой группой студентов закрепляется
рабочее место, на котором в течение всего года должны соблюдаться чистота,
порядок, а также бережное отношение к мебели и инвентарю кафедры.
В. Студент обязан заранее ознакомиться с темой
предстоящего занятия и изучить теоретический материал согласно разработанным
вопросам.
Перед выполнением практических работ проводится
собеседование для определения уровня знаний студентов по теоретическому
материалу.
Все практические занятия должны приобретать
характер небольшой научно-исследовательской работы, подтверждающей положение
теоретического курса. Каждому студенту следует активно участвовать в
экспериментах, проявлять творческий и исследовательский интерес.
Для выполнения работы дежурный студент получает
у лаборанта кафедры необходимые инструменты, аппараты, животных и т.д. По
окончании занятий студенты убирают рабочие места, моют инструменты, а дежурный
сдает полученные аппараты.
Приступая к выполнению экспериментальных работ,
студент должен в первую очередь ознакомиться с правилами техники безопасности,
которые изложены в настоящей методической разработке, и расписаться в журнале.
После завершения работы студенты оформляют
протокол, который подписывается преподавателем в конце занятия. Оформляются
протоколы в специальной толстой тетради, на обложке которой студент указывает
фамилию, имя, отчество, номер группы и факультет. Протокольные записи ведутся
аккуратно черными чернилами или пастой, рисунки выполняются цветными
карандашами или фломастерами. При сдаче экзамена студент представляет
экзаменатору свою протокольную тетрадь.
Ход работы
В данном разделе протокола студент дает краткое
описание проделанной работы и наблюдений, вписывает полученные результаты,
которые сопровождаются схемами, рисунками, таблицами, графиками, вклеивает
кимограммы и другие материалы, полученные при регистрации физиологических
функций.
Усвоение материала по каждому разделу
определяется на итоговых занятиях, которые проводятся в соответствии с учебным
рабочим планом кафедры. Оценки, полученные студентами, заносятся в журнал и
сохраняются до экзамена.
Пропущенные по уважительным причинам занятия
отрабатываются во внеурочное время в соответствии с графиком, установленном
кафедрой.
Примечание:
Первую часть протокола, до раздела «Ход работы», студент заполняет до начала
занятия (на основании настоящего руководства и плана практических занятий
кафедры).
Правила по технике безопасности при
работе в физиологической лаборатории
1. Рабочее место должно быть свободно от
посторонних предметов. На столе должны находиться только необходимые для работы
приборы и реактивы, рабочая тетрадь с заданиями по теме.
2. При выполнении лабораторной работы
следует строго придерживаться методических указаний, пользоваться приборами и
реактивами, предназначенными непосредственно для данной работы.
. Все опыты с ядовитыми и неприятно
пахнущими веществами следует проводить только в вытяжном шкафу. Выливать их в
раковину категорически запрещается!
4. Легко воспламеняющиеся жидкости (спирт,
эфир, и др.) нельзя наливать в пробирки вблизи огня. Нагревать эти вещества на
открытом пламени и открытых электрических плитах запрещается!
5. Запрещается входить
в лабораторию в верхней одежде, принимать пищу и курить.
. Пробовать реактивы и их растворы на
вкус строго запрещается!
. Студенты не должны без разрешения
преподавателя или специальной инструкции включать и выключать приготовленные к
занятию приборы.
. Перед включением электрических приборов
в электрическую сеть следует проверить заземление.
9. Категорически запрещается включать
в розетки питания оголенные концы проводов.
. Необходимо регулярно проверять провода,
предназначенные для питания приборов, на них не должно быть лишенных изоляции
участков.
. Перед уходом из лаборатории необходимо
выключить все нагревательные и осветительные приборы, закрыть водопроводные
краны и окна.
II.
Преподаватель знакомит студентов с методами исследования физиологических
функций: наблюдения, вивисекции, изолированных органов, хронического
исследования. Необходимо отметить, что разные методические подходы
определили основные этапы развития экспериментальной физиологии: аналитический,
синтетический, аналитико-синтетический, кибернетический.
III. Следующий
этап - знакомство студентов с аппаратурой, применяемой для раздражения и
регистрации.
Для раздражения в физиологическом
эксперименте обычно используют лабораторные электростимуляторы.
Демонстрируют приборы для механической регистрации
физиологических функций (кимограф, рычажок Энгельмана, миограф, воздушная
капсула Марея), а также приборы, используемые как для физиологических
экспериментов, так и для клинико-физиологических исследований
(электрокардиограф, метатест, электроэнцефалограф, полиграфии и др.).
Приготовление нервно-мышечного
препарата
Цель работы: ознакомиться с методикой
приготовления нервно- мышечного препарата.
Необходимо для работы: лягушка, препаровальный
набор, дощечка, раствор Рингера.
Проведение работы:
1. Обездвижить лягушку путем разрушения
спинного мозга кровавым или бескровным способом;
2. Взять лягушку за задние лапки, повернуть
вниз брюшком и, отступив на 1,5 см выше крестца ( ростральнее места сгиба),
перерезать позвоночник. Дугообразным разрезом вдоль крестца удалить свисающую
переднюю половину туловища со всеми внутренними органами (рис.1, п.1);
. Держа задние лапки левой рукой за
позвоночник, правой - (используя марлевую салфетку) снять с них кожу (препарат
задних лапок лягушки) (рис.1, п.2,3);
. Полученный препарат разделить пополам,
разрезав его вдоль позвоночника и симфиза (рис.1, п.3, 4);
. Положить лапку на препаровальную
дощечку, изучить выход корешков, образующих седалищный нерв, отпрепарировать
его до тазобедренного сустава. Положить конечность дорсальной стороной вверх,
стеклянным крючком раздвинуть мышцы бедра, найти седалищный нерв и осторожно
освободить его на всем протяжении от выхода из позвоночника до коленного
сустава. Удалить мышцы и кости выше коленного сустава (препарат одной задней
лапки) (рис.1, п.5,6);
. Перерезать ахиллово сухожилие у
пяточной кости, отвести от голени икроножную мышцу и удалить голень ниже
коленного сустава. Полученный нервно-мышечный препарат должен состоять
из икроножной мышцы, коленного сустава и седалищного нерва (рис. 1,
п.7,8).
Для приготовления изолированной мышцы требуется
удалить седалищный нерв.
Во время приготовления нервно-мышечного
препарата необходимо соблюдать следующие условия. Кость резать большими
ножницами, мягкие ткани - маленькими. Не прикасаться к нерву металлом!
Препарируя седалищный нерв, пользоваться только стеклянным крючком. Нерв не
травмировать и не растягивать! Препарат постоянно орошать раствором
Рингера.
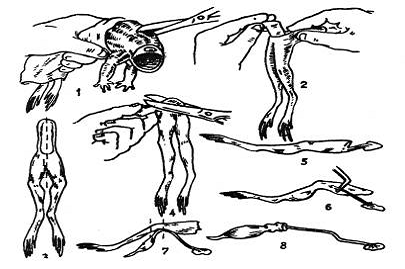
Рис.1 Этапы приготовления нервно-мышечного
препарата:
1. обездвиживание лягушки и перерезка
позвоночного столба
2. снятие кожи с задних конечностей
. разделение лапок по срединной линии
. удаление копчика
и 6. препарирование седалищного нерва
7. отделение икроножной мышцы с пяточным
сухожилием и перерезка бедра и голени
8. нервно-мышечный препарат
V. В
конце занятия студенты под руководством преподавателя оформляют первый протокол
по указанной выше форме.
Тема №2. Физиология возбудимых
тканей. Строение и физиологические функции биологических мембран возбудимых
тканей
Необходимо знать:
1. Основные цели и задачи курса нормальной
физиологии.
2. Перечислить принципы, лежащие в основе
жизнедеятельности живых организмов. Понятие гомеостаза.
. Функциональные системы организма
(определение понятия, виды функциональных систем).
. Раздражимость и возбудимость клеток -
универсальные свойства живой материи.
. Современные представления о структуре и
функциях биологических мембран. Мембранные каналы, их классификация. Виды
транспорта веществ через мембрану.
. Поляризованность мембраны (мембранный
потенциал покоя), как необходимое условие ее возбудимости. Механизмы
формирования потенциала покоя, способы регистрации.
. Процессы, возникающие в мембране при
действии стимулов подпороговой и пороговой величины. Основные особенности
локального ответа мембраны, значение критического уровня деполяризации.
. Потенциал действия, его фазы и ионные
механизмы. Следовые потенциалы.
. Зависимость пороговой силы раздражителя
от его длительности (реобаза, хронаксия). Явление аккомодации.
. Фазы изменения возбудимости при
возбуждении (рефрактерность). Понятие о лабильности (Н.Е. Введенский).
. Парабиоз, его фазы. Значение учения
Введенского о парабиозе для биологии и медицины.
Ключевые понятия и определения
Функциональная система
- совокупность органов, тканей и клеток организма, функциональное
взаимодействие между которыми, приводит к достижению полезного результата.
Полезный результат
(основной системообразующий фактор) - достижение гомеостаза.
Гомеостаз - относительное
постоянство параметров внутренней среды организма, необходимое для нормального
существования живого организма: уровень артериального давления, сахара в крови,
постоянство рН, осмотического давления, температуры и т.д.
Раздражимость
- способность активно отвечать на внешнее воздействие той или иной формой
деятельности, например, усилением метаболизма и роста, ускорением деления,
выбросом секрета, движение, электрическим импульсом.
Возбудимость - способность
специализированной ткани (нервной, мышечной, железистой) отвечать реакцией
возбуждения на действие раздражителей.
Мембранный потенциал покоя (МПП) - разница
потенциалов, существующая между наружной и внутренней поверхностями мембраны
возбудимой клетки, в состоянии покоя.
Возбуждение - специфический
физиологический ответ возбудимой клетки, связанный с изменением свойств
мембраны, которое обусловлено действием раздражителя, обладающего определенным
запасом энергии.
Возбуждение местное (локальное) -
процесс локальной, не распространяющейся деполяризации мембраны без ее реверсии
(перезарядки): локальный ответ (ЛО), постсинаптический потенциал, рецепторный
потенциал.
Возбуждение распространяющееся
(потенциал действия) - быстрое колебание мембранного
потенциала (деполяризация мембрана с последующей реверсией заряда).
Порог раздражения - минимальная
сила раздражителя, которая способна вызвать в возбудимых клетках возбуждение -
потенциал действия (ПД).
Рефрактерность - состояние
полного исчезновения (абсолютная рефрактерность) или снижения (относительная
рефрактерность) возбудимости клетки в момент ее возбуждения, связанное с
изменениями процессов активации и инактивации ион-селективных каналов.
Лабильность (функциональная
подвижность) - скорость протекания элементарного
акта возбуждения (понятие введено Н.Е. Введенским). Мерой лабильности является
предельный ритм возбуждения (максимальное число ПД), который возбудимая
структура способна генерировать в полном соответствии с ритмом раздражения.
Необходимо уметь:
1. Воспроизвести первый и второй
опыты Гальвани.,
2. Уметь определить порог раздражения мышцы
и нерва.
Работа №1. Первый опыт Гальвани
(сокращение с металлом).
Цель работы: воспроизвести классический опыт
Гальвани для знакомства с историей открытия животного электричества.
Необходимо для работы: лягушка, медный крючок,
припаянный к цинковой пластинке, препаровальный набор.
Проведение работы:
1. Приготовить препарат задних лапок лягушки
(см. протокол №1).
2. Зафиксировать препарат задних лапок
лягушки на медном крючке.
. Покачивая препарат, пронаблюдать за
сокращением мышц в момент соприкосновения лапки с цинковой пластинкой (рис.
2а).
Работа №2. Второй опыт Гальвани
(сокращение без металла).
Цель работы: убедиться в том, что между
поврежденным и неповрежденным участками мышцы имеется разница потенциалов,
которая обладает раздражающим действием.
Необходимо для работы: лягушка, препаровальный
набор, дощечка.
Проведение работы:
1. Приготовить препарат одной задней лапки (см.
протокол №1).
2. На икроножной мышце ножницами сделать
надрез ближе к коленной чашечке.
. Седалищный нерв, поддерживая за
позвоночник, легко набросить на мышцу так, чтобы он касался поврежденного и
неповрежденного участков. В момент соприкосновения наблюдается сокращение мышцы
(рис. 2б).
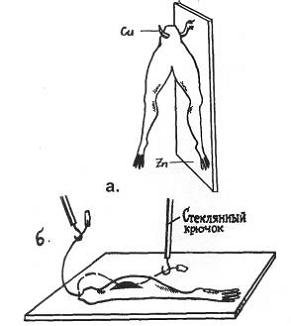
Рис. 2. Препарат задних лапок лягушки на
гальваническом крючке
Опыт Гальвани с металлом (а)
и без него (б)
Работа №3. Наблюдение раздражения
мышцы токами действия (опыт Маттеучи. Вторичный тетанус).
Цель работы: убедиться в том, что при
возбуждении мышцы возникают потенциалы действия, способные распространяться и
раздражать нервно-мышечный препарат.
Необходимо для работы: лягушка, препаровальный
набор, дощечка, электростимулятор.
Проведение работы:
1. Уложить два препарата задних лапок
лягушки на дощечку так, чтобы нерв одного препарата располагался на мышце
второго, а нерв второго - на электродах, соединенных с раздражающим прибором.
2. Нанести частые раздражения. При этом
наблюдаем сокращение мышцы обоих препаратов, (рис.3А)
.

Рис. 3 Схема опыта Маттеучи (А) и раздражения
нервно-мышечного препарата токами действия сердца (Б)
1
- сердце лягушки (изолированное или in
situ),
2 - седалищный нерв
Работа №4. Наблюдение раздражения
нервно-мышечного препарата потенциалами действия сердца (опыт Гинецинского).
Цель работы: та же, что и в предыдущей работе.
Необходимо для работы: лягушка, препаровальный
набор, дощечка.
Проведение работы:
1. В передней части туловища лягушки,
оставшейся после приготовления нервно-мышечного препарата, обнажить и
изолировать сердце. Можно взять интактную лягушку, обездвижить и приколоть
булавочками к деревянной дощечке. Разрезать кожу, приподнять грудину, подрезать
ключицы и удалить всю грудную стенку, обнажив сердце.
2. Седалищный нерв препарата задней лапки
лягушки набросить вдоль на сокращающееся сердце.
. Наблюдать сокращение мышцы в ритме
возбуждения и сокращения сердца (рис. №3б). Сделать выводы.
Работа №5. Определение пороговой
силы раздражителя при прямом и непрямом раздражении мышцы одиночными стимулами.
Цель работы: определить порог раздражения мышцы
и нерва. На основании наблюдения сделать выводы о возбудимости нервной и
мышечной ткани.
Необходимо для работы: лягушка, препаровальный
набор, дощечка, электростимулятор.
Проведение работы:
1. Приготовить нервно-мышечный препарат
одной задней лапки лягушки.
2. Включить в сеть электростимулятор,
тумблер показателя величины стимула установить в нулевое положение.
3. На раздражающие электроды поместить
седалищный нерв.
. Определить пороговое значение
раздражителя. При раздражении мышцы электростимулятором, находим положение
тумблера, при котором появляется слабое сокращение. Итак, мы определили
пороговое значение стимула - минимальную силу тока-раздражителя, достаточную для
того, чтобы вызвать возбуждение.
. Раздражающие электроды поместить прямо
на мышцу (перед раздражением желательно обработать препарат миорелаксантом), и
как в предыдущем случае определить порог раздражения мышцы.
. В протокол внести полученные результаты,
сделать выводы.
Тема №3. Особенности структуры и
функции нервных волокон. Физиология нервно-мышечного синапса
Необходимо знать:
1. Морфологические и физиологические
особенности нервного волокна.
Классификация нервных волокон. Виды аксонального
транспорта, понятие
трофического контура.
2. Законы проведения возбуждения по
нервным волокнам.
3. Механизм проведения возбуждения в
миелиновых и безмиелиновых нервных волокнах.
. Нервно-мышечное соединение (синапс).
Особенности строения, физиологические свойства пресинаптической и
постсинаптической мембраны.
. Механизм передачи возбуждения в
синапсе, хемовозбудимые
каналы. Холинэстераза и её роль в процессах нервно-мышечной передачи.
. Законы проведения через синапс.
Возможные механизмы блокады проведения возбуждения через синапс. Миорелаксанты.
Ключевые понятия и определения
Нейрон-главный
структурно-функциональный элемент нервной системы.
Основными функциями нейрона являются восприятие,
переработка информации и передача сигнала либо другой нервной клетке, либо
органу-исполнителю.
Важнейшая специфическая функция
отростков нейронов (нервных волокон)- проведение
возбуждения.
Классификация нервных волокон:
· По особенностям строения (миелиновые и
безмиелиновые)
· По функциональному значению -
афферентные (чувствительные )
и эфферентные (двигательные);
· струтурно-функциональная классификация по
Эрлангеру - Гассеру
представлена в таблице:
|
Тип
волокна
|
Средний
диаметр (мкм)
|
Средняя
скорость проведения (м/с)
|
Длительность
абсолютной рефрактерности (мс)
|
|
А-
|
20,0
|
70-120
|
0,4
|
|
А-
|
10,0
|
30-70
|
-
|
|
А-
|
5,0
|
15-30
|
-
|
|
А-
|
2,5
|
12-30
|
0,8
|
|
В
|
2,5
|
3-12-15
|
1,2
|
|
С
|
1,2
|
0,5-2
|
2,0
|
Распространение нервного импульса - потенциала
действия (ПД) в нервном волокне осуществляется при помощи местных токов,
возникающих между возбужденным и невозбужденным участками мембраны. Этот
механизм распространения возбуждения достаточно широко используется и в других
возбудимых структурах.
Распространение и передача информации
осуществляется не только при помощи залпов нервных импульсов в нервных волокнах
(кабельные свойства волокна), но и при помощи других механизмов, связанных с
использованием химических передатчиков информации и хеморецептивных свойств
возбудимых мембран.
Синапс - специализированная
структура, обеспечивающая передачу информации с нервной клетки на иннервируемую
структуру (рис.4).
Основными структурными особенностями синапса
являются три элемента:
· пресинаптическая мембрана, которая
покрывает окончание нервного волокна;
· постсинаптическая мембрана - участок
мембраны иннервируемой клетки, в которой имеются хеморецепторы - белки,
чувствительные к действию того или иного медиатора;
· синаптическая щель -
расстояние между пре- и постсинаптической мембраной (в различных синапсах может
иметь различную величину).
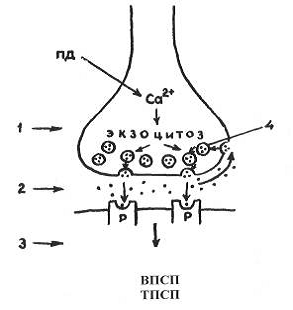
Рис 4. Схема химического синапса
1. пресинаптическое окончание
2. синаптическая щель
. постсинаптическая мембрана
. везикулы, содержащие
медиатор
Р. Рецептор постсинаптической
мембраны
ВПСП и ТПСП - возбуждающий и
тормозной постсинаптические потенциалы соответственно(на постсинаптической
мембране может возникнуть деполяризация либо гиперполяризация только локального
характера).
Еще одна особенность постсинаптической мембраны
- наличие хемовозбудимых ионных каналов. На постсинаптической мембране
никогда не возникает потенциал действия!
Миорелаксанты -
это лекарственные вещества, которые блокируют Н-холинорецепторы в
нервно-мышечных синапсах.
Аксональный транспорт
- это передвижение от тела клетки к окончанию аксона синтезированных в
клеточных органеллах секреторных гранул, в состав которых могут входить
различные физиологически активные вещества: ферменты, медиаторы, гормоны,
нейропептиды, аминокислоты, трофогены.
Помимо прямого аксонного транспорта
существует и обратный (ретроградный), сущность которого заключается в
захватывании аксонными окончаниями (пиноцитоз) из синаптической щели различных
веществ и транспортировка их в тело нейрона. Ретроградно в центральную нервную
систему (ЦНС) могут проникать некоторые токсины, вирусы и вещества, выделяемые иннервируемой
структурой, необходимые для нормальной деятельности нейрона, иннервирующего
данную структуру.
Трофический контур -
обмен между нейроном и иннервируемой клеткой факторами, регулирующими трофику
обоих структур, благодаря наличию прямого и обратного аксонального транспорта.
Необходимо уметь:
1. Экспериментально воспроизвести три
основные закона проведения возбуждения в нервных волокнах.,
2. Воспроизвести эффект действия
миорелаксантов.
Работа №6. Законы проведения
возбуждения по нервному волокну
Цель работы: воспроизвести в эксперименте три
основных закона проведения возбуждения в нервных волокнах.
Необходимо для работы: лягушка, препаровальный
набор, пластинка с наклеенными кусочками пробки для фиксации препарата,
электростимулятор, электроды для раздражения нерва, лигатуры, р-р Рингера, р-р
аммиака или хлороформа, ватные фитилечки.
Проведение работы:
1. Приготовить препарат задних лапок
лягушки. Зафиксировать препарат за позвоночник в висячем положении в штативе
(рис.4а).
2. Под каждый спинномозговой корешок
пинцетом подвести лигатуру. Поддерживания нервный корешок при помощи лигатуры,
подвести под него электроды и раздражать током пороговой силы. Наблюдать, какие
группы мышц будут сокращаться. Повторить опыт, подводя электроды таким же
образом под другие корешки (закон изолированного проведения возбуждения).
. Зафиксировать препарат задних лапок
лягушки энтомологическими булавками на пробковых пластинках. На дорсальной
поверхности бедра разрезать кожу, раздвинуть мышцы и стеклянным крючком выделить
седалищный нерв. Под него подвести ножницы и перерезать мышцы и бедренную кость
в средней части, сохранив целостность нерва (рис. 4б).
. Нанести частые раздражения током
сверхпороговой силы на седалищный нерв и наблюдать сокращения мышц бедра и
голени выше и ниже места разреза (закон двухстороннего проведения
возбуждения по нервному волокну).
. На седалищный нерв наложить ватный
фитилек, смоченный хлороформом (или лигатуру). Раздражать седалищный нерв током
пороговой силы выше и ниже места альтерации и наблюдать, в каком случае будет
происходить сокращение икроножной мышцы (закон физиологической целостности
нерва). Схемы опытов зарисовать в протокольную тетрадь. Сделать выводы.

Рис. 5. Схема проведения экспериментов, подтверждающих
три основных закона проведения возбуждения в нервных волокнах
Воспроизведение закона
изолированного проведения возбуждения (а) и двухстороннего проведения и
физиологической целостности нервного волокна (б):
1. седалищный нерв
2. седалищный нерв (мышцы и
кость бедра рассечены)
. раздражающие электроды
. место альтерации нерва
Работа№7. Влияние кураре на позу и
поведение лягушки.
Цель работы: ознакомить студентов с эффектом
действия одного из представителей миорелаксантов на организм животных.
Необходимо для работы: лягушка, стеклянный
колпак, шприц, р-р кураре или 0,1 р-р миорелаксина.
Проведение работы:
1. Лягушку поместить под стеклянный колпак и в
течении пяти минут наблюдать за ее поведением (обратить внимание на позу,
движения, положение головы).
2. Ввести 01,-0,3 мл р-ра миорелаксина в
спинной лимфатический мешок лягушки и продолжить свои наблюдения.
Обратить внимание на тот факт, что если лягушку
теперь положить на спину, то она не станет стремиться вернуться в исходное
положение. Через 5 мин. Исчезнет двигательная активность, дыхательные движения
сначала замедляться, потом вообще исчезнут. Вскрыв грудную полость лягушки,
можно убедиться в том, что ее сердце продолжает сокращаться.
Объяснить наблюдаемые явления и сделать выводы.
Работа №8. Исследование действия
кураре на сокращение мышц.
Цель работы: та же, что и в предыдущей работе.
Необходимо для работы: лягушка, препаровальный
набор, чашка Петри, электростимулятор, раздражающие электроды, 0,1% р-р
миорелаксина, р-р Рингера.
Проведение работы:
1. Приготовить нервно-мышечный препарат.
2. Поместить препарат на дощечку и нанести
раздражение током пороговой силы на нерв, а затем прямо на мышцу. Наблюдать за
ее сокращением.
3. Внутримышечно ввести небольшую дозу
любого миорелаксанта.
4. Через одну-две минуты снова произвести
прямое и непрямое раздражение препарата. Если нарушения проведения возбуждения
в нервно-мышечном соединении не произошло, опыт повторить через одну-две
минуты.
5. В протоколе кратко описать ход работы,
зарисовать схему опыта, сделать выводы.
Тема №4. Физиологические
свойства скелетных и гладких мышц
Необходимо знать:
1. Значение скелетных и гладких мышц для
организма. Физиологические свойства мышечного волокна, основного структурного
элемента мышечной ткани.
2. Структурные элементы мышечного волокна,
обеспечивающие проведение возбуждения и его сокращение. Саркомер.
. Сопряжение процессов возбуждения и
сокращения. Механизм сокращения мышц. Роль ионов Са2+. Мышечное
расслабление.
. Энергетика мышечного сокращения и расслабления.
Процессы теплообразования в мышце. Значение аэробных и анаэробных процессов в
обеспечении мышц энергией. Кислородный долг.
. Одиночное мышечное сокращение, его
фазы. Виды суммации мышечных сокращений (тетанус). Понятие оптимума и пессимума
раздражения по Введенскому.
. Понятие моторной единицы. Закон силы
для скелетных мышц.
. Работа и сила мышц. Методика расчета
величины работы, выполняемой мышцей. Правило средних нагрузок.
. Мышечное (физическое) утомление, его
физиологические механизмы (для изолированной мышцы и в целостном организме).
Значение трудов И.М. Сеченова. Адаптационно-трофическая роль симпатической
нервной системы.
. Гладкие мышцы, их значение для
организма. Основные физиологические особенности. Механизм автоматизма.
Особенности иннервации.
Ключевые понятия и определения
Поперечно-полосатые мышцы формируют
двигательные аппараты скелета, глазодвигательный, жевательный и некоторые
другие. Все эти мышцы (кроме мышцы сердца) лишены автоматизма, полностью
контролируются центральной нервной системой и относятся к системе произвольной
регуляции, т.е. подчиняются воле человека.
Моторная единица - комплекс,
включающий один мотонейрон и иннервируемые им мышечные волокна в пределах
данной мышцы.
Режимы сократительной деятельности
включают в себя три вида:
· изотонический - когда
мышца укорачивается при неизменном внутреннем напряжении;
· изометрический - когда
мышца не укорачивается, а лишь развивает внутреннее напряжение;
· ауксотонический (смешанный)-
наблюдается при обычных условиях трудовой деятельности.
Мышечные сокращения бывают
двух видов:
Ø одиночное сокращение -
возникает при действии одиночного стимула и состоит из трех фаз: латентного
периода, периода укорочения и периода расслабления (рис. 6);
Ø тетаническое -
возникает при ритмической стимуляции мышцы с частотой более 10 имп/с. При этом
происходит слияние и наложение (суперпозиция) одиночных сокращений. В
зависимости от частоты стимуляции может возникнуть неполная суммация или
зубчатый тетанус. При более высокой частоте стимуляции наблюдается полная
суммация или гладкий тетанус.
Оптимум раздражения -
частота стимуляции, при которой возникает тетанус с наибольшей амплитудой.

Рис. 6 Механизм суммации мышечных сокращений
возбудимый ткань
физиологический нервный
Стрелками показаны моменты
стимуляции
Периоды мышечного сокращения:
I. латентный
II. укорочения
III. расслабления
Б. Одиночные сокращения
В. Зубчатый тетанус (неполная
суммация)
Г. Гладкий тетанус (полная
суммация)
Пессимум раздражения -
частота стимуляции, при которой происходит снижение амплитуды тетануса или
полное расслабление мышцы.
При поднятии груза в изотоническом режиме мышцы
выполняют работу (А), которая вычисляется по формуле: А=Ph=Р∆α,
Р - вес груза
h- высота подъема
груза
∆α - укорочение
мышцы.
Утомление мышцы - снижение
амплитуды или полное расслабление мышц в результате длительной стимуляции и
выполнения работы. Утомление изолированной мышцы связано в первую очередь с
накоплением в ней (внутри волокон и в межклеточных щелях) ряда продуктов
метаболизма, ацидоза, дефицита кислорода и питательных веществ. В целостном
организме мышечное утомление развивается как отказ от работы аппаратов ЦНС,
т.е. первичное утомление возникает в двигательных нервных центрах. Вторичное
утомление может возникнуть в элементах нервно-мышечной передачи возбуждения.
Необходимо уметь:
1. Зарегистрировать разные виды сокращений
скелетной мышцы.,
2. Определить мышечную силу.,
. Произвести регистрацию биопотенциалов
мышц у человека.,
. Произвести динамометрию.
Работа №10. Одиночное и титаническое
сокращение скелетной мышцы.
Цель работы: зарегистрировать одиночное и
тетаническое сокращение скелетной мышцы и изучить условия, при которых
возникают разные виды суммации мышечных сокращений.
Необходимо для работы: лягушка, препаровальный
набор, миограф, кимограф с наклеенной бумагой, электростимулятор для
раздражения, растворр Рингера, чернила.
Проведение работы:
1. Приготовить препарат икроножной мышцы
лягушки. Зафиксировать его в миографе и отрегулировать запись на бумаге
кимографа.
2. Подсоединить провода от
электростимулятора к клеммам кимографа.
. Нанести одиночные стимулы разной
величины. Записать одиночные сокращения мышцы. Наблюдать зависимость амплитуды
сокращения от величины стимула (закон силы).
. Включить кимограф, зафиксировать
барабан и, нанося ритмические раздражения стимулом пороговой величины, записать
кривые зубчатого и гладкого тетануса. Обратить внимание на частоту стимуляции,
при которой получается зубчатый и гладкий тетанус.
. При оформлении протокола необходимо
полученные кимограммы вклеить в протокольную тетрадь, описать фазы одиночного
мышечного сокращения и условия, при которых возникает тетаническое сокращение
(полная и неполная суммация мышечных сокращений), (рис.6 и 7).

Рис. 7 Зависимость характера мышечного
сокращения от частоты раздражения
Зубчатый и гладкий тетанус:
1. одиночные сокращения;
2. зубчатый тетанус;
. гладкий тетанус и
контрактура;
. падение амплитуды
сокращения при пессимальной частоте раздражения (стрелками обозначена
нарастающая частота раздражений).
Работа №11. Работа и утомление
изолированной скелетной мышцы.
Цель работы: изучить зависимость работы мышцы от
нагрузки и определить мышечную силу. Записать кривую утомления икроножной мышцы
лягушки. Проанализировать механизм утомления изолированной икроножной мышцы.
Необходимо для работы: лягушка, препаровальный
набор, кимограф, р-р Рингера, электростимулятор, линейка, набор грузов, весом
10, 20, 50, 100, 200 г.
Проведение работы:
1. Приготовить препарат изолированной
икроножной мышцы лягушки, зафиксировать его в миографе и отрегулировать запись
на кимографе (рис.8).
2. Первое сокращение мышцы записать без
груза (стимул пороговой величины).
. В дальнейшем записать серию сокращений
с поднятием груза (гирька при помощи крючка подвешивается к подвижному рычагу
миографа в месте фиксации мышцы). Величину груза увеличивать до тех пор, пока
мышца не сможет его поднять.
. Произвести расчет проделанной работы.
Для этого необходимо измерить на кимографе высоту каждого сокращения (Н)
в соответствии с поднимаемым грузом и данные внести в таблицу. Измерить
длину записывающего рычага L
и
расстояние от оси вращения до места крепления мышцы к рычагу 1. Для
каждой величины Н вычислить истинную величину подъема груза по формуле h=I.H/L
(на
основании подобия двух треугольников), в которых L/I=H/h
(рис.
9)

Рис. 8 Схема установки для графической
регистрации мышечных сокращений
1. стимулятор УЭС-1
2. универсальный штатив
. вертикальный миограф
. мышца лягушки,
фиксированная за коленный сустав (сверху) и пяточное сухожилие (снизу)
. подвижное плечо миографа
. кимограф
. барабан кимографа
Данные записать в таблицу и на основании
полученных результатов построить график зависимости работы от нагрузки.
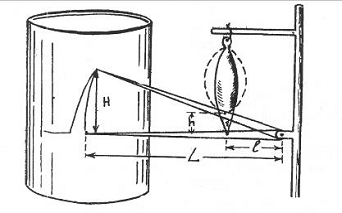
Рис. 9 Схема измерения основных показателей для
расчета произведенной работы.
Необходимо учесть вес груза, который фиксируется
к подвижному рычагу в месте крепления мышцы (на схеме груз не обозначен).
5. Мышцу смочить раствором Рингера (можно
мышцу заменить на свежую).
6. Найти силу тока, вызывающую максимальное
сокращение мышцы.
. Записывать серию одиночных сокращений
мышцы до тех пор, пока амплитуда сокращений не уменьшится или не произойдет
полное расслабление мышцы, при сохранении стимуляции. Отметить время, через
которое наступило выраженное утомление.
. Опыт можно повторить, увеличивая
частоту стимуляции или подвешивая груз разной величины при одном и том же ритме
раздражений.
. Полученную кимограмму (или несколько
кимограмм) вклеить в протокол и проанализировать. Ответить, почему развивается
утомление, и при каких условиях оно будет развиваться быстрее.
Работа №12. Электромиография (ЭМГ).
Цель работы: ознакомиться с методикой
регистрации биопотенциалов мышц у человека.
Необходимо для работы: испытуемый,
электромиограф или электрокардиограф, пластинчатые электроды, физиологический
раствор, спирт, динамометр.
Проведение работы:
2. У испытуемого для обезжиривания
протереть кожу предплечья спиртом.
. На предплечье зафиксировать
пластинчатые электроды с межэлектродным расстояние 6-8 см.
. На другое предплечье (или ногу)
наложить электрод для заземления объекта.
. Электромиограмма регистрируется при
сгибании пальцев руки с легким, средним и максимальным усилий (величина усилия
дозируется по показаниям динамометра, который испытуемый держит в руке).
. На записанных электромиограммах
необходимо отметить изменения (количество импульсов и амплитуду), которые
зависят от силы мышечного сокращения.
Работа №13. Динамометрия.
Исследование максимального мышечного усилия и силовой выносливости мышц кисти.
Цель работы: ознакомить студентов с методом
определения уровня работоспособности и выносливости мышц с использованием
метода динамометрии.
Необходимо для работы: кистевой динамометр,
секундомер.
Проведение работы:
1. Испытуемому в положении стоя отвести
вытянутую руку с динамометром в сторону под прямым углом к туловищу. Вторую
руку опустить и расслабить.
2. По сигналу экспериментатора испытуемый
дважды должен выполнить максимальное усилие на динамометре. Силу мышц оценить
по лучшему результату.
. Испытуемому выполнить 10 раз усилия с
частотой 1 раз в 5 сек. Результаты записать и определить уровень
работоспособности по формуле:
P=(f1+f2+f3+….fn)
/ n,
где Р - уровень работоспособности; f1+f2+f3+….fn
- показатели
динамометра при отдельных мышечных усилиях; n
-
количество попыток.
4. Эти же результаты можно использовать для
определения показателя снижения работоспособности мышц:
S= [(f1-fmin)/fmax]
x 100,
где S
- показатель
снижения работоспособности мышцы; f1
-
величина начального мышечного усилия; fmin
fmax
- минимальная и
максимальная величины усилия соответственно.
Результаты можно сравнить у нескольких
испытуемых с различной степенью тренированности.
Тема №5.
Учение о рефлексе. Понятие о нервном центре. Особенности распространения
возбуждения в нервных центрах
Необходимо знать:
1. Нейрон как структурная и функциональная
единица центральной нервной системы, его физиологические функции и взаимосвязь
глиальными клетками, способы переработки информации одиночным нейроном.
2. Строение, классификация и функциональные
свойства синапсов ЦНС. Особенности передачи возбуждения в них, медиаторы.
. Рефлекторный принцип регуляции функций
организма (Р.Декарт, Г. Прохаска), его развитие в трудах И.М. Сеченова, И.П.
Павлова, П.К. Анохина.
. Принцип рефлекторной теории.
Классификация рефлексов.
. Рефлекторная дуга, ее звенья. Принцип
обратной связи. Понятие нервного центра. Нервный центр в узком и широком
смысле.
. Особенности организации нейрональных
цепей в ЦНС. Принцип общего конечного пути (Шеррингтон).
. Одностороннее и замедленное проведения
возбуждения в нервных центрах. Понятие центрального времени рефлекса, от каких
факторов оно зависит. Явление окклюзии.
. Механизмы, облегчающие проведение
возбуждения в нервных центрах: тонус нервных центров, явление суммации,
трансформация ритма, последствие, посттетаническая потенциация.
. Лабильность и утомляемость нервных
центров. Принцип доминанты в деятельности нервных центров (А.А. Ухтомский).
Свойства нейронов доминантного очага.
Ключевые понятия и определения
Элементарной единицей ЦНС является нейрон. Его
клеточная мембрана представляет поле, на котором происходит интеграция
синаптических влияний.
|
Структура
нейрона
|
Основные
функции
|
|
1.
рецепторы (первичные афферентные нейроны)
|
восприятие
раздражения и преобразование его в нервный импульс (залп импульсов, паттерн)
|
|
2.
дендриты
|
восприятие
раздражения (возбуждения), проведение возбуждения
|
|
3.
тело нейрона
|
интеграция
возбуждающих и тормозных влияний вследствие взаимодействия ВПСП и ТПСП;
выполнение трофической функции; синтез нейрогормонов и других активных
веществ
|
|
4.
аксональный холмик (начальный сегмент аксона)
|
возникновение
потенциала действия
|
|
5.
аксон
|
проведение
нервного импульса
|
|
6.
терминальные ветвления аксона с образованием бляшек
|
Передача
информации путем выделения специального вещества (медиатора нейропептида, нейрогормонов)
|
Классификация синапсов ЦНС
1. Нейроны ЦНС, аксоны которых выходят на
периферию образуют конечно эффекторные синапсы (например, нервно-мышечные).
2. В пределах ЦНС образуются
синапсы:
· аксосоматические;
· аксодендритические;
· аксо-аксональные.
3. По способу передачи информации
различают:
· электрические;
· химические;
· смешанные синапсы.
Следует отметить, что в ЦНС
млекопитающих и человека наибольшую роль играют химические синапсы!
4. В зависимость от влияния освобожденных
медиаторов на ионную проницаемость постсинаптической мембраны
выделяют:
· возбуждающие;
· тормозные синапсы.
5. В зависимости от выделяемого медиатора
синапсы могут классифицироваться так:
· Холинергические;
· Адренергические;
· дофаминергические;
· серотониненергические и т.д.
Переработка информации одиночным нейроном
включает два механизма:
Первый,
наиболее
быстрый, заключается в механизме суммации ВПСП и ТПСП, скорости нарастания
амплитуды постсинаптических потенциалов, что в конечном итоге, определяет
процессы, происходящие в триггерной зоне: возникновение ПД, либо его
отсутствие.
Второй,
заключается в том, что медиатор, после его взаимодействия с мембранными
рецепторами, активирует систему вторичных посредников (мессенджеров), что
приводит к изменениям в геноме клетки и синтезу новых белков (белков обучения).
Описанный механизм лежит в основе длительного сохранения информации и
приобретения нейроном новых свойств.
Основным принципом деятельности центральной
нервной системы является рефлекторный принцип.
Рефлекс - ответная
реакция организма на раздражение из внешней или внутренней среды,
осуществляющаяся с участием центральной нервной системы.
Рецептивное поле рефлекса - область
тела, раздражение рецепторов которой, вызывает всегда определенную ответную
реакцию (рефлекс).
Время рефлекса - время
от начала действия раздражителя до наступления ответной реакции.
Центральное время рефлекса - время,
затраченное на переработку информации в нервном центре. Оно зависит от степени
сложности организации нервного центра, числа вставочных нейронов, исходного
функционального состояния и тонуса нервного центра.
Структура рефлекса: 1
- рецептор, 2- афферентный путь, 3- нервный центр (совокупность элементарных
нервных сетей), 4 - эфферентный путь, 5- эффектор (орган-исполнитель), 6 - обратная
связь или санкционирующая афферентация, которая возникает при любом действии,
поступает от рецепторов в ЦНС и информирует о произведенном действии.
Необходимо уметь:
1. Воспроизвести ряд рефлексов на
экспериментальном животном.,
2. Определить время рефлекса.
Работа №15. Рецептивное поле
рефлекса.
Цель работы: экспериментально доказать, что
каждый рефлекс начинается с раздражения рецепторов и имеет свое поле.
Необходимо для работы: лягушка, штатив с крючком
для ее фиксации, препаровальный набор, 1% раствор серной кислоты, банка с
водой, фильтровальная бумага.
Проведение работы:
I. Произвести
наблюдение рефлексов при раздражении соответствующих рецептивных полей на
интактной лягушке.
Мигательный рефлекс. Дотронуться
пинцетом до роговицы глаза лягушки и пронаблюдать за рефлекторной мигательной
реакцией. Убедиться в том, что, раздражая другие участки тела, данный рефлекс
получить невозможно.
Квакательный рефлекс.
Сжать пальцами боковые поверхности тела самца лягушки и пронаблюдать за
квакательным рефлексом. Убедиться в отсутствии данного рефлекса и при
раздражении других рецептивных полей.
Обхватывательный рефлекс. Надавить
на мозоли передних лапок самца или на область грудины и пронаблюдать за
рефлексом обхватывания, который не может быть вызван с других рецептивных
полей.
П. Произвести наблюдение рефлексов на
спинальной лягушке при раздражении соответствующих рецептивных полей.
. приготовить спинальную лягушку. Для
этого браншу больших ножниц ввести в ротовую полость и отсечь верхнюю челюсть
по задней линии глазниц (удалить головной мозг). Спинальную лягушку подвесить
за нижнюю челюсть на крючке в штативе (рис. 10А);
. кусочек фильтровальной бумаги (1х1 см)
смочить 1% раствором серной кислоты и приложить к различным участкам кожи.
Наблюдать рефлекторные реакции. Произвести раздражение области следующих кожных
рецептивных полей: ахиллова сухожилия, голени, верхней части латеральной
поверхности бедра, передних лапок, боковых поверхностей туловища;
. отметить характер рефлекторных реакций
при раздражении каждого поля. Схему рецептивных полей нарисовать в тетради
(рис. 10Б).

Рис. 11 Схема установки для определения
спинальных рефлексов
А - определение времени рефлекса по
Тюрку: 1 - штатив; 2- лягушка
Б - рецептивные поля:1 - защитного
сгибательного рефлекса;
- ритмического рефлекса потирания
Работа №16. Определение времени
рефлекса по Тюрку.
Цель работы: научить студентов определять время
двигательной реакции и установить зависимость времени рефлекса от силы
раздражителя.
Необходимо для работы: лягушка, штатив с крючком
для ее фиксации, стакан с водой, 0,25%, 0,5%, 1% растворы серной кислоты,
фильтровальная бумага, секундомер.
Проведение работы:
1. Приготовить спинальную лягушку и
подвесить ее за нижнюю челюсть на крючке штатива (см. рис. 10А).
2. Через одну-две минуты на поверхность
голени наложить бумажку, смоченную 0,25% раствором серной кислоты, и
одновременно включить секундомер. Отметить время от начала действия
раздражителя до наступления ответной реакции (время кислотного сгибательного
рефлекса). Лапку отмыть от кислоты, погружая в стакан с водой. Опыт
повторить два раза.
. Такие же опыты проделать с кислотой
0,5% и 1%. Полученные результаты внести в таблицу.
. Провести анализ полученных результатов
и сделать выводы.
|
Концентрация
(%)
|
Номер
измерения
|
Среднее
время
|
|
1
|
2
|
3
|
|
|
0,25%
|
|
|
|
|
|
0,5%
|
|
|
|
|
|
1%
|
|
|
|
|
Работа №17. Иррадиация возбуждения в
спинном мозге.
Цель работы: познакомить студентов с внешними
проявлениями иррадиации возбуждения в спинном мозге.
Необходимо для работы: лягушка, штатив с
крючком для ее фиксации, препаровальный набор, электростимулятор.
Проведение работы:
1. Приготовить препарат спинальной лягушки
и зафиксировать его на крючке в штативе.
2. Включить электростимулятор.
. Прикладывая раздражающие электроды к
поверхности кожи голени, подобрать пороговое значение стимула по появлению
рефлекса сгибания лапки.
. Усиливая последующие раздражения,
пронаблюдать за изменением структуры рефлекторных ответов.
. В протоколах описать наблюдаемые
явления и объяснить, какой процесс называется иррадиацией возбуждения, и какие
анатомические особенности нервных центров обеспечивают этот процесс.
Работа №18. Временная суммация
возбуждения в центрах спинного мозга.
Цель работы: познакомить студентов с
проявлениями и условиями возникновения суммации в нервных центрах спинного
мозга.
Необходимо для работы: лягушка, штатив с крючком
для ее фиксации, препаровальный набор, электростимулятор.
Проведение работы:
1. Приготовить препарат спинальной лягушки и
зафиксировать его на крючке в штативе.
2. Включить стимулятор.
. Приложить раздражающие электроды к
поверхности кожи голени, подобрать пороговое значение стимула до появления
рефлекса сгибания.
. Величину раздражителя уменьшить.
Обратить внимание, что рефлекс при этом не наблюдается.
. Нанести ритмические раздражения
подпороговым стимулом до момента наступления рефлекторного ответа. Отметить
время, через которое возникла рефлекторная реакция.
. В протоколах описать наблюдаемый
эксперимент, и объяснить какие физиологические механизмы лежат в основе
временной суммации.
Работа №19. Анализ рефлекторной
дуги.
Цель работы: установить значение целостности
всех звеньев рефлекторной дуги в осуществлении рефлекса.
Необходимо для работы: лягушка, штатив с крючком
для ее фиксации, стакан с водой, 1% раствор серной кислоты, нитки для наложения
лигатуры или ватные фитилечки, раствор аммиака или хлороформа, фильтровальная
бумага.
Проведение работы:
1. Приготовить препарат спинальной лягушки и
укрепить его за нижнюю челюсть на крючке штатива.
2. Воспроизвести кислотный сгибательный
рефлекс.
. На одной лапке сделать круговой разрез
кожи ниже коленного сустава и снять ее с голени.
. Наложить кусочек фильтровальной бумаги,
смоченный кислотой, на поверхность голени там, где отсутствует кожа, и пронаблюдать
за реакцией лягушки.
. На другой интактной лапке разрезать
кожу по задней поверхности бедра, раздвинуть мышцы и стеклянным крючком
приподнять седалищный нерв. Нарушить его проводимость, наложив лигатуру или
ватный фитилек, смоченный аммиаком или хлороформом. На кожу голени этой лапки
нанести кислотное раздражение.
. Разрушить при помощи зонда спинной мозг
и нанести кислотное раздражение на любое рецептивное поле кожи туловища.
Продолжить наблюдение.
. В протоколе описать проведение
эксперимента. Объяснить наблюдаемые явления. Зарисовать схему рефлекторной дуги
простого соматического рефлекса и обозначить основные звенья рефлекторной дуги.
Сделать выводы.
Тема №6. Процессы торможения в
центральной нервной системе
Необходимо знать:
1. Открытие центрального торможения И.М.
Сеченовым. Опыт Сеченова. Значение торможения для организма. Отличие процесса
торможения от возбуждения.
2. Торможение, возникающее в системе
возбуждающих нейронов: пессимальное, торможение вслед за возбуждением.
. Постсинаптическое торможение. Тормозные
нейроны, их медиаторы. Механизм формирования ТПСП.
. Пресинаптическое торможение. Синапсы и
медиаторы, обеспечивающие механизм формирования пресинаптического торможения.
Значение пресинаптического торможения для организма.
. Особенности организации нейрональных
цепей в формировании опережающего и ретроградного торможения.
. Общие принципы координационной
деятельности ЦНС. Роль реципрокного торможения в координации физиологических
функций.
Необходимо уметь:
1. Воспроизвести опыт Сеченова.,
2. Экспериментально воспроизвести различные
виды торможения.
Работа №21. Торможение
спинномозговых рефлексов (опыт Сеченова).
Цель работы: экспериментально подтвердить
нисходящие тормозные влияния промежуточного мозга на спинномозговые рефлексы.
Необходимо для работы: лягушка, штатив с крючком
для ее фиксации, 0,25% раствор серной кислоты, стакан с водой, кристаллы
поваренной соли, препаровальный набор, метроном или секундомер.
Проведение работы:
1. Приготовить препарат таламической лягушки.
Для этого верхнюю челюсть лягушки отрезать по линии, соединяющей задние края
глазниц.
2. Укрепить лягушку в штативе за нижнюю
челюсть.
. Определить время сгибательного
кислотного рефлекса на 0,25% раствор Н2SO4.
Произвести
измерение три раза и вычислить среднее время рефлекса.
. Через 2-3 мин. Нанести кристаллик соли
на раневую поверхность зрительных бугров. Спустя 1-2 мин.снова определить время
кислотного сгибательного рефлекса при той же концентрации кислоты. Рефлекс
воспроизводится до тех пор, пока его время не начнет увеличиваться.
. В протокольную тетрадь внести условия
эксперимента и результаты. Зарисовать сеченовский разрез и сделать выводы
(рис.11). Объяснить механизм сеченовского торможения исходя из современных
представлений о центральном торможении.

Рис 12. Сеченовское торможение (нейрональный
механизм).
На схеме показано распространение
возбуждения при наложении кристалла NaCl
на область зрительных бугров
Работа №22. Взаимное торможение
спинномозговых рефлексов.
Цель работы: убедиться в том, что при
возникновении двух очагов возбуждения сильное раздражение вызывает торможение
рефлекторной реакции на более слабый раздражитель.
Необходимо для работы: лягушка, штатив с крючком
для ее фиксации, 0,25% раствор Н2SO4,
стакан
с водой, метроном или секундомер, препаровальный набор, фильтровальная бумага.
Проведение работы:
1. Приготовить препарат спинальной лягушки
и зафиксировать его в штативе.
2. Через 1-2 мин. определить время
кислотного сгибательного рефлекса по Тюрку на раздражение 0,25% раствором Н2SO4.
. Спустя 2 мин. одновременно с кислотным
раздражением одной лапки другую сильно сдавить пинцетом (болевое раздражение).
Пронаблюдать за изменением времени кислотного сгибательного рефлекса.
. Полученные результаты записать в
протокольную тетрадь. Объяснить механизм наблюдаемого явления.
Работа №23. Сопряженное торможение
сгибательного рефлекса
Цель работы: убедиться в наличии механизмов
сопряженного (реципрокного) торможения, необходимого для координационной
деятельности мышц антагонистов.
Необходимо для работы: лягушка, предварительно
выдержанная на холоде (в течение двух суток при температуре 20С),
штатив с крючком для ее фиксации, препаровальный набор, 1% раствор Н2SO4,
стакан
с водой, фильтровальная бумага.
Проведение работы:
. Спинальную лягушку (предварительно
охлажденную) подвесить на крючке в штативе (опыт можно проводить и на интактной
лягушке). Необходимо учесть, что у охлажденных лягушек рефлексы протекают
замедленно и характеризуются длительным последствием.
. Произвести раздражение кожи одной из
лапок, достаточное для возникновения сгибательного рефлекса. При этом следует
учесть, что одновременно реципрокно затормаживаются центры разгибателей на
стороне, где наносится раздражение.
. Одновременно с раздражение кожи одной
лапки во время протекания рефлекса сгибания произвести раздражение
симметричного участка кожи другой лапки. Одновременно со сгибанием другой
лапки происходит разгибание первой. Такое разгибание является
следствием сопряженного торможения центра сгибательного рефлекса, которое
возникает при раздражении лапки с противоположной стороны. Продолжать
наблюдение, поочередно раздражая лапки.
. В протокольную тетрадь записать ход
работы и результаты наблюдений. Сделать выводы и объяснить механизм реципрокного
торможения.
Тема №7. «Особенности строения
вегетативной нервной системы. Вегетативные ганглии. Медиаторное обеспечение
деятельности автономной нервной системы»
Необходимо знать:
1. Периферический отдел вегетативной нервной
системы (ВНС) - общий план строения и особенности иннервации внутренних органов
различными ее отделами.
2. Рефлекторная дуга вегетативного
рефлекса, ее отличия от рефлекторной дуги соматического рефлекса.
. Ганглии вегетативной нервной системы.
Особенности проведения возбуждения в ганглиях автономной нервной системы.
Понятие о ганглиоблокаторах.
. Медиаторное обеспечение в симпатическом
отделе автономной нервно системы. Механизм ауторегуляции освобождения медиатора
в эффекторных синапсах. Эффекты взаимодействия медиатора с постсинаптическими
рецепторами. Системы вторичных посредников.
. Медиаторное обеспечение в
парасимпатическом отделе автономной нервной системы. Механизмы ауторегуляции
освобождения медиатора в эффекторных синапсах. Эффекты взаимодействия медиатора
с постсинаптическими рецепторами. Системы вторичных посредников.
. Метасимпатическая (энтеральная) нервная
система, ее роль в регуляции висцеральных функций организма. Взаимодействие с
экстраорганными нервными волокнами.
. Функциональный антагонизм и
физиологический синергизм симпатического и парасимпатического отделов
автономной нервной системы.
. Сегментарный уровень организации
вегетативных рефлексов. Классификация вегетативных рефлексов. Значение для
практической деятельности врача.
. Тонус вегетативных центров. Значение
для деятельности внутренних органов, механизм формирования.
Ключевые понятия и определения
Автономная (вегетативная) нервная система - это
комплекс центральных и периферических клеточных структур и их отростков,
регулирующих функциональный уровень внутренней жизни организма, который
необходим для адекватных реакций внутренних систем для сохранения гомеостаза в
различных условиях.
Анатомические особенности:
вегетативная нервная система представлена сегментарными и надсегментарными
структурами.
Сегментарный отдел представлен
нейронами, заложенными главным образом в спинном мозге и частично в стволе
головного мозга (ядра глазодвигательного, блуждающего, лицевого и
языкоглоточного нервов).
Нейроны сегментарных отделов, их отростки и
ганглии образуют периферический отдел автономной нервной системы. Здесь
различают три отдела ВНС:
· симпатический;
· парасимпатический;
· метасимпатический (энтеральный).
Надсегментарный отдел представлен
ретикулярной формацией, ядрами среднего и промежуточного мозга, лимбической
системой, мозжечком и центрами коры больших полушарий.
Особенностью строения рефлекторной
дуги вегетативных рефлексов является:
· отсутствие четкого рецептивного поля;
· наличие интернейронов в области
поступления первичной афферентации;
· принцип мультипликации (дивергенции);
· двухнейронность эфферентной части
рефлекторной дуги;
· возможность вовлечения в ответную
реакцию множества эффекторов.
Вегетативные ганглии
- структурные образования, где происходит передача информации с
преганглионарных волокон (отростки первого нейрона, расположенного в ЦНС) на
второй нейрон, который образует постганглионарные волокна, иннервирующие
внутренние органы или передающие информацию на нервные элементы
метасимпатической (энтеральной) нервной системы.
Медиаторы автономной нервной системы:
· ацетилхолин взаимодействует
на постсинаптической мембране с Н- или М-холинорецепторами (в
зависимости от расположения синапсов);
· норадреналин и адреналин
взаимодействуют с α1-, α2-,β1-, β2-адренорецепторами.
Медиаторы эффекторных синапсов автономной
нервной системы, в зависимости от постсинаптических рецепторов, включают
различные системы вторичных посредников.
Холиномиметики - лекарственные
средства, которые, воздействуя на холинорецепторы, оказывают на эффекторный
орган действие подобное ацетилхолину.
М-холиноблокаторы - это
лекарственные вещества, которые, воздействуя на М-холинорецепторы,
предотвращают влияние на них ацетилхолина.
Н-холиноблокарующее действие
оказывают: ганглиоблокаторы и миорелаксанты.
Ганглиоблокаторы - это
лекарственные вещества, которые блокируют Н-холинорецепторы в вегетативных
ганглиях.
Миорелаксанты - это
лекарственные вещества, которые блокируют Н-холинорецепторами в нервно-мышечных
синапсах.
Н-холинорецепторы блокируются
аммониевыми соединениями.
М-холинорецепторы выключаются
атропином, скополамином.
Адреномиметики -
лекарственные средства, которые, воздействуя на адренорецепторы, оказывают на
эффекторный орган действие подобное норадреналину.
Адреноблокаторы - это
лекарственные вещества, которые соединяясь с адренорецепторами, блокируют
действие на них норадреналина.
Метасимпатическая часть ВНС - комплекс
микроганглионарных образований, расположенных в стенках внутренних органов:
сердца, бронхов, мочевого пузыря, пищеварительного тракта, матки и т.д. Передача
возбуждения в ганглиях метасимпатической системы опосредуется ацетилхолином и
норадреналином, а с постганглионарных волокон на рабочий орган - при помощи АТФ
и аденозина; рецепторы для данных медиаторов называются пуринергическими.
Необходимо уметь:
воспроизвести опыты Гольца, Данини-Ашнера,
дермографию.
Работа №22. Опыт Гольца.
Цель работы: провести наблюдения за
рефлекторными влияниями на деятельность сердца рецепторов и чувствительных
волокон брюшной полости.
Необходимо для работы: лягушка, препаровальный
набор, кимограф, рычажок Энгельмана, серфины, 0,1% раствор атропина сульфата.
Проведение работы:
1. Лягушку декапитировать и зафиксировать
на дощечке брюшком вверх (для лучшей иммобилизации можно перерезать седалищные
нервы задних лапок).
2. Разрезать кожу, приподнять край грудины
пинцетом и ножницами рассечь мышечную стенку и ключицы. Грудину удалить и
обнажить сердце. Подсчитать число сердечных
сокращений в одну минуту. Можно также соединить
сердце с рычажком Энгельмана и отрегулировать запись кардиограммы на кимографе.
3. Шпателем или пинцетом нанести 2-3 удара
по брюшной стенке лягушки и подсчитать число сердечных сокращений. Может
произойти кратковременная остановка сердца. Опыт следует повторить несколько
раз.
4. Оросить сердце (или ввести
внутрисердечно) одной каплей 0,1% раствора атропина сульфата. Пронаблюдать за
изменениями в частоте сердечных сокращений.
. На фоне действия атропина еще раз
воспроизвести опыт Гольца и по частоте сокращений сердца определить,
сохраняется ли на него влияние блуждающего нерва.
. В протоколе описать последовательность
проведения опыта, внося результаты или вклеивая полученные кардиограммы на
разных этапах эксперимента.
. Проанализировать полученные результаты
и сделать выводы.
Работа №23. Рефлекс Данини-Ашнера
Цель работы: пронаблюдать за рефлекторными
реакциями со стороны сердца в ответ на раздражение рецепторов глазных яблок.
Необходимо для работы: испытуемый, секундомер.
Проведение работы:
1. У испытуемого по пульсу определить
частоту сердечных сокращений.
2. Через стерильные марлевые салфетки
большими пальцами рук в течение 10 с. медленно надавливать на глазные яблоки
(не сильно).
. Сразу после надавливания вновь
подсчитать частоту сердечных сокращений. При этом необходимо учесть, что в
норме в этих условиях наблюдается урежение пульса в среднем на 10 ударов.
. В протоколе кратко описать ход работы,
отметить частоту пульса до и после надавливания на глазные яблоки. Зарисовать
схему рефлекторной дуги наблюдаемого рефлекса.
Работа №24. Дермография
Цель работы: определить латентный период и
длительность сосудистой реакции на местное механическое раздражение для
характеристики тонуса ВНС.
Необходимо для работы: испытуемый, перкуссионный
молоточек, секундомер.
Проведение работы:
1. Концом перкуссионного молоточка (или тупым
концом карандаша, ручки) произвести штриховое, равномерное движение по коже
внутренней поверхности предплечья испытуемого, одновременно включив секундомер.
Отметить в протоколе, когда на коже появится и исчезнет красная полоса, которая
является прямой реакцией сосудов кожи на механическое раздражение. Вокруг
раздраженного участка кожи по аксон-рефлексу изменяется тонус артериол и
кровенаполнение капилляров; при этом кожа краснеет, но в некоторых случаях
может и побледнеть.
2. Оценку результатов произвести с учетом
показателей, представленных в таблице:
|
Возраст
(лет)
|
Латентный
период (с)
|
Длительность
(мин)
|
|
2-10
|
3,5
|
-
|
|
10-20
|
4,0
|
27
|
|
20-30
|
5,9
|
30
|
|
30-40
|
6,0
|
30
|
Тема №8. Центральные механизмы
регуляции висцеральных функций
Необходимо знать:
1. Спинальный уровень регуляции
вегетативных функций. Спинальный шок. Вегетативные проявления спинального шока.
Адаптивные возможности спинального животного.
2. Роль продолговатого и среднего мозга в
регуляции висцеральных функций. Адаптивные возможности бульбарного животного.
. Гипоталамус, как высший подкорковый
отдел регуляции висцеральных функций. Интегративные механизмы, осуществляющие
вегетативное обеспечение биологически детерминированных форм поведения,
эмоционального реагирования. Эрго- и трофотропные зоны гипоталамуса.
. Лимбическая система мозга, её основные
структурные образования. Роль лимбической системы в регуляции висцеральных
функций, и включение их в интегративные реакции, направленные на сохранение
индивида и вида.
. Значение коры больших полушарий в
регуляции вегетативных функций. Кортико-висцеральные взаимоотношения (К.М.
Быков). Физиологические основы психотерапии.
Ключевые понятия и определения
Спинальный шок - это
временное угнетение функционального тонуса нервных центров, расположенных ниже
области перерезки (повреждения) спинного мозга, вследствие нарушения его связей
с вышележащими центрами головного мозга.
Адаптивные реакции - это
рефлекторные реакции, направленные на поддержание гомеостаза, в ответ на
раздражения, поступающие из внутренней или внешней среды. Например, реакции со
стороны сосудистой стенки в ответ на раздражение барорецепторов сосудистых
рефлексогенных зон.
Необходимо уметь:
1. Произвести оценку функционального тонуса
отделов ВНС.,
2. Произвести оценку вегетативной
реактивности.
Работа №25. Оценка вегетативных
показателей. Расчет вегетативного индекса Кердо.
Цель работы: овладеть методикой оценки
функционального тонуса отделов ВНС.
Необходимо для работы: испытуемый, тонометр,
фонендоскоп, секундомер.
Проведение работы
1. Измерить у испытуемого частоту сердечных
сокращений (ЧСС) за одну минуту и величину артериального давления.
(Преподаватель должен объяснить технику измерения артериального давления).
2. Произвести расчет вегетативного индекса
(ВИ) Кердо по следующей формуле:
ВИ= (1-величина диастолического
давления : ЧСС) . 100
3. Произвести трактовку полученных
результатов:
А) при полном вегетативном равновесии (эйтония)
в сердечно-сосудистой системе ВИ=0
Б) если коэффициент положительный, то
преобладают симпатические влияния, если цифровое значение коэффициента
отрицательное, то преобладает парасимпатический тонус.
. Результат измерений внести в
протокольную тетрадь, рассчитать ВИ, сделать выводы.
Работа №26. Исследование
вегетативной реактивности.
Цель работы: овладеть простейшими методами
оценки вегетативной реактивности.
Необходимо для работы: секундомер, тонометр,
фонендоскоп, электрокардиограф.
Проведение работы
А. Симптом дыхательной аритмии
(рефлекс Геринга)
1. У испытуемого подсчитать пульс или зарегистрировать
электрокардиограмму (ЭКГ), (демонстрирует преподаватель).
. Испытуемому произвести серию глубоких
дыхательных движений (до чувства дискомфорта).
. На протяжении гипервентиляции у испытуемого
периодически подсчитывать пульс или продолжать регистрацию ЭКГ. При нормативном
вегетативном реагировании пульс несколько урежается. При вегетативных
нарушениях рефлекс может резко усилиться.
. В протоколе кратко описать выполнение работы.
Объяснить механизм рефлекса Геринга. Полученные результаты внести в таблицу:
|
Условия
измерения
|
ЧСС
|
|
Покой
|
|
|
Гипервентиляция
|
|
|
30
сек
|
|
|
1
мин
|
|
|
2
мин
|
|
|
3
мин
|
|
Б. Ортостатическая проба
1. У обследуемого после пяти минут пребывания в
положении лежа дважды подсчитать ЧСС и измерить артериальное давление.
. По команде испытуемому спокойно, без рывков
занять положение стоя.
. Пульс подсчитать на первой и третьей минутах
пребывания в вертикальном положении, артериальное давление определить на
третьей и пятой минутах. Оценку пробы можно осуществлять только по пульсу и
артериальному давлению по трехбалльной системе (см. таблицу).
|
Переносимость
пробы
|
ЧСС
|
Давление
|
Вегета-тивные
реакции
|
|
|
Систоли-ческое
(АС)
|
Диастоли-ческое
(АД)
|
пульсовое
|
|
|
Хорошая
|
не
более чем на 11 ударов
|
повышается
|
снижается
|
повышается
|
отсутст-
вуют
|
|
Удовлетворительная
|
на
12-18 ударов
|
не
меняется
|
не
меняется или слегка повышается
|
не
меняется
|
потли-
вость
|
|
неудовлетворительная
|
на
19 ударов и более
|
снижается
в пределах 5-10 мм.рт.ст.
|
повышается
|
снижается
|
потливость,
шум в ушах
|
. Таблицу расчертить в виде бланка в протокольной
тетради и внести в нее полученные результаты, на основании которых дать оценку
пробы и заключение о рефлекторных механизмах регуляции гемодинамики при
изменении положения тела.
В. Клиностатическая проба
1. Обследуемому следует находиться в вертикальном
положении в течение 5-10 минут.
. Измерить артериальное давление и пульс.
. Затем по команде испытуемый должен лечь на
кушетку, после чего у него необходимо сразу измерить артериальное давление и
пульс с минутными интервалами.
. Результаты внести в таблицу:
|
Условия
измерения
|
АД
|
Пульс
|
|
Положение
стоя
|
|
|
|
Положение
лежа
|
|
|
|
1
мин.
|
|
|
|
2
мин.
|
|
|
|
и
т.д.
|
|
|
5. Произвести трактовку результатов. При
переходе из вертикального в горизонтальное положение возвращение АД и ЧСС
должны через 3 мин. прийти к исходному уровню. Непосредственно после
укладывания может наступить кратковременный подъем давления.
Оценку изменения частоты сердечных сокращений
лучше всего производить при регистрации ЭКГ по П. стандартном отведении по
величине R-R
интервалов.
Тема 9. Физиология желез внутренней
секреции. Гормональная регуляция функций организма.
Необходимо знать:
1. Понятие о железах внутренней секреции.
Функциональное значение гормонов для организма. Методы изучения функций желез
внутренней секреции.
2. Классификация гормонов. Три уровня
ответа организма на действие раздражителя. Основные отличия гормонального
механизма регуляции функций - от нервного.
. Механизмы влияния гормонов на
клетку-эффектор: рецепция гормона, вторичные посредники, гашение гормонального
сигнала.
. Типы влияния гормонов на организм.
. Гормоны гипофиза, метаболические и
функциональные эффекторы. Тропные и эффекторные гормоны гипофиза.
. Регуляция эндокринной функции гипофиза.
Гипоталамо-гипофизарные взаимоотношения. Понятие нейросекреции. Структурные и
функциональные особенности нейросекреторных клеток.
. Особенности секреции гормонов
щитовидной железы. Метаболические и функциональные эффекты Т3, Т4.
Регуляция секреции тиреоидных гормонов. Принцип отрицательной обратной связи.
. Надпочечники. Гормоны коркового
вещества надпочечников, их метаболические и функциональные влияния на организм.
Регуляция секреции.
. Гормоны мозгового вещества
надпочечников. Влияние адреналина на организм. Роль адреналина в организации
стресс-реакции.
. Женские половые гормоны, их
физиологическое значение, регуляция секреции. Эндокринная функция плаценты.
Мужские половые гормоны.
. Гормональные механизмы поддержания
уровня глюкозы в крови.
. Гормональные механизмы поддержания
уровня Са2+ в организме.
Ключевые понятия и определения
Перечислим основные этапы развития регуляторных
механизмов в живых организмах.
1. Древнейшей формой взаимодействия между
клетками многоклеточных организмов является их взаимное химическое влияние,
осуществляемое продуктами обмена веществ, которые выделяются в жидкости
организма. Продукты распада белков, углекислый газ, электролиты и другие
вещества создают гуморальный механизм регуляции и связи между органами.
2. Механизмы гуморальной регуляции в
процессе эволюции животного мира дополнились более сложными и более
совершенными механизмами нервной регуляции функций. Гуморальные
механизмы все более подчиняются нервному влиянию, при этом формируется единая нейрогуморальная
система регуляции функций организма.
. Следующий этап развития регуляторных
систем организма связан с появлением специальных органов - эндокринных желез,
которые вырабатывают гормоны, действующие гуморально, т.е. через жидкие
среды организма, но имеющие весьма тонкую специализацию. Гормоны регулируют
обмен веществ в организме, оказывают влияние на рост и физическое развитие,
обеспечивают выполнение репродуктивной функции, формирование иммунитета и
оказывают влияние на функциональное развитие нервной системы.
По химической природе гормоны
делятся на две основные группы:
· гормоны стероидной природы;
· производные аминокислот, пептиды и
белки.
Регулирующий эффект гормонов осуществляется
путем взаимодействия их
с рецепторами эффекторных органов или
клеток-мишеней.
Выделяют мембранную и ядерную рецепцию гормонов.
Рецепторы белковых, пептидных гормонов и
катехоламинов расположены на наружной поверхности мембраны.
Рецепторы стероидных гормонов и гормонов
щитовидной железы локализованы в цитоплазме и ядре клетки. Проходя через
мембрану, эти гормоны образуют комплекс белок-гормон, который после ряда
превращений проникает в ядро, где действие гормона реализуется на генетическом
уровне.
Гормон-рецепторный комплекс приводит к активации
мембранных ферментов и образованию вторичных посредников, через
которые реализуется гормональный сигнал.
I
система:
аденилатциклаза - цАМФ
В зависимости от гормонов, связывающихся с
рецепторами мембраны, может происходить либо активация, либо подавление
активности аденилатциклазы.
Следует отметить, что кратковременное увеличение
в клетке Са2+ является пусковым для многочисленных физиологических
процессов: сокращение мышц, секреция гормонов, выделение медиаторов и т.д.
Между вторичными посредниками устанавливаются
различные взаимосвязи:
1. равноправное
участие, когда различные посредники реализуют наиболее полно гормональный
сигнал;
2. один из посредников способствует реализации
эффекта другого;
. посредники действуют последовательно;
. посредники дублируют друг друга,
с целью надежности регуляции;
. посредники могут быть антагонистами:
один из них стимулирует реакцию, а другой тормозит. Например, в гладких мышцах
сосудов инозитол-3-фосфат и кальций вызывают реакцию сокращения, а цАМФ-
расслабление.
Ведущую роль в регуляции деятельности желез
внутренней секреции играет гипоталамо-гипофизарная система. Вырабатываемые
нейросекреторными клетками гипоталамуса либерины и статины оказывают
регулирующее влияние на секреторную функцию передней доли гипофиза.
Нейрогипофизарная система (гипоталамус - задняя доля гипофиза) вырабатывает
висцеротропные нейрогормоны - вазопрессин и окситоцин.
Кроме того, существует нейросекреторная
иннервация нейронов вегетативных центров стволовой части мозга и лимбической
системы. Особую систему гормональной регуляции функций в пределах
гипоталамо-гипофизарного комплекса составляют нейрорегуляторные пептиды -
энкефалины, эндорфины, нейротензин, вещество Р и др.
Регуляция постоянства гормонов в организме
осуществляется механизмом отрицательной обратной связи или принципом «+», «-» -
взаимодействия. Возмущающим фактором может быть либо отклонение константы
гормона, либо колебание регулируемого данным гормоном параметра внутренней
среды (например, изменения концентрации сахара в крови).
Гипоталамус имеет обширные нервные афферентные и
эфферентные связи практически со всеми отделами центральной нервной системы.
Именно поэтому данный отдел промежуточного мозга в ответ на многочисленные
влияния на организм способен формировать чрез гипоталамо-гипофизарную систему
комплекс гормональных эффекторов, благодаря которым достигается тонкая
координация и интеграция жизнедеятельности клеток, тканей, органов и организма
в целом.
Необходимо уметь:
1.Экспериментально доказать функциональное
влияние гормонов.,
. Показать участие гормонов в механизмах
биологической адаптации.
Работа №27. Влияние адреналина на
зрачок энуклеированного глаза лягушки.
Цель работы: наблюдать кинетическое
(функциональное) влияние гормонов.
Адреналин вызывает сокращение мышцы, расширяющей
зрачок (m. Dilatator
pupille). Его действие
может наблюдаться не только на целостном организме, но и на энуклеированных
глазах, помещенных в физиологический раствор.
Необходимо для работы: лягушка, препаровальный
набор, раствор Рингера, адреналин (1:1000), стаканчик или чашечка.
Проведение работы:
1. Лягушку обездвижить и произвести
энуклеацию глаз (глазные яблоки вылущиваются из орбит).
2. В две чашечки налить по 5 мл раствора
Рингера и в каждую поместить по глазу.
. В одну чашку прибавить 0,5 мл раствора
адреналина и пронаблюдать за реакцией зрачка.
. В протокол записать ход работы,
выполнить рисунок. Сделать выводы и объяснить механизм влияния адреналина на
зрачок.
Работа №28. Влияние питуитрина и
адреналина на пигментные клетки кожи лягушки.
Цель работы: показать роль гормонов в механизмах
биологической адаптации организма на клеточном уровне.
Хроматофоры лягушек лишены иннервации, и их
функциональное состояние регулируется гормонами. Особенно важную роль в
регуляции распределения зерен пигмента имеет меланофорный гормон,
вырабатываемый промежуточной долей гипофиза. Он вызывает перемещение зерен
пигмента из центральной части клетки в ее отростки, что ведет к значительному
потемнению кожи. Антагонистами гормона являются адреналин и мелатонин, которые
вызывают концентрацию зерен пигмента в центральной части клетки и,
следовательно, посветление окраски тела.
Необходимо для работы: лягушка, препаровальный
набор, растворы питуитрина и адреналина (1:1000), раствор Рингера, чашечки,
микроскопы.
Проведение работы:
1. У обездвиженной лягушки на боковой стороне
туловища или бедра вырезать квадратные кусочки кожи размером 5-7 мм2
и поместить их в стеклянные чашечки с 5 мл раствора Рингера. В первую чашечку
прибавить три капли питуитрина, во вторую - две капли адреналина. Третья
чашечка с раствором Рингера будет служить контролем. Питуитрин является
экстрактом задней доли гипофиза и содержит меланофорный гормон.
2. Через каждые 10-15 мин. кусочки кожи
рассматривать под микроскопом под малым увеличением.
. Отмечаем, что действие меланофорного
гормона (питуитрина) начинает проявляться через 30 мин., зерна пигмента перемещаются
в начал ьную часть отростков пигментных клеток. Максимальное распространение
зерен пигмента наблюдается через 2 часа; действие адреналина проявляется
быстрее. Уже через 15-20 мин. все зерна пигмента собираются в центральную часть
меланофоров; в кусочках кожи, находящихся в чистом растворе Рингера (контроль),
меланофоры под микроскопом имеют вид звездочек, так как зерна пигмента
заполняют отростки этих клеток.
. В протокол записать ход работы,
зарисовать меланофоры после влияния на них питуитрина и адреналина, объяснить
биологическое значение наблюдаемых реакций.
Работа №29. Реакция Галли-Майнини.
Цель работы: наблюдать морфогенетический тип
влияния гормонов на организм.
Для ранней диагностики беременности у женщин
предложен ряд методов, среди которых наибольшую ценность имеют биологические
реакции подопытных животных на действие хориального гонадотропина. К
таким методам относятся сперматозоидная реакция Галли-Майнини. У самцов лягушки
вне естественного периода их размножения в содержимом клоаки никогда не бывает
сперматозоидов. Освобождение зрелых сперматозоидов из семенников и выход их в
клоаку происходит под влиянием гонадотропных гормонов. Этот процесс может
произойти в течение нескольких десятков минут после введения мочи беременной
женщины, содержащей гормон - хориальный гонадотропин.
Необходимо для работы: самец лягушки
(характеризуется наличием резонаторных мешков, коричневыми мозолями у основания
первого пальца передних лапок), шприц, моча беременной женщины (или гормон -
хориальный гонадотропин в стандартной упаковке), предметное стекло, пипетка,
микроскоп.
Проведение работы:
1. Самцу лягушки в спинной
лимфатический мешок ввести 2 мл мочи беременной женщины.
2. Через 40-60 мин. из клоаки пипеткой
набрать небольшое количество содержимого и перенести на предметное стекло. Если
реакция положительная, то под микроскопом в капле видны подвижные
сперматозоиды.
. Наблюдаемую картину зарисовать,
объяснить механизм влияния.