|
тип
|
число углеродных атомов
|
Пример
|
|
|
строение
|
название
|
|
гемитерпены
|
5
|
 изопрен изопрен
|
|
|
монотерпены
|
10
|
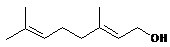 гераниол гераниол
|
|
|
сексвитерпены
|
15
|
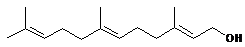 фарлезол фарлезол
|
|
|
дитерпены
|
20
|
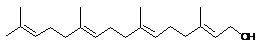 геранил-гераниол геранил-гераниол
|
|
|
сестертерпены
|
25
|
 офноболин А офноболин А
|
|
|
тритерпены
|
30
|
 сквален сквален
|
|
|
тетратерпены
|
40
|
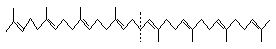 фитоин фитоин
|
|
|
политерпены
|
от 7*103 до 3*105
|
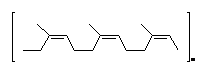 каучук каучук
|
|
Гемитерпены в растениях содержатся в очень малых количествах и были
найдены с помощью высокоэффективной масс-спекрофотометрии. В следовых же
количествах и также во всех растениях присутствуют фосфорилированные гемитерпны-D2-изопентилпирофосфат и D3-изопентилпирофосфат, являющиеся ключевыми
интермедиаторами в биосинтезе терпенов [66,62].
Монотерпены - достаточно летучие вещества, с сильным и оригинальным
ароматом, что используется в производстве душистых веществ. В силу своей
летучести, они постоянно испаряются растениями в процессе вегетации, а в
лаборатории их выделяют из растительного сырья перегонкой с водяным паром.
Монотерпены, содержащие спиртовые группы могут находиться в растениях в
связанной форме - в виде гликозидов, что соответствует их удерживанию и
пролонгированному использованию.
Различают ациклические (мирцен), моноциклические (лимонен, логанин,
хризантемовая кислота) и бициклические (a - пинен, борнимен, камфен) терпены.
Сесквитерпены представляют собой самую обширную группу среди всех
терпеноидов как по количеству соединений, обнаруженных в природе, так и по
множеству структурных вариантов и разнообразию типов углеродного скелета. В
наибольшем количестве и разнообразии сексвитерпены присутствуют в растениях из
семейств Magnoliaceae, Rutaceae, Cornaceae и Asteraceaee. Сексвитерпены бывают
ациклические (фарнезен, нероледол), моноциклические (b - бисобален, элемол), бициклические
(ледол, пачулевый спирт). Полученные свойства сесквитерпенов достаточно разнообразны.
Некоторые из них обладают приятным и устойчивым запахом, что позволяет
использовать их в парфюмерии в качестве душистых компонентов и фиксаторов
запаха. В качестве лекарственных препаратов наиболее перспективными являются
сесквитерпеновые лактоны. Спектр их действия достаточно широк: они обладают
бактерицидной, фунгицидной, антифидантной и антитрактантной активностью. Но
особенно ярко выражена цитотоксическая активность [66,37].
Дитерпены представлены значительно в меньшей степени в растительном мире.
Дитерпены также делятся на ациклические (фитол), моноциклические (цембрен),
бициклические (лабдан) и трициклические (циатан). Биологическая активность
дитерпенов ярко выражена: соединения этой группы терпеноидов очень часто
проявляют цитотоксическую активность, причем столь эффективную, что ряд из них
проходят клинические испытания; также противоопухолевое , антифидантное и
антифунгицидное действие .
Сестерпеноиды - самая многочисленная группа терпеноидов, но и самая
молодая. Основными источниками этой группы являются морские организмы (особенно
губки). Яркими представителями этой группы являются: тетроловая кислота
(антимикробная активность), маноамид (ингибитор фосфолипазы А2,
противовоспалительный эффект), спонгианолид А (ингибитор протеинкиназы С) и др.
Тритерпеноиды обычно накапливаются в растениях в виде эфиров различных
кислот или в виде гликозидов. В последнем случае они образуют так называемые
стероидные сапонины, а тритерпены, участвующие в этих образованиях, выделяют в
группу сапогенинов. В растительном мире тритерпены представлены в свободной
форме, т.е. не в качестве агликонов сапогениновых гликозидов. По структуре
выделяют несколько типичных групп таких как:
- витостероиды (витеферин А)
- хинонметидные тритерпены (целастрол)
лимоноиды (овакунон, трихимен Н)
Среди них обнаружены биологически активные субстанции различного типа:
антифедантная, противовирусная, иммунно-регулирующая, цитотоксическая и т.д
[66].
Тетратерпеноиды включают одну единственную, структурную группу -
каротиноиды. Всего известно около 500 соединений этой группы, распространены
они, в большей степени, в растительных организмах, где они и сентезируются.
Основной структурной особенностью каротиноидов является наличие длинной
сопряженной системы p -
связи. Отсюда вытекают такие свойства каротиноидов как легкость окисления и
восстановления, их способность поглощать фотоны малой и средней энергии (т.е.
видимый и УФ - свет) и, соответственно, быть окрашенными соединениями. А из
этих свойств уже вытекают и биологические функции каротиноидов: во - первых -
это участие в процессе фотосинтеза, т.к. этот процесс включает стадии
поглощения света и переноса электронов; во - вторых - это светозащитные
свойства, связанные со способностью поглощать световую энергию (очевидно,
излишнюю для растений), без существенных изменений структуры молекулы
каротиноида.
.3.2 Методы выделения терпеноидов
Терпеновые соединения, представляют собой большую группу органических
веществ растительного происхождения, отличающиеся высокой и разнообразной
активностью. Они находят широкое применение в медицине как в качестве
индивидуальных лекарственных веществ (ментол, тимол, камфора), так и в составе
сложных лекарственных препаратов.
Объектом анализа обычно служит выделяемая из растительного материала
смесь моно - и сесквитерпеновых соединений - так называемое эфирное масло (ЭМ)
[65,37].
Обычными методами выделения ЭМ из природных источников для последующего
анализа является экстракция, перегонка с водяным паром, концентрирование на
твердых сорбентах и в криоловушках. При этом ЭМ, выделенное из растительного
материала различными способами, могут существенно отличаться по составу и
соотношению основных компонентов.
Экстракцию терпеноидов из твердых и жидких образцов проводят
органическими растворителями с низкими температурами кипения. Часто экстракцию
осуществляют в течение определенного времени (иногда до нескольких суток) в
аппарате Сосклета. Полученный экстракт концентрируют упариванием в токе
инертного газа или с помощью вакуумной отгонки при низких температурах. К
преимуществам этого метода можно отнести возможность выделения из образца
термолабильных и малолетучих соединений, к недостаткам - необходимость
концентрирования экстракта, что может привести к потерям мелколетучих веществ,
возможность загрязнения испарителя и колонки газового хроматографа нелетучими
соединениями и продуктами их разложения.
Для выделения ЭМ из растительного материала широко используются перегонка
с водяным паром. Здесь используется стеклянные приборы различной конструкции,
позволяющие с точностью ±
0,02 мл измерить объем выделенного ЭМ. Анализ на этой стадии заканчивается и на
основании величины содержания ЭМ решается вопрос о качестве лекарственного
растительного сырья. В процессе перегонки ЭМ собирается в 100 мл пентана или
гексана и полученная смесь исследуется с помощью ГЖХ [65].
Разработан комбинированный метода выделения ЭМ с помощью сочетания
перегонки с водяным паром и экстракция терпеновых соединений из дистиллята
органическими растворителями. Для анализа требуется от 1 до 15 г растительного
материала, ЭМ собирается в 1 мл растворителя.
Другим методом выделения и концентрирования терпеноидов является
улавливание летучих веществ сорбентами (тенакс, полисорб). Этот метод удобен в
тех случаях, когда необходимо исследовать легколетучие вещества в газовых
образцах. Определенный объем газа, содержащего летучие вещества, пропускают
через трубку с сорбентом или капилляр, охлажденный жидким азотом.
Быстрым методом выделения является испарение ЭМ из очень малых количеств
растительного материала (3 - 5 мг), помещенных непосредственно в
модифицированный испаритель газового хроматографа.
.3.3 Идентификация терпеноидов
Для идентификации терпеноидов используются различные методы хроматографии
для разделения смесей терпеновых соединений. Широко применяются
спектроскопические методы (УФ -, ИК -, ЯМР - спектроскопии, рентгеноструктурный
метод) [65,37].
1) Физико-химические методы анализа.
Если цель исследования состоит в определении одного или нескольких
компонентов в сложной смеси терпеноидов, то могут применяться различные
относительно селективные физико - химические методы. Так, для определения
отдельных компонентов ЭМ описано применение колориметрии окрашенных производных
терпеноидов, спектрофотометрии в ИК - и УФ - областях спектра. Кислородсодержащие
терпеноиды (спирты, альдегиды, кетоны) определяли с помощью неводной
оксидиметрии и полярографии. Определение главных компонентов в ЭИ проводилось
также методами ПМР - и13С - ЯМР - спектроскопии.
2) Хроматографические методы
а) ТСХ (тонкослойная хроматограмма) и БХ (бумажная хроматограмма)
Большую роль в исследовании смесей терпеновых соединений сыграла
хроматография на бумаге и в тонком слое сорбента. Эти сравнительно доступные
методы позволяют проводить качественное и полуколичественное определение
основных компонентов ЭМ. Для разделения ЭМ применяются системы растворителей
различной полярности. Детектирование проводят облучением хроматограмм в УФ -
светом или с помошью реагентов - проявителей (к. Н2SO4 ,
иногда с добавлением ванилина или анисового альдегида, SbCI3 или
фосфорномолибденовой кислоты и др.), образующих окрашенные соединения с
определяемыми веществами. Недостатками ТСХ и БХ является относительно большая
длительность анализа, сравнительно малая эффективность разделения,
невозможность точного количественного определения компонентов смеси.
б) ВЭЖХ (высоко эффективная жидкостная хроматограмма )
ВЭЖХ с успехом используется для анализа смесей терпеновых соединений.
Важным преимуществом ВЭЖХ является возможность анализа малолетучих и термолабильных
соединений .
Полупрепаративная ВЭЖХ позволяет разделить сложные смеси терпеноидов на
фракции, что значительно упрощает их последующее исследование с помощью ГЖХ.
в) ГЖХ (газо-жидкостная хроматограмма)
ГЖХ наиболее широко используется для сложных смесей терпеновых
соединений. Это обусловлено следующим: терпеноиды имеют температуру кипения от
150 до 350 0С и достаточное парциальное давление для проведения
анализа этим методом. ГЖХ в настоящее время является наиболее эффективным
методом разделения сложных смесей, она может использоваться в сочетании со
спектроскопическими методами идентификации. Для анализа смесей терпеноидов
успешно используют различные неподвижные фазы (НЖФ) широкого диапазона
полярности - от неполярных (SE - 30, OV - 101) до полярных (карбовакс 20М).
Чувствительность метода ГЖХ определяется типом используемого детектора.
При исследовании смеси терпеновых соединений преимущественно используются
пламенно-ионизационный детектор и детектор по теплопроводности,
чувствительность которых составляет в среднем соответственно 10-10 -
10-13 и 10-8 - 10-10 г/сек [65,75].
) Предварительное фракционирование и вспомогательные реакции
Наиболее простым, но очень эффективным способом предварительного
фракционирования смесей терпеноидов является их адсорбционная хроматография на
силикогеле. При использовании в качестве растворителя чистого алкана, например
пентана, из колонки элюируются только терпеновые углеводороды. Более полярные
растворители (эфиры, галогенуглеводороды) элюируют кислородсодержащие терпеноиды.
Использование ступенчатого градиентного элюирования при увеличении содержания
диэтилового эфира в пентане позволяет разделить отдельные группы
кислородсодержащих монотерпеновых соединений. Первыми элюируются эфиры, затем
альдегиды и кетоны, последними - спирты, при этом порядок элюирования
терпеноидов дает ценную информацию о характере функциональных групп [65].
1.3.4 Количественное определение терпеноидов
Каротиноиды являются одной единственной группой тетратерпенов. Широкое
разнообразие физико - химических характеристик (полярность, эктинкция,
растворимость и др.) каротиноидов используется при разработке простых и
эффективных методов их качественного и количественного анализа.
Для извлечения из сырья липофильных биологически активных веществ (к ним
относятся и каротиноиды) в качестве экстрагентов используют: жиры и масла, СО2,
органические растворители (хлороформ, гексан, четыреххлористый углерод и т.д.).
Также применяются системы несмешивающихся растворителей различной полярности -
двухфазные системы экстрагентов (ДС 7). Ранее были показаны преимущества
экстракции ДСЭ по сравнению с экстракцией сырья растительным маслом. Было
установлено, что количественное содержание липофильных веществ в масляных
экстрактах, полученных с применением ДСЭ, значительно выше, чем при экстракции
растительного сырья маслом.
В последнее время наибольшее распространение для количественного анализа
каротиноидов получили методы ВЭЖХ, зачастую не требующие предварительной
подготовки образцов и решающие проблему различной полярности анализируемого
класса соединений, применения градиентного элюирования в обращенно - фазовом
варианте. Вместе с тем необходимо отметить, что метод градиентного элюирования
обладает рядом недостатков, делающих реализацию его затруднительной. Для количественного
определения каротиноидов, а также их суммы, применяют спектрофотометрический
метод [66,65].
1.4 Общая характеристика мазей и мазевых основ
1.4.1 Мази как лекарственная форма
Мазь - мягкая лекарственная форма для наружного применения. Мази представляют
собой высоковязкие жидкости, способные образовывать на поверхности кожи или
слизистой оболочки ровную, несползающую сплошную пленку. При комнатной
температуре мази вследствие высокой вязкости сохраняют форму и теряют ее при
повышении температуры, превращаясь в густые жидкости. По дисперсологической
классификации мази должны быть отнесены к свободным всесторонне дисперсным
бесформенным системам с пластично - или упруговязкой дисперсионной средой. От
типичных жидкостей они отличаются отсутствием заметной текучести.
Мази состоят из основы и равномерно распределенных в ней лекарственных
(действующих) веществ.
В форме мазей в настоящее время применяются лекарственные препараты,
относящиеся практически по всей фармакологическим группам.
В мази вводятся как твердые, так и жидкие лекарственные вещества
различной вязкости (жидкость Бурова, эфирные масла, деготь, ванилин и др.)
[10,24].
Классификация мазей
Мази классифицируют по типу основ дисперсионных систем.
Классификация мазей по типу основ:
1. Мази на гидрофильных основах.
2. Мази на гидрофобных основах.
. Мази на эмульсионных (дифильных) основах:
а) мази на основах типа эмульсии В/М;
б) мази на основах типа эмульсии М/В;
Классификация мазей по типу дисперсных систем:
1. Гомогенные мази:
а) мази - сплавы
б) мази - растворы
в) экстракционные мази
2. Суспензионные мази:
а) двухфазные системы
б) трех - и многофазные системы
3. Эмульсионные мази:
а) мази - эмульсии типа М/В
б) мази - эмульсии типа В/М
4. Комбинированные мази.
Существует так же классификация по месту применения и по консистенции.
Лекарственные вещества, используемые в производстве мазей
Лекарственные вещества являются носителями фармакологического действия,
определяющего медицинский смысл назначения мази. В количественном отношении эта
группа представляет меньшую часть и обозначается «Exupiendum» (восприемлимое).
ВВ (вспомогательные вещества) обеспечивают надлежащий объем лекарства,
необходимую концентрацию лекарственного вещества и нужные физические свойства -
мягкую консистенцию, способность образовывать на поверхности кожи или слизистой
оболочки ровную, сплошную, несползающую пленку.
Совокупность ВВ называют основой «Basis Ungventum». Мазевые основы играют
важную роль в обеспечении необходимой массы и надлежащей концентрации
лекарственных веществ, оказывает существенное влияние на стабильность мазей.
Степень высвобождения лекарственных веществ из мазей во многом зависит от
природы и свойств основы, скорости и полноты резорбции [10,25].
1.4.2 Классификация основ для мазей
В современной фармации используется множество мазевых основ. Мазевые
основы можно разделить на три группы:
1. Гидрофобные;
2. Гидрофильные;
. Эмульсионные дифильные;
1) Гидрофобные мазевые основы
К группе гидрофобных мазевых основ относятся липофильные, углеводородные,
силиконовые, полиэтиленовые и полипропиленовые гели.
Липофильные основы представляют собой или отдельные жиры (свиной,
гусиный, бычий, тюлений), или комбинации твердых и жидких основ, имеющих упруго
- эластичную консистенцию.
Все большую популярность завоевывают так называемые модифицированные
жиры, полученные из растительных масел, жидких жиров гидрогенизацией,
фракционированием (саломас, комбижир, хлопковое масло, гидрогенизированное
подсолнечное масло и др.) [33].
Углеводородные основы представляют собой смесь жидких и твердых
углеводородов с числом атомов С17 - С35.
Сравнительно широкое применение в производстве мазей углеводороды нашли в
связи с тем, что они не окисляются и не прогоркают при длительном хранении,
устойчивы к воздействию кислот и щелочей, окислителей и восстановителей.
Недостатком этой группы является медленная и неполная передача лекарственных
веществ, тканями, т.е. углеводороды не всасываются кожей и слизистыми
оболочками. Представителями этой группы основ являются: вазелин, петролятум, парафин,
церезин, вазелиновое масло, искусственный вазелин [24].
Силиконосодержащие безводные основы.
Эти основы получают путем сгущения жидких силиконовых масел аэросилом или
сплавлением жидкостей с другими гидрофобными компонентами.
Полиэтиленовые или полипропиленовые основы. В эарубежной практике в
качестве основ для мазей применяют композиции, известные под
названиями:Plastibase, Selene, Equle, и др. Они представляют собой смеси
полиэтилена низкой и высокой плотности с вазелиновым маслом [33].
2) Гидрофильные основы
В эту группу основ объединены водные растворы и гели низко - и
высокомолекулярных веществ.
Гидрофильные основы не оставляют на коже жирного следа, легко смываются
водой. Эти основы способны легко отдавать медикаменты из наружной водной фазы в
ткани организма.
Растворы и гели полисахаридов.
Для их приготовления используется МЦ, которая набухает в воде, образуя
вязко пластичные гели. Наибольшее применение в производстве основ этого типа
нашли эфиры целлюлозы: МЦ, натриевая соль карбоксиметилцеллюлозы (Na - КМЦ). Их
растворы безвредны для организма, но вследствие высокой прочности Na - КМЦ
может нарушать кислотный барьер кожи.
Полиэтиленовые основы (ПЭГ)
Могут представлять собой как отдельные мономеры, полученные
полимеризацией окиси этилена и имеющие упруго - вязкую пластичную консистенцию,
так и смесь, твердых и жидких ПЭГ. Своей высокой химической и фармакологической
индифферентностью эти основы завоевали большую популярность. ПЭГ основы хорошо
адсорбируют экссудат, растворяют труднорастворимые в воде лекарственные
вещества и не вызывают их гидролиза, легко удаляются с кожи смыванием водой
[25].
Гели глинистых материалов
Бентонитовые глины обладают высокой адсорбирующей способностью,
эмульгирующими свойствами и дают возможность готовить мази с маслянистыми
жидкостями (деготь, скипидар). Мази на бентонитовых основах хорошо пристают к
коже, адсорбируют кожные экссудаты, не пачкая белья. Ценными свойствами глины
является высокая химическая индифферентность, позволяющая вводить в мази иод,
KМnO4.
Аэросил - аморфная непористая двуокись кремния. В отличие от бентонита,
эфиров целлюлозы и др., набухающих компонентов, аэросил не набухает. В мазях
аэросил применяется как структурообразующий компонент, повышает температурную
устойчивость мазей в условиях климата [32].
Гели на основе сополимеров акриловой кислоты
Среди большого разнообразия полимерных материалов основной интерес
представляют акриловые полиэлектролиты, применяемые в качестве носителей
лекарственных веществ.
Карбопол - производное полиакриловых кислот, используемые в качестве
гелеобразователя.
САКАП - белый мелкодисперсный порошок, относится к ограниченно набухающим
сополимерам [33].
3) Эмульсионные дифильные мазевые основы
Это искусственно созданные композиции, обладающие липофильными и
гилрофильными свойствами.
Благодаря своеобразному составу мазевых дифильных основ, в них удается
вводить как водорастворимые, так и жирорастворимые лекарственные вещества,
диспергировать воду или водные растворы медикаментов.
В группе дифильных мазевых основ различают:
- Эмульсионные,
- «абсорбционные», мазевые основы.
Эмульсионные основы содержат в своем составе воду. Для их образования и
стабилизации необходимо присутствие ПАВ - эмульгаторов. Эти основы могут быть
двух видов: «М/В» и «В/М».
Мази, приготовленные с использованием эмульсионных основ, характеризуются
малой вязкостью, сравнительно невысокими адгезивными свойствами. Они легко
наносятся на кожу и легко удаляются.
«Абсорбционными» мазевыми основами называют безводные комбинации
разнообразных компонентов мазевых основ с эмульгатором, обладающие способностью
инкорпорировать воду или водные растворы лекарственных веществ с образованием
эмульсии типа «В/М».
В качестве абсорбционных мазевых основ используются безводные композиции
вазелина, вазелинового масла, свиного сала с безводным ланолином, жирными
высокомолекулярными спиртами и др. ПАВ [33,25].
Требования, предъявляемые к мазевым основам
Мазевые основы должны обладать совокупностью свойств [12,24,32].
1. Обладать мажущей способностью;
2. Обладать хорошими абсорбирующими свойствами;
. Быть химически стойкими, т.е. не изменяться под действием света,
не окисляться на воздухе, не реагировать с вводимыми в них лекарственными
веществами;
. Быть индифферентными в фармакологическом отношении;
. Не подвергаться обсеменению микроорганизмами;
. Соответствовать своему основному лечебному назначению;
. Не должны пачкать одежды, не быть излишне липкими, легко
смываться;
. По возможности сохранить первоначальное значение рН кожи и
слизистой оболочки.
1.4.3 Стандартизация мазей. Контроль качества
Однородность мази и ее внешний вид определяют визуальным контролем.
Однородность определяется по методике ГФ ХI издания. Для этого берут 4 пробы
мазей по 0.02 - 0.03 г, помещают по две на предметные стекла, плотно прижимают
до образования пятен диаметром 0.2см. При рассмотрении невооруженным глазом в
трех из четырех проб не должно обнаруживаться видимых частиц. Если же частицы
видны в большом числе пятен, определение повторяют на 8 пробах. При этом
допускается наличие видимых частиц не более чем в двух пятнах [10].
Определение размера частиц в мази проводят по методу, описанному в ГФ XI
издания. Проводят на биологическом микроскопе, снабженным окулярным микроскопом
МОВ - 1 при увеличении окуляра 15* и объектива 8*, Проба мази должна быть не
менее 5г и представлять собой объединенные точечные пробы (одномоментно
отобранные), взятые примерно в равных количествах из верхнего, среднего нижнего
слоев упаковочной единицы. Убеждаются в однородности точечных проб (визуально),
затем смешивают их. Если концентрация лекарственных веществ в мазях превышает
10%; то их разбавляют соответствующей основой до 10%. Из средней пробы мази
берут навеску 0.05г и помещают на необработанную сторону предметного стекла.
Другая сторона предметного стекла обработана следующим образом: на середине его
алмазом, или каким - либо другим абразивным материалом наносят квадрат со
стороной 15мм и диагоналями. Линии окрашивают с помощью карандаша по стеклу.
Предметное стекло помещают на водяную баню до растворения основы, прибавляют
каплю 0.1% раствора Судана III для жировых, углеводородных и эмульсионных основ
типа В/М или 0.15% раствор метиленового - синего для гидрофильных и
эмульсионных типа М/В, перемешивают. Пробу накрывают покровным стеклом
(24*24мм), фиксируют его путем слабого надавливания и просматривают в четырех
полях зрения сегментов, образованных диагоналями квадрата. Для анализа одного
препарата проводят 5 определений средней пробы. В поле зрения микроскопа должны
отсутствовать частицы, размер которых превышают нормы, указанные в частных
статьях [11].
Мази стандартизируют по содержанию лекарственных веществ, значению рН их
водных растворов и степени дисперсности твердых частиц в суспензионных мазях.
Определение дисперсности частиц мази проводится микроскопическим методом.
Для анализа одного препарата проводят 5 определений средней пробы. В поле
зрения микроскопа должны отсутствовать частицы, размер которых превышает нормы,
указанные в частных статьях. Нормы степени дисперсности индивидуальны для
каждой мази [10].
Определение рН мази необходимо для контроля над поведением лекарственных
веществ и основы во время хранения. Сдвиг рН свидетельствует об изменении
физико-химических свойств последних.
Значительное влияние на терапевтическую ценность мази как лекарства и ее
поведение при хранении и фасовке в тару оказывают структурно-механические
свойства.
Мази и мазевые основы обладают некоторыми свойствами твердых тел -
отсутствием текучести при малых напряжениях сдвига, заметной прочностью и
упругостью. В связи с этим консистенция мази должна определяться механическими
параметрами, такими как вязкость, прочность, адгезия, модуль сдвига,
тиксотропия и т.д.
Выводы по главе 1
. Растения рода Tagetes
нашли широкое применение в народной, но не в официальной медицине. Они содержат
важные биологически активные вещества, в том числе каротиноиды, терпены и
флавоноиды и могут служить источником их выделения.
. Для экстракции флавоноидов и терпенов используют разные органические
растворители. Способы выделения основаны на их физико-химических свойствах.
. Для установления строения этих групп соединений и количественного
определения их в сырье применяют химические и физико-химические методы анализа.
Из них наиболее чувствительными и широко используемыми являются различные виды
хроматографии (ТСХ, БХ, ВЭЖХ, ГЖХ) и спектрофотометрии в различных областях
оптического спектра: видимой и ИК.
. Отсутствие токсических эффектов флавоноидов и терпеноидов, в частности
каротиноиды, имеют широкий спектр фармакологического действия, что позволяет
использовать их в качестве лечебных и лечебно-профилактических средств.
. На основании вышеизложенного мы поставили перед собой цель провести
фармакотехнологическое исследование цветков бархатцев отклоненных как
перспективного источника получения суммы липофильных веществ (терпеноиды и
каротиноиды) и флавоноидов, и разработать на их основе лекарственную форму.
Глава 2. Фармакогностический анализ T. patula
.1 Анатомическое строение и диагностические признаки цветков Tagetes
patula
.1.1 Макроскопический анализ цветков T. patula
Бархатцы отклоненные Tagetes patula - является характерным представителем
семейства Asteraceae.
Для исследования нами были выбраны цветки бархатцев отклоненных,
собранные во время цветения. Образцы сырья (цветки) T. patula были заготовлены
в г. Пятигорске. Сырье представляет собой цельные или частично осыпавшиеся
корзинки диаметром 5-7 мм. Обертка серо-зеленая, однорядная; цветоложе плоское,
голое. Краевые цветки однорядные, язычковые, темно-оранжевого цвета. Цветки
диска трубчатые, обоеполые, оранжевые. Лопасти столбика туповатые, у средних
цветков более длинные, закрученные, у краевых - язычковых - расходящиеся. Вкус
солоновато-горький. Запах сырья сильно ароматный
.1.2 Микроскопический анализ цветков T. рatula
Изучение анатомического строения цветков бархатцев отклоненных проводили
на высушенном сырье. Просветляли препараты кипячением в 10% растворе
хлоралгидрата. Срезы приготавливали лезвием безопасной бритвы от руки и после
соответствующей обработки заключали в глицерин-желатиновую смесь. Изучение
анатомического строения проводили на временных препаратах.
Клетки мезофилла язычковых цветков лопастные, в силу чего образуются
крупные межклетники (рис.1). Проводящие пучки мелкие, состоящие из
немногочисленных элементов ксилемы и флоэмы, механическая обкладка отсутствует.
Клетки нижнего, наружного, эпидермиса в поперечном сечении квадратные или
прямоугольные (рис.2,Б). При рассматривания с поверхности они несколько крупнее
клеток верхнего эпидермиса: у одних растений мельче и с сильно извилистыми
боковыми стенками, у других - крупнее и с менее извилистыми боковыми стенками.
Кутикула продольно-бороздчатая на поперечном срезе мелкозубчатая. Клетки
верхнею эпидермиса (рис.2,А) сосочковидные, в основании с ровными боковыми
стенками. Сосочки варьируют по высоте: низкие под покровным стеклом имеют вид
кружков, а более высокие полегают, Кутикула сосочков продольно-бороздчатая:
бороздчатость более частая, чем у нижнего эпидермиса. Высота сосочков на
поперечном срезе может быть больше ширины их основания. Желтые хромопласты
имеются во всех клетках мезофилла и эпидермисов, особенно они обильны в
основании эпидермальных клеток. На язычковых цветках наблюдаются 1-рядные
многоклеточные волоски редко с 2-рядной верхушкой (рис.3; 1-4). На трубчатых
цветках клетки эпидермиса сильно вытянуты, длинные, боковые стенки их прямые
или слабо извилистые. На свободной части трубчатых цветков волоски широкие
(рис.3; 9-10), с перехватами, тонкостенные, 1-рядные, многоклеточные, реже
1-клеточные, содержащие хромопласты (рис.4). На листочках обертки на верхней их
части присутствуют обильные, 1-рядные, многоклеточные железистые волоски,
изредка встречаются раздвоенные и простые 1-рядные (рис.3; 5-8). Железки
расположены в углублениях обертки и сопровождаются секреторными ходами,
заполненными желтоватым маслянистым содержимым (эфирным маслом) (рис.5).

Рис. 1. Поперечный срез язычкового цветка T. patula
- клетки мезофилла; 2 - межклетники; 3 - проводящий пучок; 4 - нижний
эпидермис; 5 - зубчики кутикулы; 6 - верхний эпидермис; 7 - хромопласты.
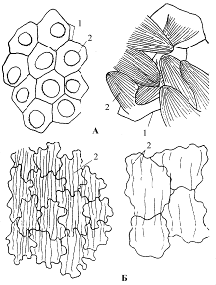
Рис. 2. Верхний (А) и нижний (Б) эпидермис с поверхности язычкового
цветка
- эпидермальные клетки с высокими и низкими сосочками; 2 - складчатость
кутикулы
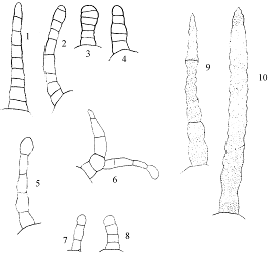
Рис. 3. Типы волосков соцветия T. patula
-4 - волоски язычковых цветков; 5-8 - волоски обёртки соцветия; 9, 10 -
волоски трубчатых цветков

Рис. 4. Хромопласты язычкового цветка T. Patula
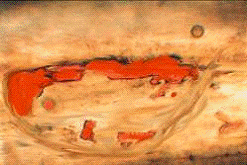
Рис.5. Вместилище с остатками эфирного масла в эпидермисе обертки
соцветия T. patula
2.2 Определение товароведческих показателей цветков T. рatula
.2.1 Определение влажности
Содержание влаги в исследуемом сырье проводили согласно методики
приведенной в ГФ XI издания, т.1 (стр.285). Цветки предварительно измельчали до
размера частиц не более 10 мм.
Влажность сырья (Х), в процентах, определяли по формуле:
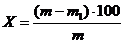 ,
,
где-
масса сырья до высушивания, в г;1 - масса сырья после высушивания, в
г
Результаты
представлены в таблице 5.
Таблица 5
Определение влажности сырья T. patula
|
№
|
Влажность
|
х- хi
|
(х - хi)2
|
Метрологические характеристики
|
1.
2. 3. 4. 5. 6. 5,8 6,3 6,0 5,7 5,5 5,9  S=35,2- 0,1
S=35,2- 0,1
+
0,4
+
0,1
0,2
0,4
,01
,16
,01
,04
,16
S=0,118;
Sx=0,290;
Dх=0,3;
e=5,15%;
.2.2 Определение общей золы
Определение общей золы в цветках T. patula проводили по методике
рекомендованной ГФ XI издания, т.2 (стр24). Содержание общей золы (X), в процентах, вычисляли по формуле:
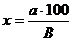 ,
,
где
а
- масса золы, в г;
В
- навеска сырья, в г
Пересчет
на абсолютно сухое сырье проводили по формуле:
 ,
,
где
х
- количество общей золы, в %;
Н
- влажность сырья, в %
Результаты
анализа представлены в таблице 6.
Таблица
6
Определение
общей золы в сырье T. patula
|
№
|
Зола, %
|
х - хi
|
(х - хi)2
|
Метрологические характеристики
|
1.
2. 3. 4. 5. 6. 9,8 9,3 9,1 8,7 9,1 9,2  S=55,2- 0,6
S=55,2- 0,6
0,1
+
0,1
+
0,5
+
0,1
,36
,01
,25
,01
S=0,146
Sx=0,358 Dх=0,38 e=4,08%
2.2.3 Определение золы, не растворимой в 10 %
хлористоводородной кислоте
Определение золы, не растворимой в 10 % хлористоводородной кислоте
проводили согласно методике рекомендованной ГФ XI издания, т.2 (стр.25).
Содержание золы (X), в процентах,
вычисляли по формуле:
Результаты анализа представлены в таблице 7.
Таблица 7
Определение золы, не растворимой в 10 % хлористоводородной кислоте, в
сырье T. patula
|
№
|
Зола не растворимая в 10 % хлористоводородной кислоте, %
|
х - хi
|
(х- хi)2
|
Метрологические характеристики
|
1.
2. 3. 4. 5. 6. 1,87 1,77 1,81 1,83 1,85 1,84  S=10,97- 0,04
S=10,97- 0,04
+
0,06
+
0,01
0,02
0,010,0016
,0036
,0001
,0004
,0001S=0,014
Sx=0,035 Dх=0,037 e=2,0%
2.3 Скрининг сырья T. patula на возможное присутствие
основных классов биологически активных веществ
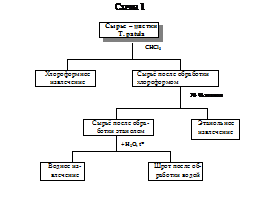
Скрининг проводили в извлечениях из цветков T. patula, полученных по
следующей схеме:
.3.1 Определение каротиноидов
- К 1 мл хлороформного извлечения аккуратно добавляли 10% раствор
треххлористой сурьмы. Наблюдали появление синего окрашивания.
- К 1 мл хлороформного извлечения, по стенке пробирки, осторожно,
добавляли концентрированную серную кислоту. Наблюдали появление темно-синего
окрашивания.
.3.2 Определение антраценпроизводных
Водное извлечение разливали в 2 пробирки по 2 мл. В одну пробирку
добавляли 1 мл 10 % раствора едкой щелочи. Вторая пробирка являлась
контрольной. Вишнево-красное окрашивание, указывающее на наличие
антраценпроизводных, отсутствовало.
.3.3 Определение дубильных веществ
В две пробирки помещали по 2 мл водного извлечения. В одну пробирку
добавляли несколько капель железоаммонийных квасцов. Вторая пробирка являлась
контрольной. Черно-зеленое окрашивание, указывающее на наличие дубильных
веществ, отсутствовало.
.3.4 Определение оксикоричных кислот
Наличие фенолкарбоновых кислот определяли с помощью ТСХ и БХ в системе
растворителей: 15% уксусная кислота и н-бутанол - уксусная кислота - вода
(4:1:1). Хроматограммы рассматривали в УФ-свете с последующей обработкой
реактивами: свежеприготовленными диазосоединениями в растворе Na2CO3; 2% раствором FeCl3 и 0,5н
спиртовым раствором NaOH. Наличие
пятен, характерных для оксикоричных кислот не наблюдали, что указывает на их
отсутствие в сырье.
.3.5 Определение азотистых оснований
К 3 мл извлечения прибавляли 3 капли (0,1 мл) 50 % раствора серной
кислоты до рН 1,0 - 2,0 и фильтровали на часовое стекло. При прибавлении к
фильтрату 3 капель (0,1 мл) 1 % раствора кремневольфрамовой кислоты появление
мути, а затем осадка, не наблюдали, что указывает на отсутствие азотистых
оснований.
2.3.6 Определение кумаринов
5,0 г цветков T. patula заливали 20 мл спирта этилового 95 % и нагревали
на водяной бане до кипения, после чего оставляли настаиваться. Спиртовое
извлечение отфильтровывали, упаривали на водяной бане до 5 мл. С полученным
экстрактом проводили реакцию, позволяющую быстро провести предварительное
обнаружение кумаринов. Для этого извлечение поместили в 2 пробирки по 2,5 мл. В
одну прибавляли 5 мл 10 % раствора едкого натра и нагревали на водяной бане. После
охлаждения в каждую пробирку добавляли по 4 мл дистиллированной воды. Появление
желтой окраски в первой пробирки свидетельствует о наличие кумаринов.
.3.7 Определение стеринов
Наличие стеринов можно доказать реакцией Либермана-Бурхарда (качественная
реакция на стероидное ядро). 1 мл извлечения выпаривали досуха в выпарительной
чашке, добавляли 2 мл этилового спирта, затем 2-3 капли уксусного ангидрида,
перемешивали. Наслаивали аккуратно по стенке чашечки концентрированную серную
кислоту. Наблюдали переход окраски от зеленой до фиолетовой, что
свидетельствует о наличие стеринов.
.3.8 Определение витаминов (аскорбиновой кислоты)
0,5 г измельченных цветков T. patula заливали 5 мл дистиллированной воды,
перемешивали, оставляли на 15 мин и фильтровали. К 1 мл полученного извлечения
прибавляли по каплям 0,04 % раствора 2,6 - дихлорфенолиндофенолята натрия в
воде. Образование белого осадка не наблюдалось, что свидетельствует об
отсутствие аскорбиновой кислоты.
.3.9 Определение белка и аминокислот
а) биуретова проба на пептидную связь. В пробирку помещали 0,5 мл
извлечения, прибавляли несколько капель биуретового реактива, слегка
взбалтывали. Окрашивание, свидетельствующего о наличие белка не наблюдали.
б) нингидриновая реакция на a-аминокислоты. В пробирку вносили 0,5 мл извлечения
прибавляли несколько капель 3 % спиртового раствора нингидрина, нагревали до
кипения. Окрашивания, свидетельствующего о наличие a-аминокислот и белка не наблюдали.
.3.10 Определение флавоноидов
Со спиртовым извлечением из цветков T. patula проводили следующие
качественные реакции на флавоноиды:
а) Цианидиновая реакция. 3 мл извлечения упаривали досуха на водяной
бане, остаток растворяли в 96 % этаноле. Полученное извлечение добавляли в
сухую пробирку с 0,5 г металлического магния, приливали 5-7 капель
концентрированной хлористоводородной кислоты. Через 5 минут наблюдали появление
красного окрашивания, что свидетельствует о наличие флавоноидов.
б) К 1 мл извлечения добавляли 1-2 капли раствора хлористого железа.
Наблюдали появление сине-зеленого окрашивания, что указывало на наличие
фенольных соединений.
в) К 1 мл извлечения прибавляли 3-5 капель раствора основного ацетата
свинца. Наблюдали образование желтого осадка, что подтверждает наличие
флавоноидов.
.3.11 Определение сапонинов
Определение проводили на основе физических свойств сапонинов - реакции
пенообразования.
мл водного извлечения помещали в пробирку, в другую - 10 мл спиртового
извлечения, в третью - 10 мл воды (контроль). Все пробирки встряхивали в
течение 10 мин. Образования стойкой пены не наблюдалось.
2.4 Количественное определение флавоноидов в цветках T. patula
Аналитическую пробу сырья измельчали до размера частиц, проходящих сквозь
сито с отверстиями диаметром 1мм. Около 1г (точная навеска) сырья помещали в
колбу со шлифом вместимостью 150мл, прибавляли 30мл 70% спирта. Колбу
присоединяли к обратному холодильнику и нагревали на кипящей водяной бане в
течение 30 мин. Затем колбу охлаждали до комнатной температуры и фильтровали
через бумажный фильтр в мерную колбу вместимостью 100 мл. Экстракцию повторяли
еще раз указанным выше способом, затем еще 1 раз 70% спиртом в течение 30 мин.
Извлечение фильтровали через тот же фильтр, в ту же мерную колбу, промывали
фильтр 70%-ным спиртом и доводили объем фильтрата 70%-ным спиртом до метки
(раствор А).
В мерную колбу вместимостью 50мл помещали 1мл раствора А и доводили объем
до метки 70%-ным спиртом. Измеряли оптическую плотность раствора на
спектрофотометре СФ-56 при длине волны 370нм в кювете с толщиной слоя 10мм. В
качестве раствора сравнения использовали 70%-ный спирт.
Содержание суммы флавоноидов в пересчете на кверцетин и абсолютно сухое
сырье в процентах (X) вычисляют по формуле:
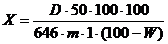 ,
,
гдеоптическая
плотность исследованного раствора;
-удельный
показатель раствора кверцетина при длине волны 370нм;масса сырья в
граммах;потеря в массе при высушивании сырья в процентах.
Результаты
представлены в таблице 8
Таблица 8
Содержание суммы флавоноидов в сырье T. patula
|
№
|
Сумма флавоноидов, %
|
х - хi
|
(х - хi)2
|
Метрологические характеристики
|
1.
2. 3. 4. 5. 6. 4,65 4,58 4,89 4,52 4,60 4,61  S=27,85- 0,01
S=27,85- 0,01
|
+ 0,06 - 0,15 + 0,12 + 0,04 +0,030,0001 0,0036 0,0225
0,0144 0,0016 0,0009S=0,053 Sx=0,129 Dх=0,135 e=2,91% х±Dх=4,64±0,135
|
|
|
|
.5 Количественное определение каротиноидов в цветках T. patula
г (точная навеска) измельченного сырья помещали в коническую колбу
вместимостью 100мл с притертой пробкой. С помощью пипетки наливали 85мл
гексана. Экстрагировали при периодическом перемешивании в течение 1,5ч.
Экстракт отфильтровывали через бумажный фильтр. 10мл экстракта помещали в
предварительно высушенную и взвешенную выпарительную чашку, упаривали на
водяной бане при 100-105°С в
течение 30 мин.
Содержание масла в сырье (в %) рассчитывали по формуле:
X
=  ,
,
где
а
- привес чашки, г;
А
- навеска абсолютно сухого сырья, г.
Содержание
масла в цветках бархатцев прямостоячих составило 12,99%.
Для
определения содержания суммы каротиноидов 0.2мл гексанового экстракта помещали
в мерную колбу вместимостью 25мл. Довели объем до метки тем же растворителем.
Определяли оптическую плотность полученного раствора на спектрофотометре СФ-56
при длине волны 450нм в кюветах с толщиной слоя 10мм. В качестве раствора
сравнения использовали гексан. Параллельно определяли оптическую плотность
раствора стандартного образца, приготовление которого проводят в соответствии с
ФС 42-1730-86 «Масло облепиховое».
Содержание
суммы каротиноидов С (в пересчете на b-каротин) в миллиграмм-процентах
рассчитывают по формуле:
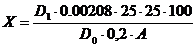 ,
,
где1-оптическая
плотность исследуемого раствора;0-оптическая плотность раствора
стандартного образца дихромата калия;
.00208-количество
b-каротина в мг, в растворе, соответствующем по окраске
раствору стандартного образца дихромата калия.
Содержание суммы каротиноидов в полученном образце составило 80,8мг/%.
Таблица 9
Содержание каротиноидов в сырье T.
patula
|
№
|
Сумма каротиноидов, мг/%
|
х - хi
|
(х - хi)2
|
Метрологические характеристики
|
1.
2. 3. 4. 5. 6. 80,80 86,32 81,64 78,21 77,16 80,59  S=484,72- 0,01
S=484,72- 0,01
5,53
0,85
+
2,58
+
3,63
+0,200,0001
,5809
,7225
,6564
,1769
,0400S=1,306
Sx=3,199 Dх=3,36 e=4,15%
.6 Определение эфирного масла
.6.1 Получение эфирного масла из цветков T. patula
ГФ XI издания предлагает 4 способа получения эфирного масла. Нами
проведены сравнительные эксперименты по определению характеристик процесса
отгонки масла и особенностям его состава при использовании трех методик с
применением прибора Гинзберга и Клевенджера.
Сравнительное изучение методов отгонки эфирного масла из цветков T.
patula показало, что выделение масла методом Гинзберга не наблюдалось. По
методу Клевенджера выделение эфирного масла длилось в течение двух часов. При добавлении
органического растворителя (толуола) длительность процесса отгонки уменьшалась,
а объем масла увеличивался. Поэтому для количественного определения эфирного
масла в сырье нами был использован 3-й метод Клевенджера.
.6.2 Количественное определение эфирного масла в сырье T.
patula
Навеску измельченного сырья помещали в колбу, приливали 300 мл воды,
колбу соединяли с паропроводной трубкой и заполняли водой градуированную и
сливную трубки через кран при помощи резиновой трубки, оканчивающейся воронкой.
Затем через боковую трубку при помощи пипетки вливали в приемник около 0,5 мл
толуола и точно замеряли его объем, опуская для этого уровень жидкости в
градуированную часть трубки. Колбу с содержимым нагревали и кипятили с
интенсивностью, при которой скорость стекания дистиллята составляет 60-65
капель в мин.
Через 5 мин после окончания перегонки открывали кран, постепенно спуская
дистиллят так, чтобы эфирное масло заняло градуированную часть трубки
приемника, и еще через 5 мин замеряли объем эфирного масла.
Содержание эфирного масла в объемно-весовых процентах (Х) в пересчете на
абсолютно сухое сырье вычисляют по формуле:
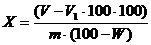 ,
,
гдеобъем
раствора масла в толуоле, в мл;1 - объем толуола, в мл;- масса
сырья, в г;- потеря в массе при высушивании сырья, в %.
Содержание
эфирного масла в пересчете на абсолютно сухое сырье составило 0,135%.
Таблица
10
Содержание
эфирного масла в сырье T. patula
|
№
|
Содержание эфирного масла, в %
|
х - хi
|
(х - хi)2
|
Метрологические характеристики
|
1.
2. 3. 4. 5. 6. 0,131 0,147 0,138 0,141 0,139 0,133  S=0,829+ 0,009
S=0,829+ 0,009
0,007
+
0,002
0,001
+
0,001
+
0,0070,000081
,000049
,000004
,000001
,000001
,000049S=0,002
Sx=0,006 Dх=0,006 e=4,36%
.6.3 Органолептические признаки полученного масла
Эфирное масло из цветков T. patula представляет собой желто-зеленую
жидкость, со своеобразным резким запахом.
Выводы по главе 2
. С помощью макро- и микроскопического анализа установили
принадлежность данного растения к семейству Asteraceae, род Tagetes, вид T.
patula;
. Фитохимически в сырье установлено наличие биологически активных
веществ: флавоноидов, каротиноидов, терпенов, кумаринов, стеринов;
. Определены товароведческие показатели сырья (влажность %,
содержание общей золы и золы, не растворимой в 10% хлористоводородной кислоте
(%), которые соответствуют требования ГФ XI издания;
. С помощью метода Клевенджера (3-й метод) было выделено эфирное
масло, содержание которого в сырье составило 0,13%. Проведен органолептический
анализ полученного масла;
. В сырье установили содержание каротиноидов 80,8 мг/% и
флавоноидов 4,64% в пересчете на абсолютно - сухое сырье.
Глава 3. Получение липофильной фракции, и ее анализ
.1 Получение липофильной фракции
Для экстракции из сырья липофильных биологически активных веществ обычно
используют растительные масла и органические растворители: хлороформ, гексан,
четыреххлористый углерод, диэтиловый эфир и т.д. Нами в качестве экстрагента
был выбран хлороформ, т.к. по данным литературы в него переходят не только
глицериды и терпены (в т.ч. каротиноиды), но и многие метоксилированные
флавоноиды. Экстракцию сырья проводили по следующей методике: 20 г цветков
T.patula сушили на воздухе, измельчали и исчерпывающе экстрагировали в аппарате
Сокслета до получения практически бесцветного экстрагента. Растворитель
полностью удаляли сначала с помощью роторного испарителя, затем на водяной бане
в выпарительной чашке и окончательно в сушильном шкафу при 50°С. В результате получили 1,3976 г
густого экстракта желто-коричневого чвета. Всего по данной методике нами было
получено 20 г экстракта, для его химического и биологического анализа.
.2 Качественный анализ липофильной фракции
Качественный анализ полученной фракции на наличие биологически активных
соединений проводили с помощью качественных реакций, бумажной (БХ) и
тонкослойной (ТСХ) хроматографии, УФ-спектроскопии.
.2.1 Качественный анализ липофильной фракции на наличие стероидных
соединений
1. Реакция Сальковского
Несколько мг экстракта растворяли в 2 мл хлороформа. К полученному
раствору осторожно, по стенкам пробирки, добавляли концентрированную серную
кислоту. Через некоторое время хлороформный слой окрасился в оранжево-красный
цвет.
2. Реакция Либермана-Бурхарда
Реакцию проводили на выпарительной чашке. Несколько мг экстракта
растворили в 2 мл хлороформа, добавили 10 капель уксусного ангидрида и 3 капли
концентрированной серной кислоты. Наблюдали синюю окраску, переходящую в
красно-бурую.
Наличие фитостеринов в экстракте определяли также с помощью ТСХ на
силикагеле ЛС-5/40 m в
системах растворителей: петролейный эфир - ацетон (7:3)
В качестве реагентов-проявителей использовали концентрированную серную
кислоту и реактив Либермана-Бурхарда, который готовили осторожным смешиванием
20 мл охлажденного до 0°С
укусного ангидрида и 5 мл концентрированной серной кислоты. На хроматограммах
наблюдали пятно, которое под действием конц.H2SO4 окрашивалось в темно - бурый цвет
(Rf = 0.78), а после обработки реактивом Либермана-Бурхарда в зеленую,
переходящей в синюю, окраску (Rf = 0.84).
На основании проведенных исследований можно сделать вывод о том, что
экстракт содержит фитостероиды.
.2.2 Качественный анализ липофильной фракции на наличие каротиноидов и
других терпенов
Для предварительного исследования экстракта на наличие каротиноидов 0,1 г
растворяли в 2 мл хлороформа, добавляли 2 капли хлорида сурьмы (III). Наблюдали
синее окрашивание, характерное для каротиноидов.
Обнаружение каротиноидов методом ТСХ проводили на пластинках “Silufol” и
на стеклянных пластинках с закрепленным слоем силикагеля ЛС 5/40m. Исследуемый экстракт обрабатывали
гексаном и полученные извлечения подвергали хроматографированию в системе
растворителей: петролейный эфир - бензол (6:9). В видимом свете наблюдали три
желтых пятна. Хроматограмму опрыскивали насыщенным раствором треххлористой
сурьмы в хлороформе, пятна окрашивались в синий цвет. Rf пятен: 0,15; 0,40;
0,69, соответственно. Другую хроматограмму, из той же системы растворителей,
обрабатывали концентрированной серной кислотой. По истечению 2 - 3 минут также
наблюдали три пятна сине - зеленого цвета.
Хроматографирование в тех же условиях использовали для препаративного
разделения каротиноидов. Зону, имеющую наиболее интенсивную окраску в видимом
свете и после обработки треххлористой сурьмой, элюировали гексаном и
исследовали с помощью УФ - спектроскопии.
В УФ - свете наблюдали максимумы поглощения при длинах волн lmax (гексан) 472, 444 и 420 нм. Такие
максимумы, по данным литературы, характерны для каротиноидов, в частности,
виолоксантина. Кроме того извлечение давало реакции, характерные для
виолоксантина: при добавлении ледяной уксусной кислоты появилась окраска
зеленого цвета, а при добавлении концентрированной серной кислоты - синее.
На ТСХ в системе растворителей диэтиловый эфир - гептан (1:2) помимо
пятен, соответствующих каротиноидам, наблюдали четыре пятна с голубой и
зеленоватой флюоресценцией. Вещества не давали положительных реакций при
обработке хроматограмм спиртовым раствором AlCL3; 5%-ным раствором
Na2CO3 и 1%-ным водным раствором FeCL3. три из
этих веществ были выделены с помощью препаративной ТСХ. Они представляли собой
масла с характерным запахом и имели УФ - спектры в этаноле в области 215 - 225
нм, следовательно, это не ароматические вещества. И так как по значению Rf на
ТСХ, и окраске, они совпали с веществами обнаруженными нами в эфирном масле, мы
предположили, что это терпены.
3.2.3 Качественный анализ липофильной фракции на наличие фланоидных
соединений
Для предварительного обнаружения флавоноидов в экстракте выполняли
цианидиновую реакцию (проба Синода).
,1г густого экстракта растворяли при нагревании в 5 мл 96%-ном этиловом
спирте, добавляли порошок металлического магния и, осторожно, концентрированную
хлористоводородную кислоту. Появление красного окрашивания свидетельствовало о
наличии флавоноидов.
Дальнейшее исследование экстракта проводили с помощью ТСХ и восходящей
БХ. Использовали системы растворителей:
1) н - бутанол : уксусная кислота : вода (4 : 1 : 5) - для БХ;
2) этанол - хлороформ (0,5:9) - для ТСХ.
На бумажной хроматографии обнаружили пятно, имеющее в УФ - свете желтую
окраску (Rf = 0,62). Хроматограммы обрабатывали: 10%-ным раствором Na2CO3
; парами аммиака; реактивом Бенедикта для приготовления которого 17,3 г
цитрата натрия и 11,7 г Na2CO3 × 10Н2О и смешивали с 1,73
г CuSO4 × 5H2O, растворенном в 10мл дистиллированной воды. (Реактив
позволяет обнаружить орто - дигидроксигруппировку в боковом фенольном
радикале).
На ТСХ также наблюдали одно пятно, имеющее темно - коричневую окраску в
УФ - свете и значение Rf = 0,60. Хроматограммы обрабатывали концентрированной
серной кислотой и 5% -ным раствором NaOH.
Результаты анализа представлены в таблице 11.
Таблица 11
Качественный анализ флавоноидов с помощью ТСХ
|
Окраска на хроматограмме
|
|
В видимом свете
|
В УФ - свете
|
Раствор аммиака
|
5% Na2CO3
|
10% AICL3
|
Реактив Бенедикта
|
Конц. H2SO4
|
5% NaOH
|
|
БХ
|
Бледно-желтая
|
желтая
|
Ярко-желтая
|
желтая
|
Желто-зеленая
|
Ослабление первоначальной окраски
|
_
|
_
|
|
ТСХ
|
_
|
Желто-коричневая
|
_
|
_
|
_
|
_
|
Ярко-желтая
|
Желтая
|
Результаты анализа позволяют предположить, что обнаруженное вещество
является флавонолом, имеющим орто-дигидроксигруппировку в боковом фенольном
радикале.
Для более точного установления строения, вещество выделяли из экстракта.
Для этого 10г экстракта растворяли при нагревании в небольшом количестве
хлороформа и оставляли при комнатной температуре . Через несколько дней выпал
желто-зеленый осадок (0,1 г). После перекристаллизации из водного этанола
получили светло-желтые кристаллы с Т.пл. 260-263°С.
УФ - спектр вещества в этаноле имеет два максимума поглощения при длине
волны 260 и 375 нм, что характерно для флавонолов. Для установления положения гидроксильных
групп УФ-спектры вещества снимали в присутствии комплексообразующих и
ионизирующих добавок. Результаты приведены в таблице 12.
Таблица 12
УФ-спектральные характеристики вещества, выделенного из липофильной
фракции
|
lmax, нм (Dl) 2×10-5
М раствор в этаноле
|
|
C2H5OH
|
+NaOAc
|
+NaOAc, +H3BO3
|
+AICL3
|
AICL3, HCI
|
C2H5ONa
|
|
260 375
|
+10 390 +15
|
270 400 +25
|
270 435 +60
|
270 430 +55
|
290 +20 450 +75
|
Батохромный сдвиг I полосы поглощения при прибавлении к его этанольному
раствору флавоноида (рис.6) ацетата натрия указывает на наличие ОН - группы у
седьмого атома углерода (рис.7), а батохромный сдвиг той же полосы на 75 нм при
прибавлении этилата натрия (рис.8) на наличие ОН - группы у С¢4 . Присутствие орто-диоксигруппировки
в боковом фенольном радикале подтверждается батохромным сдвигом I полосы на 25
нм после добавления NaOAc и H3BO3 (рис.9). На
гидроксилирование положений С3 и С5 указывает
значительный батохромный сдвиг I полосы после прибавления к этанольному
раствору вещества AICL3 (рис.10), причем этот сдвиг практически
сохраняется после добавления HCI (рис.11). Происходит лишь небольшое смещение в
сторону более коротких волн (гипсохромный сдвиг).
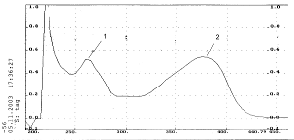
Рис.6. Спиртовой раствор флавоноида
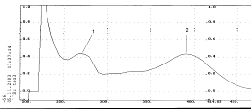
Рис. 7. Спиртовой раствор флавоноида с добавкой ацетата натрия
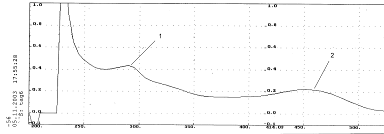
Рис. 8. Спиртовой раствор флавоноида с добавкой этилата натрия
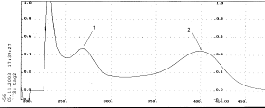
Рис. 9. Спиртовой раствор флавоноида с добавкой NaOAc и H3BO3
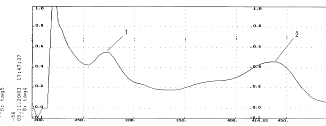
Рис. 10. Спиртовой раствор флавоноида с добавкой AICl3
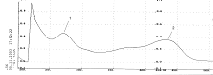
Рис. 11. Спиртовой раствор флавоноида с добавкой HCI
Таким образом мы доказали, что выделенный флавоноид является флавонолом и
имеет свободные гидроксильные группы у С7; С¢3; С¢4
и С5 . Однако вещество не совпадало на хроматограммах по значению Rf
с достоверным образцом кверцетина, но совпадало как по окраске, так и по
значению Rf c достоверным образцом патулетина, который по данным литературы
содержится некоторых видах бархатцев. Проба смешения выделенного вещества с
патулетином не давала депрессии температуры плавления.
На основании проведенных исследований мы сделали вывод, что в липофильной
фракции содержится патулетин (3,5,7,3¢,4¢ - пентагидрокси - 6 - метоксифлавон).
.3 Количественное определение каротиноидов в липофильной фракции
.1г сгущенного хлороформного извлечения, высушенного до постоянной массы
при 60°С, поместили в колбу вместимостью
100мл с притертой пробкой и добавили 75мл гексана. Экстрагировали при
постоянном перемешивании в течение 1.5 часа. Полученный экстракт фильтровали
через бумажный фильтр в колбу вместимостью 100мл. Фильтр промывали гексаном, и
полученный объем экстракта довели до метки. 1мл полученного раствора перенесли
в колбу вместимостью 25мл и довели объем до метки тем же растворителем.
Измеряли оптическую плотность полученного раствора на спектрофотометре СФ-56
при длине волны 450нм.
В качестве раствора сравнения использовали гексан. Параллельно измеряли
оптическую плотность раствора стандартного образца дихромата калия (в
соответствии с ФС 42-1730-86 «Масло облепиховое»).
Содержание суммы каротиноидов С (в пересчете на b-каротин) в миллиграм-процентах
рассчитывали по формуле:
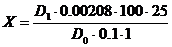 ,
,
где1-оптическая
плотность исследуемого раствора;1- оптическая плотность раствора
стандартного образца;
,00208-
количество b-каротина в мг, в растворе, соответствующем по окраске
раствору стандартного образца дихромата калия.
Результаты
представлены в таблице 13.
Таблица 13
Содержание каротиноидов в липофильной
фракции
|
№
|
Сумма каротиноидов, мг/%
|
х - хi
|
(х - хi)2
|
Метрологические характеристики
|
1.
2. 3. 4. 5. 6. 62,8 61,93 60,29 65,78 64,32 61,47  S=376,59- 0,03
S=376,59- 0,03
+
0,84
+
1,48
,01
1,55
+1,300,009
,7056
,1904
,0601
,3025
,69S=0,817
Sx=2,00 Dх=2,10 e=3,34%
.4 Количественное определение флавоноидов в липофильной фракции
В липофильной фракции: Около 0,1 г, предварительно высушенного до постоянной массы,
липофильной фракции (точная навеска) помещали в мерную колбу вместимостью 100
мл, добавляли 70 мл 95%-ного спирта и растворяли при нагревании на водяной бане
при 60°С. Раствор охлаждали, доводили тем же
95%-ным спиртом до метки и перемешивали (раствор А). Затем раствор фильтровали
через бумажный фильтр “синяя лента”, отбрасывая первые 10мл фильтрата. 4 мл
полученного раствора переносили в мерную колбу объемом 25 мл, доводили раствор
тем же 95%-ным спиртом до метки и перемешивали (раствор Б). Оптическую
плотность раствора Б измеряли на спектрофотометре СФ-56 в кювете с толщиной
слоя 10 мм относительно 95%-ного спирта при длине волны 370 нм.
Содержание суммы флавоноидов в пересчете на кверцетин рассчитывали по
раствору стандартного образца. 0,04 г (точная навеска) стандартного образца (ФС
42-12090-72), высушенного до постоянной массы при 130 °С, в 95 % этаноле в колбе
вместимостью 50 мл, доводили объем раствора 95% этанолом до метки и
перемешивали. Помещали 1 мл полученного раствора в мерную колбу вместимостью
100 мл, доводили объем раствора 95 % этанолом до метки и перемешивали.
Содержание суммы флавоноидов в пересчете на кверцетин в липофильной
фракции (Х), в процентах рассчитывали по формуле:
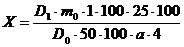 ,
,
где1
- оптическая плотность испытуемого раствора; 0 - оптическая
плотность кверцетина (ГСО);0 - масса кверцетина, в г;
а
- навеска липофильной фракции, г.
Количественное
содержание суммы флавоноидов в липофильной фракции (Х) в процентах в пересчете
на кверцетин по удельному показателю поглощению при длине волны 370 нм ( 646) рассчитывали по формуле:
646) рассчитывали по формуле:
 ,
,
где1
- оптическая плотность испытуемого раствора;
-
удельный показатель поглощения кверцетина при длине волны 370 нм.
Результаты
представлены в таблицах 13, 14.
Таблица 13
Содержание флавоноидов в липофильной
фракции по раствору стандартного образца
|
№
|
Сумма флавоноидов, %
|
х - хi
|
(х - хi)2
|
Метрологические характеристики
|
1
2 3 4 5 6 8,52 8,54 8,69 8,97 8,43 8,87  S=52,02+ 0,15
S=52,02+ 0,15
+
0,13
0,02
0,30
+
0,24
,200,0225
,0169
,0004
,09
,0576
,04S=0,087
Sx=0,213 Dх=0,22 e=2,58%
Таблица 14
Содержание флавоноидов в липофильной
фракции по удельному показателю поглощения
|
№
|
Сумма флавоноидов, %
|
х - хi
|
(х - хi)2
|
Метрологические характеристики
|
1.
2. 3. 4. 5. 6. 7,55 7,49 7,86 7,41 7,37 7,63  S=45,31 0
S=45,31 0
+
0,04
0,31
+
0,14
+
0,18
0,080
,0016
,0961
,0256
,0324
,0064S=0,073
Sx=0,178 Dх=0,19 e=2,47%
Выводы по главе 3
1. Установлено, что для экстракции сырья с целью получения
липофильной фракции лучшим растворителем является хлороформ, так как в него
перешли не только стероиды и терпены (в том числе каротиноиды), но и
метоксилированный флавоноид.
. Проведен качественный анализ липофильной фракции и установлено
наличие в ней биологически активных веществ, таких как: стероидов, каротиноидов
и метоксилированных флавоноидов.
. С помощью физико-химических методов (ТСХ, БХ и УФ спектроскопии)
доказано, что липофильная фракция содержит один метоксилированный флавоноид,
который по литературным данным соответствует патулетину.
. Количественное содержание каротиноидов в липофильной фракции
составило 62,7мг/%; флавоноида 8,7% (по раствору стандартного образца) и 7,6%
(по удельному показателю поглощения).
Глава 4. Разработка технологии мази с липофильной фракцией из цветков T.
Patula
4.1 Исследование биологической доступности мазей
Биологическая доступность мази зависит от целого ряда факторов, в том
числе от способности лекарственного вещества к высвобождению из мази - важный
показатель качества мази.
Для этого мы пользовались модельным опытом in vitro - диффузия в
желатиновый гель при прямом контакте мази со средой.
В чашки Петри (4 штуки) разливали 3 % раствор желатина, содержащий 1%
хлорида железа (III). Хлорид железа используется как индикатор, с которым
образуется окрашенное соединение. Пробы мазей помещали в колодцы, диаметром 8
мм и высотой 10 мм. По величине диффузии лекарственного вещества из мази.
Измерение проводили через 24 часа.
Для исследования были выбраны три основы: «Олиогель», эмульсионную и
«Аквасорб». На каждой основе приготовили три мази, содержащие 5% липофильной
фракции из цветков T.patula.
Далее выявили наиболее активную мазь. Наибольший диаметр окрашенной зоны
был у той, в которой основа лучше всех высвобождала действующие вещества.
Диаграмма высвобождения действующих веществ из мази на различных основах.
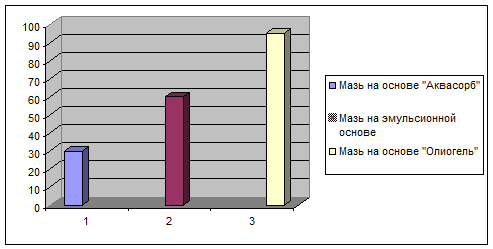
Из
приведенной выше диаграммы видно, что оптимальной основой, способной хорошо
высвобождать действующее вещество, является «Олилгель».
Исходя
из полученных данных, можно сделать вывод о целесообразности разработки
технологии мази на основе «Олиогель», с содержанием липофильной фракции 5%.
4.2 Разработка технологии и состава мази с липофильной фракцией из
цветков T. patula
Учитывая данные литературы о действии каротиноидов и флаваноидов, и
принимая во внимание наше исследование, представляется целесообразным
разработка 5% мази с содержанием липофильной фракции 0.5.
Состав мази на основе «Олиогель»
Липофильная фракция из
цв. T.patula 0.50
Аэросил 0.45
Масло подсолнечное 9.15
Общая масса 10.0
Физико-химические свойства ингредиентов
Аэросил - аморфная непористая двуокись кремния. В воде набухает. Так же
не растворим в спирте. Устойчив к воздействию температур, повышает
температурную устойчивость мазей в условиях жаркого климата. Очень хорошо
смешивается с жирами и маслами, образуя гели.
Характеристика лекарственной формы
Мягкая лекарственная форма - комбинированная мазь на гидрофильной основе.
Расчет и составление прописи
Липофильная фракция из
цв. T.patula 0.5
Аэросил 0.45
Подсолнечное масло 9.15
Общая масса 10.0
Технология
Отвешенное количество липофильной фракции растворяли в масле
подсолнечном. Затем добавляли Аэросила в качестве загустителя и тщательно
перемешивали до характерного потрескивания.
Оценка качества мази
Определение однородности мази проводили по общепринятой схеме. Мазь
однородная с характерным запахом.
Выводы по главе 4
1. Проведен выбор оптимальный основы - носителя.
2. Теоретически обоснована технология мази на базе выбранной основы.
Глава 5. Разработка способов идентификации биологически активных веществ
липофильной фракции в мази
.1 Определение флавоноидов химическими физико-химическими методами
.1.1 Химические методы
Цианидиновая реакция или проба Chinoda
.1 г мази растворяли при нагревании в 5мл 96%-ног этилового спирта,
добавляли порошок магния и концентрированной хлористоводородной кислоты.
Появлялось слабое малиновое окрашивание, характкризующее наличие флавоноидов.
Реакция с хлоридом железа
0.1г мази растворяли в спирте этиловом 96% ном, добавляли 2-3 капли
хлорида железа (III). Наблюдали появление сине-зеленого окрашивания.
.1.2 Физико-химические методы
Для определения подлинности флавоноидов в растительных лекарственных
препаратах широко применяется метод бумажной хроматографии. Использовали
системы растворителей: н-бутанол : уксусная кислота : вода (4 : 1 : 5).
На БХ обнаружили пятно имеющее в УФ-свете желтую окраску (Rf=0.62).
Хроматограммы обрабатывали: 10%-ным раствором AICL3 в этаноле;
5%-ным раствором Na2CO3; парами аммиака; реактивом
Бенедикта. Установили, что в исследуемой мази проявляется пятно со значением
Rf, принадлежащем флавоноиду липофильной фракции. Это позволяет сделать вывод о
целесообразности использования метода БХ для идентификации полученной мази.
Также нами был использован спектрофотометрический метод.
Методика приготовления исследуемого раствора.
Около 1,0г (точная навеска) растворяли при нагревании в небольшом
количестве хлороформа и оставляли при комнатной температуре. Через 2ч выпал
желтый осадок, который отфильтровали. Полученный осадок поместили в колбу на
25мл, растворили в небольшом количестве 96%-ного этанола и довели объем до
метки тем же растворителем. Измерили оптическую плотность исследуемого раствора
на спектрофотометре СФ-101 в области длин волн от 250-500 нм в кювете с
толщиной слоя 10мм. В качестве раствора сравнения использовали этанол.
Из полученных оптических спектров видно, что спиртовой раствор мази имеет
выраженный максимум поглощения при 260 нм и небольшое плечо при 375 нм.
Полученные максимумы соответствуют максимумам поглощения спиртового раствора
флавоноида липофильной фракции (260 и 375 нм).
.2.1 Химические методы
Реакция с треххлористой сурьмой
,5г мази растворяли в 1-2мл хлороформа. К полученному раствору по каплям
добавляли концентрированную серную кислоту. Наблюдали зеленое окрашивание,
переходящее в синее.
.2.2 Физико-химические методы
Как свидетельствуют литературные данные, для идентификации каротиноидов в
растительных препаратах применяется метод ТСХ.
ТСХ проводили на пластинках “Silufol” и на стеклянных пластинках с
закрепленным слоем силикагеля ЛС 5/40m. 5%-ную мазь растворяли в гексане и полученный раствор
подвергали хроматографированию в системе растворителей: петролейный эфир :
бензол (6 : 9). В видимом свете обнаружили четыре пятна. Хроматограмму
обработали насыщенным раствором хлорида сурьмы (III) в хлороформе: три пятна
окрашивались в слабо-синий цвет с Rf 0.16; 0,38 и 0,71 соответственно.
Также получили другую хроматограмму, в той же системе растворителей,
которую обработали концентрированной серной кислотой. Через некоторое время
наблюдали три пятна зелено-голубого цвета.
Кроме хроматографических методов, для идентификации каротиноидов
применяется спектрофотометрия.
Для изучения аналитических возможностей спектрофотометрического метода
были измерены УФ-спектры хлороформных растворов 5%-ной мази. Методика
приготовления исследуемого раствора:
Точную навеску мази (около 2г) растворяли в гексане в мерной колбе,
вместимостью 50мл. Доводили объем до метки гексаном. Оптическую плотность
полученного раствора измеряли на спектрофотометре СФ-101 в области длин волн от
300 до 500 нм в кювете с толщиной слоя 10мм. В качестве раствора сравнения использовали
гексан.
Оптические спектры гексанового раствора мази имеют максимумы поглощения в
области 444 и 420 нм, которые близки по значению максимумам поглощения
гексанового раствора липофильной фракции (472, 444 и 420 нм), что позволяет
осуществлять идентификацию каротиноидов в полученной мази.
.3 Разработка способа стандартизации мази по количественному содержанию
суммы каротиноидов
Точную навеску мази (около 2г), поместили в колбу вместимостью 100мл с
притертой пробкой и добавили 75мл гексана. Экстрагировали при постоянном
перемешивании в течение 1.5 часа. Полученный экстракт фильтровали через
бумажный фильтр в колбу вместимостью 100мл. Фильтр промывали гексаном, затем
отбрасывали, а полученный объем экстракта довели до метки гексаном. 1мл
полученного раствора перенесли в колбу вместимостью 25мл и довели объем до
метки тем же растворителем. Измеряли оптическую плотность полученного раствора
на спектрофотометре СФ-56 при длине волны 450 нм. В качестве раствора сравнения
использовали гексан. Параллельно измеряли оптическую плотность раствора
стандартного образца дихромата калия (в соответствии с ФС 42-1730-86 «Масло
облепиховое»).
Содержание суммы каротиноидов С (в пересчете на b-каротин) в миллиграм-процентах
рассчитывали по формуле:
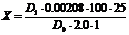 ,
,
где1-оптическая
плотность исследуемого раствора;1- оптическая плотность раствора
стандартного образца;
,00208-
количество b-каротина в мг, в растворе, соответствующем по окраске
раствору стандартного образца дихромата калия.
Полученные результаты и их метрологические характеристики приведены в
таблице 15.
Таблица 15
Содержание каротиноидов в 5% ной мази
|
№
|
Содержание каротиноидов в мази, %
|
х- хi
|
(х - хi)2
|
Метрологические характеристики
|
1.
2. 3. 4. 5. 6. 3,14 3,20 2,96 3,17 3,16 3,21  S=18,840
S=18,840
0,06
+
0,18
0,03
0,02
0,070
,0036
,0324
,0009
,0004
,0049S=0,038
Sx=0,092 Dх=0,096 e=3,07%
Как свидетельствуют полученные результаты, содержание каротиноидов в мази
находится в пределах 3,14 мг/% (допустимые отклонения ± 3,07%).
Данная методика может быть рекомендована для стандартизации полученной
мази.
Выводы по главе 5
. Разработаны способы идентификации флавоноидов в мази
химическими, хроматографическими и спектрофотометрическими методами.
. Предложены методики определения подлинности каротиноидов.
. Разработан способ количественного определения каротиноидов в
мази: спектрофотометрический метод. Содержание каротиноидов в пересчете на b-каротин 3,14мг/%.
Глава 6. Фармакологическое изучение липофильной фракции и, приготовленной
на ее основе 5%-ной мази
.1 Изучение гепатозащитного действия липофильной фракции из цветков T. patula
Ранее проведенными исследованиями на кафедрах биохимии (Фролова Л.Н.,
Василенко Ю.К.) и технологии лекарств (Богданов А.Н.) некоторые субстанции,
полученные из цветков бархатцев прямостоячих: масляной экстракт, спиртовая
вытяжка и новогаленовый препарат, обладали выраженной гепатозащитной
активностью, которая по ряду показателей превышала действие фламина [48]. В связи
с этим представляется интерес изучить гепатозащитное действие полученной нами
липофильной фракции, содержащей каротиноиды и флавоноиды. Модель
четыреххлористого гепатоза воспроизводили путем перрорального введения 3 раза
через день 50%-ного масляного раствора CCl4 в дозе 0,15мл/100 г
массы тела. Липофильную фракцию вводили в дозах 3 и 30 мг/кг перрорально за 7
дней до воспроизведения модели CCl4 - поражения печени. В качестве
препарата сравнения использовали эссенциале в дозе 30 мг/кг [20]. Контролем служили
животные, которым вводили такой же объем растворителя (вазелиновое или
подсолнечное масло). Эффективность гепатозащитного действия оценивали по
нормализации некоторых показателей функционального состояния печени. Активность
аланинаминотрансферазы (АлАт) в сыворотке крови определяли по методу Reitman S. и Frankel S., щелочной
фосфатазы (ЩФ) по методу Бесселя, Лоури, Брока [68]. Для определения содержания
в сыворотке крови общего билирубина использовали метод Йендрашика, общего
холестерина - метод Илька [69]. Содержание гликогена в печени определяли по
реакции с фенолом в кислой среде после щелочного гидролиза и выражали в г/кг
[74]. Количество триглицеридов в гомогенате печени (мкмоль/г) измеряли по Gottfried S.P., Rosenberg B. В модификации Сенбетовой [70]. Для определения ТБК-активных
продуктов в печени крыс за основу был взят метод Ohkawa и соавт [73]. Определение нуклеиновых кислот и белка
проводили спектрофотометрически по разнице экстинкций при 270 и 290 нм и по
разнице экстинкции при 260 и 280 нм соответственно [71]. Как видно из данных,
представленных в таблице, лечебно-профилактическое применение липофильной
фракции в дозах 3 и 30мг/кг привело к значительному снижению, по сравнению с
контролем, содержания в печени ТБК-активных продуктов на 67% и 78%, Р<0,001 соответственно. Одновременно
наблюдалось изменение показателей липидного обмена в сторону их нормализации:
снижение в печени триглицеридов на 24% и 33%, Р<0,01 и снижение в сыворотке крови холестерина на 34% и
40%, Р<0,01 соответственно. При этом
содержание холестерина достоверно не отличалось от уровня интактных животных.
Применение липофильной фракции в условиях CCl4-гепатоза оказало также выраженное нормализующее
действие на белковый обмен в печени. При этом наблюдалось повышение содержания
в печени нуклеиновых кислот при применении исследуемой фракции в дозе 3мг/кг на
20%, Р<0,05, а дозе 30мг/кг - на 44%, Р<0,01, что достоверно не отличалось от
значений интактных животных. Содержание же белка в печени увеличилось
соответственно на 156% и 168%, Р<0,001, что даже превышало уровень интактных значений.
Таблица 16
Влияние липофильной фракции на биохимические показатели функционального
состояния печени при остром CCl4-гепатозе у
крыс
|
Группы. Показатели
|
Интактные
|
Контроль 1 (CCl4-гепатоз
+ вазелиновое масло)
|
CCl4-гепатоз + вазелиновое масло +
липофильная фракция, 3мг/кг
|
CCl4-гепатоз + вазелиновое масло +
липофильная фракция, 30мг/кг
|
Контроль 2 (CCl4-гепатоз
+ подсолнечное масло)
|
CCl4-гепатоз + подсолнечное масло +
эссенциале, 30мг/кг
|
|
Аланинаминотрансфераза сыворотки крови, мкат/л
|
0,59±0,054
n=6
|
1,79±0,019
n=6
|
1,68±0,042
n=6 Рк>0,05
|
1,72±0,033
n=5 Рк>0,05
|
1,82±0,075
n=4
|
1,07±0,074
n=5 (-41%) Рк<0,01
|
|
Щелочная фосфотаза сыворотки крови, мкат/л
|
1,13±0,218 n=6
|
1,88±0,188 n=6
|
1,58±0,167 n=6 Рк>0,05
|
1,33±0,125
n=5 (-29%) Рк<0,05
|
1,89±0,031 n=4
|
1,77±0,183 n=5 Рк>0,05
|
|
Холестерин сыворотки крови, мкмоль/л
|
1,71±0,052 n=6
|
2,53±0,170 n=6
|
1,67±0,106 n=6 (-34%) Рк<0,01
|
1,51±0,207
n=5 (-40%) Рк<0,01
|
1,69±0,068 n=4
|
1,93±0,044 n=5 Рк>0,05
|
|
Общий билирубин сыворотки крови, мкмоль/л
|
8,28±0,513 n=6
|
18,00±0,962 n=6
|
21,33±0,68 n=4
|
15,67±2,211 n=5 Рк>0,05
|
17,58±0,418 n=4
|
14,66±0,91
n=5 (-17%) Рк<0,05
|
|
Триглицериды печени, мкмоль/г
|
35,2±3,39 n=6
|
160,0±5,99 n=6
|
121,4±6,32 n=6 (-24%) Рк<0,01
|
107,0±5,90
n=5 (-33%) Рк<0,001
|
101,8±5,84 n=4
|
99,6±2,86 n=5 Рк>0,05
|
|
Гликоген печени, г/кг
|
16,91±1,520 n=6
|
4,35±0,580 n=6
|
2,79±0,206 n=6 Рк>0,05
|
5,505±0,924
n=5 Рк>0,05
|
7,33±0,640 n=4
|
5,00±0,960 n=5 Рк>0,05
|
|
ТБК-активные продукты печени, нмоль/мг белка
|
0,31±0,0206 n=4
|
0,44±0,024 n=6
|
0,14±0,010 n=5 (-67%) Рк<0,001
|
0,097±0,010
n=5 (-78%) Рк<0,001
|
0,39±0,042 n=4
|
0,36±0,008 n=4 Рк>0,05
|
|
Белок печени, мг/г
|
112,1±2,07 n=6
|
87,6±6,19 n=6
|
224,2±28,15 n=6 (+155,8%) Рк<0,01
|
234,7±16,12
n=5 (+168%) Рк<0,001
|
92,7±6,48 n=4
|
126,9±14,00 n=5 Рк>0,05
|
|
Нуклеиновые кислоты печени, мг/г
|
45,2±2,30 n=6
|
35,2±1,80 n=6
|
42,2±1,98 n=6 (+20%) Рк<0,05
|
50,6±2,83
n=5 (+44%) Рк<0,01
|
34,24±1,632 n=4
|
37,55±2,00 n=5 Рк>0,05
|
Примечание: Рк - уровень достоверности по отношению к соответствующему
контролю.
В то же время остальные показатели либо достоверно не отличались от
таковых у контрольной группы животных (активности АлАт и ЩФ крови), либо
изменялись в сторону углубления поражения, как, например, содержание билирубина
в крови и гликогена в печени при применении липофильной фракции в дозе 3 мг/кг.
Использование же данной фракции в дозе 30 мг/кг привело к нормализации
активности щелочной фосфатазы в крови, но активность аланинаминотрансферазы,
содержание билирубина в крови и гликогена в печени в этом случае достоверно не
отличались от контрольных показателей.
В отличие от этого, лечебно - профилактическое применение эссенциале в
дозе 30мг/кг привело к нормализации активности аланинаминотрансферазы и
снижению по сравнению с контролем содержания билирубина в крови на 16%, Р<0,05, в то время как остальные
показатели не отличались от контрольных значений.
Таким образом, липофильная фракция из цветков бархатцев в условиях CCl4-поражения печени достаточно эффективно подавляет
накопление в печени перекисных ТБК-активных продуктов, нормализует и улучшает
показатели липидного обмена и даже активирует белково-синтетическую функцию
печени. При этом в дозе 30 мг/кг это действие более выражено и сопровождается
также нормализацией активности щелочной фосфатазы.
В сравнении с эссенциале липофильная фракция в отношении одних
показателей обладает выраженным преимуществом, а в отношении других уступает
этому препарату. Если же сравнить липофильную фракцию в более эффективной дозе
(30мг/кг) с эссенциале в той же дозе, можно сказать, что липофильная фракция
нормализует и улучшает значительно большее число показателей (щелочная
фосфатаза, холестерин, триглицериды, ТБК-активные продукты, белок и нуклеиновые
кислоты печени), чем эссенциале (аланинаминотрансфераза и билирубин крови).
Разнонаправленное действие липофильной фракции и эссенциале возможно,
объясняется тем, что их защитная активность проявляется на различных стадиях
развития повреждения печени под влиянием CCl4 . Известно [75], что при метаболизме CCl4 образуются высокореакционные свободные радикалы,
которые могут повреждать белки, ядерный материал (нуклеиновые кислоты), а также
инициировать процесс свободно-радикального окисления ненасыщенных жирных кислот
фосфолипидов, входящих в состав биологических мембран. Повреждение мембран,
нарушение их проницаемости, накопление в клетке токсических перекисных
продуктов в конечном итоге приводит к гибели гепатоцитов.
Эссенциальные фосфолипиды, как компоненты природных мембран, способствуют
регенерации, т.е. восстановлению уже поврежденных клеточных и субклеточных
мембран, не оказывая, по-видимому, существенного влияния на интенсивность
самого процесса перекисного окисления липидов (ПОЛ), приводящего к повреждению
мембран, о чем свидетельствует сохранение достаточно высокого уровня ТБК-активных
продуктов в печени при применении эссенциале. В результате репарации клеточных
мембран и нормализации их проницаемости наблюдается снижение выхода ферментных
белков и билирубина из печени в кровь, что приводит к снижению в сыворотке
крови активности аланинаминотрансферазы и содержания билирубина.
Соединения, содержащиеся в липофильной фракции, достаточно эффективно
тормозят процесс ПОЛ в печени, поскольку наблюдается значительное снижение в
ней ТБК-активных продуктов, особенно выраженное при использовании фракции 30
мг/кг т.е. эти соединения обладают антиоксидантным действием и, тем самым,
препятствуют разрушению мембран клеток. Антиоксидантное действие соединений
липофильной фракции может быть связано с тем, что они способны выступать в
качестве “ловушек” свободных радикалов, инициирующих ПОЛ. Инактивируя свободные
радикалы, данные соединения будут препятствовать не только усилению ПОЛ, но
также и повреждению клеточного генома [76], нормализуя, тем самым, процессы
биосинтеза белков, что и отмечалось в наших исследованиях.
Можно предположить, что защитный эффект липофильной фракции в условиях CCl4-гепатоза реализуется на начальных стадиях развития
патологического процесса. В то же время защитный эффект эссенциале связан с
тем, что он способствует восстановлению разрушенных мембран, т.е. реализуется
уже после развития повреждений. С этим, вероятно, связана установленная в наших
опытах недостаточная эффективность эссенциале как лечебно-профилактического
средства на модели острого поражения печени. Более эффективно эссенциале должен
действовать как лечебное средство, что выявляется на моделях хронических
патологий печени. Изученная нами липофильная фракция, тормозя патологический
процесс на начальных стадиях его развития, более эффективно, чем эссенциале,
“работает” как лечебно-профилактическое средство.
.2 Изучение ранозаживляющей активности липофильной фракции из
цветков бархатцев распростертых
В связи с выявленной нами способностью липофильной фракции (ЛФ)
стимулирования процесса биосинтеза белка, на модели CCl4-гепатоза можно предположить, что ЛФ способна
стимулировать процессы регенерации, что будет обуславливать ранозаживляющую
активность данной фракции. В медицинской практике для лечения ожогов и ран
используют масляные каротиноидосодержащие препараты растительного происхождения
- масло шиповника, облепиховое масло, «экзофит» и другие. Наиболее широко для
терапии ожоговых повреждений применяется облепиховое масло. Однако спрос на
облепиховое масло полностью не удовлетворяется, так как в плодах облепихи очень
низкое содержание масла, происходит уменьшение сырьевой базы этого растения и
его культивирование является довольно трудоемким.
Целью данной работы явилось изучение ранозаживляющей активности
липофильной фракции из цветков бархатцев распростертых на модели термического
ожога.
Ожоги моделировались на крысах- самцах (по 8 животных в каждой группе)
массой 180-200 г. Шерсть у животных на месте нанесения ожога (область спины)
выстригали, а остатки шерстяного покрова удаляли смачиванием выстриженной
области 15% раствором сернистого натрия. Через 2 минуты после нанесения
раствора сернистого натрия, депилированный участок промывали теплой проточной
водой и высушивали марлевой салфеткой. Во время нанесения ожога животные
находились под наркозом, вызванным введением этаминала в дозе 40 мг/кг. Ожог
получали при помощи стеклянного цилиндра с плоским дном (диаметр 10 мм),
заполненного кипящей водой (1000С). Время экспозиции составляло 15
секунд. Через 1 час, после температурного воздействия, на поврежденный участок
кожи, наносили раствор ЛФ в подсолнечном масле с содержанием исследуемого
объекта 50 мг/%. В качестве препарата сравнения использовалось заводское
облепиховое масло с содержанием каротиноидов 50 мг/%. В эксперименте также были
выделены группы животных, ожоги которых обрабатывались очищенным подсолнечным
маслом, которое использовалось в качестве основы для получения раствора
липофильных веществ из цветков бархатцев и получения облепихового масла. Также
имелась контрольная группа животных, ожоги которой не обрабатывались ни чем.
Изучаемые вещества наносились на ожоговую поверхность при помощи ватного
тампона без наложения повязки один раз в день в течение всего срока наблюдения.
О темпах заживления раневых поверхностей судили по динамике изменения весовых
показателей ожогов, которые получали путем снятия выкроек ожога на плотную
пленку с последующим их взвешиванием на весах.
Результаты эксперимента представлены в таблице 17.
Таблица 17
Влияние липофильной фракции из цветков бархатцев на размеры ожогов (в
весовых показателях, мг)
|
группы животных время наблюдения
|
Контроль n=8 мг
|
Подсолнечное масло n=8 мг
|
маслян. р-р липофильной фракции n=8, мг
|
Облепиховое масло n=8, мг
|
|
через 1сутки
|
175,5±11,86
|
159,6±14,72 -9,06%
|
133,6±7,29 * -23,87%
|
164,8±13,16 -6,10%
|
|
через 4суток
|
174,4±8,99
|
148,3±12,94 -14,97%
|
72,3±3,71 * -58,54% # -51,25%
|
137,4±17,22 -21,22%
|
|
через 7суток
|
163,3±10,68
|
124,3±13,78 * -23,88%
|
43,8±2,14 * -73,18% # -64,76% ¤¤- 32,62%
|
65±4,45 * -60,20%
|
Примечание. * - достоверно (Р<0,05 ) по отношению к контрольной группе
животных.; # - достоверно (Р<0,05 ) по отношению к группе животных,
получавших масло подсолнечное ; ¤ - достоверно (Р<0,05) по отношению к
группе животных, получавших облепиховое масло.
Как видно из представленных данных, размеры ожогов у животных,
обрабатываемых препаратом из цветков бархатцев, уже на первые сутки нанесения
ожога, достоверно меньше (на 24 %) по сравнению с животными из контрольной
группы. Исходя из этого, можно говорить о том, что ЛФ бархатцев уменьшает
развитие воспалительного процесса при нанесении ее сразу после термического
воздействия. На четвертые сутки эксперимента весовые показатели ран уменьшались
в группе животных, леченных ЛФ из бархатцев, на 58% и на 51% по отношению к
контролю и к группе животных, обрабатываемых подсолнечным маслом,
соответственно. В остальных группах также происходило уменьшение размеров
ожогов, но эти изменения достоверно не отличались от контрольных значений. На
7-е сутки, после снятия струпа, у животных получавших ЛФ, дно раны было чистым,
розового цвета и находилось на уровне кожных краев. К этому времени у животных,
леченных облепиховым маслом, струп отошел частично лишь у нескольких особей, а
в остальных группах этого и вовсе не наблюдалось. При изучении весовых
характеристик размеров ран на седьмые сутки после нанесения ожога у животных,
для лечения которых использовали ЛФ, наблюдалось снижение размеров повреждения
на 73%, а при использовании подсолнечного и облепихового масла этот показатель
уменьшился на 24% и 60,2% соответственно. В контрольной группе животных размеры
ожоговых поверхностей за этот период значительно не изменились. Следует
отметить, что эффективность действия ЛФ была достоверно выше эффективности
действия масла облепихового, поскольку весовые показатели ожогов у крыс, получавших
ЛФ, были ниже на 33 % по сравнению с теми же показателями у животных,
получавших облепиховое масло.
Дальнейшие измерения размеров ран не производились, так как уже на
одиннадцатые сутки в группе животных, лечение которых проводилось при помощи ЛФ
из цветков бархатцев распростертых, наступило полное заживление пораженных
участков и началось восстановление волосяного покрова. В тоже время у животных,
леченных облепиховым маслом, поврежденные участки кожи восстановились примерно
на 15-16 сутки с начала эксперимента.
Т.о. проведенные исследования показали, что сумма веществ, содержащихся в
липофильной фракции (каротиноиды и флавоноиды) обладает выраженной способностью
усиливать регенерацию поврежденных термическим ожогом участков кожи.
Эффективность этого действия достоверно превышает таковое облепихового масла.
6.3 Изучение ранозаживляющей активности мази липофильной фракции из
цветков бархатцев распростертых (Tagetes patula) при
термическом и химическом повреждении
Установленное в наших исследованиях выраженное противоожоговое действие
липофильной фракции послужило основанием для создания на базе ЛФ лекарственной
формы для наружного применения, которая бы сохранила ранозаживляющую активность
биологически активных веществ из цветков бархатцев. Была разработана мазь, с
содержанием липофильной фракции 5%, на основе «олеогель».
Изучение влияния мази ЛФ на заживление раневых поверхностей проводили на
моделях ожоговых повреждений кожных покровов лабораторных животных (крыс) под
воздействием термических и химических агентов. Термические ожоги воссоздавали
по методике описанной раннее в главе, посвященной изучению ранозаживляющего
действия ЛФ. Химический ожог получали при помощи 50% раствора серной кислоты по
следующей схеме [72].
Ожоги моделировались на крысах- самцах (по 8 животных в каждой группе)
массой 180-200 г. Шерсть у животных на месте нанесения ожога (область спины)
выстригали, а остатки шерстяного покрова удаляли смачиванием выстриженной
области 13% раствором сернистого натрия. Через 2 минуты после нанесения
раствора сернистого натрия, депилированный участок промывали теплой проточной
водой и высушивали марлевой салфеткой. Во время нанесения ожога животные
находились под наркозом, вызванным введением этаминала в дозе 40 мг/кг.
Химический ожог наносили с помощью ватного тампона, смоченного в 50% -м
растворе серной кислоты. Обращали внимание на стандартность получаемых ран,
размеры которых не превышали 400 мм2.
Помимо опытной группы животных в эксперименте также была выделены группа
животных, не получавших лечения (контроль) и группа, для лечения которой
использовали мазевую основу «олеогель» и группа, ожоги которой обрабатывались
препаратом сравнения - мазью календулы. Выбор данного лекарственного средства
объясняется, прежде всего, тем, что оно, как и мазь из ЛФ, растительного
происхождения, имеет сходный с ней химический состав и обладает ранозаживляющей
активностью.
Термическое повреждение кожи привело к образованию на первые сутки после
нанесения ожоговой травмы у всех животных струпа серо-бурого цвета плотно
соединенного с краями раны. Нанесение на ожоговые поверхности мази ЛФ и
календулы уже на 2 сутки после поражения привело к достоверному, по отношению к
нелеченным животным, уменьшению весовых характеристик раневых поверхностей на
42% и 31% соответственно (таб.16). При дальнейшем применении мазей наблюдалось
постепенное восстановление поврежденных участков кожи через 4, 6 и 8 суток. При
этом по эффективности действия мазь ЛФ и календулы достоверно не отличались
между собой, и на 8 сутки их использования произошло уменьшение размеров ожогов
по сравнению с контролем на 62 и 52% соответственно. В группе животных, ожоги
которых обрабатывались мазевой основой - «олеогель», размеры ран не отличались
от данных значений контрольной группы. Это позволяет сделать вывод о том, что
действие мази ЛФ в первую очередь реализуется за счет тех веществ, которые
содержаться в ЛФ.
Таблица 18
Влияние мази липофильной фракции из цветков бархатцев на размеры
термических ожогов (в весовых показателях, мг)
|
группы животных время наблюдения
|
Контроль n=6,
мг
|
основа «олеогель» n=6,мг
|
мазь бархатцев n=6, мг
|
мазь календулы n=6, мг
|
|
1
|
2
|
3
|
4
|
5
|
|
через 2 суток
|
190,0±11,63
|
170,6±8,97
|
110,0±10,30 * -42,1% # -35,5%
|
130,8±9,44 * -31,2%
|
|
через 4суток
|
181,5±11,40
|
152,5±13,22
|
96,6±7,32 * -46,8% # -35,9%
|
106,6±7,12 * -41,3%
|
|
через 6суток
|
158,1±9,84
|
132,1±10,14
|
68,7±6,40 * -56,5% # -48,0%
|
71,0±8,22 * -55,1%
|
|
через 8 суток
|
112,0±13,65
|
82,6±6,77
|
42,6±1,17 * -62,0% #
|
53,9±8,08 * -51,9%
|
Примечание: * - достоверно (Р<0,05 ) по отношению к контрольной группе
животных.;
# - достоверно (Р<0,05 ) по отношению к группе животных, получавших
«олеогель»;
¤ - достоверно (Р<0,05 ) по отношению к группе животных, получавших
мазь календулы.
При лечении ожогов, вызванных нанесением серной кислоты, в группе
животных, обрабатываемых мазью ЛФ, наблюдалось на 5 сутки достоверное
уменьшение весовых характеристик раневых поверхностей по сравнению с
аналогичными показателями контрольных животных на 45%, а под влиянием мази
календулы на 31% (таб.17). При этом размеры ран у животных, лечение которых
проводилось при помощи мази ЛФ, были на 21% меньше, чем у животных получавших
мазь календулы. Последующие наблюдения показали, что регенерация раневых
поверхностей, обрабатываемых мазью ЛФ, более эффективна, чем в случае
применения мази календулы, т.к. весовые показатели раневых поверхностей в
первом случае были достоверно ниже, чем во втором (табл. 19). При отдельном
использовании основы, на которой готовилась мазь ЛФ, весовые показатели ран достоверно
не отличались от контроля.
Таблица 19
Влияние мази липофильной фракции из цветков бархатцев на размеры
химических ожогов (в весовых показателях, мг)
|
группы животных Время наблюдения
|
Контроль n=6,
мг
|
основа «олеогель» n=6,мг
|
мазь бархатцев n=6, мг
|
мазь календулы n=6, мг
|
|
через 1 сутки
|
245,2±17,54
|
240,0±20,03
|
210,5±8,64
|
226,2±14,51
|
|
через 5суток
|
232,2±20,11
|
226,2±15,94
|
127,7±10,63 * -45,0% #-20,7%
|
161,1±10,29 * -30,6
|
|
через 7суток
|
204,2±14,68
|
210,0±20,32
|
98,4±4,09 * -51,8% # -19,2%
|
121,8±7,16 * -40,4%
|
|
через 9суток
|
198,1±18,25
|
202,3±9,66
|
90,7±3,06 * -54,2% #
|
98,0±5,99 *
|
|
через 11 суток
|
175,8±14,21
|
176,9±19,55
|
69,5±3,34 * -60,5% #-16,5%
|
83,2±4,11 * -52,7%
|
|
|
|
|
|
|
|
|
Примечание: * - достоверно (Р<0,05 ) по отношению к контрольной группе
животных.;
# - достоверно (Р<0,05 ) по отношению к группе животных, получавших
«олеогель»;
¤ - достоверно (Р<0,05 ) по отношению к группе животных, получавших
мазь календулы.
Таким образом, мазь, изготовленная на основе ЛФ, также обладает
способностью ускорять процессы регенерации кожной поверхности пораженной
термическими и химическими агентами. При этом мазь ЛФ не уступает по
эффективности противоожогового действия мази календулы при термическом ожоге и
даже превосходит ее при химическом ожоге.
Выводы по главе 6
. Липофильная фракция в условиях острого CCl4-гепатоза оказывает защитное
действие на печень, более выраженное в дозе 30 мг/кг и проявляющееся в снижении
накопления в печени перекисных ТБК-активных продуктов, торможении холестаза и
улучшении показателей липидного обмена и белково-синтетической функции печени.
2.Липофильная фракция в дозе 30мг/кг по большинству биохимических
показателей является более эффективным лечебно-профилактическим средством при
остром CCl4-гепатозе, чем эссенциале в той же дозе.
.Липофильная фракция, полученная из цветков бархатцев распростертых,
стимулирует репаративную регенерацию кожи при ее термическом повреждении и по
эффективности действия превосходит облепиховое масло.
4. Мазь, полученная на основе ЛФ, ускоряет процессы восстановления
участков кожи, пораженных термическими и химическими агентами. При термическом
ожоге мазь ЛФ не уступает по эффективности противоожогового действия мази
календулы, а при химическом ожоге даже превосходит ее. Мазь ЛФ может быть
рекомендована в качестве эффективного средства для лечения термических и
химических ожогов.
Общие выводы
. Проведено фитохимическое изучение цветков бархатцев отклоненных и
установлено наличие следующих классов соединений: флавоноидов, кумаринов,
каротиноидов и стероидов.
. Изучены основные морфолого-анатомические признаки сырья. Основными
анатомическими признаками являются: большое количество хромопластов
(каротиноидов), строение эпидермальных волосков и эфирномасличные вместилища
схизолизигенного типа;
. Проведен количественный анализ основных биологически активных веществ в
сырье. Содержание флавоноидов составило 4,64%, каротиноидов - 80,8мг/%.
.Определены товароведческие показатели сырья (общая зола 9,2%, зола, не
растворимая в 10% хлористоводородной кислоте 1,83%, влажность 5,9%).
.С помощью прибора Клевенджера выделено эфирное масло процентное
содержание которого составило 1,4% в пересчете на абсолютно-сухое сырье.
.Разработана методика получения липофильной фракции с помощью экстракции
неполярным растворителем (хлороформ) и проведен ее качественный и
количественный анализ. Доказано наличие в ней биологически активных веществ,
таких как: стеринов, кумаринов, каротиноидов и метоксилированных флавоноидов.
.С помощью физико-химических методов (ТСХ, БХ и УФ - спектроскопии)
впервые было доказано, что липофильная фракция содержит метоксилированный
флавоноид, который по литературным данным соответствует патулетину. Его
количественное содержание в липофильной фракции составило 8,67%;
.Разработаны и теоретически обоснованы состав и технология мази,
содержащая липофильную фракцию.
.Проведена стандартизация мази по содержанию каротиноидов, которых должно
быть не менее 3,14мг/%.
.Проведены фармакологические исследования липофильной фракции и мази,
полученной на ее основе. В результате установлено, что липофильная фракция
обладает гепатоэащитным действием, превышающем действие эссенциале, и
противоожоговой активностью. Мазь, полученная на основе ЛФ, ускоряет процессы
восстановления участков кожи, пораженных термическими и химическими агентами, и
может быть рекомендована в качестве эффективного средства для лечения
термических и химических ожогов.
флавоноид эфирный липофильный мазь
Список литературы
1. Бандюкова В.А. Применение цветных реакций для
обнаружения флавоноидов путем хроматографии на бумаге. - Раст. ресурсы, 1965.
Т.1, вып. 4, С. 591-596.
2. Бандюкова В.А. Распространение флавоноидов в
некоторых семействах высших растений. Сообщ. №2. сем. Asteraceaee. - Раст. ресурсы, 1968. Т.IV, №1. С. 138-193.
3. Бандюкова В.А., Шинкаренко А.Л. Тонкослойная
хроматография флавоноидов. Химия природ. соедин., 1973, №1, С. 20-25.
5 Беликов В.Г., Пономарев Н.И., Коковкин-Щербак. Применение
математического планирования и обработка результатов эксперимента в фармации.
М.: Медицина, 1973, 232 с.
6 Беликов В.В., Швайбер М.С. Методы анализа
флавоноидных соединений. Фармация, 1970, №1, С. 66-78.
Биохимия фенольных соединений/ Под общ. Ред. Дж.
Харбона.- М.,Мир, 1968.-452 с.
Блажий А., Шутый Л. Фенольные соединения
растительного происхождения. -М.: Мир, 1977. -240 с.
Георгиевский В.П., Казаринов Н.А., Каррыев М.О.
Физико-химические методы анализа биологически активных веществ растительного
происхождения. Ашхабад: Ылым, 1976.- 238 с.
Крестов Г.А. Основные понятия современной химии./
Крестов Г.А., Березин Б.Д. - 2-е изд. - Л., 1986. - С. 104.
Государственная фармакопея СССР, XI изд. М: Медицина, 1987.- Т.1.-336,
333, 337 с.
Государственная фармакопея СССР, XI изд. М: Медицина, 1989.- Т.2.-400с.
Грядунова Г.П. Мази. М.: 1973 - С.68.
Ермакова В.А., Самылина И.А., Бобкова Н.В.,
Перешивкина О.Н. Разработка методики определения подлинности измельченного
сырья различных морфологических групп// Современные аспекты изучения
лекарственных растений. Науч. тр.- Т. 34.-Москва, 1995.- С.135-142.
Запрометов М.Н. Основы биохимии фенольных
соединений. М.: Высшая школа, 1974. -214с.
Кирхнер Ю. Тонкослойная хроматография: В 2-х Т. М.:
Мир, 1981.-Т. 2.- 523 с.
Клышев Л.К., Бандюкова В.А., Алюкина Л.С. Флавоноиды
растений. Алма-Ата, 1978.
Ковалев И.П., Гордиенко В.Г., Шелковый В.Д.
Применение физических методов для установления строения флавоноидов. - В кн.:
Тезисы Третьего Всесоюзного симпозиума по фенольным соединениям. Тбилиси, 1976,
С. 90-91.
Ковалев И.П., Титов Е.В. Инфракрасные спектры
поглощения некоторых групп природных соединений. Атлас спектров. - Харьков:
Изд-во Харьк. гос. ун-та. 1966, 203 с.
Лабораторное руководство по хроматографическим и
смежным методам/ Под общ. редакцией О. Микеша. - М.: Мир, 1982. - 783 с.
Машковский М.Д. Лекарственные средства: в 2-х т. -
М., 2000. - Т. I - 300 c.
Беликов В.Г. Фармацевтическая химия. В 2ч./ В.Г.
Беликов - М.: Высш. Шк., 1993. Ч.1. Общая фармацевтическая химия. - С.432.
Медведева В.К. Ботаника. - М.: Медицина, 1985, С.
251-254.
Методические рекомендации к лабораторным занятиям по
заводской технологии лекарств (галеника) / Под. ред. доктора фармац. наук Ю.Г.
Пшукова. Пятигорск, 1990. - 114 с.
Муравьев И.А. Технология лекарств - М.: Медицина, в
2-х томах. Т.
I - С. 703; т. II - С. 31.
26 Муравьев И.А. Технология лекарств - М.: Медицина,
1980. Ч. 1 - 707 с.
Оганесян Э.Т., Симонян А.В., Шинкаренко А.Л.
Использование цианидиновой реакции в анализе флавоноидов: Метод. рекоменд. -
Пятигорск, 1975. - 23 с.
Пехов А.В., Дюбанькова Н.Ф., Мазуренкова Р.С.
Экстрагирование лекарственного растительного сырья / Тр. Краснодар. НИИ ПИЩ.
Пром-ти. 1969, т. 5. С. 244-247.
Практикум по анатомии растений // под ред. Д.А.
Транковского - М.: Высшая школа, 1985. С. 224.
Роль фенольных антиоксидантов в повышении
устойчивости органических систем к свободно-радикальному окислению / И.В.
Сорокина, А.П. Крысин, Т.Б. Хлебникова и др. // Анал. обзор. - Новосибирск:
Сиб. отделение РАН. - Вып. 46. - 1997. - 67 с.
Справочник по клиническим лабораторным методам
исследования / Под ред. Кост Е.А. - М.: Медицина, 1975. - 383 с.
Технология лекарственных форм: Учебник в 2-х томах /
Под ред. Л.А. Ивановой - М.: Медицина, 1991. - Ч.1. - 544 с.
Тенцова А.И., Грецкий В.М. Современные аспекты
исследования и производства мазей - М.: Медицина, 1980 - 143 с.
Грецкий В.М. Создание новых основ для мазей - одно
из направлений совершенствования этой лекарственной формы/ Грецкий В.М.,
Константинов А.В.// Актуальные вопросы дерматологии. - М., 1971. - С.54.
Установление структуры органических соединений
физическими и химическими методами/ Под общ. ред. А. Вайсберга: в 2-х томах. -
М.: Химия, 1967. - Т.2. 531 с.
Флора Северного Кавказа вопросы ее истории / под
ред. А.И. Галушко. - Ставрополь, 1976.
Флора СССР / Под общ. ред. В.Л. Комарова: в 30-ти
томах-М.-Л.: Изд-во АН СССЗ, 1934-1964-. - Т.26. - 593 с.
Химический анализ лекарственных растений / Гринкевич
Н.И., Сафронович Л.Н. - М.: Высш. Школа. - 1983. - С.82 -89, С. 111 - 119.
Хайс И.М., Мацик К. Хроматография на бумаге. - М.:
И, 1962, 851 с.
Шинкаренко А.Л., Бандюкова В.А., Казаков А.П. Методы
исследования природных флавоноидов. Метод. рекоменд. Для студентов. -
Пятигорск, 1977. - 71 с.
Антиоксидантная активность гепатотропных препаратов
при лечении хронических болезней печени/ А.С. Логинов, Б.Н, Матюшин, Г.В.
Сухарева, В.Д. Ткачев // Терапевт. Арх. - Т.60, №8. С.74-77.
Барабой В.А. Биологическое действие растительных
фенольных соединений. - Киев: Наукова думка, 1976. - 260 с.
Венгеровский А.Н. Механизм действия
гепатопротекторов при токсических поражениях печени // Венгеровский А.Н.,
Саратиков А.С.// Фармакология и токсикология. - 1988. - Т.51, №1. - С. 89-93.
Владимиров Ю.А., Арчаков А.И. Перекисное окисление
липидов в биологических мембранах. - М.: Нука, 1972. - 252 с.
Зайчик А.Ш. основы общей патологии/ Зайчик А.Ш.,
Чурилов Л.П. = СПб., 2000. - Ч.2. Основы патохимии. - С.379-380.
Моргунов Т.В. Влияние лекарственных средств на
свободно-радикальное окисление/Моргунов Т.В., Лазарева Д.Н.//Эксперим. и
клинич. фармакология. - 2000. - Т.63, №1. - С.71-75.
Калошина Н.А., Мазулин А.В., Сорико В.И.
Стандартизация лекарственного сырья, субстанции и препарата цветков
распростертых по содержанию биологически активного флавоноида/ Тез.докл. -
Ярославль, 1987. - С. 396-397.
Калошина Н.А. Новые источники биологически активных
веществ представителей сем. Asteraceaee/ - Кишинев, 1980. - С.183-184.
49 Гепатозащитное действие цветков
бархатцев распростертых/ Е.Г.Доркина, А.Ю. Терехов, Э.Т. Оганесян, О.А. Андреева, Е.П. Парфентьева, Ю.К. Василенко, Л.А. Саджая, И.В.Скульте// Фармация. - 2004. - №2. - С. 33-35.
50 Гепатозащитные свойства препаратов из бархатцев
распростертых/ Ю.К. Богданов, Л.М. Фролова, А.В. Фролов// Хим. - фармац. журн.
- 1990. - Т.24, №1. - С.53-56.
Машанов В.И., Покровский
А.А.,"Пряно-ароматические растения", Москва, Агропромиздат, 1991 г.
Бархатцы - эфирномасличные растения// Раст. Ресурсы.
- 1971. - Т.7, №4. - С. 571-574.
Бандюкова В.А., Бондаренко Н.В. Гелениен из
прямостоячих бархатцев, выращенных на Северном Кавказе/ Биолог. Науки, 1965,
№1. - С. 168-171.
Новые каротиноидсодержащие фитопрепараты/ П.П.
Ветров, Г.В. Оболенцква, Т.Д. Носовская и др// Провизор. - 2000. - №16. -
С.19-20.
Ветров П.П., Гарная С.В., Долганенко Л.Г.
Определение содержания липофильных веществ и суммы каротиноидов в растительном
сырье.// Хим. - фармац. журн. - 1989. - Т. 23, №3 - 23 с.
Сергеева Н.В., Захарова Н.Д. Качественное и
количественное изучение каротиноидов в некоторых галеновых препаратах//
Фармация. - 1977. - Т.26, №1. - С. 34-38.
Содержание каротиноидов и флавоноидов в соцветиях
некоторых сортов Calendula officinalis./ С.А. Ивасенко, Л.Н. Прибыткова,
С.М. Адекенов идр.// Раст. Ресурсы. - 2000. - Т.36, вып.2. - С.107-110.
Лукин Ю.П., Симонов Е.А. Хроматографическое
разделение каротиноидов растительного происхождения.// Хим. - фармац. журн. -
1991. - Т.25, №9. - С. 75-77.
Дороднева В.И. Идентификация каротиноидов грецкого
ореха методами спектрометрии и тонкослойной хроматографии// Раст. ресурсы. -
1967. - Т.3, вып.2. - С. 266-268.
Кушинская И.Н., Шнайдман Л.О. Идентификация
каротиноидов, содержащихся в сухих плодах шиповника вида R. cinnamomea// “Мед. пром. СССР”. - 1964, - №4. -
С. 38-40.
Пигулевский Т.В. Химия терпенов. Л.: Изд - во ЛГУ. -
1949. - 288 с.
Евтушенко Н.С., Багирова В.Л., Лутцева А.И. Изыскание
способов оптимизации условий газохроматографического анализа лекарственных
веществ, содержащих терпеноиды// Тез. Докл. - Ярославль, 1985. - С.255-256.
Максютина. Терпеноиды// Растит. лекарств. средства.
- Киев,1985. - С. 52-68.
Сур С.В. Состав эфирных масел лекарственных
растений// Раст. ресурсы. - 1993. - Т.29, вып. 1. - С. 98-117.
С.А.Иванова, Ю.Т.Демченко, И.Е.Каухова, В.А.
Вайнштейн. Изучение особенностей экстрагирования липофильных веществ из
растительного сырья двухфазной системой экстрагентов и органическими
растворителями.
С.В. Сур. Методы выделения, идентификации и
определения терпеновых соединений// Хим. - фармац. журн. - 1990. - №5. - С.
42-48.
Племенков В.В. Введение в химию природных соединений
- Казань, 2001. - 376 с.
С.В. Первушкин., В.А. Куркин., А.В. Воронин., А.А.
Сохина., И.Ф. Шаталаев. Методики идентификации различных пигментов и
количественного спектрофотометрического определения суммарного содержания
каротиноидов и белка в фитомассе Spirulina platensis (Nords.) geilt.//Раст. ресурсы. - Т.38, вып.1, - С.112-119.
Колб В.Г., Камышников В.С. Справочник по клинической
химии. - Минск: Беларусь, 1982. - 336 с.
Методические указания по применению унифицированных
клинических лабораторных методов исследования / Под ред. М.И. Прохоровой. - Л.:
Изд - во ЛГУ, 1982. - 272 с.
Сентебова Н.А., Салицкая Н.В. Предложения по
унификации методов определения триглицеридов в сыворотке крови// Унификация
лабораторных методов исследования. - М., 1978. - Вып.8. - С. 67-75.
Строев Е.А., Макарова В.Г. Практикум по
биологической химии: Учеб. Пособие для фармац. вузов и фак. - М.: Высш. шк.,
1986. - 231 с.
Раны и их лечение в тибетской медицине/ И.О.
Убащеев, В.Э. Назаров-Рыгдылон, С.М. Баторова, К.С. Лоншакова. - Новоссибирск:
Наука. Сиб. отд-ние, 1990. - 192 с.
74 Ohkawa H., Ochini N., Vagi K. Assay for lipid
peroxides in animal tissues by thiobarbituric acid reaction// Anal. Biochem. -
1979. - Vol. 95, №2. - P. 351-358.
Montgomery R. Determination of glycogen //
Arch. Biochem. Biophys. - 1957. - Vol. 67, №2. - P. 378/
Poly G., Albano E., Diazani M.U. The role of
lipid peroxidation in liver damage // Chem. End Phys. Lipids. - 1987. - Vol.
45, №.2-4. - P. 117-142.
Slater T.F. Free-radical mechanism in tissue
injuri // J. Biochem. - 1984. - Vol. 222, №3. - P. 1-15.
GLC and GLC-MS Analysis of Thiophene
Derivatives in Plants and in in vitro Cultures Tagetes patula L. (Asteraceaee)
Z. Naturforsch. 57c, 63-71 (2002); received July 17/September 17, 2001
Downum K. R.. and Towers G.H.N. (1983),
Analysis of thiophenes in the Tagetes (Asteraceaee) by HPLC. J. Nat. Prod. 46,
98-103.
Flavour Fragr. J. 2003; 18: 62-65 Studies on
essential oils. Part 35: chemical and biocidal investigations on Tagetes erects
leaf volatile oil.
Bouvier, F., d'Harlingue, A., Camara, B. 1997
Molecular analysis of carotenoid cyclase inhibition. Arch. Biochem. Biophys.,
346, 53 64.
Britton, G. 1988 Biosynthesis of carotenoids.
In Plant Pigments (Goodwin, T.W., ed.). London: Academic Press, pp. 133 180.