Вычисление термодинамических функций
Содержание
1. Вычисление термодинамических функций
1.1 Вычисление термодинамических функций H0(T)-H0(0),S0(T),Ф0(T), G0(T) - G0(0)
для заданного вещества Mo
интервале температур 100-500К
.2 Описание химических свойств вещества Мо и его применение
.3 Расчет константы равновесия реакции MоO3+3С(графит) ↔ Mо+3 СО
двумя способами (с помощью энтропии и приведенной энергии
Гиббса) в интервале температур 1300 - 2200 К
. Построение и исследование диаграммы состояния
двухкомпонентной системы Ge-Mo
.1 Построение и исследование диаграммы состояния
двухкомпонентной системы Ge-Mo по пунктам
Список литературы
Приложение А
Приложение Б
Приложение В
Приложение Г
Приложение Д
1.
Вычисление термодинамических функций
1.1 Вычисление термодинамических функций H0(T)-H0(0),S0(T),Ф0(T), G0(T) - G0(0) для заданного вещества Mo интервале температур 100-500К
молибден температура химический реакция
Для вычисления термодинамических функций H°(T)-H°(0), S°(T), Ф°(Т), G°(Т)-G°(0) заданного вещества Мо, в интервале
температур 100-500 К с шагом 25 К используем табличные значения
термодинамических функций Ср(Т), S0(100)
и H0(100)-H0(0), приведенные в источнике [1]. Расчет термодинамических
функций при температурах 100, 200, 300, 400, 500 К производим по формулам из
источника [2]:
а) изменение энтальпии
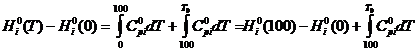 (1)
(1)
б)
изменение энтропии  (2)
(2)
в)
изменение энергии Гиббса  (3)
(3)
г) изменение приведенной энергии Гиббса:
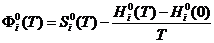 , (4)
, (4)
где:
 -
высокотемпературная составляющая стандартной энтальпии;
-
высокотемпературная составляющая стандартной энтальпии;
 -
значение стандартной теплоёмкости;
-
значение стандартной теплоёмкости;
 - стандартная
энтропия индивидуального вещества при указанной температуре;
- стандартная
энтропия индивидуального вещества при указанной температуре;
 -
приведённая энергия Гиббса;
-
приведённая энергия Гиббса;
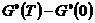 -
разность стандартных энергий Гиббса при заданной температуре и при 0 К.
-
разность стандартных энергий Гиббса при заданной температуре и при 0 К.
Для
обеспечения точности вычисления термодинамических функций индивидуального
вещества при указанных температурах с ошибкой не выше ~1%, стоградусный
интервал, с которым приведены теплоемкости в источнике [1], разбивается на
четыре равные части, и проводятся вычисления термодинамических функций  и
и 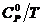 c шагом 25К, что достигается с помощью аппроксимации
уравнений.
c шагом 25К, что достигается с помощью аппроксимации
уравнений.
Выполнение
расчетов термодинамических функций индивидуального вещества осуществляется с
помощью специальной компьютерной программы в компьютерном классе.
Значение
термодинамических функций C0(T) и C0(T)/T для индивидуального вещества Мо приведены в таблице
1.
Таблица
1 - Значение функций С0(Т) и С0(Т)/Т для Мо
|
Т, К
|
С0(Т), Дж/моль* К
|
С0(Т)/Т
|
|
100
|
13.5200
|
0.1352
|
|
125
|
16.4035
|
0.1294
|
|
150
|
18.6039
|
0.1226
|
|
175
|
20.2560
|
0.1151
|
|
200
|
21.4800
|
0.1074
|
|
225
|
22.3808
|
0.0998
|
|
250
|
23.0486
|
0.0926
|
|
275
|
23.5582
|
0.0859
|
|
300
|
23.9700
|
0.0799
|
|
325
|
24.3289
|
0.0747
|
|
350
|
24.6651
|
0.0702
|
24.9938
|
0.0664
|
|
400
|
25.3150
|
0.0633
|
|
425
|
25.6140
|
0.0605
|
|
450
|
25.8611
|
0.0508
|
|
475
|
26.0113
|
0.0552
|
|
500
|
26.0050
|
0.0520
|
Примечание: С0(Т) - теплоёмкость вещества, рассчитывается при P=const.
Таблица 2 - Значение функций H0(T)-H0(0),S0(T), Ф0(Т), G0(T)-G0(0) для Мо.
|
Т,К
|
Н0(Т)-Н0(0), кДж/моль
|
S0(T), Дж/моль*К
|
Ф0(Т),
Дж/моль*К
|
G0(T)-G0(0), кДж/моль
|
|
100
|
0.4910
|
6.9970
|
2.0870
|
-0.20870
|
|
200
|
2.3147
|
19.2112
|
7.6376
|
-1.52752
|
|
300
|
4.6089
|
28.5049
|
13.1418
|
-3.94255
|
|
400
|
7.0748
|
35.5721
|
17.8850
|
-7.15400
|
|
500
|
9.6544
|
41.3582
|
22.0495
|
-11.02474
|
Примечание:
Н0(Т)-Н0(0)-изменение энтальпии;
S0(T)-энтропия; Ф0(Т)-приведённая энергия
Гиббса;
G0(T)-G0(0)-изменение энергии Гиббса.
Вывод:
При вычислении термодинамических функций с помощью готовых программ мы
показали, что ошибка в расчетах не превышает 1 %, в сравнении с приложением А
[1]. Из результатов вычислений видно, что, так как функция  является возрастающей функцией температуры, то
является возрастающей функцией температуры, то  ,
,  являются
возрастающими функциями температуры, что и следует из законов термодинамики
являются
возрастающими функциями температуры, что и следует из законов термодинамики 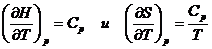 (графики 1-3).
(графики 1-3).
1.2 Описание химических свойств
вещества Mo
Молибде́н - d элемент
<#"605297.files/image016.gif"> (5)
где ni - соответствующие стехиометрические
коэффициенты, S°i(T) - стандартная
абсолютная энтропия индивидуального вещества при данной температуре, H0i(T) - H0i(0) - высокотемпературные составляющие энтальпии
индивидуального вещества, ∆fH0(0)
- стандартная энтальпия образования индивидуального вещества при Т = 0 К [2].
Расчет при температуре 1300 К:
ΣniSio(1300) = S0Mo(1300) +3S0СO(1300) - 3S0Cгр(1300) - S0MoO3(1300)=
= 67.857+3*243.321-3*30.381-264.409=442.268Дж/моль*К
Σni*[Hi0(1300)-Hi0(0)+∆fHi0(0)]=
3[H0CO(1300)-H0CO(0)+∆fH0CO(0)]-
[H0Mo(1300)-H0Mo(0)+∆fH0Mo(0)]-3[H0Cгр(1300)-H0Cгр(0)+∆fH0Cгр(0)]-[H0MoO3 (1300)-H0MoO3(0)+∆fH0MoO3(0)]=3[40.535-113.812]+[31.922+0]-3[19.588+0
]-[163.684-739.587]=-219.831+31.922-58.764+575.903=329.23 кДж/моль

2) С помощью приведенной энергии Гиббса:
 , где (6)
, где (6)
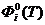 -
приведенная энергия Гиббса;
-
приведенная энергия Гиббса;  -
стандартная теплота образования индивидуального вещества при Т=0 К.
-
стандартная теплота образования индивидуального вещества при Т=0 К.
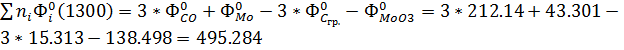

Дж/моль*К
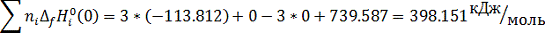
Аналогично
рассчитывается константа равновесия химической реакции и для всех остальных
температур из интервала 1300-2200K; все необходимые данные находятся в таблицах
приложений. Полученные результаты для всего интервала температур приведены в
таблице 3.
Таблица 3 - Расчет lnKp
двумя способами в интервале температур 1300-2200K
|
T,K
|
1/T*103, К
|
Σni [Hi0(T)- Hi0(0)+∆f Hi0(0)],кДж/моль
|
I способ,lnKP
|
II способ,lnKP
|
КР
|
|
1300
|
0.769
|
329.23
|
22.735
|
22.734
|
7.5*10^9
|
|
1400
|
0.714
|
322.868
|
24.89
|
24.89
|
6.5*10^10
|
|
1500
|
0.667
|
311.568
|
26.722
|
26.722
|
6.0*10^11
|
|
1600
|
0.625
|
310.351
|
28.292
|
28.292
|
1,9*10^12
|
|
1700
|
0.588
|
304.229
|
29.652
|
29.655
|
7.6*10^12
|
|
1800
|
0.556
|
298.221
|
30.835
|
30.836
|
2.5*10^13
|
|
1900
|
0.526
|
292.333
|
31.875
|
31.874
|
6.96*10^13
|
|
2000
|
0.5
|
286.579
|
32.79
|
32.791
|
1.7*10^14
|
|
2100
|
0.476
|
280.954
|
33.603
|
33.604
|
3.9*10^14
|
|
2200
|
0.455
|
275.47
|
34.327
|
34.328
|
8.1*10^14
|
Используя полученный график (рисунок 4) и формулу:
 (7)
(7)
ΔƒН0(Т)срдн=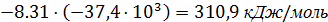
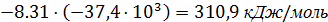
Вывод:
Данная реакция является эндотермической, так как с ростом температуры
увеличивается константа равновесия и равновесие смещается в сторону прямой
реакции.
Вывод
основан на принципе Ле - Шателье, который гласит: если на систему, находящуюся
в равновесии, воздействовать извне и тем изменить условия, определяющие
положение равновесия, то в системе усиливается то из направлений процесса,
течение которого ослабляет влияние этого воздействия, в результате чего
положение равновесия сместится в этом же направлении.
2.
Построение и исследование диаграммы состояния двухкомпонентной системы Ge-Mo.
.1
Построение и исследование диаграммы состояния Ge-Mo в
атомных и массовых долях
Данная
диаграмма, изображённая на рисунке 5, является двухкомпонентной системой с
полной растворимостью в жидком состоянии, с ограниченной растворимостью в твердом
состоянии, с образованием 4 неустойчивых химических соединений, c
отсутствием полиморфизма.
Число степеней свободы находится по правилу фаз Гиббса:
С=К-Ф+1,
где С - степень свободы, которая характеризует число независимых
параметров, которые можно свободно изменять; Ф - число фаз системы; К - число
компонентов системы.
Фазовый состав:
I. L, однородный расплав, одна фаза, число термодинамических степеней свободы
С=К-Ф+1=2-1+1=2, т.е. произвольно, не нарушая равновесия, можно изменять и
температуру, и состав системы.
II. L + SМо, расплав находится в равновесии с
твердым раствором на основе Мо, число термодинамических степеней свободы
С=2-2+1=1, т.е. произвольно, не нарушая равновесия можно изменять или
температуру, или состав системы.
III. L+ SМо3Ge, расплав находится в равновесии с неустойчивым химическим
соединением Mo3Ge, число термодинамических степеней свободы С=2-2+1=1, т.е.
произвольно, не нарушая равновесия можно изменять или температуру, или состав
системы.
IV. SMo+ SМо3Ge, область существования в равновесии двух фаз: твердого
раствора на основе Мо и неустойчивого химического соединения Mo3Ge.
V. SMo, область существования твердого раствора на основе Мо, одна фаза, число
термодинамических степеней свободы С=2-1+1=2.
VI. L+SМо5Ge3, расплав находится в равновесии с твердым раствором на
основе неустойчивого химического соединения Mo5Ge3, число
термодинамических степеней свободы С=2-2+1=1.
VII. SМо5Ge3+SМо3Ge,
область существования в равновесии неустойчивых химических соединений Mo3Ge и Mo5Ge3, число термодинамических степеней
свободы С=2-2+1=1.
VIII. L+SМо13Ge23, расплав находится в равновесии с неустойчивым химическим
соединением Mo13Ge23, число термодинамических степеней свободы С=2-2+1=1.
IX. SМо13Ge23+SМо5Ge3,
область существования в равновесии неустойчивых химических соединений Mo13Ge23 и Mo5Ge3, число термодинамических степеней
свободы С=2-2+1=1.
X. L+SGe, расплав находится в равновесии с Ge, число термодинамических степеней
свободы С=2-2+1=1.
XI. L+S МоGe2, расплав находится в равновесии с неустойчивым химическим
соединением MoGe2, число термодинамических степеней
свободы С=2-2+1=1.
XII. SМоGe2+SМо13Ge23,
область существования неустойчивых химических соединений MoGe2 и Mo13Ge23, число
термодинамических степеней свободы С=2-2+1=1.
XIII. SGe+ SМоGe2, область существования в равновесии Ge и неустойчивого химического
соединения MoGe2, число термодинамических степеней
свободы С=2-2+1=1.
Переведём атомные доли в массовые, соответствующие следующим точкам: A=0,75 ат.д.; B=0,8 ат.д.; C=0,97ат.д.
Для этого воспользуемся следующей формулой:
Масс.д.(Мо)
= 

Проведём
пересчёт для каждой из точек:
А:Масс.д.(Мо)
= 
 = 0.8
= 0.8
В:Масс.д.(Мо)
=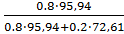
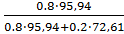 = 0.84
= 0.84
С:Масс.д(Мо)
=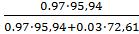
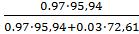 = 0.977
= 0.977
На данной диаграмме имеются 4 неустойчивых химических соединений:
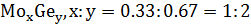
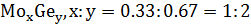 -
-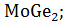
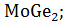
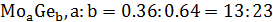
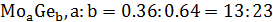 -
- 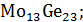
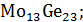

 -
- 

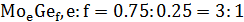
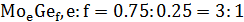 -
- 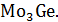
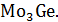
Температура начала кристаллизации расплава системы Ge-Mo, содержащей 0.2ат.д.Mo,равна 1490°С, температура конца кристаллизации равна 900°С.
Первые
выпавшие кристаллы из расплава системы Mo-Ge,
содержащего 0.2ат.д.Mo отвечают выпадению кристаллов химического соединения 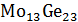
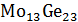 . Составу
последней капли этого расплава соответствует точка эвтектики(E),
содержащая 0.02ат.д.Mo.
. Составу
последней капли этого расплава соответствует точка эвтектики(E),
содержащая 0.02ат.д.Mo.
Воспользовавшись данными, полученными в пункте 2.1.1, определим по
правилу рычага для системы Ge-Mo, содержащей 0.8ат.д.Mo при температуре 18500C и при массе сплава 70г.
mL/ mS=bc/ab;
mL+ mS= 70;= 70 - mS;
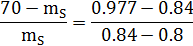
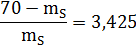


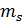
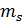 =15,82 г
=15,82 г
mL= 70 - 15,82 =
54,18 г
Число степеней свободы находится по правилу фаз Гиббса:
Отсюда следует, что система, у которой:
Состав
0.4ат.д.Mo, температура 1520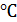
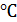 ,
имеет:К=2, Ф=3, С=2-3+1=0;
,
имеет:К=2, Ф=3, С=2-3+1=0;
Состав
0.2ат.д. Mo, температура 1900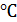
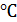 ,
имеет:К=2, Ф=1, С=2-1+1=2;
,
имеет:К=2, Ф=1, С=2-1+1=2;
Состав
1.0ат.д. Mo, температура 2623
 , имеет:K=1,
Ф=2,C=1-2+1=0;
, имеет:K=1,
Ф=2,C=1-2+1=0;
Система
Ge-Mo содержащая 0,2 ат.д. Mo до
температуры 1490
 представляет собой однородный жидкий расплав Ф=1, С=2, при достижении
температуры 1490
представляет собой однородный жидкий расплав Ф=1, С=2, при достижении
температуры 1490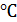
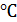 начинает
кристаллизоваться химическое соединение
начинает
кристаллизоваться химическое соединение 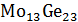
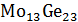 Ф=2,
С=1. При охлаждении от 1490
Ф=2,
С=1. При охлаждении от 1490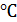
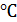 до 1090
до 1090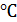
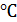 масса
кристаллов
масса
кристаллов 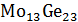
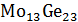 растёт,
в составе расплава увеличивается содержание Ge. При
достижении состава перитектики (P) начинается перитектическое превращение:
растёт,
в составе расплава увеличивается содержание Ge. При
достижении состава перитектики (P) начинается перитектическое превращение:

При
охлаждении от 1090
 до 900
до 900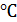
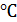 масса
кристаллов химического соединения
масса
кристаллов химического соединения 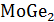
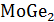 растёт,
в составе расплава продолжает увеличиваться содержание Ge, при достижении
состава точки E (0,02 Mo) начинается эвтектическое превращение:
растёт,
в составе расплава продолжает увеличиваться содержание Ge, при достижении
состава точки E (0,02 Mo) начинается эвтектическое превращение:

Которое
заканчивается исчезновением расплава. При дальнейшем понижении температуры идёт
охлаждение сплава содержащего две фазы Ge и 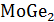
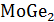 .
.
Список
литературы.
1. Термодинамические свойства индивидуальных веществ.
Т.1-4 книга вторая. Таблицы термодинамических свойств: Справочное издание / Под
ред. В.П. Глушкова. - М.: Наука 1979.
2. Методические указания для выполнения курсовой работы
по дисциплинам «Физическая химия» и «Химия». /ВГТУ; Сост. В.В. Корнеева, А.А
Щетинин, А.Н. Корнеева, 2008. 24 с.
. Общая Химия. Глинка Н.Л. 1982
. #"605297.files/image049.gif">
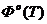
|
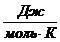 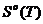 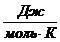 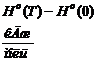
|
|
|
|
|
|
100
|
13.520
|
2.087
|
6.997
|
0.491
|
|
200
|
21.480
|
7.784
|
19.444
|
|
300
|
23.970
|
13.304
|
28.718
|
4.624
|
|
400
|
25.315
|
18.080
|
35.824
|
7.098
|
|
500
|
26.005
|
22.221
|
41.554
|
9.666
|
Приложение Б
Значение термодинамических функций для Сграфит.
T,К 
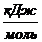
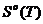
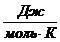
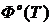
|
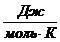
|
|
|
|
|
1300
|
19.588
|
30.381
|
15.313
|
|
1400
|
21.96
|
32.138
|
16.453
|
|
1500
|
24.367
|
33.799
|
17.554
|
|
1600
|
26.802
|
35.371
|
18.619
|
|
1700
|
29.258
|
36.859
|
19.649
|
|
1800
|
31.729
|
38.272
|
20.645
|
|
1900
|
34.212
|
39.614
|
21.608
|
|
2000
|
36.703
|
40.892
|
22.54
|
|
2100
|
39.203
|
42.112
|
23.444
|
|
2200
|
41.71
|
43.278
|
24.319
|
ΔƒН0(0) = 0
Приложение В
Значение термодинамических функций для Mо.
T.К 
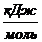
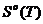
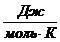
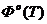
|
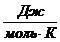
|
|
|
|
|
1300
|
31.922
|
67.857
|
43.301
|
34.951
|
70.101
|
45.136
|
|
1500
|
38.054
|
72.241
|
46.872
|
|
1600
|
41.237
|
74.295
|
48.522
|
|
1700
|
44.506
|
76.277
|
50.097
|
|
1800
|
47.868
|
78.199
|
51.605
|
|
1900
|
51.331
|
80.070
|
53.054
|
|
2000
|
54.900
|
81.901
|
54.451
|
|
2100
|
58.582
|
83.697
|
55.801
|
|
2200
|
62.384
|
85.466
|
57.109
|
ΔƒН0(0) = 0 кДж
Приложение Г
Значение термодинамических функций для СO
T.К 
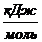
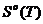
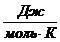
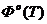
|
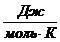
|
|
|
|
|
1300
|
40.535
|
243.321
|
212.14
|
|
1400
|
44.01
|
245.896
|
214.469
|
|
1500
|
47.516
|
248.315
|
216.638
|
|
1600
|
51.051
|
250.596
|
218.689
|
|
1700
|
54.61
|
252.754
|
220.63
|
|
1800
|
58.191
|
254.8
|
222.472
|
|
1900
|
61.79
|
256.747
|
224.225
|
|
2000
|
258.601
|
225.898
|
|
2100
|
69.038
|
260.373
|
227.498
|
|
2200
|
72.683
|
262.068
|
229.031
|
ΔƒН0(0) = - 113.812 кДж
Приложение Д
Значение термодинамических функций для MоO3
T.К 
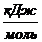
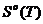
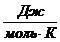
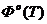
|
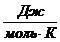
|
|
|
|
|
1300
|
163.684
|
264.409
|
138.498
|
|
1400
|
176.384
|
273.82
|
147.832
|
|
1500
|
189.084
|
282.582
|
156.526
|
|
1600
|
201.784
|
290.779
|
164.664
|
|
1700
|
214.484
|
298.478
|
172.311
|
|
1800
|
227.184
|
305.737
|
179.524
|
|
1900
|
239.884
|
312.604
|
186.349
|
|
2000
|
252.584
|
319.118
|
192.826
|
|
2100
|
265.284
|
325.314
|
198.989
|
|
2200
|
277.984
|
331.222
|
204.866
|
ΔƒН0(0) = - 739.587 кДж