Буферные растворы
Ïëàí
Теория кислот и
оснований. Буферные растворы
Теория кислот и оснований
Буферные растворы
Определение буферных систем и их классификация
Механизм действия буферных систем Вычисление рН
и рОН буферных систем
Уравнение Гендерсона-Гассельбаха
Буферная емкость
Буферные системы человеческого организма
Нарушения кислотно-оснoвного равновесия крови.
Ацидоз. Алкалоз
СПИСОК ЛИТЕРАТУРЫ
Òåîðèÿ
êèñëîò è
îñíîâàíèé.
Áóôåðíûå
ðàñòâîðû
Теория кислот и
оснований
Содержание понятий «кислота» и
«основание» в процессе развития химической науки существенно менялось,
оставаясь одним из основных вопросов химии.
В 1778 г. французским ученым
Лавуазье была выдвинута «кислородная теория кислот», согласно которой
общие свойства кислот обусловлены обязательным наличием в них атомов кислорода.
Однако эта теория сразу же встретилась с затруднениями.
Антуан Лоран
Лавуазье (1743-1794)
Антуан Лоран Лавуазье,
выдающийся французский ученый, родился 26 августа 1743 г. в Париже. Он, как и
Ломоносов, последовательно применял для решения основных проблем химии
теоретические представления и методы физики своего времени, что позволило
достигнуть очень важных научных результатов.
Большой заслугой Лавуазье
является приведение в систему огромного фактического материала, накопленного
химией. Он разработал (вместе с тремя другими французскими химиками)
рациональную химическую номенклатуру, произвел точную классификацию всех
известных в то время веществ (элементов и химических соединений).
Ряд соединений (соляная кислота
HCl, синильная кислота
HCN и др.), обладающих
ярко выраженными кислотными свойствами, тем не менее атомов кислорода в своем
составе не имеют. В то же время оксиды металлов, также как и некоторые оксиды
неметаллов, содержащие кислород, не обладают кислотными свойствами.
В начале XIX
века немецким ученым Юстусом Либихом была предложена «водородная теория
кислот», согласно которой кислотой является водородное соединение способное
замещать атомы водорода на металл. Но данное определение не отражало наиболее
существенного свойства кислот, благодаря которому эти вещества были выделены в
особый класс соединений, - способности вступать в реакцию нейтрализации с
основаниями.
В конце XIX
века немецким ученым Вильгельмом Оствальдом и шведским ученым Сванте Аррениусом
на основании теории электролитической диссоциации были предложены новые
определения кислот и оснований.
По теории Аррениуса-Оствальда
кислотой называется электронейтральное вещество, которое при растворении в воде
диссоциирует с образованием ионов Н+, а основанием -
электронейтральное вещество, которое диссоциирует с образованием ионов ОН-.
Все общие свойства кислот -
кислый вкус, действие на металлы, индикаторы и т.д. - являются свойствами ионов
Н+. В свою очередь, все общие свойства оснований являются свойствами
ионов ОН-.
Реакция нейтрализации между
кислотой и основанием, таким образом, обусловлена взаимодействием водородных и
гидроксильных ионов, приводящих к образованию недиссоциированных молекул воды:
Н+ + ОН-
= Н2О
Однако представления о кислотах
и основаниях согласно теории Аррениуса-Оствальда также являются не
всеобъемлющими и не удовлетворяют во многих случаях наблюдаемым
экспериментальным фактам, особенно если они относятся к неводным растворам.
Так, например, кислоты и
основания могут взаимодействовать между собой и не будучи диссоциированы на
ионы. В частности газообразный хлороводород реагирует с твердой щелочью:
HCl + NaOH = NaCl +
H2O
Тот же хлороводород при
растворении в бензоле совершенно не распадается на ионы, однако изменяет
окраску индикатора и взаимодействует с металлами, выделяя газообразный Н2.
Существует много реакций
образования солей, аналогичных реакции нейтрализации, протекающих как в водной
так и безводной среде, но без участия ионов Н+ и ионов ОН-:
NH3(газ.)
+ HCl(газ.)
= NH4Cl(тв.)
Таким образом, теория кислот и
оснований Аррениуса-Оствальда полностью применима лишь к водным растворам
веществ. Процессы, протекающие без участия растворителя, а также в неводных
жидких средах, требуют существенного дополнения и обобщения данной теории.
Такой более общей теорией
кислот и оснований явилась протолитическая теория, предложенная в 1923
г. независимо друг от друга датским ученым Бренстедом и английским
ученым Лоури.
Йоханнес Николаус
Бренстед (1879-1947) - датский физикохимик. Томас
Мартин Лоури (1875 - 1936) - английский химик. Независимо друг от друга
практически одновременно сформулировали основные положения протолитической
теории кислот и оснований.
Бренстед, основные работы
которого посвящены термодинамике растворов и кислотно-основному катализу,
разработал детали и количественное описание протолитической теории. Основной
областью научных интересов Лоури были оптически активные органические
соединения.
Согласно этой теории кислотой
называется всякая частица (молекула или ион), способная отдавать протон. Основанием
является частица (молекула или ион), способная присоединять протон.
Причем отдача иона водорода
кислотой всегда происходит в присутствии основания, которое его должно
присоединить. При диссоциации кислоты в растворе в роли основания выступают
молекулы растворителя:
|
НА
|
+
|
Н2О
|
↔
|
А-
|
+
|
Н3О+
|
|
кислота
|
|
основание
|
|
сопряженное
основание
|
|
сопряженная
кислота
|
Образующаяся после отделения
иона водорода частица А- называется сопряженным данной кислоте
основанием, т.к. она способна снова присоединять к себе ион Н+.
Соответственно, частица,
полученная после присоединения к основанию иона Н+, называется сопряженной
данному основанию кислотой, т.к. способна отдавать его обратно:
|
В
|
+
|
Н+
|
↔
|
ВН+
|
|
основание
|
|
|
|
сопряженнаякислота
|
Кислота и основание в
кислотно-основной паре взаимосвязаны друг с другом. Чем сильнее (слабее)
кислота, тем слабее (сильнее) сопряженное с ней основание (табл. 13). Например,
в водном растворе хлороводородная кислота HCl
сильнее чем уксусная кислота СН3СООН поэтому ацетат ион СН3СОО-
будет более сильным основанием чем хлорид ион Cl-.
Трактовка понятия «кислота» в
протолитической теории Бренстеда-Лоури совпадает с теорией Аррениуса-Оствальда
и лишь распространяет ее и на неводные растворы.
В случае же трактовки понятия
«основание» подход совершенно другой. Например, гидроксид натрия NaOH
считается основанием не потому что он диссоциирует с отщеплением гидроксид-иона
ОН-, а потому что этот ион может присоединять к себе ион Н+
с образованием молекулы воды. И именно его следует считать основанием в данном
случае. Причем основные свойства ион ОН- проявляет в присутствии
кислоты, способной отдать ему Н+. При растворении основания в роли
такой кислоты опять же выступают молекулы растворителя:
|
NН3
|
+
|
HOH
|
↔
|
NH4+
|
+
|
ОH-
|
|
основание
|
|
кислота
|
|
сопряженная
кислота
|
|
сопряженное
основание
|
Таблица 1 Значения рKa
и pKв
сопряженных кислот и оснований в разбавленных водных растворах
|
Кислота
|
рKa
|
Сопряженное
основание
|
pKв
|
|
H3O+
|
-1,74
|
H2O
|
15,74
|
|
HNO3
|
-1,32
|
NO3-
|
15,32
|
|
H2C2O4
|
1,26
|
HC2O4-
|
12,74
|
|
H2SO3
|
1,92
|
HSO3-
|
12,08
|
|
H3PO4
|
2,12
|
H2PO4-
|
11,88
|
|
HF
|
3,14
|
F-
|
10,86
|
|
CH3COOH
|
4,76
|
CH3COO-
|
9,24
|
|
H2S
|
7,05
|
HS-
|
6,95
|
|
NH4+
|
9,25
|
NH3
|
4,75
|
|
HCN
|
9,22
|
CN-
|
4,78
|
|
H2O
|
15,74
|
OH-
|
-1,74
|
Согласно протолитической теории
кислоты и основания могут быть трех типов: нейтральные, анионные и катионные.
В роли первых выступают нейтральные
молекулы, способные отдавать или присоединять ион Н+, например: HCl,
H2SO4,
HNO3
(кислоты); NH3,
CH3-O-CH3
(основания).
Анионные основания
и кислоты представляют собой отрицательно заряженные
ионы, например: HSO4-,
HPO42-,
HS-
(кислоты); OH-,
Cl-,
NO3-
(основания).
В роли катионных оснований и
кислот выступают положительно заряженные ионы, например: NH4+,
H3O+
(кислоты); H2N-NH3+,
H2N-(CH2)2-NH3+
(основания).
Многие частицы (как молекулы,
так и ионы) обладают амфотерными свойствами, т.е. в зависимости от условий
могут выступать как в роли кислоты так и в роли основания, например: H2O,
NH3,
HSO4-,
H2N-NH3+
и т.д. Данные соединения называются амфипротными или амфолитами.
В некоторых случаях провести
резкую грань между их кислотными и основными свойствами и определить какие из
них выражены сильнее бывает затруднительно.
Кислотные свойства соединения в
растворе определяют по отношению к растворителю как к основанию. Количественно
они оцениваются константой равновесия (К) реакции, заключающейся в переносе
протона от кислоты к основанию (протолитическая реакция). Покажем это на
примере диссоциации муравьиной кислоты в водном растворе:
|
НСООН
|
+
|
Н2О
|
↔
|
НСОО-
|
+
|
Н3О+
|
|
Муравьиная
кислота
|
|
основание(избыток)
|
|
формиат-ион(сопряженное
основание)
|
|
ион
гидроксония (сопряженная кислота)
|
Константа равновесия данной
реакции равна
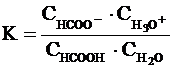
Эта константа отличается от обычного
выражения константы диссоциации кислоты (Kдисс.),
приводимого ранее, множителем 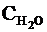 . При рассмотрении диссоциации
разных кислот в одном и том же растворителе данный множитель остается
одинаковым, поэтому его обычно включают в константу равновесия в виде
произведения
. При рассмотрении диссоциации
разных кислот в одном и том же растворителе данный множитель остается
одинаковым, поэтому его обычно включают в константу равновесия в виде
произведения 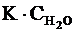 и обозначают
Ka (константа
кислотности):
и обозначают
Ka (константа
кислотности):
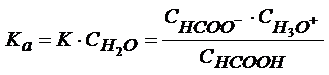
Чем больше величина Ka, тем
сильнее кислота, т.е. тем она легче отдает ионы Н+ основанию
(молекулам растворителя). Для оценки силы слабых кислот чаще используют не
величину Ka, а ее
десятичный логарифм, взятый с обратным знаком:
lg Ka
= pKa
Чем больше значение рKa, тем слабее
кислота.
Для количественной характеристики
основности соединения в водном растворе служит константа равновесия K реакции:
|
:B
|
+
|
H2O
|
↔
|
ВН+
|
+
|
ОН-
|
|
основание
|
|
кислота
|
|
Сопряженная
кислота
|
|
Сопряженное
основание
|
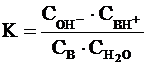
С учетом того, что  (константа
основности), можно записать:
(константа
основности), можно записать:
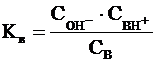
Для оценки силы слабых оснований,
как и в случае слабых кислот, также удобнее применять не значение Kв, а ее
отрицательный десятичный логарифм:
pKв
= -lg
Kв
На практике для оценки основных
свойств соединения часто вместо Kв (pKв) используют
величину Ka (pKa)
сопряженной данному основанию кислоты ВН+:

Например, мерой NH3 служит
величина Ka иона
аммония NH4+
(сопряженной аммиаку кислоты):
NH4+
+ H2O ↔ NH3 + H3O+
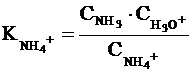
Чем меньше значение 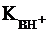 тем более
сильным является основание.
тем более
сильным является основание.
Для кислоты и сопряженного ей
основания в разбавленном водном растворе справедливо равенство:
Kw = Ka · Kв
где Kw - ионное
произведение воды.
Кислотные свойства вещества в
растворе зависят не только от его способности отдавать ион Н+, но и
от способности молекул растворителя его принять. Так хлороводород при
растворении в воде практически полностью распадается на ионы, а его растворы в
бензоле, наоборот, не содержат ионов и не проводят электрический ток. Чем
больше у растворителя сродство к протону, тем легче диссоциирует в нем кислота.
Растворители с ярко выраженным сродством к ионам Н+ называются
протофильными.
В таких растворителях (жидкий NH3, гидразин)
даже очень слабые в водных растворах кислоты: HCN, H2S - являются
сильными.
Растворители, обладающие гораздо
большей способностью к отдаче протона, чем к его присоединению называются
протогенными. К ним относятся: ледяная уксусная кислота, концентрированная
(100%) H2SO4 и др. В их
среде затрудняется диссоциация кислот, но облегчается ионизация оснований.
Растворители, обладающие сравнимой
способностью к присоединению или отдаче ионов Н+ называются
амфипротными. К ним относятся Н2О, насыщенные одноатомные спирты (СН3ОН,
С2Н5ОН) и т.д.).
Существуют также апротонные
или инертные растворители: бензол, толуол, CCl4, дихлорэтан
и др. Способность присоединять или отщеплять от себя ион Н+ у них
выражена очень слабо. В их среде кислоты и основания практически не
диссоциируют.
Таким образом, в теории кислот и
оснований Бренстеда-Лоури понятия кислоты и основания относятся лишь к функции,
которую выполняет рассматриваемое соединение в том или ином процессе. Одно и
тоже вещество может в одних условиях проявлять себя как кислота, а в других -
как основание. Например, в водных растворах СН3СООН ведет
себя как кислота:
СН3СООН + Н2О ↔
СН3СОО- + Н3О+
а в 100% H2SO4 - как
основание
СН3СООН + H2SO4 ↔ HSO4- + СН3СООН2+
Таким образом, в системе из двух
способных взаимодействовать с протоном веществ основанием всегда служит то,
которое его прочнее связывает, т.е. характеризуется большим протонным
сродством.
Все реакции кислотно-основного
взаимодействия (ионизации, нейтрализации, гидролиза) согласно теории
Бренстеда-Лоури состоят в обратимом переносе протона от кислоты к основанию,
вследствие чего их часто называют протолитическими. В результате такого
взаимодействия образуется пара частиц: одна из которых опять способна отдавать
протон, а другая его присоединять. Таким образом кислота оказывается в
равновесии с сопряженным основанием, а основание с сопряженной кислотой:
|
НА
|
+
|
В
|
↔
|
ВН+
|
+
|
А-
|
|
кислота
|
|
основание
|
|
Сопряженная
кислота
|
|
сопряженное
основание
|
Данный процесс называется
кислотно-основным равновесием. До наступления равновесия он преимущественно
протекает в сторону образования более слабой кислоты и основания.
Рассмотрим примеры некоторых
протолитических реакций.
. Реакция ионизации:
|
СН3СООН
|
+
|
Н2О
|
↔
|
СН3СОО-
|
+
|
Н3О+
|
|
кислота
|
|
основание
|
|
сопряженное
основание
|
|
сопряженная
кислота
|
Реакция, протекающая в прямом
направлении является реакцией ионизации уксусной кислоты, а в обратном
направлении - реакцией нейтрализации основания (ацетат-иона) кислотой.
Равновесие данного обратимого
процесса в значительной степени смещено влево, т.к. СН3СООН и Н2О
являются более слабыми кислотой и основанием, чем Н3О+ и
СН3СОО- (табл. 13). Данная прямая реакция является
реакцией гидролиза ацетат-иона, а обратная - реакцией нейтрализации уксусной
кислоты сильным основанием ОН-.
. Реакция гидролиза:
|
СН3СОО-
|
+
|
Н2О
|
↔
|
СН3СООН
|
+
|
ОH-
|
|
основание
|
|
кислота
|
|
сопряженная
кислота
|
|
сопряженное
основание
|
Более слабыми кислотой и
основанием являются Н2О и СН3СОО- (табл. 13) и
поэтому в данном обратимом процессе обратная реакция превалирует над прямой.
Теория Бренстеда-Лоури хоть и
является более совершенной чем теория Аррениуса, однако тоже имеет определенные
недостатки и не является всеобъемлющей. Так она неприменима ко многим
веществам, проявляющим функцию кислоты, но не содержащих в своем составе ионов
Н+, например: BCl3,
AlCl3,
BF3,
FeCl3
и др.
В 1923 г. Г.Н. Льюисом была
выдвинута электронная теория кислот и оснований, в которой кислотные
свойства соединения вообще не связываются с наличием в нем ионов водорода.
Гильберт Нильтон
Льюис (1875 -1946). Американский физикохимик. Его работы
связаны с химической термодинамикой и теорией строения вещества. Ввел в
термодинамике понятие активности, разработал теорию обобщенных электронных пар
в моделях ковалентной связи (структуры Льюиса). В 1926 г. практически
одновременно с Бренстедом и Лоури предложил новую концепцию кислот и оснований,
в которой основой является передача электронной пары: кислоты Льюиса -
акцепторы, а основания Льюиса - доноры электронной пары. В 1930-х гг. Льюис разработал
метод получения тяжелой воды.
Кислотой по Льюису является
частица (молекула или ион), способная присоединять электронную пару (акцептор
электронной пары). Она должна содержать в своем составе атом с незаполненной до
октета внешней электронной оболочкой: BF3,
AlCl3,
BeCl2,
H+,
Cu2+
и т.д. Основанием является частица (молекула или ион), способная предоставлять
для образования связи электронную пару (донор электронной пары). Основание по
Льюису должно содержать в своем составе атом с неподеленной электронной парой
на внешнем слое: :NH3,
:NH2-NH2,
:OH-,
:Cl-.
Согласно теории Льюиса кислота
и основание взаимодействуют друг с другом с образованием ковалентной связи по
донорно-акцепторному механизму:
|
А
|
+
|
:В
|
→
|
А
: В
|
|
кислота
|
|
основание
|
|
кислотно-основной
комплекс
|
|
BF3
|
+
|
:NH3
|
→
|
F3B
: NH3
|
|
кислота
|
|
основание
|
|
|
|
H+
|
+
|
Н2О:
|
→
|
Н3О+
|
|
кислота
|
|
основание
|
|
|
Теория Льюиса не противоречит
теории Бренстеда-Лоури. Понятие основания в обеих этих теориях практически
совпадает, однако понятие кислоты в концепции Льюиса значительно шире и
охватывает кроме иона Н+ многие другие электроноакцепторные частицы,
в том числе и катионы металлов Men+.
Соответственно значительно увеличивается и число реакций, которые по своему
характеру относятся к кислотно-основному взаимодействию. Так, например,
согласно теории Льюиса кислотно-основными являются многочисленные реакции
комплексообразования:
|
Cu2+
|
+
|
4NН3
|
→
|
[Cu(NН3)4]2+
|
|
кислота
|
|
основание
|
|
|
Теория Льюиса широко
используется для объяснения реакционной способности органических соединений и
очень удобна при описании механизма химических реакций, протекающих с их
участием.
Áóôåðíûå
ðàñòâîðû
Определение
буферных систем и их классификация
Многие реакции в растворе
протекают в нужном направлении только при определенной концентрации ионов Н+.
Изменение её в ту или иную сторону от соответствующего оптимального значения
приводит к появлению новых, часто нежелательных продуктов. В связи с этим,
поддержание постоянного значения рН на протяжении всего времени осуществления
реакции часто является важным условием ее успешного завершения.
Особенно актуально это для
биохимических процессов, протекающих в живых организмах. Большинство из них
катализируется различными ферментами или гормонами, проявляющими свою
биологическую активность только в строго определенном и достаточно узком
интервале значений рН.
Растворы, способные сохранять
постоянной концентрацию ионов Н+ при добавлении к ним небольших
количеств сильной кислоты или щелочи, а также при разбавлении, называются
буферными растворами или буферными системами.
Свойство данных растворов
сохранять неизменным присущее им значение рН при вышеперечисленных
обстоятельствах, называется иначе буферным действием.
Буферные растворы в зависимости
от своего состава делятся на 2 основных типа: кислотные и основные.
Кислотные буферные системы
обычно образованы слабой неорганической или органической кислотой и солью этой
же кислоты с сильным основанием. Например:
С точки зрения теории
Бренстеда-Лоури кислотной буферной системой является равновесная смесь слабой кислоты
и сопряженного ей основания. Причем роль сопряженного основания играют
образующиеся при диссоциации солей анионы слабых кислот.
|
1)
|
СН3СООН
|
+
|
СН3СООNa
|
-
|
ацетатный
буфер
|
|
слабая
кислота
|
|
соль
кислоты
|
|
|
|
2)
|
Н2СО3(Н2О
+ СО2)
|
+
|
NaНСО3
|
-
|
гидрокарбонатный
или бикарбонатный буфер
|
|
слабая
кислота
|
|
соль
кислоты
|
|
|
В связи с этим состав буферных
растворов можно записать иначе:
|
1)
|
СН3СООН
|
/
|
СН3СОО-
|
-
|
ацетатный
буфер
|
|
слабая
кислота
|
|
сопряженное
основание
|
|
|
|
2)
|
Н2СО3(Н2О
+ СО2)
|
/
|
НСО3-
|
-
|
гидрокарбонатный
буфер
|
|
слабая
кислота
|
сопряженное
основание
|
|
|
Кислотная буферная система
может быть образована и смесью двух солей многоосновной кислоты,
соответствующих различным стадиям нейтрализации этой кислоты.
В этом случае кислотный остаток
одной из солей (менее замещенный) играет роль слабой кислоты, а кислотный
остаток второй соли (более замещенный) - сопряженного ей основания.
Примером таких систем могут
служить:
) карбонатная буферная
система, представляющая собой смесь кислой (NaHCO3)
и средней (Na2CO3)
солей угольной кислоты
|
HCO3-
|
/
|
СО32-
|
|
слабая
кислота
|
|
сопряженное
основание
|
2) фосфатные буферные растворы
|
NaH2PO4 +
Na2HPO4
|
(H2PO4-
|
/
|
HPO42-
|
|
слабая
кислота
|
|
сопряженное
основание
|
|
Na2HPO4 +
Na3PO4
|
(HPO42-
|
/
|
PO43-
|
|
слабая
кислота
|
|
сопряженное
основание
|
Следует отметить, что не только
смеси, но и растворы некоторых индивидуальных солей (например: тетрабората
натрия (Na2B4O7),
карбоната аммония ((NH4)2CO3)
и др.) тоже обладают буферными свойствами, которые объясняются сильным
гидролизом этих солей и образованием вследствие этого компонентов, необходимых
для буферного действия:
(NH4)2CO3
+ HOH ↔
NH4HCO3
+ NH4OH
Основные буферные системы
образованы слабым неорганическим или органическим основанием и солью этого
основания с сильной кислотой. Например:
|
1)
|
NH3
· H2O(NH4OH)
|
+
|
NH4Cl
|
-
аммиачный буфер
|
|
слабое
основание
|
|
соль
|
|
|
2)
|
C2H5-NH2
|
+
|
C2H5NH3Cl
|
-
этиламиновый буфер
|
|
слабое
основание
|
|
соль
|
|
Определенным буферным действием
обладают также и растворы многих органических веществ, молекулы которых одновременно
содержат в своем составе функциональные группы, проявляющие как слабые
кислотные (СООН-группы), так и основные (NH2-группы) свойства.
С точки зрения теории
Бренстеда-Лоури основная буферная система также представляет собой равновесную
смесь слабой кислоты и сопряженного ей основания, только роль кислоты в данном
случае выполняет образующийся при диссоциации соли катион:
|
1)
|
NH4+
|
/
|
NH3
|
-
аммиачный буфер
|
|
слабая
кислота
|
|
сопряженное
основание
|
|
|
2)
|
C2H5-NH3+
|
/
|
C2H5-NH2
|
|
слабая
кислота
|
|
сопряженное
основание
|
|
По своей природе данные
соединения являются амфолитами. К ним относятся аминокислоты, белки, пептиды.
Таким образом, любая
кислотно-основная буферная система является равновесной смесью, состоящей из
донора и акцептора протонов.
В такой системе, содержащей в
своем составе слабую кислоту, различают общую, активную и потенциальную
кислотности:
) общая кислотность
соответствует максимально возможной концентрации ионов Н+ в данном
растворе, если теоретически предположить, что все имеющиеся в нем молекулы
кислоты полностью распадутся на ионы, а гидролиз имеющейся соли можно не
учитывать. Общая кислотность численно равна молярной концентрации химического
эквивалента кислоты в растворе и определяется опытным путем (например с помощью
титриметрического метода анализа);
) активная кислотность
равна концентрации (или активности) содержащихся «свободных» ионов Н+
(Н3О+), образовавшихся в результате диссоциации
некоторого количества молекул кислоты;
) потенциальная кислотность
определяется совокупностью присутствующих в системе недиссоциированных молекул
кислоты.
Потенциальная кислотность может
быть вычислена вычитанием из общей кислотности активной. Например, для
ацетатного буфера все эти виды кислотности можно условно представить следующим
образом:
Схема
|
СН3СООН
|
D
|
Н+
|
+
|
СН3СОО-
|
|
|
|
|
|
|
потенциальная
кислотность
|
|
активная
кислотность
|
|
|
|
|
|
|
|
|
общая
кислотность
|
|
По аналогии с растворами слабых
кислот в растворах слабых оснований можно также различать активную и
потенциальную щелочность.
Механизм действия
буферных систем
Сущность буферного действия
смеси слабой кислоты с ее солью можно рассмотреть на примере ацетатного
буферного раствора. При добавлении к нему сильной кислоты (например, HCl)
происходит реакция:
3COONa
+ HCl = NaCl + CH3COOH- молекулярное
уравнение3COO-
+ Na+ + H+ + Cl- = Na+ + Cl-
+ CH3COOH- полное ионное
уравнение+
+ CH3COO-
= CH3COOH-
сокращенное ионное уравнение
В результате этого воздействия
сильная кислота замещается на эквивалентное количество плохо диссоциированной
слабой кислоты буферной системы, поэтому концентрация ионов Н+ в
растворе существенно не изменяется. Пока солевая компонента буферной системы не
расходуется в данной реакции раствор в той или иной степени будет сохранять
свое буферное действие.
При добавлении к буферной смеси
сильного основания происходит реакция: В результате сильное основание
замещается на эквивалентное количество нейтральной соли буферной системы,
поэтому концентрация ионов водорода в ней опять изменится незначительно.
Буферное действие раствора при
этом будет наблюдаться пока полностью не расходуется слабая кислота.
CH3COOH
+ NaOH = CH3COONa
+ H2O-
молекулярное уравнение
CH3COOH
+ Na+
+ OH-
= CH3COO-
+ Na+
+ H2O-
полное ионное уравнение
CH3COOН
+ OH-
= CH3COO-
+ H2O-
сокращенное ионное уравнение
Если к буферному раствору
попеременно добавлять в небольших количествах сильную кислоту или щелочь, то
его буферное действие сможет сохраняться более длительное время, т.к. в
результате протекающих реакций буферная система будет периодически
восстанавливать свой первоначальный количественный и качественный состав.
Для кислотной буферной системы,
образованной двумя солями механизм действия будет аналогичным. Рассмотрим его
на примере фосфатного буфера: NaH2PO4
+ Na2HPO4.
Добавленная к нему сильная
кислота провзаимодействует с солевой компонентой системы и заместится на
эквивалентное количество компоненты, играющей роль слабой кислоты.
Na2HPO4
+ HCl = NaH2PO4
+ NaCl- молекулярное
уравнение
2Na+
+ HPO42-
+ H+
+ Cl-
= 2Na+
+ H2PO4-
+ Cl--
полное ионное уравнение
HPO42-
+ H+
= H2PO4--
сокращенное ионное уравнение
Внесенная щелочь, наоборот,
заместится на эквивалентное количество нейтральной солевой компоненты буфера:
NaH2PO4
+ NaOH = Na2HPO4
+ H2O-
молекулярное уравнение
Na+
+ H2PO4-
+ Na+
+ OH-
= 2Na+
+ HPO42-
+ H2O-
полное ионное уравнение
H2PO4-
+ OH-
= HPO42-
+ H2O-
сокращенное ионное уравнение
Механизм действия основных
буферных систем рассмотрим на примере аммиачного буфера. Добавленная к нему
сильная кислота провзаимодействует со слабым основанием и заместится на
эквивалентное количество солевой компоненты буфера:
NH3
+ HCl = NH4Cl-
молекулярное уравнение
NH3
+ H+
+ Cl-
= NH4+
+ Cl--
полное ионное уравнение
NH3
+ H+
= NH4+-
сокращенное ионное уравнение
Щелочь вступит в реакцию с
солью буферной системы и вместо нее образуется эквивалентное количество слабого
основания:
NH4Cl +
NaOH = NH3 + H2O + NaCl-
молекулярное уравнение
NH4+
+ Cl-
+ Na+
+ OH-
= NH3
+ H2O
+ Na+
+ Cl--
полное ионное уравнение
NH4+
+ OH-
= NH3
+ H2O-
сокращенное ионное уравнение
Таким образом, рассмотренные
примеры показывают, что буферное действие растворов независимо от их состава
обусловлено взаимодействием внесенных в них ионов Н+ или ОН-
с соответствующим компонентом буфера. В результате этого происходит их связывание
в растворе за счет образования слабодиссоциированного продукта реакции, т.е.
(говоря другими словами) перевод в потенциальную кислотность либо основность.
Вследствие этого активная кислотность (основность) самой буферной системы
существенно не изменяется и остается на первоначальном уровне.
Вычисление рН и рОН
буферных систем. Уравнение Гендерсона-Гассельбаха
Каждая из буферных систем
характеризуется определенной присущей ей концентрацией ионов Н+
(активной кислотностью), которую система и стремится сохранить на неизменном
уровне при добавлении к ней сильной кислоты либо щелочи. Установим на примере
ацетатного буфера факторы, влияющие на величину активной кислотности.
В растворе данной буферной
системы происходят следующие реакции электролитической диссоциации:
CH3COOH D
CH3COO- + H+3COONa
→
CH3COO-
+ Na+
(Гидролиз соли, т.е.
взаимодействие ацетат-ионов с Н2О учитывать
не будем.)
CH3COO-
+ HOH D
CH3COOH
+ OH-
Таким образом, ионы Н+
образуются только за счет диссоциации некоторого числа молекул уксусной
кислоты. Этот процесс является обратимым и количественно характеризуется
константой кислотности Kа:
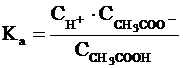
где 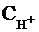 (или
(или 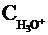 ),
),  и
и 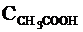 равновесные молярные концентрации
ионов Н+, СН3СОО- и непродиссоциированных
молекул кислоты.
равновесные молярные концентрации
ионов Н+, СН3СОО- и непродиссоциированных
молекул кислоты.
Из данного уравнения можно выразить 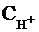 или
активную кислотность буферной системы:
или
активную кислотность буферной системы:
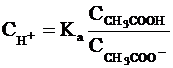
Кроме уксусной кислоты в растворе
присутствует ее соль CH3COONa. Она
является сильным электролитом и полностью распадается на ионы. В результате
этого концентрация анионов СН3СОО- резко возрастает и
согласно принципа Ле-Шателье равновесие реакции диссоциации уксусной кислоты
смещается влево, т.е. в сторону образования ее молекул. Причем диссоциация
уксусной кислоты в присутствии собственной соли может быть настолько
подавленной, что равновесную концентрацию ее нераспавшихся молекул в растворе
можно считать равной концентрации СН3СООН, а равновесную
концентрацию ацетат-ионов - исходной концентрации соли. В связи с этим
выражение, по которому рассчитывается концентрация ионов Н+, можно
записать иначе:
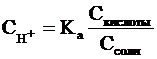
где Скислоты и Ссоли
- исходные концентрации компонентов буферной системы.
Прологорифмируем полученное
уравнение (с учетом того, что логарифм произведения равен сумме логарифмов
сомножителей):
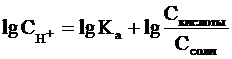
и умножим обе его части на -1:
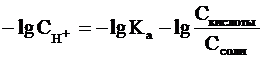
Как было показано нами ранее
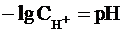 , a
, a 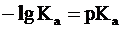
В связи с этим запишем уравнение для
расчета концентрации ионов Н+ в окончательном виде:
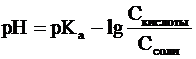
Данное выражение называется иначе уравнением
Гендерсона-Гассельбаха. Его можно использовать для вычисления рН любой
кислотной буферной системы. Например, для фосфатного буфера уравнение
Гендерсона-Гассельбаха запишется следующим образом:
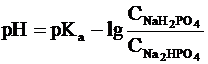
(в данной системе роль слабой
кислоты играет анион Н2РО4-, то  .
.
В водных растворах рН и рОН являются
сопряженными величинами. Их сумма всегда равна 14, т.е.:
рН + рОН = 14
Зная концентрацию ионов Н+
или рН можно вычислить концентрацию гидроксильных ионов или рОН.
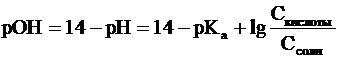
Уравнения Гендерсона-Гассельбаха для
расчета рОН и рН в оснóвных
буферных системах выглядят следующим образом:
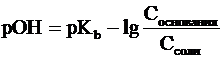
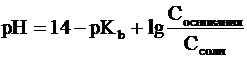
где pKb = -lg Kb (основания), Соснования
и Ссоли - исходные молярные концентрации компонентов данных буферных
систем, т.е. слабого основания и его соли с сильной кислотой.
Из приведенных выше уравнений
следует, что рН и рОН буферной системы зависит от константы кислотности или
основности слабого электролита, входящего в ее состав и от соотношения
концентраций компонентов буфера.
Значение рК для слабого электролита
является величиной постоянной, не зависит от концентрации этого электролита в
растворе и приводится в соответствующих справочниках. Зная его можно с помощью
уравнения Гендерсона-Гассельбаха рассчитать рН буферного раствора, если
известен его количественный состав или, наоборот, определить состав раствора
(исходные концентрации его компонентов), который будет обеспечивать заданное
значение рН. На практике обычно пользуются готовыми таблицами, в которых
указано, в каком соотношении должны быть взяты компоненты для получения
буферного раствора с желаемым значением рН.
Если концентрации веществ в буферной
системе одинаковые, т.е.
Скислоты = Ссоли
или Соснования = Ссоли, то
рН = рKa (для
кислотной буферной системы)
pOH = pKb (для оснóвной
буферной системы)
Изменяя концентрацию какого-либо
компонента можно сместить значение рН в ту или иную сторону для достижения
нужной величины.
В буферных системах, используемых на
практике, концентрации компонентов не отличаются друг от друга более чем в 10
раз, т.е. их рН не отклоняется больше чем на единицу от величины рK своего
слабого электролита. Таким образом, область практических значений рН буферных
систем (область буферирования) лежит в интервале pK ± 1.
Если концентрации компонентов
буферного раствора различаются более чем в 10 раз, то такой раствор обладает
слабым буферным действием и может удерживать неизменным содержание ионов Н+
только при добавлении очень малых количеств сильной кислоты либо щелочи. Это
делает неудобным его использование в практических целях.
При разбавлении концентрации обоих
компонентов буферных растворов уменьшаются в одинаковое число раз, поэтому их
соотношение остается неизменным. Следовательно по уравнению
Гендерсона-Гассельбаха величина рН буферного раствора при этом тоже не должна
изменяться. При разбавлении в 10-20 раз экспериментальные измерения рН хорошо
согласуются с теоретическими расчетами. Однако при большем разбавлении наблюдается
небольшое увеличение рН раствора, которое связано с возрастанием степени
диссоциации слабого электролита и увеличением константы его диссоциации.
Уравнение Гендерсона-Гассельбаха
является приближенным и его не рекомендуется использовать в следующих случаях:
) если кислота либо основание
буферной системы не является достаточно слабым электролитом (например, для
кислоты pKa < 3).
Тогда нельзя пренебрегать их диссоциацией в присутствии собственной соли;
) если кислота либо основание
буферной системы являются, наоборот, слишком слабыми электролитами (например,
для кислоты pKa > 11).
Тогда нельзя пренебрегать гидролизом их солей.
Буферная емкость
Способность буферных систем
противодействовать резкому изменению рН при добавлении к ним сильной кислоты или
основания является ограниченной. Буферная смесь поддерживает рН постоянным
только при условии, что количество вносимых в раствор сильной кислоты или
щелочи не превышает определенной величины. В противном случае наблюдается
резкое изменение рН, т.е. буферное действие раствора прекращается. Это связано
с тем, что в результате протекающей реакции изменяется соотношение молярных
концентраций компонентов буферной системы: Скислоты/Ссоли
или Соснования/Ссоли. При этом концентрация компонента,
реагирующего с добавленной кислотой или щелочью, уменьшается, а концентрация
второго компонента возрастает, т.к. он дополнительно образуется в ходе реакции.
Количественно буферное действие раствора характеризуется с помощью буферной
емкости (В). При этом различают буферную емкость по кислоте (Вк.) и
буферную емкость по основанию или щелочи (Во.). Буферной емкостью
по кислоте является то количество химического эквивалента сильной кислоты,
которое нужно добавить к 1 литру (1 дм3) буферной системы, чтобы
уменьшить её рН на единицу. Ее можно рассчитать по следующей формуле:
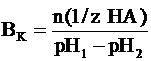
где n(1/z HA) - число
молей химического эквивалента сильной кислоты, добавленное к 1 литру буферной
системы;рН1 - водородный показатель системы до добавления сильной
кислоты;рН2 - водородный показатель системы после добавления сильной
кислоты.
В более общем случае (если брать не
1 литр буферной системы, а любой другой ее объем, выраженный в литрах или дм3)
формула для подсчета буферной емкости будет иметь следующий вид:
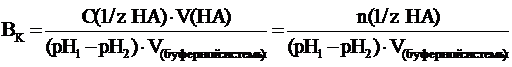
где С(1/z НА) -
молярная концентрация химического эквивалента сильной кислоты в добавляемом
растворе; V(НА) - объем
(л) добавленного раствора сильной кислоты; V(буферной
системы)
- объем буферного раствора, к которому добавляют раствор кислоты.
Соответственно буферной емкостью
по основанию является то количество химического эквивалента сильного
основания (щелочи), которое нужно добавить к 1 литру (1 дм3)
буферной системы, чтобы вызвать увеличение ее рН на единицу:
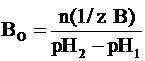
где n(1/z В) - число
молей химического эквивалента основания, которое добавили к 1 литру буферного
раствора; рН1 - водородный показатель раствора до добавления
основания; рН2 - водородный показатель раствора после добавления
основания. В более общем случае (если брать не 1 литр буферной системы, а любой
другой ее объем) формула для подсчета буферной емкости по основанию примет
следующий вид:

где С(1/z В) -
молярная концентрация химического эквивалента основания в добавляемом растворе;
V(В) - объем
(л) добавленного раствора сильного основания; V(буферной
системы)
- объем буферного раствора (л), к которому добавляют раствор сильного
основания.
Величина буферной емкости зависит от
концентраций компонентов буферной системы и от их соотношения.
Чем более концентрированным является
буферный раствор, тем выше его буферная емкость, т.к. в этом случае добавление
небольших количеств сильной кислоты или щелочи не вызовет существенного
изменения концентраций его компонентов, а значит и их соотношения.
Из буферных растворов с одинаковым
суммарным содержанием химического количества их компонентов наибольшей емкостью
будут обладать те, которые составлены из равного числа молей слабой кислоты и
её соли или слабого основания и его соли (рис. 35). В таких растворах молярные
концентрации компонентов будут одинаковые, а значит соотношение Скислоты/Ссоли
= 1 и Соснования/ Ссоли.= 1.
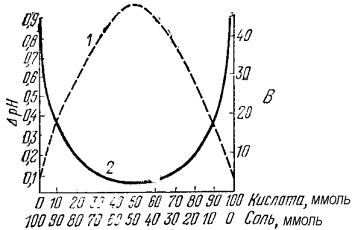
Рис. Изменение буферной емкости (1)
и изменение рН кислотной буферной системы при добавлении к ней определенного
количества сильной кислоты (2) в зависимости от содержания её компонентов
Данные растворы будут иметь примерно
одинаковые значения буферной емкости как по кислоте, так и по основанию.
Если же соотношение концентраций
компонентов буферной системы не равно 1, то значения ее буферной емкости по
основанию и кислоте будут отличаться друг от друга (причем тем существеннее,
чем в большей степени соотношение Скислоты/Ссоли и Соснования/Ссоли
отклоняется от единицы).
Например, если в кислотной буферной
системе солевой компоненты содержится больше чем слабой кислоты, то ее буферная
емкость по кислоте будет выше чем по основанию, т.е. Вк. > Во.
Соответственно буферная емкость по кислоте для основной буферной системы будет
больше чем по основанию в том случае, если содержание солевой компоненты в этом
случае будет меньше чем слабого основания. Таким образом можно сделать вывод,
что в данных случаях буферная емкость выше по тому веществу, которое реагирует
с избыточным компонентом буферного раствора. Если буферная система не обладает
достаточной буферной емкостью, то ее можно повысить, увеличив концентрацию
обоих компонентов в необходимое количество раз.
Буферные системы
человеческого организма
В организме человека в
результате протекания различных метаболических процессов постоянно образуются
большие количества кислых продуктов. Среднесуточная норма их выделения
соответствует 20-30 литрам раствора сильной кислоты с молярной концентрацией
химического эквивалента кислоты равной 0,1 моль/л (или 2000-3000 ммоль
химического эквивалента кислоты).
Образуются при этом и основные
продукты: аммиак, мочевина, креатин и др., - но только в гораздо меньшей
степени.
В состав кислых продуктов
обмена веществ входят как неорганические (H2CO3,
H2SO4),
так и органические (молочная, масляная, пировиноградная и др.) кислоты.
Соляная кислота секретируется
париетальными гландулацитами и выделяется в полость желудка со скоростью 1-4
ммоль/час.
Угольная кислота является конечным
продуктом окисления липидов, углеводов, белков и различных других
биоорганических веществ. В пересчете на СО2 ежесуточно ее образуется
до 13 молей.
Серная кислота выделяется при
окислении белков, поскольку в их состав входят серосодержащие аминокислоты:
метионин, цистеин.
При усвоении 100 г белка
выделяется около 60 ммоль химического эквивалента H2SO4.
Молочная кислота в большом
количестве образуется в мышечных тканях при физических нагрузках.
Из кишечника и тканей
образовавшиеся при обмене веществ кислые и основные продукты постоянно
поступают в кровь и межклеточную жидкость. Однако подкисление этих сред не
происходит и их водородный показатель поддерживается на определенном постоянном
уровне. Так значения рН большей части внутриклеточных жидкостей находится в
интервале от 6,4 до 7,8, межклеточной жидкости - 6,8-7,4 (в зависимости от вида
тканей). Особенно жесткие ограничения на возможные колебания значений рН
накладываются на кровь. Состоянию нормы соответствует интервал значений рН =
7,4±0,05.
Постоянство кислотно-основного
состава биологических жидкостей человеческого организма достигается совместным
действием различных буферных систем и ряда физиологических механизмов. К
последним прежде всего относятся деятельность легких и выделительная функция почек,
кишечника, клеток кожи.
Основными буферными системами
человеческого организма являются: гидрокарбонатная (бикарбонатная),
фосфатная, белковая, гемоглобиновая и оксигемоглобиновая. В различных
количествах и сочетаниях они присутствуют в той или иной биологической
жидкости. Причем только кровь содержит в своем составе все четыре системы.
Кровь представляет собой взвесь
клеток в жидкой среде и поэтому ее кислотно-основное равновесие поддерживается
совместным участием буферных систем плазмы и клеток крови.
Бикарбонатная
буферная система является самой регулируемой системой
крови. На ее долю приходится около 10% всей буферной емкости крови. Она
представляет собой сопряженную кислотно-основную пару, состоящую из гидратов
молекул СО2 (СО2 · Н2О) (выполняющих роль
доноров протонов) и гидрокарбонат ионов НСО3-
(выполняющих роль акцептора протонов).
Гидрокарбонаты в плазме крови и
в других межклеточных жидкостях находятся главным образом в виде натриевой соли
NaНСО3, а
внутри клеток - калиевой соли.
Концентрация ионов НСО3-
в плазме крови превышает концентрацию растворенного СО2 примерно в
20 раз.
При выделении в кровь
относительно больших количеств кислых продуктов ионы Н+
взаимодействуют с НСО3-.
Последующее снижение
концентрации получившегося СО2 достигается в результате его ускоренного
выделения через легкие в результате их гипервентиляции.
Н+ + НСО3-
= Н2СО3
Если же в крови увеличивается
количество основных продуктов, то происходит их взаимодействие со слабой
угольной кислотой:
Н2СО3 +
ОН- → НСО3- + Н2О
При этом концентрация
растворенного углекислого газа в крови уменьшается. Для сохранения нормального
соотношения между компонентами буферной системы происходит физиологическая
задержка в плазме крови некоторого количества СО2 за счет
гиповентиляции легких.
Фосфатная буферная
система представляет собой сопряженную кислотно-оснóвную
пару Н2РО4-/НРО42-.
Роль кислоты выполняет
дигидрофосфат натрия NaH2PO4,
а роль ее соли - гидрофосфат натрия Na2HPO4.
Фосфатная буферная система составляет всего лишь 1% буферной емкости крови.
Отношение С(Н2РО4-)/С(НРО42-)
в ней равно 1 : 4 и не изменяется со временем, т.к., избыточное количество
какого-либо из компонентов выделяется с мочой, правда, это происходит в течение
1-2 суток, т.е. не так быстро, как в случае гидрокарбонатного буфера.
Фосфатная буферная система
играет решающую роль в других биологических средах: некоторых внутриклеточных
жидкостях, моче, выделениях (или соках) пищеварительных желез.
Белковый буфер
представляет собой систему из белковых (протеиновых) молекул, содержащих в
своих аминокислотных остатках как кислотные СООН-группы, так и оснóвные
NH2-группы,
выполняющие роль слабой кислоты и основания. Компоненты этого буфера могут быть
условно выражены следующим образом:
|
1)
|
Pt-COOH
|
+
|
Pt-COONa
|
Pt-COOH
/
Pt-COO-
|
|
слабодиссоциированная
белок-кислота
|
|
соль,
образованная сильным основанием
|
|
|
|
|
|
|
|
2)
|
Pt-NH2
|
+
|
Pt-NH3Cl
|
(Pt-NH2 / Pt-NH3+
|
|
слабодиссоциированное
белок-основание
|
|
соль,
образованная сильной кислотой
|
|
Таким образом, белковый буфер
по своему составу является амфотерным. При увеличении концентрации кислых
продуктов с ионами Н+ могут взаимодействовать как белок-соль (Pt-СОО-),
так и белок-основание (Pt-NH2):
Pt-COO-
+ H+
→ Pt-COOH
Pt-NH2
+ H+
→ Pt-NH3+
Нейтрализацию основных
продуктов обмена веществ осуществляют за счет взаимодействия с ионами ОН-
как белок - кислота (Pt-СООН),
так и белок-соль (Pt-NH3+)
Pt-COOН
+ OH-
→ Pt-COO-
+ Н2О
Pt-NH3+
+ OH-
→ Pt-NH2
+ Н2О
Благодаря белкам все клетки и
ткани организма обладают определенным буферным действием. В связи с этим
попадающее на кожу небольшое количество кислоты или щелочи, довольно быстро
оказывается нейтрализованным и не вызывает химического ожога.
Наиболее могучими буферными
системами крови являются гемоглобиновый и оксигемоглобиновый буфера, которые
находятся в эритроцитах. На их долю приходится примерно 75% всей буферной
емкости крови. По своей природе и механизму действия они относятся к белковым
буферным системам.
Гемоглобиновый буфер
присутствует в венозной крови и его состав можно условно отобразить следующим
образом:
|
HHв
|
+
|
KНв
|
|
слабая
органическая кислота
|
|
соль
этой кислоты
|
Поступающие в венозную кровь СО2
и другие кислые продукты обмена веществ реагируют с калиевой солью гемоглобина.
KHв
+ CO2
→ KНСО3 + H
Hв
Попадая в капилляры легких
гемоглобин превращается в оксигемоглобин ННвО2, присоединяя к себе
молекулы О2.
Оксигемоглобин обладает более
сильными кислотными свойствами, чем гемоглобин и угольная кислота. Он
взаимодействует с гидрокарбонатом калия, вытесняя из него Н2СО3,
которая распадается на СО2 и Н2О. Образовавшийся
избыточный СО2 через легкие удаляется из крови.
HHвO2
+ KНСО3
→ KHвO2 + Н2CО3
Системы гемоглобинового и
оксигемоглобинового буферов являются взаимопревращающимися системами и
существуют как единое целое. Они в значительной степени способствуют
поддержанию в крови концентрации гидрокарбонат-ионов НСО3-
(так называемый щелочной резерв крови) на постоянном уровне.
Нарушения
кислотно-основного равновесия крови. Ацидоз. Алкалоз
кислота буферный метаболический
ацидоз
Когда компенсаторные механизмы
организма не способны предотвратить сдвиги концентрации водородных ионов,
наступает нарушение кислотно-оснóвного
равновесия. При этом наблюдаются два противоположных состояния - ацидоз и
алкалоз.
При ацидозе концентрация
водородных ионов в крови становится выше границ нормы. При этом, естественно рН
уменьшается. Снижение величины рН ниже 6,8 вызывает смерть.
Состояние алкалоза наблюдается
при уменьшении концентрации ионов Н+ (рН, соответственно,
возрастает) по сравнению с нормой. Увеличение значений рН до 8,0 приводит к
быстрому летальному исходу.
В зависимости от механизмов
развития нарушений кислотно-основного равновесия разделяют дыхательный и
метаболический ацидоз или алкалоз.
Дыхательный ацидоз
возникает в результате уменьшения минутного объема дыхания (например, при
бронхиальной астме, отеке, эмфиземе легких, асфиксии механического порядка и
т.д.). Все эти заболевания ведут к гиповентиляции и к повышению парциального
давления СО2 артериальной крови и содержания в плазме НСО3-
ионов.
Дыхательный алкалоз,
наоборот, возникает при вдыхании чистого кислорода, компенсаторной одышке,
сопровождающей ряд заболеваний, пребывании в разряженной атмосфере.
При дыхательном алкалозе в
крови уменьшается концентрация растворенного СО2 и гидрокарбонат-ионов
(щелочной резерв крови).
Метаболический
ацидоз - самая частая и тяжелая форма нарушений
кислотно-основного равновесия. Он обусловлен накоплением в тканях и крови
органических кислот. Этот вид ацидоза связан с нарушением обмена веществ и
возможен при диабете, голодании, лихорадке, заболеваниях желудочно-кишечного
тракта и т.д. Метаболический алкалоз развивается при потере в результате
неукротимой рвоты большого количества кислотных эквивалентов) и всасывании в
кровь большого числа основных эквивалентов кишечного сока, а также при
накоплении в тканях основных продуктов обмена веществ.
Ñïèñîê
ëèòåðàòóðû
Болтромеюк В. В «Общая химия»