Методы нанесения антибактериального покрытия на имплантат
Введение
имлантат титан медицина
Инфекции, связанные с медицинскими имплантатами, представляют
большую проблему для здравоохранения. Нозокомиальные инфекции являются
непосредственной причиной смерти 190000 людей ежегодно и, так или иначе, вносят
свой негативный вклад в более чем 580000 случаев. Для борьбы с данной серьезной
клинической проблемой устройства покрывали антибактериальными препаратами
«катетер с поверхностью, длительно выделяющей противомикробные препараты»,
«Силиконовые и полимерные катетеры с улучшенными
противомикробными/противогрибковыми свойствами» и так далее. Но так же
существуют имплантанты, которые должны выступать в качестве суставов, и
следовательно будут участвовать в процессе трения. Такие имплантанты должны
обладать помимо антибактериальных свойств хорошими триботехническими
свойствами.
Существует много различных методов нанесения
антибактериальных покрытий: окунанием, кистью, распылением, вакуумные методы и
так далее. На подложку наносят антибактериальное покрытие в которое внедрен антибактериальный
препарат, который в процессе работы должен выделяться из самого покрытия.
Таким образом целью курсовой работы является изучение
литературных источников по антибактериальным покрытия содержащим
антибактериальный препарат, и методикам их нанесения. Так же в ходе курсовой
работы будут рассмотрены свойства титана, так как в большинстве случаев
внедрения имплантантов используется титан, традиционные методы нанесения и
вакуумные методы нанесения антибактериальных покрытий содержащий антибактериальный
препарат.
Раздел 1. Область применения титана в медицине и
его свойства
Конструкторов медицинской техники, медицинского
инструментария и врачей разных профессий в новом конструкционном металле
привлекают прежде всего биологическая инертность по отношению к организму
живого существа в сочетании с высокими механическими свойствами,
антикоррозионной стойкостью, а также дешевизна и доступность. Эти качества
титана, усиленные специфическими свойствами, и обеспечили очень большой интерес
к нему и интенсивное проведение конструкторских работ и клинических испытаний
самых различных изделий. Известно, что по коррозионной стойкости во многих
медицинских агрессивных средах титан не уступает платине; он стоек в растворах
кислот и щелочей. Скорость коррозии титана в морской воде (по своему
химическому составy очень похожей на лимфу) - 0,00002 мм/год или 0,02 мм в 1000
лет. Титан и его сплавы устойчивы и перекиси водорода, бензине, феноле,
формальдегиде. После многократной стерилизации кипячением и обработки в автоклаве,
многомесячной выдержки в 3%-ном растворе хлорамина, 96-градусиом этиловом
спирте, растворе сулемы, трихлорэтилене следов коррозии на титановых сплавах не
обнаружено. Точечная коррозия наблюдается у титановых сплавов лишь после
пребывания в течение нескольких суток в 10%-ной спиртовой настойке йода.
Титан и его сплавы обладают высокой усталостной прочностью
при знакопеременных нагрузках, что очень важно при изготовлении внутрикостных
фиксаторов, наружных и внутренних протезов, которые постоянно подвергаются
переменным нагрузкам.
Титан - пластичный металл; он хорошо поддается механической
обработке: резанию, сверлению, фрезерованию, шлифованию. Изготавливать из него
различные конструкции не труднее, чем из нержавеющей стали. Титан - немагнитный
материал с низкой электропроводностью, что особенно ценно, так как благодаря
этому можно использовать физиотерапию для лечения больных, в организме которых
находятся титановые конструкции. Все это делает титан весьма перспективным для
широкого применения в медицине.
Но самым важным результатом многолетних и тщательных
исследований оказалось то, что титан является инертным металлом по отношению к
биологической среде. Конструкции из титановых сплавов хорошо переносится
человеческим организмом, обрастает костной и мышечной тканью. Металл
практически не корродирует в агрессивных средах человеческого тела, а структура
тканей, окружающих титановые конструкции, не изменяется на протяжении
длительного времени. Своей химической индифферентностью титан превосходит не
только все нержавеющие стали, но и нашедший в последнее время широкое
применение «виталлиум» - сплав на кобальтовой основе. Ценно, что технически
чистый титан содержит гораздо меньше примесей, чем другие используемые в
медицине сплавы.
Длительные и систематические исследования возможности
использования титановых сплавов » медицинской технике были проведены во
Всесоюзном научно-исследовательском институте хирургической аппаратуры и
инструментов (ВНИИХАИ); в последние годы эти работы велись при участии
Института титана и ряда отраслевых институтов и медицинских объединений. Первый
опыт использования титановых сплавов для хирургических инструментов относится к
1905-1966 гг. Тогда металл применили при изготовлении имплантата глазного
яблоки. После длительных поисков металла для имплантата остановились ни
титановом сплаве марки ВТ5; изготовленные из него имплантаты были и 2 раза
легче аналогичных, изготовленных из стали Х18Н9Т (при диаметре 20 мм имплантат
из титана весил всего 0,0016 кг, а из стали - 0,0032кг). Клинические наблюдения
и течение полутора лет и токсикологические исследования показали его
биологическую инертность.
Успешное завершение работ по созданию имплантатов для
протезирования культи глазного яблока, изготовленного из титана, позволило
применить титан не только в конструкциях различных хирургических инструментов,
рабочие части которых несут нагрузки.
В настоящее время разработаны и переданы в клинические
учреждения на испытания хирургические инструменты более 200 наименований.
Испытания приводятся в Институте хирургии им. А. В. Вишневского, клинике
болезней уха, горла и носа Центрального института усовершенствования врачей,
Московском научно-исследовательском институте глазных баржей нм. Гельмгольца,
Центральном научно-исследовательском институте травматологии (ЦИТО),
Запорожском институте усовершенствования врачей. На некоторые инструменты уже
получены первые положительные отзывы врачей-специалистов.
При изготовлении инструментов были использованы титановые
сплавы, обладающие высокой коррозионной стойкостью, биологической инертностью,
высокой прочностью, достаточной для некоторых типов инструментов твердостью,
пластичностью и другими свойствами.
Основная задача, которая ставилась при конструировании
инструментов из титана,- создание инструментов, по своим функциональным
свойствам не уступающим, а превосходящим аналогичные, выполненные из
нержавеющих сталей. Исследования показали, что, если для сохранения
функциональных свойств образца изделия из титана требуется увеличить сечение
более чем на 30% (по сравнению с инструментом из нержавеющей стали), то
разработка такого инструмента нецелесообразна, кроме случаев, когда вес не
является доминирующей характеристикой инструмента.
При конструировании неразборных инструментов (зажимов и
пинцетов) для сохранения их функциональных свойств сечения некоторых элементов
были увеличены на 10-30%, при этом вес их по сравнению с образцами из
нержавеющей стали уменьшился на 30-35%. Твердость после термообработки
составила HRC35-38.
Такие инструменты, как зеркала, крючки пластинчатые,
ранорасширители и другие, которые при работе не испытывают больших нагрузок и
рабочая площадь которых достаточно велика, были выполнены с сечениями,
уменьшенными на 20-30%, что снизило их вес на 40-50%.
Режущие инструменты были выполнены комбинированными: съемные
рабочие части - из соответствующей стали, ручки -из титановых сплавов. К этой
группе относятся стамески, крючки хирургические, скальпели со съемными лезвиями
и др.
Неразъемные режущие инструменты изготавливались из стали,
ручки - из титановых сплавов. Элементы соединялись при помощи заклепок или
прессовой посадки (ножницы, распаторы, стержневые инструменты).
Исследования показали, что титановые сплавы могут широко
применяться там, где необходима очень высокая коррозионная стойкость медицинских
инструментов и не требуется большой твердости. Невысокая твердость титана,
отсутствие режущих свойств не дает пока возможности расширить его применение в
хирургическом инструментарии. Следовательно, исследования возможности повышения
твердости и придания режущих свойств титану - задача первостепенной важности.
Трудность объясняется тем, что существующие в промышленности методы упрочнения
титана в медицинской промышленности применять нельзя, так как к изделиям
предъявляются совершенно особые требования. Кроме того, медицинские аппараты и
инструменты работают в специфических условиях (в контакте с физиологическим
раствором, йодом, стерилизуются путем кипячения в воде или в автоклавах при
температуре до 200˚C и т. П.).
Во ВНИИХАИ были проведены специальные исследования по этому
вопросу. Для увеличения твердости, износостойкости, снижения коэффициента
трения были проведены термическая и химико-термическая обработки (азотирование
и альфирование).
Процесс анодирования позволил получить на образцах (в
дальнейшем - на изделиях) цветную пленку различных оттенков: золотистую,
зеленую, синюю, фиолетовую, лиловую. Все они подвергались стерилизации путем
кипячения в воде в течение 1800°С при шестикратном повторении. После каждого
цикла стерилизации проводили визуальное наблюдение изменения цвета покрытия и
появления пятен коррозии. Наиболее коррозионностойкой и прочной пленкой
является оксидная пленка желтого (золотистого), фиолетового и лилового цветив.
Таким образом было установлено, что медицинские инструменты,
изготовленные из титановых сплавов, на 20-30% легче таких же изделий из
нержавеющей стали, обладают лучшей коррозионной стойкостью, более долговечны и
удобны в работе. Сотрудниками ВНИИХАИ разработаны и изготовлены из титановых
сплавов опытные партии для общей хирургии, оториноларингологии и стоматологии.
В состав комплекта для общей хирургии входят: пластинчатые
пинцеты; кровоостанавливающие зажимы; пластинчатые двухсторонние крючки;
печеночные зеркала; V-образный проволочный крючок; расширитель с кремальерой; скальпель
со съемными лезвиями и др.- всего 27 наименований (общая масса инструмента -
1,59 кг).
В состав комплекта, предназначенного для
оторииоларинго-логических операций, входит: трахеотомический крючок;
рано-расширитель типа «Лира»; трахеотомический расширитель с пружиной; ушной
штыкоойразный пинцет; стаместка Воячека; ушные воронки; ушные тампонные щипцы
(масса указанных инструментов - 0.235 кг).
Комплект стоматологических инструментов, разработанный
ВНИИХАИ, успешно прошел испытания в Центральном научно-исследовательском
институте стоматологии.
Одним из довольно распространенных способов лечения переломов
костей в настоящее время является металлический остеосинтез. Используемые дли
остеосинтеза стержни обеспечивают полную неподвижность осколков и тем самым
способствуют процессу консолидации перелома. Однако в дальнейшем у многих
больных возникают осложнения, обусловленные применением конструкций из
нержавеющей стали, структурная и химическая неоднородность которой в ряде
случаев является причиной разрушения фиксаторов, что ведет к переломам
конструкции. Продукты коррозии повреждают костную ткань; наблюдается также
явления ионизации и электропроводности; ионы железа активно вступают во
взаимодействие с физиологическими солями организма, вызывая реактнивное
воспаление и боль. Таким образом, нержавеющая сталь, даже самая
высококачественная, не является безупречным материалом для проведения
остеосинтеза.
Изготовление костных фиксаторов из титана позволяет избежал,
подобных осложнений за счет биологической нейтральности металла, что дает
возможность использовать титановые конструкции для длительного и даже
постоянного нахождения в человеческом организме. Это чрезвычайно важно, когда
остеосинтез делается лицам пожилого возраста, так как использование нового металла
избавляет пациента от операции по удалению фиксатора.
Использование титана дает возможность лечить околосуставные
переломы, применяя конструкции сложной конфигурации, которые прежде не могли
быть употреблены из-за трудностей по их удалению. В технике скелетного
вытяжения начинают применять титановые скобы (клеммы).
Конструкции из титана в Советском Союзе успешно применяют В,
И. Аверин (Ленинград), В. В. Волкова и Б, С. Гавриленко (Запорожье), С. И.
Кутновский (Новосибирск), Н. К. Митюнин (Ленинград), Г. И. Татеосов
(Мончегорск), Г. М. Фролов (Ленинград) и др.
Титан выгодно отличается от других, конкурирующих с ним,
металлов не только своей биологической инертностью, но и ценными механическими
свойствами. Чтобы обладать такой же прочностью на разрыв, какую имеет стержень
титана диаметром 10 мм, железный стержень должен быть не менее 14 мм в
диаметре. Титан является таким конструкционным материалом, который позволяет
повысить прочность изделия, сохранив его размеры, или без потери прочности
получить выигрыш в весе до 40% и значительно уменьшить объем конструкции. Это
делает титан наилучшим металлом для внутренних протезов. Особенно эффективно
применение титана в артопластике бедра.
1.2 Сплавы на основе титана
Суставные протезы и другие конструкции из титановых сплавов
успешно разрабатывают в СКВ Центрального института травматологии и ортопедии
(г. Москва) под руководством проф. К. М. Сиваша.
В отечественной стоматологии при изготовлении зубных
пластмассовых протезов для получения косметического эффекта используется белое
кристаллическое вещество - двуокись титана. Однако в зубном протезировании
можно широко применять не только соединение титана с кислородом, но и
конструкционный титан - легкий, прочный, биологически инертный и хорошо
поддающийся обработке металл.
В клинике челюстно-лицевой хирургии, руководимой доц. К. И.
Татаринцевым (Запорожский институт усовершенствования врачей им, Горького),
предложен и разработан новый метод лечения переломов нижней челюсти П-образными
скобками из титана марки BT1-00. Он заключается в том, что с помощью разжимных
ножек П-образных скобок обеспечивается прочное закрепление обломков челюсти в
правильном положении. Только в 1971-1973 гг. предложенным методом излечено 50
больных с одно- и двусторонними переломами нижней челюсти. Результаты лечения
свидетельствуют о том, что примененный метод значительно сокращает сроки
заживления костной раны и временной потери трудоспособности.
Стабилизация позвоночника металлическими имплантатами
используется в медицине с начала ХХ века. В настоящее время широко применяются
пластины ЦИТО, Цивьяна, стяжки Цивьяна-Рамиха, различные виды транспедикулярных
аппаратов [1] и т.п. Их изготавливают из нержавеющих сталей, титановых сплавов,
реже из кобальтовых и молибденовых сплавов. Главными требованиями,
предъявляемыми к этим материалам были высокая коррозиционная стойкость и
хорошая прочность. Ради последней зачастую забывали о невысокой биологической
инертности легированных сталей, кобальтовых сплавов. Кроме того, вопросы
механической совместимости имплантата и структур организма стал рассматриваться
только в последнее время.
Дело в том, что модуль упругости большинства конструкционных
сплавов (230 - 110 Гпа) значительно выше, чем у кости (25 - 15 Гпа), а тем
более хрящевых структур(1 - 0,2 Гпа). При совместной работе кость-имплантат
происходит неравномерное распределение деформаций и напряжений, которые
максимальны, как правило, в местах крепления имплантата к кости, что вызывает
опасность их разрушения. Поэтому, проводятся попытки использования сплавов с
низким модулем упругости, например, системы Ti-Ta (80 - 70 Гпа), или изменять
конструкцию имплантата, вводя в нее различные вырезы, изгибы, в стремлении
снизить жесткость имплантата.
Однако при этом повышается риск его разрушения вследствие
концентрации напряжений при нагружении. В тоже время известен материал,
механическое поведение которого приближается к поведению тканей организма. Это
сплавы на основе никелида титана или по-другому ѕ «нитинол»[2].
При определенной температуре, которая может быть равна
температуре человеческого тела, эти сплавы проявляют сверхупругое поведение
(СУ), когда значительные деформации (до 12%), возникающие при нагружении,
устраняются при разгрузке,рис.1. При этом механическое поведение сплавов
приближается к поведению кости структур.
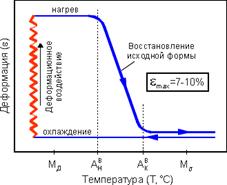
Рис. 1 Свойства сверхупругости (СУ) никелида титана
Кроме того, эти сплавы обладают эффектом запоминания формы
(ЭЗФ), который заключается в том, что деформированный в охлажденном состоянии
(ниже Mд) образец может сколь угодно долго сохранять новую форму.
При нагреве образца в интервале температур АВН - АВК он
восстанавливает свою исходную форму.

Рис. 2 Свойства эффекта запоминания формы (ЭЗФ) никелида
титана.
Кроме того, сплавы на основе никелида титана обладают
отличной коррозиционной стойкостью и биологической инертностью. Поэтому они
являются идеальным материалом для создания биологически и механически
совместимых с организмом человека имплантатов (БМСИ).

Рис.3 Механическое поведение тканей организма (а) и
имплантатов из никелида титана
2. Методы нанесения антибактериальных покрытий
2.1 Подготовка поверхности изделия к нанесению
покрытия
Правильный выбор метода и режима поверхностной обработки
изделия в ряде случаев является определяющим для нанесения покрытий.
Антибактериальные покрытия следует наносить после завершения всех операций по
обработке изделия. При разработке конструкции изделия необходимо предусмотреть,
чтобы отсутствовали острые грани, кромки.
Механическая обработка наиболее эффективна при использовании
дробеструйной очистки (фракция металлического песка 0,3 0,8 мкм). При этом
достигается оптимальная шероховатость поверхности (1 10 мкм) и удаляются
различные загрязнения.
Обезжиривание изделий проводят органическими растворителями,
щелочными растворами, моющими составами. Обезжиривание водными растворами можно
проводить окунанием или распылением. После химической обработки поверхность
изделия тщательно промывают горячей водой.
Жидкие композиции
Жидкие композиции наносят кистью и пульверизатором или
методом окунания. Например. В подготовленную композицию окунают изделие или
покрытие наносят на поверхность кистью. Если необходимо получить покрытие
толщиной 100...200 мкм, то композицию наносят на поверхность сразу после
приготовления, а для получения более толстого слоя (300...400 мкм) -через 4 ч
после приготовления.. Наполнители и другие ингредиенты вводят в композицию
после тщательного перемешивания пластификатора и отвердителя со смолой.
На эффективность процесса электроосаждения существенно влияют
дисперсность и электрофизические свойства напыляемых полимеров, параметры
электростатического поля и конструктивное оформление заряжающего устройства.
Избирательная способность полимеров к электроосаждению в зависимости от
дисперсности позволяет рекомендовать для практических целей размер частиц в
интервале 75...160 мкм.
При достаточно высокой степени наполнения вязкость композиции
увеличивается, что дает возможность получать покрытия с толщиной 0,3 мм.
Вакуумные методы.
В вакууме возможно получение тонких металлических пленок в
результате испарения металла с последующей его конденсацией на покрываемой
поверхности (так называемой подложке). Например, серебрение. В ряде случаев
вакуумное напыление является единственным методом получения тонких пленок. Этот
метод значительно экономичнее других известных методов массового производства
металлизированных изделий. При его использовании механическая обработка
поверхностей покрытия минимальна. Способ металлизации в высоком вакууме
обеспечивает покрытие пластмасс, фольги, бумаги, тканей тонким металлическим
слоем и прочное сцепление его с основным материалом. В процессе металлизации
изделие вращается вокруг испарителя и покрывается слоем металла. Специальные
зажимные приспособления должны обеспечивать простое и надежное крепление
изделий; приспособления не должны затемнять металлизируемую поверхность.
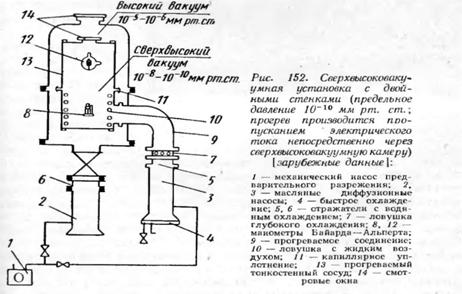
На рис. 4 показана сверхвысоковакуумная установка для
напыления с одинарными стенками. Сверхвысокий вакуум создается двумя
последовательно включенными паромасляными диффузионными насосами, которые
соединены с камерой напыления через один лабиринтный отражатель. Установка
прогревается надвигаемой печью. Диаметр камеры 350 мм, скорость откачки на
входе в насос 100 л/с, предельное давление 3*10-10 мм рт. ст.

Управление установкой полностью
автоматизировано. Если применяют установку с двойными стенками, то того же
значения предельного давления можно достичь с одним диффузионным насосом, но в
пространстве между стенками должен быть создан вакуум 10-5 - 10-6 мм рт. ст.
(рис. 5). Здесь применены охлаждаемые жидким воздухом ловушка и змеевик внутри
откачиваемого объема.
Ловушка служит в основном для улавливания
водяного пара. Внутренняя оболочка прогревается пропускаемым через нее током,
поэтому прогрев здесь занимает меньше времени, чем в установке с одинарными
стенками. Предельное давление в установке достигает 10-10 мм рт. ст. Для
достижения сверхвысокого вакуума требуется от 4 до 6 ч.
В установках для получения покрытий в
вакууме различны способы нагрева испаряемого вещества. Применяют термическое
испарение с электрическим или электроннолучевым нагревом и катодное распыление.
В некоторых случаях требуется сочетание вакуумного напыления с ионной
бомбардировкой. Для испарения тугоплавких материалов использовали луч лазера
[65] с длиной волны 1,06 мкм, генерируемый в стекле, легированном Nd,
мощностью100-150 Дж в 2-4 мс. Луч проектировался в вакуумную установку через
стеклянное окно и фокусировался на испаряемом материале. Испарялись Cr, W, Ti,
углерод и некоторые соединения. Скорости испарения составляли 100000-1000000
А/с. Получали слои толщиной 500- 1000 А. Полученные пленки имели все
необходимые для практических целей параметры.
Наиболее простое устройство для
термического испарения легкоплавких металлов- плоский кварцевый или шамотный
тигель, в котором металл плавится с помощью токов Фуко. Тугоплавкие металлы
свивают в спирали, и испарение происходит непосредственно из спиралей при
пропускании через них электрического тока определенной силы. Для испарения
больших количеств металла применяют вольфрамовые или молибденовые лодочки, а
также тигли из алунда или окиси бериллия; испаритель разогревается джоулевым
теплом, выделяемым испарителем при пропускании электрического тока. Для
осаждения золота и серебра их можно заготовить в виде проволоки, вокруг которой
наматывается вольфрамовая спираль; для осаждения никеля, хрома, платины, родия
вначале наносят их электролитическим путем на чистый вольфрамовый
подогреватель. Вакуумная установка ВУТП-2 дает возможность наносить
тонкослойные оптические покрытия из диэлектрических, полупроводниковых и
проводниковых материалов термическим испарением с одновременным контролем
толщины слоя в процессе его нанесения. На установке можно изготовлять
многослойные интерференционные оптические фильтры; отражающие, просветляющие,
светоделительные, защитные покрытия. Установка колпакового типа. Размеры
колпака: высота 630 мм, внутренний диаметр 550 мм, наружный диаметр 650 мм,
объем 162 л.
Колпак поднимается и опускается с помощью
электродвигателя. Колпак устанавливают на плиту, на которой расположен механизм
планетарного вращения образцов, три] испарителя с питателями и нагреватель
образцов. Температура нагрева печью сопротивления составляет 200° С. Образцы
могут иметь два вида вращения: одиночное и планетарное. В случае одиночного
вращения максимальный диаметр обрабатываемых деталей 450 мм, в случае планетарного-
165 мм.

Механизированная дозированная подсыпка
может производиться без нарушения вакуума в объеме. С наружной стороны колпака
припаяна трубка для водяного охлаждения. Система откачки установки показана на
рис. 6. При охлаждении ловушки водой давление в рабочем пространстве 2*10-5 мм
рт. ст. достигается за 12 мин с помощью диффузионного насоса Н-2Т. Для
предварительного разрежения применяют насос ВН-2МГ, за 4 мин достигается
давление 10-2 мм рт. ст.

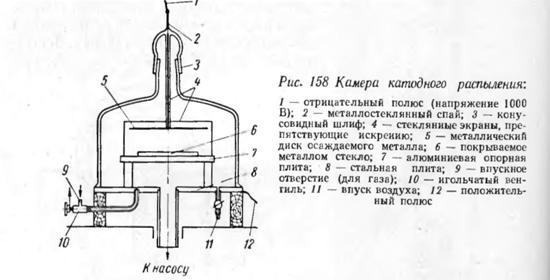
При таких условиях как раз и происходит
выбивание атомов металла из катода положительными ионами. Атомы металла
осаждаются на стеклянной пластине 6. Применяя в качестве катода платину,
распыляемую в водороде при напряжении 1000 В и расстоянии между электродами 4
см, можно получить в течение часа плотную непрозрачную пленку. Метод катодного
распыления позволяет наносить защитные пленки на любые материалы и проводить
процесс при довольно низких температурах. Однако металлические пленки
полученные методом катодного распыления, по качеству значительно уступают
пленкам, полученным методом испарения.
Преимущество вакуумных методов перед традиционными методами
нанесения покрытия очевидно, при нанесении покрытия в вакууме, можно получать
пленки различной толщины, равномерность и сплошность покрытия намного лучше , а
так же качество самого покрытия на порядок выше. Однако существенным минус
является сложность конструкции и процесса нанесения. (окунанием или кистью
легче и быстрее).
3. Имплантанты и Антибактериальные препараты
В 1951 году профессор Норвичского университета Джордж Кеннет
МакКи (G. К. МсКее) установил первый, так называемый тотальный тазобедренный
эндопротез - заменил оба компонента сустава на металлические: и головку, и
суставную впадину. У его изобретения еще не было выверенной философии дизайна,
да и технологии тогда не позволяли оптимально уменьшить трение между
искусственными поверхностями. Недостатков хватало, но, тем не менее, протез
имел успех. Позже, в 1960 году, английский профессор Джон Чарнли (G. J.
Charnley) использовал для суставной впадины вместо металла полимер высокой
плотности. Результаты оказались куда лучше, но и этот вариант не был
совершенным. Несмотря на низкое трение между гладкими полированными деталями,
полимер со временем все равно истирается, образуя мелкое крошево. Этот «мусор»
накапливается окружающими тканями, из-за чего в них нарушается кровообращение,
что вызывает боли и неправильный рост соединительной ткани. Сейчас тотальные
эндопротезы суставов делают из титановых и стальных сплавов, иногда используются
элементы из керамики и пластика. Однако разработки новых материалов с
улучшенными свойствами не прекращаются - в идеале износ от трения должен быть
сведен к нулю.
Для онкологических больных, у которых опухоль поражает
костную ткань, разработаны большие эндопротезы. При взгляде на эти конструкции
вспоминаются фантастические истории о киборгах, ведь здесь меняется не только
сустав, но и сама кость на большом протяжении. В нужных местах в металле
предусмотрены отверстия для подшивания связок и мышц, для дополнительного
скрепления с костью винтами. Но даже хирурги-онкологи признаются: замена
собственных структур организма на искусственные в этом случае операция
отчаяния, когда ничего больше уже не может помочь. Проблема в том, что
кровоснабжение и питание тканей, прикрепленных к металлу, очень сильно
нарушается. Мышцы атрофируются и прорастают рубцами, теряется качество кости. И
если здоровый человек с таким устройством, к примеру, в ноге еще смог бы
научиться ходить заново, то больному после удаления из ноги опухоли гораздо
сложнее - у него и так не все в порядке с костями и мышцами.
3.1 Характеристика основных групп АБП
С целью систематизации использования АБП существует Перечень
жизненно важных лекарственных средств ВОЗ (WHO Моde1 List of essential Drugs).
Представленный ВОЗ перечень является примерной моделью разработки такого списка
в каждой стране с учетом особенностей местного здравоохранения. Как показывает
практика, количество антимикробных препаратов примерно совпадает в разных
странах. В своем обзоре мы хотим представить основные АБП, которые используются
в медицине критических состояний.
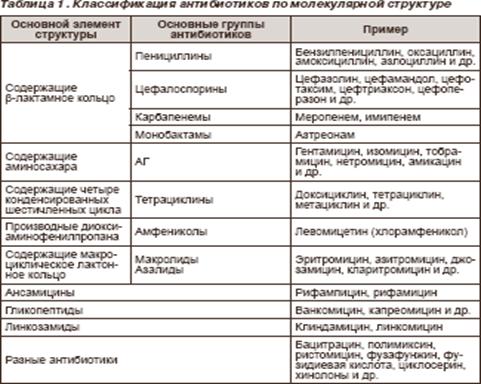
Пенициллины
Пенициллиназостабильные пенициллины. Спектр антимикробной
активности оксациллина близок к природным пенициллинам (грамположительные
бактерии), однако уровень активности против стрептококков и пневмококков в
несколько раз ниже; не действует на энтерококки, гонококки и анаэробные
бактерии. Основным отличием оксациллина от природных и других полусинтетических
пенициллинов является устойчивость к стафилококковым бета-лактамазам -
ферментам, разрушающим бета-лактамное кольцо пенициллинов.
Оксациллин является высокоактивным средством в отношении
золотистого и коагулазонегативных стафилококков, однако не действует на
стафилококки с другим механизмом устойчивости - так называемые метициллин- или
оксациллин-резистентные стафилококки. Основные показания для оксациллина -
инфекции, вызванные стафилококками, чувствительными к оксациллину, а также при
предполагаемой стафилококковой этиологии (острый артрит, острый остеомиелит,
неосложненные инфекции кожи и мягких тканей, эндокардит трикуспидального
клапана). Адекватный режим дозирования оксациллина при госпитальных
стафилококковых инфекциях - 2 г внутривенно с интервалом 4-6 ч. При пероральном
приеме оксациллин плохо всасывается в пищеварительном тракте, поэтому
предпочтительнее использовать клоксациллин или диклоксациллин.
Аминопенициллины обладают более широким спектром активности
по сравнению с природными пенициллинами за счет некоторых грамотрицательных
бактерий - Е.соli, Shigella spp., Salmonella spp., Proteus mirabilis,
Haemophilus influenzae (преимущественно внебольничные штаммы); препараты
проявляют также активность в отношении анаэробных микроорганизмов, но уровень резистентности
к ним высокий. В то же время аминопенициллины гидролизуются β-лактамазами стафилококков и грамотрицательных бактерий, поэтому не
имеют в настоящее время существенного значения при лечении внутрибольничных
инфекций.
Ампициллин применяется парентерально (при пероральном приеме
низкая биодоступность) при внебольничной пневмонии, инфекционном эндокардите,
менингите. Амоксициллин применяется при нетяжелых внебольничных респираторных
инфекциях, а также может назначаться для замены ампициллина при ступенчатой
терапии.
Ингибиторзащищенные аминопенициллины не разрушаются
большинством бета-лактамаз грамотрицательных бактерий, в результате чего их
спектр антимикробной активности по сравнению с незащищенными препаратами более
широкий в отношении некоторых грамотрицательных бактерий (Klebsiella spp.,
Proteus vulgaris, Moraxella catarrhalis, Citrobacter diversus) и анаэробов
(Bacteroides fragilis). Основное показание для применения ингибиторзащищенных
пенициллинов в стационаре - интраоперационная профилактика послеоперационных
гнойно-септических осложнений. С этой целью препарат вводится в однократной
дозе за 30-60 мин до операции (амоксициллин/клавуланат 1,2 г,
ампициллин/сульбактам (амписульбин-КМП) 3 г, уназин). Ингибиторзащищенные
пенициллины высокоэффективны при абсцедирующей пневмонии и нетяжелых инфекциях
малого таза. Амоксициллин/клавуланат также является базовым средством для
лечения госпитализированных больных с внебольничной пневмонией средне-тяжелого
течения или обострением хронического бронхита. При госпитальных инфекциях
(пневмония, перитонит, кожи и мягких тканей) значение этих препаратов невелико
из-за существенного уровня резистентности основных возбудителей.
Карбоксипенициллины и уреидопенициллины. Эти препараты обычно
объединяют одним названием - антипсевдомонадные пенициллины. Они обладают более
широким спектром активности по сравнению с аминопенициллинами (чувствительны
большинство бактерий семейства Enterobacteriaceae, Рseudomonas aeruginosa),
однако эти препараты разрушаются β-лактамазами грамотрицательных
бактерий и стафилококков, поэтому применение их в настоящее время ограничено.
Основное показание - псевдомонадные инфекции, однако следует учитывать
возросший уровень устойчивости Р.аeruginosa к карбокси- и уреидопенициллинам.
При назначении этих препаратов при псевдомонадной инфекции (при установленной
чувствительности!) следует их комбинировать с аминогликозидами, использовать
адекватные дозировки: карбенициллин внутривенно 4-5 г с интервалом 4 ч,
пиперациллин внутривенно 2-4 г с интервалом 6-8 ч. При использовании
антипсевдомонадных пенициллинов (особенно карбоксипенициллинов!) необходимо
контролировать электролиты в крови и показатели свертываемости крови.
Защищенные антипсевдомонадные пенициллины. Имеют более
широкие показания при внутрибольничных инфекциях, однако следует также
учитывать увеличившуюся в последние годы устойчивость грамотрицательных
бактерий к этим препаратам. Тикарциллин/клавуланат и пиперациллин/тазобактам
применяются в основном при смешанных аэробно-анаэробных инфекциях -
интраабдоминальные и гинекологические инфекции, легочные нагноения.
Целесообразно сочетание этих препаратов с аминогликозидами, особенно при
тяжелых инфекциях. Режим дозирования тикарциллин/клавуланата составляет 3,2 г
внутривенно с интервалом 6-8 ч, пиперациллин/тазобактама - 2,5-4,5 г с
интервалом 8 ч.
Цефалоспорины
Потребление цефалоспоринов «так резко возросло, что можно
сравнить его с первоначальной реакцией на появление пенициллина». Считаются
самыми назначаемыми в ОИТ АБП в мире
В эту группу входят препараты с различным спектром
антимикробной активности, поэтому в зависимости от спектра их разделяют на
поколения. Общим для всех цефалоспоринов (кроме цефоперазон/сульбактама)
является слабая активность в отношении анаэробных микроорганизмов (поэтому при
смешанных инфекциях их следует комбинировать с метронидазолом или
линкозамидами). Все ЦС не активны в отношении энтерококков,
метициллинрезистентных стафилококков, листерий и атипичных микроорганизмов
(легионелла, хламидии, микоплазма).
Цефалоспорины I поколения. Обладают преимущественной
активностью в отношении грамположительных бактерий (стафилококки, стрептококки,
пневмококки) и некоторых грамотрицательных - Е.соli, Shigella spp., Salmonella
sрр., Р.mirabilis.
Однако в связи с широким распространением приобретенной
устойчивости госпитальных штаммов грамотрицательных бактерий клиническое
значение цефалоспоринов I поколения при этих инфекциях невелико. Основная
область клинического применения цефазолина в стационаре - установленная
стафилококковая инфекция различной локализации.
Цефалоспорины II поколения, представителем которых является
цефуроксим (зинацеф, кимацеф), обладающие более широким спектром активности
против грамотрицательных бактерий, находят более широкое применение при
внутрибольничных инфекциях, однако в большинстве случаев их целесообразно
сочетать с аминогликозидами. Цефуроксим эффективен при неосложненной
внебольничной пневмонии. Показан для профилактики инфекционных осложнений после
операций.
Цефалоспорины III поколения характеризуются высокой
активностью в отношении грамотрицательных энтеробактерий, причем цефотаксим и
цефтриаксон превосходят цефтазидим и цефоперазон. Принципиальное различие между
этими препаратами заключается в действии на синегнойную палочку: цефотаксим и
цефтриаксон не обладают значимой активностью против Р.аeruginosa (их
целесообразно выделить в подгруппу IIIа), цефтазидим и цефоперазон активны в
отношении Р.аeruginosa (цефтазидим несколько превосходит цефоперазон) -
подгруппа IIIб. Соответственно различается и место этих цефалоспоринов при
внутрибольничных инфекциях. Цефтазидим (цефтум) и цефоперазон (гепацеф,
цефобид) являются базовыми препаратами при лечении установленных псевдомонадных
инфекций или заболеваний с высоким риском наличия Р.аeruginosa. Цефоперазон, в
высоких концентрациях проникающий в желчь, также показан для лечения инфекций
желчевыводящих путей. Цефотаксим и цефтриаксон (офрамакс) являются в настоящее
время базовыми препаратами при лечении различных госпитальных инфекций. Уровень
активности у этих цефалоспоринов одинаков, различия между ними связаны со
скоростью элиминации: период полувыведения цефтриаксона составляет около 8 ч,
поэтому препарат назначается в дозе 2 г с интервалом 24 ч, цефотаксим выводится
быстрее, поэтому обычно дозируется 2 г с интервалом 6-8 ч.
Цефалоспорины IV поколения. Представлены в настоящее время
одним препаратом - цефепимом (максипим), обладающим наиболее широким и
сбалансированным спектром антимикробной активности среди цефалоспориновых
антибиотиков. Клинически важно, что цефепим может сохранять активность в
отношении некоторых штаммов Enterobacteriaceae (прежде всего Enterobacter spp.,
Serratia spp., Morganella morganii, Providencia rettgeri, C.freundii,
являющихся гиперпродуцентами хромосомных бета-лактамаз класса С), резистентных
к цефалоспоринам III поколения. Цефепим также проявляет активность в отношении
некоторых штаммов Klebsiella spp., продуцирующих бета-лактамазы расширенного
спектра, однако ряд штаммов устойчив. Основная область применения цефепима в
клинике - тяжелые внутрибольничные инфекции, особенно в случае резистентных к
цефалоспоринам III поколения энтеробактерий. Цефепим может применяться в
клинике в схемах ротации, т. е. для временной замены в схемах эмпирической
терапии цефалоспоринов III поколения в случае высокой к ним резистентности.
Показано, что периодическая ротация цефалоспоринов III поколения на цефепим в
отделениях реанимации и интенсивной терапии (ОПТ) позволяет ограничить рост
устойчивых штаммов микроорганизмов и даже восстановить чувствительность
микробов к цефалоспоринам III поколения.
Карбапенемы
На украинском фармацевтическом рынке представлены в основном
двумя антибиотиками - имипенемом/циластатином (тиенам) и меропенемом (меронем).
Характеризуются наиболее широким спектром антимикробной активности среди всех
бета-лактамных антибиотиков - грамположительные и грамотрицательные аэробные
бактерии, анаэробы. Из возбудителей внутрибольничных инфекций природную
устойчивость к карбапенемам проявляют только три микроорганизма: Enterococcus
faecium, Stenotrophomonas maltophilia, а также метициллинрезистентные штаммы
Staphylococcus sрр. Клинически важно, что вторичная устойчивость госпитальных
штаммов микроорганизмов к карбапенемам развивается крайне редко (исключение -
Р.аеruginosa). Резистентность Р.аеruginosa к карбапенемам выше и в ОИТ может
достигать 15-20 %. Карбапенемы сохраняют активность в отношении штаммов
Enterobacteriaceae, резистентных н цефалоспоринам III и IV поколений,
аминогликозидам и фторхинолонам (ФХ).
Имипенем характеризуется несколько более высокой активностью
in v itro в отношении грамположительных микроорганизмов, меропенем проявляет
более высокую активность в отношении грамотрицательных бактерий (клинически эти
различия вероятно не значимы); активность препаратов против анаэробов одинакова
и превосходит таковую у метронидазола и линкозамидов. Карбапенемы применяются
для лечения тяжелых внутрибольничных инфекций, вызванных полирезистентной и
смешанной микрофлорой, прежде всего при неэффективности препаратов первого ряда
- цефалоспоринов или фторхинолонов. В контролируемых клинических исследованиях
показано, что карбапенемы равноэффективны или превосходят стандартные
комбинированные режимы антибактериальной терапии на основе цефалоспоринов (или
полусинтетических пенициллинов) и аминогликозидов.
Основные показания для карбапенемов: интраабдоминальные
инфекции, послеоперационные раневые инфекции, внутрибольничная пневмония, в том
числе связанная с ИВЛ, легочные нагноения (абсцесс, эмпиема), инфекции органов
малого таза, осложненные инфекции мочевыводящих путей с сепсисом, остеомиелит,
менингит (только меропенем). Следует подчеркнуть, что при жизнеугрожающих
инфекциях карбапенемы необходимо рассматривать не как резервные средства, а как
антибиотики первого ряда, так как прогноз у тяжелых больных может быть улучшен
только в случае возможно более раннего назначения адекватной антибактериальной
терапии. К таким ситуациях прежде всего следует отнести инфекционные осложнения
у больных в ОРИТ, находящихся на ИВЛ (особенно при АРАСНЕ II > 20), инфекции,
вызванные Р.аеruginosa и Acinetobacter sрр., грамотрицательными бактериями
(прежде всего, Klebsiella sрр., P.vulgaris), продуцирующими бета-лактамазы
расширенного спектра, инфекции у больных с иммунодефицитом (фебрильная
нейтропения), гнойный послеоперационный менингит, вызванный грамотрицательными
бактериями или Р.аеruginosa.
В последнее время в клинической практике появился новый
карбапенем - эртапенем, МSD (инванз), который характеризуется улучшенными
фармакокинетическими свойствами и назначается 1,0 грамма 1 раз в сутки; способ
введения: внутримышечно и внутривенно.
Бактерицидные макролиды
Макролиды-азолиды - азитромицин (наименее токсичный
антибиотик, активность в отношении грамположительных кокков и внутриклеточных
возбудителей - хламидии, микоплазмы, кампилобактерии, легионеллы).
Макролиды-кетолиды - эритромицин-ацистрат (высокая активность
против энтерококков, в том числе нозокомиальных, ванкомицинрезистентных
штаммов, микобактерий, бактероидов).
Бактериостатические макролиды (препараты широкого спектра,
имеют длительный период полувыведения, можно вводить 1-2 раза в сутки, широкое
применение в лечении токсоплазмоза и профилактике менингита, активность в
отношении хламидий и легионелл).
-е поколение - эритромицин, олеандомицин.
-е поколение - спиромицин, рокситромицин, мидекамицин,
джозамицин, диритромицин, кларитромицин, китазамицин.
Общие свойства макролидов:
. Преимущественно бактериостатическое действие.
. Активность против грамположительных кокков (стрептококки,
стафилококки) и внутриклеточных возбудителей (микоплазмы, хламидии,
легионеллы).
. Высокие концентрации в тканях (в 5-10-100 раз выше
плазменных).
. Низкая токсичность.
. Отсутствие перекрестной аллергии с β-лактамами.
Среди макролидов особого внимания заслуживает кларитромицин
(клацид) как единственный из новых макролидов, имеющий внутривенную форму
введения. Данное обстоятельство позволяет использовать его при лечении
неосложненной внегоспитальной пневмонии или как препарат 2-го ряда при терапии
госпитальной пневмонии. Однако, по последним сообщениям, детального
рассмотрения заслуживает проблема устойчивости S.рпеитоniае к макролидным
антибиотикам. Устойчивость пневмококков к макролидам (так же, как и пиогенных
стрептококков) может быть обусловлена либо ферментативной модификацией мишени
действия (метилированием рибосомальной РНК), либо активным выведением
препаратов из микробной клетки. При первом механизме наблюдают полную
перекрестную устойчивость между всеми макролидами, при втором пневмококки
проявляют устойчивость к 14- и 15-членным макролидам при чувствительности к
16-членным. Между всеми включенными в Аlexander Project макролидами наблюдали
полную перекрестную резистентность. Вторым практически важным фактом является
наличие ассоциации между устойчивостью к пенициллину и макролидам. Это
наблюдение находит полное подтверждение во всех исследованиях, посвященных
антибиотикорезистентности пневмококков. Тревожным фактом является также
стабильный рост устойчивости к макролидам (в некоторых европейских странах
устойчивость к макролидам выше, чем к пенициллину). Причем нарастание
устойчивости коррелирует с увеличением потребления современных макролидов с
пролонгированной фармакокинетикой (азитромицина и кларитромицина). Для
макролидов традиционные и фармакодинамически обоснованные критерии
чувствительности совпадают. Следовательно, есть все основания предполагать
наличие у этих антибиотиков высокой бактериологической эффективности при
пневмококковых инфекциях, вызванных чувствительными штаммами. Имеющиеся
клинические данные находятся в полном соответствии с этим предположением. В то
же время нерешенным является вопрос о клинической эффективности 14- и
15-членных макролидов при инфекциях, вызываемых пневмококками с устойчивостью,
обусловленной активным выведением. Ряд наблюдений свидетельствует о том, что
при пневмониях, вызываемых такими микроорганизмами, клиническая эффективность
14- и 15-членных макролидов сохраняется. Обсуждаются предложения о пересмотре
критериев чувствительности пневмококков к макролидам (увеличение значения
пограничной МПК эритромицина от 1 до 8 или 16 мкг/мл). Таким образом, как для β-лактамов, так и для макролидов микробиологическая устойчивость
далеко не всегда означает неудачу лечения.
4. Биодеградирующие материалы
.1
Общие представления о биосовместимых материалах
Исследования в области материалов медицинского назначения
являются одним из актуальных направлений на стыке химии высокомолекулярных
соединений, физической химии, молекулярной биологии, биофизики и медицины и
включают в себя следующие взаимосвязанные задачи:
изучение механизма взаимодействия биоматериалов с кровью и ее
компонентами;
разработку количественных методов оценки физико-химических и
медико-технических свойств биоматериалов и изделий из них;
разработку новых материалов или методов их модификации;
экспериментально-клиническое применение материалов и изделий
для контакта с кровью.
Материалы медицинского назначения (синонимы: биоматериалы,
медицинские материалы, биомедицинские материалы) с необходимым комплексом
физико-химических и механических свойств, должны быть биосовместимы с тканями
организма, кровью и другими биологическими средами. В 1994 г. под термином
«биосовместимость» было предложено понимать способность материала, изделий или
устройств выполнять свои функции без заметной клинической реакции «хозяина» (Klinkmann and Davison, 1994).
При разработке медицинских изделий используют широкий круг
материалов естественного и искусственного происхождения, в том числе,
синтетические полимерные, биополимеры, металлы, керамику, гидроксиапатиты, углерод,
биоткани и гибридные (биоискусственные), основанные на комбинированном
использовании биоматериалов и функционирующих клеток различных тканей и
органов.
Биосовместимые материалы, предназначенные для контакта с
кровью, выделяют в группу гемосовместимых материалов, т. е. материалов
совместимых с кровью. Необходимо подчеркнуть, что все гемосовместимые материалы
являются биосовместимыми, но не каждый биосовместимый материал можно
использовать для контакта с кровью. Так, биосовместимость металлокерамики или
сплавов, используемых для изготовления штифтов, ортопедических или
стоматологических протезов, не означает, что эти материалы не будут, например,
провоцировать изменения клеточного состава крови.
4.2
Области применения искусственных материалов
С каждым годом расширяется номенклатура биоматериалов в
различных областях практического здравоохранения. Кратко рассмотрим ряд
примеров использования биоматериалов в изделиях медицинского назначения.
Материалы
для сердечно-сосудистой хирургии
Наиболее большую группу материалов медицинского назначения
представляют собой материалы для сердечно-сосудистой хирургии (таблица2).
Таблица 2 Биомедицинские материалы для сердечно-сосудистой
хирургии и область их применения
|
Наименование материала
|
Применение
|
|
Синтетические биостабильные
|
|
Акрилаты
|
Конструкционные материалы для экстракорпоральных устройств
|
|
Эпоксисоединения
|
Клапаны сердца и элементы искусственного сердца
|
|
Фторуглероды
|
Протезы кровеносных сосудов, покрытия катетеров
|
|
Гидрогели
|
Покрытия катетеров
|
|
Полиацеталь
|
Элементы искусственного сердца
|
|
Полиамиды
|
Шовные нити
|
Конструкционные материалы для экстракорпоральных устройств
|
|
Полиэфиры
|
Протезы кровеносных сосудов, баллоны для реконструкции сосудов
|
|
Полиэфиркетоны
|
Клапаны сердца и элементы искусственного сердца
|
|
Полиимиды
|
Клапаны сердца и элементы искусственного сердца
|
|
Полиолефины
|
Шовные нити
|
|
Полиолефиновые эластомеры
|
Трубки, искусственное сердце
|
|
Высококристалличные полиолефиновые пленки
|
Баллоны для реконструкции сосудов
|
|
Полисульфоны
|
Клапаны сердца и элементы искусственного сердца
|
|
Полиуретаны
|
Катетеры, искусственное сердце
|
|
Поливинилхлорид
|
Трубки, емкости для крови
|
|
Силиконы
|
Трубки, шариковые клапаны сердца
|
|
Биодеградируемые
|
|
Полиаминокислоты
|
Контролируемое высвобождение, пептиды для адгезии клеток
|
|
Полиангидриды
|
Контролируемое высвобождение
|
|
Поликапролактаны
|
Контролируемое высвобождение
|
|
Сополимеры лактидов и гликолидов
|
Контролируемое высвобождение, шовные нити
|
4.3
Синтетические биодеградируемые материалы
Биодеградируемыми биосовместимыми материалами называются
материалы, способные разрушаться после определенного времени имплантации с
образованием нетоксичных продуктов, которые выводятся организмом или
усваиваются им. Наиболее перспективными областями применения таких материалов в
медицине являются: биодеградируемые шовные нити, матрица для доставки лекарств
в определенные участки организма, сердечно-сосудистые, стоматологические и
ортопедические хирургические временные крепежные элементы (Липатова и Пхакадзе,
1983; Пхакадзе, 1990; Degradable Materials, 1990; Биосовместимость, 1999; Amass
et al.,1999).
В таблице 1.4 перечислены современные биоабсорбируемые
материалы, главным образом, на основе лактидов, гликолидов и их сополимеров,
выпускаемые рядом зарубежных фирм. Основным фактором, сдерживающим клиническое
применение новых биодеградируемых материалов, является проблема регулируемости
и контролируемости процессов их биодеструкции в реальных условиях организма.
Наиболее изученными в этом плане являются полиуретаны. Было показано, что
деструкция медицинского полиуретанового клея КЛ-3 в организме происходит, как
по пути неферментативного гидролиза, так и клеточным путем (Пхакадзе Г.А.,
1990). При этом резорбция полимерного материала протекает клеточным путем и связана,
в основном, с двумя типами клеток - макрофагами, осуществляющими фагоцитоз
мельчайших частиц полимера, и гигантскими клетками инородных тел, вызывающими
его лизис. «Доля» клеточного компонента биодеструкции обычно тем более
выражена, чем больше развита поверхность полимера, например, у перисто-губчатых
имплантатов, или на поздних этапах деструкции полимеров, когда поверхность
имплантата увеличивается за счет эрозии. Эта закономерность сохраняется и для
полиуретанов тривиального состава, как правило, подвергающихся
неферментативному гидролизу, и для полиуретанов со «слабыми звеньями» (сложные
эфирные группы, полисахаридные звенья), способных подвергаться ферментативному
расщеплению (Пхакадзе Г. А., 1990).
Таблица 3 Перечень, состав и область применения
биоабсорбируемых материалов
|
Наименование, материал
|
Область применения, фирма-производитель
|
|
Absolock, полидиоксанон
|
Сшивающая скобка для кровеносных сосудов, Ethicon, Inc., США
|
|
Alzamer, полиортоэфир
|
Матрица для доставки (бывш. Chronomer) лекарственных веществ,
Alza, Inc., США
|
|
BAR
|
Частично биоабсорбируемое анастомозное кольцо для кровеносных
сосудов, BAR, США
|
|
Biodel, поли(бис(п-карбокси-фенокси пропан ангидрид) себациновой
кислоты)
|
Матрица для доставки лекарственных веществ, Nova
Pharmaceutical, Inc., США
|
|
Biofix, полидиоксанон, армированный полигликолидом
|
Штифт для фиксации фрагментов кости, Bioscience, Ltd., Tampere,
Финляндия
|
|
Capronor, поликапролактон
|
Матрица для контрацептивного (стероидный) имплантата, Research
Triangle Institute, Inc., США
|
|
Dexon, полигликолид
|
Плетенные хирургические нити American Cyanamid Co., Inc., США
|
|
Drylac, поли-L-лактид
|
Пористая повязка для оральной хирургии
|
|
Ethipin, полидиоксанон
|
Штифт для фиксации костно-хрящевых фрагментов, Ethicon, Inc.,
США
|
|
Lactomer, сополимер поли-(L-лактид - 30 %-гликолид)
|
Сшивающие сосуд скобки, U.S. Surgical Corp., Inc., США
|
|
Orthosorb, полилактид
|
Ориентированные материалы для восстановительной ортопедии,
Johnson & Johnson, Inc., США
|
|
Полидиоксанон
|
Хирургическая шовная мононить, Ethicon Inc., США
|
|
Valtrac, полигликолид и сульфат бария.
|
Частично биодеградируемое анастомозное кольцо для абдоминальной
хирургии, American Cyanamid Co., Inc., США
|
|
Vicryl, сополимер поли(гликолид-10 %-L-лактид), или полиглактин
910
|
Плетенные хирургические нити Еthicon, Inc., США
|
В свете этого особое внимание уделяется разработке методов
прогнозирования времени жизни имплантатов из биодеградируемых материалов с
полностью охарактеризованными физико-химическими и физико-механическими
свойствами, состоящей, в основном, из тестов трех уровней отбора (Stokes., 1993):
– ускоренные испытания in vitro;
– оценка биостабильности in vivo;
– клинические испытания.
Одной из главных причин осложнений при использовании
биодеградируемых материалов является воспалительная и аллергическая реакция
организма на продукты деструкции материала (Anderson, 1993), проявление
канцерогенности (James, 1997). Это необходимо учитывать при определении сроков
тестирования биодеградируемых имплантатов.
В последние 15 лет непрерывно растет интерес к бактериальным
полиэфирам (полигидроксиалканотам, ПОА) - биодеградируемым материалам
природного происхождения (Biomedical Polymers, 1994; Севастьянов,
2001). К наиболее изученным ПОА относятся поли(3-гидроксибутират, ПОБ) и
сополимеры 3-оксибутирата с 3-оксивалератом, ПОБ-со-ПОВ. Полиоксибутират -
гомополимер, синтезируемый различными видами прокариотидных клеток в
специфических условия роста, он является субстратом эндогенного дыхания и
поддерживает жизнеспособность клеток в неоптимальных условиях среды. ПОБ
образован мономерами b-оксимасляной кислоты, являющейся продуктом
обмена веществ у высокоорганизованных организмов и одним из компонентов крови
человека. Физико-химические, механические, технологические свойства сополимеров
оксибутирата с оксивалератом делают их весьма привлекательными для разработки
шовных материалов, мембран, временных каркасов для гибридных органов, систем
для пролонгированного введения лекарственных веществ (Биосовместимость, 1999; Amass et al., 1998; More and Sauders, 1998; Sudesh et al., 2000).
4.4
Материалы для ортопедии и стоматологии
Современные биодеградируемые и биостабильные материалы,
применяемые или разрабатываемые в ортопедии и стоматологии, относятся к шести
основным группам (Handbook of Bioactive Ceramics, 1990; Osseo-integrated implants, basics, materials, and joint replacements, 1990; A Comprehensive Guide to Medical/Pharmaceutical Applications, 1991; Применение
плазменного напыления в производстве имплантатов для стоматологии, 1993). Среди
них:
– биоактивное стекло,
– керамика из гидроксиапатитов,
– биоактивная стеклокерамика,
– биоактивные композиты (трикальций фосфаты, кальций
фосфаты, гидроксиапатиты);
Стоматологические цементы:
– акрилатные,
– гидроксиапатитные с полилактидом,
– алюмосиликатные;
Металлы и их сплавы
– медь (76-87 % Cu, 6-11 % Al, 0-12 % Zn, 1-5 % Ni, 0-4
% Fe, 0.5-1.2 % Mn),
– нержавеющая сталь,
– титан,
– сплавы титана,
Композиты металлов с керамикой:
– никель-титановые,
– кобальт-хром-молибденовые,
– титан с керамическим покрытием,
– титан с керамическим и с фосфат кальциевым покрытием,
– сплавы титана с керамическим покрытием,
– титан со стеклокерамическим покрытием,
– кальций-фосфат титана;
Полимерные материалы:
– полиметилметакрилат (ПММА),
– полифосфорэфиры,
– полилактид,
– силикон,
– полиэтилен;
Наполнители:
– стекло в виде пудры,
– микро- и макропористые гели,
– частицы титана со стеклокерамикой.
Следует отметить, что ткани наиболее толерантны к титану,
поэтому он, наряду с кобальт-хромовыми сплавами, часто используется в
ортопедической и стоматологической практике при изготовлении имплантатов.
Защитная функция титана обусловлена пассивированным слоем окиси титана (TiO2,
TiO, Ti2O3, Ti3O4), который на воздухе за несколько минут достигает толщины от
2 до 10 нм. Весьма перспективным является использование изделий из порошков
легированного и нелегированного титана. Сплавы титана применяют в
ортопедической стоматологии для изготовления вкладок, штифтовых конструкций,
коронок, базисов съемных протезов.
Тем не менее, остается недостаточно изученным вопрос о
влиянии титана на костно-мозговые остеогенные клетки (предшественники
фибробластов) и их пролиферативную активность, которая, как правило, резко
возрастает при имплантации и трансплантации.
Для стоматологических имплантатов наиболее часто привлекают
ПММА, цельный и пористый. При изготовлении съемных протезов челюсти используют
пять базисных полимерных материалов (сополимер поливинилацетат-полиэтилен, или
этилен-винилацетат, поливинилхлорид, натуральный каучук, полиуретан, акрил), но
предпочтение отдается сополимеру, который обладает лучшими физико-механическими
свойствами.
Полимерные материалы применяют также в качестве покрытий
поверхности титановых и металлокерамических изделий. Тем не менее, основной
недостаток имплантатов, включающих в свой состав полимерные материалы, состоит
в том, что по мере старения полимера проявляются реакции отторжения,
раздражение мягких тканей и аллергические реакции (Anderson, 1993).
Важнейшими отличительными характеристиками керамических
материалов (корундовая керамика, сапфир, углеродные и стеклоуглеродные
соединения, алюмооксидная керамика и др.) являются высокая коррозионная
стойкость, хорошая совместимость с тканями (Костюков, 1985; Седунов, 1988;
Применение плазменного напыления в производстве имплантатов для стоматологии,
1993). Однако следует отметить сложность технологии изготовления имплантатов из
керамики, поэтому до сих пор керамика не нашла широкого применения.
Весьма перспективными материалами являются композиционные
системы ситаллы (стеклокерамика), основой кристаллической фазы которых являются
сподумен и дискалит лития (Седунов, 1988). Серьезным недостатком биологического
стекла и стеклокерамики является невысокая механическая прочность и заметная
деструкция в тканях организма. Стеклокерамика в настоящее время используется
лишь в качестве покрытия имплантатов.
Одна из основных проблем в ортопедической и стоматологической
хирургии - существующая разница в жесткости естественной костной ткани и
металлических и керамических имплантатов, широко используемых в настоящее время
(последние, по крайней мере, в 10-40 раз жестче при заданной прочности). На
практике при изготовлении суставов, челюстей, стоматологических и
ортопедических штифтов широкое применение нашли конструкции имплантатов сложной
структуры. Они, как правило, состоят из основы (титан или нержавеющие стали),
системы переходного слоя (например, порошок титана) и тонкого биокерамического
слоя (гидроксиапатит, трикальций фосфат, стеклокерамика с активной компонентой
и др.).
Формирование на поверхности имплантата тонкого биологически
активного слоя с определенной пористой структурой и морфологией поверхности, с
необходимыми адгезионно-когезионными и другими свойствами является сложной
задачей. Наиболее перспективной представляется технология плазменного напыления
порошковых материалов (Применение плазменного напыления в производстве
имплантатов для стоматологии, 1993). При введении в костную ткань таких
имплантатов происходит эффективное прорастание кости в поры покрытия. В
процессе заживления наблюдается интеграция пористопорошкового тонкого слоя
напыленной гидроксиапатитовой керамики в собственную костную ткань. Это
обеспечивает прочное и длительное закрепление имплантата и нормальное его
функционирование в организме.
Сравнительно недавно была выдвинута идея использования
композитных материалов для изготовления имплантатов, варьируя состав которых
можно добиться высокой прочности в сочетании с низкой жесткостью. Кроме того,
изделия из композитных материалов устойчивы к циклическим нагружениям, легко
адаптируемы к механическим воздействиям и могут иметь разную прочность в
необходимых направлениях. Среди таких композитных материалов наиболее
перспективны следующие:
– композиты на основе коллагена, желатины, фибрина или
полимерных материалов (полисульфоны, силиконы, полифосфазены) c
диспергированием в объеме матрицы до 20-30 вес. % биоактивной керамики (стекло,
гидроксиапатиты, стеклокерамика, трикальцийфосфат, фосфаты кальция);
– углеродсодержащие композиты: углерод, армированный
углеродными волокнами; полисульфон, армированный углеродными волокнами; резины,
армированные углеродными волокнами. Обычно, углеродные волокна получают
пиролизом таких органических волокон, как полиакрилонитрил или искусственный
шелк.
– органоапатиты.
Заключение
В ходе курсовой работы был проведен обзор методов нанесения
антибактериальных покрытий и их свойств, а так же антибактериальных препаратов.
В процессе изучения антибактериальных покрытий и методов их нанесения, была
разработана методика проведения экспериментального испытания для дипломного
проектирования. Методика проведения испытания была разработана с учетом
существующих проблем, и способствует снижению их влияния, а так же уменьшение
влияния сторонних факторов.
Литература
1. Адамян
А.А. Основные направления и перспективы в создании и клиническом применении
полимерных имплантатов // Биосовместимость. - 1994. - № 2. - С. 97-107.
. Волова
Т.Г., Калачева Г.С., Константинова В.М. Накопление полиоксибутирата аэробной СО
- окисляющей карбоксидобактерией Seliberia // Микробиология. - 1994б. - Т. 63.
- С. 211-216.
. Карлов,
А.В. Клеточные и тканевые механизмы оптимальной био- механики аппаратов внешней
фиксации /А.В. Карлов, И.А. Хлусов/ VII съезд травматологов-ортопедов России:
тез. докл.: в 2-х ч.- Новосибирск, 2002. - Ч.2. - С. 66-67.
4. W. Hill & D. Pillsbury, Argyria - The Pharmacology of
Silver, Baltimore: Williams & Wilkins, 1939.
. The Merck Index. 10th ed. Rahway, New Jersey: Merck Co.,
Inc., 1983, p. 1222
6. Иванов
В.Н., Ларионов Г.М., Кулиш Н.И. и др. Некоторые экспериментальные и клинические
результаты применения катионов серебра в борьбе с лекарственно-устойчивыми
микроорганизмами // Препринт №4 "Серебро в медицине и технике". -
Новосибирск: Издательство СО РАМН , 1995. - C. 53-62.
. Пузырь
А.П., Букаемский А.А., Белобров П.И., Волова Т.Г. Равномерное распределение и
стабилизация наночастиц в полимерном геле полиоксибутирата. - Доклады РАН.
-2001. - Т. 376, № 4, - С. 547-549.
. Михалковский
С.В., Алексеева Т.А., Носков А.М. и др. Иммуносорбенты на основе синтетических
углей // Украинский биохимический журнал. - 1987. - T. 59. - C. 100-106.
. Севастьянов
В.И., Беломестная З.М., Дубович Т.И., Петров М.В. О предварительной оценке
тромборезистентности полимерных материалов // Высокомолекулярные соединения. -
1981. - Т. 23А. - С. 1864-1867
. Чапут
К., Ассад М., Яхиа Х., Ривард Ч.-Х., Селмани А. Оценка цитотоксичности и
гемолитической активности бактериальных сополимеров на основе
полигидроксибутирата в условиях in vitro // Биосовместимость. - 1995б. - Т. 3. - С.
31-42.
. Шишацкая
Е.И., Еремеев А.В., Гительзон И.И. Исследование свойств биодеградируемых
полимеров (полиоксиалканоатов) в культуре животных клеток // Перспективные
материалы. - 2001. - № 3. - C. 40-47.
. Фрешни
З. Культура животных клеток // М.: Мир. - 1989. - 322 с.
. Шефтель
В.О. Полимерные материалы. Токсические свойства: Справочник // Л.: Химия. -
1982. - 239 с.