Бронхіт курей
Вступ
бронхіт інфекційний
курка штам
Реформування
агропромислового комплексу в Україні та безконтрольний завіз племінної
продукції птахівництва вплинули на систему господарсько-економічних зв’язків в
галузі птахівництва. На сьогодні в період відсутності конкурентоздатних кросів
птиці і завозу гібридного молодняку в Україну, з’явилось багато вірусних
захворювань, які раніше не реєстрували на нашій території: інфекційний бронхіт,
хвороба Гамборо, реовірусна інфекція, вірусний енцефаломієліт птиці, тощо [12].
Інфекційний бронхіт
птиці реєструється в усіх країнах світу і спричиняє значні економічні збитки
промисловим та фермерським господарствам за рахунок гибелі молодняка, зниження
яєчної й м’ясної продуктивності, зниження якості тушки - у бройлерів, зниження резистентності
організму і затримки росту перехворілої птиці. Вірус інфекційного бронхіту
курей вражає птицю усіх вікових груп та кросів. В Україні існує велика
кількість виробників яйця (близько 200 птахофабрик), крім того, значна частина
птиці (близько 56%) вирощується у приватних господарствах. Понад 97%
промислового птахівництва припадає на виробництво яєць та м’яса бройлерів, з
них промислове стадо курей-несучок складає 41%. Тому в зв’язку з інтенсивним
розвитком птахівничої галузі зростає необхідність максимально підвищити захист
птиці від інфекційних хвороб [3].
Не дивлячись на
широке використання вакцин проти інфекційного бронхіту, контроль захворювання
ускладнюється із-за циркуляції епізоотичних штамів вірусу інфекційного
бронхіту, які антигенно відрізняються від вакцинних штамів, так як перехресний
захист між ними відсутній [7].
Розповсюдження і
значні економічні збитки від інфекційного бронхіту викликають необхідність
постійного моніторингу цього захворювання і оптимізації схем
вакцинопрофілактики ІБК. Тому застосування науково-обгрунтованих програм
профілактики інфекційного бронхіту, що базуються на постійному
епізоотологічному моніторингу в птахогосподарствах та вдосконалення методів
контролю ефективності вакцинації є єдиним напрямком вирішення проблеми.
Основна
мета і завдання виконаної роботи -
проведення аналізу специфічної імунопрофілактики та схем вакцинації проти
інфекційного бронхіту курей в Україні, вивчення еволюції штамів інфекційного
бронхіту та дослідження ефективності вакцинації за допомогою серологічного
моніторингу в НДППЗ ім. Фрунзе.
Об’єктом
дослідження - є специфічна
профілактика інфекційного бронхіту, штами інфекційного бронхіту курей.
Предметом дослідження - є серологічні показники ефективності специфічної
профілактики ІБК, моніторинг еволюції штамів інфекційного бронхіту курей.
Методи
дослідження - епізоотологічний
аналіз, серологічні дослідження.
Новизною
проведених досліджень - є
обґрунтування тотального серологічного моніторингу ІБК в зв’язку з
швидкою еволюцією вірусу на основі доповнення даних в карту міграції штамів
інфекційного бронхіту з метою ефективного застосування специфічної
профілактики.
1. Огляд літератури
1.1 Характеристика
інфекційного бронхіту курей (епізоотологія, патогенез, клінічні і
патологоанатомічні ознаки, імунітет, діагностика ІБК)
Інфекційний бронхіт
курей (ІБК) є гострим, висококонтагіозним захворюванням, що завдає істотної
шкоди промисловому птахівництву. Вірус ІБК вражає верхні дихальні шляхи,
репродуктивні органи і викликає нефрозо-нефрити. У дорослих несучок відзначають
спад яєчної продуктивності, деформацію і знебарвлення шкаралупи, розрідження
яєчного білка і зниження виводимості [9,10].
Збудником інфекційного
бронхіту курей є вірус Avian Infectious Bronchitis Coronavirus, який
відноситься до сімейства коронавірусів (Coronaviridae), роду коронавірус
(Coronavirus) і типу Avian [47]. Вірус інфекційного бронхіту птахів, як і всі
коронавіруси, є поліморфним. Пташиний коронавірус має яскраво виражену
генетичну мінливість. Відмінною особливістю вірусу інфекційного бронхіту курей
є крапкові мутації і рекомбінація генома, які пов'язані з роботою РНК-залежної
РНК-полімерази, яка не має здатності коректувати генетичні помилки при
реплікації вірусного генома, це проявляється наявністю багатьох серотипів і появою
нових антигенних варіантів вірусу [53].
Постійне виникнення
нових серотипів і варіантів віруса ІБК ускладнює здійснення програм контролю
захворювання за допомогою вакцинації. Це обумовлює необхідність у швидкій і
точній діагностиці для своєчасного виявлення нових варіантів збудника і
порівняння їх з існуючими вакцинними штамами [25].
У природних умовах до
інфекційного бронхіту сприйнятливі кури всіх вікових груп. Локалізація і
розвиток віріонів відбувається в цитоплазмі, дозрівання і розмноження - в цистернах
або везикулах ендоплазматичної мережі [42].
Стійкість вірусу у
зовнішньому середовищі невисока. Більшість штамів вірусу інактивуються при 56°С
за 10 хв. У трупах загиблої птиці його активність швидко зникає. У питній воді
при кімнатній температурі вірус зберігається протягом 11 годин. В умовах
пташника при температурі 17 - 23° С і відносній вологості повітря 60-90% вірус
ІБК втрачає біологічні властивості протягом 4-7 діб; восени, при 12 - 18° С і
50-74% вологості протягом 12-14 днів; взимку, при мінус 7 - 13,5° С і 39-66%
вологості 13-21 день. В пері і пуху вірус в приміщенні зберігає життєздатність
до 12 діб, а на поверхні яєць 8-9 днів [43]. Вірус інфекційного бронхіту в
аллантоїсній рідині курячого ембріона при температурі 32°С зберігається 3 дні,
при 20-30°С - 24 дні, при 4°С - 427 днів, при мінус 25°С - 537 днів. Це вказує,
що низькі температури консервують вірус. Заморожування і відтавання вірусу не
чинять негативного впливу на його життєздатність. Вірус добре розмножується в
курячих ембріонах 8-10-денної інкубації, також в культурі клітин нирок і
фібробластів курячого ембріона [47].
Розчин хлорного вапна,
що містить 0,2 і 0,3% активного хлору, 0,3 і 0,6%-вий розчин їдкого лугу
інактивують вірус ІБК за 10 хвилин, а 0,1%-ний розчин формаліну за 5 хвилин.
Вірус руйнується після трихвилинного впливу на нього звичайних дезинфікуючих
засобів (1-% розчину фенолу, 0,5-% розчину формальдегіду, розчину перманганату
калію 1:10000, 70-%-ного етилового спирту) [27,36]. Чутливість до розчинників
жирів є характерною ознакою, що дозволяє діфференціювати від деяких інших -
адено - або реовірусів [12]. Антибіотики і хіміопрепарати (нітрофурани,
сульфаніламіди, тощо) не надають згубної дії на вірус [44].
Епізоотологія хвороби:
До інфекційного бронхіту
сприйнятливі кури будь-якого віку, однак найчутливіші курчата віком до 30 діб.
Джерелом збудника інфекції є хвора та перехворіла птиця, яка виділяє вірус з
витіканнями з носа, очей, з фекаліями, яйцями [8]. Вірусоносійство та виділення
вірусу перехворілою птицею триває до 105 діб. Факторами передавання збудника
можуть бути синантропні птахи, загибла птиця, контаміноване вірусом повітря,
корми, а також транспортні засоби, тара, взуття та одяг обслуговуючого
персоналу. Доведено можливість трансоваріального передавання збудника. Появі
хвороби та її поширенню сприяє скупчене утримання курчат, переохолодження,
недостатня вентиляція, неповноцінні корми, нестача вітамінів. Зараження птиці
відбувається аерогенним шляхом, можливо, перорально, а також трансоваріально
[24]. Епізоотологічною особливістю інфекційного бронхіту є швидке й значне
поширення в стаді. Спочатку захворюють курчата, потім молода й доросла птиця.
Упродовж 1 - 4 тижнів хвороба охоплює майже все стадо, особливо в разі великого
скупчення та незадовільного мікроклімату. Нерідко господарства стають
стаціонарно неблагополучними щодо інфекційного бронхіту, що супроводжується
періодичними спалахами хвороби серед курчат 30-денного віку після зникнення у
них материнських антитіл. У курчат 30 - 60 денного віку інфекційний бронхіт
часто ускладнюється колібактеріозом або мікоплазмозом. Летальність серед курчат
до 30-денного віку може сягати 100%, у молодняку 2 - 3-місячного віку - 90%
(частіше 10 - 35%) [39,40].
Патогенез:
Вірус інфекційного
бронхіту, потрапивши в організм тим чи іншим шляхом, дуже швидко проникає в
сприйнятливі клітини, головним чином в епітелій дихального аппарату, де швидко
розмножується[41]. Це сприяє скупченню в трахеї і бронхах в'язкого слизового
ексудату, який зумовлює утруднене дихання і появу сухих, дрібно- і
крупнопузирчатих хрипів. Такі зміни у верхніх дихальних шляхах курчат, що
виникають вже через 18-24 годин після їх зараження, сприяють прояву у них
перших клінічних ознак захворювання [25].
У міру розвитку
захворювання вірус струмом крові заноситься в усі органи і тканини. Вірус
інфекційного бронхіту птахів впливає на організм пантропно і викликає глибокі
патологічні зміни в усіх органах, а не тільки в дихальних шляхах хворих птахів
[7]. У курей, хворих ІБК, вірус виявляють в епітелії яєчників, під його впливом
порушується синтез альбумінів, і несучки відкладають яйця з водянистим білком.
Нефропатогенні штами вірусу ІБК ушкоджують епітеліальні клітини ниркових
канальців, що уповільнює просування в них рідини та електролітів. Нирки
розбухають і бліднуть, їх маса збільшується, відбувається мінералізація тканини
і утворення каменів [55].
Варіантні штами вірусу,
близькі до серотипу D207, вражають епітелій яєчника і яйцепроводів, в
результаті чого зменшується розмір клітин, зникають війки, залози і лімфатичний
центр збільшується. Жовтки або деформовані яйця у курей можуть потрапляти в
черевну порожнину, що призводить до розвитку перитонітів [18].
Варіантні штами, родинні
серотипу 793/В, розмножуються не тільки в респіраторному тракті птиці, але і в
кишечнику, викликаючи діарею. У бройлерів, експериментально заражених вірусом
серотипу 793/В, спостерігали білатеральну міопатію з рідкісними фасціальними
крововиливами [53]. Відбувалося слабке розділення м'язових волокон в результаті
набряклості і підвищення концентрації креатиніну в сироватці крові. Вірус
вдавалося виділити також із фабріцієвої сумки, слізної залози, сперми та яєць
інфікованих курей і півнів.
Клінічні ознаки ІБК:
Перебіг і характер
захворювання залежить від багатьох чинників, до яких відносяться: рівень
біобезпеки на підприємстві, характеристика польового вірусу (вірулентність,
тропізм, серотип), вік птиці, рівень імунного захисту в момент інфікування,
наявність імуносупресивних факторів, наявність супутніх інфекцій, рівень
менеджменту на підприємстві [15]. У природних умовах інкубаційний період
хвороби триває від 18 до 36 годин, інколи до 10 діб, що залежить від
вірулентності штаму і резистентності організму птиці [11].
На сьогоднішній день
розрізняють три основних синдроми перебігу захворювання ІБК: респіраторний,
нефрозо-нефрітний і репродуктивний. Вони можуть протікати самостійно, але
частіше в змішаних варіаціях. Хоча, ІБК вважається, головним чином,
захворюванням респіраторної системи, різні штами ІБК показують варіабельний
тканинний тропізм і вражають також яйцепровід і нирки з тяжкими наслідками.
Деякі штами реплікуються в кишечнику, але явно без патологічних змін [16].
Респіраторний синдром
характеризується кашлем, трахеальними хрипами, носовими виділеннями,
утрудненням дихання (з відкритим дзьобом), іноді кон'юнктивітом, ринітом,
синусітом, хворі погано поїдають корм, слабшають і стають сонливими. Пір'я
скуйовджене, крила опущені. Висока летальність спостерігається, головним чином,
серед курчат до місячного віку. Причина загибелі - асфіксія. У молодняку 2-3-місячного
віку вона може досягати 90%, але частіше коливається в межах 10-35%. Хвора
птиця відстає в рості і розвитку. Захворювання курчат в ранньому віці може
призвести до аномального розвитку репродуктивних органів з необоротними наслідками,
і появи курей, які не можуть нести яйця, так званих, «несправжніх» несучок. У
курчат 30-60-денного віку ІБ протікає зазвичай хронічно і в асоціації з
колібактеріозом. Захворювання триває 3-6 днів, і до 15 дня стан стає
задовільним [15].
Нефрозо-нефрітний
синдром викликає гострий перебіг хвороби, у хворих птахів відзначають
депресію і діарею з домішками уратів. При первинній циркуляції вірусу в
господарстві, летальність при даній формі хвороби досягає 57-70% [35].
Репродуктивний синдром
проявляється зазвичай у курей старше 6 місяців. Захворювання протікає
безсимптомно або з незначним ураженням органів дихання. Єдиним проявом хвороби
в цих випадках є тривале зниження несучості. Продуктивність кур, перехворілих у
віці до трьох тижнів, на 35-65% нижче, ніж не перехворівших. У перехворілих
дорослих курей відзначають тимчасове (4-5 тижнів) зниження несучості на 20-30%.
Надалі несучість відновлюється, але не досягає попереднього рівня. Перехворіли
кури довгий час несуть дрібні яйця з тонкою шкаралупою неправильної форми [8].
Останнім часом з’явилися
незвичайні клінічні прояви цього захворювання - міопатія грудних м’язів у
бройлерів; враження репродуктивної системи без впливу на респіраторну систему у
несучок, що пов’язано з появою варіантних штамів, які відрізняються від
«класичного» своїм тропізмом. Так, варіантні штами, які споріднені серотипу
793/В, розмножуються не тільки в респіраторному тракті, але і в кишечнику та
викликають діарею. Штами цього типу мають підвищену вірулентність. Вони можуть
викликати загибель дорослої птиці без асоціації з іншими патогенами [56].
На бройлерних
підприємствах України прояв ІБК протікає в першу чергу у вигляді
нефроз-нефрітного синдрому з наявністю або відсутністю легкої респіраторної
картини [5]. В останні роки накопичується все більше спостережень про прояв
ВІБК нефропатогенності: індукції запалення нирок, уремії та утворення сечових
каменів. Така форма інфекції характеризується високим рівнем смертності [6].
Ще одним фактором, який
ускладнює важкий перебіг ІБК, є супутні інфекції. Перебіг ІБК в асоціації з
М.galinarum викликає частішання випадків важких ринітів, трахеїтів та
аеросаккулітів у птиці. При зараженні курчат ІБК і Е. сoli скорочується
інкубаційний період хвороби, а ураження респіраторного тракту, нирок та м’язів
носять більш виражений характер [7]. Важкий перебіг ІБК спостерігається при
одночасному інфікуванні ІБК, Е. соli та мікоплазмами.
Часто серед бройлерів та
дорослого птахопоголів’я м’ясних кросів перебіг ІБК реєструють у асоціації з
вірусним захворюванням, «синдромом опухання голови». Таким чином, декілька
патогенів, що взаємодіють синергічно з вірусом ІБК або вакцинами проти ІБК,
підвищують вірогідність важкого та затяжного перебігу хвороби. Проте механізм
цього прояву не зовсім ясний; є думка, що синергізм є наслідком пригнічення
імунної відповіді або наслідком ураження епітелію вірусом ІБК, що призводить до
підвищення проникнення та реплікації секундарної інфекції [50].
Є дані про здатність
вірусу ІБК викликати більш високий падіж бройлерів, ніж несучок. У бройлерів
відзначається зниження споживання корму і темпів зростання, респіраторна
картина у вигляді чхання, задишки, хрипів, виділення з носових раковин, явища
раптової смерті через задуху, аеросаккуліт через вторинні бактеріальні інфекції
(Е.соli, O. rhinotrachеа1е і т.д.), смертність через ураження видільної
системи, високий відсоток вибракування птиці [60].
Півні в два рази більш
схильні до нефриту, ніж кури. Відзначено, що високобілкові раціони, високий
рівень кальцію в кормі підвищують смертність від ІБК [3]. У курей, отримуючих
м'ясо-кісткове борошно в корм, смертність вища, ніж у вирощених на соєвих
раціонах. Низькі температури та інші несприятливі фактори зовнішнього
середовища (недостатній повітрообмін в пташниках, підвищений вміст в повітрі аміаку)
підвищують смертність птахів.
Патологоанатомічні
зміни:
Макроскопічні зміни при
інфекційному бронхіті малохарактерні. У гострих випадках захворювання в носовій
порожнині загиблих або вбитих курчат виявляють скупчення помірної кількості
серозного або серозно-слизового ексудату. Слизова оболонка гіпермійована і
помірно набрякла. Судини розширені, кровонаповнені та рельєфно вимальовуються
на поверхні. При більш тривалому перебігу захворювання в носовій порожнині
знаходять серозно-слизовий ексудат біло-мутного кольору, і нерідко в
інфраорбітальних синусах зустрічається скупчення казеозних мас [28].
У трахеї виявляють
гіперемію слизової оболонки, скупчення серозно-слизового ексудату, можуть бути
одиничні крапкові крововиливи. Нерідко в середній і нижній частинах трахеї
виявляють казеозно-слизові пробки, які легко видаляються. Іноді ці пробки мають
вигляд кілець. В великих бронхах скупчення в'язкого, сметаноподібного ексудату,
в якому є плівки фібрину. Слизова оболонка бронхів гіпермійована і набрякла.
Навколо головних бронхів відзначаються ділянки пневмонії [52].
Легені незначно
збільшені в обсязі, рожево-червоного або темно-червоного кольору. Поверхня
розрізу їх гладка. При натисканні з легень виділяється каламутна піниста
рідина. У верхівках легень виявляють невеликі осередки ателектазу [4].
У повітроносних мішках
знаходять скупчення пінистої прозорої або мутнуватої рідини [28]. Стінки
повітроносних мішків спочатку мають осередкове помутніння, а потім дифузне. У
ряді випадків вони вкриті плівками фібрину У господарствах часто доводиться
зустрічати ниркову форму інфекційного бронхіту. Її практично можна виявити з
2-3 - до 230-250-денного віку. Патологічний процес протікає в три стадії і
здатний повторюватися знову.
Спочатку реєструється
нефрит, потім у нирках розвиваються дистрофічні процеси, що часто
супроводжуються внутрішньоклітинною подагрою «мармурова нирка». Після цього
частина нирки відмирає і розсмоктується, інша частина відновлюється до виду
нормальної тканини [14]. Процес часто повторюється в тій же послідовності:
нефрит-нефроз-часткова атрофія нирки.
Коли інфекційний процес
протікає з нефрито-нефрозним синдромом, то при розтині загиблих курчат і
дорослих курей в нирках знаходять відкладення великої кількості сечокислих
солей. При цьому нирки збільшені, на розрізі видно судинні клубочки у вигляді
сірих піщинок, сечоводи розтягнуті і заповнені білуватою масою. У окремих
курчат спостерігається відкладення сечокислих солей в печінці і перикарді [48].
У дорослих курей
відзначають атрофію яйцевих фолікулів. Яєчник зменшений в розмірі і покритий
жовтими тілами. У яйцеводі виявляють кісти, особливо в передній його частині.
Задня частина яйцевода в більшості випадків атрофується. Нерідко
спостерігаються перетяжки, обриви і пляшкообразні розширення яйцевода. Печінка
застійно гіперемована, її капсула напружена, края печінки притуплені. Селезінка
трохи збільшена, кровонаповнена. Відзначається сильне кровонаповнення
кровоносних судин оболонок головного мозку. В інших органах макроскопічних змін
не спостерігається.
Імунітет:
Птиця, перехворіла
інфекційним бронхітом, набуває стійкості до повторного зараження вірулентним
штамом вірусу. Однак у відношенні тривалості імунітету у перехворілої птиці
немає єдиної думки.
Деякі автори
відзначають, що вірус нейтралізуючі антитіла з'являються на 11-й день після
захворювання. Потім йде поступове наростання їх до 36-го дня. Надалі вірус
нейтралізуючі антитіла зберігаються в організмі перехворілої птиці до 483 днів
[1].
Кури, які перехворіли
інфекційним бронхітом, передають антитіла з яйцем. Курчата, виведені з таких
яєць, володіють пасивним імунітетом, який можна виявити протягом 2-3 тижнів їх
життя.
Наявність пасивного
імунітету не завжди оберігає курчат від природного або штучного зараження.
Курчата, що походять від імунних матерів, вдається заразити інфекційним
бронхітом в 6-денному віці і старше [60].
Діагностика ІБК:
Діагноз ставлять на
підставі епізоотичних даних, клінічних ознак у птиці, патологоанатомічних змін
та результатів лабораторних досліджень. Діагностика ІБК ускладнюється тим, що
гостра форма хвороби зустрічається рідко [13]. Зазвичай вона протікає в
асоціації зі СЗН, ІЛТ, мікоплазмозом, колібактеріозом, кокцидіозом.
Лабораторна діагностика
включає виділення та ідентифікацію вірусу на курячих ембріонах, дослідження
парних сироваток крові хворої та перехворілої птиці, проведення біопроби на 10
- 25-денних курчатах. У лабораторію для дослідження направляють 5 - 10 клінічно
хворих курчат, а також по 5 мл крові, взятої на 14-ту та 28-му добу
захворювання не менш ніж від 15 - 25 хворих та перехворілих курей.
Серологічні дослідження:
Серологічні дослідження
дають змогу швидко встановити діагноз, визначити ступінь поширення інфекції в
господарстві. Сироватки крові досліджують за допомогою реакції нейтралізації з
еталонними, адаптованими до курячих ембріонів вірусними штамами, також за
реакцією дифузної преципітації. Для індикації вірусу навколоплідну рідину
досліджують за РГА з 1%-ю суспензією курячих еритроцитів. З метою ідентифікації
та серотипування виділеного вірусу використовують найчастіше РЗГА.
Як і на кожен чужерідний
протеїн, кури реагують на місцеве інфікування вірусом ІБ або на вакцинацію
утворенням специфічних антитіл. Антитіла, що виробляються через вірус ІБ,
можуть складатися з трьох різних класів: IgМ, IgG і IgА, причому, перш за все,
мова йде про наявність антитіл класу IgG, які проявилися в сироватці або як
гуморальні антитіла [8]. Найвищі титри досягаються на 7-8 день після
інфікування і поступово знижуються, незалежно від того, чи відбудеться
вакцинація птахів. І коли ці антитіла присутні хоча б короткий час, їх
наявність дає можливість встановити діагноз, що встановився з результаті
інфікування вірусом ІБ. Рівні антитіл класу IgG, встановлені серологічними
методами (ELISА), можна виявити як мінімум через 7 днів після інфікування і
найвищі титри з’являються приблизно через 10-14 днів після інфікування.
Для ізолювання інфекції
з навколишнього середовища рекомендується використовувати принцип утворення
антитіл, причому для серологічного дослідження відбираються зразки в період
гострої фази захворювання (період інфікування) і в період реконвалесцентної
фази (3 тижні після інфікування), щоб за підвищеним рівнем одержаних антитіл
підтвердився хід місцевого інфікування [8]. В лабораторіях вимагається надання
зразків гострої і реконвалесцентної фаз в один день, для того, щоб можна було
провести тестування методом ЕLISA в той же самий день, коли досліджують
патогени, що викликають респіраторні захворювання. Серологічна лабораторія може
проводити серологічний тест тільки на наявність ІБ або провести «Респіраторний
профіль», який включає дослідження на вмістимість антитіл проти вірусу
захворювання Ньюкасла, пташиного енцефаломієліта і, можливо, проти Мусорlasmaa
gallinarum. Інтерпретація титрів антитіл повинна базуватись на даних інформації
про проведені вакцинації в виводку. Серологічні профілі завжди визначаються на
базі цілого стада, а не за результатами окремих особин. Дослідження повинні
завжди забезпечуватись репрезентативними зразками з цілого стада, тобто мінімум
від 20 особин. Також важливо завжди тестувати в один і той же час парні
сироватки [1].
Важливим для діагностики
ІБК моментом є ідентифікація серотипу віруса. У всьому світі відомо багато
серотипів ІБК. Ізоляти вірусних штамів класифікують як варіанти або мутації вакцинних
штамів, або йдеться про нові серотипи в пташиних виводках. Тому необхідно, щоб
діагностична лабораторія мала в наявності всі необхідні серотипи для проведення
серотипізаціі. Для цього використовують РН, РГГА або проводять типізацію з
моноклональними антитілами в ІФА [30]. При цьому слід враховувати, що антитіла,
які продукуються молодою птицею, більш специфічні. Серотип віруса встановлюють
також по його «протектотипу» в перехрестній РН на курчатах. В останні роки все
ширше використовують молекулярно-біологічні методи досліджень. Розроблено
систему індикації геному вірусу ІБК в різних біологічних системах за допомогою
полімеразної ланцюгової реакції. Геном вірусу ІБК вдається виділити із
заражених ембріонів і проб патологічного матеріалу [32].
Ізоляція вірусу ІБК:
Вірус ІБ можна ізолювати
прямо від хворих особин або від індикараторних кур, підданих контакту з
комерційними несучками або бройлерів. Зразки для ізоляції вірусу ІБ
відбираються, як тільки з'являються клінічні ознаки захворювання (кашель, чхання,
шуми в трахеї). У ветеринарну діагностичну лабораторію доставляють цілі тушки
загиблих особин (до 24 годин після смерті, охолоджені, але не заморожені) і
живих птахів (5 живих курчат як репрезентативний зразок проблематики, але не
обраних) [13]. Зразки тканин на дослідження, повинні бути передані в
лабораторію протягом 24 годин в охолодженій упаковці (на льоду). Щоб патогенний
штам вірусу ІБ ізолювався без домішок вакцинного штаму, рекомендується не
відбирати зразки протягом 3 тижнів після вакцинації живої IБ-вакциною [14]. Як
зразки для ізоляції вірусу відбирають легені, бронхи, гортань, трахею, нирки,
яйцепровід, лімфатичні вузли сліпої кишки і використовують їх для виділення
вірусу на курячих ембріонах та проведення біопроби. Сам відбір проводить ветлікар
або працівник діагностичної лабораторії. Оскільки вірус ІБ знаходиться в
кишковому тракті, то ізоляція вірусу з лімфатичних вузлів сліпої кишки можлива
через кілька тижнів після зникнення клінічних ознак. Після відповідної
підготовки патологічний матеріал інокулюють в алантоїсну порожнину 8 -
10-денних курячих ембріонів. Через 3 - 4 доби після зараження третину курячих
ембріонів охолоджують при 4°С, відбирають від них алантоїсну рідину та
хоріоналантоїсну оболонку, які використовують для наступних пасажів. Решту
ембріонів на 7 -8-му добу після зараження досліджують з метою виявлення
характерних макроскопічних змін - «карликовості» ембріонів: маса 8 -14 г.
замість 35 г.), зморщування, перекручування шиї, приклеювання лапок до голови,
згортання в клубок, потовщення амніона, утворення на поверхні оболонки
фібринозних плівок [1].
Проби, що мають вірус,
досліджують також під електронним мікроскопом, шукаючи частинки з морфологією,
типовою для коронавірусів. У заражених курчат через 18-36 годин з'являються типові
респіраторні ознаки. У сироватці крові через 4 тижні після інфікування птиці
отримують антитіла проти збудника ІБК. Зрізи або зіскрібки з трахеї або інших
тканин, узятих від загиблої птиці, можна досліджувати на наявність антигену
вірусу ІБК методами імунофлюоресценції або імунопероксидазним [17].
Біопробу проводять на 10
- 25-денних курчатах з благополучних щодо інфекційного бронхіту господарств.
Досліджуваний патологічний матеріал у дозі 0,2 - 0,3 мл вводять курчатам
інтратрахеально. Одночасно для контролю заражають перехворілих на інфекційний
бронхіт курчат. За наявності вірусу перші ознаки хвороби спостерігаються у
піддослідних курчат вже через 18 - 36 год після зараження: серозні виділення з
носа, хрипи, кашель, пригнічення, сонливість. Захворює від 10 до 100%
інфікованих курчат, загиблих серед них може й не бути. Через 7 діб курчат
розтинають для з’ясування патологоанатомічних змін. Виявлення характерних
патологоанатомічних змін в органах дихання дають підставу для встановлення
попереднього діагнозу.
Диференціальна
діагностика:
При встановленні
діагнозу на інфекційний бронхіт слід виключити ларинготрахеїт, респіраторний
мікоплазмоз, хворобу Ньюкасла, грип птиці і ряд інших захворювань, що
викликають ураження органів дихання у птахів.
Інфекційний ларинготрахеїт
(ІЛТ) - відрізняється від інфекційного бронхіту тим, що до ІЛТ найбільш
сприйнятливі птиці у віці 60-120 днів. При розтині трупів птиці, загиблої від
ІЛТ, виявляють крововиливи в слизовій оболонці трахеї та гортані [24]. Нерідко
відзначають геморагічні пробки в трахеї. У бронхах і в повітроносних мішках
патологічні зміни відсутні. У заражених ембріонів на хоріон-аллантоїсній
оболонці знаходять різної величини білуваті бляшки, але не виявляють
«карликовості» ембріонів, яка спостерігається при інфекційному бронхіті [15].
Вірус інфекційного ларинготрахеїту не викликає захворювання у курчат при
внутрішньом'язевому введенні і не нейтралізується сироваткою проти вірусу
інфекційного бронхіту.
Респіраторний
мікоплазмоз на відміну від інфекційного бронхіту протікає хронічно і частіше
вражає курчат 3-6-місячного віку і старше. При розтині птиці, полеглої від
мікоплазмозу, виявляють потовщення стінок повітроносних мішків і накопичення в
їх в порожнині щільних фібринозних мас жовтувато-білого кольору. При посівах на
спеціальні живильні середовища виділяють мікоплазму галлісептікум [12].
Курячі ембріони,
заражені мікоплазмою галлісептікум, нормально розвиваються, а їх
екстроембріональна рідина володіє гемаглютинуючими властивостями. У реакції
затримки гемаглютинації з екстраембріональною рідиною таких ембріонів виявляють
мікоплазмений антиген. Застосування препаратів тіланового ряду надає
лікувальний ефект, чого не спостерігається при інфекційному бронхіті.
Хвороба Ньюкасла швидко
поширюється і протікає гостро у птахів різного віку. Поряд з ураженням органів
дихання у хворої птиці спостерігаються і нервові явища. При розтині виявляють
катарально-геморагічне запалення слизової оболонки шлунково-кишкового тракту,
геморагічне кільце на ній при переході залозистого шлунка в м'язовий, крапкові
і полосчаті крововиливи в прямій кишці. Нерідко в тонкому відділі кишечнику
виявляють некротичні вогнища ураження слизової оболонки (бутони) [24].
Ембріони, заражені
матеріалом від хворих птахів, гинуть через 36-48 год вірус хвороби ньюкасла
птахів аглютинує еритроцити курей і легко ідентифікується за допомогою реакції
затримки гемаглютинації зі специфічною гіперімунною сироваткою.
Інфекійний риніт вражає
курчат 1-5-місячного віку. У хворих птахів не спостерігається ознак ураження
бронхів і легенів. При розтині виявляють скупчення слизу в носовій порожнині і
подглазнічних синусах, слизова оболонка носа гіперемійована і набрякла. Збудник
заразного нежитю викликає захворювання у курчат тільки при нанесенні його на
слизову оболонку верхніх дихальних шляхів, тоді як вірус інфекційного бронхіту
патогенєн при підшкірному та внутрішньом'язовому введеннях. При заразному
нежиті застосування сульфаніламідних препаратів дає позитивний лікувальний
ефект.
Інфекційна бурсальная
хвороба відрізняється блискавичним поширенням захворювання в групі птахів,
сильним водянистим проносом. Послід пінистий, жовтувато-білого кольору. При
розтині виявляється збільшення фабріцієвої сумки. Всередині неї знаходиться
сирниста маса, слизова оболонка сумки некротизована. У тонкому й товстому
відділах кишечника слизова оболонка почервоніла, потовщена і нерідко всіяна
крапковими крововиливами.
Грип вражає птахів в
основному у віці 120-150 днів і старше, рідше 30-50 днів. Летальність дорослої
птиці при грипі досягає 10-20%, чого не спостерігається при інфекційному
бронхіті курей [23].
При розтині загиблої
птиці знаходять катаральне запалення шлунково-кишкового тракту, переповнення
зоба рідиною і геморагічне запалення яєчника. При інфекційному бронхіті
відзначають атрофію яєчника.
Ембріони, заражені
патологічним матеріалом від хворої птиці, гинуть через 48-72 ч. При цьому тіло
ембріона гіпермійоване і набрякше. У екстраембріональній рідини виявляють
гемаглютинуючий вірус, який легко ідентифікується за допомогою реакції затримки
гемаглютинації (РЗГА) зі специфічними гіперімунними сироватками.
Віспа при атиповому
перебігу має подібну клінічну картину з інфекційним бронхітом. Однак віспа
вражає птахів різного віку. При віспі на слизовій оболонці язика, щік і гортані
знаходять невеликі діфтеричні плівки [24]. При зараженні курячих ембріонів
шляхом нанесення вірусовмістного матеріалу на хоріоаллантоїсну оболонку на
1-2-му пасажі виявляють білуватого кольору розлите потовщення аллантоїса на
місці аплікації матеріалу. При втиранні в пір'яні фолікули матеріалу від таких
ембріонів у курчат розвивається віспяний фолікуліт [49,24].
А-авітаміноз
супроводжується утворенням на слизовій оболонці стравоходу щільних
білувато-жовтуватих вузликів величиною від просяного до конопляного зерна; в
нирках виявляють зернисте переродження і сечокислі відкладення солей. Хвороба
не контагіозна [54]. Після введення в раціон вітаміну А кількість хворої птиці
швидко зменшується. Простудний нежить на відміну від інфекційного бронхіту
швидко припиняється при поліпшенні умов утримання птиці. Витіки з носової
порожнини завжди рідкі, а ураженням очей зазвичай характеризуються легким
серозним кон'юнктивітом. Хвороба не заразна, і при створенні сприятливих умов
утримання птиця швидко одужує.
1.2 Заходи з профілактики
та ліквідації інфекційного бронхіту курей
З метою охорони
господарств (ферм, відділень) від занесення збудника інфекції керівники
господарств, інших підприємств та організацій, які мають птицю, зобов'язані
виконувати вимоги, передбачені Законом України «Про ветеринарну медицину», і
дотримуватися вимог діючих ветеринарно-санітарних правил та інших
нормативно-правових актів. Спеціалісти ветеринарної медицини повинні
організувати в господарствах і населених пунктах, що знаходяться в зоні
обслуговування, систематичний нагляд за станом птиці та мати інформацію про
серологічний моніторинг щодо ІБК у молодняка та в батьківському стаді курей
[13].
З метою запобігання
занесенню збудника ІБК в птахогосподарства власники повинні виконувати такі
вимоги:
. Господарство повинно
працювати в закритому режимі.
. Комплектувати ферму,
майданчик, зону птицею одного віку і тільки з господарств, благополучних щодо
ІБК. Використовувати інкубаційні яйця для виводу молодняка тільки від клінічно
здорової птиці.
. Після ввезення курчат
у господарство проводити карантинні заходи згідно з діючими ветеринарними
вимогами.
. Дотримуватись
міжциклових профілактичних перерв між посадками птиці, проводити очищення і
дезінфекцію приміщень та обладнання.
. Проводити дезінфекцію
завезених з племінних господарств інкубаційних яєць методами і деззасобами,
прийнятими в країні, згідно з настановами, інструкціями щодо їх застосування.
Заходи при загрозі
виникнення захворювання:
. У загрозливих до
прояву ІБК господарствах птицю батьківського стада щеплюють інактивованою
вакциною, а сприйнятливий молодняк - живими вірус-вакцинами згідно з
інструкціями щодо їх застосування. При виборі вакцини слід ураховувати серотип
вірусу, що циркулює в даному регіоні, схему вакцинації погоджувати з головним
державним інспектором ветеринарної медицини району, міста, області [34].
. При підозрі на ІБК
лікар ветеринарної медицини вживає необхідних заходів щодо уточнення діагнозу.
З цією метою направляє на дослідження в лабораторію ветеринарної медицини свіжі
трупи або хвору птицю (5 - 10 голів) та 10 проб сироваток крові від птиці з
пташника, де виявлено хворобу.
. ІБК діагностують на
підставі епізоотологічних даних, клінічних ознак, результатів
патолого-анатомічного розтину та підтверджують серологічними і вірусологічними
дослідженнями. При цьому необхідно виключити інфекційний ларинготрахеїт, грип,
аденовірусну інфекцію (1 серотип), синдром зниження несучості.
Заходи щодо ліквідації
захворювання:
. При встановленні
діагнозу на ІБК керівники господарств незалежно від форм власності, спеціалісти
ветмедицини, які обслуговують ці птахогосподарства, негайно інформують про
захворювання головного державного інспектора ветеринарної медицини району,
міста, області.
. Господарство
(птахофабрику, ферму), у якому встановлено ІБК, оголошують неблагополучним і
вводять карантинні обмеження, при яких забороняється:
а) вивіз інкубаційних
яєць і ембріонів у благополучні господарства, а також в науково-дослідні
установи та інші організації;
б) вивіз живої птиці в
інші господарства та продаж її населенню;
в) переміщення птиці,
кормів та господарчого інвентарю з неблагополучного пташника в інше приміщення,
де утримується здорова птиця;
г) увіз сприйнятливої до
інфекційного бронхіту птиці з інших господарств, ферм, пташників;
ґ) відбір сперми від
півнів-плідників при штучному заплідненні батьківського стада.
. У неблагополучних
господарствах батьківське стадо щеплюють інактивованою вакциною, а
сприйнятливий молодняк - живими вірус-вакцинами проти ІБК згідно з інструкціями
щодо їх застосування і даними серологічних і вірусологічних досліджень, які
аналізує і контролює головний державний інспектор ветеринарної медицини району,
області.
. При виникненні
захворювання у молодняка товарних господарств проводять вибраковку хворої та
некондиційної птиці, яку переробляють на м'ясо-кісткове борошно з наступним
його знищенням. Решта птахомолодняка щеплюється вірус-вакцинами згідно з
інструкціями щодо їх застосування.
. У бройлерних
господарствах весь санітарний брак утилізують, кондиційну хвору птицю відправляють
на промислову переробку. Умовно здорову птицю після закінчення технологічного
циклу направляють на забій без обмежень.
. При виявленні ІБК у
племінних господарствах хвору дорослу птицю відправляють на забій, а умовно
здорову використовують для отримання товарного яйця з наступним забоєм птиці.
Так чинять з батьківським стадом у товарних господарствах.
. Реалізацію яєць з
неблагополучного пташника допускають після дезінфекції парами формальдегіду або
іншими дозволеними деззасобами, безпосередньо перед вивезенням з господарства і
тільки для промпереробки (яєчний порошок), з умовно благополучних пташників або
від перехворілої птиці - для харчових потреб.
. Тушки забитої птиці з
неблагополучних пташників направляють на промислову переробку в межах адміністративного
району. Тушки курей з благополучних пташників реалізують на загальних
підставах.
. Пух і пір'я, отримані
під час забою хворої або підозрілої на захворювання птиці, просушують у
спеціальних установках при t 85 - 90° C протягом 15 хвилин або дезінфікують
шляхом занурення у 3%-ний розчин формальдегіду при t 45 - 50° C з експозицією
30 хвилин, висушують та вивозять на пухопереробні підприємства в тарі з
подвійною упаковкою, із зазначенням у ветеринарному свідоцтві про
неблагополуччя господарства щодо ІБК.
. Інкубація яєць,
отриманих від птиці благополучних пташників, дозволяється в інкубаторах
господарства після дворазової дезінфекції (перед закладкою в інкубатори -
парами формальдегіду з розрахунку на 1 м3 об'єму камери 30 - 45 мл
формаліну, 25 - 30 г. марганцевокислого калію, 30 - 45 мл води протягом 30
хвилин і при виводі курчат - 40%-ним формальдегідом, розведеним водою у
співвідношенні 1:1). Одержаний молодняк можна використовувати в господарстві
для внутрішньогосподарських потреб.
. Відходи інкубації
утилізують або знищують.
. Дезінфекцію повітря в
присутності птиці проводять через кожні 5 діб до закінчення технологічного
процесу і зняття карантинних обмежень, парами молочної кислоти,
триетиленгліколю, резорцину та іншими дозволеними деззасобами. Інвентар
дезінфікують щоденно шляхом занурення на 5 - 10 хвилин у кип'ячий 2%-ний розчин
кальцинованої соди. Після дезінфекції його просушують, потім ретельно змивають
водою і знову просушують.
. Після закінчення
технологічного процесу та звільнення приміщень від птиці проводять вологу
дезінфекцію, послід та підстилку збирають, вивозять та біотермічно
знезаражують. Увесь інвентар спочатку зрошують дезінфекційним розчином, а потім
очищають від пуху, посліду та сміття. Стіни, стелі, сідала, гнізда обмітають щітками
або мітлами, змоченими у дезінфекційному розчині. Після цього все приміщення,
клітки, сідала, підлогу ретельно обмивають гарячим 2%-ним розчином
кальцинованої соди, після чого проводиться у всіх виробничих приміщеннях
дератизація, дезінсекція та завершальна дезінфекція.
Спочатку в пташниках
проводять вологу дезінфекцію гарячим 2%-ним розчином каустичної соди або 2%-ним
розчином формальдегіду, територію й інші приміщення дезінфікують 3%-ним
розчином каустичної соди.
Після вологої
дезінфекції приміщення білять, а потім проводять аерозольну завершальну
дезінфекцію парами формальдегіду з розрахунку 30 мл на 1 м3 при
експозиції 3 години. Аерозольну дезінфекцію в приміщенні проводять при t 15 -
20°C, вологості 70%.
Очищенню та дезінфекції
підлягають усі вигульні майданчики, які обробляють суспензією хлорного вапна,
із вмістом не менше 5% активного хлору, із розрахунку 5 л на 1 м2
площі.
. Карантинні обмеження з
господарства знімають після забою усієї перехворілої і клінічно здорової птиці,
яка перебувала в приміщеннях на одному майданчику з хворою птицею, та після
проведення комплексу санітарних заходів.
. Перед зняттям
карантинних обмежень державна лабораторія ветеринарної медицини району здійснює
контроль за якістю дезінфекції та видає відповідний висновок.
. Господарство
оголошують благополучним щодо ІБК через 3 місяці після останнього випадку
виявлення хворої птиці.
Керівники, працівники
господарств, ферм, орендарі, які допустили порушення карантинних обмежень та
інших ветеринарно-санітарних правил, визначених інструкцією, несуть
відповідальність згідно з чинним законодавством [13].
1.3 Епізоотичний та серологічний моніторинг
Епізоотичний моніторинг
- це виявлення та кількісне визначення параметрів розповсюдження збудників
хвороб тварин на території моніторингу, визначення умов, що сприяють і
перешкоджають поширенню заразних хвороб тварин, їх збудників. Результати
епізоотичного моніторингу є основою для прогнозування розвитку епізоотичної
ситуації; розробки комплексу заходів щодо обмеження поширення збудників
заразних хвороб тварин; визначення епізоотичного статусу України в цілях
міжнародної торгівлі та перевезень, в цілях внутрішньої торгівлі та перевезень;
компартментов, в яких здійснюється утримання тварин, їх забій, переробка
продукції тваринного походження з метою безпечного здійснення господарської
діяльності в умовах поширення і загрози розповсюдження заразних хвороб [8].
Результати
епізоотологічного моніторингу та прогнозування є основою для розробки планів
протиепізоотичних заходів. Епізоотичний моніторинг проводиться шляхом збирання
інформації про результати заходів по здійсненню діагностичних і клінічних
досліджень, ветеринарно-санітарної експертизи, проведення протиепізоотичних
заходів, екологічних та біологічних досліджень навколишнього середовища, а
також організації і здійснення спеціальних моніторингових програм, пов'язаних з
відбором проб зовнішнього середовища, біологічного та патологічного матеріалу,
продукції тваринного походження з їх подальшими дослідженнями методами
лабораторної діагностики та іншими методами, що дозволяють виявляти збудників
заразних хвороб, специфічні антитіла до них [45].
Регіоналізація
представляє собою поділ території України на регіони, щодо яких встановлено або
передбачається на основі даних епізоотичного моніторингу певний рівень ризику
розповсюдження заразної хвороби або певний статус у відношенні наявності та
поширення хвороби. Статус регіону щодо наявності та поширення хвороби
встановлюється як:
. регіон, вільний від
даної хвороби без вакцинації,
. регіон, вільний від
даної хвороби з вакцинацією,
. регіон з невизначеним
статусом у відношенні даної хвороби,
. регіон неблагополучний
щодо даної хвороби,
. регіон стаціонарно
неблагополучний по даній хворобі.
Рівень ризику щодо
наявності та поширення хвороби встановлюється як
. регіон з незначним
рівнем ризику,
. регіон з низьким
рівнем ризику,
. регіон з
контрольованим рівнем ризику,
. регіон з високим
рівнем ризику.
На підставі даних
моніторингової програми, даних епізоотологічного аналізу та прогнозування
ветеринарного нагляду, одержуваних з Українських, зарубіжних і міжнародних
джерел, ведеться карта регіоналізації території України. На даних
регіоналізації засновані спеціальні режими здійснення господарської діяльності,
спеціальних профілактичних, діагностичних та моніторингових заходів, процес
сертифікації тварин, кормів для тварин та продукції тваринного походження для
їх перевезення за межі регіону [8].
Серологічний моніторинг
є важливим інструментом розробки і підтримки ефективних програм вакцинацій.
Його мета - уявлення інформації про імунний статус птахів, базуючись на якій,
підприємство може прийняти ефективні заходи щодо забезпечення здоров'я
птахопоголів’я. Моніторинг допомагає здійснити ранню діагностику захворювання
для ідентифікації та обмеження дії чинників, що викликають збитки у
виробництві. Завдяки моніторингу та ранньому виявленню захворювань можна
знизити виробничі витрати за допомогою підвищення ефективності програм
вакцинації та мінімізувати збитки від хвороб [19].
Моніторинг племінної
птиці проводиться у встановлені моменти після первинної і вторинної вакцинації.
Первинну відповідь антитіл в сироватці крові птиці після контакту з інфекційним
агентом або вакцинації можна виявити вже через 7-10 днів, і зазвичай вони
досягають піку протягом 2-3 тижнів. Рівень антитіл звичайно знижується через
кілька днів після піку, оскільки патоген інактивується і виводиться. Вторинна
імунна відповідь настає швидше після вторинного зараження або ревакцинації, ніж
при першій відповіді. Зазвичай рівень антитіл при вторинній відповіді
знижується повільніше протягом більш тривалого часу [45]. Правильно проведена
первинна вакцинація дуже важлива для одержання високих і стійких титрів
протягом продуктивного циклу. Однак сам факт використання ефективних вакцин не
є гарантом захисту поголів'я від вірусних хвороб. Важливу роль у профілактиці
цих хвороб відіграє схема використання вакцинних препаратів. Комбіноване
застосування живих та інактивованих вакцин дозволяє поєднати в собі всі їхні
переваги і переслідує дві важливі мети - як захист курей від вірусних хвороб
протягом усього життєвого циклу, так і створення напруженого і тривалого
імунітету у курчат, які були отримані від цих курей [47]
1.3.1 Серологічний
моніторинг як засіб збільшення ефективності застосування вакцин в промисловому
птахівництві
Незважаючи на те, що
традиційні імунологічні методи як і раніше широко використовуються у
ветеринарній практиці, метод імуноферментного аналізу зайняв провідне місце при
проведенні рутинних досліджень. Використання даних серології, отриманих за
допомогою методу ELISA, в системі організації здоров'я птиці було повсюдно
прийнято для багатьох захворювань, включаючи інфекційний бронхіт (ІБК).
Серологія є корисним інструментом для відстеження імунної відповіді після
вакцинації і для постановки діагнозу [59].
Переваги ІФА як методу
полягають у швидкості постановки, чутливості, специфічності, безпеки,
можливість автоматизації процесу. Комерційні набори для ІФА знайшли широке
застосування в національних програмах боротьби з інфекційними хворобами птахів
у багатьох країнах Західної Європи і Америки. Найбільшими фірмами - виробниками
імуноферментних наборів для діагностики хвороб птахів являються: IDEXX (США),
Synbiotics, Guildhay (Великобританія), Biochek (Голландія). Застосування
вимірювального обладнання, зокрема, спектрофотометрів для зчитування значень
оптичної щільності в мікропланшетному форматі, дозволило розробити методологію
тестування великої кількості проб сироваток одночасно проти декількох
антигенів. Це, в свою чергу, призвело до створення і впровадження у ветеринарну
практику спеціалізованих комп'ютерних програм не тільки для перекладу оптичної
щільності в числове значення точного титру, але і для автоматичної обробки,
зберігання та створення баз даних [2].
Імуноферментний аналіз, або
ІФА (англ. Enzyme-Linked ImmunoSorbent Assay, ELISA) - це лабораторний
імунологічний метод якісного визначення і кількісного виміру антигенів, а також
імуноглобулінів і гормонів.
Метод імуноферментного
аналізу (ІФА) дає можливість визначення антитіл (IgG, IgA, IgM) до збудників
інфекції в крові. Ці антитіла виробляються організмом у відповідь на
інфікування. Завдяки тому, що імуноглобуліни різних класів виробляються в
певній послідовності, за допомогою ІФА можна діагностувати інфекцію на різних
стадіях, і відслідковувати динаміку розвитку процесу. Антитіла виявляються при
взаємодії із спеціальними препаратами, що містять відповідні антигени, що
утворюють з антитілами міцний комплекс [6]. В основі методу лежить принцип
взаємодії імуносорбент - антигену збудника інфекції з антитілами, що
визначаються. В залежності від того, які антитіла використані, тест-система
буде виявляти в досліджуваному зразку або специфічні антитіла незалежно від їх
класу, або антитіла тільки певного класу. Матеріалом для дослідження служить
сироватка або плазма венозної крові [5].
Доцільність застосування
ІФА:
Іноді захворювання
виникають навіть у вакцинованого поголів'я птахів. Причиною цього може бути
якість застосованого препарату. Але найчастіше, інфікування імунізованих птиці
виникає через некоректне поводження з вакциною або похибки в її застосуванні.
Оцінка якості проведення вакцинації є найбільш важливим фактором, особливо при
роботі з живими вакцинами проти респіраторних захворювань птахів, наприклад,
таких як ІБК. При використанні техніки масової імунізації (випоювання та
аерозольне застосування) практично неможливо забезпечити ефективною дозою 100%
прищеплюваних птахів. Проведений поствакцинальний ІФА-моніторинг може виявити
похибки в техніці виконання робіт і вказати на необхідність проведення
своєчасного коригування вакцинації в разі її неефективності. В такому аспекті
серологічні дослідження можуть розглядатися як контроль якості проведених в
птахівничому господарстві профілактичних заходів. З цього випливає висновок про
необхідність використання ІФА-моніторингу для планування заходів з метою
отримання належних результатів. Без висновку за результатами ІФА неможливо
поліпшити, оптимізувати і зберегти ефективність вакцинації.
Інтерпретація
результатів ELISA для вірусу інфекційного бронхіту:
Для того щоб успішно
інтерпретувати результати ELISA після серологічного моніторингу вакцинованих
стад, повинні бути дотримані наступні умови:
В лабораторії слід
використовувати зовнішні референтні контролі, щоб мати додаткову гарантію відтворюваності
і точності результатів і забезпечити правильну інтерпретацію. Без референтних
контролів, у разі отримання аномальних титрів, ми не знаємо, або це результат
помилок при проведенні процедури тесту, або це фактичне віддзеркалення імунного
статусу птахів в польових умовах [52]. Перед проведенням аналізу необхідно мати
уявлення про те, який результат є очікуваним (базисний рівень титрів для
успішної вакцинації). Це дозволить легше інтерпретувати результати, порівнюючи
з базисним рівнем, і легко судити про успішність програми вакцинації. Також
необхідно мати уявлення про те, які дії слід зробити, якщо результати не
відповідають очікуваним [29].
На практиці
інтерпретація результатів вакцинації зазвичай проводиться шляхом оцінки трьох
основних компонентів гуморальної відповіді після введення вакцини, якими є:
Інтенсивність відгуку,
на що вказує значення середнього титру. Чи розвиваються у птахів рівні титрів в
очікуваному діапазоні (базисний рівень) для застосованої вакцини? Ці титри
базисного рівня можуть варіювати в залежності від типу птиці, віку, типу
вакцини, програми вакцинації і т.д. У кожному конкретному випадку слід
розробити власні базисні рівні для своїх програм вакцинації та умов на місці.
Базисні рівні (середній титр) можуть варіювати в залежності від використаних
вакцинних штамів [22]. Застосування відносно м'яких вакцин Н120 буде давати
значно менші титри в порівнянні з відповіддю, отриманою після застосування
більш імуногенних вакцинних штамів, таких як IB 4/91 [26].
Однорідність відгуку вказує%
CV (коефіцієнт варіації) на якість доставки вакцини кожній птиці. Також
потрібно мати на увазі, що використання живих вакцин проти респіраторних
захворювань на зразок ІБК, генерує в цілому неоднорідний відгук у титрах.
Горизонтальне поширення вакцинного вірусу серед стад може бути обмеженим, а
крім цього, живі ІБК вакцини можуть також давати місцевий імунний відгук, який
не можна виміряти за допомогою методу ELISA. Тому в разі застосування таких
живих вакцин, як вакцина Н120 очікуваний СV для хорошої вакцинації буде
складати 40 -70%. Значення CV на рівні <30% після вакцинації вакциною Н120
слід розглядати, як підозра зараження. Однак, при використанні в програмі
вакцинації більш імуногенних вакцин, на зразок штаму 4/91, значення CV нижче
45% не є рідкісними.
У разі племінного
поголів'я або курей-несучок, де перед інактивованою вакциною застосовується
цілий ряд вакцинацій за допомогою живих вакцин, повна сероконверсія (100%
птахів позитивні) є більш важливим критерієм успіху, ніж тільки один показник%
CV. Було продемонстровано, що хороше праймування живими вакцинами перед
інактивованою надає сильний і сприятливий вплив на величину і стійкість титрів
протягом усього періоду продуктивності. Слід перевірити, чи є всі птахи (100%)
серопозитивними [33].
Тривалість відгуку, на
що вказує середній титр в залежності від часу. Чи достатньо довго зберігаються
титри в часі? Чи необхідна ще одна вакцинація з метою форсування підйому титрів
вище мінімальних захисних рівнів або для додавання місцевої захисту?
Як уже згадувалося,
існує чіткий зв'язок між титрами отриманими після живих вакцин і стабільністю
титрів в ході продуктивного періоду племінного поголів'я та курей-несучок після
вакцинації інактивованою вакциною. Гарне праймування (позитивні й однорідні
титри) перед застосуванням інактивованої вакцини призведе до більш стабільних і
високих титрів протягом продуктивного періоду. І, навпаки, слабкі титри після
праймування (низькі, неоднорідні титри з високим відсотком негативних
результатів) призведуть до високих титрів на початку періоду продуктивності та
до низьких титрів в середині і наприкінці періоду яйцекладки. В цілому, титри
ІБК мають тенденцію до меншої стабільності протягом періоду продуктивності в
порівнянні з титрами до хвороби Гамборо і хвороби Ньюкасла. Дійсна причина
такої нестабільність залишається невідомою, проте вона лише підкреслює
необхідність відстеження титрів ИБК в критичних точках з метою визначення того,
чи не слід провести додаткову вакцинацію з метою стимуляції підйому понижаємих
титрів.
Ще одним фактором, що
визначає успіх інактивованої вакцини, є рівень антитіл в момент введення.
Високі титри антитіл в момент застосування можуть перешкодити серологічному
відгуку на інактивовану вакцину. Така ситуація, зокрема, була помічена після
застосування більш імуногенних вакцин, на зразок 4/91, незадовго до вакцинації
інактивованою вакциною курей-несучок і племінного поголів'я. Прикладом такої
програми може бути ситуація, коли племінне поголів'я вакцинують у період
вирощування з застосуванням стандартних живих вакцин типу Н120 і МА5 після чого
слідує вакцинація за допомогою IBV4/91 у віці 10-15 тижнів і, нарешті,
вакцинація інактивованою вакциною проти ІБК у віці 18 тижнів. При застосуванні
такої програми часто відзначається зниження титрів антитіл при тестуванні
зразків сироватки у віці 24 тижні, а не підйом титрів, як це має місце у
випадку застосування програми вакцинації без вакцини 4/91 [22].
Успіх чи невдача
вакцинації:
Індикаторами успішної
вакцинації зазвичай є високі однорідні і тривало титри, що знаходяться в
очікуваному діапазоні для даного типу вакцини. Ці зразки повинні бути 100%
позитивними [26].
Індикатори поганого
результату вакцинації в цілому є протилежними: тобто, титри нижче очікуваних,
неоднорідні і недовговічні. Титри «нижче базисного рівня» зазвичай
супроводжуються деякою кількістю негативних результатів - від помірного до
високого ступеня. Моніторинг ІБК з певними інтервалами у курей-несучок і
племінного поголів'я особливо корисний для раннього виявлення невдалої
вакцинації. Негайна ревакцинація відразу після виявлення невдалої вакцинації
сприятиме запобіганню втрат продуктивності в майбутньому. Таким чином,
відстеження результатів вакцинації має профілактичну природу що є важливим у
плані економічного обґрунтування застосування програм моніторингу [29].
У випадку прояву
польового зараження ІБК, моніторинг також сприятиме забезпеченню ранньої
діагностики захворювання з метою обмеження причин втрат продуктивності.
Діагностика польового
зараження ІБК:
Діагноз можна поставити
комплексною оцінкою історії стада, клінічних ознак, серології, а також ізоляції
та ідентифікації патогена. Серологічний моніторинг особливо корисний для
встановлення часу появи і характеру польовий інфекції [17].
Для невакцинованих стад
присутність польового зараження ІБК може бути легко продемонстровано позитивної
серологією ІБК. Однак для ІБК вакцинованих стад ідентифікація польового
зараження скрутна і вимагає знання очікуваних титрів після вакцинації (базисний
рівень). Кожен користувач системи ELISA повинен розробити свої власні базисні
рівні титрів в залежності від: програми вакцинації, специфіки використовуваних
вакцин та виду птахів. Ці дані в поєднанні з періодичним аналізом серологічного
профілю стад, тобто серологічної історії, дозволяють визначити чи є серологічні
результати нормальними або аномальними. Несподіваний підйом титрів, що значно
перевищує очікувані титри після вакцинації, може вказувати на присутність
польового зараження. Однак слід підкреслити, що титри самі по собі не можуть
використовуватися для постановки діагнозу. Діагностику слід проводити на основі
комплексної оцінки результатів серології, клінічної симптоматики, а також
ізоляції патогена. До тих пір, поки не буде поставлений діагноз, рекомендується
використовувати поняття «підозра на інфекцію», замість терміна «інфекційні
титри» [7].
Ідентифікація IBV
інфекції:
У разі аномально високих
ІБК титрів слід враховувати три ключові критерія, які повинні виконуватися для
того, щоб зробити висновок, що отримана серологія - результат зараження IBV:
Середній титр після
інфекції повинен бути значно підвищений. Звичайним правилом є те, що середній
титр після інфекції, повинен, щонайменше, в два рази перевищувати рівень, який
є очікуваним після вакцинації, або повинен хоча б у два рази перевищувати
середній рівень титрів до інфекції [33].
Значення CV повинні бути
знижені. Коефіцієнт варіації (CV) повинен бути значно нижче рівнів, які є
очікуваними після вакцинації, або значно нижче рівнів CV до інфекції.
Наприклад, якщо і вакцинуються курчата-бройлери двічі за допомогою вакцини
Н120, очікуваний CV знаходиться в діапазоні 50 - 80%. Якщо після вакцинації ми
отримуємо значення CV на рівні 35%, то це є вказівкою на аномальний відгук
[26].
Клінічні ознаки повинні
відповідати серології якщо серологія IBV підвищена, але клінічні ознаки
відсутні або не узгоджуються з інфекцією IBV, тоді просто не можна буде
підтвердити інфекцію IBV [17].
Ускладнені IBV інфекції:
Незважаючи на те, що в
разі прояву респіраторних ознак можна підозрювати інфекцію IBV, рекомендується
також провести тестування інфікованих птахів на предмет присутності інших
респіраторних патогенів з двох причин:
Інфекції IBV часто
відбуваються в поєднанні з іншими респіраторними патогенами, зокрема, вірусом
пташиного ринотрахеїта (ART) (відомий також, як пташиний пневмовірус (APV),
Ornithobactenum rhinotracheale (OR), Mycoplasma gallisepticum (MG) і Mycoplasma
synoviae (MS). Ускладнені інфекції можна діагностувати лише шляхом перегляду
всієї серологічної картини. Тестування тільки на IBV не вкаже на взаємодіючі
патогени респіраторної хвороби [4].
Серологія після
респіраторних вакцин типу IBV і NDV часто аномально спотворюється через
пошкодження, присутніх після респіраторного зараження (трахеїту або
аеросакуліту). Ці ушкодження роблять можливим більш активний контакт і
проникнення вакцинного вірусу в рецепторних місцях, що призводить в результаті
до підвищеної в порівнянні з нормою серології після застосування живих вакцин
IBV і NDV. Це є однією з причин частої помилкової діагностики інфекції
пневмовірусами (ART), як інфекції IBV, якщо оцінювати тільки серологію IBV.
Аналіз всієї
серологічної картини дозволяє побачити характер взаємодії з іншими
респіраторними агентами, що дозволяє належним чином поставити діагноз
ускладненої інфекції [50].
Часто прийняття до уваги
ключових критеріїв при визначенні інфекції (як описано вище) допомагає
виключити «ефект ураженої трахеї»: як правило посилені реакції на вакцину не
приводять до подвоєння очікуваних середніх титрів або значного зниження
коефіцієнта варіації (% CV).
Основна перевага
серологічного моніторингу інфекційного бронхіту за допомогою ELISA полягає в
удосконаленні методики введення вакцини і підвищення її ефективності, а також
негайної діагностики захворювання з метою ідентифікації причин виробничих
втрат.
Ключовим пунктом
застосування програми моніторингу є те, що в залежності від отриманих
результатів слідують певні дії. Прийняття негайних відповідних заходів є дуже
важливим для обмеження та запобігання подальших економічних втрат. Якщо
результати вакцинації є незадовільними, це дозволить провести повторну оцінку
процедур вакцинації проти IBV і здійснити коригувальні дії. Це робить
регулярний моніторинг економічно ефективним профілактичним засобом. Підвищення
ефективності застосування вакцини приведете в результаті до більш ефективного
контролю над захворюванням і підвищенню продуктивності стад.
Вивчаючи джерела
літератури можна зробити висновок, що інфекційний бронхіт курей може наносити
значних економічних збитків промисловим та фермерським господарствам за рахунок
гибелі молодняка, зниження яєчної й м’ясної продуктивності, зниження якості
тушки - у бройлерів, зниження резистентності організму і затримки росту
перехворілої птиці. Це веде до висновку, що оптимізації схем
вакцинопрофілактики ІБК є необхідною для забезпечення ефективного захисту птиці
від хвороби.
Не
дивлячись на широке використання вакцин проти інфекційного бронхіту, контроль
захворювання ускладнюється із-за циркуляції епізоотичних штамів вірусу
інфекційного бронхіту, які антигенно відрізняються від вакцинних штамів, так як
перехрестний захист між ними відсутній. Тому постійний моніторинг штамів
інфекційного бронхіту є єдиним методом вирішення проблеми.
2. Напрями та методи
досліджень
2.1 Матеріали і методи
дослідження
Матеріалом для
дослідження були статистичні данні МЕБ, матеріали звітів центральної державної
лабораторії ветеринарної медицини, департаменту ветеринарної та фітосанітарної
служби України та данні власних досліджень проведених вакцинацій в НДППЗ ім.
Фрунзе.
Методи
дослідження - епізоотологічний аналіз, серологічні дослідження.
Було проведено вивчення
еволюції штамів інфекційного бронхіту, аналіз специфічної імунопрофілактики та
схем вакцинації проти інфекційного бронхіту курей в Україні.
При проходженні
виробничої практики в НДППЗ ім. Фрунзе було проведено визначення ефективності
вакцинації проти інфекційного бронхіту курей вакциною Nobilis 4/91 на курчатах
10 денного віку в кількості 5635 голів за допомогою інтепритатації результатів
ІФА досліджень.
2.2
Характеристика бази виконання роботи
Навчально-дослідний
племінний птахівничий завод ім. Фрунзе НАУ розміщений в степовій частині Криму.
Західна частина землеволодінь омивається водами Чорного моря. Землеволодіння
господарства складають єдиний масив. Загальна площа сільськогосподарських угідь
- 3019 га, з них: пасовища 124 га, господарські застройки 87 га, насадження 70
га, інше 94 га, застройки 71 га, під водою 128 га, дороги 69 га. Повна адреса
підприємства: Автономна Республіка Крим, Сакський район, с. Фрунзе, вул.
Гагарина 4.
Центральна
садиба с. Фрунзе знаходиться в 4 км. Від автодороги Євпаторія - Севастополь і в
2 км від Чорного моря. Територія розташована на пологому складному плоскому
плато, яке розділяє басейни озер Кизил - Яр і Багайли. Південна частина села
лежить на схилі балки.
На
північно - західному кордоні землекористуванні розташоване озеро Кизил - Яр
площа якого 690 га. На території землекористуванні знаходиться озеро Багайли
загальною площею 14 га. Це озеро відділяє від Чорного моря полоса суходолу
шириною 65 м і довжиною 1300 м. Обидва озера збагачені лікувальними грязями.
Характеристика
господарської діяльності НДППЗ ім. Фрунзе:
Навчально-дослідний
племінний птахівничий завод імені Фрунзе Національного аграрного університету
(НДППЗ ім. Фрунзе НАУ) являється єдиним підприємством в Україні, яке має
прабатьківське, а також батьківське стадо кросів Хайсекс Білий та Хайсекс
Коричневий, завезених у серпні 2003 року та у вересні 2004 року від компанії
Hendrix Poultry Breeders BV (Нідерланди). Підприємство технологічно пов’язане з
навчальним процесом у системі підготовки спеціалістів сільського господарства,
інших галузей агропромислового комплексу і створене з метою практичного
навчання студентів НАУ виробничій і комерційній діяльності, забезпечення
навчально-науковим структурним підрозділам НАУ умов для проведення наукових
досліджень, проведення виробничої перевірки та впровадження наукових розробок у
виробництво. Але основним напрямком діяльності НДППЗ ім. Фрунзе є виробництво
племінної продукції птахівництва, що складає 77% від загального об’єму
реалізованої товарної продукції. Племінне молочне скотарство складає 14%. Інша
продукція тваринництва 0,8%. Вирощування зернових та кормових культур для
кормової бази племзаводу 1,8%. Надання послуг на базі відпочинку та
культурно-спортивного комплексу 2,8%. Рішення соціальних питань мешканців с.
Фрунзе 3,6%. В таблиці №2.1 представлені показники кількості поголів’я тварин в
НДППЗ ім. Фрунзе.
Таблиця
2.1. Кількість поголів’я тварин в НДППЗ ім. Фрунзе
|
Поголів’я птиці
|
203930 гол.
|
|
Поголів’я курей-несучок
|
108304 гол.
|
|
Поголів’я ВРХ
|
864 гол.
|
|
Поголів’я корів
|
435 гол.
|
Данні
таблиці демонструють високий рівень і об’єм ведення тваринництва в різних
напрямках. Але одна, сама найважливіша галузь в господарстві, що приносить
основний дохід - це птахівництво. Показники племінного птахівництва
представлені в таблиці 2.2
Таблиця
2.2. Показники племінного птахівництва
|
Валове виробництво яєць
|
39,2 млн. шт.
|
|
Отримано яєць не середню
курку-несучку
|
320,1 шт.
|
|
Реалізація добових курчат
|
8500 тис. шт.
|
|
Реалізація курчат дорощування
|
231,1 тис. шт.
|
|
Реалізація племінного
інкубаційного яйця
|
1500 тис. шт.
|
Данні
таблиці №2.2 свідчать про високий рівень реалізації курей кросів Хайсекс Білий
та Хайсекс Коричневий, що засвідчує значний попит на продукцію і підтверджує
якість перевірену роками.
Підприємство
є виконавцем державної програми селекції в тваринництві та птахівництві, має
статуси племінного птахорепродуктора I та II порядку по розведенню яєчних курей
кросу Хайсекс Коричневий та Білий, а також племінного репродуктора по
розведенню корів української червоної породи голштинозованої, займає біля 30%
ринку України по реалізації добових курчат. Господарство забезпечує робочими
місцями 480 працівників, не має заборгованості по податкам та заробітній платі.
Середньомісячна заробітна плата за 2012 рік склала 2640 грн.
3. Результати
експериментальних досліджень
.1 Еволюція штамів
інфекційного бронхіту курей
Незважаючи на практично
повсюдне проведення вакцинації, інфекційний бронхіт курей (ІБК) залишається
серйозною проблемою для країн з промисловим птахівництвом. На сьогоднішній день
ІБК - найбільш важливе ендемічне вірусне захворювання, що заподіює величезний
економічний збиток, через зниження якості продукції, що приводить до великих
втрат у виробництві.
Вірус інфекційного
бронхіту курей - пташиний коронавірус, має яскраво виражену генетичну
мінливість, обумовлену властивостями мутацій і рекомбінації. Вона проявляється
наявністю багатьох серотипів і появою нових антигенних варіантів вірусу, що
значно ускладнює здійснення програм контролю захворювання за допомогою
вакцинації через антигенну мінливість збудника і низьку ступінь перехреснго
захисту між серотипами вірусу.
Проведений нами аналіз
результатів авторських досліджень, засвідчує, що до теперішнього часу вже
ідентифіковано понад 50 серотипів, які умовно можна розділити на три групи:
американські, європейські, австралійські. До основних американських серотипів
відносяться такі, як Massachusetts, Connecticut, Iowa 97 і Iowa 609, Gray,
Holte, SE 17, Arkansas, California, Florida, варіанти a, b, с, d, e, f,
Delaware, PP14. Європейські серотипи - A (Mass), В (D207), С (D212), D (D3128),
Е (D3896), UK7918/67, UK/82, UK/84, UK/86, 793 / B. Австралійські серотипи - A
(Vac-1), В (Ql/76), С (N1/62), D (N9/74), E (Ql/73), F (V2/71), G (Vl/71), H
(N1/75), I (N2/75), J (N3/62), К (Tl/82), L (N1/88), M (Q3/88), N (N25/87), О
(V18/91).
Вірус інфекційного
бронхіту курей вперше виділили Біч і Шалкія в США в 1936 р. Ідентифікували
вірус в Європі (Англія) в 1948 р. Серологічну відмінність між окремими штамами
вірусу інфекційного бронхіту було встановлено в 1956 р. Спочатку розрізняли два
серотипу вірусу. Першим був визначений серотип Массачусетс, прототипом якого
був вірус інфекційного бронхіту, виділений VanRoekel в 1942 р. в університеті
штату Массачусетс. Протягом багатьох років серотип Massachusetts вважали єдиним
серотипом вірусу ІБК, наявними в Європі. Другим серотипом вірусу інфекційного
бронхіту з'явився Коннектикут, виділений Е. Z. Jungheretal в 1951 р. в штаті
Коннектикут. Однак, в 1980-і роки в Нідерландах була показана можливість появи
спалахів захворювання в стадах птиці, вакцинованої проти ІБК вакцинами з штамів
Н-120 і Н-52 серотипу Massachusetts. Було встановлено зв'язок цих спалахів з
новими серотипами віруса ІБК: D207 (D274), D212 (D1466), D3128, D3896, що
відрізнялися від звичайних американських серотипів. Початок 1990-х років було
відзначено появою нового серотипу вірусу 798 В (4/91), який на сьогодні
поширився практично по всьому світу, за винятком США і Австралії. Штам
Італія-02 вперше з'явився в Європі в 2000 році, і вже в 2002 році у 75% всієї
птиці з клінічними ознаками ІБ в Західній Європі діагностували зараження штамом
Італія-02. До 2006 року ситуація дещо змінилася, частка штаму Італія-02
скоротилася до 10%, а більшу половину зайняв новий штам QX-аналогічний, більш
50%. Вперше QX-аналогічний штам (так само відомий, як L1148 або D388) був
виявлений в Голландії в січні 2004 р і вже в травні 2004 р. перші випадки
зареєстровані Німеччини, Бельгії, а у вересні у Франції. Циркуляція 4 типів ВІБ
(793 / У, 6241, В1648 і Massachusetts) була виявлена в Італії, причому показана
можливість персистенції деяких типів віруса на протязі багатьох років. На
діаграмі №3.1 показана еволюція штамів ІБ в Західній Європі за 2002-2007 рр.,
яка засвідчує швидку зміну картини штамів які домінують.
За даними діаграми №3.1
в 2002 р. штам Італія-02 займав 75% за кількістю виявлення ІБК в странах
Європи. З роками ситуація змінилась на користь штаму QX, який в 2007 р. зайняв
домінуюче положення, що склало 30%, на другому місці опинився штам D1466 (21%),
а штам Італія-02 зайняв лише третю ланку (12%).
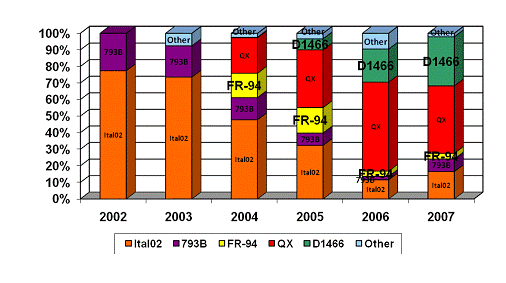
Діаграма 3.1. Еволюція штамів ІБ в
Західній Європі за 2002-2007 рр.
За останні роки ситуація в Європі дещо
змінилась, про що свідчить таблиця №3.1.1.
Таблиця 3.1.1. Розповсюдження (%)
різноманітних серотипів вірусів ІБК в країнах Європи за 2008-2011 р.
|
Країна
|
Серотипи вірусів ІБК
|
|
793В
|
Масачусетс
|
Італія - 02
|
QX-подібний
|
D274
|
Арканзас
|
D1466
|
Інші
|
|
Великобри-танія
|
32,8
|
34,2
|
22,6
|
0,0
|
6,6
|
10,8
|
0,8
|
0,7
|
|
Франція
|
56,4
|
24,4
|
8,6
|
8,0
|
0,9
|
0,0
|
0,3
|
1,4
|
|
Німеччина
|
30,6
|
29,2
|
1,7
|
22,0
|
11,0
|
0,0
|
4,8
|
0,7
|
|
Нідерланди
|
26,0
|
30,8
|
6,8
|
20,9
|
10,3
|
2,1
|
2,1
|
1,0
|
|
Бельгія
|
17,6
|
23,1
|
2,8
|
21,3
|
24,1
|
7,4
|
3,7
|
0,0
|
|
Іспанія
|
26,8
|
22,0
|
46,3
|
0,0
|
4,9
|
0,0
|
0,0
|
0,0
|
Домінуючим серотипом став 793В, у
Франції він є найбільш розповсюдженим (56,4%). Другим в процентному відношенні
став Масачусетс, його частіш за всі інші виявляли у Великобританії (34,2%). І
третю ланку, як і раніше, посідає серотип Італія-02, що охопив територію
Іспанії (46,3%).
На території Радянського Союзу ІБК
вперше був зареєстровано в 1982 році у курчат, завезених з Угорщини, коли з
легень трупів птиці виявили антигеноспоріднений серотипу Массачустес вірус ІБК.
В подальшому ІБК розповсюдився і на інші бройлерні фабрики держави.
Проведення в 2003-2010 р.р. на
території держав СНД моніторинг за допомогою ПЛР та ІФА вказує на домінування
розповсюдження ізолятів (біля 40%) генотипу Массачусетс. Також достатньо часто
(5-15%) зустрічаються ізоляти генотипу 793 / В, D274, QX, B1648; біля 20%
віднесені до 5-ти різних європейських серотипів, включаючи нові серотипу 624 I
і Itа1у-02. Крім того, 27% проб не булі віднесені до раніше відомих генотипів і
склали російську групу. У 2006 р. було виявлено польовий ізолят віруса ІБК,
віднесений до генотипу Арканзас. Данні розподілу ізолятів на території СНД дещо
відрізняються від розповсюдження на території ЄС, де домінує генотип 793 / В
(33%), Массачусетс (25%) та Італія-02 (13%).
В Україні вірус ІБК поширений на
птахофабриках промислового типу м'ясного і яєчного напрямку практично у всіх
регіонах. Всі промислові підприємства проводять вакцинацію поголів'я птиці
проти ІБК. Незважаючи на це, в господарствах періодично з'являються спалахи ІБК
серед вакцинованого поголів'я. В таблиці №3.1.2 представлені данні дослідження
авторських джерел по виявленню антитіл до віруса ІБ різних серотипів у 8
областях України.
Таблиця 3.1.2. Виявлення антитіл до
віруса ІБ різних серотипів в сироватках крові курей птахогосподарств різних
регіонів України за 2007-2011 р.
|
№ п.п
|
Область
|
Кількість випадків виявлення антитіл до ВІБ серотипів:
|
|
|
М41
|
4/91
|
D 274
|
D 3128
|
D 1466
|
D 8880
|
QX
|
Italy -02
|
|
1
|
АР Крим
|
-
|
2
|
1
|
-
|
-
|
-
|
-
|
-
|
|
2
|
Вінницька
|
1
|
2
|
-
|
-
|
-
|
1
|
-
|
-
|
|
3
|
Дніпропетровська
|
8
|
9
|
6
|
5
|
2
|
6
|
-
|
-
|
|
4
|
Донецька
|
1
|
5
|
2
|
1
|
-
|
1
|
1
|
1
|
|
5
|
Житомирська
|
-
|
-
|
2
|
-
|
-
|
-
|
-
|
-
|
За цими показниками Дніпропетровська
область є найбільш неблагополучною щодо інфекційного бронхіту курей, друге
місце посідає Донецька і третє Київська область. Найрозповсюдженішим штамом являється
4/91, на другому місці D274, а на третьому D8880.
Таким чином, надалі можлива зміна
картини розподілу серотипів вірусу ІБ в зв'язку з глобалізацією птахівництва та
завезенням молодняку птиці за кордону, переважно з Європи, а
також в результаті участі використання вакцин на основі серотипу 793 / B і D274
закордонного виробництва, які можуть послужити причиною виникнення польових
вірусів ІБК.
3.2 Аналіз
специфічної імунопрофілактики та схем вакцинації ІБК в Україні
Вакцини для специфічної
профілактики ІБК за складом поділяються на живі та інактивовані: перші
застосовують в стадах бройлерів і ремонтного молодняку м'ясних і яєчних курей
(первинна обробка), а другі - в стадах курей-молодиць у віці 14-18 тижнів.
Живі вакцини містять в
собі ослаблений живий мікроорганізм. Вони здатні розмножуватися в організмі і
викликати вакцинальний процес, формуючи несприйнятливість. Утрата вірулентності
в таких штамів закріплена генетично, однак можуть виникати проблеми з
імунодефіцитами.
Інактивовані вакцини
містять або убитий цілий мікроорганізм, або компоненти клітинної стінки чи
інших частин збудника. Такі вакцини є досить стабільними і безпечними, тому що
не можуть викликати реверсію вірулентності. Вони часто не вимагають збереження
на холоді, що зручно в практичному використанні. Однак у цих вакцин є і ряд недоліків,
зокрема, вони стимулюють більш слабку імунну відповідь і вимагають застосування
декількох доз (бустерні імунізації). Переваги і недоліки живих та інактивованих
вакцин представлені в таблиці №3.2
Таблиця 3.2. Переваги та
недоліки живих та інактивованих вакцин
|
Вакцини
|
Переваги
|
Недоліки
|
|
Живі
|
1. Легкість в застосовані 2.
Відносно невелика коштовність 3. Ефективність (при дотриманні певних
факторів: імунізація в оптимальні терміни, оптимальний вибір штама і метода
вакцинації, однорідність МАТ, відсутність імунодепресії та інфекції в
субклінічній формі)
|
1. Можливість інтерференції 2.
Персистенції віруса в господарстві 3. Можливість реверсії 4. Можливість
контамінації іншими патогенами 5. Реактогенність 6. Імуносупресія 7.
Нерівномірність антигена в отриманій дозі 8. Відносно коротка тривалість
імунітету
|
|
Інактивовані
|
1. Висока імуногенність 2. Більш
тривалий імунітет (1-1,5 р.) 3. Однорідний рівень імунної відповіді 4.
Безпечність, екологічність 5. Відсутність імуносупресії 6. Поєднання в різних
варіантах, відсутність інтерференції 7. Відсутність впливу МАТ на імунну
відповідь 8. Парентеральне введення-отримання індивідуальної дози вакцини
|
1. Відносно висока коштовність 2.
Парентеральне введення - додаткові витрати на оплату праці
|
У випадку ІБК, враховуючи
переваги і недоліки живих та інактивованих вакцин, слід розумно підходити до
процесу складання схем вакцинації, враховуючи технологічий процес та
фізіологічні особливості організму курей різних та порід.
При проведенні
імунопрофілактики ІБК важливо досягти утворення місцевого імунітету, який
можливо забезпечити при застосуванні живих вакцини спрей-методом починаючи з
добового віку. При встановленні циркуляції в господарстві варіантних штамів
віруса інфекційного бронхіту необхідне введення вакцинації проти цих штамів, не
відміняючи вакцинацію з застосуванням вакцини, що містить штам Массачусетс.
Терміни та кратність вакцинації визначають виходячи з епізоотичної ситуації в
господарстві, а також за результатами лабораторних досліджень. У кур-несучок і
птиці батьківських стад проводиться 2-4 кратна вакцинація живою вакциною, а
потім інактивованою. При вакцинації проти варіантних штамів віруса ІБК
необхідне чергування вакцин, що містять штам Массачусетс та варіантний штам.
Крім того інактивована вакцина проти ІБК повинна містити в своєму складі два
штами, тобто штам Массачусетс і варіантний штам. Тільки в цьому випадку птиця
може бути захищена від варіантного штаму віруса на весь продуктивний період.
У світовій практиці схеми
вакцинації дещо відрізняються друг від друга, але основний принцип один.
Обробку птиці проводять
багаторазово. Перша вакцинація проводиться живою вакциною з використанням менш
вірулентних штамів, таких, як Н-120, причому щадним методом, щоб послабити
поствакцинальну реакцію. Друга більш вірулентним і імуногенним штамом, теж
живою вакциною, наприклад Н-52, стимулює у птиці формування більш напруженого
імунітету. І третя - з використанням інактивованої вакцини.
Одноразова вакцинація
веде до підвищення рівня антитіл до 28 дня, але напруженість імунітету низька.
Максимальний рівень напруженості імунітету спостерігається після другої
вакцинації через 3 тижні незалежно від інтервалу (2, 3, 4 тижні). Встановлено,
що трансмісія вірусу значно редукується у вакцинованого поголів'я.
У неблагополучних по ІБ
господарствах допускається вакцинація ремонтного молодняку в 1-добовому віці
вакциною зі штаму «Н-120» або «АМ». Ревакцинація - вакциною з штаму «Н-120» або
«АМ» в 12-18 днів або третя вакцинація вакциною зі штаму «Н-52» в 7-8 тижнів.
Заключну вакцинацію проводять інактивованою вакциною у віці 16-18 тижнів.
Програма вакцинації повинна бути повністю завершена не пізніше, ніж за три
тижні до початку яйцекладки. Вакцинацію молодиць протягом двох останніх тижнів
перед початком яйцекладки проводити недоцільно, оскільки в цей час антитіла не
виробляються. Вакцинація несучок у період високої несучості викликає зниження
продуктивності. Бройлерів вакцинують в добовому віці вакциною зі штаму «Н-120»
і ревакцінують у віці 1-3 тижні. Інактивовану вакцину застосовують у
неблагополучних і загрозливих племінних і товарних господарствах.
Регулярне застосування в
господарстві живих вакцин серотипу Массачусетс з інтервалом в 1 міс сприяє
утворенню у птиці перехресного імунітету до інших серотипів. Встановлено, що
вакцини, виготовлені з штаму Н-120, володіють найбільш широким спектром
протективної активності та індукують напружений імунітет проти гомологічного
серотипу Массачусетс і частковий перехресний імунітет проти гетерологічних
серотипів, в тому числі і нефропатогенних. Крім того, навіть одноразове
щеплення вакциною з штаму Н-120 окулярним методом істотно зменшує поширення в
стаді вірулентного вірусу. Живі вакцини однаково ефективні при введенні їх в
організм птиці ентерально з водою, у вигляді крапель в око, ніс або спрей-методом.
Інактивовані - застосовують методом однократної ін'єкції в грудний м'яз, так як
це сприяє утворенню більш міцного імунітету, ніж аерозольний (високодисперсний)
метод, що може викликати у птиці небажані поствакцинальні реакції. Таким чином,
широке застосування живих та інактивованих вакцин є основним засобом
імунопрофілактики ІБК і дозволяє забезпечити благополуччя в господарствах.
3.3 Специфічна
профілактика інфекційних хвороб птиці в НДППЗ ім. Фрунзе
На територію птахоферми
курчата батьківського поголів’я кросу «Хайсекс білий» та «Хайсекс коричневий»
поступають із-за кордону у 1-2 добовому віці в кількості до 100 тис. голів на
за одну партію. У ветеринарному свідоцтві (форма №1), що надходить разом з
партією вказується, що курчата клінічно здорові, щеплені підшкірно вакциною
Poulvak Marek CVI+HVT проти хвороби Марека, вакциною Nobilis Ma-5 проти
інфекційного бронхіту (ІБК). Материнське стадо щеплено проти хвороби Марека,
хвороби Гамборо, псевдочуми, інфекційного бронхіту, інфекційного ларинготрахеїту,
віспи та синдрому зниження несучості.
Партія завезених курчат
ставиться на профілактичний карантин строком сім днів і комісія складає акт про
постановку партії курчат на профілактичний карантин та акт зняття з нього.
На 1-3-ю добу посадки
курчат вибірково беруть кров на перевірку напруги материнського імунітету до
хвороби Н’юкасла, інфекційного бронхіту та хвороби Гамборо.
Щеплення проти
інфекційного бронхіту курей проводиться за схемою в таблиці №3.3.1, яка
погоджена з Департаментом ветеринарної та фітосанітарної служби України.
Таблиця 3.3.1. Схема
вакцинації батьківського стада кросів Хайсекс Коричневий та Хайсекс Білий в
НДППЗ ім. Фрунзе НАУ на 2012 г.
|
№ п/п
|
Вік
|
Найменування
|
Захворювання
|
Метод вакцинації
|
|
1
|
1 день
|
Poulvak Marek CVI+HVT Nobilis Ma-5
|
Хвороба Марека Інфекційний бронхіт
|
Ін’єкція Крупнокапельний спрей
|
|
2
|
10 день
|
Nobilis 4/91
|
Інфекційний бронхіт
|
Спрей
|
|
3
|
16-18 день
|
Nobilis Ma-5+Clon-30
|
Інфекційний бронхіт + хвороба
Ньюкасла
|
Спрей
|
|
4
|
20-22 день
|
Nobilis Gumboro 228 E
|
Хвороба Гамборо
|
Випоювання
|
|
5
|
26-28 день
|
Nobilis Gumboro 228 E
|
Хвороба Гамборо
|
Випоювання
|
|
6
|
50-55 день
|
Nobilis AE+ POX Nobilis ILT
|
Віспа+ Інфекційний енцефаломієліт
Інфеккційний ларинготрахеїт
|
Прокол перепонки крыла
Інтраокулярно
|
|
7
|
70 день
|
Nobilis Ma-5+ Clon-30
|
Інфекційний бронхіт+Хвороба
Ньюкасла
|
Спрей
|
|
8
|
80 день
|
Nobilis 4/91
|
Інфекційний бронхіт
|
Спрей
|
|
9
|
95-100 день
|
Nobilis IB + G+ ND Nobilis EDS
|
Інфекційний бронхіт+Хвороба
Гамборо + Хвороба Ньюкасла СЗН
|
В/м ін’єкція
|
Птахофабрика ім. Фрунзе
протягом всього періоду вакцинації курей застосовує вакцини лише
нідерландського виробництва, фірми Інтервет Інтернейшнл.
Характеристика окремих
вакцин:
Нобіліс ІБ 4-91 (Nobilis
IB 4-91) жива, ліофілізована
вакцина проти інфекційного бронхіту. Виробника: ІНТЕРВЕТ ІНТЕРНЕЙШНЛ Б.В.
БОКСМЄЄР, НІДЕРЛАНДИ. Кожна доза 3,6 містить 10 EID50 ембріонального живого
атенуйованого штаму 4/91 ІБ. Випускають у флаконах по 1000 доз. Продовження
захисту потребує ревакцинації.
В НДППЗ ім. Фрунзе, цех
дорощування, пташник №3 проводили власні дослідження на курчатах кроссу
«Хайсекс коричневий» 10 денного віку, кількістю 5635 голів. Вакцинували курчат
проти інфекційного бронхіту курей вакциною Нобіліс ІБ 4-91.
Перед вакцинацією
ветеринарний лікар прослідкував, щоб на кожному флаконі була етикетка, з
зазначенням короткого найменування біопрепарату та номеру серії, а на коробці -
етикетки з зазначенням найменування та товарного знаку біопідприємства, номерів
серії і контролю, терміну зберігання, кількості ампул у коробці, біологічної
активності вакцини, а також умов температурного режиму зберігання вакцини, дати
виготовлення і позначення ТУ. Данні проведеної імунізації заносили у
спеціальний журнал з зазначенням кількості вакцинованого поголів’я, номерів
серій та контролю використаної вакцини, біофабрики, що виготовила препарат та
наявності поствакцинальної реакції у щепленої птиці.
Вакцинацію проводили
аерозольним методом: перед вакцинацією визначали кількість птиці, що необхідно
вакцинувати, вакцину розчиняли у чистій, прохолодній воді без домішок заліза та
хлору. Флакони з вакциною відкривали, повністю зануривши їх у воду.
Спрей-апаратура була без залишків корозії та дезінфектантів (використовують
тільки для вакцинації). 1000 доз вакцини розчиняли у 1 л води. На 5635 голів
курчат використали 3 флакони Нобіліс ІБ 4-91, залишки біопрепарату
знешкоджували кип’ятінням. Вакцинний розчин розпилювали грубо-крапельним
методом над птицею з відстані 30-40 см. Вакцинація проводилась спецодязі,
респіраторах, захисних окулярах. Після закінчення руки і обладнання мили і
дезінфікували.
Таким чином можна
засвідчити, що специфічна профілактика курей на птахофабриці ім. Фрунзе
проводиться на належному рівні.
.4 Серологічний
моніторинг імунітету проти інфекційного бронхіту курей
Серологічний моніторинг
імунітету птиці проти збудника інфекційного бронхіту курей проводиться згідно
технологічної карти, яка складається головним лікарем ветеринарної медицини
господарства. В середньому з досліджуваного пташника відбирається 22 проби
крові, яку беруть з підкрильцевої вени по 3 мл. Серологічний контроль проводили
у лабораторії діагностики «Інвек» шляхом постановки реакції імунного
ферментного аналізу (ІФА).
Успіх серологічних
досліджень залежав від декількох чинників, але насамперед - від правильності
відбору зразків. Для того, щоб відібрані зразки відображали точну картину стада
необхідно використовувати статистично достовірні методи відбору проб, правильно
готувати зразки (щоб мати однакову якість сироватки), та дотримуватися методики
постановки ІФА.
З метою одержання
статистично достовірних середніх титрів антитіл у стаді ми дотримувалися двох
основних позицій:
. Випадкова вибірки
птиці для відбирання зразків.
. Необхідна кількість
зразків.
Дуже важливо брати птицю
шляхом випадкової вибірки, для того щоб усунути впливу так званих
«неконтрольованих варіацій» (наприклад, нерівномірна вакцинація через
питну воду, нерівномірне вживання корму, вплив нерівномірного розподілення
температури, вологи тощо, в різних частинах пташника).
Відбір проб крові проводили
за допомогою одноразових шприців. Сироватку крові одержували шляхом коагуляцією
(1-2 години витримували при кімнатній температурі). Після проводили маркування
сироватки (№ птахоферми, № пташника, вік птиці, тип вакцини та ін.). Далі
зразки сироватки зберігали в умовах побутового холодильника при +4 - 8оС
(до 48 годин), а для більш тривалого зберігання їх фасували в пластикові
пробірки (мікроцентрифужні пробірки на 1,5 мл) з кришкою, які маркували і
заморожували при -20оС. Сироватки крові після багаторазового
заморожування-розморожування неможна досліджувати. Не допускається для
дослідження зіпсована сироватка (неприємний запах, тощо), бо вона має
протеолітичні ферменти, які можуть впливати на результати ІФА. Термін
зберігання зразків сироватки можна, за необхідності, подовжити при додаванні
розчинника із набору ІФА.
Як раніше вже було
зазначено, великий вплив на ступінь погрішності одержаних результатів
серологічного контролю має кількість відібраних проб крові, а вона в першу
чергу залежить від того однорідне чи неоднорідне є стадо за титрами антитіл.
Чим більший коефіцієнт варіації титрів антитіл у стаді, тим більше зразків
повинно бути відібрано для отримання «реального середнього титру».
3.4.1 Практичне
використання тестів ELISA
Відомо, що серологічний
моніторинг є важливим інструментом в розробці і підтримці ефективних програм
щеплень і його основним завданням є забезпечення інформацією про імунний статус
птиці. Моніторинг допомагає нам проводити ранню діагностику захворювання,
ідентифікацію і обмеження дії причини, яка викликає це захворювання.
В таблиці №3.4.1.1
представлені можливі титри антитіл проти збудника інфекційного бронхіту, які ми
будемо в подальшому інтерпретувати при оцінці напруженості імунітету у
курей-несучок.
Таблиця 3.4.1.1. Можливі
титри антитіл проти збудника ІБК після щеплення у курей-несучок
|
Тест
|
Тип вакцини
|
Середній титр АТ
|
Титр при підозрі на інфекцію
|
Тижні після вакцинації
|
|
Інфекційний бронхіт курей
|
Жива (Н120, Ма5) Жива (4/91)
Інактивована
|
1000-4000 6000-10000 6000-17000
|
> 6000 > 12000
|
3-5 тижнів 3-5 тижнів 5-8 тижнів
|
Також слід зазначити, що
рівень титрів антитіл проти збудника ІБК ще може коливатись в залежності від
виду птиці, типу вакцини, програми щеплення та інших факторів.
Тому при проведенні
інтерпретації серологічних результатів завжди необхідно дотримуватись таких
позицій:
. Лише за результатами
сероконверсії діагноз не ставиться.
. Щоб поставити вірний
діагноз необхідно проаналізувати серологічні та клінічними дослідження.
. Імунітет до багатьох
патогенних агентів (в тому числі і вірусів) не завжди опосередкований
антитілами.
. Антитіла є побічними
продуктами і вони не завжди відображають імунний статус птиці, але вони можуть
бути використані як індикатори успіху вакцинації.
. Місцевий імунітет в
кишечнику, трахеї не може бути змінений опосередкованими антитілами
. Не всі серологічні
тести, що вимірюють рівень антитіл, можуть розрізняти певні серотипи збудника
хвороби.
. Всі тести є важливими
і можуть бути застосовані в певній сфері.
. Вибір тесту залежить
від мети досліджень.
Серологічний моніторинг
при вакцинації дає можливість визначити інтенсивність відгуку, стабільність в
часі, однорідність імунної відповіді після введення вакцини. Низькі,
неоднорідні, нестійкі титри антитіл є показниками поганої ефективності
застосованої вакцини або похибками в її використанні. Високі, однорідні титри,
що довго тримаються, навпаки - свідчать про високу ефективність застосованої
вакцини.
При первинній вакцинації
живою вакциною повна сероконверсія є важливішою за коефіцієнт варіації, тому
необхідно переконатися, що 100% птахів дали позитивний результат. Показники
коефіцієнту варіації після проведеної вакцинації наведені в таблиці №3.4.1.2
Таблиця 3.4.1.2.
Показники оцінки коефіцієнту варіації після проведеної вакцинації
|
Результат
|
Коефіцієнту варіації (% КВ)
|
|
Відмінний
|
До 40%
|
|
Добрий
|
40 - 50%
|
|
Необхідне втручання
|
Більше 50%
|
Застосовуючи тести ELISA
можна провести оцінку та оптимізувати три важливі виміри програми вакцинації:
Час - вакцинувати
необхідно до появи захворювання.
Вид програми - (різні
штами, живі чи інактивовані).
Місце введення вакцини -
техніка вакцинації (випоювання, розпилення, інтраназальне, інтраокулярне
введення і т. ін.).
Дослідження материнських
антитіл і прогнозування дати вакцинації:
Високий рівень материнських
антитіл є показником успішної вакцинації. За допомогою тестів ELISA можна
прогнозувати зниження рівня материнських антитіл (МАТ) для оптимального
визначення часу вакцинації в ранньому віці. Птиця з низьким рівнем або
відсутністю МАТ найбільш сприйнятлива до виникнення захворювання після
вакцинації.
Визначення можливої
захворюваності:
Періодичне серологічне
дослідження стада необхідне крім моніторингу напруженості імунітету і для
постановки діагнозу тому, що безпричинне підняття титрів антитіл вказує на
появу захворювання. В таких випадках, для постановки точного діагнозу необхідно
поєднувати серологічні дослідження з клінічними. Моніторингові дослідження за
допомогою тестів ELISA дають можливість раннього визначення польових штамів
збудника інфекції. При моніторингу стада також необхідно оцінювати результати
виробництва, постійне обстеження стада, ретельне дослідження вибракуваної і
загиблої птиці.
Відбір проб крові для
власних досліджень проводили у дослідної групи курчат кросу «Хайсекс
коричневий» з пташника №3, цеху дорощування на 6-й тиждень життя, вони
попередньо були вакциновані живою вакциною Nobilis Ma-5 в 1-денному віці та
вакциною Nobilis 4/91 в 10-денному віці в кількості 5635 голів. Кров відбирали
з підкрильцевої вени в кількості 3 мл 22 проби. Також, попередньо було
відібрано 10 проб крові від контрольної групи курчат на 8-й день життя до
вакцинації.
Пробірки з кров’ю були
марковані (назва цеху, № пташника, вік птиці, тип використаної вакцини). Далі
марковані проби крові помістили на 1,5 години у термостат при Т+35оС
(щоб відбулася звичайна коагуляція), після чого сироватку крові помістили в
пластикові пробірки з кришкою, які склали в пакет і поклали в холодильник,
пізніше їх відправили для ІФА досліджень в лабораторію Інвек.
Отримані
факсом результати досліджень по системі IDEХХ з лабораторії Інвек, свідчать про
те, що поголів’я курчат має високий рівень напруженості імунітету проти
збудника ІБК, що представлено в діаграмі №3.4.1.1.
У дослідної групи курчат
коефіцієнт варіації (CV) складає 44%, що є добрим показником. Титри є
однорідними. Мінімальний титр складає: 5103. Максимальний титр складає: 9045.
У контрольної групи
курчат коефіцієнт варіації (CV) складає 36%, що для не вакцинованої птиці є
нормальним показником. Титри є однорідними. Мінімальний титр складає: 5103.
Максимальний титр складає: 9045.
Слід
зазначити, що в сучасному промисловому птахівництві для специфічної
профілактики інфекційного бронхіту курей застосовується комплексна програма
імунізації птиці, яка базується на використанні живих та інактивованих вакцин.
В НДППЗ ім. Фрунзе захист курей від захворювання протягом всього життєвого
періоду і створення напруженого і тривалого пасивного імунітету у курчат, що
були отримані від цих курей досягають шляхом 6-кратного введення живих вакцин в
моновалентному та асоційованому складі. Як правило, імунна відповідь курчат на
першу вакцинацію проти ІБК слабша за напруженістю і тривалістю (2-3 тижні). За
результатами дослідження сироваток крові курчат методом ІФА ми спостерігали, що
друге введення живої вакцини проти ІБК, призвело до різкого збільшення
вироблення гуморальних антитіл і це підтверджує високу ефективність
застосування живої вакцини Nobilis 4/91. Про це кажуть однорідні, високі титри
в дослідній групі курчат.
НДППЗ ім. Фрунзе постійно
проводиться серологічний контроль методом ІФА за рівнем антитіл до збудника
інфекційного бронхіту курей у племінного поголів’я курчат після щеплень на 10
добу.
4.
Аналіз і узагальнення одержаних результатів, їх екологічне та економічне
обґрунтування
Економічний аналіз
ефективності ветеринарних заходів у сучасних умовах набуває важливого значення,
оскільки характеризує кінцевий результат праці спеціалістів ветеринарної
медицини. Він дозволяє, застосовуючи схему економічних показників, розробити
більш ефективні заходи по зменшенню захворюваності та загибелі тварин,
підвищення їх продуктивності, скороченню строків перебігу хвороби, підвищенню
якості продукції та сировини тваринного походження.
. Попереджений
економічний збиток в НДППЗ ім. Фрунзе внаслідок профілактики інфекційного
бронхіту курей на основі вакцинації.
Пз=Мср* Кз* Кзб - З
де Мср-загальне
поголів’я сприятливої птиці, гол.
Кз- коефіцієнт можливого
захворювання птиці у неблагополучних гуртах.
Кзб - питома величина
економічного збитку у розрахунку на одну птицю, що захворіла.
З - загальна сума
економічного збитку, обумовленого хворобою.
Показник Кз дорівнює
0,53, а показник Мср дорівнює 5635 гол., Кзб - 1,71 грн, З - 0
Пз = 5635 * 0,53*1,71=
5107 грн.
. Витрати на проведення
ветеринарних заходів (Вв) складаються із заробітної плати лікаря
ветеринарної медицини що проводить вакцинацію курчат в інкубаторі, віком 1
доба, вакциною Nobilis Ma-5 спрей-методом.
З заробітної плати
лікаря ветеринарної медицини що проводить вакцинацію курчат, віком 10 днів,
вакциною Nobilis 4/91 спрей-методом.
.1 Заробітна платня
лікаря ветеринарної медицини складає 2640 грн., кількість робочих днів лікаря
на проведення вакцинації складає всього 2 доби, отже
Зп= 2*2640/30=176 грн.
.2 Флакон вакцини
Nobilis на 1000 доз коштує 56 грн. На поголів’я 5635 голів необхідно 6 флаконів
вакцини: 56*6=336 грн.
Витрати на проведення
ветеринарних заходів складають:
Вв= 176+336= 512 грн.
. Економічний ефект,
одержаний внаслідок здійснення профілактично оздоровчих та лікувальних заходів
(Ее) визначаємо за формулою:
Ее = Пз-Вв
Ее
=5107-512=4595 грн.
. Економічний ефект від
проведення профілактичних, оздоровчих та лікувальних заходів на 1 грн. витрат
(Егрн) визначаємо за формулою:
Егрн=Ее / Вв
Егрн=4595/512=8,97 грн.
Економічний ефект на 1
гривню витрат від проведення вакцинації проти інфекційного бронхіту складає
8,97 грн.
Проведення вакцинації
проти ІБК, з серологічним контролем ефективності, дає можливість запобігти
виникненню хвороби завдяки утворенню в організмі імунізованих курчат антитіл
проти віруса ІБ. Це дає можливість зменшити збитки господарства та підвищити
економічні показники діяльності.
Висновки
. Проведення аналізу
результатів оригінальних досліджень еволюції штамів інфекційного бронхіту курей
в світовій літературі на сьогодні, свідчить про те, що найрозповсюдженішим
штамом на території Європи є 793В. На території нашої держави домінуючим штамом
являється 4/91, але надалі можлива зміна картини розподілу серотипів вірусу ІБ
в зв'язку з глобалізацією птахівництва та завезенням молодняку птиці за
кордону, переважно з Європи, а також в результаті участі використання вакцин на
основі серотипу 793 / B і D274 закордонного виробництва, які можуть послужити
причиною виникнення польових вірусів ІБК.
. Встановлено, що на
сьогоднішній день на території України зареєстровано 71 вакцинний препарат
проти інфекційного бронхіту курей. Вакцини для специфічної профілактики ІБК за
складом поділяються на живі та інактивовані: перші застосовують в стадах
бройлерів і ремонтного молодняку м'ясних і яєчних курей (первинна обробка), а
другі - в стадах курей-молодиць у віці 14-18 тижнів. Обробку птиці проводять
багаторазово. Перша вакцинація проводиться живою вакциною з використанням менш
вірулентних штамів, щоб послабити поствакцинальну реакцію. Друга більш
вірулентним і імуногенним штамом, теж живою вакциною, що стимулює у птиці
формування більш напруженого імунітету. І третя - з використанням інактивованої
вакцини. Застосовуючи специфічну профілактику ІБК, необхідно перевіряти
ефективність дії вакцин на організм птиці за допомогою серологічного
моніторингу.
3. На основі власних
досліджень встановлено високу ефективність вакцини Nobilis 4/91 за допомогою
серологічного моніторингу, яка була застосована для вакцинації курчат 10
денного віку в НДППЗ ім. Фрунзе.
4. Економічна
ефективність від проведення вакцинації проти інфекційного бронхіту курей
складає 1,3 грн. на 1 грн. витрат.
Список літератури
1. Борисов В. Стратегія використання живих та інактивованих вакцин
для профілактики вірусних хвороб птиці / Борисов В, Борисов О, Старов С. та
інші. - ВНДІЗТ - БТК, 2000 рік. - 4 с.
2. Бессарабов Б.Ф.
Инфекционные болезни животных / Б.Ф. Бессарабов, А.А., Е.С. Воронин и др.; Под
ред. А.А. Сидорчука. - М.: КолосС, 2007. - 671 с.
3. Прудников В.С. Патоморфологическая диагностика инфекционных
болезней птиц / В.С. Прудников, Б.Я. Бирман, И.Н. Громов. - Минск: Бизнесофсет,
2004. - 120 с.
. Лабораторный контроль имунитета птицы / В кн. Продукты и
технологии для промышленного птицеводства: Общие принципы применения.-Корпорация
Интер - Агросистемы, 2002.-вып. №2. - С. 54-60.
. Рекомендации проведения иммунопрофилактики в зависимости от
эпизоотической ситуации по некоторым вирусным заболеваниямптиц / В кн. Основные
инфекционные болезни птиц и профілактика Россия: ООО «Интервет». - 2002. - с.
52-61.
. Куриленко А.Н. Клинико патоморфологические изменения у цыплят
при инфекционном бронхите: Сбор. науч. тр. / Моск. вет. акад., 1980. Т. 116. С.
32-35.
. Овчинникова Е.В., Бочков Ю.А., Батченко Г.В. и др. Генетическая
характеристика полевых изолятов вируса инфекционного бронхита кур, выявленных в
России. Труды Федерального центра охраны здоровья животных. 2007. Т. 5. С.
303-315.
. Разработка программного обеспечения для обработки, учета и
хранения результатов ИФА при диагностике заболеваний разных видов животных /
Ю.В. Зинковский, С.Н. Колосов, Н.С. Мудрак, В.В. Дрыгин // Труды Федерального
центра охраны здоровья животных. - Владимир, 2009. - Т. 7. - С. 215-219.
. Совершенствование непрямого варианта ИФА для выявления антител к
вирусу инфекционного бронхита кур / И.А. Лебенко, Н.Н. Луговская А.В. Щербаков,
А.С. Яковлева, Н.С. Мудрак, В.В. Дрыгин, А.В. Борисов // Труды Федерального
центра охраны здоровья животных. - Владимир, 2007. - Т. 5. - С. 292-302.
. Диагностика инфекционного бронхита кур. Ситуация в России
(2007-2008 гг.) / Е.В. Овчинникова, Л.О. Щербакова, Н.С. Мудрак, А.В. Борисов,
В.В. Дрыгин // V Междунар. ветеринарный конгр. по птицеводству. - М., 2009. -
С. 66-70.
. Изучение основных характеристик иммуноферментного набора для
определения антител к вирусу инфекционного бронхита / Н.Н. Луговская, Н.С.
Мудрак, В.В. Дрыгин, С.В. Фролов, А.В. Борисов // Роль ветеринарной науки в
развитии животноводства: материалы Междунар. науч.-произв. конф. - Алматы,
2000. - С. 141-142.
. Новые технологии в диагностике инфекционных болезней птиц /
Мудрак Н.С. // Инфекционная патология животных: материалы Междунар.
науч.-практ. конф., посвящ. 50-летию ФГУ «ВНИИЗЖ». - Владимир, 2009. - С.
104-107.
. Інструкція про заходи з профілактики та ліквідації інфекційного
бронхіту курей, яка затверджена Головним державним інспектором ветеринарної
медицини України 17.10.2001 р. №78.
. Авдосьєва І.К., Мельничук І.Л., Басараб О.Б. та ін. Особливості
специфічної профілактики інфекційного бронхіту курей // Науково-технічний
бюлетень / Інститут біології тварин, ДНДКІ ветпрепаратів та кормових добавок. -
Львів, 2006.-Вип.7, №3,4. - С. 146-150
. Авдосьєва і. К., Мельничук X.Л., Басараб Б., Регенчук В.В.
Сучасні аспекти вакцинації проти інфекційного бронхіту курей //
Науково-технічний бюлетень / Інститут біології тварин, ДНДКІ ветпрепаратів та
кормових добавок. - Львів, 2008. - Вип.
1, №9. - С. 34-39.
. Борисов А., Фролов С., Хлыбова Т. и др. Инфекционный бронхит кур
// Птицеводство. - 2001. - №8 - С. 24-27.
17. Боцуляк Н.Я., врач ветмедицины,
консультант (ООО «Симедика УА») О вирусном птичьем бронхите // Вет.мед.
України. - 2008. - №10
18. Г. Ван де Босх. Вакцинирование на инкубаторах // Международное
животноводство. - 2000. - №5.2. - С. 15-17.
. Г. Ван де Босх. Прививки: Осторожность никогда не мешает! //
Международное животноводство. -2000. - №5.2. - С. 19-21.
20. Ибрагимов А.А., Ромахова М.А.
Патоморфология мочеполовых органов при инфекционном бронхите кур //
Ветеринария. - 1983. - №9. С. 35-38.
. Ігнатов М.М. Оптимізація схем
вакцинопрофілактики інфекційного бронхіту курей // Вет.мед. України. - 2002. -
№2.-С. 21-22
. Ігнатов М.М., Герман В.В. Ізоляція
вірусу інфекційного бронхіту курей // Вет.мед. України. - 2001. - №7.
23. Инфекционный бронхит кур - современная ситуация, лабораторная
диагностика, специфическая профилактика // Сучастна ветеринарна медицина.
-2011. - №1. С. 23-28
. Коровин Р.Н., Николаева И.П., Серова Н.Ю. и др. Биологические
свойства изолятов вируса инфекционного бронхита // Ветеринария. - №5.-С. 28-30.
. Несторова Л.Ю., Герілович А.П. Молекулярно-генетичний аналіз
епізоотичних штамів вірусу інфекційного бронхіту курей // Ветеринарна медицина:
Міжвід. темат. наук. зб./ННЦ «ІЕКВМ».-Харків, 2007.-В. 88.-С. 159-161
. Николаева И.П., к.в.н. - НПП «Авивак» Инфекционный бронхит кур
(на заметку практикующему врачу) // Птицеводство. - 2004. - №9. - С. 23-26.
. Потоцький М. Інфекційний бронхіт птахів (bronchitis infectiosa
avium) // Ветеринарна медицина України. -2007. - №6.-С. 24-25
. Сандин М. Инфекционный бронхит под контролем // Животновод.
-1999. - №9. - С. 24.
. Сергеев В.Д. Диагностика инфекционного бронхита кур // Био.
Екатеринбург. -2001. - №2 (5). - С. 16.
. Сергеев В.Д. Диагностика инфекционного бронхита кур // Розвиток
вет. науки в Украшкздобутки та проблеми. Харьков. -1997.-С. - 270-271.
. Хохлачёв О.Ф., Терюханов А.Б. Ассоциированное течение
инфекционного бронхита и синдрома снижения яйценоскости кур // Ефективне
птахівництво. -2007. - №12. - С. 50-54
. Герман В.В. Довідник з хвороб птиці / Герман В.В., Вербицький
П.І., Ігнатов М.М. та ін. - Харків «Фоліо». - 2002. - 295 с.
. Alexander D.J., GoughR.E., Pattison M. A long-term study of the
pathogenesis of infection of fowls with three strains of avian infectious
bronchitis virus. Res Vet Sci, 1978, 24, 228-233.
. Bacon L.D., Hunter D.B., Zhang H.M., Brand K., Etches R.,
Retrospective evidence that the MHC (B haplotype) of chickens influences
genetic resistance to attenuated infectious bronchitis vaccine strains in
chickens, Avian Pathol. (2004) 33:605-609
. Cavanagh D., aqi S. Infectious bronchitis. In: Diseases of
Poultry, 11th Edition. Saif Y.M., et al (Eds). - Ames, Iowa, USA: Iowa State
Press, 2003,101-119.
. Cavanach D. Coronavirus avian infectious bronchitis virus.
//Vet. Res. 38 (2007)
. Cavanah D. Severe acute respiratory syndrome vaccine
development: experiences of vaccination against avian infectious bronchitis
coronavirus. Avian Pathol, 2003, 32, 567-582.
. Capua I., Minta Z., Karpinska E., Mawditt K., Britton P.,
Cavanagh D., Gough R.E., Cocirculation of four types of infectious bronchitis
virus (793/B 624/I B1648 and Massachusetts), Avian Pathol. (1999) 28:587-592.
. Collisson E.W., Pei J., Dzielawa J., Seo S.H., Cytotoxic T
lymphocytes are critical in the control of infectious bronchitis virus in
poultry, Dev. Comp. Immunol. (2000) 24:187-200
. Dawson P.S., GoughR.E. Antigenic variation in strains of avian
infectious bronchitis virus. Arch. Gesamte Virusforsch, 1971, 34, 32-39.
. De Haan C.A., Masters P.S., Shen X., Weiss S., Rottier P.J., The
group-specific murine coronavirus genes are not essential but their deletion by
reverse genetics is attenuating in the natural host, Virology (2002)
296:177-89.
. Ganapathy K., Cargill P.W., Jones R.C., Acomparison of methods
of inducing lachrymation and tear collection in chickens for detection of
virus-specific immuoglobulins after infection with infectious bronchitis virus,
Avian Pathol. (2005) 34:248-251.
. Hopkins S.R. Serological comparisons of strains of infectious
bronchitis virus plaque purified isolates. Avian Dis, 1974, 18, 231-239
. Hodgson T., Casais R., Dove B., Britton P., Cavanagh D.,
Recombinant infectious bronchitis coronavirus Beaudette with the spike protein
gene of the pathogenic M41 strain remains attenuated but induces protective
immunity, J. Virol. (2004) 78:13804-13811.
. Ignjatovic J., Gould G., Sapats S. et al. Isolation of a variant
infectious bronchitis virus in Australia that further illustrates diversity
among emerging strains // Arc. Virol. - 2006. Vol. 151. pp. 1567-1585.
. Koch G., Kant A., Cook J.K.A., Cavanagh D. Location of antigenic
sites defined by neutralising monoclonal antibodies on the S1 avian infectious
bronchitis virus glycopolypeptide. J Gen Virol, 1992, 73, 591-596.
. Ladman B.S., Loupos A.B., Gelb J. Jr., Infectious bronchitis
virus S1 gene sequence comparison is a better predictor of challenge of
immunity in chickens than serotyping by virus neutralization, Avian Pathol.
(2006) 35:127-133.