|
Физические
свойства
|
|
Состояние
(нормальные условия)
|
жидкость
|
|
Относительная
молекулярная масса
|
98,082 а. е. м.
|
|
Молярная масса
|
98,082 г./моль
|
|
Плотность
|
1,8356 г./см³
|
|
Плотность
растворов (г/см3) растворитель - вода
|
1,005 (0.986%,
20°C,)
|
|
1,08 (11.96%,
20°C,)
|
|
1,31 (40.82%,
20°C,)
|
|
1,815 (90.12%,
20°C,)
|
|
Термические
свойства
|
|
Температура
плавления
|
-10,38°C
|
|
Температура
кипения
|
279,6°C
|
|
Температура
воспламенения
|
не
воспламеняется°C
|
|
Удельная
теплота плавления
|
10,73 Дж/кг
|
|
Химические
свойства
|
|
pKa
|
-3
|
|
Растворимость в
воде
|
смешивается
г/100 мл
|
|
Оптические
свойства
|
|
Показатель
преломления
|
1.397
|
|
Структура
|
|
Дипольный
момент
|
2.72 Д
|
Химические свойства.
Концентрированная кислота при взаимодействии с органическими
веществами (сахар, бумага, дерево, волокна) обугливает., отнимая от них
элементы воды[7]. При этом образуются гидраты серной кислоты. Обугливание
сахара можно описать уравнением
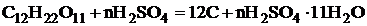 .
.
Во взаимодействие с кислотой вступает частично образовавшийся
уголь
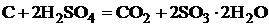 .
.
Поэтому кислота, которая идет в продажу, имеет бурый цвет от
случайно попавших и обуглившихся в ней пыли и органических веществ.
На поглощении (отнятии) воды серной кислотой основана осушка
газов.
Как сильная нелетучая кислота H2SO4 вытесняет другие кислоты
из сухих солей:
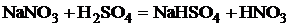 .
.
При добавлении H2SO4 к растворам солей вытеснения кислот не
происходит.
При взаимодействии концентрированной серной кислоты с
различными металлами, как правило, происходит ее восстановление до SO2:
 .
.
Концентрированная H2SO4 окисляет медь, серебро, углерод, фосфор:
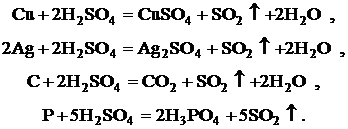 .
.
Разбавленная серная кислота окисляет только металлы, стоящие
в ряду напряжений левее водорода, за счет ионов Н+:
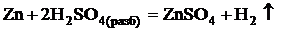
Из всех сульфатов наименьшей растворимостью обладает сульфат
бария - именно поэтому его образование в виде белого осадка используют как
качественную реакцию на сульфат-ион:
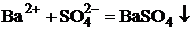
Свойства
серы
Элементарную серу получают из: а) самородных руд; б)
сероводорода природного газа, газов нефтепереработки, коксовых газов и т.д.; в)
сульфидных руд.
Это один из самых лучших видов сырья:
При сжигании образуется газ с большим содержанием SO2 и О2, что
особенно важно при получении контактной серной кислоты.
После сжигания не остается огарка.
Незначительное содержание мышьяка.
Дешевый способ добычи.
Свойства серы.
Сера проявляет многообразие физ. химических свойств, что
связано с ее способностью менять валентность от -2 до +6. Кроме того твердая
сера существует в двух аллотропных формах:
Ромбическая Sα Тпл=112,80С
Многоклинная Sβ Тпл=119,30С
(наиболее устойчивая)
Сера обладает малой электро- и тепло-проводностью, в воде не
растворима, хорошо растворима в сероуглероде, хуже в бензине, ацетоне, толуоле.
При плавлении увеличивается в объеме на 15%.
Расплавленная сера - желтая легкоподвижная жидкость.
Ткип=444,60С
Обжигу целесообразно подвергать руды с содержанием серы 20% и
более, есть месторождения с содержанием серы до 90%. Обычно серу не выжигают, а
выплавляют: в автоклавах, в печах, или непосредственно из подземных залежей.
Последний метод наиболее выгоден и называется подземная выплавка серы, впервые
был осуществлен в США. Суть метода: серу расплавляют перегретой водой,
закачиваемой в скважину, а затем выдавливают сжатым воздухом. Температура
поддерживается в интервале 120-1590С (т.к. при дальнейшем увеличении
Т повышается вязкость серы) [8]. Этот способ полностью исключил необходимость
добычи руды и ее обогащение. Однако метод применим к залежам, удовлетворяющим
следующим требованиям:
покрывающие и подстилающие породы должны быть
водонепроницаемыми,
оптимальная глубина залегания 120-500 метров,
мощность пласта от 3 до 10 м.
степень извлечения не менее 40%.
Автоклавный метод применяют с флотацией. Суть: руда из
карьера дробится и измельчается в шаровых мельницах, затем направляется на
флотацию. Концентрат обезвоживают до 10-15% влаги и направляют во флотационный
автоклав, сюда же подают водный раствор флотореагентов улучшающих отделение
породы от серы[9]. При перемешивании в автоклаве вода диспергируется с паром,
капли ее адсорбируются на поверхности частиц породы и вместе с ними всплывают
на поверхность, а жидкая чистая сера собирается на дне автоклава.
При выплавке серы в печах используют тепло горения самой
серы, которую частично сжигают. Применяют 2, 4 и 6-ти камерные печи. Суть
метода использование тепла огарка предыдущей камеры, для плавления серы в
последующей. В настоящее время таким методом не пользуются.
Свойства
сернистого и серного ангидрида
Диоксид серы при обычной температуре бесцветный газ с
характерным резким запахом, сильно раздражающий слизистые оболочки. При
атмосферном давлении и температуре -10,10С превращается в жидкость.
В одном объеме воды растворяется около 40 объемов SO2, с повышением
температуры растворимость уменьшается. Растворимость SO2 в серной кислоте меньше,
чем в воде.
Соединяясь с водой SO2 образует сернистую кислоту, которая может
существовать только в растворе:
SO2+H2O↔H2SO3
В химических реакциях сернистый ангидрид может быть как
окислителем, так и восстановителем.
Серный ангидрид в обычных условиях
бесцветный газ. На воздухе с парами воды образует туман серной кислоты.
Сжижается при 44,750С с образованием бесцветной жидкости. Твердый
существует в нескольких формах:
α-форма SO3 Tпл=16,80С
β-форма S2O6 Tпл=32,50С
γ-форма S3O9 Tпл=62,30С
σ-форма Tпл=950С
Формы отличаются друг от друга кристаллической решеткой, химической
активностью и другими свойствами. Твердые формы серного ангидрида образуются за
счет процессов полимеризации, при хранении. При полимеризации выделяется
различное количество теплоты[10].
SO3(ж)↔α-SO3(тв) +7,1 кДж/моль
α-SO3(тв) ↔β-SO3(тв)+3,48 кДж/моль
α-SO3(тв) ↔ γ-SO3(тв)+14,33 кДж/моль
Твердые формы при нагревании диссоциируют.
С водой SO3 реагирует энергично с образованием серной кислоты
и выделением большого количества тепла:
SO3+H2O=H2SO4+131,1 кДж
Являясь сильным окислителем, вызывает обугливание
растительных и животных тканей. [10].
Жидкий SO3 смешивается с сернистым ангидридом во всех
отношениях, твердый растворяется в жидком SO2 не реагируя химически.
Сорта
серной кислоты.
Промышленность выпускает несколько сортов серной кислоты,
различающихся содержанием Н2SO4 и SO3 (своб.), а также
количеством и составом примесей. Все требования, предъявляемые к сортам серной
кислоты, регламентируются стандартами и систематически пересматриваются в
соответствии с изменениями техники производства кислоты и нужд ее потребителей.
Нитрозным методом получают сравнительно
низкоконцентрированную кислоту, содержащую 75% H2SO4. контактным методом
может быть получена серная кислота практически любой концентрации[12].
Чтобы уменьшить возможность кристаллизации серной кислоты при
перевозке и хранении, установлены такие концентрации товарных сортов серной
кислоты, которые соответствуют низким температурам кристаллизации.
Сырьем служит элементарная сера или серосодержащие вещества,
из которых может быть выделена сера или получен сернистый ангидрид.
руды самородной серы
сернистые соединения металлов
сернистые соединения природных горючих газов, нефти, угля
сульфаты
серосодержащие отходы различных производств.
1.2 Сырьевые источники и методы получения серной кислоты
Содержание серы в земной коре составляет меньше 0,1%. Сера
встречается в виде самородных серных руд, в виде сернистых металлов(FeS2, ZnS, PbS) в виде сернокислых
солей (CaSO4, BaSO4, MgSO4). При извержении вулканов выделяется сернистый газ, при гниении
животных отходов - сероводород. Сера также содержится в клетках животных и
растений, в нефти, в каменном угле.
Основным сырьем для производства элементарной серы,
сернистого ангидрида, серной кислоты служат самородные серные руды и сульфиды.
Некоторые сульфиды, например пирит FeS2 или специально добываются из-зи содержания
серы или попутно, при извлечении других сульфидов, применяемых при производстве
цветных металлов.
Основные технологические стадии процесса:
) получение диоксида серы,
) окисление диоксида серы,
) абсорбция триоксида серы,
Рассмотрим каждую из них в отдельности.
Как видно из схема необходимым шагом является получение SO2, его получают различными
способами, наиболее распространенный - обжиг железного колчедана при доступе
воздуха[13].
Вместо пирита обжигу подвергают флотационный колчедан,
продукт флотации медных руд с низким содержанием меди и углистый колчедан,
получаемый при обогащении каменных углей с высоким содержанием серы.
Диоксид серы также получают сжиганием серы. В этом случае
образуется газ, свободный от примесей, поэтому его не надо очищать, что
значительно удешевляет производство.
Важным источником диоксида серы являются отходящие газы
заводов цветной металлургии, при выплавке одной тонны меди образуется 7, 5 тонн
SO2, из которого можно получить
более 10 тонн серной кислоты.
Также диоксид серы получают из топочных газов печей на
каменном угле с высоким содержанием серы[4].
Более подробно рассмотрим получения диоксида путем сжигания
серы, т.к. этот способ используется в рассматриваемом цеху.
1.3 Окисление серы
Горение серы представляет собой сложный процесс, в связи с
тем, что сера имеет молекулы с различным числом атомов в различных аллотропных
состояниях и большой зависимостью ее физико-химических свойств от температуры.
Механизм горения серы меняется в зависимости от температуры и давления
кислорода.
Окисление серы начинается еще до ее загорания. При давлении
8,0-22,6 кПа (0,6-170 мм рт. Ст.) и температуре 55-1500 С процесс
протекает по цепной реакции. Для каждой температуры имеются свои минимальные и
максимальные давления кислорода, за пределами которых реакция не идет. При
160-2600С и нормальном давлении бывает так называемое
холоднопламенное горение, характеризующееся очень малой скоростью реакции.
Процесс горения серы представляет собой испарение жидкой серы
и горение паров в газовой фазе. На интенсивность испарения серы значительное
влияние оказывает температура. Так при повышении температуры от 120 до 180
интенсивность испарения возрастает в 5-10 раз, а от 180 до 4400С -
300-500 раз.
При высоких температурах скорость химической реакции
окисления серы больше скорости физических процессов, поэтому скорость процесса
горения определяется процессами тепло- и массо-отдачи (протекает в диффузионном
режиме). Чтобы увеличить скорость процесса необходимо уменьшить размер капель,
при этом сократится время их испарения[14]. Мелкое распыление частиц и
равномерное их распределение в воздушном потоке увеличивает поверхность
контакта, облегчает нагрев и испарение частиц.
Исследование горения капель серы с применением метода следа
(фиксация на фотопленку) привело к разработке теории горения - связанной со
«взрывным» характером горения серы и изучение его основных закономерностей.
Сжигание серы происходит в печи, которые делятся на:
А) Печи для сжигания жидкой серы.
Б) Печи для сжигания твердой серы.
. Наиболее распространены горизонтальные форсуночные печи,
оборудованные распыливающими форсунками. Обычно это стальной футерованный
барабан диаметром от 3,4 до 7 м, длинной 10-15 м. производительность по сере
300 т/сутки и более.
Одной из главных задач при конструировании серосжигающих
установок является получение газа заданной концентрации с минимальным
содержанием примесей. Это не только вещества, поступающие с не достаточно
чистым сырьем, но также триоксид серы, оксиды азота, продукты неполного
сгорания серы, не успевшая окислится сера. Присутствие примесей в газе зависит
от технологического режима работы серосжигающих установок.
Более концентрированный газ по SO2 получают при
меньшем суммарном объеме газа и более высокой температуре.
Нижний предел температуры печи для сжигания серы в кислороде
в зависимости от содержания SO3 в печном газе установлен следующим
образом:
При Т=350-4000 содержание SO3 составляет 35%;
-6500 7%
-7500 4%
При 9000 и выше SO3 отсутствует, поскольку при
высоких температурах происходит термическая диссоциация.
При высоких температурах более 13000С кислород
воздуха реагирует с азотом с образованием оксидов азота. Содержание оксидов
азота по ГОСТу не должно превышать 0,0005% (2 мг/м3). Для достижения
норм вводят дорогостоящий денитратор - гидразинсульфат.
Также для сжигания серы успешно применяются циклонные печи,
которые представляют собой полую камеру с тангенциональным вводом жидкой серы и
воздуха[15].
Скорость потока 100-120 м/с, Т=1200-13000С,
содержание SO2=16-18% об. Объем аппарата в 30-40 раз меньше
форсуночной печи при такой же производительности.
Достоинства:
улучшенный тепло- и массообмен
уменьшение объема конструкции и эксплуатационных расходов.
меньшее образование оксидов азота из-за высоких скоростей
. В процессе сжигания твердой серы исключаются ее
предварительное плавление и операции отстаивания и очистки.
Сжигание твердой серы - это двухстадийный процесс:
плавление твердой серы
испарение ее и взаимодействие паров с кислородом воздуха.
По конструкции печи делят на:
А) Ванные
Б) С псевдоожиженным (кипящим) слоем
В) комбинированные.
А) Футерованная ванна с расплавленной серой через слой
которой барботирует первичный воздух. Частицы серы за счет турбулизации
плавятся при Т=300-380. на границе раздела фаз Т=4500 сера
испаряется. Для сжигания паров серы над уровнем барботажного слоя по
касательной вводится вторичный воздух. Верхний слой над расплавом серы
представляет собой шлак, через который фильтруются пары серы. Концентрация SO2
в газе 14-15%.
Б) С псевдоожиженным (кипящим) слоем, ее достоинство - можно
сжигать серу с высоким содержанием примесей (мышьяк, селен и т.д.). Т.к.
температура кипения этих примесей ниже Тпл. серы они остаются в шламе. Шлам
содержит песок и шамотную крошку, которые специально вводят для создания
кипящего слоя.
В) Печь ПГС (предварительной газификации серы). Основные
достоинства: хорошая утилизация тепла горения серы, очистка печного газа от
паров воды и летучих примесей. Т. в зоне испарения 350-4000, в зоне
обжига 600-11000 конц. SO2 в газе13-14%.
1.4 Физико-химические основы процесса контактного окисления
диоксида серы
Равновесие
процесса
Напишем уравнение реакции:
SO2 + O2 2SO3 + 99 кДж/моль ((500ºС)
Равновесие обратимой реакции в соответствии с принципом
Ле-Шателье сдвигается в сторону образования SO3 при понижении
температуры и повышении давления; соответственно увеличивается равновесная
степень превращения SO2 в SO3
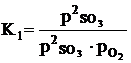 , (1.1)
, (1.1)
где K1 - константа равновесия;
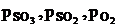 - парциальные давления SO2, SO3, O2.
- парциальные давления SO2, SO3, O2.
Для не слишком высоких давлений К1 зависит только
от температуры[16].
Для расчета равновесных состояний удобно преобразовать
уравнение, извлекая из обеих частей квадратный корень.
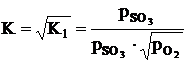 . (2.1)
. (2.1)
Зависимость К от температуры определяется уравнением
Ван-Гоффа:
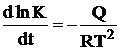 , (1.3)
, (1.3)
где Q - теплота реакции, отнесенная к одному молю сернистого газа;
T - абсолютная температура;
R - газовая постоянная.
Зависимость теплоты реакции от температуры может быть
выражена для ограниченного интервала температур простым уравнением
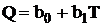 (1.4)
(1.4)
где 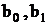 - постоянные.
- постоянные.
Подставляя (4) в (3), интегрируя и переходя к десятичным
логарифмам, получаем не которое уравнение, подставив в него экспериментально
рассчитанные константы равновесия в интервале температур 400-600ºС имеем следующее уравнение:
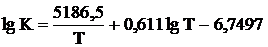 . (1.5)
. (1.5)
Значения К, рассчитанные с помощью этого уравнения приведены
на рисунке 1.5.
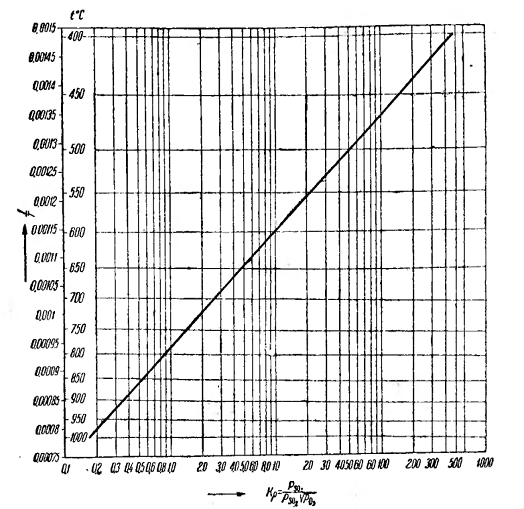
Рисунок 1.5 - Константы равновесия 2SO2 + O2 2SO3
С учетом вышестоящего уравнения получаем выражение
молекулярной теплоты реакции
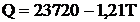 (1.6)
(1.6)
Влияние
температуры на равновесие процесса
Степенью контактирования называют отношение парциального
давления SO3 в данной смеси к сумме парциальных давлений SO3 и SO2.
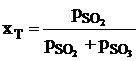 , (1.7)
, (1.7)
где 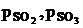 - парциальные давления в состоянии
равновесия
- парциальные давления в состоянии
равновесия
С учетом уравнения 2 получим:
 (1.8)
(1.8)
где р - обще давление газа, атм;
а - начальный объемный процент SO2 в газовой смеси (до
начала образования триоксида);
b - начальный объемный процент кислорода.
Объединяя вышеуказанные уравнения получим окончательное
выражение для х.
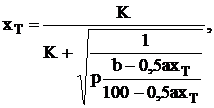 (1.9)
(1.9)
В состоянии равновесия достигается максимальное значение
степени контактирования. [17].
В таблице 1.2 приведены значения хТ при различных
температурах, давление газа составило 1 атм., состав газовой смеси: 7% SO2, 11% О2, 82% N2.
Таблица 1.2 - Зависимость хТ от температуры
|
Температура, ºС хт·102
|
400 99,25
|
430 98,5
|
450 97,64
|
480 95,6
|
510 92,5
|
540 88,06
|
570 81,75
|
600 73,85
|
|
Температура, ºС хт·102
|
620 67,9
|
650 59,6
|
675 49,9
|
700 44,2
|
750 31,5
|
850 15,2
|
900 10,3
|
1000 5,0
|
Влияние
начального состава газа
Из уравнения 10 видно, при постоянных температурах и давлении
теоритическая степень контактирования тем выше, чем больше b - начальная концентрация
кислорода и меньше а - начальная концентрация диоксида серы. В реальном
производстве невозможно менять начальное содержание диоксида серы, поэтому
увеличивать степень контактирования можно, изменяя концентрацию кислорода.
Таблица 1.3 - Зависимость хТ от разбавления
воздухом обжиговых газов
|
а
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
b хт
|
18,4 97,32
|
16,72 97,16
|
15,28 96,98
|
13,68 96,75
|
12,43 96,47
|
11,00 96,07
|
8,15 94,61
|
6,72 92,78
|
Влияние давления
С повышением давления член уравнения 9 уменьшается, а так как
он обратно пропорционален с хT, следовательно степень контактирования
возрастает. В литературе имеются данные зависимости степени контактирования от
давления, которые были получены для газа состава: 7% SO2, 11% О2, 82% N2.
Таблица 1.4 - Зависимость степени контактирования от давления
|
Температура, ºС
|
хT, при давлении в отм.
|
|
1
|
5
|
10
|
25
|
50
|
100
|
|
400 500
|
99,25 93,61
|
99,67 97,15
|
99,76 97,90
|
99,85 99,25
|
99,90 99,06
|
99,93 99,33
|
Однако при высоких давлениях уравнение 9 перестает быть
точным из-за большого отклонения от закона идеальных газов, анализ рисунка 8
показывает, что при увеличении давления и достижения высоких значений могут
быть достигнуты высокие показатели контактирования.
Следующим шагом производства серной кислоты является
абсорбция триоксида серы.
Кинетика
процесса
Скорость реакции оказывает определяющее влияние на количество
окисляющегося SO2 в единицу времени на единице поверхности катализатора и технико-экономические
показатели процесса. Процесс стремятся проводить так, чтобы скорость окисления SO2, а также степень его
превращения были максимальны.
Механизм процесса каталитического окисления описывается
уравнениями
[A] + SO2 [B] + SO3
[C] + O2[A]+ SO3
[B] + SO2 [C]
[C] V24+ + SO3
где [A], [B], [C] - комплексы пятивалентного ванадия, ([A]
соответствует V25+O22-, [B] - V25+O2-,
[C] - V25+SO32-).
Следует отметить, что повышение давления естественно
увеличивает и скорость реакции. Однако повышенное давление в этом процессе
применять нерационально, так как кроме реагирующих газов пришлось бы сжимать
балластный азот, составляющий обычно 80% от всей смеси.
Механизм каталитической реакции окисления строится на
изучение кинетики представлении об активном центре. Современные промышленные
ванадиевые катализаторы имеют разнообразный и сложный состав: основной
каталитически активный компонент - V2O5, структурообразующую основу и промоторы,
различающиеся по назначению. Каталитическая активность промотированных ванадиевых
катализаторов в несколько сотен раз выше активности чистого пентоксида ванадия.
В настоящее время в промышленности используются ванадиевые
катализаторы, промотированные калием. Результаты рентгено-структурного анализа
и исследований плавкости системы показали, что активным комплексным соединением
здесь является V2O5∙K2S2O7, которое при температуре процесса (больше 380°C) находится в виде тонкой
пленки расплава на поверхности пористого носителя.
Ванадиевые контактные массы в промышленных условиях эксплуатируются
при температурах 400-600°С. Это обусловлено оптимальным сочетанием высокой
скорости процесса с максимальной равновесной степенью превращения.
На общую скорость процесса окисления SO2 в SO3 на катализаторе
оказывают влияние внешне- и внутреннедиффузионные торможения. Влияние внешней
диффузии незначительно ~3%. Внутренняя диффузия приобретает решающее влияние
при высококонцентрированном сернистом газе. Уменьшить суммарное диффузное
влияние позволяет:
увеличение скорости газа;
уменьшение размера зерна катализатора.
Но это приводит к увеличению гидравлического сопротивления
слоя. Его можно уменьшить применяя специальную форму гранул КМ, например кольца
для стационарного слоя катализатора.
Давление с точки зрения термодинамики и кинетики положительно
влияет на скорость процесса и выход.
Для проведения процесса чаще всего используют ванадиевый
катализатор, о котором в литературе имеется достаточно много информации,
рассмотрим альтернативный катализатор на основе олова [5].
1.5 Физико-химические основы процесса абсорбции триоксида серы
Последней стадией процесса производства серной кислоты
контактным методом является извлечение SO3 из газовой смеси и
превращение его в серную кислоту. В зависимости от того, подвергается ли газ
осушке перед контактным аппаратом, различают два механизма процесса выделения SO3:
. Газ подвергается осушке - SO3 абсорбируют серной
кислотой. Метод наиболее распространенный, осуществляется в башнях абсорберах. SO3 растворяется в кислоте,
а затем взаимодействует с содержащейся в ней водой:
nSO3+H2O→H2SO4 +(n-1) SO3
А) если n>1 образуется олеум
Б) если n<1 образуется разбавленная серная кислота
Для получения олеума газ содержащий SO3 вначале пропускают через
олеумный абсорбер. Здесь поглощается часть SO3 (в соответствии с равновесием
процесса абсорбции). Окончательное поглощение SO3 происходит в
моногидратном абсорбере. По мере повышения концентрации олеума к нему добавляют
кислоту из моногидратного абсорбера (разбавляют до товарного состава) и избыток
подают на склад.
. Газ не подвергается осушке Если газ, выходящий из
контактного отделения, содержит больше воды чем необходимо для образования
кислоты, происходит не абсорбция SO3, а конденсация паров серной кислоты, при
охлаждении такого газа в башне. Одновременно с конденсацией паров на
поверхности башни наблюдается конденсация паров с образованием тумана,
выделяемого затем в электрофильтрах. Если продукция сернокислотного цеха
выдается в виде серной кислоты концентрацией ниже 95%, выделение триоксида серы
желательно вести путем конденсации паров кислоты, которая протекает с большей
скоростью чем абсорбция SO3. Кроме того конденсация происходит при высокой
температуре, что облегчает отвод тепла и его использование.
1.6 Получение концентрированного триоксида серы и концентрированного
олеума
%-ный SO3 обладает высокой химической активностью и
поэтому широко применяется в различных химико-технологических процессах вместо
серной кислоты и олеума. Основные способы получения 100% SO3:
1. Окисление 100% SO2 в среде чистого
кислорода на ванадиевом катализаторе. Этот метод связан с использованием
дорогостоящего сырья.
2. Отгонка SO3 из олеума концентрацией более 20% в аппаратах,
обогреваемых топочными газами. Способ применяют на заводах органического
синтеза.
3. Отгонка SO3 из олеума циркулирующего в абсорбционном
отделении сернокислотного производства с использованием тепла газов,
поступающих из контактного отделения, или топочных газов.
Сжижается 100%-ный SO3 при 44,750С, кристаллизуется при 16,80С.
После замерзания триоксид серы полимеризуется, перевести в жидкое состояние
нагреванием при атмосферном давлении невозможно, поскольку SO3 часто возгоняется со
взрывом. Чтобы сохранить серный ангидрид в жидком состоянии к нему добавляют
стабилизаторы (борсодержащие соединения BF3, B2O3 и др.). Концентрация
стабилизатора составляет от 0,01 до 2% (в расчете на SO3) в зависимости от его
состава и температуры. Например, SO3 при добавке В2О3 в
количестве 0,7-1,0% не полимеризуется даже при температуре -300С.
Т.к. получение и перевозка серного ангидрида связаны с
большими трудностями, вместо него в некоторых случаях применяют
высокопроцентный олеум, содержащий 65% SO3(св.).
Высококонцентрированный олеум применяется в производстве
анилиновых красителей и некоторых др. производств. Температура кристаллизации
такого олеума равна -350С, в связи с этим он удобен для перевозок.
Приготавливают его насыщением олеума или моногидрата газообразным или жидким SO3, получаемым при
термическом разложении 20-25%-ого олеума за счет тепла топочных газов или тепла
контактного узла.
В данном разделе рассмотрены вопросы механизма и кинетики
процессов окисления серы, диоксида серы, абсорбции триоксида серы. По анализу
литературных данных окисления диоксида серы в триоксид контактным методом
установлено, что температура (до 400ºС), давление сдвигают
равновесие в сторону образования продуктов, к тому же при работе в области
высоких давлений (выше 100 атм.) возможно получение достаточно высоких значений
степени контактирования, т.е. выхода реакции.
2.
Технологический раздел
2.1
Принципиальная блок-схема процесса
Процесс получения серной кислоты из элемента серы по короткой
схеме методом двойного контактирования с промежуточной абсорбцией газов состоит
из следующих стадий:
1) Разгрузка и складирование жидкой серы;
2) Осушка атмосферного воздуха концентрированной
серной кислотой;
3) Сжигание жидкой серы в атмосфере сухого воздуха и
утилизация тепла с получением перегретого пара;
4) Окисление диоксида серы в триоксид серы в
четырехслойном контактном аппарате;
5) Абсорбция триоксида серы;
6) Складирование и отгрузка готовой продукции.
2.2
Описание аппаратурно-технологической схемы установки
Узел
приема жидкой серы.
Схема получения начинается с приемки серы из железнодорожных
цистерн 1 в емкости хранилища А-3, А-4. При поступлении жидкой серы в
железнодорожных цистернах предусмотрен узел разогрева цистерн. Разогрев цистерн
осуществляется посредством электрообогревателя или с помощью насыщенного пара
для достижения и поддержания температуры серы 135-145°С.
Жидкая сера из цистерны 1 с помощью сжатого воздуха сливается
в промежуточные сборники серы А -1, А-2 из которых погружными насосами подается
в хранилища А-3, А-4. Уровень в складских сборниках А-3, А-4 поддерживается в
интервале 0,9-7,2 м, обеспечивается сигнализация при превышении максимального и
минимального уровней.
Осушка
воздуха
Прежде, чем подать воздух в печь для сжигания серы его нужно
осушить, так как влага воздуха взаимодействует с триоксидом серы, образуя туман
серной кислоты, который плохо улавливается в абсорбционном отделении, и это
приводит к потере продукции и загрязнению атмосферы, так как туман серной
кислоты вместе с выхлопными газами выбрасывается в атмосферу. Кроме того, при
плохой осушке воздуха в теплообменной аппаратуре будет происходить конденсация
паров серной кислоты, что вызовет коррозию оборудования.
Осушка воздуха проводится кислотой с массовой долей
моногидрата (H2SO4) 98,6±0,3%. При осушке воздуха
кислота нагревается за счет поглощения влаги, поэтому кислоту необходимо
охладить.
Процесс поглощения влаги воздуха кислотой является
абсорбционным процессом, в котором участвуют две фазы - жидкая и газовая,
происходит переход вещества из газовой фазы в жидкую.
Скорость поглощения воды определяется скоростью диффузии их
через газовую пленку. Количества паров воды (кг/т), диффундирующих через
пленку, то есть поглощенных серной кислотой определяется по уравнению:
= K × F × DP,
где Q - количество паров воды, кг/т;
К - коэффициент абсорбции, кг/(м2×ч×Па);
D Р - среднелогарифмическая разность
давлений паров воды в начале и конце процесса (движущая сила абсорбции, Па);-
поверхность соприкосновения фаз (поверхность насадки), м2.
Воздух подается в сушильную башню А-5 из компрессорного
отделения воздуходувками.
Атмосферный воздух подается на осушку в нижнюю часть противоточной
сушильной башни А-5 насадочного типа, в верхней части башни установлены
осадители тумана патронного типа, предназначенные для очистки осушенного
воздуха от брызг и тумана серной кислоты. На орошение подается серная кислота с
концентрацией 98,6±0,3% из сборника А-6 в количестве погружным
насосом, охлажденная с температурой не более 60оС.
В сушильно-абсорбционном отделении (САО) использован метод
работы с совмещением циклов орошения сушильной башни А-5 и промежуточного
моногидратного абсорбера А-9. Для обоих циклов орошения совместным является
циркуляционный сборник А-6.
Кислота с температурой не более 70ºС, выходящая из нижней части сушильной башни поступает в сборник
А-6, куда также поступает кислота из нижней части промежуточного абсорбера А-9
и вода на разбавление кислоты совмещенного цикла до концентрации 98,3-98,9% Н2SО4 из
отделения химводоочистки. На сборнике А-6 установлены 3 погружных насоса два из
которых предназначены для орошения промежуточного абсорбера А-9, один для
орошения сушильной башни.
НА линию нагнетания насоса, подающего кислоту из сборника А-6
в сушильную башню, последовательно установлены по два горизонтальных
кожухотрубчатых холодильника А-7, А-8..Пройдя через которые, кислота
поступает в общий коллектор, а из него - на орошение сушильной башни А-5 через
устройства для распределения кислоты[18].
Температура кислоты, поступающей на орошение сушильной башни,
после смешения потоков не должна превышать 600С.
Сжигание
жидкой серы
Сжигание жидкой серы происходит по реакции:
(жидк) + О2 (газ) = SO2 (газ) +
362,4 кДж
Процесс сжигания жидкой серы в атмосфере воздуха зависит от
условий обжига, температуры и скорости газового потока, физико-химических
свойств жидкой серы (наличие в сере зольных и битумных примесей).
Капли серы в результате прогрева начинают испаряться, а пары
серы активно взаимодействовать с кислородом воздуха. Происходит процесс
диффузионного горения серы с образованием диоксида серы (SO2).
При высоких температурах скорость окисления серы выше
скорости физических процессов испарения и диффузии. Поэтому общая скорость
реакции определяется процессами массо- и теплопередачи (протекает в
диффузионном режиме) [21].
Подвод необходимого количества предварительно осушенного
воздуха к серной форсунке способствует полному сгоранию серы. Мелкое распыление
серы увеличивает поверхность нагрева и скорость испарения и способствует
быстрому сгоранию серы.
Таким образом, необходимым условием полного и быстрого
сгорания серы является подвод необходимого количества воздуха к устью факела,
мелкое и равномерное распыление серы, турбулентность потока, высокая
температура.
При сжигании серы получают газ тем концентрированней, чем
выше температура.
На практике получение концентрированного газа ограничивается
тем, что при температуре выше 1300°С разрушается футеровка
печи и газоходов, а также при этой температуре образуются окислы азота, которые
являются нежелательной примесью в газе, идущим на дальнейшую переработку.
Поэтому сжигание серы ведут при температуре 1000-1100°С.
Теоретически максимальная объемная доля диоксида серы в газе,
которую можно получить - 21% (без учета образования SO3), то есть не
выше объемной доли кислорода в воздухе. Имеется тесная взаимосвязь между
температурой на выходе из печи и концентрацией газа SO2. Концентрация SO2 может приблизительно
проверяться на основе температуры на выходе печи. Теоретическая температура
пламени, соответствующая различному проценту содержания SO2 в газах печи, следующая,
данные приведены в таблице 2.1:
Таблица 2.1 - Примерная температура на выходе из серной печи
|
% SO2
|
% O2
|
Примерная
температура на выходе из серной печи Подаваемый воздух при 55 0С
|
|
6,0
|
13,1
|
692 0С
|
|
7,0
|
11,7
|
758 0С
|
|
8,0
|
10,2
|
826 0С
|
|
8,5
|
9,4
|
861 0С
|
|
9,0
|
8,6
|
897 0С
|
|
9,5
|
7,8
|
934 0С
|
7,0
|
970 0С
|
|
10,5
|
6,2
|
1007 0С
|
|
11,0
|
5,3
|
1044 0С
|
|
11,5
|
4,5
|
1081 0С
|
|
12,0
|
3,6
|
1119 0С
|
Указанные температуры и концентрации О2 будут не в
точности такими, как преобладающие значения температур и концентрации при
указанных концентрациях газа SO2. Температуры возрастают пропорционально величине
тепла в воздухе горения и уменьшаются пропорционально величине потерь тепла
вследствие теплового излучения, конвекции и т.д. Температура также
увеличивается за счет предварительной конверсии диоксида серы в триоксид серы в
печи.
Для обеспечения полного сгорания серы, процесс ведут с
избыточной подачей воздуха в печь, которая обеспечивает объемную долю диоксида
серы в газе в интервале (11,2-11,8)%.
Жидкая сера из хранилищ серы А - 3,4 поступает в
циркуляционный сборник А-10 и оттуда погружным насосом фирмы подается в серную
печь А-11 на три (четыре) форсунки. Давление серы - 1,04-1,24 МПа (10,4-12,4
кгс/см2).
Серные форсунки - парообогреваемые механического типа,
установлены в торцевой части печи. Их характеристика:
1
производительность
по сере - 4,5 - 5,0 м3/час (8,0-9,0) т/ч;
2
давление
серы оптимальное 1,04-1,24 МПа (10,4-12,4 кгс/см2).
Серная печь - цилиндрический горизонтальный сосуд, внутри
футерован огнеупорным кирпичом.
Серная печь для пуска ее в работу из холодного состояния
оборудована пусковой горелкой (для разогрева применяется природный газ).
Осушенный воздух из сушильной башни А-5 с остаточным
содержанием паров воды не более 0,01% объемных (~80,36 мг/нм3)
подается в серную печь А-11, в которую через форсунки впрыскивается жидкая
сера. В печи образуется газ, содержащий 11,2 - 11,8% SO2, при температуре
1050-1100°С, который охлаждается в котле-утилизаторе А-12 до температуры
410-430°С
и направляется на первый слой контактного аппарата А-13. Содержание сернистого
ангидрида в газе регулируется подачей серы в печь с корректировкой по
температуре газа на выходе из нее.
Котел-утилизатор А-12 - с естественной циркуляцией, с
одноступенчатой системой испарения, в состав которого входит барабан и два
испарителя, соединённые с барабаном с помощью опускных и подъёмных трубопроводов.
Для поддержания температуры газа перед 1 слоем контактного
аппарата имеется байпасная линия, предназначенная для пропуска газа через часть
котла-утилизатора, минуя две его секции.
На байпасной линии и газоходе после котла-утилизатора
установлены регулирующие заслонки, изменением положения которых регулируется
температура перед контактным аппаратом.
Окисление
диоксида серы в триоксид серы в четырехслойном контактном аппарате
В производстве серной кислоты контактным методом окисление
диоксида серы в триоксид идет по реакции:
SO2 + 1/2 O2 « SO3 + 96,114
кДж,
в присутствии катализатора. Реакция окисления диоксида серы в
триоксид серы обратима, при этом для каждой температуры имеется определенный
предел степени контактирования, который зависит от температуры (при прочих
равных условиях). С увеличением температуры равновесие сдвигается влево. Отсюда
вытекает, что для получения наибольшей степени контактирования необходимо
процесс окисления диоксида серы вести в несколько ступеней, охлаждая газ перед
каждой ступенью, но не ниже температуры зажигания катализатора. Для этой цели
установлены теплообменники.
В производственных условиях большое значение имеет скорость
реакции окисления диоксида серы в триоксид серы. От скорости этой реакции
зависит количество диоксида серы, окисляющегося в единицу времени на единицу
массы катализатора и, следовательно расход катализатора, размеры контактного
аппарата и другие показатели процесса контактирования.
Скорость процесса контактирования прямо зависит от константы
скорости реакции, которая увеличивается с повышением температуры, скорость
процесса окисления зависит также от равновесной степени контактирования,
которая с повышением температуры уменьшается.
Следовательно, скорость процесса окисления диоксида серы в
триоксид серы зависит от двух величин, одна из которых с повышением температуры
увеличивается, другая - уменьшается.
Кроме того, скорость окисления зависит от состава газовой
смеси. Поэтому при различном составе газа оптимальные температуры неодинаковы.
Для выбранной контактной системы применен метод двойного
контактирования, сущность которого состоит в том, что после окисления диоксида
серы в триоксид серы технологический газ выводят из контактного аппарата на
абсорбцию образовавшегося SO3, а затем опять направляют на окисление
оставшегося в газе диоксида серы.
Это позволяет:
·
повысить
процент контактирования диоксида серы в триоксид серы и обеспечить минимальные
выбросы в атмосферу;
·
увеличить
скорость окисления диоксида серы в триоксид серы за счет увеличения соотношения
SO2 / SO3 путем абсорбции SO3 после третьего
слоя катализатора, что сдвигает равновесие реакции окисления в сторону
образования триоксида серы.
В качестве катализаторов применяются ванадиевые катализаторы.
Форма гранул - полые цилиндры и полые цилиндры с оребренной поверхностью -
обеспечивает низкое гидравлическое сопротивление слоев катализатора.
Катализаторы характеризуются низкой температурой зажигания - 380оС
(390оC).
Активным комплексом ванадиевого катализатора является
соединение пятиокиси ванадия с пиросульфитом калия (V2O5 × K2S2O7).
Это соединение при температуре процесса контактирования находится в состоянии
расплава на поверхности носителя. Диоксид серы и кислород, сорбируемые в
расплаве, взаимодействуют с пятиокисью ванадия, при последовательном протекании
следующих реакций:
V2O5 + SO2 « V2O4
+ SO3
V2O4 + 1/2 O2 « V2O5
С течением времени активность ванадиевого катализатора
снижается, поэтому для достижения максимальной степени контактирования
постепенно повышают температуру газа на входе во все слои контактного аппарата.
Контактный аппарат двухступенчатый четырехслойный А-13
представляет собой цилиндрический аппарат из нержавеющей стали, изолирован
снаружи минераловатными матами и гофрированными алюминиевыми листами. По центру
контактного аппарата проходит опорная колонна. Между колонной и корпусом
аппарата смонтированы радиальные торообразные (изогнутые) перегородки -
разделительные (для разделения слоев контактного аппарата) и перфорированные
(для поддерживания катализатора). На перфорированные перегородки укладываются
керамические седловины до образования горизонтального уровня, на которые
помещается слой керамических шариков высотой около 50 мм. Поверх керамических
шариков насыпается ванадиевый катализатор, сверху которого помещают слой
керамических шариков высотой около 50 мм.
На первых трех слоях контактного аппарата осуществляется
первая ступень контактирования - окисления диоксида серы в триоксид серы, на 4
слое - вторая ступень. Процесс контактирования происходит при температуре
410-625°С.
При температуре ниже 380°С (температуры зажигания катализатора) процесс
контактирования прекращается, при температуре выше 625°С возникает опасность
спекания контактной массы (при повышении температуре выше 645оС в
течение 15 мин. катализатор спекается).
Пройдя первый слой контактного аппарата, газ в результате
реакции нагревается до 610-625ºС. Степень конверсии SO2 на первом слое - около
65%. Нагретый газ охлаждается в пароперегревателе второй ступени А-14 и
направляется на второй слой катализатора. Регулирование температуры газа перед
вторым слоем в пределах 430-450оС осуществляется перепуском части
горячего газа мимо пароперегревателя через байпас, снабженный регулирующим
дросселем.
Степень конверсии SO2 после второго слоя - около 89%. После второго
слоя газ охлаждается с 515-530°С до 430-450°С в А-14, и поступает на
третий слой.
Степень конверсии SO2 после третьего слоя составляет не менее 96%.
После третьего слоя газ охлаждается с 455-475°С до 270-300 °С, проходя по трубному
пространству теплообменника А-15 и поступает в следующий теплообменник А-16,
где охлаждается до температуры 170-185оС, после чего поступает на
абсорбцию SО3
в промежуточный моногидратный абсорбер А-9.
После абсорбера газ, содержащий около 0,55% SO2, нагревается от 80-95оC до 310-375ºС, проходя по межтрубному пространству теплообменника А-15,
нагревается до 415-430оС, и далее - на четвертый слой катализатора.
Температура перед четвертым слоем регулируется за счет перепуска части
нагреваемого газа по байпасу мимо межтрубного пространства теплообменника А-15.
Степень конверсии SO2 после четвертого слоя составляет не менее 99,7%.
Выходящий с четвертого слоя контактного аппарата газ с
температурой 430-4500С охлаждается до 140-1750С в
экономайзере А-18, представляющем собой однокорпусной аппарат, и направляется
во второй моногидратный абсорбер А-92.
Абсорбция
триоксида серы
При поглощении газообразного триоксида серы из газовой смеси
одновременно с физическим процессом растворения газа в жидкости, протекает
химическое взаимодействие поглощенного триоксида серы с водой:
H2O (жидк) + SO3 (газ) = H2SO4
(жидк) + 131,1 кДж
В процессе поглощения триоксида серы серной кислотой
выделяется тепло, которое разогревает серную кислоту. Для использования этой
кислоты в процессе поглощения триоксида серы ее охлаждают. Поглощение триоксида
серы проводится в башнях (абсорберах). Полнота абсорбции зависит от массовой
доли моногидрата в кислоте, температуры поглощающей кислоты и от плотности
орошения и температуры газа.
Газообразный триоксид серы наиболее полно абсорбируется
кислотой с массовой долей моногидрата 98,3%. При меньшей или большей массовой
доле моногидрата в серной кислоте способность ее поглощать триоксид серы
ухудшается.
Над кислотой с массовой долей моногидрата (H2SO4)
менее 98,3% в газовой фазе находятся пары воды, над кислотой с массовой долей
моногидрата более 98,3% - триоксид серы.
При поглощении триоксида серы из газовой смеси кислотой с
массовой долей моногидрата (Н2SO4) менее 98,3% часть
триоксида серы соединяется с парами воды, образуя туман серной кислоты, который
плохо улавливается в процессе поглощения и уносится с выходящими из абсорбера
газами. Чем ниже массовая доля моногидрата в серной кислоте и выше ее
температура, тем больше образуется тумана, и тем выше потери триоксида серы.
При концентрации кислоты более 98,3% триоксид серы
поглощается неполностью, так как из этой кислоты выделяется SO3. В этом случае с газами,
выходящими из абсорберов, уносится триоксид серы.
Таким образом, в обоих случаях ухудшается абсорбция триоксида
серы, увеличиваются его потери и загрязнение атмосферы.
Полнота абсорбции в значительной степени зависит от
температуры серной кислоты: чем ниже температура, тем выше степень абсорбции.
Контактный газ после первой ступени контактирования и
охлаждения в теплообменнике А - 15 и А-16 до температуры 170-185оС
поступает в верхнюю часть моногидратного абсорбера А-9 на первую ступень
абсорбции. Моногидратный абсорбер А-9 представляет собой вихревую прямоточную
башню, конструктивно состоящую из трех аппаратов (корпусов) - непосредственно
самой абсорбционной башни с вихревыми тарелками и двух брызготуманоуловителей,
предназначенных для очистки газа от брызг и тумана серной кислоты. На орошение
подается серная кислота концентрацией 98,6±0,3%.
Подача кислоты на орошение промежуточного абсорбера А-9
производится двумя погружными насосами из сборника А-6. Кислота от первого
насоса поступает в два параллельно работающих кожухотрубчатых холодильника поз.
А-171,2, в которых она охлаждается до температуры не более 75ºС, и подается в «голову» промежуточного абсорбера А-9. Кислота от
второго насоса, пройдя два параллельно работающих холодильника А-181,2
подается на верхний коллектор и на три ступени орошения.
Из абсорбера серная кислота с температурой 80-95оС
поступает в сборник А-6.
Газ после первой ступени абсорбции проходит очистку от брызг
и тумана серной кислоты в двух последовательно установленных
брызготуманоуловителях. В каждом брызготуманоуловителе организована
двухступенчатая очистка, на первой ступени установлен осадитель тумана,
представляющий собой двухслойный сетчатый мат, на второй ступени - осадители
тумана - концентрические элементы (патроны), в качестве фильтрующего слоя
используется стекловолокно.
Далее, пройдя через межтрубное пространство теплообменника
А-15 газ поступает на вторую ступень контактирования на четвертый слой
контактного аппарата.
Степень абсорбции в моногидратном абсорбере А-92 -
не менее 99,9%.
Складирование
готовой продукции (склад кислоты)
Для хранения и отгрузки производимой цехом кислоты предусмотрен
склад кислоты с общей вместимостью хранилищ не менее недельной
производительности цеха.
На складе имеются три складских сборника кислоты (хранилища)
А-19 емкостью 3000 м3 каждое, установленные в поддоне, способном в
случае аварии вместить 1500 т кислоты.
Для перекачки кислоты из хранилищ установлены три
промежуточных сборника А-20 - по одному на каждое хранилище, емкостью 16 м3
каждый с установленными на них вертикальными насосами.
Из промежуточных сборников кислота погружными насосами
подается в цех экстракционной фосфорной кислоты
Кроме приема серной кислоты из сушильно-абсорбционного
отделения, ее хранения и отгрузки потребителям технологическая схема склада
позволяет производить перекачку кислоты в сушильно-абсорбционное отделение (для
пуска цеха).
Серная кислота из склада откачивается в цех экстракционной
фосфорной кислоты.
К складу подведен железнодорожный путь нормальной колеи.
Предусмотрена возможность слива кислоты из цистерн в хранилища, а также залив
кислоты в цистерны.
Уровень в хранилищах замеряется уровнемерами, при превышении
уровней сверх установленных срабатывает сигнализация.
2.3
Неполадки в работе и способы их ликвидации
Произведем расчет материальных потоков по
аппаратурно-технологической схеме получения 100% серной кислоты из серы,
исходные данные приведены в таблице 2.2
Таблица 2.2 - исходные данные
|
Массовая доля
моногидрата (H2SO4), %
|
92,5 - 94,0
|
|
Массовая доля
свободного триоксида серы (SO3), % не менее
|
-
|
|
Массовая доля
железа (Fe), %, не более
|
0,006
|
|
Массовая доля
ос-татка после прокаливания, %, не более
|
0,02
|
|
Массовая доля
окис лов азота (N2O3), %, не более
|
0,00005
|
|
Массовая доля
нитросоединений, %, не более
|
не нормируется
|
|
Массовая доля
мышьяка (As), %, не более
|
0,00008
|
|
Массовая доля
хлористых соединений (Cl), %, не более
|
0,0001
|
|
Производительность
по кислоте, т/г
|
1000
|
Технологический цикл состоит из трех массообменных процессов:
1) Сжигание серы
(жидк) + О2 (газ) = SO2 (газ)
2) Окисление диоксида серы в триоксид серы
2 + 1/2 O2 « SO3,
3) Абсорбция триоксида серы
H2O (жидк) + SO3 (газ) = H2SO4
(жидк)
Расчет будем проводить в обратном порядке, исходя из годовой
потребности.
По реакции определим массы всех компонентов:
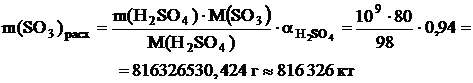

По реакции определим массы всех компонентов:
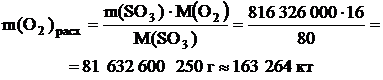
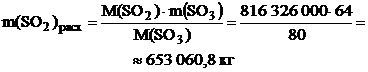
По реакции определим массы всех компонентов:
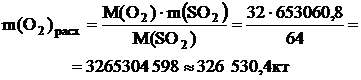
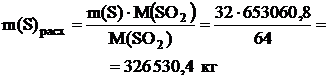
.4
Контроль и управление процессом
В химической промышленности механизации, автоматизации и
контролю параметров уделяется большое внимание. Это объясняется сложностью и
высокой скоростью протекания технологических процессов, а также
чувствительностью их к нарушению режима, вредностью условий работы, взрыво- и
пожароопасностью перерабатываемых веществ и т.д.
В свою очередь надежность и достоверность технологического
контроля в значительной мере определяется качеством автоматизации.
Таблица 2.3 - Контролируемые параметры
|
Аппарат
|
Контролируемый
параметр
|
Примечание
|
|
Сушильная башня
|
- содержание
влаги в подаваемом воздухе - содержание влаги в осушенном воздухе - расход
воздуха - концентрация орошающей кислоты на входе - pH среды - концентрация орошающей кислоты на выходе - температура
газа - - температура кислоты
|
Агрессивная
кислотная среда
|
|
Печь для
сжигания серы
|
- расход
воздуха - расход серы - температура воздуха - температура серы - концентрация
диоксида серы в печных газах - концентрация триоксида серы в печных газах -
концентрация примесей в печных газах - температура печных газов
|
Агрессивная
кислотная среда Повышенная температура
|
|
Контактный
аппарат
|
- Температура
входящих газов - расход входящих газов - содержание триоксида серы во
входящих газах - содержание диоксида серы во входящих газах - Температура
отходящих газов - расход отходящих газов - содержание триоксида серы во
отходящих газах - концентрация примесей во входящих газах - содержание
диоксида серы во отходящих газах - температура катализатора
|
Агрессивная
кислотная среда Повышенная температура
|
|
Абсорбер
|
- - Температура
входящих газов - расход входящих газов - содержание триоксида серы во
входящих газах - содержание диоксида серы во входящих газах - Температура
отходящих газов - расход отходящих газов - содержание триоксида серы во
отходящих газах - концентрация примесей во входящих газах - содержание
диоксида серы во отходящих газах - температура входящей кислоты - температура
выходящей кислоты
|
Агрессивная
кислотная среда Повышенная температура
|
Технологический контроль и управление обеспечивает
двухуровневая АСУТП с многофункциональным микропроцессорным контроллером МФК
производства НПО «Текон» (г. Москва) и ПЭВМ. С выходов контроллера управляющая
информация в виде соответствующих сигналов поступает на исполнительные
механизмы и регулирующие органы (электродвигатель привода шнека, регулирующие
клапаны). Второй уровень - выдача информации от контроллеров на
автоматизированное рабочее место (АРМ) оператора с промышленной ПЭВМ.
Информация по оптимальному управлению процессом передается от ПЭВМ к
контроллеру [22].
Регулируемые параметры контролируются с помощью датчиков
расходомеров, уровнемеров, приборов давления, pH-метров, кондуктометров и
приборов температуры.
Для контроля подачи кислоты, серы, применяется ультразвуковой
расходомер типа УРСВ фирмы «Взлет», город Санкт-Петербург.
Для контроля расхода воздуха применяются расходомеры типа ЭВ
- 200.
В данном проекте для контроля уровня в емкостном оборудовании
применяем ультразвуковой уровнемер типа Зонд 3М, который выпускает ПО
«Старорусприбор». Принцип действия ультразвуковых уровнемеров основан на
свойстве ультразвуковых колебаний отражаться от границы раздела сред с
различными сопротивлениями.
Для измерения давления в контактном аппарате выбираем
манометры АИР-20/М2-ДИ производства «Элимер» (п. Менделеево), обладающими
хорошими техническими характеристиками и применимые для агрессивных сред.
В данном проекте контроль рН среды в сушильной башне
производится pH-метрами ПМП 221, которые выпускает НПО «Измерительная техника» г.
Москва[23].
Для измерения температуры в печи применяют преобразователь
сопротивления. Его принцип действия основан на изменении электрического
сопротивления проводников и полупроводников в зависимости от температуры.
Измерение температуры сводится к измерению электрического сопротивления термопреобразователя
с помощью электроизмерительных приборов.
Выбираем платиновый преобразователь сопротивления типа
ТСП-5071, обеспечивающий диапазон измерения температуры (100 - 1100)°С.
Открытие и закрытие клапанов обеспечивается КМР-Э («Руст», г.
Москва).
В данном разделе составлена и описана
аппаратурно-технологическая схема получения серной кислоты, подробно
рассмотрены каждая стадия процесса.
Описаны возможные неполадки в технологическом процессе и пути
устранения проблемы.
Произведен материальный баланс массообменных процессов.
3.
Расчетный раздел
3.1
Исходные данные для расчета
Исходные данные для расчета контактного аппарата представлены
в таблице 1, схема представлена на рисунке 1.
Таблица 1 - Исходные данные для расчета аппарата
|
Производительность
аппарата А, т/сутки Н2SO4
|
2793
|
|
Концентрация, %
SO2, в газе (а) О2, в газе (b) N2,
в газе
|
11 63,8 27,2
|
|
Конечная
степень контактирования, х
|
0,97
|
Четырехслойный контактный аппарат с промежуточным
теплообменом загружен гранулированной контактной массой и работает по режиму
[1, стр. 229], представленному в таблице 2.
Заданная производительность 1 000 000 тонн серной кислоты в
год, или 1 000 000/365=2793
Определим объем газа, поступающего в контактный аппарат, с
указанной производительностью[6]:
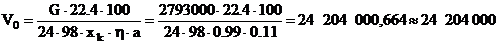 (3.1)
(3.1)
где V0 - объем газа, м3/ч;
G - производительность аппарата, кг Н2SO4/сутки;
η - коэффициент
использования SO2;
C - концентрация диоксида серы в исходном газе, %.
3.2
Расчет равновесной степени превращения от температуры
Построим кривую зависимости равновесной степени превращения
от температуры для данной газовой смеси для определения наилучших параметров
контактного аппарата, расчет будем вести послойно. Газовая смесь поступает на
первый слой при температуре 440ºС, на входе реакции
разогревается до 590ºС, найдем степень при
повышении температуры[6]:
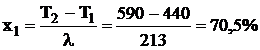 (3.2)
(3.2)
где х1 - степень контактирования, %;
T1 - температура на входе в слой, ºС;
T2 - температура на выходе из слоя, ºС;
λ - коэффициент
[1].
Построим диаграмму Т-х аппарата (рисунок 3.1) с вводом
холодного газа после первого слоя. От начальной точки А на оси х (T=440ºC) проводим прямую до точки Б (Т=590ºС, х=0,705), прямая АБ - адиабата первого слоя
После первого слоя добавляется холодный газ (15-30%) при
температуре 220ºС, температуру смеси на
входе во 2й слой принимаем 480ºС.
Найдем объем газовых потоков поступающих в аппарат на 1-й
слой(V1) и после первого слоя (V2):
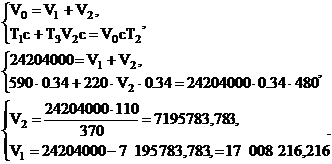
где с - теплоемкость газа, ккал/(м3·град).
2 слой.
Определим степень контактирования на входе во 2-й слой после
смешения газовых потоков
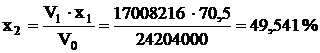
На диаграмме T-х точка В (x=49,5, T=480ºC) соответствует входу
газа во 2-й слой. Из точки В проводим прямую параллельную АБ, на ней, на
расстоянии 2% от равновесной кривой хр ставим точку Г. Температура и
степень контактирования в точке Г соответствует состоянию газа на выходе из
2-го слоя (Т=551ºС, х=83%).
После 2-го слоя газовая смесь охлаждается в теплообменнике с
551 ºC до 460 ºC, определим тепловую
нагрузку теплообменника:
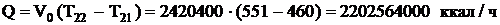
где Т21, Т22 - температура газа на
входе и выходе их слоя, ºС.
Изменением объема газа при реакции не учитываем, так как оно не
значительно. Часть газа идущего на первый слой нагревается на  , на входе в теплообменник газ имеет температуру
440-129=311ºС.
, на входе в теплообменник газ имеет температуру
440-129=311ºС.
Средняя разность температур:
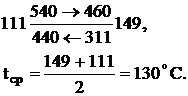
Поверхность нагрева теплообменника:
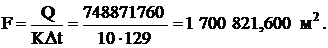
где К - коэффициент теплопередачи для кожухотрубчатых газовых
теплообменников, (К=10 ккал/(м2·ч·град), [4]
Принимаем (с учетом запаса) F=1800000 м2.
НА диаграмме T-х из точки Г проводим прямую, параллельную оси абсцисс, до
температуры 460ºС (точка Д). Из точки Д
проводим прямую, параллельную АБ, до пересечения с равновесной кривой хр.
На этой прямой на расстоянии около 1,5% до равновесной кривой ставим точку Е.
Температура и степень контактирования в точке Е есть состояние газа на выходе
из 3-го слоя[6].
слой.
По диаграмме Т-х температура газа при входе в слой 460 ºС, на выходе 481 ºС, степень контактирования
на входе 83%, на выходе 93%. После 3 го слоя катализатора газовая смесь
охлаждается в теплообменнике с 481 ºС до 438 ºС. Определим тепловую нагрузку теплообменника
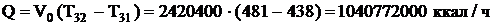
Газ нагревается на 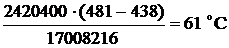 , на входе в теплообменник газ имеет температуру 311-61=250ºС.
, на входе в теплообменник газ имеет температуру 311-61=250ºС.
Средняя разность температур:
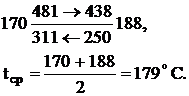
Поверхность нагрева теплообменника:
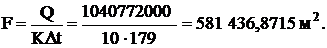
Принимаем 600000 м2.
На диаграмме Т-х из точки Е проводим прямую, параллельную оси
абсцисс до линии, отвечающей 438 ºС (точка Ж). Из точки Ж
проводим прямую, параллельную АБ, до пересечения с равновесной кривой хр.
Ниже равновесной кривой на наклонной линии ставим точку З (х=97%, Т=446 ºС).
Согласно диаграмме Т-х температура газа на входе в слой равна
438 ºС, на выходе 446 ºС, степень контактирования
93% и 97% соответственно[6].
После 4-го слоя смесь охлаждается с 446ºС до 430ºС.
Тепловая нагрузка теплообменника:
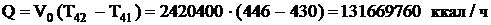
Газ нагревается на 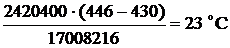 , на входе в теплообменник газ имеет температуру 250-23=199ºС.
, на входе в теплообменник газ имеет температуру 250-23=199ºС.
Средняя разность температур:
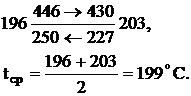
Поверхность нагрева теплообменника:
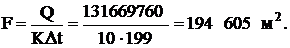
Принимаем 200 000 м2.
|
Слой
катализатора
|
Объем газа, м3/ч
|
Температура, ºС
|
Степень
контактирования, %
|
Поверхность
теплообменника, м2
|
|
|
Вход
|
Выход
|
Вход
|
Выход
|
|
|
1- й слой
|
17008216
|
440
|
590
|
0
|
70,5
|
|
|
2- й слой
|
24204000
|
480
|
551
|
49,5
|
83
|
1 800 000
|
|
3- й слой
|
24204000
|
460
|
481
|
83
|
93
|
600 000
|
|
4- й слой
|
24204000
|
438
|
4464
|
93
|
97
|
200 000
|
3.3
Определение количества катализатора
Удельная поверхность (на 1 т/сутки вырабатываемой серной
кислоты)
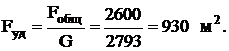
Расход катализатора определяем отдельно для каждого слоя по
уравнению:
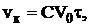
где vк - расход катализатора, м3,
V0 - объем газа, поступающего на данный слой, м3/слой,
τ - время контактирования,
с.
Если пренебрегать изменением количества кислорода в ходе
окисления, объем газа в первом слое:
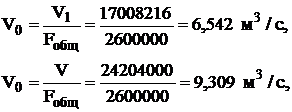
Необходимое время контактирования для достижения заданной
степени превращения в каждом слое катализатора можно найти по уравнению:

где 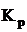 - константа равновесия,
- константа равновесия,
k - константа скорости реакции,
А - коэффициент.
Рассчитаем время контактирования, для исходного состава
смеси, задаемся степенью превращения х в первом слое равной 0,705. Разделим
слой на 8 участков, с тем что бы значение х незначительно менялось в по
сравнению с его значениями в предыдущем и последующем участке, содержание
диоксида серы примем 11,2%, кислорода 10,5%.
Температуру газа в конце каждого участка определим по формуле
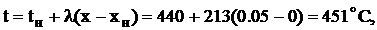
где tн - температура на входе в контактный аппарат, ºС,
х - степень превращения.
Для вычисления 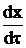 для начала участка воспользуемся значениями констант равновесия и
скорости реакции k, приведенными в [4].
для начала участка воспользуемся значениями констант равновесия и
скорости реакции k, приведенными в [4].
Для примера в начале первого участка (х=0, t=440ºC) значение 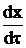 =0,206, в конце (х=0,05, t=451ºC)
=0,206, в конце (х=0,05, t=451ºC) 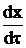 =0,422. Соответственно
=0,422. Соответственно 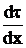 =4,848 в начале первого участка и 2,370 в
конце. Среднее значение на первом участке
=4,848 в начале первого участка и 2,370 в
конце. Среднее значение на первом участке
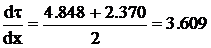
Принимая 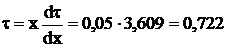 с.
с.
Результаты расчета для первого слоя приведем в таблице 3.4.
Таблица 3.4 - Результаты расчета для первого слоя
|
x1
|
x2
|
k1
|
k2
|
a
|
|
0
|
0,05
|
0,22
|
0,45
|
11,2
|
|
0,05
|
0,1
|
0,45
|
1,03
|
11,2
|
|
0,1
|
0,2
|
1,03
|
1,59
|
11,2
|
|
0,2
|
0,4
|
1,59
|
2,65
|
11,2
|
|
0,4
|
0,6
|
2,65
|
2,81
|
11,2
|
|
0,6
|
0,65
|
2,81
|
2,81
|
11,2
|
|
0,65
|
1,65
|
2,81
|
2,81
|
11,2
|
|
1,65
|
0,705
|
2,81
|
2,81
|
11,2
|
Таблица 3.5 - Результаты расчета контактного аппарата
|
Слой
катализатора
|
Объем газа, м3/с
|
τ, с
|
Коэффициент
запаса
|
Расход
катализатора, м3
|
|
1
|
6,542
|
1,625
|
4
|
42,523
|
|
2
|
9,309
|
2,025
|
3
|
56,55218
|
|
3
|
9,309
|
2,665
|
2
|
49,61697
|
|
4
|
9,309
|
2,985
|
1,3
|
36,12357
|
|
|
|
Итого
|
184,8157
|
Итоговым показателем расчета становится расход катализатора,
равный 185 м3.
3.4
Расчет патрубков
Диаметр патрубков определяется объемным расходом жидкости и
рекомендуемой скоростью движения потока по уравнению:
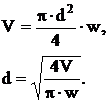
где d - внутренний диаметр патрубка, м;- скорость движения
потока (для воздуха при естественной тяге - 20 м/с);
V - объемный расход потока, который берется из материального
баланса,  .
.
а) патрубок для подачи газа на первый слой:
Объемный расход:
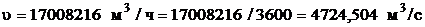 .
.
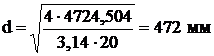 .
.
Принимаем 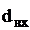 = 500 мм [5].
= 500 мм [5].
б) Диаметры всех остальных патрубков будут равны:
Объемный расход:
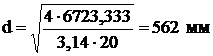 .
.
Принимаем 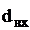 = 580 мм [5].
= 580 мм [5].
В данном разделе проведён расчет контактного четырехслойного
аппарата для окисления диоксида серы на ванадиевом катализаторе, по результатам
расчета степень контактирования составила 97%, общая поверхность теплообмена
2600 м2, производительность 1000 000 тонн/год.
4.
Экономический раздел
.1
Исходные данные для расчета
Данный проект посвящен реконструкции цеха производства серной
кислоты, которая потребляется многими отраслями промышлености, в том числе ВПК
и ракетно-космической отраслью.
В данном разделе приводится расчет технико - экономических
показателей проекта и обоснование экономической эффективности[19].
Таблица 4.1 - Исходные данные экономического расчета
|
Показатель
|
Данные
|
|
1
Производительность по готовой продукции, т/ч
|
2793
|
|
2
Продолжительность инвестиционного проекта:
|
5
|
|
- инвестиции,
год
|
2
|
|
- доходы, год
|
3
|
|
3 Страховые
взносы, %
|
34
|
|
4 Ставка налога
на прибыль, %
|
20
|
|
5 Ставка
дисконта, %
|
12
|
4.2
Расчет потока реальных денег от инвестиционной деятельности
Расчет
инвестиций в строительство здания
Для размещения проектируемого производства потребуется
помещение размером примерно 40×40 м и высотой 16 м.
Таблица 4.2 - Стоимость строительства здания
|
Наименование
помещения
|
Объем
производственного помещения, м3
|
Стоимость 1 м3,
тыс. руб./м3
|
Полная
стоимость помещения S, тыс. руб.
|
|
Производственное
здание
|
25600
|
10
|
256000
|
Расчет
инвестиций в технологическое оборудование
Итоговая стоимость оборудования в результате расчетов
представлена в таблице 4.3.
Таблица 4.3 - Стоимость оборудования
|
Наименование
оборудования
|
Кол-во
|
Стоимость ед.
тыс. руб.
|
Общая
стоимость, тыс. руб.
|
|
Цистерна
железнодорожная
|
1
|
700
|
700
|
|
Емкость-хранилище
|
1
|
3336
|
3336
|
|
Емкость-хранилище
|
1
|
37336
|
37336
|
|
Хранилище
|
1
|
1258,7
|
1258,7
|
|
Хранилище
|
1
|
5415,00
|
5415
|
|
Сушильная башня
|
1
|
5415,00
|
5415
|
|
Циркуляционный
сборник
|
1
|
3336
|
3336
|
|
Теплообменник
|
1
|
30
|
30
|
|
Теплообменник
|
1
|
30
|
30
|
|
Абсорбер
|
2
|
13000
|
26000
|
|
Циркуляционный
сборник
|
8
|
398
|
3184
|
|
Серная печь
|
1
|
20002,4
|
20002,4
|
|
Котел-утилизатор
|
1
|
1144,9
|
1144,9
|
|
Контактный
аппарат
|
1
|
15476,8
|
15476,8
|
|
Теплообменник
|
1
|
30
|
30
|
|
Теплообменник
|
2
|
30
|
60
|
|
Теплообменник
|
1
|
30
|
30
|
|
Теплообменник
|
4
|
30
|
120
|
|
Теплообменник
|
1
|
30
|
30
|
|
ИТОГО
|
|
|
122 934,8
|
|
Неучтенное
оборудование, тыс. руб.
|
22 934,8
|
|
Транспортно-заготовительные
расходы, тыс. руб. (10%)
|
22 934
|
|
Монтаж
оборудования, тыс. руб. (5%)
|
6146,74
|
|
Монтаж
т/проводов, тыс. руб. (5%)
|
6146,74
|
|
КИП, монтаж,
тыс. руб. (7%)
|
8605,436
|
|
Полная
сметная стоимость
|
189 702,516
|
Расчет
инвестиций в оборотный капитал
Среднесуточное потребление реагентов представлено в таблице
4.5.
Таблица 4.5 - Среднесуточное потребление продукта
|
Наименование
сырья, материалов и энергоресурсов
|
Единицы
измерения
|
По проекту
|
|
|
|
|
|
1. Сера
техническая в пересчете на основное вещество
|
кг/т
|
329
|
|
2. Серная
кислота в пересчете на моногидрат
|
кг/т
|
0,400
|
|
3. Катализатор
Марка LP120 Марка XLP 110 Марка XLP 220
|
кг/т (дм3/т)
|
0,102 0,022 (0,04) 0,072 (0,136) 0,008 (0,015)
|
|
4. Сода
каустическая в пересчете на основное вещество (едкий натр)
|
кг/т
|
0,500
|
|
5. Поваренная
соль
|
кг/т
|
0,304
|
|
6. Аммиак, 100% NH4OH
|
кг/т
|
0,005
|
|
7. Кварцевый песок 0,5-2,0 мм
|
кг/т
|
0,132
|
|
8. Катиониты: Амберлайт IR 120Н
|
кг/т
|
0,0018
|
|
9. Аниониты: IRA 402Cl IRA 67
|
кг/т кг/т
|
0,0009 0,0009
|
|
10. Органопоглотитель Пьюролайт А - 860S
|
кг/т
|
0,0008
|
|
11. Тринатрийфосфат 12. Сульфат алюминия
|
кг/т кг/т
|
0,0045 0,095
|
|
13. Полиакриламид
|
кг/т
|
0,0017
|
|
14. Ингибитор Jurbysoft 80 plus 15. Биоцид Jurbysoft DB 16. Биоцид Jurbysoft 63
|
кг/т кг/т кг/т
|
0,0056 0,0013 0,002
|
|
17. Электроэнергия
|
кВт.ч/т
|
61
|
|
18. Сжатый
воздух 18.1 Технологический для раскачки серы 18.2 Для КИПиА
|
Нм3/т
|
10,1 8,0
|
|
19. Пар технологический
|
Гкал/т
|
0,02
|
|
20. Топливо условное (природный газ)
|
кг у.т./т м3/т
|
2,3 2,0
|
|
21. Вода техническая
|
м3/т
|
1,26*
|
|
22. Пар энергетический
|
т/т Гкал/т
|
1,25 0,95**
|
Заключение
В данном дипломном проекте представлена технология получения
серной кислоты(моногидрата) контактным способом.
Рассмотрена термодинамика и кинетика процесса
контактирования, абсорбции триоксида серы изучены вопросы получения
концентрированной серной кислоты и олеума.
Разработана технологическая схем, состоящая из узла приемки
жидкой серы, осушки воздуха, сжигания жидкой серы в печи, окисления диоксида
серы, абсорбции триоксида серы и складирования готовой продукции.
Произведены необходимые расчеты (расчет равновесной степени
превращения, определения количества катализатора, расчет патрубков). В
соответствии с проделанными расчетами выбран и начерчен основной аппарат
процесса - контактный аппарат.
Литература
серный кислота аппарат контактный
1. Клименко
В.В., Клименко А.В., Снытин С.Ю., Федоров М.В. Энергия и климат: что же в самом
деле известно науке? // Теплоэнергетика. 1994. 1. С. 5-11.
2. Глинка,
Н.Л. Общая химия: учебное пособие для вузов / Н.Л. Глинка; под ред. А.И.
Ермакова. - 28-е изд., перераб. и доп. - М.: Интеграл-Пресс, 2000. - 728 с. -
Предметный указатель: с. 706-727
. Известия
томского ордена трудового красного знамени политехнического института им. с.м.
Кирова, Исследование активности хромооловянных катализаторов для окисления SO2
в SO3, Н.П. Курин и Н.Т. Рудюк, том 58, 1996 год
. Справочник
сернокислотчика / под ред. К.М. Малина. - 2-е изд., доп. и перераб. - М.:
Химия, 1971. - 744 с.: ил.
. Лащинский
А.А. Конструирование сварных химических аппаратов. Справочник. - Л.:
Машиностроение, 1981.
. Ахметов
Н.С. Общая и неорганическая химия: учебник для вузов / Н.С. Ахметов. - 3-е
изд., перераб. и доп. - М.: Высшая школа, 1998.
. Фишер.
Практикум по общей химии: вводный курс по экологически безопасной программе с
экспериментами по регенерации химических реактивов / Х. Фишер; пер. М.Б.
Тарабана; под ред. Н.М. Бажина. - Новосибирск: НАУКА, 1996.
. Реми
Г. Курс органической химии = Lehrbuch der Anorganischen Chemie: пер. с нем. /
Г. Реми. - М.: Мир, 1972-1974. Т. 1 / пер. А.И. Григорьева; под ред. А.В.
Новоселовой. - 1972.
. Спицын
В.И. Неорганическая химия: учебник для вузов / В.И. Спицын, Л.И. Мартыненко. -
М.: Изд-во МГУ, 1991.
. Химическая
технология: учебник для вузов / под ред. А.В. Белоцветова. - 3-е изд., испр. и
доп. - М.: Просвещение, 1971
. Малин
К.М., Боресков Г.К., Пейсахов и др. Технология серной кислоты и серы. -
М.:Государственное научно-техническое издательство химической литературы. 1941
. «Справочник
химика» т. 3, Л.-М.: Химия, 1965 стр. 118, 522-523
. Хорват,
Ласло. Кислотный дождь = Savas eso / Л. Хорват; пер. с венг. В.В. Крымского;
под ред. Ю.Н. Михайловского. - М.: Стройиздат, 1990
. Егоров
А.П. Общая химическая технология неорганических веществ: Учебное пособие для
химических техникумов / А.П. Егоров, А.А. Шерешевский, И.В. Шманенков. - 3-е
изд., перераб. - М.: НТИ химической литературы, 1955
. Химическая
технология неорганических веществ: в 2 книгах: учебное пособие для вузов / Т.Г.
Ахметов, Р.Т. Порфирьева, Л.Г. Гайсин и др.; под ред. Т.Г. Ахметова. - М.:
Высшая школа, 2002
. Менковский
М.А. Технология серы / М.А. Менковский, В.Т. Яворский. - М.: Химия, 1985
. Павлов
Н.Н. Неорганическая химия: учебник для вузов / Н.Н. Павлов. - М.: Высшая школа,
1986
. Егоров
А.П. Общая химическая технология неорганических веществ: учебное пособие для
техникумов / А.П. Егоров, А.А. Шерешевский, И.В. Шманенков. - 4-е изд.,
перераб. - М.: Химия, 1964
. Экономика:
учебник / под ред. А.С. Булатова. - 2-е изд., перераб. и доп. - М.: БЕК, 1997
. Савицкая
Г.В. Анализ хозяйственной деятельности предприятия: учебник для вузов / Г.В.
Савицкая. - 2-е изд., перераб. и доп. - Минск: Экоперспектива, 1998
. Амелин
А.Г. Производство серной кислоты / А.Г. Амелин. - 3-е изд., испр. - М.: Химия,
1967
. Голубятников
В.А. Автоматизация производственных процессов в химической промышленности:
учебник для техникумов / В.А. Голубятников, В.В. Шувалов. - 2-е изд., перераб.
и доп. - М.: Химия, 1985
. Кулаков
М.В. Технологические измерения и приборы для химических производств: учебник
для вузов / М.В. Кулаков. - 2-е изд., перераб. и доп. - М.: Машиностроение,
1974
. Экономика
и статистика фирм: учебник для вузов / В.Е. Адамов [и др.]; под ред. С.Д.
Ильенковой. - 2-е изд. - М.: Финансы и статистика, 1997
. Зайцев
Н.Л. Экономика, организация и управление предприятием: учебное пособие для
вузов / Н.Л. Зайцев; Государственный университет управления. - 2-е изд., доп. -
М.: ИНФРА-М, 2008
. Коровин,
Н.В. Общая химия: Победитель конкурса учебников. Для вузов. - М.: Высшая школа,
1998
. Панин
В.Ф. Экология для инженера: общеэкологическая концепция биосферы и
экономические рычаги преодоления Глобального экологического кризиса; обзор
современных принципов и методов защиты биосферы: учебное пособие / В.Ф. Панин,
А.И. Сечин, В.Д. Федосова. - М.: Ноосфера, 2000
. Альперт
Л.З. Основы проектирования химических установок: учебник для техникумов / Л.З.
Альперт. - 4-е изд., перераб. и доп. - М.: Высшая школа, 1989