Производство безводного и десятиводного сульфата натрия как ускорителя для затвердения бетона
"Производство
безводного и десятиводного сульфата натрия, как ускорителя для затвердения
бетона"
Введение
Тема ускорителей в современной технологии бетона
чрезвычайно скандальна, умышленно запутанная и заангажированая самими
производителями и продавцами хим. добавок.
В первую очередь данное положение вещей
обусловлено тем, что с помощью ускорителей можно достаточно легко, просто и
дешево существенно модифицировать технологическую производственную цепочку. А
это деньги, большие деньги. А так как деньги любят тишину, продавцы хим.
добавок стараются её соблюдать, особенно не распространяясь на тему
ускорителей. Гораздо охотней они популяризируют и пропагандируют свои
полифункциональные составы вообще, хотя немалую часть успеха следует, по праву,
отдать удачно подобранным в их составах ускорителям.
Так для тяжелых бетонов весьма критичный
параметр - время оборачиваемости дорогостоящей формоснастки, становится
возможным модифицировать не по пути затратной и энергоемкой тепловлажностной
обработки, а «подстегивая» кинетику набора прочности химическим путем.
В легких бетонах, и в частности в пенобетонах, с
помощью ускорителей удается минимизировать влияние минералогии, тонины помола и
длительности хранения цемента на качество продукции, «выпередить» осадку
свежеприготовленной пенобетонной матрицы ускоренным набором её прочности.
Как это ни парадоксально, но именно тема
ускорителей - краеугольный камень также и экономики полифункциональных
модификаторов. Простейшая композиция подобного рода состоит как минимум из двух
компонентов, - обычно это пластификатор второй (реже третьей) группы
эффективности и какой либо ускоритель, либо специально подобранная смесь
ускорителей, обеспечивающих аддитивность (или даже синергизм) компонентов.
Элементарный рецептурно-экономический анализ показывает, что стоимость именно
ускорителя и является основным ценообразующим фактором таких полифункциональных
составов. Иными словами, - кто «сидит» на дешевых ускорителях - тот владеет
рынком полифункциональных добавок. Даже «легкаятехногенность» (а порой и не
легкая) некоторых составов не является преградой для их массового применения -
критерии экономической целесообразности перевешивают.
Одним из ускорителей является сульфат натрия и
его разновидности.
безводный десятиводный
сульфат натрий
Характеристика сульфата натрия как
ускорителя для затвердевания бетонов
В промышленности (СН) сульфат натрия (глауберова
соль) очень широко применяется в производстве красителей, стекла и соды. В
основном его получают естественным путем - из минерала мираболита. Крупнейшим в
мире поставщиком мираболита является залив Кара-Богаз-Гол на Каспии. Дешевизна
и доступность (СН) сделала его очень привлекательным для многих отраслей
промышленности. В т.ч. и для строительной индустрии.
Да, давно гостирован, да применяется, куда ни
сунься - все и везде о нем упоминают. Но информация присутствует в форме
отрывочных фрагментов и кусков. Мало того, еще в 1977 - 1978 гг. выдающиеся
советские бетоноведы Баженов и Волженский устроили, что называется, форменную
грызню на страницах журнала «Бетон и железобетон» (ведущего периодического
издания страны по строительным технологиям, той поры), - перемыли косточки как
друг другу(культурно и цивилизовано, разумеется), так и сульфату натрия, под
горячую руку. Видно утверждение, что некоторые щелочные соли, и в первую
очередь сульфат натрия, резко негативно влияют на длительную прочность
цементного камня, особенно при малых В/Ц, действительно имеет место - нет дыма
без огня. (Негативное влияние сернокислых солей и сульфата натрия, в частности,
было доказано еще исследованиями Бутта Ю.М. и Рояка Г.С. в 1956 г.)
Западноебетоноведение, в большинстве своем,
также игнорирует (СН) как ускоритель. Во всяком случае, в знаменитой книге
канадскогобетоноведаРамачандрана «Добавки в бетон» о нём практически не
упоминается.
Механизм действия сульфата натрия заключается в
том, что реагируя с гидратом окиси кальция, выделяющимся из цемента, он
образует гипс по формуле:
Ca(OH)2
+ Na2SO4
+ nH2O
= CaSO4
x 2H2O
+ 2NaOH + H2O
Образующийся мелкодисперсный гипс реагирует с
цементным клинкером и способствует более быстройвыкристализации новообразований
из цементного геля. Наиболее эффективно как ускоритель, сернокислый натрий
проявляет себя на шлакопортландцементах и пуццолановых портландцементах. При
тепловлажностной обработке его эффективность увеличивается, хотя следует особо
оговорить влияние сульфата натрия (в той или иной степени данные выводы будут
справедливы и для других сернокислых солей - электролитов) на марочную 28-ми
суточную прочность пропаренных бетонов в реальных диапазонах водо-цементных
соотношений. Ведь не секрет, что в производственных условиях В/Ц далеко от
оптимальных значений. [1]
Производство сульфат натрия.
Свойства и характеристики
Сульфат натрия - важный химический продукт,
потребность в котором неуклонно растет и до сего дня не полностью
удовлетворяется. Задачи ликвидации дефицита сульфата натрия, повышения его
качества и улучшения технико-экономических показателей соответствующих
производств требуют проведения целого ряда научно-исследовательских работ,
расширения и углубления знаний научных работников, заводского персонала и
проектантов.
Кристаллогидрат сульфата натрия был описан Р.
Глаубером в 1658 г. как остаток, получаемый в результате взаимодействия
поваренной соли с серной кислотой, и был назван им мирабилитом. В 1767 г.
мирабилит, который стали также называть глауберовой солью, был выделен из
природных рассолов, найденных в Германии в местечке Фридрихсхалле.
В дальнейшем сульфат натрия был обнаружен во
многих природных рассолах на разных континентах земного шара, а также в виде
твердых соляных отложений, содержащих, в зависимости от места нахождения,
мирабилит (декагидрат) или тенардит (безводная соль).
Сульфат натрия занимает одно из важнейших мест
среди продуктов химической промышленности большинства развитых стран. Общее
производство сульфата натрия в мире росло до 1975 г., в последующие годы
производство уменьшилось, одновременно увеличился спрос на продукт высокого
качества. Согласно данным зарубежных экономистов к 1980 г. в США производство
должно возрасти в 1,5 раза, хотя предсказания роста в 1975-1976 гг. не
оправдались.
Сульфат натрия используют во многих
производствах, главным образом в целлюлозно-бумажной и стекольной
промышленности, а также в производстве синтетических моющих средств (CMC).
Введение сульфата натрия в процессе переработки древесины приводит к получению
так называемой «крафт»-целлюлозы. Последняя обладает жесткостью; применяют ее
для производства технических сортов бумаги повышенной прочности, используемой в
качестве упаковочного материала. В стекольной промышленности сульфат натрия
может заменить в случае необходимости соду, но годен также и в качестве
самостоятельного компонента шихты.
Порошкообразные CMC
содержат значительное количество сульфата натрия, доходящее в отдельных случаях
до 70% от общего количества.
Сульфат натрия получают из природного сырья, т.
е. природных рассолов, преимущественно морского и сульфат-карбонатного типа,
солевых отложений, содержащих мирабилит, астра-ханит, тенардит и различные
гидратированные формы сульфата магния. Две из наиболее крупных
стран-производителей - Россия и США - получают около половины продукта
переработкой природного сырья. Остальная часть сульфата натрия в этих странах -
попутный продукт производств синтетических жирных кислот, волокна (главным
образом, вискозы), хромсодержащих соединений. В ряде стран (Япония, Франция)
используют отходы серной кислоты и сульфата железа; кроме того, сульфат натрия
получают в качестве попутного продукта в производстве соляной кислоты
конверсионным методом из хлорида натрия.
В некоторых отраслях промышленности, например
нефтеперерабатывающей, образуются большие количества низкосортного сульфата
натрия, который может быть использован только после соответствующей
переработки. Использование таких отходов определяется общими ресурсами и
потребностями страны, экспортными возможностями и общим техническим уровнем
производства минеральных солей.
Основные природные источники сульфата натрия
расположены в аридной зоне земного шара, главным образом в северном полушарии.
К таким источникам относятся: зал. Кара-Богаз-Гол и оз. Кучук (Россия); Большое
Соленое Оз., оз. Сёрлз; отложения мирабилита и смеси мирабилита и тенардита в
штатах Невада, Ныо-Мехико, Техас и Калифорния (США); рапа и отложения тенардита
и мирабилита в провинциях Саскачеван и Альберта (Канада); озерная вода и
подземные рассолы в Индии и другие.
Многокомпонентный характер сырья, отчасти
находящегося в виде концентрированных растворов или получаемого в виде таковых
в результате подземного выщелачивания, определяет сложный характер переработки
его, основанный на использовании различий в физико-химических свойствах солевых
систем в зависимости от температуры проведения процесса, а также на различии в
кинетике кристаллизации отдельных твердых фаз. Во многих случаях природные
рассолы и солевые отложения перерабатывают комплексно с получением нескольких
продуктов, что является более сложной задачей, чем выделение одного продукта.
Изучение физико-химических равновесий в данных
системах было начато Я. Г. Вант-Гоффом в 1877 г. и продолжено исследователями
многих стран. Отечественная наука обогатила мир исследованиями Н. С. Курнакова,
В. П. Ильинского, В. И. Николаева, А. В. Николаева, Г. С. Сидельникова, И. Н.
Лепешкова, А. Б. Здановского, О. Д. Кашкарова, С. 3. Макарова, И. Г. Дружинина,
О. К. Янатьевой. Природные рассолы и их модели - предмет изучения на протяжении
столетия, однако все еще остаются вопросы, требующие дальнейшего рассмотрения.
Изучению различных аспектов физической химии и
технологии производства сульфата натрия посвящен ряд книг и разделов
общетеоретических монографий
Физические свойства
Молекулярная масса сульфата натрия (сернокислого
натрия) 142,048. В виде безводных кристаллов он устойчив выше 32,383 °С, а в
интервале 32,4-400 °С образует ряд полиморфных модификаций. Из них в первую
очередь следует отметить тенардит, имеющий бипирамидальные кристаллы
ромбической сингонии с отношением осей а :b
: с = 0,597 : 1 : 1,254 и переходящий при 245 СС в призмы моноклинной
сингонии. Указанные кристаллические формы отличаются по теплоемкости и
растворимости.
Для тенардита, выделенного из горячих растворов
и высушенного при 110 °С, отмечены следующие переходы:
-т
__ 180-200°С „ 240 °С
,, 570-600° С
, _
a-Na2S04--------------- P-Na2S04--------- *
Y"Na2S04 « 6-Na2S04
Склонность к связыванию с влагой у |3-формы
понижена. Процесс гидратации протекает по мере перехода Р ->- а [16, 17].
Плотность кристаллов 2,698 г/см3 и
может меняться в незначительных пределах в зависимости от условий образования.
Исследования термической устойчивости показали, что уменьшение массы начинается
с 1000 °С [18]. Прокаливание сульфата натрия сопровождается частичным
разложением; водный раствор, образующийся при растворении остатка, имеет рН 7.
Термодинамические характеристики сульфата натрия приведены в табл. 1.1. Для
расчета гиббсовой энергии образования сульфата натрия при различных
температурах предложено уравнение [19]:
AG = -1 368
908 + 38,58Г In Т -
0,005225Г2 + 130,12т
Коэффициент преломления кристаллов, измеренный в
спирте и бензоле, равен:
«а= 1,471; ng
= 1,477; = 1,485
При хранении на воздухе сульфат натрия поглощает
влагу и цементируется в монолит.
Сульфат натрия диамагнитен. Магнитная
восприимчивость составляет 0,643-10"6 В.
Температура кипения сульфата натрия 1404 °С. В
интервале от -1,2 до 32,4 °Сиз водных растворов в качестве стабильной формы
кристаллизуется декагидрат сульфита натрия Na2S04
ЮН20 (мирабилит, глауберова соль).
Мирабилит (М - 322,208) образует бесцветные
прозрачные моноклинные призмы. Плотность кристаллов 1,464 г/см3.
Мирабилит можно рассматривать как лед, в
структуру которого внедрились натрий- и сульфат-ионы; его термодинамические
характеристики приведены в табл. 1.1. При обычном давлении мирабилит
инконгруэнтно плавится при 32,4 °С, выделяя тенардит и образуя насыщенный
раствор сульфата натрия. С повышением давления температура плавления мирабилита
незначительно меняется, проходя через максимум при 32,4 °С. Значительное
понижение точки перехода вызывают посторонние вещества (например, аммиак,
хлорид натрия, едкий натр и др.; см. в последующих главах), так как их
присутствие разрушает кристаллическую решетку декагидрата.
Физико-химические свойства системы
Na2S04-Н20
На политерме системы Na+
|| S04~, Н20
(рис. II. 1).сплошной линией обозначены равновесные составы насыщенных
растворов в стабильном состоянии, а штриховой - в метастабильном.
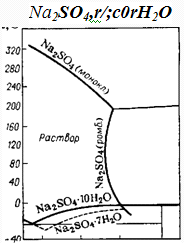
Рис.1
В указанном температурном интервале
растворимость испытывает несколько инверсий. В пределах от -1,2 до 32,38 °С в
равновесии с жидкой фазой находится мирабилит, растворимость которого
возрастает с повышением температуры. В интервале 32,38-102,88 °С (102,88 °С -
температура кипения насыщенного раствора сульфата натрия при атмосферном
давлении) зависимость растворимости от температуры носит обратный характер.
Дальнейшее повышение температуры до 150 °С слабо
* В интервале 0-32,38 °С равновесная твердая
фаза состоит из дека- гидрата сульфата натрия, а в интервале 32,38 - 241 °С из
ромбоэдрических кристаллов сульфата натрия; выше 241 °С равновесная донная фаза
представлена моноклинными кристаллами сульфата натрия.влияет на растворимость.
Выше этой температуры наблюдается прямая зависимость между растворимостью и
температурой вплоть до точки перехода ромбических кристаллов в моноклинные
(около 240 °С). Начиная с 248 °С и до критической температуры воды
растворимость резко падает и при 365 °С составляет 0,4%
В интервале 15-25 °С растворимость сульфата
натрия может быть вычислена по уравнению
lgS = 0,66006 +
0,П296Ш + 0,6962 .10~4i2
гдеS - растворимость, г/100 г Н20.
В табл. II.1 приведены значения растворимости
метастабильной твердой фазы - гепта гидрата сульфата натрия. Отметим, что выше
24,45 °С система переходит в стабильное состояние, для которого равновесной твердой
фазой является мирабилит.
Система Na2S04
- Н20 характеризуется тремя четверными точками (табл. II.2).
Кроме двух упомянутых кристаллогидратов возможно
образование других форм, существующих лишь в специальных условиях (например, в
изоморфных кристаллах на основе Na2Cr04
• 4Н20 существует Na2S04-4H20
[21]). При выветривании кристаллов мирабилита ниже температуры их плавления
могут образовываться низшие кристаллогидраты, в частности дигидрат.
Содержание сульфата натрия в растворе,
находящемся в метастабильном равновесии с твердой фазой Na2S04-7H20
Из-за наличия метастабильного гептагидрата при
охлаждении растворы сульфата натрия легко переходят в пересыщенное состояние,
которое сохраняется длительное время.[2]
Заводские способы получения
мирабилита
Химические системы, подвергающиеся охладительной
кристаллизации, проходят через три области состояний: ненасыщенных,
пересыщенных и насыщенных растворов. Область пересыщенных растворов, лежащая
выше кривой растворимости, может быть условно разделена на лабильную и
метастабильную. Вещества из пересыщенного раствора с концентрацией,
соответствующей лабильной области, кристаллизуются практически мгновенно. Из
метастабильных же растворов кристаллизация обычно происходит при вмешательстве
извне, например при введении затравочных кристаллов или интенсивном
перемешивании.
Границы метастабильной области существования
растворов сульфата натрия довольно значительны в интервале от 5 до -3 °С.
Помимо декагидрата из раствора чистого сульфата натрия может образовываться семиводный
кристаллогидрат. Лишь значительное переохлаждение приводит к переходу в область
кристаллизации. Кристаллизация при умеренном снижении температуры может идти за
счет испарения части растворителя.
При сильном пересыщении раствора в момент начала
кристаллизации образуется большое число зародышей и сравнительно мелкие
кристаллы. Для получения оптимального гранулометрического состава рекомендуется
довести раствор до состояния умеренно пересыщенного и позволить кристаллизации
протекать медленно.
Размер кристаллов также зависит от присутствия
поверхностно-активных веществ и интенсивности перемешивания суспензии. Первый
из указанных факторов тормозит рост кристаллов. Во втором случае с увеличением
интенсивности движения создаются благоприятные условия для возникновения
зародышей, т. е. образования мелкокристаллической твердой фазы. Один из
основных способов снижения скорости кристаллизации - введение затравочных
кристаллов в умеренно пересыщенный раствор. В качестве последних можно
использовать мелкую фракцию, отделенную на ситах или специально полученную
измельчением. Размер кристаллов мирабилита 0,2-1,0 мм считается оптимальным.
При размере менее 0,1 мм потери при фильтрации на центрифугах становятся
заметными.
Чистота получаемого сырого мирабилита зависит от
способа кристаллизации, размера кристаллов, способа фильтрования, промывок,
количества посторонних веществ в исходном растворе.
Примеси могут окклюдироваться - захватываться
внутрь кристаллов, а могут и присутствовать в остаточном маточном растворе. Если
последний содержит полезные компоненты, то, как правило, осадок на фильтрующей
поверхности промывают (например, при переработке растворов осадительных ванн
вискозного производства). Если маточные растворы сбрасывают в канализацию, то
необходимость промывки определяется экономическими соображениями (сравнение
потерь мирабилита за счет промывки с увеличением потерь сульфата натрия со
сбросными растворами, выводящими примеси из системы).
В основе заводского получения мирабилита путем
охлаждения рассолов подходящего состава лежит либо вакуум-кристаллизация, либо
охладительная кристаллизация за счет теплообмена с хладоагентом.
Выбор способа кристаллизации определяется
технико-экономическими соображениями и назначением маточных растворов.
Охладительная вакуум-кристаллизация позволяет
довести температуру охлаждаемой системы до 0-5 °С. Этот способ чаще всего
используют тогда, когда маточные рассолы не составляют отходов производства,
сбрасываемых в канализацию (например, при регенерации растворов из осадительных
ванн вискозного производства).
Вакуум-кристаллизация основана на охлаждении
раствора за счет адиабатического испарения части растворителя при понижении
давления. Одна из схем вакуум-кристаллизационной установки для переработки
упомянутых выше растворов приведена на рис. XIV.3, стр. 227. Скорость
кристаллизации зависит от скорости перемещения суспензии через камеры
кристаллизатора и испарения воды.
Хладоагентом служит жидкий аммиак, который в
результате теплообмена испаряется, а рассол при этом охлаждается. Температура
охлаждения зависит от давления, под которым находится аммиак: при атмосферном
давлении аммиак кипит при -34 °С; температура выходящей из кристаллизатора
суспензии -30 °С. Обычные кристаллизаторы, однако, работают под давлением и,
соответственно, при более высокой температуре (например, в ГДР на предприятии
ПО «Калий» рекомендовано охлаждение до -3° С).
С участием хладоагента охладительная
кристаллизация возможна за счет прямого контакта хладоагента и охлаждаемого
раствора в аппаратуре колонного типа. Хладоагентом служат вещества,
малорастворимые в воде, легко переходящие в газовую фазу или расслаивающиеся на
выходе смеси из колонны, например углеводороды, фреоны [57]. В верхнюю часть
колонны подается раствор, в нижнюю - хладоагент.
Непосредственный контакт и большая площадь
теплообмена обеспечивают высокие значения коэффициентов теплопередачи. Кроме
того, стенки теплообменника не зарастают мирабилитом. Недостаток метода -
загрязнение мирабилита хладоагентом и необходимость герметичной аппаратуры,
если хладоагент летуч.
Безводный сульфат натрия. Способ
плавления
Конверсия мирабилита в сульфат натрия без
применения реагентов обычно осуществляется способами плавления, выпаривания,
распылительной сушки при различных температурах [18, с. 116; 58].
Декагидрат сульфата натрия устойчив в химически
чистом состоянии ниже температуры 32,4 °С (при Р = 1 ат). Примеси, как правило,
понижают температуру его плавления (см. соответствующие системы в Части
первой). В процессе плавления мирабилита образуются две фазы: твердая -
безводный сульфат натрия, и жидкая - насыщенный раствор сульфата натрия,
содержащий растворимые примеси, присутствовавшие в мирабилите; по отношению к
последним раствор остается ненасыщенным. Распределение сульфата натрия между
твердой и жидкой фазами зависит от температуры процесса, а повышение ее
уменьшает долю сульфата, оставшегося в растворе:
Температура, °С 32,4 40 50 60 70 80 90 100 120
150
Распределение сульфата натрия, %
в твердой фазе 37,0 38,2 40,5 42,7 44,2 45,4
46,0 46,4 46,4 46,6
в жидкой фазе 63,0 61,8 59,5 57,3 55,8 54,6
54,0 53,6 53,6 53,4
Из приведенных данных следует, что повышение
температуры до 100 °С приводит к увеличению теоретического выхода продукта в
твердую фазу от 37,0 до 46,4%. Однако увеличивается и расход теплоты на
нагревание мирабилита. Технико-зкономическая оценка показывает, что оптимальной
является температура 50-80 °С. Выбор температуры определяется затратами на
теплоту, а также решением проблемы дальнейшей утилизации растворов.
Общее изменение АН энтальпии составляет
АН = АН 2 +All-л + А #4
где АН2 = С, («пл - tt) Gt;
АН4 = С2 (t2 - *пл).10» + С3 (t2 -tD^(Gl - 10»)
(С15 С2, С3 - теплоемкости мирабилита, безводного сульфата натрия и насыщенного
раствора; Gt - масса мирабилита, необходимого для получения 1 т сульфата
натрия, кг). И окончательно:
Табл. Х.1 позволяет оценить увеличение расхода
теплоты при получении 1000 кг сульфата натрия из мирабилита теоретического
состава способом плавления при различных температурах.
Переработка влажного мирабилита, содержащего
примеси (например, полученного при охладительной кристаллизации в заводских
условиях и подаваемого в плавитель непосредственно из машин, разделяющих
суспензию на твердую и жидкую фазы), увеличивает расходные коэффициенты по
сырью. Обусловлено это тем, что насыщенный при 0-5 °С маточный раствор в
условиях плавления переходит в ненасыщенное состояние, увеличивает расход
теплоты на нагревание системы до заданной температуры и плавление избыточного
мирабилита.
Сульфат натрия характеризуется обратной
зависимостью растворимости в воде от температуры, поэтому плавление
сопровождается образованием твердых отложений на греющих поверхностях, имеющих
более высокую температуру, чем прилегающий раствор. Скорости образования инкрустаций
и их рост уменьшаются при уменьшении шероховатости поверхности, в присутствии
10-15% твердой фазы и интенсивном перемешивании.
Плавят мирабилит в оборудовании, различающемся
по ап-паратурно - технологическому оформлению. В настоящее время практически не
используют аппараты, в которых мирабилит непосредственно соприкасается с
теплопередающими стенками греющих камер.
Только за счет плавления сульфат натрия получают
редко. Этот процесс должен быть связан с переработкой маточных растворов в
мирабилит в процессе охладительной кристаллизации.
Первоначально такой способ получения сульфата
натрия был предложен в Канаде [59]. Он заключался в том, что мирабилит
расплавляли при 32 °С, выпавшую твердую фазу отделяли^ а раствор возвращали на
повторную кристаллизацию мирабилита. Маточный раствор, остававшийся после
второго цикла, отбрасывали; вместе с ним удалялись примеси, и продукт получался
высококачественным. В СССР был предложен способ, в котором растворы, остающиеся
после отделения безводного продукта, утилизируют за счет естественного
охлаждения в бассейнах (рис. Х.1) [60, с. 35].
Один из современных вариантов этого способа
применительно к регенерации растворов осадительных ванн вискозного производства
описан в [61]. Аппаратурно-технологическая схема включает два каскада
вакуум-кристаллизационных аппаратов
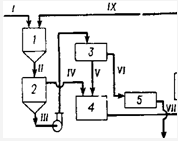
Рис. Х.1. Схема обезвоживания мирабилита
способом плавления с выделением вторичного мирабилита в бассейне: Оборудование:
1 - плавитель; г - сгуститель; з - центрифуга; 4 - бак;S - сушильный барабан; в
- бассейн для кристаллизации мирабилита. Потоки: I - мирабилит; II - суспензия;
III - суспензия сгущенная; IV - слив; V - фугат; VI - сырой продукт; VII -
сухой продукт; VIII - плавильный раствор; IX - вторичный мирабилит; X - сбрссной
раствор.
Один из современных вариантов этого способа
применительно к регенерации растворов осадительных ванн вискозного производства
описан в [61]. Аппаратурно-технологическая схема включает два каскада
вакуум-кристаллизационных аппаратов для кристаллизации мирабилита, центрифуги
для разделения мпра-билитовой суспензии; плавитель, снабженный высокой греющей
камерой и циркуляционным насосом; центрифуги для разделения сульфатной
суспензии, поступающей из плавителя. Один из двух каскадов для кристаллизации
мирабилита работает только за счет испарения растворителя, во втором
кристаллизация сочетается с охлаждением посредством хладоагента. Различие в
режиме работы каскадов связано с назначением маточных растворов, отделяемых из
суспензий мирабилита.
В первый каскад направляют первичные растворы из
осади- тельных ванн; маточные растворы возвращают совместно со щелоками от
плавления мирабилита на кристаллизацию мирабилита во второй каскад. Маточные
растворы второго каскада возвращают в цикл производства вискозы. Температурный
режим процессов, °С:
Кристаллизация в I каскаде 5
Кристаллизация во II каскаде От -3 до О
Плавление мирабилита 55-60
Примерный баланс по массе веществ и затрате
тепла приводится ниже.
Материальный баланс:
плавление 1 т мирабилита дает 0,190 т твердой
фазы и 0,810 т раствора;
при кристаллизации из исходных растворов
выделяется 2,30 т мирабилита;
нри кристаллизации из растворов процесса
плавления образуется 3,45 т мирабилита.
Итого: 2,30 -j- 3,45 = 5,75 т мирабилита
позволяют получить 1 т Na2S04.
Теплота, вносимая паром, т пара/т Na2S04:
плавление мирабилита 1,03 кристаллизация мирабилита 0,60.
Недостаток метода - высокая стоимость передела.
Иные варианты этого способа изложены в патентах
Франции [62] и ФРГ [63], применительно к утилизации отработанных растворов
осадительных ванн вискозного производства. Маточные растворы, остающиеся после
отделения мирабилита, возвращаются в схему производства вискозы. Один из
вариантов предусматривает удешевление процесса выделения сульфата натрия за счет
использования на стадии плавления мирабилита теплоты, получаемой при смешении
серной кислоты с маточными растворами, возвращаемыми в схему производства
вискозы.
По [64] стадии плавления и кристаллизации
мирабилита связаны процессом теплообмена, а именно: на стадии плавления
используют теплоту, выделяющуюся при сжатии хладоагента, испарившегося при
охлаждении поступивших на кристаллизацию мирабилита растворов.
Обезвоживание мирабилита без применения
нормальной выпарной установки возможно в аппарате, состоящем из емкости и
вращающегося в ней барабана, обогреваемого изнутри [65].
Загружаемый в емкость мирабилит плавится за счет
теплоты, передаваемой стенками барабана. Стенки удерживают на своей поверхности
часть суспензии, из которой вода испаряется, а остающаяся пластичная масса
снимается и направляется на сушку во вращающийся барабан. Температура
поверхности барабана должна быть выше температуры кипения раствора.
Приведенные варианты получения сульфата натрия
достаточно просты в аппаратурном отношении, но стоимость передела высока и
удельная производительность аппаратуры мала, так как 80% выделившегося
мирабилита в виде насыщенного раствора возвращаются на стадии кристаллизации.
Способ плавления - выпаривания
Способ выделения безводного сульфата натрия из растворов,
получаемых при плавлении мирабилита, путем выпаривания этих растворов в
многокорпусных выпарных установках экономически предпочтительнее рассмотренного
в предыдущем параграфе способа повторной кристаллизации мирабилита и его
плавления. Обусловлено это тем, что расходы пара и электроэнергии значительно
меньше по причине многократного использования теплоты и обеспечения процесса
плавления вторичной теплотой процесса выпаривания.
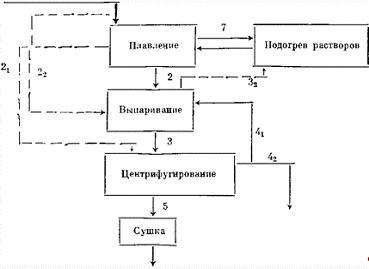
Рис.
Технологическая схема различных вариантов этого
способа представлена на схеме 2.
Основной процесс на схеме 2 изображен сплошными
линиями. Плавление происходит за счет теплоты вторичного пара выпарной
установки (32). Теплоносителем в процессе плавления является суспензия (7),
образующаяся при плавлении. Часть суспензии подается на выпаривание (2). Все
суспензии разделяют обычно в фильтрующих центрифугах. Процесс упаривания
лимитирует концентрация твердой фазы и примесей. Маточные растворы разделяются
на два потока - оборотный (44) и сбросной (42).
Пунктиром обозначены возможные отклонения от
простейшей прямоточной схемы. Суспензию, полученную в результате плавления,
сгущают и разделяют на два потока - сгущенную часть (2j), направляемую на
центрифугирование, и разбавленную суспензию (22), перерабатываемую в выпарной
установке. Другой вариант - использование суспензий из выпарных установок в
процессе плавления мирабилита с сокращением расхода в этом процессе теплоты,
получаемой при теплообмене с вторичным паром.
Аппаратурное оформление этой технологической
схемы весьма разнообразно. Общим является наличие двухкорпусных установок на
стадии выпаривания растворов, что определяется тепловым балансом процесса
плавления - выпаривания при сумме солей 29% Ci = 3270 Дж/(кг-К) С2 = 1822
Дж/(кг • К) АН = -243 800 Дж/кг
Доля холода, использованного в процессе
кристаллизации мирабилита, составит:
АН +С2 (t, -1{) ■ 103 + СН 0(t*-f!)-610 9= ^ !
Здесь СНго - теплоемкость воды, 610 - количество
воды, остающейся в маточном растворе при кристаллизации мирабилита из чистых
растворов сульфата натрия, имеющих концентрацию -30% (значение теплоемкости
должно соответствовать 1% раствору сульфата натрия, но его можно приравнять к
теплоемкости воды).
Доля холода, идущего на кристаллизацию, тем
больше, чем выше выход мирабилита в расчете на 1 м3 рассола и выше температура
маточных растворов, выходящих из рекуператора.
Цель научно исследовательской работы
Целью данной научно исследовательской работы,
является получение сульфата натрия, как ускорителя для затвердевания бетона из
промышленных отходов. Содового плава ОАО «Гродно Азот» и серной кислоты РУП
"СПО" ХИМВОЛОКНО" Светлогорск
Постановка задачи исследования
На начальном этапе исследований первой
практической задачей явилось определение состава применяемого сырья. Необходимо
определить состав и содержание основных компонентов в промышленных отходах.
Методы анализа. Метод определения
содержания кальцинированной соды
Взвешивают от 2,3 до 2,5 г кальцинированной
соды, взятой после определения потерь массы при прокаливании по п.4.5
(результат в граммах записывают с точностью до четвертого десятичного знака),
помещают в коническую колбу вместимостью 250 см3, растворяют в 20 см3 воды и
титруют раствором серной кислоты в присутствии метилового оранжевого до
изменения окраски раствора из желтой в оранжево-розовую. Раствор сохраняют для
определения массовой доли хлоридов по п.4.6.
Допускается титрование раствора соляной кислотой
при отсутствии необходимости у потребителя определения массовой доли хлоридов.
Обработка результатов
Массовую долю углекислого натрия (X) в процентах
вычисляют по формуле:
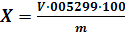
где V- объем раствора серной кислоты или соляной
кислоты концентрации точно 1 моль/дм3 или с (НСl)=1 моль/дм3, израсходованный
на титрование,см3;
,05299 - масса углекислого натрия в
граммах,соответствующая 1 см3 раствора серной кислоты или соляной кислоты
концентрации точно- масса навески кальцинированной соды, г.
За результат анализа принимают среднее
арифметическое результатов двух параллельных определений, абсолютное
расхождение между которыми не превышает допускаемое расхождение, равное 0,2 %
при доверительной вероятности Р=0,95.
Расчетный метод (для углекислого натрия в
пересчете на непрокаленный продукт).
Массовую долю углекислого натрия в пересчете на
непрокаленный продукт (X') в процентах вычисляют по формуле:
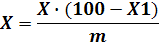
где X- массовая доля углекислого натрия, г,
определенная по п.4.4.3;- массовая доля потери при прокаливании, г,
определенная по п.4.5.3.
Аппаратура
Весы лабораторные общего назначения по ГОСТ
24104 2-го класса точности с наибольшим пределом взвешивания 200 г.
Гири Г-2-210 по ГОСТ 7328.
Эксикатор по ГОСТ 25336
Шкаф сушильный, обеспечивающий температуру
нагрева 250- 300 °С.
Тигли низкие 3 или 4 по ГОСТ 9147.
Силикагель технический по ГОСТ 3956, высушенный
при 150- 180 °С или кальций хлористый по ТУ 6-09-4711, прокаленный при 250-300
°С.
(Измененная редакция, Изм. № 1).
Проведение анализа
В тигле, предварительно прокаленном при 270-300
°С до достижения постоянной массы, взвешивают от 5 до 6 г кальцинированной соды
(результат в граммах записывают с точностью до четвертого десятичного знака).
Тигель с навеской прокаливают при 270-300 °С до достижения постоянной массы и
после охлаждения в эксикаторе взвешивают (результат в граммах записывают с
точностью до четвертого десятичного знака).
Обработка результатов
Потери массы при прокаливании (X1) в процентах
вычисляют по формуле:
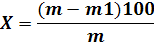
где m - масса навески кальцинированной соды, г;-
масса навески кальцинированной соды после прокаливания, г.
За результат анализа принимают среднее
арифметическое результатов двух параллельных определений, абсолютное
расхождение между которыми не превышает допускаемое расхождение, равное 0,05 %
при доверительной вероятности Р=0,95.
Метод определения нерастворимого
остатка
Метод проводили следующим образом. Навеску
определенной массы растворяли в соляной кислоте. Количество кислоты рассчитано
со 100% избытком. Для полного растворения помещали на плитку и постепенно
перемешивали. Полученный раствор отфильтровали, поместили в мерную колбу и
довели до метки водой. Фильтр сушили до постоянной массы и определяли массу
нерастворимого остатка.
Получение сульфата натрия из лабараторной соды и
серной кислоты
Разложение каустического магнезита проводим в
соответствии с реакцией:
Na2CO3+H2SO
4+9H2O=Na2SO410H2O+CO2
В качестве реагентов используем 55% серную
кислоту и ЧДАNa2CO3.
Для анализа взвешиваем навеску соды 16,46 г По
уравнению химической реакции рассчитываем(расчет ведемна 50г конечного
продукта) количество серной кислоты 100% и пересчитываем на 55 %.
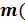 H2SO4)
= (50*98*0,55)/ 322 = 15,274 г.
H2SO4)
= (50*98*0,55)/ 322 = 15,274 г.
Обьем серной кислоты:
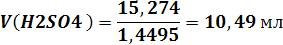
Стехиометрическое соотношение реагентов - с
11,26 мл кислоты взаимодействует 16 г магнезита.
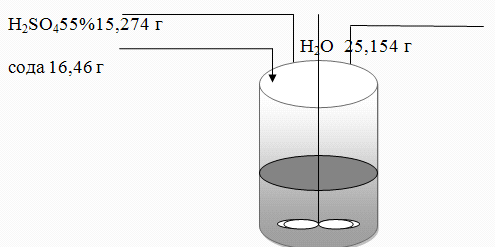
Рисунок 3 - Схема лабораторной установки
Воду помещаем в стакан и приливаем серную кислоту
Постепенно присыпаемсоду небольшими порциями, проверяем рН раствора. Для
полного растворения соды и перемешиваем до полного растворения.Раствор
перемешивался около 2 часов ,затем кристаллизовался. Затем был проведен
аналогичный опыт, но использованием содовогоплава, предварительно прокаленного
подt=400 C.
Материальный баланс получения Na2SO410H2O
Таблица 3.1
|
Приход
|
Расход
|
|
Компонент
|
кг
|
Компонент
|
г
|
|
1.H2SO4 55% Вт.ч.
H2SO4 H2O 2. Na2CO3 3.
H2O
|
1000
550 450 594,89 459,18
|
1.Na2SO410H2O
2.CO2
|
1807,14 246,93
|
|
∑
|
2054,82
|
∑
|
2054,82
|
Результаты эксперимента
Проанализировав содовыйплав получили следующие
результаты,:
Содержание Na2CO3=
99%
Органические примеси и смолы=1%
Потери массы при прокалке 0,0021г
Также проведен термический анализ(Приложение1)
При проведении эксперимента получены результаты:
. При получении сульфата натрия из лабароторной
соды
Полученное количество раствора и нерастворимого
остатка:
mр-ра
= 73,4г, mос-ка=
46г.
2. При получении сульфата натрия из содового
плава
Полученное количество раствора и нерастворимого
остатка:
mр-ра
= 32г, mос-ка
- нет нерастворимого остатка.
В следующем семестре планируется анализ
полученного осадка и раствора.
Заключение
Перед проведением синтеза был исследован содовый
плав, который содержит 99% Na2CO3
.Также были проведены :термический, рентгенографический, ИК-спектроскопический
аналаиз.
В ходе получения сульфата натрия из лабораторной
соды осадок кристаллизовался. При получении сульфата натрия из содового плава,
предварительно прокаленного под t=4500C,
синтез проходил очень медленно и неопределенное количество соды не
растворилось. Полученную смесь проанализировать не успел.