Определение молярной массы. Электронные формулы атомов
Задачи
Задача 1
Вычислите в молях: а) 6,02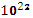
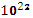 молекул С₂Н₂; б) 1,80
молекул С₂Н₂; б) 1,80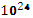
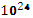 атомов азота; в) 3,01
атомов азота; в) 3,01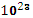
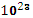 молекул NH₃.
молекул NH₃.
Решение:
а) 6,02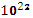
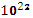 молекул С₂Н₂.
молекул С₂Н₂.
Определим количество вещества (моль)
Ѵ=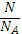
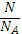 =
=
 =0.1 (моль)
=0.1 (моль)
б) 1,80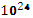
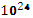 атомов азота:
атомов азота:
Ѵ=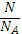
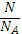 =
=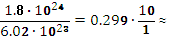
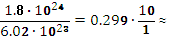 0.3 (моль)
0.3 (моль)
в) 3,01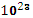
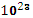 молекул NH₃:
молекул NH₃:
Ѵ=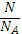
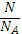 =
=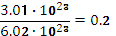
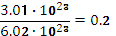 (моль)
(моль)
Задача 2
При взаимодействии 3,24 г трехвалентного металла с кислотой
выделится 4,03 л водорода (н. у.). Вычислите молярную массу эквивалента,
молярную и относительную атомную массы металла.
Решение:
Определим молярную массу эквивалента металла по закону
эквивалентов:

где: 
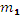 - масса вещества 1, г;
- масса вещества 1, г;
молярная масса эквивалента вещества 1, г/моль;
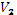
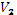 - объем вещества 2, л;
- объем вещества 2, л;
эквивалентный объем вещества 2, л/моль, в нашем случае = 11,2
г/моль.
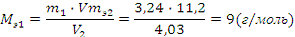
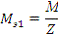
где: М - молярная масса вещества, г/моль;
Z - эквивалентное число, в нашем случае это валентность
металла.
M =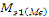 * 3 = 9 * 3 = 27 (г/моль)
* 3 = 9 * 3 = 27 (г/моль)
Молярная масса металла равна относительной атомной массе
металла, т.е. Аr (Ме) = 27.
Ответ: Мэ (Ме) = 9 г/моль; М (Ме) = 27 г/моль; Аr (Ме) = 27.
Задача 3
Какие орбители атома заполняются электронами раньше 4d или 5s; 6s или 5р. Почему? Напишите
электронную формулу атома элемента с порядковым № 43.
Решение:
Заполнение электронами орбиталей в атоме происходит по
правилу Клечковского: орбитали в атоме заполняются в порядке возрастания суммы
(n+l), а при одинаковом значении этой суммы в порядке возрастния n (n - главное квантовое
число, l - орбитальное квантовое число).
Для орбитали 4d: n = 4, l = 2; n + l = 6 Для орбитали 5s: n =
5, l = 0; n + l = 5 Значит 5s заполнится раньше, чем 4d.
Для орбитали 6s: n = 6, l = 0; n + l = 6 Для орбитали 5p: n =
5, l = 1; n + l = 6 Значит 5p заполнится раньше, чем 6s.
Элемент № 43 - технеций. Электронная формула: 43Tc
1s22s22p63s23p63d104s24p64d55s2.
орбиталь = 0, p-орбиталь= 1, d-орбиталь= 2, f-орбиталь=
3

Задача 4
Напишите электронные формулы атомов элементов с порядковыми
номерами 24 и 33, учитывая, что у первого происходит "провал" одного
4s-электрона на 3-d-подуровень. Чему равен
максимальный спин d-электронов у атомов первого и p-электронов у атомов
второго элементов?
Решение:
Состояние атома с полностью или наполовину заполненным
подуровнем (т.е. когда на каждой орбитали имеется по одному неспаренному
электрону) является более устойчивым.
Cr: 1s2 2s2 2p6 3s2 3p6 4s 3d5, а не 1s2 2s2 2p6
3s2 3p6 4s2 3d4,т.е. происходит "провал" электрона с 4s-подуровня на
3d-подуровень.
Элемент с порядковым номером 33 - это мышьяк (As), его электронная
формула выглядит так:
s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3.
ДОРЕШЕНИЕ
Спиновое квантовое число характеризует вращение электрона
вокруг своей оси, которое может происходить в двух противоположных направлениях,
следовательно, это квантовое число принимает только два значения. Они равны
+1/2 и - 1/2.
У хрома на d-орбиталях в устойчивом состоянии 5 неспаренных электронов,
т.е. спины: +1/2, +1/2, +1/2, +1/2, +1/2. Сумма = 5/2.
На p-орбиталях мышьяка 3 электронов, число квантовых ячеек = 3,
т.е. максимальный спин 1/2 + 1/2 + 1/2 = 3/2.
Спин (от англ. spin - вертеть [-ся], вращение) - собственный
момент импульса элементарных частиц, имеющий квантовую природу и не связанный с
перемещением частицы как целого. Спином называют также собственный момент
импульса атомного ядра или атома; в этом случае спин определяется как векторная
сумма (вычисленная по правилам сложения моментов в квантовой механике) спинов
элементарных частиц, образующих систему, и орбитальных моментов этих частиц,
обусловленных их движением внутри системы.
Спин измеряется в единицах ħ (приведённой постоянной
Планка, или постоянной Дирака) и равен где J - характерное для каждого сорта
частиц целое (в том числе нулевое) или полуцелое положительное число - так
называемое спиновое квантовое число, которое обычно называют просто спином
(одно из квантовых чисел).
В связи с этим говорят о целом или полуцелом
спине частицы.
Задача 5
Какой из элементов четвертого периода - ванадий или мышьяк
обладает более выраженными металлическими свойствами? Какой из элементов
образует газообразные соединения с водородом? Ответ мотивируйте, исходя из
строения атомов данных элементов.
Решение:(ванадий) и As (мышьяк) находятся в одной группе (V)
периодической системы, в одном периоде (IV), но в разных подгруппах.
Число протонов ванадия составляет 23 - элемент, который
находится в побочной подгруппе пятой группы. Запишем на основании этого
электронную формулу:
+23V 1s2 2s2 2p6 3s2 3p6 3d 3 4s2
V - неметалл, d - элемент.
Электронная формула мышьяка:
+33As 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
- неметалл, p - элемент.