Непрерывное культивирование микроорганизмов (хемостатный процесс)
МИНОБРНАУКИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«ПЕНЗЕНСКАЯ ГОСУДАРСТВЕННАЯ ТЕХНОЛОГИЧЕСКАЯ АКАДЕМИЯ» (ПГТА)
Кафедра «Биотехнология и техносферная безопасность»
КУРСОВАЯ
РАБОТА
Дисциплина
«Теоретические основы биотехнологии»
На тему
Непрерывное
культивирование микроорганизмов
(хемостатный
процесс)
Выполнила
студентка группы 09БТ
Алексеева А.С.
Руководитель
к.б.н., доц.
Кузьмин А.А.
Пенза, 2012г.
Утверждаю
Зав. каф. БТБ
д.т.н., профессор Таранцева К.Р.
«…...»…..…………2012 г.
ЗАДАНИЕ
на курсовую работу по дисциплине «Теоретические основы биотехнологии»
Студенту Алексеевой А.С. Группа 09БТ
Тема работы:
Непрерывное культивирование микроорганизмов
(хемостатный процесс)
Исходные данные (задание на проектирование)
1.
Кассификация непрерывного культивирования микроорганизмов
.
Непрерывный процесс культивирования
.
Общие принципы хемостата
.2
Концентрации биомассы и лимитирующего рост субстрата
.3
Критическая скорость разбавления
.
Основные закономерности процессов непрерывной ферментации в аппаратах полного
смешения
.1
Хемостатный реактор с рециклом по биомассе и культуральной жидкости
.2
Каскад хемостатов
. Специальные цели хемостатной культуры
Руководитель
………………….………………Кузьмин А.А.
Введение
Биотехнология - это наука, изучающая получение продуктов с
непосредственным участием биологических объектов, коими могут являться
организмы, органы, ткани животных или человека. Тем не менее, как правило, в
этих целях используются одноклеточные микроорганизмы, либо клетки растений или
животных.
Биотехнология является механизмом, который, используя вышеназванные
продукты жизнедеятельности в качестве сырья, помогает получать огромное
количество очень важных веществ, а именно:
• В области медицины: витамины, аминокислоты, ферменты, вакцины,
антибиотики, антитела, иммуномодуляторы, и другие не менее важные вещества.
• В области ветеринарии и сельского хозяйства: инсектициды, вакцины,
гормоны, липиды, спирты и пр.
• В химической промышленности: бутанол, ацетон.
• В энергетической промышленности: этанол, биогаз.
Из этого можно сделать заключение, что главной целью биотехнологии
является разработка и производство лечебный, профилактических и диагностических
препаратов. Кроме того, важными задачами выступают такие, как: обеспечение
всевозможных технологических механизмов в разных отраслях промышленности;
возрастающее участие в экологических мероприятиях; решение различных вопросов
продовольствия.
Роль промышленного производства в биотехнологии включает в себя следующие
принципы: брожение, биоконверсия, культивирование клеток, вирусов и бактерий, а
также различные генетические процессы. Так как подобные вещи требуют особого
оборудования, на данный момент на благо биотехнологической промышленности
служат различные специализированные учреждения, заводы, исследовательские
институты. Несмотря на то, что благодаря биотехнологии ежегодно вырабатывается
огромное количество антибиотиков, ферментов, кормового белка, аминокислот и
многого другого, потребности в биотехнологической продукции постоянно растут.
Поэтому биотехнология заслуженно получает огромное внимание к себе и хорошие
ресурсы для дальнейшего развития.
1.
Классификация непрерывного культивирования микроорганизмов
Культивирование продуцентов в промышленных условиях принято называть
ферментацией. В зависимости от классификационного признака различают следующие
типы ферментационных процессов:
· по отношению микроорганизмов продуцентов к кислороду: аэробные и
анаэробные;
· по локализации продуцентов в питательной среде: глубинные и
поверхностные;
· по условиям проведения процесса: периодические,
полунепрерывные (отъемно-доливные, с подпиткой); непрерывные.
Непрерывные процессы. Различают два типа непрерывной (проточной)
ферментации. Биореакторы полного смешения - жидкая фаза в них интенсивно
перемешивается, постоянно подается питательная среда и отводится культуральная
жидкость. Данные реакторы могут работать по принципу хемостата или
турбидостата. В первом случае в системе поддерживается постоянная концентрация
одного из компонентов среды, причем постоянный подвод клеток не обязателен,
поскольку в начальном периоде проводят периодическое культивирование, а затем
включают подачу жидкости с клетками или без них. Во втором случае в биореакторе
поддерживают постоянную концентрацию клеток, регулируя скорость протока среды.
При достижении определенной максимальной концентрации клеток подача среды может
быть автоматически прекращена и процесс протекает некоторое время в
периодических условиях. Биореакторы полного вытеснения (тубулярные). Среда
протекает по турбулярному реактору без перемешивания, состав и концентрация
питательных веществ, продуктивность неодинаково распределены по объему
реактора; вместе со средой в реактор подаются клетки. Целью количественного
описания процессов культивирования в биореакторах являются расчет и оптимизация
производительности аппарата, определение рабочего объема.
2.
Непрерывный процесс культивирования
Непрерывное культивирование перспективное. Его сущность заключается в
том, что в ферментаторе поддерживаются постоянные условия среды, в результате
чего микроорганизмы остаются в определенном физиологическом состоянии. Подается
свежая питательная среда и удаляется избыток среды с продуктами метаболизма,
поддерживается фаза экспоненциального роста.
Если для культивирования продуцента используется один ферментатор, то
говорят о гомогенно-непрерывном процессе. Если же используется батарея, то это
гетеро-непрерывный процесс, так как в каждом ферментаторе, соединенном в
батарею, поддерживаются постоянные условия.
При непрерывном культивировании микроорганизмов отсутствует смена фаз
развития культуры. В таких процессах скорость потока питательной среды и отвода
культуральной жидкости из системы необходимо отрегулировать, чтобы концентрация
клеток оставалась постоянной. В стерильных условиях непрерывный метод
обеспечивает сохранение культуры в физиологически активном состоянии длительное
время.
Поддержание динамики равновесия в реакторе осуществляется двумя методами:
турбидостатным и хемостатным.
Хемостатный контроль проще, так как он происходит по входящему потоку.
Этот метод регулирования применим ко всем типам микроорганизмов и клеток
различных тканей животных и растений. Методы искусственного биосинтеза
популяций микроорганизмов находят широкое применение в современной биологии и
медицинской промышленности.
Выращивание полезной биомассы микроорганизмов (бактерий) производится в
хемостатах. Биореактор в хемостатном режиме снабжен устройствами для вливания и
выпуска питательной жидкости, имеет систему контроля скорости потока,
перемешивание.
Термин хемостат (впервые был предложен Новиком и Сцилардом), обозначает
лабораторное устройство микробиологии, в котором изучают динамику развития
популяций микроорганизмов. Хемостат предназначен для непрерывного
культивирования микроорганизмов и состоит из трех основных частей: герметичного
резервуара, заполненного специальным раствором (субстратом), устройства подачи
питающего субстрата и выходного отверстия для выхода приросшей биомассы.
Управление скоростью роста биомассы в хемостате осуществляется путем
изменения концентрации питательного субстрата, которая регулируется либо
скоростью подачи субстрата, либо скоростью вымывания (удаления) продуктов
жизнедеятельности на выходе хемостата.
3. Общие
принципы хемостата
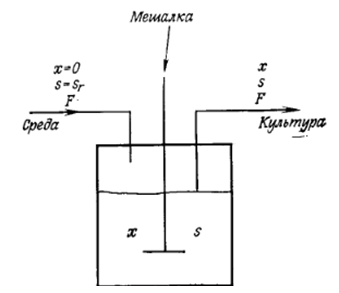
Рис. 1. Хемостат
Хемостат (рис. 1) представляет собой культуру, в которую с постоянной
скоростью непрерывно подается свежая среда, а объем культуры поддерживается при
этом на постоянном уровне путем непрерывного отлива части культуры. В идеале
перемешивание в хемостате должно быть полным, т. е. капли поступающей в сосуд
среды должны немедленно и однородно распределяться по всей культуре.
На практике это означает, что время, необходимое для перемешивания
небольшого объема среды в культуре, должно быть значительно меньше, чем время
замещения tr, равное V/F, где V - объем, a F - скорость течения среды.
Рассмотрим некую культуру, в которой рост биомассы лимитируется
количеством одного-единственного субстрата, а все остальные компоненты среды
находятся в избытке. Предположим, что вначале добавления среды не происходит и
рост биомассы протекает так же, как и в периодической культуре. Затем, когда
начнется поступление среды, рост культуры будет происходить в соответствии с
одной из трех возможностей, изображенных на рис. 2. Первая возможность состоит
в следующем: скорость вымывания биомассы окажется больше скорости роста и
концентрация биомассы будет в результате падать, а концентрация лимитирующего
рост субстрата будет стремиться к увеличению до значения sr. Вторая возможность: начальная
скорость вымывания биомассы будет точно равна скорости роста. При этом
организмы будут расти с их максимальной
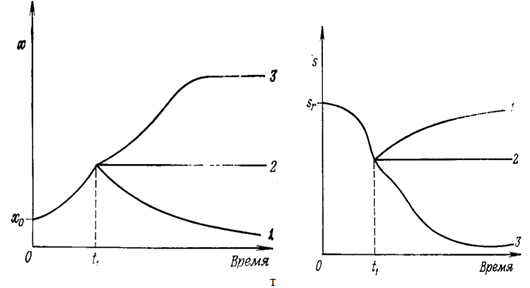
Рис. 2. Три возможных результата в хемостатной культуре, в которой
скорость роста биомассы (х) ограничена концентрацией (s) лимитирующего рост субстрата
Поток среды, содержащий лимитирующий рост субстрат в концентрации Sr, включен в момент времени t1.
Различные случаи таковы: 1 - скорость вымывания биомассы превосходит
максимальную скорость роста; 2 - скорость вымывания равна максимальной скорости
роста; 3-начальная скорость вымывания меньше, чем максимальная скорость роста
биомассы.
Вторая возможность: начальная скорость вымывания биомассы будет точно
равна скорости роста. При этом организмы будут расти с их максимальной удельной
скоростью роста µm.
В этом случае установится стационарное состояние, при котором концентрация
биомассы и лимитирующего рост субстрата остаются постоянными. Однако такое
состояние не будет устойчивым стационарным состоянием, поскольку любое
временное изменение условий, влияющее на концентрацию биомассы и субстрата,
приведет к непрерывному изменению этих концентраций. Третья возможность
осуществится, если скорость вымывания биомассы вначале будет меньше
максимальной скорости роста. Тогда концентрация биомассы будет непрерывно
увеличиваться. Однако соответствующее уменьшение концентрации лимитирующего
рост субстрата приведет к тому, что удельная скорость роста биомассы будет
уменьшаться до тех пор, пока скорость роста биомассы не станет равной скорости
вымывания.
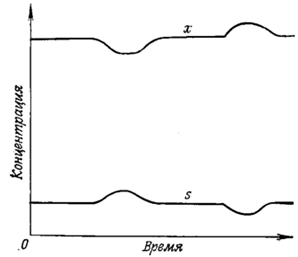
Рис. 3. Действие временного возмущения стационарных условий в хемостате,
если удельная скорость роста биомассы меньше, чем максимальная скорость
х - концентрация биомассы, s-концентрация
субстрата.
Дальнейших изменений в концентрации биомассы и лимитирующего субстрата не
может быть. В этом случае удельная скорость роста биомассы будет ниже µm и будет определяться скоростью потока
среды. Такое стационарное состояние является саморегулирующимся. Последствия
возмущений стационарного состояния во времени показаны на рис. 4. Уменьшение
концентрации биомассы приведет к увеличению концентрации субстрата, что в свою
очередь вызовет повышение скорости роста и обусловит восстановление условий
стационарного состояния. Увеличение концентрации биомассы вызовет
противоположный эффект.
.1 Удельная скорость роста
Задача количественной теории состоит в том, чтобы предсказать значения
скорости роста, концентраций биомассы и субстрата в различных условиях. Пусть µ
- удельная скорость роста; обозначения для других параметров приведены на рис.
10. Значение F/V = D
известно как скорость разбавления: но характеризует скорость потока на единицу
объема. Увеличение концентрации биомассы дается уравнением баланса биомассы:
Для бесконечно малого промежутка времени dt для полной культуры этот баланс будет выглядеть следующим
образом:
• dx = V * µх * dt - Fx * dt.
Поделив уравнение на V dt,
получим
dx/dt = (µ - D)x.
В стационарном состоянии, когда dx/dt = 0, мы имеем µ = D.
.2
Концентрации биомассы и лимитирующего рост субстрата
Баланс для лимитирующего субстрата дается уравнением
Общее увеличение = Поступление - Отток - Субстрат, использованный на
рост.
Для бесконечно малого промежутка времени dt этот же баланс для полной культуры выражается уравнением
V * dx = Fsr dt - Fs - V * µх • dl/Y,
где Y - экономический коэффициент.
Следовательно, ds/dt = D (sr - s) - µх/Y.
В стационарном состоянии dx/dt = ds/dt = 0.
Тогда значения стационарных концентраций s их даются уравнениями
(µ-D)x = 0 и D (sr - s) - µх/Y = 0
где тильда означает значение в стационарном состоянии.
Для того чтобы по пучить x и s, подставим выражение для
удельной cкорости роста
µ = µтs/(s + Ks)
Подставив в уравнение µ = D,
получим уравнение для стационарного состояния: s=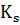 D/(µm-D),
D/(µm-D),
А из уравнения D (sr - s) - µх/Y = 0
при подстановке µ = D получим х = Y (sг - s) = Y {sr - КsD/(µт - D)}.
.3
Критическая скорость разбавления
При s = sr достигается максимальная скорость
роста. Подставив это значение в уравнение, получим
µ= Dc= µmsr/(sr+Ks)
где Dс - критическая скорость разбавления; при этом значении
стационарная концентрация биомассы равна нулю.
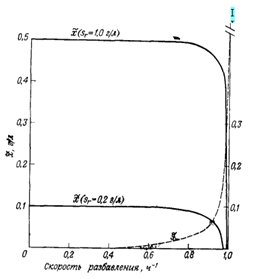
Рис. 4. Концентрации биомассы (Z) и лимитирующего рост субстрата (J) в хемостате в стационарном состоянии в соответствии с
уравнениями s=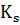 D/(µm-D), х = Y (sг - s) = Y {sr - КsD/(µт - D)}.
D/(µm-D), х = Y (sг - s) = Y {sr - КsD/(µт - D)}.
Если Sr>>Ks, то из уравнения µ= Dc= µmsr/(sr+Ks), следует, что Dc~µm. График зависимости х и s от скорости разбавления при типичных значениях параметров
приведен на рис. 5.
4. Основные
закономерности процессов непрерывной ферментации в аппаратах полного смешения
Использование непрерывно действующих (проточных) реакторов имеет ряд
преимуществ перед периодическими процессами. Это открытые системы, которые при
определенных условиях приходят в стационарное состояние, когда все параметры
системы (концентрации всех компонентов среды и клеток) постоянны во времени.
Это резко упрощает управление работой биореактора и автоматизацию процесса.
Количественные показатели процесса непрерывного культивирования:
· Скорость протока (коэффициент разбавления)
D = W/V
где: W - скорость потока среды, м3/ч;
· Скорость образования биомассы и выноса биомассы из системы
dX/d τ = μX - DX = (μ - D)X$
· Скорость поступления и потребления лимитирующего субстрата
dS/dτ = D(S0 - S1)
- μX/Yx/s
· Скорость образования и выноса из системы продукта Р
dP/dτ = qpX - DP = 0
Если μ = D, то dX/dτ = 0, т.е. система находится в
состоянии динамического равновесия. В зависимости от метода, благодаря которому
поддерживается данное состояние, различают хемостатный (поддержание постоянной
концентрации лимитирующего субстрата) и турбидостатный (поддержание постоянной
концентрации биомассы) принципы культивирования.
Также известны методы управления ростом непрерывной культуры при рН
(рН-стат) и по кислороду (оксистат).
В промышленности из аппаратов полного смешения наиболее широко используют
биореакторы, работающие по принципу хемостата.
Их преимущества - простота конструкции, легкость поддержания заданного
режима, возможность длительного непрерывного культивирования.
Стационарные концентрации клеток [X] и субстрата [S]
связаны с соответствующими концентрациями во входном потоке уравнениями
материального баланса.
V*rx + W*[X]0 - W*[X] = 0;*[S]0
- W*[S] - V*rx*1/Y = 0.
Если выразить скорость прироста по уравнению Моно, получим основное
кинетическое уравнение процесса ферментации в режиме хемостата
µmax*[X]*[S]/(Ks + [S]) = µ*[X] =
D*([X[ - [X]0)
Из этого уравнения следует, что подача клеток в аппарат в непрерывном
режиме хемостата не обязательна; в этом случае работа биореактора начинается с
периодического культивирования некоторой посевной дозы, а после перехода
культуры в экспоненциальную фазу включают непрерывную подачу питательной среды.
Для такого режима кинетическое уравнение принимает вид (при [X]0 = 0)
µ*[X] = D*[X];
µ = D.
Последнее равенство называют законом хемостата, который заключается в
том, что в стационарном режиме удельная скорость роста устанавливается равной
скорости разбавления среды, которая задается подбором параметров V и W0. Согласно уравнению Моно:
D = µ
= µmax* [S] /(Ks + [S]);
[S]= Ks * D/(µmax - D);
где: [S] - концентрация субстрата в
стационарном режиме работы хемостата.
Концентрация биомассы в стационарном режиме (при [X]0 = 0)^
[X] = Y*([S]0 - Ks*D/(µmax -
D)/
Концентрация субстрата [S]
накладывает ограничение на скорость разбавления
<D<Dкр;
где: Dкр
= μmax*[S]0/(Ks + [S]0) - критическая скорость
разбавления, превышение которой вызывает вымывание клеток из биореактора.
Производительность отдельно работающего хемостата по биомассе
определяется как число клеток, образующихся в единицу времени в единице объема
биореактора:
Gx = [X[/τ = D*[X] =
D*Y*([S]0 - D*Ks/(μmax - D)).
Оптимальная производительность хемостата определяется выражением
dGx/dD = 0
При этом
opt = μmax*(1 - √Ks/([S]0+Ks));
[S]opt = Ks*Dopt/(µmax
- Dopt) = (√Ks/([S]0+Ks)) - Ks;
[X]opt = Y*([S]0 - [S]opt) =
Y*([S]0 + Ks - √Ks/([S]0+Ks));xopt
= [X]opt*Dopt = Y*µmax*(√([S]0+Ks)
- √Ks)2
4.1
Хемостатный реактор с рециклом по биомассе и культуральной жидкости
В промышленных процессах используют при хемостатном культивировании блоки
«биореактор-сепаратор».
Основные закономерности процесса:
· W1 = W0 + W2;
· Кратность рециркуляции a = W2/W0 > 0;
· Степень сепарации b = [X]2/[X]1 > 0 (при рецикле по
осветленной жидкости b <
1, по биомассе b > 1):
· Материальный баланс ферментатора с рециклом:
[X]1 = W2*[X]2/(W1
- V*µ).
Выражая2
= a*W0; W1 = W0 + a*W0 = (1 + a)*W;
[X]2 = b*[X]1,
Получим
a*W0*b*[X]1
(1 + a)*W - V*µ
Исходя из этого, основной закон хемостата для аппаратов с рециклом примет
вид
µ = u*D;
где: u = 1 = а - а*b - фактор рециркуляции;
[S]1 = Ks* D*u /(µmax -
D*u);x = D*[X] = D*Y*([S]0 - Ks* D*u /(µmax
- D*u));xopt = Y*µmax/u *(√( Ks
+[S]0) - √Ks)2
При рецикле по биомассе [X]2
> [X]1, при этом u < 1и производительность по
сравнению с хемостатом без рецикла увеличивается. Недостаток: увеличение
среднего возраста клеток и снижение их активности (падение µmax), опасность заражения культуры
посторонней микрофлорой.
При рецикле по культуральной жидкости снижается производительность
аппаратуры, т.к. u > 1. Это
процесс может быть использован для более полной утилизации дорогостоящих
субстратов. Его применение ограничивает торможение роста культуры повторно
поступающим в реактор продуктом.
4.2 Каскад
хемостатов
В производственных условиях в ряде случаев оказывается целесообразным
культивирование в системе из нескольких последовательно или параллельно
соединенных аппаратов. Батарея параллельно соединенных хемостатов имеет общую
линию подачи сырья и отвода культурвльной жидкости. Концентрации и биомассы
субстрата на выходе из установки связаны с концентрациями в отдельных аппаратах
соотношениями
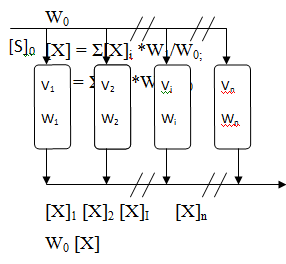
Материальные балансы каждого ферментера имеют вид:
Vi*µmax* [X]I*[S]i/(Ks
+ [S]I) - Wi[X]I = 0;
[S]I = Ks*Di/(µmax
- Di);x = Di*Y*([S]0 - [S]I);x
= Y* ΣWi*
([S]0 - [S]I)
V
Если параметры роста культуры µmax и Кs в аппаратах одинаковы. То максимальная
производительность батареи Gx достигается при равномерном распределении потоков по аппаратам так,
чтобы скорости разбавления в каждом ферментаторе совпадали с общей скоростью
разбавления:
Diopt = ΣWi/ΣVi ,т.е. объемные подачи в каждый
аппарат пропорциональны его объему: W1/V1 = …Wi/Vi =…Wn/Vn.
При последовательном соединении реакторов скорость потока через всю
систему остается постоянной, т.к. во входном потоке каждого из аппаратов
каскада содержатся клетки из предыдущего аппарата.
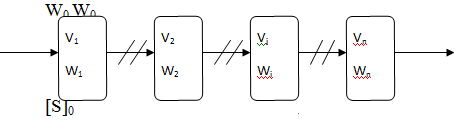
Если [X]0 ≠ 0, то скорость
разбавления в каждом аппарате составляет:
Di = µmax * [S]I * [X]Is
+ [S]I [X]I - [X]i-1
Производительность каскада последовательно соединенных хемостатов
определяется приростом клеток за время пребывания D = 1/τ/
Gxi = ([X]I - [X]i-1)/τ
= D ([X]I - [X]i-1)
Производительность каскада в целом достигает максимального значения при
заданной концентрации биомассы на выходе:
Gxopt = W0 [X]opt/
ΣVi = Dopt [X]opt;
При этом минимальный объем каскада достигается при постоянной степени
превращения субстрата на каждый степени превращения:
[S]1/[S]0 = …[S]2/[S]2 =…[S]n/[S]n-1.
5.
Специальные цели хемостатной культуры
Ниже сформулированы три уникальных, единственных в своем роде
предназначения хемостатной культуры в деле контроля за ростом и поведением
микроорганизмов.
1. Хемостат дает возможность изменять скорость роста биомассы, не
производя в окружающей среде никаких изменений, кроме изменений концентрации
лимитирующего рост субстрата. В простой периодической культуре изменения
скорости роста могут быть вызваны только качественными изменениями в составе
питательной среды или количественными изменениями физико-химических условий,
таких, как температура или pH. Эти методы изменения скорости роста вносят
побочные эффекты, маскирующие действие самой скорости роста. Так, изменение
температуры, например, независимо действует и на скорость роста и на содержание
РНК у бактерий.
2. Хемостат можно использовать и прямо с противоположной целью, а
именно фиксировать скорость роста при изменении окружающих условий. Это очень
существенно в тех случаях, когда необходимо отдифференцировать влияние
изменения условий окружающей среды и влияние изменения скорости роста.
. Хемостат, кроме того, используется для поддержания постоянной
скорости роста при лимитирующей концентрации субстрата, тогда как в
периодической культуре рост, лимитированный субстратом, можно получить лишь
кратковременно, причем это сопровождается изменением скорости роста. Данная
функция хемостата расширяет возможный диапазон постоянных окружающих условий и
дает возможность изучать не только избыток или истощение лимитирующего рост
субстрата, но и все промежуточные состояния.
. В хемостатном методе существенно то, что он упрощает системы
культуры и, следовательно, облегчает как изучение реакций организма на его
окружение, так и управление процессами, протекающими в самих микроорганизмах.
Преимущества этого упрощения приобретают особенно большое значение, когда
возникает необходимость в изучении или управлении взаимодействием двух или
более видов.
хемостатный биомасса микроорганизм
Заключение
Непрерывные процессы имеют технологические преимущества по сравнению с
периодическими, поскольку теоретически их можно осуществлять неограниченно
длительное время. На практике они обычно прерываются в связи с инфицированием
культуры посторонней микрофлорой.
Литература
1. Методы
культивирования клеток. Л.: Наука, 2006. 315 с.
. Перт С. Дж.
Основы культивирования микроорганизмов и клеток. М.: Мир, 1978. 333 с.
. Культура
клеток растений. М.: Наука, 2005. 168 с.
. Адамс Р.
Методы культуры клеток для биохимиков. М.: Мир, 2007.
с.
. Новые
методы культуры животных тканей. М.: Мир, 2006. 255 с.
. Культура
животных клеток. Методы / Под ред. Р. Ферши. М.: Мир,
. 332 с.
. Никольский
Н. Н., Вахтин Ю. Б., Игнатова Т. Н. и др. Биология клетки в культуре. Л.:
Наука, 2004. 280 с.
. Баснакьян
И. А. Культивирование микроорганизмов с заданными свойствами. М.: Медицина,
2008. 192 с.
. Методы
общей бактериологии. М.: Мир, 2008. Т. 1, ч. 2. С. 163−512.
. Глеба Ю.
Ю., Сытник К. М. Клеточная инженерия растений. Киев: Наук. думка, 2006. 160 с.