|
Состав смеси, %
|
Номер варианта
|
|
7
|
|
Оксид углерода
|
-
|
|
Водород
|
-
|
|
Метан
|
-
|
|
Этан
|
24
|
|
Пропан
|
-
|
|
Бутан
|
-
|
|
Этилен
|
16
|
|
Пропен
|
-
|
10
|
|
Углекислый газ
|
10
|
|
Азот
|
15
|
|
Кислород
|
25
|
|
a
|
1,2
|
Решение.
1. Составляем уравнения реакций горения смеси горючих газов в
воздухе:
C2H5Cl + 3(O2 + 3,76 N2) = 2 CO2 + 2 H2O + HCl + 3 × 3,76 N2H4S + 6(O2 + 3,76
N2) = 4 CO2 + 2 H2O + SO2 + 6 × 3,76 N2NH2 + 2,25 (O2 + 3,76 N2) =
CO2 + 2,5 H2O + 0,5 N2 + 2,25 × 3,76 N2
2. Рассчитаем теоретические объёмы воздуха и продуктов горения при
полном сгорании 1 м3 газовой смеси по формуле:
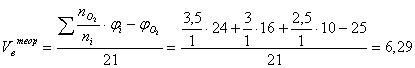 (м3/м3)
(м3/м3)

3. Рассчитаем действительные объёмы воздуха и продуктов горения с
учётом 20 % - ного избытка воздуха (a = 1,2).
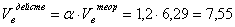 (м3/м3)
(м3/м3)
 (м3/м3)
(м3/м3)
4. Рассчитаем состав продуктов горения.
Учитывая,
что горение протекает с избытком воздуха, то при расчёте количества молей
продуктов горения учитывается избыточное число молей кислорода и азота (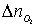 и
и 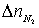 ):
): 
nобщ =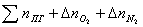 =
=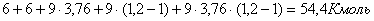


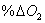 =
= 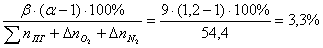
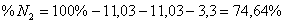 .
.
Ответ: На сгорание 1м3 смеси газов заданного в условии состава требуется
7,55 м3 воздуха, при этом образуется 12,91м3 продуктов горения, из которых
углекислый газ и пары воды составляют по 11,03%, а азот 74,64 % от общего
объема.
Задание №3
горение воздух этиленгликоль пропанол
Методом последовательных приближений рассчитать адиабатическую
температуру горения для стехиометрической смеси горючего вещества с воздухом
(табл. 6)
Табл. 6
|
Номер варианта
|
Горючее вещество
|
Химическая формула
|
|
7
|
Пропилацетат
|
С5Н10О2
|
Решение.
1. Составляем уравнение реакции горения пропилацетата в воздухе:
С5Н10 О2 + 6,5 (О2 + 3,76 N2) =
5CО2 + 5Н2О + 6,5×3,76 N2
2. Объём продуктов горения составляет:


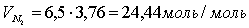
Таким образом, общий объём продуктов горения
 .
.
. Теплота образования пропилацетата в справочниках отсутствует, поэтому
ее рассчитаем. По закону Гесса, теплота реакции равна сумме теплот образования
продуктов реакции за вычетом теплот образования исходных веществ.
Поэтому записываем реакцию образования пропилацетата:
COOH + C3H7OH = CH3COOC3H7 + H2O
Далее по справочнику определяем теплоту образования уксусной кислоты,
пропилового спирта, воды (жидк.):
ΔQобр(CH3COOH) = 484.2 кДж/моль ΔQобр(C3H7OH) = 307.19 кДж/моль ΔQобр(H2O) = 286.3 кДж/моль Теплота
реакции этерификации ΔQ(реакц) = 8.9 кДж/моль.
ΔQ(реакц) = ΔQобр(H2O) + ΔQобр(CH3COOС3Н7) - ΔQобр(CH3COOH) -
ΔQобр(C3H7OH) ,
откуда теплота образования пропилацетата:
ΔQобр(CH3COOС3Н7) = ΔQобр(CH3COOH) + ΔQобр(C3H7OH) - Qобр(H2O) + ΔQ(реакц)=484.2+307.19-286.3-8.9=496,19
кДж/моль.
Так
как |ΔQ|=|-ΔH|,
следовательно ΔH  = -496,19кДж/моль
= -496,19кДж/моль
.
Подставляя полученные данные, рассчитаем низшую теплоту сгорания пропилацетата
по следствию из закона Гесса:
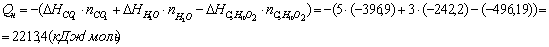
5. Так как теплопотери отсутствуют, то всё выделившееся тепло идёт
на нагрев продуктов горения. Среднее теплосодержание 1 моля продуктов горения
Нср будет составлять:
 (кДж/моль)
(кДж/моль)
6. Воспользовавшись зависимостью теплосодержания газов от
температуры (табл. IX приложения к
методическим рекомендациям), можно установить какой температуре соответствует
такое теплосодержание. Лучше всего это сделать , ориентируясь на азот, так как
его больше всего в продуктах горения. Из табл. IX видно, что при температуре 1900°С теплосодержание азота 63,1
кДж/моль. Уточним, сколько потребовалось бы тепла, чтобы нагреть продукты
горения до такой температуры. При Т1 = 1900 °С
 (кДж/моль)
(кДж/моль)
Но
это больше, чем выделилось тепла в результате реакции горения 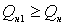 , поэтому можно сказать, что температура горения
меньше, чем 1900 °С. Определим, сколько потребуется тепла для нагревания
продуктов горения до 1700 °С.
, поэтому можно сказать, что температура горения
меньше, чем 1900 °С. Определим, сколько потребуется тепла для нагревания
продуктов горения до 1700 °С.
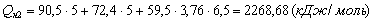
Но
и 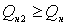 , значит Тг < 1700°С
, значит Тг < 1700°С
При
температуре 1600°С

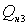
уже
меньше, чем  , из этого можно сделать вывод, что температура
горения этанола имеет значение между 1700 и 1600°С. Уточним
эту температуру линейной интерполяцией между двумя этими ближайшими значениями:
, из этого можно сделать вывод, что температура
горения этанола имеет значение между 1700 и 1600°С. Уточним
эту температуру линейной интерполяцией между двумя этими ближайшими значениями:
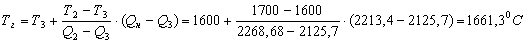 или
1934,3 К
или
1934,3 К
Ответ:
адиабатическая температура горения пропилацетата составила 1934,3 К
Задание
№4
Рассчитать,
какое минимальное количество горючей жидкости (табл. 8) должно испариться в
закрытом помещении объёмом Vп при нормальных условиях, чтобы создалась
взрывоопасная концентрация горючих паров. Условно принять, что пары горючей
жидкости равномерно распределены в объёме помещения. Нижний концентрационный
предел распространения пламени рассчитать по предельной теплоте сгорания.
Табл.8
|
Номер варианта
|
Химическая формула
|
Объём помещения, м3
|
|
7
|
Пропанол
|
С3Н7ОН
|
800
|
Решение.
. Составляем уравнение реакции горения пропанола в воздухе:
С3Н7ОH + 4,5 (О2 + 3,76 N2) = 3 СО2 +4 Н2О + 4,5 *3,76 N2
2. Рассчитываем низшую теплоту сгорания пропанола по закону Геса (
теплоты образования веществ взяты из приложения к методическим рекомендациям):
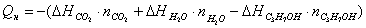
Qн = 396,9×7 + 242,2×7 - 307,19 =
1853,1 кДж/моль (справочные данные 1852 кДж/моль).
3. Поскольку предельная теплота сгорания выражена в кДж/м3 и
составляет 1830 кДж/м3, то и низшую теплоту сгорания выражаем в кДж/м3,
учитывая что объём одного моля пропанола при нормальных условиях составляет
0,0224 м3:

. Рассчитываем НКПРП пропанола, учитывая что предельная теплота сгорания
для большинства горючих веществ одинакова и равна 1830 кДж/м3:
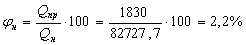
.
Рассчитываем объём паров пропанола, необходимого для создания НКПРП в ёмкости
объёмом 800м3:

.
Рассчитываем количество пропанола, при испарении которого в ёмкости объёмом 800
м3 создаётся минимальная взрывоопасная концентрация (т.е. НКПРП), учитывая, что
1 моль пропанола (М = 60 г/моль) при нормальных условиях занимает объём 0,0224
м3:
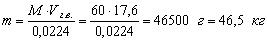
Ответ:
для образования в ёмкости объёмом 800 м3 минимальной взрывоопасной концентрации
пропанола в ней должно испариться 46,5 кг вещества.
Задание №5
Рассчитать температуру вспышки или температуру воспламенения горючей
жидкости (табл. 12) по формуле В.И. Блинова. Сравнить найденное значение с
экспериментальным, взятым из справочника.
Табл. 12
|
Номер варианта
|
Название жидкости
|
Химическая формула
|
Определяемый параметр
|
|
7
|
Бутанол
|
С4Н9ОН
|
Температура воспламенения
|
Решение.
. Для решения задачи по формуле В.И. Блинова необходимо иметь
значение коэффициента n -
число молей кислорода, необходимое для полного сгорания одного моля паров
бутанола, для чего записываем уравнение реакции горения бутилового спирта:
H9OH + 6(О2+ 3,76N2) = 4СО2 + 2Н2О + 6·3,76N2, откуда n = 6.
2. Из формулы В.И. Блинова
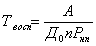
вычислим
произведение
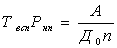 ,
,
где
D0 определяем по таблице IV приложения к
методическим рекомендациям. D0=0.0681(м2/с)
При определении Твосп параметр А = 53,3 (К×Па.м2)/с, поэтому
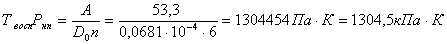
.
Найдем такую температуру, при которой произведение РТ будет равно 1304,5 кПа·К.
Тогда найденное значение температуры будет соответствовать температуре
воспламенения.
Воспользуемся
для этого зависимостью давления насыщенного пара от температуры жидкости,
приведенной в таблице XI приложения к методическим рекомендациям. Для бутанола
при Т1 = 314,5 К давление паров составляет Р1 = 2,666 кПа, а Р1Т1 =838,46 кПа×K. Это меньше, чем РвоспТнп. При Т2 = 326,4 К давление
паров Р2 = 5,332 кПа, а Р2Т2= =1740,37 кПа×К. Это уже
больше, чем РвоспТнп. Значит, Твосп имеет значение между Т1 и Т2. Найдём его
методом интерполяции:
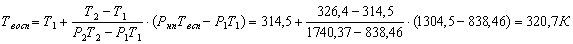
Сравнение полученного значения с экспериментальным (314 К) показывает,
что погрешность расчета по формуле В. И. Блинова для бутанола составляет 6,7 К.
Ответ: температура воспламенения бутанола 320,7 К.