Разработка методов получения особо чистых модифицированных алюмооксидных катализаторов и носителей и изучение их свойств
Содержание
Введение
. Литературный обзор
1.1 Смешанные оксиды в катализе
1.2 Гомогенность в смешанных оксидах
.3 Методы получения смешанных
алюмооксидных носителей
.4 Влияние условий получения на
свойства смешанных алюмооксидных носителей
.5 Состояние комплексов алюминия в
спиртовых растворах
.6 Каталитическая активность
.7 Дегидратация бутанола на
модифицированных оксидах алюминия
. Методика эксперимента
.1 Получение алкоголятов алюминия
.1.1 Метод активации йодом
.1.2 Метод активации сулемой
.2 Совместный гидролиз бинарных
систем
.2.1 Система Al2O3/SiO2
.2.2 Система Al2O3/ZrO2
.2.3 Система Al2O3/TiO2
.3 Исследование каталитической
активности
. Результаты и их обсуждение
.1 Изучения влияние условий
приготовления гидроксидов алюминия на их фазовый состав
3.2 Изучение фазового состава
модифицированных окидов алюминия
.3 Изучения процессов происходящих
при гидролизе по данным ЯМР (27Al,
13C) и МУРР
(малоуглового рентгеновского рассеяния)
.3.1 Изучение состояния Al(III)
в спиртовых растворах алкоксидов алюминия по данным ЯМР (27Al,
13C) и МУРР
(малоуглового рентгеновского рассеяния)
.3.2 Изучения процесса гидролиза
методом ЯМР спектроскопии
.3.3 Изучение осадка гидроксида
алюминия методом МУРР
.4 Изучение влияние добавок четырех
валентных элементов на основные и кислотные центры γ-Al2О3
.5 Удельная каталитическая
активность
Выводы
Список использованной литературы
Введение
Анализ патентных данных и анализ химического
состава зарубежных катализаторов показывает, что наиболее эффективные
катализаторы риформинга, гидроочистки нефтяных фракций, реакции Фишера-Тропша и
селективного окисления СО в водороде получаются при использовании в качестве
носителя для катализаторов, перечисленных реакций особо чистого оксида
алюминия. Этот носитель получают гидролизом алкоголятов алюминия. Вероятнее
всего, высокая эффективность носителей обусловлена не только низким содержанием
примесей, но и какими-то другими свойствами, зависящими от способа получения.
Кроме того, в последнее время в промышленности появились большие избытки низших
спиртов, таких как метанол, этанол и бутанол, которые можно использовать в
качестве дешевого сырья для получения различных олефинов. И использование в
качестве катализатора, для этих процессов, особо чистого оксида алюминия,
является очень перспективным в настоящее время. Особый интерес представляют
оксиды алюминия, модифицированные другими элементами, как правило,
четырехвалентными. Метод их получения [1,2], основан на совместно гидролизе
алкоксидов алюминия и соединений Э4+. Такая модификация позволяет регулировать
кислотные свойства носителя, что очень важно для катализаторов
нефтепереработки, которые должны обладать многофункциональным действием, а
также для многих других химических процессов, для которых необходимы
катализаторы, с оптимальной силой кислотных и основных центров.
В России, практически отсутствуют технологии
производства алюмооксидных носителей особой чистоты. На сегодняшний день
существует только одно предприятия в Редькино, которое производит этот носитель
очень ограниченными партиями. Вероятнее всего, именно этот фактор обусловливает
более низкие показатели отечественных катализаторов по сравнению с зарубежными.
Производство модифицированных особо чистых оксидов алюминия в России
отсутствует. В связи с этим, в Институте катализа СО РАН ведется разработка
технологии производства модифицированных алюмооксидных носителей и
катализаторов. Технология основана на совместном гидролизе алкоголятов алюминия
и соединений Э4+.
Цель данной работы - разработка научных основ
приготовления особо чистого модифицированного гамма-оксида алюминия, в т.ч.
попытка изучения механизма гидролиза алкоксидов алюминия и механизма
образования гидроксидов алюминия при гидролизе алкоксидов. А также определение
перспективных направлений применения модифицированных оксидов алюминия в
качестве катализаторов.
Личный вклад автора состоит в следующем:
§ работа с литературой;
§ приготовление всех образцов;
§ тестирование полученных катализаторов;
§ участие в обсуждение результатов;
§ написание и оформление дипломной работы;
§ участие в оформлении статьи и тезисов на
конференцию;
Благодарности:
Автор выражает глубокую признательность своему
руководителю д.х.н. Молчанову В.В., д.х.н. Федотову М.А. за съемку ЯМР спектров
и помощь при интерпретации, м.н.с. Богданова C.В.
и д.х.н. Мороз Э.М. за съемку рентгенограмм, д.х.н. Тузикову Ф.В. за съемку
рентгенограмм на малых углах.
1. Литературный обзор
.1 Смешанные оксиды в катализе
Многокомпонентные оксиды играют центральную роль
в химических и нефтехимических процессах как катализаторы и как носители для
катализаторов. Основной компонент смеси может быть стабилизирован от спекания
даже в присутствии небольшого количества второстепенного компонента. Таким
образом, материал с такой добавкой может использоваться при более высоких
температурах. Например, добавление к титану 10% по массе кремния приводит к
увеличению площади поверхности и объема пор [3]. Кроме того, присутствие
кремния увеличивает температуру кристаллизации оксида титана. Этот эффект
осуществляется из-за препятствия спекания оксида титана соединениями кремния
через образования Ti-0-Si
связи. Комбинация оксидов c
разной валентностью дает возможность для создания новых кислотных центров,
которые не присутствуют ни в одном из чистых соединений.
Золь-гель метод один из наиболее эффективных
методов для синтеза бинарных оксидов, которые трудно получить обычными
способами. Золь-гель метод для бинарных систем, основанный на гидролизе
алкоксидов, является одним из наиболее изученных. Достижение гомогенного
катионного распределения является решающим к пониманию преимуществ золь-гель
метода. Пока еще, во многих случаях, с помощью золь-гель метода для бинарных
оксидов трудно получить желательное или гомогенное распределение.
.2 Гомогенность в смешанных оксидах
Достижение гомогенности на молекулярном уровне
является важным для синтеза смешанных оксидов. В результате гомогенного
смешения появляется новая фаза. Наличие в такой фазе металлов с разными
валентностями приводит к появлению кислотных или основных по Льюису и Бренстеду
центров. Кислотные центры в таких гомогенных смешанных оксидах имеет
принципиально другую природу, чем кислотные центры в негомогенных смешанных
оксидах, и основаны на замещении атомов в узлах кристаллической решетки,
например, трехвалентных, четырехвалентными, в результате чего появляется
Льюисовские центры. Обычно такие гомогенные оксиды металлов обладают большей
каталитической активностью в реакциях, в которых необходимо наличие кислотных
центров. Например, активность гомогенного образца(10% Si
и 90% Ti) в два раза
больше в реакции изомеризации бутена, чем негомогенного. Активность в таких
реакциях увеличивается за счет увеличения концентрации и силы, кислотных по
Льюису и Бренстеду центров [3].
.3 Методы получения смешанных алюмооксидных
носителей
Для получения смешанных алюмооксидных носителей
применяются различные методы. Например, пропитка γ-Al2O3
или бемита солями или алкоголятами металлов, соосаждение солей или алкоголятов,
золь-гель метод и др. Анализ литературных данных показал, что именно применение
методов основанных на гидролизе алкоголятов с возможностью контроля на каждом
этапе синтеза дает наилучшие результаты по величине поверхности, пористой
структуре и термической стабильности. И как следствие более высокой реакционной
способности смешанных алюмооксидных носителей.
Система g-Al2O3
c TiO2
К довольно неплохим результатам приводит метод
получения смешанных алюмооксидных носителей с титаном, описанный в статье [1].
В качестве предшественников используется три-изобутилат алюминия (TИБA)
и тетра-бутилат титана (ТБТ). В качестве растворителя использовался
изопропанол. Гидролиз проводился в кислых условиях. При постоянном
перемешивании по каплям добавлялся раствор азотной кислоты. Количество
реагентов было использовано такое, чтобы получить следующее соотношение: HNO3/(ТИБА+ТБТ)~0.2;
H2O/(ТИБА+ТБТ)~20;
ROH/(ТИБА+ТБТ)~75.
Затем осадок оставили под маточным раствором в течение 24 часов. После этого
гель был высушен потоком воздуха при комнатной температуре и прокален при 500oC.
В статье [4] описывается три различных способа
получения смешанных алюмооксидных носителей с титаном - пропитка, соосаждение
солей, гидролиз алкоголятов.
. Пропитка. Сначала был получен γ-Al2O3,
прокаливанием бемита при 500оС. Пропитку, тетрабутанолятом титана в н-пентане,
проводили при комнатной температуре в течение 12 часов, а затем прокалили
образец при 500оС.
2. Соосаждение солей. Растворы сульфата
алюминия и алюмината натрия смешали в стеклянном реакторе и нагрели до 70оС,
при постоянном перемешивали в течение 30 мин и pH
7-8. Затем добавили раствор сульфата титана; для поддержания pH
7-8 использовали раствор гидроксида аммония. Осажденный гель нагревали 30 мин
при температуре 70оС. Полученную суспензию отфильтровали и промыли три раза.
Сушку полученного модифицированного гидроксида проводили при 110оС в течение 8
часов, а затем полученный осадок формовали, методом экструзии, с получением
экструдатов с диаметром 1/10 дюйма. Полученные экструдаты хранились всю ночь
при комнатной температуре, затем их высушили при 120оС и прокалили при 500оС в
течение 4 часов.
. Гидролиз алкоголятов. В качестве
предшественников использовался три-изобутилат алюминия и тетра-бутанолат
титана. В качестве растворителя изопропанол. Гидролиз проводился при pH≈7.
Соотношение спирт/алкоголят ≈ 50, соотношение вода/алкоголят ≈ 20.
Экструдированные носители были получены, как было сказано выше. Полученные
экструдаты хранились всю ночь при комнатной температуре, затем их высушивали
при 120оС и прокаливали при 500оС в течение 4 часов.
Система g-Al2O3
c ZrO2
Поиск литературы по смешанным алюмооксидным
носителям с добавками четырехвалентными элементов показал, что система Al2O3
- ZrO2 изучена еще
меньше чем с TiO2. По данной
теме была найдена только одна статья. Метод получения смеси оксидов алюминия и
циркония основан на гидролизе алкоголятов алюминия и циркония [2]. В качестве
предшественников использовались три-изопропилат алюминия и тетра-изопропилат
циркония. Гидролиз проводился раствором аммиака (24 мас %) при комнатной
температуре. Затем раствор медленно в течение 1 часа нагревался до 75 оС. при
постоянном перемешивании. Полученный осадок отцентрифугировали и 10 мин.
промывали горячей водой. Сушка проводилась при 120 оС.
Система g-Al2O3
c SiO2
В многокомпонентной системы, два или более
предшественника находятся на разных стадиях гидролиза, что приводит к
увеличению числа возможных реакций гидролиза и конденсации. Установление
контроля над скоростью гидролиза и конденсации, важно в многокомпонентном
случае, из-за различий в скорости гидролиза различных алкоксидов.
В связи с этим непосредственный гидролиз может
привести к тому, что более реакционноспособный предшественник гидролизуется и
конденсируется первым. Менее реакционноспособный предшественник реагирует
позже, таким образом, покрывает более реакционноспособный, формируя отдельные
фазы. Для того чтобы избежать этого, для этих систем был предложен метод
предварительного гидролиза. По этому методу вначале гидролизуют менее
реакционноспобный алкоголят металла (в данном случае это алкоголят кремния)
действием эквивалентного, для замещения одной алкококси группы, количества
воды, а затем добавляют более реакционноспособный алкоголят алюминия.
Наибольшее признание при проведении согидролиза
получил в последнее время метод предварительного согидролиза, предложенный Левиным
и Томасом [5]. В системе Al(OR)3
- Si(OR)4
по этому методу вначале частично гидролизуют Si(OR)4
действием 0,5 - 1 моль H2O,
затем вводят Al(OR)3:
Si(OR)4 + H2O → Si(OR)3OH +
ROH
Si(OR)3OH + Al(OR)3 →
(RO)3SiOAl(OR)2
При введении Al(OR)3
авторы отмечали образование белого осадка, который постепенно растворялся.
Причины и механизм этого явления не обсуждался [5].
Хотя возможно, что небольшие добавки кремния (до
5 масс. %) не приведут к разделению фаз, а будут формироваться фаза оксида
алюминия в объеме и фаза алюмосиликата на поверхности. Это теория будет
проверена в нашей работе.
.4 Влияние условий получения на свойства
смешанных алюмооксидных носителей
Очень часто при получении смешанных оксидов
следует добиваться равномерного распределения. Как видно из статьи [4], в
случае с титаном это удается, используя методы соосаждения солей и гидролиз
алкоголятов, которые описаны выше. Напротив, при использовании пропитки,
получается отдельная фаза анатаза на поверхности оксида алюминия. Использование
же метода, основанного на гидролизе алкоголятов, позволяет получить гомогенные
образцы с содержанием титана до 14 масс. % [6].
Как было сказано раньше, для кремния трудно
добиться равномерного распределения из-за различной реакционной способности.
Поэтому в этом случае часто применяется метод предварительного гидролиза,
который был описан выше.
Не смотря на все усилия, для циркония не удалось
найти литературных данных о влияние условий получения на свойства полученных
смешанных алюмооксидных носителей.
Хорошо известно, что формирование величины
поверхности идет на стадии образования гидроксидов. В дальнейшем на стадиях
сушки и прокаливании поверхность только уменьшается. Поэтому, варьируя условия
на стадии гидролиза алкоголятов, мы можем получить смешанные оксиды с хорошей
удельной поверхностью. В статье [1] предлагается метод получения алюмотитановых
носителей, основанный на гидролизе алкоголятов в кислых условиях (добавлением
по каплям раствора азотной кислоты). И при содержании титана 6 масс % они
получают образец с поверхностью Sуд~260m2/g.
В статье [4] предлагаются другие условия получения алюмотитановых носителей.
Гидролиз проводится в нейтральных условиях и с другим соотношением реагентов.
При содержании титана 5 масс % получается образец с поверхностью Sуд~242
m2/g.
Сравнить пористую структуру не удается из-за отсутствия данных в [1] статье.
Подробнее методы получения были описаны в пункте 1.3.
В статье [7] было изучено влияние различных
факторов при гидролизе алкогятов алюминия на пористую структуру. И был
обнаружен интересный факт, что параметры пористой структуры зависят от
соотношения г=[H2O]/[Al(sec-BuO)3]. С уменьшением отношения воды к алкоголяту,
объем и размер пор уменьшается. С другой стороны увеличение r
ведет к плохой однородности распределения пор, и оптимальное соотношение r≈1.5.
.5 Состояние комплексов алюминия в спиртовых
растворах
При первом исследовании раствора триизопропилата
алюминия [Al(OPri)3)]4
в бензоле методом ЯМР на ядрах 27A
авторыl [8] обнаружили
только одну линию с химическим сдвигом (ХС) d = 0. Но в
растворах хлорида алюминия в спиртах [9] AlCl3
+ ROH / CH3CN
были обнаружены две линии ЯМР 27Al,
d
= 10 и 5,5 м.д., отнесенные с использованием данных ЯМР 1Н к [Al(MeOH)6]3+
и [Al(MeOH)6-xClx]3-x.
Растворы в изопропиловом спирте в этой работе не изучались.
Исследования методом ЯМР 1Н [10] и 13С [10]
показали лабильность образующихся комплексов при комнатной температуре.
Растворы (Bu4N)[Al(OR)4]
в органических неполярных растворителях изучались в [12] методом ЯМР 27Al
в поле 4,7Т. Из растворов алкоксидов были выделены полиядерные формы [13-15],
что дало основание полагать, что часть алюминия в растворе присутствует в виде
полиядерных форм.
Все ранние работы были сделаны на спектрометрах
с магнитными полями 1¸2,3Т, что препятствовало обнаружению
широких линий ЯМР на фоне узких. Можно было ожидать, что спектры в высоких
полях будут более информативны вследствие «замедления» обмена между формами в
шкале времени ЯМР и лучшего разрешения широких линий.
.6 Каталитическая активность
С каждым годом количество нефти уменьшается, и
приходится использовать новые, зачастую более грязные месторождения, а
потребности в бензине и других легких фракциях все возрастают. Так же
ужесточаются экологические требования по содержанию металлов и сераорганики.
Поэтому сейчас в нефтяной отрасли существует острая потребность в новых, более
активных катализаторах гидрообессеривания и деметаллизации, которые бы отвечали
современным экологическим требованиям.
Одни из наиболее широко применяемых
катализаторов в процессе гидроочистки - это NiMo/g-Al2O3,
NiCo/g-Al2O3
и NiW/g-Al2O3.
Оксид титана является также привлекательными в качестве носителя для синтеза
катализаторов гидроочистки. Однако он обладает двумя недостатками. Это
маленькая площадь поверхности и низкая стабильность при высокой температуре.
Поэтому, большой интерес представляют именно смешанные оксидные носители,
содержащие титан. Оксид алюминия имеет большую площадь поверхности и обладает
лучшей термической стабильностью, но катализаторы на основе алюмооксидных
носителей проявляют низкую активность в реакции гидрообессеривания. Поэтому,
смешанный алюмотитановый оксидный носитель представляется хорошей альтернативой
для преодоления этих проблем. Кислотные свойства, которые могут влиять на
каталитическую активность, у бинарных оксидов выше, чем кислотные свойства
индивидуальных оксидов. Смешанные оксиды TiO2
и g-Al2O3,
как сообщают [16], являются многообещающими носителями для катализаторов
гидрообессеривания, так как эти оксиды увеличивают эффективность удаления серы.
Кроме того, Zhaobin
и соавторы сообщили, что модификация g-Al2O3
оксидом титана улучшает эффективность не только реакции гидрообессеривания, но
и реакции гидрирования [17]. Pophal
и соавторы сообщили, что катализаторы с носителем g-Al2O3-TiO2
были наиболее эффективными в реакции гидрообессеривания 4,6 -
диметилбензотиофена. Это было приписано эффекту предгидрирования бензольного
кольца аликил-дибензотиофеновых производных производных [18]. По мнению авторов
[18] реакции гидродеметаллизация, включающие в себя последовательность шагов,
включая гидрирования, дегидрирования и затем крекинга (разрыв C
- C связи),
катализируется протоном на поверхности катализатора. Это означает, что
кислотные носители могут способствовать размыканию циклов гидрированных интермедиатов,
шаг, включенный в механизм гидродеметаллизации, как было недавно предложено.
Так же здесь необходимо упомянуть недавнюю
работу, проведенную V. Santes
и соавторами по изучению влияния метода получения алюмотитановых носителей на
активность в процессе гидроочистки [4] Результаты показали, что катализаторы,
полученные из смешанных оксидных носителей показывают более высокую
каталитическую активность, чем катализаторы, полученные из чистого
алюмооксидного носителя, что подтверждает интерес к таким материалам. Кроме
того, каталитическая активность в реакциях гидрообессеривания и
гидродеметаллизации зависела от способа получения носителя. Для реакции
гидрообессеривания она была выше в случае, когда носитель был получен методом
гидролиза алкоголятов. А для гидродеметаллизации, когда носитель был получен
методом осаждения.
.7 Дегидратация бутанола на модифицированных
оксидах алюминия
Получение алкенов, особенно изобутена,
представляет большой интерес и в нефтехимической промышленности и в
органическом синтезе. Изобутен широко используется как предшественник для
получения эфиров (например: метил-третбутиловый эфир (МТБЕ); этил-третбутиловый
эфир (ЭТБЕ); и других эфиров), которые повышают октановое число моторных
топлив. Не в меньшей степени изобутен находит применение в полимерной химии,
или непосредственно как мономер, или как промежуточное соединение для получения
метакриловой кислоты.
Для получения изобутена (например: из бутенов
или бутанолов), в качестве катализатора часто используется микро и мезопористый
γ-Al2O3,
активированный разбавленной серной или азотной кислотой, сульфатом или
гидросульфатом или нитратом аммония [19,20]. На первой стадии идет дегидратация
с последующей структурной изомеризацией. Температура процесса по различным
литературным источникам варьируется от 350 - 650°С, при более низких
температурах идет только процесс дегидратации.
Известно [21-23], что под действием кислотных
центров катализаторов происходит дегидратация спиртов, и ее скорость растет с
увеличением силы кислотных центров. Поэтому наибольшая скорость в реакции
дегидратации должна наблюдаться для катализаторов с сильными протонными
(Бренстодовскими центрами) и сильными льюисовскими центрами. На протонных
катализаторах спирт активируется в результате образования с протонным центром
катализатора водородносвязанного комплекса - М - O
- H…O(H)R,
разложение последнего или непосредственно или через образование поверхностных
алкокси - структур приводит к дегидратации спирта. В результате взаимодействия
с льюисовскими центрами возникают связанные с катионами алкоксидные группы M-OR,
их последующее превращение с участием основных центров приводит к выделению
алкена.
Gangundi
P. Babu,
et. al.
сообщили, что для фосфатированного оксида алюминия, скорость в реакции
дегидратации бутанола увеличивается при увеличение мольного соотношения P:Al
от 0.17 до 0.66, дальнейшее увеличение фосфора приводит к снижению скорости
реакции, значит кислотные свойства зависят не только от количества введенной
кислоты [24]. Ими было сделано заключение, что P - OH группы становятся
сильными Бренстодевскими килотными центрами, только в присутствии Al
- OH групп.
Выводы
Из рассмотренной литературы можно сделать
следующие выводы:
. Известны общие характеристики для хорошо
смешанных образцов, включая высокую концентрацию кислотных и основных центров и
высокую активность в реакциях, которые требуют кислотных или основных центров.
Потребности в будущих исследованиях в этой области включают лучшее изучение
связи между молекулярными процессами, которые происходят в начальной стадии
синтеза гидроксидов и свойств прокаленных оксидов, используя методы ЯМР, ЭПР,
МУРР ИК-спектроскопии.
2. В литературе не обнаружено экспериментально
доказанных механизмов гидролиза алкоголятов алюминия. Установление механизма
гидролиза позволило бы сознательно и целенаправленно управлять свойствами
оксида алюминия. Информация о возможности регулирования кислотно-основных
свойств оксида алюминия при введении модифицирующих добавок на стадии гидролиза
в литературе практически также практически отсутствует.
2. Методика эксперимента
.1 Получение алкоголятов алюминия
Связи с низкой реакционной способности алюминия
в реакции со спиртами, существуют различные методы его активации. В нашей
работе мы освоили два таких метода. Это активация йодом и сулемой.
.1.1 Метод активации йодом
На первом этапе нужно очистить алюминия от
оксидной пленки. Для этого помещали 10 г алюминия в раствор азотной кислоты.
После удаления оксидной пленки, алюминий промывали сначала несколько раз водой,
а затем изопропиловым спиртом.
Очищенный таким образом алюминия помещали в
колбу на 500 мл и заливали избытком изопропилового спирта (300 мл), который был
предварительно осушен над цеолитами, и добавляли 0,05 г йода. Затем интенсивно
перемешивали, при нагревании до полного растворения алюминия. Полученную смесь
отцентрифугировали, для того чтобы очистить раствор алкоголята от взвешенных,
не прореагировавших частичек алюминия.
.1.2 Метод активации сулемой
Сначала помещали 20 г алюминия в раствор азотной
кислоты, чтобы очистить его от оксидной пленки. Затем промывали водой и
помещали на 5-10 мин в 50 мл ~0.2 % масс раствора сулемы. После этого
многократно промывали активированный алюминий водой и спиртом.
Очищенный таким образом алюминия помещали в
колбу на 1000 мл и заливали избытком изопропилового спирта (600 мл), который
был предварительно осушен над цеолитами. Затем интенсивно перемешивали, при
нагревании, до полного растворения алюминия. Полученную смесь
отцентрифугировали, для того чтобы очистить раствор алкоголята от взвешенных,
не прореагировавших частичек алюминия.
.2 Совместный гидролиз бинарных систем
Для того чтобы корректно можно было сравнивать
полученные данные, все смешанные оксиды были получены в одинаковых условиях и с
одинаковым мольным содержанием добавок четырехвалентных элементов (Э = Si,
Ti и Zr).
Было приготовлено две серии образцов. В первой, соотношение Al/Э(IV)≈64/1,
во второй количество вводимого четырех валентного элемента было увеличено в 1.5
раза и составило Al/
Э(IV) ≈42/1
.2.1 Система Al2O3/SiO2
В колбу объемом 1000 мл помещали 0.1270 молей
триизопропилата алюминия и 0.0020 (0,0030) молей тетраэтоксисилана и растворяли
в 370 мл изопропилового спирта. После этого нагревали раствор до 50˚С и
при интенсивном перемешивании небольшими порциями приливали 100 мл 1% раствора
хлорида аммония NH4Cl.
После добавления, примерно, 10 мл раствора образовывался студень, и
перемешивание затруднялось. Но при дальнейшем добавлении раствора хлорида
аммония студень растворялся. Перемешивание продолжали в течение двух часов при
50˚С. А затем полученный осадок оставляли под маточным раствором в течение
суток.
Для отделения гидроксида от жидкой фазы
использовали центрифугу. Сушку полученного модифицированного гидроксида
проводили при температуре 120ОС в течение шести часов.
Прокаливание гидроксидов алюминия полученных по
выше приведенным методикам проводили в корундовых тиглях в муфельной печи при
температуре 550ОС в течение четырех часов.
2.2.2 Система Al2O3/ZrO2
В колбу объемом 1000 мл помещали 0.1270 молей
триизопропилата алюминия и 0.0020 (0,0030) молей хлорида циркония и растворяли
в 370 мл изопропилового спирта. После этого нагревали раствор до 50˚С и
при интенсивном перемешивании небольшими порциями приливали 100 мл 1% раствора
хлорида аммония NH4Cl.
После добавления, примерно, 10 мл раствора образовывался студень, и
перемешивание затруднялось. Но при дальнейшем добавлении раствора хлорида
аммония студень растворялся. Перемешивание продолжали в течение двух часов при
50˚С. А затем полученный осадок оставляли под маточным раствором в течение
суток.
Для отделения гидроксида от жидкой фазы
использовали центрифугу. Сушку полученного модифицированного гидроксида
проводили при температуре 120ОС в течение шести часов.
Прокаливание гидроксидов алюминия полученных по
выше приведенным методикам проводили в корундовых тиглях в муфельной печи при
температуре 550ОС в течение четырех часов.
.2.3 Система Al2O3/TiO2
В колбу на 1000мл помещали 0.1270 молей
триизопропилата алюминия и 0.0020 (0,0030) молей хлорид титана и растворяли в
370 мл изопропилового спирта. После этого нагревали раствор до 50˚С и при
интенсивном перемешивании небольшими порциями приливали 100 мл 1% раствора
хлорида аммония NH4Cl.
После добавления, примерно, 10 мл раствора образовывался студень, и
перемешивание затруднялось. Но при дальнейшем добавлении раствора хлорида
аммония студень растворялся. Перемешивание продолжали в течение двух часов при
50˚С. А затем полученный осадок оставляли под маточным раствором в течение
суток.
Для отделения гидроксида от жидкой фазы
использовали центрифугу. Сушку полученного модифицированного гидроксида
проводили при температуре 120ОС в течение шести часов.
Прокаливание гидроксидов алюминия полученных по
выше приведенным методикам проводили в корундовых тиглях в муфельной печи при
температуре 550ОС в течение четырех часов.
Физико-химические методы исследования.
ЯМР спетроскопия
Спектры ЯМР 27Al
и 13С снимали на спектрометре AVANCE-400
BRUKER с частотами ЯМР
104,26 МГц и 100,13 МГц, соответственно. Разложение спектров проводили по
программе WINNMR.
Рентгенофазовый анализ.
Рентгенофазовый анализ проводился с
использованием дифрактометра HZG-4C
на CuKa излучении и
графитового монохроматора на отраженном пучке.
Удельная поверхность.
Удельная поверхность определялась по тепловой
десорбции азота методом БЭТ на приборе Asap
2400 (Micrometrics,
США)
ЭПР спектроскопия
Спектры ЭПР сняты на спектрометре ESR-221.
Концентрация основных и кислотных центров определялась по методике, описанной в
статье [25].
МУРР (малоуголовое рентгеновское рассеивание)
Измерения рентгенограмм МУРР проводились на
малоугловом рентгеновском дифрактометре фирмы SIEMENS
(Германия).
.3 Исследование каталитической активности
Каталитическая активность определялась в
установке с проточным дифференциальным реактором. Схема установки приведена на
рисунке 1. Скорость подачи н-бутанола ~ 0.28 г/мин . Температура реакции
варьировалась от 275˚С до 300˚С . Навеска катализаторов ≈ 1.8
г. Время контакта ≈ 1.4 с.
Часть моей работы была посвящена сборке
установке для дегидратации бутанола для того, чтобы увеличить точность
полученных данных.

Рис. 1. Схема установки дегидратации
бутанола
1- бутанол
2- перистальтический насос
- испаритель
- печь
- реактор
- холодильник
- коллектор
3. Результаты и их обсуждения
.1 Изучение влияния условий приготовления
гидроксидов алюминия на их фазовый состав
В ходе проведенных работ был исследован гидролиз
алкоголятов алюминия и модифицированных (Zr,
Ti, Si)
алкоголятов алюминия. Были выявлены некоторые закономерности влияния алкильного
радикала на формирование морфологии гидроксида алюминия (данные приведены в
таблице 1).
Таблица 1. Влияние алкоксидной группы на
свойства получаемых гидроксидов и оксидов алюминия.
|
СН3О-
|
изо-С3Н7О-
|
трет-
С4Н9О-
|
изо-
С5Н11О-
|
n-С6Н13О-
|
|
ПБ
66% дефектный
|
Аморфная
фаза
|
Аморфная
фаза
|
ПБ
75% дефектный
|
ПБ
60% дефектный
|
|
D020 (Å)
|
30
|
|
|
30
|
20
|
|
d020
|
6.916
|
|
|
7.31
|
7.2
|
|
S (м2/г)
|
304
|
|
|
315
|
|
|
ППП,
%
|
28.1
|
38,3
|
34,4
|
21.5
|
22.1
|
|
γ-Al2О3
|
68%
|
Аморф.
фаза
|
Аморф.
фаза
|
85%
|
85%
|
|
D (Å)
|
35
|
|
|
30
|
|
|
a
|
7.94
|
|
|
7.94
|
|
|
S (м2/г)
|
224
|
|
|
220
|
|
Было установлено, что увеличение длины цепи
алкоксидной группы приводит к снижению содержания аморфной фазы, повышению
содержания псевдобемита и совершенствованию его кристаллической структуры.
В дальнейшем варьировались условия гидролиза,
время и температура старения осадка на примере триизопропилата алюминия. Данные
приведены в таблице 2.
Таблица 2. Влияние кислотности среды,
температуры и времени старения на формирование получаемого псевдобемита.
|
Образец
|
Среда
гидролиза
|
Температура
старения, 0С
|
Время
ста-рения, час
|
Фазовый
состав
|
d020, A
|
D020, A
|
|
ААБ-14
|
HCl
|
20
|
4
|
aм.
|
|
|
|
ААБ-15
|
HCl
|
50
|
2
|
aм.
|
|
|
|
ААБ-17
|
HCl
|
50
|
4
|
50%ПБ+aм.
|
6,66
|
20
|
|
ААБ-21
|
HCl
|
50
|
8
|
70%ПБ+ам.
|
6,56
|
20
|
|
ААБ-22-1
|
HCl
|
80
|
4
|
70%ПБ+ам.
|
6,56
|
20
|
|
ААБ-22-2
|
HCl
|
Прокален
5500С
|
50%g+h
|
|
35
|
|
ААБ-23-1
|
HCl+NH4Cl
|
20
|
2
|
40%ПБ+ам.
|
6,56
|
<20
|
|
ААБ-23-2
|
|
Прокален
5500С
|
60-70g+h
|
|
38
|
|
ААБ-27
|
H2O
|
20
|
8
|
100%ПБ
|
6,28
|
30
|
|
4
|
NH3+H2O
|
60
|
0
|
100%ПБ
|
6,42
|
30
|
* - образец 4 получен во ВНИИОС
(Новокуйбышевск).
Было показано, что увеличение температуры и времени
старения образцов под маточным раствором приводит к снижению содержания
аморфной фазы, повышению содержания псевдобемита и совершенствованию его
кристаллической структуры. Гидролиз в щелочной (водный раствор аммиака) и
нейтральной среде позволяет получать образцы с практически 100% содержанием
псевдобемита. В то же время, в образцах, полученных гидролизом в кислой среде,
содержится аморфная фаза.
Таблица 3. Влияние добавок на свойства
гидроксида алюминия.
|
%
Me, по массе
|
b, А
|
c, A
|
d020,A
|
d002, A
|
D020, А
|
D002, A
|
|
Si
|
5
|
-
|
3.7
|
-
|
1.85
|
-
|
54.2
|
|
5
(предварит. гидр.)
|
-
|
3.7
|
-
|
1.85
|
-
|
69.7
|
|
1
|
-
|
3.7
|
-
|
1.85
|
-
|
53.4
|
|
Ti
|
5
|
-
|
3.72
|
-
|
1.86
|
-
|
33
|
|
Zr
|
1
|
12,56
|
-
|
6,28
|
-
|
35
|
-
|
|
2
|
12,64
|
-
|
6,32
|
-
|
25
|
-
|
Добавление 4-х валентных металлов приводило к
лучшей окристаллизованности образцов, полученных в кислых условиях, о чем можно
судить по увеличению интенсивности и уменьшению ширины пиков.
На основании проведенных исследований
оптимизированы условия получения и отработаны методики приготовления оксида
алюминия. По этим методикам наработаны опытные партии катализаторов.
.2 Изучение фазового состава модифицированных
окидов алюминия
После отработки методике, в дальнейшем, все
модифицированные образцы получались в одинаковых условиях, которые описаны в
пункте 2. Были получены две серии модифицированных оксидов алюминия. В первой,
мольное соотношение Al/Э(IV)
≈ 64/1, во второй количество вводимого Э(IV)
четырех валентного элемента было увеличено в 1.5 раза и составило Al/Э(IV)
≈ 42/1. Данные по этим образцам представлены в таблицы 4.
Таблица 4. Параметры ячейки γ-Al2О3
|
4.4.0
|
%
Me, по массе
|
a(Ao)
|
D(Ao)
|
Sуд(m2*g-1)
|
|
γ-Al2О3
|
|
0
|
7.94
|
35
|
220-225
|
|
γ-Al2О3 с Si
|
|
1.6
|
7.95
|
35
|
225
|
|
γ-Al2О3 с Zr
|
I
|
5
|
7.95
|
35
|
189
|
|
γ-Al2О3 с Ti
|
|
2.7
|
7.95
|
35
|
268
|
|
γ-Al2О3 с Si
|
|
2.42
|
7.95
|
30
|
286
|
|
γ-Al2О3 с Zr
|
II
|
7.5
|
7.95
|
20
|
|
γ-Al2О3 с Ti
|
|
4
|
7.95
|
30
|
227
|
Оксид γ-Al2О3
имеет кубическую решетку с параметром ячейки a=b=c=7.92.
Как мы видим в таблице 4, в нашем случае параметр ячейки для читстого γ-Al2О3
(a=7.94). Вероятно,
это может быть связано с присутствием углерода, который не полностью удалился
после прокалки.
Рентгенограммы модифицированных γ-Al2О3
не показали наличие фаз оксида титана (анатаза), оксида кремния (тридимит,
кристобалит) и оксида циркония соответственно. Но по изменению параметра ячейки
(a=7,95) можно
сказать, что все эти элементы как-то встроились в кристаллическую структуру
оксида алюминия. То есть в нашей работе нам удалось добиться равномерного
распределения для каждого из модифицированных оксидов.
.3 Изучения процессов происходящих при гидролизе
по данным ЯМР (27Al,
13C) и МУРР
(малоуглового рентгеновского рассеяния).
Анализ отечественной и зарубежной литературы
показал, что механизм гидролиза алкоголята алюминия еще совсем не изучен. В
найденной литературе были предложены только схемы последовательного гидролиза
всех алкокси групп, которые экспериментально не были подтверждены. В связи с
этим нами была предпринята попытка изучения механизма гидролиза методом ЯМР
спектроскопии (спектры снимали на ядрах Al27,
C13) и МУРР
(малоуглового рентгеновского рассеивания).
алюминий бинарный каталитический
спиртовой
3.3.1 Изучение состояния Al(III)
в спиртовых растворах алкоксидов алюминия по данным ЯМР (27Al,
13C) и МУРР
(малоуглового рентгеновского рассеяния)
Изучение форм алюминия и их эволюции в процессе
гидролиза позволит открыть пути управления свойствами образующихся твердых
осадков [26]. Поэтому начальным этапом этих работ должно быть изучение
состояния алкоксидов алюминия в спиртовых растворах. Чему посвящена данная
часть работы.
Были приготовлены образец I
- 0,05M раствор
триметоксиалюминия в метиловом спирте, образец II
- 1М раствор триэтоксиалюминия в этиловом спирте, образец III
- 0,3М раствор триизопропоксиалюминия в изопропиловом спирте. Спектры ЯМР 27Al
образца I в диапазоне
температур 296 - 253 К (рис.2, табл.5) представляют линию с шириной около 5
кГц. При 283 К проявилась асимметрия линии, указывающая на наличие второй
компоненты. Дальнейшее снижение температуры приводит к уширению линий, которое
маскирует наличие компонент.
Согласно шкале химических сдвигов 27Al
[27], линия А в спектре образца I
(58 м.д.) относится к атомам алюминия в тетраэдрическом кислородном окружении,
линия В (29 м.д.) - к пентакоординированным атомам алюминия. Наличие слабой
узкой линии 72 м.д., которую можно отнести к моноядерному метоксиду [Al(OMe)3(HOMe)],
указывают на то, что широкие линии относятся к полиядерным формам.
Ширина линий W
квадрупольных ядер, в том числе и ядра 27Al,
пропорциональна квадрату градиента электрического поля (ГЭП) и времени
корреляции вращательного движения tс [28]:
µ (ГЭП)2tс.
(1) .
Таблица 5. Параметры ЯМР 27Al
алкоксидов алюминия.
|
Образец,
T(K)
|
A, d(W), %a)
|
B, d(W), %
|
C, d(W), %
|
D, d(W), %
|
|
I, 296 283 273 253 среднее II, 297 283
273 253 среднее III, 296 283 273 среднее
|
58
±2,5(5000)
58 ±2(4400),
77% 61 ± 3(5300)
60 ± 3(5400)
59 ± 1,5 -0,3 ± 0,1(55),
38% -0,4 ± 0,2(110),
35% -0,3 ± 0,3(200),
89% -0,4 ± 0,3
(350), 94% -0,35±0,1
62 ± 2(4200),
54% 66 ± 3(6300),
43% 60 ± 4(7200),
41% 62,7 ±1,7 м.д.
|
29
±2(4500),
23% 0,2 ± 0,5(230),
62% 0,7 ± 0,5(260),
65% 1,6 ± 0,7(260),
11% 2,9 ±1(300),
6%. 1,4±1 35,8 ±
1,5(3500), 27% 36,7 ±
2(4500), 24% 32,9 ±
2,5(5200), 30% 35,1 ±1,4
м.д.
|
4,6(730),
11% 5,5(2400), 17% 5,5(1400), 16% 5,1 ± 0,5м.д.
|
2,2(150), 8% 2,1(310), 17% 2,3(380), 13% 2,2 ± 0,3 м.д.
|
ХС, м.д. (ширина линии, Гц),% - интенсивность
линии, весь спектр - 100%.

Рис. 2. Спектр ЯМР 27Al
образца I при 283 К.
Большая ширина линии А может определяться или
обменом лигандов, или искажением симметрии окружения алюминия, или увеличением tс
за счет увеличения молекулярной массы комплекса. Снижение температуры замедляет
обмен, и зависимость ширины линии от температуры показывает, что основной вклад
в ширину дает квадрупольный механизм релаксации по формуле (1).
Электронейтральность полиядерных комплексов,
сложенных из тетраэдров или квадратных пирамид, может быть соблюдена при
условии циклических форм комплексов. Тетрамеры алкоксидов алюминия были изучены
методом рентгеноструктурного анализа в [29].
Образование пентакоординированного окружения
алюминия могут предопределить возникающие стерические препятствия при
образовании цикла из октаэдров. Возможности образования пентакоординационных
органических соединений алюминия ab
initio исследованы в
[29], а структура пентакоординированных изопропокси этилендиаминовых комплексов
алюминия - в [30].
На рис.3 приведен спектр ЯМР 13С образца
этоксиалюминия. Линии 60,1 и 20,7 относятся к атомам С метиленовых и метильных
групп связанного с алюминием этанола, остальные - к свободным молекулам. Видно,
что обмен лигандами в шкале ЯМР углерода - медленный. Это не исключает быстрого
внутрикомплексного обмена лигандов или протона при 303 К.
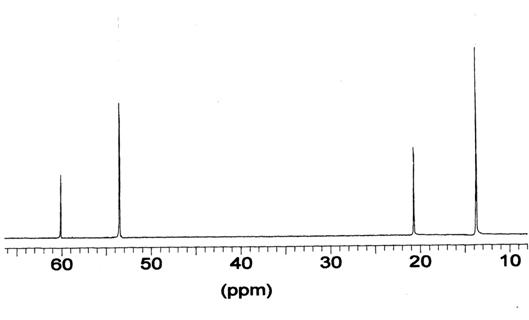
Рис. 3. Спектр ЯМР 13С образца II
при 303 К.
В спектрах алюминия наблюдается два
октаэдрических комплекса, соотношение между которыми меняется по мере снижения
температуры (рис. 4, таблица 5), и происходит медленный в шкале ЯМР обмен. При
самой низкой температуре ширина линий форм примерно одинакова, что говорит в
пользу примерно одинаковой ядерности наблюдаемых форм. ≈Оба комплекса
должны быть незаряженными, поскольку отношение их концентраций меняется от
температуры.
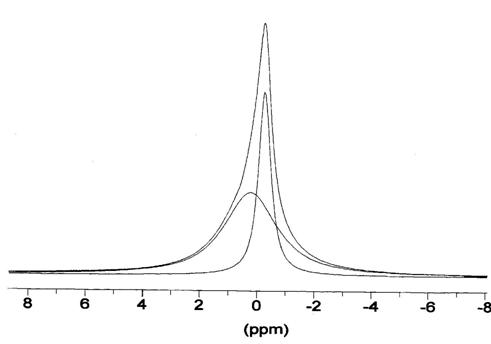
Рис. 4. Спектр ЯМР 27Al
образца II при 297 К.
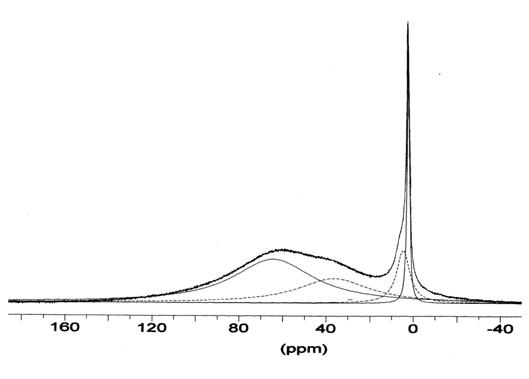
Рис. 5. Спектр ЯМР 27Al
образца III при 296 К.
В спектрах ЯМР 27Al
образца III (рис.5)
видны 4 линии (параметры приведены в таблице 5). Оказалось, что в высоком поле
при комнатной температуре реализуется режим медленного обмена как для спектров
ЯМР 27Al, так и 13С.
В то же время обмен лигандами между свободным и координированным состоянием -
быстрый при 303 К, что следует из спектра ЯМР 13С. Подобная картина не
удивительна, поскольку окружение алюминия в результате этого обмена остается
тем же самым. Можно также предположить, что обмен идет по ассоциативному
механизму, при котором влияние промежуточного состояния на параметры спектра
ЯМР 27Al минимально.
Исходя из шкалы химических сдвигов 27Al
[27], линия А в спектре образца III
относится к алюминию в тетраэдрическом кислородном окружении, линия В - к
пентакоординированному алюминию, линии C
и D - к
октаэдрическому кислородному окружению алюминия. Поскольку не обнаружено
целочисленного соотношения величин интенсивностей каких-либо линий A,
B, C,
D, их следует
относить к индивидуальным формам.
Учитывая положение и небольшую ширину линии D,
ее можно отнести к моноядерному октаэдрическому состоянию комплекса,
по-видимому, fac-Al(OPri)3(PriOH)3
(наименьший ГЭП у комплекса МL13L23
будет у fac-конфигурации
лигандов). По аналогии с водными растворами гидроксоформ алюминия [31,32] линию
С можно отнести к димеру (PriOH)2(PriO)2Al(m-OPri)2Al(OHPri)2(OPri)2.
Линии А и В изопропилатных растворов, как и в
метилатной системе, представляют полиядерные формы. Масштаб уширения линии за
счет искажения октаэдра показывает сравнение ширин линий димера (ХС 5 м.д.) и
мономера (2 м.д.). Бóльшая ширина
линий А и В по сравнению с линией димера, указывает на большую, чем димер, ядерность
форм А и В. Можно было бы предположить, что в растворе содержатся анионные и
катионные формы алюминия, образующие ионные пары. В этом случае соотношение
катионных (октаэдрических) и анионных (тетраэдрических) комплексов должно быть
постоянным для сохранения электронейтральности раствора. Однако по мере
охлаждения соотношение форм, соответствующих линиям ЯМР, меняется (как и у
этоксиалюминия). Это указывает на нулевой заряд форм изопропоксиалюминия. Хотя
при разложении общей линии на составляющие и допускается определенный произвол,
изменение рисунка огибающей подтверждает изменение соотношения форм при
охлаждении раствора. Строение предполагаемых на основании данных, полученных
методом ЯМР, комплексов показано на рисунке 6.
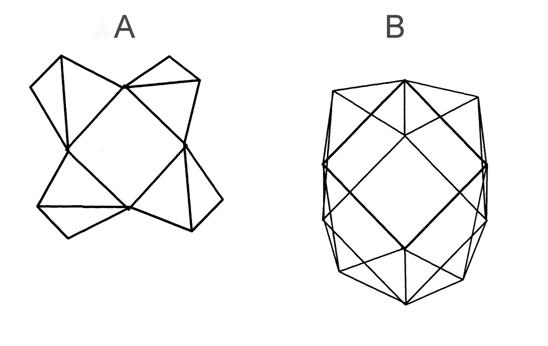
Рис.6. Предполагаемое строение комплексов в
растворе III.
А - тетраэдрический алюминий, В -
пентакоординированный алюминий, С - димер октаэдра, D
- октаэдр.
Для подтверждения строения последних было
проведено изучение раствора триизопропоксиалюминия методом малоуглового
рентгеновского рассеяния (МУРР) [33]. Характер приведенной рентгенограммы МУРР
для раствора триизопропоксида алюминия на рис. 6 показал, что в первом
приближении можно использовать форм-факторы близкие к однородным равноосным
наночастицам (отношение осей не более чем 1:3). Структурными моделями таких
частиц могут являться однородные сферы [34].
Из полученных экспериментальных данных МУРР
(рис. 7) от образца в различных состояниях после процедур аппаратной коррекции
были вычислены значения функций распределений наночастиц по размерам (Dv(R))
в образцах (как решения обратных задач рассеяния) в виде гистограмм в % (значок
v - означает, что
распределение объемное).
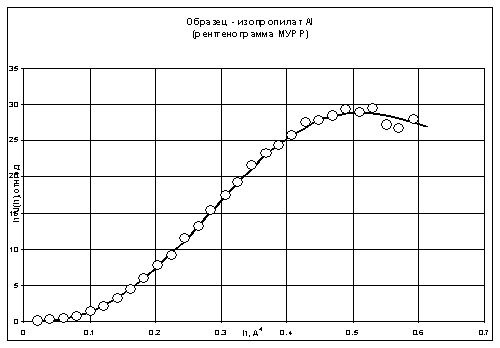
Рис. 7. Рентгенограмма МУРР раствора III
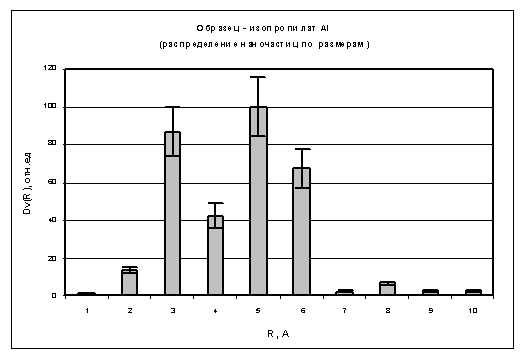
Рис. 8. Объемное распределение частиц в растворе
III
Из приведенной гистограммы (рис. 8) видно, что
основная доля комплексов в растворе триизопропилата алюминия соответствует
интервалу размеров от 0,2 до 0,7 нм (по радиусу). Так как по данным ЯМР
известно, что алюминий в растворе содержится в четырех разных формах, то в этой
области мы имеем право выделить четыре основных пика. Наличие других пиков на
гистограмме (рис. 8) может быть обусловлено ограниченной информативностью
данных МУРР и образованием более крупных агрегатов комплексов алюминия в
растворе.
Для сравнения с данными ЯМР (рис. 5), из
объемных соотношений комплексов, приведенных на рис. 8, делением на объем
предполагаемой формы были получены числа атомов алюминия в соответствующей
полосе, исходя из сферического приближения для всех комплексов (рис. 9). Как
можно видеть из рисунка 9, данные по мольному соотношению комплексов,
полученные методами МУРР и ЯМР, соответствуют друг другу, а их размеры не
противоречат предложенным на рис.6 структурам.
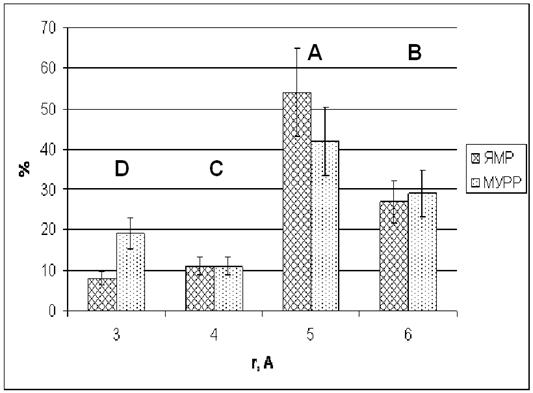
Рис. 9. Доля алюминия в комплексах раствора III
по данным МУРР и ЯМР (обозначения рис. 5).
3.3.2 Изучения
процесса гидролиза методом ЯМР спектроскопии
Следующий этап нашей работы посвящался изучению
процесса гидролиза триизопропилата алюминия в изопропиловом спирте методами ЯМР
спектроскопии и МУРР.
Гидролиз образцов проводился в различных
условиях. В качестве осадителей использовали растворы 0.1М HCl,
H2O,
1% масс раствор NH4Cl
и 0.5% масс раствор NH3.
Стехиометрическое отношение алкоголята алюминия и гидролизующего агента
варьировалась от 0 до 1.
Попытка изучения кинетики гидролиза алкоголята
алюминия не удалась. Независимо от выбора условий, гидролиз шел быстро, практически
с моментальным образованием достаточного крупных коагулятов алюминия, которые
методом ЯМР обнаружить нельзя. И в дальнейшем в растворе уже никаких изменений
не происходило. Все последующие процессы шли в образовавшемся геле.
Варьируя степень гидролиза для образца III
(0,3М раствор триизопропоксиалюминия в изопропиловом спирте), мы не наблюдали
новых форм алюминия (рис. 10). Менялось только абсолютная интенсивность
описанных выше форм, относительная же оставалась примерно одинаковой (рис. 11).
Логично было бы предположить, что скорость гидролиза разных форм должна быть
различной и относительная интенсивность их на разных стадиях гидролиза должна
меняться, но, как видно из спектров, она сохраняется на каждом этапе гидролиза.
Значит, между этими формами существует равновесие, которое устанавливается,
быстрее, чем идет гидролиз, либо все три алкоксидных группы замещаются на
гидроксильные группы практически одновременно.
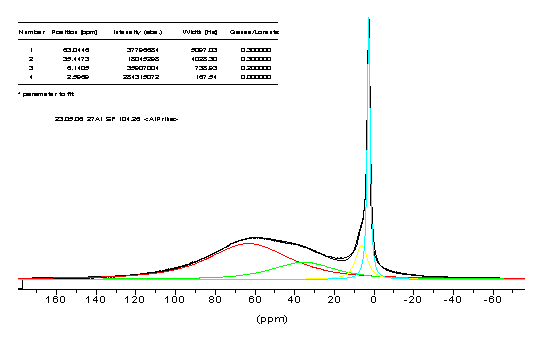
Рис. 10. Спектр ЯМР 27Al
р-ра изопропилата алюминия, к которому добавлено 0,5 экв. Н2О.
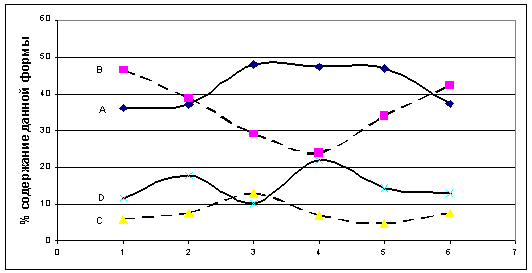
Где A-
пик с хим. сдвигом 63,5 м.д.,
B- пик с хим.
сдвигом 36.9 м.д.,
C- пик с хим.
сдвигом 6.1 м.д.,
D- пик с хим.
сдвигом 2.6 м.д.
Рис. 11. Доли форм алюминия в различных
образцах.
Проведенные исследования показали несостоятельность
приведенных в литературе схем гидролиза алкоголята алюминия, которые являются
слишком упрощенными вариантов тех процессов, которые происходят при гидролизе.
И они не отражают тех реальных химических превращений, которые протекают при
гидролизе алкоголятов алюминия. Этот процесс нуждается в дальнейших
исследованиях, и основной упор нужно сделать уже на изучение изменений,
происходящих во влажном геле.
3.3.3 Изучение динамики процесса старения
гидроксида алюминия методом МУРР (малоугловое ренгеновское рассеивание)
Так как в начале нашей работы (таблица 2) нами
было показано, что выбор гидролизующего агента влияет на соотношение аморфной
фазы и псевдобемита, а также на кристаллическую структуру полученных
псевдобемитов. То большой интерес, представляло изучение динамики процессов,
происходящих при старении полученного осадка гидрокида алюминия, во времени и
влияние на него различных гидролизующих агентов. В качестве гидролизующих
агентов были выбраны - 0.1M
раствор HCl соляной
кислоты, дистиллированная вода, 1% масс раствор NH4Cl
хлорида аммония и 0.5% масс NH3
раствор аммиака.
Как и в случае раствора, характер приведенных
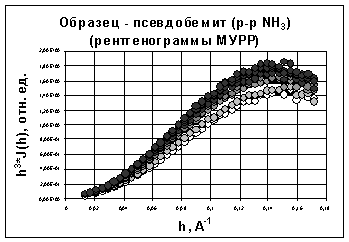
рентгенограмм МУРР для полученных осадков гидроксидов алюминия (рис. 12 - 15)
показал, что в первом приближении можно использовать форм-факторы близкие к
однородным равноосным наночастицам (отношение осей не более, чем 1:3).
Структурными моделями таких частиц могут являться однородные сферы [27].
Рис. 12

Рис. 13
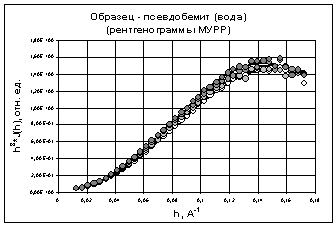
Рис. 14
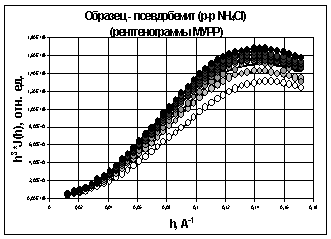
Рис. 15
J(h)
- интенсивность рентгеновского рассеивания, h
= 4π*sin(θ)/λ,
2θ - угол рассеивания
У осадков гидроксидов алюминия полученных,
гидролизом раствора HCl
соляной кислоты (рис. 12) и дистиллированной водой (рис. 13) изменения
структуры проходили очень медленно во времени. Рентгенограммы с разными
временами старения гидроксида алюминия, лежат очень близко к друг другу.
Изменения в структуре гидроксидов алюминия, полученных гидролизом раствор NH4Cl
хлорида аммония (рис. 14) и раствор NH3
аммиака (рис. 15) идут значительно быстрее, о чем свидетельствуют значительные
изменения у полученных рентгенограмм с разными временами старения.
Из полученных экспериментальных данных МУРР от
образцов в различных состояниях после процедур аппаратной коррекции были
вычислены значения функций распределений наночастиц по размерам (Dv(R))
в образцах (как решения обратных задач рассеяния) в виде гистограмм в % (значок
v - означает, что
распределение объемное) (см. рис. 16 - 19). Измерения проводились in
situ. На гистограммах
также показана динамика процесса, каждые столбик соответствует определенному
времени старения осадка гидроксида алюминия, увеличение времени идет слева
направо (от 5 мин. до 2,5 часов).
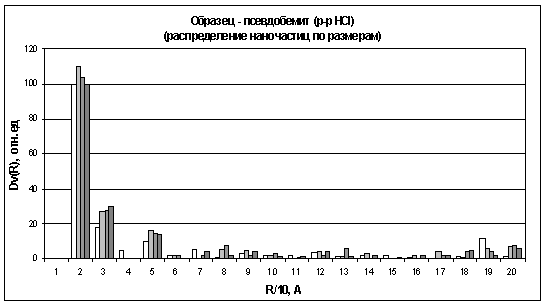
Рис. 16. Распределение частиц по размерам для
осадков гидроксидов алюминия, полученного гидролизом раствора HCl.
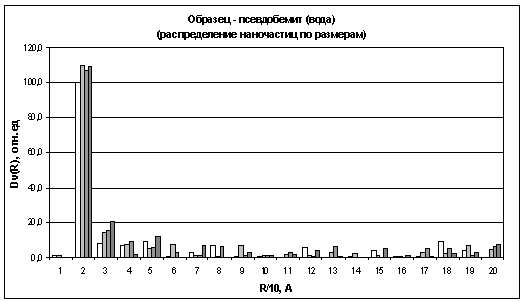
Рис. 17. Распределение частиц по размерам для
осадков гидроксидов алюминия, полученного гидролизом дист. водой.
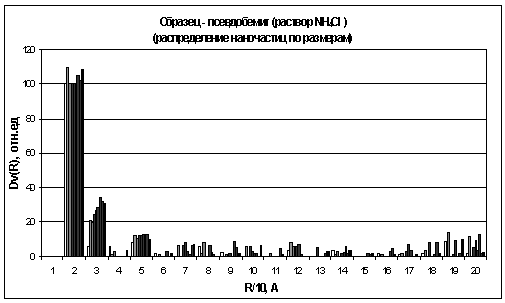
Рис. 18. Распределение частиц по размерам для
осадков гидроксидов алюминия, полученного гидролизом раствора NH4Cl.

Рис. 19. Распределение частиц по размерам для
осадков гидроксидов алюминия, полученного гидролизом раствора NH3.
Отсутствие мелких частиц говорит о том, что
процесс гидролиза проходит очень быстро и методика эксперимента не позволяет
зафиксировать самое начало процесса гидролиза. Это подтверждает данные ЯМР о
высокой скорости гидролиза.
Из гистограмм видно, что наибольшее количество
частиц для осадков гидроксидов алюминия, находится в области 15 - 25A,
и их количество незначительно меняется во времени, уменьшается или возрастает,
какую-то тенденцию для этой области проследить трудно.
В области 25 - 35А, на всех гистограммах,
наблюдается постоянное увеличение количества частиц. Причем эти изменения более
ярко выражены для осадков гидроксидов алюминия, полученных гидролизом раствора NH4Cl
хлорида аммония (рис. 18) и гидролизом раствора NH3
аммиака (рис. 19).
Интересным представляется факт, что у осадков
гидроксидов алюминия, полученных гидролизом водой (рис. 17) и раствором NH3
аммиака (рис. 19), присутствуют частицы в области 35 - 45А, и количество этих
частиц постепенно уменьшается во времени. В тоже же время у осадков гидроксидов
алюминия полученных, гидролизом раствора HCl
соляной кислоты (рис. 16) и раствора NH4Cl
хлорида аммония (рис. 18), частицы в этой области практически отсутствуют, и
они полностью исчезают при увеличении времени старения. Можно сделать
предположение, что это как-то связано с кислотностью среды или, например, с
присутствием хлорид ионов в растворе.
Значительное количество частиц так же лежит в
области 45 - 55А, и количество этих частиц в начале процесса старения немного
увеличивается, а потом остается практически неизменным.
Для более крупных частиц, из-за недостатка
статистических данных, очень трудно выявить какие-то закономерности.
И, наконец, если сравнить данные по
распределению частиц у осадков гидроксида алюминия и в растворе триизопропилата
алюминия. То можно заметить одну закономерность. Как было установлено ранее, в
растворе триизопропилата алюминия, алюминий содержится в четырех разных формах.
А из гистограмм для гелей легко заметить, что наблюдается четыре основных
области распределения частиц. По-видимому, каждая из этих форм алюминия
отвечают, за выпадения и дальнейший рост частиц определенного размера.
Например, из окта координированного алюминия получаются только частицы, которые
лежат в области 25 - 35А.
.4 Изучение влияние добавок четырех валентных
элементов на основные и кислотные центры γ-Al2О3
Как было сказано выше, введение четырехвалентных
элементов в кристаллическую решетку трехвалентных элементов приводит к
появлению Льюисовских центров. Такие центры имеет принципиально другую природу,
чем центры в негомогенных смешанных оксидах.
Определение концентрации основных и кислотных
центров для чистых и модифицированных алюмоокидных носителей проводилось
методом спиновых зондов [28]. Метод основан на образование стабильных анион-
или катион-радикалов на оксидной поверхности. Количество образовавшихся
радикалов пропорционально количеству основных или кислотных центров.
Концентрации основных центров определялась по адсорбции тринитробензола.
Концентрация кислотных центров определялась по адсорбции параксилола.
Еще до снятия спектров ЭПР, по изменению цвета
раствора можно было качественно судить об относительной основности и
кислотности образцов. Результаты ЭПР подтвердили первоначальные выводы и дали
представления о количестве этих центров (таблица 6).
Таблица 6. Количество основных и кислотных
центров
|
%
Э(IV), по
массе
|
Nосновных центр../гр
|
Nкислотных центр../гр
|
|
γ-Al2О3
|
0
|
6.6E+18
|
2.61E+15
|
|
γ-Al2О3 с Si
|
|
1.6
|
6.47E+18
|
4.6E+15
|
|
γ-Al2О3 с Zr
|
I
|
5
|
3.43E+18
|
4.97E+15
|
|
γ-Al2О3 с Ti
|
|
2.7
|
4.3E+18
|
4.71E+15
|
|
γ-Al2О3 с Si
|
|
2.42
|
1.8E+18
|
4.36
E+15
|
|
γ-Al2О3 с Zr
|
II
|
7.5
|
0.95E+18
|
3,81
E+15
|
|
γ-Al2О3 с Ti
|
|
4
|
1.49E+18
|
3,4
E+15
|
Как мы видим из таблицы, введение одинакового
количества четырехвалентных элементов в кристаллическую структуру оксида
алюминия приводит к уменьшению количества основных центров в следующем порядке Si>Ti>Zr,
при одинаковом мольном количестве этих элементов, как в первой серии образцов (I),
так и во второй (II),
в которой содержание вводимых Э(IV)
было увеличено в 1.5 раза. Наиболее акцепторными в первом случае (I)
является образец с цирконием, а во втором (II)
образец с Ti. Чистый γ-Al2О3
гамма оксид алюминия, из всех вышеприведенных (таблица 6) содержит наибольшее
количество основных и наименьшее количество кислотных центров.
.5 Удельная каталитическая активность
Каталитическая активность модифицированных
образцов была исследована на примере модельной реакции дегидратации бутанола.
Была изучена температурная зависимость (рис. 20-25) и определена энергия
активации для каждого из образцов (таблица 7).
Рис. 20.
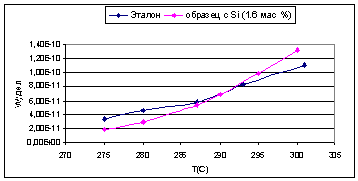
Рис. 21.
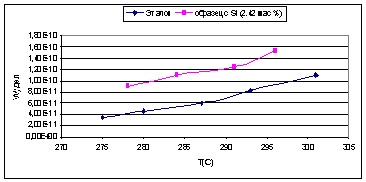
Рис. 22.
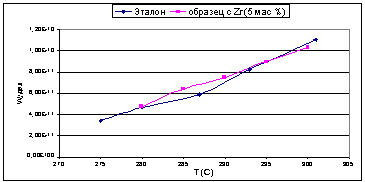
Рис. 23.
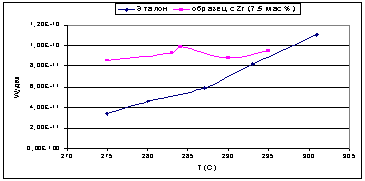
Рис. 24.
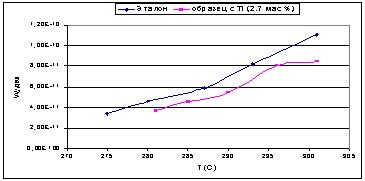
Рис. 25.
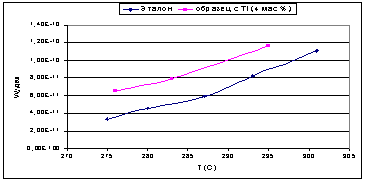
Таблица 7. Энергия активации в реакции
дегидратации бутанола
|
%
Э(IV), по
массе
|
Ea(кДж)
|
|
γ-Al2О3
|
|
0
|
120
|
|
γ-Al2О3 с Si
|
|
1.6
|
205
|
|
γ-Al2О3 с Zr
|
I
|
5
|
100
|
|
γ-Al2О3 с Ti
|
|
2.7
|
115
|
|
γ-Al2О3 с Si
|
|
2.42
|
70
|
|
γ-Al2О3 с Zr
|
II
|
7.5
|
8
|
|
γ-Al2О3 с Ti
|
|
4
|
80
|
Для первой серии образцов, наибольшая удельная
каталитическая активность наблюдалась у оксида алюминия с добавкой циркония.
Для титана же она была несколько ниже, чем у чистого оксида алюминия, но так
как введение титана приводило к увеличению величины поверхности, то активность,
отнесенная к одному грамму катализатора, была выше, чем у эталона. Оксид
алюминия с добавкой кремния при более низких температурах показал меньшую
удельную каталитическую активность, чем чистый оксид алюминия, но при повышение
температуры его активность возрастала быстрее и начиная с 290°С, его удельная
активность становится выше, чем у чистого оксида алюминия.
Во второй серии образцов, с увеличенным
содержанием вводимых Э(IV)
в 1.5 раза, все модифицированные оксиды показали значительно большую удельную
каталитическую активность, которая в 1.5-2 раза превышала активность чистого
оксида алюминия. Для образца с добавкой циркония удельная активность
практически не изменялась с увеличением температуры. Вероятно, это факт можно
объяснить конкуренцией с идущей параллельно реакцией этерификации, с
образованием простого дибутилового эфира.
Рис. 26. График зависимости скорости от
температуры, построенный в Аррениусовских координатах
Где, W - скорость,
выраженная в единицах W[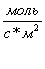 ], a T -
температура (К).
], a T -
температура (К).
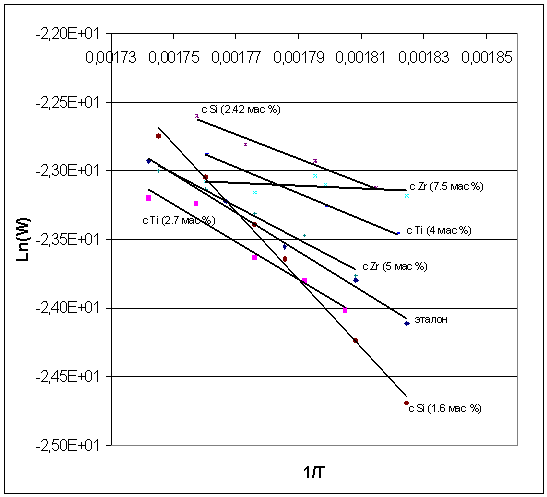
Энергия активации увеличивается в
ряду Zr (7.5 мас
%)<Si (2.42 мас
%)<Ti (4 мас
%)<Zr (5 мас
%)<Ti (2.7 мас
%)<эталон (таблица 7). Эти данные говорят о положительном влияние добавок. У
образца с кремнием Si (1.6 мас %) энергия активации
значительно больше, чем у чистого оксида алюминия γ-Al2О3, и
сильно отличается предэкспоненциальный множитель, а для образца с цирконием Zr (7.5 мас %)
наблюдается практически нулевая энергия активации.
Кроме того, нами были получены
корреляционные зависимости между количеством кислотных и основных центров и
удельной скоростью протекания реакции дегидратации н-бутанола W[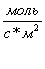 ].
Результаты представлены на рис.27 и 28.
].
Результаты представлены на рис.27 и 28.
Рис. 27. Влияние количества основных
центров на скорость реакции дегидратации н-бутанола.
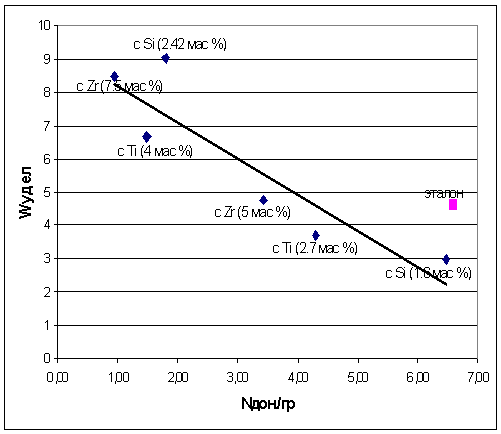
Где, W - скорость,
выраженная в единицах W[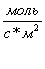 ],
],
a Nдон./г -
количество основных центров на 1 г катализатора.
Было установлено, что удельная скорость реакции
обратно пропорционально количеству донорных центров. То есть, уменьшение
количества основных центров приводит к увеличению удельной скорости реакции. И
наибольшие удельная скорость реакции наблюдается для образцов с добавкой
циркония (7.5 мас %), титана (4 мас %) и кремния (2.42 мас %) которые являются
наименее основными. Видно, что чистый оксид алюминия γ-Al2О3
выпадет из этой закономерности. Вероятно, это связано с другой природой
основных центров.
Рис. 28. Влияние количества кислотных центров на
скорость реакции дегидратации н-бутанола

Где, W - скорость,
выраженная в единицах W[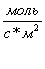 ],
],
Nак./г -
количество кислотных центров на 1 гр. катализатора.
На данной корреляционной зависимости
(рис. 28) видны две отдельные линейные зависимости между количеством кислотных
центров и удельной скорость реакции Wуд.. Из них
легко увидеть, что скорость реакции линейно возрастает с увеличением
концентрации кислотных центров. Причины, по которым нами были получены две
независимых прямых, могут быть связаны с несколькими факторами. Во-первых, по
методике, которую мы использовали для определения кислотных центров мы мерим
достаточно сильные кислотные центры (пункт 3.4), а в реакции дегидратации могут
принимать участия и более слабые кислотные центры, которые не фиксируются
данным методом. Кроме того, при проведении реакции дегидратации, нами
отмечалось образование простого дибутилового эфира. И полученные различия могут
быть связаны с разной селективностью в этих двух параллельно идущих процессах
Выводы
1. Для того, чтобы получить образцы с
максимальным содержанием псевдобемита необходимо:
§ Увеличение длина алкоксидной группы у алкоголята
алюминия.
§ Увеличение температура и времени старения.
§ Проведение гидролиза в щелочных или нейтральной
условиях.
§ Добавление четырех валентных элементов (Э=Zr,
Ti, Si).
2. На основании метода рентгенофазового
анализа, было установлено, что модифицирующие добавки входят в структуру оксида
алюминия γ-Al2О3.
3. В спиртовых растворах алкоксидов алюминия (R
= OMe, OEt,
OPri) существует набор
комплексов с тетраэдрическим, октаэдрическим окружением алюминия, а также
комплексы с пентакоординированным алюминием. В растворах триметокси- и
триизопропоксиалюминия преобладают тетраэдрические и пентакоординированные
формы алюминия, в растворах триэтоксиалюминия преобладают октаэдрические формы.
Большая часть алюминия в растворе триизопропоксиалюминия содержится в
незаряженных полиядерных комплексах, вероятно, в виде 4-звенных циклов.
Обнаружены комплексы с пятикоординированным окружением алюминия. Полученная
информация открывает возможность регулирования свойств высокодисперсного оксида
алюминия .
4. Установлено, что в растворе
триизопропилата алюминия, наблюдаются четыре типа комплексов:
§ Полиядерный циклический комплекс, построенный из
четырех тетраэдров.
§ Полиядерный циклический комплекс, построенный из
четырех пяти координированных атомов алюминия
§ Октаэдр
§ Димер октаэдра
5. По данным МУРР для гидроксидов алюминия
наблюдаются четыре основных области распределения частиц. Предполагается, что
каждый из вышеперечисленных комплексов алюминия отвечает, за образование и
дальнейший рост частиц определенного размера.
6. Данные ЯМР и МУРР показывают, что
процесс гидролиза проходит очень быстро и методика эксперимента не позволяет
зафиксировать самое начало процесса гидролиза.
. Установлено, что удельная скорость
модифицированных образцов оксида алюминия в реакции дегидратации н-бутанола
линейно снижается при увеличении концентрации основных центров и линейно
возрастает при увеличении концентрации кислотных центров.
. Модифицирование оксида алюминия
добавками четырехвалентных элементов (Zr,
Ti Si)
является эффективным способом регулирования кислотно-основных и каталитических
свойств.
Литература
1. Montoya,
A., del Angela, P., Viveros, T. The effect of temperature on the structural and
textural evolution of sol-gel Al2O3-TiO2 mixed oxides// J. Mater. Chem. - 2001.
- V.11. - P. 944-950.
2. Inamura,
S., et al. T. Formation and hot isostatic pressing of Zr02 solid solution in
the system ZrO2-AI203 // J of Mater. Scinence. -1994. - V.281. - P. 4913-4917.
3. Miller,
B., Ko, E.I. Control of mixed oxide textural and acidic properties by the
sol-gel method // Catalysis Today. - 1997. - V.35. - P. 269-292.
4. Santes,
V., et al. Catalytic hydrotreating of heave gasoil FCC feed on alumina-titania
supporte NiMo catalysts // Applied Catalysis A. - 2005. - N. 281 - P. 121-128.
5. Chem.
Abstr. 1972. 77. 167990г.//
пат.
3640093 США.
1972.
. Stranick,
M.A., Houalla, M., Hercules, D. Spectoscopic characterization of TiO2-Al2O3 and
Co/Al2O3- TiO2 // J. Catal. - 1987. - N. 106 . - P.362.
. Kim,
Y., Kim, C. Kim, P. and Yi, J. Effect of preparation conditions on the phase
transformation of mesoporous alumina // Journal of Non-Crystalline Solids. -
2005. -N. 351. - P.550-556.
8. Haraguchi,
H., Fujiwara, S. Aluminum Complexes in Solution as Studied by Aluminum-27
Nuclear Magnetic Resonance // J.Phys.Chem. -1969. - V.73. - N 10. - P.3467.
9. Буслаев,
Ю.А., Тарасов, В.П., Петросянц, С.П., Киракосян Г.А. Особенности взаимодействия
иона хлора с координарованными молекулами спирта в растворах хлоридов аммония
//Докл. РАН. - 1978. Т.241. - № 4.- С.848.
. Коньшин,
В.В., Чернышев, Б.Н. Радиоспектроскопическое исследование процессов
пероксигидратации и комплексообразования фторперикисных соединений //
Журн.структ.химии. - 1983. - Т.24. - № 1. - С.137
11. Stockton,
G.W., Martin, J.S. A carbon-13 nuclera magnetic resonance study of cation
salvation in alcohols // Can.J.Chem. - 1974. - V. 52. - N 5. - P.744-748.
12. Heřmánek,
S., Křiž, O., Fusek, J. et al. The
influence of alkyl subsitituents, solvent, and temperature on the molar
fractions of components, equilibrium constats, ans 27Al NMR date for
equilibrium mixtures containing Bu4N+AlH4-N(OR)n- // J.C.S. Perkin tr. 2. -
1989. - N.8. - P.987.
. Gelbrich,
T., Dumichen, U., Jorchel, P. A trimeric aluminium alkoxide: methoxyaluminium
dichloride // Acta cryst. - 1999. - V.55C. - N 6. - P.856-858.
. Rhine,
W.E., Eyman, D.P., Schaner, S.J. Trimer-dimer
equilibrium studies of alkylaluminum alkoxides
// Polyhedron. - 1999. - V.18. - N 6. - P.905-908.
15. Meese-Markscheffel,
J.A., Weinann, R., Schumann, H., Gilje, J.W. Potassium aluminium alkoxides:
characterization of polymeric [(PriOH)2K(.mu.-OPri)2Al(.mu.-OPri)2]n
//Inorg.Chem. - 1993. V.32. - N 25. - P.5894-5896.
. Tursiloadi,
S., Imai, H. Preparation and characterization of mesoporous titania-alumina
ceramic by modified sol-gel method // Journal of Non-Crystalline Solids. -
2004. - N. 350. - P.271-276.
17. Zhaobin,
W., Qin, X., Xiexian, G., et al. Titania-modified hydrodesulfurization
catalysts. II, dispersion state and catalytic activity of molybdena supported
on titania-alumina carrier// Appl. Catal. A. - 1991. - N. 75. - P.179.
. Pophal,
C., Kameda, F., Hoshino, K., Yoshinaka, S., Segawa, K. Hydrodesulfurization of
dibenzothiophene derivatives over TiO2-Al2O3 supported sulfided molybdenum
catalyst // Catal. Today. - 1997. - N. 39. - P. 21.
19. Macho,
V., Kralik, M., Jurecekova, E. et. al. Dehydration of C4 alkanols conjugated
with a positional and skeletal isomerisation of the formed C4 alkenes // Appl.
Catal. A. - V.214 - N. 2. - P.251-257.
20. Dehydrative
isomerization process and catalysts for the skeletal isomerization of olefins
derived from alcohol Pat. 280789 Slovakia. &&&&/ Macho V.;
Technologii Trencianskej Univerzity (Slovakia) - 11.07.2000, Slovakia - 6.pp.
. Казанский,
В.Б. Современные представления о механизмах гомогенного и гетерогенного
катализа: сходство и различия // Успехи химии. - 1988. - Т. 57. - № 12. - С.
1937.
22. Крылов,
О.В., Матышак, В.А. Промежуточные соединения и механизмы гетерогенных
каталитических процессов. Простейшие реакции углеводородов, спиртов, кислот //
Успехи химии. - 1994. - V.4.
- N.2. - С.585.
23. Malysheva,
L.V., Kotsarenko, N.S., Paukshtis, E.A. Influence of the basicity of butyl
alcohols on their reactivity // React. Kinet. Catal.
Lett. - 1981. - V.16.
- N.4. - P.365.
24. Babu,
G. P., Ganguli, P., Metcalfe, K. Structure-Property Relationships of some
Amorphous and Crystalline Aluminophosphates // J. Mater. Chem. - 1994. - V.4 -
N.2. - P.331-336.
25. Konovalova,
Т.А.,
Volodin, A.M. Photo-induced generation of radicals from g-Al2O3
- adsorbed m-dinitrobenzene: direct evidence for the formation of electron
donor-acceptor (EDA) complexes with participation of solvent molecules. //
React. Kinet. Catal. Lett. - 1993. - V.51. - N.1. - P.227-232.
. Криворучко,
О.П., Буянов, Р.А., Федотов, М.А., Плясова, Л.М. О механизме формирования
псевдобемита и байерита // Журн.неорган. химии. - 1978. - Т.23. - № 7. - C.1798.
27. Multinuclear
MNR. // Ed.J.Mason. - Plenum Press: N.-Y., L.
28. Абрагам,
А. Ядерный магнетизм.- М.: ИЛ, 1963. - 551с.
29. Atwood,
D.X., Jegier, J.A., Liu, S.et al. Tetrametallic D3-Symmetric Alkoxide Molecules
Containing Aluminum // Organometallics.- 1999. - V.18. - N 6. - P.976-981.
30. Laussac,
J.-P., Renee, E., Galy, J., Laurent, J.-P. Tetra-, penta- and hexacoordinated
aluminium: NMR and X-ray diffraction studies of the complexes of
ethylenediamine with aluminium isopropoxide and its fluoro analogues //
J.Coord.Chem. -1983. - V.12. - N 3. - P.133.
31. Федотов,
М.А., Буянов, Р.А., Криворучко, О.П. Зависимость состава продуктов
полимеризации аква-ионов Al(III)
от концентрации исходных растворов // Изв.АН. Сер.хим. - 1977. - № 10. -
С.2183.
32. Akitt,
J.W., Greenwood, N.N., Khandelwall, B.L., Lester, G.D. Al nuclear magnetic
resonance studies of the hydrolysis and polymerization of the
hexa-aquoaluminium(III) caton // J.C.S.Dalton tr. - 1972. - N 5. - P.604.
. Tuzikov,
F.V., Tuzikova, N.A., Galimov, R.V., Panin, L.E., Nevinsky, G.A. // Поверхность.
Рентгеновские,
синхротронные
и
нейтронные
исследования.
- 2004. - № 10. - С.84-91.
. Свергун
Д.И., Фейгин Л.А. Рентгеновское и нейтронное малоугловое рассеяние. - М.: Мир,
1986. - 68 c.