Конверсия оксида углерода водяным паром (низкотемпературная)
ЗАДАНИЕ
НА КУРСОВУЮ РАБОТУ
Тема
«Конверсия оксида углерода водяным паром (низкотемпературная)»
Конверсию оксида углерода проводят по уравнению:
+ H2O
↔
CO2 + H2
− ∆H0
Состав исходной газовой смеси (мольные доли):
0CO=0,13;
z0H2O=0,50;
z0CO2=0,05;
z0H2=0,1
, остальное азот.
Кинетическое уравнение окисления:

Е = 40000 кДж/кмоль; k0 = 2.03∙106.

Задание:
. Проанализировать изменение
скорости конверсии СО с водяным паром от температуры (Т=400÷1300К) при
давлении Р=1,5,10 ат. для степеней превращения Х=0,2 и 0,9
. Рассчитать значение равновесной
степени превращения в зависимости от входной температуры смеси (T0 задаётся
интервалом) при двух давлениях.
. Сравнить адиабатические и
изотермические РИВ и РПС в зависимости от температуры, построить графики
зависимостей мольной доли ключевого компонента от объёмов реакторов. Обосновать
выбор реактора.
. Рассчитать производительность
реактора
Руководитель _______________
Александрова Юлия Владимировна
Студент _______________ Гребёнкин
Евгений Викторович
Краткие сведения о процессе
Процесс конверсии оксида углерода
водяным паром протекает по реакции:
+ H2O ↔ CO2 + H2 − ∆H0
Эта реакция частично осуществляется
на стадии паровой конверсии метана, однако степень превращения оксида углерода
при этом очень мала и в выходящем газе содержится до 11% СО и более. Для
получения дополнительных количеств водорода и снижения до минимума концентрации
оксида углерода в конвертированном газе осуществляют самостоятельную стадию
каталитической конверсии СО паром.
В соответствии с условиями
термодинамического равновесия повысить степень конверсии СО можно удалением
диоксида углерода из газовой смеси, увеличением содержания водяного пара или
проведения процесса при возможно низкой температуре. Конверсия оксида углерода,
как видно из уравнения реакции, протекает без изменения объёма, поэтому повышение
давления не вызывает смещения равновесия. Вместе с тем проведение процесса при
повышенном давлении оказывается экономически целесообразным, поскольку
увеличивается скорость реакции, уменьшаются размеры аппаратов, полезно
используется энергия ранее сжатого природного газа.
Процесс конверсии оксида углерода с
промежуточным удалением диоксида углерода применяется при производстве водорода
с минимальным количеством примеси метана.
Концентрация водяного пара в газе
обычно определяется количеством дозируемого на конверсию метана и оставшегося
после её протекания. Соотношение: газ перед конверсией СО в крупных агрегатах
производства аммиака составляет 0.4-0.5. Проведение процесса при низких
температурах - рациональный путь повышения равновесной степени превращения
оксида углерода, но возможный только при наличии высокоактивных катализаторов.
Следует отметить, что нижние предельные температуры процесса ограничены
условиями конденсирования водяного пара. В случае проведения процесса под
давлением 2-3 МПа они составляют 180 - 200 0С. Снижение температуры ниже точки
росы вызывает конденсацию влаги на катализаторе, что не желательно.
Реакция конверсии СО сопровождается
значительным выделением теплоты, что обусловило проведение процесса в две
стадии при разных температурных режимах на каждой. На первой стадии высокой
температурой обеспечивается высокая скорость конверсии большого количества
оксида углерода; на второй стадии при пониженной температуре достигается
высокая степень конверсии оставшегося СО. Теплота экзотермической реакции
используется для получения пара.
Таким образом, нужная степень
конверсии достигается при одновременном сокращении пара.
Катализаторы
Температурный режим на каждой стадии
конверсии определяется свойствами применяемых катализаторов. На первой стадии
используется среднетемпературный железохромовый катализатор, который
выпускается в таблетированном и формованном видах.
Для железохромового катализатора
ядами являются сернистые соединения. Сероводород реагирует с Fe3O4, образуя
сульфид железа. Органические сернистые соединения в присутствии железохромового
катализатора взаимодействуют с водяным паром с образованием сероводорода.
Помимо сернистых соединений
отравляющее действие на железохромовый катализатор оказывают соединения
фосфора, бора, кремния, хлора.
Низкотемпературные катализаторы
содержат соединения меди, цинка, алюминия, иногда хрома. Известны двух-, трех-,
четырех- и многокомпонентные катализаторы. В качестве добавок к указанным выше
компонентам применяются соединения магния, титана, палладия, марганца, кобальта
и др. Содержание меди в катализаторах колеблется от 20 до 50% (в пересчёте на
оксид). Наличие в низкотемпературных катализаторах соединений алюминия, магния,
марганца сильно повышает их стабильность, делает более устойчивыми к повышению
температуры.
Перед эксплуатацией
низкотемпературный катализатор восстанавливают оксидом углерода или водородом.
При этом формируется его активная поверхность. Оксид меди и другие соединения
восстанавливаются с образованием мелкодисперсной металлической меди, что, по
мнениюмногих исследователей, и обуславливает его каталитическую активность.
Срок службы низкотемпературных
катализаторов обычно не превышает двух лет. Одной из причин дезактивации
катализаторов является рекристаллизация под действием температуры и реакционной
среды. При конденсации влаги на катализаторе происходит снижение его
механической прочности и активности. Потеря механической прочности
сопровождается разрушением катализатора и ростом гидравлического сопротивления
реактора. Соединения серы, хлора, а также ненасыщенные углеводороды и аммиак
вызывают отравления низкотемпературных катализаторов. Концентрация сероводорода
не должна превышать 0,5 мг/м3 исходного газа.
НТК-4, НТК-8 техническая
характеристика низкотемпературных катализаторов:
|
Показатели
|
Марка
катализатора
|
|
НТК
- 4
|
НТК
- 8
|
|
Содержание
(на прокаленное вещество), % меди (На СuO) хрома
(На Cr2O3) цинка
(На ZnO) алюминия
(на Al2O3) Размер
гранул, мм диаметр высота Насыпная плотность, кг/л Удельная поверхность, м2/г
Пористость, % Прочность, МПа средняя минимальная Теплоёмкость при 2000С
кДж.(кг∙К)
|
54,0±3,0
14,0±1,5 11,0±1,5 19,6±2,0 5 или 6 5 или 4 1,5-1,6 50-60 35-40 28 17 0,712
|
38,0±3,0
1,5±0,5 27,0±2,0 33,0±3,0 5 или 6 5 или 4 1,1-1,4 70-80 50-60 32 20 0,712
|
Основные показатели характеризующие работу
низкотемпературных катализаторов конверсии оксида углерода:
Катализатор……………………………………………….. НТК-4 НТК-8
Температура
максимально возможная на входе в слой
катализатора. 200-210 190-200
максимально допустимая в слое катализатора……….
250 280
Объёмная скорость, ч-1…………………………….. 2000-3000
3000-5000
Соотношение пар:газ……………………………. (0,4-0,7):1
(0,3-0,7):1
Степень превращения СО (от равновесия),
%.................... до 95 97
Срок службы, годы…………………………………………. 2-4 3-5
В случае частичной потери активности
катализатора в результате кратковременного повышения температуры он может быть
регенерирован окислением (температура не выше 2300С) с последующим
восстановлением.
Схемы установки конверсии оксида углерода
При совмещении процессов каталитической
конверсии метана и оксида углерода при 2,0 МПа в одном агрегате газ после
конвертора метана и увлажнителя при температуре 4000С и отношении
пар:газ=1,187:1 последовательно проходит конвектор 1 оксида углерода I
ступени (рис.1), испаритель 2 и конвектор 3 оксида углерода II
ступени. В конверторах газ движется в радиальном направлении. Тепло газа,
выходящего из конвертора СО, используют для нагревания исходной смеси
природного газа и пара в теплообменнике. При этом температура конвертированной
парогазовой смеси (80%) используется в процессе очистки газа от диоксида
углерода. Окончательное охлаждение газа с использованием его тепла зависит от
схемы производства и потребности в тепловой энергии.

рис.1 Схема конверсии оксида углерода в агрегате
с каталитической конверсией природного газа под давлением 2,0 МПа. 1-конвертор
СО I ступени;
2-испаритель; 3-конвертер СО II
ступени.
Химические реакторы
Любые химические продукты получают в
последовательно соединенных между собой аппаратах различной конструкции и
разного назначения. Среди аппаратов технологической схемы всегда можно выделить
аппараты, в которых происходят собственно химические превращения. Такие
аппараты называются реакторами.
Реакторы идеального вытеснения (РИВ)
Это реакторы характеризуются тем, что реагенты
последовательно «слой за слоем» без перемешивания ламинарным потоком проходят
весь реакционный путь, определяемый, как правило, длиной (высотой) аппарата.
Время пребывания 
 любого элемента объема равно
среднерасходному времени
любого элемента объема равно
среднерасходному времени 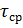
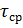 , определяемому по уравнению:
, определяемому по уравнению:

Где V - реакционный
объем аппарата, Vp - объемный расход реагентов; H - высота
реакционного пространства, 
 - фиктивная, рассчитанная на полное
сечение скорость потока.
- фиктивная, рассчитанная на полное
сечение скорость потока.


 эффективный коэффициент диффузии.
эффективный коэффициент диффузии.
В РИВ перемешивание отсутствует,
т.е. 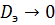
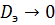 и диффузный критерий Пекле Pe
и диффузный критерий Пекле Pe
 .
.
По длине реактора плавно изменяются
концентрации реагентов, и в соответствии с этим изменяется скорость реакции.
Так для простейшей необратимой реакции A
 протекающей без изменения объема
при постоянстве температуры по мере протекания реакции по длине (высоте) реактора
или, что то же, по времени его пребывания в реакторе уменьшается концентрация
вещества А от СА0 до СА, увеличивается степень превращения и снижается скорость
реакции.
протекающей без изменения объема
при постоянстве температуры по мере протекания реакции по длине (высоте) реактора
или, что то же, по времени его пребывания в реакторе уменьшается концентрация
вещества А от СА0 до СА, увеличивается степень превращения и снижается скорость
реакции.
Если рассматривать процесс,
протекающий в элементарном объеме реактора dV за время d
 , то приход реагента в этот объем
, то приход реагента в этот объем

- объем исходной смеси, поступающей
в единицу времени, м3/с; СА0 - начальная концентрация исходного реагента, кмоль/м3;
ХА - степень превращения на входе в элементарный объем
Убыль (уход):
Количество исходного реагента,
расходуемого на химическую реакцию:

Где UA - скорость
реакции, отнесенная к единице объема.
Уравнение материального баланса для
элементарного объема:
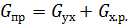

Уравнение материального баланса
всего реактора:

Это характеристическое уравнение
РИВ.
Реакторы полного смешения (РПС)
Проточный РПС - это аппарат, в
котором интенсивно перемешиваются реагенты, например, при помощи мешалки. В
него непрерывно подаются реагенты, и непрерывно выводятся продукты реакции.
Поступающие в такой реактор частицы вещества мгновенно смешиваются с
находящимися в нем частицами, т.е. равномерно распределяются в объеме аппарата.
В результате во всех точках реакционного объема мгновенно выравниваются
параметры, характеризующие процесс: концентрации, степени превращения, скорости
реакции, температуры и др.
Время пребывания единичных частиц
может колебаться в широких пределах вплоть до 
 .
.

Характеристическое уравнение РПС
можно выводить на основании материального баланса. Поскольку в реакторе
идеального смешения концентрации реагентов одинаковы во всем объеме аппарата,
материальный баланс составляется для всего объема аппарата.
Приход вещества равен:

Убыль (уход):

Количество исходного вещества,
вступившего в реакцию:

Материальный баланс реактора:
реакция конверсия оксид
углерод
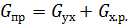

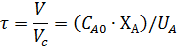
Это характеристическое уравнение
проточного РПС.
Для реакций, протекающих без
изменения объема, степень превращения будет:


Температурный режим реакторов
По температурному режиму реакторы
подразделяются на адиабатические, изотермические и политермические.
Адиабатические реакторы. Такие
аппараты при спокойном (без перемешивания) течении потока реагентов не имеют
теплообмена с окружающей средой, т.е. снабжены хорошей изоляцией. Вся теплота
реакции аккумулируется потоком реагирующих веществ.
Изменение температуры в
адиабатическом реакторе 
 прямо пропорционально степени
превращения Х, концентрации основного реагента СА0, тепловому эффекту реакции q и обратно
пропорциональна теплоемкости реакционной смеси с. Изменение температуры
положительно для экзо- и отрицательно для эндотермических процессов.
прямо пропорционально степени
превращения Х, концентрации основного реагента СА0, тепловому эффекту реакции q и обратно
пропорциональна теплоемкости реакционной смеси с. Изменение температуры
положительно для экзо- и отрицательно для эндотермических процессов.
В изотермическом режиме температура
реакционной смеси, входящей в реактор, равна температуре в реакторе и
температуре смеси, покидающей реактор. Это возможно, если выделение или
поглощение теплоты в результате химической реакции полностью компенсируется
теплообменом с окружающей средой.
Расчетная часть
Проанализировать изменение скорости
конверсии СО с водяным паром от температуры (Т=400÷1300К) при
давлении Р=1,5,10 ат. для степеней превращения Х=0,2 и 0,9
Программный код:
Состав исходной газовой смеси
(мольные доли):





Стехиометрические коэффициенты:
а:=1 b:=1
c:=1 d:=1
Изменение числа молекул:

Универсальная газовая постоянная:
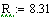
Энергия активации:

Предэкспоненциальный сомножитель:
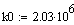
Диапазон изменения температуры, давления и
степени превращения:


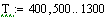

Изменение числа молей в системе:
Равновесная концентрация веществ:





Константа скорости реакции:
Константа равновесия:

Парциальные давления:

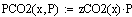

Уравнения скорости прямой и обратной реакций:

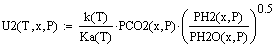
Уравнение суммарной скорости реакции:

График зависимости скоростей прямой, обратной и
суммарной скоростей от температуры, при давлении в 5 атм. и степени превращения
0.6. (рис.2)

рис.2
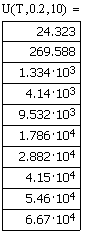
Значения скоростей прямой, обратной и суммарной
скоростей от температуры, при давлении в 1, 5, 10 атм. и степени превращения
0.2




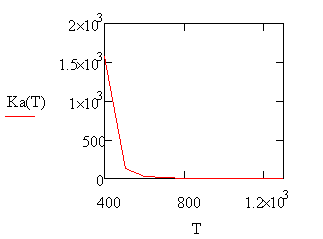
График зависимости константы равновесия реакции
от температуры рис.3
Значения скоростей прямой, обратной и суммарной
скоростей от температуры, при давлении в 1, 5, 10 атм. и степени превращения
0.9


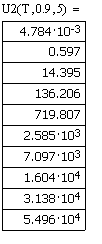



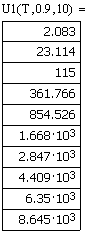
График зависимости константы скорости реакции от
температуры рис.4

Рассчитать значение равновесной степени
превращения в зависимости от входной температуры смеси (T0
задаётся интервалом) при двух давлениях.
Программный код:
Состав исходной газовой смеси (мольные доли):





Стехиометрические коэффициенты:
а:=1 b:=1
c:=1 d:=1
Изменение числа молекул:

Универсальная газовая постоянная:
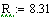
Энергия активации:

Предэкспоненциальный сомножитель:
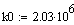
Диапазон изменения температуры, давления и
степени превращения:


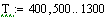
Изменение числа молей в системе:

Равновесная концентрация веществ:




Константа скорости реакции:

Константа равновесия:

Парциальные давления:

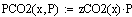


Определим функцию для расчёта равновесной
степени превращения:

Расчёт равновесной степени превращения с
ипользованием численной функции поиска root:
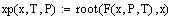
Значения равновесной степени превращения в
зависимости от температуры смеси, при давлении 1, 5, 10 атм.:


График зависимости равновесной степени
превращения в зависимости от температуры смеси при давлении 10 атм. рис.5



Сравнить адиабатические и изотермические РИВ и
РПС в зависимости от температуры, построить графики зависимостей мольной доли
ключевого компонента от объёмов реакторов. Обосновать выбор реактора.
Рассчитать производительность реактора
Адиабатический режим
Программный код:
Состав исходной газовой смеси (мольные доли):




Стехиометрические коэффициенты:
а:=1 b:=1
c:=1 d:=1
Изменение числа молекул:

Универсальная газовая постоянная:
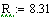
Энергия активации:

Предэкспоненциальный сомножитель:
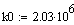
Диапазон изменения температуры, степени
превращения и значение давления:
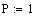


Коэффициент адиабатического расширения:

Температура в реакторе:

Изменение числа молей в системе:

Равновесная концентрация веществ:




Константа скорости реакции:
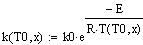
Константа равновесия:

Парциальные давления:
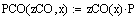





Уравнения скорости прямой и обратной реакций:
Уравнение суммарной скорости реакции:

Время пребывания реагентов в реакторах полного
смешения и идеального вытеснения:


Значения времени пребывания реагентов в
реакторах полного смешения и идеального вытеснения в зависимости от температуры
на входе в реактор:


Диапазон изменения расхода смеси реагентов:

Объём реакторов полного смешения и идеального
вытеснения:



Значения и график (рис.6) зависимости объёмов
реакторов полного смешения и идеального вытеснения в от температуры на входе :



рис.6
Производительность реакторов полного смешения и
идеального вытеснения:



Значения производительности РПС и РИВ от
температуры на входе:

Изотермический режим
Программный код:
Состав исходной газовой смеси (мольные доли):




Стехиометрические коэффициенты:
а:=1 b:=1
c:=1 d:=1
Изменение числа молекул:

Универсальная газовая постоянная:
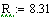
Энергия активации:

Предэкспоненциальный сомножитель:
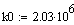
Диапазон изменения температуры, степени
превращения и значение давления:
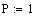


Изменение числа молей в системе:

Равновесная концентрация веществ:




Константа скорости реакции:

Константа равновесия:
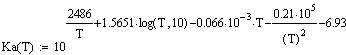
Парциальные давления:
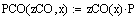


Уравнения скорости прямой и обратной реакций:


Уравнение суммарной скорости реакции:
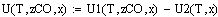

Время пребывания реагентов в реакторах полного
смешения и идеального вытеснения:



Значения времени пребывания реагентов в
реакторах полного смешения и идеального вытеснения в зависимости от температуры
на входе в реактор:
Диапазон изменения расхода смеси реагентов:

Объём реакторов полного смешения и идеального
вытеснения:



Значения и график (рис.7) зависимости объёмов
реакторов полного смешения и идеального вытеснения в от температуры на входе :


рис.7


Производительность реакторов полного смешения и
идеального вытеснения:
Значения производительности РПС и РИВ от
температуры на входе:


Список использованных источников
1.
Кутепов, А.М. Общая химическая технология./А.М. Кутепов, Т.И. Бондарёва, М.Г.
Беренгартен, - М.: ИКЦ «Академкнига», 2003. - 528с.
.
Справочник азотчика: Физико-химические свойства газов и жидкостей. Производство
технологических газов. Синтез аммиака. 2-е изд., перераб., М.: Химия, 1986. -
512с.
.
Краткий справочник физико-химических величин. 11-е изд., перераб., М.: ООО «ТИД
«Аз-book», 2009.
-240с.
.
Луцко, Ф.Н. Химико-технологические расчеты с применением MathCAD:
учебное пособие. / Ф.Н. Луцко, В.Е. Сороко, Прокопенко А.Н., - СПб.:
СПбГТИ(ТУ), 2006. -456с.