Методи дослідження функціонального стану печінки в стадії декомпенсації
Державний
вищий навчальний заклад
«Запорізький
національний університет»
МіністерствА
освіти і науки України
Дипломна
работа
Методи
дослідження функціонального стану печінки в стадії декомпенсації
Виконав
Маллакурбанова Д.А.
Керівник Омельянчик
В.М.
Нормоконтролер
доцент Копійка В.В.
Запоріжжя
2010
ВСТУП
За медико - соціальною значущістю та поширеністю
патологія травної системи, а саме захворювання печінки займає одне з провідних
місць, тому дослідження її патогенетичних механізмів є актуальною проблемою.
У літературі описані зміни з боку клітин крові
при патології печінки в стадії декомпенсації.
Печінка виконує в людському організмі досить
складну та багатосторонню функцію, головним чином в обміні речовин. Вона,
утворюючи і виділяючи в кишечник жовч, особливим чином впливає на процеси
травлення. З іншого боку, вона володіє здатністю перероблювати, затримувати,
перерозподіляти, засвоювати, руйнувати ті чи інші речовини, які в неї
потрапляють із шлунку, а також із селезінки та інших органів і тканин, та разом
з тим синтезувати із цих різних речовин нові біохімічні продукти, важливі для
організму. Печінка (hepar) сама велика з травних залоз.
Цироз печінки - хронічне прогресуюче або рідше
не прогресуюче дифузне поліетиологічне захворювання печінки, з різним ступенем
вираженості ознак функціональній недостатності печінки і портальною
гіпертензією, яке є кінцевою стадією розвитку найчастіше несприятливо
протікаючих форм хронічного гепатиту, наслідком утруднення відтоку жовчі або
крові з печінки або генетично обумовлених метаболічних дефектів. Це
захворювання характеризується значним зменшенням маси функціонуючих
гепатоцитів, перебудовою структури паренхіми - цитоархитектоніки часточки і
судинної мережі печінки.
Мета роботи - вивчити картину крові та
можливості сучасних методів діагностики печінки у стадії декомпенсації.
Для досягнення поставленої мети вирішувалися
наступні завдання :
визначити показники червоної крові у осіб із
даною патологією;
визначити показники білої крові;
визначити рівень загального білірубіну;
визначити показники тимолової проби;
визначити показники АсАТ;
визначити показники АлАТ;
визначити показники сечовини;
визначити показники креатінину;
визначити показники протромбінового індексу
крові.
Матеріалом дослідження були проби і мазки
периферичної крові 40 осіб, серед яких 20 чоловік були практично здоровими і
складали контрольну групу. Середній вік варіював від 43 ± 48 років, давність
захворювання від 1 року до 8 років. Іншу групу складали 20 осіб: вірусний
гепатит В встановлено у 7 пацієнтів, вірусний гепатит С - 4 хворих, кріптогений
цироз (нез'ясованої етіології) - 5 пацієнтів, алкогольної етіології - 4
пацієнтів.
При виконанні роботи використовували наступні
методики: визначали загальну кількість еритроцитів за допомогою
фотоелектричного еритрогемометра, застосовували гемоглобінціанідний метод,
встановлювали ШОЕ, загальну кількість лейкоцитів у камері Горяєва, проводили
підрахунок лейкоцитарної формули, проводили визначення біохімічних показників
(загальний білірубін, тимолову пробу, АсАТ, АлАТ, сечовини креатінину,
протромбіновий час плазми).
Теоретичне значення роботи полягає в розширенні
уявлень про клітинно- молекулярні механізми розвитку захворювання печінки в
стадії декомпенсації.
Практичне значення роботи полягає у застосуванні
клінічних лабораторних тестів, що включають визначення активності ферментів
цитолізу: АСАТ (аспартатамінотрансферази), АЛАТ (аланінамінотрансферази);
ферментів холестазу - г-ггт (гаммаглутамілтранспептідази), лужної фосфатази,
ЛДГ (лактатдегидрогенази). Результати цих тестів відображають функціональну
здатність печінки, тому можуть бути використані як маркери пошкодження печінки.
печінка кров декомпенсація
захворювання
1. ОГЛЯД НАУКОВОЇ ЛІТЕРАТУРИ
.1 Анатомічна будова печінки
.1.1 Поверхні печінки
Розглянемо печінку та її функції як з боку
анатомії, так і з боку гістології, фізіології. Печінка (hepar) сама велика з
травних залоз. Вона займає верхній відділ черевної порожнини, розташовуючись
під діафрагмою, головним чином з правого боку. Залоза має форму, що з одного
боку нагадує шляпку великого гриба, чи форму клину; має верхню, випуклу, та
нижню злегка увігнуту, поверхню. ЇЇ випуклість немає симетричності тому що
найбільш випуклою та об’ємною її частиною є не центральна, а права задня, яка до
переду і ліворуч дещо клиновидна звужується. Розміри печінки з права на ліво
складають в середньому 26-30 см., спереду назад - права частка 20-22 см., ліва
частка - 15-16 см., а найбільша товщина (права частка) 6-9 см. Вага печінки
досягає в середньому 1500 г. Колір червоно-бурий, консистенція м’яка.
Розглянемо поверхню більш детально. Взагалі в
печінці розрізняють верхню, випуклу, діафрагмальну поверхню (facies
diaphragmatica), нижню, місцями ввігнуту, внутрішньоносну поверхню (facies
visceralis), гострий нижній край (margo inferior hepatis), відокремлюючи
спереду верхні і нижні поверхні, злегка випуклу задню частину (pars posterior),
діафрагмальної поверхні.(Мал.1) На передньому краю печінки є вирізка круглої
зв’язки (incisura ligamenti teretis), та праворуч розташована вирізка жовчного
міхура (incisura vesicae felleae).
Верхня, діафрагмальна поверхня печінки випукла і
відповідає за формою куполу діафрагми. Від діафрагмальної поверхні печінки
доверху, до діафрагми, йде сагітально розташована черевна серповидна зв’язка
(lig. falciforme) вона йде від переднього краю печінки назад на протязі
приблизно 2/3 ширини печінки, ззаду листки зв’язки розходяться праворуч та
ліворуч, переходячи в вінцеву зв’язку (lig. coronarium hepatis). Серповидна
зв’язка ділить печінку відповідно верхньої її поверхні на дві частини - праву
частку (lobus dexter) більшу та, що має найбільшу товщину і ліву частку (lobus
sinister) -меншу. Права частка розташована під правим куполом діафрагми, ліва -
під лівим. На верхній поверхні лівої частки видно невелике серцеве вдавлення
(inpressio cardiaca) відповідне розташування серця над діафрагмою. На
діафрагмальній поверхні печінки розрізняють верхню частину (pars superior)
повернену до діафрагми передню частину (pars anterior), повернену до переду, до
реберної частини діафрагми, і до передньої стінки живота в області очеревини,
праву частину (pars dextra), направлену праворуч до бічної черевної стінки і
задню частину (pars posterior), повернену в бік спини.
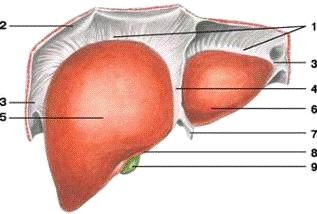
- вінцева зв'язка печінки;
- діафрагма;
- трикутна зв'язка печінки;
- серповидна зв'язка печінки;
- права частка печінки;
- ліва частка печінки;
- кругла зв'язка печінки;
- гострий нижній край;
- жовчний міхур
Рисунок 1.1 - Печінка діафрагмальна поверхня.
Між клітками часточок печінки розташовуються
жовчні капіляри або проточки (ductuli biliferi) (мал. 167), які, з'єднуючись за
межами часточок, утворюють міжчасточкові проточки (ductuli interlobulares)
(мал. 167), що формують правий і лівий печінкові протоки (ductuli hepatis
dexter et sinister), збираючи в загальну печінкову протоку.
Діаметр часточок печінки складає 1-2 мм.
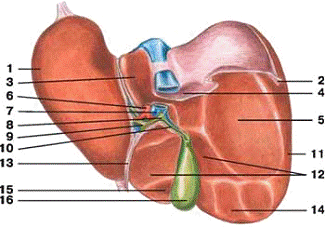
- ліва частка печінки; 10 - міхурна протока;
- трикутна зв'язка печінки; 11 - права частка
печінки;
- задня (хвостата) частка печінки; 12 -
дванадцятипало-кишкове втискування;
- надниркове втискування; 13 - кругла зв'язка
печінки;
- ниркове втискування; 14 - ободово-кишкове
втискування;
- власна печінкова артерія; 15 - передня
(квадратна) частка;
- комірна вена; 16 - жовчний міхур
- загальна жовчна протока;
- загальна печінкова протока;
Рисунок 1.2 - Печінка нижня поверхня
Нижня, внутрішньо-остна поверхня печінки, має
нерівну плоску злегка увігнуту поверхню, відповідно конфігурації нижче лежачих
органів.(Мал.2) На нижній поверхні розташовуються три борозни. Дві борозни
мають сагітальне направлення і тягнуться по нижній поверхні печінки, майже
паралельно одна одній, від переднього до заднього його краю; приблизно
посередині цієї відстані їх з’єднує у вигляді перекладини третя поперечна
борозна. Ліва борозна складається з двох відділів: переднього, що
розташовуються до рівня поперечної борозни та заднього ззаду від поперечного
Передній більш глибокий відділ щілина круглої зв’язки (fissura ligamenti teretis)
починається на передньому краю печінки від вирізки круглої зв’язки; в ній
залягає кругла зв’язка печінки (lig. teres hepatis), що йде з переду і знизу
від пупка. Задній відділ лівої борозни - щілина венозної зв’язки (fissura
ligamenti venosi), вона тягнеться від поперечної борозни назад до лівої
печінкової вени. Ліва борозна за своїм розташуванням на нижній поверхні
відповідає лінії прикріплення серповидної зв’язки на верхній поверхні печінки і
таким чином служить тут межею лівої і правої часток печінки. Разом з тим кругла
зв’язка печінки закладена в нижньому краї серповидної зв’язки, на вільному
передньому її кінці. Права борозна представляє поздовжньо розташовану яму та
називається ямою жовчного міхура (fossa vesicae felleae). Вона менш глибока,
ніж борозна круглої зв’язки, але більш широка і являє відбиток розташованого в
ній жовчного міхура (vesica felleae), ямка тягнеться назад до поперечної
борозни; продовженням її ззаду від поперечної борозни служить борозна нижньої
порожнистої вени (sulcus venae cavae).
Поперечна борозна представляє ворота печінки
(porta hepatis), де залягають власне печінкова артерія (arteria hepatica
propria), печінковий протік (duktus hepaticus) та ворітна вена (vena portae).
Як артерія, так і вена діляться на основні гілки, праву та ліву, вже в воротах
печінки.
У зв'язку з розвитком хірургії і розвитком
гепатології в даний час створено вчення про сегментарну будову печінки, яка
змінила колишнє уявлення про ділення печінки тільки на долі і часточки. Як
наголошувалося, в печінці є п'ять трубчастих систем: 1) жовчні шляхи, 2)
артерії, 3) гілки комірної вени (портальна система), 4) печінкові вени
(ковальна система) і 5) лімфатичні судини.
Портальна і канальна системи вен не збігаються
один з одним, а решту трубчастих систем супроводжують розгалуження комірної
вени, йдуть паралельно один одному і утворюють судинно-секреторні пучки, до
яких приєднуються і нерви. Частина лімфатичних судин виходить разом з
печінковими венами.
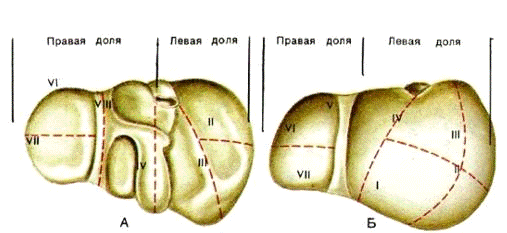
Рисунок 1.3 Сегментарна будова печінки. Проекція
сегментів печінки
( I - VIII), диафрагмальна(А) та вісцеральна(Б)
поверхності.
Сегмент печінки - це пірамідальна ділянка її
паренхіми, прилегла до так званої печінкової тріади: гілка комірної вени 2-го
порядку, супутня нею гілка власної печінкової артерії і відповідна гілка
печінкової протоки.
Сегменти, групуючись по радіусах навколо воріт
печінки, входять в крупніші самостійні ділянки печінки, звані зонами, або
секторами. Розрізняють п'ять таких секторів.( Мал. 3)
. Лівий парамедіаний сектор утворений III і IV
сегментами.
. Правий парамедіаний сектор складають V і VIII
сегменти.
. Правий латеральний сектор включає VI і VII
сегменти.
. Лівий дорсальний сектор відповідає I сегменту
(моносегментарний сектор).
.2 Кровообіг в печінці
Розглянувши детальну внутрішню будову печінки,
ми можемо перейти до розгляду кровообігу в печінці, що було б майже не можливим
без знання внутрішньої структури органу. Печінка володіє унікальним
кровообігом, тому що для неї приноситься як артеріальна так і венозна кров.
Венозна кров, будуче ще артеріальною, пройшла через більшу частину
шлунково-кишкового тракту, де в капілярах проходило всмоктування продуктів
травлення вуглеводів та білків, амінокислоти і багатьох інших речовин. Таким
чином, венозна кров від шлунка, кишечника, підшлункової залози та селезінки йде
не безпосередньо до серця, а через ворітну вену в печінку. Однак печінка
потребує і артеріальної крові, саме ця кров приноситься по печінковій артерії,
яка проникає в орган теж в області воріт. Через ворітну вену проходить ¾
всієї
поступаючої в печінку крові, тоді як через печінкову артерію - тільки ¼.
В
між часткових просторах як печінкова артерія, як ворітна вена розгалужується на
мілкі судини, які утворюють по напрямку до часток та по їх периферії в судину
сітку. Між частковими венами артеріями існують багаточисельні з’єднання, тому
більша частина печінкової паренхіми отримає змішану - портальну та артеріальну
- кров. Тільки ті печінкові клітини, що розташовані по периферії часток,
отримують окремо артеріальну кров.
Крім того, що печінка має потребу як в
артеріальній так і венозній крові, для неї ще характерний і повільний тік крові
(в порівнянні з іншими органами). Він сповільнений, по-перше, тому, що
синусоїди відрізняються великою шириною і неправильністю просвіту, по-друге,
тому, що синусоїди представляють собою уже другу у капілярну сітку на протязі
одного судинного шляху від серця (першою сіткою є капіляри на які розпадаються
артерії непарних черевних внутрощів і які дають початок портальній вені), за
рахунок чого енергія руху, що придасться серцем крові, доходить до печінки вже
різко послабленою. Ще однією особливістю кровообігу у печінці є наявність в
печінкових судинах цієї системи затискачів чи шлюзів, які регулюють рух крові
через печінку. Вже в синусоїдах - в місці їх впадання в центральні вени - є
сфінктери, які змінюють кровонаповнення синусоїдів, в залежності від характера
хімічних субстанції, що містяться в крові, що проходить крізь печінку. Також у
виходу із печінки в стінках печінкових вен є циркулярні м’язові волокна, що
можуть скорочуватися що відтік крові з печінки значно зменшується. Протилежною
дією адреналін, що впливає на розслаблення, а тобто, розширює печінкові вени та
прискорює відтік крові печінки. Потім вся кров збирається в печінкові вени, що
несуть кров із печінки і впадають в нижню порожнисту вену, що проходить
поблизу. Ця частина кровообігу і має назву кровообігу ворітної вени. Таким
чином всі особливості кровообігу дають змогу зрозуміти, як хімічні продукти, що
потрапляють в печінку, мають можливість відповідний час тісно взаємодіяти з
тканинними елементами цього органу та продукованими ними ферментами в
залежності від потреб організму, що регулюються нейрогуморальним шляхом. Нема
сумніву в тому, що печінка в своїй роботі прямо залежить від стану як
вегетативної так і центральної нервової системи.
1.3 Функції печінки
Основні функції печінки:
«судинна»заключна в створенні депонуючої функції
і фільтрації крові;
метаболічна;
секреторна;
Ексреторна;(виділення жовчі)
Біологічний фільтр(бар’єр) для крові який в ній
тече від органів травного тракту.
Згортання крові. В ній утворюються багато
факторів згортаючої та протизгортаючої системи крові.
Білковий обмін (синтез амінокислот, білків -
Альбуміну, Фібриногену, протромбіну і інших чинників згортання, частини
-глобулінів,ферментів, гепарину; розщеплювання білків до Nh3 і сечовини).
Вуглеводний обмін (синтез і розпад глікогену,
перетворення галактози і фруктози в глюкозу, глюконеогенез, синтез глюкуронової
кислоти).
Жировий обмін (окислення тріглециридів з
утворенням кислот і гліцеріну синтез кетонових тіл, ліпопротеїдів фосфоліпідів.
Синтез холестерину, з якого утворюються кортикостероїди, жовчні кислоти,
вітамін Д).
Пігментний обмін (освіта і екскреція
білірубіну).
Детоксикація ксенобіотиків (реакції окислення,
відновлення, гідролізу, коньюгациії з глюкуроновою кислотою,глютатіоном,
сірчаною кислотою).
Обмін гормонів, вітамінів, мікроелементів
(інактівація стероїдів тіроксину,інсуліну, серотоніну,гістаміну; депонування і
всмоктування за допомогою жовчі жиророзчинних вітамінів, депонування заліза,
міді, цинку, марганцю, молібдену).
Обмін ферментів, що забезпечують всі метаболічні
процеси.
метаболічні (регулює обмін білків і амінокислот,
ліпідів, вуглеводів і біологічно активних речовин (гормонів, вітамінів),
мікроелементів. Печінка бере участь в регуляції водного обміну).
Секреторні (утворення жовчі, яка є важливим
шляхом видалення з плазми ряду речовин, перетворених в печінці, і бере участь в
травленні, емульгуючи жири ).
Екскреторна функція печінки виражається у
виділенні з крові у складі жовчі великого числа речовин, зазвичай
трансформованих в печінці, що є її участю в забезпеченні гомеостазу. (утворення
і виділення жовчі, що містить жовчні кислоти, холестерин, фосфоліпіди і ін.).
1.4 Метаболічні функції
Окрім виділення жовчі печінка виконує чимало
метаболічних функцій, які дуже важливі для підтримання життєздатності
організму. Наприклад, після вживання їжі, що містить велику кількість
вуглеводів, рівень глюкози в крові підвищувався без контролю, якщо б не
діяльність гепатоцитів, які в присутності інсуліну виділяють надлишок глюкози з
крові, запасаючи його в якості глікогену. І навпаки, коли рівень цукру в крові
починає знижуватися, гепатоцити перетворюють глікоген знову в глюкозу,
виділяючи її в кров. Утворення глікогену в гепатоцитах стимулюється також
гормоном гідрокортизоном, який виробляє кора наднирника, але в цьому разі
глікоген утворюється із білків чи їх похідних, при чому таке утворення
глікогену приводить до виділення глюкози в кров, а не до поглинання її із
крові. Але в білково-азотистому обміні печінка приймає не менш важливу участь
ніж метаболізмі вуглеводів. Як і у відношенні вуглеводів, печінка перш за все
виконує роль білкового депо. За даними Грунда (1910), печінка утримує білки
(пропорціально об’ему) на 30-60% більше, ніж інші органи, під час голоду,
печінка відповідно більше віддає білки. Так, після дводенного голоду печінка
білих пацюків втрачає 20% свого білка, тоді як нирки, серце та інші органи лише
4%. В печінці можна знайти типові білки крові глобулін, альбумін, фібриноген.
Адже гепатотици синтезують альбуміни та більшу частину глобулінів плазми крові.
Білки, що секретуються гепатоцитами в кров, синтезуються в цистернах
гранулярного ендоплазматичного ретикулума, які видно в різних ділянках
цитоплазми. Після завершення синтезу білки крові через апарат Гольджі
потрапляють до вільної поверхні клітини, що омивається плазмою, та виділяються
механізми екзоцитоза. Але потрібно зауважити, що разом з агентами, що приводять
до зсідання крові (протромбін, фібриноген), в печінці утворюється і речовина,
що сповільнює зсідання це анти-тромбін так званий гепарин. Важливим процесом,
що здійснюється в печінці по відношенню продуктів розпаду білків, є переробка
амінокислот. Але з дослідів Лондона та Кочнівої (1935 р.) під час перетравлення
білків в кишечнику, в кров надходять, окрім амінокислот також більш крупні
частки розпаду білків поліпептиди, вони також затримуються печінкою. Перш за
все із цих продуктів синтезується білок, а частина амінокислот, руйнуючись,
утворюють аміачні солі та сечовину.
Утворення сечовини із продуктів білкового
розпаду представляє один з найважливіших процесів організму. В той час, як
деякі аміачні сполуки токсичні для організму, сечовина безпечна і притому легко
виділяється нирками. Таким чином, печінка виконує велику роль, утворюючи
кінцевий продукт білкового зворотного метаморфозу.
В обміні вітамінів печінка виконує теж не
останню роль.
Вітамін А утворюється в печінці із провітаміну
каротину, що надходить з їжею. Печінкові клітини продукують ензим-каротиназу,
яка і перетворює каротин на дві молекули вітаміну А. Крім перетворення каротину
в вітамін А в печінці відбувається накопичення цього вітаміну. Біля 95% всієї
кількості вітаміну, що знаходиться в організмі, зосереджено в печінці. Поклади
вітаміну А піддаються впливу ряду фізіологічних та патологічних факторів. Так,
вони збільшуються не тільки при їжі, багатій каротинами, але й при сильному
споживанні жиру. Інсулін зменшує вміст вітаміну в печінці. Різні ураження
печінкової тканини супроводжується різким та швидким зменшенням запасу вітаміну
А, при цьому каротини біліше не перетворюються в вітамін А. В зв’язку з роллю, яку
виконує цей вітамін в утворені зорового пурпура, є важливий взаємозв’язок між
зором та функцією печінки. При важких захворюваннях печінки спостерігаються
такі прояви авітамінозу вітаміну А, як курчина сліпота.
Вітамін В1 його вміст в печінці в 10 разів вище
(на 1 г ваги), ніж в м’язах. Як відомо він грає важливу роль при розкладі
одного з продуктів розпаду цукру піровиноградної кислоти настільки, що при її
накопичені в крові та тканинах, говорять про ступінь недостатності вітаміну В1.
Вважають, що розклад піровиноградної кислоти відбувається саме в печінці.
Наприклад, при дифузних ураженнях печінки спостерігається порушення В1
вітамінного обміну.
Вітамін С грає роль фактора, що сприяє
глікогенізації печінки. При недостатній кількості вітаміну С в організмі вміст
глікогену в печінці різко зменшується (Палладін, 1922 р., Меньшиков, 1936 р.),
а при введені аскорбінової кислоти він підвищується (Альтенбургер, 1936 р.) За
даними Волинського (1946 р.) аскорбінова кислота є впливовим фактором, що
забезпечує фізіологічний стан печінки у відношенні її найважливіших функцій в
обміні речовин (в тому числі виділення жовчі).
Вітамін К залежить від функцій печінки:
по-перше, для всмоктування його в кишечнику необхідна нормальна секреція жовчі,
по-друге, в печінці відбувається утилізація вітаміну К і утворення протромбіну
з його участю. За допомогою вітаміну підвищується зсідання крові.
У водному та мінеральному обміні печінка теж
приймає участь. Перш за все вона може вбирати в себе надлишки рідини. Їй
властиво впливати на кількісне коливання мінрельних солей в крові та відношення
між іонами. Печінка здатна до утримання аніонів хлору та бікарбонату. При
ураженнях печінки нормальна відповідність іонів в крові печінкової вени
порушується, аніони перестають затримуватися; а порушення іонної рівноваги в
крові не залишається без впливу на водообмін. Велику цікавість має відношення
печінки до заліза. При підвищеному розпаді еритроцитів в купферових клітинах
відкладається залізо. Печінка також приймає участь у засвоєні заліза, що надійшло
в організм з їжею, і перетворює його на потрібні для єритропоеза сполуки.
1.5 Антибактерицидні та антитоксикаційні функції
Але крім багатьох метаболічних функцій, печінка
виконує ще деякі важливі функції, які умовно називають захисними. Безумовно, що
затримка деяких продуктів розпаду білків і жирів і перетворення їх в нетоксичні
для організму сполуки можуть розглядатися з цієї точки зору. Але в більш
загальному розумінні поняття “захисна функція ” показує здатність цього органу
поглинати самі різноманітні токсичні речовини та робити їх безпечними для
організму. Так, в печінці деякі отруйні метали та металоїди (ртуть, свинець,
миш’як) частково переводяться в безпечні сполуки шляхом зв’язування їх
нуклеопротеїдами. Велика кількість речовин, особливо лікарських, що
призначаються лікарем, та закінчуючи хімічними речовинами, що поглинаються з
різних джерел, піддаються метаболічним перетворенням та детоксикації
гепатоцитами. А в деяких умовах продукти розпаду цих речовин можуть бути більш
шкідливими, ніж самі речовини. Гепатоцити також метаболічно перетворюють
стероїдні гормони та алкоголь. При підсилені детоксикуючої функції гепатоцитів
в них підвищується вміст компонентів гладенького ендоплазматичного ретикулуму.
Важливу роль відіграє печінка у зв’язку з тим,
що її тканині відбувається затримка деяких мікроорганізмів, а також
знешкодження інфекційних токсинів. В цьому відношенні відомі досліди Роже
(1887). Введення сибіровиразкових бактерій кролям в периферичну вену викликало
смерть всіх семи кролів через 38-72 год., в той час як введення тринадцяти
кролям тієї ж дози в ворітну вену викликало загибель лише в трьох випадках.
Цікаві і досліди Мануорінга та його співробітників, в яких вивчалася ступінь
затримки мікробів окремими органами. Виявилось, що в мозку фіксується 0.5%
циркулюючих мікробів в крові, в легенях 6%, печінці до 80%. Якщо ж в циркулюючу
через печінку кров ввести культуру мікробів і прибавити деяку кількість імунної
сиворотки, майже всі мікроби затримуються печінкою. Затримка мікробів печінкою
відбувається за рахунок здатності купферових клітин до фагоцитозу.
1.6 Регенерація печінки
Крім всіх важливих функцій, що притаманні
печінці, для неї ще характерна регенерація. Взагалі печінка володіє великою
силою регенерації. Російський вчений Підвисоцький (1880) першим показав, що у
тварин можливо видалити більшу частину печінкової тканини і вони при цьому не
тільки виживають, а звичайно через деякий час розміри печінки в них майже
повністю відновлюються. Виявилося, що залишена частина печінки знову приймає
своїх попередніх розмірів, це говорить про швидкість зношування та відновлення
клітин печінки, а саме різноманіття виду хроматину в ядрах печінкових клітин.
Але якщо гепатоцити пошкоджуються в результаті
дефіциту різних поживних речовин в раціоні чи під дією токсичних сполук, що
знаходяться в кровотоці, на шляху регенерації внаслідок цього виникає значно
більше труднощів. Це в основному обумовлено тим, що не всі структур, необхідні
для регенерації функціонально-активної тканини печінки, здатні до гармонійного
відновлення, що необхідно для відновлення складної архітектоніки органу. В
печінковій тканині багато трубочок та протоків як всередині часток, так і за їх
межами, ці трубочки повинні формуватися заново і належним чином з’єднуватися
один з одним. Регенерація гепатоцитів може відбуватися і в ізольованих
ділянках, там де збереглися здорові клітини. Але вузли новоутвореної паренхіми
печінки виявляються без необхідних зв’язків з ворітним кровообігом і тому в них
може бути відсутня правильна організація синусоїдів. Тим часом фібробласти
можуть почати утворювати надлишкову кількість сполучної тканини, яка в свою
чергу буде запобігати встановленню нових нормальних зв’язків між регенеруючими
вузлами паренхіми та системою жовчних протоків. До того ж надлишок сполучної
тканини запобігає збільшенню об’єму печінки в цілому по мірі росту вузлів її
паренхіми, сама ж сполучна тканина при дозріванні зморщується. Це незворотне та
серйозне захворювання цироз печінки.
Разом з тим цікавим є те, що навіть невеликої
частини печінки досить для того, щоб утворилася сечовина, в цьому ж разі цієї
частки досить, щоб виділяти надлишок білірубіна з крові.
1.7 Порушення функцій печінки в стадії
декомпенсації
Розрізняють дві основні групи захворювань
печінки: гепатози і гепатити.
Гепатити характеризуються запаленням тканини
печінки, а гепатози - переродженням тканин печінки незапального характеру. По
причинному чиннику гепатити розділяються на інфекційних (вірусні, паразитарні)
і неінфекційних, причинами, розвитку яких є токсини, що поступають в печінку з
їжею, і інші отрути, що потрапляють ззовні або що утворюються в печінці в
процесі розщеплювання різних речовин. Причиною гепатозів найчастіше також є
тривала дія токсичних речовин (деяких ліків, алкоголю в небезпечних дозах), обмінні
порушення (діабет 2 типи, ожиріння, порушення жирового обміну), неправильне і
неповноцінне живлення і різка втрата ваги (більше 1,5-2 кг в тиждень).
1.7.1Гострий і хронічний гепатит
Найбільш частим захворюванням печінки є гепатит.
Розрізняють гепатит гострий і хронічний. Гострий гепатит в переважній більшості
є вірусним захворюванням. Хронічний гепатит в 50-80% випадків - це результат
гострого вірусного гепатиту. Крім того, можливий гепатит унаслідок інтоксикації
деякими органічними речовинами, тривалого вживання алкогольних напоїв.
Безконтрольне застосування сульфаніламідів, антибіотиків, гормонів, наркотиків
може викликати запалення печінки. Вважають, що окрім перерахованих вище
чинників, в розвитку його грають роль імунні процеси в організмі. В деяких
випадках хронічний гепатит протікає без виражених клінічних проявів, не
вимагаючи активного лікування, в інших - викликає важкі зміни в організмі.
Розрізняють вірусний гепатит трьох типів:
гепатит А, гепатит В (або сироватковий гепатит) і гепатит З, який викликається
вірусом іншого типу, або, як говорять медики, ні А, ні В, крім того, існує
вірус гепатиту D, який зустрічається тільки у поєднанні з вірусом гепатиту В.
При гепатиті А зараження відбувається через забруднену випорожнюванну воду,
харчові продукти, а також руки і предмети домашнього ужитку. Не виключається і
роль мух в механічній, передачі вірусу. Цей тип вірусу зустрічається в
неблагополучних регіонах (Індія, африканські країни). Гепатитом В заражаються
при попаданні в організм вірусу з крові хворої людини. Гепатит З передається
обома вищеописаними способами. Присутність вірусу типу D підсилює хворобливі
прояви гепатиту С.
Всі вірусні гепатити мають схожі симптоми.
Інкубаційний період вірусного гепатиту складає від 18 до 100 днів. Захворювання
починається з появи слабкості, швидкої стомлюваності. Часто у хворих
наголошується зниження апетиту, відчуття гіркоти в роті, відрижка, печія,
нудота, болі в животі, може спостерігатися блювота. Іноді першими ознаками
вірусного гепатиту є кашель, нежить, головний біль, нерідко болі в м'язах і
суглобах, підвищується температура (до 40°с). Спостерігається зміна кольору
сечі, вона стає схожою на пиво або міцно зварений чай. Кал втрачає звичайне
забарвлення, набуваючи сіро-білого кольору. Надалі шкіра і слизисті оболонки
забарвлюються в жовтий колір з оранжевим відтінком. Але можливий перебіг
хвороби і без ознак жовтяниці, з незначним погіршенням загального стану. Такі
форми вельми небезпечні: Пізнє звернення до лікаря і невчасна госпіталізація
можуть привести до затяжного перебігу захворювання з важкими ускладненнями, а
також створюють умови для зараження тих, що оточують.
Проте існують і особливості, пов'язані з
характерними проявами того або іншого типу вірусу.
Вірусний гепатит А - це гостра інфекційна хвороба,
яка починається раптово, серед повного здоров'я, і цим нагадує спалах грипу.
Ті, що не хворіли і не вакциновані абсолютно сприйнятливі до вірусу
(захворюють). Збудник передається здоровій людині від «гострого» хворого,
особливо якщо той страждає легкою, «стертою» формою захворювання, що вислизає
від уваги лікарів. Інкубаційний період в цьому випадку складає 10-12 днів.
Вірус знаходиться в крові декілька годин або днів, потім розмножується в
печінці протягом двох-трьох тижнів і весь цей час (заразливий період)
виділяється з жовчю назовні. Коли хворий «жовтіє», він, як правило, вже
незаразливий. Гепатит А медики називають хворобою «брудних рук», типова кишкова
інфекція.
Вірус гепатиту В поводиться по-іншому. Він може
місяцями навіть роками перебувати в організмі людини, Гепатит В передається
тільки через кров - наприклад, при що перелив зараженій крові здоровій людині
або при використанні нестерильних інструментів. Вірусом цього типу дуже часто
заражені наркомани. У організмі віруси А і В поводяться по-різному. Вірус типу
А упроваджується в клітки і руйнує їх. Вірус типу В «живе» разом з клітками
печінки, зовні нічим їх не ушкоджуючи. Імунна система зараженого організму
починає атаку проти чужорідного агента, але вражають не вірус, а власні клітки
печінки. Гепатит типу В гущавині викликає летальний результат, чим гепатит А.
Лікування гострого гепатиту повинно здійснюватися в лікарняних умовах.
Результатом хронічного гепатиту може бути цироз печінки.
Профілактика хронічного гепатиту полягає в
попередженні розповсюдження хвороби Боткіна і своєчасному лікуванні цього
захворювання, попередженні інтоксикацій, а також в обмеженні прийому деяких
медикаментів. Хворі хронічним гепатитом повинні систематично спостерігатися
лікарем. Для профілактики вірусних гепатитів розроблені спеціальні вакцини,
"свої"для кожного типу вірусу.
Ті, що перехворіли вірусним гепатитом потребують
щадного режиму. Якщо трудова діяльність цих людей зв’язана з професійними
шкідливостями або важким фізичним навантаженням, їм рекомендується перейти на
легшу роботу, тимчасово або постійно, в залежності: від висновку лікаря. Такі
хворі повинні знаходитися на амбулаторному обліку не менше 6 місяців. Той, що
кожен перехворів повинен пам'ятати, що при недотримання режиму і дієти,
наказаних лікарем можливі ускладнення, аж до цирозу печінки. Протягом певного
часу, вказаного лікарем, необхідно уникати перевтоми, перегрівання,
переохолодження, занять спортом. Після виписки з лікарні протягом 6-12 місяців
дотримують дієту, повністю виключаючи спиртні напої (зокрема пиво), консерви,
копченину, маринади, гострі приправи, смажені блюда, шоколад. Рекомендується
молочно-рослинна дієта, нежирні сорти м'яса і риби (у вареному вигляді).
Профілактика включає обов'язкову госпіталізацію
хворих, дезінфекцію в приміщенні, де вони знаходилися. За особами, що
спілкувалися з хворим гепатитом А, встановлюють медичне спостереження протягом
45 днів. Медичні інструменти ретельно стерилізують.
Гепатит С - запальне захворювання печінки, що
розвивається під дією вірусу гепатиту С.
Щеплення від гепатиту С не існує.
Зараження відбувається переважно через кров і
статевим шляхом.
У 85% хворих гострим гепатитом С розвивається
хронічний гепатит.
У 20% хворих гепатитом С розвивається цироз
печінки.
У 5% - виникає рак печінки.
Застосування методів ЕГ в лікуванні гепатиту С
Відомо, що ефективність дії лікарських
препаратів при лікуванні гепатиту С багато в чому залежить від кількості
вірусних частинок, що виявляються в організмі. Тому, для підвищення
ефективності медикаментозної терапії, зусилля лікарів мають бути направлені на
безпосереднє видалення вірусних частинок з організму. У нашій клініці з цією
метою використовуються різні схеми комбінованої лікарської терапії і методів
кріоафереза, каскадній фільтрації плазми. Останні дозволяють істотно знижувати
вірусне навантаження на організм (приблизно у тисячу разів), тим самим удвічі
підвищуючи ефективність медикаментозного лікування гепатиту С (з 40 до 86%), а
також видаляти з крові інші патологічні молекули, що утворюються при цьому
захворюванні.
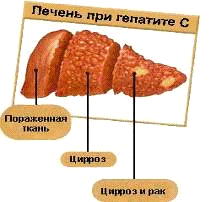
Рисунок 1.4 - Печінка при гепатиті С.
Дуже часто при гепатиті С вірус змінює клітки
організму (печінки, лімфоцитів), тим самим «дезорієнтуючи» імунну систему.
Запускається аутоіммунний процес, починають вироблятися антитіла на власні
білки і тканини (аутоантитіла), Аутоантитіла різного вигляду виявляються в
сироватці крові 18-91% хворих хронічним гепатитом С. Таким образом до гепатиту
С додаються аутоіммунний гепатит і інші аутоіммунні захворювання (аутоіммунний
тиреоїдит, полінейропатії, цукровий діабет і ін.). При аутоіммунному процесі
стає небезпечним застосування необхідних в лікуванні гепатиту З препаратів
інтерферону, адже вони стимулюють імунну відповідь і можуть підсилити
аутоіммунну агресію.
1.7.2 Алкогольна хвороба печінки
Алкогольна хвороба печінки (АХП) є самостійним
хронічним захворюванням печінки, що розвивається унаслідок тривалого вживання
алкоголю в небезпечних дозах (середньодобова доза більше 40 грама чистого
етанолу для чоловіків і більше 20 грама чистого етанолу для жінок). Алкоголь -
сильна отрута, яка при вживанні в невеликих кількостях легко знешкоджується
здоровою печінкою. Для цього в людській печінці утворюються спеціальні речовини
(ферменти), що розщеплюють алкоголь. При хронічному надходженні алкоголю ця
здатність печінки порушується. У великих кількостях алкоголь руйнує не тільки
клітки печінки, а також клітини мозку і клітки інших органів. Нарешті, може
скластися така ситуація, коли здатність до відновлення загиблих печінкових
кліток виявляється недостатньою, і кількість відновлених кліток не заповнює
кількість загиблих кліток. В цьому випадку розвиваються захворювання печінки -
від жирової дистрофії - до гепатиту і цирозу. По такому ж механізму діють і
інші отрути (деякі лікарські засоби, хімічні речовини шкідливих виробництв,
отруйні гриби, токсичні речовини, проживання, що викидаються в середу, і що
відносяться до продуктів життєдіяльності людини). При отруєннях великими
кількостями отруйних речовин печінкові клітки, що знешкоджують отрути, працюють
з непомірно високим навантаженням і при цьому не мають можливості відновитися.
АХП також має 2 стадії: жирове переродження
печінки, гепатит.
1.7.3 Неалкогольна жирова хвороба печінки
Неалкогольна жирова хвороба печінки (НЖХП) є
самостійним захворюванням і має
Жировий гепатоз або стеатоз (жирове переродження
печінки)
Неалкогольний стеатогепатит - НАСГ (запалення
печінки на тілі жирового переродження печінки) - друга стадія розвитку
захворювання, небезпечна своїм переходом у ряді випадків в цироз і рак печінки.
(у 60-80% спостережень цироз печінки (ЦП) неясної етіології розвивається з
нерозпізнаного НАСГ.
НАСГ розділяють на первинний і вторинний.
Основні причини розвитку первинного НАСГ:
Ожиріння, особливо при відкладенні жиру в
області талії (вісцелярне ожиріння) - у 75% з НАСГ індекс маси тіла підвищений
на 10-40% в порівнянні з нормою. У пацієнтів з індексом маси тіла більше 30
кг/м. практично в 100% випадків спостерігають жирове переродження печінки. А в
20-47% - НАСГ.
Цукровий діабет 2 типи у 60% пацієнтів
поєднується з жировою дистрофією і в 15% - з НАСГ.
Підвищений вміст жирів в крові виявляється у
20-80% хворих НАСГ. (підвищений вміст тригліцеридів спостерігається частіше,
ніж високий вміст холестерину.
Причини розвитку вторинного НАСГ.
Деякі лікарські препарати (глюкокортикоїди,
аміодарон, естроген, Тамоксифен. Тетрациклін, аспірин, індометацин, бруфен,
інші протизапальні засоби)
Недостатнє живлення, особливо недолік білка (
при обширних операціях на шлунку і тонкій кишці, при різкому - більше 1.5 кг за
тиждень - зниженні ваги, при деяких природжених аномаліях обміну - хвороба
Вільсона-Коновалова, хвороба Вебера-Крісчена).
До чинників ризику відносяться: жіноча стать,
вік 45-55 років.
В більшості випадків захворювання протікає
безсимптомний і випадково виявляється при обстеженні по приводу:
ожиріння
ішемічній хворобі серця
артеріальній гіпертензії
цукрового діабету 2 типи
жовчнокам’яній хворобі
Діагностика здійснюється на підставі:
Ультразвукового дослідження печінки (при цьому
виявляються збільшені розміри печінки і зміна її щільності (підвищена
єхогеність)
Біохімічних показників - маркерів пошкодження
печінки. Підвищена активність деяких печінкових ферментів спостерігається як
правило на стадії НАСГ (підвищені рівні трансаміназ виявляються у 50-90%,
лужної фосфатази - у 30-60%, підвищений білірубін - у 12-17% пацієнтів)
Гастроскопії - методу огляду стравоходу і шлунку
зсередини за допомогою гастроскопа - апарату, передавального зображення за
допомогою фіброоптичного волокна. Під час переходу НАСГ в цироз ендоскопічно
можуть бути виявлені варикозні розширені вени стравоходу і верхніх відділів
шлунку.
Частіше зустрічаються поєднані пошкодження
печінки, коли на розвиток хвороби робить вплив декілька чинників: токсичні препарати,
всілякі порушення жирового обміну, вживання алкоголю в небезпечних дозах
(середньодобова доза чистого алкоголю більше 40 р. для чоловіків і більше 20
грама чистого етанолу для жінок).
1.7.4 Цироз печінки
Цироз печінки (зморщування печінки) - хронічні
прогресуючі захворювання, що характеризуються поразкою як паренхіми, так і
строми органу з дистрофією печінкових кліток, вузловою регенерацією печінкової
тканини, розвитком сполучної тканини, дифузною перебудовою часточкової
структури і судинної системи печінки.
1.7.4.1 Етіологія
Етіологічний чинник розвитку цирозу: формування
цирозу печінки відбувається протягом багатьох місяців або років. За цей час
міняється генний апарат гепатоцитів, і створюються покоління патологічно
змінених кліток. Цей процес в печінці можна охарактеризувати, як
імуннозапальний [5, 6, 10]. Цироз печінки частіше спостерігається у чоловіків,
співвідношення хворих чоловічої і жіночої статі складає в середньому 3:1.
Захворювання наголошується у всіх вікових
групах, але частіше після 40 років. Найбільш частими причинами захворювання є
хронічний алкоголізм (питома вага алкогольних ЦП складає в різних країнах від
20 до 95%) і вірусний гепатит (складає 10-40 % від всіх ЦП) [21, 13, 17].
Найбільше етіологічне значення має один з варіантів
гепатиту, гепатит З, що приводить до ЦП в 40 % (іноді до 80 %) випадків, і
гепатит В, в результаті якого ЦП формується в 0,5-1 % випадків [13]. Причиною
ЦП може бути токсична дія промислових отрут, лікарських засобів (Метотрексат,
ізоніазід і ін.), а також венозний застій в печінці, найчастіше пов'язаний з
тривалою і важкою серцевою недостатністю.
ЦП розвивається при багатьох спадкових хворобах
- гемохроматозі, гепатоцеребральной дистрофії, недостатності a1=антітріпсина,
галактоземії, глікогенозах і ін. Існує група ЦП, жовчних шляхів, що
розвиваються у зв'язку з тривалою поразкою. Первинний біліарний цироз, що
зустрічається переважно у жінок в клімактеричному періоді, обумовлений
наявністю внутрішньо печінкового холестазу, первинна причина якого у більшості
хворих не встановлена. Причиною вторинного біліарного цирозу є обтурація
крупних жовчних проток, що приводить до неповного рецидивуючого порушення
відтоку жовчі (при повній обтурації перешкода або ліквідовується оперативним
шляхом, або летальний результат наступає раніше, ніж розвивається цироз), що
може спостерігатися при жовчнокам'яній хворобі, природженій атрезії жовчних
проток, післяопераційних стриктурах і ін. Приблизно у 50% хворих ЦП
розвивається унаслідок дії декількох етіологічних чинників (частіше за вірус
гепатиту В і алкоголю). При невстановленій етіології говорять про криптогений
цироз печінки. Найбільш частими причинами розвитку цирозу печінки визнаються
хронічна інтоксикація алкоголем (по різним даним, від 40-50 % до 70-80 %) і
вірусні гепатити В, З і D (30-40 %) [13, 10, 7, 20]
.7.4.2 Патогенез
Походження захворювання у багатьох випадках
пов'язане з тривалою безпосередньою дією етіологічного чинника (вірус,
інтоксикація і т. д.) на печінку, порушеннями кровообігу в ній. Розвиток
сполучної тканини у вигляді тяжій і рубців, які змінюють нормальну
архітектоніку печінки, веде до здавлення її судин, порушення нормального
кровопостачання печінкових кліток; гіпоксія ж сприяє подальшим порушенням
нормального протікання окислювально-відновних ферментних реакцій в печінковій
тканині, підсилює дистрофічні зміни і, сприяючи прогресу процесу, створює
порочний круг. Продукти некробіотичного розпаду гепатоцитов сприяють
регенераторним процесам, а також розвитку запальної реакції. У прогресі цирозів
вірусної етіології, мабуть, велике значення має персистірований вірус гепатиту
в організмі хворого.
Одночасно із здавленням печінкових судин
вузликами регенеруючої печінкової паренхіми і з’єднаннотканими тяжам
збільшується число анастомозів між розгалуженнями комірної і печінкової вен, а
також печінковою артерією, що полегшують місцевий внутрішньопечінковий
кровообіг. Разом з тим кров по цих анастомозах йде в обхід печінкової
паренхіми, що збереглася, що різко погіршує її кровопостачання і може приводити
до нових ішемічних некрозів, вторинних колапсів, тобто до прогресу цирозу.
У прогресі хронічному захворюванні-печінці і
розвитку цирозу мають значення також імунні порушення, що виявляються в
придбанні деякими зміненими білками гепатоцитов антигенних властивостей і
подальшому виробленню до них аутоантитіл. Комплекси антиген - антитіло,
фіксуючись на гепатоцитах, викликають їх подальше ураження.
.7.4.3 Класифікація цирозу печінки
А. По етіології розрізняють цирози:
а) унаслідок вірусного ураження печінки;
б) унаслідок недостатності живлення;
г) унаслідок хронічного алкоголізму;
грамхолестатичні;
д) як результат токсичних або токсико-алергічних
гепатитів;
е) конституційно-сімейні цирози; ж) унаслідок
хронічних інфільтрацій печінки деякими речовинами з подальшою запальною
реакцією (гемохроматоз, хвороба Коновалова-Вільсона);
з) цирози, що розвиваються на тілі хронічних
інфекцій (туберкульоз, сифіліс, бруцельоз), і цирози іншої етіології, зокрема
що виникають унаслідок невияснених причин (криптогенні).
Б. По морфологічним і частково клінічним ознакам
виділяють мікронодулярний, або мікровузлової, цироз (в основному відповідає
портальному цирозу колишніх класифікацій), макронодулярний, або крупновузлової,
цироз (по багатьом ознакам відповідає постнекротичному цирозу), змішаний і,
нарешті, біліарний (первинний і вторинний) цирози печінці.
В. По активності процесу розрізняють цирози:
а) активні, прогресуючі,
б) неактивні.
Г. По ступені функціональних порушень
розрізняють цирози:
а) компенсовані,
б) некомпенсовані.
1.7.4.4 Клінічна картина
Клініка залежить від виду цирозу, стадії хвороби
(компенсована або некомпенсована) і ступеня активності патологічного процесу в
печінці.
Основними клінічними ознаками цирозу печінки, що
дозволяють відрізнити його від гепатитів і інших уражень цього органу, є:
) наявність збільшеної щільної печінки і
селезінки (у випадках, що далеко зайшли, розміри печінки можуть бути зменшені),
) асцит і інші ознаки портальної гіпертензії і
) так звані печінкові стигми, особливо шкірні
печінкові «зірочки» (телеангіоектазії).
При різних варіантах цирозу болю виникають в
області печінки, в підкладковій області або по всьому животу, мають тупий
ниючий характер, посилюються після їжі, особливо жирної, рясного пиття і
фізичної роботи. Причиною болів зазвичай є збільшення печінки і розтягування
капсули, поява вогнищ некрозу, близько розташованих до капсули, і реактивне
залучення до процесу близько розташованих ділянок печінкової капсули.
При цирозах печінці звичайні диспепсичні явища у
вигляді зниження апетиту до повної анорексії (частіше при алкогольному цирозі),
тяжкість в підкладковій області після їжі, нудоти, метеоризму і розладу стільця
(особливо пронос після прийому жирної їжі), рідко - вираженої нудоти і блювоти,
що обумовлене головним чином порушенням секреції жовчі і супутньою дискінезією
жовчних шляхів або алкогольним гастроентеритом. Виражений метеоризм іноді
супроводиться дістензіоними болями в животі, зазвичай короткочасними нападами.
Частими скаргами хворих цирозом печінки є зниження працездатності, загальна
слабкість, швидка стомлюваність і безсоння.
Цирози печінки, особливо постнекротич і
біліарні, часто супроводяться субфебрильною температурою тіла. Лихоманка буває
в більшості випадків неправильного, рідше хвилеподібного типу. Деякі автори розцінюють
лихоманку як прояв прогресуючого некрозу гепатоцитов і активності процесу, з
цих позицій підвищення температури тіла може розглядатися як несприятливий
симптом. Підвищення температури може бути також слідством і висхідного
холангіту (при вторинному біліарному цирозі).
1.8 Клінічні лабораторні тести
Включають визначення активності ферментів
цитолізу: АСАТ (аспартатамінотрансферази), АЛАТ (аланінамінотрансферази);
ферментів холестазу - г-ггт (гаммаглутамілтранспептідази), лужної фосфатази,
ЛДГ (лактатдегидрогенази). Результати цих тестів відображають функціональну
здатність печінки, тому можуть бути використані як маркери пошкодження печінки.
Маркери пошкодження гепатоцитів. Ферменти АЛАТ
зустрічаються в клітках різних тканин, причому найбільша активність АЛАТ в
мембранах кліток, АСАТ - в печінці, серцевій і скелетній мускулатурі, нирках і
підшлунковій залозі. АЛАТ знаходиться в основному в цитоплазмі і мітохондріях
кліток печінки і, у меншій мірі, в м'язових клітках і клітках Купфера. Отже,
активність цих ферментів в сироватці може бути підвищена не тільки при
захворюваннях, що асоціюються з пошкодженням печінки, але і при ендокардиті,
інфаркті міокарду, м'язово-скелетних травмах, панкреатиті, захворюваннях нирок
[8, 9, 10, 15, 24] . У випадках, коли причиною підвищення активності ферментів
в крові є захворювання печінки, ступінь цього підвищення дозволяє обмежити круг
захворювань для диференціальної діагностики. Найбільше підвищення активності
ферментів спостерігається при токсичному, лікарському, вірусному і/або
ішемічному гепатитах. Ступінь ферментемії пропорційний вираженості гострого
пошкодження печінці. Збільшення активності трансаміназ рідко перевищує 10 000
ME у випадках гострого некрозу печінки при отруєнні ацетамінофеном або при
ішемічному гепатиті. Зазвичай концентрація ферментів коливається від 500 до
3000 ME, причому переважання АлАТ над АлАТ свідчить на користь вірусного
гепатиту. Співвідношення Асат/алат менше 1,0 типово для вірусного гепатиту, як
гострого, так і хронічного, а також для позапечінкової обструкції жовчних
шляхів. Навпаки, збільшення рівня ферментів до 300 ME і співвідношення
Асат/алат більше 2,0 свідчать про алкогольний гепатит [24, 15, 9].
Лактатдегідрогеназа (ЛДГ) міститься в серцевому
і скелетному м'язах, печінці, легенях і клітках крові. Не дивлячись на те, що
визначення активності ЛДГ включене в діагностичний мінімум, цей показник
недостатньо специфічний. Незначне підвищення активності ЛДГ типовіше для
гепатоцелюлярних захворювань і менш - для холестатичних. Ізофермент ЛДГ
міститься в печінці. Інфаркт міокарду, гемоліз є прикладами підвищення ЛДГ
позапечінкового походження.
Сорбітолдегідрогеназа також є ферментом, що
відображає пошкодження гепатоцитів - синдром цитолізу.
Маркери холестазу. Лужна фосфатаза міститься в
печінці, кістках, плаценті, кишечнику, лейкоцитах. Більше 80% лужної фосфатази
зосереджено в печінці і кістках. Лужна фосфатаза печінки пов'язана із
зовнішньою поверхнею каналікулярної мембрани гепатоцитів. При пошкодженні
кліток печінки може спостерігатися деяке підвищення активності лужної
фосфатази, але ступінь її збільшення значно вищий, ніж підвищення трансаміназ
холестатичних станів [20, 24, 9]. Фракційне визначення ізоферментів лужної
фосфатази дозволяє встановити джерело підвищення її активності.
Іншим способом оцінки джерела підвищення
активності лужної фосфатази у випадках захворювань печінки служить визначення
г-глутамілтранспептідази (г-гтп), 5'-нуклеотидазы (5'нт) і сироваткової
лейцинамінопептідази (ЛАП). Всі ці ферменти локалізовані на каналікулярній
мембрані гепатоциту, оберненій в жовчний капіляр, г-гтп також визначається в
нирках, в підшлунковій залозі, кишечнику і, у меншій мірі, в серцевому м'язі.
Підвищення рівня г-гтп індукується прийомом алкоголю і, отже, може служити
маркером пошкодження печінки при хронічному алкоголізмі. Але іноді ізольоване
підвищення рівня г-гтп може спостерігатися після епізодичного прийому алкоголю
у пацієнтів, одержуючих протисудомну терапію або варфарін. Іноді причину
підвищення рівня г-гтп не вдається встановити навіть після морфологічного
дослідження печінки. Збільшення активності всіх вищеперелічених ферментів
свідчить з гепатобіліарній поразці і збігається з підвищенням активності лужної
фосфатази. Різке підвищення рівня білірубіну в крові також служить показником
холестазу.
Оцінка синтетичної функції печінки. Гепатоцити
відповідають за синтез Фібриногену, протромбіну, чинників V, VII, IX, X і
більшості глобулінів (виняток становить гамма-глобулін). Визначення цих білків
в сироватці крові має клінічне значення для оцінки синтетичної функції печінки.
Альбумін складає велику частину білків плазми;
печінка синтезує приблизно 12 грама Альбуміну в добу. Нормальний вміст
Альбуміну в плазмі складає 35-45 грама/л і відображає швидкість синтезу,
швидкість руйнування і його розподілу в організмі. Синтез Альбуміну регулюється
залежно від змін харчового статусу, осмотичного тиску, наявності системних
запальних процесів, прийому кортикостероїдів.
Вміст Альбуміну в сироватці не змінюється при
гострих вірусних гепатитах, лікарському ураженні печінки, обструкції жовчних
шляхів. Більш того, гіпоальбумінемія характерна не тільки для захворювань
печінки, оскільки може наступати при білковому голодуванні, хронічних запальних
процесах, ентеропатіях, що супроводжується втратою білка, при нефротичному
синдромі [10, 9, 24]. Проте, в оцінці патології печінки зміст Альбуміну, що
становить менше 30 грама/л, свідчить об хронізації захворювання.
Згортанням крові є результат каскадного
комплексу ферментативних реакцій. Печінка відповідальна за синтез 11 білкових
чинників згортання, включаючи Фібриноген, протромбін, чинники V, VII, IX,
лабільний чинник, тромбопластин, чинники X, XII, XIII. Печінка також відповідає
за часткове поглинання з крові цих чинників. Унаслідок хвороб печінки згортаюча
система крові часто порушується. Вона може бути оцінена вимірюванням окремих
чинників або визначенням взаємодії декількох чинників. Протромбіновий час -
найбільш зручний метод, оцінки даних аспектів синтетичної функції печінки.
Протромбіновий час відображає швидкість
перетворення протромбіну в тромбін, який не обходимо для полімеризації
Фібриногену у фібрин. Протромбіновий час зв'язаний чинниками I, II, V, VII, X з
рівнями Фібриногену і протромбіну [20, 9]. При їх дефіциті воно збільшується.
Для синтезу чинників II, VII, IX, X печінці потрібна присутність вітаміну К.
Таким образом, збільшення протромбінового часу може спостерігатися при
порушенні функції печінки, дефіциті вітаміну До, прийомі антагоністів вітаміну
До, природженому дефіциті чинників згортання, підвищеній їх утилізації.
Гіповітаміноз До і масивні паренхіматозні ураження печінки можна
диференціювати, використовуючи внутрішньо-м’язове введення вітаміну К. Якщо
протромбінів час нормалізується або зменшується на 30% через 1 доб. після
однієї внутрішньо-м'язової ін'єкції вітаміну До, робиться вивід, що синтетична
функція печінки не порушена, а збільшення протромбінового часу пов'язане з
гіповітамінозом До [20, 9, 8]. Гіповітаміноз До може розвиватися повторно при
тривалих обструктивних жовтяницях із стеатореєю і дисбактеріозі кишечника на
фоні антибіотикотерапії. Навпаки, відсутність відповіді на парентеральне
введення вітаміну До хворих із збільшеним протромбіновим часом свідчить про
паренхіматозне ураження печінки. Якщо гіпоальбумінемія відображає хронізацію
печінкової дисфункції, то збільшення протромбінового часу може служити маркером
тяжкості гострої дисфункції печінки. Наприклад, при вірусному гепатиті
збільшення протромбінового часу на 5-6 з, говорить про можливість блискавичного
некрозу печінкової тканини. Його виявлення при гострій дисфункції печінки по
протромбіновому часу, можливо, завдяки короткому періоду напіврозпаду чинника
VII.
Активність орнітиндекарбоксилази крові є
чутливим тестом для визначення як раннього, так і пізнього порушення білково-синтетичної
функції гепатоциту при хронічних гепатитах і цирозах печінки. Під дією
орнітиндекарбоксилази зменшується утворення біологічно активних речовин -
поліамінів, які є могутніми індукторами синтезу білка в гепатоцитах.[25]
1.9 Додаткові методи діагностики
Для постановки остаточного діагнозу проводять
додаткові інструментальні методи обстеження, які включають в себе пункційону
біопсію печінки (на ранніх стадіях цирозу), ультразвукове дослідження печінки
(дає можливість визначити не тільки розміри та структурне порушення печінки,
але і розміри порожнистої вени , селезінки, явищ асциту), еходоплердослідження,
лапароскопію, ангіографію (целіакографію, спленопортографію), комп'ютерну
томографію, ендоскопічну езофагогастродуоденоскопію.
2. МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
.1 Об’єкт дослідження
Матеріалом дослідження були проби і мазки
периферичної крові 40 осіб, серед яких 20 чоловік були практично здоровими і
складали контрольну групу. Середній вік варіював від 43 ± 48 років, давність
захворювання від 1 року до 8 років. Іншу групу складали 20 осіб: вірусний
гепатит В встановлено у 7 пацієнтів, вірусний гепатит С - 4 хворих, кріптогений
цироз (нез'ясованої етіології) - 5 пацієнтів, алкогольної етіології - 4
пацієнтів.
2.2 Методика узяття крові із пальця
Для дослідження крові на загальний клінічний
аналіз, кров беруть із пальця зранку, до фізичного навантаження та
діагностичних процедур, натще.
Реактиви:
% розчин тризамінного цитрату натрію;
Трансформуючий розчин;
Ізотонічний розчин натрію хлориду;
% розчин оцтової кислоти;
70º етиловий спирт.
Обладнання:
)Скарифікатор;
)Пробірки;
)Піпетки вмістом 0,02, 5 та 1 мл;
)Капіляри від апарата Панченка;
)Предметне та шліфувальне скло.
Узяття крові:
) У пробірки наливають відповідні реактиви:
для визначення ШОЕ- в капіляр Панченка набирають
(до мітки 0,75)реактив 1;
для визначення концентрації гемоглобіну - 5 мл
реактиву 2;
для підрахунку еритроцитів - 4 мл реактиву 3;
для підрахунку лейкоцитів -0,4 мл реактиву 4.
) Обробляємо IV палець ватним шариком змоченим
спиртом, робимо укол стерильним скарифікатором до упору.
) Першу краплю крові витирають, із наступних
крапель швидко набирають необхідну кількість крові. Починають узяття зазвичай з
розведення крові для визначення ШОЕ, так як для дослідження необхідна найбільша
кількість крові.
) Для визначення ШОЕ в капіляр від апарата
Панченка, промитий у розчині 1, набирають кров до мітки 0 (100 поділок) і
ретельно видувають її в пробірку з приготовленим розчином цитрату натрію
(співвідношення реактиву і крові 4:1), пробірку струшують. Пучку пальця
витирають сухим ватним шариком і після надавлювання збирають новоутворену
краплю.
) Для визначення концентрації гемоглобіну в суху
стерильну піпетку 0,02мл набирають кров до мітки, видувають в пробірку з
розчином 2 та декілька раз промивають піпетку у цьому розчині. Знову витирають
місце уколу, та видавлюють свіжу краплю крові.
) Для підрахунку числа еритроцитів кров беруть у
кількості 0,02 мл в піпетку і видувають в пробірку з реактивом 3.
) Для підрахунку лейкоцитів кров беруть піпеткою
до мітки 0,02 мл і видувають її в пробірку з розчином 4, промиваючи декілька
раз а розчині оцтової кислоти (розведення крові у 20 раз). Для взяття крові у одного
пацієнта можливо використовувати одну піпетку 0,02 мл, але обов’язково набирати
кров для лейкоцитів в останню чергу.
) Для дослідження лейкоцитарної формули,
морфології еритроцитів, лейкоцитів, тромбоцитів готовлять мазки крові :
витирають місце уколу сухим шариком вати та наносять краплю крові на сухе
знежирене предметне скло, потім швидко готують тонкі мазки за допомогою
шліфувального скла, краєм якого швидким рухом подвигають по предметному склу
краплю крові [67,68].
2.3 Визначення загальної кількості еритроцитів
Метод заснований на фотоелектричній зміні
ступеню поглинання світла, певних довжин хвиль в інфрачервоній області спектру
суспензією еритроцитів.
До 4 мл розчину хлориду натрію додають 0,02 мл
крові, перемішують і дають постояти не менше 20 хвилин. Потім вимірюють
фотоелектричними еритрогемометром. Контролем слугує хлорид натрію. Розрахунок
ведуть по калібрувальному графіку.
Норма: чоловіки 4-5x1012л,
жінки 3,7x1012л [67,68].
2.4 Визначення рівня гемоглобіну
Застосовується гемоглобінціанідний метод у
дослідженні ацетон-ціангідриду. Гемоглобін при взаємодії з залізосиньородним
калієм (червона кров'яна сіль) окислюється в метгемоглобін, забарвлений
гемоглобінцианід, інтенсивність забарвлення якого пропорційна вмісту
гемоглобіну. До 5 мл реактиву додають 0,02 мл крові (розведення в 251 раз),
перемішують не раніше ніж через 30 хвилин. Вимірюють проти контролю (реактив
Дробкіна), при зміні хвилі 540 нм, вимірюють за тих же умов стандартний розчин.
Розрахунок вмісту гемоглобіну проводять по калібрувальному графіку або по
формулі:
Еоп
Нb(2%)= -------- 59,75•251•0,001, (2.1)
Ест
де Еоп - екстинкція дослідної проби;
Ест - екстинкція стандартного розчину;
,75 - концентрація гемоглобінціаніду в
стандартному розчині в
мг/100мл, що відповідає концентрації гемоглобіну
в крові 15 гр.
на 100мл при розведенніїїу251раз;
- розведення крові;
,001 - коефіцієнт для перерахунку мг/100 мл у
гр/100 мл.
Норма становить: чоловіки 130 - 160 г/л; жінки
120 - 140 г/л [67, 68].
.5 Визначення швидкості осідання еритроцитів
При стадії стабілізованої крові еритроцити
осідають з різною швидкістю, залежно від зміни хімічних і фізичних властивостей
крові. Швидкість осідання виражається в міліметрах за 1 годину.
Заздалегідь промивають капілярну піпетку 5%
розчином цитрату натрію, потім набирають цей розчин до мітки «Р» і видувають у
видавлену2.5 пробірку. Тим же капіляром з пальця набирають двічі кров до мітки
«К» і спускають в тугішу пробірку. Добре змішують, насмоктують суміш у капіляр
до відмітки «0», і відмітивши час, ставлять у штатив. Отримане співвідношення
між об'ємами розчинника і крові рівне 1:4. Через 1 годину відлічують по
діленнях на капілярній піпетці величину стовпчика плазми, що звільнився від
еритроцитів. Якщо кров з пальця набирається насилу, можна обмежитися половинною
кількістю її і реактиву.
Норма: чоловіки 1-10 мм/год, жінки 2-15 мм/год
[67, 68].
2.6 Підрахунок кількості тромбоцитів
Підрахунок в камері.
Принцип. Метод 2 заснований на підрахунку
тромбоцитів в 1 мкл крові при постійному розведенні крові і визначеному обсязі
лічильної камери з використанням фазово-контрастного пристрою.
Обладнання.
. Мікроскоп.
. Фазово-контрасний пристрій (КФ).
. Лампа освітлювальна до мікроскопу (ОІ-7, Т)
І-18).
. Камера Горяєва.
Реактиви. 1. 3 г кокаїну гідрохлориду, 0,25 г
хлориду натрію, 0,025 р фурациліну розводять у 100 мл дистильованої води або 2.
1% розчин оксалату амонію. Розчин кип'ятять і фільтрують. Зберігають у
холодильнику. Отримання фазового ефекту - відповідно до інструкції, що
додається до фазово-контрастного пристрою. Хід визначення. 0,02 мл. крові з
пальця додають в пробірку з 4 мл розчину 1 або 2. Залишають на 25-30 хв для
гемолізу еритроцитів. Після повторного перемішування заповнюють камеру Горяєва,
яку розміщують у вологу камеру. Через 5 хв підраховують кількість тромбоцитів в
25 великих квадратах.
Розрахунок. Кількість тромбоцитів в 1 мкл крові
визначають за формулою:

 (2. 2)
(2. 2)
де а - кількість тромбоцитів,
підрахованих в 400 малих квадратах;
- розведення крові;
- множник, що приводить результат до
об'єму 1 мкл, виходячи з обсягу малого квадрата;
- число перелічені малих квадратів.
Практично підрахувати число тромбоцитів в 400 малих квадратах множать на 2000.
2.7 Визначення загальної кількості
лейкоцитів
2.8 Узяття крові для приготування мазка,
фіксація, фарбування Романовському-Гімза
Добре знежирити і промити предметні стекла:
помістити їх в розчин хромпіка на 24 години, потім промити під проточною водою,
протерти досуха і помістити в банку з сумішшю спирт-ефір. Перед вживанням
висушити.
До краплі крові доторкнутися предметним склом
так, щоб воно не торкалося пальців. Крапля крові переходить на скло, вона
повинна бути діаметром 2-5мм. Шліфувальне скло ставимо під кутом 30-45° на
відстані 1-2мм перед краплею, тримаючи його великим і вказівним пальцями правої
руки. Шліфувальне скло зрушують назад так, щоб воно торкнулося краплі крові і
крапля розтеклася до кута між шліфувальним і предметним склом. Швидким рухом
руки роблять рух вперед. Шліфувальне скло повинне бути вужчим, ніж предметне;
якщо їх ширина однакова, то у шліфувального скла відламують кути, скоротивши на
1-2мм .
Мазок просушують, фіксують за допомогою
метилового спирту (3-5хв) або ацетону (5хв). Як найкращі результати на фіксації
метиловим спиртом. Фіксуючі рідини наливають на стекла, або стекла занурюють в
банку з фіксатором. Після фіксації і висушування - забарвлення [67, 68].
Метод Романовського-Гімза.
Фарбник Романовського-Гімза складається з лужної
(азур) і кислої (еозин) частин.
Робочий розчин фарбника отримують розведенням
готового розчину дистильованою водою (1 - 2 краплі фарбника на 1 мл
дистильованої води). Дистильована вода повинна мати нейтральну рН. Реакцію води
проводять за допомогою гематоксилінової проби. У 4-5 мл води кидають фарбу
гематоксиліну. Якщо вода має лужну реакцію, то забарвиться раніше 3-ої хвилини.
Якщо фарбування через 5 хвилин або зовсім не відбувається, то вода має кислу
реакцію. Якщо вода забарвлюється в рожево-фіолетовий колір через 1-4 хвилини,
то вона нейтральна і придатна до приготування. Робочий розчин готують
безпосередньо перед забарвленням. Препарат поміщають мазком вниз на 2 скляні
палички, покладені на дно чашки Петрі. Фарбу підливають під препарат.
Офарблюють 20-40 хвилин. Потім мазок промивають під струменем води, висушують і
мікроскопують. При забарвленні по цьому методу еритроцити забарвлюються в
блідо-рожевий колір, ядра клітин - у синьо-фіолетовий, гранулоцити еозинофілів
- в яскраво-червоний, базофілів - у синій, цитоплазма лімфоцитів і моноцитів -
у блакитний колір [67, 68].
2.9 Підрахунок лейкоцитарної формули
Забарвлений мазок мікроскопують з імерсійною
системою, використовують окуляр 7 або 10, об'єктив 90. Робота з імерсійним
об'єктивом проводиться, коли він занурений у рідину, поміщену надосліджений
препарат. На мазок наносять краплю імерсійного масла, об'єктив занурюють у
нього до зіткнення з препаратом. Під контролем ока піднімають тубус доотримання
зображення. Чіткості добиваються за допомогою мікрогвинта. Лейкоцити,
розташовані в мазку розташовані нерівномірно, тому підрахунок слід вести як по
середині, так і по краю мазка, де добре розглядається структура клітин.
Вважають лейкоцити, що все зустрічаються,
диференціюючи їх по видах. Всього налічують 100 клітин.
У нормі:
палички - 1 - 6%;
сегменти - 47 - 72%;
еозинофіли - 0 - 5%;
лімфоцити - 19 - 37%;
моноцити -3 - 11% [67].
2.10 Визначення вмісту білірубіну і його фракцій
у сироватці крові
колориметричним
діазометодом (за Йендрашіку, Клеггорну, Грофом)
Принцип. При взаємодії сульфаніловой кислоти з
азотнокислий натрієм утворюється діазофенілсульфінова кислота, яка, реагуючи із
зв'язаним білірубіном сироватки, дає рожево-фіолетове фарбування. За
інтенсивності його судять про концентрацію білірубіну, який набирає пряму
реакцію. При додаванні до сироватки крові кофеїнового реактиву незв'язаний
білірубін переходить в розчинний дисоційований стан, завдяки чому він також
викликає рожево-фіолетове фарбування розчину з сумішшю діазореактивів. По
інтенсивності останнього фотоколорометрично визначають концентрацію загального
білірубіну. По різниці між загальним і пов'язаним білірубіном знаходять зміст
незв'язаного білірубіну, що дає непряму реакцію.
Реактиви.
) Кофеїновий реактив. 5 г чистого кофеїну, 7,5 г
бензойнокислого натрію (C6H5COONa), 12,5 г кристалічного оцтовокислого натрію
(CH3COONa) розчиняють у 90 мл дистильованої води, нагрівають вміст колби до +50
- 60 ° С і добре перемішують. Після охолодження доводять дистильованою водою до
100 мл (деякі автори рекомендують доводити обсяг до 200 мл або до 1л). Розчин
придатний протягом двох тижнів.
) Фізіологічни розчин (розчин NaCl, 9 г / л).
) Діазосуміш:
а) діазореактив I. 5 г сульфаніловой кислоти
розчиняють при підігріванні, в 300-400 мл дистильованої води, додають 15 мл
концентрованої соляної кислоти (щільність 1,19 кг / л). Якщо частина
сульфаніловой кислоти залишається в осаді, колбу поміщають у теплу воду і її
вміст помішують. Тільки після повного розчинення сульфаніловой кислоти та
охолодження розчину обсяг колби доводять дистильованою водою до 1 л. Реактив
стійкий, зберігається в посуді з темного скла;
б) діазореактив II. Розчин азотнокислий натрію
(NaN02, 0,5 г/100 мл). Реактив нестійкий, міститься в склянці темного скла
близько 2-3 тижнів. Перша ознака його непридатності - поява жовтого відтінку.
Перед роботою змішують 10 мл діазореактива I і
0,3 мл діазореактива II.
Хід визначення. У три пробірки (для визначення
загального білірубіну, зв'язаного білірубіну і постановки контрольної реакції
на колір сироватки) вводять реактиви згідно зі схемою. При визначенні
загального білірубіну пробу для розвитку забарвлення залишають стояти на 20 хв.
При подальшому стоянні проби забарвлення не змінюється.
Для дослідження свяганого білірубіну
колориметрірювання здійснюють через 5-10 хв після додавання діазосумішші, так
як при тривалому стоянні проби в реакцію вступає вільний білірубін.
Контрольну пробу на каламутність сироватки
ставлять для кожної дослідної проби.
Колориметріють розчини на фотоелектроколориметрі
при зеленому світофільтрі (довжина хвилі 500-560 нм) у кюветі з шириною шару 5
мм.
Розрахунок проводять за калібрувального графіку,
побудова якого надана у підрозділі «Побудова калібрувальної кривої для
визначення білірубіну сироватки крові». Знаходять вміст загального та
зв'язаного білірубіну в мкмоль / л. Для визначення рівня незв'язаного
(вільного) білірубіну з цифри загального його змісту віднімають показник
зв'язаного білірубіну (прямого).
Вміст загального білірубіну становить у нормі
8,55 - 20,52 мкмоль / л (0,5 - 1,2 мг/100 мл). 75% припадає на частку вільного
білірубіну.
2.11 Тимолова проба (по Хуерго і Поппера)
Принцип. Ора взаємодії сироватки з
тимолово-вероналовим буфером з'являється каламутність внаслідок утворення
глобулін-тимол-ліпідного комплексу.
Реактиви.
. Спиртовий розчин тимолу - 10 г/100 мл. 10 г
очищеного тимолу розчиняють у 100 мл 96 ° етилового спирту в мірній колбі.
Для отримання очищеного тимолу 100 г його
вносять до 100 мл 96 ° етилового спирту, суміш ретельно перемішують і
фільтрують. До фільтрату додають 1 л холодної дистильованої води, вміст склянки
сильно струшують і залишають стояти на 20 мін. Потім розчин фільтрують,
кристали, що залишилися на фільтрі, промивають два рази холодною дистильованою
водою, сушать - спочатку на фільтрувальному папері, а потім, протягом 2 -3
днів, в ексикаторі над безводним хлористим кальцієм до набуття ними постійної
маси.
. Буферний розчин - 2,76 г вероналу (точно!) І
2,06 г медіналу (вероналу натрію) розчиняють в 1 л дистильованої води.
Зберігати в холодному місці, при появі осаду розчин не придатний до вживання.
. Тимолово-вероналовий буфер. У мірній колбі на
100 мл змішують 80 мл буферного розчину і 1,0 мл спиртового розчину тимолу
концентрації 10 г/100 мл, суміш струшують і доливають буферним розчином до
мітки (рН 7,55).
. Приготування стандартної суспензії BaSO4: а)
0,0962 н розчин хлористого барію. Беруть 1,175 г кристалічного ВаС12-2Н20 і
розчиняють в 100 мл у води мірній колбі;
б) 0,2 н розчин H2S04;
в) суспензія ВaSO4. 3 мл 0,0962 н розчину ВаС12
вливають в мірну колбу на 100 мл і доводять до потрібного обсягу 0,2 н H2SO4
при 10 ° С (розміри частинок преципітированого при цій температурі BaS04 дають
відносно стабільний результат).
Хід визначення. До 6 мл тимолово-вероналового
буфера додають 0,1 мл негемолізированної сироватки, вміст пробірки перемішують,
залишають стояти 30 хвилин і потім фотометрують при 660 нм, з огляду на
показання в порівнянні з такими контрольними проб. Як остання використовують 6
мл буферного розчину. Реакцію проводять при температурі +25 ° С. Розрахунок
роблять по калібрувальної кривої. Для її побудови зі стандартної суспензії
BaS04 готують низку розведень, які отримують розведенням стандартної суміші 0,2
н розчином H2S04. Знайдені значення екстинкції відповідають одиницям помутніння
по Shank і Haagland (S-Н).
Так, оптичну густину суміші, приготованої з 1,35
мл стандартної суспензії і 4,65 мл 0,2 н H2S04, приймають за 5 од. S-Н; для
2,70 мл суспензії і 3,30 мл кислоти ступінь помутніння складе 10 од. Для 5,40
мл суспензії і 0 відповідний обсяг дистильованої води. За отриманими даними
будують калібрувальну криву.
Норма - 0-4 од. S-Н.
2.12 Колориметричний дінітрофенілгідразіновий
метод дослідження
активності
амінотрансфераз в сироватці крові (по Райтману, Френкелю, 1957)
Принцип. У результаті переамінування, що
відбувається під дією АсТ і АлТ, утворюються щавелоотцтова і піровиноградна кислота.
щавелоотцтова кислота здатна в процесі ферментативної реакції перетворюватися
на піровиноградну кислоту. При додаванні кислого 2,4-дінітрофенілгідразину
ензиматичних процес зупиняється і виходить гідразон піровиноградної кислоти.
Останній у лужному середовищі дає фарбування, інтенсивність якого пропорційна
кількості утворившийся піровиноградній кислоті.
Реактиви.
. 0,1 моль / л фосфатного буфера, рН 7,4. Для
приготування буферного розчину змішують 840 мл 0,1 моль / л розчину
двозаміщенного фосфату натрію Na2HP04 * 2H20 (17,4 г кристалічної солі
розчиняють в 1 л дистильованої води; двозаміщений фосфорнокислий натрій, що
містить дві молекули води, отримують шляхом вивітрювання на повітрі протягом
двох діб кристалічної солі, яка містить зазвичай 12 молекул води, сіль
попередньо розтирають у ступці в порошок) і 160 мл 0,1 моль/л розчину
безводного однозаміщеного фосфату калію КН2РО4 (13,6 г КН2РО4 розчиняють в 1 л.
дистильованої води).
Буферний розчин з індикатором
бром-тимоловим-синім (реактив 2) повинен давати блакитне забарвлення. В якості
консерванту до нього можна додати 5-10 мл хлороформу.
. Розчин бром-тимолового-синього - 0,04 г/100
мл. 100 мг індикатора розчиняють у ступці з 3,2 мл 0,05 н розчину їдкого натру.
Потім суміш змивають водою у мірну колбу ємністю 250 мл і доводять водою до
мітки.
Субстратний розчин для визначення
аспартатамінотрансферази. 29,2 мг а-кетоглутарової і 2,66 г DL-аспарагінової
кислот (при використанні замість DL-аспарагінової кислоти L-аспарагінової, а
замість DL-аланіну - L-аланіну міру субстрату слід зменшити вдвічі) відважують
на аналітичних вагах і вносять у 1 н розчин NaOH. Їдкий натр доливають
обережно, невеликими порціями до повного зникнення осаду і до отримання суміші
з рН 7,4 (для визначення рН використовують універсальну індикаторну папір або
застосовують рН-метр). Розчин переливають в мірну колбу ємністю 100 мл,
ополіскують посуд 0,1 ммоль/л фосфатним буфером (рН 7,4) і доводять їм обсяг
колби до мітки. Буферний розчин ретельно перемішують, додають 1 краплю хлороформу,
розливають у флакончики з-під пеніциліну і зберігають у холодильнику в
замороженому стані. Перед вживанням заморожений розчин слід повністю
розморозити.
. Субстратний розчин аланінамінотрансферази для
визначення активності. 29,2 мг а-кетоглутарової кислоти та 1,78 г DL-аланіну
(0,89 г L-алаііна) відважують на аналітичних вагах. Далі все виконується за
вказівками для першого субстратного розчину (реактив 3).
. Розчин 2,4-дінітрофенілгідразіна. 19,8мг
2,4-дінітрофенілгідразіна розчиняють у невеликій кількості 1 н розчину соляної
кислоти при нагріванні суміші на водяній бані. Після того, як розчин остигне,
доводять його обсяг соляною кислотою до 100 мл. На наступний день реактив
фільтрують. Розчин зберігають у посуді з темного скла в холодильнику. Придатний
протягом року.
. 0,4 н NaOH, вільний від карбонатів. Реактив
можна приготувати з сильно концентрованого розчину NaOH (50 г/100 мл),
розбавляючи його водою свежекіп̕ яченою, вільної від карбонатів, до
отримання суміші з щільністю 1,016 кг/л при +20 ° С або 1,018 кг/л при +15 ° С.
Однак переважніше готувати реактив з фіксаналу. Судини з реактивом і
дистильованої водою закривають пробками з поглинальними трубками, наповненими
натронним вапном або гідроокисом барію.
. Стандартний розчин піровинограднокислого
натрію CHaCOCOONa. 11 мг точно зваженого кристалічного піруватого натрію
(білого кольору) розчиняють у невеликій кількості дистильованої води,
переносять в мірну колбу ємністю 100 мл і доводять об'єм дистильованою водою до
мітки; 1,0 мл розчину містить ПЗ мкг піруватого натрію, що відповідає 88 мкг
піровиноградної кислоті. Розчин використовують для побудови калібрувального
графіка.
Хід визначення активності
аспартатамінотрансферази (АсТ). Дослідну пробу готують наступним чином. У
пробірку вносять 0,5 мл субстратного розчину і прогрівають суміш при +37 ° С
протягом 5 хв. Потім додають 0,1 мл випробуваної сироватки та пробірку
поміщають у термостат при +37 ° С на 60 хв. Після вилучення її з термостата в
вміст пробірки доливають 0,5 мл дінітрофенілгідразинового розчину, і проби
витримують протягом 20 хв при кімнатній температуру для розвитку реакції. Потім
додають 5 мл 0,4 н NaOH і після ретельного перемішування розчину залишають його
при кімнатній температурі на 10 хв для розвитку забарвлення. Оптичну щільність
проб вимірюють на ФЕКе із зеленим фільтром (530, 500-560 нм) у кюветі з шириною
шару 10 мм. Результати порівнюють з аналогічними даними контрольних проб.
Контрольна проба на реактиви містить всі
інгредієнти дослідної проби за винятком сироватки крові. Замість неї беруть,
0,1 мл дистильованої води. Контрольну пробу інкубують в тих же умовах, що і
дослідну.
Райтман, Френкель (1957) пропонують проводити
контрольні проби для кожної сироватки. Контрольні проби ставлять так само, як
Досвідчені, але розчин 2,4 дінітрофенілгідразіна додають до їх інкубації.
Здійснення контрольної проби для кожної, сироватки дає можливість отримувати
більш точні результати.
Хід визначення активності аланінамінотрансферази
(АлТ). У пробірку вносять 0,5 мл субстратного розчину для дослідження АлТ,
потім додають 0,1 мл випробуваної сироватки і поміщають суміш на 30 хв у
термостат для інкубації при +37 ° С.
Подальший хід аналізу здійснюють так само, як і
при визначенні АсТ.
Амінотрансферазну активність сироватки розраховують
за калібрувальною кривою. У пробірки наливають інгредієнти, вказані в табл. 14,
перемішують їх, додають по 0,5 мл 2,4-дінітрофенілгідразінау і через 20 хв
доливають по 5 мл 0,4н розчину NaOH. Потім вимірюють оптичну щільність проб на
фотоелектроколориметрі із зеленим світлофільтром (530 нм) в кюветах з шириною
шару 10 мм, порівнюють з аналогічними даними контрольної проби, в яку замість
розчину піровиноградної кислоти додають дистильовану воду. При побудові
калібрувального графіка на осі ординат відкладають знайдену величину оптичної
щільності, на осі абсцис відповідне їй зміст піровиноградної кислоти (ммоль).
Починаючи з величини екстинкції 0,30, графік, як
правило, відхиляється від прямої. Для дотримання прямій пропорції між
концентрацією речовини та оптичної щільністю при показниках екстинкції вище
0,30 ці сироватки (з великої ферментативною активністю) розводять будь-якою
інактивованою сироваткою. Отримані цифри множать на величину розведення.
В сироватці крові практично здорових людей
активність аспартатамінотрансферази (АсТ) складає 0,1-0,45 ммоль
піровиноградної кислоти на 1 л сироватки за J, ч інкубації при +37 ° С
(0,1-0,45 ммоль / (ч л) ; активність аланінамінотрансферази (АлТ) - 0,1 -0,68
ммоль / (ч • л).
Переклад прийнятих раніше одиниць ферментативної
активності (норма для АсТ - 8-40 їв, для АлТ - 5-30 од.) В ммоль
піровінаградної кислоти на І л сироватки за 1 год інкубації при +37 ° С
проводять за формулами:
Д/88 - для аспартатамінотрансферази, (2.3)
Д • 2 / 88 - для аланін амінотрансферази, (2.4)
де Д - показники активності ферментів, виражені
в старій розмірності (одиницях ферментативної активності); 88 - коефіцієнт
перерахунку, чисельно рівний молекулярній масі піровиноградної кислоти.
2.12 Визначення сечовини в сироватці крові по
кольоровій реакції з діацетілмонооксимумом
Реактиви.
. Розчин трихлороцтової кислоти -10 г/100 мл.
. Водний розчин діацетилмонооксимума - 2,5 г/100
мл. Реактив стійок.
. Водний розчин (0,25 г/100 мл) тіосемікарбазиду
або солянокислого тіосемікарбазиду (0,32 г/100 мл). Обидва реактиву стабільні
необмежено довгий час, якщо зберігати їх у темній посуді при кімнатній
температурі.
. Розчин хлорного заліза. 5 г хлорного заліза
розчиняють в 100 мл дистильованої води і підкисляють 1 мл концентрованої
сірчаної кислоти. Приготований таким чином основний розчин використовують для
отримання робочого розчину хлорного заліза шляхом додавання до 1 мл першого
дистильованої води до об'єму 100 мл і подальшого наливання 8 мл концентрованої
сірчаної кислоти і 1 мл розчину ортофосфорної кислоти (85 г/100 мл). Розчин
зберігають в темній посуді і використовують протягом 2 тижнів.
. Кольоровий реактив. До 30 мл робочого розчину
хлорного заліза додають 20 мл дистильованої води, 1 мл розчину
діацетілмонооксімума (реактив 2) і 0,25 мл розчину тіосемікарбазіду (реактив
3). Кольоровий реагент готують кожен раз безпосередньо перед вживанням.
. Стандартний розчин сечовини. 1,0 г сечовини
розчиняють в 100 мл дистильованої води. З цього основного розчину готують
робочий розведенням основного в 10 разів.
Згідно з наказом МОЗ СРСР про уніфікацію
лабораторних методів дослідження (1972, № 290, с. 69-70), рекомендується
відразу готувати робочий розчин сечовини, використовуючи замість води розчин
бензойної кислоти концентрації 0,2 г/100 мл (0,2 г кристалічної бензойної кислоти
розчиняють у 100 мл дистильованої води при інтенсивному перемішуванні і
нагріванні вмісту склянки на водяній бані). Стандарт на розчині бензойної
кислоти більш стабільний, ніж водний.
При роботі обидва розчину повинні давати
невеликі коливання екстинкції. В іншому випадку їх необхідно замінити.
мл стандартного розчину містить 1 мг сечовини (I
г/л, або 16,65 ммоль/л).
Хід визначення концентрації сечовини в сироватці
крові.
У центрофужну пробірку вносять 0,8 мл
дистильованої води, 0,2 мл сироватки та 1,0 мл розчину трихлороцтової кислоти,
вміст її змішують. Через 15-20 хв суміш центрофугують.
У чисту пробірку вносять 0,5 мл надосадову
рідину і 5 мл кольорового реактиву (5). Пробірку витримують у киплячій водяній
бані 20 хв, потім охолоджують протягом 2-3 хв під водопровідною водою.
Вимірювання екстинкції проби проводять на фотоелектроколориметрі при довжині
хвилі 500-560 нм (зелений світлофільтр) у кюветі з шириною шару 10 мм.
Враховують оптичну щільність контрольної проби,
яку ставлять так само, як досвідчену, але замість надосадової рідини беруть 0,5
мл дистильованої води.
Стандартну пробу проводять, як досвідчену, з
тією лише різницею, що замість сироватки в ній використовують 0,2 мл
стандартного розчину сечовини.
Припустимо і другий варіант постановки
стандартної проби, при якому в пробірку вносять 0,05 мл робочого стандартного
розчину, 0,25 мл розчину трихлороцтової кислоти, 0,2 мл дистильованої води і
відразу 5,0 мл кольорового реактиву. Цей спосіб, незважаючи на простоту,
відрізняється трохи меншою точністю через труднощі взяття піпеткою рівно 0,05
мл рідини.
В обох випадках розрахунок проводять за
формулою:
 (2.5)
(2.5)
де х - концентрація сечовини
(ммоль/л); Еоп.- екстинкції дослідної проби;.- Ест - екстинкції стандартної
проби; 16,65 - концентрація сечовини (ммоль/л) у стандартному розчині.
Норма вмісту сечовини в сироватці
крові - 2,50-8,33 ммоль / л.
2.13 Визначення креатиніну в сироватці крові і в
сечі по кольоровій реакції Яффі (метод Поппера зі співавт.)
Принцип. У результаті реакції креатиніну і
пікринової кислоти в лужному середовищі утворюється забарвлене з'єднання,
інтенсивність забарвлення якого пропорційна концентрації креатиніну.
Реактиви.
. Насичений розчин пікринової кислоти. 2 г
пікринової кислоти розчиняють у 100 мл гарячої (+70-80 ° С) дистильованої води
(суміш нагрівають у водяній бані). Розчин залишають на добу при кімнатній
температурі (для осадження надлишку пікринової кислоти), після чого його
фільтрують. Пікринової кислота, наявна в продажу, містить 15-20% води, однак
сушить не слід - це вибухонебезпечне! До того ж пікринової кислота являє собою
сильний отрута. Поводитися з нею треба обережно.
. Основний стандартний розчин креатиніну .- 8,80
ммоль / л. 100 мг креатиніну розчиняють в 100 мл 0,1 н розчину соляної кислоти.
Зберігають у холодильнику в посуді з притертою пробкою. Для визначення
креатиніну сироватки крові робочий стандартний розчин отримують розведенням
основного розчину дистильованою водою у 100 разів (0,088 ммоль / л). 1 мл
робочого розчину креатиніну містить 0,01 мг креатиніну. Цей розчин нестійкий.
. Розчин їдкого натру -10 г/100 мл.
. 0,1 н розчин соляної кислоти.
Хід визначення концентрації креатиніну в
сироватці крові. 2,0 мл сироватки змішують у пробірці з 6,0 мл прозорого
насиченого розчину пікринової кислоти. Через 5 хв пробірку поміщають на 15-20 с
в киплячу водяну баню, потім вміст пробірки центріфугують (або фільтрують).
До 4,0 мл центрифугату додають 0,2 мл розчину
NaOH і все ретельно змішують. Іноді після підлужнювання розчин каламутніє через
випадання фосфатів у цьому випадку розчин слід ще раз вітцентріфігувати, потім
його доводять до об'єму 10 мл дистильованою водою.
Через 10 хв проби колориметрують при зеленому
світофільтрі (довжина хвилі - 530 нм; 500-560 нм) у кюветі з шириною шару 20
мм, результати колориметріювання порівнюють з аналогічними даними контрольних
проб. Інтенсивність забарвлення не змінюється протягом години.
Контрольні проби готують наступним чином. До 3,0
мл насиченого розчину пікринової кислоти додають 0,2 мл розчину NaOH і доводять
об'єм дистильованою водою до 10 мл.
Стандартну пробу обробляють точно так само, як і
дослідну, з тією лише різницею, що замість сироватки беруть 2,0 мл робочого
стандартного розчину. Вміст пробірки не центріфігують.
Постановку стандартної проби можна спростити,
якщо виключити етап відбору половинного об'єму вихідного розчину і відразу до
1,0 мл робочого стандартного розчину креатиніну додати 3,0 мл пікринової
кислоти, 0,2 мл розчину NaOH і 5,8 мл дистильованої води.
Розраховують концентрацію креатиніну за формулою
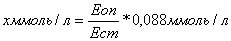 , (2.6)
, (2.6)
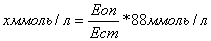 , (2.7)
, (2.7)
де х - вміст креатиніну в сироватці
крові; Еоп .- екстинкція досвідчених проб; Ест - екстинкція стандартних проб
(за вирахуванням значень оптичної щільності контрольних проб); 0,088 ммоль / л
(88 мкмоль / л) - концентрація креатиніну в стандартній пробі.
Концентрацію креатиніну в сироватці
крові можна розрахувати по калібрувальній кривій. Знайдену цим способом зміст
креатиніну в пробі відповідає такому в 1 мл сиворотки крові (див. хід
визначення креатиніну в сироватці). Наводяться значення перерахунку даних в
розмірності ммоль / л сироватки крові. Показання ФЕКа відкладають на осі
ординат, концентрацію креатиніну - на осі абсцис. Прямолінійна залежність
зберігається при концентрації креатиніну від
,026 до 0,440 ммоль / л (26 до 440
мкмоль / л).
2.14 Визначення протромбінового часу
Принцип. При надлишку тромбопластину та
оптимальному вмісту кальцію час утворення згустку в плазмі залежать від
активності протромбінового комплексу II, VII, IX, X.
На цій підставі до реакційної суміші вводять
тканинний тромбопластин та хлористий кальцій. Джерелом факторів протромбінового
комплексу є досліджувана плазма. Якщо у неї знижена активність одного або
декількох факторів протромбінового комплексу, то час утворення згустку у плазмі
буде сповільнено. При достатньому вмісту факторів протромбінового комплексу
перехід протромбіну в тромбін та дії останнього на фібриноген можуть
перешкоджати антикоагулянти (анти- тромбіни), в основному - гепарин, і дуже
низький вміст фібриногену в плазмі (нижче, ніж 100 мг%). Це визначається
допоміжними тестами.
Визначення протромбінового часу плазми
Реактив.
,8% розчин лимоннокислого натрію або 1,34%
розчин щавлевокислого натрію;
,025М розчин хлористого кальцію;
% розчин тромбопластину.
При недостатньо активному тромбопластині
використовують 2% суспензію.
Обладнання: водяна баня, секундомір.
Визначення. Кров у донора або хворого беруть у
центрифужні пробірки з 1,34% розчин щавлевокислого натрію або 3,8%
лимоннокислого натрію у співвідношенні 9:1. Пробірки з кров’ю відразу поміщають
у баню з льодом, потім центрифугують 10 хвилин при 1.200 - 1.500 об/хв. В
пробірку із 0,1 мл цитратної або оксалатної плазми додати 0,1 мл розчину
тромбопластину та інкубують 1 хвилину на водяній бані при 37оС. Потім додають
0,1 мл 0,025 М розчин хлористого кальцію та відразу вмикають секундомір. Час
від моменту додавання розчину хлористого кальцію до утворення щільного згустку
фібрину відповідає протромбіновому часу та виражається у секундах. Результат
виражають у вигляді протромбінової активності (індексу). Протромбінові
активність плазми (ПАП) визначають за формулою
ПАП (%)=А:В)·100, (2.8)
де А - протромбіновий час здорової людини .
В - протромбіновий час досліджуваної плазми.
Нормальні величини. Протромбінова активність
(індекс) плазми здорової людини в середньому дорівнює 80 - 100%. Протромбіновий
час плазми здорової людини визначають кожен раз при роботі з новою серією
тромбопластину [67, 68].
2. 15 Статистична обробка даних
Статистичну обробку даних проводили за Г.Ф.
Лакіним [73]
Середнє арифметичне:
 , (2.9)
, (2.9)
де n - кількість випадків;
Σ - сума варіант.
Середнє квадратичне відхилення σ - показник
розмаїтості ознаки:
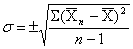 (2.10)
(2.10)
Похибка вибіркової середнього
арифметичного (mx):=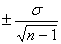 (2.11)
(2.11)
Вірогідність різниці (td):
= (2.12)
(2.12)
Показник вірогідності (р)
встановлювали по таблиці Ст’юдента на підставі даних td і (n1+n2-2).
3. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
.1 Дослідження клінічних показників
крові
У таблиці 3.1 наведені дані визначень загальної
кількості еритроцитів та вмісту в крові гемоглобіну, а також відображений один
з показників функціональних хімічних властивостей крові - швидкість осідання
еритроцитів (ШОЕ). Вказані показники загальної кількості загальної кількості
лейкоцитів, вміст тромбоцитів, лімфоцитів, моноцитів.
Як видно із отриманих даних, у осіб, які
складали контрольну групу, загальна кількість еритроцитів складала
4,39±0,075x1012/л, рівень гемоглобіну дорівнював 137±2,095 г/л, ШОЕ становило
7,9±0,536 мм/год, лейкоцити становили 6,4±0,333 х109 г/л, тромбоцити складали
223±8,748 х109/л, лімфоцити дорівнювали 28,6±1,191 %, рівень моноцитів складав
7,2±0,403 %.
При даній патології не встановлено достовірних
змін рівня гемоглобіну (р>0,05), у процентному співвідношенні, це на 5%
менше контрольних величин. Рівень гемоглобіну при цьому складав 130±4,911 г/л.
Швидкість осідання еритроцитів становила
17,65±4,584 мм/год, у процентному співвідношенні, це на 123% більше норми.
Встановлено достовірні відмінності з контролем (р<0,05).
При захворюванні печінки в стадії декомпенсації
спостерігаємо зменшення відносного вмісту тромбоцитів на 201±7,831х 109 г/л, що
на 10% нижче контролю. Відмінність з контролем недостовірна (р>0,05).
Показники загальної кількості лейкоцитів
достовірно не відрізнялись від контрольних величин 6,15±0,409 х 109 г/л
(р>0,05), а саме на 4% нижче норми.
Показники загальної кількості лімфоцитів
достовірно не відрізнялись від контрольних величин і складали 26,55±1,973 %, що
на 7% нижче контролю (р>0,05).
Встановлено зменшення відносного вмісту
моноцитів на 17%, показники становили 5,95±0,584 %. Відмінність з нормою
недостовірна (р>0,05).
Виходячи з наших даних можна зробити висновок,
що при декомпенсованних станах печінки завжди присутня зниження еритроцитів,
лейкоцитів, тромбоцитів і збільшення ШОЕ.
У хворих ЦП, особливо за наявності асциту, а
також при тривалій обструктивної жовтяниці, гепатиті, збільшується об'єм
плазми. Ця гіперволемія може частково, а іноді й повністю пояснити зниження
концентрації гемоглобіну, еритроцитів у крові. Загальна кількість циркулюючого
гемоглобіну зменшено у половини пацієнтів. Що стосується лейкоцитів -
наголошується лейкопенія в основному зменшення поліморфних клітин.
Відзначається тромбоцитопенія, що є наслідком секвестрації клітин в селезінці.
Це викликано значним підвищенням селезінкової пулу тромбоцитів. У хворих на ЦП
у стадії С за Чайлд, порушена функція тромбоцитів, особливо агрегації.
На нашу думку ці показники дуже наочно і
достовірно пре-доставляють інформацію про декомпенсації печінки, що можна
простежити і в інших джерелах.
.2 Дослідження біохімічних показників крові при
патології печінки в стадії декомпенсації
У таблиці 3.2 наведені результати біохімічних
показників крові при патології печінки в стадії декомпенсації
Як видно із даної таблиці 3.2 у осіб, які
складали контрольну групу, показники загального білірубіну становили 13,9±0,864
мкмоль/л, тимолова проба складала 2,91±0,089 од. S-Н, відносна кількість АсАТ
дорівнювала 0,29±0,022 ммоль/(г.л), АлАТ дорівнювала 0,36±0,033 ммоль/(г.л),
сечвина становила-4,5±0,124 ммоль/л, креатінин складав 86,9±1,724 мкмоль/л,
показник протромбінового індексу становив 85,9±1,397%.
У осіб при патології печінки в стадії
декомпенсації показники загального білірубіну становили 26,2±0,876 (р <0,001)
, що на 88% вище норми. Різниця з контролем високо достовірна. Показник
перевищує допустимі норми, що свідчить про наявності жовтяниці.
Тимолова проба дорівнювала 5,1±0,548 од. S-Н,
показник вірогідності складає (р<0,001), це на 75% вище контролю. Різниця з
нормою високо достовірна. Реакція позитивна у хворих із постгепатитним та
постнекротичним станами, особливо при цирозі.
Показники АсАТ та АлАТ складали 1,20±0,068
ммоль/(г. л) - (р <0,001), 1,36±0,089 ммоль/(г. л) - (р<0,001),
відповідно на 313% та 277% вище контрольних величин. Різниця з контролем високо
достовірна.
При цирозі активність AсАT вище АлАТ в 100%
випадках. Активність АлАТ і AсАT є ранньою ознакою безжовтяничного гепатиту.
При значному збільшення активності АлАТ і AсАT більш характерна для
паренхіматозної гіпербілірубінемії.
Рівень сечовини становив 5,1±0,548 ммоль/л, що
на 13%більше показників норми. Відмінність даних показників з контролем високо
достовірна (р<0,001).
При даній патології рівень сечовини в крові
незначно збільшується, за рахунок збільшення вмісту азоту, амінокислот та
аміаку.
Креатінин складав 130±4,911 мкмоль/л
(р<0,001), це на 49% вище контролю. При збільшені сечовини, відповідно
збільшується рівень креатінину в крові.
При даній патології протромбіновий індекс становив
65±2,009%, що на 24% менше контролю. Відмінність цих показників з контролем
високо достовірна (р<0,001). Зниження протромбінового індексу є оцінка
тяжкості ураження паренхіми печінки.
4. ОХОРОНА ПРАЦІ
Мета даного розділу показати практичні вміння застосовувати
теоретичне знання при вивченні охорони праці.
Охорона праці займає одне з провідних місць в
організації виробництва, проведенні наукових досліджень. Правила з охорони
праці спрямовані на попередження професійних захворювань, травм, смерті у випадку
нещасних випадків. Уяких правил.ванням у лабораторії, то мені довелося
дотримуватись разі реєстрації нещасного випадку закон з охорони праці дозволяє
врегулювати трудові конфлікти [].
Предметом дослідження було вивчення
гематологічних показників у осіб із судинною патологією, в умовах норм та
патології. Для досягнення визначеної мети вирішувалися наступні задачі:
визначити показники червоної крові у осіб із
даною патологією;
визначити показники білої крові;
визначити рівень загального білірубіну;
визначити показники тимолової проби;
визначити показники АсАТ;
визначити показники АлАТ;
визначити показники сечовини;
визначити показники креатінину;
визначити показники протромбінового індексу
крові.
Перед початком роботи я отримала інструктаж щодо
правил безпеки та поведінки в умовах лабораторії: при користуванні
електроприладами, при роботі з токсичними та їдкими речовинами, правилами
пожежної безпеки, ознайомлена з вимогами щодо використання індивідуальних
засобів захисту та вимогами до апаратури, меблів і устаткування. Ознайомилася з
наказом про гігієну зору та роботи з біологічним матеріалом [].
У лабораторії є наступне обладнання :електронний
лічильник для підрахунку лейкоцитарної формули, центрифуга, термостат типу
ТУ-1382, ТС-301, сухо жарова шафа, дистилятор.
Електропостачання приладів відбувається від
електричної мережі змінного струму із заземленою нейтраллю 380/220В. Заземлення
електрообладнання має бути виконане згідно ДОСТу 12.1.019-79 «Електробезпека».
У лабораторії використовується обладнання лише заводського виробництва, до
експлуатації приладів приступати після ретельного ознайомлення з паспортом та
інструкцією. Перед експлуатацією електроприладу ретельно перевіряють його
справність. Про виявлені дефекти ізоляції, електропроводки, ушкодження приладів,
розеток, вилок, заземлення, засобів захисту повідомляють адміністрацію. Для
забезпечення електробезпеки в лабораторії необхідна повна ізоляція
електрообладнання для запобігання потрапляння людей під напругу та вірогідності
пожеж під час короткого замикання. В лабораторії використовується органічна
полімерна ізоляція. Вмикання та вимикання всієї електромережі здійснюється
загальним рубильником [].
Приміщення забезпечене автоматичною пожежною
сигналізацією, вогнегасниками, які розташовані у доступних місцях. Пожежна
безпека забезпечується проведенням організаційних та технічних засобів,
відповідно правил пожежної безпеки в Україні [56].
Метеофактори лабораторії підтримувалися у межах
найбільш оптимальних для роботи: температура у приміщені коливалася у межах від
20º
С
до 22º
С,
у зимовий період її рівень підтримується центральною системою опалення. Для
забезпечення необхідного рівня вологості повітря (60-40%) двічі на день
проводилося вологе прибирання приміщення[51].
Природне та штучне освітлення робочих місць
лабораторії відповідає санітарно-гігієнічним нормам. Захист від надлишкового
світла сонячних променів в лабораторії здійснюється за допомогою жалюзі. Стіни
та стеля приміщення пофарбовані світлою фарбою, долівка вкрита керамічною
плиткою та лінолеумом. Обладнання відповідає загальним вимогам: покриття
робочих поверхонь столів виготовлене з вогнестійкого матеріалу а також стійкого
до води, кислот та лугів. Прилади, меблі та обладнання розташовані таким чином,
що забезпечує комфортну працю, простоту використання, очищення, знезараження та
контролю[52,57].
Неподалік робочої зони знаходиться аптечка для
надання першої допомоги при нещасному випадку, до її складу входять: розчин
йоду, сульфацил натрію, 3% розчин перекису водню, етиловий спирт, стерильні
гумові рукавички, напаличники, спирт нашатирний, 2% розчин борної кислоти (для
знешкодження дії лугу при попаданні на шкіру), 2% розчин гідрокарбонату натрію
(при опіку кислотою)[51,52].
У своїй роботі користувалася хімічними
реактивами, при необережному використовуванні яких можливе травмування: опіки
(концентрована H2SO4 HCL) , отруєння (барвники, фіксатори) та легкозаймисті
речовини (ефір, спирт, ацетон). Уся необхідна робота проводилася у витяжній
шафі та застосовувала засоби захисту(окуляри та гумові рукавички). Витяжна шафа
має приточно-витяжну та електричну вентиляцію[54].
Зберігання хімічних реактивів проводиться згідно
методичних вказівок №2684-73 та інших правил у спеціальних приміщеннях, які
мають вентиляцію, штучне освітлення, опалення. Температура повітря у приміщенні
для збереження реактивів повинна бути від +8 до +20 С, відносна вологість
60-70%. Реактиви розміщають по групам: неорганічні по катіонам, органічні по
класам (по алфавіту)- вуглеводи, галогени, спирти, кетони та ін. Кислоти та луги
тримають окремо. Усі реактиви мають етикетки де вказана назва та дата
(виготовлення і термін зберігання)[].
Згідно наказу №408,120,916,720 та ОСТУ при
заборі біологічного матеріалу, з метою запобігання зараженню небезпечними
захворюваннями (гепатит В та С, СНІД, сифіліс та ін.) використовувала разові
стерильні рукавички. Відпрацьований матеріал та посуд знезаражувався та
оброблявся.
При проведенні дослідження користувалася
люмінесцентним та світловим мікроскопами. Для захисту очей використовувала
світловий фільтр ЖС-18, який кріпився на окуляр. Після підрахунку кожної
формули крові робила короткочасні перерви для відпочинку та зорової гімнастики
[].
Завдяки знанням і навичкам, отриманим під час
викладання в університеті курсів «Охорона праці», я змогла безпечно провести
свої експерименти. Якщо б стався нещасний випадок, я б діяла таким чином:
при потраплянні кислоти чи лугу на шкіру негайно
б промила уражене місце великою кількістю проточної води і обробила 2% розчином
борної кислоти (якщо потрапив луг ) та 2% розчином гідрокарбоната натрію (якщо
потрапила кислота);
при влученні в очі потрібно негайно промити їх
проточною водою. Місце опіку збезводнити етиловим спиртом.
У випадку виникнення пожежі я б використала
вогнегасник, а якщо б займання виникло у витяжній шафі, треба було б засипати
джерело піском. Для гасіння пожежі не електричного походження можна
використовувати воду.
Завдяки виконанню правил техніки безпеки я
змогла запобігти впливу шкідливих речовин та будь-яким нещасним випадкам.
Враховуючи те, що для оформлення даної роботи
неможливо обійтись без комп’ютерної техніки, дотримувалась при роботі певних
правил. Я намагалася не сідати позаду інших працюючих комп’ютерів, а якщо і
порушувала це правило, то сиділа на відстані не менше ніж на 1,2 м.
Враховуючи, що тривала робота з комп’ютером
призводить до іонізації приміщення позитивними та негативними іонами, я через
кожну годину 20 хвилин робила перерви. В цей час провітрювалась кімната. Так як
робота з комп’ютером є роботою з тривалим перебуванням в фіксованій позі, я
виконувала під час перерви фізичні вправи та вправи для очей.
При своїй роботі користувалась комп’ютером та
дотримувалась наступних правил, які допомагають зберегти правильну поставу,
здоровий зір та зменшити навантаження на кисті рук.
.Бажано розташовувати комп'ютер у кімнаті під
кутом 90 градусів
до
стіни з вікном. При ясному світлі зашторьте вікна, щоб уникнути відблисків на
екрані. Використовування жалюзі дозволить направити світло з вікна не на вас, а
на стелю і стіни. Прибрати занадто яскраві лампи з поля зору.
Документи для роботи повинні знаходитися перед
монітором, бажано на спеціальній підставці, щоб уникнути маси непотрібних рухів
очей.
Навантаження на кисті рук можна зменшити, якщо
тримати їх при наборі прямо. Можна використовувати м'які підставки для кистей
рук, на яких вони будуть відпочивати в перервах між набором тексту.
Тримайте мишу легко, розслабленою кистю. Не
тримайте мишу подовгу на однім місці.
Доведено, що очам комфортно, якщо погляд
спрямований на екран трохи вниз (центр екрана нижче рівня очей на 10-20 см).
Оптимальна відстань між очами та екраном - 50-65
см.
Висота стільця повинна бути, такою щоб ноги
міцно стояли на підлозі, а сидіння було вище колінної чашечки. Добре, якщо
спинка стільця має вигин, що підтримує нижню частину спини. Відпочинок рукам
при наборі тексту забезпечать підлокітники [].
Завдяки отриманим знанням та навичкам під час
вивчення курсів «Охорона праці» експериментальні дослідження які я проводила
були виконані в безпечних умовах [].
ВИСНОВКИ
Загальна кількість еритроцитів в крові
знижувалась на 12% при патології печінки в стадії декомпенсації.
ШОЕ підвищувалося на 123% - при даній патології.
Встановлено зростання кількості загального
білірубіну в крові на 88% при захворюванні печінки.
Рівень тимолової проби в крові зростав на 75%
при патології печінки в стадії декомпенсації.
Встановлено зростання кількості АсАТ та АлАТ
відповідно на 313% та 277%.
Вміст сечовини збільшувався відносно контролю на
13%.
Збільшення креатиніну в крові становило 49%.
Протромбіновий індекс зменшувався на 24% при
захворюванні печінки в стадії декомпенсації.