Автоматическая сегментация электроэнцефалографической записи на стационарные участки
Содержание
1. Введение
1.1 Электроэнцефалография человека
1.2 Природа электрической активности мозга
1.3 Регистрация электроэнцефалограммы по системе "10-20"
1.4 Электроэнцефалографическая семиотика
1.5 Ритмы ЭЭГ
1.6 Применение ЭЭГ
1.7 Нестационарность ЭЭГ
1.8 Важность сегментации в решении задач ЭЭГ
1.8.1 Классификация сна на основе ЭЭГ
1.8.2 Фундаментальные исследования работы мозга
2. Постановка задачи
3. Математический аппарат
3.1 Стационарный случайный процесс
3.2 Алгоритмы сегментации ЭЭГ
3.2.1 Метод фиксированных интервалов
3.2.2 Параметрическая сегментация
3.2.3 Непараметрическая сегментация
3.2.4 Метод фрактальной размерности
4. Результаты
4.1 Описание модуля
4.2Метод фрактальной размерности
4.2.3 Построение гипнограммы
4.3 Метод непараметрической сегментации
4.3.1 Результаты сегментации
4.3.2 Построение гипнограммы
Выводы
Список литературы
Сокращения
1.
Введение
1.1
Электроэнцефалография человека
Мозг человека - едва ли не самое большое таинство природы. В
гигантских популяциях миллиардов нервных клеток, в еще большем (на три-четыре
порядка) количестве нервных связей и в астрономическом числе эффективных
межнейронных комбинаций саморазвивающаяся природа обратилась к самой себе в
форме самопознания. Порождающиеся в ходе этого процесса субъективные образы и
представления первичной реальности стали у человека доминирующими мотивами
программирования и управления поведением, от элементарных актов типа забивания
гвоздей и придумывания научных гипотез до сложных межличностных контактов и
экзистенциальных размышлений.
Теперь все в природе стало подвластным анализу, даже сам
мозг. Однако в последнем случае исследователи столкнулись с уникальной и
казалось бы практически безвыходной ситуацией, когда в сети экспериментальных
процедур следовало поймать реально существующие, но быстротечные и бестелесные
психические феномены: эмоциональные состояния, процедуры мышления и ментальные
образы! Какими же нужно обладать инструментами экспериментального анализа,
чтобы зафиксировать хотя бы элементарные акты человеческой психики?
Можно было бы попробовать измерять потребление нервными
клетками кислорода или питательных веществ (глюкозы), предполагая, что в
состоянии активации то и другое требуется клеткам в большем количестве. Можно
измерять теплопродукцию нервной ткани. И такие методы действительно существуют
в настоящее время, например, в виде технологий позитронно-эмиссионной
томографии, ядерно-магнитного резонанса, тепловидения и др. Однако, подобные
подходы, очевидно, лишь косвенным образом могут отражать собственно информационную
активность мозга. К тому же большая инерционность этих методов (секунды и
десятки секунд) не позволяет им "отреагировать" на мимолетную по
своей природе аналитическую деятельность нейронов.
К счастью для многих поколений психофизиологов в основе
аналитических процедур нервных клеток оказался заложенным вполне материальный
носитель - разность электрических потенциалов по обе стороны клеточной
мембраны, достигающая 70-80 милливольт (мВ)! Распространяющиеся по отросткам
нервных клеток кратковременные сдвиги мембранного потенциала или нервные
импульсы можно было зарегистрировать с помощью обычных вольтметров, снабженных
каскадом предварительного усиления электрического сигнала. Таким образом,
динамика состояний нейронов могла передаваться на стрелки электрических
регистраторов без малейшей задержки. Для исследований на человеке трудность
этого экспериментального подхода заключалась только в том, что электрическую
активность мозга нужно было зарегистрировать "неинвазивно", т.е. без
каких-либо разрезов, проколов и др. повреждений биологических тканей. А как
иначе, без повреждений, "отвести" потенциалы коры головного мозга,
защищенной от внешних воздействий не только кожей и костями черепа, но
дополнительно еще укрытой несколькими оболочками, между которыми циркулирует
токопроводящая цереброспинальная жидкость? Как видно, природа сделала все,
чтобы защитить мозг не только от механических повреждений, но и от внешних
электромагнитных полей. Вот эту последнюю защиту одинаково трудно
"пробить" как с внешней, так и с внутренней стороны черепной коробки.
Корковые электрические потенциалы если и проникают на поверхность черепа, то
они ослаблены в тысячи раз, в конечном итоге не превышая одной - двух сотен
миллионных долей вольта. Это притом, что в сотни раз большие потенциалы
наводятся на теле человека от внешних природных и техногенных электромагнитных
полей.
электроэнцефалограмма сегментация электрическая активность
Тем не менее около 80 лет назад технология регистрации
электрических потенциалов мозга непосредственно с кожной поверхности головы
человека была продемонстрирована немецким психиатром Гансом Бергером. Этот
метод получил название электроэнцефалографии (ЭЭГ), и в настоящее время ни одно
неврологическое отделение в больницах, ни одна поликлиника соответствующего
профиля не обходится без лаборатории электроэнцефалографии. Диагностике с
помощью метода ЭЭГ теперь хорошо поддаются многочисленные очаговые поражения
мозга, опухолевые процессы, эпилептические и некоторые другие нейрогенные
заболевания.
1.2 Природа
электрической активности мозга

Основными элементами центральной нервной системы (ЦНС)
являются нейроны. Типичный нейрон состоит из трех частей: дендритное дерево,
тело клетки (сома) и аксон (рис.1). Сильное разветвленное тело дендритного
дерева имеет большую поверхность, чем остальные его части, и является его
рецептивной воспринимающей областью. Многочисленные синапсы на теле дендритного
дерева осуществляют прямой контакт между нейронами. Все части нейрона покрыты
оболочкой - мембраной. В состоянии покоя внутренняя часть нейрона - протоплазма
- имеет негативный знак по отношению к внеклеточному пространству и составляет
приблизительно 70 мВ.
Этот потенциал называют потенциалом покоя. Он обусловлен
разностью концентраций ионов Na+, преобладающих в экстраклеточной
среде, и ионов К+ и Cl-, преобладающих в протоплазме
нейрона. Если мембрана нейрона деполяризуется от - 70 мВ до - 40 мВ, при
достижении некоторого порога нейрон отвечает коротким по длительности импульсом,
при котором мембранный потенциал сдвигается до +20 мВ, а затем обратно до - 70
мВ. Этот ответ нейрона называют потенциалом действия. Длительность данного
процесса составляет около 1мс.
Потенциал действия является основным механизмом, с помощью
которого аксоны нейронов передают информацию на значительные расстояния.
В функциональном отношении нейроны делятся на три основных
класса.
Чувствительные (сенсорные) или рецепторные
нейроны несут информацию от периферии к центру в виде последовательности
разрядов потенциалов действия, в которых кодируются физические и другие
параметры стимула.
Интернейроны действуют на другие нейроны посредством
постсинаптических возбуждающих или тормозных потенциалов. Это самая
многочисленная группа, состоящая из 20 миллиардов нейронов ЦНС.
Двигательные (моторные) или эффекторные
нейроны - это все нейроны, которые посылают эфферентные аксоны для активации
мышц.
Глия. Более половины объема ЦНС состоит из глиальных
клеток, которые поддерживают функцию нейронов, но непосредственно не участвуют
в функционировании нейронов.
1.3
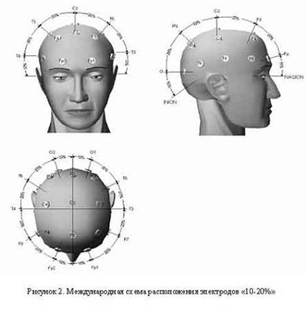
Регистрация электроэнцефалограммы по системе "10-20"
В настоящее время чаще всего используется расположение
электродов по международной системе "10-20 %". Система "10-20
%" (рис.2) - стандартная система размещения электродов на поверхности
головы, которая рекомендована Международной федерацией электроэнцефалографии и
клинической нейрофизиологии, она была создана в 1950-х годах канадским
нейрофизиологом Гербертом Генри Джаспером. Всего в этом случае на поверхность
головы накладывают 21 электрод [2].
1.4
Электроэнцефалографическая семиотика
Электроэнцефалография как самостоятельная область клинической
диагностики имеет свой специфический язык, устанавливающий соответствие между
наблюдаемыми на ЭЭГ изменениями электрических потенциалов и терминами,
используемыми для их обозначения, а также между этими терминами и определенными
представлениями анатомии, физиологии и клиники. Совокупность этих
взаимосоответствий и составляет содержание электроэнцефалографической семиотики
[4].
Для выделения на ЭЭГ значимых признаков ее подвергают
анализу. Как для всякого колебательного процесса, основными понятиями, на
которые опирается параметризация ЭЭГ, являются её частота, амплитуда и фаза.
Частота определяется количеством колебаний в секунду.
Поскольку ЭЭГ представляет собой вероятностный процесс, на каждом участке
записи встречаются, строго говоря, волны различных частот, поэтому в заключение
приводят среднюю частоту оцениваемой активности. Обычно берут 4-5 отрезков ЭЭГ
длительностью в 1 с и сосчитывают количество волн на каждом из них. Средняя из
полученных данных будет характеризовать частоту соответствующего ритма на ЭЭГ
(рис.3а).

Амплитуда - размах колебаний электрического потенциала на
ЭЭГ, измеряют от пика предшествующей волны до пика последующей волны в
противоположной фазе (рис.3б), оценивают амплитуду в микровольтах (мкВ). Для
характеристики какой-либо ритмической активности ЭЭГ выбирается мода (наиболее
часто встречающееся значение амплитуды).
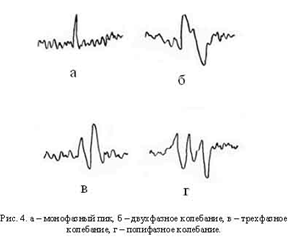
Фаза определяет текущее состояние процесса и указывает на
направление вектора его изменений. Некоторые феномены на ЭЭГ оценивают
количеством фаз, которые они содержат. Монофазным называется колебание в одном
направлении от изоэлектрической линии с возвратом к исходному уровню,
двухфазным - такое колебание, когда после завершения одной фазы кривая
переходит исходный уровень, отклоняется в противоположном направлении и
возвращается к изоэлектрической линии. Полифазными называют колебания,
содержащие три и более фаз (рис.4).
1.5 Ритмы ЭЭГ
ЭЭГ представляет собой случайный процесс, обусловленный
суммацией электрических потенциалов, генерируемых многими миллионами нейронов,
активность которых в свою очередь определяется случайной синаптической
бомбардировкой и, возможно, собственными колебаниями потенциала, обусловленными
метаболическими процессами. В связи с этим ее спектр оказывается чрезвычайно
сложным и широким, хотя количественные соотношения мощностей по каждой из этих
частот различны. Из-за ограниченных перцепторпых возможностей человека при
визуальном анализе ЭЭГ, применяемом в клинической электроэнцефалографии, целый
ряд частот не может быть достаточно точно охарактеризован оператором, так как
глаз человека выделяет только некоторые основные частотные полосы, явно
присутствующие в ЭЭГ. В соответствии с возможностями ручного анализа введена
классификация ритмов ЭЭГ по некоторым основным диапазонам, которым присвоены
названия букв греческого алфавита [5].
Под понятием "ритм" в ЭЭГ подразумевается
определенный тип электрической активности, соответствующий некоторому состоянию
мозга и связанный с определенными церебральными механизмами. Соответственно при
описании ритма дается его частота, типичная для определенного состояния и
области мозга, амплитуда и некоторые характерные черты его изменений во времени
при изменениях функциональной активности мозга.
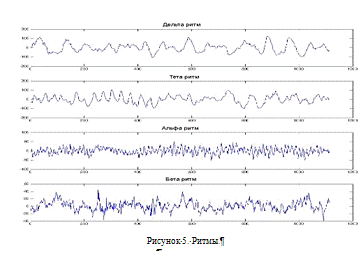
В клинических исследованиях обычно выделяют четыре типа
ритмов, последовательно возрастающей частоты: дельта, тета, альфа и бета ритмы.
Альфа-ритм с частотой 8-13 Гц и амплитудой до 100 мкВ является
основным для предварительного выявления отклонений от нормы, и он
регистрируется у 85-95% здоровых взрослых в спокойном расслабленном состоянии с
закрытыми глазами. Лучше всего он выражен в затылочных (зрительных) отделах, по
направлению ко лбу амплитуда его постепенно уменьшается и комбинируется с
бета-ритмом. В лобных отделах регистрируется очень слабо выраженный альфа-ритм
и бета-колебания, сравнимые с ним по амплитуде. Ритм исчезает при афферентных
раздражениях любой модальности, но особенно он чувствителен к зрительным
раздражениям. Амплитуда альфа-активности может варьировать (20-110мкВ), она максимальна
в состоянии пассивного бодрствования, снижается, как в состоянии активного
бодрствования (активация коры), так и в состоянии дремоты (дезактивация коры).
Амплитуда альфа-ритма даже в одном и том же состоянии колеблется от минимума до
максимума, формируя веретёна - горизонтально ориентированные амплитудные
модуляции.
Экзальтация (или гиперсинхронизация) альфа-активности
(увеличение индекса и амплитуды) наблюдается при раздражении как ассоциативных,
так неспецифических ядер таламуса. Дезорганизация альфа-ритма - нерегулярность
частоты, изменение формы волн, рост амплитуды и нарушение пространственного
распределения по коре мозга, возникают при поражении зрительного бугра.
Редукция (ослабление) альфа-активности - уменьшение индекса, амплитуды колебаний,
замедление ритма, обычно сопутствует локальным или диффузным поражениям самой
коры больших полушарий, а также негрубым поражениям различных уровней ствола
мозга. Наряду с этим известен феномен "альфа-комы" - наличия
сохранной альфа-активности при коматозных состояниях с летальным исходом,
связанных с грубыми поражениями ствола мозга на понто-мезенцефальном уровне.
Бета-ритм с частотой 14-40 Гц и амплитудой до 15 мкВ
является ведущим ритмом активного бодрствования и лучше всего регистрируется в
области передних центральных извилин, однако распространяется и на задние
центральные и лобные извилины. Бета-ритм связан с соматическими, сенсорными и
двигательными корковыми механизмами и даёт реакцию на двигательную активацию
или тактильную стимуляцию. При выполнении или даже умственном представлении
движения бета-ритм исчезает в зоне соответствующей корковой проекции. Различают
два диапазона бета-ритма: β1 с частотой 14-18 Гц и β2 с частотой 18-40 Гц. Обычно бета-ритм выражен достаточно слабо
(3-7 мкВ) и может маскироваться шумами и электромиограммой (ЭМГ).
Для здоровых людей в состоянии бодрствования выделяют три
варианта β1:
затылочный, высокоамплитудный, блокируемый при зрительной
стимуляции (его синоним "быстрый вариант альфа-ритма");
центральный, блокируемый контралатерально при сенсомоторных
раздражениях. Этот вариант связан с двигательной деятельностью. У больных с
полушарной, корковой патологией отсутствует на стороне поражения;
диффузный, низкоамплитудный, не изменяющийся ни при каких
раздражениях. У больных эпилепсией β1 этого варианта
усиливается перед спонтанным развитием судорожных припадков. При этом ритм
сначала имеет частоту 24-22 пер/сек, затем замедляется до 18-16 пер/сек,
нередко сопровождаясь в это время появлением комплексов "пик-волна".
Медленные ритмы: тета-ритм с частотой 4-6 Гц и дельта-ритм
с частотой 0,5-3 Гц имеют амплитуду 40-300 мкВ и в нормальном состоянии
характерны для некоторых стадий сна.
Тета-активность доминирует в детском возрасте, пока ещё не
сформирована альфа-активность. У здоровых взрослых людей нерегулярная,
низкоамплитудная тета-активность может сохраняться в передних отделах мозга, не
являясь признаком патологии. Установлена связь тета-активности с эмоциональными
состояниями. Диффузно выраженная тета-активность отмечается у больных с
клиническими признаками поражения диэнцефальной области. В лобных отделах
тета-активность обнаруживается при патологии в области заднечерепной ямки с
воздействием на мозжечок. Перемежающаяся тета-активность в задних отделах мозга
отмечается у больных с психическими нарушениями.
Дельта-активность в норме регистрируется во время
физиологического сна. В патологии она является наиболее характерным признаком
нарушения функционального состояния мозга. Местными факторами, вызывающими
изменения деятельности корковых нейронов с появлением дельта-активности,
являются, главным образом, гипоксия, нарушение метаболизма и дисциркуляции
расстройства в системах ликворообращения и кровообращения. Описано появление
дельта-активности на ЭЭГ в связи с состоянием нижележащих структур мозга, а
именно: фармакологическое блокирование таламуса, раздражение переднего
гипоталамуса, патологические состояния базолатеральных отделов миндалин или
заднего гипоталамуса, поражения в области базальных систем переднего мозга, поражения
мозжечка и других поражений [3].
1.6
Применение ЭЭГ
Диагностика заболеваний. ЭЭГ позволяет судить о
таких свойствах мозга как физиологическая зрелость, функциональное состояние,
наличие очаговых поражений, общемозговых расстройств и их характере. Вследствие
чего, ЭЭГ является основным методом диагностики таких заболеваний человека как
эпилепсия, опухоли мозга и расстройства сна.
Эпилепсия - хроническое заболевание головного мозга,
характеризующееся повторными приступами, которые возникают в результате
чрезмерной нейронной активности и сопровождаются различными клиническими и
параклиническими проявлениями.
С помощью ЭЭГ можно:
установить участки мозга, участвующие в провоцировании
приступов;
следить за динамикой действия лекарственных препаратов;
решить вопрос о прекращении лекарственной терапии.
Расстройство сна - это медицинское состояние, при котором у
человека нарушается естественный цикл сна. Описано около сотни различных видов
расстройств сна, таких как обструктивное апноэ сна (одним из симптомов которого
является храп), бессонница и нарколепсия.
При исследовании сна устанавливают специальные датчики для
длительной регистрации дыхания, движения ног, электроокулограммы (ЭОГ),
электрокардиограммы (ЭКГ), ЭЭГ, ЭМГ, насыщения крови кислородом, уровня углекислого
газа, положения пациента, звука и температуры. Затем эта информация
анализируется врачами-сомнологами и пациенту выдается заключение с
рекомендациями по лечению.
Лечение с помощью биологической обратной связи. ЭЭГ, проводимая обычным
способом (регистрация активности клеток мозга на бумаге), сопровождается
световыми и звуковыми проявлениями. Пациент видит свою ЭЭГ и пробует
воздействовать на ее ритм. Этот процесс выглядит в виде тренировки больного с
целью управления световыми, звуковыми сопровождениями ЭЭГ или меняющимися
изображениями на экран компьютера. Таким способом удается в определенной
степени управлять активностью клеток мозга и воздействовать на некоторые виды
приступов.
Нейрокомпьютерный интерфейс. При намерении совершить
какое-либо действие у человека изменяется электрическая активность
соответствующих зон головного мозга. Эти сигналы снимаются
электроэнцефалографом и в виде цифровых данных поступают в компьютер, где
производится вычисление признаков сигнала, характерных для того или иного
мысленного процесса. Далее набор признаков разделяют по типам, и компьютер
вырабатывает команду, управляющую исполнительным устройством. Пользователь в
режиме реального времени наблюдает за реакцией системы на свое мысленное
действие. Такая система называется нейрокомпьютерным интерфейсом (НКИ).
Подобный интерфейс может найти применение как в клинике для больных с
нарушенным мышечным контролем, так и в повседневной жизни.
1.7
Нестационарность ЭЭГ
Несколько лет назад ученые полагали, что основные изменения
динамики ЭЭГ могут быть изучены на основе вероятностно-статистических
приближений, не принимая во внимание биофизическую природу электрических
процессов коры головного мозга. Главным выводом было, что ЭЭГ может быть
описано с помощью основных стохастических принципов (другими словами с помощью
вероятностных распределений), но только на довольно коротких промежутках
времени (обычно не больше 10 - 20 секунд), так как ЭЭГ оказалась очень
нестационарным процессом. Вариация мощности основных спектральных характеристик
электроэнцефалограммы (для 5 - 10 секундных участков) достигала 50 - 100% [6].
В первых работах, посвященных анализу статистических свойств
ЭЭГ как стохастического процесса, было показано, что распределение амплитудных
значений ЭЭГ соответствует гауссовским параметрам. Это очень важное заключение
для понимания природы суммарной ЭЭГ. В соответствии с центральной предельной
теоремой гауссовские свойства ЭЭГ можно было бы объяснить взаимной
независимостью индивидуальных источников (генераторов) коркового электрического
поля, что разрешало бы в полной мере применение параметрических методов
математической статистики к анализу ЭЭГ сигнала и существенно упрощало бы его
содержательные трактовки. Однако, ряд авторов не подтвердил гауссовскую
структуру ЭЭГ. Причина столь явных противоречий в основном была связана с тем,
что для тестирования авторы использовали фрагменты ЭЭГ разной длительности.
Короткие сегменты ЭЭГ, до 10 с, как правило хорошо аппроксимировались
гауссовским распределением, а более длинные - до 1 мин, обычно не подчинялись
нормальному закону. Можно было предположить, что более продолжительные записи
ЭЭГ отличались тем, что были составлены из отдельных фрагментов, каждый из
которых аппроксимировался своим законом нормального распределения, а в
совокупности - распределение естественно оказывалось не нормальным.
Позднее были получены конкретные данные о зависимости между
соответствием гауссовскому распределению и длиной участка оценивания ЭЭГ.
Оказалось, что при увеличении длительности ЭЭГ от 4-х до 64-х секунд количество
участков соответствующих гауссовскому распределению снижалось от 90 до 20% при
дискретизации ЭЭГ сигнала на частоте Найквиста.
Итак, в попытках оценить базовые статистические параметры ЭЭГ
исследователи в явном виде столкнулись с проблемой, когда свойства даже одно -
двух минутного фрагмента ЭЭГ не соответствуют свойствам составляющих этот
фрагмент коротких участков ЭЭГ записи. Следовательно, суммарные оценки для
неоднородного фрагмента ЭЭГ не могут адекватно отражать содержания нервной
деятельности на анализируемом интервале. Только стационарные участки ЭЭГ
сигнала могут быть подвергнуты обычному статистическому анализу. В этой связи
потребовалось определить и само понятие стационарности в отношении к ЭЭГ.
В узком смысле этому понятию соответствуют такие
процессы, основные моменты n-мерного распределения которых остаются неизменными
во времени при любых n, где n - число последовательных отсчетов ЭЭГ на участке
оценивания. Теоретически каждый такой отсчет имеет свое распределение, которое
проявляется при многократных реализациях тестируемого процесса, генерирующих
целый ансамбль значений для каждого отсчета. Однако на практике для
отслеживания стационарности динамического процесса обычно достаточно
контролировать постоянство во времени математического ожидания, дисперсии и
параметров корреляционной функции для одномерного распределения значений по
каждому отсчету этого процесса. В этом случае можно говорить о стационарности в
широком смысле. В частном случае, когда одинаково нормальными
оказываются все n распределений данного процесса - этот процесс называется гауссовским.
Тем не менее обычно исследователь не имеет возможности
набрать достаточное число синхронных реализаций ЭЭГ для оценивания
статистических моментов по ансамблю реализаций каждого отсчета. Остается
надеяться, что ЭЭГ является так называемым эргодическим процессом, когда
статистические оценки, усредненные по ансамблям реализаций каждого отсчета
совпадают с соответствующими оценками, усредненными по последовательным отсчетам
во времени однократной реализации. Достаточным условием эргодичности процесса
является стремление к нулю модуля функции автокорреляции при увеличении
временного сдвига, что обычно характерно для ЭЭГ сигнала. При этом условии
основные характеристические параметры ЭЭГ сигнала можно вычислить по
совокупности последовательных отсчетов только одной, но достаточно
представительной реализации.
Оценивая подобным образом участки ЭЭГ различной длительности
Макэвен и Андерсон показали, что гауссовость и стационарность соблюдаются
одновременно лишь для 15-20% участков ЭЭГ записи длительностью по 16 с каждый,
а при уменьшении продолжительности этих участков до 4-х секунд указанные
условия выполняются для 70-80% записи ЭЭГ. Если же не учитывать свойство
гауссовости, то можно говорить о стационарности в широком смысле. Этому
критерию отвечают до 70-80% 16-ти сек участков ЭЭГ и до 95% участков ЭЭГ,
длительностью менее 4 с [7]. Таким образом, главный вывод серии работ,
посвященных рутинному статистическому анализу ЭЭГ как стохастического процесса
состоит в том, что ЭЭГ сигнал на обычных интервалах оценивания в десятки секунд
является явно нестационарным процессом, тогда как значительная доля коротких
участков ЭЭГ, в пределах 2-4 с, все же обладает свойством стационарности.
Статистическая неоднородность ЭЭГ сигнала заставляет
исследователей с большой осторожностью относиться к содержательным
интерпретациям суммарных фазово-частотных характеристик. Пользователи систем
картирования ЭЭГ хорошо знают, что, как правило, усредненная на 1-2-х минутной
записи карта корковых электрических потенциалов может иметь мало общего с
последовательными картами, построенными для более дробных участков этой записи.
Даже для наиболее генерализованных реакций коркового
электрического поля, например при реакции десинхронизации ЭЭГ в ответ на
предъявление структурированного зрительного стимула, за хорошо выраженной
картиной трансформации усредненного в пределах 1 мин частотного спектра
скрываются разнородные спектральные перестройки на коротких интервалах
оценивания. Оказалось, что усредненная спектральная картина десинхронизации
складывается за счет статистически значимых однонаправленных изменений спектра
всего для 15-40% 2-х секундных участков ЭЭГ. Следовательно, большинство
коротких участков ЭЭГ на фоне ее тотальной десинхронизации либо вовсе не меняют
свой спектр относительно фона, либо имеют даже противоположные основной
тенденции спектральные сдвиги.
В своей совокупности подобные факты свидетельствует о том,
что динамическая картина ЭЭГ процесса становится отчетливой только при
рассмотрении достаточно коротких его сегментов. Это побудило исследователей к
разработке специализированных методов сегментации ЭЭГ.
1.8 Важность
сегментации в решении задач ЭЭГ
1.8.1
Классификация сна на основе ЭЭГ
В норме уровень функциональной активности мозга определяется
циклом бодрствование - сон, а в состоянии бодрствования дополнительные градации
вносятся интенсивной психической активностью, напряженным вниманием. Этому
состоянию соответствует десинхронизация на ЭЭГ, которая выражается в уменьшении
амплитуды и увеличении частоты ритмов.
Активным бодрствованием определяется состояние
человека, занимающегося какой-либо деятельностью, которая требует высокой
степени внимания. При исследовании ЭЭГ, длительного состояния активного
бодрствования можно добиться, предложив обследуемому решить какую-либо
достаточно сложную, например вычислительную, задачу в уме. В этой
экспериментальной ситуации десинхронизация на ЭЭГ поддерживается достаточно
длительно, однако, как правило, не бывает столь выраженной, как при реакции
активации на одиночный неожиданный стимул.
Расслабленным бодрствованием определяется состояние
обследуемого, покоящегося в удобном кресле или на постели с расслабленной
мускулатурой и закрытыми глазами, не занятого какой-либо специальной физической
или психической активностью. У большинства здоровых взрослых людей, обследуемых
в этом состоянии, на ЭЭГ регистрируется регулярный альфа-ритм максимальной
амплитуды. Этот ритм может изредка прерываться, очевидно, в связи с активностью
за счет собственной психической активности обследуемого. Предъявление в этой
стадии внешних раздражителей вызывает реакцию активации на ЭЭГ.
Организация процесса сна представляет собой
последовательность появления различных стадий сна, циклическая их организация
свидетельствуют о существовании определенной регуляторной системы. Различают
два состояния - фазу медленного и фазу быстрого сна.
Фаза медленного сна (синонимы:
медленноволновой сон, синхронизированный, ортодоксальный) характеризуется
замедленной ритмикой, в частности, появлением в ЭЭГ сонных веретен (сигма-ритм,
веретенообразные комплексы колебаний частотой 12-16 периодов в 1 сек.) и
высокоамплитудной дельта-активностью.
У человека в фазе медленного сна выделяют ряд стадий, характеризующихся
определенной электроэнцефалографической картиной и глубиной сна:
Стадия I, или дремотная стадия, характеризуется
постепенным замещением альфа-ритма на ЭЭГ низкочастотными колебаниями,
появлением низкоамплитудных тета (4-7 Гц) и дельта (1-4 Гц) волн, а также
низкоамплитудной высокочастотной активности. Визуально ЭЭГ может быть расценена
как уплощенная и десинхронизированная с наличием полиморфной низкоамплитудной
активности. Предъявление на этом фоне внешних стимулов может вызвать появление
вспышек высокоамплитудного альфа-ритма. Продолжительность этой стадии обычно
1-7 минут. Медленные колебания появляются к концу этой стадии, амплитуда их не
превышает 75 мкВ. В это же время спонтанно или в ответ на сенсорные стимулы
могут появиться вертексные острые переходные потенциалы, представляющие собой
одиночные или групповые монофазные поверхностно негативные острые волны с
максимумом в области макушки, обычно не превосходящим 200 мкВ. Первая стадия,
особенно ее начало, характеризуется также медленными движениями глаз.
Стадия II, или стадия сонных веретен, характеризуется
появлением сонных веретен - комплексов колебаний частотой 12-16 периодов в
секунду. Продолжительность веретен составляет 0,5-3 с, амплитуда обычно около
50 мкВ. Для этой стадии характерно наличие К-комплексов - двухфазных колебаний
потенциала, часто непосредственно переходящих в сонные веретена. Амплитуда его
максимальна в области макушки, продолжительность не менее 0,5 с. К-комплексы
возникают спонтанно или в ответ на сенсорные стимулы. В этой стадии
эпизодически наблюдаются также вспышки полифазных высокоамплитудных медленных
волн. Медленные движения глаз отсутствуют. Эта картина ЭЭГ соответствует
относительно неглубокой стадии сна.
Стадия III характеризуется увеличением числа регистрируемых
на ЭЭГ дельта-волн (частотой 2 кол/с и менее), занимающих от 20 до 50% эпохи
записи. Критерием отнесения ЭЭГ к третьей стадии является количество медленных
волн амплитудой больше 75 мкВ. В этой стадии часто трудно дифференцировать
К-комплексы от дельта-волн. Сонные веретена могут полностью отсутствовать.
Стадия IV определяется наличием на ЭЭГ дельта-волн
частотой 2 кол/с и менее, амплитудой выше 75 мкВ, занимающих более 50% эпохи
записи ночного сна.
Фаза быстрого сна характеризуется
значительным снижением амплитуды колебаний на ЭЭГ, пилообразными разрядами,
низкоамплитудной быстрой активностью, иногда появлением альфа-ритма, частота
которого снижается на 1-2 кол/с; появлением быстрых движений глаз на ЭОГ,
резким снижением тонуса мышц, регистрируемым на ЭМГ. Фазу быстрого сна еще
называют фазой быстрого движения глаз или REM стадией (Rapid Eye Movements),
или парадоксальным сном.
Появлению эпизода быстрого сна обычно предшествует
"переходная" стадия, в которой имеет место сочетание
электрографических признаков обеих фаз сна. В переходной стадии, составляющей
обычно 1-5% общей длительности сна, наблюдается значительная представленность
вертекс-потенциалов (острые волны амплитудой около 200 мкВ), К-комплексов,
замедленных колебаний, сонных веретен, быстрой ритмики и участков плоской
кривой, появление хаотичных движений глаз.
Для объективного изучения сна и его нарушений используется
полисомнография - метод, включающий параллельную регистрацию ЭЭГ, ЭОГ и ЭМГ.
Эти показатели являются базовыми для идентификации стадий и фаз сна. На
основании анализа этих показателей строится гипнограмма - временной график сна,
отражающая динамику стадий и фаз сна в течение периода регистрации. На рисунке
6 представлен пример гипнограммы, отражающей естественный цикл сна человека.

В естественных условиях сон начинается с фазы медленного сна,
с первой стадии постепенно углубляется до самых глубоких стадий и затем
сменяется фазой быстрого сна. Это составляет цикл сна. В течение ночи у
здоровых лиц наблюдается 4-5 циклов, в среднем повторяющихся через 90-120 мин.
Первый цикл начинается с момента засыпания и заканчивается первым эпизодом
быстрого сна, последующие циклы - от конца предыдущего периода быстрого сна до
окончания следующего эпизода быстрого сна. Длительность эпизодов быстрого сна,
минимальная в первых циклах, к утру постепенно возрастает, в то время как
представленность наиболее глубокого дельта-сна (III и IV стадии вместе),
максимальная в первых 2-3 циклах, уменьшается в последних циклах сна.
Система, разработанная Рейхшаффеном и Келли (R&K) в 1968
году, была первой универсальной и общепринятой системой классификации стадий
сна [8]. Она позволила провести стандартизацию критериев разделения стадий сна
и тем самым дала возможность сравнивать результаты исследований, проведенных в
разных лабораториях и клиниках.
По системе R&K стадиям сна соответствуют следующие
характеристики:
Бодрствование - равномерная альфа активность и
низкоамплитудная смешанная активность;
Стадия 1 "дремотная" - сравнительно
низкоамплитудная смешанная активность на ЭЭГ;
Стадия 2 "легкий сон" - 12-14 Hz сонные веретена и
K-комплексы;
Стадия 3 "глубокий сон" - появление
высокоамплитудной низкочастотной активности;
Стадия 4 "глубокий сон" - преобладание
высокоамплитудной низкочастотной активности;сон "быстрый сон" -
относительно низко амплитудная смешанная активность на ЭЭГ (десинхронизация
ЭЭГ), эпизоды быстрого движения глаз, низкоамплитудная активность на ЭМГ.
Система базируется на том, что для анализа, необходимы записи
с одного канала ЭЭГ (C4/A1 или C3/A2 согласно системе 10-20), двух каналов ЭОГ
и одного канала ЭМГ.
Вся запись делится на сегменты по 30 секунд и для каждого
сегмента рассчитываются основные параметры ритмов: индексы и амплитуды. Индекс
ритма рассчитывается как отношение суммы длительностей отрезков представляющих
ритм к общей длительности сегмента. В качестве амплитуды, характеризующей ритм,
используется максимальная амплитуда данного ритма в сегменте.
Однако сегодня становится очевидным, что система R&K подразумевает
некоторые ограничения. Одно из ограничений - это фиксированная длина сегмента
20 - 30 секунд. А если переход между стадиями случится в середине этого
участка, то эксперту все равно придется выбирать одну из стадий. Другая
проблема данной системы в том, что она была разработана относительно молодых и
здоровых пациентов, в случае обследования пациентов старшего возраста или с
расстройствами сна этот метод может не дать точных результатов. Из-за того, что
анализ должен выполняться человеком, что само по себе требует много времени и
сил, возникает проблема субъективной интерпретации [6]. Поэтому сейчас
исследователи нуждаются в объективных компьютеризированных методах
классификации стадий сна. Для этих целей могут быть использованы классификаторы
на основе нейронных сетей. Для коротких сегментов ЭЭГ рассчитываются
определенные характеристики, например статистические или
спектрально-корреляционные, которые будут идентифицировать конкретный сегмент.
После этого классификатор разделяет все сегменты на заданное количество групп.
Очевидно, что такой анализ применим к ЭЭГ сигналу, но только после его
предварительного сегментирования на участки относительной стационарности. Это,
в свою очередь, привело исследователей к необходимости разработки технологий выделения
так называемых квази-стационарных участков в ЭЭГ сигнале. Первые же позитивные
данные в этом направлении позволили не только указать путь более корректного
оценивания статистических свойств ЭЭГ сигнала, но, что представляется более
важным, - дали первые основания к совершенно новому пониманию организации ЭЭГ
как кусочно-стационарного процесса [9].
.8.2
Фундаментальные исследования работы мозга
Изучению могут подлежать не сами стационарные сегменты, а
моменты перехода от одного сегмента к другому, т.е. моменты резких изменений
характеристик ЭЭГ. Эти моменты могут отражать реакции ЭЭГ на
"переключения” различных систем мозга из одного микросостояния в другое.
Исследуя же синхронность таких переключений в различных отделах коры больших
полушарий с помощью анализа совпадений во времени моментов изменений в
различных отведениях ЭЭГ, можно получать информацию о пространственно-временной
организации различных процессов, идущих в мозге.
Для оценки кооперативности работы различных участков коры
подавляющее большинство исследователей в настоящее время использует когерентный
анализ. Оценки когерентности весьма чувствительны к различным сдвигам
функционального состояния человека, к когнитивным нагрузкам, к
индивидуально-типологическим особенностям, к патологическим сдвигам в работе
мозга и к медикаментозной терапии. Однако когерентный анализ оценивает лишь
линейную статистическую связь динамики биопотенциалов исследуемых областей в
частотной области, которая отнюдь не тождественна их функциональной
связанности.
Отличием подхода изучения синхронности резких изменений ЭЭГ
является предварительное выделение из ЭЭГ информации о функционально важных
"событиях”, синхронность которых затем оценивается. В качестве индикаторов
этих "событий" удобно использовать резкие изменения характеристик
ЭЭГ. Резкое изменение может быть представлено единственной точкой на временной
оси, и это позволяет эффективно анализировать синхронность изменений динамики
потенциалов в пространственно удаленных друг от друга участках коры [10].
2. Постановка
задачи
Целью данной работы является разработка и реализация
программного модуля автоматической сегментации ЭЭГ записи на стационарные
участки для дальнейшего применения результатов сегментации в системах
автоматической классификации стадий сна человека.
В качестве исходных данных используется 8-10 часовая запись
ЭЭГ, полученная во время сна пациента. Для сегментации будут использоваться
данные одного из каналов ЭЭГ.
Сегментация будет производиться на основе двух методов:
непараметрической сегментации и метода фрактальной размерности. Будет
произведена сравнительная оценка работы данных методов.
Метод непараметрической сегментации основан на поиске резких
разладок в нестационарной последовательности.
Метод фрактальной размерности основан на нахождении
коэффициента, характеризующего сложность нестационарной последовательности.
Используемый инструментарий: среда разработки Microsoft
Visual Studio 2003.net с использованием библиотеки MFC.
3.
Математический аппарат
3.1
Стационарный случайный процесс
Важным классом случайных процессов являются стационарные
процессы. Свойство стационарности означает независимость некоторых
характеристик сечений процесса от времени. Конечно, для реальных процессов это
условие весьма ограничительно, однако оно выполняется довольно часто, если
рассматривать процесс на достаточно коротком интервале времени, в течение
которого вероятностные характеристики процесса изменяются мало.
Итак случайный процесс  ,
, 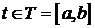 называют стационарным в узком смысле,
если для любых
называют стационарным в узком смысле,
если для любых 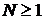 ,
, 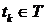 ,
,  и
и 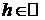 совместное распределение случайных величин одно и то же для всех
совместное распределение случайных величин одно и то же для всех  , таких что,
, таких что, 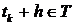 ,
,  . То есть, для функции распределения случайного процесса:
. То есть, для функции распределения случайного процесса:
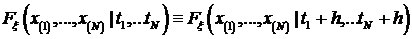
Или, что то же самое, для функции плотности вероятностей
случайного процесса:
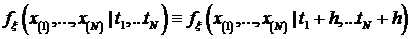
Если стационарный в узком смысле случайный процесс  ,
,  имеет моменты первого и второго порядка, то его математическое
ожидание
имеет моменты первого и второго порядка, то его математическое
ожидание 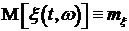 - постоянно, а ковариационная функция
зависит лишь от разности аргументов:
- постоянно, а ковариационная функция
зависит лишь от разности аргументов:

Случайный процесс  ,
,  называется стационарным в широком смысле,
если его математическое ожидание - постоянно, а ковариационная функция зависит
от разности аргументов:
называется стационарным в широком смысле,
если его математическое ожидание - постоянно, а ковариационная функция зависит
от разности аргументов:

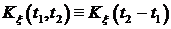
Таким образом из стационарности в узком смысле следует
стационарность в широком смысле.
В той мере, в какой теория случайных процессов отражает явления
реального мира, понятие стационарности случайного процесса отражает идею
неизменности (стационарности) условий, в которых он протекает.
ЭЭГ является нестационарным процессом, но короткие ее сегменты по
отдельности могут считаться стационарными. То есть можно ввести математическую
модель электроэнцефалограммы, как объединение реализаций набора стационарных
случайных процессов.
3.2 Алгоритмы
сегментации ЭЭГ
3.2.1 Метод
фиксированных интервалов
В принципе, если длительность минимального участка
стационарности составляет, как правило, не менее 2 секунд, то процедура
сегментации ЭЭГ сигнала на квази-стационарные фрагменты могла бы состоять из
четырех этапов. На первом этапе запись ЭЭГ предварительно разбивается на равные
элементарные участки длительностью 2 с. Затем каждый из этих участков получает
статистическое описание, состоящее из некоторого набора признаков, например,
спектральных оценок. На третьем этапе элементарные участки ЭЭГ классифицируются
в соответствии со своими признаками одним из методов многомерной статистики,
получая каждый свое классификационное наименование. Наконец, на четвертом этапе
"стираются" границы между одноименными элементарными участками, что
превращает всю запись ЭЭГ в последовательность сегментов, в рамках которых
параметры ЭЭГ остаются относительно постоянными. Каждый такой
квази-стационарный сегмент будет отличаться конкретной длительностью и
соответствующими типовыми признаками. Если число сегментных классов в реальной
ЭЭГ окажется не слишком большим, то идея о кусочно-стационарной организации ЭЭГ
получит явное преимущество перед своей альтернативой - изначальным пониманием
ЭЭГ как континуального процесса.
Именно такой подход с предварительным разбиением записи ЭЭГ
на равные участки (fixed-interval segmentation) использовали в первых работах
по сегментации ЭЭГ [11,12]. Количество типовых сегментов ЭЭГ действительно
оказалось весьма ограниченным - для разных ЭЭГ не более 15-35 [12], а
длительность большинства сегментов не превышала 4 с, что явно свидетельствовало
в пользу идеи о кусочно-стационарном устройстве ЭЭГ. Однако существенным
недостатком метода сегментации с предварительным разбиением ЭЭГ на элементарные
участки равной длительности было то, что какая-то часть из этих участков
обязательно должна была прийтись на "стыки" между стационарными
сегментами ЭЭГ. Это приводило к появлению целого кластера фрагментов ЭЭГ, содержащих
в себе переходные процессы, и потому не являющихся собственно стационарными
сегментами. Кроме того, границы между стационарными сегментами определялись,
таким образом, достаточно приблизительно, с точностью не менее величины
интервала фиксированного разбиения ЭЭГ.
Чтобы избежать появления подобного рода погрешностей в поиске
квази-стационарных участков ЭЭГ, требовалась такая технология сегментации,
которая включала бы в себя последовательный перебор возможных расстановок
межсегментных границ с выбором оптимального варианта. Эта методология была
названа адаптивной сегментацией.
3.2.2
Параметрическая сегментация
В самом общем виде процедура адаптивной сегментации могла бы
основываться на оценивании степени сходства начального фиксированного участка
ЭЭГ с фрагментом ЭЭГ той же длительности, рассматриваемом в движущемся вдоль
ЭЭГ записи временном "окне". Очевидно, что как только это окно
"наедет" на границу сегментов, контролируемая степень сходства резко
уменьшится, и это будет формальным признаком перехода к следующему сегменту.
По-видимому, наиболее адекватными этой задаче могут быть
методы, позволяющие прогнозировать очередные отсчеты ЭЭГ по результатам
оценивания ряда предыдущих отсчетов. Момент рассогласования между предсказанным
и реальным текущим отсчетом ЭЭГ вполне мог бы свидетельствовать о появлении
локальной нестационарности.
Методы прогнозирования временных рядов основываются на
предположении о том, что стохастичность их поведения в значительной мере
ограничена какими-то динамическими закономерностями. В таком случае, если
удастся подобрать отвечающие этим закономерностям математические модели, то с
известной точностью поведение кривой ЭЭГ действительно можно будет
предсказывать на какое-то количество отсчетов вперед. За пределами
стационарного сегмента, для которого были подобраны параметры модели, ошибка
предсказания резко возрастет, сигнализируя тем самым о завершении предыдущего и
начале нового сегмента. Для начального участка очередного сегмента можно
вычислить новые параметры модели и продолжить поиск границы со следующим
сегментом. Ключевым звеном в поиске межсегментных переходов становятся, таким
образом, параметры математической модели ЭЭГ. Очень важным поэтому является
правильный выбор модели ЭЭГ.
Наиболее разработанным способом моделирования ЭЭГ является
метод линейной экстраполяции, разработанный еще в 1942 г.Н. Винером как
приложение авторегрессионного анализа и впервые предложенный для тестирования
ЭЭГ в конце 60-х годов. В рамках авторегрессионной модели очередной отсчет ЭЭГ
может быть вычислен с некоторой погрешностью как сумма нескольких предыдущих
отсчетов, взятых с определенными коэффициентами. Базовые процедуры адаптивной
сегментации ЭЭГ, основанные на авторегрессионных моделях невысокого порядка,
первоначально были разработаны Боденштайном и Преториусом [13] и в дальнейшем
успешно использовались в различных модификациях другими авторами.
В этих работах авторы обнаружили еще более ограниченный, чем
при сегментации методом фиксированных интервалов, набор типовых сегментов.
Длина квази-стационарного сегмента по данным этих авторов варьирует в основном
в пределах от 1 - 2 до 20 секунд, а количество типов этих сегментов по разным
оценкам составляет от 6 до 50. Применение к ЭЭГ множественного регрессионного
анализа с вычислением вклада каждого из нескольких параметров модели позволило
более тщательно проводить процедуру сегментации. Этим методом авторы могли
детектировать сегменты ЭЭГ, соответствующие определенным когнитивным операциям.
В этой работе было также показано, что длительность большинства
квази-стационарных сегментов ЭЭГ составляла 2 - 10 с. Несмотря на тщательность
алгоритмической проработки, методы сегментации ЭЭГ на основе регрессионного
анализа в конечном итоге оперируют эмпирически подобранными пороговыми
критериями. Это обстоятельство значительно ограничивает возможность
исследователей не только при сравнении межиндивидуальных данных, но и при
сопоставлении результатов сегментирования ЭЭГ различных отведений у одного и
того же испытуемого.
Помимо неизбежной эмпирической заданности пороговый критерий
сегментации ЭЭГ в рассмотренных методах имеет еще один, более глубокий,
недостаток - отсутствие адаптивности к меняющимся параметрам ЭЭГ процесса. В
этой связи для математического описания ЭЭГ можно было бы применить
авторегрессионную модель с зависимыми от времени параметрами, апробированную в
исследованиях с распознаванием речевых сигналов. Такие попытки были сделаны и в
отношении ЭЭГ. Однако отсутствие априорной заданности закона изменения
параметров во времени требовало построения дополнительной модели, что в общем
случае должно было привести к накоплению еще больших погрешностей.
Последнее ограничение в определенной мере снималось в работе
[14], в которой для поиска межсегментных границ также учитывались все отсчеты
тестируемой ЭЭГ. На основе байесовского подхода авторы вычисляли наиболее
вероятную расстановку моментов множественных стыковок сегментов сразу по всей
длине записи ЭЭГ. Совмещая этот тип сегментации с авторегрессионным подходом,
авторы добились весьма точного, с экспертной точки зрения, разбиения ЭЭГ на
квази-стационарные сегменты. При этом с помощью одного из параметров алгоритма
сегментации можно было ограничивать число расчетных межсегментных стыковок в
записи ЭЭГ, что, по сути дела, позволяло проводить сегментацию с большим или
меньшим временным разрешением, тестируя иерархию субсегментных отношений в
различных временных масштабах. Авторы, однако, не оценили эту сторону
разработанной ими технологии сегментирования ЭЭГ. К тому же, отмечаемая самими
авторами вычислительная сложность предложенного подхода делает его практически
приемлемым только для очень коротких, не более нескольких секунд, фрагментов
ЭЭГ записи [14].
В целом, рассмотренный круг методов адаптивной сегментации
ЭЭГ на основе параметрического подхода, в принципе, позволяет более или менее
адекватно описать кусочно-стационарную структуру ЭЭГ сигнала. Однако указанный
принцип состоит в том, что все эти методы, изначально нацеленные на поиск
квази-стационарных участков, по определению сами могут применяться только для
стационарных процессов. Действительно, в основе этих, так называемых,
параметрических методов лежит предварительное построение математической модели,
например авторегрессионной, в референтном окне на начальном участке ЭЭГ.
Очевидно, что получить достаточно точную модель процесса можно только на его
стационарном участке. Причем, чем более длинным будет этот участок, тем более
тонкие особенности процесса могут быть отражены в его модели. Но, чем длиннее
анализируемый отрезок реальной ЭЭГ, тем более вероятным становится, что этот
отрезок окажется неоднородным. Если же модель строить на очень коротком
участке, то она окажется сильно "загрубленной", и тогда нельзя будет
надеяться на качественную сегментацию процесса с использованием параметров этой
модели.
Таким образом, параметрические методы поиска
квази-стационарных участков ЭЭГ содержат в себе довольно сильное противоречие:
сегментирование на стационарные фрагменты невозможно без построения адекватной
математической модели, а построить такую модель нельзя без предварительного
сегментирования.
Более того, поскольку суммарная ЭЭГ является высоко
композитным и существенно нелинейным процессом, вряд ли возможно ожидать
разработки строгой математической модели, адекватно отражающей собственно
природу ЭЭГ. Поэтому параметры даже хорошо подобранных моделей ЭЭГ, не являясь
отражением сути лежащих в основе ЭЭГ процессов, в любом случае существенно
"загрубляют" процедуру сегментации ЭЭГ сигнала.
Вот почему несомненный интерес представляет разработка
непараметрических методов сегментирования ЭЭГ. Применение этих методов не
требует предварительного анализа процесса на стационарность, поскольку они не
сопряжены с построением математических моделей анализируемого процесса, но
основываются на реальных его статистических характеристиках.
3.2.3
Непараметрическая сегментация
Технология непараметрической сегментации ЭЭГ была разработана
на основе теории так называемого анализа моментов резких изменений или разладок
во временных рядах, имеющих четко выраженную кусочно-стационарную структуру.
Определенные таким образом разладки являются, по сути дела, метками границ
между квази-стационарными фрагментами. В рамках теоретической разработки этой
проблемы было показано, что задача обнаружения изменения любой вероятностной
характеристики данного стохастического процесса может быть сведена к одному и
тому же алгоритму детекции изменений математического ожидания, но применяемому
к различным модификациям исходного временного ряда. Каждая такая модификация
или диагностическая последовательность может подчеркивать те или иные
статистические особенности исходного процесса. Например, корреляционное
преобразование исходного временного ряда проявит динамическую изменчивость
дисперсионных свойств этого процесса.
При адаптации этой методологии к задаче сегментирования ЭЭГ
была разработана специальная статистическая процедура для обнаружения моментов
"разладок", основанная на обобщенном варианте статистики
Колмогорова-Смирнова [15, 16]. Использование этих критериев в технике
сегментирования ЭЭГ с учетом их вероятностных распределений, полученных в
численном эксперименте на ЭЭГ подобных кривых, впервые позволило не только
надежно обнаруживать границы сегментов, но и оценивать доверительные интервалы
их позиционирования в рамках тестируемого фрагмента ЭЭГ [16]. В ходе адаптации
методов обнаружения разладок для целей сегментирования ЭЭГ было показано, что в
качестве диагностической последовательности целесообразно использовать
нормированную автокорреляционную функцию ЭЭГ сигнала [15, 16].
Конкретный алгоритм поиска разладок в ЭЭГ был разработан, в
том числе, и с намерением оценить всю иерархию сегментных описаний ЭЭГ в разных
временных масштабах. Для этого, во-первых, была принята безоконная система
компарации оценок ЭЭГ, позволяющая при поиске неоднородностей учитывать всю
запись целиком: сравнение оценок математического ожидания сигнала или его
диагностической последовательности проводилось слева и справа от движущейся
вдоль записи ЭЭГ точки ее деления на две части. Во-вторых, для более точного
вычисления порогового критерия, фиксирование разладок производилось поэтапно:
сначала обнаруживалась самая мощная разладка, ставящая границу между двумя
наиболее крупными сегментами ЭЭГ записи. Затем процедура повторялась, но уже не
для всей записи, а для более однородных ее участков по обе стороны от первой
разладки. Относительно разладок второго уровня также формировались еще более
однородные участки, которые в свою очередь подвергались поточечному
сканированию, и так до того момента, когда количество отсчетов очередного
участка ЭЭГ не достигнет порога, ниже которого оценки математического ожидания
в данном методе становятся статистически неустойчивыми.
Поскольку при любой технологии поиска моментов физических
перестроек в ЭЭГ результаты этого поиска могут быть получены только в
вероятностных оценках, существенным преимуществом данного подхода является
возможность задавать в явном виде вероятность "ложной тревоги"
(детекция отсутствующего сигнала) и "ложного спокойствия" (пропуск
имеющегося сигнала) при детектировании границ сегментов. Помимо возможности
гибкой оптимизации задачи обнаружения границ сегментов с точки зрения
экспериментатора, это позволяет настраивать процедуру на работу в разных
временных шкалах. Поднимая пороговый уровень "ложных тревог", например,
можно настроиться только на наиболее выраженные межсегментные переходы,
оценивая, таким образом, только макроскопическую сегментную структуру ЭЭГ. При
снижении порога "ложных тревог" можно получить более детальную
"микроскопическую" картину сегментной организации ЭЭГ.
Методология непараметрического анализа основана на двух
идеях. Доказано, что определение изменений в любой функции распределения или
вероятностной характеристике может быть сведено (с любой степенью точности) к
определению изменений в математическом ожидании какой-либо другой
последовательности, сформированной из первоначальной. Новую последовательность
будем называть диагностической последовательностью. Например, рассматривая
автокорреляционные функции
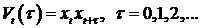
мы сведем задачу к определению изменений в одной из
последовательностей 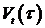 . Изменения в автокорреляционных значениях
соответствуют изменениям в спектрах мощности, так как спектр мощности равен
преобразованию Фурье автокорреляционной функции. В частности
. Изменения в автокорреляционных значениях
соответствуют изменениям в спектрах мощности, так как спектр мощности равен
преобразованию Фурье автокорреляционной функции. В частности 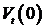 идентично полной мощности (по теореме
Парсеваля).
идентично полной мощности (по теореме
Парсеваля).
Вторая идея подхода - это использование следующего семейства
статистик:
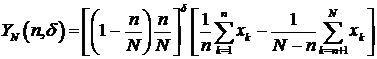
Где  ,
, 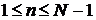 ,
,  - реализация диагностической
последовательности. N - количество отсчетов в этой последовательности (в нашем
случае во всей записи ЭЭГ). Это семейство статистик - обобщенный вариант
статистики Колмогорова-Смирнова, которая используется для изучения совпадений
или различий в функциях распределения двух последовательностей (фиксированного
размера n). Другими словами мы рассчитываем разницу между средним значением
первых n отсчетов и последних N-n отсчетов, умноженную на коэффициент в
зависимости от
- реализация диагностической
последовательности. N - количество отсчетов в этой последовательности (в нашем
случае во всей записи ЭЭГ). Это семейство статистик - обобщенный вариант
статистики Колмогорова-Смирнова, которая используется для изучения совпадений
или различий в функциях распределения двух последовательностей (фиксированного
размера n). Другими словами мы рассчитываем разницу между средним значением
первых n отсчетов и последних N-n отсчетов, умноженную на коэффициент в
зависимости от 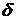 . Это вычисление проводится для всех n:
. Это вычисление проводится для всех n: 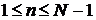 . Затем мы сравниваем максимум из этих n
разностей со специальным порогом. Порог рассчитывается на основе предельных
характеристик статистики (при
. Затем мы сравниваем максимум из этих n
разностей со специальным порогом. Порог рассчитывается на основе предельных
характеристик статистики (при 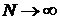 ). Мы принимаем решение о стационарности реализации ЭЭГ если этот
порог не достигнут, в противном случае считаем эту точку границей стационарных
сегментов.
). Мы принимаем решение о стационарности реализации ЭЭГ если этот
порог не достигнут, в противном случае считаем эту точку границей стационарных
сегментов.
Метод может характеризоваться с помощью таких величин, как
вероятность ложной тревоги (вероятность принятия решения о наличии границы,
когда ее на самом деле нет), вероятность ложного спокойствия (вероятность того,
что мы не заметим границу там, где она есть на самом деле) и временная
погрешность границы сегментов. Для данной статистики эти величины являются
функциями, зависящим от 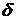 . Важное свойство используемой статистики
заключается в том, что случай
. Важное свойство используемой статистики
заключается в том, что случай 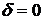 обеспечивает минимум вероятности ложной тревоги, с другой стороны
случай
обеспечивает минимум вероятности ложной тревоги, с другой стороны
случай 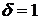 соответствует минимуму вероятности
ложного спокойствия и случай
соответствует минимуму вероятности
ложного спокойствия и случай  обеспечивает минимальную временную погрешность границ сегментов.
обеспечивает минимальную временную погрешность границ сегментов.
Главным параметром, который должен определить пользователь для
вычисления сегментации, является вероятность ложной тревоги. Чем меньше эта
вероятность, тем больше порог и тем более сильные изменения статистики будут
замечены. Корректируя вероятность ложной тревоги, можно фокусироваться либо на
изучении макроструктуры ЭЭГ (высокий порог), либо микроструктуры (низкий
порог).
Данный метод сегментации состоит из 3 этапов.
1 этап. На
первом этапе задается вероятность ложной тревоги максимальной 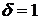 , т.е. нужно обнаружить все точки, в
которых возможно изменение стационарности, включая те точки, которые могут быть
ложными.
, т.е. нужно обнаружить все точки, в
которых возможно изменение стационарности, включая те точки, которые могут быть
ложными.
Формируем диагностическую последовательность, состоящую из
автокорреляционных значений ЭЭГ данных:
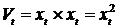
Затем вычисляется статистика для данной последовательности и
находится  и порог C. Если
и порог C. Если  , то можно считать последовательность
стационарной, в противном случае мы нашли точку нестационарности и получили 2
участка исходной последовательности, для которых заново находим статистику и
порог, и повторяем процедуру проверки стационарности. Продолжаем вычисления
рекурсивно, пока не получим набор стационарных сегментов.
, то можно считать последовательность
стационарной, в противном случае мы нашли точку нестационарности и получили 2
участка исходной последовательности, для которых заново находим статистику и
порог, и повторяем процедуру проверки стационарности. Продолжаем вычисления
рекурсивно, пока не получим набор стационарных сегментов.
Порог рассчитывается на основе предельной теоремы в зависимости от
данной вероятности ложной тревоги. Доказано, что для стационарных
последовательностей вероятность 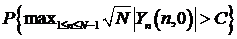 стремится к значению
стремится к значению 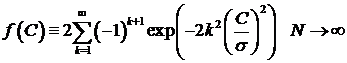 , где
, где 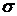 - дисперсия последовательности [19].
- дисперсия последовательности [19].
2 этап. На
данном этапе нужно отбросить сомнительные точки, найденные на 1 этапе. Пусть на
1 этапе было найдено k точек нестационарности. Тогда формируем k новых
отрезков.

Где  ,
, 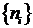 - набор точек нестационарностей (номера отсчетов).
- набор точек нестационарностей (номера отсчетов).
Таким образом, получаем набор предположительно нестационарных
сегментов 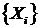 с центрами в точках
с центрами в точках  . Для каждого сегмента вычисляется
статистика с меньшей вероятностью ложной тревоги (более точный результат),
порог C и проверятся действительно ли сегмент является нестационарным. Если
нет, то данный сегмент исключается из дальнейшего рассмотрения.
. Для каждого сегмента вычисляется
статистика с меньшей вероятностью ложной тревоги (более точный результат),
порог C и проверятся действительно ли сегмент является нестационарным. Если
нет, то данный сегмент исключается из дальнейшего рассмотрения.
Так как границы сегмента формируется половиной расстояний до
ближайших точек нестационарности, сегмент получается более коротким, чем
изначальный сегмент 1 этапа, на котором  была максимумом и вычисленная статистика должна дать более точный
результат.
была максимумом и вычисленная статистика должна дать более точный
результат.
3 этап. На
данном этапе рассматриваются только те сегменты  , которые остались после 2 этапа. Для них рассчитывается
статистика с вероятностью ложной тревоги
, которые остались после 2 этапа. Для них рассчитывается
статистика с вероятностью ложной тревоги 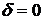 (самый точный случай). Так как на 2 этапе мы уже было выяснено,
что данные сегменты нестационарны, то сейчас не нужно находить порог и
сравнивать максимум статистики с ним. Просто находим максимум статистики для
каждого сегмента и считаем эту точку окончательным вариантом точки
нестационарности.
(самый точный случай). Так как на 2 этапе мы уже было выяснено,
что данные сегменты нестационарны, то сейчас не нужно находить порог и
сравнивать максимум статистики с ним. Просто находим максимум статистики для
каждого сегмента и считаем эту точку окончательным вариантом точки
нестационарности.
3.2.4 Метод
фрактальной размерности
Понятие фрактальная размерность было введено как индекс,
описывающий сложность временной последовательности. Фрактальная кривая обладает
следующим свойством: каждая часть этой кривой может быть рассмотрена, как
уменьшенный в масштабе образ целой кривой. Другими словами спектральная
характеристика подчиняется одному закону по всем диапазонам частот. Фрактальная
размерность определяется напрямую из временной последовательности - без перевода
ее в фазовую область. Так как эта размерность описывает сложность кривой, то
значения ее варьируются от 1 до 2.1 - это прямая линия (одномерное
пространство), 2 - это плоскость (двумерное пространство). То есть чем сильнее
меняется временная последовательность, тем больше фрактальная размерность [18].
В случае реальных нестационарных временных
последовательностей статистические характеристики могут зависеть от выбранного
временного масштаба, то есть вся последовательность может не подходить под
определение фрактальной кривой. Тем не менее можно определять размерность не на
целой последовательности, а по частям, на которых условие фрактальной кривой
выполняется. Усовершенствованный метод нахождения фрактальной размерности был
предложен Т. Хигучи в 1988г. Особая ценность метода в том, что для него не
нужно большой длины последовательности, что важно в таких случаях, как изучение
различных природных процессов [17]. Рассмотрим последовательность наблюдений,
выполненных через равные промежутки времени:

Из данной последовательности создадим новые 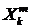 последовательности, определенные
следующим образом:
последовательности, определенные
следующим образом:
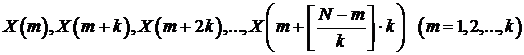
Где 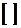 - целая часть от числа, а m и k
- целые числа, определяющие начальный отсчет и временной интервал
соответственно. Для временного интервала равного k мы получим k
новых временных последовательностей.
- целая часть от числа, а m и k
- целые числа, определяющие начальный отсчет и временной интервал
соответственно. Для временного интервала равного k мы получим k
новых временных последовательностей.
Пример. В случае k = 3 и количестве точек N = 100
получим 3 подпоследовательности:
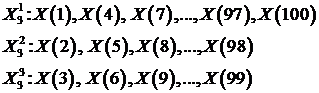
Далее нужно определить длину каждой кривой, соответствующей
подпоследовательностям 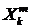 по формуле:
по формуле:

Где
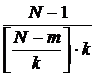 - нормализующий множитель для длин подпоследовательностей. Чтобы
определить длину последовательности для временного интервала k берем
среднее значение длин подпоследовательностей:
- нормализующий множитель для длин подпоследовательностей. Чтобы
определить длину последовательности для временного интервала k берем
среднее значение длин подпоследовательностей:
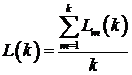
Если выполняется следующий закон:
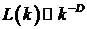
то можно сказать, что кривая фрактальна с размерностью D.
Если построить график  в логарифмической системе координат точки
должны образовать прямую линию с коэффициентом наклона - D, который
находим методом наименьших квадратов:
в логарифмической системе координат точки
должны образовать прямую линию с коэффициентом наклона - D, который
находим методом наименьших квадратов:
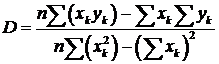
где  ,
, 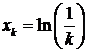 ,
,  , n - количество различных значений
k, для которых была посчитана L [18].
, n - количество различных значений
k, для которых была посчитана L [18].
Для сегментации ЭЭГ на стационарные участки разделим всю запись на
короткие участки (1-5 сек) и найдем фрактальную размерность каждого участка.
Далее стираем границы между соседними сегментами с "равными"
фрактальными размерностями, в результате этого получаем разбиение на
стационарные сегменты.
4. Результаты
4.1 Описание
модуля
В ходе работы был создан программный модуль, осуществляющий
сегментацию ЭЭГ непараметрическим методом, методом фрактальной размерности и на
сегменты равной длины, расчет фрактальной размерности для сегментов заданной
длины, расчет амплитуды спектров заданных частот для рассчитанной сегментации,
построение гипнограммы ручным способом, а также автоматически: по средним
значениям фрактальной размерности и с помощью нейросетевого классификатора
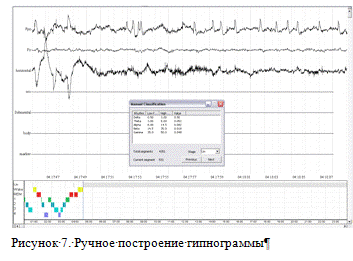
(реализованного ранее на основе скрытых моделей Маркова). Общий вид программы
представлен на рисунке 7. В верхней половине экрана отображается запись
электроэнцефалограммы, далее представлен пример рассчитанной гипнограммы, затем
график фрактальной размерности и последние 3 графика - мощности спектров,
выбранных диапазонов частот.
Для сегментации ручным способом пользователю необходимо
задать длину сегмента. Для сегментации непараметрическим методом необходимо
задать вероятность обнаружения границ сегментов. А для сегментации с помощью
фрактальной размерности нужно предварительно посчитать эту размерность для
сегментов указанной длины.
При наличии сегментации можно посчитать амплитуды спектров
для полученных сегментов. Для этого пользователю необходимо указать границы
частот, для которых будут рассчитываться спектры.
Для ручного построения гипнограммы достаточно рассчитать
сегментацию. При наличии рассчитанных амплитудных спектров в специальном окне
указываются их величины для текущего сегмента. Это позволяет пользователю
точнее определить текущую стадию сна (рис.7).
Для построения гипнограммы по средним значениям фрактальной
размерности необходимо посчитать размерность и просегментировать запись ЭЭГ по
полученным результатам.
Для применения нейросетевого классификатора при построении
гипнограммы нужно провести сегментацию и рассчитать амплитудные спектры для
данных сегментов, так как на основе значений амплитуд классификатор ведет
разбиение по группам.
4.2Метод
фрактальной размерности
Результаты
сегментации. В начале
приведем пример нестационарного сегмента ЭЭГ и его спектра, полученного с
помощью быстрого преобразования Фурье. Возьмем 4 минутный участок ЭЭГ с
частотой дискретизации 100 Гц (рис.8).

Рисунок 8. Участок ЭЭГ, 240 сек, 100 Гц
Это пример является иллюстрацией неэффективности применения
спектрального анализа к нестационарным процессам, в данном случае
преобразование Фурье не позволит определить точно присутствующие частоты
(рис.9).
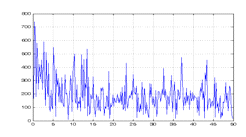
Рисунок 9. Преобразование Фурье нестационарного участка ЭЭГ
на рис. 9
Разделим запись ЭЭГ на короткие участки и найдем для каждого
фрактальную размерность. Например, для записи ЭЭГ длиной в 24 часа (цикл
бодрствование - сон - бодрствование) и длиной изначальных сегментов в 30 секунд
получим следующий результат (рис.11).
В ходе работы были проведены исследования клинических
гипнограмм и выявлены следующие средние значения фрактальной размерности,
соответствующие 6 классическим стадиям сна:
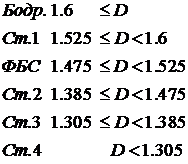
На рисунке 11 определенным цветом представлены области,
соответствующие найденным средним значениям для стадий сна. Желтый цвет -
область бодрствования, зеленый - 1-я стадия, красный - фаза быстрого сна, синий
- 2-я стадия, голубой - 3-я стадия и фиолетовый - 4-я стадия сна.
На следующем этапе у соседних сегментов, значения фрактальной
размерности которых попадает в одну и ту же область, сотрем границы. В
результате получим сегментацию ЭЭГ записи на участки, в пределах которых
фрактальная размерность принадлежит определенной стадии.
Для полученной сегментации создадим гипнограмму и присвоим
сегментам последовательно значения от 1 до 4 стадии, с помощью этого сможем
посмотреть на границы сегментов и сравнить их с гипнограммой, построенной
экспертом (рис.11).
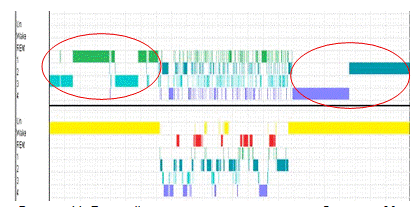
Рисунок 11. Верхний рисунок - сегментация при разбиении по 30
сек. Нижний рисунок - гипнограмма эксперта
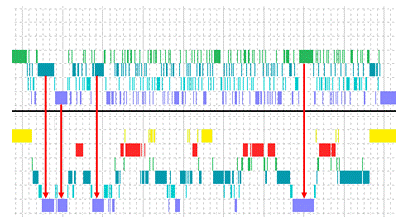
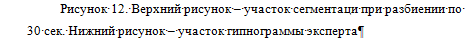
Разбиение производилось по 30 сек участкам 24 ч записи.
Количество сегментов в данном примере составило 467. Хорошо определились
участки бодрствования - им соответствуют большие сегменты (на рис.12 помечены
красным). Это удобно для использования классификатора, обработка большого
участка, представляющего один сегмент, займет гораздо меньше времени, чем если
бы он был разбит на множество сегментов (равномерная сегментация).
Если рассмотреть полученную сегментацию без участков
бодрствования, то очевидно, что также хорошо определились сегменты, находящиеся
в 4-й стадии (рис.12, сегменты помечены красными стрелками).
Рисунок 12. Верхний рисунок - участок сегментаци при
разбиении по 30 сек. Нижний рисунок - участок гипнограммы эксперта
Для подтверждения стационарности полученных сегментов
произведем расчет преобразования Фурье для нескольких сегментов. На рисунке 13
изображен спектр сегмента, соответствующего 4 стадии сна. Для этой стадии характерны
дельта-волны частотой 0 - 5 Гц.
На рисунке ясно видно, что основные частоты лежат в пределах
дельта-ритма.
Это подтверждает, что сегмент является стационарным.
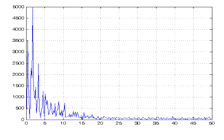
Рисунок 13. Преобразование Фурье стационарного сегмента для 4
стадии сна
На
рисунке 14 изображен спектр сегмента, соответствующего стадии бодрствования.
Для этой стадии характерно преобладание альфа-волн частотой 8 - 13 Гц. На
рисунке 15 ясно видно преобладание этих частот.
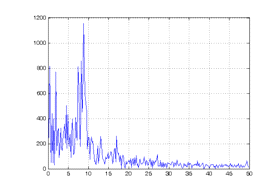
Рисунок 14. Преобразование Фурье стационарного сегмента для
стадии бодр.
Влияние
длины изначальных сегментов на сегментацию
Исследуем как влияет уменьшение длины изначальных участков на
результаты сегментации.
Произведем разбиение по 10 сек. участкам 24 ч записи.
Количество сегментов возросло до 1642. По-прежнему хорошо выделенными остались
участки бодрствования и 4 стадии.

Рисунок 15. Верхний рисунок - сегментация при разбиении по 10
сек. Нижний рисунок - гипнограмма эксперта
Разбиение по 5 сек. участкам 24 ч записи приводит к
увеличению количества сегментов до 3732.
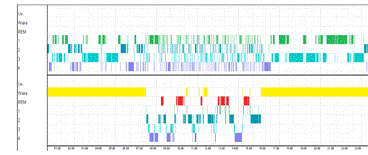
Рисунок 16. Верхний рисунок - сегментация при разбиении по 5
сек. Нижний рисунок - гипнограмма эксперта
Результат имеет сходство с предыдущими, отличаясь только
количеством сегментов, что влияет на значимость изменений в ЭЭГ, которые нужно
заметить. Если важны только сильные изменения, например, для определения, в
какие моменты человек спал, а в какие нет, то не нужно изначально разбивать
запись на слишком короткие участки. А если же интерес представляет
микроструктура ЭЭГ, то нужно разделить изначально на более мелкие участки,
тогда будут заметны и более слабые изменения в электроэнцефалограмме.
4.2.3 Построение
гипнограммы
С помощью метода фрактальной размерности можно не только
сегментировать ЭЭГ на стационарные участки, но и построить саму гипнограмму,
используя найденные средние значения фрактальной размерности, соответствующие
стадиям сна. Для этого каждому полученному сегменту определим стадию в
соответствие с фрактальной размерностью данного сегмента.
В нашем распоряжении имеются гипнограммы, построенные
экспертом для сегментов равной длины в 30 секунд. Посчитаем фрактальную
размерность для сегментов в 30 секунд, определим для каждого соответствующую
стадию и сравним полученную гипнограмму с экспертной.
Пример 1. Результаты классификации отображены на рисунке 17.
Процент совпадений по стадиям составил 83%. На рисунке хорошо видно, что
гипнограммы имеют сходную структуру. Рассмотрим гипнограммы без учета стадии
бодрствования (рис. 18) и пересчитаем процент совпадений. Точность снизилась до
60%. Это обусловлено тем, что большой вклад вносила стадия бодрствования,
которая занимала 2/3 времени и имела большой процент совпадений.
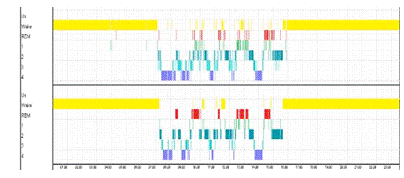
Рисунок 17. Верхняя гипнограмма построена по средним
значениям фрактальной размерности. Нижняя построена экспертом. Точность 83%
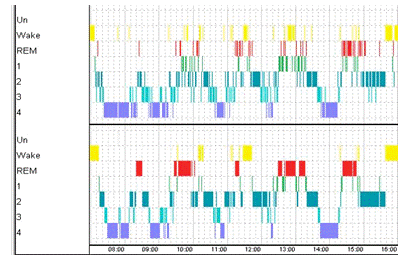
Рисунок 18. Верхняя гипнограмма построена по средним
значениям фрактальной размерности. Нижняя построена экспертом. Точность 60%
Рассмотрим процент совпадений по стадиям. Для этого составим
таблицу, в которой строчки будут представлять собой процентное соотношение
определения компьютером конкретной стадии. Например, ячейка, являющаяся
пересечением 1-й строки и 3-го столбца, означает, что стадию бодрствования
эксперта компьютер в 1.4% случаев признал второй стадией. Таким образом по
диагонали таблицы будут значения совпадений конкретных стадий. Таблицу следует
читать только по строкам.
Табл.1. Проценты совпадений по стадиям.
|
Комп. Эксп.
|
Бодр.
|
Ст.1
|
Ст.2
|
Ст.3
|
Ст.4
|
ФБС
|
|
Бодр.
|
91
|
5
|
1,4
|
0
|
0,1
|
2,5
|
|
Ст.1
|
0
|
1,6
|
72,8
|
6,7
|
0
|
18,6
|
|
Ст.2
|
0
|
0,3
|
33,5
|
61,4
|
4,3
|
0,5
|
|
Ст.3
|
0
|
0
|
2,1
|
39,4
|
58,5
|
0
|
|
Ст.4
|
0
|
0
|
0,9
|
3,4
|
95,5
|
0
|
|
ФБС
|
0
|
6,5
|
48,8
|
1,8
|
0
|
42,7
|
Процент совпадений по стадиям кажется невысоким (кроме стадий
бодрствования и 4 стадии). Однако, судя по рисунку, гипнограмма является
довольно точной: цикл стадий определен верно и большинство стадий совпадают.
Вклад в погрешность могут вносить кратковременные сегменты, которые не несут
большую смысловую нагрузку, но учитываются компьютером, а эксперт мог их
усреднить и не учитывать.
Также с помощью этой таблицы можно увидеть, какие стадии
компьютером путаются. Так компьютер путает 1, 2 и 3 стадию друг с другом, а
фазу быстрого сна со 2 стадией. Это, возможно, может служить доказательством
того, что некоторые ученые ставят под сомнение необходимость разделения между
стадиями медленного сна.
Пример 2.
Результаты классификации отображены на рисунке 19. Процент
совпадений составил 80%. Гипнограммы имеют сходную структуру. Рассмотрим только
стадию сна без учета стадии бодрствования (рис.20). Процент совпадений снизился
до 62% по тем же причинам, что и в примере 1 - большой вклад в процент
совпадений вносила стадия бодрствования, определенная верно.

Рисунок 19. Верхняя гипнограмма построена по средним
значениям фрактальной размерности. Нижняя построена экспертом. Точность 80%
Проценты совпадений по стадиям приведены в таблице 2. В
данном примере наблюдается похожая ситуация, процент по стадиям не велик, но в
целом характер гипнограммы и циклы сна определены верно.

Рисунок 20. Верхняя гипнограмма построена по средним
значениям фрактальной размерности. Нижняя построена экспертом. Точность 62%
Табл.2. Процент совпадения по стадиям
|
Комп. Эксп. Бодр. Ст.1Ст.2Ст.3Ст.4ФБС
|
|
|
|
|
|
|
|
Бодр.
|
96,9
|
1,9
|
0,3
|
0,2
|
0,1
|
0,4
|
|
Ст.1
|
27,1
|
26
|
27,2
|
3,2
|
0
|
16,3
|
|
Ст.2
|
0,6
|
1,9
|
49,4
|
38
|
2,8
|
7,1
|
|
Ст.3
|
0
|
0
|
0
|
15
|
85
|
0
|
|
Ст.4
|
0
|
0
|
0,6
|
2,9
|
96,5
|
0
|
|
ФБС
|
2,8
|
9,6
|
31,8
|
0,5
|
0
|
55
|
Таким образом, с помощью метода фрактальной размерности можно
не только сегментировать запись ЭЭГ на стационарные участки, но еще и
проклассифицировать запись по стадиям сна с хорошей точностью. В задаче
классификации стадий сна данный метод может служить альтернативой использованию
нейросетевых классификаторов. Возможно, по точности метод фрактальной
размерности будет им уступать, но его преимущество заключается в быстроте
использования. Например, расчет фрактальной размерности 24-х часовой записи с
частотой дискретизации 100 Гц занимает порядка 1 минуты, в то время как
классификатору требуется гораздо больше времени.
4.3 Метод
непараметрической сегментации
.3.1
Результаты сегментации
Для расчета сегментации на основе этого метода пользователю
нужно задать вероятность, с которой максимум статистики на каждом сегменте
должен превысить порог. Чем больше мы зададим вероятность, тем больше точек
нестационарности будет найдено и тем менее заметные изменения в
последовательности будут выявлены.
Как и в случае с методом фрактальной размерности, для
просмотра результатов каждому сегменту последовательно будем присваивать стадии
от 1 до 4, в результате получим гипнограмму, показывающую границы найденных
сегментов. Результат будем сравнивать с гипнограммой, построенной экспертом.
Пример 1. Вероятность, с которой максимум статистики превысит
порог, равна 0,02. Количество сегментов в этом случае равно 9190. Результаты
сегментации приведены на рисунке 21. Ярко выражены сегменты соответствующие
стадии бодрствования (выделены красном на рис.21), а также некоторые из
сегментов 4 стадии.
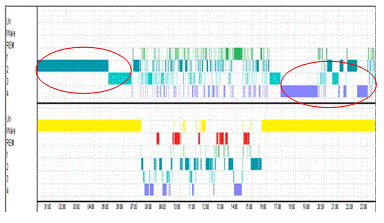
Рисунок 21. Верхний рисунок - сегментация при вероятности
0,02. Нижний рисунок - гипнограмма эксперта
Табл.3. Длины сегментов
|
Длина, сек
|
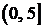   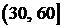
|
|
|
|
|
Проценты
|
88
|
8.2
|
2.3
|
0.3
|
Эти данные подтверждают результаты исследования ученых в том,
что длина большинства стационарных сегментов ЭЭГ не превышает 5 секунд.
Увеличим вероятность обнаружения точек нестационарности до
0,05. Число сегментов возрастает до 12600 (рис.22).

Рисунок 22. Верхний рисунок - сегментация при вероятности
0,05. Нижний рисунок - гипнограмма эксперта
По-прежнему хорошо выделены сегменты бодрствования. Заметить
соответствие сегментов сна стадиям гинограммы уже сложнее, так как задавая
большую вероятность, мы заставляем алгоритм находить более мелкие изменения в
характере ЭЭГ, тем самым создавая сегменты маленькой длины. Количество
сегментов длиной до 5 секунд увеличилось до 93% (табл.4).
Табл.4. Длины сегментов
|
Длина, сек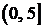   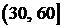
|
|
|
|
|
|
Проценты
|
93
|
5.5
|
1.1
|
0.2
|

Рисунок 23. Верхний рисунок - сегментация при вероятности
0,1. Нижний рисунок - гипнограмма эксперта
Пример 2. Вероятность превышения порога максимумом статистики
равна 0,1. Количество сегментов в данном случае равно 13700. Результаты
сегментации приведены на рисунке 24. В данном примере по сравнению с предыдущим
нам пришлось увеличить вероятность обнаружения нестационарностей, так как
алгоритм некоторые участки ЭЭГ определял в один сегмент, в то время как эксперт
разделял его на несколько стадий. Видимо это происходило из-за того, что
изменения ЭЭГ на этом участке слабо выделялось на фоне остальных
нестационарностей. Процентное соотношение длин сегмент, как и в предыдущем
примере, подтверждает, что средняя длина стационарного сегмента не превышает 5
секунд (табл.5).
Табл.5. Длины сегментов
|
Длина, сек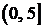   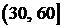
|
|
|
|
|
|
Проценты
|
89,8
|
7,2
|
2
|
0,4
|
Увеличим величину вероятности обнаружения до 0,2. Количество
сегментов возросло до 15800 (рис.24). Также увеличилось количество сегментов
длиной до 5 секунд до 92% (табл.6).
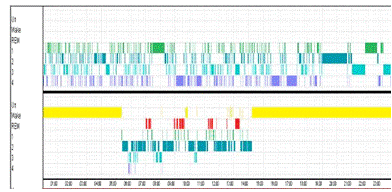
Рисунок 24. Верхний рисунок - сегментация при вероятности
0,2. Нижний рисунок - гипнограмма эксперта
Табл.6. Длины сегментов
|
Длина, сек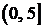   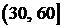
|
|
|
|
|
|
Проценты
|
91,9
|
6
|
1,4
|
0,2
|
4.3.2
Построение гипнограммы
Теперь построим гипнограммы для полученных сегментированных
ЭЭГ записей. Для этого для найденных сегментов находим фрактальную размерность
и определяем каждому сегменту стадию сна в соответствие с найденными средними
значениями размерности. Результаты будем оценивать по таблицам совпадения вероятностей.
Пример 1. Результаты классификации отображены на рисунке 25.
Процент совпадений стадий составил 80%. На рисунке ясно видно, что гипнограммы
имеют сходную структуру. Если не учитывать стадию бодрствования (рис.26)
точность снижается до 63%. Результаты схожи с результатами классификации по
сегментации с помощью фрактальной размерности.
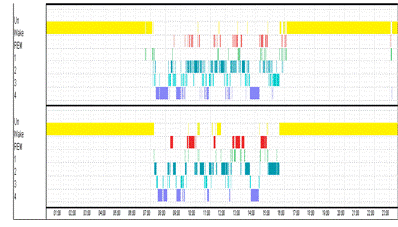
Рисунок 25. Верхняя гипнограмма построена по средним
значениям фрактальной размерности. Нижняя построена экспертом. Точность 80%

Рисунок 26. Верхняя гипнограмма построена по средним
значениям фрактальной размерности. Нижняя построена экспертом. Точность 63%
Табл.7. Процент совпадений по стадиям
|
Комп. Эксп.
|
Бодр.
|
Ст.1
|
Ст.2
|
Ст.3
|
Ст.4
|
ФБС
|
|
Бодр.
|
93,1
|
2,7
|
1,7
|
0,2
|
0,1
|
2,2
|
|
Ст.1
|
1,8
|
4
|
58
|
12,3
|
1
|
22,8
|
|
Ст.2
|
0,4
|
1,2
|
39,5
|
46,8
|
9,7
|
2,4
|
|
Ст.3
|
0,2
|
0,7
|
5,5
|
32,2
|
60,5
|
0,9
|
|
Ст.4
|
0,1
|
0,1
|
0,6
|
4,2
|
94,7
|
0,1
|
|
ФБС
|
0,9
|
14,4
|
48,7
|
5,2
|
0,2
|
30,5
|
Проценты совпадений по стадиям приведены в таблице 7. Большой
процент совпадений у стадии бодрствования и 4 стадии.
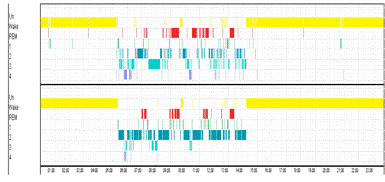
Рисунок 27. Верхняя гипнограмма построена по средним
значениям фрактальной размерности. Нижняя построена экспертом. Точность 79%
Пример 2. Результаты классификации отображены на рисунке 28.
Общий процент совпадений составил 79%. Если не учитывать стадию бодрствования
процент совпадений снижается до 61% (рис.28).

Рисунок 28. Верхняя гипнограмма построена по средним
значениям фрактальной размерности. Нижняя построена экспертом. Точность 61%
Проценты совпадений по стадиям приведены в таблице 8. В
данном случае хорошо определилась стадия бодрствования и фаза быстрого сна.
По-прежнему происходит путаница при разделении стадий фазы медленного сна.
Табл.8. Процент совпадений по стадиям
|
Комп. Эксп. Бодр. Ст.1Ст.2Ст.3Ст.4ФБС
|
|
|
|
|
|
|
|
Бодр.
|
97,4
|
1,5
|
0,3
|
0,3
|
0,1
|
0,4
|
|
Ст.1
|
16,9
|
25
|
21
|
5,4
|
1,5
|
29,6
|
|
Ст.2
|
2,4
|
4,5
|
36,4
|
35,2
|
7,6
|
13,8
|
|
Ст.3
|
0,1
|
0,1
|
1,6
|
59,5
|
38,3
|
0,2
|
|
Ст.4
|
0
|
0
|
0,8
|
39,8
|
59,4
|
0
|
|
ФБС
|
1,7
|
4,1
|
18
|
2
|
0,2
|
73,8
|
Выводы
В результате работы был создан программный модуль,
позволяющий производить автоматическую сегментацию ЭЭГ записи на стационарные
участки с помощью метода фрактальной размерности и метода непараметрической
сегментации.
Данные методы сегментации дали похожие результаты. Однако,
плюсом метода непараметрической сегментации является его гибкость, он дает
более широкие возможности для исследований, позволяя задавать вероятность, с
которой будут найдены точки нестационарности. Плюсом метода фрактальной
размерности является его быстродействие - сегментация 24-х часовой записи с
частотой 100 Гц занимает менее 1 минуты, в то время как метод непараметрической
сегментации требует 7-8 минут.
Была продемонстрирована неэффективность применения спектрального
анализа к нестационарному сегменту. Фурье преобразование стационарного участка
правильно выделало основные частоты, соответствующие текущей стадии сна.
Результаты сегментации показали, что средняя длина стационарных сегментов не
превышает 5 секунд, а количество таких сегментов составляет до 90%, что
подтверждает литературные данные.
Также в результате работы была показана возможность
применения метода фрактальной размерности для классификации ЭЭГ записи на
стадии сна. Процент совпадений полученной гипнограммы и гипнограммы эксперта
составил 80%. Одной из причин несовпадений результатов может являться
субъективная оценка эксперта, незначительные и кратковременные изменения могли
быть усреднены человеком, в то время как компьютер обрабатывает все изменения.
Данный метод классификации может служить альтернативой применения нейросетевых
классификаторов, так как занимает гораздо меньше времени, с его помощью можно
судить о циклах стадий сна, а также о наличии конкретных стадий.
Список
литературы
1. Гнездицский
В.В. Обратная задача ЭЭГ и клиническая энцефалография. ТРТУ 2000
2. Гнездицкий
В.В. Вызванные потенциалы мозга в клинической практике. Таганрог: Издательство
ТРТУ, 1997
. Жирмунская
Е.А. Клиническая электроэнцефалография, М., МЭЙБИ, 1991
. Егорова
И.С. Электроэнцефалография. - М.: Медицина, 1973
. Зенков
Л.Р., Ронкин М.А. Функциональная диагностика нервных болезней: (Руководство для
врачей). М.: Медицина, 1982
. A.
Kaplan, J. Roschke, B. Darkhovsky, J. Fell. Macrostructural EEG
characterization based on nonparametric change point segmentation: application
to sleep analysis. Journal of Neuroscience Methods (2001)
. McEwen
J. A., Anderson G. B. Modeling the stationary and gaussianity of spontaneous
electroencephalographic activity. IEEG Transactions on Biomed. Engineering.
1975
. Rechtschaffen
A., Kales A. A. A Manual of Standardized Terminology, Techniques and Scoring
System for Sleep Stages of Human Subjects. Washington DC: U. S.government
Print. Office, Nat. Inst. Help Publ., 1968
. Каплан
А.Я. Проблема сегментного описания электроэнцефалограммы человека. Физиология
человека, 1999, том 25, №1
. Шишкин
С.Л. Исследование синхронности моментов резких изменений альфа-активности ЭЭГ
человека. Москва, 1997
. Barlow
J. S. Methods of analysis of nonstationary EEGs, with emphasis on segmentation
techniques: a comparative review. J. Clin. Neurophysiol. 1985.
. Jansen
B. H., Hasman A., Lenten R. Piece-wise EEG analysis: an objective evaluation.
Internet J. Bio-Med.comput. 1981.
. Bodenstein
G., Praetorius H. M. Feature extraction from the electroencephalogram by
adaptive segmentation Proc. IEEE. 1977. V.65.
. Biscay
R., Lavielle L., Gonzalez A., et al. Maximum a posteriori estimation of change
points in the EEG. Int. J. of Biomed.computing. 1995. V.38.
. Бродский
Б.Е., Дарховский Б.С., Каплан А.Я. и др. Непараметрическая сегментация
электрических сигналов мозга. Автоматика и телемеханика. 1998. №2.
. Шишкин
СЛ., Бродский Б.Е., Дарховский Б. С, Каплан А.Я. ЭЭГ как нестационарный сигнал:
под ход к анализу на основе непараметрической статистики. Физиология человека.
1997. Т.23. № 4.
. Higuchi
T. Relationship between the fractal dimension and the power law index for a
time series: a numerical investigation. Physica D 46.1990.
. Higuchi
T. Approach to an irregular time series on the basis of a fractal theory.
Physica D 31.1988.
. Brodsky
B. E., Darkhovsky B. S. Nonparametric methods in change-point problems. Kluwer
Academic Publishers, 1993.
Сокращения
мВ - милливольт
мкВ - микровольт
ЭЭГ - электроэнцефалограмма
ЭМГ - электромиограмма
ЭОГ - электроокулограмма
ЭКГ - электрокардиограмма
ЦНС - центральная нервная система
НКИ - нейрокомпьютерный интерфейс- rapid eye movement&K -
система Рейхшаффена и Келли