Эксергетический анализ и управление энергоресурсами процесса конверсии метана
Содержание
Глава 1. Литературный обзор
.1 Краткое описание технологической
схемы производства аммиака
.2 Оптимальные условия синтеза
аммиака
.3 Краткая характеристика процессов
каталитической конверсии метана
.3.1 Паровая каталитическая конверсия
углеводородов
.3.2 Автотермическая конверсия метана
.4 Эксергетический анализ основных
стадий паровоздушной конверсии метана
.4.1 Критерии эффективности
использования эксергии
.4.2 Оценки основных составляющих
потерь эксергии в трубчатой печи
.4.3 Потери эксэргии в шахтном
реакторе
.5 Технологическая схема получения
синтез-газа в агрегате синтеза аммиака мощностью 1360 т/сут
Глава 2. Теоретическая часть
.1 Введение
.2 Термодинамический анализ установки
.3 Цели работы
.4 Описание технологической схемы
Глава 3. Практическая часть
Исходные данные
.1 Конверсия метана в трубчатой печи
.1.1 Определение расходов природного
газа на конверсию и сжигание для производства 1360 т/сут аммиака
.1.2 Термодинамический анализ
процесса горения
.1.3 Технологический расчёт и
эксергетический анализ процесса конверсии метана
.1.4 Разработка энергосберегающей
технологии на базе печи конверсии метана
.1.5 Определение эксергетического КПД
химического реактора
.2 Шахтная доконверсия
.2.1 Эксергетический анализ процесса
вторичного рифоминга метана
.3 Определение эксергетического КПД
узла конверсии метана
Заключение
Список использованной литературы
Введение
Каталитическая конверсия природного газа в настоящее
время стало основным методом получения водорода и синтез газа для ведущих
отраслей народного хозяйства. Наиболее крупными потребителями водорода и его
смесей с окисью углерода или азотом являются нефтеперерабатывающая
(гидрогенизационные процессы), химическая и нефтехимическая (процессы
гидрирования, синтез метанола, бутанола, высших спиртов, аммиака, карбамида,
искусственных топлив, пластмасс, синтетических волокон и т.д.), пищевая,
энергетическая, металлургическая и другие отрасли промышленности. Промышленными
методами получения водорода и его смесей конверсией природного газа являются процессы
паровой, паровоздушной и парокислородной с последующей конверсией окиси
углерода.
На современном этапе развития науки и техники для
производства собственно водорода (технического) считается более перспективным и
прогрессивным процесс паровой конверсии под давлением, осуществляемый при
высоких температурах (1200-1300 0С) и высоких давлениях 40-100 МПа в
реакторах, заполненных никелевым катализатором. В нефтехимии и азотной
промышленности наибольшее распространение получил двухступенчатый автотермический
каталитический процесс конверсии природного газа смесью водяного пара и
кислорода или обогащенного кислородом воздуха при давлении порядка 40-60МПа,
осуществляемый в первой стадии в трубчатых печах и доконверсией в реакторах
шахтного типа. Одностадийная парокислородная каталитическая конверсия
природного газа в шахтных конверторах признана менее экономичным и поэтому
неперспективным процессом. Однако вопрос о том, какой из технологических
вариантов процессов каталитической конверсии окажется перспективным, далеко не
ясен.
Природный газ - очень распространенное природное
сырье, используемое для получения синтез-газа. Прямое одностадийное окисление
природного газа в синтез-газ может осуществляться двумя способами:
каталитическое и термическое. Совершенствование технологических процессов
превращения природного газа в метанол путем разработки эффективных
катализаторов не дает положительных результатов, так как конверсия природного
газа при их использовании не превышает 16%. В настоящее время степень, конверсии
природного газа в метанол доведена до 32%. Пока практически единственным
методом химической переработки природного газа является его паровая конверсия с
получением синтез-газа (СО +ЗН2) на никелевых катализаторах. Водород
из синтез-газа далее используют для получения аммиака, а смесь состава СО + 2H2
- для синтеза метанола.
Глава 1. Литературный
обзор
1.1 Краткое описание технологической
схемы производства аммиака
Для достижения высокой производительности аппарата
процесс синтеза аммиака следует вести, не стремясь к получению равновесных
выходов. Напротив, надо пропускать газ с такой объемной скоростью, при которой
выходящая из аппарата газовая смесь далека от состояния равновесия и содержание
аммиака в ней невелико. Поэтому необходимо, выделив аммиак из газа, вновь
направить азотоводородную смесь на синтез, что может быть осуществлено двумя
приёмами. Можно соединить последовательно ряд агрегатов для синтеза аммиака,
пропуская газ через все агрегаты (схема с открытой цепью). Каждый агрегат
состоит из колонны синтеза, холодильника (в котором газ охлаждается и
конденсируется аммиак) и газоотделителя для разделения газа и жидкого аммиака.
Можно проводить процесс в одном агрегате, направляя азотоводородную смесь после
выделения аммиака и добавки к ней соответствующего количества свежей смеси
обратно в колонну синтеза. Такой циклический процесс благодаря своим
преимуществам, прежде всего компактности и простоте регулирования, применяется
в настоящее время почти на всех установках.
Первой стадией процесса является сжатие
азотоводородной смеси до давления, под которым осуществляется процесс синтеза
аммиака. В настоящее время в производстве синтетического аммиака применяются
давления от 100 до 1000 ат. Расход энергии на сжатие смеси незначительно
возрастает с повышением давления, так как работа сжатия приблизительно
пропорциональна логарифму отношения давлений.
Сжатый газ после компрессора проходит через фильтр,
где очищается от масла.
Второй стадией процесса в ряде способов синтеза
аммиака является дополнительная очистка азотоводородной смеси от ядов: окиси
углерода, кислорода и водяных паров. Напомним, что смесь, полученная описанными
выше способами, содержит эти примеси в количествах, измеряемых тысячными или
сотыми долями процента. Дополнительная очистка производится каталитическим
способом.
Она осуществляется различными методами, например путем
гидрирования:
СО + ЗН2 = СН4 + Н2О
О2+2Н2 = 2Н2О
Эти реакции идут при повышенном давлении и температуре
300-350° в присутствии специального катализатора. При последующем охлаждении
газа большая часть водяных паров, образовавшихся в так называемой колонне
предкатализа, конденсируется и удаляется.
Хотя метан не является ядом для катализатора синтеза
аммиака, но повышение его содержания в газе понижает парциальное давление
реагирующих веществ и, следовательно, производительность. Поэтому
каталитический способ очистки применяется лишь для удаления незначительных
количеств окиси углерода и кислорода. Содержание окиси углерода и водорода в
газовой смеси, поступающей в колонну предкатализа, очень мало. Поэтому процесс
не может протекать автотермично и необходим постоянный подвод тепла для
поддержания в аппарате требуемой температуры. Процесс можно провести
автотермично, если выбрать такие условия для предкатализа, при которых частично
реагирует и азотоводородная смесь. Сжатая и очищенная азотоводородная смесь
направляется далее вместе с циркуляционным газом в колонны синтеза аммиака.
Следующей операцией является выделение из газа аммиака
путем конденсации. Температура, до которой нужно охладить газ, чтобы
сконденсировать аммиак, зависит от давления.
Количество аммиака, остающегося в газе при данной
температуре конденсации, обратно пропорционально общему давлению, что
позволяет, применяя для синтеза аммиака давление 750-1000 ат, достигать
удаления 80-90% аммиака из газа охлаждением его в водяных холодильниках. При
меньших давлениях газ приходится охлаждать дополнительно в аммиачных
холодильниках до температуры от 0° до -55° (в зависимости от давления). В
аммиачном холодильнике используется производимый на установке жидкий аммиак,
который после испарения направляется в газообразном виде в перерабатывающие
цехи.
Освобожденная в той или иной степени от аммиака
азотоводородная смесь после добавления к ней свежего газа возвращается в колонну
синтеза. Для циркуляции газов применяются в большинстве случаев циркуляционные
насосы, компенсирующие падение давления в системе (перепад давления измеряется
10-20 ат). В системах высокого давления иногда взамен циркуляционных насосов
применяются инжекторы. Свежий газ подводится к инжектору под давлением,
превышающим давление циркулирующего газа я а 10 - 15 ат
1.2 Оптимальные условия синтеза
аммиака
Содержание аммиака в газе падает с увеличением
объемной скорости, т. е. с уменьшением времени контактирования.
С повышением давления увеличивается равновесный выход
аммиака и возрастает скорость реакции. Скорость реакции растет также с
уменьшением размеров зерен катализатора.
Зная зависимость степени превращения исходной смеси от
объемной скорости, температуры, давления и размеров зерен катализатора, можно
определить условия, необходимые для достижения высокой производительности
катализатора.
При данной объемной скорости производительность
катализатора прямо пропорциональна содержанию аммиака, т. е. достигает
максимума при оптимальном температурном режиме и увеличивается с повышением
давления.
С увеличением объемной скорости производительность
катализатора растет, потому что, как было показано выше, содержание аммиака
уменьшается медленнее, чем возрастает объемная скорость.
Производительностью катализатора (G) называется вес
продукта, полученного в течение одного часа с 1 м3 катализатора.
Производительность катализатора выражается в кг/м3 час.
Для повышения производительности катализатора нужно
увеличивать объемную скорость, что приводит к понижению содержания аммиака в
газе после контакта. Это возможно только при условии, что неиспользованная
азотоводородная смесь вновь направляется в колонну синтеза.
При выборе объемной скорости учитывают не только
необходимость наилучшего использования катализатора, но и влияние изменения
объемной скорости на производительность остальных аппаратов (входящих в агрегат
синтеза аммиака), а также на расход энергии на транспорт газа и на нагревание и
охлаждение газовых смесей.
Расход энергии на транспорт газа через реакционную
аппаратуру пропорционален объемной скорости, а не производительности
катализатора. Следовательно, с увеличением объемной скорости расход энергии по
этой статье на 1 т аммиака увеличивается.
Выделение аммиака из газовой смеси производится
обыкновенно его конденсацией. Так как с увеличением объемной скорости
уменьшается парциальное давление аммиака, то для того, чтобы сконденсировать
аммиак, газ должен быть охлажден до более низкой температуры.
Количество тепла, выделяющееся при реакции в единицу
времени на единицу объема катализатора, пропорционально производительности
катализатора. Поэтому с увеличением объемной скорости количество тепла,
приходящееся на 1 м3 газа, уменьшается.
При заданной температуре газа на выходе из аппарата
количество уносимого газами тепла возрастает прямо пропорционально объемной
скорости.
Выбор объемной скорости в каждом отдельном случае
может быть сделан только на основании разностороннего анализа процесса.
Повышение производительности путем увеличения объемной скорости ограничивается,
в первую очередь, требованием вести процесс без затраты тепла извне.
Первое время при производстве синтетического аммиака
работали с небольшими объемными скоростями (5000-10000), теперь перешли к
скоростям 30 000-60 000 нм3/м3 час.
Таким образом, для достижения более высокой
производительности необходимо проводить процесс при высоких давлениях и
оптимальном для данного катализатора температурном режиме, при больших объемных
скоростях и на возможно более чистом газе.
1.3
Краткая характеристика процессов каталитической конверсии метана
Большие масштабы потребления водорода и его смесей с
азотом, окисью и двуокисью углерода требуют постоянного совершенствования
технологии их получения, оптимизации и интенсификации крупнотоннажных
промышленных процессов каталитической конверсии природного газа. Природный газ,
содержащий от 90 до 99% об. метана, в последнее время стал основным сырьем для
производства водорода. Роль процессов газификации твердых топлив, занимавших в
прошлом доминирующих положение в мировом производстве водорода, в наши дни
продолжает непрерывно понижаться. Достаточно широко перерабатываются также
жидкие углеводороды нефти и газообразные гомологи метана, удельный вес которых
в сырьевой базе производства заметно увеличился. Водород может использоваться в
народном хозяйстве как и в чистом виде (процессы гидроочистки и гидрокрекинга в
нефтепереработке), так и в виде смесей с азотом или двуокисью углерода (в
производствах аммиака, спиртов, моторных топлив).
В связи с этими направлениями процессы каталитической
конверсии метана можно разделить на следующие основные способы:
. Паровая конверсия в трубчатых печах.
. Парокислородная в шахтных реакторах.
. Парокислородовоздушную в шахтных реакторах.
. Пароуглекислотную в трубчатых печах.
. Двухступенчатая с паром и воздухом.
Процессы каталитической конверсии природного газа по
(1) и (2) способам с последующей конверсией окиси и очистки от двуокиси
углерода предназначены для получения чистого водорода. Процессы
парокислородовоздушной конверсии с последующей конверсией окиси углерода,
отчисткой от двуокиси углерода и тонкой доочисткой от следов окиси углерода
предназначены для получения азотоводородной смеси. Процессы пароуглекислотной
конверсии осуществляются с целью получения смеси, состоящей из водорода и окиси
углерода в различных соотношениях, направляемую для синтеза спиртов различного
молекулярного веса.
Поскольку в процессах паровой и пароуглекислотной
конверсии метана протекают эндотермические реакции, то для поддержания
необходимой температуры в зоне реакции избыточное количество тепла подводится
извне путем обогрева реакционных труб печи, заполненных катализатором, горячими
топочными газами.
При автотермической конверсии тепло, необходимое для
проведения процесса, выделяется непосредственно в реакционной зоне в результате
сгорания в потоке кислорода части исходного углеводородного сырья и продуктов
конверсии-окиси углерода, и водорода. В процессах комбинированной конверсии на
первой ступени конвертируется определенная часть метана с водяным паром в
трубчатой печи, затем конвертированный газ поступает в шахтный реактор, где в
присутствии воздуха производится полная конверсия метана.
Производства-потребители в зависимости от их
технологии предъявляют неодинаковые требования к составу и чистоте водорода и
синтез-газа. Так, каталитические процессы производства аммиака требуют
тщательной очистки азотоводородной смеси от окиси и двуокиси углерода, а в
процессах синтеза спиртов и оксосинтеза окись углерода является
стехиометрически необходимым компонентом. Водород в процессах гидроочистки
нефтяных дистиллятов также не требует тонкой очистки от примесей окиси и
двуокиси углерода.
В качестве катализаторов в процессах конверсии метана
обычно используют никель, нанесенный на различные термостойкие носители (шамот,
окись алюминия, цеолиты, соединения бора, корунд, графит, хром, магний и др.).
С целью обеспечения прочности катализаторов при
прессовании в его состав на последнем этапе приготовления добавляют 2-3 вес.
части графита. Для прочности контакта в состав добавляют бор, а для обеспечения
пористости в состав добавляют летучие вещества, которые при нагревании
улетучиваются и создают необходимую пористость.
Как известно, никель относится к классу
окислительно-восстановительных катализаторов. Никелевые катализаторы широко
применяются и в процессах гидрирования и дегидрирования углеводородов.
На технико-экономические показатели процесса
существенное влияние оказывают соединения серы в исходном природном газе,
которые являются ядом для никелевых катализаторов. В связи с этим требуется
дополнительная установка сероочистки исходного газа.
Проведение технологических процессов конверсии при
недостатке окислителей приводит к выпадению свободного углерода, который
покрывает поверхность катализатора и снижает его механическую прочность.
Термодинамический анализ равновесия реакций конверсии показывает, что
вероятность выделения элементарного углерода или так называемая область
зауглероживания, определяется содержанием углеводорода в исходной
конвертируемой смеси. Количество выделяющегося углерода увеличивается с
повышением парциального давления углеводорода и с увеличением соотношения С : Н
в нем. При проведении процесса конверсии с избыточным по сравнению со
стехиометрически необходимым количеством окислителей удается предотвратить
образование элементарного углерода. Однако это не свидетельствует о том, что
реакция образования углерода является побочной, сопутствующей основным реакциям
конверсии углеводородов.
Анализ большого экспериментального материала по
механизму реакций, протекающих в процессах конверсии метана показывает, что
каталитическая конверсия протекает многостадийно через окисление-восстановление
катализатора и образование газификации углерода на катализаторе.
Следовательно, стадию углеобразования следует
рассматривать как составную часть суммарного процесса каталитической конверсии.
Об этом свидетельствует экспериментально установленные факты сохранения и даже
возрастания активности катализатора при наличии углерода.
Наиболее существенным параметром, позволяющим
устранить опасность образования элементарного углерода в процессах конверсии,
являет соотношение окислитель : углеводород. Как это видно из стехиометрии
реакций
СmHm + mH2O = mCO + (m + 0,5m)H2, (1.1)
CmHm + 0,5O2 = mCO + 0,5mH2 (1.2)
соотношение окислитель : углеводород пропорционально
числу углеродных атомов углеводорода.
Это означает, что процесс конверсии высокомолекулярных
гомологов метана и жидких углеводородов будет протекать при большем расходе
окислителей по сравнению с конверсией метана. Как правило, паровую конверсию
метана проводят с двукратным избытком водяного пара по сравнению со
стехиометрическим, а парокислородную- при соотношении водяной пар: метан равным
единице и расходе кислорода на процесс 0,55-0,65 мол/моль метана. Из (1.1) и
(1.2) следует, что кислород как окислитель эквивалентен двум молям водяного
пара. Следовательно, в пересчёте на водяной пар соотношение окислитель : метан
в процессах парокислородовоздушной конверсии составит 1,1-2,3 моль/моль. Т.е.
по этому показателю оба способа конверсии близки. Промышленные процессы
конверсии метана осуществляются при атмосферном и повышенном давлениях. В
первом случав процесс протекает в сравнительно простой и дешевой аппаратуре при
высокой степени превращения исходного сырья. Повышение давления
термодинамически не благоприятствует процессу конверсии. Однако, в ряде случаев
экономичнее проводить процесс при повышенном давлении (17-70 ата).
Применение давления имеет определенные преимущества в
тех случаях, когда получаемый водород или синтез-газ используют для синтезов
под' давлением. При этом снижаются затраты на компремирование газа в процессе
его дальнейшей переработки. При повышенном давлении, кроме того уменьшается
объём аппаратов и трубопроводов.
Как было выше сказано, что производства, потребляющие
водород или его смеси, предъявляют жесткие требования к составу синтез-газа.
Та, для аммиачных производств требуется синтез-газ с содержанием остаточного
метана не более 0,5% об. Расчеты показывают, что для получения синтез-газа с
содержанием метана меньше 0,6% об., реакционные аппараты промышленных
агрегатов конверсии природного газа должны обеспечить при принятых режимах,
близкую к равноценном степень прекращения мотана. Эта особенность позволяет
определить материальный баланс, технико-экономические показатели, решать,
некоторые задачи оптимизации и интенсификации процессов конверсии по
термодинамическим равновесиям реакций. Поэтому вполне понятно, что расчетам
равновесия реакции, протекающих в процессах конверсии углеводородов
(преимущественно метана) водяным паром, углекислотой, кислородом и их смесями,
посвящено достаточно много работ. Следует отметить, что проектирование
промышленных процессов конверсии метана осуществлялось до сих пор также путем термодинамических
расчетов. Этим, по видимому, и обуславливалось, недостаточное внимание
исследователей вопросам механизма и кинетики процессов конверсии, подбору и
разработке оптимальных катализаторов и оптимальному проектированию реакционных
аппаратов.
|
 Рис. 1. Удельные потери эксергии DExуд, отнесенные на 1 кмоль произведенной по реакции (10) смеси (Н2+СО)
в зависимости от концентрации метана yCН4 в продуктах
реакции. Рис. 1. Удельные потери эксергии DExуд, отнесенные на 1 кмоль произведенной по реакции (10) смеси (Н2+СО)
в зависимости от концентрации метана yCН4 в продуктах
реакции.
|
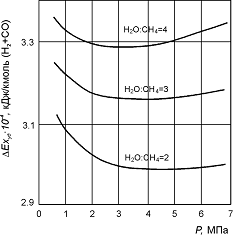 Рис. 2. Зависимость удельных потерь эксергии DExуд в ходе реакции (10) от давления. Рис. 2. Зависимость удельных потерь эксергии DExуд в ходе реакции (10) от давления.
|
1.3.1
Паровая каталитическая конверсия углеводородов
Каталитической конверсией углеводородов принято
называть процесс получения водород содержащих технологических газов - сырья для
синтеза аммиака, метанола и других продуктов.
В настоящее время конверсия метана и его гомологов
является основным промышленным методом получения водорода и технологических
газов для синтеза аммиака, спиртов, моторных топлив и других продуктов, В
процессе конверсии метан окисляется водяным паром, диоксидом углерода или
кислородом но следующим основным реакциям:
4 + Н2О= СО + ЗН2 - 206,4
кДж/моль (1)
СН4 + СО2 =2СО + 2Н2
- 248,3 кДж/моль (2)
СН4 + 0,5О2 =CO+2H2+
35,6 кДж/моль (3)
СО + H2О=СО2 +Н2
+41,0кДж/моль(4)
Реакции окисления гомологов метана протекают
аналогично. Так, взаимодействие их с водяным паром может быть в общем виде
выражено уравнением
CnHm+ nH2O
=nCO+H2(2n+m)/2 +Q
Если требуется получить технически чистый водород,
проводят реакцию (1) или (3) с последующей конверсией СО по реакции (4). При
получении азотоводородной смеси для синтеза аммиака необходимое количество
азота вводят с воздухом на стадии конверсии углеводородных газов либо при
промывке конвертированного газа жидким азотом для удаления остатков оксида
углерода. При получении смесей Н2-СО для синтеза спиртов комбинируют
реакции (1), (2) и (3), подбирая соотношение Н2О : СО: по объему в
исходной смеси таким образом, чтобы отношение Н2 : СО но объему в
конвертированном газе составляло (2-2,5) : 1. Для проведения в промышленных
условиях сильно эндотермических реакций (1) и (2) требуется подвод тепла извне.
При добавлении кислорода протекает экзотермическая реакция (3), что позволяет
осуществить процесс конверсии углеводородных газов автотермично.
Зависимости констант равновесия от температуры (Т в К)
могут быть представлены в виде уравнений:
Кр1= ехр [(8,752 Ln(Tp) -
(-22635;63- 29,76863Tp
,005269261Т2Р + 0,4927824*10-6Т3р
+ 8,736*10-12Т4р)/Т] (5)4= ехр
(-0,768335 Ln (Тр) - (4943,27 - 1,50621 +
+ 30,1О18*10-4Т2р-9,6605*10-7Т3р+
1,475*10-10Т4р)/Т] (6)
На основе известных методик через мольные доли всех
компонентов, участвующих в реакциях (1) и (4) ведут расчет равновесных составов
конвертированного газа при различных значениях давления (в МПа) соотношениях
пар : газ в температурах реакций.
Химические превращения, лежащие в основе
рассматриваемого процесса, относятся к реакциям окисления углеводородов.
Многочисленные реакции данного типа можно разделить на две большие группы:
реакции мягкого окисления (без деструкции углеводородного скелета) и реакции
деструктивного окисления.
Реакции деструктивного окисления в зависимости от
достигаемой степени окисления элементов углеродного скелета также подразделятся
на две группы: на реакции, сопровождающиеся полным окислением (до углекислоты и
воды) и неполным окислением (до оксида углерода и водорода).
Согласно данной классификации, каталитическая конверсия углеводородов
представляет собой реакцию деструктивного окисления углеводородов при неполном
окислении углерода и водорода. Во многих случаях применение активных
катализаторов позволяет не только интенсифицировать химические процессы, но и
снизить температуру процесса. Последняя задача в случае каталитической
конверсии углеводородов, если она ориентирована на получение водорода,
утрачивают всякий смысл, поскольку по термодинамическим причинам этот процесс
может быть реализован с требуемой полнотой только при очень высоких
температурах (1000-1300 0С). Такого рода процессы следовало бы
отличить от тех, которые проводятся при высоких температурах лишь потому, что
для них еще не подобраны достаточно активные катализаторы, и классифицировать
их как высокотемпературные каталитические процессы. Процессы каталитической
конверсии углеводородов разнообразны. Предложена классификация этих процессов,
включающая следующее шесть групп показателей (фасетов): 1) вид углеводородного
сырья; 2) природу окислителя; 3) температурный уровень процесса; 4) величину
давления; 5) способ аппаратурного оформления процесса; 6) целевое назначение
продукта. Эти фасеты рассматриваются в порядке их подчиненности (от первого к
шестому). В каждом из перечисленных фасетов в порядке уменьшения значимости
перечисляются признаки, характеризующие процесс конверсии.
Рассмотренная классификация может оказаться полезной
для систематизации сведении о процессах каталитической конверсии
углеводородного сырья. Также в соответствии с данной классификацией рассмотрены
некоторые недостатки и обсуждены пути усовершенствования существующих процессов
конверсии углеводородов Расширение масштабов применения каталитической
конверсии углеводородов сопровождается постепенным увеличением молекулярного
веса применяемого углеводородного сырья. Так, в последнее время на некоторых
заводах стали перерабатывать природный газ с повышенным содержанием гомологов
метана, что в отдельных случаях привело к некоторому снижению
производительности установок и возникновению осложнений, связанных с
зауглероживанием катализатора. Кстати сказать, в таких случаях, вероятно,
следует подвергать газ очистке способом низкотемпературной паровой очистки от
гомологов метана. Этот способ очистки, разработанный, состоит в следующем. В
природный газ дозируется небольшое количество водяного пара, который над
активным никелевом катализаторе при 320-340 °С селективно реагирует с
гомологами метана с образованием в основном метана. Все чаше в производство
водорода каталитической конверсией углеводородов вовлекаются бензиновые
фракции. Причем для переработки такого сырья обычно применяют аппаратурное
оформление и условия, разработанные для природного газа (одноступенчатая
конверсия бензина). При этом, естественно, возникают трудности, связанные с
отложением углерода па катализаторе и необходимостью увеличения расхода
водяного пара. Частичное решение этой проблемы состоит в применении никелевых
катализаторов с активностью, пониженной за счет введения в них некоторого
количества щелочных добавок.
Конверсия углеводородов с применением водяного пара в
качестве окислителя в настоящее время считается наиболее эконономичным и
перспективным процессом. Вторым по назначению является способ конверсии
углеводородов с применением кислорода в качестве окислителя
(парокислородовоздушная и парокислородная конверсия). В последнее время
внимание исследователей начинает привлекать углекислотная конверсия. Конверсия
углеводородов с кислородом оксидов металлов не нашла применения. То же можно
сказать о способе получения водорода термокаталитическим разложением
углеводородов до элементов (конверсия без окислителя).
Ранее считали, что первичным молекулярными продуктами
паровой конверсия углеводородов является оксид углерода и водород, которые
превращаются в метан. Однако проведенное специальное изучение
последовательности превращений этана при его низкотемпературной конверсии с
паром на никелевом катализаторе показало, что лог процесс протекает в две
макроскопические стадии.
1.3.2
Автотермическая конверсия метана
От чисто паровой каталитической конверсия метана
автотермическая конверсия отличается тем, что в зону реакции помимо водяного
пара в качестве окислителя вводится кислород (парокислородная конверсия), так
же иногда вводят водород для увеличения зоны реакции. При взаимодействии
кислорода с метаном выделяется тепло, что исключает необходимость в подводе со
стороны тепла, требуемого для осуществления эндотермической реакции паровой
конверсии метана. Это является существенным преимуществом способа, поскольку
упрощает аппаратурное оформление процесса в реакторе шахтного типа.
Для получения конвертированного газа с минимальным
содержанием азота добавляют технический кислород(~95% О2) при
производстве технологического газа для синтеза аммиака к исходной газопаровой
смеси добавляют воздух, обогащенный кислородом (40-42% О2) для
уменьшения расхода технического кислорода смесь исходных компонентов
целесообразно предварительно нагревают до возможно более высокой температуры
(400-500 0С). В этом случае автотермичность процесса достигается при
добавлении к 1 объему метана 0,5- 0,6 объема кислорода и обеспечивается
практически полная конверсия метана.
Развитие производства водорода путем каталитической
конверсии углеводородов нельзя рассматривать как простой количественный рост
единичной мощности агрегатов конверсии углеводородов при неизменности
традиционных технических решений. Действительно, при достижении определенной
мощности агрегатов можно ожидать своеобразного качественного скачка, когда
зарекомендовавшие себя способы и аппараты перестанут быть оптимальными. В то же
время процессы, ранее считавшиеся бесперспективными, могут оказаться наиболее
применяемыми. В связи с этим не исключено, что в будущем потребуется пересмотр
традиционно отрицательного отношения к некоторым процессам конверсии
углеводородов. Этот пересмотр может коснуться и процессов автотермической
конверсии углеводородов. Поэтому в настоящее время уделяется большое внимание
изучению данного процесса. Поскольку автотермическая конверсия метана
осуществляется в промышленном масштабе в шахтных конверторах с применением
кислорода и качестве окислителя, то при этом в слое катализатора возникает
узкая высокотемпературная зона беспламенного горения метана, где полностью
расходуется введенный в конвертор кислород. Указанная зона обычно
распространяется по всему поперечному сечению шахты, но имеет небольшую ширину
(порядка нескольких сантиметров).
Одним из свойств зоны горения является ее лабильность.
Под влиянием ряда факторов она может существенно изменять конфигурацию:
изгибаться, принимая выпуклую, вогнутую или волнообразную форму. Средний
уровень ее размещения в шахте может колебаться в широких пределах. Зона может
подниматься навстречу потоку газа и достигать уровня расположения устройства,
предназначенного для смешения исходных компонентов реакции, В последнем случае,
как правило, происходят перегорание смесильного устройства, и возникает
аварийная ситуация. В иных условиях зона может постепенно смешаться по
направлению потока газовой смеси и достигать выходного канала конвертора, что
также приводит к аварийной остановке агрегата. Лабильность температурной зоны
особенно характерна для промышленного процесса парокислородовоздушной конверсии
метана, осуществляемого при давлении, близком к атмосферному.
Условия возникновения лабильности золы горения в
указанных условиях не изучались. В работах впервые было исследовано влияние
катализаторов на стабилизацию зоны горения в условиях парокислородовоздушной
конверсии метана.
Для оценки способности катализаторов стабилизировать
зону горения метана предстоит разработать специальную методику.
1.4 Эксергетический анализ основных
стадий паровоздушной конверсии метана
Задача эксергетического анализа - оценка степени
термодинамического совершенства технологической системы в целом, а также
выявление тех стадий технологического процесса, где сосредоточены основные
потери эксэргии (потенциальной работоспособности системы). Ранжирование стадий
по величине потерь эксэргии позволяет целенаправленно проводить мероприятия по
повышению эффективности использования энергоресурсов в данном процессе.
Потери эксэргии напрямую связаны с генерацией энтропии
в результате неравновесных процессов. С учетом уравнения баланса, имеем
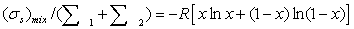
Это
уравнение может быть положено в основу расчета потерь эксэргии в каждом
отдельном блоке технологической системы.
В
качестве конкретного примера продолжим рассмотрение основных стадий
паровоздушной конверсии метана в трубчатой печи и шахтном реакторе

1.4.1 Критерии эффективности использования эксергии
Непосредственное
применение уравнений баланса эксергии (1) и (2) для оценки термодинамической
эффективности отдельных элементов (блоков), действующих технологических систем
затруднительно в связи со сложностью расчета слагаемого полной работы 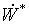 , зависящего от потоков приведенной теплоты. Для
такого расчета требуется детальное описание условий теплообмена на поверхности
контакта рассматриваемой подсистемы с другими подсистемами производства.
Однако, в большинстве случаев трудности с расчетом
, зависящего от потоков приведенной теплоты. Для
такого расчета требуется детальное описание условий теплообмена на поверхности
контакта рассматриваемой подсистемы с другими подсистемами производства.
Однако, в большинстве случаев трудности с расчетом  можно обойти путем расширения объекта анализа таким
образом, чтобы теплообменные поверхности оказались внутри исследуемой системы,
и межсистемные тепловые потоки были исключены из баланса эксергии. Для решения
второй задачи необходима экспериментально подтвержденная, достаточно полная
математическая модель аппарата.
можно обойти путем расширения объекта анализа таким
образом, чтобы теплообменные поверхности оказались внутри исследуемой системы,
и межсистемные тепловые потоки были исключены из баланса эксергии. Для решения
второй задачи необходима экспериментально подтвержденная, достаточно полная
математическая модель аппарата.
Конечно,
при указанном расширении объекта анализа из баланса не могут быть исключены
потоки теплоты, обусловленные тепловым рассеянием от внешних поверхностей
аппарата в окружающую среду. Более того, теплообмен с окружающей средой может
являться необходимым элементом технологического процесса (например, при
воздушном или водяном охлаждении аппаратов).
Однако,
как в том, так и в другом случае теплота или холод, отданные окружающей среде, не
создают дополнительной работы. Обусловленные теплообменом с внешней средой
потери эксергии автоматически будут учитываться в балансе эксергии
диссипативным слагаемым 
На
основании вышесказанного, интегральные уравнения баланса эксергии практически
без снижения общности могут быть записаны в более простом виде:
для
систем, которые производят или потребляют работу (электрическую или
механическую):
 , (1)
, (1)
и
для многочисленной категории химико-технологических процессов, не
сопровождаемых производством или потреблением работы:
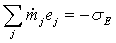 . (2)
. (2)
К
этому необходимо добавить, что тот факт, что мы избавляемся в итоге от явного
«присутствия» слагаемого полной работы 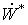 в
интегральных уравнениях баланса эксергии, не умаляет значения понятия полной
работы в обосновании физического смысла функции эксергии.
в
интегральных уравнениях баланса эксергии, не умаляет значения понятия полной
работы в обосновании физического смысла функции эксергии.
1.4.2 Оценки основных составляющих потерь эксергии в
трубчатой печи
К основным составляющим потерь эксергии в Т.П. относятся:
) потери при горении метана в межтрубном пространстве Т.П.;
) потери при передаче теплоты через стенки реакционных труб;
) потери в процессе конверсии метана, осуществляемом в реакционных
трубах; 4) потери на смешение метана и водяного пара перед конверсией;
) потери на смешение метана и воздуха на входе в камеру сгорания
(межтрубное пространство Т.П.).
.4.3 Потери эксэргии в шахтном
реакторе
Так как Ш.Р. - адиабатический аппарат, то потери
эксэргии в нем определяются по более простой, чем (3.1), формуле
 , (3)
, (3)
где
модуль каждого слагаемого в сумме по входам и выходам можно представить в виде:
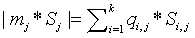
здесь
Si,j, Дж К-1 моль-1 − парциальная
энтропия i-го вещества на j-м входе (выходе); q{ j, моль с-1
− абсолютная величина потока i -го вещества на у -м входе (выходе)
системы; k − число химических компонентов в системе. Парциальная
энтропия i-го идеального газа в смеси при температуре Tj равна
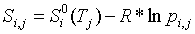
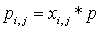 , (4)
, (4)
где
в приближении постоянной теплоемкости
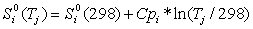 (5)
(5)
.
Скорость производства энтропии в Ш.Р.
Производство
энтропии в Ш.Р. согласно (3.2) - (3.3) и в соответствии с системой нумерации
потоков, принятой на рис. 3.1, равно

Парциальные
давления газов на входах в Ш.Р. при расчете по уравнению (3.6) берутся до
смешения входящих потоков, поэтому энтропия смешения газов включена в
рассчитываемую величину производства энтропии.
2.
Потери на смешение потоков в головной части Ш.Р.
Рассчитаем
энтропию смешения (точнее говоря, скорость ее производства) двух потоков смесей
идеальных газов при следующих условиях: 1) потоки до смешения имеют одни и те
же температуры и давления; 2) смешиваемые потоки не содержат одинаковых
компонентов. В этом случае, как следует из уравнений (3.2) - (3.4),
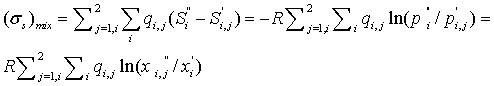
где
j=1 соответствует первому смешиваемому потоку, j = 2 − второму,
индекс «'» соответствует состоянию до смешения, а индекс «"» − после
смешения потоков. Обозначим  ,
,  (для каждого I поток
(для каждого I поток  отличен
от нуля лишь для одного из значений j), тогда мольные доли в первом
потоке равны
отличен
от нуля лишь для одного из значений j), тогда мольные доли в первом
потоке равны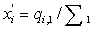 , во втором потоке
, во втором потоке 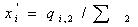 и после
смешения
и после
смешения 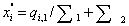 . С учетом сделанных обозначений
. С учетом сделанных обозначений
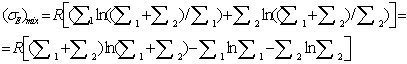
Уравнение,
описывающее смешение стационарных потоков идеальных газов, подобно выражению
для энтропии смешения конечных количеств газов. Обозначим через х долю
1-го потока в суммарном потоке после смешения,  , тогда доля 2-го потока
, тогда доля 2-го потока 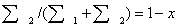 ; подставляя эти обозначения в первое равенство (3.8),
получим:
; подставляя эти обозначения в первое равенство (3.8),
получим:
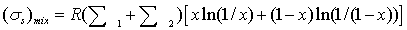
или,
возрастание энтропии в расчете на 1 моль веществ в образующемся после смешения
потоке

.5
Технологическая схема получения синтез-газа в агрегате синтеза аммиака
мощностью 1360 т/сут
Природный
газ, содержащий до SO мг/м3 серы, поступает на производство аммиака
с давлением 0,5-0,9 МПа и распределяется на дв2 потока: для технологического
процесса и для сжигания.
Для
гидрирования сераорганических соединений в технологический поток природного
газа подается азотоводородная смесь в количестве, обеспечивающем содержание
водорода в газовой смеси перед сероочисткой, равной 10% (об.). При нормальной
работе азотоводородная смесь поступает после метанирования, в пусковой период
подается со стороны.
Природный газ, смешанный с азотоводородной смесью, поступает на
центробежный компрессор, в котором сжимается до давления 4,1-4,5 МПа. Затем
газовая смесь перед поступлением на сероочистку нагревается в огневом
подогревателе до температуры 670 К дымовыми газами, образующимися при сжигании
природного газа. После огневого подогревателя газовая смесь проходит реактор
гидрирования сераорганических соединений, который загружен
алюмо-кобальт-молибденовым или алюмоникель-молибденовым катализатором, и затем
последовательно проходит два сероочистных аппарата для поглощения сернистых
соединений, загруженных оксидом цинка. При насыщении поглотителя серой его
заменяют свежим, не останавливая агрегат. После сероочистки газовая смесь,
очищенная до содержания серы не менее 0,5 мг/м3, с температурой 640 К
и давлением 3,9 МПа направляется на паровую конверсию метана в трубчатую печь.
Перед печью газовая смесь смешивается с водяным парим до соотношения пар :
природный газ, равного 4 : 1
После смешивания парогазовая смесь с температурой 620-650 К направляется
в подогреватель, расположенный в конвекционной зоне трубчатой печи, где
нагревается за счёт теплоты дымовых газов до температуры 780-810 К. Нагретая
парогазовая смесь направляется в реакционные трубы печи паровой конверсии
метана.
СН4 + Н2О =3 Н2 + СО (1)
СО + Н2О = Н2 + СО2 (2)
В реакционных трубах на никелевом катализаторе под давлением 3,7 - 4 МПа,
при температуре на выходе 1100К и объёмной скорости 1750 ч^-1 осуществляется
эндотермический процесс паровой конверсии метана и других УВ с получением водорода,
оксидов углерода (II) и (IV) в соотношении, близком к равновесному, при
температуре 1000 К. Содержание остаточного метана в конвертированном газе на
выходе из труб печи паровой конверсии близко к равновесному и составляет
9,2-10% (об).
Теплоту, необходимую для эндотермического процесса
паровой конверсии метана, получают за счёт сжигания смеси природного газа с
танковыми и продувочными газами в горелках, размещённых на потолке печи между
рядами реакционных труб. Тепловое напряжение, отнесенное к внутренней
поверхности реакционных труб, составляет 350 • 103кДж/(м2-
ч). Расчетная температура стенки труб составляет 1200 К. Трубчатая печь, кроме
радиационной зоны с реакционными трубами, оснащена конвекционной зоной с блоком
теплоиспользующей аппаратуры (БТА) и вспомогательной печью, в которой за счет
сжигания природного газа образуется пар давлением 10,5 МПа. Дымовые газы после
вспомогательной печи направляются в конвекционную зону печи. Теплота дымовых
газов, выходящих из печи при температуре 1310 К, используется:
для подогрева парогазовой смеси, поступающей в
реакционные трубы, до температуры 780-800 К;
для подогрева паровоздушной смеси, направляемой в
конвертор метана II ступени, до температуры 755 К;
для перегрева пара в двухступенчатом пароперегревателе
до 760 К;
для подогрева деаэрированной воды, поступающей на
питание котлов от 375 до 590 К;
для подогрева природного газа, подаваемого на сжигание
в горелках трубчатой печи, до температуры 420 К.
Дымовые газы трубчатой печи после использования их
теплоты в БТА с температурой 470-510 К выбрасываются дымососами через
дымовую трубу 5 в атмосферу В новых технологических схемах предусмотрена
каталитическая очистка дымовых газов от оксидов азота
После трубчатой печи конвертированная парогазовая
смесь по футерованному соединительному трубопроводу подается в шахтный
конвертор метана второй ступени. Конверсия остаточного метана в нем
осуществляется паром и воздухом на никелевом катализаторе.
В верхней части шахтного конвертора расположен смеситель, в который через
центральную трубу поступает паровоздушная смесь с температурой 755 К, а по
кольцевому пространству - парогазовая смесь с температурой 1100 К. Воздух в
конвертор подается центробежным компрессором с приводом от конденсационной
паровой турбины. Он не должен содержать соединений серы и хлора.
Количество воздуха для процесса подбирают таким образом, чтобы перед
отделением синтеза обеспечить соотношение Н2 : N2 = 3 : 1. Перед подачей в
конвертор метана в воздух постоянно дозируется пар с давлением 1,1 МПа и температурой
640 К. Соотношение пар : воздух составляет 0,1 : 1.
После смесителя паровоздушная смесь поступает па
никелевый катализатор. Для предохранения от перегрева и обеспечения нормальной
роботы катализатора над ним в конверторе метана имеется свободный объем, где
происходит горение части газа с кислородом воздуха. Затем парогазовая смесь
проходит последовательно через шестигранные огнеупорные плитки, служащие для
равномерного распределения газового потока по сечению конвертора, слой
термостойкого алюмохромового катализатора, а затем никелевого катализатора.
Процесс конверсии метана осуществляется при температуре на выходе 1270 К и
объемной скорости 3500 ч^-1.
Остаточное содержание метана в сухом конвертированном
газе составляет 0,35-0,55% (об).
Конвертированная парогазовая смесь после шахтного
конвертора метана охлаждается в котлах-утилизаторах I ступени, II ступени и с
температурой 650 К направляется через увлажнитель на конверсию оксида
углерода (II).
После увлажнителя конвертированная смесь с соотношением
пар : газ =0,57 поступает в конвертор I ступени II, где на среднетемпературном
железохромовом катализаторе при температуре на выходе 723 К, объёмной скорости
до 2000 ч^-1 протекает реакция конверсии оксида углерода (II) с водяным паром.
Остаточное содержание оксида углерода (II) после конвертора I составляет 3,7%
(на сухой газ)
После конвертора I теплота парогазовой смеси
используется для получения насыщенного пара с давлением 10,5 МПа в
котле-утилизаторе. При этом парогазовая смесь охлаждается до 603 К.
Затем парогазовая смесь охлаждается до температуры 493
К в подогревателе, нагревая при этом очищенный от СО2 конвертированный газ
перед метанированием до 593 К. После подогревателя парогазовая смесь с
температурой 493 К и соотношением пар : газ =0,45 поступает в конвертор СО II
ступени, где на низкотемпературном медьсодержащем катализаторе при объёмной
скорости 2000 ч^-1 и температуре на выходе 523 К происходит конверсия СО с
водяным паром до содержания СО в конвертированном газе 0,15-0,5% (об) (на сухой
газ).
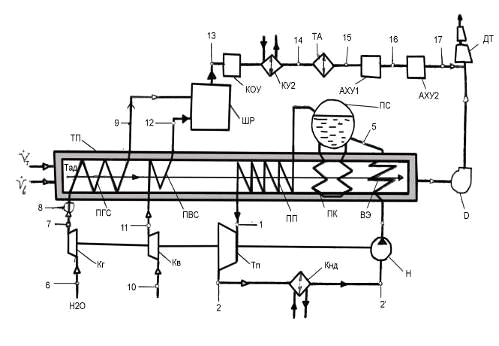
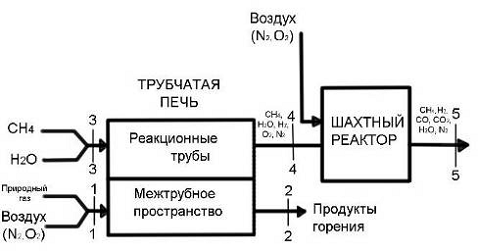
Схема получения технологического газа
двухступенчатой конверсией природного газа:
ТП - трубчатая печь; Кг - компрессор газовый;
Ка - компрессор воздушный; Тп - турбина паровая; Н - насос питательный; ВЭ -
водяной экономайзер; ПК - паровой котёл; ПП - пароперегреватель; Кнд -
конденсатор; ПГС - подогреватель газовой смеси; ПВС - подогреватель воздушной
смеси; Д - дымосос; ШР - шахтный реактор; КОУ - конвектор оксида углерода; ТА -
технологический аппарат; КУ2 - котёл-утилизатор; АХУ 1,2 - абсорбционные
холодильные установки; ДТ - дымовая труба.
Данный аппарат выполняет в рассматриваемой схеме две
важные функции: увеличение степени конверсии метана за счет значительного
повышения температуры по сравнению с температурой, достигаемой в Т.П., и
приготовление смеси газов с необходимым содержанием азота для последующего
синтеза аммиака.
Далее полученная азотоводородная смесь освобождается
от углекислого газа абсорбцией раствором моноэтаноламина или бикарбоната калия
в технологическом блоке 7. Оставшиеся в смеси незначительные примеси оксидов
углерода, являющихся ядами для катализатора синтеза аммиака, нейтрализуют во
вспомогательном каталитическом реакторе - метанаторе, в котором реакции (1) и
(2) протекают справа налево, превращая оксиды углерода в метан, инертный по
отношению к катализатору синтеза аммиака. Из метанатора очищенная
азотоводородная смесь идет в отделение синтеза аммиака, небольшая часть смеси
поступает в головной аппарат схемы.
Глава 2. Теоретическая часть
2.1 Введение
Промышленная печь представляет собой
энерготехнологический агрегат, предназначенный для термической обработки
материалов с целью придания им необходимых свойств. Этот процесс, как правило,
связан со сложными химическими и физико-химическими процессами.
Источником теплоты в топливных печах служат различные
виды углеродного топлива (газ, мазут и т.д.), процесс генерации теплоты в них
органически сочетается с теплообменом в зоне технологического процесса.
Термодинамические расчеты печей позволяют получить
величину и знак теплового эффекта реакций в печи и определить возможный
механизм процесса термической переработки топлива.
В данной работе проводится эксергетический анализ
установки паровоздушной конверсии метана (трубчатая печь + шахтный реактор),
определение КПД трубчатой печи, шахтного реактора, а так же суммарный расчет
КПД узла конверсии метана при производстве аммиака мощностью 1360 т/сут, а так
же основных характеристик процессов в печи конверсии метана - теплоты и работы,
фундаментальное значение для которого имеет закон сохранения энергии. Кроме
того, поставлена задача разработки энергосберегающей технологии, то есть
включения в энерго-химико-технологическую систему (ЭХТС) энерготехнологических
установок, которые не используют поступающую извне электроэнергию и теплоту,
так как потребности в них покрываются (частично пли полностью) тепловыми или
горючими отходами самого производства.
Технологические
газы, получаемые на выходе из трубчатой печи и шахтного реактора - смесь 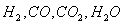 используют в агрегатах синтеза аммиака и метанола.
используют в агрегатах синтеза аммиака и метанола.
2.2
Термодинамический анализ установки
Термодинамический
анализ, основанный на использовании балансовых уравнений эксергии, позволяет
получить количественные характеристики степени совершенства термодинамического
процесса. Наиболее объективной оценкой степени термодинамического совершенства
процесса является эксергетический КПД, который для технологической установки,
не производящей механической работы, имеет вид:
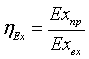
Где
 соответственно эксергия, вносимая в установку и
покидающая её с продуктами.
соответственно эксергия, вносимая в установку и
покидающая её с продуктами.
В
обратимом процессе эксергетический КПД. максимален, (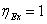 ), в реальных процессах его значение находится между 0
и 1,0.
), в реальных процессах его значение находится между 0
и 1,0.
Эксергия
продуктов может быть вычислена путем расчета потерь эксергии ∑D, тогда
Епр = Евх - ∑D. Эксергетический КПД определяют либо вычисляя Евх
и Епр, либо рассчитывая Eвх и ∑D. Выбор способа
определения КПД зависит в каждом конкретном случае от
имеющейся информации о величинах Евх, Епр и ∑D. В тех случаях, когда
требуется дифференцированно оценить источники потерь эксергии, следует
определять отдельные слагаемые потерь.
Целью
термодинамического анализа явилось определение эксергетического КПД
технологической установки, а также эксергетического КПД её элементов:
топки и печи.
2.3 Цели работы
1. Эксергетический анализ установки двухступенчатой
конверсии метана
2. Определение эксергетического КПД трубчатой
печи
. Определение эксергетического КПД шахтного
реактора
. Определение эксергетического КПД установки в
целом
. Разработка энергосберегающей установки
2.4 Описание технологической схемы
Процесс конверсии метана является двухступенчатым,
1. первая ступень конверсии.
2. вторая ступень доконверсии.
В первой ступени, которой служит трубчатая печь,
совершается конверсия метана с водяным паром; во второй ступени, которой
является шахтный реактор, конверсия метана осуществляется кислородом воздуха.
Очищенный от тяжелых фракций во входном холодильнике-конденсаторе природный газ
сжимается турбокомпрессором ТК от давление Р1
до давления Р2.
Турбокомпрессор - двухступенчатый. После сжатия в первой ступени метан
охлаждается до исходной температуры. Охлаждение осуществляется водой в охладителе
ОХ.
Пройдя аппарат сероочистки нагретый до газ смешивается
с водяным паром и подается в трубчатую печь, в первую её ступень -
подогреватель газовой смеси ПГС. Трубчатая печь состоит из двух последовательно
включенных по ходу газа теплообменников: конвективного подогревателя ПГС и
радиантных труб РТ. Конвективный и радиантный подогреватели конструктивно
представляют систему параллельно включенных труб. Радиантные трубы содержат
насадку-катализатор в форме колец Рашига или таблеток.
Химический процесс конверсии метана эндотермический,
поэтому для осуществления такого превращения необходим подвод теплоты к
конвертируемому газу, С этой целью в топке-печи сжигается топливо.
Конвертируемый газ после радиантных труб РТ трубчатой печи ТП направляется с
параметрами Р3, Т3 в конвертор второй ступени - шахтный реактор.
На выходе Ш.Р. в энерготехнологической схеме
производства аммиака получают смесь газов с требуемым содержанием азота для
последующего синтеза аммиака. Монооксид углерода, получаемый на выходе Ш.Р.,
практически полностью вступает затем в реакцию с водяным паром в следующих за
Ш.Р. конвертерах и таким образом заменяется в смеси эквивалентным количеством
молей водорода. Для синтеза аммиака соотношение компонентов в азотоводородной
смеси должно быть близким к стехиометрическому согласно уравнению реакции
3H2+N2=2NH3, следовательно, на выходе Ш.Р. необходимо получить отношение
суммарного количества водорода и монооксида углерода к азоту, близкое к 3:1.
Однако в связи с тем, что часть водорода из азотоводородной смеси используется
на гидрирование остаточных количеств СО и СО2 в метанаторе, а часть - на
гидрирование сернистых соединений в аппарате сероочистки, соотношение
суммарного количества водорода и монооксида углерода к азоту на выходе Ш.Р.
должно быть несколько большим, чем 3 - от 3.05 до 3.12]. Это отношение зависит
от количества серосодержащих веществ в природном газе, от глубины конверсии СО
в СО2 и глубины очистки азотоводородной смеси от диоксида углерода. Целевой
функцией работы отделения конверсии природного газа является не степень
превращения метана, а величина выхода азотоводородной смеси в расчете на моль
конвертируемого метана.
Дымовые газы, образовавшиеся при сжигании топлива в
топке трубчатой печи, передают теплоту конвертируемому газу в РТ и ПГС, потом
воде и водяному пару в котле-утилизаторе КУ. Котел-утилизатор состоит из
водяного экономайзера ВЭ, парового котла ПК, паросборника-сепаратора
пароперегревателя ПП.
После того как дымовые газы, передав теплоту воде в
водяном экономайзере, покинут парогенератор, они с температурой 400°С проходят
очистку и выбрасываются дымососом D через дымовую трубу.
Питательная вода для парогенератора подается
питательным насосом ПП сначала в водяной экономайзер ВЭ, затем в барабан
паросборника ПС.
Из парогенератора выходит перегретый пар с параметрами
Р1, Т1.Перегретый пар, получаемый в парогенераторе, используется в паровой
турбине ПТ для привода турбокомпрессора и насоса, а также и других целей, если
мощность турбины превосходит суммарную мощность турбокомпрессора и насоса.
После совершения работы на лопатках турбины пар конденсируется в конденсаторе
при давлении 0,05 бар и снова подаётся питательным насосом в парогенератор.
Вода, используемая в конденсаторе для охлаждения водяного пара, также
охлаждается с помощью градирни.
Глава 3. Практическая часть
Исходные данные
аммиак эксергетический конверсия метан
1. В качестве топлива был выбран природный газ
Ставропольского месторождения
|
Состав газа по объёму, %
|
|
 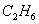 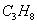   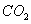 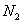 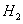
|
|
|
|
|
|
|
|
|
92.8
|
2.8
|
0.89
|
0.2
|
0.03
|
0.49
|
2.5
|
0
|
2. Температура окружающей среды 298,15 К
3. Давление окружающей среды 760 мм. рт.ст.
. Производительность аммиака составляет 1360
т/сут
3.1 Конверсия метана в трубчатой печи
.1.1 Определение расходов природного
газа на конверсию и сжигание для производства 1360 т/сут аммиака
Суммарные
затраты на ПГ на сжигание и конверсию при расчёте на 1 т/сут аммиака составляют
1200 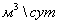 , следовательно, для производства 1360 т/сут
затрачивается 1632000
, следовательно, для производства 1360 т/сут
затрачивается 1632000 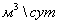 ПГ.
ПГ.
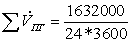 =
18,888889
=
18,888889 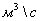
 =
0,843254 кмоль/с
=
0,843254 кмоль/с
Расчет ведётся через водород, получаемый в ходе
конверсии метана и затрачиваемый на синтез аммиака
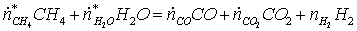 (1)
(1)
 (2)
(2)
Определим
мольные расходы ПГ и метана:
· расход производимого аммиака
составит:
 =
15,740741 кг/с
=
15,740741 кг/с
 =
0,9259259 кмоль/с
=
0,9259259 кмоль/с
· мольный расход водорода в реакции (2) равен количеству
водорода, получаемого в ходе реакции (1)
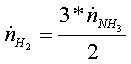 =
=  = 1,3888889 кмоль/с
= 1,3888889 кмоль/с
1. Мольные и объёмные расходы метана, водяного пара и ПГ,
затрачиваемые на конверсию:
Степень превращения:
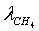 =0,795
=0,795  =0,35
=0,35
Мольный
(объёмный) состав исходной газовой смеси:
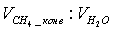 =1 : 4
=1 : 4
Прореагировало:
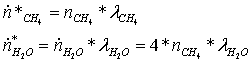
Поэлементарный
материальный баланс по водороду:
 ,
,
отсюда
определим мольный расход затрачиваемого метана:
 =
= 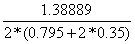 = 0,4645113 кмоль/с
= 0,4645113 кмоль/с
 = 0,4645113*22,4
= 10,405054
= 0,4645113*22,4
= 10,405054 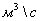
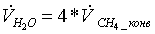 =
4*10,405054 = 41,6202155
=
4*10,405054 = 41,6202155 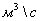
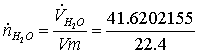 =
1,85804534 кмоль/с
=
1,85804534 кмоль/с
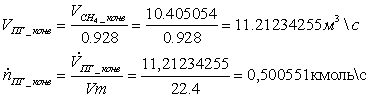
2. Мольные и объёмные расходы метана и ПГ, затрачиваемые на сгорание:
 =
18,888889 -11.21234255 = 7,6765463
=
18,888889 -11.21234255 = 7,6765463 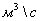
 =
0,342703 кмоль/с
=
0,342703 кмоль/с
 =
7,6765463 *0,928 = 7,123835
=
7,6765463 *0,928 = 7,123835 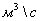
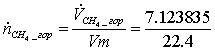 =
0,3180283 кмоль/с
=
0,3180283 кмоль/с
Полученные
данные сводим в таблицу
|
Процесс
|
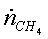 , кмоль/с , кмоль/с , , 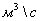  ,
кмоль/с ,
кмоль/с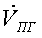 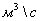
|
|
|
|
|
Конверсия
|
0,4645113
|
10,405054
|
0,500551
|
11,21234255
|
|
Горение
|
0,3180283
|
7,123835
|
0,342703
|
7,6765463
|
3.1.2 Термодинамический анализ процесса горения
Исходные данные и допущения:
1. Процесс горения - адиабатный.
2. Процесс протекает изобарно при давлении 1атм
. Исходные компоненты и продукты сгорания рассматриваются как
идеальные газы.
. Все балансовые выражения записываются на 1 моль топлива.
. Воздух, подаваемый в камеру сгорания, рассматривается как
двухкомпонентная система с объёмным соотношением компонентов

. Воздух,
подаваемый в камеру сгорания, подаётся с избытком. Коэффициент избытка воздуха  =1,03
=1,03
1. ОПРЕДЕЛЕНИЕ СТЕХИОМЕТРИЧЕСКИХ КОЭФФИЦИЕНТОВ В УРАВНЕНИИ ГОРЕНИЯ
ПРИРОДНОГО ГАЗА.
Из уравнений реакций горения компонентов топлива в расчёте на 1 моль
топлива
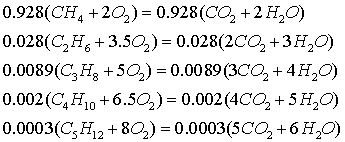
Следует:
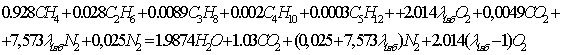
С
учётом того, что  =1,03, уравнение реакции будет иметь вид:
=1,03, уравнение реакции будет иметь вид:

Материальный
баланс:
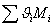 =0,928*16+0,028*30+0,0089*44+0,002*58++0,0003*72+
=0,928*16+0,028*30+0,0089*44+0,002*58++0,0003*72+
+2,074*32+0,049*44+7,828*28=301,9985
г/моль
 =1,9874*18+1,03*44+7,8287*28+0,06042*32=302,0232
г/моль
=1,9874*18+1,03*44+7,8287*28+0,06042*32=302,0232
г/моль
 =
=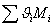
.
ЭНЕРГЕТИЧЕСКИЙ БАЛАНС
.1.
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ АДИАБАТНОГО ГОРЕНИЯ
Рассматриваемый
процесс является стационарным процессом с переменным составом. Совершающимся в
открытой термодинамической системе. В этом случае энергетический баланс
записывается в виде:
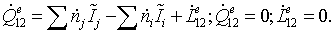
Полученное
балансовое выражение является энтальпийным балансом:

Энтальпия
компонента на входе в камеру сгорания равна стандартной энтальпии образования
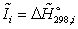 ;
;
на
выходе - определяется из соотношения:
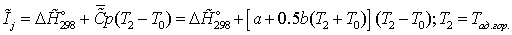
Энтальпии
компонентов на входе в камеру сгорания
|
Компонент
|
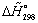 , МДж/кмоль , МДж/кмоль 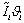 ,
МДж/кмоль ,
МДж/кмоль
|
|
|
|
CH4
|
-74.8
|
0.928
|
-69.4144
|
|
C2H6
|
-84.7
|
0.028
|
-2.3716
|
|
C3H8
|
-103.3
|
0.0089
|
-0.91937
|
|
C4H10
|
-126.15
|
0.002
|
-0.2523
|
|
C5H12
|
-146.44
|
0.0003
|
-0.043932
|
|
N2
|
0
|
7.82877
|
0
|
|
O2
|
0
|
2.0744
|
|
CO2
|
-393.5
|
0.0049
|
-1.92815
|
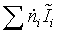 =
-74,929752 МДж/кмоль
=
-74,929752 МДж/кмоль
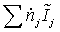 =
= 
Энтальпии компонентов на выходе из камеры сгорания
|
Компонент
|
 , МДж/кмольab , МДж/кмольab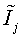 ,
МДж/кмоль ,
МДж/кмоль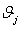
|
|
|
|
|
|
CO2
|
-393.5
|
32.20
|
0.022
|
 1.03 1.03
|
|
|
O2
|
0
|
31.50
|
0.003
|
 0.06042 0.06042
|
|
|
H2O
|
-241.8
|
32.30
|
0.002
|
 1.9874 1.9874
|
|
|
N2
|
0
|
27.90
|
0.004
|
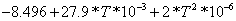 7.8287 7.8287
|
|
Согласно энтальпийному балансу,
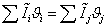
 =
-74,929752, отсюда
=
-74,929752, отсюда
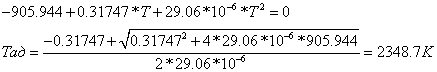
.
ЭКСЕРГЕТИЧЕСКИЙ АНАЛИЗ ПРОЦЕССА ГОРЕНИЯ
Эксергетический
баланс процесса горения:

Потери
эксергетической мощности:

Зависимость
эксергии компонента от температуры и парциального давления выражается
соотношением:
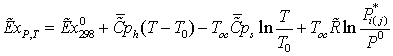
Сечение
1-1:
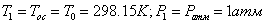
Эксергии
компонентов на входе вычисляем по формуле:

Эксергии
компонентов
|
CH4
|
C2H6
|
C3H8
|
CO2
|
N2
|
O2
|
|
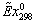 , МДж/кмоль8301494214920,10,73,95 , МДж/кмоль8301494214920,10,73,95
|
|
|
|
|
|
|
|
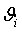 0,9280,0280,00890,00492,074427,828770476 0,9280,0280,00890,00492,074427,828770476
|
|
|
|
|
|
|
|
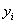 ,
мольн.д.0,0853490,002575190,0008190,0004510,7200199880,190786519 ,
мольн.д.0,0853490,002575190,0008190,0004510,7200199880,190786519
|
|
|
|
|
|
|
|
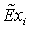 ,
МДж/кмоль823,8991479,22182131,381,001330,11422700,1563805 ,
МДж/кмоль823,8991479,22182131,381,001330,11422700,1563805
|
|
|
|
|
|
|
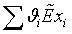 =0,928*823,9+0,028*1479,223+0,0089*2131,381+0,0049*1,00134+2,0744*(-0,11423)+7,829*(-0,1564)=823,753
МДж/кмоль
=0,928*823,9+0,028*1479,223+0,0089*2131,381+0,0049*1,00134+2,0744*(-0,11423)+7,829*(-0,1564)=823,753
МДж/кмоль
Сечение
2-2:
Эксергия
компонентов рассчитывается по формуле:
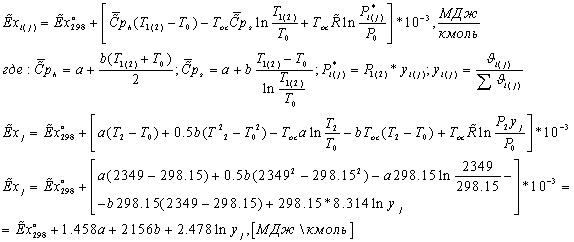
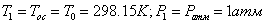
Эксергии
компонентов
|
CO2
|
H2O
|
N2
|
O2
|
|
 , МДж/кмоль20,18,60,73,95 , МДж/кмоль20,18,60,73,95
|
|
|
|
|
|
 1,031,98747,828770,06042 1,031,98747,828770,06042
|
|
|
|
|
|
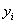 , мольн.д0,0944380,18222010,7178020,00554 , мольн.д0,0944380,18222010,7178020,00554
|
|
|
|
|
|
 57,1177534,5652532,430534,89788 57,1177534,5652532,430534,89788
|
|
|
|
|
|
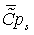 51,6607234,069155931,4383134,15373 51,6607234,069155931,4383134,15373
|
|
|
|
|
|
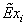 , МДж/кмоль80,5166780,262554336,3181630,10102 , МДж/кмоль80,5166780,262554336,3181630,10102
|
|
|
|
|
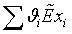 =80.5167*1.03+1.9874*80.26255+7.8288*36.3182+0.06042*30.10102=482.5912
МДж/кмоль
=80.5167*1.03+1.9874*80.26255+7.8288*36.3182+0.06042*30.10102=482.5912
МДж/кмоль
Рассчитаем
величину потерь эксергетической мощности:
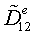 =
823,753 - 482.5912 =341,161 МДж/кмоль
=
823,753 - 482.5912 =341,161 МДж/кмоль
 =
295,1614*0,342703 = 126,29 МВт
=
295,1614*0,342703 = 126,29 МВт
3.1.3
Технологический расчёт и эксергетический анализ процесса конверсии метана
1.
МАТЕРИАЛЬНЫЙ БАЛАНС
Процесс
конверсии метана является эндотермическим. Источником теплоты является горение
топлива.
Исходные
данные:
Объёмный
расход метана 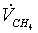 = 10,405054
= 10,405054 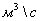
Степень
превращения:  =0,795
=0,795  =0,35
=0,35
Мольный
(объёмный) состав исходной газовой смеси:
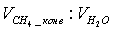 =1 : 4
=1 : 4
Уравнение
реакции конверсии метана:
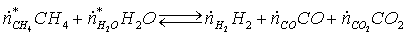
Мольные
потоки на входе в реактор:
 =
0,46451133 кмоль/с
=
0,46451133 кмоль/с
 = 4*
0,46451133 = 1,85804534 кмоль/с
= 4*
0,46451133 = 1,85804534 кмоль/с
Массовый
поток на входе:
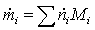 =
0,46451133*16 + 1,85804534*18 = 40,876 кг/с
=
0,46451133*16 + 1,85804534*18 = 40,876 кг/с
Мольные
потоки на выходе:
 =
(1-0,795)*0,46451 = 0,09522482 кмоль/с
=
(1-0,795)*0,46451 = 0,09522482 кмоль/с
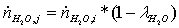 =
(1-0,35)* 1,85804534 = 1,20772947 кмоль/с
=
(1-0,35)* 1,85804534 = 1,20772947 кмоль/с
Прореагировало:
 =
0,46451*0,795 = 0,36928651 кмоль/с
=
0,46451*0,795 = 0,36928651 кмоль/с
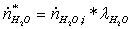 =
1,85804534*0,35 = 0,65031587 кмоль/с
=
1,85804534*0,35 = 0,65031587 кмоль/с
Поэлементный
материальный баланс:
А)
по «С»: 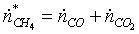
Б)
по «О»: 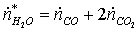
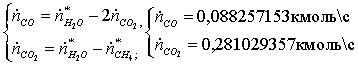
Массовый
поток на выходе:
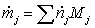 =
0,095225*16 + 1,02077*18 + 0,08826*28 + 0,28103*44 +
=
0,095225*16 + 1,02077*18 + 0,08826*28 + 0,28103*44 +
+
1,3889*2 = 40,876 кг/с
Массовые
потоки на входе и на выходе совпадают. Значит, материальный баланс составлен
правильно.
.
ЭНЕРГЕТИЧЕСКИЙ БАЛАНС ПИРОЛИЗА.
.1.
ОПРЕДЕЛЕНИЕ ПОЛЕЗНОЙ ТЕПЛОВОЙ НАГРУЗКИ
Исходные
данные:
Температура
на входе в реактор и выходе из него:
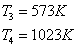
Давление
на входе в реактор:
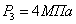
Энергетический
баланс:
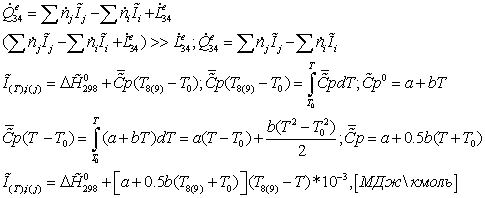
Энтальпии
компонентов на входе и выходе из реактора
|
Компонент
|
 , МДж/кмоль , МДж/кмоль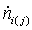 ,
кмоль/с ,
кмоль/с ,К ,К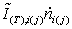 ,
МДж/кмоль ,
МДж/кмоль
|
|
|
|
|
CH4
|
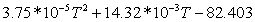 0,46451133573-28,74642442 0,46451133573-28,74642442
|
|
|
|
|
H2O
|
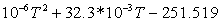 1,85804534573-432,3351375 1,85804534573-432,3351375
|
|
|
|
|
CH4
|
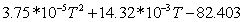 0,095224821023-2,714745686 0,095224821023-2,714745686
|
|
|
|
|
H2O
|
 1,207729471023-262,5961002 1,207729471023-262,5961002
|
|
|
|
|
H2
|
 1,38888889102328,995 1,38888889102328,995
|
|
|
|
|
CO2
|
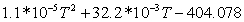 0,281029361023-101,0653458 0,281029361023-101,0653458
|
|
|
|
|
CO
|
 0,088257151023-7,766518478 0,088257151023-7,766518478
|
|
|
|
Тепловая мощность процесса (необходимая для осуществления этого
процесса):
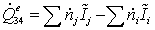 =
-7,766518478 - 101,0653458 + 28,995 -
=
-7,766518478 - 101,0653458 + 28,995 -
262,5961002
- (-28,74642442 -432,3351375) = 115,93 МВт
.
ОПРЕДЕЛЕНИЕ ДАВЛЕНИЯ НА ВЫХОДЕ ИЗ ХИМИЧЕСКОГО РЕАКТОРА
Допущения:
1. Газовые смеси подчиняются законам идеальных газов.
2. Все параметры и характеристики процесса изменяются вдоль длины
змеевика химического реактора по линейному закону.
Параметры трубчатой печи:
Число труб Nтр = 426
Диаметр
трубы 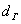 = 0,072 м
= 0,072 м
Длина
трубы 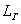 = 42 м
= 42 м
Диаметр
зерна в зернистом слое 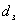 = 0,0027 м
= 0,0027 м
Баланс
кинетической энергии:

Основное
уравнение для расчёта давления - это баланс кинетической энергии для участка
Трубчатой
печи 3-4:
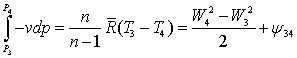
Диссипацию
определим из выражения:

Потери
давления в трубах с насадкой при  определяем
по формуле, применяемой для квазигомогенных зернистых слоёв
определяем
по формуле, применяемой для квазигомогенных зернистых слоёв
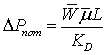
где
 - средняя скорость газа в трубе
- средняя скорость газа в трубе
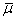 -
средняя вязкость при средней температуре
-
средняя вязкость при средней температуре
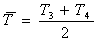
 -
коэффициент проницаемости зернистого однородного слоя:
-
коэффициент проницаемости зернистого однородного слоя: 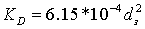
Показатель
политропы:
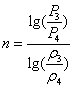
Давление
на выходе из реактора ищем методом итераций:
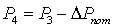
Определим
величины, не изменяющиеся в ходе итераций:
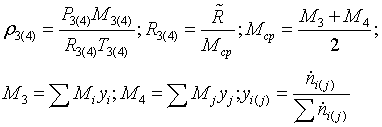
Допустим,
Вычислим
мольные массы в сечениях «3» и «4» :

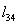
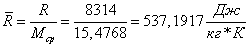
Вычислим
плотности:

Массовый
расход парогазовой смеси:

Живое
сечение пучка труб в трубчатой печи:
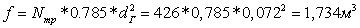
Скорость
потока газов на входе и выходе из реактора:
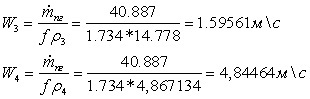
Коэффициент
проницаемости зернистого слоя:

Вязкость
газовой смеси определим как среднее арифметическое средних вязкостей на входе в
реактор и выходе из него:
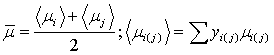
|
Компонент
|
 t, °C t, °C  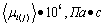
|
|
|
|
|
|
CH4
|
13.4+0.019t
|
300
|
19.1
|
0.2
|
20.06
|
|
H2O
|
8.3+0.04t
|
300
|
20.3
|
0.8
|
|
|
H2O
|
8.3+0.04t
|
750
|
38.9
|
0.5
|
29.15
|
|
H2
|
9.5+0.014t
|
750
|
20
|
0.5
|
|
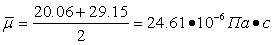

Следовательно:
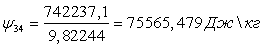
Вычислим
показатель политропы:
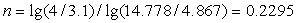
Рассчитаем
располагаемую работу: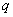
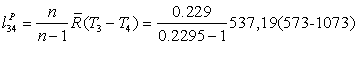 =
72005,32 Дж/кг*К
=
72005,32 Дж/кг*К
Проверка
уравнения баланса кинетической энергии

Расхождение
располагаемой работы и диссипации не превышает 4%, поэтому ограничимся первой
итерацией.
Ответ:

.
ЭКCЕРГЕТИЧЕСКИЙ АНАЛИЗ КОНВЕРСИИ МЕТАНА
Исходные
данные:
Температура
на входе в реактор и выходе из него:
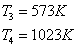
Давление
на входе в реактор и выходе из него:

Сечение
3-3:
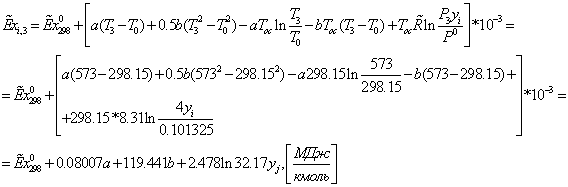
Эксергии
компонентов
|
Компонент
|
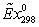 , МДж/кмольab , МДж/кмольab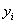 ,
мольн.д ,
мольн.д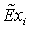 , МДж/кмоль , МДж/кмоль ,кмоль/с ,кмоль/с
|
|
|
|
|
|
|
CH4
|
830
|
14.32
|
0.075
|
0.2
|
839,1014
|
0,4645113
|
|
H2O
|
8.6
|
32.3
|
0.002
|
0.8
|
19,656275
|
1,85804534
|
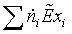 =
839,1014*0,4645 + 19,6563*1,858 = 426,2944 МВт
=
839,1014*0,4645 + 19,6563*1,858 = 426,2944 МВт
Сечение
4-4:
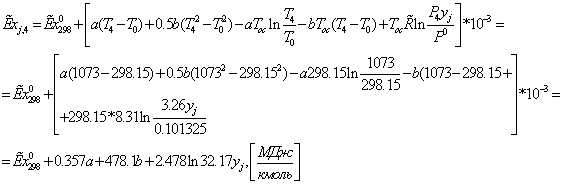
Эксергии
компонентов
|
Компонент
|
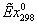 , МДж/кмольab , МДж/кмольab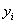 , мольн.д , мольн.д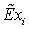 , МДж/кмоль , МДж/кмоль ,кмоль/с ,кмоль/с
|
|
|
|
|
|
|
CH4
|
830.0
|
14.32
|
0.075
|
0,0311077
|
854,81917
|
0,0952248
|
|
H2O
|
8.6
|
32.3
|
0.002
|
0,39453718
|
26,9621961
|
1,20772947
|
|
H2
|
235.0
|
28.8
|
0
|
0,453718
|
251,9328
|
1,388889
|
|
CO2
|
20.1
|
32.2
|
0.022
|
0,091806
|
40,06633
|
0,281029
|
|
CO
|
275.4
|
28.4
|
0.004
|
0,028832
|
286,4091
|
0,088257
|
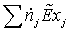 =
854.819*0.09522 + 26.9622*1.20773 + 251.9328*1.3889 +
=
854.819*0.09522 + 26.9622*1.20773 + 251.9328*1.3889 +
+
40.0663*0.28103 + 286.4091*0.088257 = 500,4072 МВт
3.1.4
Разработка энергосберегающей технологии на базе печи конверсии метана
Исходные данные:
Давление
водяного пара на входе в турбину  = 101,3
бар
= 101,3
бар
Температура
водяного пара на входе в турбину 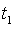 = 500 °С
= 500 °С
Давление
в конденсаторе  = 0,05 бар
= 0,05 бар
Энтропийный
КПД турбины 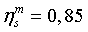
Энтропийный
КПД насоса 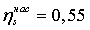

Параметры водяного пара (по i-s диаграмме)
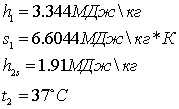
Допущение:
теплообмен между топочными газами и водой происходит без потерь тепла.
РАСЧЁТ
МЕХАНИЧЕСКОЙ МОЩНОСТИ ПАРОСИЛОВОГО ЦИКЛА
Расчёт
проводится как для реального цикла, так и для теоретического.
1-2s Изоэнтропный процесс расширения в турбине
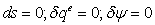
 ;
; 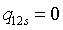
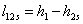 =3,34-1,91=1,434
МДж/г
=3,34-1,91=1,434
МДж/г
-2 Реальный процесс расширения в турбине
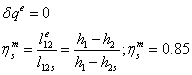
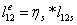 =0,85*1,43=1,2189
МДж/кг
=0,85*1,43=1,2189
МДж/кг
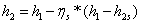 3,34-0,85*(3,34-1,91)=2,1251
МДж/кг
3,34-0,85*(3,34-1,91)=2,1251
МДж/кг
s-3 Теоретический процесс конденсации
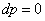
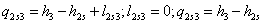
 =4,187*97=0,154919
МДж/кг
=4,187*97=0,154919
МДж/кг
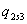 =0,15492-1,91=-1,755081
МДж/кг
=0,15492-1,91=-1,755081
МДж/кг
-3 Реальный процесс конденсации
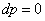

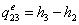 =0,154919-2,1251=1,97081
МДж/кг
=0,154919-2,1251=1,97081
МДж/кг
-4s Изоэнтропный процесс в насосе
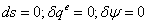
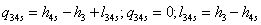 ;
;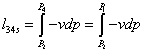
 =154,919+0,00102*(100-0,05)=0,1651139
МДж/кг
=154,919+0,00102*(100-0,05)=0,1651139
МДж/кг
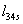 =-0,00102*(100-0,05)*100=-10.1949
кДж/кг = 0.0101949 МДж/кг
=-0,00102*(100-0,05)*100=-10.1949
кДж/кг = 0.0101949 МДж/кг
-4 Реальный процесс в насосе
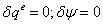
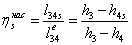
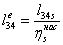 =(-10.1949/0,55)=-0,0185362
МДж/кг
=(-10.1949/0,55)=-0,0185362
МДж/кг
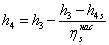 =15,919-((154,919-165,1139)/0,55)=0,1734552
МДж/кг
=15,919-((154,919-165,1139)/0,55)=0,1734552
МДж/кг
s-1 Теоретический процесс в котле-утилизаторе
dp=0;

 =3,34-0,1651139=3,1788861
МДж/кг
=3,34-0,1651139=3,1788861
МДж/кг
-1 Реальный процесс в котле-утилизаторе
=0
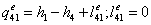
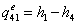 =3,34-0,1734552=3,1705
МДж/кг
=3,34-0,1734552=3,1705
МДж/кг
Теплота
и работа обратимого и необратимого циклов
|
Обратимый цикл
|
|
|
|
|
q
|
l
|
|
1-2s
|
0
|
1,434
|
|
2s-3
|
-1,755081
|
0
|
|
3-4s
|
0
|
-0,010195
|
|
4s-1
|
3,1788861
|
0
|
|
∑
|
1,4238051
|
1,4238051
|
|
Необратимый цикл
|
Qe
|
Le
|
|
1-2
|
0
|
1,2189
|
|
2-3
|
-1,970181
|
0
|
|
3-4
|
0
|
-0,01854
|
|
4-1
|
3,17054482
|
0
|
|
∑
|
1,20036382
|
1,200364
|
Зависимость энтальпии газов от т-ры на 1 кмоль топлива
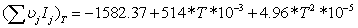 =325,503
МДж/кг
=325,503
МДж/кг
Расход
топлива:  =0,328 кмоль/с
=0,328 кмоль/с
Тепловая
мощность парогенератора:
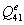 =0,328*325,503
=111,55091 МВт
=0,328*325,503
=111,55091 МВт
В
реальном цикле:

Расход
воды:
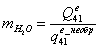 =(111,55091
/3,1705)= 35,183515кг\с
=(111,55091
/3,1705)= 35,183515кг\с
Механическая
мощность паросилового цикла:
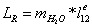 =35,18351*1,2189=42,885187МВт
=35,18351*1,2189=42,885187МВт


3.1.5
Определение эксергетического КПД химического реактора
Эксергетический
КПД химического реактора определяется из соотношения:
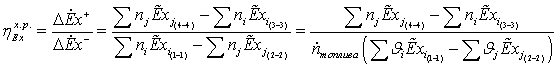
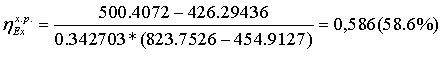
Эксергетический
КПД химического реактора также можно определить по следующему уравнению:
 ,
,
Где
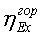 - Эксергетический КПД горения топлива
- Эксергетический КПД горения топлива
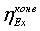 -
Эксергетический КПД конверсии метана
-
Эксергетический КПД конверсии метана
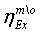 -
Эксергетический КПД теплообмена
-
Эксергетический КПД теплообмена
Определим
эксергетический КПД горения топлива:
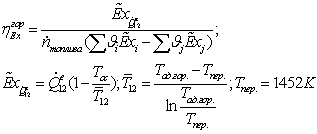

Определим
эксергетический КПД конверсии метана:
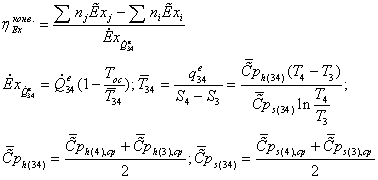

Продукты
реакции
|
CH4
|
H2O
|
CO2
|
CO
|
H2
|
|
 63,86312533,6211546,7326531,042328,8 63,86312533,6211546,7326531,042328,8
|
|
|
|
|
|
|
 58,41427933,475847445,1343230,7516928,8 58,41427933,475847445,1343230,7516928,8
|
|
|
|
|
|

Исходные
компоненты
|
CH4
|
H2O
|
|
 46,98812533,17115 46,98812533,17115
|
|
|
|
 45,87379933,1414346 45,87379933,1414346
|
|
|
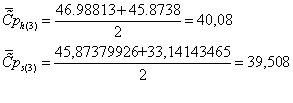
Отсюда
находим:
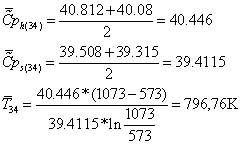

Определим
эксергетический КПД теплообмена:

Эксергетический
КПД химического реактора:
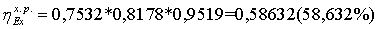
3.2
Шахтная доконверсия
3.2.1
Эксергетический анализ процесса вторичного рифоминга метана
1.
ОПРЕДЕЛЕНИЕ ЭКСЕРГЕТИЧЕСКОГО КПД ШАХТНОГО РЕАКТОРА
Входные
данные:
.
Мольный поток на входе в Ш.Р. равен выходному потоку из реактора трубчатой
печи: 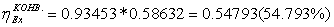
Степень
превращения метана в Ш.Р.: 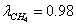
Степень
превращения монооксида углерода: 1ая ступень 
ая
ступень 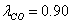
Параметры
подаваемого газового потока:
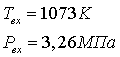
.
Параметры подаваемого в Ш.Р. воздуха:

Воздух,
подаваемый в Ш.Р., рассматривается как двухкомпонентная система с объёмным
соотношением компонентов

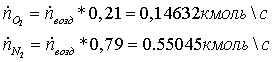

Выходные
данные:
Мольный
поток:
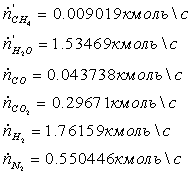
Мольные
доли компонентов:

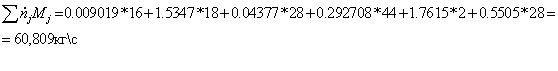
Входящие
и выходящие мольные потоки проверим материальным балансом:
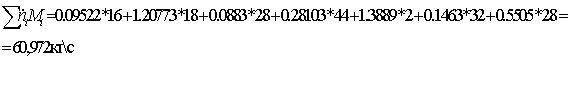
Баланс
составлен правильно.
Зависимость
эксергии компонента от температуры и парциального давления выражается
соотношением:
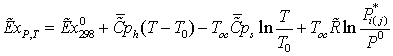
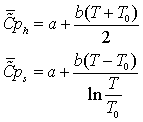
Сечение
4-4:
Эксергии
компонентов
|
Компонент
|
 , МДж/кмольab , МДж/кмольab ,
мольн.д ,
мольн.д , МДж/кмоль , МДж/кмоль ,кмоль/с ,кмоль/с
|
|
|
|
|
|
|
CH4
|
830.0
|
14.32
|
0.075
|
0,0311077
|
854,81917
|
0,0952248
|
|
H2O
|
8.6
|
32.3
|
0.002
|
0,39453718
|
26,9621961
|
1,20772947
|
|
H2
|
235.0
|
28.8
|
0
|
0,453718
|
251,9328
|
1,388889
|
|
CO2
|
20.1
|
32.2
|
0.022
|
0,091806
|
40,06633
|
0,281029
|
|
CO
|
275.4
|
28.4
|
0.004
|
0,028832
|
286,4091
|
0,088257
|
Подаваемый воздух
|
Компонент
|
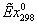 , МДж/кмольab , МДж/кмольab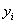 ,
мольн.д ,
мольн.д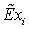 , МДж/кмоль , МДж/кмоль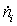 ,кмоль/с ,кмоль/с
|
|
|
|
|
|
|
O2
|
3,95
|
31,5
|
0,003
|
0.21
|
15,1418024
|
0,14632107
|
|
N2
|
0,7
|
27,9
|
0,004
|
0..79
|
20,732495
|
0,550445931
|
 =
854.819*0.09522 + 26.9622*1.20773 + 251.9328*1.3889 + 40.0663*0.28103 +
286.4091*0.088257 + 0.14632*15.1418 + 0.55045*20.7325= 514,0349 МВт
=
854.819*0.09522 + 26.9622*1.20773 + 251.9328*1.3889 + 40.0663*0.28103 +
286.4091*0.088257 + 0.14632*15.1418 + 0.55045*20.7325= 514,0349 МВт
Сечение
5-5:
Эксергии
компонентов
|
Компонент
|
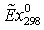 , МДж/кмольab , МДж/кмольab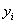 ,
мольн.д ,
мольн.д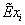 , МДж/кмоль , МДж/кмоль ,кмоль/с ,кмоль/с
|
|
|
|
|
|
|
CH4
|
830.0
|
14.32
|
0.075
|
0,002151411
|
825,28065
|
0,009019
|
|
H2O
|
8.6
|
32.3
|
0.002
|
0,366086999
|
15,9604757
|
1,534685
|
|
H2
|
235.0
|
28.8
|
0
|
0,420191928
|
242,4887
|
1,8215
|
|
CO2
|
20.1
|
32.2
|
0.022
|
0,069823184
|
23,76866
|
0,292708
|
|
CO
|
275.4
|
28.4
|
0.004
|
0,010441942
|
273,7942167
|
0,043774
|
|
N2
|
0,7
|
27,9
|
0,004
|
0,131304534
|
5,345325
|
0,550446
|
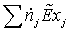 = 486,80613
МВт
= 486,80613
МВт
КПД
шахтного реактора:

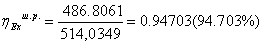
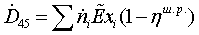
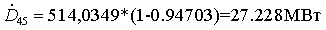
3.3
Определение эксергетического КПД узла конверсии метана
Суммарный
КПД установки конверсии метана можно определить по следующему отношению:
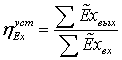
Где
 - сумма потоков эксергий всех компонентов, вводимых в
систему
- сумма потоков эксергий всех компонентов, вводимых в
систему
 - сумма
потоков эксергий всех компонентов, выводимых из системы (также включает в себя
механическую мощность паросилового цикла)
- сумма
потоков эксергий всех компонентов, выводимых из системы (также включает в себя
механическую мощность паросилового цикла)
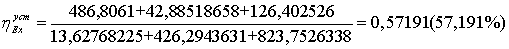
Заключение
В данной работе была рассмотрена схема конверсии
метана, состоящая из трубчатой печи и шахтного реактора. Учтены технологические
особенности данного процесса. Определены КПД, характеризующие процессы,
протекающие в данной системе. Полученные результаты удовлетворяют физическим
представлениям.
Для процесса адиабатного горения топлива составлен
материальный баланс этого процесса, рассчитана температура адиабатного горения.
Составлен эксергетический баланс и определена величина эксергетического КПД
процесса горения.
Так как процесс первичной конверсии метана на первой
ступени является процессом эндотермическим, то к реагентам подводится теплота,
получаемая в процессе горения. Методом итераций определено давление на выходе
из зоны реакции.
По данным о производстве аммиака были получены
величины расхода природного газа на конверсию и сжигание.
Были определены КПД процесса конверсии, горения и
теплообмена, по которым определён КПД хим. реактора. Также посчитан КПД
шахтного реактора и КПД установки в целом.
Разработана энергосберегающая технология, в которую
включён паросиловой цикл Ренкина. Паросиловой цикл применяется для отвода
теплоты от топочных газов путем передачи её воде, которая переходит в
перегретый водяной пар, который поступает в паровую турбину, на которой
происходит выработка электроэнергии, которая затрачивается на нужды
производства.
Список использованной литературы
1. Лейбуш А. Г. Производство технологического газа для синтеза аммиака и
метанола из углеводородных газов. М, Химия, 1971. 286с.
2.
Справочник
азотчика - Издание 2-е, переработанное. - М. Химия, 1986. 511 с.
3.
И.Л. Лейтес, М.Х.
Сосна, В.П. Семёнов. Теория и практика химической энерготехнологии - М. Химия,
1988
4.
Сафонов М.С.,
Пожарский С.Б. Метод интегральных уравнений баланса потоков массы, энергии и
эксергии в анализе химико-технологических систем.
5.
Мельников Е.Я.,
Салтанова В.П., Наумова А.М. Технология неорганических веществ и минеральных
удобрений.
6.
Ведерников М.И.,
Кобозев В.С., Рудой И.В. Технология соединений связанного азота.
7.
Атрощенко В.И.
Технология связанного азота.
8.
Баскаков А.П.,
Берг О.К., Витт О.К. Теплотехника - М. Энергоатомиздат. 1991 - 224 с.
9.
А.И. Дементьев,
В.А. Миронов, Н.Д. Волошин, С.В. Миносьянц. Теплотехнические расчеты печей
химической промышленности - Москва, 1985. 58с.
10.
В.А Смирнов, Л.Ф. Шибаева, С.В. Миносьянц. Термодинамические расчеты основных
процессов в энерго-химико-технологических системах - Москва, 1988. 68с.