Синтез оксида серы VI
Содержание
Введение
Синтез оксида серы VI
Задание на курсовую работу
Расчеты
Выводы
Список использованной литературы
Введение
Химическая Технология - это наука о наиболее
экономичных и экологически обоснованных методах химической переработки сырья в различные
виды продуктов и энергию с применением химических реакций.
Химические процессы и реакторы, объединенные в
химико-технологические системы, составляют основу производства во многих
отраслях промышленности, в том числе химической, нефтехимической, минеральных
удобрений, металлургии черных и цветных металлов, целлюлозной и лесохимической,
строительных материалов, пищевой, химико-фармацевтической, фото- и
киноматериалов. Продукты химической промышленности обеспечивают химизацию всего
народного хозяйства, в том числе и агропромышленного комплекса.
Развитие химической промышленности требует все
больше делать акцент на разработку и внедрение высокоэффективных энерго- и
ресурсосберегающих, а также экологически чистых технологий.
Химико-технологическими методами производят
десятки тысяч продуктов, изучение технологии которых в общем курсе химической
технологии невозможно. В этом и нет необходимости, так как по мере развития
химической технологии все более типизируются химические процессы и реакторы.
Разработаны химико-технологические системы с однотипными процессами и
реакторами, которые можно применять в производстве многих химических продуктов
с учетом не принципиальной специфики. Поэтому инженерам-технологам-химикам
необходимо твердое знание общих закономерностей химической технологии, наиболее
типичных химико-технологических процессов и реакторов, принципов создания
рациональных автоматизированных химико-технологических систем.
Центральным аппаратом в любой
химико-технологической системе, включающей целый ряд машин и аппаратов,
является химический реактор - аппарат, в котором протекает химический процесс.
Выбор типа, конструкции и расчет химического реактора - одна из важных задач
химической технологии.
В данной курсовой работе решается похожая задача
с некоторыми упрощениями. Выбор реактора, адиабатического по условию, будет
проводиться из 2х типов: реактора полного смешения и реактора идеального
вытеснения.
Протекающие в реакторах химические реакции
сопровождаются тепловыми эффектами. При отсутствии теплообмена с окружающей
средой химический реактор является адиабатическим. В нем вся теплота,
выделяющаяся или поглощающаяся в результате химических процессов, расходуется
на «внутренний» теплообмен - на нагрев или охлаждение реакционной смеси.
Реактор идеального вытеснения (РИВ) - реактор, в
котором при прохождении потока идеального вытеснения через реакционную зону все
частицы движутся с одной скоростью, не перемешиваясь друг с другом. Если
выделить в потоке малый объем, то этот объем будет двигаться, как поршень,
вытесняя предыдущие элементы потока. В реакторе идеального вытеснения
перемешивание носит локальный характер: оно происходит в каждом элементе
потока, а между соседними по оси реактора элементами перемешивания нет.
Идеальное вытеснение возможно при выполнении
следующих допущений: 1) движущийся поток имеет плоский профиль линейных
скоростей; 2) отсутствует обусловленное любыми причинами перемешивание в
направлении оси потока, параметры процесса (концентрации, температуры и т.д.)
полностью выровнены, но плавно изменяются по длине или высоте реакционной зоны.
Вследствие одинаковой скорости всех частиц время
прохождения ими любого отрезка по длине реакционной зоны и время пребывания в
ней одинаковы. В данном случае истинное время пребывания каждой частицы равно
среднему времени пребывания, рассчитанного по отношению объема реакционной зоны
к объемному расходу смеси.
В реальном реакторе можно приблизиться к режиму
идеального вытеснения, если реакционный поток - турбулентный и при этом длина
канала существенно превышает его поперечный размер.
Реактор полного смешения (РПС) - реактор, в
котором при прохождении потока полного смешения частицы, поступающие в
реакционную зону, мгновенно смешиваются с частицами, уже находящимися в этой
зоне, т.е. равномерно распределяются по всей длине и во всем объеме реакционной
зоны. Допускается, что в результате интенсивного перемешивания устанавливаются
абсолютно одинаковые условия в любой точке реактора: концентрации реагентов и
продуктов, степени превращения реагентов, температура, скорость химической
реакции.
Чтобы перечисленные допущения могли быть
выполнены, необходимо принять еще одно условие: переход от одной концентрации к
другой не должен иметь протяженности во времени.
На входе в реакционную зону концентрации,
степени превращения, скорость реакции изменяются скачкообразно вследствие
мгновенного смешения компонентов, содержащихся в потоке до входа в реакционную
зону, с компонентами, находящимися в реакционной зоне. Время пребывания частиц
в реакционной зоне потока полного смешения распределено неравномерно. При
среднем значении времени пребывания часть частиц покинет реакционную зону
раньше, другие задержатся дольше. Смешение исходных реагентов с продуктами
реакции и неравномерность времени пребывания частиц в реакционной зоне приводят
к уменьшению движущей силы процесса по сравнению с проведением его в реакторе
идеального вытеснения.
При отсутствии теплообмена с окружающей средой
изменение энтальпии реакционной смеси определяется лишь тепловыми эффектами
реакций, протекающих в потоке. В реакционной зоне реакторов полного смешения
всегда устанавливается изотермический температурный режим независимо от
значений теплового эффекта, концентраций исходных веществ и степеней
превращения вследствие полного перемешивания и выравнивания температуры во всем
объеме реактора.
Синтез оксида серы VI
Оксид серы (VI)
SО3) (cе́рный
ангидри́д,
трео́кись
cе́ры)
SO3 - в обычных
условиях легколетучая бесцветная жидкость с удушающим запахом. Температура
плавления 16,9 °C, кипения 45
°C. При температурах
ниже 16,9 °C застывает с
образованием смеси различных кристаллических модификаций твёрдого SO3.
При охлаждении из пара сначала образуется бесцветная, похожая на лёд, масса,
которая затем переходит в белые «шёлковистые» кристаллы. Обе модификации на
воздухе «дымят» (образуются капельки H2SO4)
вследствие высокой гигроскопичности SO3.
SО3 получают
окислением SО2 только в
присутствии катализатора (Рt
или \/2О5) и высоком давлении to
SO2 + O2 = 2SO3 + Q
Необходимость использования катализатора в этой обратимой
реакции обусловлена тем, что сместить равновесие вправо можно только при
понижении температуры (поскольку реакция экзотермическая!), однако при низких
температурах сильно падает скорость протекания реакции. Поэтому, так же, как в
случае синтеза аммиака приходится искать компромиссное решение. Поскольку для
оптимального сдвига равновесия (1) вправо требуется низкая температура, а для
достижения удовлетворительной скорости - высокая температура, на практике
процесс проводят при температуре 400-450 °С.
Задание на курсовую работу
Проанализировать изменение скорости окисления SO2
от T, P
и концентрации SO2
SO2 + O2
= 2SO3 + Q
Исходные концентрации реагентов: Z0SO2
= 0.07; Z0O2
= 0.09; Z0SO3
= 0.02; остальное инертное вещество (N2)
Кинетическое уравнение:
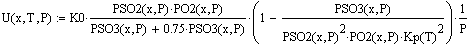
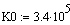 ;
; 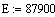
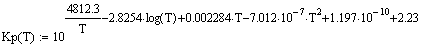
T =
400-1200К; Р = 1-10 атм
Сравнить объем адиабатического
реактора идеального вытеснения и полного смешения зависимости от степени
превращения, если объемный расход газовой смеси 100 м3/с.
Построить графики скорости реакции и
объема реактора от степени превращения.
Посчитать производительность.
Расчеты
SO2 + O2 = 2SO3 + Q
Расчет изменения температуры через
адиабатический коэффициент L:
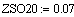
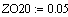
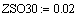
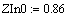
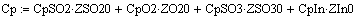
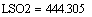
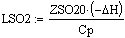
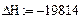

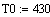
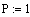
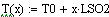

2. Вычисление равновесных концентраций веществ:



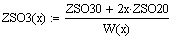

3. Вычисление парциальных давлений:

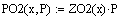
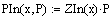
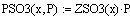
. Вычисление константы равновесия:
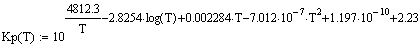

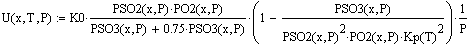

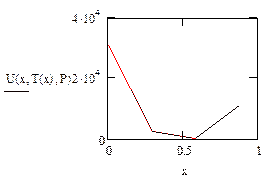

. Реактор идеального вытеснения:
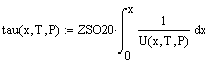

окисление реактор вытеснение давление
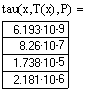
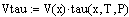

7. Реактор полного смешения (РПС):

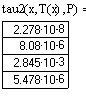
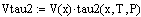


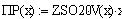

Выводы
Из использованной литературы
известно, что при одинаковых условиях проведения одной и той же реакции для
достижения равной глубины превращения среднее время пребывания реагентов τ
в
реакторе полного смешения больше, чем в реакторе идеального вытеснения (мои
расчеты показали то же самое). Следовательно, при равном объемном расходе для
достижения одинаковых результатов РИВ должен иметь меньший объем, чем РПС, что
говорит о пользе выбора РИВ.
Также известно, что при средних
и ниже среднего значениях адиабатического коэффициента L
(в расчетах L=444.305, а
теоретически изменяется в пределах 100-2000) большую роль играет движущая сила
(ДС), а ДС РИВ больше ДС РПС, что естественно предпочтительнее. При проведении
экзотермической реакции, необходимо проводить анализ выбора реактора:
1. Константа равновесия
реакции Kp с
увеличением температуры уменьшается (видно из расчетов), что говорит о том, что
реакция экзотермическая.
2. Скорость реакции
сначала увеличивается, так как k
- кинетический параметр увеличивается быстрее, чем падает движущая сила, далее
скорость реакции резко падает, так как движущая сила падает быстрее, чем
увеличивается k
. Сравнивая график
объемов реакторов, делаем вывод, что сначала объемы реакторов приблизительно
равны, а затем объем РПС резко возрастает, в то время как объем РИВ много
меньше, поэтому использование РПС становится невыгодным.
На основе знаний из книг и
собственного анализа, сделаем вывод о предпочтительном использовании РИВ.
Список использованной литературы
1. Кутепов
А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. -
М.:АКАДЕМКНИГА, 2003.
2. Сороко
В.Е., Вечная С.В., Попова Н.Н. Основы химической технологии. - Ленинград:
Химия, 1986.