Синтез 3-Бром-2-Тиофенкарбоновой кислоты
Введение
Гетероциклическими называют
соединения, содержащие циклы, включающие один или несколько гетероатомов, в
основном О, S, N.
Гетероциклические соединения
встречаются во многих природных соединениях и производятся в больших масштабах
в промышленности. В данной работе мы будем рассматривать главным образом
гетероциклические соединения, обладающие ароматическим характером. Такие
гетероциклы называют гетероароматическими.
На сегодняшний день химия
гетероциклических соединений приобрела важное значение в современных
технологиях производства лекарственных препаратов.
В курсовой работе мы рассмотрели
методы получения и химические свойства тиофена и его производных.
Целью работы является разработка
методики получения 3-Бром-2-Тиофенкарбоновой кислоты, опираясь на литературные
сведения о свойствах тиофена.
1. Тиофен
Тиофен был открыт В. Майером 1882 г.
в бензоле, добытом из каменноугольной смолы, где такого гетероцикла содержится
приблизительно 0,5%. В дальнейшем тиофен и его гомологи были обнаружены в продуктах
высокотемпературной переработки нефти, а в последнее время и во фракциях
первичной перегонки.
По ряду физических и химических
свойств тиофен очень близок к бензолу: температура кипения тиофена 84оС,
бензола 80оС; запах чистого тиофена напоминает запах бензола, очень
близка их склонность к реакциям нуклеофильного замещения. Однако тиофен более
реакционноспособен, чем бензол, и во многом сходен с пирролом.
Хорошо растворим в углеводородах и
других органическое растворителях, не растворим в воде. Молекула тиофена
плоская.
Тиофен - наиболее ароматический из
пятичленных гетероциклов.
.1 Получение тиофена
В промышленности тиофен производят
по реакции ацетилена с сероводородом при 400оС или из н-бутана и
серы в газовой фазе:
Очень известна и популярна реакция
Юрьева:
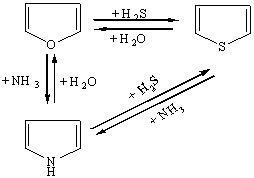
.2 Свойства тиофена
Тиофен, в отличие от
фурана и пиррола, не дает с обычными кислотами тиониевых солей и,
следовательно, в кислой среде не утрачивает ароматических свойств. Он не
обладает ацидофобностью.
Тиофен легко вступает в характерные
для ароматических соединений реакции электрофильного замещения. Механизм этих
реакций аналогичен механизму соответствующих реакций фурана:



Тиофен a-Нитротиофен
Тиофен легко на холоде сульфируется
концентрированной серной кислотой c образованием тиофен-2-сульфокислоты:
a-Тиофенсульфокислота
Поскольку бензол в аналогичных
условиях не сульфируется, эта реакция используется для очистки бензола от
тиофена.
В отличие от фурана тиофен замещает
на хлор и бром лишь два атома. С йодом в присутствии оксида ртути замещается
только один атом водорода.
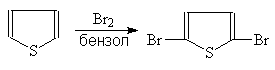

При бромировании тиофена
N-бромсукцинамидом образуется 2-бромтиофен:

Реакцию Фриделя-Крафтса в случае
тиофена приходится осуществлять не с AlCl3, а с более мягко
действующими SnCl4 или SiCl4. Возможно также ацилирование
тиофена:
Тиофен почти совсем не обнаруживает
ненасыщенного характера и не полимеризуется под действием кислот. Гидрирование
тиофена в присутствии палладиевого катализатора приводит к образованию тиофана,
в присутствии же никелевого катализатора гидрирование сопровождается
десульфурированием:
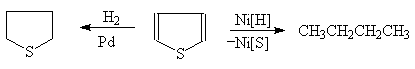
Тиофан
В отличие от фурана для тиофена
характерны реакции диенового синтеза, но с сильными диенофилами, например,
динитрилом ацетилендикарбоновой кислоты он взаимодействует таким образом:

Аддукт Фталодинитрил
присоединения
Тиофен устойчив к окислению, на него
не действует даже KMnO4 при нагревании, но
полностью гидрированный тиофен легко образует сульфоксид или сульфон:

Тиофен и его производные способны к
прямому металлированию под действием литийорганическое соединение по механизму
так называемой протофильного замещения. Реакция протекает быстро и практически
количественно при комнатной температуре в большинстве случаев с высокой
региоспецифичностью с образованием a-металлированных производных. В очень
мягких условиях (-70°С) под действием C4H9Li протекает
также реакция обмена атома галогена в цикле тиофен на металл, причем обмен
галогена в a-положении предпочтительнее, чем в b-положении, а обмен I на Li
идет легче, чем Вг. В реакции нуклеофильного замещения легко вступают главным
образом замещенные тиофены, содержащие в цикле ориентанты II рода.

2. Практическая часть
Стадии получения 3-Бром-2-Тиофенкарбоновой кислоты
Синтез 3-Бром-2-Тиофенкарбоновой
кислоты осуществляется в несколько стадий:
1) Получение фениллития:

или

2) Получение 2,3,5 - Трибромтиофена:

3) Получение 3-Бромтиофена:

-Бромтиофен
4) Получение 3-Бром-2-Тиениллития:
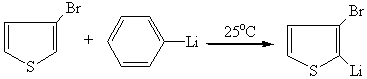
5) Получение 3-бром-2-Тиофенкарбоной кислоты:

2.1 Методика получения
фениллития
Получение фениллития из
бромбензола в среде эфира

Фениллитий
Получение фениллития из
йодбензола
Фениллитий получают,
прибавляя раствор 11,3 г йодбензола (0,055 моля)
В 60 мл эфира к
суспензии 12,1 г лития, нарезанного на мелкие кусочки в 100 мл эфира.
Прибавление йодбензола занимает 2,5 часа, всё это время применяют наружное
охлаждение льдом. Затем, не прекращая охлаждение, перемешивают ещё 2 часа и
концентрируют до объёма 45 мл. Выход фениллития 96%.

Фениллитий
2.2 Методика получения
2,3,5 - Трибромтиофена
В трехгорлую колбу емкостью 1 л,
снабженную мешалкой, капельной воронкой и обратным холодильником, соединенным с
ловушкой с водой (для улавливания бромистого водорода), помещают 252 г. (3
моля) тиофена и 100 мл хлороформа. При непрерывном охлаждении колбы струей воды
прибавляют по каплям 1440 г. (9 молей) брома. Сначала прибавление брома ведут
очень быстро; когда будет израсходовано около двух третей всего количества
брома, прибавление замедляют и прекращают охлаждение колбы током воды. Когда
весь бром будет прибавлен, содержимое колбы перемешивают еще 12 час., затем
обрабатывают при перемешивании двумя порциями 10%-ного раствора соды (по 150 мл
каждая) и отделяют органический слой. Органический слой постепенно вводят в
кипящий спиртовой раствор 4 молей поташа и кипятят с обратным холодильником.
Смесь выливают в большой объем воды, отделяют органический слой, отгоняют
хлороформ и остаток перегоняют в вакууме, применяя эффективную колонку. Сначала
отгоняется немного 2,5 - дибромтиофена с т. кип. 100 - 107° (17 мм), а затем
перегоняется 2,3,5 - трибромтиофен с т. кип. 135 - 138° (17 мм); выход
составляет 75 - 85% от теоретического.

2.3 Методика получения
3-Бромтиофена
В трехгорлую колбу
емкостью 2 л, снабженную мешалкой, капельной воронкой и эффективным обратным
холодильником, помещают 58 г. магния и прибавляют по каплям раствор 193 г. (0,6
моля) 2,3,5 - трибромтиофена и 196 г. (1,8 моля) бромистого этила в 900 мл
абсолютного эфира с такой скоростью, чтобы реакционная смесь умеренно кипела.
По окончании прибавления смесь кипятят в течение часа, охлаждают колбу смесью
льда с солью и гидролизуют магнийорганическое соединение ~ 5 н. соляной
кислотой, которую медленно прибавляют к реакционной смеси при перемешивании.
Затем отделяют органический слой, сушат, отгоняют эфир и остаток фракционируют.
Получают 69 г. 3-бромтиофена с т. кип. 156-158°, (выход равен 42% от теорет.) и
104 г. смеси 2,3- и 2,4 - дибромтиофенов (выход равен 43% от теорет.). Смесь
дибромтиофенов обрабатывают так же, как 2,3,5 - трибромтиофен, и получают
дополнительное количество 3-бромтиофена; выход на этой стадии составляет 78% от
теорет.
Общий выход
3-бромтиофена, считая на исходный тиофен, составляет
- 56% от теоретического
[288].

2.4 Методика получения
3-Бром-2-Тиофенкарбоновой кислоты
К 4 г 3-бром тиофена в 25 мл сухого
эфира прибавляют 0,025 моля фениллития в 25 мл эфира и оставляют стоять на ночь
при комнатной температуре.
После карбонизации получают 3,6 г
3-Бром-2-тиофенкарбоновой кислоты с выходом 72%, температура плавления 195-197оС.

Выводы
Тиофен имеет лечебное и защитное и
терапевтическое действия против возбудителей мучнистой росы, ржавчины, гнилей и
пятнистостей на овощных и технических культурах.
В курсовой работе были рассмотрены
методы получения тиофена и его производных и их химические свойства.
Также в работе нами была рассмотрена
и освоена методика получения 3-Бром-2-Тиофенкарбоновой кислоты.
В написании работы систематизировали
литературные данные по методам синтеза промежуточных продуктов, таких как, фениллитий,
3-Бромтиофен, 3-Бром-2-тиениллитий и конечного продукта
3-Бром-2-Тиофенкарбоновой кислоты.
Список литературы
1) Т.В. Талалаева, К.А. Кочешков. Методы элементоорганической
химии. - Москва: Наука, 1971. - 450-455 с.
) Ю.О. Ластухін,
С.А. Воронов. Органічна хімія.-Львів: Центр Європи, 2001. - 779 -781 с.
) Р. Моррисон, Р. Бойд. /Под редакцией проффесора И.К.
Коробициной. Органическая химия. Москва: Мир, 1974. - 1015-1020 с.
) http://www.xumuк.ru
) http://www.cementi.ru
6) http://www.ximicat.com