Обмен аргинина
Министерство
образования Российской Федерации
Челябинская
Государственная медицинская академия
Кафедра
биологической химии
Курсовая
работа
По
Биологической химии
На
тему: «Обмен аргинина»
Челябинск
2012
Общие данные
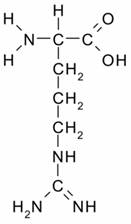
Аргинин или α-амино-δ-гуанидиновалериановая
кислота - является алифатической основной α-аминокислотой.
 <#"581107.files/image002.jpg">
<#"581107.files/image003.jpg"> <#"581107.files/image004.gif">
<#"581107.files/image002.jpg">
<#"581107.files/image003.jpg"> <#"581107.files/image004.gif">
Рис. 3
Трансаминирование аргинина
Под трансаминированием
<#"581107.files/image005.jpg">
Рис. 4
Участие в цикле синтеза мочевины
(орнитиновый цикл)
Аргинин является одним из ключевых метаболитов в
процессах азотистого обмена (синтез мочевины).
Наземные позвоночные, в том числе человек,
выделяют лишь небольшое количество аммиака.
Аммиак - очень токсичное соединение, особенное
для нервных клеток. При накоплении его возникает возбуждение нервной системы.
Поэтому в тканях существуют механизмы его обезвреживания. Одним из них это
синтез мочевины. Она образуется в результате циклической последовательности
реакций, протекающих в печени.
В прошлом веке русские ученые Ненский и Салазкин
показали, что в печени происходит образование мочевины из аммиака и
углекислоты. Кребс и Гензенлейт установили, что синтез мочевины представляет
собой циклический процесс, в котором каталитическую роль играет орнитин. Коген
и Ратнер выяснили, что начальной реакцией этого цикла является синтез
карбамоилфосфата.
Этапы цикла синтеза мочевины
Атомы азота берутся из свободного аммиака и за
счет дезаминирования аспартата, карбонильная группа - из гидрокарбоната.
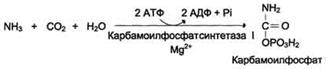
На первм этапе из гидрокарбоната (НСО3-) и
аммиака с потреблением 2 молекул АТФ образуется карбамоилфосфат. Как ангидрид
это соединение обладает высоким реакционным потенциалом.
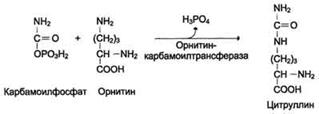
Далее под действием орнитинкарбамоилтрансферазы
карбамоильная группа карбамоилфосфата переносится на α-аминокислоту
орнитин, и образуется другая α-аминокислота
- цитруллин
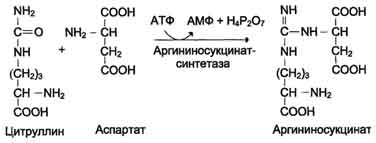
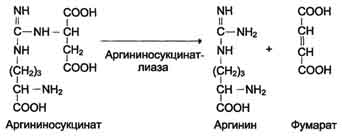
В следующей реакции аргининосукцинатсинтетаза
связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарную
кислоту). Этот фермент нуждается в ионах Mg2+. В реакции затрачивается 1
молекулу АТФ, но используется энергия двух макроэргических связей. Аспартат -
источник второго атома азота мочевины
Далее фермент аргининосукцинатлиаза
(аргининосукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом
аминогруппа аспартата оказывается в молекуле аргинина.
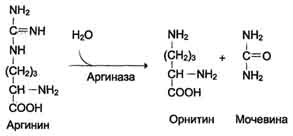
Аргинин подвергается гидролизу под действием
аргиназы, при этом образуются орнитин и мочевина. Кофакторами аргиназы являются
ионы Са2+ или Мn2+. Высокие концентрации орнитина и лизина, являющихся
структурными аналогами аргинина, подавляют активность этого фермента.
Образующийся орнитин взаимодействует с новой
молекулой карбамоилфосфата, и цикл замыкается.
Схема цикла синтеза мочевины
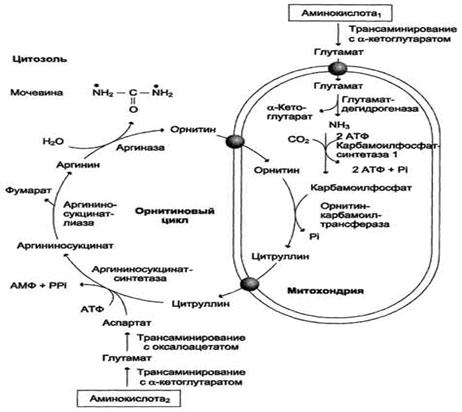
Рис. 5
Таким образом, аргинин является важнейшим
компонентом в синтезе мочевины.
Участие в биосинтезе креатина.
Креатин - азотсодержащая карбоновая кислота
<#"581107.files/image012.jpg">
-я стадия: происходит метилирование
гуанидинуксусной кислоты с участием гуанидинацетат-метилтрансферазы. Донором
метинильных групп является активная форма метионина - S-аденозилметионин:
Участие в синтезе оксида азота
В организме человека и млекопитающих оксид азота
главным образом образуется в результате окисления гуанидиновой группы
аминокислоты L-аргинина с одновременным синтезом другой аминокислоты цитруллина
под влиянием фермента NO-синтазы. Фермент был назван синтазой, а не синтетазой,
поскольку для его работы не требуется
энергия АТФ
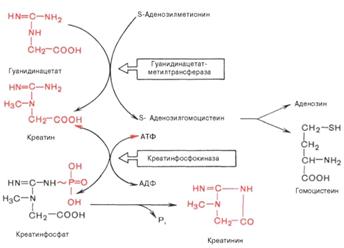
Рис. 6

Кроме L-аргинина NOS может использовать в
качестве субстратов гомоаргинин, аргиниласпарагин, метиловый эфир аргинина,
гуанидинотиолы. При недостатке субстрата в клетках или Н4Б фермент начинает
восстанавливать кислород до супероксид радикала и перекиси водорода. Такие
условия могут быть следствием как нарушения транспорта аминокислоты (в
некоторых тканях она не синтезируется), так и недостатка в пище, поскольку
синтез L-аргинина при этом в организме не увеличивается.
аргинин синтез мочевина креатин
Недостаток аргинина
Дефицит аргинина приводит к инфарктам,
ослаблению организма, гипертонии, нарушению мозговой деятельности,
преждевременному старению, замедлению роста детей, развитию диабета 2-го типа,
при котором инсулинозависимые ткани становятся невосприимчивы к вводимому
инсулину.
Содержание в продуктах питания
Аргинин встречается во многих продуктах питания,
как животного, так и растительного происхождения. В таблице приведены данные по
содержанию аргинина на 100 грамм продукта и указано содержание белка.
|
Продукт
|
Белок
|
Аргинин
|
А/Б
|
|
Свинина
сырая
|
20,95
г
|
1394
мг
|
6,7
%
|
|
Сырое
куриное филе
|
21,23
г
|
1436
мг
|
6,8
%
|
|
Сырое
филе лосося
|
20,42
г
|
1221
мг
|
6,0
%
|
|
Куриное
яйцо
|
12,57
г
|
820
мг
|
6,5
%
|
3,28
г
|
119
мг
|
3,6
%
|
|
Кедровые
орехи
|
13,69
г
|
2413
мг
|
17,6
%
|
|
Грецкие
орехи
|
15,23
г
|
2278
мг
|
15,0
%
|
|
Тыквенные
семечки
|
30,23
г
|
5353
мг
|
17,7
%
|
|
Пшеничная
мука г/п
|
13,70
г
|
642
мг
|
4,7
%
|
|
Кукурузная
мука
|
6,93
г
|
345
мг
|
5,0
%
|
|
Рис
нешлифованный
|
7,94
г
|
602
мг
|
7,6
%
|
|
Гречишный
хлеб
|
13,25
г
|
982
мг
|
7,4
%
|
|
Горох
сушеный
|
24,55
г
|
2188
мг
|
8,9
%
|
Применение
Лекарственные средства.
Аргинин присутствует в рецептуре
гепатопротекторов, иммуномодуляторов, кардиологических препаратов,
лекарственных препаратов для ожоговых больных, больных ВИЧ/СПИД, а также в
рецептурах средств для парентерального питания в послеоперационный период. В
последнее время лекарства с аргинином появились в геронтологии и онкологии.
Проводится тестирование L-аргинина в качестве
средства терапии инсультоподобных
<http://ru.wikipedia.org/wiki/%D0%98%D0%BD%D1%81%D1%83%D0%BB%D1%8C%D1%82>
эпизодов при митохондриальном заболевании
<http://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D1%82%D0%BE%D1%85%D0%BE%D0%BD%D0%B4%D1%80%D0%B8%D0%B0%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5_%D0%B7%D0%B0%D0%B1%D0%BE%D0%BB%D0%B5%D0%B2%D0%B0%D0%BD%D0%B8%D1%8F>
- синдроме MELAS <http://ru.wikipedia.org/wiki/%D0%A1%D0%B8%D0%BD%D0%B4%D1%80%D0%BE%D0%BC_MELAS>
(Mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes -
«митохондриальная энцефаломиопатия, лактатацидоз
<http://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D0%BA%D1%82%D0%B0%D1%82%D0%B0%D1%86%D0%B8%D0%B4%D0%BE%D0%B7>,
инсультоподобные
<http://ru.wikipedia.org/wiki/%D0%98%D0%BD%D1%81%D1%83%D0%BB%D1%8C%D1%82>
эпизоды»)
Пищевые добавки.
Аргинин широко рекламируется как компонент БАД
<http://ru.wikipedia.org/wiki/%D0%91%D0%90%D0%94> (Биологически активные
добавки
<http://ru.wikipedia.org/wiki/%D0%91%D0%B8%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8_%D0%B0%D0%BA%D1%82%D0%B8%D0%B2%D0%BD%D1%8B%D0%B5_%D0%B4%D0%BE%D0%B1%D0%B0%D0%B2%D0%BA%D0%B8>)
для бодибилдеров <http://ru.wikipedia.org/wiki/%D0%91%D0%BE%D0%B4%D0%B8%D0%B1%D0%B8%D0%BB%D0%B4%D0%B5%D1%80>
и спортсменов- тяжёлоатлетов с целью улучшения питания мышц, и пожилых людей
для улучшения эректильной функции.
Список литературы
1. А.А.
Сосунов «Оксид азота как межклеточный посредник». Московский государственный
университет им. Н.П. Огарева, Саранск.
2. В.А.
Володин «Энциклопедия» Москва, 2000.
. Реутов
В.П. «Цикл окиси азота в организме млекопитающих.// Успехи биол. химии. 1995.
Т.35. С. 189-228.
. Н.П.
Дмитренко, Д.О. Кишко, С.Г. Шандренко «Украинский химиотерапевтический журнал»
- №1-2 (22) - 2008.
. Овчинников
Ю.А. Биоорганическая химия / Ю.А. Овчинников. - М.: Просвещение, 1987.
. Нейланд
О.Я. Органическая химия.- М., 1990.
. <http://www.xumuk.ru/>