|
Микотоксин
|
Мол. масса
|
t пл., °С
|
λ макс, нм *
|
Флуоресценция, цвет, нм *
|
|
Афлатоксин B1
|
312
|
268-269
|
265,362
|
голубой, 425
|
|
Афлатоксин G1
|
328
|
244-246
|
-
|
зелёный, 450
|
|
Афлатоксин M1
|
328
|
299
|
265,357
|
голубой, 425
|
|
Токсин Т-2
|
466
|
150-151
|
- **
|
-
|
366
|
162-164
|
-
|
-
|
|
Дезоксиниваленол
|
296
|
151-153
|
218
|
-
|
|
Ниваленол
|
312
|
222-223
|
218
|
-
|
|
Зеараленон
|
318
|
164-165
|
236,274,316
|
сине-зелёный
|
|
Патулин
|
153
|
105-108
|
276
|
-
|
|
Охратоксин А
|
403
|
169
|
213,332
|
зелёный, 475
|
|
Охратоксин В
|
369
|
221
|
218,318
|
голубой
|
* - Растворитель метанол.
** - Отсутствие поглощения в УФ
спектре или флуоресценции.
Образование
микотоксинов во время хранения
Основными
факторами, влияющими на растения и, следовательно, на продукцию микотоксинов,
являются наличие свободной воды, температура и время колонизации в процессе
хранения.
Фузариотоксины
(зеараленон, трихотецены, фумонизин, и т. д.) образуются в основном на поле
(фаза культивации). Микотоксины грибов Aspergillus и Penicillium (афлатоксин,
охратоксин и др.) образуются большей частью во время хранения.
В противоположность
этому синтез афлатоксина может иметь место в тропических и субтропических
условиях в процессе вегетации растений.
Принципиальными
факторами, оказывающими влияние на образование микотоксинов, являются:
§ Внутренние
факторы, связанные с плесневым
§ Интенсивность
генерации токсинов, которая может варьировать в пределах каждого штамма от 1 до
103-104
§ Вид
гриба, который определяет категорию продуцируемых микотоксинов.
§ Начальный
уровень контаминации, который влияет на количество образованных микотоксинов
(чем больше грибов, тем больше потенциал образования микотоксинов)
§ Внешние
факторы, например, условия окружающей среды. Эти факторы определяют размножение
и рост грибков, а, следовательно, и образование микотоксинов
§ Химические,
физико-химические и физические факторы, такие как влажность, наличие свободной
воды, температура, тип субстрата, газовый состав (атмосфера) и и механические
повреждения
§ Биологические
факторы, такие как насекомые, или как фактор переноса спор грибов или как
фактор, обуславливающий механические повреждения вплоть до кариопсиса,
облегчающие проникновение гриба внутрь; микрофлора и конкуренция между
штаммами; стресс растений (засуха); прочность (устойчивость) оболочки, или
генетическая сила, ли целостность кариопсиса.
Чтобы предотвратить
контаминацию кормов микотоксинами необходимо предотвратить рост плесени.
Следовательно необходимо иметь работающую стратегию (эффективный план мероприятий),
который бы был разработан на основе законов, которые регулируют жизнь грибов
плесени. Им необходимы вода, кислород (как минимум 1-2 %), время и
благоприятная температура (в зависимости от вида гриба; повышенные температуры
стимулируют грибы видов Aspergillus, пониженные Fusarium. Одной из общих
особенностей плесневых грибов на слабогидратированных кормах является их
способность к образованию и распространению спор. Ниже приведены идеальные
условия для роста:
Влажность
окружающей среды или свободная вода
Наиболее интересным
параметром (точкой отсчета benchmark) является свободная вода. Колонизация
плесневыми грибами происходит чаще, если бактериальная нагрузка свободной воды
ниже, чем 0,85. Это не потому, что плесень не может расти при более высоком ее
уровне, но именно потому, что бактерии являются сильным конкурентом и
становятся преобладающей микрофлорой в диапазоне от 0,85 до 1,00 и иногда в
диапазоне от 0,9-0,93. При уровне свободной воды между 0,85 и 0,93 только
некоторые бактерии способны быстро увеличивать свою численность (в частности
лактобактерии и кокковые формы), поэтому преобладающей является инвазия
плесневыми микроскопическим грибами и дрожжами.
В соответствии с
«поведенческими» различиями относительно наличия (доступности) воды, виды
плесневых грибов могут быть классифицированы следующим образом
§ Гидрофильные (например, Epicoccum nigrum, Trichothecium roseum, Mucor
circinelloides) Споры могут прорастать при концентрации свободной воды выше
0,99 (оптимальный рост достигается 0,95-1.00
§ Средний
уровень (например, Alternaria tenuissima,
Cladosporium cladosporioides, Penicillium cyclopium): Споры могут прорастать
при уровне свободной воды между 0,8 и 0,9. Самый лучший рост происходит при
уровне 0,95-1.00.
§ Ксерофилы (например, Aspergillus repens, Aspergillus restrictus,
Aspergillus versicolor): Споры могут прорастать при концентрации свободной воды
ниже 0,80. Оптимум роста составляет 0,95.
§ Минимальный
уровень свободной воды, при котором наблюдается рост плесени составляет 0,61,
при этом токсигенные грибы не могут расти при 0,78. Обычно минимальный уровень
воды выше, чем это требуется для роста плесневого гриба.
Температура
Идеальная
температура для развития плесеней находится в пределах от 15 до 30 °C с
оптимумом при 20-25 °C. Некоторые виды, такие, например, как Cladosporium
herbarium, дают видимый рост при -6 °C. Другие, такие как некоторые виды
Penicillium могут расти в замороженной рыбе при -20 °C. По литературным данным
некоторые споры (Rhizopus nigricans, Mucor mucedo, Aspergillus niger,
Aspergillus glaucus) способны выживать после погружения на 77 часов в жидкий
водород при -253 °C и на 492 часа в жидком воздухе при -190 °C.
Колонии не растут при высокой температуре кроме Aspergillus fumigatus, которые
контаминировать верхние дыхательные пути при температуре тела. При 35-40 °C
Monilia sitophila, типичный контаминант хлеба, тоже может выживать. Другие
виды, например Bortytis cinerea может выдерживать температуру замораживания и
размножается при 5 °C.
рН и
кислород
Развитие колоний
плесневых грибов имеют место при значениях рН от 4 до 8. Однако некоторые
плесени могут расти при больших или меньших значениях, изменяя кислотность
среды в процессе разрастания колонии.
Плесени
преимущественно аэробные организмы, которые растут на поверхности среды.
Некоторые виды могут однако расти в глубине среды, такие как Stachybotrys, или
в жидкой среде - с низким уровнем кислорода, включая желе, или даже в атмосфере
с диоксидом углерода и азотом.
Продукция
токсинов
Условия окружающей
среды и содержание влаги оказывает влияние на продукцию микотоксинов.
Образование токсинов усиливается при содержании свободной воды 0,90.
Aspergillus flavus может начать образовывать афлатоксин при 0,83. A. ochraceus
для выработки охратоксина требует как минимум 0,97
Влажность субстрата
является принципиальным фактором, который следует учитывать при предупреждении
контаминации, и ее контроль становится основным, например, при производстве
кормов.
При температуре
около 25С Aspergillus flavus активно производит афлатоксины. При 10 С
образование токсинов никогда не отмечалось. Fusarium tricinctum может
продуцировать Т-2 токсин при температурах между 1 и 4 С, максимально - 15С.
Образование охратоксина Aspergillus ochraceus идет при 20-30С, но никак не ниже
12 С. Тот же микотоксин продуцирует Penicillium viridicatum в температурном
диапазоне от 4 до 31 С.
Таким образом
представляется трудным определить температурный оптимум и контролировать
продукцию микотоксинов, за исключением афлатоксина, который никогда не
образуется при температуре ниже 10 С, даже при условии сильной заплесневелости.
Концентрация кислорода и кислотность субстрата не являются существенными для
продукции микотоксина
Важный фактор,
который следует принять во внимание - тип субстрата. Растительный субстрат усиливает
образование микотоксинов больше чем животный и животного происхождения.
В особенности
присутствии крахмал генерировать микотоксин. Кроме того, присутствие цинка, но
это относится только к продукции афлатоксина. Более часто контаминируемые
продукты - кукуруза, арахис и хлопок. Соки и фрукты явлются главными носителями
патулина и зерновых охратоксина.
Среди продуктов
животного происхождения молоко - один из основных носителей афлатоксинов у
коров, получавших корма с высоким уровнем контаминации зоотехнических
продуктов. Молочные продукты также могут быть контаминированны афлатоксином,
связанным с протеинами. Кроме того, некоторые микотоксины могут быть образованы
плесенями сырной корки.
.3 Биотехнологическая
способность получения
Всем этим
характеристикам отвечают методы на основе иммунологических реакций. Коммерчески
доступные иммунологические методы для анализа микотоксинов базируются на
применении специфических моноклональных и поликлональных антител против
определенных токсинов, и в целом делятся на:
метод на основе
иммуноафинных колонок (ИАК, IAC);
иммуноферментный
анализ (ИФА, ELISA) (таблица 1.3.1).
Таблица 1.3.1
Коммерчески доступные иммунологические методы анализа для микотоксинов
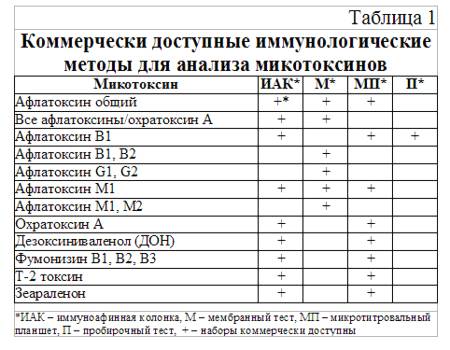
Обычно, иммуноафинные
колонки фактически используются для очистки образца от матричных соединений и
позволяют провести выделение и концентрирование определенного микотоксина.
Следующая за этим элюция
токсина из ИАК позволяет провести количественное определение с использованием
классических аналитических методов. В случае проведения иммуноферментного
анализа, процедуры очистки обычно не столь интенсивны как при других
аналитических методах. Гомогенат или экстракт образца, содержащий микотоксин,
или непосредственно исследуется количественно, используя стандартный
микротитровальный планшет или пробирочный анализ формата ИФА, или используется
иммуноферментный мембранный тест для проведения качественного или
полуколичественного определения наличия микотоксинов.
Другие методы по
исследованию микотоксинов, использующие иммунологический подход, о которых
сообщается в литературе, включают оптические и акустические биосенсоры,
капиллярный электрофорез.
Образец, содержащий
микотоксин, льют по иммуноафинной матрице. Образец с микотоксином фильтруется
через матрицу и микотоксин связывается на шариках. Элюирующий буфер льют по
матрице, и очищенный микотоксин вымывается в кювету для проб.
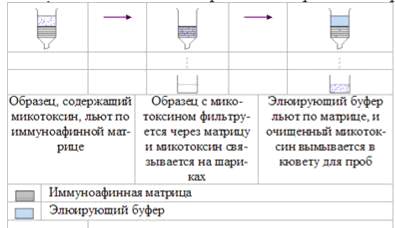
Рисунок 1.3.1
Принцип иммуноафинной очистки микотоксинов
Иммуноафинные колонки
обычно используются для очистки исследуемого образца от сложных матриц и
концентрации токсинов перед обнаружением и оценкой содержания микотоксина,
используя ряд классических аналитических методов, таких как ВЭЖХ, газовая
хроматография, масс-спектрометрия, флуорометрия, ВЭТСХ и ТСХ. Метод заключается
во введении экстракта образца в колонку, содержащую иммуноафинную матрицу,
содержащую твердую фазу (например, гранулы агарозы), к которой ковалентно
присоединены антитела против микотоксина (рисунок 1.3.1). Молекула токсина,
содержащаяся в образце, присоединяется к соответствующему иммобилизированному
антителу.
Последующие шаги
включают удаление несвязанных матричных компонентов и экстрагента, элюцию
токсина, изменяя элюирующий состав и, наконец, обнаружение токсина, используя
аналитические методы. Как альтернатива, микотоксин, связанный в колонке, может
быть элюирован и непосредственно измерен флюорометрией, основанной на
собственной флюоресценции микотоксинов.
Мембранный тест
позволяет за короткий период времени (около 10-15 мин) дать ответ на вопрос:
присутствуют ли в испытуемом образце микотоксины выше уровня предела
чувствительности данного теста? То есть фактически это качественное определение
наличия / отсутствия микотоксинов в пробе. Метод требует экстракции,
фильтрации, очистки (через колонку) и разведения образца. Далее раствор
наносится на мембрану сенсибилизированную моноклональными антителами, куда
также добавляется ферментный конъюгат микотоксина. Если концентрация
микотоксинов в образце превышает предел чувствительности теста, все антитела на
поверхности связываются с ними и весь добавленный конъюгат удаляется на этапе
отмывки. При добавлении бесцветного субстрата конъюгат на поверхности мембраны
катализирует цветную реакцию, в результате которой на месте связывания
конъюгата образуется цветное пятно. Окрашивание аналитической зоны мембраны
говорит об отсутствии микотоксинов в образце.
Иммуноферментный анализ
обычно используется для мониторинга наличия микотоксинов выше определенного
уровня (или их отсутствия) в испытуемом образце. В настоящее время доступен ряд
качественных, полуколичественных и количественных методов. Основываясь на
результатах ИФА подозрительные образцы должны быть перепроверены классическими
методами. Доступны различные варианты ИФА для анализа микотоксинов (например,
мембранные тесты, микротитровальные планшеты и пробирочные методы). Как
правило, метод ИФА основан на конкурентом анализе, который использует или
связанные с ферментным конъюгатом микотоксины, или антитела против
определенного анализируемого токсина (рисунок 1.3.2). Типичная
последовательность реакций, используя готовые реактивы в формате
микротитровального планшета следующие:
. ферментный конъюгат
добавляется к экстракту испытуемого образца;
. смесь добавляется к
соответствующим антителам, нанесенным на поверхность лунок планшета (например,
микротитровальный планшет, сенсибилизированный антителами);
. количество
соединенного с токсином конъюгата, связываемое иммобилизированными антителами
зависит от количества токсина в образце; чем выше количество токсина в образце,
тем ниже будет количество ферментного конъюгата присоединившегося к антителам,
нанесенным на поверхность лунок планшета и наоборот;
. ферментативная
активность связанного с поверхностными антителами конъюгата определяется
добавлением соответствующего субстрата, что приводит к образованию окрашенных
продуктов, концентрация которых обратно пропорциональна концентрации токсина в
испытуемом образце.
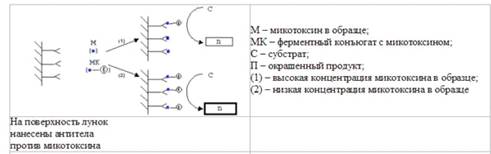
Рисунок 1.3.2
Принцип конкурентного ИФА для определения микотоксинов
Можно провести анализ
содержания микотоксинов в кормах с использованием иммуноферментного метода. Для
исследования применим готовые тест-системы производства компании R-Biopharm,
Германия. Этой компанией выпускается ряд наборов для количественного
определения микотоксинов: афлатоксины В, G, М, зеараленон, охратоксин А, Т-2
токсин, дезоксиниваленол, фумонизин В1, цитринина. Следует отметить, что
практически для всех перечисленных микотоксинов существуют варианты тест-систем
для определения особо малых концентраций этих токсичных соединений с пределом
чувствительности на уровне хроматографических методик (RIDASCREEN® Mycotoxins)
(время инкубации 1-2 часа) и экспресс-методы, позволяющие определять
практически такие же концентрации в течение 15-30 минут (RIDASCREEN® FAST
Mycotoxins). Все методики прошли утверждение и могут использоваться в
лабораториях, входящих в структуру Министерства сельского хозяйства и
продовольствия.
Организация анализа
микотоксинов в кормах и пищевых продуктах иммуноферментным методом возможна
минимальными средствами и в самые короткие сроки. Простота эксплуатации и
незначительная стоимость необходимого оборудования выгодно отличают
иммуноферментный метод от классических методов анализа и делают его особенно
привлекательным для лабораторий с ограниченными финансовыми возможностями.
Необходимо отметить, что
при практически равных показателях пределов обнаружения методы иммуноферментного
анализа являются более производительными и позволяют проводить избирательное
исследование только подозрительных по ИФА образцов инструментальными методами.
Например, методом ИФА один лаборант может провести исследование 10-100 образцов
за одну рабочую смену, в то время как при использовании ВЭЖХ - только 1-10
проб. При этом на проведение иммуноферментного анализа затрачивается от 15
минут до 3 часов (пробоподготовка до 1 часа), а методом ВЭЖХ - 2-4 часа при
1-3-дневной пробоподготовке.
2.
Методы анализа за основными показателями качества с описанием
методик по определению содержания основных компонентов
В работе анализируются
возможности различных методов лабораторного исследования содержания
микотоксинов в кормах для подтверждения диагноза на микотоксикоз. Приводится
сравнительная стоимостная характеристика инструментальных и экспресс-методов.
Микотоксины - нелетучие,
сравнительно низкомолекулярные «вторичные» продукты обмена веществ
микроскопических грибов, которые могут воздействовать на людей и животных. Эти
соединения считают «вторичными» метаболитами, так как они не являются
необходимым компонентом для роста и развития грибов. Функции микотоксинов до
сих пор четко не установлены, но они, как полагают, играют роль в устранении
других микроорганизмов, конкурирующих за тот же самый питательный субстрат.
Предполагается, что они также помогают паразитическим грибам проникать в ткани
хозяина1. Количество токсинов необходимое для получения неблагоприятного
эффекта для здоровья разнится в зависимости от вида микотоксина, а также от
иммунного статуса каждого животного или человека.
Нормируемые микотоксины
продуцируются в основном грибами родов Aspergillus, Fusarium, Penicillium.
Однако микотоксины выделяются и от многих других видов грибов при определенных
условиях роста. Виды и количества продуцированных микотоксинов зависят от
штамма гриба, условий роста, а также от наличия или отсутствия других
микроорганизмов в той же среде обитания. Микотоксины накапливаются на спорах
грибов, фрагментах клетки и субстратах (источники питания).
Присутствие
токсинообразующих грибов на кормах или продуктах питания не должно
автоматически связываться с контаминацией соответствующими микотоксинами, так
как на этот процесс влияет множество факторов. И наоборот, видимое благополучие
(т. е. отсутствие плесени на корме) совсем не гарантирует отсутствие его
токсичности, так как грибы могли погибнуть при изменившихся условиях хранения,
а большинство микотоксинов обладает повышенной стойкостью к условиям окружающей
среды.
Микотоксины - очень
важные грибковые метаболиты, которые представляют потенциальную угрозу здоровью
животного и человека. Термин микотоксины охватывает широкую группу соединений
весьма отличающихся по своему химическому строению (рисунок 13), а, следовательно,
по оказываемому токсическому действию. Опасность для человека и животных,
представляемая микотоксинами постоянно переоценивается. Для некоторых
микотоксинов уже установлены максимально допустимые уровни2,4. Необходимость
четкого определения вида и концентрации микотоксина, содержащегося в том или
ином корме обуславливается также возможной контаминацией их несколькими
микотоксинами одновременно, что не позволяет четко поставить диагноз на
микотоксикоз, основываясь только на клинической картине. Исследование проб
кормов, проводимое нами с 2003 года подтвердило, что, как правило (? 85-90 %
случаев), в одном образце присутствует сразу несколько видов микотоксинов.
Особенно это касается токсинов, продуцируемых грибами рода Fusarium. Исходя из
изложенного, можно сделать вывод, что есть потребность в аналитических методах
исследования гарантирующих, что корма и продукты питания не содержат
микотоксины выше допустимых пределов.
В настоящее время
существует ряд приборных методов количественного определения микотоксинов в
кормах и продуктах питания. Наиболее распространенными из них в настоящее время
являются методики с использованием тонкослойной хроматографии (ТСХ, TLC),
высокоэффективной жидкостной хроматографии (ВЭЖХ, HPLC), газовой хроматографии
(ГХ, GC), масс-спектрометрии (МС, MS) и их сочетаний.
Тонкослойная
хроматография является хроматографической методикой, применяемой для
разделения, оценки чистоты и идентификации органических соединений. Она
основана на применении пластин с нанесенной неподвижной фазой и подвижной фазы
(растворитель). Идентификация анализируемого вещества проводится при
одновременном внесении на пластину экстракта образца и стандартных растворов с
известной концентрацией. Различные соединения в смеси продвигаются по пластине
с различной скоростью вследствие различия в закономерностях их разделения между
мобильной жидкой и неподвижной фазами (рисунок 2.1). На этом принципе основано
разделение веществ в смеси экстракта. Флуоресцирующие вещества выявляют в
УФ-свете, все остальные - с помощью специфических реагентов.
Дальнейшее развитие
метод получил под названием высокоэффективной тонкослойной хроматографии
(ВЭТСХ, HPTLC). Уменьшение толщины слоя неподвижной фазы (до 100 мкм) и
величины частиц (до 5 мкм), привело к лучшему разделению веществ за более
короткий период времени.
Методы ТСХ доступны
почти для всех микотоксинов. Обнаружение и специфическая идентификация
разработана для каждого отдельного микотоксина, используя молекулярные свойства
или реакции трансформации веществ.
Главные недостатки
тонкослойной хроматографии:
малая
производительность;
большинство образцов
нуждается в этапах экстракции и очистки для удаления потенциальных помех и
матричных соединений перед анализом;
концентрация
анализируемого вещества должна быть в диапазоне 0,01-0,1 %;
использование токсичных
и летучих веществ в качестве растворителя.
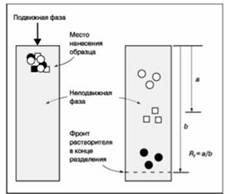
Рисунок 2.1 Тонкослойная
хроматография
Методы высокоэффективной
жидкостной хроматографии (ВЭЖХ) в области исследования микотоксинов главным
образом используются для заключительного отделения матричных соединений и
обнаружения интересующего анализируемого вещества. В настоящее время методы
ВЭЖХ широко распространены из-за их превосходящих характеристик и надежности по
сравнению с тонкослойной хроматографией. Методы ВЭЖХ были разработаны для
большинства основных микотоксинов в зерновых культурах и другой
сельскохозяйственной продукции. Большинство методов надежны и стабильны.
Метод ВЭЖХ основан на
разделении анализируемого экстракта в неподвижной фазе хроматографической
колонки (рисунок 2.2) (для анализа микотоксинов чаще используются колонки С8 и
С18) и дальнейшей их идентификации и количественном определении с помощью
специальных детекторов. Наиболее распространенными детекторами для анализа
микотоксинов в настоящее время являются ультрафиолетовый и флюоресцентный.
Пределы чувствительности методов ВЭЖХ с применением данных детекторов могут
доходить до 1 мкг/кг образца. В литературе сообщалось о разработке методов ВЭЖХ
для одновременного анализа нескольких микотоксинов. Особенно успешно таким
образом анализируются трихотеценовые микотоксины, в частности трихотецены.
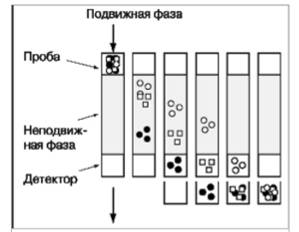
Рисунок 2.2 Жидкостная
хроматография
3. Статистическая
обработка данных
Случайные погрешности, вызванные
случайными причинами никак нельзя избежать. Существования случайных
погрешностей проявляется в том, что результаты параллельных анализов,
выполненных в одинаковых условиях. почти всегда немного отличаются. Отклонения
от среднего значения определяет воспроизводимость и наоборот. Каждому методу
анализа отвечает своя воспроизводимость результатов. Совсем избавиться
случайных погрешностей невозможно.
В теории отклонений доказывается,
что если погрешности соблюдают закона распределения Гаусса, то наиболее
имоверным значением считается среднее арифметическое полученных результатов
измерений. И это определяется по формуле:

X
= 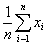
Коэффициент Стьюдента
используют для расчёта доверительного интервала 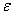 около среднего
арифметического выборочной совокупности:
около среднего
арифметического выборочной совокупности:
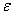 =
=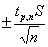
Где S - стандартное отклонение:
S=
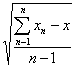
В этом интервале с
имоверностью(надёжностью) P
находится среднее арифметическое.
Относительную
погрешность  считают,
деля доверительный интервал на среднее арифметическое:
считают,
деля доверительный интервал на среднее арифметическое:
 =
= 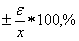
.1 Определение промахов за Q-критерием
Промахи это грубые ошибки, что
возникают вследствии неаккуратности и невнимательности при выполнении анализа.
Промахи выкривляют результаты
анализа, потому их нужно откинуть. Это легко сделать, если один из полученных
результатов очень отличается от других. Если результаты неочень отличаются, то
для выполнения вопроса про судьбу такого результата используют Q-критерий.
Численное значение единичного
результата называют вариантной и обозначают X или C.
Для расчёта Q-критерия результаты повторных n
определений размещают в ряд по возрастанию. Сомнительными могут быт первый и
последний результат, то есть x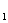 и x
и x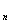 .Путём
отношения этих разниц ко всему диапозону результатов анализа получают значение Q для первого и последнего результата, что в общем виде можна
записать формулой:
.Путём
отношения этих разниц ко всему диапозону результатов анализа получают значение Q для первого и последнего результата, что в общем виде можна
записать формулой:
Q=
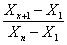
Численные значения этих
отношений сравнивают с их критическими значениями, которые рассчитаны для
вероятности, что чаще всего используются 95 % и числа параллельных результатов n:
Таблица 3.1.1
|
n
|
3
|
4
|
5
|
6
|
8
|
9
|
10
|
|
Q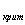 0.940.760.640.560.510.470.440.41 0.940.760.640.560.510.470.440.41
|
|
|
|
|
|
|
|
|
При Q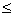 Q
Q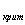 с вероятностью 95 % можна принять, что промахов нет.
с вероятностью 95 % можна принять, что промахов нет.
Если Q>Q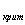 то результат есть
промахом, его откидывают и повторяют расчёты для результатов, что остались.
то результат есть
промахом, его откидывают и повторяют расчёты для результатов, что остались.
.2 Определение
погрешности измерения
Каждое аналитическое
определение, как и вообще любое измерение всегда имеет какую-нибудь
погрешность. Оценка погрешности результата анализа является частью анализа.
Количественный анализ включает в себя несколько стадий: отбор пробы и взятие
навески, подгонки пробы, получение аналитического сигнала и расчёт результатов
анализа. На каждых из этих стадий допускаются погрешности, какие в сумме дают
погрешность результата анализа. Разница между получением результата Х и
истинным значением содержания вещества, что определятся µ.
Х=Х-µ
Называют абсолютной
погрешностью. Она имеет размерность исследуемой величины.
Делением абсолютной
погрешности на истинное значение получают относительную погрешность.
Относительную
погрешность почти всегда определяют в процентах:
Количественное
определение, как правило, повторяют несколько раз. Результаты, что получают,
полностью не совпадают. Если отличия незначительные и причины их возникновения
нельзя выяснить, то погрешности относят до случайных. Если не все результаты
повторных определений на одну и ту величину отличаются от истинного значения,
то погрешности относятся к систематическим.
Грубые(большие)
погрешности называют промахами. Главной задачей химического анализа есть
правильное определение содержания отдельных компонентов в пробе. Правильность
обеспечивается тогда, когда получается совсем избежать систематических
погрешностей.
Точность анализа
характеризуется близостью результата анализа до истинного содержания
определяемого компонента в пробе.
Проверка правильности
результата анализа
Правильность результата
анализа можно проверить такими методами:
а) проведение анализа
двумя или несколькими независимыми методами. Если все методы дают одинаковые
результаты, то анализ выполнено правильно.
б) применение
стандартных образцов, что есть эталонами химического состава. Каждый стандартный
образец имеет официальный документ - паспорт, в котором указано аттестованное
содержание отдельных компонентов. Чтоб установить правильность анализа
какого-нибудь материала, выбирают близкий по химическому составу и проводят
параллельно анализ пробы и стандартного образца. Если метод анализа даёт
правильные результаты, то найденное содержание отдельных элементов в
стандартном образце отвечает паспортным данным.
в) применение метода
добавок. Проводят несколько параллельных определений, добавляя к пробам точно
известное количество элемента, что определяется. Если анализ правильный, то
разница в количестве элемента в пробе с добавкой и без добавки должна отвечать
количеству добавки.
Выводы
Микотоксины - метаболиты
микроскопических грибов, которые поражают зерна злаковых, бобовых, семян
подсолнечника, а так же овощи и фрукты. Чаще всего синтезируются несовершенными
грибами родов Fusarium, Aspergillus, Myrothecium, Stachybotrys, Trichoderma,
Trichothecium, Penicillium и др.
Наличие микотоксинов в
кормах приводит к ухудшению продуктивности, репродуктивности и иммунного
состояния животных. Известно более 250 видов грибов, продуцирующих несколько
сотен микотоксинов. Многие из них обладают мутагенными (в том числе
канцерогенными) свойствами. Среди микотоксинов представляющих опасность для
здоровья человека и животных, наиболее распространенны афлотаксины,
трихотецены, патулин, охратоксины, зеараленон и зеараленол.
Внимание исследователей
к микотоксинам привлекли афлатоксины, открытые при исследовании причины
«заболевания Х» - падежа 100000 индеек на фермерских хозяйствах Англии в 1960
г.
Основными
представителями микотоксинов являются:
Ø Трихотеценовые
микотоксины
Ø Афлатоксины
Ø Охратоксины
Ø Цитринин
Ø Зеараленон
Ø Патулин
Микотоксины широко распространены в
растительных продуктах, хранившихся в условиях, благоприятных для развития
плесневых грибов.
Токсическое действие большинства
микотоксинов характеризуется определенными чертами специфичности, поэтому
микотоксикозы (за небольшим исключением) не имеют строго очерченной клинической
картины.
Из выделенных более чем 300
микотоксинов, лишь некоторые представляют риск для здоровья человека и животных
и обнаруживаются повсеместно в качестве природных контаминантов
продовольственного сырья и пищевых продуктов.
Наибольшую опасность для человека
представляют микотоксины фитопатогенных грибов - возбудителей болезней
растений. Основными продуцентами микотоксинов являются фитопатогенные грибы
рода Penecillium, Aspergillus, Fusarium, вызывающие плесени на ряде сельскохозяйственных культур,
являются продуцентами афлатоксинов. Сельскохозяйственные культуры, пораженные
токсичными грибами и содержащие микотоксины, являются первичным источником
микотоксикозов.
Сложность проблемы защиты человека
от микотоксикозов усугубляется тем, что зерно и зернопродукты, содержащие
микотоксины не теряют токсичности в течении многих лет.
Основной путь попадания микотоксинов
в организм - пищевой (алиментарный). Для людей, работающих с загрязненным
сырьем, существует профессиональный риск поражения микотоксинами респираторным
путем или контактным - через кожу.
Существующие химические методы
определения микотоксинов сложны, трудоемки и не отвечают запросам массового
анализа. Биологические методы, к сожалению, не всегда достаточно специфичны или
же требуют большого числа лабораторных животных. Инструментальные методы, при
их привлекательности, требуют высококвалифицированного обслуживания и
значительных затрат времени на предварительную подготовку образцов. К тому же
они очень дорогостоящие.
Представляется перспективной
разработка методов микробиологической индикации микотоксинов, основанных на
использовании высокочувствительных и высокоспецифичных и тест - культур.
Полностью исключить образование
микотоксинов в кормовой продукции не представляется возможным, задача
контролирующих ее качество служб - выявить наличие микотоксинов и сравнить
обнаруженное количество с нормами предельного содержания. Информированность об
уровне содержания микотоксинов в кормах поможет принять решение о
целесообразности и дозах применения различных препаратов.
Список используемой
литературы
1. К.И., Соболев B.C. «Идентификация и количественное определение
трихотеценовых микотоксинов методом капиллярной газожидкостной хроматографии»,
Журнал аналитической химии, том 38, № 5, стр. 903-906, 1983
. Ветеринарно-санитарные нормы по безопасности кормов и кормовых
добавок: № 48: утв. М-вом сельского хозяйства и продовольствия РБ от 28.04.08:
ввод. в действие 28.04.08.
. Кужаков, В. Препарат для защиты зерна и кормов от плесени и мокотоксинов
/ В. Кужаков, Т. Айдинян // Комбикорма. 2000. - № 6. - С. 3839.
. Костыркина Т.Д., Клещёв Н.Ф. «Пособник по аналитической химии»,
1999 год.
. Буркин А.А, Кононенко Г.П., Кислякова О.С. «Микотоксины.
Микотоксикозы и отравление грибами»
. Интернет-источники:
1) Wikipedia.ru
) www.ekotoksikologia.ru
Размещено на http://www.allberst.ru/