Математическое моделирование лизиса фибринового сгустка плазмином
Введение
Фибриновые сгустки образуются в
результате работы системы свертывания в ответ на нарушение целостности стенки
кровеносного сосуда и предотвращают потерю крови организмом. После репарации
повреждения, когда необходимость в сгустке исчезает, важно его разрушить и
удалить, чтобы восстановить нормальный поток крови. Эту задачу выполняет
система фибринолиза, обеспечивающая превращение циркулирующего в крови
профермента плазминогена в активный фермент плазмин и последующий лизис сгустка
этим ферментом.
Одной из наиболее распространенных и
опасных патологий систем свертывания и фибринолиза является образование тромбов
в кровеносных сосудах. Тромбозы являются одной из основных причин смертности и
инвалидности. Основным способом борьбы с образующимися тромбами является
использование тромболитических препаратов, стимулирующих систему фибринолиза.
Однако применение таких препаратов всегда граничит с риском тяжелейших
кровотечений вследствие повышающейся активности фибринолиза. Поэтому крайне
важно знать особенности регуляции этой системы для более эффективного и
разумного использования таких препаратов и разработки новых.
Более полно понять механизмы
регуляции фибринолиза может помочь создание и исследование математических
моделей этого процесса. Математическое моделирование фибринолиза могло бы
способствовать обобщению и структурированию эмпирически выведенных
закономерностей, а также указанию дальнейшего направления экспериментальных
исследований этого процесса. В существующей литературе известно несколько математических
моделей фибринолиза, однако каждая из них направлена на решение определенного
класса задач, которые зачастую слабо пересекаются друг с другом. Только малая
часть из существующих моделей принимает во внимание особенности внутренней
структуры отдельного волокна фибринового сгустка, что в определенных случаях
может иметь решающее значение. Кроме того, ни одна из существующих моделей не
способна описать некоторые наблюдаемые в экспериментах принципиальные явления
при лизисе сгустка, такие как образование поперечных разрезов фибринового
волокна и увеличение скорости лизиса сгустка, при увеличении радиуса
составляющих его фибрилл, но с использованием одинакового количестве общего
фибрина.
Целью данной работы было
исследование лизиса фибринового сгустка плазмином с помощью математического
моделирования.
В работе были поставлены следующие
задачи:
§ разработать
математическую модель реакции лизиса фибринового сгустка плазмином с учетом
структуры отдельного фибринового волокна;
§ на основании
сравнения модели с существующими в литературе экспериментальными данными
определить лимитирующую стадию этой реакции, оценить ее кинетические константы,
сравнить их со значениями, известными в литературе;
§ исследовать и
объяснить причину появления поперечных разрезов фибринового волокна в процессе
его лизиса.
1.
Обзор литературы
фибрин плазмин разрез тромбин
Фибринолиз - процесс, необходимый
для нормальной работы организма человека. Его суть заключается в растворении
сгустков крови, образующихся в результате действия системы свертывания. Процесс
свертывания крови запускается организмом как ответ на повреждение стенки
кровеносного сосуда и препятствует потери крови организмом [1]. Фибринолиз же
восстанавливает циркуляцию крови по сосуду, после репарации его повреждений,
устраняя ставшие ненужными сгустки. На рис. 1-1 приведена фотография
фибринового сгустка в отсутствие клеток крови.

Рис. 1-1. Фотография фибринового
сгустка, полученная с помощью сканирующего электронного микроскопа [2].
Прежде чем переходить к обзору
системы фибринолиза, рассмотрим сначала, как образуется сам фибрин.
1.1
Процесс полимеризации фибрина
Предшественником фибрина является
белок фибриноген. Он циркулирует в крови человека в концентрации около 8,8 мкМ.
Молекулярная масса фибриногена 340 кДа, размеры - 45х9х9 нм [3]. На рис. 1-2
показан схематичный вид его молекулы [4]. Фибриноген состоит из трех пар
полипептидных цепочек (Аα-66,5 кДа, Bβ-52 кДа и γ-46,5 кДа), связанных между собой дисульфидными мостиками. В его
структуре выделяют несколько доменов: два D-домена, центральный E-домен и два αС домена. В Е-домене
находятся N-концы всех трех пар полипептидных цепей. В D-домене - С-концы Вβ и γ цепей. γС-домен представляет
собой С-конец Аα полипептидной цепи. αС-домены в фибриногене замкнуты друг на друга. На рис. 1-3
показана модель молекулы фибриногена цыпленка, основанная на его
кристаллической структуре [5]. N-концы Аα и Вβ цепей, а также αС-домены на модели молекулы не показаны.
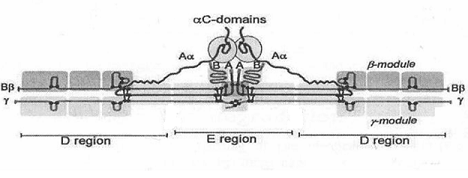
Рис. 1-2. Схематичный вид молекулы
фибриногена [4].
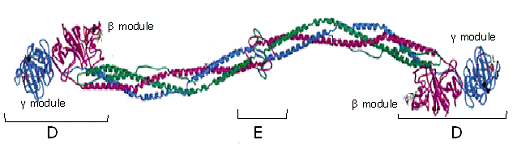
Рис. 1-3. Модель молекулы
фибриногена цыпленка [5]
Полимеризация фибрина происходит в
три этапа:
1) Удаление тромбином
фибринопептидов А и В молекулы фибриногена.
Белок тромбин - результат работы
«каскада» реакций системы свертывания [1] - отрезает от N-концов Аα и Вβ цепей фибриногена
фибринопептиды А и В, превращая при этом фибриноген в фибрин-мономер (рис.
1-4). N-концы Аα и Вβ цепей становятся реакционными областями (a-knob и b-knob), комплементарными
определенным областям в D-доменах фибрин-мономера (a-hole и b-hole). После этого
начинается второй этап полимеризации.
2) Образование
протофибриллы.
Фибрин-мономеры агрегируют друг с
другом через комплементарные knob-hole взаимодействия и образуют двухцепочечную нить - протофибриллу
(рис. 1-4). Нити протофибриллы сдвинуты одна относительно другой на половину
молекулы фибрина. В длину протофибрилла растет примерно до 15 мономеров [6].
Далее следует третий этап полимеризации, приводящий к агрегации протофибрилл
друг с другом и образованию фибриллы.
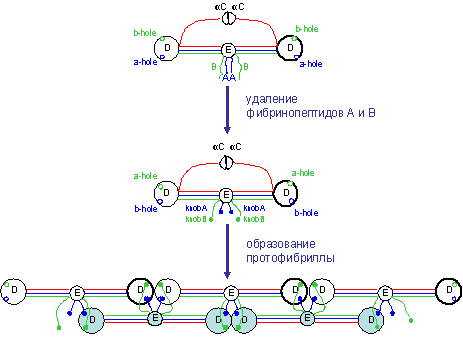
Рис. 1-4. Первые два этапа
полимеризации фибрина
3) Латеральная агрегация
протофибрилл. Образование фибриллы.
До сих пор ученые пытаются выяснить,
как же точно происходит латеральная агрегация протофибрилл, какие
взаимодействия приводят к такой агрегации и какова же упаковка протофибрилл в
фибриновом волокне. За неимением достаточной информации по этим вопросам обычно
ограничивались представлением о фибриновом волокне в виде длинной нити,
состоящей из более мелких нитей - протофибрилл - заполняющих волокно так, чтобы
обеспечить определенную его пористость, наблюдаемую в экспериментах (20%
фибрина / 80% водной фазы в объеме волокна) [7]. Наглядным примером таких
представлений является модель структуры фибриллы из работы [8], используемая
при математическом моделировании фибринолиза (рис. 1-5). В той работе отдельная
фибрилла представлялась в виде длинного цилиндра определенного радиуса, равномерно
заполненного более мелкими длинными цилиндрами (протофибриллами), оси которых
параллельны оси фибриллы. Определенная плотность упаковки протофибрилл давала
необходимую пористость всей фибриллы.
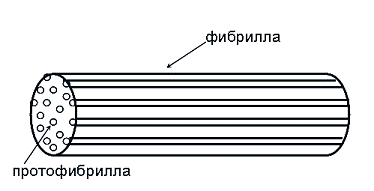
Рис. 1-5. Модель цилиндрической
структуры фибриллы
Только в 2000 г. в работе [9]
авторы, основываясь на данных кристаллической структуры фибриногена и
фрагментов фибрина в комплексе с синтетическими субстратами, предложили более
конкретную модель структуры фибринового волокна. Основным вопросом исследования
авторов была стадия латеральной агрегации протофибрилл. Описанный ими механизм
латеральной агрегации на сегодняшний день представляется довольно убедительным,
однако их окончательная модель трехмерной структуры фибриллы еще не была
подтверждена необходимыми экспериментами и пока является только гипотетической.
Рассмотрим процесс латеральной
агрегации протофибрилл, описанный в той работе.
После того, как с помощью knob-hole взаимодействий
образовалась протофибрилла (ее три вида проекции показаны на рис. 1-6а), на
каждом D-домене открываются по два сайта латеральной агрегации
протофибрилл: один - в βС участках D-доменов, другой - в γС. Сама такая агрегация идет через взамодействия βС-βС и γС-γС D-доменов разных протофибрилл.
Латеральные взаимодействия происходят в плоскостях, лежащих под углами примерно
30-45º по отношению к плоскости
взаимодействия двух нитей в протофибрилле. На рис. 1-6б представлена агрегация
двух протофибрилл в трех ракурсах. При этом нити двух протофибрилл, связанные
латеральными взаимодействиями, в отличие от нитей одной протофибриллы, не
являются сдвинутыми относительно друг друга. На рис. 1-6в показана агрегация
трех протофибрилл. Для наглядности от каждой протофибриллы показана только одна
из двух цепей.
(а)

(б)

(в)
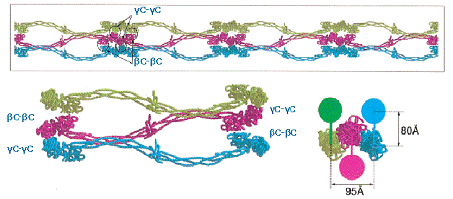
Рис. 1-6. (а) - три вида проекции
протофибриллы; (б) - три вида проекции латеральной агрегации двух протофибрилл;
(в) - латеральная агрегация трех протофибрилл, от каждой протофибриллы
представлена только одна из цепей; в правом нижнем углу показан вид агрегации
трех протофибрилл в поперечном сечении, закрашеннами кругами изображены цепи
протофибрилл, отсутствующие на предыдущих изображениях. [9].
С помощью таких латеральных
взаимодействий протофибриллы собираются вместе и образуют фибриллу. На рис. 1-7
изображен один из вариантов структуры фибриллы, предложенный авторами. Причем,
по их предположению, при латеральной агрегации трех протофибрилл через разные
цепи какой-либо из них и по одну сторону от нее обязательно необходим их сдвиг
относительно друг друга, вследствие запрещающего объемного эффекта (рис. 1-7а,
б). Благодаря такому сдвигу структура фибриллы оказывается в значительной мере
пористой (примерно 80% жидкой фазы в фибрилле), что согласуется с
экспериментальными измерениями [7].
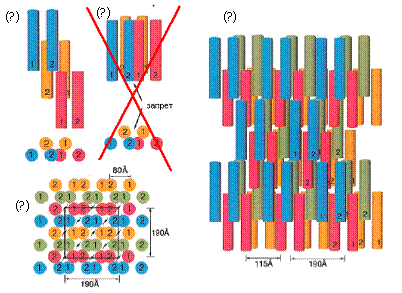
Рис. 1-7. Структура фибриллы,
предложенная в работе [9]. (а) Разрешенная агрегация трех протофибрилл
(индексами 1 и 2 обозначены цепи протофибрилл) (б) Запрещенный вариант
агрегации трех протофибрилл. (в) Структура фибриллы в поперечном сечении. (г)
боковой вид структуры фибриллы. [9].
Схематичный трехмерный вид такой
агрегации протофибрилл показан на рис. 1-8, на котором, в отличие от рис. 1-7,
для наглядности одним блоком изображена не одна цепь протофибриллы, а сама
протофибрилла. Как видно, такая фибрилла имеет слоистую структуру.
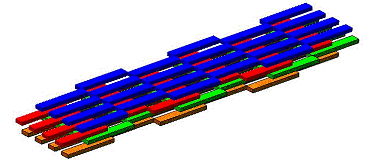
Рис. 1-8. Трехмерный вид структуры
фибриллы, соответсвующий структуре, изображенной на рис. 1-7.
Такая «блочная» структура фибриллы
(один «блок» - это одна протофибрилла длиной примерно в 15 мономеров фибрина)
пока не подтверждена убедительными экспериментами и не считается общепринятой.
Помимо описанных выше взаимодействий
βС - βС и γС - γС при латеральной
агрегации происходит переключение взаимодействий αС - αС с внутримолекулярных (внутри одной молекулы) на межмолекулярные
(между разными молекулами), что дополнительно укрепляет связи протофибрилл друг
с другом [4], [10].
Известно, что фибриллы при
полимеризации могут ветвиться [11]. Степень ветвления (количество точек
ветвления), а также диаметр образующихся фибрилл зависят от условий полимеризации:
концентрации фибриногена, концентрации тромбина, ионной силы раствора и др [7],
[12]. Повышенная концентрация фибриногена, пониженная концентрация тромбина,
низкая ионная сила раствора - эти факторы приводят к образованию сгустка,
состоящего из более толстых фибрилл. При физиологических условиях диаметр
образующейся фибриллы составляет 50-100 нм [11], [13].
1.2
Обзор системы фибринолиза
Ключевой компонент системы
фибринолиза - плазмин (Пм). Этот белок, являющийся сериновой протеазой,
способен напрямую осуществлять гидролиз фибрина. Плазмин циркулирует в крови в
виде своего неактивного предшественника - плазминогена (Пг). Плазминоген
активируется до плазмина одним из двух белков-активаторов: тканевым активатором
плазминогена (тПА) или урокиназным активатором плазминогена (уПА). На рис. 1-9
показана схема основных реакций системы фибринолиза. Рассмотрим отдельные
компоненты этой системы, а потом перейдем к механизмам ее регуляции.
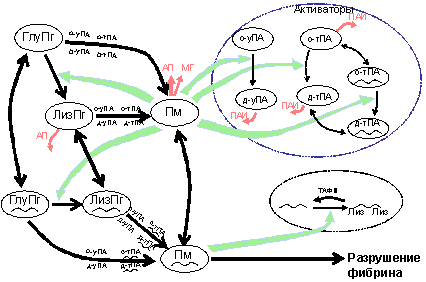
Рис. 1-9. Схема основных реакций системы
фибринолиза. Волнистой линией обозначен фибрин. Волнистая линия под названиями
белков означает, что те белки находятся в связанном с фибрином состоянии. «Лиз»
под волнистой линией обозначает фибрин с С-концевыми лизиновыми аминокислотными
остатками
Основные
компоненты системы фибринолиза
Плазминоген
и плазмин
Плазминоген является одноцепочечным
гликопротеином с молекулярной массой 92 кДа. Синтезируется плазминоген в печени
и циркулирует в крови в виде своей Глу-формы (ГлуПг) в концентрации примерно 2
мкМ. Глу-плазминоген имеет на своем N-конце аминокислоту глутамин. В его структуре выделяют семь
доменов: преактивационный пептид, пять крингл-доменов (К1-К5) и протеазный
домен [16] (перечислены, начиная с N-конца). Удаление плазмином преактивационного пептида приводит к
переходу Глу-формы плазминогена в его Лиз-форму (ЛизПг). Лиз-плазминоген имеет
более открытую конформацию, лучше связывается с фибрином и лучше активируется
активаторами по сравнению с Глу-плазминогеном [17], [18], [19], [20]. Крингл-домены
обеспечивают узнавание плазминогеном лизиновых аминокислотных остатков,
входящих в сайты связывания на фибрине, ингибиторах и клеточных рецепторах
[19], [21], [22], [23], [24]. На молекуле фибрина обнаружено два низкоафинных
сайта связывания плазминогена (плазмина), находящихся между D и E доменами молекулы и включающих в
себя аминокислотные остатки Аα148-160, и по одному высокоафинному сайту на каждом αС домене,
представленному остатками Аα392-610 [4]. Однако роль высокоафинных сайтов остается неопределенной,
т.к. они, по-видимому, не являются доступными плазминогену (плазмину) на
фибрине, организованном в фибриновое волокно (в экспериментах с фибриновыми
сгустками наблюдаются только низкоафинные сайты связывания) [19], [25].
Если же говорить о размерах
плазминогена, то его Глу-форма представляет собой глобулу диаметром 9 нм,
лизиновая же форма является более открытой и имеет форму, напоминающую «дверную
ручку» длиной порядка 14 нм [17]. Плазминоген, связанный своими кринглами с
лигандом, принимает еще более открытую конформацию. Его длина в этом случае
достигает примерно 24 нм [26]. При разрезании активаторами (тПА или уПА) связи
Арг561-Вал562 в молекуле плазминогена, начинает функционировать его протеазный
домен, и плазминоген превращается в активную протеазу плазмин. Плазмин состоит
из двух полипептидных цепей, связанных дисульфидными связями. Тяжелая А-цепь
плазмина содержит все пять кринглов, а в состав легкой В-цепи входит
характерный для трипсиновых протеаз каталитический сайт, состоящий из остатков
Гис602, Асп645 и Сер740. Плазмин способен осуществлять гидролиз многих связей в
молекуле фибрина [27]. Гидролиз определенных связей приводит к разрушению всей
молекулы и образованию продуктов деградации фибрина (ПДФ), разных размеров
[28], [29], [30]. Разрезание же плазмином некоторых других связей около
лизиновых аминокислотных остатков обеспечивает эффект наблюдаемого в
экспериментах улучшения связывания плазминогена (плазмина) [21], [22], [31],
[32]. Такой эффект положительной обратной связи обеспечивают появляющиеся
С-концевые лизины, однако связан ли эффект с появлением новых дополнительных
сайтов связывания или улучшением афинности старых остается не вполне понятным.
Активаторы
плазминогена
Тканевый
активатор плазминогена
Тканевый активатор плазминогена
(о-тПА) является одноцепочечным гликопротеином с молекулярной массой 68 кДа.
Синтезируется он эндотельальными клетками и в норме циркулирует в крови в
концентрации 60 пН [33], хотя только 20% от этого количества находится в
свободной форме, другая же часть циркулирует в комплексе со своим ингибитором
ПАИ. N-концевая часть о-тПА состоит из finger-домена, домена
эпидермального фактора роста и двух крингл-доменов. С-концевая часть молекулы
содержит каталитический домен, характерный для трипсиновых протеаз. Finger и второй крингл-домен
способны взаимодействовать с фибрином [34]. Во взаимодействии о-тПА с
ингибитором ПАИ участвуют его второй крингл-домен, каталитический домен
(активный сайт) и аминокислотные остатки 296-304 [35]. Хотя о-тПА и является
ферментом, его активность по отношению к своему субстрату-плазминогену довольно
мала в отсутствии фибрина, тогда как в присутствии последнего активность
повышается примерно в 1000 раз, благодаря формированию тройного комплекса
активатор-плазминоген-фибрин [36], [20]. Плазмин может превращать
одноцепочечный активатор (о-тПА) в двухцепочечный (д-тПА) путем разрезания
связи Арг275-Иле276. Однако значение такого превращения о-тПА в д-тПА для
ускорения процесса активации остается спорным вопросом. По данным одних ученых
д-тПА связывается с фибрином лучше, чем о-тПА [37], т.е. появление д-тПА
является положительной обратной связью, по данным же других - хуже [38], что
предполагает отрицательную обратную связь.
Урокиназный
активатор плазминогена
Урокиназный активатор плазминогена
(о-уПА) является одноцепочечным гликопротеином с молекулярной массой 55 кДа.
Синтезируется он многими клетками (соединительнотканными, эпителиальными,
макрофагами, эндотелиальными клетками) и в норме циркулирует в крови в
концентрации 70 пМ [39]. О-уПА состоит из домена эпидермального фактора роста
(необходимого для связывания с клеточными рецепторами), крингл-домена (не
имеющего афинности к лизину) и каталитического домена (гомологичного
трипсиновым протеазам). Разрезание плазмином связи Лиз158-Иле159 приводит к
превращению одноцепочечного урокиназного активатора (о-уПА) в двухцепочечный
(д-уПА), являющийся гораздо более эффективным [40], [41]. Урокиназный активатор
имеет очень низкое сродство к фибрину, однако присутствие фибрина все же
повышает активацию плазминогена с помощью о-уПА (но не д-уПА) [42]. Интересно,
что основной ингибитор активаторов плазминогена ПАИ способен ингибировать
только д-уПА, но не о-уПА [43].
Ингибиторы
Антиплазмин
Антиплазмин (АП) является очень
быстрым ингибитором плазмина [44]. Этот белок принадлежит к семейству серпинов
и является гликопротеином с молекулярной массой 70 кДа. Синтезируется
антиплазмин в печени и циркулирует в крови в концентрации 1 мкМ. Антиплазмин
взаимодействует с лизин-связывающими кринглами и активным сайтом плазмина.
Плазмин, находящийся в связанном с фибрином состоянии, гораздо меньше подвержен
ингибированию антиплазмином: эффективность его инактивации уменьшается в 430
раз и его время жизни составляет около 7 минут (тогда как время жизни свободного
плазмина примерно 1 с) [45].
Макроглобулин
Макроглобулин (МГ) - ингибитор
большого числа протеиназ, его молекулярная масса 725 кДа. В системе фибринолиза
наиболее заметное действие оказывает на плазмин, хотя эффективность
ингибирования плазмина макроглобулином составляет примерно 10% от эффективности
ингибирования антиплазмином [46].
Ингибитор
активаторов плазминогена
Тромбин-активируемый
ингибитор фибринолиза
Тромбин-активируемый ингибитор
фибринолиза (ТАФИ) является одноцепочечным гликопротеином с молекулярной массой
60 кДа. Он синтезируется в печени и циркулирует в крови в концентрации 220 нМ
[49]. ТАФИ является проферментом и нуждается в активации для превращения в
активный фермент ТАФИа. Такая активация осуществляется в основном комплексом
тромбин-тромбомодулин [50], [51], но также может осуществляться и плазмином
[52], [53], трипсином [52] или одним тромбином [50], [52], хотя и гораздо
медленнее. ТАФИа является нестабильным при 37°С, время его полужизни при этой
температуре 8-9 мин [51]. Ингибирующее действие ТАФИ заключается в удалении
С-концевых лизиновых аминокислотных остатков, появляющихся на фибрине в
процессе его деградации [54].
Стадии
фибринолиза
Весь процесс фибринолиза можно
разбить на две стадии:
) превращение плазминогена в плазмин
с помощью активаторов плазминогена;
) лизис фибринового волокна
плазмином.
Причем в первой стадии активное
образование плазмина из плазминогена происходит только там, где появляется
фибрин, т.е. где образуется сгусток. Это связано с тем, что, во-первых,
некоторые реакции фибринолиза идут быстрее на поверхности фибрина, чем в плазме
(например, активация плазминогена с помощью тПА ускоряется фибрином примерно в
1000 раз [20], [36]) и, во-вторых, белки, связанные с фибрином, оказываются защищенными
от ингибиторов (например, время полужизни плазмина в присутствии фибрина
составляет 7 мин, тогда как в плазме оно гораздо меньше - 0,1 с [45]). Таким
образом, появление в крови фибрина запускает процесс его же растворения.
Образуется фибрин за минуты, растворяется же за часы.
Для первой стадии фибринолиза
характерно также наличие множества положительных обратных связей,
осуществляемых плазмином и ускоряющих процесс его же образования: появление
С-концевых лизинов, превращение Глу-плазминогена, о-тПА, о-уПА в более
эффективные Лиз-плазминоген, д-тПА и д-уПА соответственно.
Вторая стадия фибринолиза является
не менее сложной, чем первая, хотя в ней участвуют всего два белка: фибрин в
качестве субстрата и плазмин в качестве фермента, разрушающего этот субстрат.
Данная реакция протекает в две стадии: обратимое связывание плазмина с фибрином
и гидролиз фибрина. В литературе не удалось обнаружить прямых экспериментов,
направленных на определение кинетических констант этой реакции, вследствие ряда
ее особенностей. Во-первых, плазмину не равновероятно доступен весь объем
фибрина. До сих пор у ученых нет однозначного мнения по поводу степени
проникновения плазмина в фибриновое волокно. Одни считают, что плазмину
доступна только внешняя поверхность фибриллы [55]. Другие предполагают, что
плазмин может проникать внутрь волокна [56]. Кроме того, для нахождения
кинетических констант этой реакции необходимы эксперименты с равномерным
распределением плазмина в сгустке для того, чтобы избежать влияния диффузии
плазмина. А в таких экспериментах, вероятно, является затруднительным точное
наблюдение за концентрацией появившихся продуктов деградации фибрина.
Во-вторых, в процессе лизиса на фибрине появляются дополнительные центры
связывания плазмина [21], [22], [31], [32], что также затрудняет точное
определение констант реакции. В-третьих, известно, что образующиеся продукты
деградации способны ингибировать реакцию лизиса фибрина, т.к. содержат сайты
связывания плазмина [57].
Долго была общепринятой модель
равномерного послойного лизиса фибрина, в которой считалось, что плазмин
действует только на поверхности фибриллы. При этом по мере расщепления внешнего
слоя фибриллы плазмину становятся доступными внутренние области волокна [8],
[55]. Однако исследования фибринолиза с помощью электронной, конфокальной и
атомно-силовой микроскопии показали, что отдельная фибрилла вместо того, чтобы
утоньшаться, разрезается плазмином в поперечных сечениях, а ее средний радиус
увеличивается, вопреки предполагавшемуся его уменьшению [2], [56], [58], [59],
[60], [61] (рис. 1-10). В литературе встретилось только одно объяснение
появлению таких поперечных разрезов: плазмин, благодаря наличию в его структуре
нескольких фибрин-связывающих крингл-доменов, возможно, способен проникать
внутрь фибриллы, связываясь поочередно то одним, то другим крингл-доменом с
соседними протофибриллами, «перешагивая» от одной протофибриллы к другой. Таким
образом, проникнув внутрь, он мог бы разрезать последовательно все
протофибриллы, находящиеся в поперечном сечении и образовать поперечный разрез
фибриллы [56]. Однако экспериментального подтверждения такого механизма пока
нет. Увеличение среднего радиуса фибриллы, по-видимому, связано с тем, что
высвободившиеся из фибриллы кусочки фибрина способны связываться с другими ее
участками и увеличение среднего радиуса фибриллы компенсируется уменьшением ее
длины.
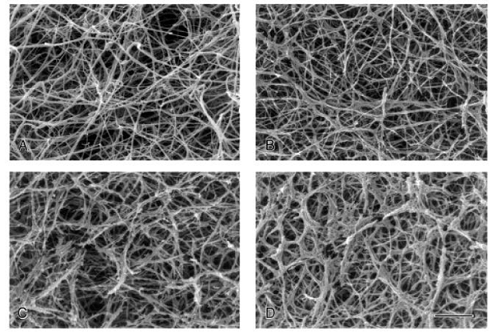
Рис. 1-10. Фотографии фибринового
сгустка в процессе его лизиса плазмином, полученные с помощью сканирующего
электронного микроскопа [56]. (А) Контрольный сгусток, в отсутствии плазмина.
Сгусток при 30 мин (В), 1 ч (С) и 3,5 ч (D) лизиса плазмином (0,2 U/ml)
Известно, что радиус фибринового
волокна влияет на скорость его лизиса. Причем, интересно, что, хотя отдельная
более тонкая фибрилла лизируется быстрее более толстой, однако весь сгусток,
состоящий из тонких фибрилл лизируется медленнее сгустка, состоящего из толстых
фибрилл, при одинаковом количестве полного фибрина [55], [58]. Одно из
объяснений этого феномена такое: т.к. лизис фибриллы преимущественно идет ее
поперечными разрезаниями, то в сгустке, состоящем из толстых фибрилл большее
количество белка сосредоточено в одной фибрилле, а количество фибрилл меньше,
и, поэтому, задержка, связанная с переходом плазмина от одних фибрилл к другим
меньше, чем в случае сгустка, состоящего из тонких фибрилл [58].
Математическое
описание системы фибринолиза
В существующей литературе известно
несколько математических моделей фибринолиза. Каждая из них направлена на
решение определенного класса задач. Некоторые из этих моделей являются
попытками довольно полно описать всю систему фибринолиза, другие же
сосредоточены только на какой-либо ее части. В Таблице 1 приведены основные
области проблем, исследуемых авторами в своих моделях.
Таблица 1. Существующие
математические модели фибринолиза
|
|
Год
|
Авторы
|
Область проблем, исследуемых авторами
|
Ссылка
|
|
1984
|
Sobel BE Gross RW
Robinson AK
|
оценка повышения фибринолитической активности крови при введении
разного количества тПА
|
62
|
|
1986
|
Tiefenbrunn AJ Graor
RA Robison AK Lucas FV Hotchkiss A Sobel BE
|
|
63
|
|
1993
|
Diamond SL Anand S
|
исследование лизиса фибринового сгустка при наличии потока
|
8
|
|
1996
|
Anand S Diamond SL
|
|
64
|
|
1995
|
Anand S Wu J Diamond
SL
|
сравнение лизиса двух биополимеров: фибрина и коллагена при
наличии потока
|
65
|
|
1995
|
Zidansek A Blinc A
Lahajnar G Keber D Blinc
R
|
исследование формы распространяющегося фронта лизиса при
использовании урокиназы в качестве активатора плазминогена
|
66
|
|
1997
|
Kolev K Tenekedjiev K
Komorowicz E Machovich R
|
оценка участия разных доменов плазмина в лизисе фибринового
сгустка
|
67
|
|
2002
|
Pleydell CP David T
Smye SW Berridge DC
|
лизис остаточного после реканализации сгустка в условиях потока
|
68
|
|
2003
|
Anand M Rajagopal K
Rajagopal KR
|
взаимодействие систем свертывания и фибринолиза
|
69
|
|
2005
|
Anand M Rajagopal K
Rajagopal KR
|
|
70
|
|
2000
|
Голомысов И.С.
|
исследование кинетики лизиса фибринового сгустка а) плазмином,
б) с использованием урокиназы в качестве активатора плазминогена
|
71
|
Работы [69], [70] являются попытками
создать полную математическую модель, описывающую одновременно и процесс
свертывания, и фибринолиз. Однако модели являются довольно запутанными и
сложными для восприятия кроме того, в работах совершенно отсутствует сравнение
моделей с экспериментальными данными, что делает затруднительным проверку их
корректности.
Остальные работы направлены на
исследование определенных областей фибринолиза. Причем, в моделях с разной
степенью подробности описываются параметры сгустка. Только работы [8], ([64],
[65]), [71] вводят в рассмотрение отдельное фибриновое волокно. Изучение именно
этих работ представляло наибольший интерес при создании математической модели
лизиса фибринового сгустка в данной работе.
1.3
Постановка задачи
Анализ литературы показал, что
вторая стадия фибринолиза - реакция разрушения фибрина плазмином - является
наименее изученной и объясненной областью этой системы.
Каковы кинетические константы данной
реакции? От каких параметров они зависят? Справедливы ли их литературные
значения? Какова структура фибринового волокна? Может ли плазмин проникать
внутрь фибриллы? Почему и как образуются поперечные разрезы фибрилл? Почему,
если отдельные тонкие фибриллы лизируются быстрее толстых, весь сгусток,
образованный тонкими фибриллами, разрушается медленнее сгустка, образованными
толстыми, при одинаковом общем количестве фибрина? Как происходит лизис
фибриллы: только ли поперечными разрезаниями или же еще имеет место послойный
лизис?
На все эти вопросы точных ответов,
однозначно подтвержденных экспериментами, пока нет.
Среди существующих математических
моделей фибринолиза только в работах [8], [71] были произведены попытки описать
вторую стадию фибринолиза с учетом внутренней структуры фибринового волокна,
однако многие процессы, происходящие при его лизисе, теми моделями объяснить не
удается.
Поэтому целью данной работы было
исследование лизиса фибринового волокна плазмином с помощью мотематической
модели этого процесса, которая была бы более приближена к описанию наблюдаемых
при лизисе явлений и позволила бы дать ответы на некоторые из поставленных
вопросов.
В задачи исследования входили:
§ выявление
лимитирующей стадии реакции, оценка ее кинетических констант, сравние их со
значениями, известными в литературе;
§ объясните причины
появления поперечных разрезов фибриллы в процессе ее лизиса.
2.
Методы исследования
2.1 Математическая
модель для кинетического исследования лизиса фибринового сгустка плазмином
Для моделирования лизиса фибрина
плазмином принималась следующая идеализация фибринового волокна. Фибрилла
рассматривалась в виде цилиндра радиуса R. Каждая фибрилла состояла из
протофибрилл, которые представлялись в виде цилиндров радиуса r, оси которых параллельны оси
фибриллы (рис. 2-1А). В поперечном сечении фибриллы предполагалось равномерное
по плотности кольцевое расположение протофибрилл (рис. 2-1Б).
фибрин плазмин разрез
тромбин
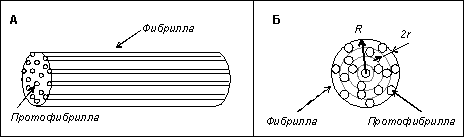
Рис. 2-1. Модель цилиндрического
послойного строения фибринового волокна.
Плазмину был доступен только внешний
слой протофибрилл. На каждый мономер фибрина для плазмина приходилось два сайта
связывания. По мере лизиса от фибрина отщеплялись продукты деградации, радиус
фибриллы уменьшался, и для плазмина оказывались доступными следующие слои
протофибрилл.
Схема реакции расщепления фибрина
плазмином имела следующий вид:
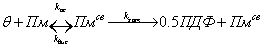
где 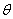 −
свободные сайты связывания плазмина на поверхности фибрина;
−
свободные сайты связывания плазмина на поверхности фибрина;
Пм − свободный
плазмин;
Пмсв −
плазмин, связанный с фибрином;
ПДФ − продукты
деградации фибрина;
kас
и kас - кинетические константы ассоциации и диссоциации плазмина с
фибрином соответственно;
kкат−
каталитическая константа расщепления фибрина плазмином.
Кинетика гомогенного
лизиса фибрина описывалась системой дифференциальных уравнений, написанных в
соответствии с приведенной выше схемой на основании закона действующих масс и с
учетом изменения количества сайтов связывания на поверхности фибриллы при
изменении её радиуса:
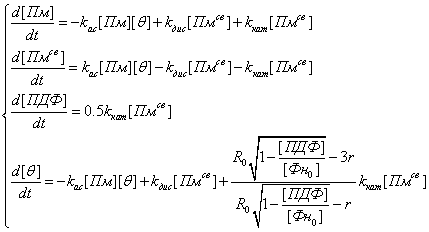
где [i] обозначает объёмную концентрацию i-й
переменной.
Все переменные модели
были отнесены к полному объёму сгустка, тем самым модель была упрощена до
случая гомогенного распределения всех компонент. Такое упрощение для переменных
Пм и ПДФ оправдано, если учесть, что объём, занимаемый фибриллами в сгустке,
составляет <1% от полного объёма всего сгустка при физиологической
концентрации фибриногена (8,8 мкМ). Для переменных Пмсв и θ
упрощение также возможно, вследствие достаточно быстрой диффузии
плазмина в поре.
Последний член в правой
части уравнения для изменения θ со временем
описывал изменение концентрации сайтов связывания за счет изменения радиуса
фибриллы в процессе лизиса. Он равен
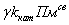
где γ
− отношение количества протофибрилл в соседних слоях:
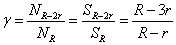
R,
SR-2r −
площади слоев с внешними радиусами R
и R-2r соответственно и
толщиной 2r.
Радиус фибриллы R в момент времени t
выражался через [ПДФ] в момент времени t
и начальные R0 и [Фн0]:
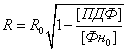
Начальные условия для
данной системы дифференциальных уравнений имели следующий вид:
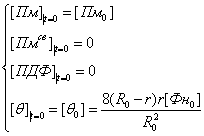
где R0 − начальный радиус фибриллы, r − начальный радиус протофибриллы, [Фн0] −
объемная начальная концентрация фибрина, [Пм0] − объемная
начальная концентрация плазмина.
Выражение для [θ0]
было получено из тех соображений, что отношение количества мест связывания,
содержащихся во внешнем слое фибриллы к их полному количеству внутри фибриллы
равно отношению площадей поперечного сечения внешнего слоя и всей фибриллы
соответственно:
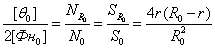
где NR, SR − количество протофибрилл в слое с внешним радиусом R0 и толщиной 2r и площадь такого слоя
соответственно; N0, S0 − количество протофибрилл в поперечном сечении фибриллы
радиуса R0 и площадь такого
поперечного сечения соответственно.
Система дифференциальных уравнений
(2) начальными условиями (6) решалась численно с помощью стандартной функции ODE15S математического пакета MATLAB 7.0.
2.2 Математическая
модель для проверки гипотезы, объясняющей причину появления поперечных разрезов
фибрилл
Для проверки предложенной в работе
гипотезы (см. п. 3.2) предыдущая модель (2) была расширена: в нее вводились
увеличение афинности плазмина к фибрину в процессе лизиса и возможность
фиксировать поперечные разрезы фибрилл. Структура фибриллы предполагалась аналогичной
описанной выше (рис. 2-1). Однако при этом фибрилла была условно поделена на
секции длиной в один мономер фибрина (рис. 2-2).
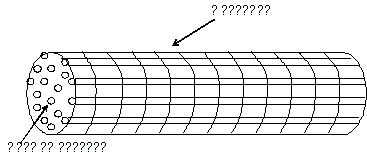
Рис. 2-2. Разделение фибриллы на
секции
Каждая секция характеризовалась
количеством удаленных из нее плазмином протофибрилл длиной также в один
мономер. Максимальное количество протофибрилл в секции определялось начальным
радиусом фибриллы. При физиологических условиях формирования фибриллы среднее
значение ее радиуса равно примерно 40 нм [11], [13], а коэффициент пористости ε=0.8 [7]. При этом количество
протофибрилл радиуса r=4 нм в фибрилле равно 20. Таким образом, выделялось 20 классов
секций. Первый класс характеризовался индексом 0, в него входили секции
фибриллы, в которых не было удалено ни одной протофибриллы. Последнему классу
приписывался индекс 20, что значило, что в тех секциях были удалены все 20
протофибрилл, и это же значило, что в фибрилле в местах, где находились эти
секции, произошли поперечные разрезы. Вся фибрилла представлялась как набор
секций, каждая из которых принадлежала определенному классу. До начала лизиса
все секции фибриллы характеризовались индексом 0. При воздействии плазмина на
фибриллу секции переходили в следующие классы.
Плазмину считались доступными два
верхних слоя протофибрилл. Это предположение было сделано исходя из сравнения
размеров плазмина с характерными размерами фибринового волокна. Изначально
количество протофибрилл в двух верхних слоях было равно 12 (в соответствии с
физиологическими значениями R, r и ε). Для удобства эти два слоя были объединены в один, и фибрилла
рассматривалась состоящей из слоев толщиной в две протофибриллы.
Ниже приведены события, происходящие
при лизисе одной секции и принцип, по которому в модели вводилось увеличение афинности
плазмина к фибрину:
1. Изначально: секция фибриллы
состояла из 20 протофибрилл; 12 протофибрилл находились в верхнем слое и были
доступны плазмину; все сайты связывания на протофибриллах условно были названы
«нативными»;
2. При гидролизе одной протофибриллы
считалось, что плазмин успевал «обрабатывать» в среднем еще одну протофибриллу
из этого же слоя, а также открывшуюся протофибриллу из следующего слоя,
превращая находящиеся на них «нативные» сайты в «новые». «Новые» сайты имели в
два раза большую афинность по сравнению с «нативными». При этом секция
переходила в следующий класс;
. При переходе секции в
следующий класс количество «нативных» и «новых» сайтов в поверхностном слое
изменилось в соответствии с изменением радиуса этого слоя; при этом при
переходе к 11 классу в поверхностном слое оставались только «новые» сайты.
. При гидролизе всех 20
протофибрилл в одной секции появлялся поперечный разрез фибриллы.
Кинетика появления поперечных
разрезов фибриллы описывалась системой дифференциальных уравнений, написанных
на основании закона действующих масс:
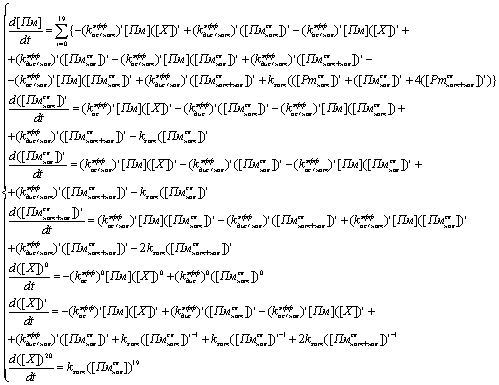
где символом ()i обозначаются переменные, относящиеся к i-му
классу секций
(i принимает значения от 0 до 19);
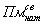 - плазмин, связанный
только с «нативными» сайтами секции;
- плазмин, связанный
только с «нативными» сайтами секции;
 - плазмин, связанный
только с «новыми» сайтами секции;
- плазмин, связанный
только с «новыми» сайтами секции;
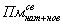 - плазмин, связанный и
с «нативными» и с «новыми» сайтами секции;
- плазмин, связанный и
с «нативными» и с «новыми» сайтами секции;
X
- секции фибрина, свободные от плазмина;
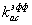 - эффективный
коэффициент ассоциации плазмина со всеми «нативными» сайтами секции, для разных
секций выражающийся формулами:
- эффективный
коэффициент ассоциации плазмина со всеми «нативными» сайтами секции, для разных
секций выражающийся формулами:
для i=0 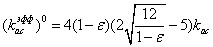
для i=1:10 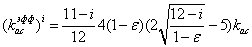
для i=11:19 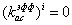
kас
- коэффициент ассоциации плазмина с одним «нативным» сайтом;
 - эффективный
коэффициент диссоциации плазмина, связанного с «нативными» сайтами секции; с
- эффективный
коэффициент диссоциации плазмина, связанного с «нативными» сайтами секции; с 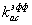 связан
через равновесную константу диссоциации формулой:
связан
через равновесную константу диссоциации формулой:
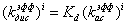
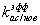 - эффективный
коэффициент ассоциации плазмина со всеми «новыми» сайтами секции, для разных
секций выражающийся формулами:
- эффективный
коэффициент ассоциации плазмина со всеми «новыми» сайтами секции, для разных
секций выражающийся формулами:
для i=0 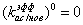
для i=1:12 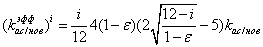
для i=13:19 
kас/нов
- коэффициент ассоциации плазмина с одним «новым» сайтом;
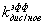 - эффективный
коэффициент диссоциации плазмина, связанного с «новыми» сайтами секции; в
модели он имел такое же значение, как и
- эффективный
коэффициент диссоциации плазмина, связанного с «новыми» сайтами секции; в
модели он имел такое же значение, как и  :
:
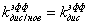
Выражения для эффективных
коэффициентов связывания представляют собой формулы типа:
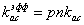 или
или 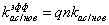
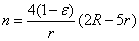
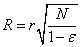
N - количество протофибрилл в фибрилле;
p, q - относительные доли «нативных» и «новых» сайтов в поверхностном
слое соответственно;
Начальные условия для системы
уравнений (8) имели следующий вид:
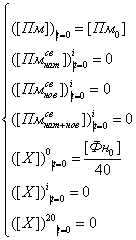
Для проверки влияния появления
«новых» сайтов связывания плазмина на образование поперечных разрезов фибриллы
была написана модель, аналогичная модели (8), но без учета появления «новых»
сайтов:
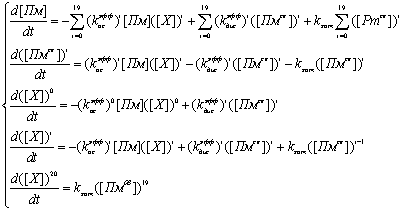
где 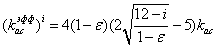 ;
;
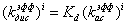 .
.
Начальные условия для
модели (21) имели следующий вид:
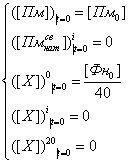
Системы дифференциальных уравнений
(8), (21) с соответствующими им начальными условиями (20) и (22) решались
численно с помощью стандартной функции ODE15S математического пакета MATLAB 7.0.
3.
Результаты и обсуждение
.1 Кинетическое
исследование лизиса фибринового сгустка плазмином
Сравнение результатов
модели с существующими экспериментальными данными.
На рис. 3-1 представлены результаты
эксперимента по кинетике лизиса фибринового сгустка плазмином, полученные в
работе [71]. В том эксперименте в лунке формировался фибриновый сгусток объемом
60 мкл и высотой 1,5 мм из биотин-меченого фибриногена концентрации 10 мкМ.
Сверху сгустка в ту же лунку добавлялось 60 мкл раствора плазмина высотой 1,5
мм с концентрацией 0,6 мкМ. В процессе инкубации при перемешивании на
шейкер-инкубаторе при 37ºС через определенные промежутки времени отбирали аликвоты раствора
и измеряли концентрацию продуктов деградации фибрина авидин-биотиновым методом.
На этом же графике изображено решение гомогенной модели (2) с начальными
условиями (6), приближенными к условиям проведения эксперимента, и
литературными значениями констант реакции, представленными в Таблице 2 (кривая
1). В качестве начальных условий брались значения [Фн0]=10 мкМ, [Пм0]=0,3
мкМ (концентрация плазмина, пересчитанная на начальный объем фибринового
сгустка), r=4 нм (при
физиологических условиях) [8], R0=40 нм (при физиологических условиях) [11].
Таблица 2: Литературные значения
констант реакции расщепления фибрина плазмином
|
Константа
|
Значение
|
Ссылка
|
|
kкат
|
2,72 мин-1а
|
[57]
|
|
300 мин-1б
|
[72]
|
|
kас
|
0,006 мкМ-1мин-1
|
[8]
|
|
|
0,03 мкМ-1мин-1
|
[64]
|
|
Kd
|
0,5 мкМ
|
[25]
|
|
а
Рассчитано из значения наблюдаемой kкат=1,36
мин-1 для гидролиза плазмином фибрина [57] и учетом того, что на
один мономер фибрина для плазмина приходится два сайта связывания [25].
бРассчитано из kкат=1500
мин-1 для гидролиза плазмином специфических хромогенных субстратов
[72] и с учетом того, что для растворения одной молекулы фибрин-мономера
плазмин должен расщепить около 10 пептидных связей [8].
|
При данных начальных условиях и
предположенных константах реакции решение модели не соответствует экспериментальным
результатам. Было предположено, что такое сильное несоответствие вызвано либо
неверным значением начального радиуса фибриллы, используемым в модели, от
которого зависит начальное количество доступных для плазмина сайтов связывания,
либо неверными значениями кинетических констант реакции. Для проверки первого
предположения, в модели (2) все сайты связывания в объеме фибриллы были сделаны
доступными плазмину (в модели было убрано слагаемое, характеризующее изменение
концентрации сайтов связывания при изменении радиуса фибриллы). Решение такой
модели при доступности всех мест связывания изображено кривой 2. Очевидно, что
модель по-прежнему довольно сильно отличалась от эксперимента. Далее было
исследовано влияние констант реакции на кинетику лизиса фибрина. Изменение
константы kкат на два порядка до
значения 300 мин-1 не дало практически никаких изменений в решении
модели (данные не показаны). Изменение же константы kас (и, соответственно, kдис, т.к. они связаны
через равновесную константу диссоциации Kd=0,5 мкМ [25]) на один порядок до значения 0,1 мкМ-1мин-1
позволило модели хорошо описать результаты эксперимента (кривая 3). Таким
образом, было сделано предположение, что, по-видимому, именно скорость
связывания плазмина с фибрином (характеризующаяся константой kас) определяет скорость всей реакции расщепления фибрина.
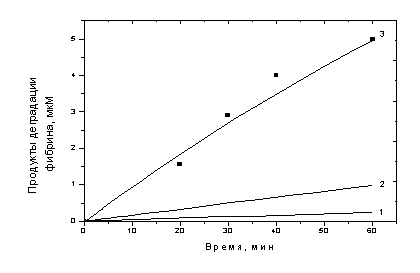
Рис. 3-1. Кинетика
лизиса биотин-меченого фибринового сгустка плазмином. Символами изображены
результаты эксперимента (концентрация фибрина в сгустке - 10 мкМ, концентрация
плазмина в верхнем слое - 0,6 мкМ) Кривая 1 - результат решения модели (2) с
начальными условиями: [Фн0]=10 мкМ, [Пм0]=0,3 мкМ, r=4 нм, R0=40
нм и значениями констант kкат=2,72
мин-1, kас=0,006
мкМ-1 мин-1, kдис=0,003
мин-1. Кривая 2 - результат решения модели (2) (при условии, что
плазмину доступны все сайты связывания в объеме фибриллы) с начальными
условиями: [Пм0]=0,3 мкМ, θ0=20
мкМ и значениями констант kкат=2,72
мин-1, kас=0,006
мкМ-1мин-1, kдис=0,003
мин-1. Кривая 3 - результат решения модели (2) с начальными
условиями: [Фн0]=10 мкМ, [Пм0]=0,3 мкМ, r=4 нм, R0=40
нм и значениями констант kкат=2,72
мин-1, kас=0,1
мкМ-1мин-1, kдис=0,05
мин-1.
Модель (2) также была применена для
описания эксперимента по кинетике лизиса фибринового сгустка плазмином,
проведенного в работе [57] В том эксперименте формировались 125I-меченые фибриновые сгустки объемами
0.1, 025 и 0.35 мкл одинаковой концентрации (8,8 мкМ) и погружались каждый в 2
мл раствора плазмина с концентрацией 5-60 нМ. В процессе инкубации при
постоянном перемешивании на качалке при 37ºС отбирали аликвоты раствора, окружающего сгусток и измеряли
радиоактивность растворимых продуктов деградации фибрина. Результаты одного из
экспериментов, проведенных таким образом, изображены на рис. 3-2.
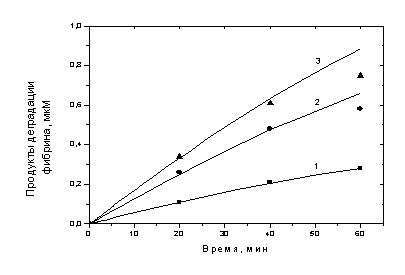
Рис. 3-2. Кинетика
лизиса 125I-меченого
фибринового сгустка плазмином
Символами изображены
результаты экспериментов. Начальные
концентрации фибрина (пересчитанные на полный объем раствора плазмина вместе со
сгустком) (мкМ): 0.44 (■), 1.1 (●), 1.54 (▲). Начальная
концентрация плазмина 0,06мкМ. Сплошные кривые представляют результаты решений
модели (2) с начальными условиями: [Фн0]=0.44 (1), 1.1 (2), 1.54 (3)
мкМ, [Пм0]=0,06 мкМ, r=4
нм, R0=40 нм и значениями констант k1=2,72
мин-1, kас=0,8
мкМ-1мин-1, kдис=0,4
мин-1.
Для описания этого
эксперимента также была применена модель (2) с начальными условиями,
соответствующими условиям проведения эксперимента. Результаты анализа и
сравнения модели с экспериментом дали аналогичный вывод о лимитирующем действии
скорости связывания плазмина с фибрином на скорость расщепления фибрина. Для
того, чтобы описать эксперимент, значения kас
и kдис потребовалось изменить до значений 0,8 мкМ-1мин-1
и 0,4 мин-1 соответственно (рис. 3-2, кривые 1-3).
Влияние начального
радиуса фибриллы и констант реакции на поведение модели.
Для более полного
представления о влиянии начального радиуса фибриллы и констант реакции на
решение модели приведена Таблица 3. Таблица заполнена значениями параметров и
констант, которые давали бы совпадение результатов решения модели с
экспериментальными данными. Начальный радиус фибриллы R0,
соответствующая ему начальная концентрация сайтов связывания θ0
и каталитическая константа kкат
фиксировались. А значение kас
варьировалось до значения, при котором модель описывала
эксперимент. Значение kдис
было связано с kас
через равновесную константу диссоциации Kd=0.5
мкМ [25].
Из таблицы видно, что
при всех приведенных значениях радиуса фибриллы и константы kкат для описания экспериментов моделью
приходится довольно сильно (на 1-3 порядка) изменять значение
константы kас, оцененное в работе [8]. Исходя из этих результатов, можно
сделать вывод о том, что из двух стадий реакции лизиса фибрина лимитирующей
является стадия связывания плазмина. Стадия же непосредственного гидролиза
фибрина плазмином гораздо слабее влияет на кинетику всей реакции. Кроме того,
для физиологических значений радиуса фибриллы и из исследования Таблицы 3 можно
дать численную оценку значения константы связывания плазмина kас (0,05-1,0 мкМ-1мин-1).
Таблица 3. Значения
варьируемых в модели констант kас а
|
Эксперимент из работы [71] ([Фн0]=10 мкM; [Пм0]=0.3 мкM)
|
Эксперимент из работы [57] ([Фн0]=1.54 мкM; [Пм0]=0.03 мкM)
|
|
R0,
нм
|
θ0,
мкМ
|
Варьируемая константа kас
[мкМ-1мин-1] и соответствующая ей kдис [мин-1]б
|
R0,
нм
|
θ0, мкМ
|
Варьируемая константа kас
[мкМ-1мин-1] и соответствующая ей kдис [мин-1]
б
|
|
|
Для kкат=2,72 мин-1
|
Для kкат=300 мин-1
|
|
|
Для kкат=2,72 мин-1
|
Для kкат=300 мин-1
|
|
200
|
1,568
|
kас=0,6 kдис=0,3
|
Kас=0,4
Kдис=0,2
|
200
|
0,241
|
kас=5,0 kдис=2,5
|
kас=3,0 kдис=1,5
|
|
100
|
3,072
|
kас=0,3
kдис=0,15
|
100
|
0,473
|
kас=2,0 kдис=1,0
|
kас=1,5 kдис=0,75
|
|
50
|
5,888
|
kас=0,15
kдис=0,075
|
kас=0,12
kдис=0,06
|
50
|
0,907
|
kас=1,0 kдис=0,5
|
kас=0,8 kдис=0,4
|
|
40
|
7,2
|
kас=0,1
kдис=0,05
|
kас=0,09
kдис=0,045
|
40
|
1,109
|
kас=0.8 kдис=0,4
|
kас=0,65 kдис=0,325
|
|
20
|
12,8
|
kас=0,07
kдис=0,035
|
kас=0,06
kдис=0,03
|
20
|
1,971
|
kас=0,5 kдис=0,25
|
kас=0,4
kдис=0,2
|
|
Все места связывания доступны плазмину в
|
20
|
kас=0,05
kдис=0,025
|
kас=0,04
kдис=0,02
|
Все места связывания доступны плазмину в
|
3,08
|
kас=0,2
kдис=0,1
|
kас=0,2
kдис=0,1
|
|
а Значения
θ0
(соответствующие значениям R0)
и kкат в модели фиксировались, значения kас
варьировались до совпадения модели с экспериментом. б kдис рассчитывалось из kас
и константы диссоциации Kd=0,5
мкМ [25]. в Плазмину считались доступными все сайты связывания в
объеме фибриллы, модель (2) рассматривалась без последнего слагаемого в
правой части уравнения для изменения θ.
|
О значениях констант
реакции, известных в литературе.
В литературе не удалось обнаружить
прямых экспериментов, направленных на определение констант kкат и kас. Это связано с рядом
особенностей, затрудняющих её экспериментальное исследование, о которых
говорилось в п. 1.2.2. Однако в литературе все же существует несколько оценок
констант этой реакции (Таблица 1). Например, в теоретической работе [8] была
произведена оценка для kас, равная 0,006 мкМ-1мин-1, однако она была
довольно условной. В той работе предполагалось, что kас для плазмина является такой же, как и для Lys-формы плазминогена в
силу схожести их Kd. Оценивая kf для Lys-плазминогена авторы
ссылались на статью [19], где довольно приближенно оценивалось время, в течение
которого диспергированный фибрин насыщался плазмином разной концентрации. В еще
одной теоретической работе тех же авторов kас оценивалась как 0,03 мкМ-1мин-1 [64] на
основании результатов статьи [73], в которой одновременно наблюдалась кинетика
превращения плазминогена в плазмин и кинетика ингибирования плазмина
несколькими ингибиторами как в свободной плазме, так и в связанном с фибрином
состоянии. Значение же концентрации свободного плазмина, необходимое для оценки
kас, определялось как
разность концентраций других компонент, вычисление которой могло привести к
довольно большой ошибке. Таким образом, известные в литературе значения kас являются довольно
сомнительными. Большой разброс в литературных данных существует и по поводу
каталитической константы kкат (Таблица 2), однако из
наших результатов вытекает, что точное значение этой константы не настолько
критично для скорости протекания всей реакции расщепления фибрина, как значение
kас.
Основные результаты
кинетического исследования и недостатки модели.
Сравнение разработанной модели с
экспериментами позволило сделать вывод о том, что скорость связывания плазмина
лимитирует скорость всей реакции деградации фибрина плазмином, и дать численную
оценку значению константы связывания kас (0,05-1,0мкМ-1мин-1).
Однако модель являлась гомогенной, для нее принималось равномерное распределение
плазмина по сгустку, хотя сравнение проводилось с экспериментами, в которых
плазмин диффундировал в сгусток. Учет в модели конечной диффузии не должно
изменить основных выводов, сделанных из нашей работы, за исключением верхней
границы диапазона оценочных значений для kас (ее значение
увеличится). Также в модели не было учтено появление дополнительных сайтов
связывания плазмина в процессе лизиса, которые, возможно, играют значительную
роль в фибринолизе (смотри следующий пункт), и ингибирующее действие продуктов
деградации фибрина. Это является оправданным только для начальных стадий
фибринолиза. Кроме того, модель основывалась на идее послойного лизиса, хотя,
на самом деле, характер лизиса, как говорилось в п. 1.2.2, другой: он
предполагает поперечные разрезания фибрилл. Но, с учетом того, что причина
образования таких разрезов пока до конца не выяснена, модель, благодаря своей
простоте и наглядности, не теряет своей значимости.
3.2 Исследование
вопроса о причине появления поперечных разрезов фибрилл в процессе их лизиса
Как уже говорилось выше, в
существующей литературе нет удовлетворительного объяснения, почему же лизис
фибриллы происходит преимущественно ее поперечными разрезаниями, а не послойно
уменьшением ее диаметра. Встретилось только одно предположение о том, что
плазмин, благодаря наличию в его структуре нескольких фибрин-связывающих
крингл-доменов, способен проникать в фибриллу и последовательно перерезать
внутренние протофибриллы [56]. Однако экспериментального подтверждения этому
пока нет.
В данной работе было предложено
другое объяснение этому явлению. Оно заключалось в следующем. Плазмину, чтобы
произвести поперечный разрез, вовсе не обязательно проникать внутрь фибриллы.
Вполне возможно, что за это явление ответственны появляющиеся на фибрине в
процессе его лизиса С-концевые лизиновые аминокислотные остатки. Из
экспериментов известно, что плазмин помимо гидролиза основных связей,
приводящего к разрезанию фибрин-мономера, осуществляет также гидролиз некоторых
других, дополнительных, связей и образует С-концевые лизины [21], [22], [31],
[32]. С такими С-концевыми лизинами плазминоген и плазмин связываются лучше,
чем с внутренними лизинами, входящими в состав исходных сайтов связывания на
нативном фибрине. Способствуют ли С-концевые лизины появлению новых сайтов
связывания для этих белков или же они улучшают афинность исходных, считается
спорным вопросом. Каким же образом улучшение связывания плазмина может
способствовать появлению поперечных разрезов фибриллы? Предполагаемый ответ
таков: плазмин, связавшись в каком-либо месте фибриллы с «нативным» сайтом,
предварительно «обрабатывает» протофибриллу, с которой связан, и, возможно,
некоторые протофибриллы, находящиеся в его окрестности, и повышает тем самым в
той области фибриллы, сродство к ней для других молекул плазмина. В результате
чего, в том месте локально увеличивается концентрация плазмина по сравнению с
остальными «необработанными» ее участками, что, в итоге приводит к увеличению
вероятности образования разреза в той области фибриллы.
Для начальной проверки данной
гипотезы решено было использовать математическое моделирование. Были созданы
две математические модели, способные фиксировать появление поперечных разрезов
фибрилл в процессе лизиса, но в одной из них было учтено увеличение плазмина к
фибрину (модель (8), описанная в п. 2.2), а в другой нет (модель (21), п. 2.2).
Проверка гипотезы происходила путем сравнения результатов моделей.
На рис. 3-3 представлено сравнение
кинетики образования поперечных разрезов для этих двух моделей.
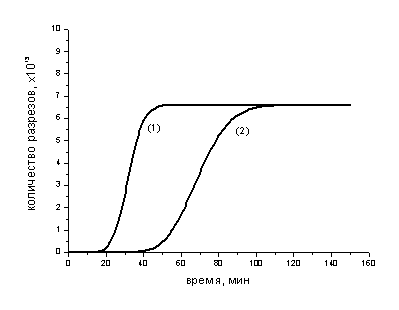
Рис. 3-3. Скорости появления
поперечных разрезов фибриллы в процессе лизиса для модели (8) (кривая 1) и для
модели (21) (кривая 2)
Видно, что в модели (8) (кривая 1)
образование разрезов происходит в два раза быстрее, чем в модели (21) (кривая
2). Однако это сравнение, тем не менее, не свидетельствует о справедливости
гипотезы, т.к. кривая (2) могла пройти так же, как и кривая (1), если бы в
модели (21) была просто увеличена афинность всех сайтов до соответствующего значения.
Более наглядным является сравнение
гистограмм моделей, характеризующее распределение участков фибриллы по толщинам
(рис. 3-4). Верхний ряд гистограмм - для модели (8) в определенные моменты
времени, а нижний - для модели (21) при тех же временах. Как описано в п.
модели строились по принципу разделения всей фибриллы на секции, а каждая
секция разделялась на классы по количеству удаленных из нее протофибрилл. Класс
0 соответствовал начальной толщине фибриллы, а класс 20 - нулевой толщине, т.е.
ее поперечному разрезу. Таким образом, в процессе лизиса все секции переходили
из класса 0 в класс 20.
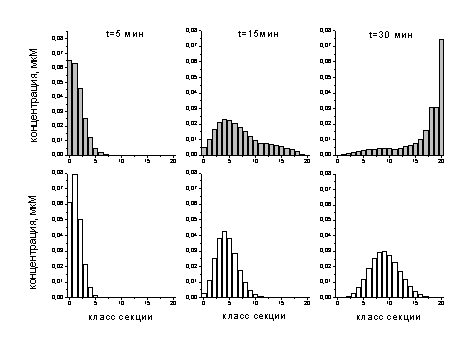
Рис. 3-4. Гистограммы распределения
участков фибриллы по толщинам. Верхний ряд - гистограммы - для модели (8),
нижний - для модели (21)
Из сравнения гистограмм для двух
моделей можно, во-первых, наблюдать тот же эффект, о котором говорилось выше -
увеличение скорости образования разрезов. А, во-вторых, что является
значительно более важным, эффект уширения спектра распределения для модели (8).
Именно это является положительным аргументом в пользу выдвинутой гипотезы.
Действительно, такое уширение спектра свидетельствует о неравномерном лизисе
фибриллы по ее длине, а именно, о более быстром лизисе в определенных участках
фибриллы по сравнению с другими. Это и показывает повышение вероятности
появления поперечных разрезов фибриллы на фоне ее послойного лизиса.
Таким образом, выдвинутая в работе
гипотеза дает повод задуматься о роли повышения сродства плазминогена и
плазмина к фибрину в процессе лизиса. Является ли это только очередной
положительной обратной связью, наряду с другими, в процессе фибринолиза? Или же
оно определяет характерные особенности самого механизма лизиса фибрина?
Используемая
литература
1. Бутенас С, Манн КГ. Свертывание крови. Обзор. Биохимия.
2002; 67:5-15.
2. Veklich Y, Francis CF, White J, Weisel JW. Structural
studies of fibrinolysis by electron microscopy. Blood. 1998:92:4721-4729.
3. Bachmann L, Schmitt-Furmian WW, Hammel R, Lederer K. Size
and shape of fibrinogen. Electron microscopy of the hydrated molecule. Macromol
Chemie. 1975; 176:2603-2618.
4. Medved L, Nieuwenhuizen W. Molecular mechanisms of
initiation of fibrinolysis by fibrin. Thromb Haemost. 2003; 89:409-19.
5. Yang Z, Kollman JM, Pandi L, Doolittle RF. Crystal Structure
of Native Chicken Fibrinogen at 2.7 A Resolution. Biochemistry. 2001; 40:12515-12523.
6. Bale MD, Jamney PA, Ferry JD. Kinetics of formation of
fibrin oligomers. II. Size distributions of ligated oligomers. Biopolymers. 1982;
21:2265-2277.
. Carr ME, Hermans J. Size and density of fibrin fibers
from turbidity. Macromolecules. 1978; 11:46-50.
. Diamond SL, Anand S. Inner clot diffusion and permeation
during fibrinolysis. Biophys J. 1993; 65:2622-43.
. Yang Z, Mochalkin I, Doolittle RF. A model of fibrin
formation based on crystal structures of fibrinogen and fibrin fragments
complexed with synthetic peptides. PNAS. 2000;
97:14156-14161.
10. Collet J, Moen JL, Veklich YI, Gorkun OV, Lord ST,
Montagolescot G, Weisel JW. The αC domains of fibrinogen affect the structure of the fibrin clot, its physical
properties and its susceptibility to fibrinolysis. Blood. 2005; 106:3824-3830.
11. Baradet TC, Haselgrove JC, Weisel JW. Three-dimensional
reconstruction of fibrin clot networks from stereoscopic intermediate voltage
electron microscope images and analysis of branching. Biophys. 1995; 68:1551-60.
. Weisel JW, Nagaswami C. Computer modeling of fibrin
polymerization kinetics correlated with electron microscope and turbidity
observations: clot structure and assembly are kinetically controlled. Biophys
J. 1992; 63:111-128.
13. Blomback B. Fibrinogen and fibrin - proteins with complex
roles in hemostasis and thrombosis. Thromb Res. 1996; 83:1-75.
. Doolittle RF. Fibrinogen and fibrin. Ann Rev Biochem. 1984; 53:195-229.
. Weisel JW. Fibrinogen and fibrin. Adv Prot Chem. 2005;
70:247-299.
. Weisel JW, Nagaswami C, Korholm B, Petersen LC, Suenson
E. Interaction of plasminogen with polymerizing fibrin and its derivatives,
monitored with a photoaffinity cross-linker and electron microscopy. J Mol Biol.
1994; 235:1117-1135.
. Marcus G, Priore RL, Wissler FC. The binding of
tranexamic acid to native (glu) and modified (lys) human plasminogen and
itseffect on conformation. J Biol Chem. 1979; 254:1211-1216.
. Lucas MA, Fretto LJ, McKee PA. The binding of human
plasminogen to fibrin and fibrinogen. J Biol Chem. 1983; 258:4249-4256Mangel
WF, Lin B, Ramakrishnan V. Characterization of an extremely large,
ligand-indused conformational change of plasminogen. Science. 1990; 248:69-73.
. Hoylaerts M, Rijken DC, Lijnen HR, Collen D. Kinetics of
the activation of plasminogen by human tissue plasminogen activator: role of
fibrin. J Biol Chem. 1982; 257:2912-2929.
21. Fleury V, Angles-Cano E. Characterization of the binding of
plasminogen to fibrin surfaces: the role of carboxy-terminal lysines.
Biochemistry. 1991; 30:7630-7638.
22. Suenson E, Lutzen O, Thorsen S. Initial
plasmin-degradation of fibrin as the basis of a positive feed-back mechanism in
fibrinolysis. Eur J Biochem. 1984; 140:513-522.
. Wiman B, Boman L, Collen D. On the Kinetics of the
Reaction between Human Antiplasmin and a Low-Molecular-Weight Form of Plasmin.
Eur J Biochem. 1978; 87:143-146.
. Miles LA, Dahlberg CM, Plow EF. The cell-binding domains
of plasminogen and their function in plasma. J Biol Chem. 1988; 263:11928-11934.
. Suenson E, Thorsen S. Secondary-site binding of
Glu-Plasmin, Lys-Plasmin and miniplasmin to fibrin. Biochem J.1981; 197:619-628.
. Mangel WF, Lin B, Ramakrishnan V. Characterization of an
extremely large, ligand-induced conformational change in plasminogen. Science.
1990; 248:69-73.
. Henschen A. On the structure of functional sites in
fibrinogen. Thromb Res. 1983; Suppl V: 27-39.
. Francis CW, Marder VJ, Barlow GH. Plasmic degradation of
crosslinked fibrin. Characterization of new macromolecular soluble complexes
and a model of their structure. J Clin Invest. 1980; 66:1033-1043.
. Gaffney PJ. Fibrin degradation products. A review of
structures found in vitro and vivo. Ann of NY Acad Sci. 2001; 936:594-610.
. Walker JB, Nesheim ME. The molecular weights, mass
distribution, chain composition, and structure of soluble fibrin degradation
products released from a fibrin clot perfused with plasmin. J Biol Chem. 1999;
274:5201-5212.
. Bok RA, Mangel WF. Quantitative characterization of the
binding of plasminogen to intact fibrin clots, lysine-sepharose, and fibrin
cleaved by plasmin. Biochemistry. 1985; 24:3279-3286.
. Tran-Thang C, Kruithof E, Atkinson J, Bachmann F.
High-affinity binding sites for human Glu-plasminogen unveiled by limited
plasmic degradation of human fibrin. Eur J Biochem. 1986; 160:599-604.
. Robbie LA, Bennett B, Croll AM, Brown PA, Booth NA.
Proteins of the fibrinolytic system in human thrombi. Thromb Haemost. 1996; 75:127-133.
. van Zonneveld AJ, Veerman H, Pannekoek H. On the
interaction of the finger and the kringle-2 domain of tissue-type plasminogen
activator with fibrin. Inhibition of kringle-2 binding to fibrin by
epsilon-amino caproic acid. J Biol Chem. 1986; 261:14214-14218.
. Madison EL, Goldsmith EJ, Gerard RD, Gething MJ, Sambrook
JF, Bassel-Duby RS. Amino acid residues that affect interaction of tissue-type
plasminogen activator with plasminogen activator inhibitor 1. Proc Natl Acad
Sci. 1990; 87:3530-3533.
. Ranby M. Studies on the kinetics of plasminogen
activation by tissue plasminogen activator. Biochim Biophys Acta. 1982;
704:461-469.
. Boose JA, Kuismanen E, Gerard R, Sambrook J, Gething MJ.
The single-chain form of tissue-type plasminogen activator has catalytic
activity: studies with a mutant enzyme that lacks the cleavage site.
Biochemistry. 1989; 28:635-643.
. Tate KM, Higgins DL, Holmes WE, Winkler ME, Heyneker HL,
Vehar GA. Functional role of proteolytic cleavage at arginine-275 of human
tissue plasminogen activator as assessed by site-directed mutagenesis.
Biochemistry. 1987; 26:338-343.
. Darras V, Thienpont M, Stump DC, Collen D. Measurement of
urokinase-type plasminogen activator (u-PA) with an enzyme-linked immunosorbent
assay (ELISA) based on three murine monoclonal antibodies. Thromb Haemost.
1986; 56:411-414.
. Ellis V, Scully MF, Kakkar VV. Plasminogen activation by
single-chain urokinase in functional isolation. A kinetic study. J Biol Chem. 1987; 262:14998-15003.
. Lijnen HR, Van Hoef B, De Cock F, Collen D. The mechanism
of plasminogen activation and fibrin dissolution by single chain urokinase-type
plasminogen activator in a plasma milieu in vitro. Blood. 1989; 73:1864-1872.
. Gurewich V, Pannell R, Louie S, Kelley P, Suddith RL,
Greenlee R. Effective and fibrin-specific clot lysis by a zymogen precursor
form of urokinase (pro-urokinase). A study in vitro and in two animal species.
J Clin Invest. 1984; 73:1731-1739.
. Andreasen PA, Nielsen LS, Kristensen P, Grondahl-Hansen
J, Skriver L, Dano K. Plasminogen activator inhibitor from human fibrosarcoma
cell binds urokinase-type plasminogen activator, but not its proenzyme. J Biol
Chem. 1986; 261:7644-7651.
. Wiman B, Collen D. On the kinetics of the reaction
between human antiplasmin and a low-molecular-weight form of plasmin. Eur J
Biochem. 1978; 87:143-146.
. Kolev K, Lerant I, Tenekejiev K, Machovich R. Regulation
of fibrinolytic activity of neutrophil leukocyte elastase, plasmin and
miniplasmin by plasma protease inhibitors. J Biol Chem. 1994; 269:17030-17034.
. Aoki N, Moroi M, Tachiya K. Effect of alpha-2-plasmin
inhibitor on fibrin clot lysis. Its comparison with alpha-2-macroglobulin.
Thromb Haemost. 1978; 39:22-31.
. Booth NA, Simpson AJ, Croll A, Bennett B, MacGregor IR.
Plasminogen activator inhibitor (PAI-1) in plasma and platelets. Br J Haematol. 1988; 70:327-333.
. Fay WP, Eitzman DT, Shapiro AD, Madison EL, Ginsburg D.
Platelets inhibit fibrinolysis in vitro by both plasminogen activator
inhibitor-1-dependent and - independent mechanisms. Blood. 1994; 83:351-356.
. Stromqvist M, Schatteman K, Leurs J, Verkerk R, Andersson
JO, Johansson T, Scarpe S, Hendriks D. Immunological assay for the
determination of procarboxypeptidase U antigen levels in human plasma. Thromb Haemost. 2001; 85:12-17.
. Bajzar L, Morser J, Nesheim M. TAFI, or plasma
procarboxypeptidase B, couples the coagulation and fibrinolytic cascades
through the thrombin-thrombomodulin complex. J Biol Chem. 1996; 271:16603-16608.
. Boffa MB, Wang W, Bajzar L. Nesheim M.E. Plasma and
recombinant thrombin-activable fibrinolysis inhibitor (TAFI) and activated TAFI
compared with respect to glycosylation, thrombin/thrombomodulin-dependent
activation, thermal stability and enzymatic properties. J Biol Chem. 1998;
273:2127-2135.
. Eaton DL, Malloy BE, Tsai SP, Henzel W, Drayna D.
Isolation, molecular cloning, and partial characterization of a novel
carboxipeptidase B from human plasma. J Biol Chem. 1991; 269:21833-21838.
. Mao SS, Cooper CM, Wood T, Shafer JA, Gardell SJ.
Characterization of plasmin-mediated activation of plasma procarboxypeptidase
B. J Biol Chem. 1999; 274:35046-35052.
. Wang W, Boffa MB, Bajzar L, Walker JB, Nesheim ME. A
study of the mechanism of inhibition of fibrinolysis by activated
thrombin-activable fibrinolysis inhibitor. J Biol Chem. 1998; 273:27176-27181.
. Gabriel DA, Muga K, Boothroyd EM. The effect of fibrin
structure on fibrinolysis. J Biol Chem. 1992; 267:24259-24263.
. Weisel JW, Veklich Y, Collet JP, Francis CW. Structural
studies of fibrinolysis by electron and light microscopy. Thromb Haemost.1999;
82:277-282.
57. Житкова ЮВ, Айсина РБ, Варфоломеев СД. Кинетика лизиса
фибрина плазмином: ингибирование продуктами деградации. Биоорг хим. 1996; 22:911-915.
58. Collet JP, Park D, Lesty C, Soria J, Soria C, Montalescot
G, Weisel JW. Influence of fibrin network conformation and fibrin fiber
diameter on fibrinolysis speed. Dynamic and structural approaches by confocal
microscopy. Arterioscler Thromb Vasc Biol. 2000; 20:1354-1361.
. Meh DA, Mosesson MW, DiOrio JP, Siebenlist KR, Hernandez
I, Amrani DL, Stojanovich L. Disintegration and reorganization of fibrin
network during tissue-type plasminogen activator-induced clot lysis. Blood
Coagul Fibrinolysis. 2001; 12:627-637.
. Blinc A, Magdic J, Fric J, Musevic I. Atomic force
microscopy of fibrin networks and plasma clots during fibrinolysis.
Fibrinolysis and Proteolysis. 2000; 14:288-299.
. Collet JP, Lesty C, Montalescot G, Weisel JW. Dynamic
changes of fibrin architecture during fibrin formation and intrinsic
fibrinolysis of fibrin-rich clots. J Biol Chem. 2003; 278:21331-21335.
. Sobel BE, Gross RW, Robinson AK. Thrombolysis, clot
selectivity, and kinetics. Circulation. 1984; 70:160-164.
. Tiefenbrunn AJ, Graor RA, Robison AK, Lucas FV, Hotchkiss
A, Sobel BE. Pharmacodynamics of tissue-type plasminogen activator
characterized by computer-assisted simulation. Circulation. 1986; 73:1291-1299.
. Anand S, Diamond SL. Computer simulation of systemic
circulation and clot lysis dynamics during thrombolytic therapy that accounts
for inner clot transport and reaction. Circulation. 1996; 94:763-774.
. Anand S, Wu J, Diamond SL. Enzyme-mediated proteolysis of
fibrous biopolymers: dissolution front movement in fibrin or collagen under
conditions of diffusive or convective transport. Biotech and Bioeng 1995;
48:89-107.
. Zidansek A, Blinc A, Lahajnar G, Keber D, Blinc R.
Finger-like lysing patterns of blood clots. Biophys J. 1995; 69:803-809.
. Kolev K, Tenekedjiev K, Komorowicz E, Machovich R. Functional
evaluation of the structural features of proteases and their substrate in
fibrin surface degradation. J Biol Chem. 1997; 272:13666-13675.
. Pleydell CP, David T, Smye SW, Berridge DC. A
mathematical model of post-canalization thrombolysis. Phys Med Biol. 2002;
47:209-224.
. Anand M, Rajagopal K, Rajagopal KR. A model incorporating
some of the mechanical and biochemical factors underlying clot formation and
dissolution in flowing blood. J Theoret Med. 2003; 5:183-218.
. Anand M, Rajagopal K, Rajagopal KR. A model for the
formation and lysis of blood clots. Pathophysiol Haemost Thromb. 2005;
34:109-120.
71. Голомысов ИС. Моделирование индуцированного урокиназой
лизиса фибринового сгустка in vitro. Дипломная работа. 2000. МГУ им. М.В. Ломоносова. Физический
факультет, кафедра биофизики.
72. Lottenberg R, Christensen U, Jackson CM, Coleman PL. Assay
of coagulation proteases using peptide chromogenic and fluorogenic substrates.
Methods Enzymol. 1981; 80:341-361.
. Thorsen S, Mullertz S, Suenson E, Kok P. Sequence of
formation of molecular forms of plasminogen and plasmin-inhibitor complexes in
plasma activated by urokinase or tissue-type plasminogen activator. Biochem J. 1984; 223:179-187.