Исследование термических свойств трис-2,2,6,6-тертаметил-4-фторгептан-3,5-дионата скандия (III) методом дифференциальной сканирующей калориметрии
Содержание
Введение
1. Литературный обзор
1.1 Фазовые равновесия и фазовые переходы
1.2 Калориметрические методы исследования
2. Экспериментальная часть
2.1 Определение температуры Тпл и энтальпии плавления ΔплН Sc (tfhd) 3
2.2 Математическая обработка полученных данных
Выводы
Библиографический список
Приложения
Введение
В курсовой работе были получены термодинамические
характеристики плавления трис-2,2,6,6-тетраметил-4-фторгептан-3,5-дионат
скандия. Это вещество используется для получения оксида скандия, имеющего
широкое применение в электрофизике:
. Пленки оксида скандия обладают высокой механической
прочностью, хорошей адгезией к поверхности кремния и кварца и не царапаются
стальной иглой;
2. Исследования оптических свойств оксида скандия
показало перспективность использования пленок оксидов гольмия и скандия в
качестве просветляющих покрытий кремниевых фотоэлектрических преобразователей
[1];
. Оксид скандия используется в качестве примеси в
оксид циркония, что позволяет увеличить прочность данного материала и уменьшить
температуру плавления для использования оксида циркония в производстве
твердооксидных топливных элементов [2];
4. В структурах металл-диэлектрик-полупроводник
диэлектрические пленки из ОРЗЭ характеризуются высокой химической и термической
стойкостью, большими значениями диэлектрической проницаемости (ε = 8-20) и удельного сопротивления.
Одним из способов получения функциональных покрытий на основе
металлов и оксидов металлов, в частности, скандия и оксида скандия, является
метод химического осаждения из газовой фазы (английская аббревиатура - CVD). Суть метода
заключается в том, что соединение, обладающее значительным давлением пара при
определённой температуре, переводится в газовую фазу, а затем подвергается
термическому распаду на нагретой подложке. Перед применением тщательно
изучаются химические и физические свойства исходного соединения. Безусловно,
особое внимание уделяется изучению термических свойств вещества: летучести,
температурам и теплотам фазовых переходов, теплоёмкостям, поскольку они
являются необходимой основой для данного метода, сочетающего в себе различные
термодинамические процессы. Одними из наиболее распространённых соединений,
используемых в методе химического осаждения из газовой фазы, являются β-дикетонаты металлов - комплексные соединения металлов и β-дикетонов.
Эти соединения получили широкое применение для получения
оксидов металлов из-за несложного синтеза с хорошим выходом, термическая
стабильность, т.е. не разлагаются при сублимации. Следует отметить, что β-дикетонаты металлов не токсичны и могут долго храниться.
термическое свойство оксид скандий
1.
Литературный обзор
1.1 Фазовые
равновесия и фазовые переходы
Характерной особенностью гетерофазных систем является
существенная ограниченность вариантности системы - числа независимых
термодинамических переменных, которые можно независимо изменять, сохраняя
фазовый состав системы Φ. Это обусловлено
наличием жёсткой взаимосвязи величин химических потенциалов веществ и фаз,
находящихся в термодинамическом равновесии, поэтому равновесия фаз нельзя
достичь при произвольных температуре и давлении, а только при строго
определённых. При изменении температуры и (или) давления возможно изменения
фазового состояния вещества - происходит фазовый переход. Различают фазовые переходы
первого и второго рода.
Фазовые переходы первого рода, как правило, сопровождаются
термическими эффектами - выделением или поглощением теплоты. Изменение
термодинамических потенциалов, в первую очередь, энергии Гиббса ΔG в момент равновесного фазового перехода равно нулю, поэтому ΔфпG (p,T)
(в дальнейшем будем обозначать индексом ФП величины, относящиеся
непосредственно к фазовому переходу) является непрерывной функцией от p и T при фазовых
превращениях. Тем не менее, при непрерывном изменении температуры и давления
величины, выражаемые первыми производными потенциала Гиббса по давлению,
температуре и другим внешним параметрам (то есть молярный объём, энтропия и
т.д.), изменяются при фазовом переходе первого рода скачкообразно:
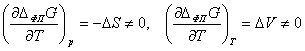 .
.
Вторые производные потенциала Гиббса по температуре и давлению в
точке фазового перехода стремятся к бесконечности. К фазовым переходам первого
рода относятся процессы испарения, конденсации, кипения, плавления, возгонки,
кристаллизации (затвердевания), изменения кристаллической модификации.
Фазовые переходы второго рода не сопровождаются выделением или
поглощением теплоты, а первые производные потенциала Гиббса в точке фазового
перехода ΔфпG по p и T непрерывны и не испытывают скачков. Соответственно,
энтропия и молярный объём являются непрерывными функциями от давления и
температуры. При этом возможно скачкообразное изменение вторых производных
энергии Гиббса (теплоёмкости, коэффициентов термического расширения и
изотермической сжимаемости):
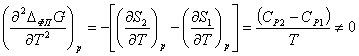 ,
,
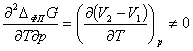 ,
, 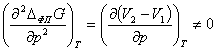 .
.
К фазовым переходам второго рода относят переходы с изменением
магнитных, диэлектрических свойств, электронного, спинового состояния, разупорядочение-упорядочение,
переход через критическую точку.
Рассмотрим однокомпонентную систему, в которой отсутствуют
химические превращения. Применяя правило фаз Гиббса к этой системе (Nf = K-Φ+2 ≥
0), находим, что в однокомпонентной системе не может одновременно
сосуществовать более трех фаз. В системе соблюдается постоянство состава,
поэтому химический потенциал совпадает с мольной энергией Гиббса. Таким
образом, при постоянном давлении и постоянной температуре условием фазового
равновесия в однокомпонентной системе является равенство мольных энергий Гиббса
компонентов в сосуществующих фазах.
При переходе из одного состояния равновесия (p, T) в другое (p + dp, T + dT) выполняется
равенство:
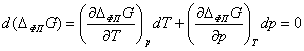 .
.
ΔфпG = 0, поэтому ΔфпH = TΔфпS.
Следовательно, для фазового перехода выполняется соотношение
Клапейрона - Клаузиуса, которое определяет возможность сосуществования
однокомпонентных фаз при изменении температуры либо давления, а также при
фазовых превращениях (жидкость - пар и твёрдая фаза - пар):
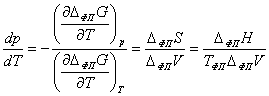 .
.
При небольших значениях давления для такого равновесия справедливо
приближение:
 ,
,
тогда уравнение Клапейрона-Клаузиуса можно переписать в виде:
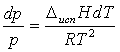 для жидкости или
для жидкости или
 для твёрдого тела.
для твёрдого тела.
Проинтегрируем уравнение в области температур, где можно
пренебречь зависимостью ΔфпH от температуры и получим зависимость:
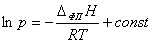 .
.
То есть, если известно давление насыщенных паров p0 при T0, то можно
найти давление при другой температуре:
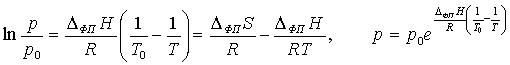 .
.
Поскольку это уравнение зависимости p от T на линии равновесия фаз, по нему можно
рассчитать энтальпии испарения или сублимации, исходя из значений давления пара
при двух разных температурах T и T0. Зависимость давления насыщенного пара от температуры в
координатах (ln p, 1/T) представляет собой прямую линию, из
наклона которой можно определить Δисп. Н либо Δсубл. Н [3].
1.2
Калориметрические методы исследования
Калориметрические методы - группа методов, которые применяются
для измерения теплоёмкости, энтальпии, теплот и температур фазовых переходов,
теплот сорбции и растворения и других исследовательских задач. Следует отметить
большое разнообразие этих методов, вызванное несколькими причинами: во-первых,
различные методы используются для различных задач (получения определённых
данных и проведения конкретных измерений), во-вторых, порядок измерения
изменения теплоты (ΔQ) и температуры (ΔT) - адиабатическая калориметрия, калориметрия теплового потока и
компенсации теплового потока, в-третьих, характер изменения температуры в
эксперименте - сканирующая либо изотермическая калориметрия [4,5].
При выполнении данной работы использовался метод
дифференциальной сканирующей калориметрии (ДСК) теплового потока, или, иначе,
калориметрия Тиана-Кальве.
При нагревании контейнера с веществом с постоянной скоростью
температура образца не вполне соответствует температуре окружения. Она
несколько ниже, но тоже меняется с постоянной скоростью. Примерно постоянное
отличие в температурах между образцом и окружением обеспечивает постоянный
поток тепла к образцу. Поглощая тепло, образец массы m и теплоемкости c нагревается:
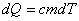 .
.
Продифференцировав уравнение по времени, получаем выражение для
теплового потока:
 .
.
Теплота, расходуемая на нагревание контейнера с веществом,
измеряется через электродвижущую силу (ЭДС) термопары:
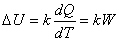 ,
,
где k - коэффициент, зависящий от температуры -
чувствительность калориметра ([k] = 1 В/Вт).
Значение этого коэффициента определяется посредством калибровки, поэтому, если
известна чувствительность калориметра k, то
теплоемкость вещества можно определить при нагревании с постоянной скоростью,
измеряя ЭДС на термопаре ΔU:
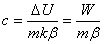 ,
,
где β - скорость нагревания: 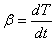 .
.
Таким образом, в калориметре теплового потока формируется градиент
температуры, обеспечивающий поток тепла. Разность температур измеряется с
помощью блока термопар, по этой разности с учетом температурной зависимости
коэффициента калибровки рассчитывается поглощаемое образцом тепло. Основными
отличиями ДСК теплового потока (и ДСК компенсации теплового потока) от других
видов калориметрии являются: отсутствие процедуры установления теплового
равновесия до и после нагревания образца, отсутствие необходимости остановки
нагревания и интегрирования теплового потока, а также измерение теплоёмкости
непрерывным образом, а не отдельными шагами. Для расчёта теплоёмкости
оказывается достаточным воспользоваться мгновенным значением теплового потока W, точность измерения которого обеспечивается процедурой
измерения нулевой линии ЭДС U0. Время
эксперимента сокращается, процесс измерения становится более технологичным, что
представляет собой очевидное достоинство и выгодное отличие данного метода [4].
Для определения теплоты и температуры плавления фазового перехода
использовался дифференциальный сканирующий калориметр теплового потока.
Основной частью калориметра является небольшой термостатированный блок (рис.1)
с регулируемой температурой 1, расположенный во внешней камере, в которой
поддерживается температура окружающей среды 2. Две тонких жаропрочных трубки 3
проходят насквозь через камеру и блок, расположение трубок в блоке полностью
симметрично, а их средняя часть служит экспериментальной камерой. Эта средняя
зона охватывается калориметрическим флюксметром 4 с термопарами, которые
соединяют ее термически с термостатированным блоком 1. Указанный принцип
измерения успешно используется на протяжении многих лет в калориметрах
Тиан-Кальве: термостатированный блок устанавливает в образце нужную температуру;
флюксметр измеряет теплообмен между образцом и блоком. Концы трубок служат для
ввода и извлечения образцов, они также соединены с трубками атмосферного
контроля. Быстрое охлаждение блока может достигаться за счет принудительной
циркуляции газа 5 (гелия, аргона). Охлаждение ниже температуры окружающей среды
обеспечивается применением жидкого азота.
Блок с образцами подключен к управляющему блоку, представляющему
собой комплекс различных электронных устройств измерения и контроля. С помощью
управляющего блока задаются температура, скорость нагрева и другие
характеристики процесса измерения. Высокоэффективный электронный
программируемый регулятор контролирует температуру. Цифровое устройство
обрабатывает поступающую информацию. Полученные данные в виде температурных
кривых выводятся для обработки либо передачей в компьютер (рабочую станцию)
посредством соответствующего программного обеспечения, либо нанесением на
специальную калиброванную бумагу при помощи самописца. Затем полученную
информацию обрабатывают и получают необходимые данные на основе
экспериментально определённых.
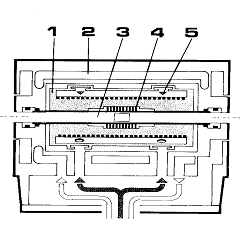
Рис. 1. Схема рабочего блока калориметра.
2.
Экспериментальная часть
2.1
Определение температуры Тпл и энтальпии плавления ΔплН Sc (tfhd) 3
Измерения проводились при помощи дифференциального
сканирующего калориметра теплового потока Setaram 111. Ошибка измерения,
полученная из калибровки по In, составила менее 1%.
Первоначально подготовили для измерений ампулу с веществом. В
предварительно взвешенную ампулу (с точность ± 0,0001 г) поместили необходимое
количество предварительно измельчённого образца (в нашем эксперименте масса
навески составляла не больше 0.02г. (≈ 4∙10-5 моль)); во всех
экспериментах старались подбирать одинаковое количество вещества для достижения
более точных и сходящихся результатов. Ампула была запаяна под вакуумом,
взвешена на аналитических весах с точностью 0,001 г. Масса вещества
определялась как разница масс пустой ампулы и её частей, получившихся после
запаивания ампулы с веществом.
Чистую сухую пустую ампулу взвешивали на аналитических весах
(точность ± 0,0001 г), массу ампулы определяли как среднее арифметическое
результатов четырёх независимых взвешиваний.
После этого ампулу с исследуемым веществом поместили в
рабочую зону измерительного блока (рис.1), такую же пустую ампулу поместили в
зону сравнения. На блоке управления выставили начальную температуру 130°С (403
К), установили чувствительность калориметра, равную 1. Включили режим нагревания
печи (1° в минуту) и регистрирующее устройство − самописец. Получили пик,
площадь которого пропорциональна количеству тепла, поглощённого при фазовом
переходе твердое вещество-жидкость. После нагревания и получения данных
производится калибровка по току. Для проведения этого процесса обе ампулы
извлекаются и заменяются специальными блоками, представляющим собой резистор с
известным сопротивлением. Калибровку проводили в тех же условиях, что и
эксперимент (чувствительность калориметра k = 1В/Вт, начальная
температура T0
= 130 C,
скорость нагрева β = мин-1). Вблизи
температуры плавления подали электрический ток, в результате чего на блоке
выделилось количество теплоты, равное 0,2 Дж. Таким образом, получен пик,
площадь которого соответствует количеству выделенного нагревателем тепла (0,2
Дж).
2.2
Математическая обработка полученных данных
Отсканировали полученные пики, с помощью специальной
программы (Grafula 3) (см. рис.2) посчитали их площадь. Ввиду того, что площадь пика
пропорциональна теплоте, можно рассчитать отношение теплот из отношения
площадей.
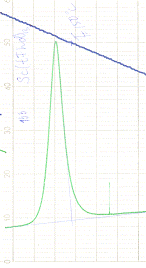
Рис.2. Кривая ДСК для процесса плавления Sc (tfhd) 3.
Отсюда определили мольную энтальпию плавления с помощью
выражения:
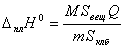 ,
,
где M - молярная масса вещества (648,739
г/моль), m - масса навески, Sвещ - площадь пика, полученного при измерении энтальпии плавления
вещества, Sклб - площадь пика, полученного при
проведении калибровки по нагревательному блоку, Q - теплота, соответствующая этому пику (0,2 Дж).
Температура плавления определяется перпендикуляром, опущенным на
прямую градиента температуры из точки пересечения базовой линии и касательной к
ветви кривой, соответствующей началу плавления.
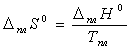
Всего было проведено 6 экспериментов с различными навесками,
результаты приведены в таблице:
|
m, г
|
Tпл., ºC
|
Tпл., K
|
ΔплHºTпл, кДж*моль-1
|
ΔплSºTпл, Дж*моль-1*K-1
|
|
0,0087
|
149,7
|
422,7
|
20,40
|
48,27
|
|
0,0118
|
150,0
|
423,0
|
21,47
|
50,75
|
|
0,0163
|
150,0
|
423,0
|
21,90
|
51,76
|
|
0,0114
|
150,0
|
423,0
|
21,04
|
49,74
|
|
0,0112
|
149,5
|
422,5
|
22,38
|
52,97
|
|
0,0113
|
149,7
|
422,7
|
22,45
|
53,10
|
После обработки данных методом наименьших квадратов получили
следующие результаты:
M = 648,739 г/моль
Tпл = (149,8±0,2) ºC
ΔплHºTпл = (21,60±1,29) кДж*моль-1
ΔплSºTпл = 21600/422.8 = (51,09±1,31) Дж*моль-1*K-1
Результаты ДСК измерений соединений Sc с различными
заместителями, полученные ранее:
1) Sc (dpm) 3
М = 594.766 г/мольпл = (152,4±0,6) ºC
ΔплHºTпл = (26,7±0,3) кДж*моль-1
ΔплSºTпл = (62,8 ±0,8) Дж*моль-1*K-1
2) Sc (tfa) 3
М = 504,163 г/мольпл = (106,5±1,0) ºC
ΔплHºTпл = (30,1±1,0) кДж*моль-1
ΔплSºTпл = (79,3±1,1) Дж*моль-1*K-1
3) Sc (pta) 3
М = 629,960 г/моль
Tпл = (58,6±0,8) ºC
ΔплHºTпл = (25,4±1,2) кДж*моль-1
ΔплSºTпл = (76,6±1,4) Дж*моль-1*K-1
Выводы
Проведены измерения термодинамических величин соединения Sc (tfhd) 3
(трис-2,2,6,6-тертаметил-4-фторгептан-3,5-дионат скандия (III)) методом
дифференциальной сканирующей калориметрии. На основе экспериментальных данных
рассчитаны величины энтальпии и энтропии плавления исследуемого вещества, и их
доверительные области, измерена температура плавления соединения.
Сравнение термодинамических величин соединений Sc с разными заместителями
показывает, что большое значение играет химический состав заместителей,
молярная масса вещества, его геометрическое расположение в пространстве.
Библиографический
список
1. В.А.
Рожков, М.А. Родионов, А.М. Гурьянов, А.В. Пашин // Вестник СамГУ -
Естественнонаучная серия. 2005, №2 (36), с. 200-206
2. А.А.
Ремпель, В.В. Иванов, А.С. Липилин, А.В. Никонов // Свойства твердого
электролита на основе ZrO2 стабилизированного Y2O3 и Sc2O3 полученного с
применением нанотехнологии Магнитно-Импульсного Прессования (МИП) слабо агрегирующих
нанопорошков.
. В.Н.
Пармон. Лекции по химической термодинамике. Новосибирск, 2004 г, с.69-90.
. В.А.
Дребущак, Г.Ю. Шведенков. Термический анализ. Новосибирск, 2003г.
. Л.Н.
Зеленина, А.А. Хасин. Практикум по физической химии. Фазовые равновесия. Часть
вторая. Термический анализ. Новосибирск, 2005 г.
Приложения
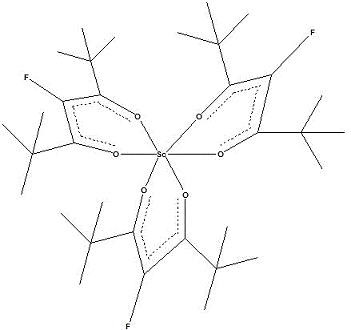
Структура Sc (tfhd) 3