|
Количество
подаваемого воздуха, м3/(м3*мин)
|
Частота
вращения мешалки, мин-1
|
|
0
|
500
|
800
|
1000
|
2000
|
|
0,35
|
1,3
|
4,0
|
7,5
|
14,5
|
15,1
|
|
0,65
|
3,5
|
7,3
|
12,1
|
19,1
|
22,1
|
|
1,00
|
6,0
|
10,0
|
15,0
|
23,0
|
24,0
|
|
1,30
|
7,5
|
13,9
|
18,0
|
26,0
|
28,0
|
|
1,60
|
11,0
|
15,5
|
20,0
|
27,0
|
29,0
|
1.2.2
Анаэробное культивирование
Анаэробные процессы биологического окисления у
гетеротрофных микроорганизмов в зависимости от того, что является конечным
акцептором водородных атомов или электронов, делят на три группы: дыхание
(акцептор - кислород); брожение (акцептор - органическое вещество) и анаэробное
дыхание (акцептор - неорганическое вещество: нитраты, сульфаты и др.).
У облигатных анаэробов брожение является
единственно возможным способом получения энергии; у факультативных анаэробов
оно составляет обязательную первую стадию катаболизма глюкозы, за которой может
следовать аэробное окисление образовавшихся продуктов, если в среде
присутствует кислород.
Обособленной промежуточной группой являются
аэротолерантные микроорганизмы, получающие необходимую для жизнедеятельности
энергию в анаэробном процессе, т. е. на уровне субстратного фосфорилирования, и
одновременно имеющие дыхательную цепь для поглощения кислорода среды и создания
благоприятных анаэробных условий. Данный эффект носит название «эффекта
дыхательной защиты».
Примерами облигатно анаэробных процессов
являются маслянокислое и метановое брожения. Универсальным для всех
микроорганизмов, за небольшими исключениями, является катаболизм глюкозы -
гликолиз до образования пирувата. Механизм гликолиза отражен в уравнении (1).
Глюкоза + 2АТР + 2 NAD = 2 Пируват + 4АТР +
2NADH + 2Н+ (1)
Возбудители спиртового брожения (дрожжи) после
декарбоксилирования пирувата и образования ацетальдегида восстанавливают
ацетальдегид до этанола. Молочнокислые бактерии гомогенного молочнокислого
брожения восстанавливают пируват до молочной кислоты. Гетероферментативные
молочнокислые бактерии сбраживают глюкозу по несколько отличающемуся
пентозофосфатному пути с образованием молочной кислоты, а также уксусной
кислоты, этанола и диоксида углерода.
Выращивание анаэробов гораздо сложнее, чем
аэробных микроорганизмов, так как соприкосновение клеток анаэробов с кислородом
воздуха должно быть сведено к минимуму или даже полностью исключено. Для этого
используют различные приемы, нередко, комбинируя их, друг с другом.
Выращивание в высоком слое среды. Это наиболее
простой способ ограничения доступа воздуха к клеткам. Жидкую среду заливают в
ферментеры высоким слоем, а посевной материал вносят на дно аппарата.
Культивирование в вязких средах. Диффузия
кислорода в жидкость уменьшается с увеличением ее вязкости. Поэтому в средах с
картофельным или кукурузным крахмалом хорошо развиваются некоторые облигатные
анаэробы, например, возбудители маслянокислого и ацетобутилового брожения.
Помимо этого анаэробные условия на производстве
создают герметизацией аппаратуры, продуванием среды инертными газами, в том
числе газообразными продуктами, образовавшимися во время ферментации.
Отсутствие необходимости аэрации среды несколько упрощает при анаэробной
ферментации конструкцию ферментера (биореактора) и облегчает управление
процессом [19].
1.3 Конструкции
ферментеров
При ферментационной технологии можно
использовать цельные живые клетки (микробов, клетки животных и растений) или
какие-нибудь клеточные компоненты (например, ферменты) с целью физических или
химических преобразований органических веществ. Однако недостаточно получать
требуемые изменения веществ, метод должен иметь преимущества перед другими,
применяемыми в настоящее время, технологиями производства этих же самых
продуктов. Преимущества производства органических продуктов биотехнологическими
способами перед чисто химическими методами достаточно многогранны:
)многие сложные органические молекулы, такие, как
белки и антибиотики, не могут практически быть синтезированы химическими
способами;
)биоконверсия обеспечивает значительно больший
выход целевого продукта;
)биологические системы функционируют при более
низких температурах, менее высоких значениях рН (близких к нейтральному) и т.
п.;
)каталитические биологические реакции намного
специфичнее, чем реакции химического катализа;
)биологические процессы обеспечивают почти
исключительно продукцию чистых изомеров одного типа, а не их смесей, как это
часто бывает в реакциях химического синтеза.
Но вместе с тем биологические способы в
сравнении с химическими методами обладают рядом явных недостатков:
)биологические системы могут легко быть
загрязнены посторонней нежелательной микрофлорой.
)целевой продукт, синтезируемый биологическим
способом, присутствует в довольно сложной смеси, что обусловливает
необходимость разделения его от примеси ненужных веществ.
)биотехнологические производства требуют больших
количеств воды, которую в итоге необходимо удалять, сбрасывая в окружающую
среду.
)биопроцессы обычно идут медленнее в сравнении
со стандартными
химическими процессами.
Ферментеры обычно представляют собой
герметические цилиндрические емкости, высота которых в 2-2,5 раза превышает
диаметр. Чаще всего их изготовляют из нержавеющей стали. Для поддержания
температуры в аппарате имеется двойной кожух или теплообменник типа змеевика.
Главное требование к аппаратам - сохранение
стерильности, поэтому они должны быть герметичными, все линии трубопроводов
должны быть доступны для обработки горячим паром. Рабочий объем ферментера
обычно не превышает 7/10 общего объема.
Тип ферментера для каждого биотехнологического
процесса выбирают с учетом специфики продуцента, свойств среды и экономических
соображений. Важное значение для аэробного процесса имеет система аэрации. При
этом оценивают, с одной стороны, скорости поступления кислорода с жидкостью и
его массопередачи от газовой фазы, с другой - скорости потребления кислорода
микроорганизмами и его удаления с отработавшей жидкостью. Скорость перехода
кислорода из газовой фазы в жидкую выражают через объемную скорость абсорбции.
Изменение концентрации кислорода в жидкой фазе характеризуется уравнением (2).
/dt = KLa (Cp - С), (2)
где KLa - объемный коэффициент массопередачи на
границе газ-жидкость; Сp - равновесная концентрация кислорода в среде; С -
фактическая мгновенная концентрация кислорода в среде.
Для каждого биотехнологического процесса должна
быть разработана
подходящая схема, а сам процесс должен постоянно
наблюдаться и тщательно контролироваться. Для большинства практических
биотехнологических процессов такими системами являются ферментеры или
биореакторы, которые обеспечивают необходимые физические условия,
способствующие наилучшему взаимодействию катализатора со средой и поставляемым
материалом. Биореакторы варьируют от простых сосудов до весьма сложных систем с
различным уровнем компьютерного оснащения.
Биореакторы изготавливаются в двух вариантах или
типах. Первый тип для нестерильных систем, когда нет абсолютной необходимости
оперировать с чистыми культурами микроорганизмов (например, ферментация при
пивоварении, производство пекарских дрожжей и т. п.).
Биореакторы второго типа предназначены для
асептических процессов, обычно используемых в производстве таких соединений
как, антибиотики, аминокислоты, полисахариды и одноклеточный бактериальный
белок. В реакторах такого типа все посторонние микроорганизмы должны быть
исключены, что, естественно, связано со значительными сложностями при их
конструировании и разработке самого биотехнологического процесса. Основное
требование к биореакторам любого типа сводится к обеспечению оптимальных
условий роста продуцента или накоплению синтезируемого им продукта. Для
достижения указанных целей необходимо разрабатывать технологию, призванную
оптимизировать процесс, а именно: использовать подходящий источник энергии,
набор питательных веществ должен соответствовать питательным потребностям
организма-продуцента, из ростовой среды должны быть удалены соединения,
ингибирующие его жизнедеятельность, должна быть подобрана соответствующая
посевная доза и, наконец, обеспечены все остальные требуемые физико-химические
условия. Экономически рентабельные процессы в своей основе весьма сходны,
независимо от избранного продуцента, используемой среды и образуемого продукта.
Главная задача - получение максимального количества клеток с одинаковыми
свойствами при их выращивании в определенных тщательно контролируемых условиях.
Фактически один и тот же биореактор (лишь с небольшими изменениями) может быть
использован для производства ферментов, антибиотиков, органического белка.
Специфика биотехнологических процессов состоит в том, что в них участвуют живые
клетки, субклеточные структуры или выделенные из клеток ферменты и их
комплексы. Это оказывает довольно существенное влияние на процессы
массопередачи (обмена веществ между различными фазами - перенос кислорода из
газообразной фазы в жидкую) и теплообмена (перераспределение тепловой энергии
между взаимодействующими фазами). Поэтому одним из важнейших компонентов
биореакторов является система перемешивания, обеспечивающая однородность
условий в аппарате, оптимальность между фазами реактора, между культуральной
жидкостью и клетками и т. д.
Системы аэрации зачастую бывают очень
сложной конструкции, поскольку они должны обеспечить баланс между расходом О2 и
его поступлением в нужных количествах, учитывая тот факт, что потребность в
кислороде не одинакова на различных стадиях культивирования. Крайне важным
является обеспечение должного уровня теплообмена в биореакторах, поскольку
жизнедеятельность и метаболическая активность объектов зависит в значительной
степени от колебаний температуры. Поддержание температуры в определенном узком
диапазоне диктуется: резким снижением активности ферментов по мере падения температуры
и необратимой инактивацией (денатурацией) макромолекул (в первую очередь
белков) при ее повышении до критических значений. Температурный оптимум у
каждого организма лежит в определенных пределах. Большинство биотехнологических
процессов осуществляется в мезофильных условиях (30-50 0С). С одной, это имеет
преимущество, потому что лишь в редких случаях обеспечивать повышенный подогрев
реакторов. Однако, с другой стороны, возникает проблема удаления избыточного
тепла, выделяющегося при интенсивном росте культивируемых клеток, поэтому
биореактор должен быть оснащен эффективной системой охлаждения. Еще одной
серьезной проблемой при культивировании в биореакторах является
пенообразование, связанное с необходимостью аэрирования содержимого, в
котором постоянно присутствуют поверхностно-активные вещества (ПАВ) продукты
распада жиров (мыла) и белки (составные компоненты субстрата например, белки
соевой и кукурузной муки и т. п.). Образующийся слой пены опять же, с одной
стороны, способствует росту аэробных микроорганизмов, а с другой - сокращает
полезный объем реактора и способствует заражению культуры посторонней
микрофлорой. Это заставляет интенсивно разрабатывать эффективные системы
пеногашения.
Специфическим элементом биореактора является
система, обеспечивающая стерильность процесса. Стерилизация
осуществляется на разных этапах процесса, как до его начала, так и при
осуществлении и после окончания. Иными словами, в биотехнологическом
производстве важное место отводится принципу асептики, выдвинутому еще в 60-е
годы XIX в. Луи Пастером.
В последнее время в биотехнологию внедряется
принцип дифференцирования режимов культивирования: разные этапы одного и того
же процесса осуществляются при различных условиях - температура, рН, аэрация и
т. п. Естественно, это создает новые (дополнительные) требования при
конструировании реакторов. Таким образом, в соответствии с основными принципами
реализации биотехнологических процессов современные биореакторы должны обладать
следующими системами:
- эффективного
перемешивания и гомогенизации среды выращивания;
обеспечения
свободной и быстрой диффузии газообразных компонентов системы (аэрирование в
первую очередь);
теплообмена,
обеспечивающего поддержание оптимальной температуры внутри реактора и ее
контролируемые изменения;
пеногашения;
стерилизации сред,
воздуха и самой аппаратуры;
- контроля и регулировки процесса и
его отдельных этапов [4] .
Для создания оптимальной биореакторной системы
необходимо точно придерживаться следующей генеральной линии:
)ферментер должен быть сконструирован так, чтобы
исключить попадание загрязняющих микроорганизмов, а также обеспечить сохранения
требуемой микрофлоры;
2) объем культивирумой смеси должен оставаться
постоянным, т. е. чтобы не было утечки или испарения содержимого;
3) уровень растворенного кислорода должен
поддерживаться выше критических уровней аэрирования культуры аэробных
организмов;
4) параметры внешней среды, такие, как
температура, рН и т. п., должны постоянно контролироваться;
5) культура при выращивании должна быть хорошо
перемешиваемая.
К материалам, используемым при конструировании
сложных, прецизионно работающих ферменторов, предъявляются определенные
требования (порой весьма строгие):
а) все материалы, вступающие в контакт с
растворами, подающимися в биореактор, соприкасающиеся с культурой
микроорганизма, должны быть устойчивыми к коррозии, чтобы предотвратить
загрязнения металлами даже в следовых количествах;
б) материалы должны быть нетоксичным и, чтобы
даже при самой малой растворимости они не могли бы ингибировать рост культуры;
в) компоненты и материалы биореактора должны
выдерживать повторную стерилизацию паром под давлением;
г) перемешивающая система биореактора и места
поступления и выхода материалов и продуктов должны быть легко доступными и
достаточно прочными, чтобы не деформироваться или ломаться при механических
воздействиях;
д) необходимо обеспечить визуальное наблюдение
за средой и культурой, так что материалы, используемые в процессе, по
возможности должны быть прозрачными.
Для оптимизации биотехнологических процессов
требуется постоянный и тщательный контроль за изменяющейся картиной
ферментации, что обеспечивается наличием в биореакторах соответствующих
датчиков, позволяющих осуществлять избирательный анализ определенных параметров
ферментационного процесса.
Неотъемлемой частью большинства ферментаций
является та или иная степень компьютеризации. За последние десятилетия форма
биореакторов существенно изменилась. Первые (исходные) ферментационные системы
представляли собой неглубокие емкости, перемешивание в которых осуществлялось
либо путем их встряхивания, либо посредством перемешиваниясодержимого вручную.
На основе первичных систем в последующем были созданы аэрируемые башенные
конструкции, которые в настоящее время доминируют в промышленном производстве.
Системы перемешивания являются важным классификационным принципом биореакторов
различного типа. Правда, поскольку биореакторы являются многопараметровыми
аппаратами, они могут классифицироваться и по другим критериям: размерам,
целевым назначениям (лабораторные, опытно-промышленные или пилотные,
промышленные), режиму работы (периодического и непрерывного действия), условиям
культивирования (аэробные и анаэробные, мезофильные и термофильные, для
поверхностного и глубинного выращивания, для жидких и твердых питательных сред,
газофазные).
И все же система перемешивания имеет не
последнее значение в классификации. По способу перемешивания и аэрации
биореакторы подразделяются на аппараты с механическим, пневматическим и
циркуляционным перемешиванием.
По структуре потоков ферментеры (биореакторы)
могут быть аппаратами полного перемешивания или полного вытеснения.
Конструктивные различия ферментеров
(биореакторов) определяются в основном способами подвода энергии и аэрации
среды:
)ферментеры с подводом энергии к газовой фазе;
)ферментеры с подводом энергии к жидкой фазе;
)ферментеры с комбинированным подводом энергии
[10].
1.3.1Ферментеры
с подводом энергии к газовой фазе
В аппаратах этого типа аэрация и перемешивание
культуральной жидкости осуществляются сжатым воздухом, который подается в
ферментер (биореактор) под определенным давлением. К таким ферментерам
(биореакторам) относят:
барботажные ферментеры представлены на рисунке
3, подача воздуха в которых осуществляется через барботажные устройства,
расположенные в нижней части аппарата;
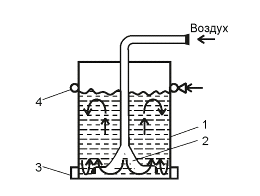
Рисунок 3 - Барботажный ферментер: 1 - корпус; 2
- воздухораспределитель; 3 - карман; 4 - коллектор
аппараты с диффузором (эрлифтные аэраторы),
имеющие внутренний цилиндр-диффузор, который обеспечивает перемешивание
поступающих по распределительным трубам в нижнюю часть аппарата субстрата и
воздуха;
трубчатые ферментеры (газлифтные), состоящие из
реактора кожухотрубчатого типа, через который жидкость потоком воздуха
перемещается в верхнюю часть аппарата и, попадая в сепаратор, возвращается в
реактор, где снова увлекается воздухом, подвергаясь таким образом циркуляции на
рисунке 4;
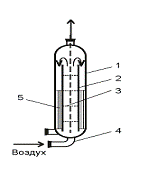
Рисунок 4 - Газлифтный ферментер: 1 - корпус; 2
- диффузор; 3 - диспергатор; 4 - воздухораспределитель; 5 - теплообменник
ферментеры (биореакторы) с форсуночным
воздухораспределением, оборудованные форсунками для подачи воздуха,
расположенными в нижней части аппарата, и находящимся над ними диффузором,
который обеспечивает внутреннюю циркуляцию жидкости;
ферментеры (биореакторы) колонного типа,
представляющие собой цилиндрическую колонну, разделенную горизонтальными
перегородками (тарелками) на секции; воздух барботирует через слой жидкости
каждой тарелки, а перемещение жидкости через кольцевую щель обеспечивает
противоточное движение жидкой и газовой фаз [6]
1.3.2
Ферментеры с подводом энергии к жидкой фазе
К таким аппаратам относят:
аппарат с самовсасывающей турбиной представлен
на рисунке 5, имеющий цилиндрический диффузор и мешалку с полыми лопастями и
валом, при вращении которой за счет создаваемого разрежения происходит
самовсасывание воздуха, благодаря чему происходит подъем жидкости в кольцевом
зазоре между диффузором и стенками аппарата с последующим ее возвращением в диффузор;
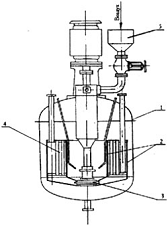
Рисунок
5 - Ферментер с самовсасывающей турбиной: 1 - корпус; 2 - диффузор; 3
-самсовсасывающая мешалка; 4 - теплообменник; 5 - фильтр
ферментер (биореактор) с турбоэжекторными
перемешивающими устройствами - аппарат, разделенный вертикальными перегородками
на секции, в каждой из которой имеется самовсасывающая мешалка турбинного типа
(эжектор) и диффузор; для перемещения жидкости из секции в секцию в
перегородках сделаны окна [9]
1.3.3
Ферментеры с комбинированным подводом энергии
В этих аппаратах осуществлен подвод энергии к
газовой фазе для аэрации и к жидкой фазе для перемешивания. Ферментер
представляет собой цилиндрический сосуд, снабженный механической мешалкой и
барботером, который устанавливается, как правило, под нижним ярусом мешалки.
По способу перемешивания, в соответствии с
которым используются аппараты, их разделяют на ферментеры с механическим,
пневматическим и циркуляционным перемешиванием [12].
Эти реакторы имеют механическую мешалку с
центральным валом и лопастями (лопатками), число которых обычно равно 6, реже 8
на рисунке 6.Лопасти могут быть прямыми или изогнутыми, часто их располагают в
несколько ярусов, что обеспечивает более эффективное перемешивание больших
объемов жидкости. В систему входят также отражательные перегородки - узкие
металлические пластинки, прикрепленные к внутренним стенкам биореактора. Они
предотвращают возникновение водоворотов и обеспечивают вихревое движение
жидкости, равномерно распределяемое по всему объему реактора. Однако в ряде
случаев они не могут быть применены (культивирование мицелиальных грибов), так
как обрастают микроорганизмами (мицелием). Нежное и медленное перемешивание
создается в биореакторах, предназначаемых для выращивания клеток животных и (в
меньшей степени) растений. Аэрация (без явного, интенсивного перемешивания)
может осуществляться путем барботажа - подачи воздуха снизу через
горизонтальную трубку с отверстиями, иногда аэрирование достигается применением
специальных вибраторов, которые обеспечивают высокую степень асептики, малый
расход энергии и относительно слабо травмируют клетки [15].
В аппаратах с пневматическим перемешиванием
мешалка отсутствует и перемешивание жидкости осуществляется пузырьками газа на
рисунке 7. Естественно, что скорость массообмена в них намного ниже, чем в
ферменторах с механическим перемешиванием (с мешалками). Классическим аппаратом
такого типа является эрлифтный реактор (air lift - подъем воздуха). Биореакторы
с пневматическим перемешиванием характеризуются более мягким (плавным)
перемешиванием содержимого и получили распространение при выращивании клеток
животных и растений. Пневматические аппараты привлекают также простотой
конструкции и малыми энергозатратами. Основной их недостаток -
"тихоходность" Однако и это не всегда является недостатком,
поскольку, например, в условиях "тихоходных" установок культуры
клеток растений характеризуются биосинтетическими способностями,
присущими целому растению. Так, клетки Digitalis lanata в эрлифтном ферменторе
продуцируют ценный кардиологический препарат - р - метилдигоксин.
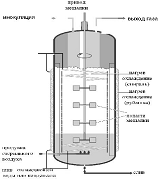
Рисунок
6 - Ферментер с механическим перемешиванием
Перемешивание и аэрация усиливаются с помощью
вращающихся дисков с отверстиями, установленных вблизи барботера, или с помощью
придонных пропеллеров. Классический эрлифтный аппарат дополнен диффузором,
нижний обрез которого находится над барботером. Возможны варианты подачи
воздуха как во внутренний, так и во внешний по отношению к диффузору объем
среды [18].
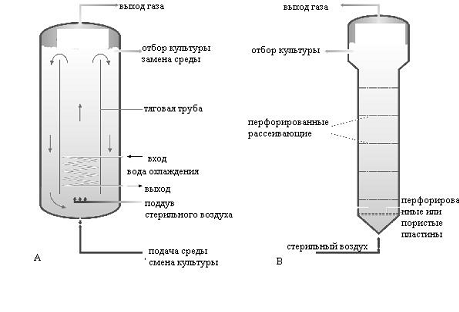
Рисунок
7 - Ферментеры с пневматическим перемешиванием: А-эрлифтный; В - пузырькового
типа
Биореакторы циркуляционного или
гидродинамичесиого типа оснащены насосами и эжекторами, создающими направленный
токжидкости по замкнутому контуру (кругу). Жидкость увлекает за собой пузырьки
газа и тем самым культуральная среда одновременно с перемешиванием может
насыщаться либо атмосферным кислородом, либо (с использованием специальных
устройств и эжекторов) газом иного типа. Эти аппараты отличаются простотой
конструкции и надежностью в эксплуатации. Ферменторы циркуляционного типа часто
заполняются твердыми частицами (насадкой), которые способствуют лучшему
перемешиванию содержимого реактора, препятствуют обрастанию стенок при
длительном культивировании, а также обеспечивают диспергирование воздуха в
жидкости. Некоторые микроорганизмы, прикрепляясь к таким насадкам (в частности,
грибы и актиномицеты), развиваются намного лучше. От биореакторов с насадками -
один шаг к ферменторам для иммобилизованных клеток или к аппаратам для
иммобилизованных ферментов. В последнее время разрабатываются новые способы
аэрации.
Например, воздух может подаваться через
специальные полипропиленовые мембраны. Это позволяет избегать пенообразования и
очень хорошо зарекомендовало себя при выращивании клеток эукариотических
организмов, в частности при промышленном получении интерферона.
Существуют разные варианты такого типа
аппаратов: аппараты типа «падающей струи», типа «погруженной струи [17]
1.4
Системы теплообмена, пеногащения, стерилизации
Теплообмен осуществляется с помощью труб с
охлаждающим или нагревающим агентом, которые оплетают аппарат и образуют так
называемую рубашку реактора. Иногда эта система труб располагается
непосредственно в полости ферментора. Нагревающими агентами в промышленных
биореакторах служат горячая вода или пар. Естественно, в лабораторных
ферментерах чаще используется электрический подогрев. В качестве охлаждающих
агентов применяют воду с низкой температурой (артезианскую или пропущенную через
холодильную установку); более глубокое охлаждение достигается использованием
этиленгликоля или фреонов. Проблема охлаждения ферменторов становится очень
значительной в промышленных масштабах.
Пеногашение - средство борьбы с избыточным
ценообразованием. Существуют химические, механические, акустические и другие
виды пеногашения. Наиболее часто применяют химические и механические способы
пеногашения. К химическим средствам относятся поверхностно- активные вещества,
которые, внедряясь в стенки пузырей, становятся центрами их неустойчивости.
Эффективными пеногасителями служат растительные (соевое, рапсовое, кокосовое,
подсолнечное, горчичное) масла, животные (сало, рыбий жир) и минеральные жиры.
Недостатком этих пеногасителей является то, что при их утилизации микробными
клетками сами по себе способствуют пенообразованию. Механические пеногасители
представляют собой различные устройства, сбивающие пену: диски, лопасти,
барабаны, располагающиеся в верхней части реактора. Более сложными
приспособлениями являются сепараторы пены, которые одновременно служат для
сбора биомассы, содержащейся в пенном слое. Все эти устройства, конечно же,
приводят к дополнительным затратам и удорожают производство [2].
Устройства и режим стерилизации определяется
конструкцией биореактора, вспомогательного оборудования, используемых
питательных сред и т. п. Наибольшее значение имеют термический метод
стерилизации оборудования и сред и фильтрационный способ, применяемый для
удаления микроорганизмов из подаваемого в ферменторы воздуха или другого газа.
Режимы термальных способов стерилизации
определяются химическим составом питательных сред. При этом определяющим
является состояние компонентов среды после стерилизации; главное сохранность ее
питательных качеств [11].
1.5
Проблемы масштабирования ферментационных процессов
Технология производственного процесса
отрабатывается поэтапно: в лабораторных, пилотных (опытно-промышленных) и
промышленных установках. Чаще встречаются аппараты с объемами ферменторной
камеры: 0,5-100 л (лабораторные), 100-5000 л (пилотные) и 5000-1000000 л и
более (промышленные). На каждом этапе увеличения масштаба ферментации
(процесса) - масштабном переходе (масштабировании биотехнологического процесса)
- решаются конкретные задачи отработки (налаживания) производства и его
оптимизации.
Лабораторные ферменторы по устройству и форме
напоминают промышленные и подразделяются на те же типы. Правда, в лабораторных
масштабах наиболее часто применяются аппараты с механическим перемешиванием. По принципу
теплообмена и стерилизации они делятся на две категории. К первой относятся
лишенные собственных системтеплообмена и стерилизации. Такие аппараты, по сути
дела, представляют собой камеры для культивирования, помещаемые в водяные бани
и стерилизуемые в автоклавах. Аппараты второй категории снабжены системами
теплообмена и стерилизации, принципиально не отличающимися от таковых
промышленных установок.
С помощью лабораторных биореакторов решаются
следующие задачи:
) кинетические - определение скорости роста
клеток, эффективность утилизации субстратов и образования целевого продукта;
) некоторые массообменные - расчет коэффициентов
массопередачи, скорость поступления в среду О2 и других газов,
скорость освобождения от газообразных продуктов, образующихся при
культивировании продуцентов (в первую очередь СО2);
) определение коэффициентов реакций, связывающих
утилизируемые субстраты и О2 с получаемыми целевым и побочными
продуктами.
Пилотные установки используют для поиска (отсюда
и название) наиболее целесообразных технологий и в общих чертах моделирование
промышленного процесса. Поэтому на данном этапе стараются применять тот тип
аппарата, который предполагается использовать в промышленном
масштабе. Иными словами, отрабатываются все
аспекты производства, вплоть до штатных вопросов. При масштабных переходах
следует постоянно иметь в виду, что при соблюдении одинаковых условий (среда,
тип аппарата, температура и рН, скорость перемешивания) уровень и скорость
синтеза целевого продукта могут существенно различаться ситуация, очень четко прослеженная
еще в 1940-1950 гг. при организации крупномасштабных производств антибиотиков.
Вследствие сказанного при переходе от
лабораторных к пилотным, а затем от пилотных к промышленным установкам,
приходится наряду с объемом изменять и конструкцию, и режимы работы аппаратов.
Центральной проблемой при этом является подбор надежных критериев
масштабирования, обеспечивающих разработку высокоэффективных и экономичных
технологий промышленного производства целевого продукта [14].
2.
Технологическая часть
2.1 Расчет
продуктового баланса получения α - амилазы
1.Количество ферментоционной среды с учетом
потерь (10%) засчет уноса среды с отходящими от ферментера газами
Количество готовой культуральной жидкости (к.ж.)
- (G) составит -1 м3.Потери
с уносом - 10%.
Количество засеянной питательной среды составит:
G1=
G×1,1м3
G1=
1×1,1 = 1,1м3
.Расход компонентов питательной среды для
приготовления 1,1 м3 (G1)
ферментационной среды, и содержание абсолютно сухих веществ в ней.
Общий расход компонентов для ферментационной
среды:
G2=g1+g2
и т.д., где g1,
g2
и т.д. - расход отдельного компонента среды.
G2=
1,1×( 0,93+0,03+0,03+0,008+0,002)= 1,1м3
Содержание абсолютно сухих веществ в
ферментационной среде:
G3=c1+c2+c3
и т.д., где с1,с2 и т.д. - содержание абсолютно сухих
веществ каждого компонента среды, которая определяется путем умножения расхода
компонента на содержание a,
c, b
в компоненте в соответствии с ГОСТом.
G3=27,9+2,94+1,8+0,04+0,01=32,69
кг
Количество посевного материала для засева
ферментационной среды (посевная доза - 2% по отношению к G1):
G4=G1×0,02
м3
G4=1,1×0,02=0,022
м3
Потери при выращивании посевного материала - 5%.
Количество готового посевного материала
составит:
G5=
G4×0,95м3
G5=
0,022×0,95=0,0209м3
Расход компонентов питательной среды для
получения посевного материала:
Общий расход компонентов для посевной среды:
G6=g1+g2+
и т.д.,где g1,
g2
и т.д. - расход отдельного компонента посевной среды.
G6=0,0209
м3
Содержание абсолютно сухих веществ в посевной
среде:
G7=
c1+с2+с3
и т.д.
G7=
0,058+0,061+0004+0,00008+0,00002 = 0,1231 кг
Количество среды, поступившей в ферментер (среда
для ферментации + посевной материал):
G8=
G1+G5
м3
G8=
1,1+0,0209 = 1,1209 м3
Содержание абсолютно сухих веществ при этом
составит:
G9=G3+G7
кг
G9=32,69+0,1231
= 32,8131 кг
Количество культуральной жидкости (к.ж.),
полученной после ферментации и поступившей на стадии обработки (выход с учетом
уноса с отходящими газами - 90%):
G10=G8×0,9
м3
G10=1,1209×0,9=
1,00881 м3
Потери к.ж. с отходящими газами составят 10%:
G11=G8×0,1
м3
G11=1,1209×0,1=
0,11209 м3
При этом потери абсолютно сухих веществ с
отходящими газами составит 10%:
G12=G9×0,1
кг
G12=32,8131×0,1=3,28131
кг
Активность культуральной жидкости: А1.
Общая активность в культуральной жидкости:
А2=А1×G10
ед
А2=8000×1,00881=
8070,48 ед
Затраты абсолютно сухих веществ на энергию
биосинтеза 15%:
G13=G9×0,15
кг
G13=32,8131×0,15=
4,9220 кг
Количество абсолютно сухих веществ в
культуральной жидкости, поступившей на обработку:
G14=G9-(G12+G13)
кг
G14=32,8131-(3,28131+4,9220)=24,6098
кг
.Фильтрация культуральной жидкости
Расход воды на промывку осадка при гидромодуле
1:0,5:
G15=G10×0,5
дм3
G15=1,00881×0,5=
504,405 дм3
Количество полученного фильтрата с учетом 10%
потерь на фильтрации:
G16=
(G10+G15)×(1-0,1)
см3
G16=
(1,00881+504,405)×(1-0,1) = 1361893,5см3
Активность фильтрата с учетом потерь от
инактивации 5%:
A3=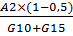 ед/см3
ед/см3
A3=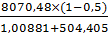 = 0,005 ед/см3
= 0,005 ед/см3
Общая активность фильтрата:
A4=G16×A3
ед
A4=1361893,5×0,005=
6809,46 ед
Потери активности
на стадии составят: a1=A2-A4=
8090,48- 6809,46= 1261,02 ед из них:
- потери активности с биомассой (а2)
составляют 7%:
а2=а×0,07=
1261,02×0,07= 88,2714 ед,
- потери от инактивации а3=а1-а2=
1261,02- 88,2714= 1172,7486 ед
Количество абсолютно сухого остатка, отделенного
при фильтрации:
При фильтрации в к.ж. в осадке остается 40% от
содержания абсолютно сухих веществ, содержащихся в к.ж.:
G17=G14×0.4
кг
G17=24,6098×0.4=
9,8439 кг
При влажности осадка 85%, его количество
составляет:
G18=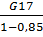 =
= 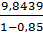 =
65,626кг, или
=
65,626кг, или
G19=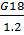 =
= 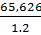 =
54,6883дм3, где 1,2 - плотность осадка.
=
54,6883дм3, где 1,2 - плотность осадка.
Содержание абсолютно схих веществ в фильтрате:
G20=G14-G17
кг
G20=24,6098-
9,8439= 14,7659 кг
.Концентрирование ферментного раствора методом
ультрафильтрации:
Количество ультраконцентрата при степени
концентрирования - 10:
G21=G16:10
дм3
G21=1361893,5:10=
136,189 дм3
Активность амилазы в ультраконцентрате с учетом
10% потерь:
А5=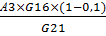 ед/см3
ед/см3
А5=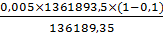 = 0,045 ед/см3
= 0,045 ед/см3
Общая активность концентрата:
А6=А5×G21
ед
А6=0,045×136189,35=
6128,52 ед
Количество абсолютно сухих веществ в концентрате
7,5%:
G22=G21×0.075
кг
G22=136,189×0.075=
10,2142 кг
Количество ультрафильтрата:
G23=1361,8935-136,189=
1225,7045дм3
Количество абсолютно сухих веществ в
ультрафильтрате:
G24=G20-G22
кг
G24=14,7659-10,2142=
4,5517 кг
Общая активность амилазыв ультрафильтрате
(потери с ультрафильтратом - 6,5% от общей активности фильтрата):
А7=А4×0,065
ед
А7= 6809,46×0,065 =
6366,84ед
Потери от инактивации - 3,5%:
а4=А7:С23 ед/мл
а4=6366,84:12257045 = 0,0005 ед/мл
.Осаждение раствором Na2SiO3
Количество Na2SiO3
для осаждения амилазы составляет 70% от объема ультрафильтрата:
G25=
G23×0,7м3
G25=
1,2257095×0,7= 0,858 м3
Содержание амилазы в ультраконцентрате
составляет 45%:
G26=
G23×0,45м3
G26=
1,2257045×0,45= 0,5516 м3
Количество осажденной амилазы составляет 98%:
G27=
G26×0,98м3
G27=
0,5516×0,98= 0,5405 м3
Активность осажденной амилазы с учетом 10%
потерь:
А8=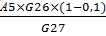 ед/см3
ед/см3
А8=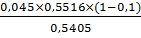 = 0,004 ед/см3
= 0,004 ед/см3
Общая активность
осадка:
А9=А8×G27
ед
А9=0,004×0,5405=
2162 ед
Количество абсолютно сухих веществ в осадке:
G28=
G24×0,1кг
G28=
4,5517×0,1= 0,45517 кг
.Фильтрация осажденной амилазы
Количество осадка с учетом влажности
увеличивается в 2 раза:
G29=
G28×2=
0,5405×2= 1,088 м3
Содержание абсолютно сухих веществ в осадке с учетом
потерь:
G30=
G28×0,1=
0,45517×0,1= 0,045517 кг
Активность амилазы при этом составляет:
А10=А8×0,9=
0,004×0,9= 0,0036 ед/см3
Общая активность осадка:
А11=А10×G29=
1,081×0,0036= 1985,8 ед
.Сушка осадка амилазы
Количество высушенного препарата с учетом 10%
потерь вещества с отходящим воздухом, содержание влаги в препарате 8%:
G31=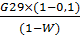 м3
м3
G31=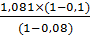 =
1,0575 м3
=
1,0575 м3
Активность амилазы:
А12=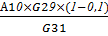 ед/см3
ед/см3
А12=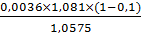 =
0,0003
ед/см3
=
0,0003
ед/см3
Общая активность препарата:
А13=А12×G31=0,0003×1,0575=
324 ед
Содержание абсолютно сухих веществ с учетом
потерь:
G32=
G30×0,1=
0,045517×0,1= 0,0045517 кг
8.Стандартизация сухого препарата
Количество препарата после стандартизации с
учетом потерь:
G33=
G32×0,98=1,0575×0,98=
1,03635 м3
Общая активность с учетом потерь:
А14=А13×0,99=
324×0,99= 320,76 ед
9.Фасовка, упаковка, маркировка
Потери на стадии упаковки составляют 1,0%.
Количество упакованного препарата: G34=
G33×0,99=1,03635×0,99=1,02599
м3
Активность препарата после упаковки составляет:
А15=А14×0,99=
320,76×0,99= 317,55 ед
С учетом плотности готового препарата его
конечный выход составляет:G35=
G34×3,2=
3.33 кг
2.2
Расчет и выбор основного технологического оборудования
Расчет и выбор оборудования для принятой в
проекте технологической схемы производителя по заданной мощности производства и
по данным материального баланса и норм технологического проектирования.
Данные для расчета:
. Объем производства - Q
= 110 кг/г.
. Количество рабочих дней в году - t
=301 день
. Выход препарата с 1 м3
культуральной жидкости - q
=3,33 кг/м3.
Для расчета оборудования принимаем: коэффициент
заполнения для смесителей отделения приготовления питательной среды и среды и
реакторов для обработки культуральной жидкости - 0,7, сборников фильтратов и
концентратов 0,8; ферментеров - 0,5, посевных аппаратов - 0,6.
.Производственные ферментеры
Объем культуральной жидкости для производства
данного объема производства в год:
Q1=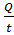 =110×1/3,33=
33,03
м3/год
=110×1/3,33=
33,03
м3/год
Необходимое количество культуральной жидкости в
сутки:
Q2=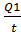 = 33,03/301= м3
= 33,03/301= м3
С учетом
коэффициента заполнения количество культуральной жидкости в сутки:
Q3=
Q2×0,5
= 0,055
м3
Для рассчитанного количества культуральной
жидкости в сутки выбирают ферментер, объем (V)
которого при коэффициенте заполнения 0,5 близок к объему Q3.
Выбрали ферментер на 55 литров высотой 124 см., диаметром 45 см. и весом 13 кг
[20].
Количество культуральной жидкости с одной
ферментации при учете потерь во время ферментации (10%) составит:
Q4=V×0,5×0,9
= 0,055×0,5×0,9 = 0,0248 м3
Количество ферментации в сутки:
n=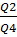 = 0,11/0,0248 = 4
= 0,11/0,0248 = 4
Количество культуральной жидкости в год с учетом
ферментации в сутки:
Q5= = 0,11/3330 = 33,03 м3.
= 0,11/3330 = 33,03 м3.
Продолжительность оборачиваемости одного
ферментера (r1).
Полный цикл работы одного ферментера
складывается из следующих величин, которые определены в задании индивидуально:
длительность ферментера;
слив к.ж.;
мойка ферментера ч;
проверка ферментера на герметичность;
стерилизация ферментера;
заполнение ферментера питательной средой;
засев
t1
=170 ч
Количество рабочих часов в году:
t2=t×24
= 301×24 = 7224 ч
Необходимое количество ферментеров:
N=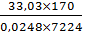 =
3
=
3
Принимаем 3 ферментера и 1 запасной.
2.Посевные аппараты
Полный цикл работы одного посевного аппарата (t3)
складывается из следующих величин, которые определены в задании индивидуально:
длительность выращивания посевного материала;
засев в ферментер;
мойка аппарата;
проверка на герметичность;
стерилизация пустого аппарата;
стерилизация питательной среды;
приготовление питательной среды в посевном
аппарате.
t3
= 26 ч
Количество посевного материала на загрузку одного
производственного ферментера:
Q6=V×0,5×c
= 0,055×0,5×0,02 = 0,00055 м3
Полный объем объем посевного аппарата при
коэффициенте заполнения 0,6:
Q7=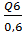 = 0,00055/ 0,6 = 0,0009 м3
= 0,00055/ 0,6 = 0,0009 м3
Выбираем посевной аппарат на 1 литр высотой 18
см. диаметром 10 см. и весом 4 кг [16]
Количество посевных аппаратов:
n=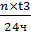 = 4×26/24
= 4
= 4×26/24
= 4
Принимаем 5 посевных аппаратов.
Расчет оборудования для пригоовления питательной
среды для производственного ферментера.
Для приготовления среды из углеводсодержащих
компонентов (I партия) и
азотсодержащих компонентов (II
партия) используют отдельные емкости, и стерилизуются водные смеси этих
компонентов последовательно.
Объем среды, который необходимо приготовить,
равен полезному объему ферментера:
V1=V×0,5
= 0,055×0,5 = 0,0275 м3
Во время стерилизации среды происходит ее
разбавление конденсатом (ориентировочно на 15-20%), в связи с этим, объем воды,
используемый для приготовления среды (V2),
должен быть уменьшен на 20% и составит:
V2=V1×0,2
=0,0275×0,2= 0,0055 м3
Объем воды для приготовления 1 партии среды
составляет 65-70% от общего объема воды:
V3=V2×0,7
=0,0055×0,7 = 0,00385 м3
а для приготовления II
партии среды объем воды составит:
V4=V2×0,3
= 0.0055×0,3 = 0,00165 м3
Полный объем реактора для I
партии среды при коэффициенте заполнения составит:
V5=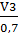 = 0,00385/0,7 = 0,0055 м3
= 0,00385/0,7 = 0,0055 м3
а для партии среды:
V6=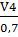 = 0,00165/0,7 = 0,0024м3
= 0,00165/0,7 = 0,0024м3
Выбираем реактор с мешалкой объемом 6 литров
высотой 42,5 см. и димаметром 20 см и 1 запасной [13].
Стерилизация питательной среды в установке
непрерывной стерилизации (УНС).
Количество среды, поступающей на стерилизацию в
сутки :
Q8=V2
= 0,0055 м3
Время стерилизации среды не должно превышать 3ч.
В соответствии с этим, производительность УНС должна составлять:
q1=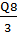 = 0,0055/3 =0,0018 м3/ч
= 0,0055/3 =0,0018 м3/ч
Общее время занятости УНС состоит из времени на
стерилизацию среды и времени подготовки УНС к работе.
Время подготовки УНС складывается из:
Мойки - 1ч
Ревизии арматуры - 1,5ч
Проверки на герметичность - 1,0ч
Стерилизации УНС - 1,5ч
Общее время занятости составит 7 ч.
Устанавливаем 1 УНС производительностью 10 л/ч и
мощностью 3Вт [21].
.Сборника культуральной жидкости
Необходимый объем сборником при коэффициенте
заполнения - 0,8.
Q9=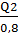 = 0,11/0,8 = 0,14 м3
= 0,11/0,8 = 0,14 м3
Полезный объем сборника:
Vп=Vполн×0,8
= 0,14×0,8 = 0,11м3
Количество сборников:
n2=
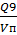 =0,14/0,11
= 1
=0,14/0,11
= 1
Выбираем 1 сборник на 150 литров и 1 запасной
[22].
4.Отделение биомассы
На отделение поступает Q2
= 0,11 м3/сутки
Фильтрующее оборудование выбираем по поверхности
фильтрации.
S=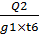 = 0,11 / 0,1× 20 = 0,055 м2.
= 0,11 / 0,1× 20 = 0,055 м2.
Выбираем фильтр с
керамической мембраной с поверхностью фильтрации 1,1 м2 [9].
5.Пеногасители
Vпен
= Q2
×0,5
=
0,11×0,5=
55 л/сутки
.Расход воздуха
На 0,11 м3
культуральной жидкости будет израсходовано 0,11 м3 воздуха в минуту.
Заключение
Ферментер - это основное звено в процессе
промышленного микробиологического синтеза. Биотехнологические процессы
рассчитаны на использование живых клеток и тканей различного происхождения.
Поэтому особенности биообъектов обуславливают различные принципы
технолггического оснащения биопроизводств. К ним относят конструкционное
совершенство, относительную универсальность ферментеров, инертность,
эксплуатационную нажедность, доступность, эстетичность, легкость обслуживания и
многое другое. Следовательно, анализ процесса ферментации и выбор
ферментационного оборудования в приложении Б является важнейшими задачами
инженера - биотехнолога.
В курсовой работе были рассмотрены важнейшие
вопросы по оснащению биотехнологического производства ферментерами, изучены их
характеристики, продблемы и недостатки экусплуатации, рассчитан продуктовый
баланс получения α - амилазы и
подобрано аппаратурное оформление.
Список
использованных источников
1. Бейли
Д., Оллис Д. Основы биохимической инженерии, в 2-х частях. - М.: Мир, 2002.-
430 с.
. Бирюков
В.В. Основы промышленной биотехнологии: Учеб. пособие для вузов. - М.: Колосс,
2004.- 122 с.
. Виестур
У.Э., Шмите И.А., Жилевич А.В. Биотехнология: биотехнологические агенты,
технология, аппаратура. - Рига: Зинатне, 2005. - 741 с.
4. Гапонов К.П. Процессы и аппараты микробиологических
производств.- М.:Легкая и пищевая промышленность, 1991. - 540 с.
5. Глик
Б. Молекулярная биотехнология. Принципы и применение. -М.: Мир, 2002. - 364 с.
.
Грачева И.М. Технология ферментных препаратов - М.: Агропромиздат., 2008 -
358с.
. Лиепиныш
Г.К., Дунце М.Э. Сырье и питательные субстраты для пищевой промышленной
биотехнологии. -Рига: Зинатне, 2001. - 652 с.
. Елинов
Н.П. Основы биотехнологии / П.Н. Елинов, - СПб.: Наука, 1995. - 314 с.
. Иванова
А.А., Л.И. Войно, И.С. Иванова. Пищевая биотехнология. - М.: Колос С, 2008 -
427 с.
.
Иоффе И.Л. Проектировнаие процессов и аппаратов химической технологии. -
Ленинград: Химия, 1998. 411 с.
.
Кислухина О.В. Ферменты в производстве пищи и кормов.-М.: ДеЛи принт, 2002. -
439 с.
.
Кулев Д.Х., Шарова Н.Ю. Биосинтез и выделение лимонной кислоты и
амилолитических ферментов. - М., ДеЛи принт, 2008. - 378 с.
.
Основы фармацевтической биотехнологии: Учебное пособие / Т.П. Прищеп, В.С. Чучалин,
К.Л. Зайков, Л.К. Михалева. - Ростов-на-Дону.: Феникс, 2006. - 184 с.
.
Северин С.Е. Биохимия и медицина - новые подходы и достижения / С.Е. Северин. -
М.: Русский врач, 2006. - 94 с.
.
Технология гидролизных производств. Шарков В.И., Сапотницкий С.А., Дмитриева
О.А., Туманов И.Ф. - М.:Лесная промышленность,2004. - 544 с.
.
Трушкин Т.А., Новиков К.А, Бородин С.Н. Процессы ферментации. - М.: Колос С,
205. - 327 с.
.
Федоренко С.М. Культивирование микроорганизмов. - М.: Биорусь, 2002. - 241 с.
.
Филютин К.А, Сотник М.Т. Биомедицинская аппаратура. - М.:Наука, 2007. - 477 с.
. http://www.fitopharm.ru/index/apparaturnaja_skhema_poluchenija_gustogo_ehkstrakta_polyni/0-20
.
http://www.bio-rus.ru/articles/34.html
.
http://www.sibai.ru/archive/index-850.htm