Производство соляной кислоты
1. Характеристика химического
продукта
СОЛЯНАЯ КИСЛОТА
<#"580065.files/image001.jpg">
Соляная кислота. Растворение
<#"580065.files/image002.gif">растворения
<#"580065.files/image002.gif"> иона
<#"580065.files/image003.jpg">
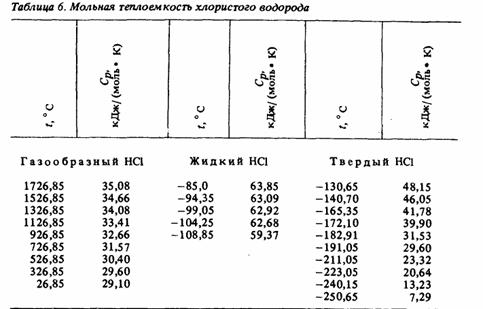
Таблица 3 - Мольная теплоёмкость хлористого
водорода
ПРИМЕНЕНИЕ ХЛОРИСТОГО ВОДОРОДА И СОЛЯНОЙ КИСЛОТЫ
Хлористый водород и соляная кислота используются
в различных отраслях народного хозяйства как хлорсодержащее сырье для получения
хлора, как реагенты при получении различных органических и неорганических
продуктов, как катализаторы технологических процессов.
Соляную кислоту
<#"580065.files/image005.jpg">
Рис. 1 - Схема распределения температур (кривая
1) и концентрации <#"580065.files/image006.jpg">
Рис. 2 - Схема типовой адиабатической абсорбции
<#"580065.files/image007.jpg">
Рис. 3 - Схема типовой комбинированной абсорбции
<#"580065.files/image008.jpg">
ХЛОР
Представляет собой зеленовато-желтый газ с
резким раздражающим запахом, состоящий из двухатомных молекул. При обычном
давлении он затвердевает при -101°С и сжижается при -34°С. Плотность
газообразного хлора при нормальных условиях составляет 3,214 кг/м3, т.е. он
примерно в 2,5 раза тяжелее воздуха и вследствие этого скапливается в низких
участках местности, подвалах, колодцах, тоннелях. Теплоёмкость хлора при 20º
равна
477,3 Дж/(кг*К).
Хлор растворим в воде: в одном объеме воды
растворяется около двух его объемов. Образующийся желтоватый раствор часто
называют хлорной водой. Химическая активность его очень велика - он образует
соединения почти со всеми химическими элементами. Основной промышленный метод
получения - электролиз концентрированного раствора хлористого натрия. Ежегодное
потребление хлора в мире исчисляется десятками миллионов тонн. Используется он
в производстве хлорорганических соединений (например, винилхлорида,
хлоропренового каучука, дихлорэтана, перхлорэтилена, хлорбензола),
неорганических хлоридов. В больших количествах применяется для отбеливания
тканей и бумажной массы, обеззараживания питьевой воды, как дезинфицирующее
средство и в различных других отраслях промышленности. Хлор под давлением
сжижается уже при обычных температурах. Хранят и перевозят его в стальных
баллонах и железнодорожных цистернах под давлением. При выходе в атмосферу
дымит, заражает водоемы.
Водород
Водород - самый лёгкий газ
<#"580065.files/image009.gif">
(где р - парциальное давление соответствующих
компонентов) рассчитывается по уравнению
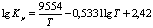
где Т - температура, К.
Теплота реакции синтеза (в кДж) с повышением
температуры (t, °С) несколько увеличивается
=172.5 + 0.0046 t
При адиабатическом сгорании стехиометрической
смеси хлора и водорода при температуре 0°С теоретическая температура факела
пламени равна 2500 °C. Практически, вследствие некоторой диссоциации HCl,
температура пламени снижается до 2200-2400 °С. Избыток одного из компонентов
газовой смеси (обычно водорода) несколько понижает температуру горения.
При обычной температуре в отсутствие световых
лучей реакция образования НС1 из элементов идет очень медленно. При нагревании
смеси хлора и водорода или под действием яркого света происходит взрыв
вследствие протекания цепной реакции:
+ hv=Cl·+Cl··+H2=HCl+H··+Cl2=HCl+Cl··+H2=HCl+H·
и т.д.
В присутствии кислорода реакция хлора с
водородом замедляется.
Зависимость скорости фотохимической реакции от
концентрации компонентов может быть выражена эмпирической формулой:
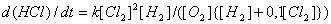
где k - константа скорости реакции, зависящая от
интенсивности возбуждающего светового луча или теплового импульса.
Считают, что определяющей стадией
неинициированного процесса является реакция CI· + Н2 = HCI + Н·. Если
обозначить константу скорости этой реакции k1, а константу диссоциации молекул
хлора k2, то константа скорости образования НСl будет равна k3 = ½(k2
k1) и может быть вычислена по эмпирической формуле:
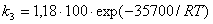
Скорость реакции зависит также от присутствия
катализаторов - влаги, твердых пористых теп (древесного угля, губчатой платины)
и некоторых минеральных веществ (кварца, глины и пр.).
Абсолютно сухие хлор и водород не
взаимодействуют между собой. Присутствие следов влаги ускоряет реакцию столь
интенсивно, что она может произойти со взрывом. Повышение содержания влаги
сверх 5 · 10-5 % не отражается на скорости реакции.
В производственных условиях осуществляется
спокойное, невзрывное горение водорода в токе хлора, которое обеспечивается
равномерным поступлением хлора и водорода и смешением их только в факеле
пламени горелки. Газы сгорают при выходе из горелки, не образуя взрывоопасной
смеси в печи.
Водород подается в избытке (5-10%), что
позволяет полностью использовать более ценный хлор и получить незагрязненную
хлором соляную кислоту. Помимо этого, избыток водорода постоянно обеспечивает в
печи восстановительную атмосферу, что способствует снижению коррозионного
разрушения как стальных, так и графитовых печей. В графитовых печах при избытке
хлора происходит хлорирование материала стенок с образованием летучих
продуктов.
Физико-химические характеристики абсорбции
хлороводорода
Производство соляной кислоты различной
квалификации (реактивной, синтетической, абгазной) заключается в синтезе
хлористого водорода с последующей его абсорбцией водой. При поглощении НС1
водой возникает проблема снятия тепла абсорбции, величина которого значительна
и достигает 72,8 кДж/моль НС1. Этого тепла вполне достаточно, чтобы
образовавшаяся кислота закипела, так как при теплоемкости 29 кДж/(кг*град) его
хватает для повышения температуры до 127 °С.
По способам отвода тепла методы абсорбции
хлористого водорода разделяют на изотермический, адиабатический и
комбинированный.
При изотермической абсорбции процесс
осуществляется с отводом тепла, и температура кислоты поддерживается постоянной
за счет непосредственного охлаждения абсорбера либо благодаря охлаждению
циркулирующей кислоты в выносном холодильнике. При этом теоретически можно
получить соляную кислоту любой концентрации, так как с понижением температуры
уменьшается и парциальное давление НСl над соляной кислотой.
Изотермическую абсорбцию следует применять для
получения концентрированной соляной кислоты (35-38%) и для переработки
хлористого водорода низкой концентрации. Однако в последнем случае при
содержании в реакционных газах свыше 40% примесей азота, водорода, метана и
других проведение абсорбции в изотермических условиях нецелесообразно ввиду
ухудшения теплопередачи и уменьшения полноты абсорбции.
Адиабатическая абсорбция была предложена
Гаспаряном для поглощения хлористого водорода водой с образованием соляной
кислоты и нашла широкое применение. При адиабатической абсорбции процесс
осуществляется без отвода тепла. Соляная кислота нагревается до кипения за счет
тепла растворения хлористого водорода. При этом увеличивается давление паров
соляной кислоты и начинается интенсивное испарение воды. Последнее вызывает снижение
температуры кипящей кислоты и возрастание концентрации соляной кислоты, что
является функцией температуры. Таким образом, кипящая в адиабатических условиях
соляная кислота будет концентрироваться. Температура абсорбции определяется
точкой кипения кислоты соответствующей концентрации.
Исходный газ, содержащий НCl, вводят снизу в
контактную башню; противотоком ему поступает абсорбент (обычно вода). Вместо
воды или вместе с водой для орошения колонны может применяться разбавленная
кислота. Доля применяемой кислоты определяется балансом НСl и воды. Если
кислота является единственным абсорбентом, эффективность абсорбции НСl
несколько снижается и составляет 95-99% в зависимости от концентрации кислоты и
давления паров НС1. Если абсорбентом является вода, хлористый водород может
быть полностью поглощен.
Концентрация хлористого водорода в жидкости
возрастает в направлении от верха колонны к низу. В соответствии с этим
меняется ее температура в колонне. Максимальной является температура кипения
азеотропной кислоты (108,5 °С). Выше и ниже этой точки температура в колонне
снижается и соответствует температуре кипения кислоты данной концентрации.
Температура и концентрация кислоты мало зависят от изменения нагрузки в широких
пределах.
Наиболее эффективно процесс адиабатической
абсорбции может быть осуществлен в насадочной или тарельчатой колонне.
Материалом для изготовления колонн служит полиэфир, армированный
стекловолокном, либо сталь, футерованная огнеупорным кирпичом или диабазовой
плиткой на диабазовой замазке на двух слоях гуммировки. Насадочные колонны
заполняются насадкой различной формы. Насадки должны обладать большой удельной
поверхностью, а также быть _ коррозионностойкими в солянокислой среде. Это
могут быть хордовые насадки из графита, пластмасс, кольцевые насадки из
керамики или фарфора, седлообразные и блочные насадки.
Недостатком насадочных абсорберов является
трудность отвода тепла в процессе абсорбции. Обычно используют циркуляционный
отвод тепла в выносных холодильниках.
Контрольно-измерительная аппаратура
адиабатической системы точна, проста и надежна. Регулятор температуры,
контролирующий температуру кипения кислоты нужной концентрации, регулирует
поток исходной жидкости. С помощью регулятора уровня жидкости постоянно
поддерживается уровень кислоты на всасывающем насосе или в холодильнике. В
адиабатических системах концентрация кислоты достигает 32%. При получении
кислоты с концентрацией более 32% уменьшается эффективность абсорбции.
Для расчета размеров колонн используют известные
методы расчета ректификационных колонн. Высота колонны, или число теоретических
тарелок, зависит от концентраций кислоты и хлористого водорода в газе и
проскока хлористого водорода на выходе из колонны.
Характеристика используемых химических
реакторов.
Характеристика печей для синтеза хлороводорода
Камеры сжигания выполнены из стали, графита,
кварца, огнеупорного кирпича. Простейшими камерами, применявшимися ранее,
являются полые кирпичные камеры, футерованные изнутри огнеупорным кирпичом.
Иногда реакционные камеры заполняют контактным материалом - графитом, коксом,
кварцем, огнеупорной глиной и т. п. Применяются также вертикальные печи из
простых или специальных сталей, снабженные снаружи водяными кожухами,
охлаждаемыми проточной водой при температуре не ниже 90-95 °С во избежание
конденсации воды из НСl на стенке печи. Стальные печи могут работать под
давлением, что увеличивает концентрацию НСl в газе благодаря устранению
подсосов воздуха.
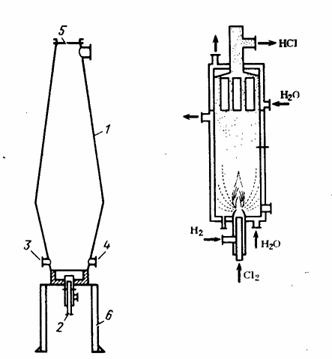
Рис. 4 - слева печь синтеза НС1, справа графитовая
камера сжигания с восходящим потоком горения (справа). 1-корпус печн; 2 -
горелке; 3 - запальный люк; 4 - смотровой штуцер; 5 - предохранительный лист; 6
- опорная конструкция
В печи диаметром 0,25 м и высотой 2,5 м можно
получать НС1 в количестве, достаточном для производства 6-25 т/сут соляной
кислоты.
Иногда применяют двухконусные стальные печи с
естественным воздушным охлаждением (рис. 4). В этой печи обеспечивается
равномерная тепловая нагрузка стенок, так как форма печи близка к форме факела.
Корпус печи изготавливается из 8-миллиметровой листовой стали.
Нижняя цилиндрическая часть корпуса и съемное
днище печи футерованы огнеупорным кирпичом. В верхнем конце печи расположена
предохранительная мембрана, изготавливаемая из паронита или асбеста. В печи
поддерживается давление 6 кПа, температура наружной стенки печи достигает 400
°С, а температура выходящего газа должна быть не выше 250 °С. Недостатком
стальной печи является то, что полученный хлористый водород содержит
относительно большое количество железа, остатков от прокаливания. Это
отрицательно влияет yа качество соляной кислоты.
Кварцевая аппаратура очень дорогая и хрупкая,
что создает затруднения при ее обслуживании. Поэтому она применяется очень
ограниченно, например при получении НСl для особо чистой соляной кислоты.
В последнее время наибольшее применение в
качестве конструкционного материала находит графит, импрегнированный
феноло-формальдегидными смолами (коробон, игурит, карбаит). Отличная
коррозионная стойкость импрегнированного графита предотвращает загрязнение НСl.
Предложены и используются в промышленности
разнообразные конструкции печей, из которых следует выделить два основных типа
печей, отличающихся по способу работы и методу охлаждения.
Первый тип представляет собой вертикальную камеру
сжигания с восходящим потоком горения (рис. 5). Печь изготовлена из
неимлрегнированного графита и состоит из корпуса, дна, крышки и трубки с
отверстием для выпуска хлористого водорода. В этой камере применяется наружное
охлаждение, причем часть воды просачивается внутрь через раковины в графите.
Кроме того, она поступает снизу на дно печи, снижая высокую температуру внутри
печи. Благодаря такому охлаждению температура выходящего газа равна 150-220 °С.
Горелка (рис. 6), используемая в печах этого
типа, состоит из двух графитовых-трубок: наружной и внутренней. Хлор
поднимается по внутренней 1 , а водород - по варианты формы и направления
отверстий 4 для хлора и водорода.наружной трубке 2 со скоростью 10-20 м/с.
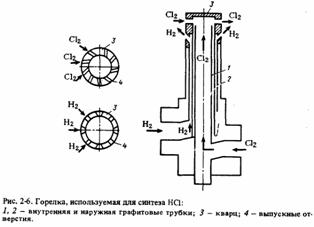
Рис. 6 - Горелка, используемая для синтеза HCl
Непосредственное соединение хлора и водорода
проводится в контактных печах, сделанных из жароупорной стали, их высота иногда
достигает нескольких метров и диаметр - более полуметра. В нижней части печи
имеется горелка, состоящая из двух труб, вставленных одна в другую. Сухой хлор
поступает во внутреннюю часть трубы, а водород - в наружную. На выходе водород
и хлор сгорают с образованием пламени; так как при реакции выделяется теплота
(22000 кал на г-мол НСl), то температура пламени доходит до 2400°. С целью
предупреждения загрязнения хлористого водорода хлором в горелку подают
некоторый избыток водорода, до 5% против теоретически необходимого количества.
Полученный хлористый водород затем направляют из верхней части печи на
поглощение водой или переводят в жидкое состояние. Ранее поглощение хлористого
водорода проводилось в специальных сосудах, охлаждаемых для отвода
выделяющегося тепла холодной водой или воздухом и действующих по принципу
противотока. Гораздо удобнее поглощение хлористого водорода проводить в
адиабатических условиях, т. е. без внешнего отвода (или подвода) тепла. В таких
условиях выделяющееся тепло идет на нагревание, а затем на испарение воды, за
счет чего и происходит охлаждение системы. При достаточно долгом пропускании
хлористого водорода получается концентрированная соляная кислота. Хлористый
водород предварительно охлаждают в стальном газоходе 2 до 200-250°, а затем
направляют в нижнюю часть поглотительной башни 3, которая имеет внутри насадку
из керамических колец. В верхнюю часть башни поступает вода, растекающаяся по
насадке. Таким образом, для облегчения поглощения создаются наиболее
благоприятные условия: имеется большая поверхность раздела между газовой и
жидкой фазами и используется принцип противотока. Хлористый водород, не
поглощенный в первой башне, направляется во вторую башню поглощения
(санитарную) 4, где образуется 1-процентный раствор соляной кислоты, сливаемый
в канализацию или направляемый в первую башню. Выходящая из нижней части башни
3 горячая соляная кислота имеет достаточно высокую концентрацию. Например, даже
при 70° временном охлаждении холодной водой. Жидкий хлористый водород из
сборника направляется на разливку в стальные баллоны. Он содержит до 99,5% НС1.
Необходимо отметить, что в сухом хлористом водороде связь между хлором и
водородом ковалентная и поэтому без нагревания он не вступает в реакцию с
железом и большинством других металлов. Соляная кислота идет на получение
разнообразных солей, находящих то или иное лабораторное или техническое
применение. Значительные количества соляной кислоты использует металлургическая
промышленность для травления поверхности металлов при наличии в газовой фазе (в
башне) 30% хлористого водорода полученная кислота содержит 30% хлористого
водорода. Согласно ГОСТ соляная кислота должна содержать не менее 27,5% НСl.
Хлористый водород может быть переведен также в жидкое состояние. Для этого
хлористый водород направляется в холодильник, где происходит конденсация паров
соляной кислоты. Дальнейшая осушка проводится в башне, орошаемой серной
кислотой. Затем хлористый водород сжимается компрессором до 100 am. с целью их
очистки от окислов. Соляная кислота является одним из наиболее ходовых
реактивов в лабораториях, применяется при анализе черных и цветных металлов.
Смесь ее с азотной кислотой применяется для растворения платины и при
переработке благородных металлов и т. д. Значительные количества сухого
хлористого водорода используются в промышленности для получения различных
хлорпроизводных из непредельных углеводородов (например, хлористый этил,
хлористый винил и т.д.).
Характеристика абсорберов хлороводорода.
Изотермическую абсорбцию можно проводить в
поверхностных абсорберах, где газ проходит над поверхностью неподвижной или
медленно текущей жидкости. Так как поверхность жидкости (а следовательно, и
массообмен) незначительна, то такие абсорберы применяют лишь при небольших
масштабах производства. Обычно устанавливают каскад абсорберов.
Ранее поверхностные абсорберы выполняли в виде
керамических турилл, целлариусов или горизонтальных цилиндрических аппаратов. В
таких аппаратах тепло отводится через стенку аппарата воздухом или водой либо с
помощью змеевиков, устанавливаемых в абсорберах, которые охлаждаются водой или
другим хладагентом.
К более совершенным типам изотермических
поверхностных горизонтальных абсорберов относятся оросительные и пластинчатые
аппараты, обладающие большой поверхностью теплопередачи.
Абсорбер оросительного типа (рис. 7) состоит из
ряда горизонтальных труб, орошаемых снаружи водой. Пластинчатый абсорбер (рис.
8) состоит из двух систем каналов. Каналы большего сечения предназначены дня
прохождения хлористого водорода и абсорбента (воды или разбавленной соляной
кислоты), а каналы с меньшим сечением - для охлаждающей воды.
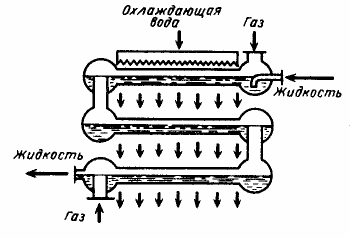
Рис. 7 - Оросительный поверхностный абсорбер с
водяным охлаждением
Более перспективны абсорберы, работающие по
принципу падающей пленки (рис. 9). В таких абсорберах газ и жидкость соприкасаются
на поверхности текущей жидкой пленки. Жидкая пленка течет по вертикальным
поверхностям, представляющим собой трубы (в трубчатых абсорберах) или пластины
(в абсорберах с листовой или плоскопараллельной насадкой). При монтаже и
эксплуатации этих абсорберов необходимо обеспечивать строго вертикальную
установку труб и пластин, а также равномерное распределение абсорбента.
Рис.8 - Поверхностный абсорбер из графита
(пластинчатый) с водяным охлаждением
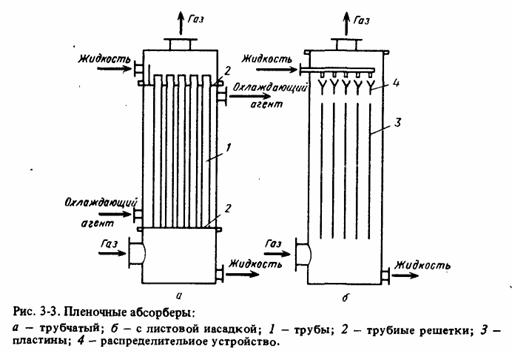
Рис. 9 - Пленочные асорберы: а - трубчатый; б -
с листовой насадкой
Характеристика отходов, проблемы их
обезвреживания и полезного использования
Как уже обозначалось ранее, синтетический метод
синтеза соляной кислоты практически не имеет отходов, так как в процессе
синтеза главным образом получается основной продукт - соляная кислота, без
побочных продуктов.
Испарённую в процессе абсорбции, воду можно
пускать заново на абсорбцию хлороводорода.
Перспективы совершенствования процесса получения
соляной кислоты
Перспективы метода могут заключаться в
совершенствовании процесса абсорбции хлористого водорода (так как степень
превращения по реакции сжигания водорода в хлоре стремится к единице, и её нет
смысла увеличивать).
Синтетический метод получения соляной кислоты
теряет свою распространённость в мире. Более распространённым является абгазный
метод (≈90% соляной кислоты производится из абгазов).
Технологические расчеты
Принципиальная схема производства синтетической
соляной кислоты может быть представлена в виде следующей блок-схемы:

Рис. 10
Расчет материального баланса производства
синтетической соляной кислоты
Данные для расчета:
расчет провести на 10т 35% соляной кислоты
считать, что хлороводород полностью поглощается
сорбентом (водой)
считать, что 5% воды для растворения
хлороводорода испаряется
считать, что степень превращения по хлору равна
100%
учесть, что водород подается с избытком в 5%
считать, что водород подаётся в печь с чистотой
100%
считать, что хлор подаётся в печь с чистотой 95%
Расчет массы чистого хлороводорода,
содержащегося в потоке соляной кислоты из абсорбера:
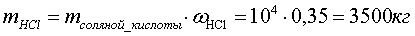
Расчет массы воды, необходимой для абсорбции
хлороводорода, поступающего из печи:

Расчет массы воды с учетом избытка (испариваемая
вода)
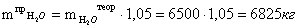
Расчет массы хлора, поступающего в печь:
Расчет теоретической массы хлора (без учета
процентного содержания хлора в исходном потоке)

Расчет практической массы хлора (с учетом
процентного содержания хлора в исходном потоке)
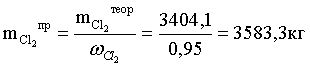
Расчет массы примесей в потоке хлора
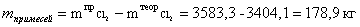
Расчет объёма Cl2 в потоке хлора

Расчет массы водорода, поступающего в печь
Расчет теоретической массы водорода (без учета
подаваемого избытка)
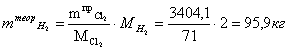
Расчет практической массы водорода (с учетом
подаваемого избытка)
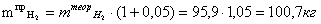
Расчет массы избытка водорода
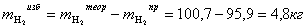
Таблица 5 - Материальный баланс для потоков
входящих и выходящих из печи
|
Приход
|
Расход
|
|
Статья
приход
|
Количество
|
Статья
расход
|
Количество
|
|
Поток
|
Компонент
|
|
Поток
|
Компонент
|
|
кг
|
М3
|
кг
|
М3
|
%
об.
|
|
кг
|
М3
|
кг
|
М3
|
%
об.
|
|
1.
Поток хлора В том числе Cl2 Примеси 2.Поток водорода В том числе H2
|
3583,3
100,7
|
1135,5
1127,84
|
3404,1
178,9 100,7
|
1074
61,5 1127,84
|
1.Поток
хлороводорода В том числе HCl Примеси Избыток H2
|
3683,7
|
2263,2
|
3500
178,9 4,8
|
2147,94
61,5 53,76
|
94,91
2,72 2,37
|
|
Итого
|
3684
|
2263,34
|
3684
|
2263,34
|
99,99
|
Итого
|
3683,7
|
2263,2
|
3683,7
|
2263,2
|
100
|
Невязка баланса 0,0081%
Таблица 6 - Материальный баланс потоков,
входящих в абсорбер и выходящих из него
|
Приход
|
Расход
|
|
Статья
приход
|
Количество
|
Статья
расход
|
Количество
|
|
Поток
|
Компонент
|
|
Поток
|
Компонент
|
|
кг
|
М3
|
кг
|
М3
|
%
об.
|
|
кг
|
М3
|
Кг
|
М3
|
%
об.
|
|
1.
Поток хлороводорода В том числе HCl Примеси Избыток H2 2. Поток воды на
растворение HCl В том числе H2O
|
3683,7
6863,3
|
2263,2
|
3500
178,9 4,8 6863,3
|
2147,94
61,5 53,76
|
94,91
2,72 2,37
|
1.Поток
соляной кислоты В том числе HCl H2O 2. Поток отводных газов Примеси Избыток
H2 H2O
|
10000
547
|
|
3500
6500 178,9 4,8 363,3
|
61,5
53,76
|
53,76
46,24
|
|
Итого
|
10547
|
2263,2
|
10547
|
2263,2
|
100
|
Итого
|
10547
|
|
10547
|
115,26
|
100
|
Невязка баланса 0
Расчет теплового баланса (стадии абсорбции
хлороводорода в аборбере, после сжигания в печи исходных газов)
Данные для расчета:
Масса получаемой соляной кислоты (mс.к. ) равна
10000 кг
Масса хлороводорода, идущая на абсорбцию (mHCl)
равна 3500 кг
Масса воды для растворения хлороводорода (mводы)
равна 6500 кг
Теплоёмкость воды (Сp воды) равна 4,2 кДж/(кг·ºС)
Температура воды на входе (Твх воды) равна 25 ºС
Теплоёмкость хлороводорода при 200ºС
(Cp HCl) равна 29,5 Дж/(мольºС)
Тепловой эффект абсорбции хлороводорода
(qабсорбции) равен 72,5 кДж/моль
Температура в процессе абсорбции равна 100ºС
и удельная теплота парообразования воды при 100ºС
(rводы) равна 2256 кДж/кг
Удельная теплоёмкость 35% соляной кислоты при 20
ºС
(Cс.к. p) равна 2,48 кДж/(кг·ºС)
Температура на выходе соляной кислоты (Твых )
равна 25
ºС
Принять, что тепловые потери равны (Qпот ) 5% от
физического прихода теплоты
Уравнение теплового баланса процесса абсорбции
хлороводорода в абсорбере
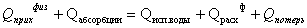
Составляющие уравнения теплового баланса
абсорбции
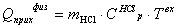

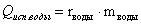
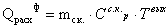
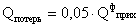
Уравнение теплового баланса в конечном виде:
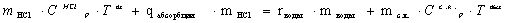
Как видно, в последнем уравнении неизвестной
величиной является mводы - масса воды, испаряющаяся в процессе абсорбции.
Найдём её:
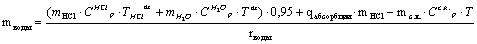
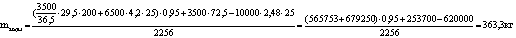
Таблица 7 - Тепловой баланс стадии абсорбции
хлороводорода
|
Приход
|
Расход
|
|
Статья
прихода
|
Q,
МДж
|
%
|
Статья
прихода
|
Q,
МДж
|
%
|
|
1.
С хлороводородным газом 2. С водой 3. Теплота абсорбции
|
565,75
682,50 253,75
|
37,67
45,44 16,89
|
1.
С соляной кислотой 2. С испаренной водой 3. С потерянной теплотой
|
620,0
818,60 62,41
|
41,30
54,54 4,16
|
|
ИТОГО
|
1502
|
100
|
ИТОГО
|
1501
|
100
|
Невязка баланса 0,0066%
Расчет теоретических и практических расходных
коэффициентов
Расчет теоретического расходного коэффициента по
хлору:
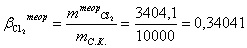
Расчет практического расходного коэффициента по
хлору:
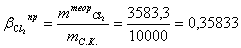
Расчет теоретического расходного коэффициента по
водороду:
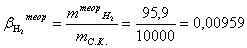
Расчет практического расходного коэффициента по
водороду:
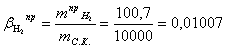
Расчет теоретического расходного коэффициента по
воде:
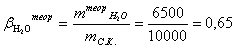
Расчет практического расходного коэффициента по
воде:
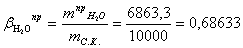
Расчет теоретического расходного коэффициента по
теплоте:
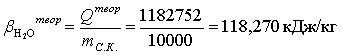
Расчет практического расходного коэффициента по
теплоте:
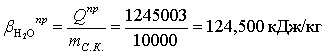
Таблица 8 - Теоретические и практические
расходные коэффициенты при производстве 35% соляной кислоты синтетическим
методом
|
Исходное
сырьё
|
Значение
расходного коэффициента
|
|
Теоретического
|
Практического
|
|
1.
Хлор, кг 2. Водород, кг 3. Вода, кг 4. Теплота, кДж
|
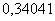 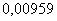 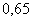 
|
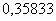   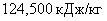
|
Список используемой литературы
1.
М.И. Левинский, А.Ф. Мазанко, И.Н. Новиков. Рецензент - д.х.н. профессор А.П.
Томилов. «Хлористый водород и соляная кислота». © Издательство «Химия», 1985 г.