|
Плотность
жидкости при 20 С0,998 г./см³
|
|
|
Теплоёмкость
|
4190 Дж/кг*К
|
|
Вязкость при 25
С
|
1003 Па*с
|
|
Температура
плавления
|
0 С
|
|
Коэфициент
преломления n20D
|
1,333
|
Пропиленгликоль (1,2 - пропандиол, 1,2 - диоксипропан)
НОСН2СНОНСН3 имеет молекулярную массу 76,09 и при обычных
условиях является бесцветной прозрачной, вязкой жидкостью без запаха и со
сладковатым вкусом.
Дипропиленгликоль (С6Н14О3)
и трипропиленгликоль (С9Н20О4) являются
бесцветными, вязкими, умеренно гигроскопичными жидкостями. Молекулярная масса
дипропиленгликоля - 134,17, а трипропиленгликоля - 192,25.
3. Краткие физико-химические основы процесса
Некаталитическая гидратация окиси пропилена протекает по
механизму:
Полученный продукт содержит группировки, способные к
дальнейшему присоединению окиси пропилена. В результате происходят
последовательно-параллельные реакции с образованием продуктов все более высокой
степени оксипропилирования.
Состав образующихся продуктов реакции зависит от мольного
соотношения исходных реагентов и относительных значений констант скорости
последовательных стадий реакций.
С1=k1/k0, С2=k2/k0,
…, Сi=ki/k0
Значения констант распределения Сi определяется,
главным образом, строением исходной a-окиси и типом катализа и
практически не зависит от температуры.
При некаталитической реакции вода предварительно активирует a-оксидный цикл по его
кислородному атому которое сопровождается смещением электронной плотности,
благодаря чему облегчается атака углеродного атома a-оксида нуклеофилом
молекулой воды:
Реакцию можно рассматривать как бимолекулярную, протекающую
по механизму нуклеофильного замещения типа SN2. Она является
лимитирующей стадией гидролиза.
Некаталитическая реакция, как правило, сопровождаются
образованием продуктов последовательного оксиалкилирования гликолей по реакции.
Состав образующихся при этом продуктов зависит от мольного соотношения исходных
реагентов и значения коэффициента распределения Сi=ki/k0.
Выходу продукта первой стадии способствует уменьшение
коэффициента распределения Ci. Из литературных данных известно, что
первая стадия протекает медленнее второй, т.е. гликоль реагирует с a-оксидом быстрее воды и
повышение степени конверсии a-оксида приводит к снижению селективности по
моногликолю. Поэтому, чем выше соотношение вода: оксид, тем выше выход
моногликоля и ниже количество образующихся побочных продуктов. В связи с этим в
промышленности для получения высоких выходов моногликоля приходится
использовать разбавленные исходные растворы a-оксидов для гидратации.
В настоящее время в промышленности пропиленгликоль в основном получают
некаталитической гидратацией окиси пропилена при температуре 180-2600С
и при давлении 1,6 МПа, при мольном соотношении Н2О:ОП =15:1. При
этих условиях получается в виде товарных продуктов, %(масс.): ПГ - 85,5;
ДПГ-13; ТПГ - 1,5.
4. Описание технологической схемы
Описание технологической схемы.
Процесс проводят без катализатора при температуре 180 - 2600С,
под давлением 1,6 МПа, обеспечивающим сохранение смеси в жидком состоянии.
Оксид пропилена, вода из ёмкостей Е1, Е2 насосами Н1, Н2
подаётся в смеситель, далее поступает в теплообменник Т1, где подогревается
паром до 900С. Далее она поступает в теплообменник Т2, где
подогревается реакционной массой выходящей из реактора до 1400С.
Поступив в реактор Р, который представляет собой пустотелую трубу. В реакторе
поддерживается давление 1,6 МПа для осуществления процесса в жидкой фазе.
Реакция происходит в адиабатическом реакторе, где смесь разогревается от 140 С
до 195 С и возвращается в теплообменник Т2, где охлаждается до 1360С.
Продуктами реакции являются пропиленгликоль, дипропиленгликоль, полигликоли.
После раствор гликолей дросселируют до атмосферного давления.
В сепараторе С1 отделяется оксид пропилена и частично вода. Газы сепаратора
затем конденсируются в холодильнике Х1. Съем тепла в холодильнике производится
водой с начальной температурой 200С. Раствор гликолей насосом Н3
подаётся на выпаривание в каскад из трёх выпарных аппаратов. В них происходит
упаривание раствора гликолей до 90% их содержания в смеси. Первый аппарат
обогревается водяным паром с давлением 10,5 кгс/см². Следующие ступени выпарной установки работают при все более
низком давлении (до вакуума) и обогреваются за счет вторичного пара с
предыдущей стадии. Вторичный пар из последнего корпуса В3 отводится в
барометрический конденсатор, охлаждаемый водой, в котором при конденсации пара
создается требуемое разряжение. Воздух и несконденсировавшиеся пары
отсасываются через ловушку-брызгоуловитель вакуум-насосом. Далее смесь
направляется в ёмкость Е4, а оттуда насосом Н6 в колонну КР1 на ректификацию. В
колонне КР1 под вакуумом отгоняется оставшееся после выпаривания количество
воды. Вода, отбираемая с верха колонны КР1 и выпариваемая в выпарных аппаратах,
возвращается в ёмкость Е2. Из куба колонны КР1 гликоли направляются в ёмкость
Е5, откуда они поступают в колонну КР2, которая также работает под вакуумом. С
верха колонны отбирается пропиленгликоль, который отправляется на товарный
склад. Из куба колонны ди- и трипропиленгликоли направляются в ёмкость Е7,
откуда они поступают в колонну КР3, где под вакуумом разгоняет ди- и
трипропиленгликоли.
Пуск и остановка установки.
Пуск установки.
Непосредственно перед пуском установки аппаратура и
трубопроводы, которые при работе будут находиться в среде взрывоопасных
веществ, продуваются азотом или инертным газом для устранения возможности
образования взрывных концентраций различных продуктов в смеси с воздухом.
1)
Перед
пуском следует убедиться в исправности оборудования, трубопроводов, запорной
арматуры, предохранительных клапанов и приборов КИП.
2)
Проверить
открытие всех заглушек.
3)
Испытать
систему на герметичность. Реакционный узел проверяется на герметичность при
повышенном давлении.
4)
Проверить
наличие энергоносителей.
5)
-
промышленной воды.
6)
Заполнить
водой барометрические затворы.
7)
Подать
теплоносители в теплообменники.
8)
Проверить
проходимость воды через кипятильники колонн.
9)
Заполнить
исходными веществами ёмкости Е1, Е2.
10)Начать подачу воды и оксида пропилена в реактор.
11)До того как реактор не выйдет на заданный режим все продукты
реакции направлять в ёмкость некондиции (на технологической схеме не показана).
12)После заполнения ёмкости Е3 на треть начинать подавать жидкость и
пар в выпарные аппараты.
13)После заполнения ёмкости Е4 на треть начинать подавать жидкость в
колонну КР1.
14)После выхода колонны на режим начинать отбирать дистилят и кубовый
остаток.
15)После заполнения ёмкости Е5 на треть начинать подавать жидкость в
колонну КР2.
16) После выхода колонны на режим начинать отбирать дистиллят
и кубовый остаток
17)После заполнения ёмкости Е6 на треть начинать подавать жидкость в
колонну КР3
18) После выхода колонны на режим начинать отбирать дистиллят
и кубовый остаток
Остановка установки.
1)
Прекратить
подачу окиси пропилена в реактор.
2)
Продукты
реакции направлять в ёмкость некондиции (на технологической схеме не показана).
3)
Прекратить
подачу теплоносителей в подогреватель Т1.
4)
После
того как реактор охладится слить его содержимое.
5)
После
опустошения ёмкости Е3 прекратить подачу раствора в выпарные аппараты,
прекратить подачу греющего пара.
6)
После
опустошения ёмкостей Е4, Е5 перестать подавать питание в соответствующие
колонны, прекратить подачу теплоносителя в кипятильники, прекратить отбор
кубового остатка и дистиллята (по очереди во всех колоннах).
7)
Сбросить
вакуум в колоннах КР4 и КР5, продувая их инертным газом.
8)
Прекратить
подачу теплоносителя в дефлегматоры.
9)
Слить
кубовые остатки колонн.
10)Установить заглушки на линиях ввода и вывода на каждой колонне.
11)Пропарить колонны и систему разложения до санитарной нормы по
содержанию углеводородов.
Рекомендации по КИП и автоматизации
технологической схемы.
Рассмотрим конкретные точки и параметры подлежащие
автоматическому управлению по позициям:
. Регулировка подачи пропиленоксида в смеситель с определенным
расходом для поддержания постоянных расхода ОП и соотношения ОП: Н2О;
. Регулировка подачи воды в смеситель с определенным расходом
для поддержания постоянных расхода ОП и соотношения ОП: Н2О;
. Регулировка расхода греющего пара для поддержания
температурного режима работы реакторного узла.
. Регулировка расхода продуктов реакции для поддержания
давления в реакторном узле.
. Регулировка расхода раствора гликолей для обеспечения
постоянного расхода.
. Регулировка подачи пара для обеспечения постоянного
расхода.
. Регулировка подачи раствора гликолей для поддержания
необходимого уровня в выпарном аппарате.
,12,14. Регулировка расхода вторичного пара для поддержания
постоянного давления в выпарных аппаратах и барометрическом конденсаторе.
,13,15. Регулировка расхода упаренного раствора гликолей для
поддержания необходимой концентрации гликолей в растворе.
,23,30. Регулировка подачи упаренного раствора гликолей для
обеспечения постоянного расхода для питания ректификационной колонны.
,24,31. Регулировка возврата флегмы в зависимости от
температуры вверху колонны.
,25,32. Регулировка отбора кубовой жидкости в зависимости от
уровня в кубе колонны.
,26,33. Регулировка расхода греющего пара для поддержания
постоянной температуры в кубе колонны.
,27,34. Регулировка расхода охлаждающей воды по температуре
выходящего из конденсатора дистиллята.
,28,35. Поддержание необходимого вакуума вверху колонны.
,29,5. Регулировка отбора дистиллята по уровню в сепараторе.
. Регулировка подачи охлаждающей воды по температуре пара.
5. Расчет реакционного узла
Некаталитический метод гидрирования оксида пропилена
реализуется на практике в виде жидкофазной реакции (для поддержания реагентов в
жидком состоянии используется избыточное давление), которая проводится в
адиабатическом реакторе. Тепловой эффект ключевой реакции DН = 89500 Дж/моль. В
целях пожарной безопасности оксид пропилена должен иметь конверсию не менее
99,9%.
Расчет
реакционного узла
Материальный
баланс реактора
3H6О+Н2O ® C3H8O.2
®
C6H14O.3® C9H20O4
Определим тепловой эффект реакции:
DH298 пг=-101,33 ккал / моль
DH298 оп=-22,17 ккал / моль
DH298 вод=-57,8 ккал / моль
Для реакции оксипропилирования тепловой эффект считается на 1
моль присоединенной окиси. Константы скоростей всех стадий равны. Тогда
тепловой эффект присоединения 1 моль окиси пропилена можно рассчитывать по
формуле:
DHхр =DH298 пг - (DH298 оп+DH298 вод)
DHxp =-101.33+22.17+57.8=-21.36 ккал /
моль=-89,5 кДж/моль
При промышленном соотношении ОП:Н2О=1:15 (мольн) и
селективности процесса 85% мощность установки при работе 8000 часов в год
составит:пг=10000*1000/(3600*8000)=0,3472 кг/с;B = 0,045633 кмоль/с.
Находим потоки исходных веществ на входе в реактор:
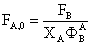
Мольный поток воды на входе
ВОД.0 = FА.0 15=5,3686*10^-3*15=80.5290*10^-3 кмоль/с
F= FА.0+ FВОД.0 =86.8976 моль/с
ХА.0 =6,25%; XВОД.0 =93.75%
Массовый расход реагентов
оп.0 = FА.0* МА.0 =5,3686*10^-3*58.08=,
3118 кг/свод.0 = Fвод.0* Мвод.0 =80.5290*10^-3
*18=1,4495 кг/ссм = Gоп.0+ Gвод.0 =, 3118+1,4495=1,7613
кг/с
ХА.0 (масс)=17,70%; XВОД.0 =82,3%
Реакция идет до полной конверсии окиси пропилена ХА.0 =1
Тепловой эффект химического процесса:хп =89,5*5,3686*1=480,5
кВт
Примем что на выходе из реактора условия таковы:
состав ПГ:H2O=1:14
Тогда на выходе имеем мольный состав:пг = FА.0
=5,3686 моль/сВОД. = Fпг* 14=75,1604
моль/с
Массовый состав
Gпг = Fпг* Мпг =5,3686*10^-3*76,09=,
4085 кг/свод.= Fвод.* Мвод.0 =75,1604*10^-3
*18=1,3529 кг/ссм = Gпг+ Gвод =, 4085+1,3529=1,7613 кг/с
Хпг (масс)=23,19%; XВОД. =76,81
Теплоемкость оксида пропилена:=-2.02+7.779*10-2*T-4.75*10-5*T2+1.152*10-8*T3
(кал/моль*К)
Пусть tвх =140 0С=22,82
кал/моль*К=95,62 Дж/моль*Коп=1,646 кДж/кг*Квод =4,2
кДж/кг*К
см =Х*оп * Cpоп + Х*вод
* Cpвод
см =, 177*1,646+, 823*4,2=3,7479 кДж/кг*К
Адиабатический разогрев:
DTад =Qхп / Cpсм*Gсм
DTад =480,5/3,75*1,7613=730С
Адиабатический разогрев небольшой, следовательно можно
использовать адиабатический реактор.
Математическая модель
Кинетическая модель процесса:
ок=К*[ок]*([H2O]+2*[гл])*([H2O]+b*[гл])вод=Rок*[H2O]/([H2O]+b*[гл])пг=Rок*([H2O]
- b*[пг])/([H2O]+b*[гл])дпг=Rок*b*([пг] - b*[дпг])/([H2O]+b*[гл])
где [ок] - оксид пропилена; [H2O] - вода; [гл] - гликоли
(моно, ди и тд);
[пг] - пропиленгликоль; [дпг] - дипропиленгликоль;
К=EXP (12.81-10673/T) л^2/мол^2*cек=2.3 - коэффициент
распределения
Проверка правильности расчетов по программе
PROEKT
Проверка производится путем сравнения расчетов по
компьютерной программе и расчетов вручную для двух случаев: изотермический
реактор и адиабатический реактор.
Расчет по компьютерной модели дает следующий результат: время
контакта при х =0.86313 равно 450 сек.
Вручную расчет проводится при тех же начальных условиях:
пропиленгликоль производство реакционный программа
Rок=К*[ок]*([H2O]+2*[гл])*([H2O]+b*[гл])
Сходимость времени контакта по программе PROEKT и
рассчитанного вручную составляет 99,8%.
По компьютерной модели DTад=194.81-140=54.81
При расчете вручную по формуле:
DTад=DH1*Fok*X/(Gсм* Cpсм)=
DH1*Соп*Х/
Cpсм
DTад=89,5*2,3919*1/3,9055=54,81
Сходимость температуры по компьютерной модели и рассчитанной
вручную составляет 100%.
Поскольку данные в двух случаях совпадают, то делаем вывод,
что программе PROEKT ведет расчет правильно.
Математическая модель
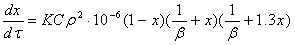
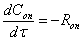
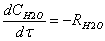
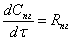
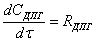
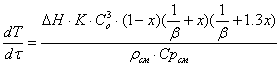 =K*[ок]*([H2O]+2*[гл])*([H2O]+b*[гл])вод=Rox*[H2O]/([H2O]+b*[гл])пг=Rox*([H2O]
- b*[пг])/([H2O]+b*[гл])дпг=Rox*b*([пг] - [дпг])/([H2O]+b*[гл])=EXP (12.81-10673/T)
л^2/мол^2.сек; b=2.3
=K*[ок]*([H2O]+2*[гл])*([H2O]+b*[гл])вод=Rox*[H2O]/([H2O]+b*[гл])пг=Rox*([H2O]
- b*[пг])/([H2O]+b*[гл])дпг=Rox*b*([пг] - [дпг])/([H2O]+b*[гл])=EXP (12.81-10673/T)
л^2/мол^2.сек; b=2.3
6. Оптимизация режима работы, анализ устойчивости системы
Оптимизация по себестоимости
При оптимизации производства по минимуму себестоимости можно
ограничиться оптимизацией реакционного узла. При этом принимаются во внимание
только переменные расходы по реакционному узлу и смежным стадиям, на которые
непосредственно влияет варьирование условий процесса в реакторе. В данном
случае, изменение соотношения исходных реагентов ОП:Н2О влияет,
кроме реакционной стадии, на стадию выделения продукта-рецикл воды после
выпаривания. Затраты же по другим стадиям производства принимаются условно
постоянными
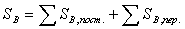
Тогда минимум себестоимости достигается при снижении суммы
переменных затрат. Экономический баланс в единицу времени:
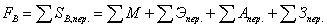
где М, Э, А, З переменные затраты на исходные материалы, энергию,
амортизацию оборудования и заработную плату в еденицу времени соответственно.
При этом в качестве затрат будем использовать только те, которые зависят от
потоков веществ. Таким образом заработная плата, стоимость оборудования,
амортизационные отчисления и другие условно постоянные расходы учитываться не
будут. Они влияют на величину себестоимости, но не на характер ее изменения с
изменением потоков.
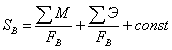
Затраты на сырье равны
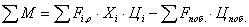
Где 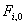 - входящие потоки веществ (пропиленоксида
и воды), моль/с.
- входящие потоки веществ (пропиленоксида
и воды), моль/с.
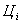 - цена на данное вещество Цоп = 1,35 $/кг и Цп =
0,024 $/кг Цвод = 0,00078 $/кг.
- цена на данное вещество Цоп = 1,35 $/кг и Цп =
0,024 $/кг Цвод = 0,00078 $/кг.
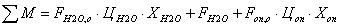
Энергетические затраты складываются из стоимости рецикла воды из
выпарной установки, работы насосов и стоимости тепло - и хладоагентов.
Учитываем только затраты энергии на выпаривание воды из водногликолевого
раствора, поскольку остальные затраты энергии практически постоянны, т.е. будем
считать энергетические затраты равными затратам на рецикл. Т.к побочных
продуктов образуется относительно немного, то величиной их потока можно
пренебречь.
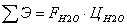
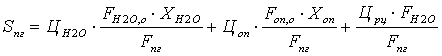
Стоимость рецикла воды из выпарной установки:
1. Тепловой баланс стадии выделения воды.
H2O*QH2O=GП*QП,
где GH2O- количество выпаренной воды, кг/сП
- количество греющего пара, кг/сH2O-теплота парообразования воды,
кДж/кг,H2O=i»п,100 С-i’ж,t, t-температура
выхода из реактора.»п,100 С =2679 кДж/кг [3, c 550]П=rп=2024
кДж/кг - теплота парообразования для пара среднего давления
,5 кгс/см² [3, c 550]
Можно считать, что стоимость рецикла 1 кг определяется
стоимостью его выделения:
цр.ц.Н2О* GH2O=цп* GП
GП= цп* GП/ GH2O=
цп*(i»п,100 С-i’ж,t)/ rп
Стоимость рецикла 1 кмоль Н2О:
ц’р.ц.= цр.ц.Н2О*MH2O
Расчет ведем с помощью программы PROEKT.
Цоп = 1,35 $/кг Цоп = 78,408
$/кмоль
Цп = 0,024 $/кг
Цвод = 0,00078 $/кг Цвод = 0,01404
$/кмоль
Рассчитываем себестоимость.
ХПГ=0,9999
Минимум себестоимости достигается при соотношении
В=FОП,о/FН2О=1/20
Выбор начальной температуры реакционной смеси
Максимальная допустимая температура - 211 °С. Для обеспечения
устойчивости процесса рабочем режиме температура в реакторе не должна превышать
200 °С,
т.к. в реальном реакторе всегда присутствуют местные перегревы. Температура на
положение минимума себестоимости влияния не оказывает (в данных интервалах
температур). Определим оптимальную температуру:
Соотношение исходных реагентов 1/В=1/20
Конверсия: 0.9999
L=4.2 м
Устойчивость
работы реактора
Одним из основных параметров, характеризующих технологический
процесс в реакторе, является устойчивость выбранного режима. Режим работы
устойчив, если отклонения, вызванные какими-либо возмущениями, самопроизвольно
исчезают после их устранения.
При отсутствии регулирования в устойчивом режиме температура
процесса будет самопроизвольно восстанавливается, а в неустойчивом -
безгранично расти, приводя в итоге к аварийному состоянию системы.
Температурный режим процесса
Изменяем температуру реакционной смеси на входе в реактор на
50С:
Температура не должна превышать 2110С
Изменяем соотношение исходных реагентов на 10%:
Результаты
оптимизации
Давление в реакторе Р=1.6 МПа
Полученные параметры режима:
Мольное соотношение исходных реагентов: ОП: Н2О=1: 20
Температура реакционной смеси на входе в реактор: 1400С
Конверсия: 0.9999
Селективность по ПГ: 0.895
Диапазон допустимого изменения технологических
параметров
1. Соотношение ОП:Н2О - от 1/18 до 1/22
. Температура входа реакционной смеси -140_+50С
7. Расчет основного технологического оборудования
Расчет теплообменника Т1
В т/о 1 из смесителя поступает исходная смесь,
содержащая:оп=0,2960 кг/с; Gвод=1,8345 кг/с с температурой 20 С и нагревается
до 90 Ссм=2,1305 кг/с
Тепловая нагрузка аппарата:
= Gсм* Cpсм* (tк-tн)
Cpсм =3,7962 кДж/кг*К=2,1305*3,7962*(90-20)=566,15
кВт
Греющий пар имеет следующие параметры:=1.4 кгс/см² t=108.7 0C.7 =2237 кДж/кгпара=Q/
r108.7пара=566,15/2237=0.25 кг/с
средняя разность температур:
Dtсp =(Dtб -Dtм)/ln Dtб /Dtм
Dtсp =(88.7-18.7)/ln88.7/18.7=45 0C
Примем К=1000 Вт/м^2*K
Требуемая поверхность теплообмена:
=Q/(К* Dtсp)
=566,15*10^3/(45*1000)=12.6 м^2
С учетом запаса 15%: F=1.15*12.6=14.5 м^2
Расчет теплообменника Т2
В т/о исходная смесь, подогретая до 900C
подогревается частью реакционной массы выходящей из реактора до 140С
н=90C tк=140C
см=2,1305 кг/с
Будем считать что 85% р/массы с температурой 195 С идет на
обогрев исходной смеси G=, 85*2,1305=1,8109 кг/с
Тепловая нагрузка аппарата:
Q= Gсм* Cpсм* (tк-tн)
см =3,8597 кДж/кг*К=2,1305*3,8597*(140-90)=411,2 кВт
,1305*3,8598*(140-90)=1,8109*3,9131*(195 - tк)к=138С (т.е.
р/масса охлаждается до 1380С
Dtсp =(Dtб -Dtм)/ln Dtб /Dtм
Dtсp =(55-48)/ln55/48=51,4
Примем К=200 Вт/м^2*K
Требуемая поверхность теплообмена:
=Q/(К* Dtсp)
=411,2*10^3/(51,4*200)=40,4 м^2
С учетом запаса 15%: F=1.2*40,4=48,5 м^2
Расчет сепаратора С1
После т/о часть смеси пошедшей на подогрев исходной смеси
с G=1.8109 кг/с и t=138 0С
смешивается с другой частью (G=0.3196 кг/с и t=195 0С)
и в результате температура потока будет равна 146 0С
Расчет ректификационной колонны КР2
Gдпг= gдпг+gтпг=0,0356 кг/с
Хпг=0,3472/(0,3472+0,0356)=0,907=90,7%
Хдпг=1-0,907=0,093=9,3%
В трубопроводе из кол. в кол. смесь охлаждается от 140 0
до 136 0С,
отдавая тепло в окружающую среду.
P=125 мм рт ст
tкип ПГ=136 0С (125 мм рт ст) [1, c
176]кип ДПГ=175 0С (125 мм рт ст) [1, c 189]
д=GПГ*(R+1)*rПГ
ПГ=783 кДж/кг [1, c 177]
Примем R=2д=0.3472*(2+1)*783=815,6 кВт
кип= Qд+ Gдпг*Срдпг*(175-136)
Срдпг=3,14 кДж/кг*К (при t=175) [1, c 191]
Qкип=815,6+0,0356*3,14*(175-136)=820 кВт
Дефлегматор охлаждается водой tн=200С,
которая нагревается до 350С.
Кор=1000 Вт/м²*К
Dtср=(116-101)/ln (116/101)=108 0С
д=Qд/(К* Dtсp)=815,6*103/(1000*108)=7,55
м²
С учетом запаса 20%: F=1.2*7,55=9,06 м²
вод= Qд/Cp*Dt=815,6/(4,19*(35-20))=12,98
кг/с
Кипятильник подогревается паром=13 кгс/см² t=190.7 0C
rпар=1984 кДж/кг [14, c 550]
пар=Qк/ rпар=820/1984=0,41
кг/ск=Qк/(К* Dtсp)
Dtср=190.7-175=15.7
Кор=1000 Вт/м²*Кк=820*103/(1000*15,7)=53
м²
С учетом запаса 20%: Fк=1.2*53=62.7 м²
Расчет ректификационной колонны КР3
В колонну поступает на разделение смесь ди- и
полипропиленгликолей. Из верхней части колонны отбираем ДПГ, а в кубе остаются
полигликоли(трипропиленгликоль)дпг= 0,0338 кг/стпг=
0,0018 кг/с
Хдпг=0,0338/(0,0338+0,0018)=0,949=94,9%
Хтпг=1-0,949=0,051=5,1%
В трубопроводе из кол. в кол. смесь охлаждается от 1750
до 1700С, отдавая тепло в окружающую среду.
P=100 мм рт ст
tкипДПГ=170 0С (125 мм рт ст) [1, c
176]кип ТПГ=199 0С (125 мм рт ст) [1, c 189]
д=GДПГ*(R+1)*rПГ
ДПГ=440 кДж/кг [1, c 177]
Примем R=0,5д=0.0338*(0,5+1)*440=22,3 кВт
Qкип= Qд+ Gтпг*Сртпг*(199-170)
Сртпг=2,83 кДж/кг*К (при t=199 0С) [1,
c 191]
Qкип=22,3+0,0018*2,83*(199-170)=22,44 кВт
Дефлегматор охлаждается водой tн=200С,
которая нагревается до 350С.
Кор=1000 Вт/м²*К
д=Qд/(К* Dtсp)=22,3*103/(1000*142,4)=0,2м²
С учетом запаса 20%: F=1.2*0,2=0,24 м²
вод= Qд/Cp*Dt=22,3/(4,19*(35-20))=0,35
кг/с
Кипятильник подогревается паром=20 кгс/см² t=211,40C
rпар=1898 кДж/кг [3, c 550]
пар=Qк/ rпар=22,4/1898=0,012
кг/ск=Qк/(К* Dtсp)
Dtср=211,4-199=12,4
Кор=1000 Вт/м²*Кк=22,4*103/(1000*12,4)=1,8
м²
С учетом запаса 20%: Fк=1.2*1,8=2,2 м².
Список литературы
1.
Дымент О.Н. Гликоли и другие производные оксидов этилена и пропилена. М.:
Химия, 1976.
.
Лебедев Н.Н. Химия и технология основного органического и нефтехимического
синтеза: Учебник для вузов, 4-е изд., перераб. и доп. М.: Химия, 1988. - 592 с.
.
Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и
аппаратов химической технологии /Учебное пособие для вузов/ Под ред. чл.-корр.
АН СССР П.Г. Романкова. - 10-е изд., перераб. и доп. - Л. Химия, 1987. - 576 с.
.
Основные процессы и аппараты химической технологии: Пособие по проектированию/
Г.С. Борисов, В.П. Брыков, Ю.И. Дытнерский и др. Под редакцией Ю.И. Дытнерского,
2-ое изд., перераб. и дополн. М.: Химия, 1991. 496 с.
.
А.Г. Касаткин Основные процессы и аппараты химической технологии, 4-е изд.,
перераб. М.: Химия, 1971. 784 с.
.
Химическая энциклопедия: в 5 томах
.
Равдель А.А., Пономарева А.М., «Краткий справочник физико-химических величин»,
Л., «Химия», 1983 г.
.
Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей: Справочное пособие.
Пер с англ. под ред. Б.И. Соколова. 3-е изд. перераб. и доп., - Л.; «Химия»,
1982 г., - 592 с.
.
Лебедев Н.Н., Манаков М.Н., Швец В.Ф. Теория процессов основного органического
и нефтехимического синтеза. - М.:Химия, 1984.-376 с.