Связь структуры и фармакологической активности фторхинолонов
Введение
Благодаря тесному сотрудничеству
фармацевтической химии с фармакологией можно не только знать механизм действия
препарата и его применение, но и обосновать их на молекулярном уровне.
Свойства, побочные эффекты, взаимодействие с другими препаратами, дозировка и
многая другая информация о лекарственном веществе зависит от его химической
структуры. Зная формулу соединения, можно её усовершенствовать в области
достигаемого эффекта, фармакокинетики, дозы, путей введения и других
показателей.
Двадцатый век явился переломной эпохой в лечении
бактериальной инфекции. Было открыто и синтезировано множество
химиотерапевтических препаратов, одной из этих групп является группа
фторхинолонов.
Фторхинолоны - большая группа антимикробных
средств класса хинолонов, ингибиторов ДНК-гиразы. Это высокоактивные
синтетические химиотерапевтические средства широкого спектра действия,
характеризующиеся хорошими фармакокинетическими свойствами, высокой степенью
проникновения в ткани и клетки, включая клетки макроорганизма и бактериальные
клетки.
Нефторированные препараты класса хинолонов
(налидиксовая кислота, пипемидиевая кислота, оксолиниевая кислота) применяются
в клинике с начала 60-х годов. Эти препараты имеют ограниченный спектр действия
(преимущественно в отношении Enterobacteriaceae) и невысокую биодоступность,
применяются в основном при лечении неосложненных инфекций мочевыводящих путей и
некоторых кишечных инфекций.
Принципиально новые соединения удалось получить
путем введения атома фтора в 6-е положение молекулы хинолина. Наличие атома
фтора (одного или нескольких) и различных групп в разных позициях определяет
особенности антибактериальной активности и фармакокинетических свойств
препаратов. Препараты группы фторхинолонов внедрены в клиническую практику в
начале 80-х годов, и сегодня они занимают одно из ведущих мест в химиотерапии
различных бактериальных инфекций. Некоторые свойства фторхинолонов позволяют им
прочно занимать ведущие позиции в арсенале современных антибактериальных
средств. К свойствам данного характера относятся:
уникальный механизм действия среди антимикробных
средств - ингибирование фермента бактериальной клетки - ДНК-гиразы;
высокая степень бактерицидной активности;
широкий спектр антимикробного действия,
включающий грамотрицательные и грамположительные аэробные бактерии (некоторые
препараты активны также в отношении анаэробов), микобактерии, хламидии,
микоплазмы;
хорошее проникновение в ткани и клетки
макроорганизма, где создаются концентрации, близкие к сывороточным или их
превышающие;
длительный период полувыведения и наличие
постантибиотического эффекта, что определяет их редкое дозирование - 1-2
раза/сут;
доказанная в контролируемых клинических
исследованиях высокая эффективность при лечении внебольничных и госпитальных
инфекций практически любой локализации (верхних и нижних дыхательных путей,
мочевыводящей системы, кожи и мягких тканей, костей и суставов, печени и
желчевыводящих путей, желудочно-кишечного тракта, глаз, центральной нервной
системы, заболеваний, передающихся половым путем);
возможность применения в качестве эмпирической
терапии при тяжелых инфекциях в стационаре;
хорошая переносимость и небольшая частота
побочных эффектов [10]. Цель данной работы: обоснование механизма действия
фторхинолонов и разъяснение зависимости фармакологического эффекта от
химической структуры.
История открытия и внедрения в
клиническую практику фторхинолонов
Открытие в 1962 г. в процессе синтеза хлорохина,
родоначальника хинолонов - налидиксовой кислоты - послужило отправной точкой в
рождении нового класса антибактериальных средств. Эволюция хинолонов
сопровождалась расширением спектра антимикробной активности и, соответственно,
перечня показаний для их клинического использования, улучшением
фармакокинетических параметров и профиля безопасности препаратов. Каждое из
последующих десятилетий применения хинолонов в медицинской практике было
отмечено появлением на фармацевтическом рынке новых представителей этого класса
антибиотиков.
Представители I поколения хинолонов
(налидиксовая кислота, пипемидовая кислота, оксолиновая кислота) оказались
активны только в отношении грамотрицательных микроорганизмов, не создавали
высоких сывороточных и тканевых концентраций и применялись по ограниченным
показаниям (инфекции мочевыводящих путей).
Новый этап развития хинолонов был связан с
появлением в 1980-х гг. фторированных соединений. Термин «фторхинолоны»
отражает особенности их химического строения: принадлежность к классу хинолонов
и наличие в молекуле атома фтора в положении 6-го цикла. Это позволило получить
соединения с принципиально новым уровнем антимикробной активности (в отношении
широкого спектра грамотрицательных, некоторых грамположительных микроорганизмов
и внеклеточных возбудителей) и фармакокинетическими свойствами, обеспечивающими
высокую биодоступность - хинолоны II поколения/фторхинолоны (ципрофлоксацин,
офлоксацин, норфлоксацин).
В последующем были синтезированы соединения,
содержащие дополнительный атом фтора в положении 8-го цикла (дифторхинолоны -
ломефлоксацин, спарфлоксацин), а также препараты, в молекуле которых второй и
третий атомы фтора введены в структуру радикала (трифторхинолоны - флероксацин,
тосуфлоксацин, темафлоксацин).
Развитие фторхинолонов в последнее десятилетие
было направлено на усиление активности в отношении грамположительных бактерий
(особенно пневмококков) и внутриклеточных возбудителей, что обусловило
появление новых или так называемых «респираторных» фторхинолонов, относимых,
согласно современной классификации, к III (спарфлоксацин, левофлоксацин) и IV
(моксифлоксацин, гатифлоксацин, гареноксацин) поколениям препаратов данного
класса.
К IV поколению хинолонов относится и
гемифлоксацин, синтезированный в конце прошлого века Chang Yong Hong и соавт. в
лаборатории LG Chemical Company (Южная Корея). Присоединение аминометиловой
группы в положении С7 пирролидинового кольца позволило создать уникальный
препарат, характеризующийся наибольшей антипневмококковой активностью среди
всех представителей этого класса антибиотиков и не утративший высокой
активности в отношении грамотрицательных и атипичных возбудителей, свойственной
другим «респираторным» фторхинолонам. В апреле 2003 г. гемифлоксацин официально
разрешен Управлением по контролю за лекарствами и пищевыми продуктами (FDA) США
для лечения внебольничной пневмонии у взрослых, обострения хронического
бронхита и хронической обструктивной болезни легких. В конце 2005 г. препарат
зарегистрирован в Российской Федерации [7].
Механизм действия
Фторхинолоны оказывают бактерицидный эффект.
Мишенью их действия являются бактериальные топоизомеразы - топоизомераза IV и
ДНК-гираза (топоизомераза II) - ферменты, осуществляющие суперспирализацию
пространственной молекулы ДНК на различных этапах ее репликации. Фторхинолоны
ингибируют топоизомеразу IV и ДНК-гиразу бактерий, что приводит к нарушению
биосинтеза ДНК и РНК и необратимому нарушению синтеза белка в микробной клетке.
В результате действия фторхинолонов снижаются агрессивные свойства бактерий,
подавляется индукция экзотоксинов, экзоферментов, повышается чувствительность
микроорганизмов к фагоцитозу. Стоит отметить, что препараты обладают
способностью действовать на микроорганизмы в период роста и покоя. Фторхинолоны
обладают определенным постантантибиотическим эффектом, который выражается в
проявлении антимикробного действия после удаления из среды препарата;
длительность постантибиотического эффекта зависит от вида микроорганизма и
величины ранее действовавшей концентрации [1, 4, 9].
Спектр антимикробного действия
Фторхинолоны обладают сверхшироким спектром
действия. Препараты этой группы активны в отношении грамположительных и
грамотрицательных, аэробных и анаэробных микроорганизмов, хламидий, микоплазм,
легионелл, микобактерий. Чувствительны к действию фторхинолонов
грамотрицательные палочки: цитробактерии, энтеробактерии, кампилобактерии,
эшерихии, сальмонеллы, серрации, морганеллы, шигеллы, вибрионы, протей (в т. ч.
мирабельный и вульгарный), клебсиеллы, синегнойная палочка, гемофильная палочка
инфлюэнцы, моракселла катарралис, провиденция, пастереллы, бруцеллы, нейссерии,
все виды стафилококков. Препараты I поколения проявляют активность в отношении
широкого спектра грамотрицательных аэробных микроорганизмов (в том числе
множественно-резистентных) и золотистого стафилококка. Ципрофлоксацин,
офлоксацин и ломефлоксацин подавляют рост микобактерий туберкулеза и лепры.
Недостатком препаратов I поколения является их низкая активность в отношении
пневмококков, хламидий, микоплазм и анаэробов. Фторхинолоны II и III поколений
по действию на грамотрицательные микроорганизмы (кроме синегнойной палочки) не
уступают препаратам I поколения. Что же касается грамположительной флоры, в том
числе пневмококков, хламидий, микоплазм, микобактерий, то действие препаратов
II и III поколений фторхинолонов существенно превосходит действие их
предшественников. Левофлоксацин, спарфлоксацин, моксифлоксацин и ситафлоксацин
отличаются повышенным сродством к топоизомеразе грамположительных бактерий и,
как следствие, большей антибактериальной активностью, поэтому их выделяют в
группу «респираторных фторхинолонов». Препараты III поколения эффективны в
отношении неспорообразующих анаэробов, в том числе устойчивых к действию
фторхинолонов I поколения. По активности по отношению к грамотрицательным
аэробным микроорганизмам они уступают ципрофлоксацину. Все фторхинолоны устойчивы
к действию β-лактамаз
грамотрицательных и грамположительных бактерий, но на метициллинрезистентные
стафилококки действуют только тровафлоксацин и моксифлоксацин. Устойчивы к
действию фторхинолонов грибы, вирусы, трепонемы и большинство простейших.
Имеются сведения, что фторхинолоны обладают иммуномодулирующим эффектом,
повышают фагоцитарную активность нейтрофилов [4, 5, 10].
Химический строение фторхинолонов
Фторхинолоны являются важнейшими представителями
лекарственных веществ группы хинолонов. Хинолонами называют лекарственные
вещества, в молекулах которых содержится фрагмент 1,4-дигидро-4-оксопиридина.
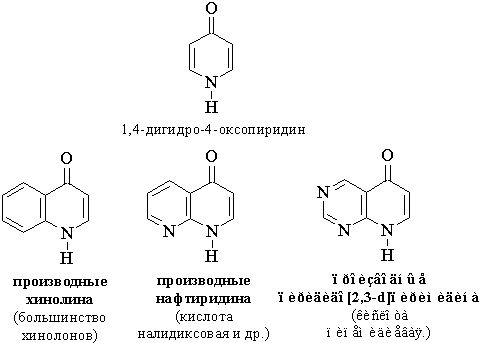
Химическое строение большинства фторхинолонов
можно описать следующей формулой

В молекуле каждого соединения класса хинолонов
имеется шестичленный цикл с СООН-группой в положении 3 и кетогруппой (С=О) в
положении 4 - фрагмент пиридона. На основании этой химической особенности
молекулы иногда эти соединения называют «4-хинолоны». Аналогичные хинолонам
химические соединения, не имеющие в молекуле фрагмента пиридона и кето-группы в
положении 4, не ингибируют ДНК-гиразу. Выраженность ингибирования ДНК-гиразы,
широта антимикробного спектра, фармакокинетические свойства отдельных
препаратов зависят от обшей структуры молекулы и характера радикалов в
каком-либо положении цикла.
Как было отмечено выше, основным химическим
отличием фторхинолонов от хинолонов является наличие атома фтора в положении 6
молекулы. Показано, что введение другого заместителя вместо фтора (другого
галоида, алкильного радикала и др.) снижает выраженность антимикробного
действия. Попытки введения дополнительных атомов фтора (ди- и трифторхинолоны)
не привели к принципиальным изменениям в активности соединений, но позволили
модифицировать ряд свойств (повышение активности в отношении некоторых групп
микроорганизмов, изменение фармакокинетических свойств).
Несмотря на сходство химического строения
нефторированных и фторированных хинолонов, они существенно отличаются по своим
свойствам. Эти различия в свойствах дают основание рассматривать фторхинолоны в
качестве самостоятельной группы препаратов в рамках класса хинолонов.
Известны также фторхинолоны, в основе которых
лежит структура, образованная тремя конденсированными циклами (офлоксацин,
левофлоксацин и др.) [1, 4].
Фармакокинетика
Все хинолоны хорошо всасываются в ЖКТ. Пища
может замедлять всасывание хинолонов, но не оказывает существенного влияния на
биодоступность. Максимальные концентрации в крови достигаются в среднем через
1-3 ч после приема внутрь. Препараты проходят плацентарный барьер, и в
небольших количествах проникают в грудное молоко. Выводятся из организма
преимущественно почками и создают высокие концентрации в моче. Частично
выводятся с желчью.
Хинолоны I поколения не создают терапевтических
концентраций в крови, органах и тканях. Налидиксовая и оксолиновая кислоты
подвергаются интенсивной биотрансформации и выводятся преимущественно в виде
активных и неактивных метаболитов. Пипемидовая кислота мало метаболизируется и
выводится в неизмененном виде. Период полувыведения налидиксовой кислоты
составляет 1-2,5 ч, пипемидовой кислоты - 3-4 ч, оксолиновой кислоты - 6-7 ч.
Максимальные концентрации в моче создаются в среднем через 3-4 ч.
При нарушении функции почек выведение хинолонов
значительно замедляется.
Фторхинолоны имеют большой объем распределения,
создают высокие концентрации в органах и тканях, проникают внутрь клеток.
Исключение составляет норфлоксацин, наиболее высокие уровни которого отмечаются
в кишечнике и предстательной железе. Наибольших тканевых концентраций достигают
офлоксацин, левофлоксацин, ломефлоксацин, спарфлоксацин, моксифлоксацин.
Ципрофлоксацин, офлоксацин, левофлоксацин и пефлоксацин проходят через ГЭБ,
достигая терапевтических концентраций.
Степень метаболизма зависит от физико-химических
свойств препарата: наиболее активно биотрансформируется пефлоксацин, наименее
активно - ломефлоксацин, офлоксацин, левофлоксацин. С калом выводится от 3-4%
до 15-28% принятой дозы.
Период полувыведения у фторхинолонов колеблется
от 3-4 ч (норфлоксацин) до 12-14 ч (пефлоксацин, моксифлоксацин) и даже до
18-20 ч (спарфлоксацин).
При нарушении функции почек наиболее значительно
удлиняется период полувыведения офлоксацина, левофлоксацина и ломефлоксацина.
При тяжелой почечной недостаточности необходима коррекция доз всех
фторхинолонов. При тяжелых нарушениях функции печени может потребоваться
коррекция дозы пефлоксацина.
При гемодиализе фторхинолоны удаляются в
небольших количествах (офлоксацин - 10-30%, остальные препараты - менее 10%)
[2, 5, 10].
7. Классификация фторхинолонов
Существует несколько классификаций
фторхинолонов:
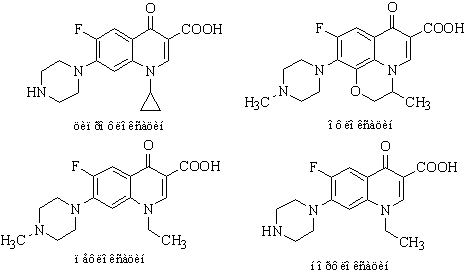
В зависимости от числа атомов фтора,
присутствующих в молекуле фторхинолона, различают моно-, ди- и трифторхинолоны.
Молекулы монофторхинолонов содержат только один атом фтора, находящийся в 6-м
положении хинолоновой системы или её аналога. К монофторхинолонам относятся,
например, ципрофлоксацин, пефлоксацин, норфлоксацин и офлоксацин.
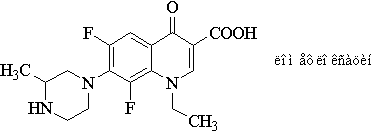
Молекулы дифторхинолонов имеют два атома фтора,
один из которых связан с 6-м углеродным атомом, а другой чаще всего с 8-м.
Примером дифторхинолонов может служить ломефлоксацин.
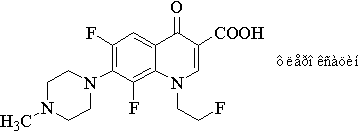
Трифторхинолоны содержат два атома фтора,
связанные непосредственно с хинолоновой системой (в 6-м и 8-м положениях), и
один атом фтора в заместителе, находящемся у атома азота. Трифторхинолоном
является, например, флероксацин.
В зависимости от времени начала использования в
клинической практике все хинолоны, в том числе и не содержащие атомов фтора,
разделяют на 4 поколения. К первому поколению относятся нефторированные
хинолоны: кислота налидиксовая, кислота оксолиниевая, кислота пипемидиевая.
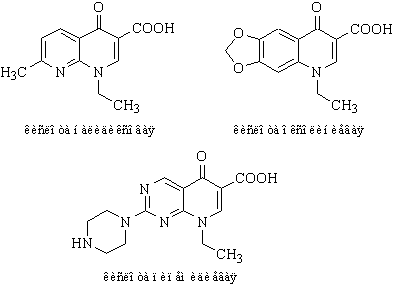
К хинолонам II поколения относятся:
норфлоксацин, ципрофлоксацин, пефлоксацин, офлоксацин, ломефлоксацин.
Хинолоны III поколения называют
«респираторными». К ним относится спарфлоксацин и левофлоксацин - левовращающий
энантиомер офлоксацина (рацемическая смесь).
спарфлоксацин
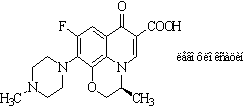
Хинолоны IV поколения, которые называют
«респираторными» + «антианаэробными» фторхинолонами, отличаются от
представителей III поколения повышенной активностью в отношении анаэробов.
Клиническое применение среди фторхинолонов IV поколения имеет моксифлоксацин.
В молекуле моксифлоксацина содержится
бициклическая система в седьмом положении (увеличивает активность в отношении
пневмококков) и метоксигруппа в восьмом (увеличивает антианаэробную активность
лекарственного вещества) [1, 2, 4].
8. Хинолоны I поколения
Налидиксовая кислота (Acidum nalidixicum)
Является синтетическим антибактериальным
препаратом, близким по типу действия к антибиотикам.
Спектр активности
|
Грамотрицательные
палочки:
|
E.coli,
шигеллы, сальмонеллы, протеи, клебсиеллы.
Синегнойная
палочка, грамположительные кокки и анаэробы устойчивы.
|
Фармакокинетика
Хорошо всасывается в ЖКТ и эффективен при приёме
внутрь. Высокие концентрации создаются только в моче. При щелочной реакции мочи
антимикробный эффект усиливается. T1/2 - 1-1,5 ч.
Показания
Пиелонефрит
<#"576943.files/image010.gif">
Фторхинолоны связываются с ДНК с образованием
сложного комплекса, в который входят 4 молекулы лекарственного вещества,
молекула ДНК и ингибируемый фермент. В молекуле фторхинолонов можно выделить
несколько участков, ответственных за связывание с ферментом-мишенью и
проникновение в клетку.
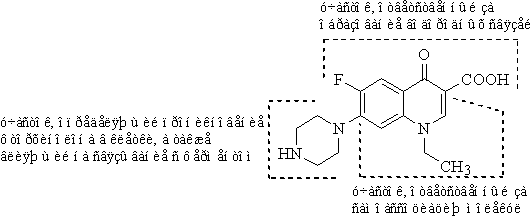
Рис. 2
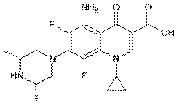
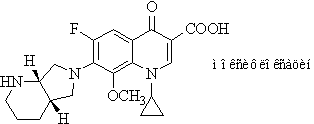
В таблице 1 показано влияние различных
заместителей на антибактериальную активность фторхинолонов. Обязательными
условиями для проявления антибактериальной активности являются атом азота в 1-м
положении, карбоксильная группа в 3-м положении и оксогруппа в 4-м положении
молекулы фторхинолона.
Таблица 1 - Влияние заместителей на активность
фторхинолонов
|
Положение
|
Влияние
на активность
|
|
N(1)
|
Играет
важную роль в проявлении антибактериальной активности. Замена на углерод,
кислород, серу приводит к значительному уменьшению активности или полному её
исчезновению. Оптимальным углеводородным остатком, связанным с N(1) является
этильный или циклопропильный. В остатке могут присутствовать один или два
атома фтора
|
|
С(2)
|
Не
содержит заместителей. Введение в данное положение CH3 или SCH3 группы из-за
стерического влияния дезактивирует молекулу фторхинолона
|
|
С(3)
|
В
данном положении обязательно должна присутствовать карбоксильная группа.
Замена такой группы на атом водорода, ацил, остатки гидроксамовой, уксусной,
фосфоновой, сульфиновой, сульфоновой кислот и т.д. приводит к резкому
снижению антибактериальной активности или полной её потере.
|
|
С(4)
|
Оксогруппа
в 4-м положении (как и карбоксильная группа в 3-м положении) является
обязательной для связывания фторхинолонов с ферментом-мишенью. Замена данной
группы на любую другую приводит к полному исчезновению антибактериальной
активности.
|
|
С(5)
|
Различные
заместители, связанные с данным атомом углерода могут уменьшать или
увеличивать антибактериальную активность. Например, введение NH2-группы
приводит к значительному повышению активности, а CH3NH-группы снижает её.
|
|
С(6)
|
Атом
галогена (особенно фтора) в данном положении оказывает благоприятное действие
на антибактериальную активность, но вовсе не обязателен для получения
высокоактивных соединений.
|
|
С(7)
|
Практически
все фторхинолоны содержат в 7 положении C-N связь. Большинство фторхинолонов
содержат в 7 положении остатки 4 - 6 членных насыщенных азотсодержащих
гетероциклов. Данные заместители необходимы для придания фторхинолонам
амфотерных свойств и улучшения их фармакокинетики. При физиологических
значениях рН лекарственное вещество будет существовать в виде цвиттер-иона и
хорошо проникать в различные ткани и органы, а также в микробные клетки.
|
|
С(8)
|
Увеличивают
активность атомы галогенов, метоксигруппа, а также замещение C(8) на атом азота.
|
Токсичность фторхинолонов
Изучению токсичности фторхинолонов уделяется
большое внимание.
Фторхинолоны, применяющиеся в клинике, являются
относительно малотоксичными препаратами и, как правило, хорошо переносятся
взрослыми больными, в том числе и при длительных курсах лечения. Частота
побочных реакций при монотерапии фторхинолонами не выше, чем при применении
высокоактивных антибактериальных препаратов других классов химических веществ.
Препараты не проявляют гепато-, нефро- и ототоксического действия. Однако в
числе нежелательных реакций необходимо отметить следующие побочные эффекты.
Таблица 2 - Зависимость токсических эффектов
фторхинолонов от положения заместителей в хинолоновом цикле молекулы
|
Положение
заместителя в цикле
|
Риск
токсических эффектов
|
Растворимость
|
|
фототоксичность
|
генотоксичность
|
взаимодействие
с теофиллином
|
ЦНС-эффекты
|
|
|
N1
|
-
|
+
|
+
|
-
|
-
|
|
C5
|
+
|
+
|
-
|
-
|
-
|
|
C6
(в том числе положение основного атома фтора)
|
-
|
-
|
-
|
-
|
-
|
|
С7
|
-
|
++
|
+
|
++
|
++
|
|
Х8
|
++
|
++
|
-
|
-
|
++
|
Комбинированное действие
Комбинация фторхинолонов с другими
антибактериальными препаратами не приводит в большинстве случаев к существенным
изменениям активности: обычно наблюдается аддитивный или индифферентный эффект,
реже - синергидный, но не антагонистический. Синергизм чаше отмечается при
сочетании ципрофлоксацина с антисинегнойными пенициллинами. В опытах in vitro
наблюдался синергизм при комбинации ципрофлоксацина с аминогликозидами, при
этом наиболее выраженное повышение бактерицидной активности фторхинолона
отмечалось при использовании субингибируюших концентраций сизомицина.
Ванкомицин, азлоциллин, мезлоциллин и цефтазидим не влияли на бактерицидную
активность ципрофлоксацина; антагонистическое действие отмечено с препаратами,
ингибирующими синтез белка или РНК (тетрациклин, хлорамфеникол). В целом,
возможно комбинированное применение фторхинолонов с клиндамицином,
эритромицином, метронидазолом, ванкомицином, пенициллинами, цефалоспоринами или
аминогликозидами.
Несмотря на ряд различий в антимикробной
активности фторхинолонов, можно отметить ряд общих свойств, характерных для
всех препаратов:
широкий антимикробный спектр действия;
преимущественную активность в отношении
грамотрипательных аэробных бактерий;
активность в отношении микробов, паразитирующих
внутриклеточно (легионеллы, хламидии, микоплазмы, микобактерии);
единый механизм действия на микробную клетку;
относительно низкую степень развития
резистентности микробов к фторхинолонам;
бактерицидный тип антимикробного действия;
относительно длительный постантибиотический
эффект [2, 3, 10].
Заключение
В результате анализа данной группы соединений
можно сделать вывод, что открытие и внедрение в клиническую практику лечения
бактериальных инфекций фторхинолонов - это одно из важнейших событий в истории
химиотерапевтических лекарственных средств. Антимикробные препараты группы
фторхинолонов, объединенные общим механизмом антимикробного действия
(ингибируют синтез ключевого фермента бактериальной клетки - ДНК-гиразы) в
настоящее время занимают одно из ведущих мест в химиотерапии бактериальных
инфекций. Благодаря широкому спектру антимикробной активности, благоприятным
фармакокинетическим свойствам, низкой токсичности они широко применяются при
лечении различных инфекций. Разработка новых фторхинолонов идет по пути
расширения спектра антимикробного действия, в том числе и на грамположительные
микроорганизмы, анаэробы и внутриклеточные патогены. Однако повышение
антимикробной активности может сопровождаться усилением ряда нежелательных
побочных эффектов препаратов.
Разработка новых фторхинолонов, с точки зрения
модификации химической структуры соединений, проводилась в следующих основных
направлениях:
дополнительное фторирование; введение фтора или
синтезированы высокоактивные непосредственно в цикл в положение 8 или в
структуру радикала по положениям 1 или 7, при этом были соединения, в том числе
и с 4 атомами фтора в молекуле:
введение в положение 8 хлора, ОСН3 или СН3
групп;
введение в положение 5 цикла NH2, CH3, C2H5,
OCH3-групп;
модификация структуры радикалов по положениям 1
или 7 цикла;
попытка синтеза и разработки новых активных
соединений в ряду три- и тетрациклических структур;
разработка препаратов по принципу
"prodrug" с целью повышения растворимости высокоактивных соединений,
в том числе действующих на анаэробы [8, 9, 10].
Список использованных источников
1.
Беликов В. Г. Фармацевтическая химия. В 2ч: Учебн. пособие / В. Г. Беликов. - 2-е
изд. - М: МЕДпресс-информ, 2008. - 616 с.
.
Википедия. Фторхинолоны [Электронный ресурс] /Режим доступа: http://
ru.wikipedia.org/wiki/ - Дата доступа: 23.04.2011.
.
В мире лекарств. Фторхинолоны [Электронный ресурс] / Режим доступа:
<http://medi.ru>. - Дата доступа: 16.04.2011.
.
Жерносек А.К. Лекция 13: Производные хинолина и хинуклидина, 2010-2011. - 7 с.
.
Кукес В.Г. Клиническая фармакология: учеб. / Под ред. В.Г. Кукеса. -2-е изд.,
перераб. и доп.- М.: ГЭОТАР-Медиа, 2006. - 944с.
.
Машковский М.Д. Лекарственные средства: В 2ч. - 9-е изд., перераб. И доп. - М.:
Медицина, 1984. - 576 с.
.
Открытие фторхинолонов [Электронный ресурс] / Режим доступа:
<http://www.pharmasvit.com>. - Дата доступа: 19.04.2011.
.
Токсичность фторхинолонов [Электронный ресурс] /Режим доступа: http://
nature.web.ru/ - Дата доступа: 24.04.2011.
.
Фторхинолоны [Электронный ресурс] / Режим доступа: <http://internal.mif>
- ua.com/archive/ - Дата доступа: 23.04.2011.
.
Фторхинолоны [Электронный ресурс] / Режим доступа:
<http://www.lvrach.ru/registration/> - Дата доступа: 23.04.2011.
11.
Харкевич Д.А. Фармакология / Д.А. Харкевич - М.: ГЭОТАР-Медиа, 2006. - 736 с.